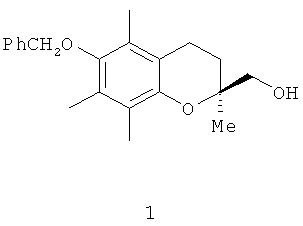
Изобретение относится к области синтеза практических важных биологически активных хиральных хроманов, конкретно к новому энантиоселективному способу получения (S)-(-)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола (1).
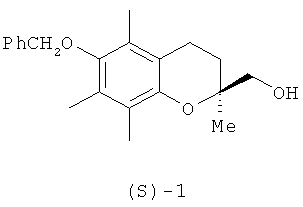
Соединение (1) или его дебензилированный предшественник (S)-(+)-6-гидрокси-2,5,7,8-тетраметил-хроман-2-илметанол (2) являются ключевыми
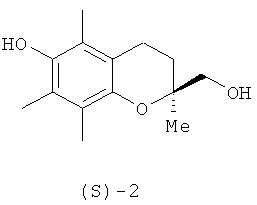
синтонами для синтеза природных токолов, таких как витамин Е и α-токотриенолы [C.Rein, P.Demer, R.A.Outten, T.Netscher, B.Breit // Angew. Chem. Int. Ed., 2007, 46, 8670; T.Netscher // Vitamins and Hormones, 2007, vol.76, 155-202; R.Chenevert, G.Courchesne, N.Pelchat // Biorg. and Med. Chem., 2006, 14, 5389-5396; M.Nozawa, K.Takhashi, K.Kato, H.Akita // Chem. Pharm. Bull., 2000, vol.48, №2, 272-277; N.Cohen, R.J.Lopresti, G.Saucy // J. Am. Chem. Soc., 1979, vol.101, 6710-6714; H.Mayer, P.Schulder, R.Ruegg, O.Isler // Helv. Chim. Acta, 1963, vol.46, 963-982].
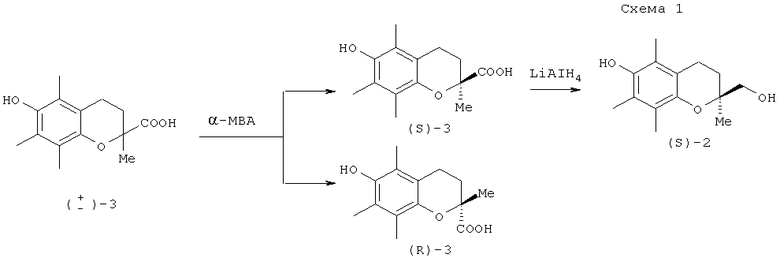
В ранних работах (S)-хроманилметанол (2) синтезировали из (S)-хроман-2-карбоновой кислоты (S)-3, которую, в свою очередь, получали с высокой энантиомерной чистотой из рацемического соединения (±)-3, используя для оптического расщепления (S)-α-метилбензиламин (α-МВА) (схема 1) [J.W.Scott, W.M.Cort, H.Harley, D.R.Parrish, G.J.Saucy // Am. Oil. Chem. Soc., 1974, vol.51, 200-203; N.Cohen, R.J.Lopresti, C.Neukom // J. Org. Chem., 1981, vol.46, 2445-2450].
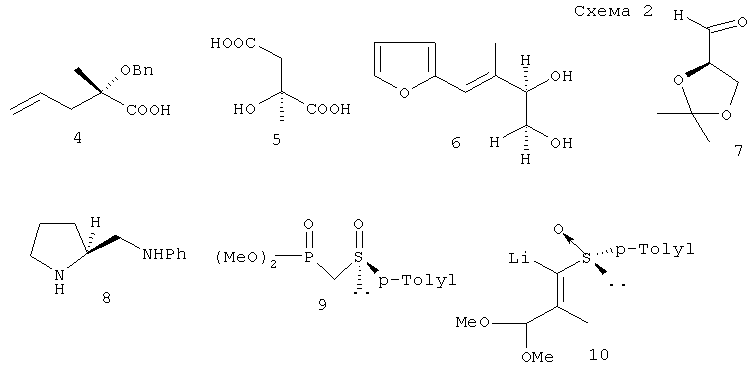
В синтезе хроманилметанолов (1) и (2) использовали различные оптически активные исходные вещества и хиральные вспомогательные реагенты, такие как (S)-2-бензилокси-2-метил-4-пентеновая кислота (4) [T.Sugai, N.Watanabe, H.Ohta // Tetrahedron Asymmetry, 1991, vol.2, №5, 371-376], (+)-(S)-цитрамалевая кислота (5) [R.Barner, M.Schmid // Helv. Chim. Acta, 1979, vol.62, 2384], (2S,3R)-диол (6), полученный восстановлением пекарскими дрожжами α-метил-β(2-фурил)акролеина [C.Fuganti, P.Grasseli // J.Chem.Soc., Chem. Communications, 1982, №4, 205-206.], ацетонид (R)-глицеринового альдегида (7) [H.Mikohiba, K.Mukami, T.Nakai // Synlett, 2001, 989-990], (S)-2-анилинометилпирролидин (8) [Y.Sakito, G.Suzukamo // Tetrahedron Lett., 1982, vol.23, №47, 4953-4954], хиральные сульфоксиды (9) и (10) [J.M.Akkerman, H.de Koning, H.O.Huisman // Heterocycles, 1981, vol.15, №2, 797-800; G.Solladie, G-Moine // J.Am.Chem. Soc., 1984, vol.106, 6097-6098] (схема 2).
Способы получения целевых хроманилметанолов (1) и (2), основанные на использовании соединений (4)-(10) состояли из большого числа стадий и в ряде случаев приводили к целевым продуктам с низким энантиомерным избытком.
В последние десятилетия в синтезе хиральных хроманолов активно развивались подходы, основанные на применении асимметрического металлокомплексного катализа. К таким подходам относится асимметрическое эпоксидирование аллильных спиртов гидроперекисью трет-бутила в присутствии тетраизопропоксититана Тi(ОРri)4 и диэтилового эфира винной кислоты (DET) (эпоксидирование по Шарплессу). Асимметрическим эпоксидированием E-аллильного спирта (11) был получен 2R,3R-эпоксиспирт (12), восстановление которого LiAlH4 привело к (S)-диолу (13). Ацетонидная защита диольного фрагмента и окисление хирального синтона (14) аммонийнитратом церия (CAN) привели к (3S)-кеталю (15). Его гидрирование над Pd-C дало хроманилметанол (2) с высокой энантиомерной чистотой (ее 95%) (схема 3) [K.Takabe, K.Okisaka, Y.Uchiyama, T.Katagiri, H.Yoda // Chem. Lett., 1985, 561-562].
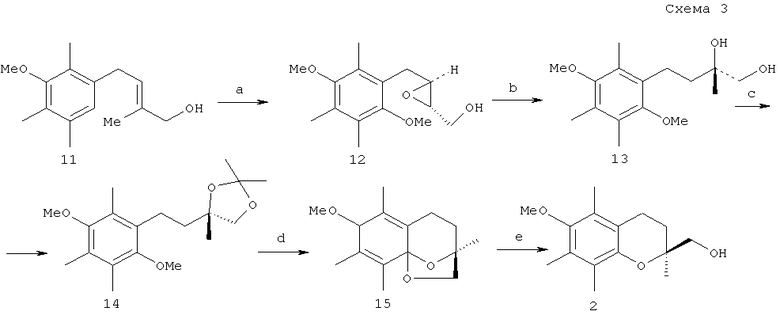
Реагенты и условия: a. t-BuOOH, D-(-)-DET, Тi(ОРri)4, СН2Сl2; b. LiAlH4/Et2O; с. 2,2-диметоксипропан, TsOH; d. CAN/MeCN, затем НСl; e. 10% Pd-C.
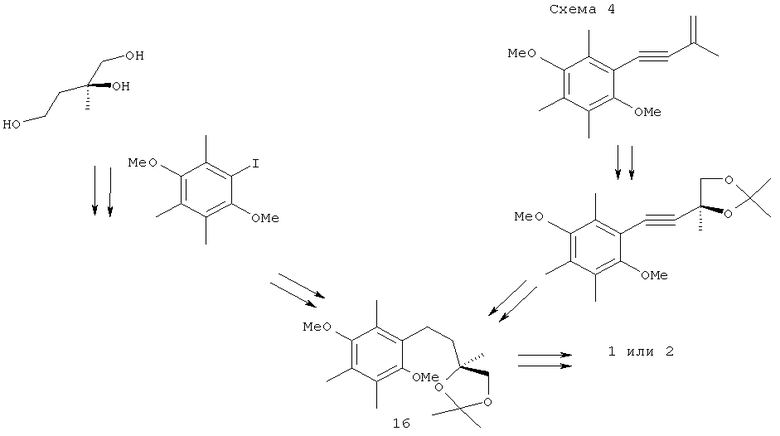
Для получения соединения (16) - хирального хроманового предшественника хроманилметанолов (1) или (2) использовалась методология дигидроксилирования енинов по Шарплессу, в комбинации с реакциями кросс-сочетания йодаренов с хиральными диолами в присутствии металлокомплексных палладиевых катализаторов (схема 4) [L.F.Tietze, J.Gorlitzer, A.Schuffenhauer, M.Hubner // Eur. J. Org. Chem., 1999, 1075-1084; L.F.Tietze, K.Sommer, J.Zinngrebe, F.Stecker // Angew. Chem. Int. Ed., 2004, vol.43, 2-4; L.F.Tietze, F.Stecker, J.Zinngrebe, K.Sommer // Chem. Eur. J., 2006, vol.12, 8770-8776].
Эффективная и универсальная синтетическая стратегия для конструирования хиральных хроманов была разработана с использованием катализируемой палладием реакции асимметрического аллильного алкилирования фенолов аллилкарбонатами. В результате систематического исследования этой реакции различными исследовательскими группами были найдены эффективные хиральные лиганды для катализаторов и установлены структурные особенности аллилкарбонатов, оказывающие существенное влияние на энантиомерную чистоту целевых продуктов [B.M.Trost, H.C.Schen, Li Dong, J.-P.Surivet, C.Sylvan // J.Am.Chem. Soc., 2004, vol.126, 11966-11983; B.M.Trost, H.C.Schen, L.Dong, J.-P.Surivet // J.Am.Chem. Soc., 2003, vol.125, 9276-9277].
Так, синтез оптически активного винилхромана (17) - синтона для хроманилметанолов (1) или (2), был проведен внутримолекулярным аллильным алкилированием аллилкарбоната (18) под действием палладий-содержащих катализаторов с хиральными лигандами (А), (Б) или (С). Наиболее эффективным оказался лиганд (С) (Trost's ligand). При использовании этого лиганда оптическая чистота винилацетата (17) возросла с 50% ее до 97% ее (схема 5).
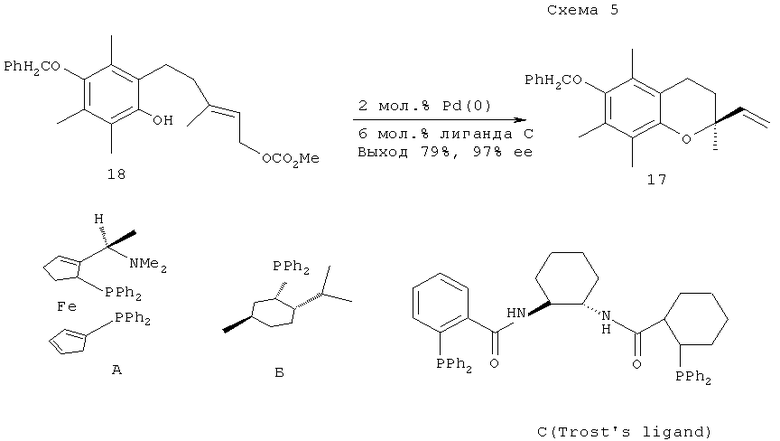
[E.Mizuguchi, K.Achiwa // Chem. Pharm. Bull., 1997, vol.45, 1209; J.-R.Labrosse, C.Poncet, P.Lhoste, D.Sinou // Tetrahedron Asymmetry, 1999, vol.10, 1069; B.M.Trost, H.C.Schen, J.-P.Surivet // Angew. Chem. Int. Ed., 2003, vol.42, 3943].
Описанные методы синтеза хиральных хроманов с применением асимметрического катализа имеют ряд общих недостатков. Они многостадийны и основаны на использовании чувствительных к действию влаги и воздуха металлоорганических реагентов и катализаторов. Синтезы хиральных лигандов для оптически активных катализаторов многостадийны и трудоемки. В связи с этим методы с применением асимметрического металлокомплексного катализа большого препаративного значения не имеют.
Более перспективными для практических целей представляются биокаталитические трансформации, рассматриваемые как актуальная альтернатива классическим химическим процессам. Уже сегодня известны примеры использования иммобилизированных гидролитических энзимов (липаз) в современном промышленном синтезе витаминов, фармацевтиков и биологически активных добавок, производство которых составляет более 10 тыс. тонн в год [W.Bonrath, R.Karge, T.Netscher // J. Of Molecular Catalysis B: Enzymatic, 2002, 19-20, 67-72].
Возможности стереодивергентного синтеза (S)-хроманилметанолов (1) или (2) с применением липаз исследованы в нескольких работах. Стереоселективным ацилированием прохирального хромандиметанола (19) винилацетатом в диэтиловом эфире в присутствии липазы Candida antarctica В был получен моноэфир (S)-20 с высокой энантиомерной чистотой (выход 60%, ее ≥98%). Простыми трансформациями с защитными группами моноэфир (S)-20 был превращен в хроманилметанол (S)-2 [R.Chenevert, G.Courchesne, N.Pelchat // Biorg. and Med. Chem., 2006, 14, 5389-5396]
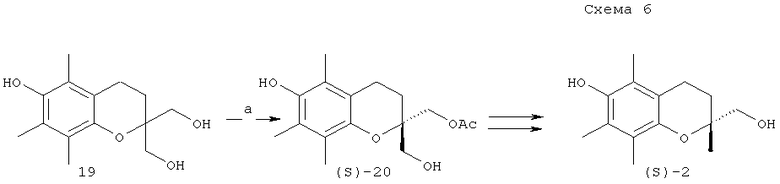
Реагенты и условия: a. Candida Antarctica lipase В, винилацетат, Et2O, 2 ч.
Кинетическое разделение хроман-2-метанола (±)-2 было реализовано также путем реакции спирта с ангидридом янтарной кислоты под действием липазы Amano PS-30 на цеолитном носителе в растворе трет-бутилметилового эфира. Данная методика позволила исключить стадию хроматографического разделения продукта реакции от остаточного спирта. Полученный гемисукцинат (S)-22 и спирт (R)-2 разделили простой химической обработкой (схема 8) [J.A.Hyatt, C.Skelton // Tetrahedron Asymmetry, 1997, vol.8, 523-526].
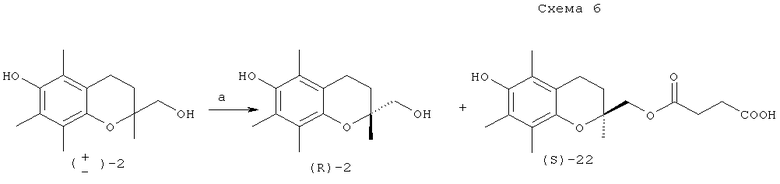
Реагенты и условия: а. Аmаnо PS-30, янтарный ангидрид, t-BuOMe.
Энантиомерная чистота гемисукцината составила 70-87% при конверсии 40-45%. Повторное ацилирование скалемической смеси позволило повысить энантиомерный избыток до 95-97% [E.A.Couladouros, V.I.Moutsos, M.Lampropoulou, J.L.Little, J.A.Hyatt // J. Org. Chem., 2007, 72, 6735-6741].
Кинетически избирательное ферментативное ацетилирование хроман-2-метанола (±)-2 было проведено под действием винилацетата и коммерчески доступной липазы PL-266 из Alcagenes sp. в диизопропиловом эфире (схема 7).
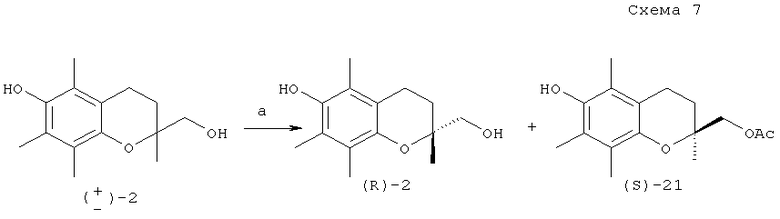
Реагенты и условия: a. PL-266, винилацетат, (Pri)2O, 33°C.
Полученный образец ацетата (S)-21 имел неудовлетворительное значение ее (67%). После снятия ацетатной защиты спирт (S)-2 был подвергнут повторному ферментативному ацетилированию, что привело к увеличению энантиомерного избытка в целевом продукте до 99% ее [M.Nozawa, K.Takhashi, K.Kato, H.Akita // Chem. Pharm. Bull., 2000, vol.48, №2, 272-277].
Во всех перечисленных выше работах в реакциях биокаталитической трансэтерификации хроманилметанолов (1) и (2) использовали органические растворители эфирного типа, которые известны своей горючностью, взрывоопасностью, токсичностью, канцерогенностью и т.д. Необходимость применения органических растворителей существенно снижает препаративную ценность описанных биокаталитических синтезов, особенно при их реализации в укрупненном масштабе.
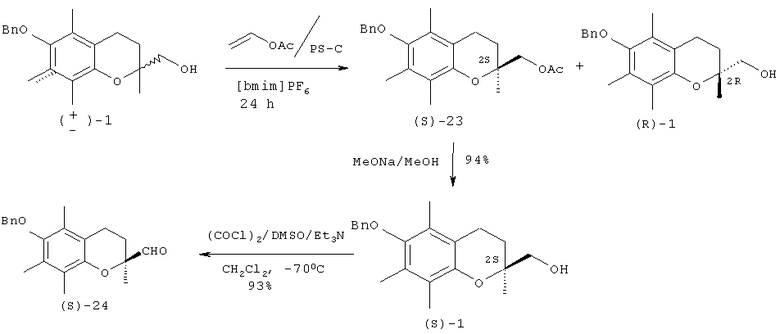
Цель предлагаемого способа состоит в том, чтобы в биокаталитическом синтезе (S)-хроманилметанола (S)-1 заменить эфирные растворители на экологически безопасный растворитель. Поставленная цель достигается путем использования в реакции энантиоселективного ацилирования рацемических хроманилметанолов (1) и (2) в качестве растворителя ионной жидкости [bmim]РF6 (1-бутил-3-метилимидазолий гексафторфосфата). Ранее ионная жидкость в реакциях трансэтерефикации хроманилметанолов не использовалась.
Предлагаемый новый способ получения (S)-(-)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола формулы (1) заключается в проведении кинетически избирательного ацетилирования (±)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола (±)-1 в ионной жидкости [bmim]PF6 с помощью винилацетата при катализе коммерчески доступной липазой Аmаnо PS из дрожжей Burkholderia cepacia. Реакцию проводили при перемешивании в течение 24 часов при комнатной температуре, используя эквимольное соотношение рацемического хроманилметанола и ацилирующего реагента и весовое соотношение спирта (±)-1 и липазы - 3:2. По достижению заданной конверсии (39%) реакционную смесь экстрагировали диэтиловым эфиром (3×8 мл), объединенные эфирные экстракты концентрировали в вакууме при 40°С. Ионную жидкость [bmim]PF6 и липазу Аmаnо PS концентрировали в вакууме при температуре не выше 40°С и повторно рециклизовали.
Продукт реакции (-)-ацетат (S)-23 отделяли от остаточного спирта (R)-1 колоночной хроматографией на силикагеле и трансформировали в целевой спирт (S)-1 обработкой 1М раствором метилата натрия в метиловом спирте. Выход спирта (S)-1 в расчете на его содержание в рацемате составил 64%. Энантиомерный избыток (ее) 93%, [α]D 20-2.1° (0.7, СНСl3). Энантиомерный избыток (S)-1 определяли на основании анализа спектров ЯМР 1Н диастереомерных эфиров (эфиров Мошера), полученных взаимодействием спирта (S)-1 с хлорангидридом (+)-α-метокси-α-трифторметил-α-фенилуксусной кислоты. Энантиомерный избыток (S)-1 был подтвержден также трансформацией спирта (S)-1 (окисление по Сверну 93% выход) в известный хроман-2-карбоксиальдегид (S)-24 [α]D 20 11.3° (0.9, СНСl3), литературные данные: [a]D 23 12.3° (1.6, СНСl3) [J.A.Hyatt, C.Skelton // Tetrahedron Asymmetry, 1997, vol.8, 523-526].
При проведении ферментативного ацилирования в смеси ионной жидкости [bmim]PF6 и (Рri)2О при соотношении v/v [bmim]PF6 (Pri)2O: 3:1, 1:1, 1:3 и в (Рri)2О, удельное оптическое вращение полученного соединения (S)-1 составило -2.0°, -1.9°, -1.5° и -1.4° соответственно. Литературные данные: [α]D 23 - 2.36° [M.Nozawa, K.Takhashi, K.Kato, H.Akita // Chem. Pharm. Bull., 2000, vol.48, №2, 272-277].
Преимущества предлагаемого способа:
1. Использование ионной жидкости [bmim]PF6 как перспективного растворителя, который минимально воздействует на окружающую среду, легко отделяется от продуктов реакции и может быть использован повторно.
2. Стабильность липазы в ионной жидкости и возможность сохранения каталитической активности фермента и энантиоселективности реакции как минимум при трехкратной рециклизации.
3. При использовании в качестве растворителя [bmim]PF6 по сравнению с традиционными эфирными растворителями существенно возрастает энантиомерная чистота целевого продукта (S)-1.
Изобретение поясняется следующими примерами:
Получение (S)-6-бензилокси-2,5,7,8-тетраметил-хроман-2-илметанола (S)-1.
Пример 1: К раствору 180 мг (0.55 ммоль) хроманилметанола (±)-1 (получен из (±)-хроман-2-карбоновой кислоты, согласно методике [M.Nozawa, K.Takhashi, K.Kato, H.Akita // Chem. Pharm. Bull., 2000, vol.48, №2, 272-277]) в 2.8 мл [bmim]PF6 (получен по методу [J.G.Huddleston, H.D.Willauer, R.P.Swatloski, A.E.Visser, R.D.Rogers // Chem. Commun., 1998, 1765]) прибавили эквимольное количество винилацетата и 120 мг липазы Аmаnо PS. Реакционную массу перемешивали магнитной мешалкой 24 ч, следя за ходом с помощью ТСХ (гексан:этилацетат=3:1) и ВЭЖХ-анализом (условия: Helwett Packard 1050, колонка С-18 «zorbax», 250×4.6 мм, Vэ=1 мл/мин, СН3СОСN:Н2O - 80:20+Et3N, λ=254 нм). По достижении заданной конверсии 39%, реакционную смесь экстрагировали диэтиловым эфиром (3×8 мл), объединенные эфирные экстракты концентрировали в вакууме при 40°С. Остаток фракционировали на колонке с SiO2 (8 г, элюент - петролейный эфир). Получили 70 мг (69% в расчете на содержание в рацемате) ацетата (S)-23, Rf 0.74 (гексан:этилацетат=3:1), [α]D 20+3.2° (с=1.3, СНСl3) и 107 мг остаточного спирта (R)-1, Rf 0.42 (гексан:этилацетат=3:1), [α]D20+1.1° (c=1.6, CHCl3).
К раствору 70 мг (0.19 ммоль) соединения (S)-23 в 4 мл метилового спирта добавили 4 мг (0.17 ммоль) натрия. Реакционную смесь перемешивали 0.5 ч, после чего прилили 5% раствор НСl (до нейтральной реакции), экстрагировали (3×7 мл) EtOAc, упарили и остаток хроматографировали на колонке с SiO2 (4 г, элюент - петролейный эфир), получили 58 мг (93%) соединения (S)-1, Rf 0.42 (гексан:этилацетат=3:1), [α]D 20-2.1° (0.7, СНСl3, ([α]D 23-2.36° [M.Nozawa, K.Takhashi, K.Kato, H.Akita // Chem. Pharm. Bull., 2000, vol.48, №2, 272-277]).
Соединение (S)-23: Спектр ЯМР 1H (δ, м.д., J/Гц): 1.38 (с, 3Н, МеС(2)); 1.87 (дт, 1Н, Н(3), J=6.4, J=13.2); 2.03 (дт, 1Н, Н(3), J=6.8, J=13.2); 2.16 (с, 3Н, МеС(3')); 2.18 (с, 3Н, МеС(7)); 2.25 (с, 3Н, МеС(5)); 2.30 (с, 3Н, МеС(8)); 2.70 (т, 2Н, Н(4), J=6.4); 4.21 (к, 2Н, Н(1'), J=11.2); 4.77 (с, 2Н, Н(1'')); 7.40 (т, 1Н, Н(5''), J=7.2); 7.47 (т, 2Н, Н(3''), Н(7''), J=7.6); 7.56 (т, 2Н, Н(4''), Н(6''), J=6.8). Спектр ЯМР 13С (δ, м.д.): 11.86, 12.06 и 12.93 (МеС(5), МеС(7) и МеС(8)); 20.20 (С(3')); 20.93 (С(4)); 22.03 (МеС(2)); 28.52 (С(3)); 68.77 (С(1')); 73.59 (С(2)); 74.80 (С(1'')); 117.29 (С(5)); 123.17 (С(8)); 126.08 (С(7)); 127.78, 127.87 и 128.53 (С(3''-7'')); 128.34 (С(4а)); 137.99 (С(2'')); 147.34 (С(8а)); 148.68 (С(6)).
Соединение (S)-1: Спектр ЯМР 1H (δ, м.д., J/Гц): 1.30 (с, 3Н, МеС(2)); 1.76-1.82 (м, 1Н, Н(3)); 2.03-2.08 (м, 1Н, Н(3)); 2.13 (уш.с, 1Н, ОН); 2.17 (с, 3Н, МеС(7)); 2.24 (с, 3Н, МеС(5)); 2.29 (с, 3Н, МеС(8)); 2.69-2.73 (м, 2Н, Н(4)); 3.68 (к, 2Н, Н(1'), J=7.0); 4.76 (с, 2Н, Н(1'')); 7.39 (т, 1Н, Н(5''), J=7.2); 7.46 (т, 2Н, Н(3''), Н(7''), J=7.6); 7.56 (д, 2Н, Н(4''), Н(6''), J=7.6). Спектр ЯМР 13С (δ, м.д.): 12.04, 12.16 и 13.00 (МеС(5), МеС(7) и МеС(8)); 20.31 (С(4)); 20.70 (МеС(2)); 27.79 (С(3)); 69.45 (С(1')); 74.89 (С(2)); 75.48 (С(1'')); 117.73 (С(5)); 123.04 (С(8)); 126.35 (С(7)); 127.91, 127.97 и 128.51 (С(3''-7'')); 128.36 (С(4а)); 138.01 (С(2'')); 147.42 (С(8а)); 148.74 (С(6)).
Пример 2: К 180 мг (0.55 ммоль) соединения (±)-1 в 2.8 мл [bmim]PF6 прибавили эквимольное количество винилацетата и 120 мг липазы Аmаnо PS. Получили, как описано в примере 1, 71 мг (70% в расчете на содержание в рацемате) ацетата (S)-23, Rf 0.74 (гексан:этилацетат=3:1), [α]D 20+3.2° (с=1.7, СНСl3) и 105 мг остаточного спирта (R)-1 ([α]D 20+1.1° (с=1.6, СНСl3)), спектры ЯМР 1H и 13С которых идентичные полученным в примере 1. Омыление соединения (S)-23, как описано в примере 1, дало 58 мг (92%) соединения (S)-1, Rf 0.42 (гексан:этилацетат=3:1), [α]D 20-2.1° (0.8, СНСl3).
Пример 3: К 180 мг (0.55 ммоль) соединения (±)-1 в 2.8 мл смеси растворителей (2.1 мл [bmim]PF6 + 0.7 мл (Рri)2О) прибавили эквимольное количество винилацетата и 120 мг липазы Аmаnо PS. Получили, как описано в примере 1, 73 мг (72% в расчете на содержание в рацемате) ацетата (S)-23, Rf 0.74 (гексан:этилацетат=3:1), [α]D 20+3.0° (с=1.1, СНСl3) и 104 мг остаточного спирта (R)-1 ([α]D 20+1.1° (с=1.5, СНСl3)), спектры ЯМР 1Н и 13С которых идентичные полученным в примере 1. Омыление соединения (S)-23, как описано в примере 1, дало 59 мг (92%) соединения (S)-1, Rf 0.42 (гексан:этилацетат-3:1), [α]D 20-2.0° (0.8, СНСl3).
Пример 4: К 180 мг (0.55 ммоль) соединения (±)-1 в 2.8 мл смеси растворителей (1.4 мл [bmim]PF6+1.4 мл (Pri)2О) прибавили эквимольное количество винилацетата и 120 мг липазы Аmаnо PS. Получили, как описано в примере 1, 76 мг (75% в расчете на содержание в рацемате) ацетата (S)-23, Rf 0.74 (гексан:этилацетат=3:1), [α]D 20+2.9° (c=1.2, СНСl3) и остаточного спирта (R)-1 ([α]D 20+1.5° (с=1.4, СНСl3)), спектры ЯМР 1H и 13С которых идентичные полученным в примере 1. Омыление соединения (S)-23, как описано в примере 1, дало 61 мг (91%) соединения (S)-1, Rf 0.42 (гексан:этилацетат=3:1), [α]D 20-1.9° (0.8, СНСl3).
Пример 5: К 180 мг (0.55 ммоль) соединения (±)-1 в 2.8 мл смеси растворителей (0,7 мл [bmim]PF6+2.1 мл (Рri)2О) прибавили эквимольное количество винилацетата и 120 мг липазы Аmаnо PS. Получили, как описано в примере 1, 60 мг (59% в расчете на содержание в рацемате) ацетата (S)-23, Rf 0.74 (гексан:этилацетат=3:1), [α]D 20+2.3° (с=1.3, СНСl3) и 114 мг остаточного спирта (R)-1 ([α]D 20+1.2° (с=1.7, СНСl3)), спектры ЯМР 1H и 13С которых идентичные полученным в примере 1. Омыление соединения (S)-23, как описано в примере 1, дало 50 мг (94%) соединения (S)-1, Rf 0.42 (гексан:этилацетат=3:1), [α]D 20 -1.5° (0.7, СНСl3).
Пример 6: К 180 мг (0.55 ммоль) соединения (±)-1 в 2.8 мл (Рri)2О прибавили эквимольное количество винилацетата и 120 мг липазы Аmаnо PS. Получили, как описано в примере 1, 66 мг (65% в расчете на содержание в рацемате) ацетата (S)-23, Rf 0.74 (гексан:этилацетат=3:1), [α]D 20+2.3° (с=1.5, СНСl3) и 111 мг остаточного спирта (R)-1 ([α]D 20+1.3° (с=1.8, СНСl3)), спектры ЯМР 1H и 13С которых идентичные полученным в примере 1. Омыление соединения (S)-23, как описано в примере 1, дало 54 мг (92%) соединения (S)-1, Rf 0.42 (гексан:этилацетат=3:1), [α]D 20 -1.4° (0.9, СНСl3).
Получение (S)-6-бензилокси-2,5,7,8-тетраметил-2-хроманкарбоксальдегида (S)-24. К раствору 198 мг (2.54 ммоль) ДМСО в 2 мл хлористого метилена при охлаждении до -70°С добавили 0.11 мл (1.32 ммоль) оксалилхлорида и перемешивали 0.5 ч. Затем добавили раствор 50 мг (0.16 ммоль) соединения (S)-1 в 2 мл хлористого метилена и перемешивали 1 ч при -70°С, после добавили 0.7 мл триэтиламина при -70°С и перемешивали 0.5 ч, температуру повысили до 0°С и перемешивали еще 0.5 ч. Реакционную смесь разбавили 10 мл воды и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои сушили над MgSO4, концентрировали при пониженном давлении. Остаток хроматографировали на колонке с SiO2 (5 г, элюент-гексан), получили 46 мг (93%) соединения (S)-24, Rf 0.67 (гексан:этилацетат=3:1), [α]D 20 11.3° (0.9, СНСl3), ([α]D 23 11.9° [N.Cohen, R.T.Lopresti, G.Saucy // J.Am.Chem. Soc., 1979, vol.101, 6710-6714]). Спектр ЯМР 1H (δ, м.д, J/Гц): 1.46 (с, 3Н, МеС(2)); 1.84-1.91 (м, 1Н, Н(3)); 2.18 (с, 3Н, МеС(7)); 2.26 (с, 3Н, МеС(5)); 2.29 (с, 3Н, МеС(8)); 2.54-2.69 (м, 2Н, Н(4)); 4.74 (с, 2Н, Н(1'')); 7.39 (т, 1Н, Н(5''), J=7.2); 7.45 (т, 2Н, Н(3''), Н(7''), J=7.2); 7.53 (д, 2Н, Н(4''), Н(6''), J=7.2); 9.69 (с, 1Н, Н(1')). Спектр ЯМР 13С (δ, м.д.): 11.97, 12.01 и 12.93 (МеС(5), МеС(7) и МеС(8)); 20.32 (С(4)); 21.60 (МеС(2)); 27.78 (С(3)); 74.77 (С(1'')); 80.47 (С(2)); 117.78 (С(5)); 123.19 (С(8)); 126.42 (С(7)); 127.76, 127.91 и 128.53 (С(3''-7'')); 128.64 (C(4a)); 137.81 (C(2'')); 147.51 (C(8a)); 149.20 (C(6)); 204.38 (C(1')).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 6-O-[β-D-(2,3,4,6-ТЕТРА-O-АЦЕТИЛ)ГЛИКОПИРАНОЗИЛ]-d,l-α-ТОКОФЕРОЛОВ | 2007 |
|
RU2350620C1 |
| БИОКОНЪЮГАТЫ ТРИТЕРПЕНОВЫХ КИСЛОТ ЛУПАНОВОГО РЯДА С ГИДРАЗИДОМ КИСЛОТЫ "ТРОЛОКС", СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИММУНОТРОПНЫХ И ПРОТИВОВОСПАЛИТЕЛЬНЫХ ВЕЩЕСТВ | 2010 |
|
RU2464273C2 |
| ПРОИЗВОДНЫЕ 2-(ИМИНОМЕТИЛ)АМИНОФЕНИЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ ВЕЩЕСТВА | 1998 |
|
RU2183211C2 |
| ТОКОФЕРОЛЫ, ТОКОТРИЕНОЛЫ И ДРУГИЕ ПРОИЗВОДНЫЕ ХРОМАНА И БОКОВЫХ ЦЕПЕЙ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 1999 |
|
RU2232758C2 |
| Способ получения хиральных монотерпеновых сульфинамидов | 2017 |
|
RU2650681C1 |
| СПОСОБ ПОЛУЧЕНИЯ (+)- И (-)-3-ОКСАБИЦИКЛО[3.3.0]ОКТ-6-ЕН-2-ОНОВ | 2008 |
|
RU2381221C2 |
| ТОКОФЕРОЛЫ, ТОКОТРИЕНОЛЫ, ДРУГИЕ ХРОМАНЫ И ПРОИЗВОДНЫЕ ПО БОКОВЫМ ЦЕПЯМ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2263672C2 |
| СПОСОБ ПОЛУЧЕНИЯ (3R,7R)-ГЕКСАГИДРОФАРНЕЗИЛБРОМИДА | 2007 |
|
RU2359952C2 |
| ЗАЩИТНОЕ СРЕДСТВО ДЛЯ НЕЙРОННЫХ КЛЕТОК СЕТЧАТКИ, СОДЕРЖАЩЕЕ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА ПРОИЗВОДНЫЕ ИНДАЗОЛА | 2006 |
|
RU2392938C2 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
Настоящее изобретение относится к энантиоселективному способу получения (S)-(-)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-метанола, который может быть применен для синтеза витаминов. Предложенный способ заключается в кинетически избирательном ацетилировании (±)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-метанола с помощью винилацетата под действием коммерчески доступной липазы Amano PS из дрожжей Burkholderia cepacia в ионной жидкости 1-бутил-3-метилимидазолий гексафторфосфате, [bmim]PF6 с последующим выделением продукта ацетилирования и его обработкой 1-молярным раствором метилата натрия в метиловом спирте известным способом. Технический результат разработки нового способа с получением высокой оптической чистоты продукта, возможностью повторного использования в реакции фермента и экологически приемлемого растворителя. 3 з.п. ф-лы, 6 пр.
1. Способ получения (S)-(-)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола формулы (1)
кинетически избирательным ацетилированием (±)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола винилацетатом под действием липазы при перемешивании в растворителе, отличающийся тем, что в качестве растворителя используют ионные жидкости, а в качестве фермента - липазу Amano PS из дрожжей Burkholderia cepacia.
2. Способ по п.1, отличающийся тем, что реакцию проводят при эквимольном соотношении (±)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола и винилацетата.
3. Способ по п.1, отличающийся тем, что реакцию проводят при весовом соотношении (±)-6-бензилокси-3,4-дигидро-2,5,7,8-тетраметил-2Н-1-бензопиран-2-илметанола и липазы 3:2.
4. Способ по п.1, отличающийся тем, что в качестве ионной жидкости используют 1-бутил-3-метилимидазолий гексафторфосфат.
| MASAKO NOZAWA ET AL, CHEM | |||
| PHARM | |||
| BULL, 2000, 48(2), 272-277 | |||
| JOHN A | |||
| HYATT ET ALL, Tetrahedron Asymmetry, 1997, 8, 4, 523-526 | |||
| ROBERT CHENEVERT ET AL, Bioorganic a Medicinal Chemistry, 2006, 14, 5389-5396 | |||
| ТОКОФЕРОЛЫ, ТОКОТРИЕНОЛЫ И ДРУГИЕ ПРОИЗВОДНЫЕ ХРОМАНА И БОКОВЫХ ЦЕПЕЙ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 1999 |
|
RU2232758C2 |
Авторы
Даты
2012-02-27—Публикация
2010-06-23—Подача