Изобретение относится к выделенному микроорганизму рода Mycobacterium, отличающемуся тем, что в нем инактивирован ген Rv0757, что дает фенотип PhoP-, и инактивирован второй ген, что предотвращает продукцию DIM (фенотип DIM-). Кроме того, настоящее изобретение относится к применению указанного микроорганизма для получения вакцины для иммунизации или профилактики туберкулеза.
УРОВЕНЬ ТЕХНИКИ
В настоящее время использование вакцин для профилактики туберкулеза, которые применяются у людей почти столетие, вызывают большие сомнения. БЦЖ, полученная из М.bovis, в настоящее время является единственной и наиболее широко используемой применяемой противотуберкулезной вакциной в мире. Разработка и повсеместное применение вакцины БЦЖ с начала 20-х годов ХХ века является значительным достижением, как предполагалось, способным ликвидировать туберкулез во всем мире. Однако эти первоначальные надежды не оправдались, и по результатам большого числа эффективных испытаний стало понятно, что вакцина БЦЖ, в своем настоящем виде, имеет ограниченное использование для контроля распространения заболевания, в частности респираторных форм у взрослого населения развивающихся стран, где заболевание является эндемичным [4]. Благодаря глубоким познаниям в области вирулентности M. tuberculosis и моделей иммунного ответа, которые приводят к возникновению защитного иммунитета, можно разработать более эффективные, чем БЦЖ, вакцины. Наблюдение, что при вакцинации БЦЖ можно получить повышенные уровни защиты, наводит на мысль, что жизнеспособность и длительная эффективность являются фундаментальными свойствами, необходимыми для эффективности противотуберкулезной вакцины. В настоящем изобретении в качестве опытной однократно дозированной живой вакцины авторы использовали штамм M. tuberculosis с инактивированным геном Rv0757 (phoP) и второй, независимой от phoP, мутацией, которая предотвращает синтез DIM, и показали, что кроме того, эта вакцина является более аттенуированной, чем БЦЖ у иммунокомпромитированных мышей SCID, она дает уровни защиты, сравнимые с уровнями БЦЖ у мышей, а у морских свинок даже большую защиту, чем БЦЖ.
Ген phoP наряду с phoR образует часть двухкомпонентной системы, которая демонстрирует высокую степень гомологии с другими двухкомпонентными системами, которые контролируют транскрипцию основных генов вирулентности внутриклеточных патогенов. Также он контролирует экспрессию многих других генов, которые не являются непосредственно вовлеченными в формирование вирулентности [19]. Устранение генов вирулентности само по себе, по-видимому, не является единственным способом аттенуации M. tuberculosis. Было показано, что ауксотрофный по пантотенату мутант M. tuberculosis, не способный синтезировать пантотеновую кислоту de novo, персистировал у мышей SCID, не вызывая заболевания [17]. Отдельные ауксотрофы по лейцину также являются значительно аттенуированными и не способными к репликации in vivo у мышей SCID [28]. Поэтому в настоящее время полагают, что вакцинные штаммы, основанные на M. tuberculosis, могут успешно быть аттенуированы, при этом сохраняя гены, которые подавляются в M. bovis BCG.
Ранее исследование более эффективных, чем БЦЖ, вакцин основывалось на том убеждении, что потеря вирулентности БЦЖ является тем самым фактором, который приводил к недостатку более мощной защитной эффективности [32]. Поэтому был сделан вывод, что новые аттенуированные мутанты M. tuberculosis со сниженной вирулентностью могли быть более эффективными в качестве вакцин. Тем не менее, недавнее исследование показало, что естественное инфицирование M. tuberculosis и вакцинация БЦЖ не отличаются по способности вызывать защитный иммунитет в отношении туберкулеза [34]. При этом возникает вопрос о возможности улучшения БЦЖ путем рациональной аттенуации M. tuberculosis. В этой связи особенно неожиданным и важным наблюдением является тот факт, что мутантный штамм M. tuberculosis по настоящему изобретению, сочетающий в себе 2 независимых мутации, 1 - относящейся к синтезу белка PhoP и 2 - относящейся к синтезу DIM, является более аттенуированным, чем БЦЖ на модели мышей SCID, даже при использовании в дозе, в 10 раз превышающей дозу БЦЖ, и вызывает более мощную защиту, чем БЦЖ на модели морских свинок.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Первый аспект изобретения относится к выделенному микроорганизму, относящемуся к роду Mycobacterium, отличающемуся тем, что содержит инактивацию гена Rv0757 (phoP) и второго гена, которая предотвращает продукцию DIM (фтиоцеролдимикоцерозатов). В настоящем документе этот выделенный микроорганизм будет обозначен как микроорганизм по настоящему изобретению.
Второй аспект настоящего изобретения относится к выделенному микроорганизму, относящемуся к роду Mycobacterium, отличающемуся тем, что содержит инактивированный ген Rv0757 (phoP) и вторую независимую от phoP мутацию, которая предотвращает продукцию DIM. В предпочтительном аспекте настоящего изобретения указанная вторая мутация находится в гене Rv2930 (fadD26) и представляет собой делецию гена fadD26, который является определяющим в синтезе DIM.
Третий аспект настоящего изобретения относится к использованию выделенного микроорганизма по настоящему изобретению для получения вакцины для профилактики туберкулеза у животных и, еще более предпочтительно, для профилактики туберкулеза у людей, а также к другим вариантам использования, которые в настоящее время имеют противотуберкулезные вакцины, для лечения заболеваний у людей, таких как рак мочевого пузыря.
В контексте настоящего изобретения «штамм M. tuberculosis SO2» может использоваться для обозначения выделенного микроорганизма штамма M. tuberculosis, который инактивировали посредством гена Rv0757, полученного из клинического штамма M. tuberculosis МТ103 путем инсерции устойчивого к канамицину маркера в сайт Bcll гена Rv0757 M. tuberculosis, используя гомологичную рекомбинацию в соответствии со способом, описанным Pelicic et al. (1997) (Efficient allelic exchange and transposon mutagenesis in Mycobacterium tuberculosis. Proc Natl Acad Sci USA 94: 10955-10960), и который дополнительно содержит инактивацию второго гена, что предотвращает продукцию DIM (фтиоцеролдимикоцерозатов). Таким образом, указанный штамм по изобретению содержит две независимых мутации в живых аттенуированных вакцинах, полученных из M. tuberculosis, причем независимая мутация phoP не влияет на свойства вакцины, полученной инактивацией указанного гена. В примере 9 описано создание выделенного микроорганизма рода Mycobacterium с независимой двойной мутацией, которая образует тот же фенотип, что и описанный для штамма M. tuberculosis SO2.
Также в контексте настоящего изобретения вакцина относится к лекарственным препаратам, введение которых стимулирует защитные силы организма в борьбе против заболевания.
Также в контексте настоящего изобретения БЦЖ будет использоваться для обозначения существующей вакцины, которую использовали для борьбы с туберкулезом с 1921. БЦЖ вакцина представляет собой живую аттенуированную вакцину, полученную из штамма M. bovis, который утратил свою вирулентность после субкультивирования в лабораторных условиях и который, как известно, имеет более ста делетированных генов (5).
В контексте настоящего изобретения Н37Rv используется для обозначения патогенного штамма M. tuberculosis, который был секвенирован, Cole et al., и обозначил эти гены как Rv (Ссылка Cole et al. 1998 Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature 393: 537-544).
В контексте настоящего изобретения также МТ103 будет использоваться для обозначения клинического изолята M. tuberculosis (ссылка 15 Camacho et al.).
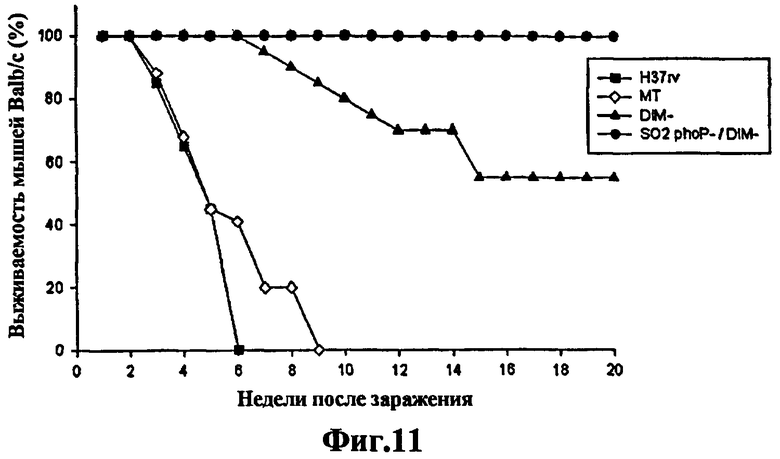
Кроме того, в контексте настоящего изобретения штамм DIM- будет использоваться для обозначения штамма комплекса M. tuberculosis, который не способен синтезировать фтиоцеролдимикоцерозаты, которые являются важными липидами, связанными с патогенностью M. tuberculosis. На Фиг.11 показано использование штамма 1А29, который состоит из штамма МТ103 с геном Rv2930 (fadD26), инактивированным с помощью транспозона 1096, описанного в ссылке 15 (Camacho et al. 1999 Identification of a virulence gene cluster of Mycobacterium tuberculosis by signature-tagged transposon mutagenesis. Mol Microbiol 34: 257-267).
В контексте настоящего изобретения штамм SO2+ pSO5 будет использоваться для обозначения штамма M. tuberculosis SO2, в котором мутацию в Rv0757 дополняют геном Rv0757 путем трансформации репликативной плазмиды с микобактериальным геном phoP, и он не способен к дополнительному синтезу DIM, его фенотипом является phoP+DIM-.
В контексте настоящего изобретения M. tuberculosis phoP- будет использоваться для обозначения штамма M. tuberculosis, который инактивирован посредством гена Rv0757 путем делеции между сайтами EcoRV-BspEI, его фенотипом является phoP-DIM+.
В контексте настоящего изобретения Rv2930 (fad26) будет использоваться для обозначения гена, который находится в начале оперона, отвечающего за синтез фтиоцеролдимикоцерозатов (ссылка 15 Camacho et al. 1999), и удаление этого гена в M. tuberculosis приводит к устойчивому фенотипу DIM-.
ОПИСАНИЕ ФИГУР
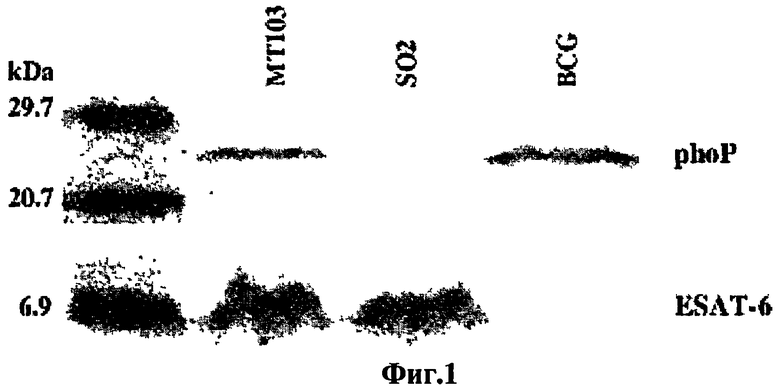
Фиг.1 - вестерн-блот. Используя поликлональные антитела, направленные против PhoP и ESAT-6, получали вестерн-блот внеклеточного белка штамма МТ103, штамма SO2 по настоящему изобретению и БЦЖ Pasteur. Штамм МТ103 имеет фенотип ESAT6+ и рhoP+, штамм SO2 имеет фенотип PhoP- и ESAT6+, и штамм вакцины БЦЖ является PhoP+ и ESAT6-.
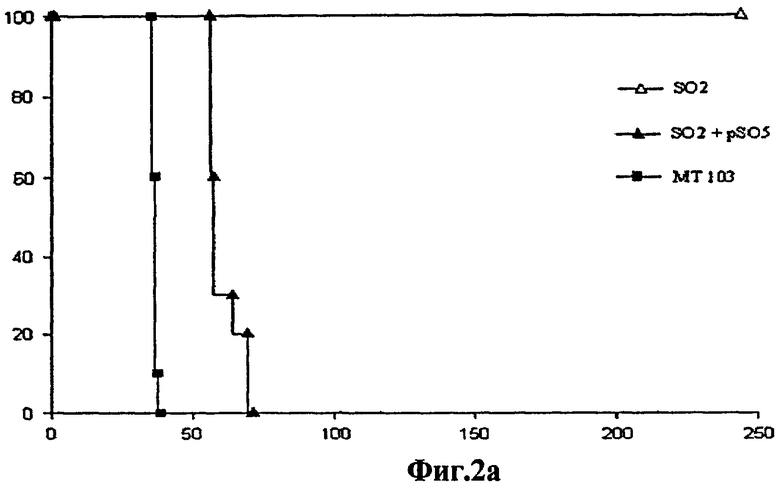
Фиг.2 - аттенуация штамма SO2 по настоящему изобретению у мышей SCID. а) График степени выживаемости мышей SCID (n=10), инфицированных аэрозолями, содержащими следующие штаммы: SO2, SO2, дополненный pSO5 (SO2 + pSO5) и МТ103 в количестве 20 КОЕ. Средний срок жизни составил более 245 дней (SO2), 62,1±5,88 (SO2 + pSO5) и 36,7±0,67 (МТ103). Мыши, инфицированные аэрозолем со штаммом SO2, выжили в течение 245 дней эксперимента, тогда как мыши, инфицированные МТ103 и штаммом SO2, дополненным рhoP, умерли до 62 дня. b) - Графики степени выживаемости мышей SCID (n=7), зараженных внутривенным введением штамма SO2 в количестве 5,4х106 КОЕ и БЦЖ Pasteur в количестве 2х105 КОЕ. Это показывает, что уровень аттенуации штамма SO2 превышает уровень аттенуации БЦЖ, противотуберкулезной вакцины, на сегодняшний день использующейся для вакцинации людей.
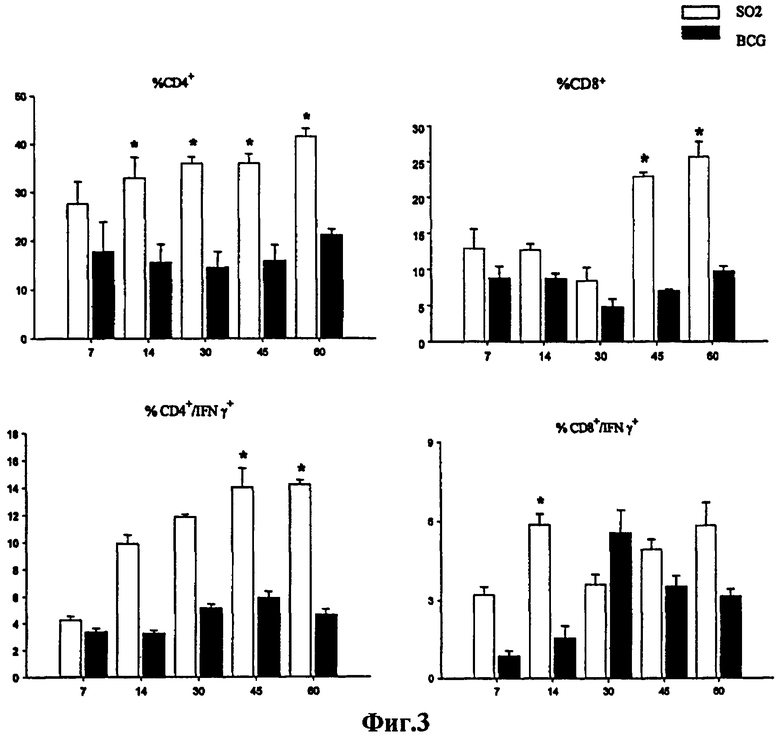
Фиг.3 - клеточные иммунные реакции у мышей, вакцинированных штаммом SO2 по настоящему изобретению и БЦЖ. Мышей Balb/c вакцинировали подкожной инъекцией БЦЖ (Phipps) в количестве 8х103 КОЕ или штаммом SO2 по настоящему изобретению в количестве 2,5х103 КОЕ. Результаты представлены в виде процента общего количества популяций CD4+/CD8+ в селезенке за промежутки времени после вакцинации и в виде процента клеток, которые экспрессируют IFN-γ от общей популяции CD4+/CD8+ после стимуляции полным антигеном M. tuberculosis. * обозначает статистически значимые различия между группами в данные точки времени (р<0,005). Результаты по клеточному иммунитету показывают, что у животных, вакцинированных штаммом SO2, по сравнению с мышами, вакцинированными БЦЖ, в дни 14, 30, 45 и 60 количество CD4+ лимфоцитов намного больше, и в дни 45 и 60 является значительной продукция специфического IFN-γ, направленного против антигенов M. tuberculosis. Количество CD8+ лимфоцитов у животных, вакцинированных штаммом SO2, больше в дни 45 и 60, а продукция специфического IFN-γ, направленного против антигенов M. tuberculosis, значительна в день 14 по сравнению с мышами, вакцинированными БЦЖ.
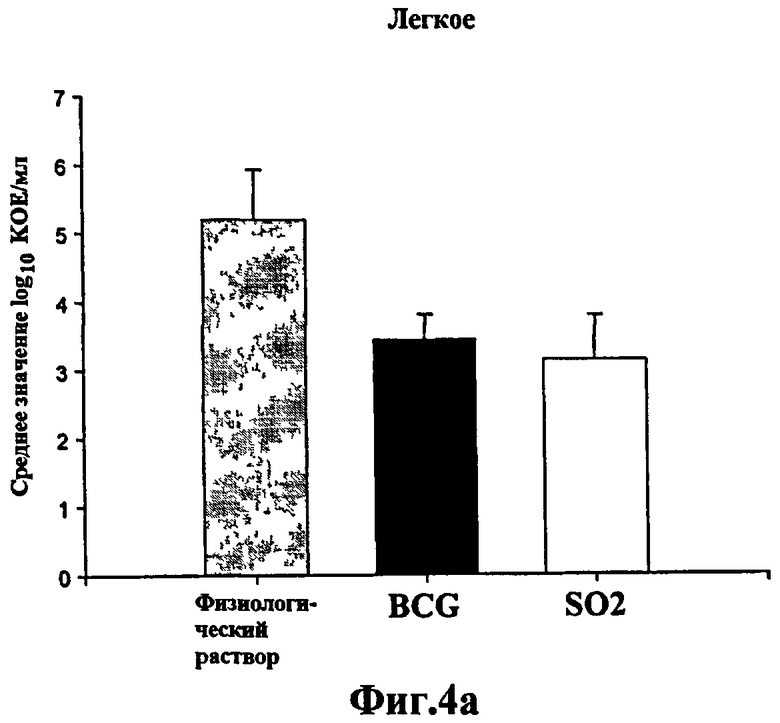
Фиг.4 - протективная эффективность штамма SO2 по настоящему изобретению в сравнении с БЦЖ у вакцинированных мышей Balb/c. Величины КОЕ, полученные при анализе легких (а) и селезенок (b) мышей Balb/c, вакцинированных штаммом SO2 по настоящему изобретению и БЦЖ, внутривенно зараженных M. tuberculosis H37Rv. Снижение значений КОЕ в легком и селезенке мышей, вакцинированных SO2, аналогично полученному у мышей, вакцинированных БЦЖ, что указывает на значительную защиту по сравнению с не вакцинированными мышами.
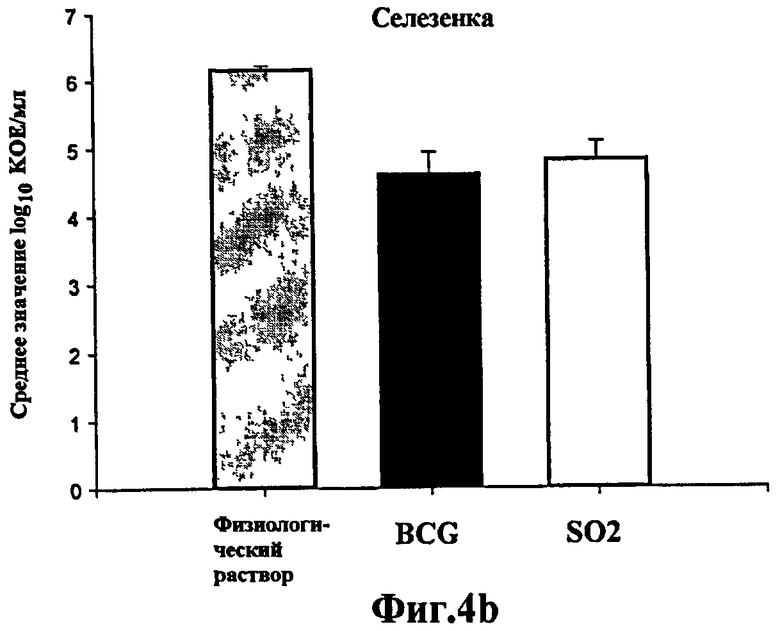
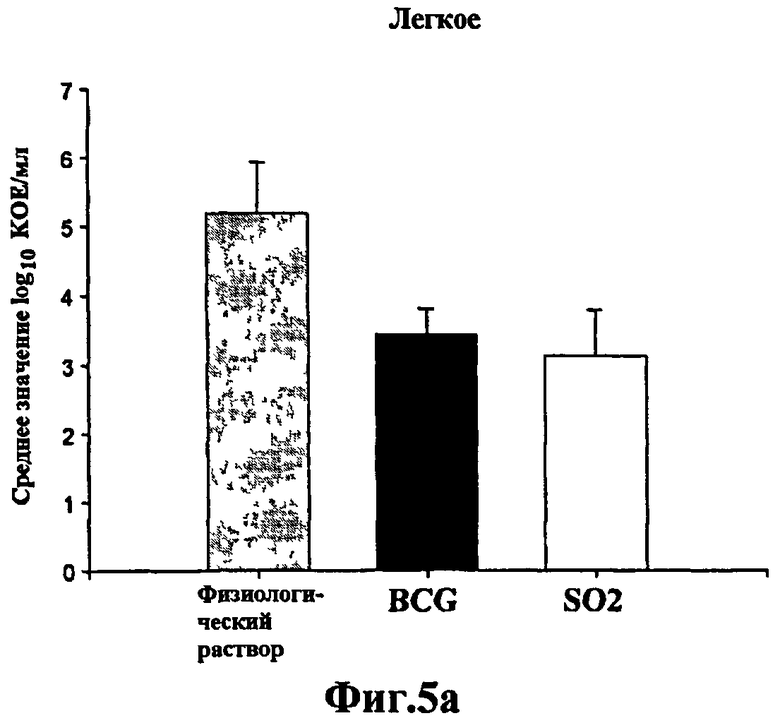
Фиг.5 - протективная эффективность у морских свинок, вакцинированных штаммом SO2 по настоящему изобретению и БЦЖ, в отношении низких доз M. tuberculosis H37Rv. Средние значения log10 КОЕ/мл в легких (а) и селезенке (b) вакцинированных морских свинок и контрольных морских свинок, которым ввели физиологический раствор, зараженных низкими дозами M. tuberculosis H37Rv. Данные представляют средние значения КОЕ всех животных (n=6), забитых через 6 недель. Планки погрешностей указывают на стандартное отклонение. Снижение значений КОЕ в легких и селезенке морских свинок, зараженных M. tuberculosis в низких дозах и вакцинированных SO2, аналогично полученному на морских свинках, вакцинированных БЦЖ, и является значительным по сравнению с не вакцинированными морскими свинками.
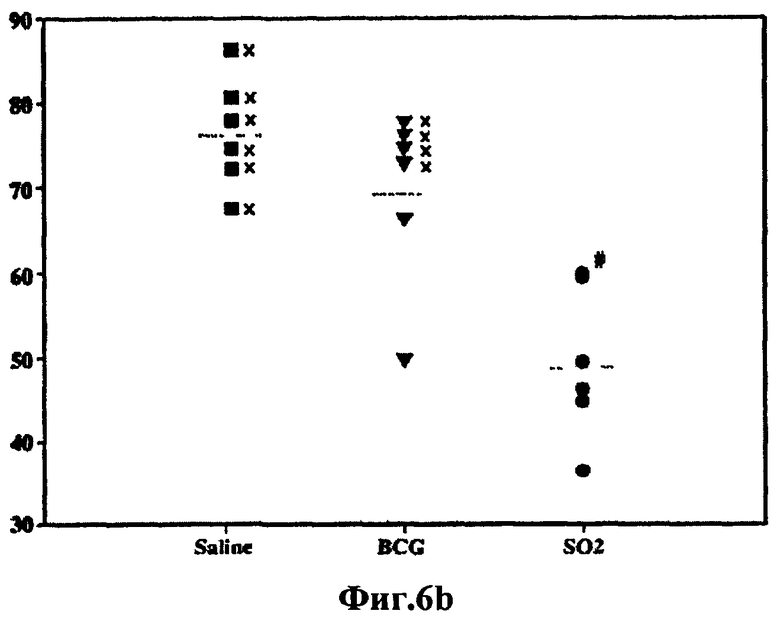
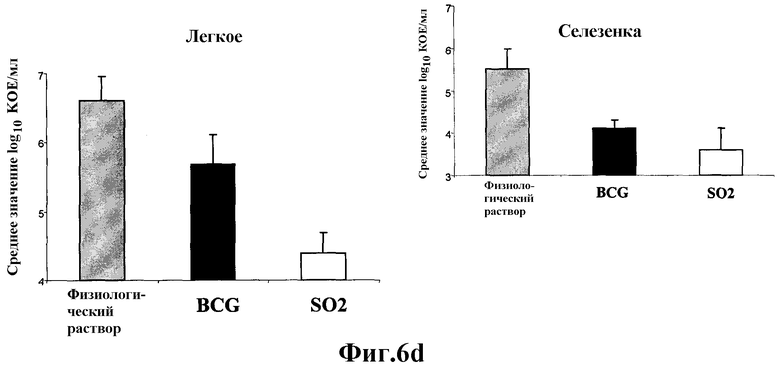
Фиг.6 - протективная эффективность у морских свинок, вакцинированных штаммом SO2 по настоящему изобретению и БЦЖ, в отношении заражения высокими дозами M. tuberculosis H37Rv. а) В связи с тем, что эксперименты, связанные с протекцией, у мышей и морских свинок, зараженных низкими дозами, показали наличие явной протекции у мышей, вакцинированных SO2 и БЦЖ, но без различий между БЦЖ и SO2, была использована модель морских свинок с заражением высокими дозами. График степени выживаемости морских свинок после аэрозольного инфицирования M. tuberculosis H37Rv. b) Степень выраженности заболевания легких и распространения инфекции, оцененные с помощью суммарной консолидации легочной ткани. Значения каждого отдельного животного, забитого в конечной точке, определенной человеком, помечают знаком «х». Пунктирная линия указывает среднее значение в процентах для данной группы (# в SO2 соответствует двум животным). с) Низкое разрешение (х30) изображений характерных гистологических срезов долей легкого, полученных от морских свинок каждой из обработанных групп. Черта представляет 1 мм. d) Среднее значение КОЕ подсчитывают в селезенке и легких вакцинированных и не вакцинированных морских свинок. Этот эксперимент показывает, что на модели морских свинок при высоких дозах заражения M. tuberculosis морские свинки, вакцинированные SO2, выживали значительно дольше, чем при вакцинации БЦЖ, и у них также образовывалось меньше поражений легких и было меньшее число КОЕ в селезенке и легких по сравнению с применяемой в настоящее время вакциной БЦЖ.
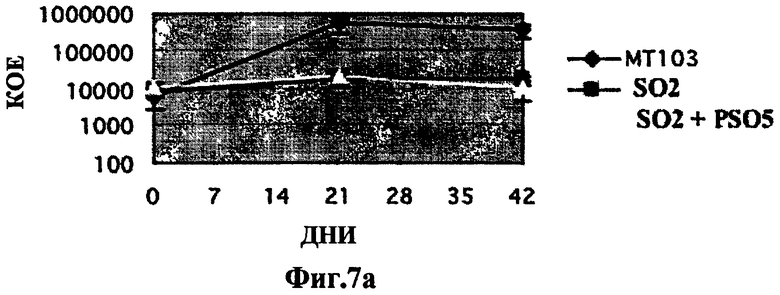
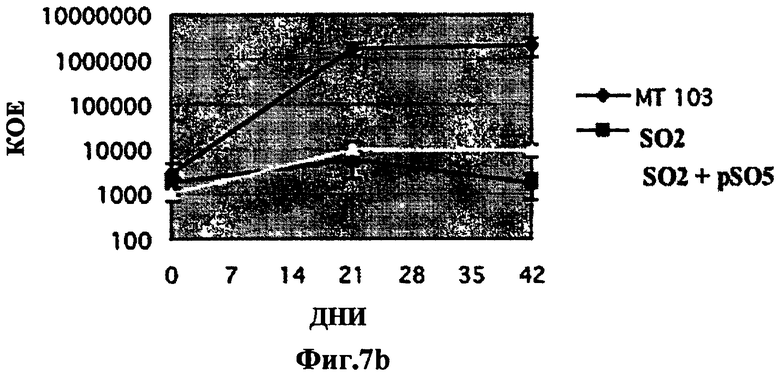
Фиг.7. Аттенуация внутривенного инфицирования штаммом SO2 по настоящему изобретению у мышей Balb/C не восстанавливается дополнением phoP. Исследование на мышах Balb/C внутривенного инфицирования штаммом SO2(phoP-DIM-) в количестве 105 КОЕ сравнили с инфицированием штаммом МТ103 дикого типа и штаммом, дополненным phoP (SO2 + pSO5). Уменьшение числа колоний (КОЕ) наблюдали и в селезенке (7а - селезенка) и в легком (7b - легкое), оценку производили через 3 и 6 недель. Уровни КОЕ штамма дикого типа не восстанавливались в дополненном штамме. Эти эксперименты у иммунокомпетентных мышей указывают на то, что неожиданная аттенуация могла быть вызвана второй дополнительной мутацией, которая не восстанавливается путем дополнения phoP.
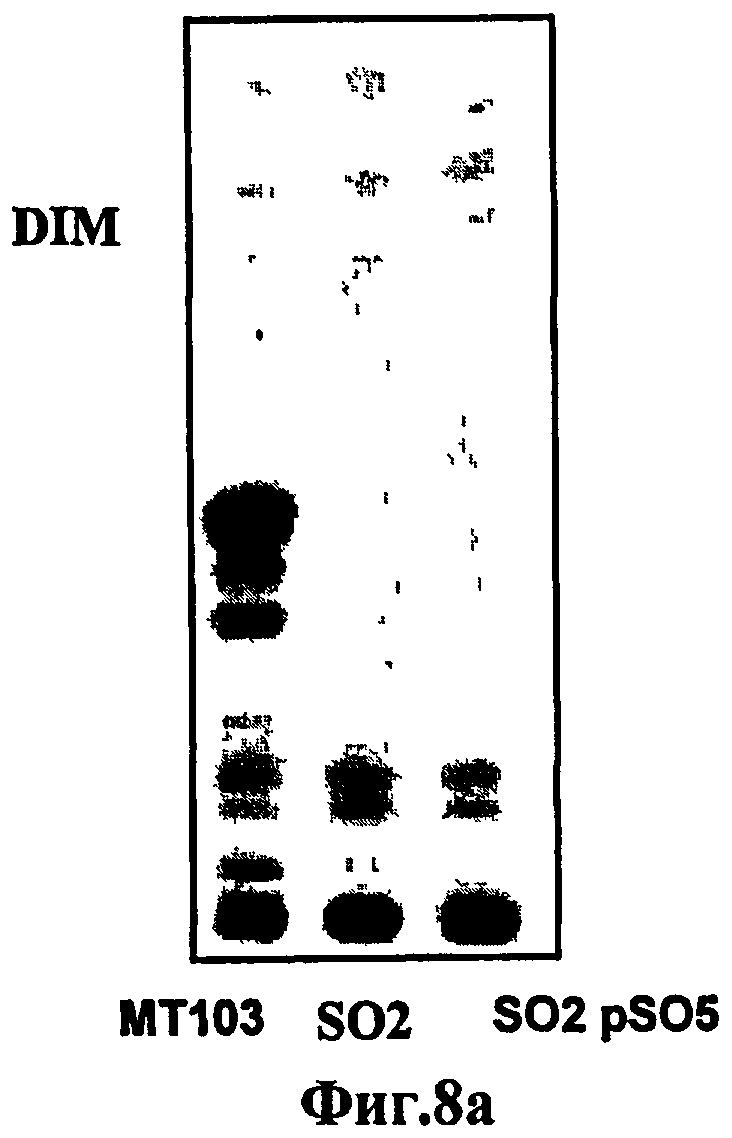
Фиг.8. Штамм SO2 по настоящему изобретению не продуцирует DIM, и синтез DIM является независимым от мутации phoP. Анализ липидов различных штаммов M. tuberculosis посредством тонкослойной хроматографии. а) У штамма МТ103 может быть обнаружена продукция DIM, тогда как DIM не продуцируется штаммом SO2 и дополненным геном phoP штаммом (SO2 pSO5). Это показывает, что отсутствие продукции DIM у штамма SO2 не зависит от phoP. На Фиг.8b показан штамм МТ103 и штамм МТ103, инактивированный только в отношении гена phoP (МТ103 ∆phoP::hyg), и оба они способны синтезировать DIM, что подтверждает, что продукция DIM не зависит от мутации phoP.
Фиг.9 - конструкция плазмид для инактивации гена fadD26.
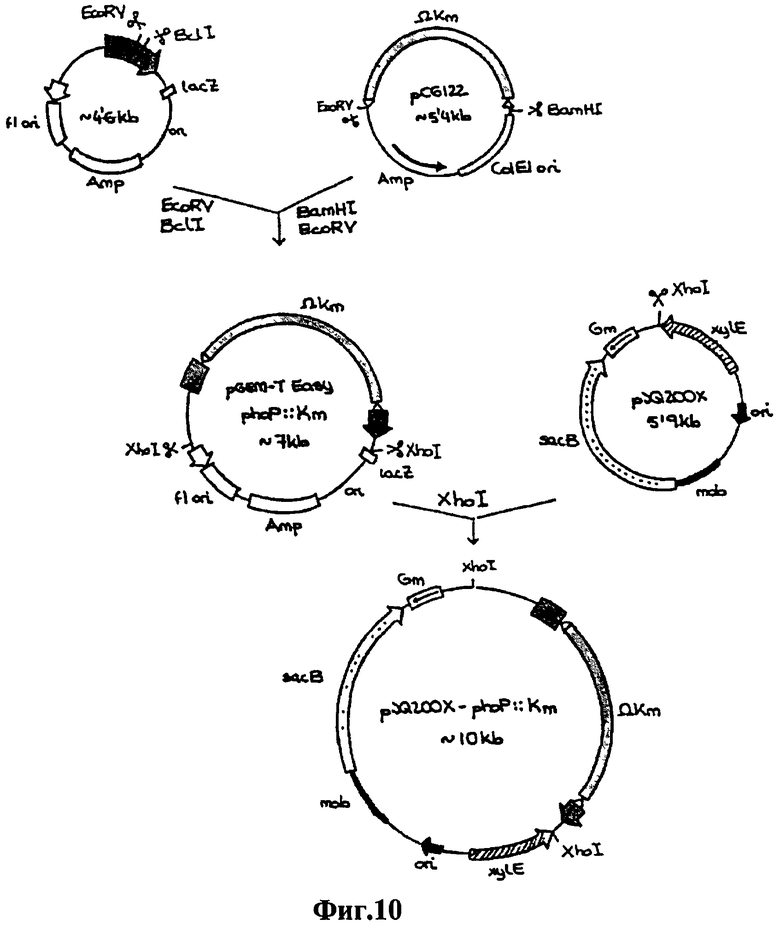
Фиг.10 - конструкция плазмид для инактивации гена phoP.
Фиг.11 - изучение аттенуации у мышей: график степени выживаемости мышей Balb/C, интратрахеально зараженных с целью изучения аттенуации различных штаммов M. tuberculosis. Н37Rv и МТ103 соответствуют штаммам M. tuberculosis без мутаций, и все мыши, зараженные этими штаммами, умерли до 10-й недели. Со штаммом M. tuberculosis DIM- (1А29) 50% мышей выжили через 20 недель. Все животные, зараженные штаммом SO2 (мутант phoP- и DIM-), выжили в течение 20 недель эксперимента.
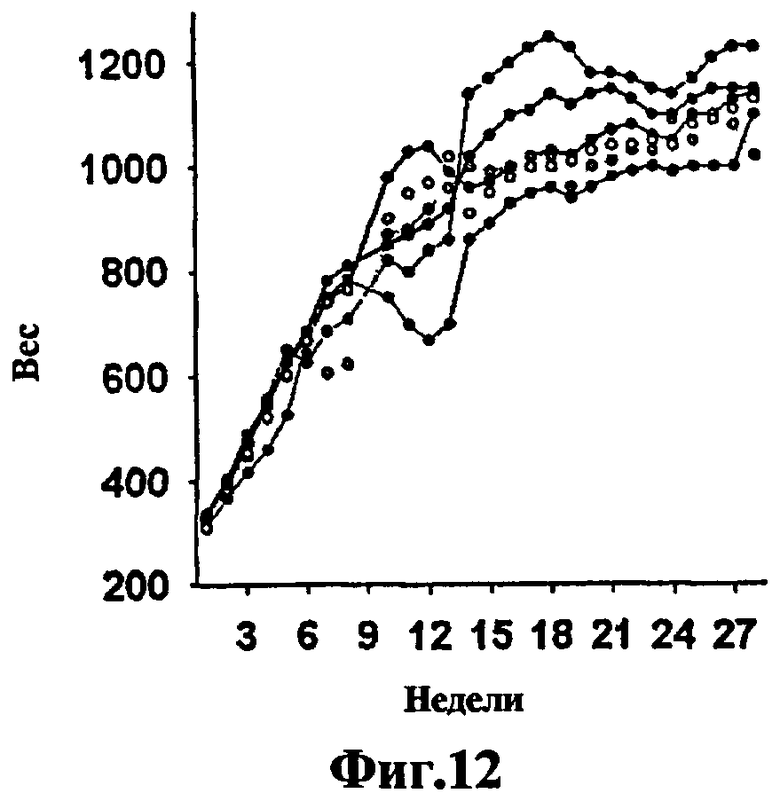
Фиг.12 - график степени выживаемости и веса морских свинок для изучения токсичности штамма SO2 (50-кратная доза вакцины). Чтобы показать, что штамм SO2 не токсичен, шесть морских свинок заражали 50-кратной дозой вакцины. После 6-месячного эксперимента степень выживаемости оказалась 100%. Увеличение массы тела наблюдали у всех животных в течение 6 месяцев, что показывает нетоксичность штамма SO2 (Y=масса в граммах каждую неделю после инфицирования. Х=время в неделях).
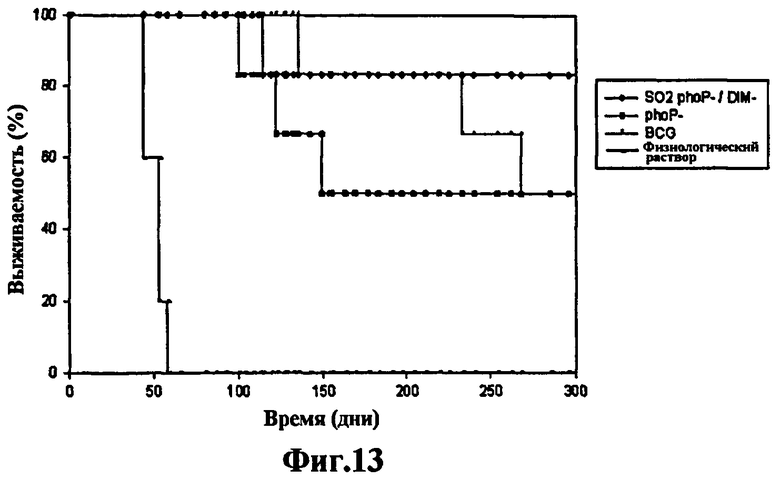
Фиг.13 - степень выживаемости вакцинированных морских свинок после заражения M. tuberculosis. Исследование протекции у морских свинок, степень выживаемости через 300 дней: график степени выживаемости не вакцинированных морских свинок (физиологический раствор), вакцинированных имеющейся в настоящее время вакциной БЦЖ, штаммом M. tuberculosis phoP- или штаммом SO2 (мутант phoP- и DIM-). Для изучения степени выживаемости после подкожной вакцинации животных заражали вирулентным штаммом M. tuberculosis (H37Rv) в высокой дозе. Через 60 дней 6 морских свинок, которые не были вакцинированы, умерли, тогда как группы, вакцинированные SO2, phoP- и БЦЖ, выжили. Через 300 дней после заражения 3 морские свинки, вакцинированные БЦЖ и phoP-, умерли, в то время как в группе, вакцинированной SO2, умерла только одна свинка, что указывает на то, что уровень защиты мутанта phoP аналогичен уровню защиты имеющейся в настоящее время вакцины БЦЖ, в то же время вакцинация штаммом SO2, двойным мутантом phoP- и DIM-, на модели морских свинок защищает лучше.
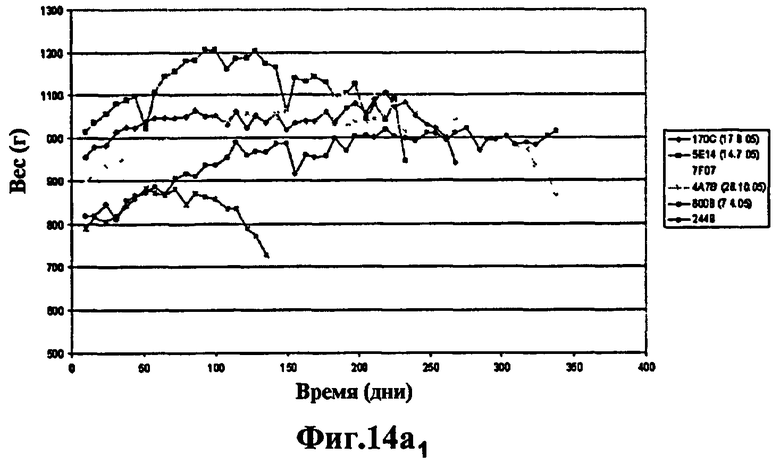
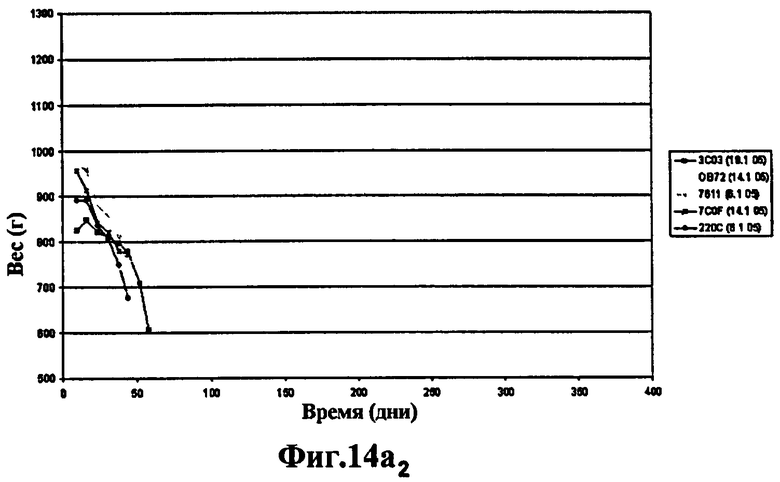
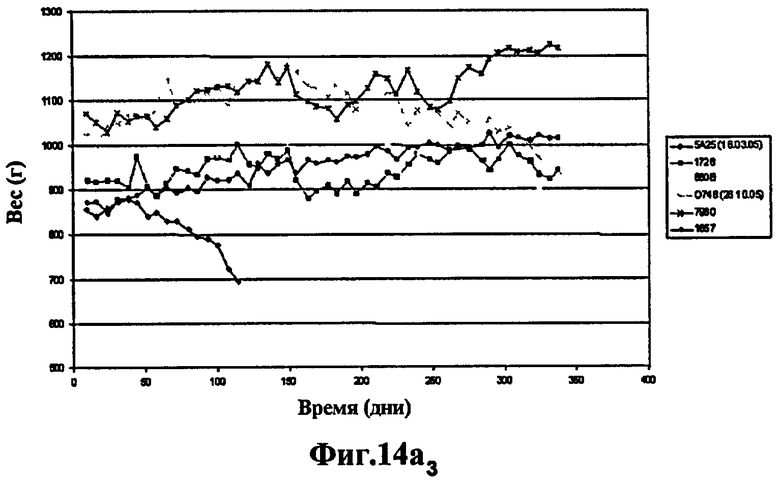
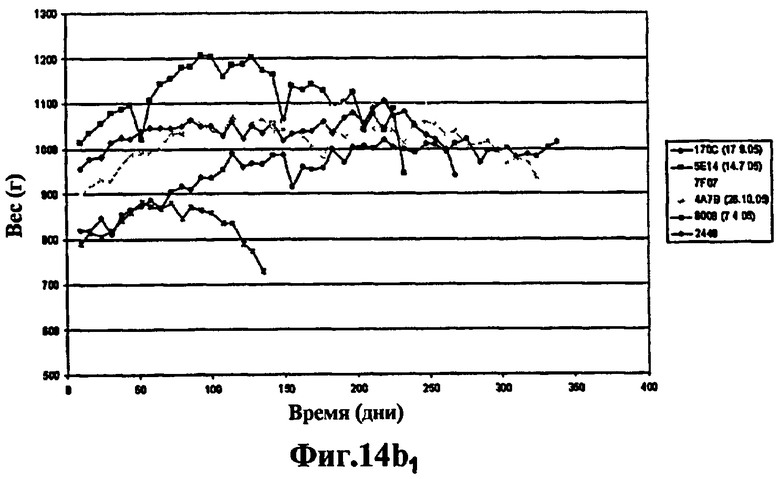
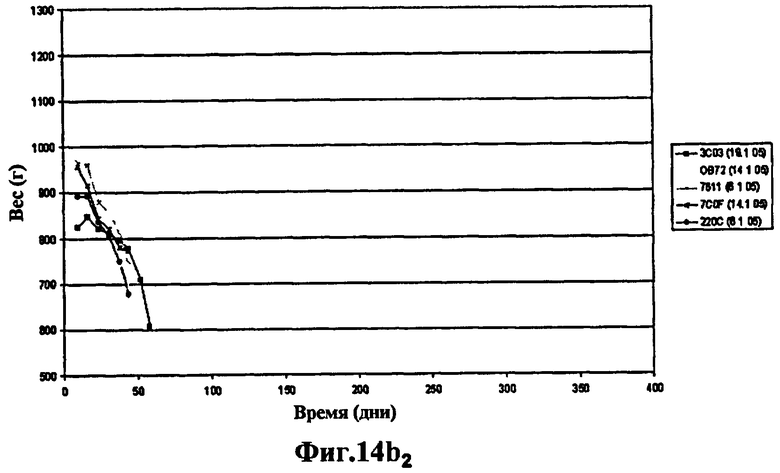
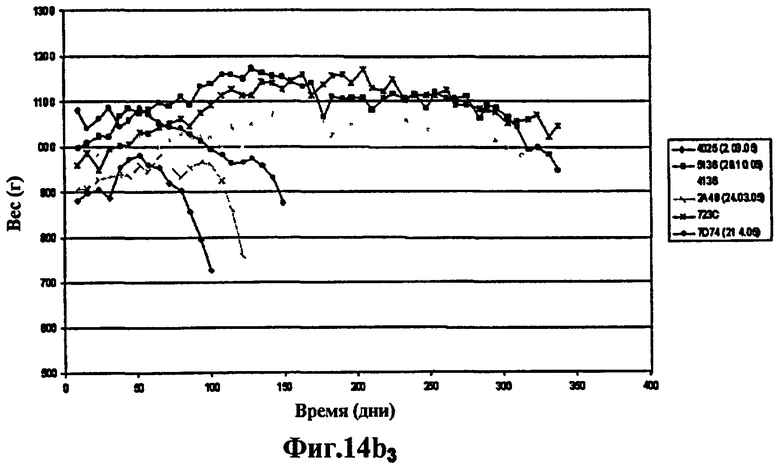
Фиг.14 - изучение протекции у морских свинок, степень выживаемости через 400 дней: продолжение эксперимента, представленного на Фиг.13. 6 не вакцинированных морских свинок умерли через 60 дней. Через 400 дней после заражения выжили 3 морские свинки из группы, вакцинированной штаммом SO2 (Фиг.14а), тогда как выжила только 1 морская свинка, вакцинированная БЦЖ (Фиг.14а и Фиг.14b) и phoP- (Фиг.14b), что вновь указывает на то, что защита мутанта phoP аналогична защите БЦЖ, в то время как вакцинация штаммом SO2, двойным мутантом phoP- и DIM-, через 400 дней эксперимента защищает лучше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретение относится к выделенному микроорганизму, относящемуся к роду Mycobacterium, отличающемуся тем, что содержит инактивацию гена Rv0757, что дает фенотип PhoP-, и инактивацию второго гена, что предотвращает продукцию DIM (фенотип DIM-). Кроме того, настоящее изобретение относится к применению указанного микроорганизма для получения вакцины для профилактики туберкулеза и непосредственно саму вакцину.
В описании настоящего изобретения показано, что выделенные штаммы phoP- DIM- рода Mycobacterium обладают характеристиками, которые делают их особенно эффективными для использования в качестве вакцин благодаря уровню аттенуации, которого они достигают, а также уровню защиты, который они создают.
Для демонстрации аттенуации иммунодепрессированных мышей SCID заражали штаммом SO2 (phoP- DIM-) из аэрозоля. Указанные мыши выживают (Фиг.2а) гораздо дольше, чем мыши, зараженные штаммом дикого типа. Кроме того, эта аттенуация сохраняется при дополнении phoP в штамме SO2 + pSO5 (phoP+ DIM-) (Фиг.8а).
Более того, при проведении исследований, связанных с аттенуацией, на иммунокомпетентных мышах Balb/C путем внутривенного введения (Фиг.7), показана очевидная аттенуация штамма SO2 по сравнению со штаммом МТ103 дикого типа, но, как ни удивительно, эта аттенуация не дополняется phoP, поскольку штамм SO2 + pSO5 (phoP+ DIM-) является столь же вирулентным для иммунокомпетентной мыши, как и штамм дикого типа. Исследования выживаемости на мышах Balb/C, при которых сравнивали штамм SO2 (DIM-, phoP) со штаммом только DIM-, демонстрируют, как ни удивительно, более высокую степень выживаемости для SO2 (Фиг.11).
Сравнительные исследования выживаемости SO2 и БЦЖ на мышах SCID, зараженных внутривенно, показывают, что уровень аттенуации штамма SO2 выше, чем БЦЖ, вакцины, которая в настоящее время используется у людей для борьбы с туберкулезом (Фиг.2b). Исследования токсичности на морских свинках с 50-кратной дозировкой вакцины, использованной для контроля качества партий вакцины БЦЖ, показывают, что в течение 6 месяцев исследования морские свинки прибавили в весе и у них ни макроскопически, ни микроскопически не наблюдались гистологические поражения, согласующиеся с туберкулезом, таким образом, подтверждая аттенуацию и нетоксичность штамма SO2 (Фиг.12). Эта неожиданная аттенуация и потеря токсичности обусловлена фенотипом PhoP- DIM-, и, кроме того, эти мутации сохраняют чувствительность к противотуберкулезным препаратам, что позволило бы провести стандартное лечение.
В настоящем описании показано, что в экспериментах с вакцинацией, осуществленных на мышах Balb/C, уровни защиты, создаваемые штаммом M. tuberculosis SO2 по настоящему изобретению и БЦЖ, были аналогичны как в легких, так и в селезенке вплоть до четырех недель после заражения. При сравнении относительных пропорций CD4+ и CD8+ клеток, полученных из селезенок вакцинированных мышей, у мышей, вакцинированных штаммом SO2 по настоящему изобретению, был обнаружен более высокий процент как CD4+, так и CD8+ клеток по сравнению с мышами, вакцинированными БЦЖ. Более того, при стимуляции этих клеток антигеном, полученным из культурального фильтрата, у мышей, вакцинированных штаммом SO2 по настоящему изобретению, на 45 и 60 дни после вакцинации определяли достоверно более высокий процент CD4+/IFN-γ+. Несмотря на то что этот процент не является значимым в каждой точке времени, аналогичную тенденцию определяли и для CD8+/IFN-γ+ у мышей, вакцинированных штаммом SO2 по настоящему изобретению. Эти данные указывают на то, что вакцинация штаммом SO2 по настоящему изобретению приводит к более эффективной активации Т-клеток по сравнению с вакцинацией БЦЖ, которую определяли по синтезу IFN-γ. При условии, что защитный иммунитет к M. tuberculosis в целом зависит от клеточного иммунного ответа типа ТН1, отличающегося секрецией IFN-γ специфическими Т-клетками в ответ на антиген, можно сделать вывод, что относительно высокие уровни Т-клеточной активации, индуцированные штаммом SO2 по настоящему изобретению, обеспечивают ему способность создавать сильный защитный ответ.
Кроме того, используя различные системы и модели для проведения эксперимента и большое число условий, авторы смогли показать сравнительную возможность использования мышиной модели для изучения различий в защите, создаваемой БЦЖ по сравнению с SO2. На мышиной модели было показано, что защиту создают две вакцины, SO2 (phoP- DIM-) и БЦЖ.
Для сравнения вакцин в более значимом и на каждом из этапов более трудоемком эксперименте с морскими свинками была предпринята определенная стратегия. Этот систематический подход для сравнения вакцин может представлять собой ценную исходную точку для определения лучших вероятных вакцин, для которых должны быть проведены дальнейшие опыты. Как правило, полагают, что морские свинки более чувствительны к заражению туберкулезом и поэтому могут быть более значимой моделью этого заболевания [30]. Преимущество морской свинки по сравнению с мышами заключается в том, что патология заболевания аналогична патологии, обнаруживаемой при туберкулезе у людей, и поэтому она является подходящей моделью для тестирования эффективности вакцины. В недавнем исследовании вакцины, вводимой путем аэрозоля, содержащей двойной ауксотрофный мутант M. tuberculosis, по пантотенату и лейцину, через пять недель после аэрозольной аппликации M. tuberculosis в легких и селезенке вакцинированных морских свинок были обнаружены уровни защиты, эквивалентные уровням, вызывающим M. bovis BCG, с ограниченным распространением инфекции в селезенку, индуцированным обеими вакцинами [34]. В другом исследовании, в котором использовали рекомбинантную БЦЖ, экспрессировавшую ESAT-6, более высокие, чем у M. bovis BCG, уровни защиты были обнаружены лишь в селезенке [6], указывая, что улучшенная защита связана с ее способностью предотвращать распространение инфекции из легкого.
Для осуществления указанного инфицирования морским свинкам в низкой дозе инокулировали M. tuberculosis H37Rv, и уровни защиты, создаваемые вакцинацией штаммом SO2 по настоящему изобретению и БЦЖ, оказались аналогичными как в легких, так и в селезенке в течение 4 недель после заражения. Обе вакцины создавали крайне эффективную защиту, снизив значения КОЕ в легких и селезенке приблизительно на 2 log по сравнению с контрольными группами, которым вводили физиологический раствор. Тем не менее, между двумя вакцинированными группами не оказалось статистически значимого различия. Авторы предположили, что за такой короткий период времени после инфицирования было бы трудно доказать большую эффективность новой вакцины по сравнению с БЦЖ. Это обусловлено тем фактом, что на данный момент КОЕ (колониеобразующие единицы) органов животных, вакцинированных БЦЖ, настолько малы, что тест не обладает дифференцирующей способностью продемонстрировать значительное дополнительное снижение КОЕ. В других исследованиях выживаемости на морских свинках было показано, что несмотря на то что вакцинация БЦЖ обеспечивает создание статистически значимой защиты по сравнению с не вакцинированными контролями (или вакцинированными неэффективными вакцинами), эта защита является всего лишь частичной даже в отношении заражения низкими дозами M. tuberculosis. В исследованиях с применением низких доз, проведенных в течение от 60 до 80 недель после инфицирования, некоторые контроли с БЦЖ не создали защиту ни одной морской свинке [35], в то время как другие создали защиту низкому проценту (между 20 и 30%) животных [36] [37]. Аппликация в высокой дозе, с другой стороны, может привести к более тяжелому заболеванию, чем обычно используемое для оценки протективной эффективности вакцин против ТВ.
Для настоящего изобретения авторы использовали аэрозольное инфицирование с относительно высокой дозой M. tuberculosis H37Rv, а период исследования был продлен до 180 дней. Авторы сделали это для создания более жесткой степени заражения, которая может продемонстрировать возможную защитную эффективность штамма SO2 по настоящему изобретению, и в то же время для содействия в установлении степени различия с БЦЖ. В пересчете на выживаемость животные группы, вакцинированной БЦЖ, оказались значительно более защищенными по сравнению с не вакцинированными контролями, и у них наблюдалась наибольшая степень защиты, аналогичная обнаруженной в других исследованиях, несмотря на относительно высокую дозу инфицирования, использованную в нашем исследовании. Более того, авторы также обнаружили статистически значимое повышение протективной эффективности штамма SO2 (phoP- DIM-) по настоящему изобретению в сравнении с БЦЖ, определенное с помощью нескольких показателей, включая увеличение срока жизни и степень консолидации поражений легких. Эта менее тяжелая форма заболевания могла непосредственно отвечать за более высокую степень выживаемости животных, вакцинированных штаммом SO2 по настоящему изобретению.
Результаты, описанные в настоящем изобретении, показывают, что в соответствии со многими критериями оценки штамм SO2, а значит, и микроорганизм, относящийся к роду Mycobacterium (в частности, относящийся к комплексу M. Tuberculosis), с фенотипом phoP- DIM- является более эффективной вакциной, чем БЦЖ. Вакцина более аттенуированная, чем БЦЖ у мышей SCID, она создает мышам протективный иммунитет, который, по меньшей мере, не хуже иммунитета, создаваемого БЦЖ, и она обеспечивает более сильные клеточные иммунные реакции. Кроме того, в экспериментах по исследованию защиты, проводившихся на морских свинках, инфицированных высокими дозами H37Rv, штамм с фенотипом DIM- phoP- приводит к 100% выживаемости морских свинок в условиях, в которых БЦЖ достигает только 33% выживаемости. Полагают, что эта защита связана со снижением тяжести заболевания и бактериальной нагрузки.
Для определения того, обусловлен ли уровень защиты штамма SO2 (phoP- DIM-) мутацией phoP или же мог быть вызван дополнительной мутацией в DIM, на морских свинках проводили другой эксперимент вакцинации с инфицированием в высоких дозах. Группы из 6 животных вакцинировали БЦЖ, SO2 (РhoP- DIM-) и M. tuberculosis phoP- DIM+, и 6 животных, использованных в качестве контроля, не были вакцинированы. Эксперимент длился 400 дней.
В этом еще одном эксперименте не вакцинированные морские свинки умирали в течение 70 дней. Через 300 дней после инфицирования умерли 3 морские свинки, вакцинированные БЦЖ и phoP- DIM+, по сравнению всего лишь с одной в группе, вакцинированной штаммом SO2, что указывает на то, что защита, создаваемая мутантом phoP- DIM+, аналогична защите используемой в настоящее время вакцины БЦЖ, в то время как вакцинация штаммом SO2, двойным мутантом phoP- и DIM-, на модели морской свинки обеспечивает лучшую защиту (Фиг.13). Через 400 дней в группе, вакцинированной SO2, выжили 3 морские свинки (Фиг.14а), тогда как выжила только 1 морская свинка, вакцинированная БЦЖ (Фиг.14а и Фиг.14b) и phoP- DIM+ (Фиг.14b), указывая на то, что через 400 дней проведения эксперимента защита мутанта phoP- DIM+ является аналогичной защите БЦЖ, тогда как вакцинация штаммом SO2, двойным мутантом phoP- и DIM-, защищает эффективнее, неожиданный эффект более высокой протекции, чем БЦЖ, объясняется не одной только мутацией phoP-, но двойной мутацией phoP- DIM- штамма SO2.
Таким образом, первый аспект настоящего изобретения относится к выделенному микроорганизму, относящемуся к роду Mycobacterium, отличающемуся тем, что содержит инактивацию или делецию:
а) гена phoP- или одного или нескольких генов, которые регулируют ген phoP-, или которые регулируются геном phoP-, и
b) второго гена, который предотвращает продукцию DIM.
В предпочтительном варианте осуществления изобретения выделенный микроорганизм по изобретению отличается тем, что ген phoP- инактивирован путем инактивации или делеции гена Rv0757.
В более предпочтительном варианте осуществления изобретения выделенный микроорганизм по изобретению отличается тем, что продукцию DIM инактивируют путем делеции или инактивации гена Rv2930 (fadD26).
В еще более предпочтительном варианте осуществления изобретения выделенный микроорганизм по изобретению отличается тем, что он содержит делецию или инактивацию генов Rv2930 и Rv0757.
В другом варианте осуществления изобретения выделенный микроорганизм по изобретению отличается тем, что вид рода Mycobacterium относится к комплексу Mycobacterium tuberculosis.
Второй аспект изобретения относится к способу получения выделенного микроорганизма по изобретению, который включает:
а) инактивацию или делецию гена phoP или одного или нескольких генов, которые регулируют ген phoP, предпочтительно, инактивацию или делецию гена Rv0757, и
b) инактивацию или делецию второго гена, который предотвращает продукцию DIM, предпочтительно делецию или инактивацию гена Rv2930 (fadD26).
Третий аспект изобретения относится к вакцине (в данном документе - вакцина по изобретению) для иммунизации индивидуума против проявления симптомов, вызванных туберкулезом, при этом указанная вакцина содержит по меньшей мере один выделенный микроорганизм по изобретению.
В предпочтительном варианте осуществления изобретения вакцина также содержит фармакологически приемлемые эксципиенты.
Четвертый аспект изобретения относится к способу получения лекарственного средства, предпочтительно, вакцины, который включает введение выделенного микроорганизма по изобретению в подходящую среду для использования на людях или животных в терапевтически эффективной дозе и, необязательно, добавление эксципиентов, которые являются фармакологически приемлемыми для получения вакцин.
Указанное лекарственное средство подходит для лечения рака мочевого пузыря, для лечения или профилактики туберкулеза или в качестве вектора или адъюванта. Предпочтительно для иммунизации индивидуума против проявления симптомов, вызываемых туберкулезом.
Пятый аспект изобретения относится к применению выделенного микроорганизма по изобретению для получения вакцины по изобретению для профилактики и/или лечения туберкулеза у людей или животных.
На протяжении всего описания и формулы изобретения слово «содержит» и его варианты не подразумевают исключения других технических характеристик, добавок, компонентов или этапов. Для специалиста в данной области другие цели, преимущества и характеристики изобретения будут частично вытекать из описания и частично при осуществлении практики изобретения. В качестве не ограничивающего наглядного примера настоящего изобретения предлагаются следующие примеры и фигуры.
ПРИМЕРЫ
Пример 1. Материалы и способы
1.1. Выделение белка и иммуноблоттинг. К белку PhoP были получены поликлональные антитела, которые получали четырьмя дозами PhoP (0,5 мг) в 0, 4, 8, 12 и 16 недели, соответственно. Антитела против PhoP определяли, используя тест ELISA (ZEU-Immunotec Zaragoza, Spain). Моноклональные антитела против ESAT-6 были любезно предоставлены S. Cole [24]. Бесклеточные белковые экстракты микобактерий получали из ранних культур в log-фазе, которые выращивали на жидкой среде Middlebrook 7H9-ADC, далее действуя обычными способами [25]. Белковые экстракты M. tuberculosis фильтровали через фильтр Millex-GP с размером пор 0,22 мкм (Millipore, Bedford, MA). Собирали фильтрат культуры M. tuberculosis H37Rv, культивированной в течение 5-6 недель, и отфильтрованные белки культуры преципитировали 45% (масса/объем) раствором сульфата аммония. В соответствии со стандартными способами проводили анализ вестерн-блот. В качестве вторичных антител использовали козьи антитела против антител кролика, меченные пероксидазой хрена (Bio-Rad Laboratories, Hercules, CA).
1.2. Заражение мышей SCID M. tuberculosis. Работу с мышами SCID проводили под наблюдением Комитета по охране животных в Университетском Госпитале “Germans Trias i Pujol” в соответствии с законами EU по защите лабораторных животных. Cвободные от специфических патогенов (spf) мыши SCID CB-17/Icr Ico были получены от Charles River (Bagneux Cedex, France). Для аэрозольного инфицирования мышей помещали в камеру для экспозиции инфекции, передаваемой воздушно-капельным путем (Glas-col Inc., Terre Haute, IN, USA). Небулайзер заполняли 7 мл суспензии M. tuberculosis, чтобы ввести в легкие около 20 жизнеспособных бацилл. Для каждой экспериментальной группы использовали по десять мышей. Для внутривенного инфицирования через латеральную хвостовую вену группы по 7 мышей инфицировали 200 мкл PBS, содержащего дозы, эквивалентные 2×105, 2×104 и 2×103 жизнеспособной БЦЖ и 5,4×106, 5,4×105, и 5,4×104 жизнеспособного штамма M. tuberculosis phoP. Используя тест Mantel-Haenszel, между обработанными мышами определяли значимость различий в сроке жизни. Подсчеты жизнеспособных клеток осуществляли по серийным разведениям гомогената, помещенного на агар Middlebrook 7H11+OADC и оцененного через 3 недели роста. Для проведения гистологического анализа ткани фиксировали в забуференном формолсолевом растворе и заливали в парафин. Делали срезы толщиной 5 мкм и окрашивали по Цилю-Нильсену.
1.3. Определение активации клеточного иммунитета у мышей Balb/c после подкожной вакцинации штаммом SO2 по настоящему изобретению и БЦЖ. Группы из четырех мышей Balb/c забивали на 7, 14, 21, 28, 45 и 60 дни после подкожной вакцинации БЦЖ (Phipps) в количестве 8×103 КОЕ или штаммом SO2 по настоящему изобретению в количестве 2,5×103. Селезенки удаляли и помещали в 2 мл среды RPMI и 10% эмбриональной сывороткой теленка (GIBCO, Invitrogen Corporation), содержащей 0,5 мг/мл коллагеназы II типа (Worthington, NJ, USA) и 2 Ед/мл ДНКазы (GIBCO), и инкубировали в течение 1 часа при 37°С в атмосфере 5% СО2. Затем пропускали их через клеточный фильтр с размером пор 70 мкм (Falcon, Becton Dickinson 70 µm Nylon 35-2350), давили плунжером шприца и промывали средой. Клетки центрифугировали, супернатант удаляли, а красные клетки извлекали лизирующим буфером [26]. После центрифугирования и отмывки средой RPMI клетки ресуспендировали в буфере FACS (1-кратный PBS, значение рН 7,2, 1% БСА) и подсчитывали их количество. Поверхность клеток метили, инкубируя 106 клеток со 100 мкл моноклональных антител против CD4-FITC или против CD8-FITC, разведенных в соотношении 1:20 в PBS, содержащем 1% БСА и 0,1% азид натрия, в течение 20 мин при 4°С и анализировали, используя цитометр FACScan.
Штамм M. tuberculosis H37Rv культивировали на среде Middlebrook 7H9 (Difco Laboratories), дополненной OADC (Difco Laboratories). После культивирования в течение 1 месяца бактериальную массу отделяли и собирали культуральный фильтрат. Антигены указанного фильтрата преципитировали 45% раствором (масса/объем) сульфата аммония, отмывали и вновь растворяли в PBS. Для стимуляции клеток клетки селезенки в количестве 1×106 ресуспендировали в 100 мкл среды RPMI на лунку и инкубировали с антигенами культурального фильтрата M. tuberculosis, взятыми в количестве 10 мкг, суспендированными в 100 мкл PBS, в течение 72 часов при 37°C в атмосфере 5% СО2. Клетки и культуральную среду центрифугировали, супернатант удаляли и после подсчета и проверки жизнеспособности 2,5×105 клеток на пробирку метили на поверхности CD4+ или CD8+ клеток, как описано выше. После отмывки клетки ресуспендировали и инкубировали в течение 20 мин при 4°C в 0,1% сапонине, растворенном в PBS. Внеклеточный IFN-γ определяли инкубированием клеток в течение 20 мин при 4°C в темноте со 100 мкл моноклональных антител против IFN-γ, взятых в разведении 1/20, меченных фикоэритрином (РЕ). Клетки фиксировали 100 мкл 4% раствора параформальдегида в PBS. Через 20 минут анализировали образцы, используя цитометр FACScan. Контролями изотипов являлись Ab-FITC (разведение 1:20) +Ab-PE (разведение 1:20).
1.4. Протективная эффективность штамма SO2 по настоящему изобретению у мышей Balb/c. Всех животных содержали в контролируемых условиях в лаборатории содержания животных высокого уровня биологической защиты Р3 в Институте Пастера в Париже в соответствии с постановлениями EU по защите лабораторных животных. Группы мышей Balb/c (7 на группу) подкожно вакцинировали в основание хвоста штаммом SO2 по настоящему изобретению или БЦЖ (Pasteur), взятыми в количестве 107 КОЕ. Через восемь недель после вакцинации всем мышам внутривенно вводили M. tuberculosis H37Rv в количестве 2,5×105 КОЕ. Через четыре недели после инъекции мышей забивали. Подсчеты жизнеспособных клеток осуществляли по серийным разведениям гомогената, культивированного на жидкой среде Middlebrook 7H11 + агар OADC, и через 3 недели оценивали рост M. tuberculosis H37Rv, исключая штамм SO2 по настоящему изобретению на основании резистентного к канамицину фенотипа последнего штамма.
1.5. Протективная эффективность штамма SO2 по настоящему изобретению у морских свинок. Экспериментальную работу с морскими свинками проводили в соответствии с законами UK по экспериментам на животных, и ее утвердил местный этический комитет организации по защите здоровья, Porton Down, UK. Самок морских свинок Dunkin-Hartley получали от лицензированных коммерческих поставщиков (UK Home Office) (David Hall, Burton-on-Trent, UK, или Harlan Ltd UK, Bicester, UK) и их разводили в полной изоляции. Результаты, представленные на Фиг.6, показывают, что штамм SO2 создает большую защиту, чем БЦЖ. Результаты, представленные на Фиг.13 и 14, показывают, что эта неожиданная защита мутанта SO2 обусловлена его двойным фенотипом DIM-/PhoP-.
1.6. Применение в низкой дозе. Группы из 6 морских свинок вакцинировали подкожно в загривок следующими препаратами в объеме 250 мкл: 5×104 КОЕ БЦЖ Pasteur; 5×104 КОЕ штамма SO2 по настоящему изобретению; или физиологическим раствором. Животных оставляли в покое в течение 12 недель перед заражением аэрозолем, используя аппарат Henderson, как описано выше [27]. Используя небулайзер Collison, получали аэрозоли из мелкодисперсных частиц M. tuberculosis H37Rv со средним диаметром 2 мкм (диапазон значений диаметра: 0,5-7 мкм) и наводили непосредственно на нос животного. Аэрозоль получали из водной суспензии, содержащей 2×106 КОЕ/мл, для достижения фиксированной ингалируемой дозы, которую рассчитывали около 10-50 КОЕ/легкое.
Через четыре недели после введения оценивали степень протекции. Животных забивали путем перитонеальной передозировки пентобарбитала натрия. Из селезенки и легких асептически удаляли ткань (левую и среднюю краниальные доли, правую среднюю долю и правые каудальные доли) и помещали в стерильные контейнеры. Материал хранили при -20°C и затем подготавливали для подсчета количества бактерий. Ткань гомогенизировали в 10 мл (для легкого) или 5 мл (для селезенки) стерильной деионизованной воды, используя систему измельчения с вращающейся лопастью (Ystral). Подсчеты жизнеспособных клеток осуществляли серийными разведениями гомогената, культивированного в среде Middlebrook 7H11 + агар OADC, и через 3 недели оценивали рост M. tuberculosis. Данные для анализа переводили в log10 и с помощью t-критерия Стьюдента число жизнеспособных M. tuberculosis для каждой вакцинированной группы сравнивали с контрольной группой, получившей физиологический раствор.
1.7. Тест на определение защиты у морских свинок после инфицирования высокой дозой M. tuberculosis. За 10 недель до аэрозольной аппликации M. tuberculosis группы из 6 морских свинок вакцинировали подкожно штаммом SO2 по настоящему изобретению или БЦЖ (Danish 1331) в количестве 5×104 КОЕ. Аэрозольную аппликацию осуществляли, как описано в предыдущем параграфе, используя суспензию 5×107 КОЕ/мл, чтобы доставить в легкие около 500 КОЕ. После аппликации животных содержали в условиях уровня защиты 3 (ACDP), изменения веса регулярно контролировали и их забивали гуманным способом через 180 дней после аппликации или в конечной точке, определенной человеком (потеря 20% максимального веса тела). Сбор и обработку образцов после вскрытия осуществляли, как описано выше, за исключением того, что консолидацию легочной ткани измеряли, используя анализ изображения срезов ткани легкого, фиксированных в формалине, окрашенных гематоксилином и эозином (Н+Е). Выживаемость животных сравнивали, используя показатели выживаемости Каплана-Мейера, и для определения статистически значимых различий использовали анализ распределения Log Rank. Данные величин КОЕ и консолидации поражения анализировали с помощью ANOVA, используя парные сравнения Фишера для сопоставления средних величин групп.
Пример 2. Характеристика M. tuberculosis phoP
Доказательство вовлеченности гена phoP в общую регуляцию генетических циклов микобактерий было получено путем наблюдения за изменениями размера бациллы и вытекающих отсюда свойств растущих клеток, содержащих инактивированный ген phoP. Учитывая основные свойства секретируемых антигенов как детерминант защиты против туберкулеза, авторы надеются определить, распространяются ли плейотропные эффекты мутации гена phoP на синтез основного иммунодоминантного антигена: ESAT-6. Используя антигены, направленные против белка PhoP и ESAT-6, проводили вестерн-блот штамма SO2, БЦЖ и МТ103. Результаты ясно показали, что белок PhoP постоянно экспрессировался в штаммах M. tuberculosis МТ103 и БЦЖ, в то время как он полностью отсутствовал в штамме SO2 по настоящему изобретению. Напротив, уровни экспрессии ESAT-6 в супернатанте культур штамма SO2 были аналогичны уровням, определенным для родительского штамма МТ103 и, как и предполагалось, в БЦЖ белка ESAT-6 определено не было.
Пример 3. Выживаемость мышей, инфицированных штаммами по настоящему изобретению и БЦЖ
Выживаемость иммунокомпромиссных мышей SCID оценивали после аэрозольного инфицирования (около 20 КОЕ) штаммом МТ103, SO2 и SO2, дополненным геном phoP (SO2 + pSO5) [23]. Все мыши, инфицированные штаммом SO2, выжили в течение более 245 дней. Наоборот, все мыши SCID, инфицированные МТ103 или дополненным M. tuberculosis SO2-рSO5, умерли через 62 дня после инфицирования, что указывает на восстановление вирулентности дополненного штамма (Фиг.2а).
У мышей SCID после внутривенного введения также сравнивали аттенуацию штамма SO2 с БЦЖ. Группы мышей SCID заражали через латеральную хвостовую вену несколькими дозами (2×105, 2×104 и 2×103 КОЕ) БЦЖ Pasteur или штамма SO2 (5,4×106, 5,4×105 и 5,4×104 КОЕ). Гистологическое окрашивание инфицированных альвеолярных макрофагов подгруппы мышей, забитых через три недели после заражения, показало меньшее число спирто-кислотоустойчивых бацилл в легких мышей, зараженных штаммом M. tuberculosis SO2, по сравнению с БЦЖ. Все мыши, зараженные более высокими дозами БЦЖ (2×105 КОЕ), умерли через 92 дня после заражения (среднее время жизни: 89±3,5 дней) (Фиг.2b). Наоборот, все мыши, инфицированные максимальной дозой штамма SO2 (5,4×106 КОЕ), остались живы после 120 дней (Фиг.2b). Во время смерти бактериальные нагрузки легких мышей, инфицированных БЦЖ в количестве 2×105 КОЕ, оказались по меньшей мере в 100 раз выше в сравнении с нагрузками мышей, инфицированных штаммом SO2 в количестве 5,4×106 КОЕ.
Пример 4. Количественные CD4+ и CD8+ ответные реакции вакцинированных мышей Balb/c
Для сравнения активации клеточного иммунитета, индуцированной вакцинацией штаммом SO2 по настоящему изобретению и БЦЖ, на 7, 14, 30, 45 и 60 дни после вакцинации из селезенки групп, состоящих, по меньшей мере, из четырех мышей Balb/c, подкожно вакцинированных штаммом SO2 по настоящему изобретению и БЦЖ Phipps, собирали суспензии клеток и цитофлуорометрически определяли соотношения клеток CD4+ и CD8+ (Фиг.3). Вакцинация штаммом SO2 по сравнению с вакцинацией БЦЖ через 14 дней после вакцинации индуцировала значимо большее число клеток CD4+, а через 45 дней и значимо большее число клеток CD8+. Эти спленоциты стимулировали полными антигенами, полученными из культурального фильтрата M. tuberculosis. Через 3 дня популяции лимфоцитов анализировали с помощью проточной цитометрии и объединяли специфические антитела для определения CD4+/CD8+ клеток и внутриклеточного синтеза IFN-γ. Вакцинация штаммом SO2 по сравнению с БЦЖ через 45 дней после вакцинации индуцировала значимо большее количественное соотношение клеток, продуцирующих CD4+/IFN-γ+ (Фиг.3). После определенного срока постоянно было выше количественное соотношение клеток, которые продуцировали CD8+/IFN-γ+, в группе, получившей SO2 (значимое различие на 14 день).
Пример 5. Протективный иммунитет, создаваемый штаммом SO2 по настоящему изобретению у мышей Balb/c
Имея доказательства, что штамм SO2 по настоящему изобретению был аттенуирован у мышей SCID, авторам было интересно определить, создало ли бы наблюдаемое снижение вирулентности некоторый вид защитных свойств у мутантного штамма. Подкожно вакцинировали мышей Balb/c штаммом SO2 по настоящему изобретению или БЦЖ (Pasteur). Через восемь недель после вакцинации всем мышам внутривенно ввели M. tuberculosis H37Rv в количестве 2,5×105 КОЕ. Через 4 недели после инъекции мышей забивали. Уровни защиты определяли, оценивая количество жизнеспособных M. tuberculosis H37Rv, полученных из легких и селезенки обеих групп мышей (Фиг.4). По сравнению с контролями, обработанными физиологическим раствором, обе вакцины привели к созданию схожих и все-таки значительных уровней протекции (р<0,05). Ингибирование роста M. tuberculosis H37Rv было отмечено и в легких, и в селезенке, снижение составило около 1,5 log10 и 1,3 log10 КОЕ, соответственно.
Пример 6. Протективный иммунитет, создаваемый штаммом SO2 по настоящему изобретению у морских свинок
Результаты, полученные в экспериментах с вакцинацией мышей, указывают на то, что аттенуация штамма SO2 по настоящему изобретению создала его вакцине свойства, аналогичные свойствам БЦЖ Pasteur. Тем не менее, обычно считается, что морские свинки являются более подходящей моделью для туберкулеза человека, со многими аналогиями с точки зрения прогрессирования и патологии заболевания. Поэтому эта модель животных представляет собой более подходящую систему для оценки эффективности вакцины. Для изучения протективной эффективности штамма SO2 по настоящему изобретению авторы провели эксперименты, которые включали аэрозольную аппликацию для вакцинирования животных в низких дозах (10-50 КОЕ) и высоких дозах (500 КОЕ). Группы из шести морских свинок подкожно вакцинировали штаммом SO2 по настоящему изобретению или БЦЖ. Через десять недель после вакцинации всем морским свинкам вводили ингалируемые дозы M. tuberculosis H37Rv.
Животных, которые получили более низкую дозу, забивали через 4 недели и рассчитывали бактериальную нагрузку в легких и селезенке. Протективную эффективность определяли сравнением количества жизнеспособных M. tuberculosis H37Rv, полученных из органов морских свинок в каждой обработанной группе. В этом эксперименте снижение величин КОЕ в легких и селезенке существенно различалось между не вакцинированными контрольными животными и вакцинированными БЦЖ или штаммом M. tuberculosis SO2 (р=0,005). Тем не менее, между вакцинированными группами не было обнаружено значительного различия (Фиг.5).
Морских свинок, которые получили высокую дозу, забивали через 180 дней после аппликации или когда регистрировали снижение массы тела на 20%. Уровни протекции определяли сравнением сроков жизни морских свинок каждой обработанной группы. У вакцинированных/инфицированных морских свинок также исследовали прогрессирование развития поражений и сравнивали с тем, что наблюдали у невакцинированных/неинфицированных животных. Во время фазы эксперимента, следующей за ингаляцией, все не вакцинированные морские свинки и четыре морские свинки, вакцинированные BCG, были забиты в конечной точке, определенной человеком, до конечной точки окончания эксперимента (180 дней) по причине развития тяжелого прогрессирующего заболевания (Фиг.6а). Наоборот, все морские свинки, вакцинированные штаммом SO2 по настоящему изобретению, остались живы на протяжении всего исследования. Морские свинки, вакцинированные штаммом SO2 по настоящему изобретению, остались живы гораздо дольше, чем вакцинированные БЦЖ (p=0,018), которые, в свою очередь, оставались живы гораздо дольше, чем контрольные морские свинки, которых обрабатывали физиологическим раствором (р=0,0049). Более того, морские свинки, вакцинированные штаммом SO2, имели прибавку в весе и у них не наблюдалось ни одного видимого или клинического симптома заболевания.
Степень выраженности заболевания легких, оцениваемая общей консолидацией ткани легкого, также варьировала между различными обработанными группами. Максимальный уровень прогрессирования заболевания наблюдался, как и предполагалось, у не вакцинированных морских свинок, и в этой группе животных был определен средний процент консолидации 76% (Фиг.6b, 6c). У морских свинок, вакцинированных БЦЖ, также было четко выражено слияние гранулем со средней величиной консолидации 70%, измеренной в легких. Наоборот, у морских свинок, вакцинированных штаммом SO2 по настоящему изобретению, наблюдали меньшую консолидацию (около 50%), эта консолидация намного меньше (р<0,05), чем у не вакцинированных животных и вакцинированных БЦЖ (Фиг. 6с). Это облегчение тяжести заболевания также нашло отражение в количестве бактерий гомогенатов легкого и селезенки. В вакцинированных группах различие уровней ингибирования роста M. tuberculosis H37Rv обнаружили в обоих органах. Величины КОЕ, полученные от морских свинок, вакцинированных штаммом SO2, оказались сниженными более чем на 1×log10 по сравнению с величинами КОЕ от морских свинок, вакцинированных БЦЖ, и это снижение было статистически значимым (р<0,05) в селезенке (Фиг.6d). Эти данные указывают на то, что штамм SO2 по настоящему изобретению оказался эффективнее, чем БЦЖ, в отношении получения более высокой степени выживаемости инфицированных морских свинок, снижения тяжести заболевания легких и предотвращения распространения инфекции в селезенку.
Пример 7. Аттенуация штамма SO2 по настоящему изобретению обусловлена двойной мутацией PhoP-DIM-
Исследования с заражением мышей Balb/c внутривенным введением штамма SO2 (phoP-DIM-) в сравнении со штаммом МТ103 дикого типа и штаммом, дополненным phoP (SO2 + рSO5), показали, что аттенуация инфицирования SO2 у мышей Balb/c путем внутривенного введения не воспроизводится дополнением phoP. Уменьшение колоний (КОЕ) как в селезенке (7а селезенка), так и в легком (7b легкое), определенное через 3 и 6 недель, не воспроизводилось в дополненном штамме, хотя он и невирулентен для иммунокомпетентных мышей, эти эксперименты указывают на то, что неожиданная аттенуация могла быть вызвана второй дополнительной мутацией (Фиг.7).
Исследования липидов различных штаммов M. tuberculosis посредством тонкослойной хроматографии показали, что штамм SO2 не продуцирует DIM, и это не зависит от мутации phoP (Фиг.8).
Чтобы показать, что штамм SO2 нетоксичен, шесть морских свинок заражали 50-кратной дозой вакцины. После окончания 6-месячного эксперимента степень выживаемости составила 100%. Через 6 месяцев у всех животных была обнаружена прибавка веса, что указывает на нетоксичность штамма SO2 (Y= масса в граммах каждую неделю после инфицирования. Х= время в неделях) (Фиг.12).
Также исследовали чувствительность к противотуберкулезным лекарственным препаратам. Для следующих противотуберкулезных лекарственных препаратов: этамбутола, изониазида, рифампицина и стрептомицина, определяли минимальную ингибирующую концентрацию (MIC) в отношении следующих штаммов M. tuberculosis: H37Rv, МТ103 (дикий тип) в качестве контроля и штамма SO2. Данные величины (микрограммы/мл) указывают на то, что после инактивации гена phoP кандидатный вакцинный штамм SO2 сохраняет свою чувствительность к большинству общеизвестных лекарственных препаратов, использующихся для лечения туберкулеза.
Исследования аттенуации на интратрахеально зараженных мышах Balb/c показали, что со штаммом M. tuberculosis DIM- (1A29) через 20 недель выжило 50% мышей. Все животные, зараженные штаммом SO2 (мутант phoP- и DIM-), удивительным образом выжили в течение 20 недель эксперимента (Фиг.11).
Пример 8. Защита штамма SO2 по настоящему изобретению обусловлена двойной мутацией PhoP-DIM-
Протекцию исследовали на морских свинках, вакцинированных и инфицированных аэрозолем с M. tuberculosis H37Rv. Выживаемость морской свинки через 300 дней. Для исследования выживаемости после подкожной вакцинации животных заражают вирулентным штаммом M. tuberculosis (H37Rv) в высокой дозе. Через 60 дней 6 морских свинок, которые не были вакцинированы, умерли, тогда как группы, вакцинированные штаммами SO2, phoP- и БЦЖ, выжили. Через 300 дней после заражения умерли 3 морские свинки, вакцинированные БЦЖ и phoP-, по сравнению с единственной свинкой из группы, вакцинированной штаммом SO2, что указывает на то, что защита мутанта phoP аналогична защите используемой в настоящее время вакцины БЦЖ, в то же время вакцинация штаммом SO2, двойным мутантом phoP- и DIM-, на модели морской свинки защищает эффективнее (Фиг.13).
Эти исследования протекции на морских свинках продолжались 400 дней, хотя 6 не вакцинированных морских свинок умерли через 60 дней. Через 400 дней после заражения из группы, вакцинированной штаммом SO2, выжили 3 морские свинки (Фиг.14а), тогда как выжила всего лишь 1 морская свинка, вакцинированная БЦЖ (Фиг.14а и Фиг.14b) и phoP- (Фиг.14b), вновь указывая на то, что защита мутанта phoP аналогична защите БЦЖ, в то время как вакцинация штаммом SO2, двойным мутантом phoP- и DIM-, через 400 дней эксперимента защищает эффективнее.
Пример 9. Создание кандидатной противотуберкулезной вакцины, основанной на мутации делецией гена fadD26
Штаммами M. tuberculosis, использованными для создания мутанта делецией гена fadD26 (∆fadD26), являются штамм SO2, который содержит ген phoP, инактивированный инсерцией устойчивой к канамицину кассеты, и клинический штамм МТ103.
1. Создание плазмид
1.1. Клонирование гена fadD26, который вовлечен в синтез DIM. Ген fadD26 амплифицировали с помощью ПЦР, используя геномную ДНК из M. tuberculosis H37Rv и используя праймеры fadD26Fw (SEQ ID NO:1) и fadD26Rv (SEQ ID NO:2). Для создания плазмиды рAZ1 продукт ПЦР встраивали в вектор рGEM-T Easy (Promega).
1.2. Делеция гена fadD26 и инсерция устойчивой к гигромицину кассеты. Для создания плазмиды рAZ3 в плазмиду рAZ1 между сайтами BamHI-EcoRV гена fadD26 встраивали фрагмент BamHI-EcoRV плазмиды pWM27 (Malaga et al. 2003), который содержит кассету res-Ωhyg-res (сайты res, распознаваемые резолвазой γδ, сделают возможным удаление резистентного маркера при втором пересеве).
1.3. Создание суицидального вектора для инактивации гена путем гомологичной рекомбинации. Плазмиду рAZ3 расщепляли рестриктазой XhoI, высвобождая инсерцию fadD26::Ωhyg, которую встраивали в вектор pJQ200X, линеаризованный тем же ферментом. Конечную плазмиду назвали рAZ5.
2. Создание штаммов M. tuberculosis DIM-
2.1. Плазмиду рAZ5 встраивали в штаммы M. tuberculosis SO2 и МТ103.
2.2. Селекция одинарных рекомбинантов. Культивирование в гигромицине (20 мкг/мл) бактерий, которые включают плазмиду, и проверка на их устойчивость к гентамицину (10 мкг/мл).
2.3. Селекция двойных рекомбинантов. Культивирование одинарных рекомбинантов в 2% растворе сахарозы (Pelicic et al. 1997) и гигромицине и проверка на их чувствительность к гентамицину.
3. Удаление из мутации ∆fadD26 маркера устойчивости к антибиотику.
3.1. Для удаления кассеты res-Ωhyg-res и продукции мутации без маркера устойчивости к антибиотику встраивают плазмиду pWM19, которая содержит резолвазу γδ, и проводят селекцию на устойчивость к гентамицину, после чего плазмиду удаляют, инкубируя при 39°С в 2% растворе сахарозы (Malaga et al. 2003).
Пример 2.2. Штамм M. tuberculosis, использованный для создания двойного мутанта посредством делеции ∆phoP ∆fadD26, представляет собой МТ103 ∆fadD26.
4. Создание плазмид
4.1. Клонирование гена phoP. Ген phoP амплифицировали посредством ПЦР, используя геномную ДНК M. tuberculosis H37Rv и праймеры phoPF (SEQ ID NO:3) и phoPR (SEQ ID NO:4). Для создания плазмиды рAZ11 продукт ПЦР встраивали в вектор pGEM-T Easy (Promega).
4.2. Делеция гена phoP и инсерция устойчивой к канамицину кассеты. Для создания плазмиды рAZ13 фрагмент BamHI-EcoRV плазмиды pCG122 (Malaga et al. 2003), который содержит кассету res-Ωkm-res, встраивали между сайтами Bc/I-EcoRV гена phoP в плазмиде рAZ11.
4.3. Создание суицидального вектора для инактивации гена с помощью гомологичной рекомбинации. Плазмиду рAZ13 расщепляли рестриктазой XhoI, высвобождая инсерцию phoP::Ωkm, которую встраивали в вектор pJQ200X, линеаризованный тем же ферментом. Конечную плазмиду назвали рAZ15.
5. Создание штамма M. tuberculosis с двойной мутацией ∆phoP ∆fadD26.
5.1. Плазмида рAZ15 должна быть встроена в штамм M. tuberculosis МТ103 ∆fadD26.
5.2. Селекция одинарных рекомбинантов. Культивирование в канамицине (20 мкг/мл) бактерий, которые включают плазмиду, и проверка на их устойчивость к гентамицину (10 мкг/мл).
5.3. Селекция двойных рекомбинантов. Культивирование одинарных рекомбинантов в 2% растворе сахарозы (Pelicic et al. 1997) и канамицине и проверка на их чувствительность к гентамицину.
6. Удаление из мутации ∆phoP маркера устойчивости к антибиотику.
6.1. Для удаления кассеты res-Ωkm-res и продукции мутации без маркера устойчивости к антибиотику необходимо встроить плазмиду pWM19, которая содержит резолвазу γδ, и провести селекцию на устойчивость к гигромицину (20 мкг/мл), после чего плазмида должна быть удалена инкубацией при 39°С в 2% растворе сахарозы (Malaga et al. 2003).
Литература
1. WHO. Global Report tuberculosis. Global tuberculosis control - surveillance, planning, financining. World Health Organization, Geneva, 2005.
http://www.who.int/tb/publications/global_report/en/index.html.
2. WHO/IUATLD. Anti-Tuberculosis Drug Resistance in the World. Report no. 3: prevalence and trends. WHO/IUATLD. Global Project on Anti-Tuberculosis Drug Resistance Surveillance 1999-2002. World Health Organization and International Union Against Tuberculosis and Lung Disease, Geneva, 2004.
http://www.who.int/tb/publications/who_htm_tb_2004_343/en/index.html.
3. Young, D.B. Building a better tuberculosis vaccine. Nat Med 2003, 9(5), 503-504.
4. Fine, P.E. Variation in protection by BCG: implications of and for heterologous immunity. Lancet 1995, 346(8986), 1339-1345.
5. Behr, M.A. BCG--different strains, different vaccines? Lancet Infect Dis 2002, 2(2), 86-92.
6. Pym, A.S., Brodin, P., Majlessi, L. et al. Recombinant BCG exporting ESAT-6 confers enhanced protection against tuberculosis. Nat Med 2003, 9(5), 533-539.
7. Young, D.B. Current tuberculosis vaccine development. Clin Infect Dis 2000, 30 Suppl 3, S254-256.
8. Orme, I.M. Preclinical testing of new vaccines for tuberculosis: A comprehensive review. Vaccine 2006, 24(1), 2-19.
9. Kaufmann, S.H. Is the development of a new tuberculosis vaccine possible? Nat Med 2000, 6(9), 955-960.
10. Britton, W.J. & Palendira, U. Improving vaccines against tuberculosis. Immunol Cell Biol 2003, 81(1), 34-45.
11. Pelicic, V., Jackson, M., Reyrat, J.M., Jacobs, W.R., Jr., Gicquel, B. & Guilhot, C. Efficient allelic exchange and transposon mutagenesis in Mycobacterium tuberculosis. Proc Natl Acad Sci USA 1997, 94(20), 10955-10960.
12. Bardarov, S., Kriakov, J., Carriere, C. et al. Conditionally replicating mycobacteriophages: a system for transposon delivery to Mycobacterium tuberculosis. Proc Natl Acad Sci USA 1997, 94(20), 10961-10966.
13. Clark-Curtiss, J.E. & Haydel, S.E. Molecular genetics of Mycobacterium tuberculosis pathogenesis. Annu Rev Microbiol 2003, 57, 517-549.
14. Cole, S.T., Brosch, R., Parkhill, J. et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature 1998, 393(6685), 537-544.
15. Camacho, L.R., Ensergueix, D., Perez, E., Gicquel, B. & Guilhot, C. Identification of a virulence gene cluster of Mycobacterium tuberculosis by signature-tagged transposon mutagenesis. Mol Microbiol 1999, 34(2), 257-267.
16. Cox, J.S., Chen, B., McNeil, M. & Jacobs, W.R., Jr. Complex lipid determines tissue-specific replication of Mycobacterium tuberculosis in mice. Nature 1999, 402(6757), 79-83.
17. Sambandamurthy, V.K., Wang, X., Chen, B. et al. A pantothenate auxotroph of Mycobacterium tuberculosis is highly attenuated and protects mice against tuberculosis. Nat Med 2002, 8(10), 1171-1174.
18. Smith, D.A., Parish, T., Stoker, N.G. & Bancroft, G.J. Characterization of auxotrophic mutants of Mycobacterium tuberculosis and their potential as vaccine candidates. Infect Immun 2001, 69(2), 1142-1150.
19. Groisman, E.A. The pleiotropic two-component regulatory system PhoP-PhoQ. J Bacteriol 2001, 183(6), 1835-1842.
20. Fields, P.I., Groisman, E.A. & Heffron, F. A Salmonella locus that controls resistance to microbicidal proteins from phagocytic cells. Science 1989, 243(4894 Pt 1), 1059-1062.
21. Soto, C.Y., Menendez, M.C., Perez, E. et al. IS6110 mediates increased transcription of the phoP virulence gene in a multidrug-resistant clinical isolate responsible for tuberculosis outbreaks. J Clin Microbiol 2004, 42(1), 212-219.
22. Gonzalo Asensio, J., Maia, C., Ferrer, N.L. et al. The virulence-associated two-component PhoP-PhoR system controls the biosynthesis of polyketide-derived lipids in Mycobacterium tuberculosis. J Biol Chem 2005.
23. Perez, E., Samper, S., Bordas, Y., Guilhot, C., Gicquel, B. & Martin, C. An essential role for phoP in Mycobacterium tuberculosis virulence. Mol Microbiol 2001, 41(1), 179-187.
24. Pym, A.S., Brodin, P., Brosch, R., Huerre, M. & Cole, S.T. Loss of RD1 contributed to the attenuation of the live tuberculosis vaccines Mycobacterium bovis BCG and Mycobacterium microti. Mol Microbiol 2002, 46(3), 709-717.
25. Sambrook, J.a.R., DW. Molecular Cloning a laboratory manual, Cold Spring Harbor Laboratory Press, New York, 2001.
26. Arriaga, A.K., Orozco, E.H., Aguilar, L.D., Rook, G.A. & Hernandez Pando, R. Immunological and pathological comparative analysis between experimental latent tuberculous infection and progressive pulmonary tuberculosis. Clin Exp Immunol 2002, 128(2), 229-237.
27. Williams, A., Davies, A., Marsh, P.D., Chambers, M.A. & Hewinson, R.G. Comparison of the protective efficacy of bacille calmette-Guerin vaccination against aerosol challenge with Mycobacterium tuberculosis and Mycobacterium bovis. Clin Infect Dis 2000, 30 Suppl 3, S299-301.
28. Hondalus, M.K., Bardarov, S., Russell, R., Chan, J., Jacobs, W.R., Jr. & Bloom, B.R. Attenuation of and protection induced by a leucine auxotroph of Mycobacterium tuberculosis. Infect Immun 2000, 68(5), 2888-2898.
29. Horwitz, M.A., Lee, B.W., Dillon, B.J. & Harth, G. Protective immunity against tuberculosis induced by vaccination with major extracellular proteins of Mycobacterium tuberculosis. Proc Natl Acad Sci USA 1995, 92(5), 1530-1534.
30. Baldwin, S.L., D'Souza, C., Roberts, A.D. et al. Evaluation of new vaccines in the mouse and guinea pig model of tuberculosis. Infect Immun 1998, 66(6), 2951-2959.
31. Horwitz, M.A., Harth, G., Dillon, B.J. & Maslesa-Galic, S. Recombinant bacillus calmette-guerin (BCG) vaccines expressing the Mycobacterium tuberculosis 30-kDa major secretory protein induce greater protective immunity against tuberculosis than conventional BCG vaccines in a highly susceptible animal model. Proc Natl Acad Sci U S A 2000, 97(25), 13853-13858.
32. Behr, M.A., Wilson, M.A., Gill, W.P. et al. Comparative genomics of BCG vaccines by whole-genome DNA microarray. Science 1999, 284(5419), 1520-1523.
33. Mollenkopf, H.J., Kursar, M. & Kaufmann, S.H. Immune Response to Postprimary Tuberculosis in Mice: Mycobacterium tuberculosis and Mycobacterium bovis bacille Calmette-Guerin Induce Equal Protection. J Infect Dis 2004, 190(3), 588-597.
34. Sampson, S.L., Dascher, C.C., Sambandamurthy, V.K. et al. Protection elicited by a double leucine and pantothenate auxotroph of Mycobacterium tuberculosis in guinea pigs. Infect Immun 2004, 72(5), 3031-3037.
35. Horwitz, M.A. & Harth, G. A new vaccine against tuberculosis affords greater survival after challenge than the current vaccine in the guinea pig model of pulmonary tuberculosis. Infect Immun 2003, 71(4), 1672-1679.
36. Brandt, L., Skeiky, Y.A., Alderson, M.R. et al. The protective effect of the Mycobacterium bovis BCG vaccine is increased by coadministration with the Mycobacterium tuberculosis 72-kilodalton fusion polyprotein Mtb72F in M. tuberculosis-infected guinea pigs. Infect Immun 2004, 72(11), 6622-6632.
37. Wiegeshaus, E.H., McMurray, D.N., Grover, A.A., Harding, G.E. & Smith, D.W. Host-parasite relationships in experimental airborne tuberculosis. 3. Relevance of microbial enumeration to acquired resistance in guinea pigs. Am Rev Respir Dis 1970, 102(3), 422-429.
38. Williams, A., Hatch, G.J., Clark, S.O. et al. Evaluation of vaccines in the EU TB Vaccine Cluster using a guinea pig aerosol infection model of tuberculosis. Tuberculosis (Edinb) 2005, 85(1-2), 29-38.
39. McShane, H., Pathan, A.A., Sander, C.R. et al. Recombinant modified vaccinia virus Ankara expressing antigen 85A boosts BCG-primed and naturally acquired antimycobacterial immunity in humans. Nat Med 2004, 10(11), 1240-1244.
40. Kamath, A.T., Fruth, U., Brennan, M.J. et al. New live mycobacterial vaccines: the Geneva consensus on essential steps towards clinical development. Vaccine 2005, 23(29), 3753-3761.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОФИЛАКТИЧЕСКОГО СРЕДСТВА ДЛЯ ПАЦИЕНТОВ С РИСКОМ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ ИЛИ В КАЧЕСТВЕ ВТОРИЧНЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИЕЙ | 2019 |
|
RU2778094C2 |
| РЕКОМБИНАНТНАЯ BCG, СВЕРХЭКСПРЕССИРУЮЩАЯ PhoP-PhoR | 2017 |
|
RU2760580C2 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-TB10.4-2A-HspX и способ специфической профилактики туберкулеза легких с использованием вакцины мукозального применения на его основе | 2019 |
|
RU2726106C1 |
| РЕКОМБИНАНТНЫЕ ШТАММЫ ВИРУСА ГРИППА, ЭКСПРЕССИРУЮЩИЕ МИКОБАКТЕРИАЛЬНЫЙ ПРОТЕКТИВНЫЙ АНТИГЕН ESAT-6, И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2005 |
|
RU2318872C2 |
| ШТАММ Mycobacterium tuberculosis BN ДЛЯ МОДЕЛИРОВАНИЯ ЛАТЕНТНОЙ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ | 2021 |
|
RU2760751C1 |
| ВАКЦИНЫ РЕКОМБИНАНТНЫХ ВНУТРИКЛЕТОЧНЫХ ПАТОГЕНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2001 |
|
RU2266132C2 |
| ПРОФИЛАКТИЧЕСКАЯ ВАКЦИНА ОТ ТУБЕРКУЛЕЗА | 2007 |
|
RU2526910C2 |
| ВАКЦИНА ПРОТИВ ТУБЕРКУЛЕЗА | 1999 |
|
RU2153354C1 |
| ВАКЦИНА РЕКОМБИНАНТНАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ И АДЪЮВАНТ ДЛЯ НЕЕ | 2017 |
|
RU2665817C1 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2004 |
|
RU2342400C2 |



Изобретение относится к области биотехнологии, конкретно к получению вакцинных микроорганизмов, и может быть использовано в медицине. Рекомбинантным путем получают микроорганизм комплекса Mycobacterium tuberculosis, который содержит инактивацию или делецию гена phoP и инактивацию или делецию гена fadD26. Полученный микроорганизм используют для профилактики туберкулеза у людей или животных. Изобретение позволяет получить вакцинный микроорганизм, обладающий свойствами высокой аттенуации и иммунопротекции против туберкулезной инфекции. 7 н.п. ф-лы, 27 ил., 9 пр.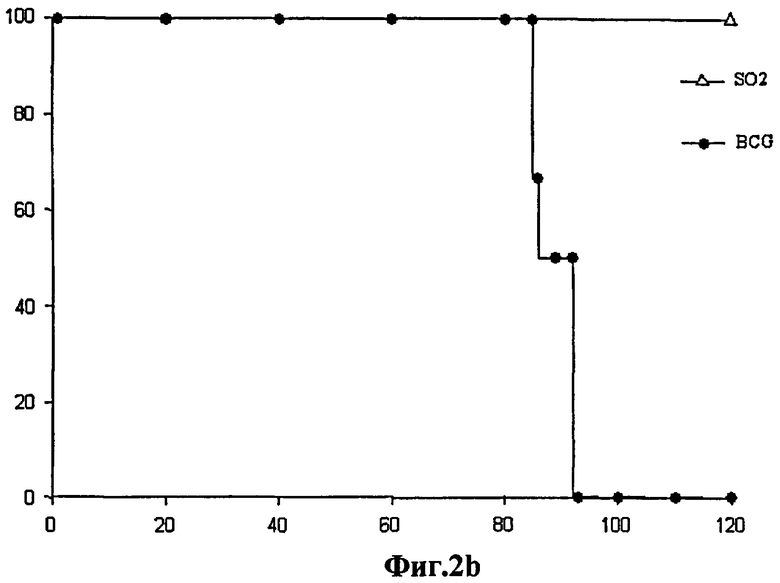
1. Рекомбинантный микроорганизм комплекса Mycobacterium tuberculosis, отличающийся тем, что содержит инактивацию или делецию гена phoP и инактивацию или делецию гена fadD26 для профилактики туберкулеза у людей или животных.
2. Способ конструирования рекомбинантного микроорганизма по п.1, который включает:
a) инактивацию или делецию гена phoP; и
b) инактивацию или делецию гена fadD26.
3. Вакцина для иммунизации против туберкулеза, которая содержит эффективное количество рекомбинантного микроорганизма по п.1 и фармакологически приемлемые эксципиенты.
4. Способ получения вакцины по п.3 для иммунизации против туберкулеза, который включает, по меньшей мере:
a) введение рекомбинантного микроорганизма по п.1 в подходящую среду для введения человеку или животным в терапевтически эффективной дозе;
b) добавление эксципиентов, которые являются фармакологически приемлемыми для получения вакцин.
5. Применение рекомбинантного микроорганизма по п.1 для профилактики туберкулеза у людей или животных.
6. Применение рекомбинантного микроорганизма по п.1 в качестве вакцины для профилактики туберкулеза у людей или животных.
7. Применение рекомбинантного микроорганизма по п.1 для получения вакцины по п.3 для профилактики туберкулеза у людей или животных.
| MARTIN С | |||
| et al., The live Mycobacterium tuberculosis phoP mutant strain is more attenuated than BCG and confers protective immunity against tuberculosis in mice and guinea pigs, Vaccine, 2006, v.24, n.17, p.3408-3419 | |||
| INFANTE E | |||
| et al., Immunogenicity and protective efficacy of the Mycobacterium tuberculosis fadD26 mutant, Clin | |||
| Exp | |||
| Immunol., 2005, v.141, n.1, p.21-28 | |||
| ВАКЦИНА ПРОТИВ ТУБЕРКУЛЕЗА | 1999 |
|
RU2153354C1 |
Авторы
Даты
2012-02-27—Публикация
2007-03-14—Подача