Область техники
Настоящее изобретение в целом относится к иммунотерапевтическим агентам и вакцинам внутриклеточных патогенных организмов, таких как бактерии, простейшие, вирусы и грибы. Более конкретно, в отличие от вакцин и иммунотерапевтических агентов предшествующего уровня техники, основанных на патогенных субъединицах, уничтожающих патогены и ослабляющих природные патогены, в настоящем изобретении применяются рекомбинантные ослабленные патогены или близкородственные виды, которые экспрессируют и секретируют иммуногенные детерминанты выбранного патогена, стимулируя эффективный иммунный ответ у млекопитающих-хозяев. Иммуностимуляторные вакцины и иммунотерапевтические агенты согласно изобретению являются производными рекомбинантных ослабленных патогенов или близкородственных видов, которые экспрессируют иммунологические детерминанты in situ.
Предпосылки к созданию изобретения
Давно известно, что микроорганизмы-паразиты обладают способностью инфицировать животных, в результате этого вызывая болезнь и часто смерть хозяина. Патогенные агенты веками были лидирующей причиной смерти и продолжают причинять большие страдания. Несмотря на то, что в течение последних ста лет наблюдаются существенные успехи в профилактике и лечении многих инфекционных заболеваний, сложные взаимодействия между паразитом и хозяином все еще ограничивают универсальную эффективность терапевтических мер. Трудности противостояния изощренным инвазивным механизмам, проявляемым многими патогенными организмами, доказываются возрождением различных заболеваний, таких как туберкулез, а также появлением многочисленных штаммов бактерий и вирусов, устойчивых к лекарствам.
Среди данных патогенных агентов существенного эпидемиологического значения внутриклеточные бактерии, как установлено, являются особенно трудно поддающимися в плане терапевтических или профилактических мероприятий. Внутриклеточные бактерии, включая род Mycobacterium и род Legionella, проводят весь или часть своего жизненного цикла в клетках инфицированного организма хозяина, а не внеклеточно. Во всем мире внутриклеточные бактерии каждый год являются причиной миллионов смертей и бесчисленных страданий. Туберкулез во всем мире является лидирующей причиной смерти от единственного агента, вызывающего болезнь, с 10 миллионами новых случаев и 2,9 миллионами смертей каждый год. Кроме того, внутриклеточные бактерии являются причиной миллионов случаев проказы. Другие истощающие заболевания, передаваемые внутриклеточными агентами, включают в себя подкожный и висцеральный лейшманиоз, американский трипаносомоз (болезнь Чагаса), листериоз, токсоплазмоз, гистоплазмоз, трахому, пситтакоз, Q-лихорадку и легионеллез. К настоящему времени относительно мало может быть сделано для профилактики истощающих инфекций у чувствительных к ним индивидуумов, контактирующих со многими из данных организмов, из-за невозможности эффективной защиты популяций от таких внутриклеточных патогенов, что ведет к заболеваемости и смертности человека и животных, причиной которых являются такие агенты, туберкулез представляет собой одно из наиболее важных заболеваний, с которым борется человечество.
Специалисты в данной области техники должны понимать, что последующий пример обсуждения M. tuberculosis является иллюстрацией указаний настоящего изобретения и никоим образом не должен рассматриваться как ограничение объема настоящего изобретения лечением от M. tuberculosis. Сходным образом представленные здесь указания никак не ограничиваются лечением туберкулезных инфекций. Наоборот, данное изобретение может быть использовано для успешного обеспечения безопасных и эффективных вакцин и иммунотерапевтических агентов любого патогенного агента с помощью применения рекомбинантных ослабленных патогенов или рекомбинантных невирулентных организмов для экспрессии и, что не менее важно, для высвобождения иммунологически значимых белков патогенного организма.
В настоящее время считается, что приблизительно одна треть всемирной популяции заражена M. tuberculosis, что ведет к миллионам случаев туберкулеза легких ежегодно. Более конкретно, туберкулез легких человека, вызываемый первично M. tuberculosis, является главной причиной смерти в развивающихся странах. Способный к выживанию внутри макрофагов и моноцитов, M. tuberculosis может вызывать хроническую внутриклеточную инфекцию. M. tuberculosis относительно успешно обходит обычные защитные системы организма-хозяина в результате того, что могут укрыться внутри клеток, которые в первую очередь отвечают за выявление чужеродных элементов и последующую активацию иммунной системы. Более того, многие из лидирующих химиотерапевтических агентов, применяемых для лечения туберкулеза, обладают относительно низкой активностью против внутриклеточных организмов по сравнению с внеклеточными формами. Такие одинаковые патогенные свойства ранее препятствовали развитию всесторонне эффективных иммунотерапевтических агентов или вакцин против туберкулезных инфекций.
Несмотря на то, что данное заболевание является особенно острой проблемой здравоохранения в развивающихся странах Латинской Америки, Африки и Азии, оно становится также более распространенной в экономически развитых странах. В Соединенных Штатах повышенным риском отмечены определенные популяции, особенно городские малоимущие, иммунодефицитные индивидуумы и иммигранты из областей с высокой степенью заболеваемости. Главным образом из-за эпидемии СПИДа, в последние годы число случаев туберкулеза выросло в экономически развитых странах, часто в форме M. tuberculosis, устойчивой ко многим лекарствам.
В последнее время устойчивость туберкулеза к одному или более лекарствам выявлена в 36 из 50 штатов Америки. В Нью-Йорке одна треть всех протестированных случаев была устойчива к одному или более основных лекарств. Хотя не обладающий устойчивостью туберкулез можно лечить с помощью длительного курса антибиотиков, перспективы в отношении устойчивых к лекарствам штаммам остаются открытыми. Больные, инфицированные штаммами, устойчивыми к двум или более основным антибиотикам, характеризуются приблизительно 50% смертностью. В соответствии с этим безопасные и эффективные вакцины таких вариантов M. tuberculosis крайне необходимы.
Первичное инфицирование M. tuberculosis почти всегда наступает в результате вдыхания аэрозольных частиц, так как патоген может оставаться жизнеспособным в течение недель или месяцев во влажной или сухой слюне. Хотя первичным очагом инфекции являются легкие, организм может также вызывать инфекцию практически в любом органе, включая, но не ограничиваясь ими, кости, селезенку, почку, оболочки мозга и кожу. В зависимости от вирулентности конкретного штамма и устойчивости хозяина, инфекция и соответствующее повреждение ткани может быть небольшим или обширным. В случае человека первоначальная инфекция контролируется у большинства индивидуумов, контактировавших с вирулентными штаммами бактерий. Развитие приобретенного иммунитета после первичного заражения снижает пролиферацию бактерий, что ведет к излечиванию повреждений и оставляет субъекта практически бессимптомным.
Когда M. tuberculosis не контролируется инфицированным субъектом, это часто ведет к обширной деструкции легочной ткани. У восприимчивых индивидуумов повреждения обычно образуются в легком, так как бациллы туберкулеза воспроизводятся в альвеолярных или легочных макрофагах. Как только организмы размножились, они могут распространяться через лимфатическую систему к дистальным лимфатическим узлам и - через кровеносную систему - к верхушкам легких, костному мозгу, почке и оболочкам, окружающим мозг. В первую очередь в результате клеточных ответов иммунной системы по типу гиперчувствительности возникают грануломатозные повреждения или туберкулы, пропорционально тяжести инфекции. Эти повреждения состоят из эпителиодных клеток, окруженных моноцитами, лимфоцитами и фибробластами. В большинстве случаев повреждение или туберкула со временем становится некротическим и подвергается казеозу (превращению поврежденных тканей в мягкую субстанцию, напоминающую сыр).
В то время как M. tuberculosis является существенным патогеном, другие виды рода Mycobacterium также вызывают заболевание у животных, включая человека, и, несомненно, входят в объем настоящего изобретения. Например, M. bovis является близко родственной M. tuberculosis и отвечает за туберкулезные инфекции у домашних животных, таких как крупный рогатый скот, свиньи, овцы, лошади, собаки и кошки. Далее, M. bovis может инфицировать человека через кишечный тракт обычно при употреблении сырого молока. Местная кишечная инфекция, в конечном счете, распространяется до дыхательных путей, и за этим через короткое время следуют классические симптомы туберкулеза. Другим важным патогенным вектором рода Mycobacterium является M. leprae, которая вызывает миллионы случаев старинного заболевания проказы. Другие виды данного рода, которые вызывают заболевание у животных и человека, включают в себя M. kansasii, M. avium intracellulare, M. fortuitum, M. marinum, M. chelonei и M. scrofulaceum. Патогенные виды микобактерий часто проявляют высокую степень гомологии в соответствующих им последовательностях ДНК и соответствующих ей последовательностях белка, и некоторые виды, такие как M. tuberculosis и M. bovis, являются близкородственными.
По очевидным практическим и этическим соображениям исходная работа на человеке для определения эффективности экспериментальных композиций в отношении таких бедствий является неосуществимой. В соответствии с этим, на ранних этапах разработки любого лекарства или вакцины стандартной процедурой является применение подходящих животных моделей по причинам безопасности и экономичности. Успех применения в качестве моделей лабораторных животных предполагается на основе того, что иммуногенные эпитопы часто активны у хозяев различных видов. Таким образом, иммуногенная детерминанта у одних видов, например, у грызунов или морской свинки, должна быть обычно иммунореактивной у других видов, таких как человек. Только после достаточной разработки подходящих животных моделей должны проводиться клинические испытания на человеке для дополнительной демонстрации безопасности и эффективности вакцины у человека.
В отношении альвеолярного или легочного инфицирования M. tuberculosis морская свинка в качестве модели во многих отношениях очень сходна с человеком по патологии заболевания. Соответственно, специалистам в данной области понятно, что уместно экстраполировать модель данного заболевания на морской свинке, на человеке и других животных. Как и люди, морские свинки восприимчивы к туберкулезному инфицированию низкими дозами патогена человека M. tuberculosis в виде аэрозоля. В отличие от человека, у которого первичная инфекция обычно контролируется, у морских свинок при инфицировании патогеном в виде аэрозоля закономерно развивается диссеминированное заболевание, что ускоряет последующий анализ. Далее, и морские свинки, и человек проявляют кожные реакции гиперчувствительности замедленного типа, характеризующиеся развитием твердого уплотнения из мононуклеарных клеток или ригидной зоны в коже на месте тестирования. Наконец, характерные повреждения в виде туберкул у человека и морских свинок имеют сходную морфологию, включая присутствие гигантских клеток Langhans. Так как морские свинки более восприимчивы к первичной инфекции и прогрессии данного заболевания, чем человек, любая защита, подтвержденная в экспериментах с применением данной животной модели, убедительно указывает на то, что такой же защитный иммунитет может быть выработан у человека или других менее восприимчивых животных. Соответственно, только с целью объяснения, но не ограничения, настоящее изобретение должно быть в первую очередь продемонстрировано в виде примера на морских свинках в качестве млекопитающего-хозяина. Специалисты в данной области техники должны понимать, что настоящее изобретение может быть применено на других млекопитающих-хозяевах, включая человека и домашних животных.
Любое животное или человек, инфицированные патогенным организмом, в частности внутриклеточным организмом, представляет собой трудную задачу для иммунной системы хозяина. Несмотря на то, что многие инфекционные агенты могут эффективно контролироваться в результате гуморального ответа и соответствующей продукции защитных антител, данные механизмы эффективны в первую очередь только против тех патогенов, которые находятся во внеклеточной жидкости организма. В частности, опсонизирующие антитела взаимодействуют с внеклеточными чужеродными агентами, тем самым делая их чувствительными к фагоцитозу и последующему внутриклеточному уничтожению. Для других патогенов это не характерно. Например, предшествующие исследования показали, что гуморальный иммунный ответ, видимо, не играет существенной защитной роли в отношении инфицирования внутриклеточными бактериями, такими как M. tuberculosis. Однако настоящее изобретение дает возможность генерировать благоприятный иммунный ответ на патоген-мишень, и по существу его эффективность не ограничивается любым специфическим компонентом вызванного иммунного ответа.
Более конкретно, опосредованная антителами защита, по-видимому, не предотвращает первичного инфицирования внутриклеточными патогенами и становится неэффективной как только бактерии изолируются внутри клеток хозяина. Как водорастворимые белки, антитела могут распространяться во внеклеточной жидкости и крови, но для них затруднена миграция через липидные мембраны клеток. Далее, продукция опсонизирующих антител против структур бактериальной поверхности может фактически помогать внутриклеточным патогенам входить в клетку хозяина. Соответственно, любое эффективное профилактическое мероприятие против внутриклеточных агентов, таких как Mycobacterium, должно включать сильный компонент ответа клеточного иммунитета, ведущий к быстрой пролиферации антигенспецифических лимфоцитов, которые активируют затронутые фагоциты или цитотоксически уничтожают их. Однако, как будет подробно обсуждаться ниже, индукция ответа клеточного иммунитета не равняется индукции защитного иммунитета. Хотя клеточный иммунитет может исходно требоваться для защитного иммунитета, получение вакцин в соответствии с указаниями настоящего изобретения требует исследований с контрольным заражением на животных.
Такой клеточно-опосредованный иммунный ответ обычно включает в себя две стадии. Первоначальная стадия, сигнализирующая об инфицировании клетки, осуществляется с помощью специальных молекул (молекул главного комплекса гистосовместимости, или МНС), которые доставляют части патогена к клеточной поверхности. Такие молекулы МНС связывают небольшие фрагменты бактериальных белков, которые подверглись деградации в инфицированной клетке, и представляют их на поверхности клетки. Их представление Т-клеткам стимулирует иммунную систему хозяина в отношении уничтожения инфицированной клетки хозяина или стимуляции клетки хозяина в плане уничтожения поселившихся в ней бактерий.
Попытки избавления от туберкулеза с применением вакцин были начаты в 1921 году после того, как Кальметт и Герен успешно ослабили вирулентный штамм M. bovis, применяя способ серийных пассажей. Полученная живая вакцина, разработанная в институте Пастера в Лилле, Франция, известна как вакцина бациллы Кальметта и Герена, или БЦЖ. Примерно восьмидесятью годами позже, уже в настоящее время, данная вакцина остается для применения только в виде профилактического лечения туберкулеза. Действительно, все вакцины БЦЖ, имеющиеся в настоящее время, происходят из первоначального штамма M. bovis, полученного Кальметтом и Гереном в институте Пастера.
Всемирная организация здравоохранения рассматривает вакцину БЦЖ как существенный фактор снижения туберкулеза в мире, особенно в развивающихся странах. Теоретически вакцина БЦЖ дает клеточный иммунитет против ослабленной микобактерии, которая иммунологически близка к M. tuberculosis. Полученный иммунный ответ должен предотвращать первичный туберкулез. Таким образом, если предотвращается первичный туберкулез, не могут наступить латентные инфекции и избегается повторная активация заболевания.
Однако контролируемые клинические испытания выявили значительные вариации в эффективности вакцины. Описанные степени эффективности варьировались между 0-80%. Испытания вакцины на детях английской школы показали, что степень защиты через десять лет после вакцинации превышала 78%. Однако при сходном испытании в Южной Индии БЦЖ оказалась неспособной защитить против подтвержденного на культуре первичного туберкулеза в первые пять лет после инокуляции. Недавний мета-анализ эффективности БЦЖ в отношении предотвращения туберкулеза установил, что в целом профилактическая эффективность составляла приблизительно 50% (Colditz, G.A., T.F.Brewer, C.S.Berkey, M.E.Wilson, E.Burdick, H.V.Fineberg, and F.Mosteller. 1994. JAMA 271:698-702).
Данное значительное несоответствие в описанных степенях эффективности остается досадной проблемой для работников здравоохранения и практических врачей, которые должны определить, когда и как применять вакцину БЦЖ. Вовлечено множество факторов, которые могут отвечать за данные наблюдаемые несоответствия в эффективности, включая различия в способах получения, схемах инокуляции и характеристиках популяций и окружающих условиях, в которых применялись вакцины. Последняя работа предполагает, что случайный контакт с микобактериями окружающей среды может вести к "природной вакцинации", которая мешает реципиенту вакцины выработать эффективный ответ к природным белкам БЦЖ.
Для того чтобы свести к минимуму вариации иммуногенности БЦЖ, производители вакцины поддерживают контрольные запасы первоначальных штаммов вакцин в лиофилизованном (высушенном при замораживании) состоянии. Каждый получаемый штамм, происходящий из них, в свою очередь, называют в честь места производства, компании или бактериального штамма, например: БЦЖ-Лондон, БЦЖ-Копенгаген, БЦЖ-Connaught или БЦЖ-Tice (продаваемая в мировом масштабе Organon Inc.). Пытаясь стандартизовать способы получения, в Соединенных Штатах центр биологического образования и исследования (CBER) федерального министерства по лекарствам и пищевым добавкам (FDA) регулирует получение вакцин. Отдел CREB FDA установил, что каждый лиофилизованный штамм БЦЖ, применяемый для вакцинации, должен обладать способностью индуцировать определенную туберкулиновую кожную тест-реакцию у морских свинок и человека. К сожалению не показано, что индуцированная туберкулиновая чувствительность коррелирует с защитным иммунитетом.
В настоящее время вакцины БЦЖ предлагают в виде лиофилизованных культур, которые регидрируют в стерильном разбавителе непосредственно перед введением. Вакцину БЦЖ дают при рождении, в младенчестве или раннем детстве в странах, которые практикуют вакцинацию БЦЖ, включая развивающиеся и промышленно развитые страны. Посещающие эндемические районы взрослые индивидуумы, которые могут контактировать с высокими дозами инфекционных микобактерий, могут получить БЦЖ в качестве профилактического доказательства того, что они не реагируют на кожный тест. Побочные реакции на вакцину являются редкими и обычно ограничиваются изъязвлениями кожи и лимфаденитом в районе места введения. Однако, несмотря на редкие побочные реакции, вакцина БЦЖ имеет беспримерную историю безопасности при введении более трех миллиардов доз во всемирном масштабе с 1930 года.
С разработки вакцины БЦЖ прошло восемьдесят лет, и сейчас сохраняется недостаточность в приемлемых альтернативных вакцинах. Недавно изобретатели настоящего изобретения добились существенного прогресса в выделении, характеристике и рекомбинантной экспрессии внеклеточных белков, секретируемых внутриклеточными патогенами. Например, изобретатели патента США №5108745, зарегистрированного 28 апреля 1992 г., и нескольких ожидающих решения патентных заявок США предлагают вакцины и способы получения защитного иммунитета против L. pneumophila и M. tuberculosis, а также других внутриклеточных патогенов. Указанные вакцины предшествующего уровня техники в широком смысле основаны на внеклеточных продуктах, исходно происходящих из белковых компонентов, секретируемых во внеклеточную среду бактериями, находящимися в инфицированных клетках хозяина in vivo. Вакцины, предлагаемые здесь, избирательно основаны на идентификации внеклеточных продуктов или их аналогов, которые стимулируют сильный иммунный ответ против патогена-мишени у млекопитающего-хозяина.
Вакцины, полученные из отобранных внеклеточных продуктов M. tuberculosis, в настоящее время оптимизируются для применения в качестве профилактической терапии человека. Исследуются коктейли белков и индивидуальные белковые препараты с применением как рекомбинантных, так и экспрессирующихся в природе белков. Одной целью текущих исследований является доведение до максимума основного иммунного ответа путем оптимизации презентации иммуногена (белка). К настоящему времени сделано более 100 различных препаратов, включая 38 различных сочетаний белков, 26 различных адъювантов, 10 различных концентраций белков и семь различных режимов дозировки. Белки-кандидаты на вакцину были также привязаны к белкам, не происходящим из M. tuberculosis, включая бычий сывороточный альбумин, главный секреторный белок Legionella sp. и столбнячный токсин. Данный перечень не включает в себя способы, применяемые авторами настоящего изобретения для презентации внеклеточных белков внутриклеточных патогенов животным-хозяевам; скорее он иллюстрирует огромную сложность и присущее им разнообразие, связанные с оптимизацией вакцины. Однако, несмотря на данную и другую активность, никакое сочетание внеклеточных белков, адъювантов, белков-носителей, концентраций или частоты введения доз, приводящее к защитному иммунному ответу у морских свинок, не сравнимо или не превышает БЦЖ.
Недавно существенное внимание было сфокусировано на применении трансформированных штаммов БЦЖ для получения вакцин, которые экспрессируют различные связанные с клетками антигены. Например, C.K.Stover, et al. описали вакцину против болезни Лайма с применением рекомбинантной БЦЖ (рБЦЖ), которая экспрессирует связанный с мембраной липопротеин OspA Borrelia burgdorferi. Сходным образом, тот же автор также получил вакцину рБЦЖ, экспрессирующую белок поверхности пневмококка (PsPA) Sreptococcus pneumoniae. (Stover, C.K., G.P.Bansal, S.Langerman, and M.S.Hanson. 1994. Protective Immunity Elicited by rBCG Vaccines. In: Brown F. (ed): Recombinant Vectors in Vaccine Development. Dev Biol Stand. Dasel, Karger, Vol.82, 163-170.)
Патент Соединенных Штатов номер (USPN) 5504005 ("патент 005") и USPN 5854055 ("патент 055"), оба выпущенные B.R.Bloom et al., раскрывают теоретические векторы рБЦЖ, экспрессирующие широкий диапазон гибридных белков, ассоциированных с клетками, из многих штаммов микроорганизмов. Теоретические векторы, описанные в данных патентах, являются или направленными к гибридным белкам, ассоциированным с клетками, в виде противопоставления внеклеточным негибридным белкам-антигенам, и/или рБЦЖ гипотетически экспрессирует гибридные белки из отдаленно родственных штаммов. Более того, гибридные белки, ассоциированные с рекомбинантными клетками, экспрессируемые в данных моделях, кодируются ДНК, которая интегрирована в геном хозяина и находится под контролем промоторов белков теплового шока. Следовательно, экспрессируемые антигены являются гибридными белками, и экспрессия ограничивается уровнями, приблизительно равными или меньшими, чем природные белки векторов.
Более того, ни в одном из патентов "005 и 055" не раскрыта животная модель тестирования безопасности, развития иммунного ответа или защитного иммунитета в животной системе, которая наиболее близко имитирует болезнь человека. Кроме того, в "005 и 055" раскрыты только теоретические векторы рБЦЖ, экспрессирующие гибридные белки M. tuberculosis, никакие действующие вакцины не разработаны. Те модели вакцин M. tuberculosis, которые раскрыты, направлены на связанные с клетками гибридные белки теплового шока, а не на внеклеточные негибридные белки.
В патенте Соединенных Штатов номер 5830475 ("патент 475") также раскрыты теоретические микобактериальные вакцины, применяемые для экспрессии гибридных белков. ДНК, кодирующая данные гибридные белки, находится во внехромосомных плазмидах под контролем промоторов микобактериального белка теплового шока и промоторов белков стресса. Раскрытые вакцины предназначены для индукции иммунного ответа у животных, не являющихся человеком, с целью продукции у них антител, и не показано предотвращения заболеваний, вызванных внутриклеточными патогенами у млекопитающих. Более того, "патент 475" не раскрывает рекомбинантные вакцинирующие агенты, которые используют специфичные для белка промоторы для экспрессии внеклеточных негибридных белков.
Изобретатели настоящего изобретения предполагают без ограничения, что главные внеклеточные негибридные белки внутриклеточных патогенов могут быть важными молекулами иммунной защиты. Во-первых, внеклеточные негибридные белки, благодаря свойству их секреции патогеном во внутриклеточную среду клетки хозяина, доступны для процессинга и презентации иммунной системе в виде фрагментов, связанных с молекулами МНС на поверхности клетки хозяина. Данные комплексы пептид-МНС служат для предупреждения иммунной системы о присутствии в клетке хозяина спрятанных другим способом инвазивных патогенов, давая возможность иммунной системе создать подходящий противомикробный ответ против инвазивного патогена. Во-вторых, эффективная иммунизация внеклеточными белками способна индуцировать популяцию иммунных клеток, которые узнают те же самые комплексы пептид-МНС через некоторое время в будущем, когда комплексы экспонируются на клетках хозяина, инвазированных относящимся к этому внутриклеточным патогеном. Иммунные клетки становятся, таким образом, способными направляться к инфицированным клеткам хозяина и либо активировать их цитокинами, в результате чего они становятся способными ограничить рост внутриклеточного патогена, либо лизировать их, лишая таким способом патоген внутриклеточной среды, в которой он размножается. В-третьих, среди внутриклеточных белков главные, т.е. те, которые продуцируются в наибольших количествах, должны представляться наиболее важными в качестве иммунозащитных молекул, так как они обычно должны обеспечивать самую обширную презентацию комплексов пептид-МНС иммунной системе.
Следовательно, остается потребность в рекомбинантных вакцинах внутриклеточных патогенов, которые экспрессируют главные внеклеточные негибридные белки внутриклеточных патогенов, являющиеся близкородственными вакцинирующему агенту. Более того, существует потребность в рекомбинантных вакцинах внутриклеточных патогенов, которые способны гиперэкспрессировать рекомбинантные внеклеточные негибридные белки благодаря нехромосомной ДНК, имеющей промоторы, отличные от промоторов генов белков теплового шока, или промоторы, отличные от промоторов генов белков стресса.
Конкретно, остается срочная необходимость получения вакцин внутриклеточных патогенов, которые обеспечивают реципиентов защитой от заболеваний, которая превосходит защиту реципиентов, создаваемую вакциной БЦЖ. Более того, существует срочная необходимость предоставления как промышленно развитым, так и развивающимся странам реального по цене иммунотерапевтического и профилактического лечения туберкулеза и борьбы с другими внутриклеточными патогенами.
Следовательно, целью настоящего изобретения является предоставление терапевтических и профилактических вакцин для лечения и профилактики заболевания, вызванного внутриклеточными патогенами.
Другой целью настоящего изобретения является предоставление вакцин для профилактики болезней, вызываемых внутриклеточными патогенами, с применением внутриклеточных патогенов, которые трансформированы для экспрессии главных рекомбинантных иммуногенных антигенов того же самого патогена, другого внутриклеточного патогена или их обоих.
Еще одной целью настоящего изобретения является предоставление вакцин для лечения и профилактики микобактериальных заболеваний с применением рекомбинантной БЦЖ, которая экспрессирует внеклеточные белок(белки) патогенной микобактерии.
Другой целью настоящего изобретения является предоставление вакцин для лечения и/или профилактики туберкулеза с применением рекомбинантных штаммов БЦЖ, которые экспрессируют и секретируют один или более главных внеклеточных белков Mycobacterium tuberculosis.
Краткое изложение существа изобретения
Настоящее изобретение преследует описанные выше и другие цели путем предоставления нового класса вакцин и иммунотерапевтических агентов, а также способов лечения и профилактики заболеваний, вызываемых внутриклеточными патогенами, у млекопитающих. Исторически вакцины внутриклеточных патогенов и иммунотерапевтические агенты получали из самого внутриклеточного патогена или близкородственных видов. Данные старые модели вакцин состояли из целого микроорганизма или его субъединиц. Например, первая и к настоящему времени единственная пригодная вакцина Mycobacterium tuberculosis является ослабленной живой вакциной, полученной от близкородственного внутриклеточного патогена M. bovis. Недавно изобретатели настоящего изобретения обнаружили, что специфические внеклеточные продукты внутриклеточных патогенов, которые секретируются в ростовые среды, могут быть использованы для вызова защитных иммунных ответов у млекопитающих либо в виде индивидуальных субъединиц, либо в виде сочетаний субъединиц. Однако данные вакцины субъединиц не обеспечивали преимуществ по сравнению с исходной ослабленной вакциной, полученной из M. bovis.
Настоящее изобретение подробно описывает вакцины и иммунотерапевтические агенты, состоящие из рекомбинантных ослабленных внутриклеточных патогенов (вакцинирующих агентов), которые трансформированы для экспрессии внеклеточного(ых) белка(белков) (рекомбинантных иммуногенных антигенов) другого или того же самого внутриклеточного патогена. В одном осуществлении вакцины настоящего изобретения сделаны с применением рекомбинантных штаммов бациллы Кальметта и Герена или БЦЖ. В данном осуществлении рекомбинантная БЦЖ экспрессирует главные внутриклеточные белки патогенных микобактерий, включая, но не ограничиваясь этим, M. tuberculosis, M. leprae и M. bovis, называя некоторые из них.
Главные внеклеточные белки, экспрессируемые рекомбинантной БЦЖ, включают в себя, не ограничиваясь ими, 12 кДа, 14 кДа, 16 кДа, 23 кДа, 23,5 кДа, 30 кДа, 32А кДа, 32В кДа, 45 кДа, 58 кДа, 71 кДа, 80 кДа и 110 кДа Mycobacterium sp. и соответствующих аналогов, гомологов и их субъединиц, включая рекомбинантные негибридные белки, гибридные белки и их производные. Специалисту в данной области понятно, что молекулярные массы, применяемые для идентификации главных внеклеточных белков Mycobacteria и других внутриклеточных патогенов, обозначены только приблизительно. Специалисты в области рекомбинантной технологии и молекулярной биологии должны понимать, что возможна коэкспрессия (котрансляция) данных белков с дополнительными аминокислотами, полипептидами и белками, так же, как можно экспрессировать данные белки в укороченных формах. Полученные модифицированные белки все еще рассматриваются как входящие в объем настоящего изобретения, обозначаются ли они как нативные, негибридные белки, слитые белки, гибридные белки или химерные белки. В целях настоящего изобретения гибридные (слитые) белки определены как включающие в себя, но не ограничивающиеся ими, продукты двух или более кодирующих последовательностей от различных генов, которые совместно клонировались и которые после трансляции образуют единую полипептидную последовательность.
В настоящем изобретении также описываются вакцинирующие агенты рекомбинантных ослабленных внутриклеточных патогенов, которые гиперэкспрессируют негибридные белки по меньшей мере от одного другого внутриклеточного патогена. Это усовершенствуется применением внехромосомных нуклеиновых кислот для экспрессии по меньшей мере одного рекомбинантного гена иммуногенного антигена и помещения данного гена(ов) под контроль генных промоторов, отличных от белков теплового шока, или генных промоторов, отличных от белков стресса, предпочтительно последовательностей промотора, специфичных для белка. Соответственно, предлагаются вакцины, имеющие негибридные рекомбинантные иммуногенные антигены, экспрессируемые в количествах, больших, чем это возможно, когда гены, кодирующие рекомбинантные иммуногенные антигены, стабильно интегрированы в геномную ДНК вакцинирующего агента. В результате этого предлагаются вакцины внутриклеточных патогенов, имеющие неожиданно превосходящую специфичность и эффективность по сравнению с существующими вакцинами субъединиц или ослабленных патогенов.
Более того, настоящее изобретение описывает способы лечения и профилактики заболеваний млекопитающих, вызываемых внутриклеточными патогенами с применением вакцин настоящего изобретения. Частичное перечисление многих внутриклеточных патогенов, которые могут быть использованы в качестве ослабленных вакцинирующих агентов и/или источника рекомбинантных иммуногенных антигенов, включает в себя, не ограничиваясь ими, Mycobacterium bovis, M. tuberculosis, M. leprae, M. kansasii, M. avium, Mycobacterium sp., Legionella pneumophila, L. longbeachae, L. bozemanii, Legionella sp., Rickettsia rickettsii, Rickettsia typhi, Rickettsia sp., Ehrlichia chaffeensis, Ehrlichia phagocytophyla geno group, Ehrlichia sp., Coxiella burnetii, Leishmania sp., Toxpolasma gondii, Trypanosoma crusi, Chlamydia pneumoniae, Chlamydia sp., Listeria monocytogenes, Listeria sp. и Histoplasma sp. В одном осуществлении настоящего изобретения рекомбинантную БЦЖ, экспрессирующую 30 кДа главный внеклеточный белок M. tuberculosis, вводят млекопитающим с применением внутрикожных инокуляций. Однако понятно, что вакцины согласно изобретению могут быть введены с применением любого способа, который будет вести к соответствующему иммунному ответу, включая, но не ограничиваясь этим, подкожный, внутримышечный, интраназальный, внутрибрюшинный, пероральный способ введения или же с помощью ингаляции. После соответствующего постинокуляционного периода млекопитающих нагружали аэрозолем инфекционных M. tuberculosis. Млекопитающие, получавшие вакцину согласно изобретению, были заметно менее подвержены заболеванию по сравнению с млекопитающими, получавшими только БЦЖ, только главный внутриклеточный белок или любые их сочетания.
Другие цели, особенности и преимущества настоящего изобретения будут очевидны для специалистов после рассмотрения подробного описания предпочтительных иллюстративных осуществлений, взятых в сочетании с чертежами, которые вначале будут описаны в краткой форме.
Краткое описание чертежей
На фиг.1 отображены окрашенные Кумасси синим гели, обозначенные 1A и 1B, иллюстрирующие секрецию рекомбинантного Mycobacterium tuberculosis 30 кДа трансформированными штаммами БЦЖ из фильтратов культур.
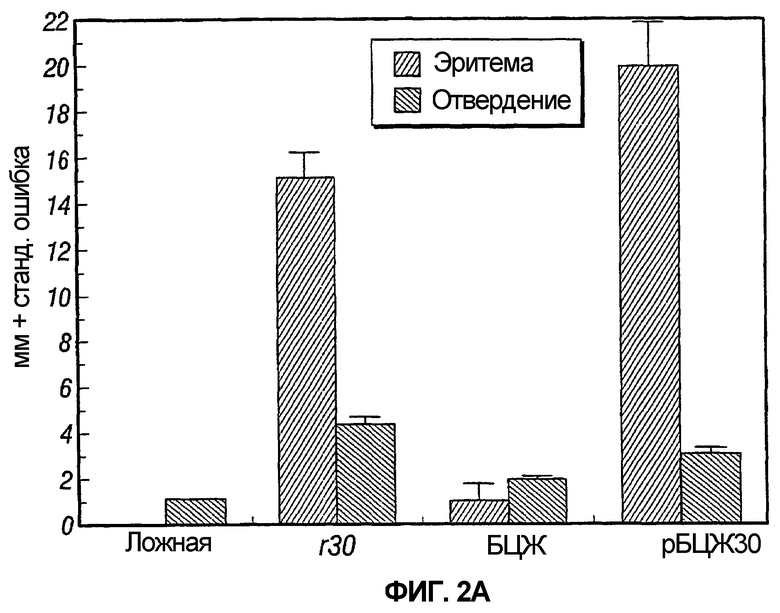
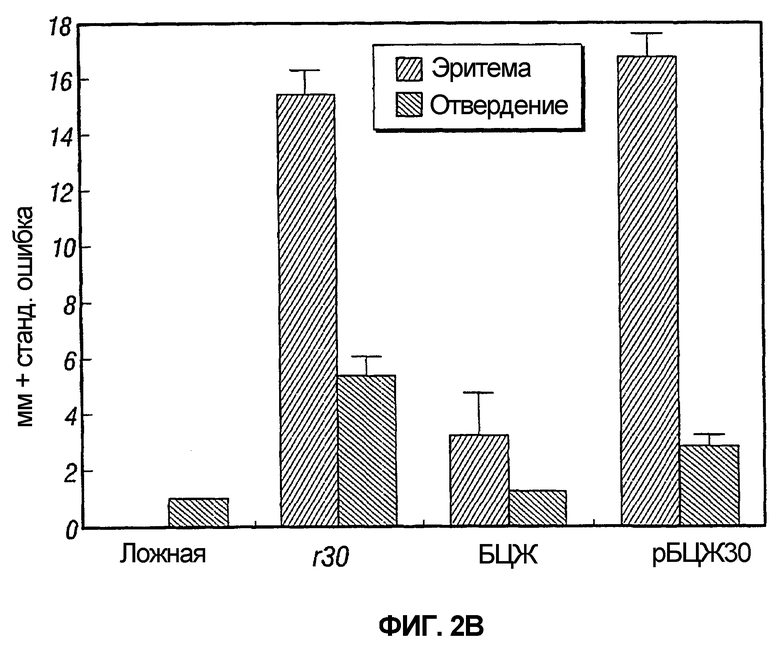
На фиг.2 графически представлены результаты двух экспериментов, обозначенных как 2A и 2B, предназначенных для сравнения результатов кожных тестов у морских свинок, инокулированных рекомбинантной вакциной БЦЖ, экспрессирующей главный внеклеточный белок 30 кДа M. tuberculosis, одной БЦЖ, одним рекомбинантным белком 30 кДа или пустой вакциной.
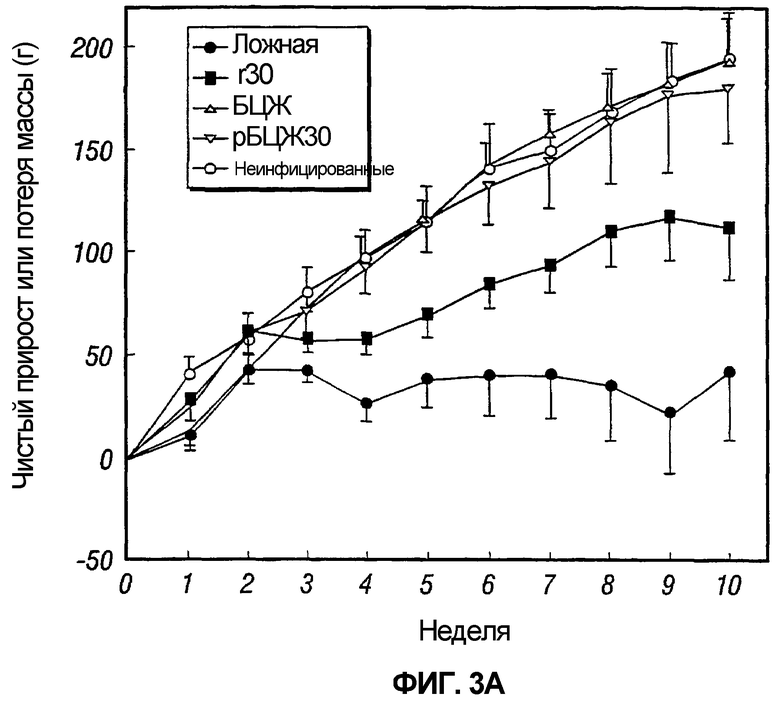
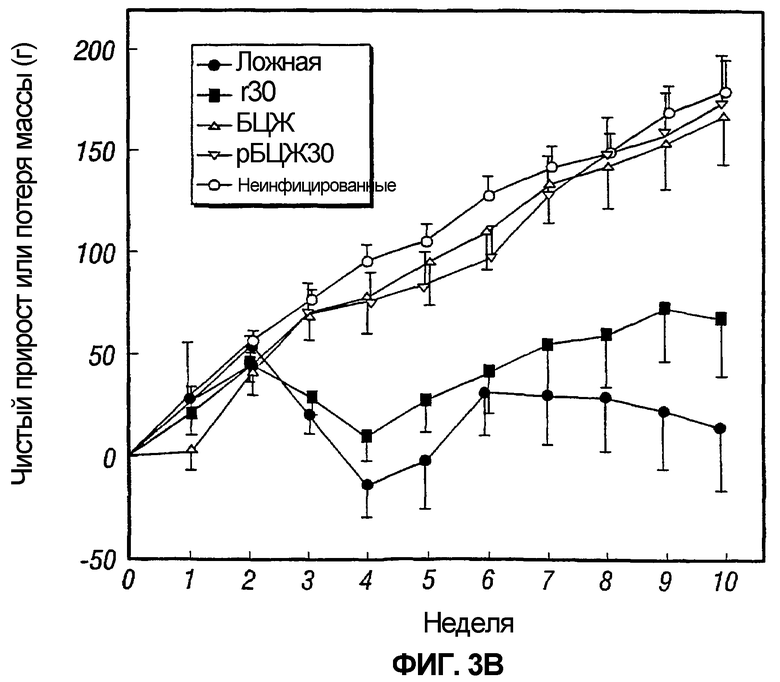
На фиг.3 графически отображено изменение массы морских свинок, обозначенных как 3A и 3B, после постиммунизационного контрольного заражения M. tuberculosis.
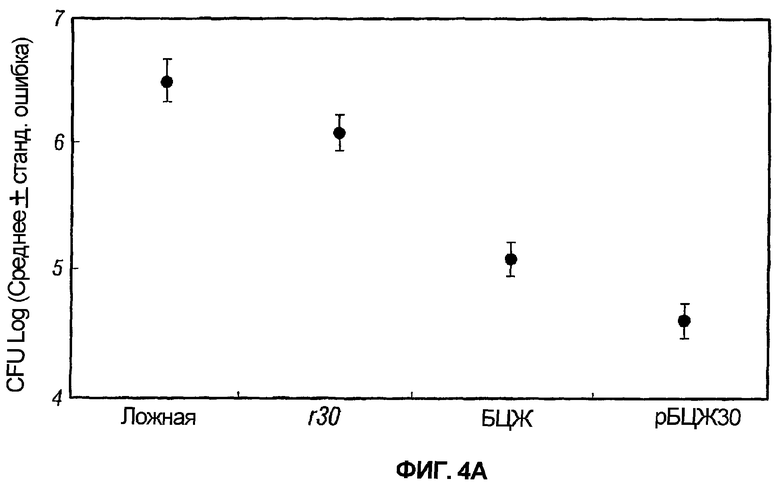
На фиг.4A графически представлены колониеобразующие единицы (CFU) инфекционного M. tuberculosis, обнаруженные в легких морских свинок после постиммунизационного заражения M. tuberculosis.
На фиг.4B графически представлены колониеобразующие единицы (CFU) инфекционного M. tuberculosis, обнаруженные в селезенке морских свинок после постиммунизационного заражения M. tuberculosis.
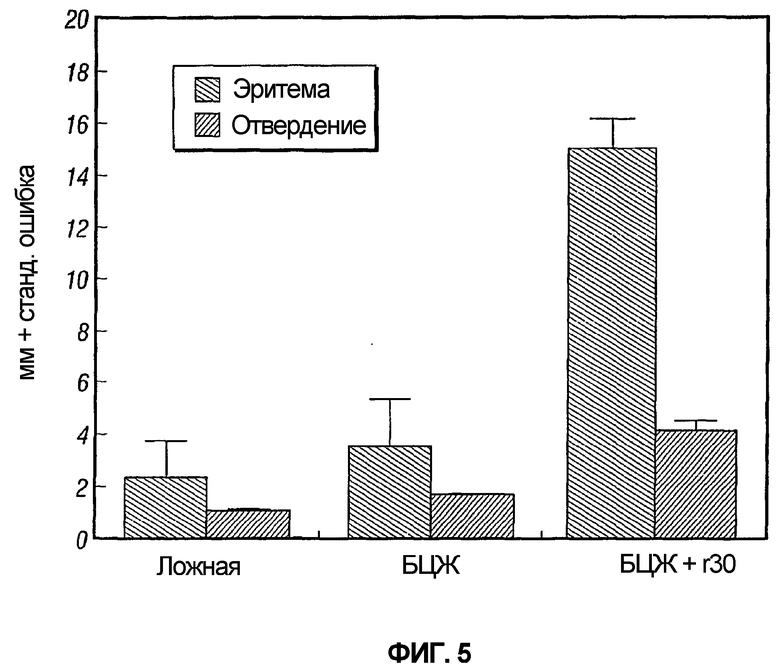
На фиг.5 графически изображена кожная реакция морских свинок в ответ на пустую вакцину, в ответ на одну только БЦЖ, и в ответ на БЦЖ, введенную вместе с 30 кДа M. tuberculosis.
Подробное описание изобретения
Настоящее изобретение направлено в целом на вакцины и иммунотерапию для лечения и профилактики инфекций у человека и животных, вызванных внутриклеточными патогенами. Конкретно, настоящее изобретение направлено на оптимизацию представления антигена внутриклеточного патогена, дающую возможность получателю иммунотерапии и/или вакцины генерировать максимальный иммунный ответ на терапевтически или профилактически важные белки. Авторы настоящего изобретения при исследованиях и экспериментировании на протяжении многих лет неожиданно обнаружили, что успешное лечение и профилактика инфекций внутриклеточным патогеном с применением внеклеточных белков, полученных из внутриклеточного патогена, зависит от представления белка хозяину.
Представление антигена охватывает группу переменных параметров, которые определяют, каким образом реципиент обрабатывает антиген и отвечает на него. Данные параметры включают в себя, не ограничиваясь ими, адъюванты, концентрацию компонентов вакцины, молекулы-носители, гаптены, частоту и способ введения дозы. Авторы настоящего изобретения показали, что одинаковые антигены в разных сочетаниях обычно вызывают статистически значимые различия в ответах у генетически сходных хозяев. Например, были составлены два препарата вакцины внеклеточного белка 30 кДа M. tuberculosis с применением одних и тех же концентраций белка и адъюванта. Одной группе морских свинок вводили вакцину, содержащую лишь белок 30 кДа и адъювант, а второй группе морских свинок вводили ту же самую вакцину, что и первой группе, за исключением того, что во вторую вакцину добавляли ИЛ-12. При сравнении иммунных ответов в двух группах оказалось, что морские свинки, получавшие вакцину с ИЛ-12, реагировали статистически значимо более сильным иммунным ответом.
В настоящем изобретении описано объединение двух технологий, одна из которых известна на протяжении восьмидесяти лет, а вторая является продуктом 1990-х годов. Совместно они представляют собой совершенно новый и неожиданно эффективный подход к представлению внеклеточных белков внутриклеточных патогенов реципиентам и индукции у них необычайно мощных защитных иммунных ответов. Авторы настоящего изобретения опробовали более 100 различных способов представления антигена с применением внеклеточных белков Mycobacterium tuberculosis как типичного внутриклеточного патогена. Однако, несмотря на многие успехи, достигнутые авторами настоящего изобретения, ни в одном из случаев не удавалось индуцировать иммунный ответ, превышающий тот, который наблюдается при действии одной только вакцины БЦЖ.
В краткой формулировке, предназначенной исключительно в качестве общего примера, настоящее изобретение включает в себя вакцины внутриклеточных патогенов с применением ослабленных или невирулентных рекомбинантных внутриклеточных патогенов ("вакцинирующего агента"), которые экспрессируют и секретируют рекомбинантные иммуногенные антигены того же самого вида, других видов или обоих типов ("иммуноген(ы)"); вакцинирующий агент и иммуноген(ы) вместе обозначаются как "вакцины" согласно изобретению. Вакцины вводят одним или более путем/путями, включая, но не ограничиваясь этим, подкожное, внутримышечное, интраназальное, внутрибрюшинное, внутрикожное, пероральное или ингаляторное введение. Вакцинирующие агенты согласно изобретению продолжают существовать в реципиенте, экспрессируя и секретируя иммуноген(ы) in situ (статус).
Не связывая себя данной теорией, авторы настоящего изобретения предположили, что иммуногенные антигены умеренных патогенов, таких как Legionella sp., могут вызывать защитные иммунные ответы легче, чем сходные иммуногенные антигены более традиционных патогенов животных, таких как Mycobacterium sp. Возможно, давление отбора привело к появлению у патогенов, таких как Mycobacterium sp., совместно эволюционировавших со своими естественными хозяевами, механизмов ускользания от иммунной атаки, отсутствующих у случайных или умеренных патогенов. Следовательно, для индукции защитных иммунных ответов против патогенных Mycobacteria должны быть разработаны значительно более мощные вакцинирующие агенты и иммуногены по сравнению с теми, которые необходимы для индукции защитного иммунитета против патогенов, для которых человек не является первичным хозяином.
Авторы настоящего изобретения ранее показали, что внеклеточные белки из умеренного внутриклеточного патогена Legionella sp. обеспечивают животным значительную иммунную защиту при введении в очищенной форме или в виде смесей с применением полного или неполного адъюванта Фрейнда. (См. USPN 5108745, включенный здесь в качестве ссылки.) Однако попытки получить сходные защитные иммунные ответы с применением внеклеточных белков M. tuberculosis в сходных условиях были не столь успешными. Поэтому авторы настоящего изобретения предположили, что гиперэкспрессия внеклеточных негибридных белков может оказаться важным аспектом представления антигена и развития защитных иммунных ответов. Ясно, однако, что хотя гиперэкспрессия негибридных иммуногенных внеклеточных белков может служить важным фактором в индукции иммунной защиты, не следует думать, что они являются единственными иммуностимулирующими факторами вакцин, предлагаемых в настоящем изобретении.
Настоящее изобретение идеально приспособлено для получения высокоэффективных иммунозащитных вакцин против множества внутриклеточных патогенов, включая, но не ограничиваясь этим, штаммы БЦЖ, гиперэкспрессирующие главные внеклеточные негибридные белки M. tuberculosis, M. bovis или M. leprae. Каждая вакцина согласно изобретению может экспрессировать по меньшей мере один иммуноген с разной молекулярной массой, специфичный для данного внутриклеточного патогена. Например, авторы настоящего изобретения ранее идентифицировали иммуногены M. tuberculosis, которые включают в себя, не ограничиваясь ими, главные внеклеточные белки 12 кДа, 14 кДа, 16 кДа, 23 кДа, 23,5 кДа, 30 кДа, 32A кДа, 32B кДа, 45 кДа, 58 кДа, 71 кДа, 80 кДа, 110 кДа и их соответствующие аналоги, гомологи и субъединицы, включая рекомбинантные негибридные белки, гибридные белки и их производные. (См. ожидающие решения патентные заявки Соединенных штатов с регистрационными номерами 08/156358, 09/157689, 09/175598, 09/226539 и 09/322116, полное содержание которых приведено здесь в качестве ссылки.) Для специалистов в данной области ясно, что молекулярные массы, применяемые для идентификации главных внеклеточных белков Mycobacteria и других внутриклеточных патогенов, используются лишь как приближения. Специалисты в области рекомбинантной технологии и молекулярной биологии должны понимать, что возможна коэкспрессия (котрансляция) данных белков с дополнительными аминокислотами, полипептидами и белками, так же, как возможна и экспрессия данных белков в укороченных формах. Полученные модифицированные белки все еще рассматриваются как входящие в объем настоящего изобретения, независимо от того, относятся ли они к природным, негибридным белкам, слитым белкам, гибридным белкам или химерным белкам. Для целей настоящего изобретения гибридные белки определяются как включающие в себя, но не ограничивающиеся этим, продукты двух или более кодирующих последовательностей различных генов, которые клонировали совместно и которые после трансляции образуют единую полипептидную последовательность.
Экспрессия антигенов, включая внеклеточные белки, обычно увеличивается, когда гены, кодирующие рекомбинантные негибридные белки, локализуются на одной или более плазмидах (внехромосомной ДНК) и находятся под их контролем, по сравнению с интегрированными в геном хозяина генами. Более того, экспрессия белка, направляемая промоторными последовательностями, специфичными для конкретного белка, обеспечивает повышенную экспрессию и улучшенные упаковку и процессинг негибридных белковых антигенов. Поэтому в настоящем изобретении предлагаются рекомбинантные внеклеточные негибридные белки, кодируемые на внехромосомной ДНК, которые контролируются промоторами, отличными от промоторов генов белков теплового шока, или промоторами генов стрессорных белков, предпочтительно промоторными последовательностями, специфичными для белка.
В настоящем изобретении предлагаются рекомбинантные ослабленные вакцинирующие агенты внутриклеточного патогена, такие как рБЦЖ, которые экспрессируют свои собственные эндогенные внеклеточные белки в дополнение к рекомбинантным внеклеточным негибридным белкам близкородственных и/или других внутриклеточных патогенов. Однако на протяжении 80 лет исследований было показано, что эндогенные внеклеточные белки сами по себе не обеспечивают полной защиты у всех реципиентов. Более того, как будет объяснено подробнее ниже, авторы настоящего изобретения показали также, что простое совместное введение внеклеточных белков M. tuberculosis и традиционной БЦЖ не дает вакцин, лучших, чем одна БЦЖ.
В одном осуществлении настоящего изобретения вакцина включает в себя рекомбинантный БЦЖ-вакцинирующий агент, экспрессирующий лишь один иммуноген, например, 30 кДа главный внеклеточный белок M. tuberculosis. В другом осуществлении настоящего изобретения рекомбинантная БЦЖ может экспрессировать два или более иммуногенов, например, 23,5 кДа и 30 кДа главные внеклеточные белки M. tuberculosis. Данное последнее осуществление может быть особенно эффективным в качестве вакцины для профилактики заболеваний у млекопитающих. Авторы настоящего изобретения предложили неограничивающую теорию, согласно которой одновременная гиперэкспрессия главных внеклеточных белков M. tuberculosis рекомбинантной БЦЖ 23,5 кДа и 30 кДа может действовать синергично для усиления защитного иммунного ответа млекопитающего против внутриклеточных патогенов согласно изобретению. Данная теория частично основана на наблюдении, что БЦЖ дикого типа и рекомбинантная БЦЖ являются делеционными мутантами M. bovis, которая в естественных условиях не экспрессирует свой собственный главный внеклеточный белок 23,5 кДа.
Ради краткости, но не для ограничения, а в силу чрезвычайно сложного описания, которое бы получилось, настоящее изобретение будет более конкретно описано с применением рекомбинантной БЦЖ в качестве вакцинирующего агента и внеклеточных негибридных белков M. tuberculosis, особенно 30 кДа главного внеклеточного негибридного белка, в качестве иллюстративного осуществления настоящего изобретения. Ясно, что любой рекомбинантный иммуногенный антиген может быть экспрессирован рекомбинантным ослабленным внутриклеточным патогеном и что вакцины настоящего изобретения не ограничены БЦЖ в качестве вакцинирующего агента и главными внеклеточными негибридными белками M. tuberculosis в качестве иммуногенов.
Для определения эффектов вариаций штаммов вакцинирующего агента, для приготовления различных осуществлений настоящего изобретения применяли два разных штамма БЦЖ: БЦЖ Tice и БЦЖ Connaught. M. bovis БЦЖ Tice дикого типа была получена от Organon, а M. bovis БЦЖ Connaught дикого типа была получена от Connaught Laboratories, Toronto, Canada. Штаммы содержали в среде 7H9 с pH 6,7 (Difco) при 37°С в 5% CO2-95% атмосферном воздухе в виде невстряхиваемых культур. Культуры сонифицировали один или два раза в неделю в течение 5 мин в водяной бане для сонификации для снижения агрегации бактерий.
Рекомбинантную БЦЖ TICE (рБЦЖ30 Tice), экспрессирующую 30 кДа главный внеклеточный негибридный белок M. tuberculosis, получали следующим образом. Плазмиду pMTB30, рекомбинантную конструкцию челночной E. coli/микобактерии плазмиды pSMT3, получали, как описано ранее авторами настоящего изобретения в публикации Harth, G., B.-Y. Lee and M.A. Horwitz. 1997. High-level heterologous expression and secretion in rapidly growing nonpathogenic mycobacteria of four major Micobacterium tuberculosis extracellular proteins considered to be leading vaccine candidates and drug targets. Infect. Immun. 65:2321-2328, полное содержание которой включено здесь в качестве ссылки.
Вкратце, плазмида pMTB30 была сконструирована для экспрессии M. tuberculosis Erdman 30 кДа главного внеклеточного негибридного белка из его собственного промотора (или промотора гена любого белка, не являющего белком теплового шока или стрессорным белком) путем вставки крупного фрагмента рестрикции геномной ДНК, содержащего ген 30 кДа негибридного белка плюс протяженные фланкирующие последовательности ДНК, в плазмидный сайт мультиклонирования с применением способов, известных специалистам в области технологии рекомбинантной ДНК. Плазмиду сначала вводили в E coli DH5α для получения больших количеств рекомбинантной плазмиды. Рекомбинантный штамм E. coli, который был неспособен экспрессировать 30 кДа негибридный белок M. tuberculosis, выращивали в присутствии 250 мкг/мл гигромицина, и последовательность ДНК плазмидной вставки определяли полностью. Плазмиду вводили в M. smegmatis с помощью электропорации с применением 6,25 кВ/см, 25 мкФ и 1000 мОм в качестве условий, дающих наибольшее количество позитивных трансформантов. Авторы настоящего изобретения подтверждали присутствие рекомбинантной плазмиды ростом в присутствии 50 мкг/мл гигромицина и конститутивной экспрессией и экспортом рекомбинантного 30 кДа негибридного белка по результатам электрофореза в полиакриламидном геле и иммуноблоттинга с поливалентным высокоспецифичным иммуноглобулином кролика против 30 кДа негибридного белка с применением способов, известных специалистам в области технологии рекомбинантной ДНК. Кроме того, изобретатели подтвердили правильность экспрессии и процессинга рекомбинантного 30 кДа негибридного белка M. tuberculosis, который был неотличим от природного белка при секвенировании N-концевых аминокислот.
Рекомбинантную pSMT3 плазмиду pMTB30 далее вводили в M. bovis БЦЖ Tice с применением 6,25 кВ/см, 25 мкФ и 200 мОм в качестве оптимальных условий электропорации. Трансформанты инкубировали в среде 7H9 с добавкой 2% глюкозы в течение 4 час при 37°С в экологическом шейкере и затем распластывали на 7H11 агаре с 20 мкг/мл гигромицина. Концентрацию гигромицина постепенно увеличивали до 50 мкг/мл путем субкультивирования трансформантов на новой ростовой среде. Рекомбинантные БЦЖ Tice культуры поддерживали при тех же самых условиях, что и культуры дикого типа, за исключением того, что среда 7H9 содержала 50 мкг/мл гигромицина.
Экспрессию и экспорт рекомбинантного 30 кДа негибридного белка M. tuberculosis подтверждали с помощью электрофореза в полиакриламидном геле и иммуноблоттинга с поливалентным высокоспецифичным иммуноглобулином кролика против 30 кДа негибридного белка. Обычно 1 из 10 трансформантов экспрессировал и экспортировал значительно большие количества рекомбинантного негибридного белка, чем другие трансформанты; были выбраны два таких трансформанта и был получен большой запас данных трансформантов и заморожен при -70°С в среде 7H9, содержащей 10% глицерин. Данные трансформанты были применены для изучения эффективности вакцины у морских свинок. На Фиг.1A показана экспрессия 30 кДа главного внеклеточного негибридного белка M. tuberculosis рекомбинантной БЦЖ Tice на ДДС-Na-ПАГЭ гелях и иммуноблотах. Рекомбинантный штамм экспрессировал значительно больше 30 кДа главного внеклеточного негибридного белка M. tuberculosis, чем дикий тип, как на окрашенных кумасси синим гелях, так и на иммуноблотах.
Затем сходным с описанным выше для рекомбинанта БЦЖ Tice (рБЦЖ30 Tice) образом с применением упомянутой плазмиды pMTB30 был получен рекомбинант штамма M. bovis БЦЖ Connaught (рБЦЖ30 Conn), экспрессирующий 30 кДа главный внеклеточный негибридный белок M. tuberculosis. Его поддерживали в среде, содержащей гигромицин в концентрации 50 мкг/мл при тех же условиях, которые были описаны для рекомбинанта штамма БЦЖ Tice. На Фиг.1b показана экспрессия 30 кДа главного внеклеточного негибридного белка M. tuberculosis рекомбинантной БЦЖ Connaught на ДДС-Na-ПАГЭ гелях и иммуноблотах. Рекомбинантный штамм экспрессировал значительно больше 30 кДа главного внеклеточного негибридного белка M. tuberculosis, чем дикий тип, как на окрашенных кумасси синим гелях, так и на иммуноблотах.
Стабильность плазмид рекомбинантных штаммов БЦЖ оценивали биохимически. Этот биохимический анализ показал, что в присутствии гигромицина обе культуры рекомбинантных штаммов БЦЖ сохраняют постоянный уровень экспрессии рекомбинантного негибридного белка на протяжении периода роста, равного 3 месяцам. В отсутствие гигромицина те же культуры проявляют лишь слабое снижение экспрессии негибридного белка (в расчете на клетку), что свидетельствует о том, что рекомбинантная плазмида стабильно сохраняется и лишь очень медленно утрачивается у бактерий, растущих в отсутствие давления селекции (Фиг.1A и Фиг.1B, дорожка 3).
Ясно, что с помощью способов, описанных выше, в сочетании со способами, известными специалистам в области технологии рекомбинантной ДНК, могут быть получены рекомбинантные штаммы БЦЖ, экспрессирующие 32(A) кДа главный внеклеточный негибридный белок M. tuberculosis, 16 кДа главный внеклеточный негибридный белок, 23,5 кДа главный внеклеточный негибридный белок и другие главные внеклеточные негибридные белки M. tuberculosis. Более того, сходные методологии могут быть применены для получения рекомбинантных штаммов БЦЖ, экспрессирующих главные внеклеточные негибридные белки M. leprae, включая, но не ограничиваясь этим, 30 кДа главный внеклеточный негибридный белок M. leprae, являющийся гомологом 30 кДа главного внеклеточного негибридного белка M. tuberculosis (a.k.a. Antigen 85B), 32(A) кДа главный внеклеточный негибридный белок M. leprae, являющийся гомологом 32(A) кДа главного внеклеточного негибридного белка M. tuberculosis (a.k.a. Antigen 85A), и другие главные внеклеточные негибридные белки M. leprae. Кроме того, сходные методологии могут быть также применены для получения рекомбинантной БЦЖ M. bovis, экспрессирующей 30 кДа главный внеклеточный негибридный белок M. bovis, являющийся гомологом 30 кДа главного внеклеточного негибридного белка M. tuberculosis (a.k.a. Antigen 85B), 32(A) кДа главный внеклеточный негибридный белок M. bovis, являющийся гомологом 32(A) кДа главного внеклеточного негибридного белка M. tuberculosis (a.k.a. Antigen 85A), и другие главные внеклеточные негибридные белки M. bovis.
После успешного получения вакцины, вакцины согласно изобретению тестируют на безопасность и эффективность с применением животной модели. В исследованиях использовали морских свинок, поскольку модель морских свинок является особенно релевантной к туберкулезу человека клинически, иммунологически и патологически. В отличие от мыши и крысы, но, как и у человека, у морской свинки выявлены a) чувствительность к низким дозам аэрозольного M. tuberculosis; b) сильная кожная DTH на туберкулин; и c) гигантские клетки Langhans и створаживание в легочных повреждениях. Однако в то время как лишь приблизительно у 10% иммунокомпетентных людей, инфицированных M. tuberculosis, развивается активное заболевание в течение всей их жизни (у половины - вскоре после экспозиции, а у половины - после латентного периода), у инфицированных морских свинок всегда быстро развивается активное заболевание. Хотя в данном отношении морские свинки отличаются от человека, постоянство, с которым у них развивается активное заболевание после инфекции M. tuberculosis, является благоприятным в испытаниях активности вакцины.
Инокуляты для иммунизации, приготовленные согласно указаниям настоящего изобретения, готовили из аликвот, взятых из логарифмически растущих культур БЦЖ дикого типа или рекомбинантных БЦЖ ("бактерии"). Каждую аликвоту бактерий осаждали центрифугированием при 3500 × g в течение 15 мин и затем промывали 1 × забуференным физиологическим раствором (1 × ЗФР, 50 мМ фосфат натрия pH 7, 150 мМ хлористый натрий). После этого инокуляты для иммунизации ресуспендировали до конечной концентрации 1 × 104 колониеобразующих единиц на мл в 1 × ЗФР при содержании 1000 жизнеспособных бактерий на 100 мкл.
Свободных от специфического патогена 250-300 г неродственных морских свинок линии Hartley от Charles River Breeding Laboratories в группах по 9 иммунизировали внутрикожно одним из следующих: 1) БЦЖ Connaught [103 колониеобразующих единиц (CFU)] лишь один раз (время 0 недель); 2) рБЦЖ30 Connaught (103 CFU) лишь один раз (время 0 недель); 3) очищенным рекомбинантным 30 кДа главным внеклеточным негибридным белком M. tuberculosis (r30), 100 мкг в 100 мкл адъювантного состава Syntex (SAF), три раза с интервалами в три недели (время 0, 3 и 6 недель); SAF составлен из Pluronic L121, сквалана и твина 80, а при первой иммунизации - аланилмурамилдипептида; и 4) одним SAF (100 мкл) (ложная иммунизация) три раза с интервалами в три недели (время 0, 3 и 6 недель). Дополнительную группу из 3 животных подвергали ложной иммунизации одним SAF (100 мкл) и использовали в качестве контроля для кожного теста. Эти и от трех до шести других ложноиммунизированных животных служили в качестве неинфицированных контролей в экспериментах с контрольным заражением.
Девять недель спустя после единственной иммунизации (группы БЦЖ и рБЦЖ30) или первой иммунизации (группа r30 и группа ложноиммунизированных для кожного теста) у морских свинок брили спину, и им вводили внутрикожно 10 мкг очищенного рекомбинантного 30 кДа главного внеклеточного негибридного белка M. tuberculosis (r30) в 100 мкл забуференного физиологического раствора. Через 24 часа измеряли диаметр эритемы и отвердения. (Отдельную группу ложноиммунизированных животных из тех, которые использовались в исследованиях с контрольным заражением, применяли для кожного теста. Ложноиммунизированных животных, использованных в исследованиях с контрольным заражением, не применяли для кожного теста, чтобы исключить возможность, что сам кожный тест мог бы влиять на результат.)
Спустя девять недель после первой или единственной иммунизации и сразу после проведения кожного теста животных подвергали контрольному заражению с помощью аэрозоля, полученного из 10 мл суспензии одиночных клеток, содержащей 1 × 105 колониеобразующих единиц (CFU) M. tuberculosis. Mycobacterium tuberculosis штамма Erdman (ATCC 35801) пассировали на неродственных морских свинках для сохранения вирулентности, культивировали на агаре 7H11, подвергали мягкой сонификации для получения суспензии одиночных клеток и замораживали при -70°C для применения в экспериментах с контрольным заражением животных. Доза аэрозольного контрольного заражения обеспечивала доставку ˜ 40 живых бацилл в легкие каждого животного. Воздушный путь инфекции применяли потому, что он является естественным путем инфекции при легочном туберкулезе. Большую дозу применяли для того, чтобы индуцировать заметное клиническое заболевание у 100% контрольных животных в пределах относительно короткого промежутка времени (10 недель). После этого морских свинок помещали в отдельные клетки из нержавеющей стали, помещаемые в камеру биологической защиты с ламинарным потоком, и обеспечивали свободный доступ к стандартному лабораторному корму и воде. Животных обследовали на заболевание и взвешивали еженедельно в течение 10 недель и затем умерщвляли. У каждого животного извлекали правое легкое и селезенку и культивировали для определения CFU M. tuberculosis.
В каждом из двух экспериментов ложноиммунизированные животные и животные, иммунизированные БЦЖ дикого типа, показали слабую эритемию и отвердение или их отсутствие при тестировании с рекомбинантным 30 кДа главным внеклеточным негибридным белком M. tuberculosis (r30). Напротив, животные, иммунизированные r30 или рБЦЖ30, показывали заметную эритему и отвердение, которые были значительно больше, чем у ложноиммунизированных или иммунизированных БЦЖ дикого типа животных (таблица 1 и фиг.2).
В каждом из двух экспериментов у неинфицированного контроля после контрольного заражения прибавка в массе была нормальной, как и у животных, иммунизированных либо рБЦЖ30, либо БЦЖ дикого типа (фиг.3). Действительно, между данными тремя группами не было существенных различий в прибавке массы. Напротив, у ложноиммунизированных животных и, в меньшей мере, у животных, иммунизированных r30, наблюдалась сниженная прибавка массы на протяжении эксперимента (таблица 2 и фиг.3). Следовательно, после контрольного заражения M. tuberculosis и БЦЖ, и рБЦЖ30 полностью защищали животных от потери массы, являющейся главным физическим показателем туберкулеза у человека и признаком туберкулеза у морских свинок, служащего моделью данного хронического инфекционного заболевания.
В каждом из двух экспериментов в конце 10-недельного периода наблюдений морских свинок умерщвляли, и у каждого животного в асептических условиях извлекали правое легкое и селезенку и подвергали их анализу на CFU M. tuberculosis. Ложноиммунизированные животные имели наибольшую бактериальную нагрузку в легких и селезенке (таблица 3 и фиг.4A и фиг.4B). Животные, иммунизированные r30, содержали меньше организмов в легких и селезенке по сравнению с ложноиммунизированными животными; животные, иммунизированные БЦЖ, содержали меньше организмов по сравнению с животными, иммунизированными r30; и, что особенно примечательно, животные, иммунизированные рБЦЖ30, содержали меньше организмов по сравнению с животными, иммунизированными БЦЖ. Статистические тесты с применением двустороннего факторного анализа дисперсии при сравнении средних значений показали, что средние значения для четырех "обработанных" групп (ложная, r30, БЦЖ и рБЦЖ30) в эксперименте 1 не отличались статистически от средних значений для четырех обработанных групп в эксперименте 2 и что поэтому было возможно объединить результаты двух экспериментов. Объединенные данные показаны в таблице 4 и на фиг.3. Наиболее интересным и важным было то, что животные, иммунизированные рБЦЖ30, содержали на 0,5 log меньше организмов в легких и почти на 1 log меньше организмов в селезенке, чем животные, иммунизированные БЦЖ. При статистическом анализе с применением методов дисперсионного анализа для сравнения средних и критерия Таки-Фишера наименьшего значимого различия для оценки статистической значимости, среднее значение для каждой из четырех групп, как в легких, так и в селезенке, значительно отличалось от среднего значения в каждой из остальных (таблица 4). Различия между животными, иммунизированными рБЦЖ30 и БЦЖ, в легких были значимы при p=0,02, а в селезенке - при p=0,001. Параллельно с различиями в CFU в легких при макроскопическом обследовании легкие животных, иммунизированных рБЦЖ30, имели меньше повреждений, чем легкие животных, иммунизированных БЦЖ (20 ± 4% против 35 ± 5%, среднее ± SE).
Таким образом, введение рекомбинантной БЦЖ, экспрессирующей 30 кДа главный внеклеточный негибридный белок M. tuberculosis, индуцировало высокую степень защиты от аэрозольного контрольного заражения M. tuberculosis на высокочувствительной модели легочного туберкулеза у морских свинок. Напротив, как описано в нижеследующих примерах, введение того же самого микобактериального внеклеточного негибридного белка (рекомбинантного 30 кДа главного внеклеточного негибридного белка M. tuberculosis) в адъюванте в сочетании с БЦЖ не индуцирует высокую степень защиты от аэрозольного контрольного заражения M. tuberculosis, так же, как и введение рекомбинантной M. smegmatis, экспрессирующей 30 кДа главный внеклеточный негибридный белок M. tuberculosis; так же, как и введение 30 кДа главного внеклеточного негибридного белка M. tuberculosis в микросферах, которые имеют приблизительно тот же размер, что и БЦЖ, и которые, подобно БЦЖ, медленно высвобождают белки на протяжении 60-90 дней; так же, как и введение 30 кДа главного внеклеточного негибридного белка M. tuberculosis, инкапсулированного в липосомы.
Крайне удивительным аспектом данного изобретения является то, что штамм рБЦЖ30 индуцировал защиту эффективнее, чем БЦЖ дикого типа, даже несмотря на то, что дикий тип экспрессирует и секретирует эндогенный высокогомологичный 30 кДа главный внеклеточный белок (см. фиг.1). Ген, кодирующий белок 30 кДа из варианта штамма БЦЖ Connaught, не был секвенирован. Однако последовательность белка 30 кДа двух других вариантов штамма БЦЖ, определяемая на основе последовательности клонированного гена указанных вариантов штамма, отличается от белка M. tuberculosis лишь одной аминокислотой (БЦЖ Paris 1173 P2) или 5 аминокислотами, включая две дополнительные аминокислоты (БЦЖ Tokyo). (См. страницы 3041-3042 публикации Harth, G., B.-Y.Lee, J.Wang, D.L.Clemens, and M.A.Horwitz. 1996. Novel insights into genetics, biochemistry, and immunocytochemistry of the 30-kilodalton major extracellular protein of Mycobacterium tuberculosis. Infect. Immun. 64:3038-3047, полное содержание которой здесь включено в качестве ссылки.) Следовательно, улучшенная защита рекомбинантного штамма, по-видимому, не обусловлена небольшим аминокислотным различием между рекомбинантным и эндогенным белками. Более вероятно, что она обусловлена повышенной экспрессией рекомбинантного негибридного белка по сравнению с эндогенным белком. Если это так, то повышенная экспрессия, полученная с применением большого количества копий плазмиды, была важным фактором в эффективности рекомбинантной вакцины.
(Средний диаметр±SE)
(мм)
(Средний диаметр±SE)
(мм)
(средняя масса ±SE) (г)
(средняя масса ±SE) (г)
Недели 0-10
(среднее±SE)
Объединенные эксперименты 1 и 2
(среднее±SE)
(среднее±SE)
CFU в легких и селезенке
Объединенные эксперименты 1 и 2
Животных иммунизировали БЦЖ или БЦЖ плюс рекомбинантный 30 кДа белок M. tuberculosis в адъюванте или подвергали ложной иммунизации
(среднее±SE)
(среднее±SE)
Животных иммунизировали живой рекомбинантной M. smegmatis, экспрессирующей 30 кДа главный внеклеточный белок M. tuberculosis (rM. smegmatis 30)
(среднее±SE)
(среднее±SE)
Животных иммунизировали микросферами, имеющими приблизительно тот же размер, что и БЦЖ, и, подобно БЦЖ, медленно высвобождающими 30 кДа главный внеклеточный белок M. tuberculosis (r30)
Животных иммунизировали липосомами, содержащими 30 кДа главный внеклеточный белок M. tuberculosis (r30)
(среднее±SE)
(среднее±SE)
Следующие примеры служат для иллюстрации нового аспекта настоящего изобретения. Каждый пример иллюстрирует средства доставки иммуногенов согласно изобретению с помощью способов, близких к вакцине согласно изобретению, но отличных от нее. В частности, Пример 1 показывает, что когда иммуногены согласно изобретению вводят вместе с БЦЖ, но не экспрессируются in vivo посредством БЦЖ, высокая степень защитного иммунитета не достигается.
Пример 2 показывает, что экспрессия иммуногенов согласно изобретению in vivo с применением Mycobacterium sp., близкородственной БЦЖ, но не способной к репликации у млекопитающих-хозяев, не обеспечивает индукции значительного уровня защиты от контрольного заражения M. tuberculosis. Примеры 3 и 4 показывают, что медленное высвобождение иммуногенов согласно изобретению синтетическими микроносителями вакцины также не способно обеспечить индукцию значительного уровня защиты от контрольного заражения M. tuberculosis.
Таким образом, следующие примеры служат для того, чтобы подчеркнуть совершенно неожиданное и замечательное достижение, которое вакцины внутриклеточного патогена согласно изобретению вносят в область иммунологии инфекционных заболеваний.
Примеры
Пример 1
Иммунизация морских свинок БЦЖ плюс рекомбинантным 30 кДа главным внеклеточным белком M. tuberculosis (r30) не вызывает высокой степени защиты от контрольного заражения M. tuberculosis.
Ранее заявители иммунизировали морских свинок БЦЖ плюс r30 в эффективном адъюванте (SAF, Syntex Adjuvant Formulation). Белок r30 (100 мкг на иммунизацию) вводили внутрикожно три раза. Это вызывало сильный ответ кожной гиперчувствительности замедленного типа (C-DTH) на r30 (фиг.5). Действительно, ответ C-DTH был сопоставим с таковым, индуцированным рекомбинантной БЦЖ, экспрессирующей r30. Тем не менее, одновременная иммунизация БЦЖ и r30 не вызывала высокой степени защиты от контрольного заражения M. tuberculosis (таблица 5). У животных, иммунизированных одновременно БЦЖ и r30, уровень CFU в легких и селезенке был не ниже, чем у животных, иммунизированных одной только БЦЖ. Данный результат является прямо противоположным результату, описанному выше, когда животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей r30, проявляли высокую степень защиты при контрольном заражении M. tuberculosis.
Пример 2
Иммунизация морских свинок живой рекомбинантной M. smegmatis, экспрессирующей 30 кДа главный внеклеточный белок M. tuberculosis (r30) в форме, неотличимой от природной формы, не вызывает высокой степени защиты от контрольного заражения M. tuberculosis.
В тех же самых экспериментах, в которых авторы изобретения иммунизировали животных БЦЖ, они иммунизировали морских свинок живой рекомбинантной M. smegmatis, экспрессирующей 30 кДа главный внеклеточный белок M. tuberculosis (r30) в форме, неотличимой от природной формы. Экспрессия и секреция 30 кДа главного внеклеточного белка M. tuberculosis (r30) M. smegmatis была такой же или более высокой по сравнений с рекомбинантным штаммом БЦЖ, экспрессирующим и секретирующим 30 кДа главный внеклеточный белок M. tuberculosis. Более того, доза рекомбинантной M. smegmatis, 109 бактерий, была очень высокой, в миллион раз превышающей дозу рекомбинантной БЦЖ (103 бактерий), более чем достаточной для компенсации плохого размножения M. smegmatis у животного-хозяина. Для дополнительной компенсации рекомбинантную M. smegmatis вводили трижды внутрикожно, тогда как рекомбинантную БЦЖ вводили лишь однократно внутрикожно. Иммунизация рекомбинантной M. smegmatis, экспрессирующей белок r30, вызывала сильный ответ кожной гиперчувствительности замедленного типа (C-DTH) на r30. Действительно, ответ C-DTH был сопоставимым или более сильным по сравнению с индуцированным рекомбинантной БЦЖ, экспрессирующей r30. Тем не менее, живая рекомбинантная M. smegmatis, экспрессирующая 30 кДа главный внеклеточный белок M. tuberculosis, не вызывала высокой степени защиты от контрольного заражения M. tuberculosis (таблица 6). Животные, иммунизированные живой рекомбинантной M. smegmatis, экспрессирующей 30 кДа главный внеклеточный белок M. tuberculosis, не имели более низкого уровня CFU в легких и селезенке по сравнению с животными, иммунизированными одной только БЦЖ. Данный результат является прямо противоположным результату, описанному выше, когда животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей r30, проявляли высокую степень защиты при контрольном заражении M. tuberculosis.
Пример 3
Иммунизация морских свинок микросферами, имеющими приблизительно тот же самый размер, что и БЦЖ, и, подобно БЦЖ, медленно высвобождающими 30 кДа главный внеклеточный белок M. tuberculosis (r30) на протяжении 60-90 дней, не вызывает высокой степени защиты от контрольного заражения M. tuberculosis.
В тех же самых экспериментах, в которых заявители иммунизировали животных рБЦЖ30 и БЦЖ, заявители иммунизировали морских свинок микросферами, имеющими приблизительно тот же самый размер, что и БЦЖ, и, подобно БЦЖ, медленно высвобождающими 30 кДа главный внеклеточный белок M. tuberculosis (r30) на протяжении 60-90 дней. Одну группу животных иммунизировали однократно микросферами, содержащими 10 мг r30. Другую группу животных иммунизировали троекратно микросферами, содержащими 3,3 мг r30. По расчетам, данное количество значительно превышало количество белка r30, экспрессируемого рекомбинантным штаммом БЦЖ. Иммунизация микросферами при любом режиме вызывала сильный ответ кожной гиперчувствительности замедленного типа (C-DTH) на r30. Действительно, ответ C-DTH был сопоставим с таковым, индуцированным рекомбинантной БЦЖ, экспрессирующей r30. Тем не менее, иммунизация микросферами, имеющими приблизительно тот же размер, что и БЦЖ, и, подобно БЦЖ, медленно высвобождающими 30 кДа главный внеклеточный белок M. tuberculosis, не вызывала высокой степени защиты от контрольного заражения M. tuberculosis (таблица 7). У животных, иммунизированных микросферами, уровень CFU в легких и селезенке был не ниже, чем у животных, иммунизированных одной только БЦЖ. Данный результат является прямо противоположным результату, описанному выше, когда животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей r30, проявляли высокую степень защиты при контрольном заражении M. tuberculosis.
Пример 4
Иммунизация морских свинок липосомами, содержащими 30 кДа главный внеклеточный белок M. tuberculosis, не вызывает высокой степени защиты от контрольного заражения M. tuberculosis.
В том же самом эксперименте, что и в примере 3, авторы изобретения иммунизировали морских свинок липосомами, содержащими 30 кДа главный внеклеточный белок M. tuberculosis. Животных иммунизировали троекратно липосомами, содержащими 50 мкг r30. Это вызывало умеренно сильный ответ кожной гиперчувствительности замедленного типа (C-DTH) на r30. Ответ C-DTH был выше такового, индуцированного БЦЖ и контрольными липосомами, но ниже индуцированного рекомбинантной БЦЖ, экспрессирующей r30. Тем не менее, иммунизация липосомами, содержащими 30 кДа главный внеклеточный белок M. tuberculosis, не вызывала высокой степени защиты от контрольного заражения M. tuberculosis (таблица 7). Животные, иммунизированные липосомами, содержащими 30 кДа главный внеклеточный белок M. tuberculosis, не имели более низкого уровня CFU в легких и селезенке по сравнению с животными, иммунизированными одной только БЦЖ. Данный результат является прямо противоположным результату, описанному выше, когда животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей r30, проявляли высокую степень защиты при контрольном заражении M. tuberculosis.
Вакцины согласно изобретению представляют собой совершенно новый подход к терапии и профилактике внутриклеточных патогенов. С помощью хорошо спланированных экспериментов и тщательного анализа авторы настоящего изобретения четко продемонстрировали, что защитный иммунитет достигается лишь тогда, когда точно выбранный внутриклеточный патоген или близкородственные ему виды трансформированы для экспрессии рекомбинантных внеклеточных белков того же самого или других внутриклеточных патогенов, в соответствии с указаниями настоящего изобретения.
Настоящее изобретение может быть также применено для получения профилактических и терапевтических эффектов в борьбе одновременно против множества внутриклеточных патогенов. Например, может быть сконструирован рекомбинантный умеренный внутриклеточный вакцинирующий агент типа M. bovis для экспрессии иммунозащитных иммуногенов одновременно против M. tuberculosis и Legionella sp. Соответственно, могла бы быть достигнута высокая эффективность целевых вакцин. Неограничивающие примеры рекомбинантной БЦЖ, экспрессирующей главные внеклеточные белки M. tuberculosis, не только являются полностью готовым осуществлением настоящего изобретения, но и представляют собой значительное достижение в медицине для человека в целом.
Таким образом, очевидно, что, хотя было показано и описано предпочтительное осуществление изобретения, могут быть внесены различные модификации и изменения в рамках истинной сути и объема данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) НА ОСНОВЕ РЕКОМБИНАНТНОГО ВНУТРИКЛЕТОЧНОГО ПАТОГЕНА | 2003 |
|
RU2337707C2 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-TB10.4-2A-HspX и способ специфической профилактики туберкулеза легких с использованием вакцины мукозального применения на его основе | 2019 |
|
RU2726106C1 |
| Рекомбинантный штамм Mycobacterium bovis rBCG-1 на основе вакцинного штамма Mycobacterium bovis BCG strain Russia 368 | 2022 |
|
RU2807732C1 |
| СИНТЕТИЧЕСКИЙ INVAPLEX | 2007 |
|
RU2440136C2 |
| ПОЛИАНТИГЕННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ И ВСПОМОГАТЕЛЬНОГО ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2019 |
|
RU2724896C1 |
| РЕКОМБИНАНТНЫЕ ШТАММЫ ВИРУСА ГРИППА, ЭКСПРЕССИРУЮЩИЕ МИКОБАКТЕРИАЛЬНЫЙ ПРОТЕКТИВНЫЙ АНТИГЕН ESAT-6, И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2005 |
|
RU2318872C2 |
| ВАКЦИНА РЕКОМБИНАНТНАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ И АДЪЮВАНТ ДЛЯ НЕЕ | 2017 |
|
RU2665817C1 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА | 2007 |
|
RU2443773C2 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2004 |
|
RU2342400C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА И ДРУГИХ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И ВАКЦИНА, ПОЛУЧЕННАЯ ПО НАЗВАННОМУ СПОСОБУ | 2001 |
|
RU2262950C2 |

Изобретение относится к медицине и касается вакцины рекомбинантных внутриклеточных патогенов, а именно: вакцины, содержащей рекомбинантную бациллу Кальметта-Герена (БЦЖ), и способа профилактики заболеваний, вызванных внутриклеточным патогеном Mycobacterium tuberculosis. Сущность изобретения заключается в разработке вакцины, содержащей рекомбинантную БЦЖ, имеющую внехромосомную ДНК, содержащую ген, который кодирует главный внеклеточный белок Mycobacterium tuberculosis в 30 кДа, а также в разработке способа профилактики заболеваний, вызванных внутриклеточным патогеном Mycobacterium tuberculosis у млекопитающих посредством введения рекомбинантной БЦЖ, экспрессирующей рекомбинантные иммуногенные антигены. Преимущество изобретения заключается в повышении эффективности БЦЖ. 3 н. и 3 з.п. ф-лы, 7 табл., 5 ил.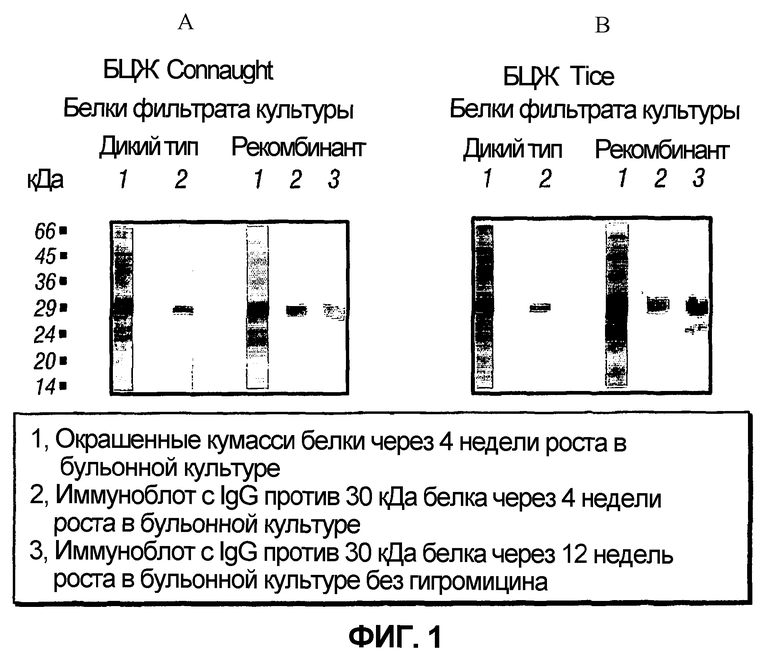
| HARTH GUNTER et al., High-lebel heterologous expression and secretion in rapidly growing nonpathogenic mycobacteria of our major Mycobacterium tuberculosis extracellular proteins considered to be leading vaccine candidates and drug targets, Infection and Immunity, 1997, v.65, pp.2321-2328 | |||
| ИММУНОМОДУЛИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2112543C1 |
| Шланговое соединение | 0 |
|
SU88A1 |
Авторы
Даты
2005-12-20—Публикация
2001-04-16—Подача