Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, клинической биохимии, медицины, ветеринарии, фармакологии, эндокринологии, онкологии и может быть использовано с целью диагностики рака предстательной железы. Изобретение предусматривает масс-спектрометрическое измерение концентраций низкомолекулярных субстанций, в частности ацилкарнитина и арахидоноил амина, в плазме крови и других биологических жидкостях пациентов с указанным заболеванием. Способ предусматривает депротеинизацию плазмы крови метанолом и прямой масс-спектрометрический анализ фракций ацилкарнитина и арахидоноил амина квадрупольно-времяпролетной масс-спектрометрией.
Изобретение может применяться также для дифференциальной диагностики заболеваний простаты неопухолевого происхождения, таких как аденома (доброкачественная гиперплазия) предстательной железы, простатит, интраэпителиальная гиперплазия простаты.
Уровень техники
Известны способы диагностики рака предстательной железы масс-спектрометрическими методами (Патенты США №№6,387,628, 6,322,970, 6,207,370). В данных патентах предусматривается детекция специфических полипетидов как маркеров указанного заболевания. Недостатком данного изобретения является тот факт, что полипептиды, как и любые продукты белкового происхождения, могут являться продуктами мутировавших генов в опухолях, благодаря чему специфика может быть утрачена и диагностическая ценность нивелирована. Все это говорит в пользу относительной несостоятельности белков или пептидов как опухолевых маркеров. Использование низкомолекулярных субстанций, в частности ацилкарнитина и арахидоноил амина, в качестве диагностических молекул при раке предстательной железы в указанных изобретениях не предусматривается.
Наиболее близким к заявленному изобретению является известный способ диагностики онкологических заболеваний по метаболитам в биологических жидкостях человека (Патент США №7,553,616 - прототип). В патенте предложен метод диагностики ряда заболеваний, в том числе и рака предстательной железы, основанный на сравнении профиля низкомолекулярных субстанций низкой из различных компартментов здоровых и подвергшихся биотрансформации клеток и тканей. В патенте обсуждается также метод идентификации тканевого источника клеток, метод для лечения генетических заболеваний, а также методика предсказания эффективности лекарственной терапии. Источником для оценки профилирования служит любая ткань или биологическая жидкость пациента. Аналогичные подходы к диагностике обсуждаются в Патенте США №7,550,260, Патенте США №7,550,258, Патенте США №7,635,556, Патенте США №7,329,489, Патенте США №7,553,616, Патенте США №7,005,255. Общим недостатком указанных изобретений является тот факт, что для поиска отличий метаболитов при норме и изучаемом заболевании необходимо иметь библиотеку сравниваемых низкомолекулярных веществ, что накладывает существенные ограничения на проведение диагностического исследования, поскольку исследователь не всегда имеет в распоряжении подобный тип специфических библиотек. Использование ацилкарнитина и арахидоноил амина для диагностики рака предстательной железы в указанных изобретениях отсутствует.
Таким образом, несмотря на тот факт, что отдельные способы диагностики рака предстательной железы на основе метаболитов известны из уровня техники, использование низкомолекулярных субстанций ацилкарнитина и арахидоноил амина в крови с целью дифференциальной диагностики рака предстательной железы предложено авторами впервые.
Раскрытие изобретения
Задачей изобретения является создание более универсального и эффективного способа диагностики рака предстательной железы. Изобретательская задача решается тем, что предлагается применение прямого масс-спектрометрического анализа для оценки уровня ацилкарнитина и арахидоноил амина. Прямой масс-спектрометрический анализ подразумевает непосредственное внесение анализируемого биоматериала в источник ионизации масс-спектрометра, без какого-либо предварительного их разделения хроматографическими или иными методами. Таким образом, достигается максимально доступная для масс-спектрометрии воспроизводимость результатов, которая позволяет более достоверно выявлять изменения в концентрациях изучаемых веществ. Для выделения их целевой фракции из плазмы крови был использован протокол пробоподготовки, основанный на осаждении метанолом белков из плазмы крови. Полученная таким образом депротеинизированная плазма крови стала пригодна для проведенного прямого масс-спектрометрического анализа. Для идентификации веществ использовали их точно измеренные молекулярные массы и экспериментально установленные изотопные распределения. Подобная идентификация стала возможна при применении современных масс-спектрометров с высокой разрешающей способностью, в частности гибридного квадруполь-времяпролетного масс-спектрометра MicrOTOF-Q.
Таким образом, в качестве маркеров рака предстательной железы предлагается способ использования ацилкарнитина и арахидоноил амина в образцах крови пациентов. Детекция может быть проведена и в других биологических жидкостях человека, не ограничивающих объема изобретения, а именно моча, слюна, слезы, пот, семенная жидкость (сперма), спинномозговая жидкость, слизи, биологические жидкости ЖКТ.
Технический результат заключается в повышении прогностической ценности использования обоих маркеров при раке предстательной железы.
Краткое описание чертежей
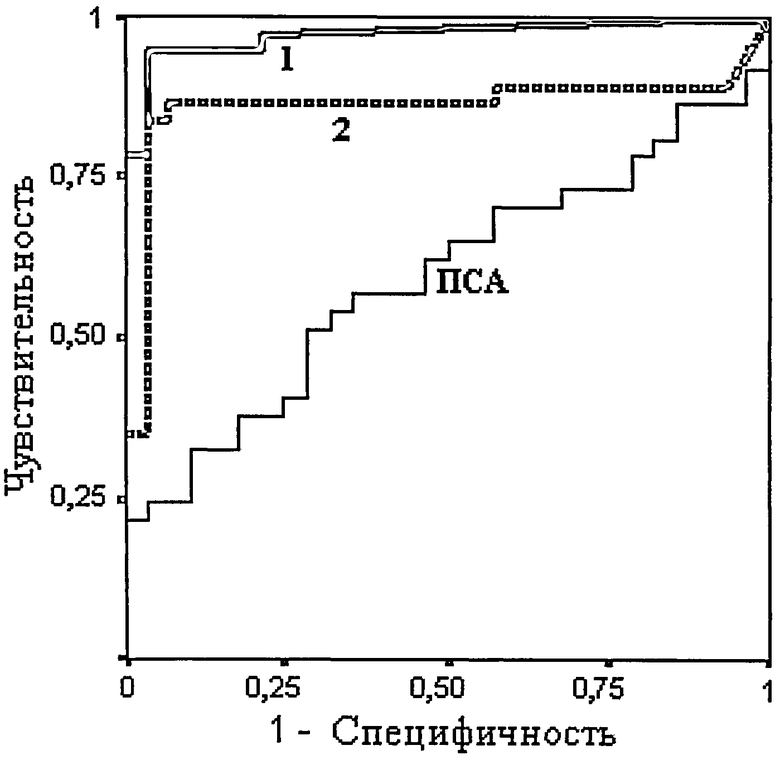
Фиг 1. ROC-кривые для моделей диагностических систем рака предстательной железы на основе измерения интенсивностей пиков метаболитов в масс-спектрометрическом профиле плазмы крови. Для построения кривых использовали пробы плазм крови 40 больных раком предстательной железы и 30-ти здоровых добровольцев. 1 - кривая для ацилкарнитина; 2 - кривая для арахидоноил амина.
Таблица 1. Параметры эффективности диагностики заболевания рака простаты на основе интенсивностей пиков низкомолекулярных субстанций в масс-спектрометрическом профиле.
Осуществление изобретения
Рак предстательной железы является второй по счету причиной смертности от онкологических заболеваний среди мужчин. Существующая лабораторная диагностика данного заболевания, основанная на измерении концентрации простат-специфического антигена (ПСА) в крови пациента, отличается низкой прогностической точностью (Lein et al., 2003). Таким образом, поиск дополнительных диагностических биомаркеров, которые были бы более специфичными для данного заболевания, является весьма актуальной проблемой.
В настоящее время накоплено множество доказательств, что многие опухолевые заболевания характеризуются специфическим профилем некоторых субстанций - низкомолекулярных веществ, продуктов метаболизма, что позволяет достоверно отличать норму от патологии. В частности, при раке имеют место нарушение функционирования множества биохимических путей, что незамедлительно сказывается в появлении метаболитов повышенного или пониженного, по сравнению с нормой, содержания. Так, например, с помощью метода ядерной резонансной спектроскопии (1H- и 31P-MRS) установлено, что при раке простаты часто наблюдается снижение цитратов и полиаминов, при раке молочной железы - увеличение холинов, при глиомах - увеличение лактата и т.д. (Serkova et al., 2009).
Интересными в диагностическом плане и наиболее прогностически значимыми субстанциями, которые можно детектировать в крови человека, представляются ацилкарнитин и арахидоноил амин.
Ацилкарнитин - это производное L-карнитина, одного из факторов, обеспечивающих в норме транспорт длинноцепочечных жирных кислот на внутреннюю мембрану митохондрии, где происходит их β-окисление с последующим образованием энергии АТФ (Monograph. L-carnitine. No authors listed, 2005). Известно, что для опухолевых клеток, в частности для рака простаты, окисление жирных кислот является доминантным источником энергии по сравнению с гликолизом (Liu, 2006). Недавние исследования показали, что опухоли сопровождаются существенными изменениями метаболизма жирных кислот за счет изменения активности ферментов, участвующих в конверсии L-карнитина, таких как ацетил-коэнзим А (Со-А) синтаза и карнитил-пальмитоил транфераза (Chapela et al., 2009). Это неизбежно приведет к изменению уровня производных карнитина, в частности ацилкарнитина. Следовательно, это вещество может выступать как маркер указанных нарушений в описанном метаболическом пути при раке простаты.
Арахидоноил амин (арахидоноил амид, арахидонамид, 5Z,8Z,11Z,14Z)-эйкозо-5,8,11,14-тетраенамид, 5Z,8Z,11Z,14Z-эйкозотетраеноил амин, арахидонамид, арахидоноиламид, эйкозо-5,8,11,14-тетраенамид), - производное 5,8,11,14-эйкозотетраеноевой кислоты, которая больше известна как арахидоновая (ω-6 полиненасыщенная жирная) кислота. Первичный путь ее конверсии - это формирование эпокси-производных (т.н. эпоксикозатриеновых кислот) под действием цитохром-P450 (CYP450)-эпоксигеназ. Эпоксикозатриеновые кислоты, в свою очередь, подвергаются дальнейшей конверсии в дигидроэйкозотетраеноевые кислоты и их метаболиты; последний шаг происходит под влиянием цитозольных эпоксидгидролаз (Natarajan & Reddy, 2003). В результате образуются специфические метаболиты; арахидоноил амин является одним из них.
CYP450-эпоксигеназы играют важную патофизиологическую роль при раке. Так, например, повышение экспрессии одной из изоформ CYP450-эпоксигеназ, а именно CYP450 2J, сопровождается усилением опухолевого роста, пролиферацией опухолевых клеток, а также ингибированием их апоптоза (Jiang et al., 2005; Jiang et al., 2009). Следовательно, нарушения в метаболическом пути, характерном для опухолей, можно детектировать по уровню изменяющихся производных в биологических жидкостях. Одним из таких путей, в частности, является специфика метаболической конверсии арахидоновой кислоты при раке простаты (Patel et al., 2008). В этой связи измерение арахидоноил амина имеет определенную диагностическую ценность, поскольку колебания его уровня отражают изменение активности ферментных систем, вовлеченных в развитие неопластических процессов.
Таким образом, колебания уровня указанных низкомолекулярных субстанций - ацилкарнитина и арахидоноил амина, могут выполнять роль прогностических факторов при раке предстательной железы, поскольку оба являются конечными продуктами сложных метаболических взаимосвязей, существенно нарушенных при данной патологии.
Примеры осуществления изобретения
Изобретение иллюстрируется следующими примерами, не ограничивающими объема изобретения.
Пример 1. Подготовка проб плазмы крови для масс-спектрометрического анализа ацилкарнитина и арахидоноил амина.
Для осаждения белков 100 мкл плазмы крови смешивали со 100 мкл воды (LiChrosolv, Merck, США) и 800 мкл метанола (Fluka, Германия) и инкубировали 10 мин при 4°C. Центрифугированием при 13 тыс.об/мин (центрифуга MiniSpin plus, Eppendorf, Германия) в течение 10 мин осаждали белок и супернатант переносили в чистые пластиковые пробирки (эппендорфы). При 45°C в течение 3 ч упаривали растворитель на вакуумном испарителе (SpeedVac, Eppendorf). Полученный сухой осадок растворяли в 100 мл 95% раствора ацетонитрила (Acros Organics, США), с добавлением 0,1% муравьиной кислоты (Fluka, Германия). Для лучшего растворения осадка пробы обрабатывали ультразвуком в ультразвуковой мойке (Bandelin RM 40UH, Sonorex Technik, Германия) два раза по 30 с. Далее пробы центрифугировали 10 мин при 13 тыс.об/мин. и полученный супернатант использовали для масс-спектрометрического анализа.
Масс-спектрометрический анализ проводили гибридным квадрупольно-времяпролетным масс-спектрометром MicrOTOF-Q (Bruker Daltonics, Германия), имеющим электроспрейный источник ионизации. Масс-спектрометр был настроен на приоритетную детекцию ионов в диапазоне от 250 до 1500 Да/заряд. Спектры снимали в режиме детекции как положительно, так и отрицательно заряженных ионов. Время снятия одного спектра 1 мин, поток пробы, подаваемой в электроспрейный источник ионизации, 500 мкл/мин. Для инъекции пробы в электроспрейный источник ионизации использовали стеклянный шприц (Hamilton Bonaduz, Швейцария), установленный в шприцевой инъекционный насос (KD Scientific, США). Масс-спектры получали в программе DataAnalysis (версия 3.4, Bruker Daltonics GmbH, Германия) суммированием записанных минутных сигналов.
Пример 2. Анализ масс-спектрометрических данных
Применяя программу DataAnalysis, по пикам масс-спектрограмм устанавливали массы ионов метаболитов с точностью до тысячных дальтона. Для этого проводили детекцию пиков в спектре, используя порог отсечения по соотношению сигнал/шум, равный 10.
Для 25-ти наиболее интенсивных пиков положительно заряженных и такого же количества отрицательно заряженных метаболитов устанавливали t-тестом достоверность отличий интенсивностей между выборкой больных и здоровых пациентов. Масс-спектрометрические пики в разных масс-спектрах считали относящимися к одному и тому же метаболиту при отличии их масс не более чем на 0,01 Да.
Для пиков метаболитов, чьи интенсивности статистически достоверно (p<0,05) меняются при возникновении болезни, рассчитывали средние значения и стандартные отклонения по группам, соответствующим больным и здоровым пациентам.
Для определения параметров лабораторной диагностики, таких как специфичность и чувствительность, а также построения ROC (Receiver Operating Characteristic)-кривой и вычисления площади под ROC-кривой использовали статистический пакет для социальных наук (“Statistical Package for the Social Sciences (SPSS)”, SPSS Inc., США), версии 10,0.
Полученные специфичность и чувствительность диагностики на основе интенсивностей метаболитов сравнивали с чувствительностью и специфичностью диагностики, основанной на концентрации ПСА в крови пациентов. Учитывая возраст больных раком предстательной железы, за нормативные значения концентрации ПСА принимали значения от 0 до 5,36 нг/мл (от 0 до 0,16×10-9 М).
Пример 3. Оценка чувствительности и специфичности маркеров.
Чтобы определить возможную эффективность подобной диагностики данные по интенсивностям масс-спектрометрических пиков использовали для построения ROC-кривых (Фигура 1), площадь под которыми дает представление об эффективности и клинической применимости диагностических методов. Клинически применимыми считаются диагностические методы, имеющие значения площади под ROC-кривой не менее 0,6, хорошими считаются системы со значениями более 0,8 (Metz, 1978).
Предложенную нами модель диагностической системы на основе метаболитов с массами 302,2442 Да и 304,2602 Да можно отнести к “хорошим”, так как они имеют значения более 0,8. Низкомолекулярные субстанции с массами 377,2680, 367,1486 и 369,1632 Да не пригодны для диагностики рака простаты, т.к. значения площади под ROC-кривой для них меньше 0,6 (см. таблицу). Для метаболита массой 307,0452 Да ROC-кривая не строилась, так как для этой массы не были зафиксированы значения в группе здоровых добровольцев.
Следует отметить, что ПСА-тест для той же выборки пациентов имеет площадь под ROC-кривой 0,59, что согласуется с данными из других источников (0,51 и 0,54 для тестовых наборов фирмы Roche и Bayer соответственно (Lein et al., 2003) и указывает на то, что применение ПСА-теста для диагностики рака предстательной железы 2-й степени является сомнительным.

| название | год | авторы | номер документа |
|---|---|---|---|
| МАРКЕР РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2007 |
|
RU2360924C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА ЗЛОКАЧЕСТВЕННОЙ ТРАНСФОРМАЦИИ КЛЕТОК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2022 |
|
RU2806518C1 |
| НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ МАРКЕРА ЭПИТЕЛИАЛЬНЫХ КАРЦИНОМ | 2018 |
|
RU2735918C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2016 |
|
RU2647433C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИЕЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2016 |
|
RU2646790C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2469333C1 |
| Способ диагностики сердечной недостаточности с сохраненной фракцией выброса | 2023 |
|
RU2814392C1 |
| СПОСОБ ДООПЕРАЦИОННОГО ПРОГНОЗИРОВАНИЯ СТАДИИ И АГРЕССИВНОСТИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2015 |
|
RU2611380C2 |
| СПОСОБ ОБНАРУЖЕНИЯ СОЛИДНОЙ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2015 |
|
RU2720148C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СТАДИИ И АГРЕССИВНОСТИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ДО ОПЕРАЦИИ ПО ЛАБОРАТОРНЫМ И КЛИНИЧЕСКИМ ПАРАМЕТРАМ | 2015 |
|
RU2614501C1 |
Изобретение относится к области молекулярной биологии, клинической биохимии, медицины, ветеринарии, фармакологии, эндокринологии и онкологии. Для диагностики рака предстательной железы забирают кровь у пациента. Осуществляют пробоподготовку крови с целью ее депротеинизации. Проводят осаждение метанолом белков из исследуемой жидкости, после чего проводят прямой масс-спектрометрический анализ квадрупольно-времяпролетной масс-спектрометрией фракций изучаемых веществ - маркеров. В качестве измеряемых маркеров используются ацилкарнитин и арахидоноил амин. Способ позволяет диагностировать рак предстательной железы. 1 ил., 3 пр., 1 табл.
Способ диагностики рака предстательной железы, характеризующийся тем, что забирают кровь у пациента, затем осуществляют пробоподготовку с целью ее депротеинизации, заключающуюся в том, что проводят осаждение метанолом белков из исследуемой жидкости, после чего проводят прямой масс-спектрометрический анализ квадрупольно-времяпролетной масс-спектрометрией фракций изучаемых веществ - маркеров, отличающийся тем, что в качестве измеряемых маркеров используются ацилкарнитин и арахидоноил амин.
| US 7553616 B2, 30.06.2009 | |||
| US 6207370 B1, 27.03.2001 | |||
| US 6387628 B1, 14.05.2002 | |||
| Фрезная головка | 1928 |
|
SU11694A1 |
| EP 0001895302 A2, 05.03.2008 | |||
| МАРКЕР РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2007 |
|
RU2360924C1 |
| CHEN C | |||
| et al | |||
| Serum metabolomics reveals irreversible inhibition of fatty acid beta-oxidation through the suppression of PPARalpha activation as a contributing mechanism of | |||
Авторы
Даты
2012-03-20—Публикация
2010-03-22—Подача