Для онкологических заболеваний характерно отсутствие каких-либо клинических проявлений на самых ранних стадиях развития болезни, что приводит к позднему выявлению онкопатологий, когда клинический прогноз неблагоприятен и вызывает высокую смертность пациентов [1]. Одним из способов раннего выявления онкологических заболеваний является выявление специфических биомолекул, так называемых "онкомаркеров", в сыворотке, тканях или жидкостях пациента, образующихся в процессе новообразования. Большинство известных к настоящему времени онкомаркеров тканеспецифичны, хотя и не обладают при этом высокой чувствительностью при выявлении самых ранних стадий рака [2-5].
В отличие от РЭА (СЕА), ПСА, СА-125 и других, новый маркер эпителиальных карцином (МЭК), N-гликопротеин СА-62 является высокочувствительным опухоль-ассоциированным белком для выявления именно самых ранних стадий эпителиальных карцином (ЭК), в частности аденокарциномы предстательной железы, молочной железы и яичников. Уникальное отличие нового маркера СА-62 от других известных маркеров заключается в том, что максимальный пик его экспрессии (пролиферации) приходится именно на самое начало развития опухолевого процесса, а не на поздние стадии болезни, когда происходит метастазирование опухоли. Именно поэтому измерение уровня экспрессии СА-62 позволяет выявлять ранние стадии заболевания, когда процент излечения максимальный. К настоящему времени с помощью биомаркера СА-62 были детально изучены панели образцов сыворотки пациентов с ранними стадиями рака предстательной железы (РПЖ), рака молочной железы (РМЖ) и рака яичников (РЯ). Эти виды рака продемонстрировали высокий уровень экспрессии онкомаркера СА-62, что позволяет использовать его в комбинации с другими тканеспецифичными онкомаркерами типа ПСА, СА-125, РЭА или СА 15-3, для повышения чувствительности последних при выявлении самых ранних стадий РПЖ, РМЖ и РЯ. Кроме этого, онкомаркер СА-62 может быть точным инструментом для верификации онкологического заболевания или для проведения дифференциальной диагностики между доброкачественными и злокачественными новообразованиями. Динамика уровня маркера СА-62 также показывает высокую эффективность при выявлении рецидивов опухоли и мониторинге лечения пациентов с поздними стадиями рака. Проведенные исследования готовятся к публикации.
Скрининговые программы для выявления ранних стадий рака на основе изучения уровня онкомаркеров, таких как ПСА, СЕА, СА-125, С А 15-3 в качестве сигнала к более углубленной диагностике данных пациентов достаточно широко распространены в Западной Европе и Канаде. Тем не менее ни один из официально признанных онкомаркеров не обладает идеальной комбинацией 100% специфичности и 100% чувствительности, дают много ложноотрицательных значений именно на ранних стадиях рака [5-7]. В то же время доброкачественные опухоли у пациентов дают много ложноположительных значений, что приводит к гипердиагностике рака, в частности, предстательной железы [8-10]. Это приводит к увеличению количества проводимых биопсий у пациентов с доброкачественными заболеваниями предстательной железы, которая является инвазивным методом диагностики и примерно в 30% случаев приводит к серьезным осложнениям.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Новый диагностический тест для выявления маркера эпителиальных карцином позволяет определять в сыворотке пациентов новый биомаркер, опухоль-ассоциированный N-гликопротеин СА-62, появляющийся на поверхности малигнизированных клеток эпителиальных опухолей, и очень специфично выявлять начало онкогенеза в организме. Эпителиальные опухолевые клетки выделяют в кровь растворимую фракцию N-гликопротеина, в результате чего количественное измерение маркера СА-62 может быть использовано в качестве диагностического метода для раннего выявления эпителиальных карцином, скрининга пациентов группы риска и для мониторинга лечения эпителиального рака. Измерение уровня маркера СА-62 может проводиться наряду с физикальными наблюдениями и инструментальными методами диагностики (УЗИ, Рентгенография, МРТ).
N-Гликопротеин с молекулярной массой около 62 кДа, имеющий N-гликозидную связь Asn-GlcNAc и несколько внешних высокоразветвленных антенн фукозилированных полисахаридов, в больших количествах образуется на поверхности малигнизированных эпителиальных клеток в самом начале канцерогенеза, что делает его специфичным маркером эпителиальных карцином. Эпителиальные опухоли предстательной железы, молочной железы или яичника развиваются из поверхностного или железистого эпителия, отличаются появлением атипичных эпителиальных клеток, их высокой пролиферацией, которая может прогрессировать и перерождаться в плоскоклеточную карциному. Процесс начинается в переходном метаплазированном эпителии, который представляет собой плоский эпителий разной степени зрелости, не полностью дифференцированный. Метаплазированный эпителий - это почва для зоны трансформации, которая считается наиболее уязвимым участком для внешнего влияния, и именно в этой зоне, при наличии незрелого эпителия, возможно развитие неоплазии.
Разработанные нами специфические моноклональные антитела (МаТ-анти-СА-62) узнают опухолеспецифичный олигосахаридный фрагмент на поверхности малигнизированных клеток эпителиальных опухолей, что позволяет идентифицировать все молекулярные формы гликопротеина СА-62. На основе разработанных нами уникальных моноклональных антител против N-гликопротеина СА-62 был разработан диагностический набор реагентов для измерения сывороточного уровня опухолевого маркера СА-62, который помогает выявить с высокой вероятностью наличие у пациентов самых ранних стадий злокачественных эпителиальных карцином, в частности аденокарциномы предстательной железы, аденокарциномы молочной железы или карциномы яичников.
Другой важной проблемой является мониторинг лечения онкологических больных, необходимый для оценки эффективности проводимого лечения и принятия своевременных решений по смене курса химиотерапии. В настоящее время для мониторинга заболевания, в основном, используются дорогостоящие инструментальные методы анализа, поскольку в наличии нет высокочувствительных биомаркеров, способных корректно отражать ответ опухоли на проводимое лечение. Проведенное нами пилотное клиническое исследование на базе МИНЦ имени Н.Н. Блохина показало, что онкомаркер СА-62 может эффективно применяться для мониторинга химиотерапии у пациентов с III-IV стадией мелкоклеточного рака легкого (МРЛ), рака желудка (РЖ) и колоректального рака (КРР). Динамика изменений маркера СА-62 в ходе химиотерапии у пациентов с РЖ, МРЛ и КРР показала хорошую корреляцию (79%) маркера СА-62 с общим состоянием пациентов в соответствии с критериями RECIST.
Рецидивы и метастазы злокачественной опухоли является тяжелым осложнением, более опасным для жизни больного, чем первичная опухоль. Раннее выявление этих осложнений и специализированное лечение являются основным путем борьбы за продолжительность жизни онкологических больных. Проведенное нами исследование на пациентах с поздними стадиями рака показало, что динамика маркера СА-62 может быть особо точным инструментом для выявления рецидивов опухоли.
В настоящее время для диагностики рака молочной железы чаще всего используются сывороточные маркеры семейства муциновых гликопротеинов, из которых СА 15-3 является наиболее чувствительным и специфичным. Положительная реакция на маркер СА 15-3 отмечается примерно у 10% больных с I стадией, у 25% со стадией II и в 45% на III стадии [11]. Поэтому, помимо СА 15-3, другим наиболее часто используемым маркером для диагностики злокачественных новообразований молочной железы является раково-эмбриональный антиген РЭА (СЕА) [12]. Таким образом, из-за малой чувствительности известных в настоящее время биомаркеров достоверно обнаружить ранние стадии рака молочной железы можно только при маммографии. Результаты онкомаркеров СА 15-3 и РЭА наиболее информативны для распознавания рецидивов и метастазов. Одновременное определение этих маркеров дает возможность обнаружения ранних метастазов в кости и печень минимум в 60% случаев.
Для диагностики рака предстательной железы используется простат-специфичный антиген (ПСА, PSA), который производится в больших количествах эпителиальными клетками [7-9]. Уровень ПСА у здоровых мужчин составляет от 0 до 4 нг/ мл, а при возникновении заболеваний простаты его уровень повышается. В связи с этим данный маркер широко используется для диагностирования и мониторинга лечения рака предстательной железы. Достоинства метода ПСА: 1. Высокая специфичность теста до 93.6% при дифференцировании здоровых от больных практически не дает ложноположительных результатов для здоровых мужчин. 2. В ряде случаев (от 20 до 30%) позволяет выявлять рак предстательной железы на ранних стадиях, когда шансы излечения максимальные. Недостатки метода: 1. Большой процент ложноположительных результатов, не позволяющий отличить злокачественные заболевания простаты от других заболеваний предстательной железы, таких как гиперплазия предстательной железы, что приводит к проведению ненужных биопсий предстательной железы. 2. Низкая чувствительность теста (около 30%) при выявлении ранних стадий онкологических патологий простаты. 3. Примерно в 1 из 4-х случаев ПСА тест не может выявить рак предстательной железы, когда используется без комплекса с другими анализами, при этом 30% мужчин, больных раком, остаются невыявленными [9].
Для диагностики рака яичников в настоящее время используется биомаркер СА-125. Несмотря на то, что СА-125 является наиболее применяемым биомаркером для рака яичников, он обладает низкой чувствительностью при определении ранних стадий и низкой специфичностью при дифференцировании злокачественных от доброкачественных заболеваний [13-14]. СА-125 - представляет собой гликопротеиновый антиген 125, муцин-16, используемый в качестве онкомаркера рака яичников и его метастазов. Референтные значения в лабораторной диагностике: меньше 35 Ед/мл для здоровых женщин. Достоинства метода: 1. Достаточно высокая чувствительность теста (до 80%) при выявлении поздних стадий рака яичников. В большинстве случаев рака яичников уровень СА-125 повышается более 5 раз. 2. Тест обладает хорошей прогностической способностью при мониторинге лечения рака яичников, диагностики его метастазирования и оценки эффективности проводимой терапии. Недостатки метода: 1) низкая специфичность маркера СА-125 (от 60% и ниже) при дифференцировании злокачественных от доброкачественных заболеваний женской репродуктивной системы; 2) тест СА-125 не может применяться для ранней диагностики рака яичников в связи с его невысокой чувствительностью (менее 60%), поскольку у большинства пациентов с ранними стадиями РЯ уровень ракового антигена СА-125 находится в пределах нормы до 35 Ед/мл.
На основе полученных нами высокоспецифичных анти-СА-62 моноклональных антител нами был разработан диагностический набор реагентов для выявления в сыворотке пациентов маркера эпителиальных карцином СА-62. Набор реагентов обладает уникальной онко-специфичностью к эпителиальным опухолям, что помогает с высокой вероятностью выявлять наличие у пациентов ранних стадий карциномы различных локализаций, своевременно обнаруживать рецидивы опухоли и осуществлять эффективный мониторинг лечения онкологических больных. Область применения набора - клиническая лабораторная диагностика, клиническая медицина (онкология).
Набор реагентов включает в себя:
1. Планшет с иммобилизованными специфическими мышиными моноклональными антителами к раковому антигену СА-62. Планшет с иммобилизованными антителами готов к использованию и не требует дополнительной подготовки, должен находиться в замороженном виде и храниться при температуре минус 20°С в течение всего срока годности набора реагентов. Моноклональные антитела мыши класса IgM, направленные против гликопротеинового антигена СА-62 (62 кДа), были выделены из разработанной нами гибридомной линии. Моноклональные антитела мыши против маркера эпителиальных карцином СА-62 были очищены методом аффинной хроматографии в соответствии с разработанным лабораторным регламентом. Специфичность иммунного связывания выделенных моноклональных антител с раковым антигеном СА-62 была подтверждена при помощи ПААГ электрофореза, Вестерн-блоттинга с меченым антигеном, а также при помощи иммунохемилюминесцентных тестов: прямого связывания антитела с антигеном, а также компетентного анализа с нативным антигеном СА-62.
2. Конъюгат «CA-62-Акридин», концентрированный раствор Конъюгата СА-62 с люминесцентной меткой, расфасованный в 1,5 мл флаконы, по 100 мкл с минимальной концентрацией 300 мкг/мл в 100×10-3 моль/л ФСБ буфере рН 7,2. Конъюгат «СА-62-Акридин» содержит 0,02% Мертиолята, стабилизатор белка. Конъюгат должен находиться в замороженном виде и храниться при минус 20°С в течение всего срока годности набора реагентов.
3. Стандартные калибраторы СА-62 в диапазоне от 10 до 30000 Ед/мл; 500 мкл; 1 мл флакон. Представляют собой стандартную панель калибраторов биомаркера, которые являются Калибровочными пробами с различной концентрацией ракового антигена СА-62, в указанном диапазоне концентраций, расфасованными в 1 мл флаконы по 500±20 мкл каждый. Стандартные калибраторы содержат указанное количество ракового антигена СА-62 в рабочем буферном раствор рН от 2,0 до 8,0, содержащий Твин-80, 0,02% Мертиолята, и не требуют дальнейшего разбавления. Стандартные калибраторы должны находиться в замороженном виде и храниться при температуре минус 20°С в течение всего срока годности набора реагентов.
4. Положительный контроль СА-62, 250 мкл; 1 мл флакон. Положительный контроль СА-62 имеет заданную концентрацию ракового антигена в диапазоне измерений от 10 до 30000 Ед/мл, который предназначен для возможности контроля работы набора реагентов при его хранении и не является обязательным к использованию при проведении теста. Положительный контроль СА-62 расфасован в 1 мл флаконы по 250±10 мкл. Образец содержит указанное на этикетке количество ракового антигена СА-62 в Ед/мл в рабочем буферном растворе, рН от 2,0 до 8,0, содержащий Твин-80, 0,02% Мертиолята и не требует дальнейшего разбавления. Положительный контроль СА-62 должен находиться в замороженном виде и храниться при температуре минус 20°С в течение всего срока годности набора.
5. Рабочий буферный раствор, рН от 2,0 до 8,0, содержащий Твин-80, расфасованный в 25 мл флакон, в замороженном виде, не требует дальнейшего разбавления. Рабочий буферный раствор содержит 6 ррм (6.5×10-3 моль/л) противомикробного препарата «Bioneutral С5». В размороженном виде буферный раствор должен быть прозрачным и иметь желтый оттенок и небольшое вспенивание, вызванное присутствием Твин-80. Буферный раствор должен храниться в замороженном виде при температуре минус 20°С в течение всего срока годности набора реагентов.
Набор реагентов по данному изобретению обладает повышенной чувствительностью (от 80 до 95%) и специфичностью (от 80 до 95%) в зависимости он нозологии рака. Изобретение может быть использовано в медицинских диагностических лабораториях.
Принцип метода
Набор реагентов «маркер эпителиальных карцином, СА-62» разработан на основе сывороточного теста, который представляет собой одностадийный конкурентный вариант твердофазного иммунохимического анализа (ИХА) с использованием высокоспецифичных моноклональных антител к гликопротеину СА-62. Иммунотест заключается в прямой конкуренции между меченым антигеном СА-62 и содержащимся в образце нативным раковым антигеном за связывание со специфическими моноклональными антителами против СА-62, иммобилизованными в лунках планшета.
Во время 2-х часовой инкубации к иммобилизованным в лунках планшета антителам добавляется раствор, содержащий разбавленный образец сыворотки и постоянную концентрацию меченого люминесцентной меткой антигена СА-62, после чего сорбент отмывается от не связавшихся компонентов и затем регистрируется люминесцентный сигнал образовавшихся на твердой фазе иммунных комплексов {Антитело-(СА-62-Акридин)}.
Величина регистрируемого люминесцентного сигнала находится в обратной зависимости от концентрации антигена в образце. Серия калибровочных стандартов (стандартные калибраторы) тестируется одновременно с образцами, на основе чего строится калибровочная кривая (Logit-Log кривая) для количественного определения маркера эпителиальных карцином СА-62 в единицах измерения (Ед/мл) в неизвестных образцах.
Процедура применения набора включает в себя следующие стадии:
Стадия 1. ПОДГОТОВКА РЕАГЕНТОВ
Перед проведением анализа необходимо вскрыть упаковку набора, извлечь все компоненты, в том числе и запечатанный пакет с планшетом. Выдержать все компоненты набора и анализируемые образцы при комнатной температуре от 22°С до 25°С не менее одного часа. При дробном использовании набора после отбора части содержимого флаконы и оставшиеся стрипы планшета следует немедленно плотно закрыть, поместить в холодильник и хранить при температуре от минус 20°С минус 30°С в пределах срока годности набора.
Стандартные калибраторы, положительный контроль, планшет с иммобилизованными антителами и рабочий буферный раствор, рН от 2,0 до 8,0, содержащий Твин-80, готовы к использованию и не требуют дополнительного разведения. Конъюгат тест-системы «СА-62» требует разбавления для получения разбавленного раствора с использованием рабочего буферного раствора. Точное разведение конъюгата «CA-62-Акридин» указано на этикетке каждой партии и паспорте на серию набора реагентов. Разбавленный раствор конъюгата необходимо использовать в течение часа во избежание потери люминесцентного сигнала. Рекомендуется разбавлять рабочий раствор конъюгата в центрифужной пробирке с закручивающейся крышкой типа Фалкон, обернутой фольгой.
Пробирки со стандартными калибраторами тест-системы «СА-62» необходимо аккуратно перемешать на вортексе без вспенивания раствора для полного перемешивания, без образования пены при пипетировании. Необходимо использовать отдельный наконечник для каждого калибратора. При желании в тесте можно использовать Положительный контроль СА-62, который не является обязательным к использованию при проведении теста и предназначен лишь для возможности контроля работы набора реагентов при его хранении. При использовании Положительного контроля СА-62 его вносят в лунки планшета в объеме 50 мкл/лунку. Положительный контроль СА-62 должен храниться в замороженном виде при температуре минус 20°С в течение всего срока годности набора реагентов.
1.1 Подготовка планшета
Следует вскрыть пакет и установить на рамку необходимое количество стрипов для проведения анализа. Планшет с иммобилизованными антителами уже готов к использованию. Неиспользованные стрипы следует немедленно поместить в пакет с влагопоглотителем, удалить из него воздух, плотно закрыть, поместить в морозильник и хранить планшеты при температуре от минус 20°С до минус 30°С в течение всего срока годности набора реагентов.
1.2 Приготовление рабочего буферного раствора
Рабочий буферный раствор, рН от 2,0 до 8,0, содержащий Твин-80, готов к использованию и не требует дальнейшего разбавления. Необходимо разморозить флакон с рабочим буферным раствором, довести его до комнатной температуры и перелить необходимое количество раствора в ванночку для буферных растворов и пробирку типа Фалкон. Рабочий буферный раствор содержит высокую концентрацию Твин-80, что вызывает пенообразование раствора в пределах нормы. Остатки буферного раствора после использования необходимо утилизировать. Не допускается сливать остатки буферного раствора во флакон с исходным раствором.
1.3 Подготовка конъюгата «CA-62-Акридин»
Конъюгат «CA-62-Акридин» представляет собой концентрированный раствор меченого люминесцентным акридином ракового антигена в 100×10-3 моль/л фосфатно-солевом буферном растворе в концентрации 300 мкг/мл, который необходимо разбавить до указанной на этикетке конъюгата концентрации (или указанной в паспорте на серию) для получения разбавленного раствора конъюгата.
1.4 Подготовка анализируемых образцов и их хранение
Для корректного выполнения тест-системы «СА-62» все анализируемые образцы должны пройти предварительную подготовку, которая заключается в термообработке всех образцов на водяной бане при 56°С в течение 30 минут (при объемах образца от 0,5 мл до 1 мл). Несоблюдение этой процедуры изменит результаты теста. Образцы с консервантом могут храниться в течение 3-х недель при 4°С до их использования. В.случае более длительного хранения образцы должны быть заморожены при температуре от минус 20°С до минус 70°С.
Разведение анализируемых образцов 1:10 производится в самих лунках планшета при смешении 10 мкл образца с 40 мкл рабочего буферного раствора и последующего добавления к смеси 50 мкл разбавленного раствора конъюгата «CA-62-Акридин».
8. Стадия 2. ПРОВЕДЕНИЕ ИХА «НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ МАРКЕРА ЭПИТЕЛИАЛЬНЫХ КАРЦИНОМ»
Все реагенты, стандартные калибраторы и образцы должны быть приведены к комнатной температуре перед выполнением теста и тщательно смешаны перед их использованием. Стандартные калибраторы и тестируемые образцы обрабатываются единообразно и должны тестироваться в дубликатах. Разбавленные растворы стандартных калибраторов, разбавленные образцы и рабочий раствор конъюгата «CA-62-Акридин» должны быть свежеприготовленными. Не следует использовать заранее разбавленные и хранящиеся материалы, поскольку это может изменить результаты измерений теста.
1. Использовать необходимое количество стрипов из разборных планшетов с иммобилизованными антителами к СА-62 для выполнения анализа.
2. Внести в дубликатах по 50 мкл стандартных калибраторов СА-62 в лунки А-Н.
3. С использованием одноканального дозатора с переменным объемом внести по 10 мкл каждого анализируемого образца в две соседние пустые лунки (дубликаты) с иммобилизованными антителами. Внести каплю сыворотки в левую часть дна лунки планшета, при этом каждый раз меняя наконечник. Время внесения образцов не должно превышать 30 минут при использовании всех лунок планшета.
4. С использованием 8-канального дозатора внести в лунки планшета по 40 мкл рабочего буферного раствора с Твином-80 для промежуточного разбавления образцов: это предотвратит их высыхание.
5. Тщательно перемешать образцы в лунках при помощи постепенного похлопывания разных сторон микропланшета.
6. Развести конъюгат «CA-62-Акридин» в соответствии с указанным фактором разбавления для получения разбавленного раствора конъюгата с рабочей концентрацией X мкг/мл. На целый планшет необходимо приготовить 6 мл разбавленного раствора конъюгата в рабочем буферном растворе, рН от 2,0 до 8,0, содержащем Твин-80. Аккуратно смешать полученный разбавленный раствор конъюгата при помощи вортекса, избегая сильного вспенивания раствора. Затем при помощи 8-канального дозатора внести по 50 мкл разбавленного раствора конъюгата «CA-62-Акридин» во все лунки (итоговая концентрация конъюгата в лунках при этом составит Х/2 мкг/мл). Тщательно смешать реакционную смесь при помощи постепенного похлопывания разных сторон микропланшета.
7. 3акрыть микропланшет защитной пленкой и алюминиевой фольгой, и выдерживать при комнатной температуре от 20°С до 25°С в течение 2,-х часов.
8. Вылить или аспирировать содержимое лунок и промыть планшет 6 раз дистиллированной водой с использованием микропланшетного вошера или промывочной бутыли, чередуя аспирацию и немедленное заполнение лунок каждого стрипа. В каждую лунку внести по 270 мкл жидкости в процессе каждого цикла промывки. По окончанию промывки перевернуть планшет на адсорбирующую бумагу или медицинскую салфетку для удаления излишков жидкости.
Стадия 3. РЕГИСТРАЦИЯ РЕЗУЛЬТАТОВ
1. Для регистрации данных эксперимента установить в люменометре «пустой» фильтр («<--->», «blank») для регистрации данных.
*При желании можно использовать Положительный контроль «СА-62», который не требует предварительного разбавления и вносится в лунку микропланшета в объеме 50 мкл, с последующим добавлением разбавленного раствора конъюгата «СА-62-Акридин».
• Проведения эксперимента для люменометров с ОДНИМ инжектором.
При помощи дозатора добавить по 50 мкл в каждую лунку микропланшета раствор пре-активатора (водный раствор 1 ммоль/л HNO3 и 0,1% Н2О2, хранить в темном месте, защищенном от света) и установить планшет в прибор. Инжектор люменометра должен диспенсировать по 50 мкл в лунку активатора (1N NaOH) люминесцентного сигнала и считывать результаты лунку в течение от 0,25 до 1 секунды. Время интеграции должно быть установлено в соответствии с чувствительностью люменометра. Для люменометра Anthos Lucy 2 рекомендуемое время считывания - 1 секунда.
• Проведения эксперимента для люменометров с ДВУМЯ инжекторами.
Установить объем диспенсирования инжектора 1 на 50 мкл в каждую лунку раствора преактиватора (водный раствор 1 ммоль/л HNO3 и 0,1% Н2О2, а объем диспенсирования инжектора 2 на 50 мкл 1N NaOH в каждую лунку. Время ожидания между диспенсированием инжекторов 1 и 2 устанавливается на 0,5 секунды. Считывание результатов должно быть выполнено в течение 1 секунды после окончания диспенсирования второго инжектора. Немедленно считать и регистрировать относительные единицы света (RLU).
Стадия 4. РАСЧЕТ УРОВНЯ МАРКЕРА ЭПИТЕЛИАЛЬНЫХ КАРЦИНОМ
Калибровочная кривая представляет собой логарифмическую функцию с отрицательным наклоном (чем ниже единицы измерения, тем больше единицы маркера СА-62). С помощью программы Microsoft Excel рассчитать величины СА-62 образцов следующим образом:
1. Рассчитать среднеарифметическую величину RLU для каждого калибратора и для каждого образца сыворотки (дубликаты).
2. Построить калибровочную кривую: по оси у отложить измеренную величину RLU калибраторов, по оси x - величину измерения калибраторов в единицах СА-62. Изменить формат горизонтальной оси на логарифмическую шкалу нажатием на правую клавишу мыши. Определить логарифмическую функцию соответствующей калибровочной кривой. Величина коэффициента детерминации R2 должна быть менее 0,9, в противном случае, необходимо будет повторить измерения для всего ряда образцов.
3. Для интерполирования единиц измерения маркера СА-62 в Ед/мл необходимо использовать коэффициенты логарифмического уравнения y=a⋅Ln(x)+b, в котором а и b являются коэффициентами в формуле, рассчитанной по Excel (Табл. 1). Необходимо решить уравнение и определить величину x для каждого индивидуального образца, используя измеренные величины «y», что осуществляется расчетами с использованием следующего уравнения: = EXP((RLU-b)/а)). Необходимо помнить, что коэффициент «а» будет отрицательным числом. В данном случае, калибровочную кривую будет описывать логарифмическое уравнение: y=-10,9 ln(x)+110,07, где а = -10,9 и b = 110,07.

4. Образцы с величинами RLU, попадающие за пределы шкалы стандартной калибровочной кривой, не следует экстраполировать на эту кривую. Вместо этого, результаты измерений необходимо указать как больше 10000 Ед/мл или меньше 50 Ед/мл, которые представляют собой значения самого большого и самого низкого калибровочного стандарта СА-62, соответственно.
5. Образцы с величинами единиц СА-62, превышающими самый большой калибратор, могут быть соответственно разбавлены, концентрация СА-62 должна быть измерена вновь, после чего точная концентрация определяется с помощью умножения на фактор разбавления.
Некоторые параметры, которые использовались при разработке теста:
Чувствительность - это процент «больных» образцов, которые были протестированы и дали положительные результаты относительно общего количества «больных» образцов. Корректно выявленные образцы онкологических пациентов называются «истинно положительными, True positives (TP)». Образцы онкологических пациентов, которые были пропущены при тестировании, называются «ложноотрицательными или False Negatives (FN)». Таким образом, чувствительность выражается следующим уравнением: Чувствительность = TP/(TP+FN).
Специфичность теста - это пропорция образцов, которые тестируются отрицательно, что может быть выражено уравнением: Специфичность = TN/(TN+FP), где TN = истинно отрицательные образцы (здоровые доноры, определенные как отрицательные на СА-62) и FP = ложноположительные (здоровые доноры, некорректно определенные тестом как положительные).
Характеристическая кривая ROC (Receiver Operating Characteristic): Кривая ROC обозначает соотношение Чувствительности теста и его Специфичности (на самом деле величину, обратную специфичности (1 - Specificity) для получения кривой, а не линейной зависимости). Она обозначает способность теста различать больных раком пациентов и здоровых людей. Тест, в котором отсутствует различие между группами образцов, покажет диагональ между осями координат. Чем больше будет наблюдаться различие между больными и здоровыми образцами, тем сильнее будет изгибаться кривая, приближаясь к осям координат. Идеальный тест (100% чувствительность и 100% специфичность) будет иметь фигуру в форме прямого угла по осям координат.
Стадия 5. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Анализ полученных нами данных по исследованию панелей образцов сыворотки пациентов с РМЖ, РПЖ и РЯ показал, что значительное повышение уровня маркера эпителиальных карцином СА-62 в крови пациентов, по сравнению с нормальным уровнем этого маркера в сыворотке здоровых людей, напрямую связано с развитием канцерогенеза. Пороговое значение СА-62 составляет 5000 Ед/мл, при этом референтный диапазон, отражающий нижнюю и верхнюю границу нормы лабораторного показателя СА-62, составляет от 50 до 4999 Ед/мл. Таким образом, результаты, выходящие за пределы референтных значений маркера и превышающие пороговое значение в 5000 Ед/мл, могут служить достаточным основанием для поиска причин необычной экспрессии ракового антигена СА-62, который может сигнализировать о возможном патологическом процессе.
Чувствительность определения ракового антигена СА-62 в крови пациентов с ранними стадиями онкологических заболеваний составляет от 80 до 95% при специфичности от 90 до 95%, что свидетельствует о большой перспективности его использования для уточнения онкологического диагноза и о чрезвычайно низком риске получения ложноположительного результата.
Нормализация уровня маркера СА-62 под воздействием эффективного противоопухолевого лечения (химиотерапия, хирургия и т.д.), а также стабилизация его нормальных значений в крови свидетельствует о достижении ремиссии у пролеченных пациентов. Повышение же уровня маркера СА-62 на фоне достигнутой ремиссии должно стать основанием для более углубленного обследования больного с целью выявления возможного рецидива заболевания. Постепенное увеличение уровня маркера СА-62 в сыворотке пациента может являться существенным прогностическим признаком, сигнализирующим об отрицательной динамике лечения или о возникновении рецидива патологического процесса.
Таким образом, повышенный уровень ракового антигена СА-62 в крови пациентов сам по себе или в сочетании с другими онкомаркерами имеет достоверные указания на наличие процесса канцерогенеза и целесообразно может применяться для ранней диагностики злокачественного процесса или выявления его агрессивности.
Ограничения теста
Наличие цитрата, оксалата, этилендиаминтетрауксусной кислоты (ЭДТК) или других хелатирующих агентов, также как и гепарина в образцах, сделают результаты теста некорректными. Корректные результаты могут быть получены только в сыворотке крови, полученной из венозной крови. Образцы плазмы крови для данного теста не подходят. Беременные и кормящие женщины не должны тестироваться с помощью данного теста, поскольку эти состояния связаны с повышенным уровнем АФП, который влияет на изменение результатов измерения гликопротеина СА-62 в крови. Наличие острого воспалительного процесса теоретически может привести к ложно-положительному результату, в связи с чем требуется избегать тестирование таких пациентов до их излечения. Первичное тестирование пациентов на маркер эпителиальных карцином СА-62 рекомендуется проводить до начала химиотерапии, поскольку это может повлиять на результаты измерения. Во время химиотерапии можно проводить измерение маркера СА-62 только под наблюдением химиотерапевта в режиме мониторинга лечения онкологического заболевания с использованием изучения динамики маркера эпителиальных карцином. Прежние исследования показали, что от 5% до 10% образцов онкологических пациентов могут быть отрицательными, в зависимости от конкретной разновидности рака, степени его распространенности (стадии рака) и дифференцированности опухолевых клеток. Также, от 2 до 5% здоровых людей и до ~10% пациентов с доброкачественными опухолями могут быть протестированы положительно (на данной стадии исследований является неизвестным, не находятся ли отдельные доброкачественные опухоли и новообразования в процессе перехода в злокачественные новообразования). В связи с вышесказанным, данный ИХА тест предназначен для помощи в диагностировании онкологических заболеваний на ранних стадиях их возникновения, в процессе наблюдения за лечением и развитием заболевания, их дифференцирования от доброкачественных новообразований в организме, с целью дальнейшего определения их локализации с использованием современных методов диагностики.
Техническая задача: Разработка диагностического онкотеста, направленного на выявление ранних стадий рака.
Техническим результатом предлагаемого изобретения является создание набора реагентов для ранней диагностики рака, выявления рецидивов опухоли и мониторинга лечения эпителиальных опухолей человека методом иммунохимического анализа, обладающего следующими преимуществами перед аналогичными решениями:
1. Набор реагентов позволяет выявлять самые ранние стадии эпителиальных опухолей молочной железы, предстательной железы и карциномы яичников, включая cancer in situ, с уровнем точности, не достижимым другими методами ин витро диагностики.
2. Набор обладает повышенной чувствительностью и специфичностью при первичном выявлении злокачественных новообразований (стадии I-IV) по сравнению с другими тестами, основанными на онкомаркерах.
3. Набор реагентов обладает высокой эффективностью при мониторинге химиотерапии пациентов с раком легкого, раком желудка и колоректальным раком.
4. Набор реагентов обладает высокой чувствительностью при выявлении рецидивов опухоли у пациентов с раком яичников и раком желудка.
Указанный технический результат достигается:
По п. 1 - применением уникальных моноклональных антител, направленных против N-гликозидного эпитопа гликопротеина СА-62 и наработанных методом гибридомной технологии. Моноклональные антитела с большой точностью позволяют узнавать все формы гликозидов на поверхности малигнизированных клеток, что позволяет выявлять самое начало онкогенеза.
По п. 2 - использованием компетентного одностадийного метода ИХА анализа с меченым раковым антигеном СА-62 на высокочувствительном флэш-люменометре, что позволяет значительно повысить как чувствительность, так и специфичность разработанного набора реагентов.
По п. 3 - изучением динамики маркера эпителиальных карцином в ходе химиотерапии пациентов с распространенными формами эпителиального рака, которая оказалась высокочувствительным инструментом для наблюдения за ответом опухоли на проводимое лечение.
По п. 4 - изучением динамики маркера эпителиальных карцином СА-62 при мониторинге пациентов с эпителиальным раком яичников после проведенного хирургического лечения, которая оказалась высокочувствительным инструментом для выявления рецидива опухоли.
Пример 1. Исследовалась закодированная панель образцов 1 «Рабочая панель образцов рака молочной железы (РМЖ), доброкачественных заболеваний молочной железы (ДМЖ) и здоровых контролей».
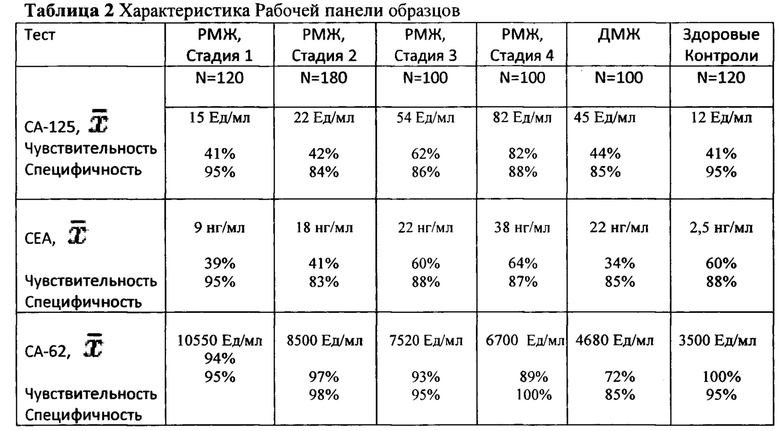
Выявление ранних стадий (I и II) рака молочной железы с помощью маркера СА-62 в панели образцов 1 «Рабочая панель образцов рака молочной железы (РМЖ), доброкачественных заболеваний молочной железы (ДМЖ) и здоровых контролей».
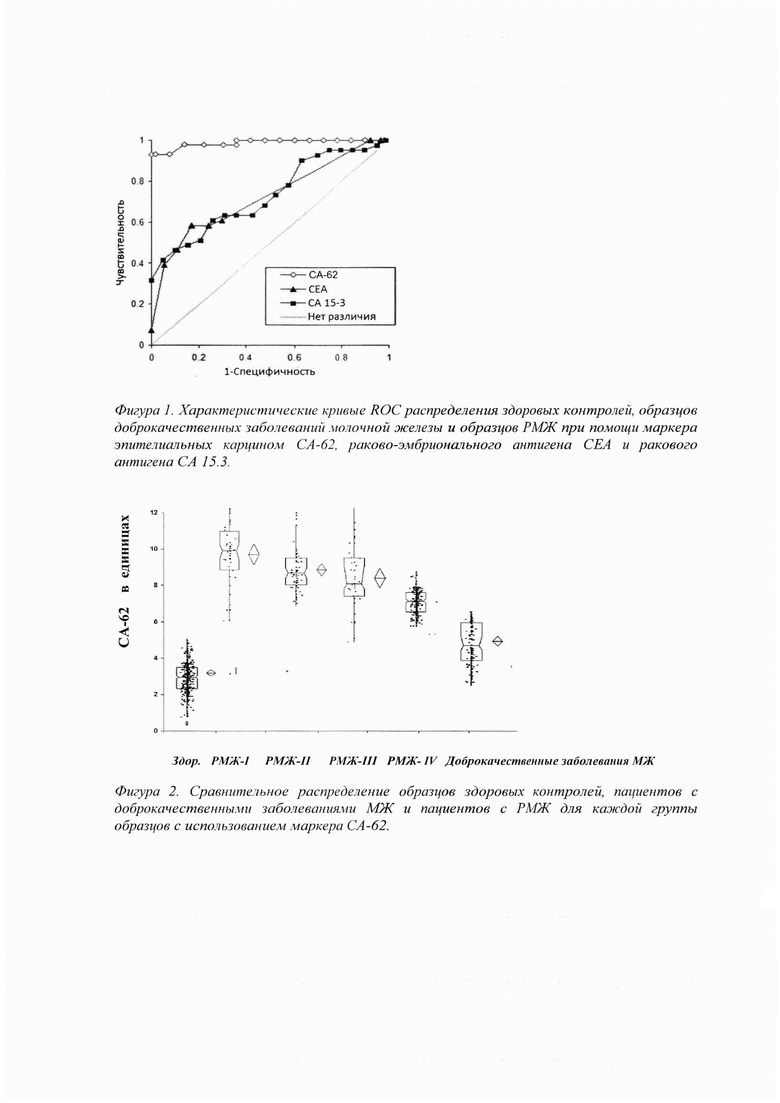
Величина p независимого t-теста при сравнении здоровых образцов с образцами больных РМЖ соответствовала 4.12×10-22. При сравнении образцов сыворотки пациентов с доброкачественными и злокачественными новообразованиями величина p для t-теста была определена 1.2×10-4. Фигура 1 демонстрирует характеристические кривые ROC для трех маркеров СЕА, СА-15-3, и СА-62, когда здоровые контрольные образцы сравнивались с образцами пациентов, имеющих аденокарциному молочной железы (РМЖ). Площадь под характеристической кривой для маркера СА-62 составила 0.985. При использовании пороговой величины в 5000 Ед/мл для маркера эпителиальных карцином СА-62, чувствительность метода составила 94% при 95% специфичности. Для тех же самых образцов при 95% специфичности чувствительность теста СЕА соответствовала лишь 39% (AUC: 0.723), а чувствительность СА 15-3 теста - 41% (AUC: 0.739). Фигура 2 изображает распределение с использованием маркера СА-62 контрольных образцов РМЖ, здоровых контролей и образцов с доброкачественными заболеваниями.
При увеличении пороговой величины до 7500 Ед/мл достигается 100% специфичность теста СА-62 с выявлением 75% самых ранних стадий РМЖ. При сохранении 100% специфичности, чувствительность тестов СЕА и СА 15-3 составила 32% и 37%, соответственно. При сравнении доброкачественных образцов с образцами панели РМЖ более высокая пороговая величина способствовала лучшему дифференцированию этих панелей. При пороговой величине 7300 Ед/мл СА-62 чувствительность теста составила 72% при 85% специфичности (AUC: 0.773). Для тех же самых образцов при 85% специфичности, чувствительность тестов СЕА и СА 15-3 составила 34% (AUC: 0.626) и 44% (AUC: 0.685), соответственно.
Стадии III и IV РМЖ Панели образцов 1 «Рабочая панель образцов рака молочной железы (РМЖ), доброкачественных заболеваний молочной железы (ДМЖ) и здоровых контролей».
Характеристическая кривая маркера эпителиальных карцином СА-62 (ROC curve), сравнивающие контрольные и доброкачественные образцы с образцами от пациентов с аденокарциномой молочной железы имеет площадь AUC: 0.99. При пороговой величине в 5000 Ед/мл СА-62 чувствительность теста составила 97% при специфичности 95%. При сравнении сыворотки пациентов с доброкачественными и злокачественными опухолями молочной железы при использовании пороговой величины в 5500 Ед/мл биомаркера СА-62, чувствительность теста составила 88% при 97% специфичности (AUC: 0.97). При анализе характеристической кривой измерения (ROC analysis) с использованием 4700 Ед/мл СА-62 чувствительность теста составила 89% при 100% специфичности. Площадь под характеристической кривой равна 0.98.
При сравнении образцов сыворотки пациентов с доброкачественными опухолями молочной железы и РМЖ повышение пороговой величины опухолевого маркера СА-62 до 7300 Ед/мл позволило дифференцировать эти категории пациентов значительно лучше, при этом чувствительность теста СА-62 составила 74% при 85% специфичности (AUC: 0,783). Те же самые образцы при 85% специфичности показывали 34% чувствительность теста СЕА (РЭА) (AUC: 0,626) и 44% чувствительность теста СА 15-3 (AUC: 0,685). Результаты проведенного исследования показали:
1. Опухолевый маркер эпителиальных карцином СА-62 способен различать с высокой чувствительностью и специфичностью здоровых пациентов и пациентов с доброкачественными заболеваниями молочной железы от больных раком молочной железы.
2. Разработанный иммунологический тест может определять ранние стадии рака молочной железы с высоким уровнем чувствительности и специфичности, не достижимыми на данный момент другими опухолевыми маркерами. При выборе низкой пороговой величины СА-62 (4700-5000 Ед/мл) повышается вероятность выявления онкологии у больных пациентов: чувствительность от 93% до 94% при 95% специфичности при сравнении со здоровыми пациентами.
3. В данном исследовании диагностическая значимость метода диагностики с использованием ракового антигена СА-62 превышала показатели тестов СЕА и СА15-3 для исследованных образцов (чувствительность 39% и 41%, соответственно, для обоих маркеров при 95% специфичности).
Пример 2. Исследовалась панель образцов 2 «Рабочая панель образцов рака яичников, образцов доброкачественных гинекологических заболеваний и здоровых контролей». Исследуемые образцы: Образцы сыворотки 200 пациентов с подтвержденным диагнозом карциномы яичников (стадии I/II = 83 и стадии III/IV = 117), 50 образцов пациентов с доброкачественными заболеваниями, а также 105 здоровых контрольных образцов были включены в исследование. Из 200 пациентов с гистологически подтвержденными злокачественными опухолями 60% составили серозные карциномы, 20% - муцинозные карциномы. 10% - эндометриоидные карциномы и 10% - недифференцированные карциномы. Все образцы сыворотки были забраны у пациентов еще до осуществления лечения, при этом диагнозы были подтверждены гистологическим исследованием до начала данного исследования. Образцы забирались в стерильные контейнеры с активатором свертывания крови (clot activator), и после того как кровь сворачивалась, образцы центрифугировались и замораживались при температуре минус 30°С.
Измерение сывороточного уровня маркера эпителиальных карцином СА-62 проводилось с помощью иммунохемилюминесцентного анализа (ИХА). Характеристика образцов рабочей панели 2 представлена в Таблице 3.
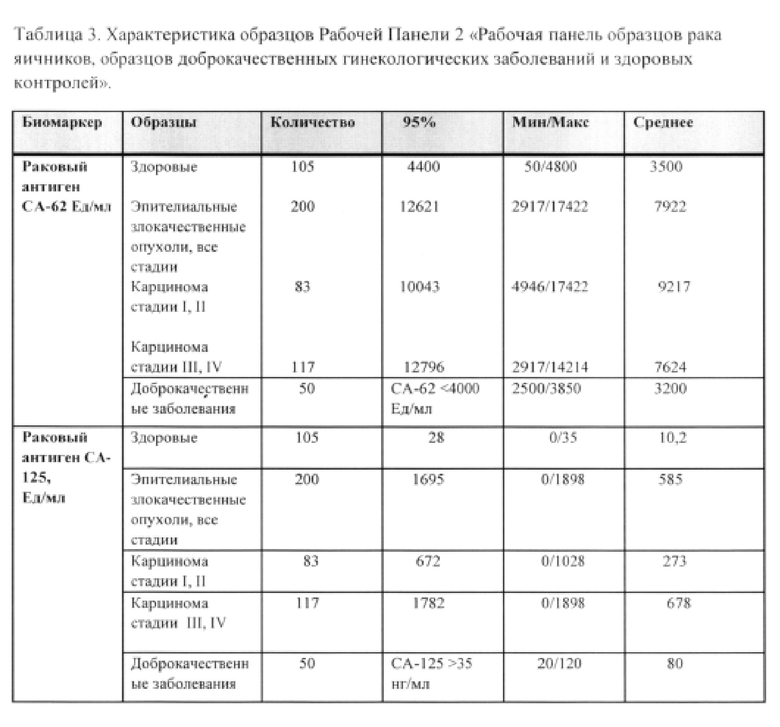
Таблица 3 показывает описательную статистику раковых антигенов СА-62 и СА-125 в сыворотке здоровых контролей и рабочей панели сыворотки пациентов с различными стадиями рака яичников. Линейный регрессионный анализ демонстрирует низкий коэффициент корреляции между величинами маркера СА-62 и ракового антигена СА-125 во всех образцах (r2=0.1318 [r=0.36] и r2=0.0056 [r=0.07] в образцах, содержащих только больных раком пациентов). Отсутствие корреляции между этими маркерами означает, что их комбинация сможет улучшить их индивидуальные диагностические характеристики по выявлению рака.
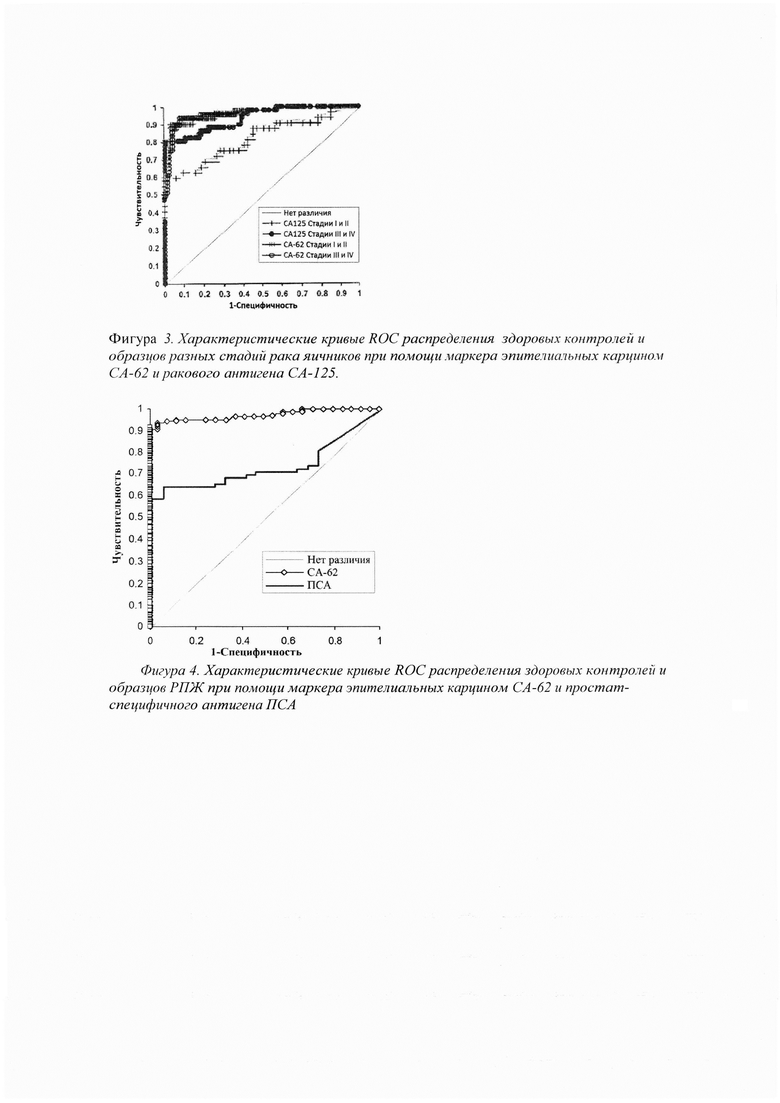
Фигура 3 показывает характеристические ROC кривые раковых антигенов СА-62 и СА-125 для всех стадий рака яичников. Способность дифференцировать образцы онкологических пациентов от здоровых контрольных образцов значительно выше у биомаркера СА-62, особенно на ранних стадиях рака, где диагностическая значимость биомаркера СА-125 ниже (площадь под характеристической кривой AUC для СА-62 составляла 0.96 по сравнению с 0.805 для СА-125).
Представляется важным отметить, что в то время как чувствительность ракового антигена СА-125 значительно ниже на ранних стадиях болезни по сравнению с поздними стадиями рака, чувствительность маркера эпителиальных карцином СА-62 остается высокой на всех стадиях болезни.
Детальный анализ различных злокачественных опухолей яичников с использованием маркера эпителиальных карцином СА-62 и ракового антигена СА-125 показан в Таблице 4:
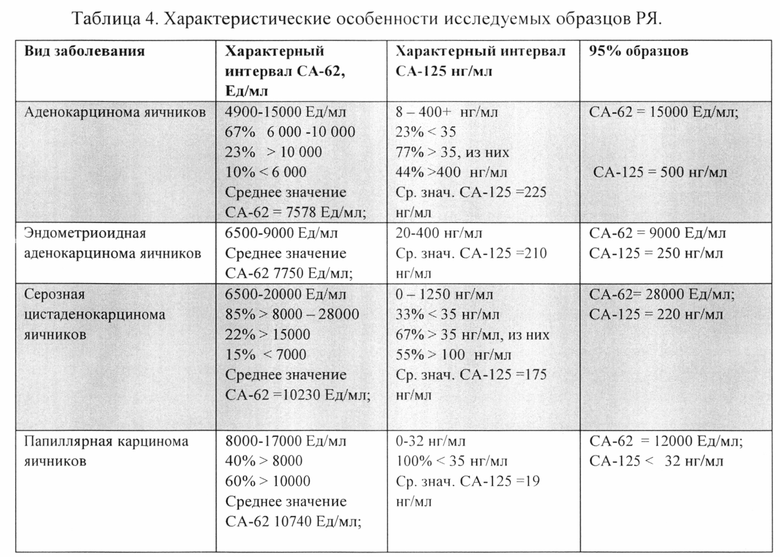
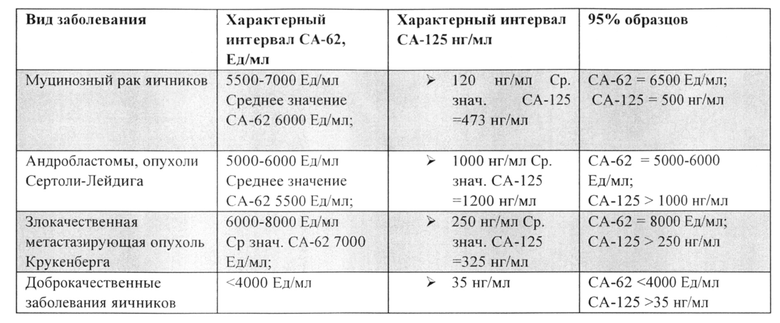
Из таблицы 4 видно, что наблюдается отсутствие корреляции между биомаркерами СА-62 и СА-125 в исследованных образцах. Именно отсутствие корреляции дает возможность согласованно использовать оба эти маркера для повышения чувствительности и тканеспецифичности при выявлении самых ранних стадий карциномы яичников.
Выявление ранних стадий рака яичников при помощи маркера СА-62 в панели образцов 2 «Рабочая панель образцов рака яичников, образцов доброкачественных гинекологических заболеваний и здоровых контролей».
Проведенное исследование показало, что чувствительность теста СА-62 значительно выше при определении самых ранних стадий рака яичников по сравнению с маркером СА-125. При использовании пороговой величины 5000 Ед/мл для ракового антигена СА-62 пр 95% специфичности чувствительность теста составила 92% при выявлении Стадии I, 90% - для Стадии II, и 87% при выявлении поздних стадий (III и IV) рака яичников.
В отличие от биомаркера СА-62, чувствительность теста СА-125 значительно повышается на поздних стадиях рака яичников, в то время как для теста СА-62 чувствительность остается высокой на всех стадиях болезни. Тест СА-125 обладает хорошей прогностической способностью при мониторинге лечения рака яичников, диагностики его метастазирования и оценки эффективности проводимой терапии, значительное повышение маркера СА-125 однозначно указывает на возникновение рецидива заболевания. Сравнительный анализ диагностической значимости тестов СА-62 и СА-125 представлен в Таблице 5:
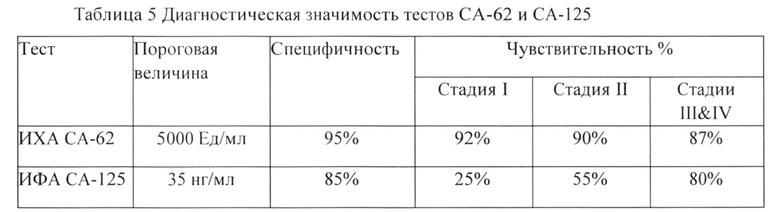
Полученные результаты сравнительного анализа показывают, что использование сывороточных величин маркера СА-62 делает вполне осуществимым получение «скринингового» теста на карциному яичников, который будет выявлять ранние стадии рака яичников, при которых процент излечения максимальный.
Результаты проведенного исследования:
1. Сравнительный анализ биомаркеров СА-62 и СА-125 на Контрольной панели образцов 2 показал, что чувствительность и специфичность маркера эпителиальных карцином СА-62 значительно превышает эти характеристики для СА-125 для всех стадий рака яичников.
2. Сывороточный уровень биомаркера СА-62 обеспечивает высокую специфичность и чувствительность, необходимые для скрининга рака яичников, и, в частности, для выявления ранних стадий этой болезни, когда процент излечения самый высокий.
3. Установление высокой пороговой величины позволит исключить здоровых людей. В этом случае, любой пациент, тестируемый положительно, очень вероятно, будет иметь какую-то патологию, которая потребует ее диагностирования, и в ряде случаев, - ее лечения. В этих случаях результаты теста должны рассматриваться как полезные для пациента, независимо от конкретной патологии.
Данное исследование обеспечивает рамки развития стратегии, которая может обеспечить экономичный и чувствительный подход к выявлению ранних стадий рака яичников и в связи с этим, к понижению смертности, вызванной этой болезнью.
Пример 3. Исследовалась панель образцов 3 «Рабочая панель образцов рака предстательной железы, образцов доброкачественных заболеваний простаты и здоровых контролей».
Исследовалась панель образцов сыворотки крови пациентов с ранними и поздними стадиями рака предстательной железы (РПЖ) и пациентов с доброкачественным заболеванием предстательной железы, в частности с гиперплазией простаты.
Цели исследования:
• Сравнительный анализ маркера эпителиальных карцином СА-62 с простат-специфичным антигеном ПСА (PSA) в качестве альтернативного метода ранней диагностики рака предстательной железы.
• Изучение возможности комбинированного использования двух маркеров (ПСА и СА-62) по сравнению с комбинацией (fPSA/total PSA) для повышения чувствительности при выявлении ранних стадий рака предстательной железы на самых ранних стадиях развития болезни и повышения процента выживаемости.
• Изучение возможности использования комбинации двух маркеров (ПСА и СА-62) для снижения количества ненужных биопсий для пациентов с доброкачественным заболеванием гиперплазии простаты.
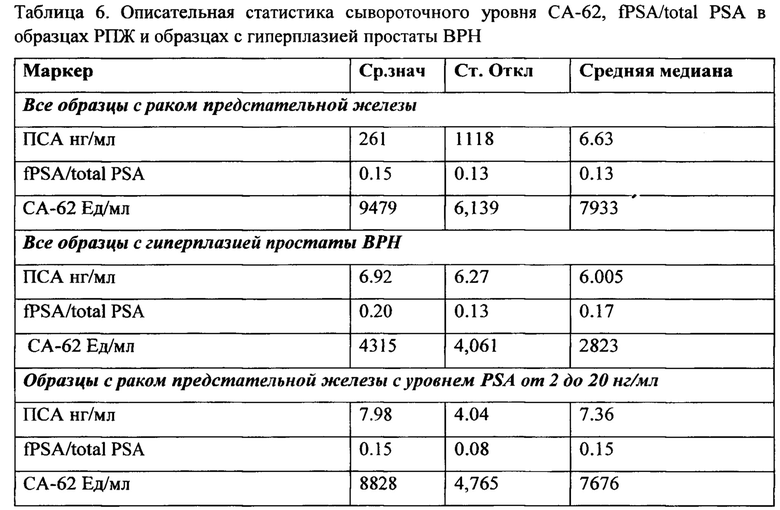
Описательная статистика исследуемых образцов приведена в Таблице 6.
Все образцы крови были забраны и обработаны в соответствии со стандартными процедурами с использованием вакуумных контейнеров с активатором свертывания и разделяющим гелем. Затем все образцы центрифугировались, после чего отделялась сыворотка, замораживалась для хранения при минус 20°С. Перед использованием все образцы делились на аликвоты и подвергались термообработке при 56°С в течение 30 минут.
Для анализа полученных данных нами использовался одностадийный компетентный сывороточный иммунотест на разработанных нами моноклональных антителах, специфичных к N-гликопротеину СА-62. Сывороточный тест «СА-62» был разработан в виде одностадийного «конкурентного» варианта твердофазного иммуно-хемилюминесцентного ИХА с использованием высокоспецифических анти-СА-62 антител. Циркулирующий уровень общего и свободного ПСА измерялись с использованием AxSYM® системы (Abbott labs, США)
После получения результатов измерения и раскрытия диагноза исследуемых образцов все образцы были разделены на 3 группы: здоровые контроли (24), образцы с доброкачественными заболеваниями простаты (118) и группа образцов с раком предстательной железы (212). Панель содержит 212 образцов с гистологически подтвержденными стадиями рака предстательной железы: Стадия I: 22 образца, Стадия II: 30 образцов, Стадия III: 70 образцов и Стадия IV: 90 образцов и 118 образцов с гистологически подтвержденной гиперплазией простаты (ВРН). Все злокачественные и доброкачественные образцы были забраны у пациентов до начала лечения и все диагнозы были подтверждены до начала исследования при помощи гистологического обследования. Полученные результаты представлены в Таблице 6:
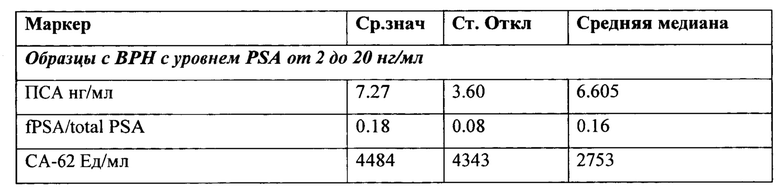
Пациенты с интервалом PSA от 2 до 20 нг/мл: 131 из 212 онкологических пациентов (62%) и 98 из 118 пациентов с гиперплазией простаты (83%) имеют от 2 до 20 нг/мл PSA (Табл. 7).

Выявление ранних стадий рака предстательной железы при момощи маркера СА-62 в панель образцов 3 «Рабочая панель образцов рака предстательной железы, образцов доброкачественных заболеваний простаты и здоровых контролей».
Важной задачей исследования было проведения сравнительного анализа маркера эпителиальных карцином СА-62 с простата-специфичным антигеном PSA в их способности выявлять ранние стадии (I и II) рака предстательной железы. Из 52 образцов, соответствующих стадиям I и II, тест СА-62 выявил 42 из 52 (81%) положительных образцов, в то время как PSA тест был положительным лишь в 15 из 52 (29%) случаев. Фигура 4 показывает сравнение характеристических кривых для исследованной рабочей панели образцов рака предстательной железы РПЖ с использованием сывороточных маркеров СА-62 и ПСА. Проведенное исследование позволило сделать следующие выводы:
1. Сывороточный тест с маркером эпителиальных карцином СА-62 с пороговой величиной 3,900 Ед/мл, проведенный на образцах с уровнем ПСА 2- 20 нг/мл или 4-10 нг/мл позволяет выявить 93% ранних стадий рака предстательной железы, при этом значительно снижая число ненужных биопсий.
2. Комбинаторное использование теста ПСА и сывороточного теста с маркером эпителиальных карцином СА-62 для различения образцов доброкачественной гиперплазии простаты от рака предстательной железы увеличивает специфичность теста в 4-6 раз и снижает необходимость инвазивного вмешательства.
3. Соотношение величин общего total PSA и свободного fPSA, полученное для исследованных образцов, находится в соответствии с литературными данными, что подтверждает, что эти образцы могут представлять большую популяцию. Эта валидация очень важна, поскольку она позволяет обобщить результаты и сделать вывод о том, что использование специфичного маркера эпителиальных карцином СА-62 может значительно снизить количество осложнений, связанных с биопсией предстательной железы. Эта валидация теста очень важна, поскольку это позволяет нам обобщить наши результаты и сделать предположение о том, что использование маркера эпителиальных карцином может значительно уменьшить риск летальных исходов, связанный с биопсией простаты. Результаты исследования подготовлены к публикации.
Пример 4. Исследование мониторинга эффективности химиотерапии и выявление рецидивов у пациентов с метастатическими эпителиальными опухолями с помощью нового Маркера Эпителиальных Карцином СА-62.
Цель исследования:
1. Оценка эффективности динамики уровня биомаркера СА-62 для мониторинга химиотерапии пациентов с различными солидными опухолями.
2. Выявление корреляций между уровнем экспрессии маркера СА-62 и ответом опухоли на проводимое лечение в соответствии с критерием RECIST.
3. Выявление рецидивов заболевания с помощью маркера эпителиальных карцином.
Схема исследования: Исследование проводилось у 100 пациентов с различными солидными опухолями (РЖ, МРЛ, КРР и НЭО), включая стабилизированных пациентов (36%), получавших системное лечение ранее и находящихся в состоянии ремиссии. Кровь у пациентов забиралась и обрабатывалась перед началом, в процессе и по окончанию лечения. Забор проводился в Российском Онкологическом Научном Центре им. Н.Н. Блохина, Москва, Россия, в соответствии с утвержденными стандартными протоколами. Общая длительность наблюдения пациентов составила 12 месяцев. За время наблюдения каждые 2-3 курса химиотерапии, согласно критериям RECIST 1.1, проводилась оценка объективного ответа по данным компьютерной томографии органов грудной клетки, органов брюшной полости, органов малого таза, УЗИ, МРТ головного мозга и сцинтиграфии костей. Производилась оценка корреляции показателя маркера СА-62 с течением заболевания, обуславливающая взаимосвязь прогрессирования заболевания по RECIST 1.1. с повышением значения СА-62 свыше 4600 Ед/мл, и положительную динамику, стабилизацию процесса - с его уменьшением.
Пациенты
Исследование проводилось с августа 2015 по декабрь 2016 года. В закодированное клиническое исследование были включены пациенты с местно-распространенными (стадии II и III) и метастатическими формами рака, подтвержденными результатами морфологического исследования, имеющими, по крайней мере, один измеряемый очаг опухоли по критериям RECIST, общее состояние здоровья на момент включения по ECOG от 0 до 2 и удовлетворительные лабораторные показатели. Измерения уровня маркера СА-62 в сыворотке каждого пациента проводились раз в месяц в ходе курса химиотерапии (2-5 месяцев) и продолжались в том же режиме после лечения (3 месяца).
Образцы крови 120 больных с подтвержденными диагнозами (стадии IIb = 22 и стадии III/IV = 88), а также образцы крови 28 здоровых людей, взятых в качестве контроля, были включены в исследование. Из окончательного анализа были исключены 20 пациентов, не проходивших регулярного обследования, необходимого для решения исследовательских задач. В окончательный анализ исследования вошли 100 больных, страдающих различными солидными опухолями:
34 - раком желудка (РЖ), 10 - колоректальным раком (КРР), 10 - раком яичников (РЯ), 22 - мелкоклеточным раком легких (МРЛ), 7 - нейроэндокринными опухолями желудочно-кишечного тракта (НЭО ЖКТ) и поджелудочной железы (НЭО ПЖ), 4 - раком шейки матки (РШМ), 3 - мезотелиомой плевры, 4 - раком молочной железы (РМЖ), 4 - адренокортикальным раком (АКР).
Выявление рецидивов опухолей
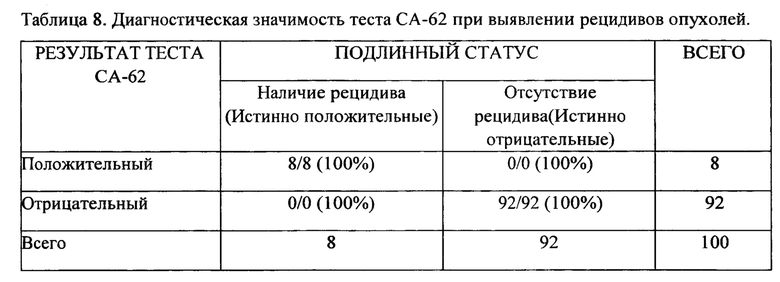
Измерения уровня маркера СА-62 в сыворотке каждого пациента в ходе курса химиотерапии (3-6 месяцев) позволило выявить рецидивы у 8% пациентов еще до их инструментального подтверждения. Результаты теста СА-62 для выявления рецидивов у пациентов с поздними стадиями эпителиальных опухолей представлены в Таблице 8.
Мониторинг химиотерапии у пациентов с местно-распространенными и метастатическими формами рака
До начала лечения, повышенный уровень биомаркера СА-62 наблюдался у 76% пациентов, который снизился до нормальных референтных значений (50-4600 Ед/мл) у 56% пациентов после прохождения химиотерапии, в то время как у 20% пациентов, оставался повышенным. При этом у всех 20% пациентов со стабильно высоким уровнем экспрессии биомаркера СА-62, независимо от проводимого лечения, наблюдалось прогрессирование заболевания. У 36% пациентов не наблюдалось изменений экспрессии СА-62 в ходе химиотерапии. После начала лечения у 22% этой группы наблюдалось прогрессирование заболевания, а у 14% пациентов была достигнута стабилизация. Фигуре 5 изображает корреляцию уровня маркера СА-62 с ответом опухоли на лечение в соответствии с критериями RECIST. В Таблице 9 приведены обобщенные данные для всех групп пациентов.
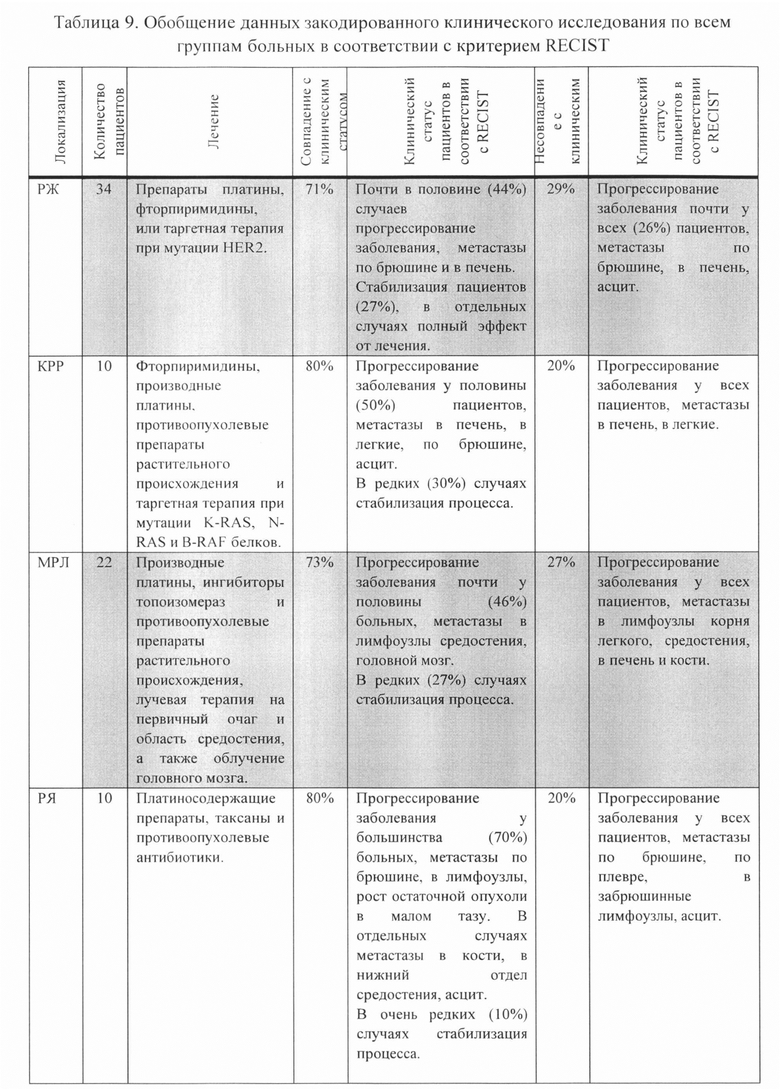
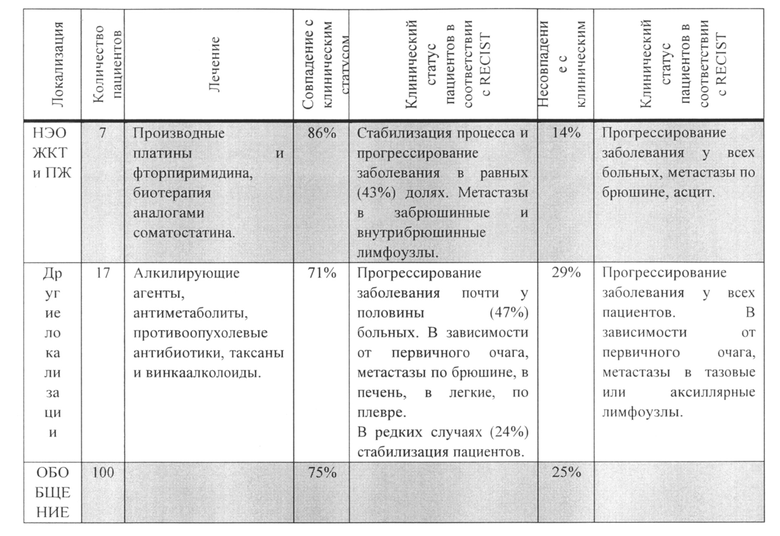
Полученные результаты:
1. У 8% пациентов были зафиксированы рецидивы заболевания, совпадающие с динамикой уровня маркера СА-62.
2. Динамика изменений маркера СА-62 в ходе химиотерапии у пациентов с РЖ, МРЛ и КРР показала хорошую корреляцию (71-80% в зависимости от локализации опухоли) с общим состоянием пациентов согласно критериям RECIST.
3. Показана возможность использования биомаркера СА-62 для мониторинга заболевания и оценки проводимого системного лечения.
Из полученных результатов следует, что из 100 пациентов со злокачественными опухолями различной локализации у 79% динамические изменения уровня биомаркера СА-62 в ходе лечения были напрямую связаны с ответом опухоли на проводимую химиотерапию. В то же время, стабильно высокий уровень маркера СА-62 в процессе нескольких курсов химиотерапии может предполагать ее неэффективность и целесообразность смены схемы лечения. При этом, стабильно низкий уровень маркера СА-62 может предполагать хороший ответ опухоли на лечение, а при его повышении -вероятность прогрессирования.
Анализ полученных данных позволяет сделать вывод о том, что экспрессия маркера СА-62 хорошо коррелирует с ответом роста опухоли на проводимое лечение. Динамика маркера СА-62 может служить индикатором ингибирования или роста опухоли, оценки проводимого лечения или выявления резистентности к избранному курсу химиотерапии, что в будущем может успешно использоваться в клинической практике для мониторинга злокачественных новообразований ЖК тракта, яичников, легкого и нейроэндокринных опухолей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
1. Фигура 1
Фигура 1 демонстрирует характеристические кривые ROC для трех маркеров СЕА, СА-15-3, и СА-62, когда здоровые контрольные образцы сравнивались с образцами пациентов, имеющих аденокарциному молочной железы (РМЖ).
2. Фигура 2
Фигура 2 изображает распределение с использованием маркера СА-62 контрольных образцов РМЖ, здоровых контролей и образцов с доброкачественными заболеваниями.
3. Фигура 3
Фигура 3 показывает характеристические ROC кривые раковых антигенов СА-62 и СА-125 для всех стадий рака яичников.
4. Фигура 4
Фигура 4 показывает сравнение характеристических кривых для исследованной рабочей панели образцов рака предстательной железы РПЖ с использованием сывороточных маркеров СА-62 и ПСА.
5. Фигура 5
Фигур5 изображает корреляцию уровня маркера СА-62 с ответом опухоли на лечение в соответствии с критериями RECIST.
Список используемой литературы:
1. Battista R.N., Grover S.A. Early detection of Cancer: an overview. Ann Rev. 1988, V. 9, p. 31-45
2. Malati T. Tumour markers: An overview. Indian Journal of Clinical Biochemistry 2007, V. 22, Issue 2, pp 17-31.
3. Чигирева И.Б., Хасанов Р.Ш., Гилязутдинов И.А., Панненко С.В., Шакиров К.Т. Ранняя диагностика рака предстательной железы.
4. Humphrey PA. The role of tumor markers in the early detection of cancer. Semin Surg Oncol. 1989; 5(3):186-93.
5. Danni L. Meany, Lori J. Sokoll, and Daniel W. Chan. Early Detection of Cancer: Immunoassays for Plasma Tumor Markers. Expert Opin Med Diagn. 2009 Nov 1; 3(6):597-605.
6. Marella S. Prognostic and Predictive Markers in Early Detection of Different Types of Cancers for Selected Organ Sites IOSR Journal of Pharmacy and Biological Sciences (IOSR-JPBS) 2013, Volume 8, Issue 4, PP 25-42
7. Helfand BT1, Conran CA, Xu, Catalona J.A multiparametric approach to improve upon existing prostate cancer screening and biopsy recommendations. WJ. Curr Opin Urol. 2017 Jun 12. doi: 10.1097/MOU.0000000000000418
8. Dani H, Loeb S. The role of prostate cancer biomarkers in undiagnosed men. Curr Opin Urol. 2017, 27(3):210-216.
9. Ankerst DP1, Thompson IM. Sensitivity and specificity of prostate-specific antigen for prostate cancer detection with high rates of biopsy verification. Arch Ital Urol Androl. 2006 Dec; 78(4):125-9.
10. Stavridis S., Saidi S., Lekovski Lj, Dohcev S., and Spasovski G. Screening for prostate cancer: a controversy or fact. Hippokratia. 2010 Jul-Sep; 14(3):170-175.
11. Kristiansen S,  L.M., Hansen M.H., Nielsen D., and
L.M., Hansen M.H., Nielsen D., and  G. Concordance of Hypermethylated DNA and the Tumor Markers CA 15-3, CEA, and TPA in Serum during Monitoring of Patients with Advanced Breast Cancer. Biomed Res Int. 2015; 2015: 986024.
G. Concordance of Hypermethylated DNA and the Tumor Markers CA 15-3, CEA, and TPA in Serum during Monitoring of Patients with Advanced Breast Cancer. Biomed Res Int. 2015; 2015: 986024.
12. A.M. Sofie Berghuis, Hendrik Koffijberg, 1 Jai Prakash, 2 Leon W. M. M. Terstappen, 3 and Maarten J. IJzerman 1 Danian Dai Detecting Blood-Based Biomarkers in Metastatic Breast Cancer: A Systematic Review of Their Current Status and Clinical Utility. Int J Mol Sci. 2017 Feb; 18(2): 363.
13. Havrilesky et al. Evaluation of biomarker panels for early stage ovarian cancer detection and monitoring for disease recurrence. Gyn. Oncol. 2008, 110,3, 374-382.
14. Сергеева H.C., Маршутина H.B. Опухолеассоциированные маркеры в скрининговых программах, направленных на активное выявление рака яичников: реальность, проблемы и перспективы. Практическая онкология, 2010, т. 11, №2, с. 110-119.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ РАКОВЫЙ АНТИГЕН ДЛЯ РАННЕГО ВЫЯВЛЕНИЯ РАКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ДЕТЕКЦИИ | 2020 |
|
RU2818471C2 |
| Способ идентификации биологических маркеров, обнаруживаемых в биологических материалах человека в связи с возможным наличием патологических состояний организма человека, в том числе онкологических заболеваний, осуществляемый путем мультиплексного иммуноферментного сэндвич-иммуноанализа | 2021 |
|
RU2779104C1 |
| ДЕТЕКТИРОВАНИЕ РАКА ЯИЧНИКА ПО ПОВЫШЕННЫМ УРОВНЯМ BCL-2 В МОЧЕ | 2007 |
|
RU2436098C2 |
| АУТОИММУННАЯ РЕГУЛЯЦИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ АННЕКСИНОМ А3 | 2008 |
|
RU2484482C2 |
| СИСТЕМЫ И СПОСОБЫ УЛУЧШЕНИЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ ИЗМЕРЯЕМЫХ АНАЛИТОВ | 2018 |
|
RU2782359C2 |
| Способ прогнозирования перитонеального распространения рака яичников | 2019 |
|
RU2722654C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2547583C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ДЕТЕКТИРОВАНИЯ ЗЛОКАЧЕСТВЕННОГО НЕОПЛАСТИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2015 |
|
RU2678135C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ОПУХОЛЕЙ ЯИЧНИКОВ | 2007 |
|
RU2334986C1 |
| СПОСОБ ОБНАРУЖЕНИЯ СОЛИДНОЙ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2015 |
|
RU2720148C2 |

Изобретение относится к области медицины, в частности к лабораторной диагностике онкологических заболеваний, и представляет собой набор реагентов для выявления маркера эпителиальных карцином СА-62 в сыворотке крови пациентов для ранней диагностики рака, выявления рецидивов и мониторинга лечения эпителиальных опухолей человека методом иммунохимического анализа, обладающего более высокой чувствительностью и специфичностью, отличной от всех имеющихся в настоящее время сывороточных маркеров, и включающий в себя планшет с иммобилизованными антителами к раковому антигену СА-62, представляющими собой моноклональные антитела класса IgM, направленные против N-гликозидного эпитопа гликопротеина СА-62, конъюгат «СА-62-Акридин», стандартные калибраторы СА-62 в диапазоне измерений от 10 до 30000 Ед/мл, включающий или не включающий положительный контроль СА-62, рабочий буферный раствор, рН от 2,0 до 8,0, содержащий Твин-80. Изобретение обеспечивает создание обладающего высокой чувствительностью и специфичностью набора реагентов для ранней диагностики рака, выявления рецидивов опухоли и мониторинга лечения эпителиальных опухолей человека методом иммунохимического анализа. 9 табл., 4 пр., 5 ил.
Набор реагентов для выявления маркера эпителиальных карцином СА-62 в сыворотке крови пациентов для ранней диагностики рака, выявления рецидивов и мониторинга лечения эпителиальных опухолей человека методом иммунохимического анализа, обладающего более высокой чувствительностью и специфичностью, отличной от всех имеющихся в настоящее время сывороточных маркеров, и включающий в себя планшет с иммобилизованными антителами к раковому антигену СА-62, представляющими собой моноклональные антитела класса IgM, направленные против N-гликозидного эпитопа гликопротеина СА-62, конъюгат «СА-62-Акридин», стандартные калибраторы СА-62 в диапазоне измерений от 10 до 30000 Ед/мл, включающий или не включающий положительный контроль СА-62, рабочий буферный раствор, рН от 2,0 до 8,0, содержащий Твин-80.
| КОМЛЕВА Е.О | |||
| Молекулярные и генетические маркеры опухолевого роста | |||
| СПб ГУЗ "Городской клинический онкологический диспансер" | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| - С | |||
| Раздвижной паровозный золотник с подвижными по его скалке поршнями между упорными шайбами | 1922 |
|
SU148A1 |
| СУХАРЕВ А.Е и др | |||
| Плуг с фрезерным барабаном для рыхления пласта | 1922 |
|
SU125A1 |
| Астрахани // Международный журнал прикладных и фундаментальных исследований | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| ТАИПОВ М.А | |||
| и др | |||
| Протеомные | |||
Авторы
Даты
2020-11-10—Публикация
2018-06-07—Подача