Область техники.
Изобретение относится к области биотехнологии и биофармакологии, а именно к технологии получения моноклональных антител (МКА) методами клеточной гибридизации, точнее к методам получения МКА, специфичных к протеину С человека (hPROC), с использованием штаммов гибридных культивируемых клеток Mus musculus и создания на основе этих МКА иммуноаффинных реагентов для количественного определения протеина С человека в кондиционированной культуральной жидкости линий-продуцентов рекомбинантного протеина С (rhPROC) и в других растворах, в том числе в плазме крови.
Предшествующий уровень техники.
Протеин С является витамин К-зависимым белком плазмы крови. Он входит в систему гемостаза и играет исключительно важную роль при регулировании свертывания крови. Протеин С синтезируется в виде неактивной молекулы предшественника, проходит многостадийный посттрансляционный процессинг в клеточных компартментах и секретируется в виде интактной (зимогенной) формы. Активация протеина С происходит в кровотоке при участии тромбомодулин-тромбинового комплекса. Активированный протеин С вместе с кофактором - протеином S выполняет антикоагулянтную функцию. Активированный протеин С может предотвращать внутрисосудистый тромбоз и подавлять рост имеющихся тромбов. Механизм действия активированного протеина С и механизм активации зимогена в активную протеазу изложен в работе Esmon Т. Charles ("Protein-C: biochemistry, physiology, and clinical implications" Blood, 1984, Vol.62(6) - P.1155-8).
Активация протеина С непосредственно осуществляется тромбином, последней сериновой протеиназой каскада свертывания крови и опосредована связанным с мембраной эндотелиальных клеток гликопротеином тромбомодулин. Тромбомодулин образует прочный нековалентный комплекс состава 1:1 с тромбином и полностью меняет функциональные свойства тромбина. Свободный тромбин в нормальных условиях активирует тромбоциты, конвертирует фибриноген до фибрина и факторы свертывания крови V и VIII до активных формы Va и VIIIa. В то же время тромбин в комплексе с тромбомодулином теряет все вышеуказанные свойства, но эффективно активирует интактный протеин С при физиологических концентрациях ионов кальция.
Активированный протеин C, в свою очередь, избирательно инактивирует активированные формы факторов свертываемости крови V и VIII, но не их исходные формы.
Следует отметить, что основные события при запуске каскада свертывания крови происходят на поверхности клеток и требуют участия мембранно-связанных белков и фосфолипидов, в то время как факторы V и VIII свободно циркулируют в кровотоке и участвуют в петле положительной обратной связи при работе системы свертывания. При их активации тромбином они ускоряют активацию фактора X и протромбина на 5 порядков и резко ускоряют генерацию тромбина в месте запуска каскада свертывания.
Таким образом, физиологическая роль активированного протеина С может быть описана как ограничение области запуска системы свертывания крови.
Основным кофактором активированного протеина С является протеин S, другой витамин K - зависимый белок плазмы крови. Протеин S более чем в 10 раз усиливает вызываемую активированным протеином C деградацию факторов Va и VIIIa.
Протеин С является важным терапевтическим агентом (EP 215549, EP 0191606) в качестве специфического антикоагулянта, имеющего потенциально более широкую область применения, чем традиционные антикоагулянты гепарин, варфарин (оксикумарин) или производные последнего. В отличие от традиционных антикоагулянтов активированный или интактный протеин С не воздействует на систему свертывания крови до момента появления тромбина и не вызывает падения концентрации зимогенных белков системы свертывания. Вследствие этого антикоагулянтная терапия протеином С потенциально является более безопасной, поскольку не вызывает постоянного риска возникновения кровотечений. Экзогенный интактный протеин С также может использоваться для заместительной терапии при наследственном дефиците протеина С, вызывающего смерть в младенческом возрасте при гомозиготном дефиците и частые тромбоэмболические состояния при гетерозиготной форме дефицита.
Основной областью клинического применения активированного протеина С являются опасные для жизни тромботические состояния, в первую очередь синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), возникающий в том числе при развитии острого сепсиса.
Активированный протеин С является маркером сепсиса, а его уровень и дефицит коррелируют с тяжестью течения заболевания. Так, дефицит протеина С наблюдается более чем у 85% больных с тяжелым сепсисом; а также дефицит протеина С коррелирует с неблагоприятными клиническими исходами, такими как септический шок (тяжелый сепсис, сопровождающийся развитием артериальной гипотонии), ДВС-синдромом и полиогранной недостаточностью.
Поскольку концентрация протеина C в плазме крови очень мала и его отделение от других витамин K-зависимых белков системы гемостаза представляется весьма затруднительным, единственным способом получения активированного протеина C для медицинского применения является биосинтез, активация и очистка рекомбинантного белка. Создание аналитических систем для количественного определения протеина С является важным элементом как промышленных решений этой задачи для биотехнологического производства, так и для клинического применения получаемых фармпрепаратов протеина C и сопутствующей диагностики коагулопатий. Одним из важных методов определения природного или рекомбинантного протеина C в биомедицинских приложениях является использование МКА, продуцируемых гибридомами, отобранных таким образом, что секретируемые иммуноглобулины не кросс-реактивны.
Известно применение моноклональных антител к фактору протеину C, описанное в патенте США 5549893 (Johann Eibl et al; "Use of protein С in the treatment of purpura fulminans"; 1995), при этом патент защищает терапевтическое применение активированного и интактного протеина С природного происхождения.
Применение конформацинно-зависимых антител для очистки и активации протеина С является объектом защиты в патенте США 4981952 (Betty Yan S.; "Method for the purification of vitamin K-dependent proteins", 1989), однако применяемое технологическое решение основано на серии последовательных раундов хроматографической очистки протеина С, где основой иммуноаффинного сорбента являются МКА, аффинность которых блокируется ионами кальция, что оставляет значительный потенциал для оптимизации технологического процесса. Известно применение конформационно-зависимых антител для анализа биологической активности и разделения модифицированных форм протеина С. Для таких целей могут быть использованы антитела хелатор-зависимой аффинности (патент США 5549893; Ohsawa K. et al. Purification of sufficiently gamma-carboxylated recombinant protein С and its derivatives. Calcium-dependent affinity shift in immunoaffinity and ion-exchange chromatography. // J Chromatography - 1992 - Vol.597(l-2) P.285-91) и кальцийзависимой аффинности (Stearns D.J. et al. The interaction of a Ca2+-dependent monoclonal antibody with the protein С activation peptide region. Evidence for obligatory Ca2+binding to both antigen and antibody. // Biol Chem- 1988 - Vol.263(2) P.826-32; Nakamura S., Sakata Y. Immunoaffinity purification of protein С by using conformation-specific monoclonal antibodies to protein C-calcium ion complex. // Biochim Biophys Acta. Biochim Biophys Acta - 1987 - Vol.925(2) P.85-93; Wakabayashi K. Conformation-specific monoclonal antibodies to the calcium-induced structure of protein C. // J Biol Chem - 1986 - Vol.261(24) P.11097-105; Tharakan J.P. Effect of feed flow rate, antigen concentration and antibody density on immunoaffinity purification of coagulation factor IX. // J Chromatography - 1990 - Vol.522 - P.153-62).
Моноклональные антитела, продуцируемые гибридомами, также используются как инструмент для получения деплетированной по протеину С плазмы человека, используемой в качестве реактива для коагулометрической диагностики. Дефицит соответствующей природной плазмы обусловлен чрезвычайной редкостью врожденных генетических коагулопатий типа PROC-, встречающихся в 1 случае из миллиона.
Существует широкий спектр возможностей для дальнейшего усовершенствования известных решений по количественному определению протеина C человека и его рекомбинантных вариантов. Возможность такого усовершенствования обусловлена тем, что при отборе клонов гибридом, продуцирующих различные МКА к протеину C, можно учитывать влияние различных факторов на ход определения протеина C и проводить отбор клонов по чувствительности или резистентности к действию этих факторов. Примерами таких факторов может быть присутствие в анализируемой смеси других витамин К-зависимых белков плазмы, протеина C крупного рогатого скота, разное соотношение интактной и активированной формы протеина C, доля протеина C в комплексе с протеином S, концентрация продуктов инактивации активированного протеина C и т.д.
Подробное описание настоящего изобретения
Технической задачей, решаемой авторами, являлось получение высокоаффинных не кросс-реактивных антител к протеину C человека, применимых для фармацевтических и биомедицинских аналитических исследований, в частности количественного обнаружения рекомбинантного фактора C человека (rhPROC).
Технический результат достигался путем создания новых штаммов гибридных культивируемых клеток Sp2/0-BC/rhPC-4F10, Sp2/0-BC/rhPC-lC6, Sp2/0-BC/rhPC-3H6, секретирующих моноклональные антитела к протеину С человека и создания на их основе иммуноаффинных реагентов для количественного анализа протеина С человека (hPROC) и его рекомбинантных вариантов (rhAPC). Полученные штаммы депонированы во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ), ФГУП ГосНИИГенетика 17 сентября 2010 г. под регистрационными номерами H-110, H-111 и H-112, соответственно.
Основным методическим подходом к созданию штаммов клеточных линий, продуцирующих моноклональные антитела, является клонирование гибридных культивируемых клеток - гибридом. Гибридомы согласно настоящему изобретению получают слиянием несекретирующих клеток миеломы мыши (Mus musculus) и антителпродуцирующих В-лимфоцитов в присутствии полиэтиленгликоля. Клетки миеломы дефицитны по гипоксантин-гуанин фосфорибозилтрансферазе (HGPRT) или тимидинкиназе (ТК). Таким образом, они не могут выжить при культивации в среде, содержащей HAT (гипоксантин, аминоптерин и тимидин). В то же время, любые не слитые В-лимфоциты селезенки сами по себе не стабильны в культуре более 3 дней. Часть гибридных клеток B-лимфоцитов и миеломы, получивших соответствующие хромосомы родительских клеток, обладает стабильностью в селективной среде, содержащей HAT. Такие клетки могут культивироваться продолжительное время и продуцировать потенциально неограниченное количество антител.
Супернатанты культуры гибридом анализируются на наличие целевых антител методом твердофазного иммуноферментного анализа (ИФА, ELISA). Затем отобранные гибридомы клонируются для того, чтобы получить субклоны, продуцирующие антитела, не обладающие кросс-реактивностью в аналитических тестах. Для этого применяется непрямой ИФА таким образом, что каждое из отобранных антител попарно сравнивается другими как в качестве адсорбированного на поверхности иммунопланшета, так и связывающегося из раствора с антигеном, уже связавшимся с другими адсорбированными антителами. Отобранные продуценты моноклональных антитела могут быть масштабированы in vivo в виде асцита мыши или in vitro в суспензионной культуре (Pepper S.D. Selection antibodies for immunoaffinity chromatography // Methods in molecular biology ed. by Kenney A. and Fowell S. - 1992 - Vol.11 - P.136-171).
Термин «моноклональное антитело» означает антитело, искусственно получаемое из клеточного клона и поэтому содержащее только один тип иммуноглобулина.
Антитело, специфичное к белку "протеин C человека", означает молекулу, которая селективно, избирательно связывается с протеином C человека и образует стабильный комплекс. Стабильным комплексом является комплекс, в котором связывание между партнерами происходит на период времени, достаточный для того, чтобы произвести детектирование указанного комплекса. Термин "селективно связывается с протеином C человека" означает способность указанной молекулы предпочтительно связываться с протеином C человека в отличие от связывания с белками, не имеющими отношения к протеину C человека, или связывания с небелковыми компонентами, присутствующими в образце. Антителом, которое предпочтительно связывается с протеином C человека, является антитело, которое связывается с протеином C человека, но не связывается в существенной степени с другими молекулами или компонентами, которые могут присутствовать в образце. Существенное связывание предполагает, например, связывание антитела, связывающегося с ротеином C человека, с молекулой, не являющейся протеином C человека, с аффиностью или силой, достаточной для того, чтобы помешать способности антитела, связывающегося с протеином C человека.
Способность антитела к связыванию с антигеном может быть определена специалистом в данной области с использованием методов, включающих, но не ограничивающихся методами ELISA и равновесного диализа. Методы определения аффинности и силы связывания хорошо известны специалисту в данной области техники и подробно описаны, например, Janeway и др. (Immunobiology: The Immune System in Health and Disease (Garland Publishing Company, 1996)).
Методика иммунизации. Штаммы гибридомы получают путем иммунизации мышей линии BALB/c рекомбинантным протеином C человека в течение 49 суток. На третьи сутки после последней бустер-инъекции проводят гибридизацию спленоцитов иммуннизированных мышей (1.2×108 клеток) с клетками мышиной миеломы Sp2/0-Agl4 (3×107 клеток). В качестве агента для слияния применяют полиэтиленгликоль с молекулярным весом 1450 (Sigma, Германия). После гибридизации проводят селекцию, скрининг, клонирование и криоконсервацию гибридомы.
Морфологическая характеристика полученных штаммов гибридомы. Культура гибридных клеток состоит из слабоприкрепленных к подложке округлых клеток с размером с исходную миеломную клетку.
Культуральные свойства. Культивирование штаммов гибридом Sp2/0-BC/rhPC-4F10, Sp2/0-BC/rhPC-3H6 и Sp2/0-BC/rhPC-lC6 ведут раздельно, не допуская кросс-контаминации, при температуре 37°C в атмосфере, содержащей 5% углекислого газа. Средой культивирования является среда RPMI-1640, содержащая 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 8 мкг/мл тилозина. Клетки культивируют в виде стационарной суспензии в вентилируемых пластиковых флаконах с адгезионной поверхностью площадью 25 см2 и рабочим объемом среды 5-10 мл. Пассирование клеток гибридомы проводят 3 раза в неделю с кратностью разведения 1:4-1:6. Посевная концентрация клеток составляет 3×105 в 1 мл среды. Максимальная концентрация гибридных клеток при культивировании составляет 1,2×106 на 1 мл среды. Гибридный клон не теряет способности синтеза антител при 12 последовательных пассажах in vitro.
Культивирование гибридомы в организме животного. Вид животного - инбредные мыши линии BALB/c. Доза клеток при прививке составляет 2×106 клеток в 0,5 мл фосфатно-солевого буферного раствора на одну мышь при первичном введении. За 1 сутки до введения клеток гибридомы мышам внутрибрюшинно вводят 1 мл неполного адъюванта Фрейнда.
Иммуноасцитическая жидкость образуется на 12-16 сутки в объеме 3-5 мл. Количественное определение иммуноглобулина, продуцируемого гибридомой, производят методом непрямого иммуноферментного анализа (ИФА).
Характеристика полезного продукта. Гибридомы Sp2/0-BC/rhPC-4F10, Sp2/0-BC/rhPC-3H6 и Sp2/0-BC/rhPC-lC6 продуцируют специфичные моноклональные антитела к hPROC, титр которых составляет в культуральной жидкости (КЖ) около 1:90000, в иммуноасцитической жидкости (ИАЖ) не менее 1:200000. Моноклональные антитела из КЖ и ИАЖ выделяют с помощью дробного осаждения сульфатом аммония с последующей аффинной хроматографией на протеин A- или протеин G-сефарозе. Гомогенность выделенных антител проверяется с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Принадлежность к классу иммуноглобулинов G определяется по иммуноферментному анализу класс-специфическими антивидовыми антителами.
Продуктивность штаммов. Продукция МКА в среде культивирования составляет 20-50 мкг/мл при времени культивирования 72 ч и посевной концентрации гибридомы 0,3 млн кл/мл; в асцитической жидкости - 2-4 мг/мл. Продукция МКА в культуральной жидкости сохраняется на протяжении 12 последовательных пассажей и воспроизводится при прививании в виде асцитных опухолей на мышах.
Контаминация штамма. Контаминанты гибридных линий, включая бактерии и грибы (определение методом прямого посева на питательные среды LB и Сабуро-Эммонса), не обнаружены; микоплазма по ПЦР и флуоресцентному анализу не обнаружена; вирусы - нет данных.
Криоконсервация производится аликвотами ресуспендированных клеток по 3×106 клеток/мл. Ампулы содержат 1,0 мл криозащитной среды, содержащей эмбриональной телячьей сыворотки - 90%, диметилсульфоксида - 10%.
Режим криоконсервации и отогрева. Гибридные клетки вносят в криоампулы, помещают в специальный контейнер с теплоносителем изопенталом и оставляют в низкотемпературном морозильнике на 3-4 часа. По достижении температуры минус 70°C криоампулы переносят в жидкий азот. Размораживание проводят быстро на водяной бане при температуре +37°C. Жизнеспособность восстанавливаемых гибридом после криоконсервации составляет 80-90%.
Полезным продуктом являются штаммы гибридом и продуцируемые ими моноклональные антитела, относящиеся к классу IgG иммуноглобулинов мыши, специфичные к hPROC и обладающие низкой кросс-реактивностью. Особенности полученных моноклональных антител (МКА) и результаты их практического применения изобретения приведены на следующих фигурах.
Краткое описание рисунков
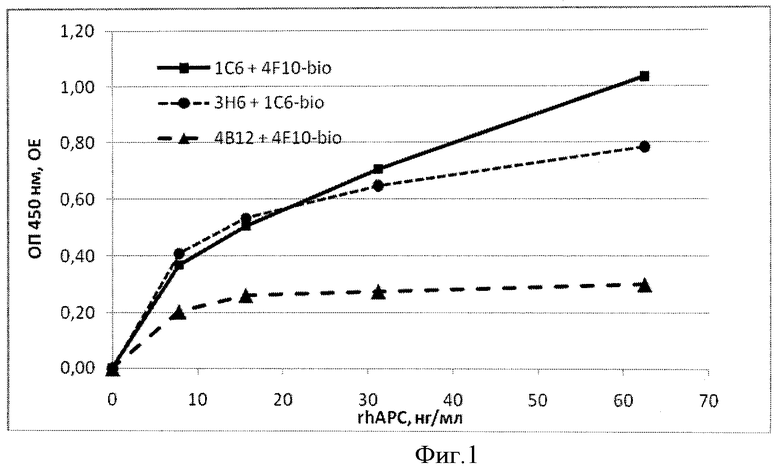
На Фиг.1 показано определение rhAPC твердофазным ИФА с использованием пар МКА 3H6 + IC6 и 4B12 + 4F10.
Практическая применимость заявляемого изобретения иллюстрируется следующими примерами, не ограничивающими каким-либо образом рамки настоящего изобретения.
Пример 1. Получение гибридомы.
Иммунизация.
Мышей линии BALB/c возраста 8-10 недель в количестве 8 штук иммунизируют rhAPC по схеме:
- внутрибрюшинное введение мышам 200 мкг rhAPC в полном адъюванте Фрейнда;
- через 21 сутки повторное введение мышам 500 мкг rhAPC в неполном адъюванте Фрейнда;
- через 35 суток внутривенная инъекция мышам 500 мкг rhAPC в неполном адъюванте Фрейнда;
- через 42 суток отбор образцов крови из орбитального синуса, определение животных с наилучшим титром антител к протеину C в сыворотке по ИФА;
- выбранным животным еще через 7 суток производится бустерная внутривенная инъекция 200 мкг rhAPC в физиологическом растворе;
- через 7 суток содержания бустированных мышей производится повторный отбор образцов крови из орбитального синуса на ИФА. Производится финальное бустирование животного с максимальным титром антител к rhAPC: внутривенная инъекция 200 мкг rhAPC в физиологическом растворе.
Через 3 дня после повторного бустирования производится сравнение титров поликлональных антител в сыворотке бустированных животных. Титры, то есть разведения сыворотки, при которых OD450=l составили для бустированного животного №1 1/82500, №2 1/19000, №3 1/615000. Для слияния первичной культуры спленоцитов с клетками миеломы Sp2/0-Agl4 выбрали животное №3.
Гибридизация.
Через 3 суток после последней внутривенной инъекции животных убивают цервикальной дислокацией, асептически извлекают селезенку и проводят гибридизацию спленоцитов иммунных мышей (1.2×108 клеток) с клетками мышиной миеломы Sp2/0-Agl4 (3×107 клеток) в присутствии 1 мл 50% раствора полиэтиленгликоля (Sigma) с молекулярным весом 1450 в течение 1 минуты. Затем в течение 15 минут последовательными двойными разведениями доводят объем до 16 мл, добавляя по каплям безсывороточную среду RPMI-1640. Разведенную гибридизационную суспензию инкубируют 1 час при 37°C в 150 мл полной среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки.
Селекция.
После инкубации клетки высевают на 96-луночные планшеты на слой культивируемых перитонеальных макрофагов, взятых у мышей линии BALB/c. Селекцию гибридных клеток проводят на селективной в среде с системой HAT (10 мМ гипоксантина, 40 мкМ аминоптерина, 1,6 мМ тимидина). Через 14 суток из состава среды убирают аминоптерин. В последующем культивирование проводят на среде A-DMEM/F-12 с 10% эмбриональной телячьей сыворотки, 2 мМ/L-глутамина, 8 мкг/мл тилозина.
Оценка продуктивности первичных пулов.
Для отбора положительных первичных пулов, продуцирующих МКА, используют прямой ИФА. Для проведения ИФА в лунки 96-луночного полистиролового планшета для ИФА вносят по 100 нг rhAPC в фосфатно-солевом буферном растворе (ФБР; рН=7.4; КН2РO4 1,7 мМ, Na2HPO4 5,2 мМ, NaCl 150 мМ) в объеме 100 мкл и затем выдерживают при температуре 6°C в течение 16 ч. Лунки планшета трижды отмывают фосфатно-солевым буферным раствором, содержащим 0,05% Твин-20 (ФБР-Тв). Вносят в лунки по 300 мкл 1% раствора бычьего сывороточного альбумина в ФБР (1% БСА) и инкубируют при температуре 37°C в течение 60 мин. Три раза промывают лунки ФБР-Тв и вносят в лунки супернатант культуральной жидкости в объеме 100 мкл, при необходимости делая разведения в 1% БСА. Планшет инкубируют при температуре 37°C в течение 1 часа. После этого лунки планшета трижды отмывают раствором ФБР-Тв и добавляют в лунки антитела против иммуноглобулинов мыши, меченные пероксидазой хрена в рабочем разведении 1/3500. Планшет инкубируют при температуре 37°C в течение 60 минут, затем 5 раз отмывают лунки раствором ФБР-Тв. Положительную реакцию оценивают по развитию желто-коричневого окрашивания при добавлении хромогенного субстрата ТМБ (4 мкл 30% Н2O2, 4 мг 3,3',5,5-тетраметилбензидина на 100 мл 0,1 M натрий-цитратного буфера рН 5,0). Реакцию останавливают добавлением в лунки по 100 мкл 5% раствора Н3РO4. Измеряют оптическую плотность при длине волны λ=450 нм (OD450). Строят калибровочную кривую зависимости OD450 от концентрации заранее охарактеризованных антител к hPROC в диапазоне линейной чувствительности метода. Определяют титр исследуемых антител и аффинность проб.
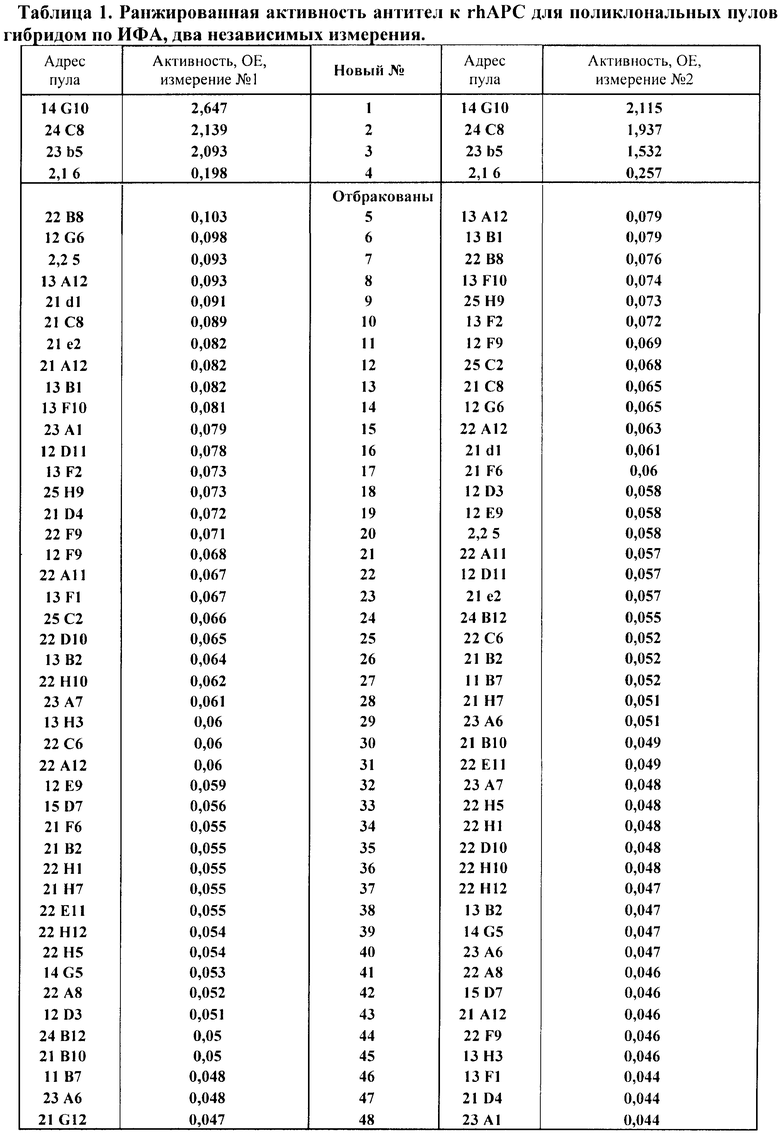
По результатам прямого ИФА первичных пулов гибридом максимальный сигнал поликлональной колонии в ИФА составил OD450=3,304, 6 образцов имели сигнал OD450>2.0, при этом верхний 5% процентиль покрывал диапазон активности OD450=3,304-0,150. Для масштабирования было отобрано 48 колоний (т.е. лунок) с сигналом на ИФА OD450>0,100.
Отобранные для масштабирования 48 поликлональных пулов в течение следующих 10 дней были масштабированы до культивационного объема 5 мл. Масштабированные до культивационного объема 5 мл колонии были тестированы на производство поликлональных антител к протеину C в двух последовательных тестах прямого ИФА с интервалом в 48 часов. Результаты представлены в Таблице 1.
Для дальнейшего клонирования были отобраны 4 первичных клона с максимальным сигналом на ИФА (OD450 от 0,257 до 2,265).
Пример 2. Клонирование и селекция, моноклональных гибридом секретирующих протеин C специфичные антитела.
Клонирование гибридных клеток проводили методом серийных разведений в 96-луночных планшетах на слое перитонеальных макрофагов из расчета 104 клеток на первую лунку и последующих двукратных разведений в вертикальном ряду, а затем в горизонтальных рядах. Детекцию МКА в лунках проводили прямым ИФА, как описано выше.
Культивирование клонов гибридомы вели при температуре 37°C в атмосфере, содержащей 5% углекислого газа. Средой культивирования является среда RPMI-1640, содержащая 10% эмбриональной телячьей сыворотки, 2 мМ/L-глутамина, 8 мкг/мл тилозина.
Клоны гибридомы криоконсервировали в среде замораживания, состоящей из 90% эмбриональной телячьей сыворотки и 10% диметилсульфоксида по 1-3 млн клеток/мл. Процедура замораживания описана выше.
Отобранные по методике, описанной в примере 1, клеточные пулы с максимальным уровнем продукции антител были клонированы в предельных разведениях, было использовано по пять 96-луночных планшетов на 1 пул. Через 8 дней было обнаружено суммарно 23 лунки с одиночными колониями. Колонии были суспендированы пипетированием и пересажены в лунки 24-луночного планшета в культивационном объеме 1 мл/лунка.
Через 7 дней после пересева было зафиксировано 7 лунок, для которых сигнал в прямом ИФА превышал OD450=1 и сохранялся при последующей культивации колоний в среде, содержащей HAT. Результаты ИФА первичных клонов приведены в таблице 2.
Отобранные первичные клоны были масштабированы до объема 5 мл, часть клеток заморожена, остатки использованы для повторного клонирования, рассев проведен на 5 96-луночных планшетов для каждого клона.
Через 8 дней после повторного клонирования было обнаружено суммарно 12 лунок с одиночными колониями. В последующие 14 дней было проведено ступенчатое масштабирование до культивационного объема 10 мл и определено 7 жизнеспособных клонов.
Через 24 дня после второго клонирования было проведен прямой ИФА в присутствии ионов кальция и параллельный ИФА в присутствии ЭДТА для супернатантов клонов с временем культивирования 48 часов. Были зафиксированы 5 клонов второй генерации, продуцирующие МКА к протеину С человека с высоким титром и постоянным сигналом в присутствии и отсутствии ионов кальция (сигнал для ИФА с 2 мМ Са2+ OD450=2.165-1.571, сигнал с 2 мМ EDTA-Na >88%). Результаты ИФА представлены в таблице 3.
Масштабированные клоны гибридом второй генерации были криопрезервированы, выживаемость после разморозки составила не менее 60% по окраске трипановым синим.
Для выделения МКА с каждого конечного клона второй генерации было получено по 30 мл кондиционированной среды.
Пример 3. Выделение, очистка и биотинилирование МКА.
Для исследуемых 5 МКА проводили отделение глобулиновой фракции, аффинную хроматографическую очистку при помощи протеин G-сефарозы и обессоливание диализом. Для этого культуральную жидкость (48 ч культивирования) смешивали с насыщенным раствором сульфата аммония до 45% насыщения. Суспензию перемешивали и выдерживали 2 ч при температуре 4°C, а затем центрифугировали при 14500 м-1 в течение 20 мин. Удаляли супернатант, осадок растворяли в ФБР, 1/8 начального объема, отделяли осадок денатурированных белков повторным центрифугированием. Полученный супернатант повторно осаждали сульфатом аммония при насыщении 50%, осаждение-растворение повторяли дважды.
Хроматографическую очистку проводили при помощи колонки с протеин G-сефарозой (GE Life Sciences, США) по протоколу производителя. Для удаления аминосодержащих соединений нейтрализованный элюат с колонки концентрировали при помощи ультрафильтрации в центрифужных пробирках Vivaspin 500 3 кДа (Сарториус Стедим, Германия) до объема 75 мкл, концентраты диализовали против ФБР на мембране с отсечением по седиментационной массе 7000 Да в течение 24 ч при температуре 4°C. Было приготовлено 5 препаратов очищенных МКА, концентрация белка в растворах составила для МКА из Sp2/0-BC/rhPC-4F10 370 мкг/мл, Sp2/0-BC/rhPC-lC6 250 мкг/мл, Sp2/0-BC/rhPC-2F8 77 мкг/мл, Sp2/0-BC/rhPC-3H6 93 мкг/мл, Sp2/0-BC/rhPC-4B 12 239 мкг/мл, объем образцов 75 мкл. Степень концентрирования относительно исходной среды составила 400х.
Полученные растворы очищенных МКА были разделены на 2 аликвоты объемами 20 мкл и 55 мкл. Меньшая аликвота была использована для модификации сульфо-N-гидроксисукцинимидбиотином (Sulfo NHS-LC-biotin, Пирс, США) в молярном соотношении 1:100 в ФБР при рН 7.0. Реакцию проводили в течение 1 часа при комнатной температуре, а затем терминировали добавлением раствора Трис-HCl рН 7.5 до 50 мМ.
Для определения сохранности аффинности МКА при выделении и конъюгации сравнивали образцы исходных кондиционированных сред в разведении 1/400, полученные препараты очищенных МКА в разведении 1/16000 (т.е. предположительно в одинаковой концентрации) и биотинилированные МКА в разведении 1/160000. Тестирование проводилось методом прямого ИФА по методике, приведенной в примере 1 с использованием конъюгата антивидовых антител с пероксидазой хрена (антимышь - ПХ) и конъюгата нейтравидина и пероксидазы хрена (Neu-ПХ, Pierce, США). Результаты представлены в таблице 4. По полученным данным был сделан вывод о том, что биотинилированные МКА применимы в качестве элемента аналитической системы только для клонов гибридом 4F10 и 1С6, при этом в качестве адсорбционных антител можно использовать МКА гибридом 1С6, 3H6 и 4B12. Полные названия соответствующих клонов гибридом: Sp2/0-BC/rhPC-4F10 и т.д.
Таким образом, возможный набор аналитических реагентов на основе полученных МКА к протеину C включает в себя биотинилированные МКА в качестве детекционного реагента и немодифицированные очищенные антитела для адсорбции антигена в непрямом тИФА анализе.
Пример 4. Определение чувствительности системы детекции протеина C на основе пар МКА.
Определение чувствительности прототипов системы детекции протеина C, то есть пар МКА, проводили при помощи непрямого ИФА по схеме "сендвич". Для этого в лунки 96-луночного полистиролового планшета для иммуноферментного анализа наносили "адсорбционные" антитела в ФБР в концентрации 4 мкг/мл, по 100 мкл на лунку и выдерживали при температуре 4°C в течение 16 часов. Затем, после блокировки неспецифической адсорбции раствором 1% БСА в ФБР в течение 1 ч, в лунки вносили по 100 мкл раствора рекомбинантного активированного протеина С в 1% БСА в концентрации от 78 нг/мл до 10 мкг/мл, двукратными разведениями (нормальная концентрация протеина C в плазме крови человека - 4 мкг/мл). Последующие стадии анализа проводили аналогично стадиям, описанным для скрининга клонов гибридом. Биотинилированные МКА использовали в разведении 1/1000, Neu-ПХ в разведении 1/8000. В качестве отрицательного контроля вместо биотинилированных МКА использовали сыворотку интактной мыши в разведении 1/1000.
Было показано, что при такой постановке реакции биотинилированные МКА клона 4F10 специфически взаимодействуют с активированным протеином C, при этом предел обнаружения антигена много ниже 0,15 мкг/мл при использовании в качестве адсорбционных антител МКА гибридом 1С6 и 3H6 (фиг.1).
Эти свойства моноклональных штаммов Sp2/0-BC/rhPC-4F10, Sp2/0-BC/rhPC-lC6 и Sp2/0-BC/rhPC-3H6, а также взаимодействие продуцируемых ими МКА с протеином C человека свидетельствует о возможности использования данных МКА для получения иммуноаффинных реагентов для количественного анализа протеина C.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Sp2/0Ag14-SpBcG/APC-15/A3 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ПРОТЕИНУ C ЧЕЛОВЕКА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ К ПРОТЕИНУ C ЧЕЛОВЕКА, И ИММУНОСОРБЕНТ ДЛЯ СОРБЦИИ ПРОТЕИНА C ЧЕЛОВЕКА, СОДЕРЖАЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО | 2011 |
|
RU2455360C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. CCHFV Vd-3-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 3H6/F2 К ВИРУСУ КРЫМ-КОНГО ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ | 2013 |
|
RU2528869C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ АЛЬФА2-МИКРОГЛОБУЛИНА ФЕРТИЛЬНОСТИ (АМГФ)/ГЛИКОДЕЛИНА, РЕАГИРУЮЩИХ С РАЗЛИЧНЫМИ ГЛИКОФОРМАМИ БЕЛКА | 2007 |
|
RU2360966C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. CCHFV VD-1-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 4G/B К ВИРУСУ КРЫМ-КОНГО ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ | 2013 |
|
RU2535982C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ РАЗНЫХ ИЗОФОРМ АЛЬФА2-МИКРОГЛОБУЛИНА ФЕРТИЛЬНОСТИ (АМГФ)/ГЛИКОДЕЛИНА | 2007 |
|
RU2355762C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 6G2 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БЕЛКУ ТЕПЛОВОГО ШОКА 70 | 2008 |
|
RU2380413C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 2E4 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БЕЛКУ ТЕПЛОВОГО ШОКА 70 | 2008 |
|
RU2381271C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. musculus - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ИВЕРМЕКТИНУ И МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ИВЕРМЕКТИНУ | 2009 |
|
RU2415930C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L. PKKK (П) 679D-ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БЕЛКОВО-ПОЛИСАХАРИДНОМУ АНТИГЕНУ YERSINIA ENTEROCOLITICA О3 И О9 СЕРОВАРОВ | 2004 |
|
RU2265051C1 |
| Штамм гибридных клеток животных Mus musculus 1F1 - продуцент моноклонального антитела к нуклеокапсидному белку N вируса SARS-CoV-2 | 2021 |
|
RU2769817C1 |
Изобретение относится к биотехнологии и биофармакологии и предоставляет штаммы гибридных культивируемых клеток животных Mus musculus Sp2/0-BC/rhPC-4F10, Sp2/0-BC/rhPC-1C6, Sp2/0-BC/rhPC-3H6, - продуценты моноклональных антител, специфичных к протеину С человека. Штаммы депонированы во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИ Генетика под номерами (ВКПМ Н-110), (ВКПМ Н-111), (ВКПМ Н-112), соответственно. Антитела относятся к иммуноглобулинам класса G мыши, специфичным к hPROC и обладающим низкой кросс-реактивностью, избирательно связываются с протеином С человека и образуют стабильный комплекс. Антитела по изобретению могут быть использованы для фармацевтических и биомедицинских аналитических исследований, в частности для количественного обнаружения рекомбинантного фактора С человека. 1 ил., 4 табл., 4 пр.
1. Штамм гибридных культивируемых клеток животных Mus musculus Sp2/0-BC/rhPC-4F10 - продуцент моноклональных антител, специфичных к протеину С человека, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика, регистрационный номер Н-110.
2. Штамм гибридных культивируемых клеток животных Mus musculus Sp2/0-BC/rhPC-1C6 - продуцент моноклональных антител, специфичных к протеину С человека, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика, регистрационный номер Н-111.
3. Штамм гибридных культивируемых клеток животных Mus musculus Sp2/0-BC/rhPC-3H6 - продуцент моноклональных антител, специфичных к протеину С человека, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика, регистрационный номер Н-112.
| ЕР 0913156 A1, 06.05.1999 | |||
| US 5549893 A, 27.08.1996 | |||
| НОВЫЕ АНТИТЕЛА К ТКАНЕВОМУ ФАКТОРУ В КАЧЕСТВЕ АНТИКОАГУЛЯНТОВ | 2003 |
|
RU2345789C2 |
Авторы
Даты
2012-03-20—Публикация
2010-11-03—Подача