Изобретение относится к области вирусологии и биотехнологии, в частности к гибридомной технологии, и касается получения моноклонального антитела (МКА) к нуклеокапсидному белку N вируса SARS-CoV-2 с помощью нового гибридного клона клеток (гибридомы) животных. Изобретение может быть использовано для создания диагностикумов и иммунохимических тест-систем для определения наличия вируса SARS-CoV-2 в биологических образцах или антител к белку N вируса SARS-CoV-2.
РНК-содержащий вирус SARS-CoV-2 относится к семейству Coronaviridae роду Betacoronavirus. Впервые вирус был выделен в конце 2019 в Ухане (Китай) [1]. 11 марта 2020 года распространение острой респираторной инфекции, вызываемой вирусом SARS-CoV-2, было признано ВОЗ пандемией [2]. К февралю 2021 года пандемия охватывает весь мир, число заболевших превышает 100 млн человек, более 2 млн умерли [3]. К наиболее распространенным симптомам COVID-19 относятся лихорадка, сухой кашель, утомляемость, утрата обоняния или вкусовых ощущений. У части пациентов инфекция SARS-CoV-2 сопровождается пневмонией, в том числе тяжелой. Инкубационный период в среднем от 2 до 6 суток [4].
Вирион SARS-COV-2 состоит из 4 структурных белков: S, М, Е, и N. N-белок связан с РНК вируса, формируя нуклеокапсид. 3 остальных белка формируют оболочку вириона. Антитела к белку N появляются у заболевших раньше, чем антитела к другим белкам вируса, поэтому тест-системы основанные на выявлении антител к белку N являются наиболее чувствительными [5, 6].
Моноклональные антитела к белку N используются для производства тест-систем для выявления антигена вируса SARS-COV-2 методами классического иммуноферментного анализа (ИФА), тест-полосок ИФА и методом иммуноблоттинга. Кроме того, МКА могут быть использованы в диагностических исследованиях для выявления специфических антител против белка N методом конкурентного ИФА [7].
Гибридомная технология получения моноклональных антител к вирусным инфекциям человека широко известна. Например, с использованием этой технологии были получены антитела к вирусу гепатита С [8], пандемическому вирусу гриппа A/IIV-Moscow/01/09 (HlN1)swl [9], против белков вируса Эболы [10, 11] и к другим патогенам.
Существует панель моноклональных антител к белку N вируса SARS-CoV-1, полученная с помощью гибридомной технологии [12]. Моноклональное мышиное антитело М4 используется в тест-системе для выявления белка N вируса SARS-CoV-2 [13]. Опубликованы результаты разработки панели полученных с помощью гибридомной технологии антител к белку N вируса SARS-CoV-2 [14]. Также существует ряд коммерческих антител к белку N вируса SARS-CoV-2, например, антитело 1А6 («Abcam»), антитела 1G1-F2 и 5F7-A3 («RayBiotech»), 14B2D («Bioss»). Однако расширение арсенала МКА к антигенам вируса SARS-CoV-2 остается актуальной задачей.
Задача предлагаемого изобретения - создание стабильного штамма гибридного клона клеток, продуцирующего МКА к нуклеокапсидному белку N вируса SARS-CoV-2, для последующего конструирования на их основе высокоспецифичных тест-систем для определения антигена вируса SARS-CoV-2 или антител к данному вирусу.
Технический результат изобретения заключается в создании моноклонального антитела (МКА) к нуклеокапсидному белку N вируса SARS-CoV-2 и расширении арсенала штаммов гибридом, продуцирующих МКА к антигенам вируса SARS-CoV-2.
Указанный технический результат достигается путем получения нового гибридного клона культивируемых клеток Mus musculus IF 1, являющегося продуцентом МКА к нуклеокапсидному белку N вируса SARS-CoV-2. Полученное МКА обладает специфичностью и сродством к белку N, что, в свою очередь, дает возможность определять вирусный антиген в биологических жидкостях человека и животных. Заявленный штамм депонирован в Коллекции перевиваемых клеточных культур федерального государственного бюджетного учреждения «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Министерства здравоохранения Российской Федерации, номер 01-2/21.
Гибридный клон культивируемых клеток Mus musculus 1F1 характеризуется следующими свойствами.
Видовая принадлежность:
Mus musculus
Способ получения штамма:
Штамм получен путем слияния клеток мышиной миеломы Sp2/0-Ag-14 с клетками селезенки мышей линии Balb/c, иммунизированных введением внутрибрюшинно рекомбинантного нуклеокапсидного белка N вируса SARS-CoV-2. Первая иммунизация - с полным адъювантом Фрейнда, вторая иммунизация - через 2 недели после первой, с неполным адъювантом Фрейнда, бустерная иммунизация через 2 недели после второй, за 3 суток до отбора спленоцитов, все иммунизации по 100,0 мкг белка/мышь. Селекцию гибридом проводят на питательной среде RPMI-1640 («Sigma», США) с добавлением HAT (Hypoxanthine-Aminopterin-Thymidine) Media Supplement (Hybri-Max®, «Sigma», США). Штамм синтезируют моноклональные антитела (МКА), специфически взаимодействующие в твердофазном иммуноферментном анализе (ИФА) с нуклеокапсидным белком N вируса SARS-CoV-2. Культуральные свойства штамма:
Гибридные клетки растут в виде суспензии in vitro или в виде асцитной опухоли в перитонеальной полости после введения сингенным мышам линии Balb/c.
Культивирование штамма in vitro:
В качестве ростовой среды используют среду RPMI-1640 («Sigma», США), содержащую 20% фетальной сыворотки теленка (ФСТ), 4,5 г/л глюкозы, 3 мМ глутамина, 0,2 ед./мл инсулина, 60 мкг/мл гентамицина. Клетки культивируют при 37°С в атмосфере, содержащей 5% СО2. Для культивирования используют пластиковые планшеты или флаконы объемом 50 и 250 мл («Greiner», Германия). Характер роста - стационарная суспензия. Частота пассирования 2 суток. Кратность рассева 1:2-1:4.
Культивирование штамма в организме животного in vivo: За 1 сутки до введения клеток гибридомы мышей линии Balb/c предварительно обрабатывают внутрибрюшинно неполным адъювантом Фрейнда («Sigma», США) в дозе 0,5 мл/животное. Далее праймированным животным вводят в брюшную полость гибридные клетки штамма в дозе 5-10×106 клеток. Асцитные жидкости, содержащие МКА, получают через 7-15 суток после введения.
Биотехнологическая характеристика штамма (продуктивность):
- титр МКА в культуральной жидкости при выращивании in vitro -1,5×104 (в ИФА);
- титр МКА в асцитной жидкости при выращивании in vivo - 8×105 (в ИФА).
Условия хранения и поддержания жизнеспособности штамма:
Штамм сохраняют посредством криоконсервации в жидком азоте. За 24 часа до замораживания клетки гибридомы пассируют с кратностью рассева 1:2. Осажденные центрифугированием (2000 об/мин, 10 мин) клетки суспендируют в криозащитной среде, содержащей 10% диметилсульфоксид (ДМСО) и 90% ФСТ, и разливают по ампулам в концентрации 3-5 млн/мл, по 1,0 мл. Выдерживают 24 часа при минус 70°С, затем переносят в жидкий азот (минус 196°С).
Восстановление после размораживания:
Быстрое размораживание штамма проводят при 37°С. Гибридомные клетки разводят в 10 раз ростовой средой без сыворотки, осаждают центрифугированием при 2000 об/мин 10 минут и ресуспендируют в ростовой среде, содержащей 20% фетальной сыворотки теленка в концентрации 3-4×105 клеток/см3. Жизнеспособность восстановленных клеток составляет 70-80% и устанавливается по дифференциальной окраске клеток с использованием 0,4% раствора трипанового синего, рН=7,2-7,3.
Стабильность штаммов:
Стабильность продуцирования антител гибридными клетками сохраняется на протяжении 70 пассажей в культуре клеток и 5 пассажей на мышах линии BALB/c.
Контаминация:
Бактерии и грибы в культурах не обнаружены при длительном наблюдении и посевах на стандартные питательные среды (мясопептонный агар - для выявления бактерий и агар Сабуро - для грибов). Заражение микоплазмой не выявлено (тест-система Mycoplasma Stain Kit, «Flow Lab.»).
Кариотип гибридных клеток, модальное число хромосом не определяли.
Характеристика продуцируемых МКА к нуклеокапсидному белку N вируса SARS-CoV-2:
- мишень - белок N вируса SARS-CoV-2;
- Изотип продуцируемых иммуноглобулинов - IgG1 (ИФА, тест-система «Mouse-Hybridoma-Subtyping Kit» («Sigma», США).
Краткое описание чертежей.
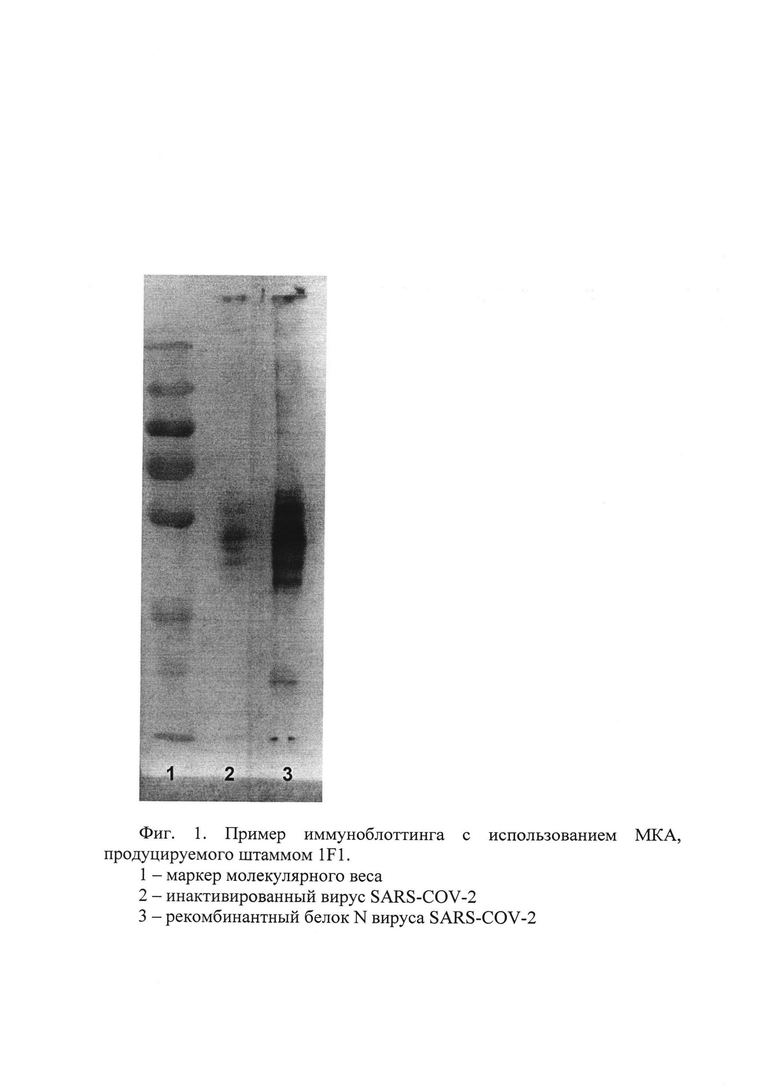
На фиг. 1 представлен пример иммуноблоттинга с использованием МКА, полученного с помощью штамма 1F1, демонстрирующий детекцию белка N вируса SARS-COV-2:
1 - маркер молекулярного веса,
2 - инактивированный вирус SARS-COV-2,
3 - рекомбинантный белок N вируса SARS-COV-2
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Получение заявленного штамма гибридомы.
Мышей линии Balb/c массой 18-20 г, 3-кратно иммунизируют рекомбинантным нуклеокапсидным белком N вируса SARS-CoV-2. Антиген получен в бактериальной культуре Е. coli. Интервал между иммунизациями составляет 2 недели. Животным вводят антиген внутрибрюшинно (100 мкг/мышь), с полным адъювантом Фрейнда (первая иммунизация) или с неполным адъвантом Фрейнда (вторая и третья иммунизации). Бустерная доза (100,0 мкг/мышь) вводится без адъюванта внутрибрюшинно за 3 суток до выделения селезенки.
Через 3 суток после введения бустерной дозы антигена получают суспензию клеток селезенки мыши стандартным методом в охлажденной ростовой среде без сыворотки.
Для слияния используют перевиваемую клеточную линию мышиной миеломы Sp2/0-Ag-14, дефектную по гену ГГФРТ, не продуцирующую собственные иммуноглобулины. Гибридизацию проводят по классическому методу Келера и Милыптейна. Суспензию клеток селезенки и миеломные клетки смешивают в соотношении 5:1 соответственно. После слияния клетки ресуспендируют в селективной среде с добавлением HAT, вносят в 96-луночные панели с фидерным слоем из перитонеальных макрофагов мышей (5×106 кл/мл, по 50 мкл/лун) в концентрации 1,5×105 клеток в лунку в объеме 0,1 мл. Панели с клетками инкубируют при 37°С в атмосфере 5% С02.
Замену среды в лунках с гибридомными клонами проводят каждые 2-3 суток, используя в течение 14 суток после слияния среду с HAT. Для селекции гибриды, продуцирующей МКА заданной специфичности, из лунок с растущими колониями отбирают культуральные жидкости. Когда клоны гибридных клеток занимают не менее 50% поверхности лунки их тестируют на наличие антител к белку N вируса SARS-CoV-2 в твердофазном иммуноферментном анализе. Клоны, обнаружившие специфическую активность, реклонируют методом лимитирующих разведений в 96-луночных панелях с фидерным слоем из перитонеальных макрофагов мышей (5×106 кл/мл, по 50 мкл/лун). Супернатанты из лунок, содержащих реклонированные гибридомы, снова тестируют на наличие антител и их специфичность.
Пример 2. Получение заявленного МКА.
Скрининг МКА заданной специфичности и иммунологической активности проводят методом непрямого ИФА. Для этого в лунки иммунологических микропланшетов («Greiner», Германия) вносят 0,1 мл антигена (рекомбинантный нуклеокапсидный белок N вируса SARS-CoV-2) в рабочем разведении в 0,1 М карбонат-бикарбонатном буфере, рН 9,5. Микропланшеты инкубируют 18 часов при 4°С. Свободные участки пластика блокируют 1% Top Block («Yuro», Швейцария) в 0,01 М фосфатно-солевом буфере (ФСБ). Инкубируют в течение 30 минут при 37°С и вносят в лунки 0,1 мл культуральной жидкости МКА в различных разведениях. Микропланшеты инкубируют 1 час при 37°С и добавляют пероксидазный конъюгат антител к IgG мыши («Sigma», США) в рабочем разведении. Инкубируют 1 час при 37°С. После каждого этапа, несвязавшиеся реагенты отмывают ФСБ с добавлением 0,1% Tween-20 (ФСБТ). В качестве хромогена используют тетраметилбензидин (ТМБ). Интенсивность окраски в лунках определяют после остановки реакции 1М H2SO4 на спектрофотометре iMark («Bio-rad», США) при длине волны 450 нм.
Клоны, проявившие специфическую активность к нуклеокапсидному белку N вируса SARS-CoV-2, реклонируют методом лимитирующих разведений в 96-луночных панелях с фидерным слоем из перитонеальных макрофагов мышей (5×106 кл/мл, по 50 мкл/лун). Супернатанты из лунок, содержащих реклонированные гибридомы, снова тестируют на наличие антител и их специфичность. Положительные реклонированные гибридомы наращивают в культуральных флаконах увеличивающихся размеров (сначала 25 см3, затем 75 см3) («Greiner», Германия).
Выделение МКА из культуральных жидкостей (КЖ) осуществляют при помощи хроматографической системы АКТА START («GE Healthcare», Швеция) и колонки HiTrap Protein A HP 1,0 мл («GE Healthcare)), Швеция), согласно протоколу фирмы производителя. Обессоливания и замену буфера в очищенном на первой стадии образце осуществляют при помощи хроматографической системы АКТА START («GE Healthcare)), Швеция) и колонки HiTrap desalting 5 ml («GE Healthcare)), Швеция), согласно протоколу фирмы производителя. После финальных стадий очистки, со 100,0 мл КЖ получают 10,0 мл препарата МКА с концентрацией 0,6 мг/мл. Выход очищенного МКА с КЖ составляет 60 мкг/мл.
Выделение иммуноглобулинов класса G (IgG) из асцитной жидкости (АЖ) проводят осаждением белков при помощи каприловой кислоты («Sigma)), США). АЖ разводят 0,06 М ацетатным буфером, рН=4,0, добавляют каприловую кислоту (3,3 мкл/мл АЖ), инкубируют 30 мин при 20°С, центрифугируют. Супернатант фильтруют через PVDF-фильтр (0,45 мкм) и диализуют в течение суток против ФСБ. Затем добавляют насыщенный раствор сульфата аммония (до 50% насыщения), инкубируют 18 час. при 40°С, центрифугируют, осадок растворяют в ФСБ и обессоливают в колонках с полусухим Сефадексом G-25 Medium в ФСБ. Оптическую плотность растворов IgG измеряют на спектрофотометре («Eppendorf)), Германия) при длине волны 280 нм. Концентрацию белка IgG определяют по формуле:
C=D/1,4, где D - оптическая плотность, С - концентрация белка (мг/мл), 1,4 - оптическая плотность раствора IgG с концентрацией 1,0 мг/мл.
Характеристики выделенного препарата представлены в таблице 1.

Пример 3. Использование МКА для детекции белка N методом иммуноблоттинга.
Электрофорез проводят в пластинах полиакриламидного геля размером 70 × 100 × 0,75 мм на приборе Mini-PROTEAN II («Bio-Rad», США) в восстанавливающих условиях при постоянном напряжении 200 В. После электрофоретического разделения белки из геля переносят на мембрану «Immobilon-Р» («МПНроге», США) на приборе Trans-Blot SD («Bio-Rad», США) при постоянной силе тока 200 мА в течение 1 часа при комнатной температуре. После электропереноса не связавшиеся с белками участки мембраны блокируют 1% желатином («Gerbu», Германия) в ФСБТ 1 час при 37°С.После этого мембраны отмывают 4 раза в ФСБТ и 4 раза в ФСБ и инкубируют с МКА, полученным с использованием штамма 2Е1 В5 (в рабочей концентрации 1 мкг/мл), 1 час при 37°С.Мембрану промывают ФСБТ и инкубируют 1 час при 37°С. Затем добавляют меченые пероксидазой антитела к иммуноглобулину G мыши («Sigma», США). После этого мембраны отмывают 4 раза в ФСБТ и 4 раза в ФСБ и окрашивают смесью 3,3'-диамино-бензидина и 4-хлоронафтола с 0,01% H2O2. Окрашивание останавливают промыванием мембраны в воде. Окрашивание с помощью полученного МКА позволяет детектировать методом иммуноблоттинга как рекомбинантный белок N, так и белок N инактивированного вируса SARS-CoV-2. Пример результата иммуноблоттинга представлен на фиг. 1.
Т.о., созданная гибридома 1F1 синтезирует моноклональное антитело (МКА) класса IgGl, которое специфически взаимодействуют в ИФА с рекомбинантным нуклеокапсидным белком N вируса SARS-CoV-2 и инактивированным вирусом SARS-CoV-2.
Изобретение может быть использовано для создания диагностикумов и иммунохимических тест-систем для определения наличия вируса SARS-CoV-2 в биологических образцах или для выявления антител к белку N вируса SARS-CoV-2. Например, полученное МКА позволяет детектировать методом иммуноблоттинга как рекомбинантный белок N, так и белок N инактивированного вируса SARS-CoV-2.
Источники информации.
1. Hui DS, Azhar EI, Madani ТА, Ntoumi F, Kock R, Dar O, et al. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. Int J Infect Dis. 2020;91:264-6.https://doi.org/10.1016/j.ijid.2020.01.009
2. WHO Director-General's opening remarks at the media briefing on COVID-19 - 11 March 2020 (https://www.who.int/ru/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19- 11 -march-2020)
3. Johns Hopkins Coronavirus Resource Center, COVID-19 map - Johns Hopkins coronavirus resource center, Johns Hopkins COVID-19 Rescent (2021)
4. C. Huang, Y. Wang, X. Li, L. Ren, J. Zhao, Y. Hu, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, ChinaLancet, 395 (2020), pp.497-506, 10.1016/S0140-6736(20)30183-5
5. Leung DT, Tarn FC, Ma CH et al. Antibody response of patients with severe acute respiratory syndrome (SARS) targets the viral nucleocapsid. J Infect Dis 2004; 190:379-86 doi: 10.1086/422040.
6. Zeng W, Liu G, Ma H, et al. Biochemical characterization of SARS-CoV-2 nucleocapsid protein. Biochem Biophys Res Commun. 2020;527(3):618-623. doi: 10.1016/j.bbrc.2020.04.136
7. La Marca A, Capuzzo M, Paglia T, Roli L, Trenti T, Nelson SM. Testing for SARS-CoV-2 (COVID-19): a systematic review and clinical guide to molecular and serological in-vitro diagnostic assays. Reprod Biomed Online. 2020;41(3):483-499. doi:10.1016/j.rbmo.2020.06.001
8. Патент RU №2329303 Моноклональные антитела, иммунореактивные с белком нуклеокапсида (кор) вируса гепатита С-4G5, способ диагностики - сэндвич-вариант иммуноферментного количественного анализа для детекции нуклеокапсида вируса гепатита С и комбинация моноклональных антител, включающая МКА 4G5, для его осуществления./ Авторы: Масалова О.В. и др., заявка №2006127947/13, приоритет 2006.08.02
9. Патент RU №2457243 Штамм гибридных культивируемых клеток мыши Mus. Musculus - 1Е7, продуцирующий моноклональное антитело, иммунореактивное с белком гемагглютинина пандемического вируса гриппа A/IIV-Moscow/01/09 (HlNl)swl./ Авторы: Климова P.P. и др., заявка №2011100099, приоритет 11.01.2011
10. Патент RU №2 395 576 Штамм гибридных клеток животного Mus musculus L.1b2 - продуцент моноклональных антител для выявления нуклеопротеина вируса Эбола, субтип Заир (штамм Mainga) (варианты), моноклональное антитело, продуцируемое штаммом (варианты), набор для иммуноферментной тест-системы формата "сэндвич" для выявления нуклеопротеина Эбола, субтип Заир (штамм Mainga)./ABTopbi: Казачинская Е.И. и др., заявка №2008149653/13, приоритет 2008.12.16
11. Патент RU №2 2 686 630 Штаммы гибридных клеток животных Mus. Musculus - продуценты моноклональных антител к белку GP вируса Эбола (subtype Zaire) и моноклональные антитела к белку GP вируса Эбола (subtype Zaire)./ABTopbi: Козлов А.Ю. и др., заявка №2017145321, приоритет 2017.12.22
12. Shang В, Wang XY, Yuan JW, Vabret A, Wu XD, Yang RF, Tian L, Ji YY, Deubel V, Sun B. Characterization and application of monoclonal antibodies against N protein of SARS-coronavirus. Biochem Biophys Res Commun. 2005 Oct 14;336(1):110-7. doi: 10.1016/j.bbrc.2005.08.032. PMID: 16112641; PMCID: PMC7092910.
13. Diao В., Wen K., Chen J., Liu Y., Yuan Z., Han C, Chen J., Pan Y., Chen L., Dan Y., Wang J., Chen Y., Deng G., Zhou H., Wu Y. Diagnosis of Acute Respiratory Syndrome Coronavirus 2 Infection by Detection of Nucleocapsid Protein. medRxiv. 2020 doi: 10.1101/2020.03.07.20032524.
14. Terry JS, Anderson LB, Scherman MS, et al. Development of SARS-CoV-2 Nucleocapsid Specific Monoclonal Antibodies. Preprint. bioRxiv. 2020;2020.09.03.280370. Published 2020 Sep 3. doi: 10.1101/2020.09.03.280370.
Изобретение относится к области вирусологии и биотехнологии, в частности к штамму гибридных культивируемых клеток животных Mus musculus 1F1. Гибридный клон клеток 1F1 был получен путем слияния клеток мышиной миеломы линии Sp2/0-Ag-14 со спленоцитами мышей линии Balb/c, иммунизированных внутримышечно рекомбинантным белком N вируса SARS-CoV-2. Гибридома 1F1 продуцирует моноклональное антитело класса IgG1, которое специфически взаимодействует с рекомбинантным нуклеокапсидным белком N и инактивированным вирусом SARS-CoV-2. Полученное антитело может быть использовано в диагностических исследованиях для выявления антигена и специфических противовирусных антител. Настоящее изобретение позволяет расширить арсенал средств для получения моноклональных антител к нуклеокапсидному белку N вируса SARS-CoV-2. 1 ил., 1 табл., 3 пр.
Штамм гибридных культивируемых клеток животных Mus musculus 1F1, депонированный в Коллекции перевиваемых клеточных культур ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России, номер 01-2/21, - продуцент моноклонального антитела к нуклеокапсидному белку N вируса SARS-CoV-2, относящегося к изотипу IgG1, способного специфично взаимодействовать с рекомбинантным нуклеокапсидным белком N вируса SARS-CoV-2 и инактивированным вирусом SARS-CoV-2.
| CN 112079920 A, 15.12.2020 | |||
| CN 112028993 A, 04.12.2020 | |||
| ANTIPOVA NADEZHDA V | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| International Journal of Molecular Sciences, 01.12.2020, 21(23), 9167; doi.org/10.3390/ijms21239167 | |||
| US 22080254440 A1, 16.10.2008 | |||
| Иммунобиологическое средство и способ его использования для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 (варианты) | 2020 |
|
RU2720614C1 |
Авторы
Даты
2022-04-06—Публикация
2021-02-15—Подача