Изобретение относится к медицине, брюшной хирургии, и может быть использовано для лечения больных с острой патологией органов брюшной полости, осложнившейся развитием гнойного-некротического панкреонекроза.
Острый панкреатит относится к числу наиболее частых нозологических форм среди хирургических заболеваний органов брюшной полости и занимает третье место после острого аппендицита и острого холецистита. При этом заболевании существует определенная закономерность: гибель больного наступает либо рано, в течение первой недели заболевания и связана с «ранними токсемическими» осложнениями, приводящими к острой полиорганной дисфункции, либо уже достаточно поздно, после 3-4 недели на фоне «поздних гнойно-септических» осложнений. Клиническое течение распространенных инфицированных форм панкреонекроза характеризуется быстрым нарастанием уровня эндогенной интоксикации, ранним развитием полиорганной дисфункции, появлением и прогрессированием очагов гнойно-некротической деструкции поджелудочной железы, забрюшинной клетчатки, вследствие транслокации в брюшинную полость и забрюшинную клетчатку симбионтной микрофлоры, а также из тонкой кишки из-за нарушения проницаемости энтерального барьера в условиях гнойно-некротического панкреонекроза.
Выявление признаков панкреонекроза всегда служит абсолютным показанием к выполнению операции - лапаротомии, удалению гнойно-некротических очагов, лаважу брюшной полости и ее дренированию. В послеоперационном периоде проводят интенсивную антибактериальную, дезинтоксикационную, корригирующую терапию нарушенных функций органов и систем, применяют иммуностимулирующие и иммунокоррегирующие препараты. Важнейшим тактически значимым моментом лечебной терапии является восстановление моторно-эвакуаторной функции кишечника, профилактика прогрессирования деструктивных процессов брюшинной полости, а также предупреждение развития полиорганной дисфункции и в первую очередь функций печени и почек.
В литературе отсутствует единый подход в хирургической тактике при этом труднопрогнозируемом заболевании (В.А.Кубышкин, 1996; А.В.Пугаев с соавт., 1997; Ю.П.Атанов, 1997 и др.).
Большинство способов лечения направлено на усовершенствование различных способов дренирования гнойных затеков и вирсунгова протока. В 40%-70% случаев происходит инфицирование очагов деструкции у больных с панкреонекрозом (Лищенко А.Н., Лаптев В.В., 1995; Брискин Б.С., 2005; Нестеренко Ю.А., Лищенко А.Н., Михайлусов Ю.А, 1998; Beger H.G., Rau В., Mayer J., 1997).
В.С.Савельев с соавт.(В.С.Савельев, М.И.Филимонов, Б.Р.Гельфанд, С.З.Бурневич, П.А.Соболев. Оценка эффективности современных методов лечения деструктивного панкреатита.- Анналы хирургической гепатологии. - 1996. - 1. - С.58-61) при инфицированном некрозе или абсцессе рекомендует дополнительно выполнять:
1) дренирование сальниковой сумки двухпросветным дренажем;
2) каждые 24-48 часов - программированные санации.
Подобная тактика при распространенных формах панкреонекроза позволила снизить летальность за последние два года с 70% до 42%. Не решенным остается вопрос о резекции поджелудочной железы панкреатэктомии при панкреонекрозе. Тогда как гнойный панкреонекроз и его осложнения - абдоминальный сепсис у больных с ургентной пататологией является причиной смерти в 50-80% случаев (Бенкс П.А., 1982; Денисенко Г.А., 2005; Lankisch P.G. et al., 1997).
Описан способ лечения гнойного панкреонекроза (Е.М.Благитко, А.А.Беспалов, С.Н.Пащина, Н.В.Бугайченко. Тактика хирургического лечения больных с гнойно-некротической стадией панкреонекроза // // Сибирский Консилиум. - 2004. - №6. - С.11-13).
Сущность проводимых операций:
1. Широкая лапаротомия.
2. Рассечение желудочно-ободочной связки на всем протяжении.
3. Ревизия парапанкреотического пространства.
4. Мобилизация селезеночного угла ободочной кишки.
5. Некрсеквестрэктомия.
6. Холицистэктомия, наружное дренирование общего желчного протока по показаниям.
7. Проведение назоинтестинального зонда для кормления за связку Трейца для устранения эвакуаторных нарушений из желудка.
8. Дренирование зоны поджелудочной железы, забрюшинного пространства с использованием многоканальных систем с постоянным промыванием и активной аспирацией.
Известен способ лечения панкреонекроза (патент РФ №2188045, 27.08.2002): под общим обезболиванием выполняют срединную надпупочную лапаротомию, производят ревизию органов и санацию брюшной полости, вскрывают сальниковую сумку через желудочно-ободочную связку, формируют оментобурсопанкреатостому, по верхнему и нижнему контурам поджелудочной железы вскрывают париетальную брюшину, производят абдоминизацию поджелудочной железы, некрсеквестрэктомию, при необходимости некрэктомию парапанкреатической клетчатки, возможна резекция хвоста железы при некрозе в этом отделе. Осуществляют назоинтестинальную интубацию энтеральным зондом, который крепится к крылу носа. В круглой связке печени находят, выделяют и вскрывают пупочную вену, производят ее реканализацию и катетеризацию. Катетер выводят на брюшную стенку через отдельный прокол справа от лапаротомной раны, крепят к коже. Производят ревизию внепеченочных желчных путей для исключения наличия камней, формируют холецистостому для наружного дренирования билиарного тракта. В случае отсутствия желчного пузыря выполняют холедохостомию. Сальниковая сумка дренируется трубчатыми дренажами - справа через Винслово отверстие, слева - через желудочно-ободочную связку или забрюшинное пространство в левом подреберье. В сальниковую сумку по всей длине помещают контейнеры из капроновой сетки с гранулами шивыртуина, насыщенного ЭАКК в соотношении 3:1. Контейнерам придается форма лепешки или колбаски с тем, чтобы их поверхность наиболее плотно соприкасалась с очагами деструкции в железе и окружающих тканях. В лапаротомную рану укладывают отдельный контейнер. Поверх раны - повязка с мазями на водорастворимой основе (левосин, левомеколь). Ежедневно под наркозом осуществляют замену контейнеров с сорбентом на новые. После полной санации сальниковой сумки она дренируется через брюшную стенку и желудочно-ободочную связку либо заменяют старые дренажи, а на лапаротомную рану накладывают ранние вторичные швы.
Данная методика принята нами за прототип.
К основным недостаткам прототипа следует отнести сложность и многоступенчатость проводимой операции, а также необходимость проведения ежедневного наркоза при осуществлении способа. Все это способствует увеличению риска послеоперационных осложнений.
В настоящее время повсеместно обсуждается возможность антибактериального воздействия на микрофлору в просвете тонкой кишки и портальной системы, т.к. доказано, что прорыв через печеночный барьер токсинов и патогенной флоры приводит к системной токсимии и бактеримии и, как следствие, к прогрессированию гнойных осложнений при панкреонекрозе.
Недостатки, присущие известным методам, устраняются в разработанном нами способе, который впервые позволяет патогенетически обоснованно, путем длительной декомпрессионной назоинтестинальной интубации с последующим кишечным лаважем, энтеросорбцией, ранним энтеральным зондовым питанием, введением пре- и эубиотиков, а также интрапортальным введением антибактериальных, протективных препаратов и проведением внутрипортальной гемодилюции достоверно улучшить непосредственные результаты лечения данной тяжелой категории больных.
Задача изобретения - повышение эффективности лечения больных с панкреонекрозом путем воздействия на аэробную и анаэробную микрофлору в портальной системе. Дренирование тонкой кишки предотвращает транслокацию патогенной флоры в брюшинную полость и забрюшинное пространство, создает каркас для петель тонкой кишки, предотвращая тем самым развитие острой тонкокишечной непроходимости, позволяет в ранних сроках проводить энтеральное питание. Дренирующая функция зонда позволяет снизить интоксикационный синдром, тем самым уменьшить количество осложнений у больных с гнойным панкреонекрозом и повысить эффективность лечения.
Поставленная задача решается тем, что выполнение тотальной назоинтестинальной интубации осуществляют введением через носоглотку в желудок зонда, направляя его через пилорический отдел в 12-перстную кишку, при этом первую петлю тощей кишки отводят влево и начинают выполнение интубации тонкой кишки методом поэтапного нанизывания кишки на зонд. К концевой части зонда присоединяют электроотсос в режиме разрежения 20-60 мм вод. ст., производят аспирацию содержимого тонкой кишки, затем лаваж /отмывание просвета/ кишки, по мере заведения на зонд петель тонкой кишки осуществляют тракцию зонда ближе к области связки Трейца, вытягивая его из желудка. Зонд устанавливают так, чтобы последние 1-2 отверстия находились в желудке, в отмытый участок кишки через тот же зонд вводят 50-80 мл суспензии энтеросорбента с антибиотиком, петли тонкой кишки укладывают в косогоризонтальном положении с длиной витка 20-30 см. Дополнительно во время операции выполняют реканализацию пупочной вены с ее канюлированием и последующими внутрипортальными инфузиями глюкозо-электролитных комплексов из расчета 30-40 мл/кг массы больного в сутки (внутрипортальная гемодилюция) и внутрипортальным введением корригирующих, противомикробных, гепатотропных и протективных препаратов в течение 5-6 дней после операции.
Способ обеспечивает эффективную эвакуацию кишечного и желудочного содержимого за счет того, что интубацию выполняют вручную методом поэтапного нанизывания тонкой кишки на зонд. Зонд устанавливают так, чтобы последние 1-2 отверстия находились в желудке.
При завершении интубации петли тонкой кишки укладывают в косо-горизонтальном положении с длиной витка 20-30 см, что обеспечивает плавность изгибов зонда и создает нормальные анатомические взаимоотношения в брюшной полости.
Внутрипортальные инфузии глюкозо-электролитных комплексов из расчета 30-40 мл/кг массы больного в сутки (внутрипортальная гемодилюция) и внутрипортальные введения корригирующих, противомикробных и протективных препаратов способствуют улучшению состояния больного, снижению или ликвидации интоксикационного синдрома, восстановлению перистальтики кишечника.
Разработанный патогенетически обоснованный алгоритм детоксикационной терапии у больных с инфицированными формами панкреонекроза в послеоперационном периоде, включающий длительную тотальную декомпрессионную назоинтестинальную интубацию с лаважем тонкой кишки, энтеросорбцией, внутрипортальной инфузионной терапией, является эффективным методом декомпрессии и деконтаминации тонкой кишки. В результате отмечается снижение транслокации симбионтной микрофлоры тонкой кишки в брюшинную полость, забрюшинное пространство, тем самым снижается количество гнойно-некротических осложнений, количество повторных операций, что благоприятно отражается на результатах лечения заболевания.
Таким образом, заявляемый способ позволяет эффективно бороться с эндогенной интоксикацией у больных с гнойно-некротическим панкреонекрозом и уменьшить число послеоперационных осложнений и послеоперационной летальности.
Исследования последних лет показали, что при панкреонекрозе как асептическом, так и гнойно-некротическом происходит повреждение энтерального барьера. При распространении патологического процесса (отека) на корень брыжейки тонкой кишки и сдавлении сосудистого и нервного звена развивается паралитическая кишечная непроходимость, тем самым тонкая кишка является резервуаром (обширным гнойником) и поставщиком бактерий и их токсинов, которые усугубляют течение панкреонекроза токсическим поражением органов и систем в целом (Костюченко А.Л., Филин В.И., 2000). В результате этого отмечается проникновение микроорганизмов (транслокация), в том числе анаэробов, через кишечную стенку в портальную систему, системный венозный кровоток, а также в брюшинную полость с обсеменением париетальной и висцеральной брюшины, проникновение бактериальных агентов в некротические ткани с возникновением и распространением гнойных осложнений, которые в большинстве случаев приводят к развитию такого грозного осложнения, как абдоминальный сепсис. Существует прямая зависимость между масштабом некроза поджелудочной железы, распространенностью некротического процесса в забрюшинной клетчатки и вероятностью их контаминации и инфицирования (Beger H.G., Bittner R., Buchler M., 1986; Beger H.G., Rau В., Mayer J. et al., 1997).
Одновременно в просвете тонкой кишки резко возрастает количество анаэробов, в том числе неклостридиальных /E.Coli, Klebsiella spp., Enterobacter spp., Bacteroides spp.и др./, которые становятся в этих условиях патогенными. Наибольший интерес представляет собой тот факт, что большинство бактерий, обнаруженных в некротический тканях, практически зеркально отображают спектр микрофлоры желудочно-кишечного тракта больного (Григорьев Е.Г., Коган А.С., 2000; Medich D.S., Lee Т.К., Melhem M.F. et al., 1993).
Кроме того, у этих больных резко уменьшается спланхнический кровоток, что снижает снабжение кислородом тонкую кишку, печень и другие органы брюшной полости. Все это происходит на фоне выраженного пареза кишечника, где в значительной степени возрастают процессы гниения и брожения, накапливается большое количество токсических веществ. Наиболее благоприятной средой для размножения микроорганизмов являются именно некротические ткани поджелудочной железы и жировой забрюшинной клетчатки. Показано, что экзогенное инфицирование представителями госпитальной микрофлоры (Pseudomonas spp., Klebsiella-Enterobakter spp., Proteus spp., Serracia и т.д.) происходит при проникновении микроорганизмов в зону стерильного некроза через дренажные трубки и системы (Dervenis С., Johnson C.D., Bassi С., 1999).
Массивное поступление в печень по портальной системе микроорганизмов и токсических веществ оказывает повреждающее действие в первую очередь на звездчатые ретикулоэндотелиальные клетки печени /клетки Купфера/ и, когда они /клетки Купфера/ не справляются с портальной бактериемией, происходит их гибель и прорыв микробов из портального в системный кровоток /общий круг кровообращения/, что приводит к развитию и прогрессированию гнойных осложнений при панкреонекрозе. Поэтому в настоящее время особое внимание уделяют антибактериальному воздействию на микрофлору в портальной системе и в просвете тонкой кишки, откуда эти микроорганизмы и поступают. В связи с этим для лечения панкреонекроза применяют наружную декомпрессию верхних отделов пищеварительного тракта с назоинтестинальной интубацией и лаважем тонкой кишки во время операции, а в послеоперационном периоде в просвет тонкой кишки вводят энтеросорбенты. Это в значительной мере уменьшает содержание токсинов и микроорганизмов в просвете кишечника /А.Г.Лебедев и соавт. Декомпрессия желудочно-кишечного тракта при тонкокишечной непроходимости. - Сб.: Материалы науч.-практ. конф., посвящ. 100-летию проф. П.Л.Сельцовского. - М. - 1998. - С.53-59; А.А.Гринберг, Т.И.Черныш Энтеросорбция в лечении распространенного перитонита. - Там же, с.38-40/.
Кроме того, как общее антибактериальное лечение применяют внутримышечно антибиотики последнего поколения, в том числе действующие на анаэробную флору в сочетании с внутривенным введением производных нитроимидазола /метрогилом, метронидазолом и др./.
Несмотря на детальное изучение патогенеза острого панкреатита и разработку связанных с этим схем лечения, не отмечается улучшения в исходах заболевания. Это связано, прежде всего, с неудовлетворительными результатами лечения гнойно-некротических осложнений панкреонекроза.
Заявляемое изобретение иллюстрируется следующими фигурами 1-7:
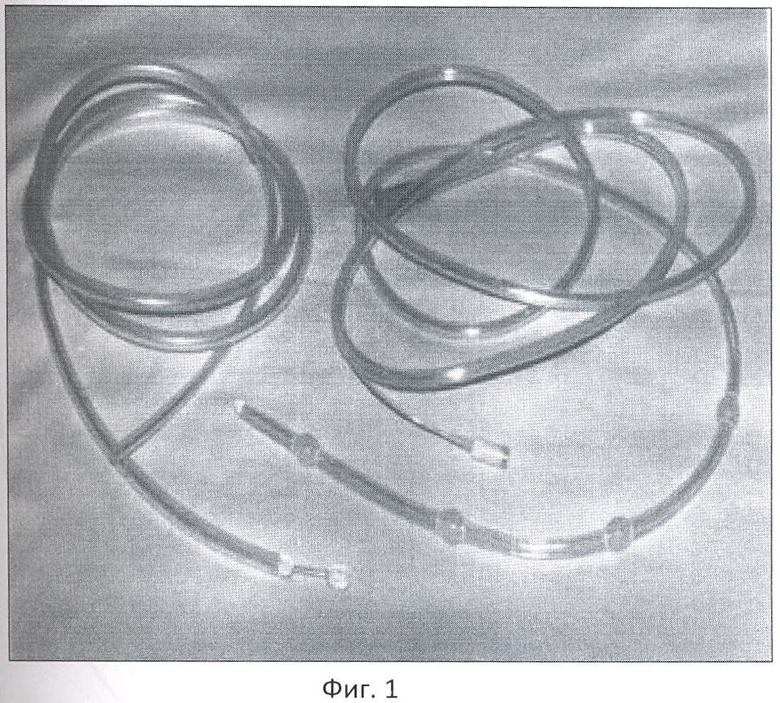
Фиг.1 - двухпросветные зонды.
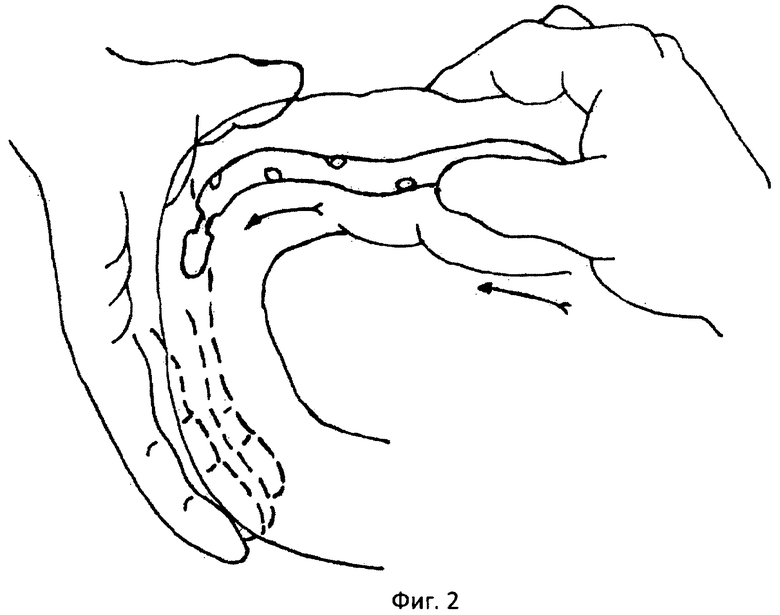
Фиг.2 - проведение зонда через 12-перстную кишку.
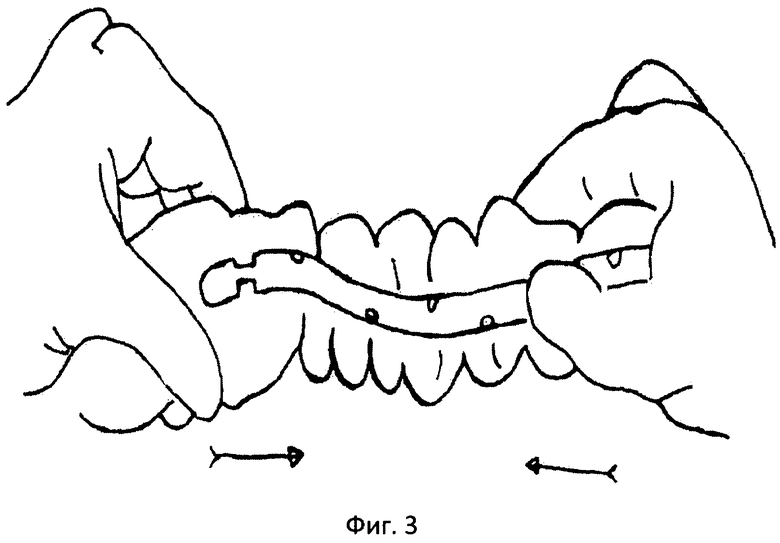
Фиг.3 - поэтапное нанизывание тонкой кишки на назоинтестинальный зонд.
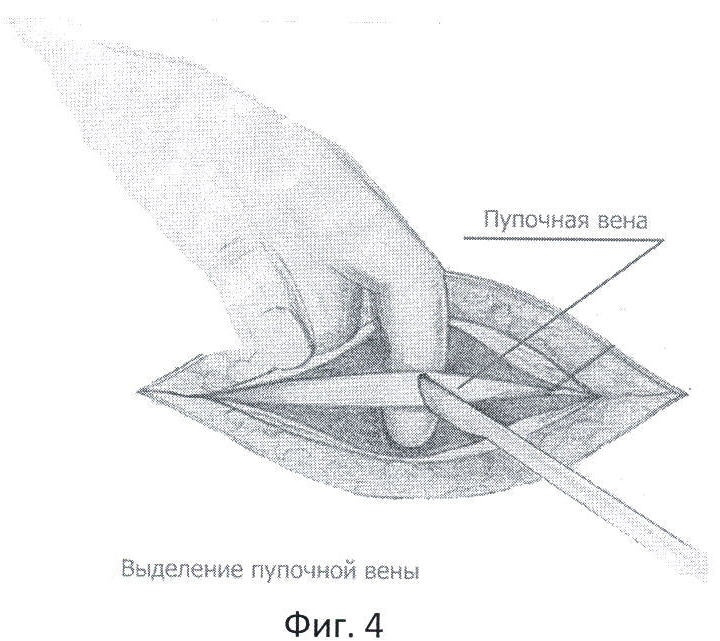
Фиг.4 - мобилизация пупочной вены.
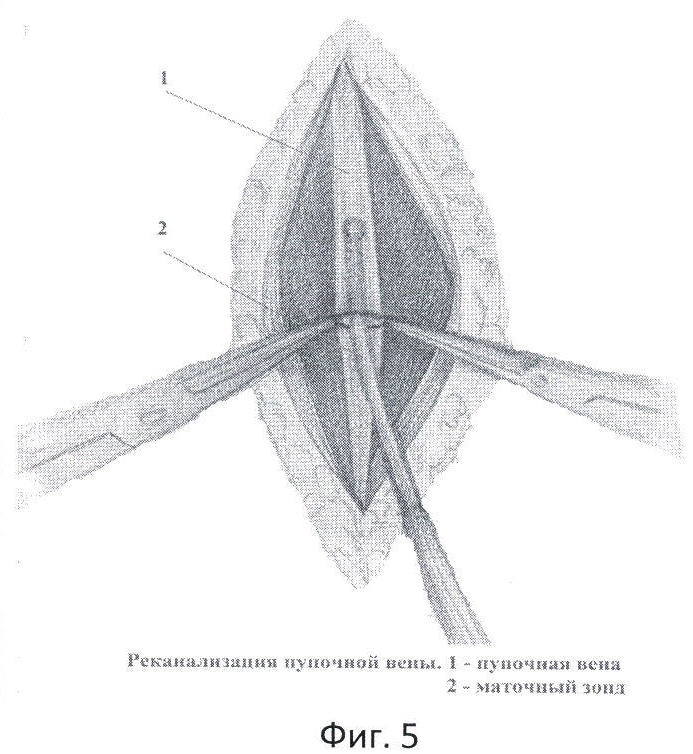
Фиг.5 - реканализация пупочной вены.
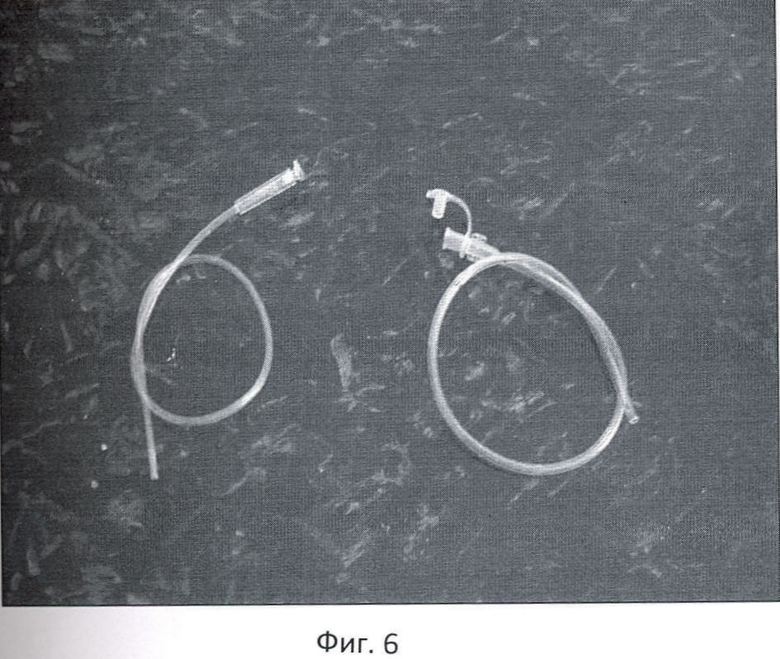
Фиг.6 - пупочный катетер.
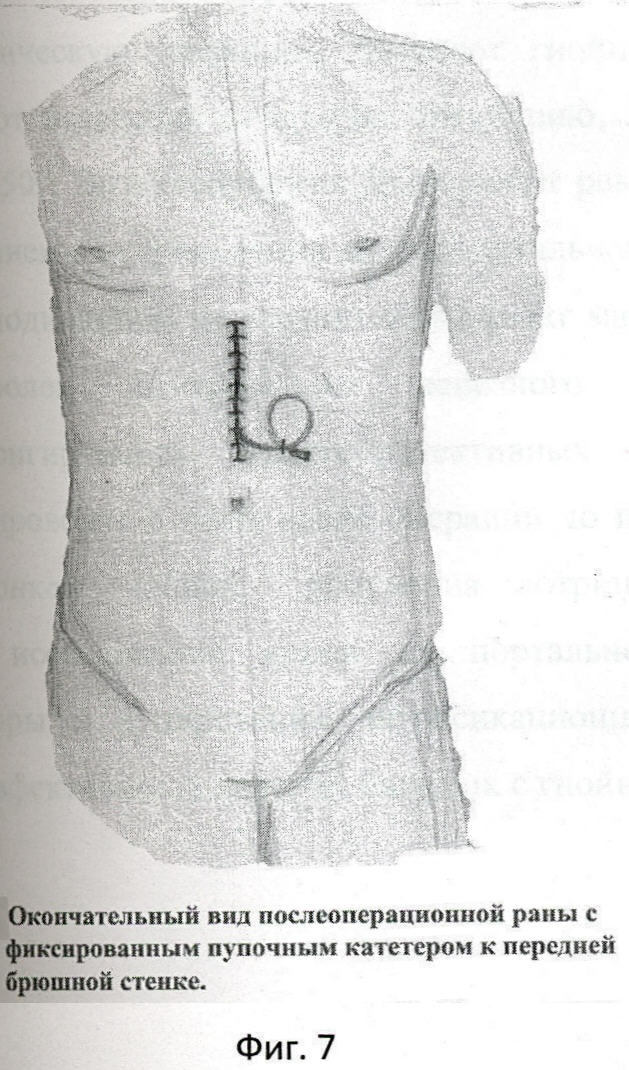
Фиг.7 - окончательный вид послеоперационной раны с фиксированным катетером к передней брюшной стенке.
Подробное описание способа и пример его клинического применения
Оперативное пособие проводят под эндотрахеальным наркозом. После выполнения широкой срединной или поперечной лапаротомии производят тщательную ревизию брюшинной полости и забрюшинного пространства со стороны живота, а также выявляют наличие или отсутствие плотных инфильтратов в зонах поражения забрюшинной клетчатки (параколон, паранефрий, в корне брыжейки тонкой, толстой кишки, поддиафрагмальном пространстве и др.). Вскрывают сальниковую сумку через желудочно-ободочную связку с эвакуацией гнойного-некротического содержимого, с взятием последнего для бактериологического исследования. Помимо взятия патологического отделяемого для бактериологического исследования у больных производят забор участков брюшины, некротизированных участков поджелудочной железы и забрюшинной клетчатки для микробиологического исследования. После вскрытия сальниковой сумки производят пальцевую ревизию и визуальный осмотр поджелудочной железы. Определяют объем поражения железы и предлежащих к ней органов. При наличии поражения забрюшинной клетчатки производят широкое ее вскрытие (при поражении левого и правого отделов толстой кишки, выполняют широкую мобилизацию соответствующих отделов толстой кишки). После эвакуации жидкого гноя электроотсосом производят некрсеквестрэктомию. При наличии оментита удаляют большой сальник. Некротизированые участки поджелудочной железы иссекают скальпелем или выстригают ножницами с последующей щадящей коагуляцией. Для снижения давления в гепатобиллиарной зоне производят дренирование холедоха по Холстеду-Пиковскому. Затем больным выполняют тотальную интраоперационную назоинтестинальную интубацию тонкой кишки двухпросветными зондами длиной 2,5-3 м и наружным диаметром 6-8 мм, с округлыми боковыми отверстиями 3-5 мм (ЗКДС-21, ЗЖКС-25) (фиг.1).
Методика проведения интраоперационной назоинтестинальной интубации заключается в следующем. Обработанный на всем протяжении вазелиновым маслом интестинальный зонд хирург, не принимающий участия в операции, проводит без усилия через носоглотку в желудок порционно так, чтобы зонд не скручивался в кольца. Правой рукой, захватив пальцами конец зонда через стенку желудка, направляя его через пилорический отдел в 12-перстную кишку (фиг.2). При проведении по 12-перстной кишке первую петлю тощей кишки ассистент отводит влево, выпрямляя тем самым дуоденоеюнальный изгиб. После того как зонд, миновав дуоденоеюнальный изгиб, проходит в тощую кишку, хирург захватывает его и начинает выполнение интубации тонкой кишки. Интубацию выполняют вручную методом поэтапного нанизывания тонкой кишки на зонд (фиг.3). Во время интубации одновременно производят аспирацию секвестрированной патологической жидкости тонкой кишки путем присоединения к концевой части зонда электроотсоса в режиме разрежения 20-60 мм вод. ст. После эвакуации секвестрированной жидкости производят лаваж /отмывание просвета/ тонкой кишки.
По мере заведения на зонд петель тонкой кишки хирург осуществляет тракцию зонда ближе к области связки Трейца, вытягивая его из желудка. Зонд устанавливают так, чтобы последние 1-2 отверстия находились в желудке. В результате весь тонкий кишечник оказывается освобожденным от кишечного содержимого и нанизанным на зонд. В последующем временно отсоединяют от проксимальной части зонда электроотсос. Вместо него к зонду подсоединяют шприц Жане и вводят 300-400 мл раствора Рингера или глюкозо-электролитного раствора. Участок тонкого кишечника, наполненный введенным раствором, слегка встряхивают, а затем к зонду вновь присоединяют электроотсос и аспирируют промывную жидкость. После этого в отмытый участок кишки через тот же зонд вводят 50-80 мл суспензии энтеросорбента с антибиотиком /15 г энтеросорбента энтеросгеля или 15 г энтеросорбента - разводя на 400-600 мл 5% раствора глюкозы или раствора Рингера и добавляют 2.0-4.0 г антибиотика, к которому наиболее чувствительны анаэробы, например ампициллина/. При завершении интубации петли тонкой кишки укладывают в косогоризонтальном положении с длиной витка 20-30 см. Назоитестинальный зонд фиксируют к коже лица лейкопластырем или отдельным швом к кожной части крыла или перегородки носа.
Перед завершением лапаротомии в крае круглой связки печени пальпаторно определяют облитерированную пупочную вену в виде тяжа, идущего к воротам печени. Над пупочной веной, параллельно ей, рассекают брюшину и мобилизуют вену на протяжении 2,5-3 см (фиг.4). Под вену подводят две капроновые нити №4. Между держалками, в поперечном направлении на 1/2 диаметра пересекают пупочную вену. Края вены берут сосудистыми зажимами. Удерживая зажимы, в просвет вены вращательно-поступательными движениями вводят смоченный маточный зонд диаметром 3 мм по направлению к воротам печени, до ощущения "провала" (фиг.5). Затем в просвет вены вводят специальный катетер №8 или №10 с заглушкой, вытянутым дистальным концом и тремя боковыми отверстиями /ТУ 25-1961.032-87/ (фиг.6). Шприцем из воротной вены забирают для бактериологического исследования 2 мл портальной крови, которую помещают в среду Блаурок и немедленно отправляют в лабораторию. В катетер медленно вводят 20 мл 0,25% раствора новокаина, одновременно завязывая дистальную держалку, концы которой не срезают, для последующего выведения на переднюю брюшную стенку. Проксимальную держалку также завязывают, а свободные концы срезают. До катетера отдельными швами ушивают рассеченную брюшину круглой связки печени. Катетер выводят через лапаротомную рану на переднюю брюшную стенку и фиксируют к ней отдельными швами. Свободные концы дистальной держалки фиксируют на марлевом шарике и оставляют на передней брюшной стенке (фиг.7).
Следующим этапом оперативного пособия проводят тщательный лаваж брюшинной полости растворами антисептиков (хлорамин, хлоргексидин, фурациллин) до чистых промывных вод, с последующей оценкой функционирования дренажных трубок. Объем используемых для промывания растворов составляет 10-20 литров. Операция заканчивается дренированием сальниковой сумки, вскрытых гнойников забрюшинной клетчатки и брюшинной полости одно- и двухпросветными полихлорвиниловыми дренажными трубками с последующей установкой в первые-вторые сутки после операции, активной проточно-промывной аспирационной системы.
У некоторых больных назоинтестинальная интубация выполняется тотчас после вскрытия брюшинной полости, так как раздутые петли тонкой кишки ограничивают, а порой и полностью сковывают объем ревизионных и хирургических манипуляций оперирующего хирурга. Назоинтестинальная интубация выполняется после блокады корня брыжейки тонкой кишки 0,25% раствором новокаина в объеме 100-110 мл.
Программа энтеральной детоксикации включает следующие этапы:
1. Декомпрессионную назинтестинальную интубацию.
2. Внутрикишечный лаваж.
3. Энтеросорбцию.
4. Интрапортальные инфузии.
5. Раннее энтеральное зондовое питание.
В день операции и первые 5-6 дней после нее через канал зонда, находящийся в просвете тонкой кишки, капельно /по 20 капель в 1 мин/ 2 раза в сутки по 400 мл вводят антибактериальные препараты, физиологические растворы, раствор Рингера. В промежутках между этими инфузиями 3 раза в сутки по тому же каналу зонда шприцем Жане вводят энтеросорбент в 150 мл раствора Рингера и/или физиологического раствора в указанной выше дозе. Наружную часть канала после этого перекрывают на 30 мин для предупреждения вытекания данного раствора наружу. Второй канал зонда служит для удаления содержимого из желудка и его промываний раствором 3% бикарбоната натрия или физиологического раствора
На фоне интракишечного лаважа дополнительно помимо физиологического раствора, раствора Рингера, внутрипортально 3 раза в сутки /через каждые 8 ч/ вводят по 100 мл препарата производного нитроимидазола, например метронидазола или метрогила капельным способом по 40 капель в 1 мин. Через 4-5 дней после операции у больного в стерильных условиях шприцем берут 2,0-2,5 мл крови из портальной системы через пупочный катетер 7 для бактериологического исследования. При улучшении общего состояния пациента, восстановлении перистальтики кишечника и отрицательном результате микроскопии и бакпосева крови из портальной системы на анаэробные микроорганизмы /через 5-6 дней после операции/ введение инфузионных растворов и энтеросорбента через назоинтестинальный зонд прекращают, зонд извлекают из пищеварительного тракта с использованием электроотсоса. Отменяют также интрапортальные инфузии препарата производного нитроимидазола. Катетер в пупочной вене сохраняют для введения глюкозо-электролитных растворов, витаминов, кровезаменителей, а затем извлекают с соблюдением правил асептики и мер, предупреждающих кровотечение из реканализированной пупочной вены.
Клинический пример.
Больной К., 56 лет, история болезни №1105/26300 от 02.09.04.
Поступил в клинику через 32 часа от начала заболевания с диагнозом: перфоративная язва двенадцатиперстной кишки? острый панкреатит?, эндотоксикоз III степени, хроническая ишемическая болезнь сердца, хронический алкоголизм. При поступлении состояние больного тяжелое (по шкале SAPS 15-18 баллов, прогностическая летальность 31-49%), больной вял, заторможен, кожные покровы бледные, покрыты липким холодным потом. В легких с обеих сторон жесткое, ослабленное в нижних отделах дыхание, ЧДД 25 в минуту. Артериальное давление 95/70 мм рт.ст., ЧСС 100 в минуту. Язык сухой обложен серым налетом, живот равномерно вздут несколько отстает в акте дыхания. При пальпации живот резко болезненный во всех отделах, преимущественно в верхних отделах (эпигастральная область, правое и левое подреберье), напряжен. В эпигастральной области пальпируется плотный инфильтрат размерами 6×5 см. Определяются положительные симптомы раздражения брюшины. Перкуторно над всей поверхностью живота определяется тимпанит, аускультативно перистальтика резко ослаблена. В общем анализе крови лейкоцитоз 6,4×10%, ЛИИ=15,6 расч.ед., мочевина 7,8 ммоль/л, креатинин 140 мкмоль/л, амилаза 17 г/л×ч., билирубин 49,5 мкмоль/л. После проведения интенсивной предоперационной 3-часовой подготовки, в условиях реанимационного отделения больной оперирован. После выполнения диагностической лапароскопии, которая показала наличие у больного панкреонекроза, для выполнения адекватного оперативного пособия решено выполнить конверсию. При лапаротомии в брюшинной полости до 1000 мл серозно-фибринозного выпота, обращает на себя внимание спаянные между собой рыхлыми спайками неперестальтирующие, расширенные до 6 см, петли тонкой кишки, в просвете отмечается наличие секвестрированной жидкости. Большой сальник покрыт множественными бляшками стеатонекроза. При вскрытии сальниковой сумки из последней отмечено поступление до 150 мл жидкого гноя без запаха, отмечается некроз головки и тела с переходом на хвост поджелудочной железы, гнойный затек распространяется на корень брыжейки тонкой кишки. После блокады корня брыжейки тонкой кишки 0,25% раствором новокаина в количестве 100 мл выполнена тотальная назоинтестинальная интубация с интраоперационной энтеросорбцией. Произведена некрсеквестрэктомия деструкции поджелудочной железы, затека корня брыжейки тонкой кишки. Произведено канюлирование пупочной вены. Брюшинная полость промыта 6 литрами раствора фурациллина и хлорамина до чистых промывных вод. Сальниковая сумка, затек на корень брыжейки тонкой кишки, брюшинная полость дренированы полихлорвиниловыми трубками. Выполнена оментобурсостомия, брюшная полость ушита послойно, больной переведен в отделение реанимации для проведения интенсивной инфузионной, антибактериальной, дезинтоксикационной терапии, включая экстракорпоральную детоксикацию (плазмоферез), лаваж кишечника с энтеросорбентами, раннее энтеральное зондовое питание. К 3 суткам состояние больного стабилизировалось, значительно уменьшились признаки эндогенной интоксикации (АД 130/80 мм рт.ст., ЧСС 90 в минуту, ЧДД 18 в минуту, ЛИИ 4,8 расч.ед., мочевина 6,0 ммоль/л, креатинин 90 мкмоль/л, амилаза 36 г/л×ч., билирубин 20,5 мкмоль), начали выслушиваться перистальтические шумы. К 6 суткам состояние больного значительно улучшилось (АД 140/90 мм рт.ст., ЧСС 87 в минуту, ЧДД 18 в минуту, ЛИИ 3,2 расч.ед., мочевина 6,5 ммоль/л, креатинин 85 мкмоль/л, амилаза 26 г/л×ч., билирубин 18 мкмоль), перистальтика активная, газы отходят. Количество отделяемого по назоинтестинальному зонду значительно уменьшилось. Зонд удален. Дренажные трубки удалены на 44 сутки от момента операции. На 12 сутки послеоперационный период осложнился развитием панкреатического свища, который самостоятельно закрылся через 13 суток. Больной выписан на 49 сутки после операции. Исход - выздоровление.
Предлагаемый способ лечения апробирован нами на 44 больных с гнойно-некротическим панкреонекрозом, с положительным результатом лечения в 91,1%.
Предложенный способ обладает следующими преимуществами:
1. Позволяет снизить количество гнойно-некротических осложнений, количество повторных операций, что благоприятно отражается на результатах лечения заболевания.
2. Позволяет снизить эндогенную интоксикацию у больных с гнойно-некротическим панкреонекрозом и уменьшить число послеоперационных осложнений и послеоперационной летальности.
Заявляемый способ лечения гнойно-некротического панкреонекроза апробирован на достаточном клиническом материале, показал эффективность применения и может быть рекомендован к использованию в специализированных хирургических стационарах.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ РАСПРОСТРАНЕННОГО ПЕРИТОНИТА | 1999 |
|
RU2154997C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАНКРЕОНЕКРОЗА | 2000 |
|
RU2188045C2 |
| СПОСОБ ЛЕЧЕНИЯ ГНОЙНОГО ПАНКРЕАТИТА | 1992 |
|
RU2064779C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ДЕСТРУКТИВНОГО ПАНКРЕАТИТА | 2006 |
|
RU2334474C1 |
| СПОСОБ ВНУТРИПОРТАЛЬНОЙ ОЗОНОТЕРАПИИ ПРИ РАСПРОСТРАНЕННОМ ПЕРИТОНИТЕ | 2015 |
|
RU2594512C1 |
| Способ стимуляции перистальтики кишечника при комплексном лечении абдоминальной инфекции | 2016 |
|
RU2634630C1 |
| СПОСОБ ПРОФИЛАКТИКИ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ ПРИ ОСТРОЙ НЕПРОХОДИМОСТИ КИШЕЧНИКА | 1993 |
|
RU2107466C1 |
| СПОСОБ ЛЕЧЕНИЯ ДЕСТРУКТИВНОГО ПАНКРЕОНЕКРОЗА ОСЛОЖНЕННОГО ФЛЕГМОНОЙ ЗАБРЮШИННОГО ПРОСТРАНСТВА | 2002 |
|
RU2243725C2 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРИТОНИТА | 1997 |
|
RU2123361C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ НЕКРОТИЧЕСКОГО ПАНКРЕАТИТА | 2009 |
|
RU2405458C1 |
Изобретение относится к медицине, хирургии. Удаляют гнойно-некротические очаги, выполняют назоинтестинальную интубацию, лаваж тонкой кишки, интракишечно вводят энтеросорбент. Петли кишки поэтапно нанизывают на зонд, осуществляют тракцию зонда ближе к области связки Трейца, вытягивают его из желудка и зонд устанавливают так, чтобы последние 1-2 отверстия находились в желудке. Петли тонкой кишки укладывают в косогоризонтальном положении. Выполняют реканализацию пупочной вены с ее канюлированием для проведения внутрипортальной инфузионной терапии из расчета 40-45 мл/кг массы больного в сутки. Лечение проводят до полного восстановления перистальтики тонкой кишки. Способ позволяет повысить эффективность лечения больных с панкреонекрозом путем воздействия на аэробную и анаэробную флору в портальной системе. Предотвращает синдром кишечной недостаточности. Снижает интоксикационный синдром. 1 пр. 7 ил.
Способ лечения гнойно-некротического панкреонекроза, включающий выполнение тотальной назоинтестинальной интубации, реканализацию и катетеризацию пупочной вены, энтеросорбцию, отличающийся тем, что выполнение тотальной назоинтестинальной интубации осуществляют введением через носоглотку в желудок зонда, направляя его через пилорический отдел в 12-перстную кишку, при этом первую петлю тощей кишки отводят влево и поэтапно нанизывают тонкую кишку на зонд, присоединяют к концевой части зонда электроотсос в режиме разрежения 20-60 см водяного столба, производят аспирацию содержимого тонкой кишки, затем лаваж тонкой кишки, по мере заведения на зонд петель тонкой кишки осуществляют тракцию зонда ближе к области связки Трейца, вытягивают его из желудка и зонд устанавливают так, чтобы последние 1-2 отверстия находились в желудке, отмытый участок кишки через тот же зонд вводят 50-80 мл суспензии энтеросорбента с антибиотиком, петли тонкой кишки укладывают в косогоризонтальном положении с длиной витка 20-30 см, дополнительно интраоперационно выполняют реканализацию пупочной вены с ее канюлированием и последующими внутрипортальными инфузиями глюкозо-электролитных комплексов из расчета 30-40 мл/кг массы больного в сутки и внутрипортальным введением корригирующих и противомикробных препаратов в течение 5-6 дней после операции.
| СПОСОБ ЛЕЧЕНИЯ ПАНКРЕОНЕКРОЗА | 2000 |
|
RU2188045C2 |
| СПОСОБ ЛЕЧЕНИЯ СПАЕЧНОЙ БОЛЕЗНИ | 1998 |
|
RU2177741C2 |
| СПОСОБ ЛЕЧЕНИЯ РАСПРОСТРАНЕННОГО ПЕРИТОНИТА | 1999 |
|
RU2154997C1 |
| ПЕТРОВ Ю.Н | |||
| Кишечная непроходимость | |||
| - М.: Медицина, 1990, с.153-154 | |||
| ВАСИЛЬЕВ А.А | |||
| Антибактериальная терапия с целью профилактики инфицирования некротического панкреатита | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ хирургического лечения спаечной болезни | 1988 |
|
SU1701292A1 |
| ДЕЛЛИНЖЕР | |||
Авторы
Даты
2012-04-10—Публикация
2010-12-24—Подача