Настоящее изобретение относится к органическим соединениям, точнее к применению ингибиторов mTOR, для лечения нейроэндокринных опухолей.
Ингибитор mTOR в контексте настоящего изобретения означает соединение, которое нацеливается на внутриклеточную мишень млекопитающих для рапамицина (mammalian Target of rapamycin - mTOR). Фермент mTOR относится к семейству киназ, близких фосфатидилинозит-3-киназе (phosphatidylinositol 3-kinase - PI3-киназе). Соединение рапамицин и другие ингибиторы mTOR подавляют активность mTOR через комплекс с его внутриклеточным рецептором FKBP12 (РК506-связывающий белок 12). Фермент mTOR модулирует трансляцию специфических иРНК через регуляцию стадии фосфорилирования нескольких разных белков трансляции, преимущественно 4Е-РВ1, P70S6K (p70S6 киназа 1) и eEF2.
Рапамицин - известный макролидный антибиотик, образуемый актиномицетом Streptomyces hygroscopicus и имеющий формулу
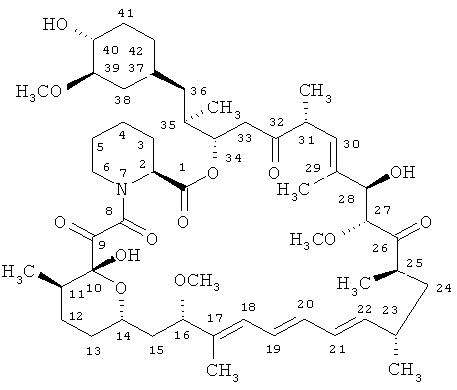
К другим ингибиторам mTOR относятся производные рапамицина, например, рапамицин, замещенный в положениях 40, и/или 16, и/или 32.
К примерам других ингибиторов mTOR относятся производные 40-O-алкилрапамицина, например, производные 40-O-гидроксиалкилрапамицина, например, 40-O-(2-гидрокси)этилрапамицин (эверолимус),
производные рапамицина, замещенные в положении 40 гетероциклом, например, 40-эпи-(тетразолил)-рапамицин (также называемый АВТ578),
производные 32-дезоксорапамицина и производные 32-гидроксирапамицина, например, 32-дезоксорапамицин,
производные 16-O-замещенного рапамицина, например, 16-пент-2-инилокси-32-дезоксирапамицин, 16-пент-2-инилокси-32(S или R)-дигидрорапамицин или 16-пент-2-инилокси-32(S или R)-дигидро-40-O-(2-гидроксиэтил)-рапамицин,
производные рапамицина, алкилированные по кислороду в положении 40, например, 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый CCI779 или темсиролимусом),
производные рапамицина (также иногда называемые рапалогами), например, описанные в WO 9802441 или WO 0114387, включая АР23573, например, 40-O-диметилфосфинилрапамицин,
соединения, описанные под названием биолимус (биолимус А9), включая 40-O-(2-этокси)этилрапамицин, и соединения, описанные под названиями ТАFА-93, АР23464, АР23675 или АР23841, или
ингибиторы mTOR, например, описанные в WO 2004101583, WO 9205179, WO 9402136, WO 9402385 и WO 9613273.
К предпочтительным ингибиторам mTOR относятся
рапамицин и/или
40-O-(2-гидроксиэтил)-рапамицин, и/или
32-дезоксорапамицин, и/или
16-пент-2-инилокси-32-дезоксорапамицин, и/или
16-пент-2-инилокси-32 (S или R)-дигидрорапамицин, и/или
16-пент-2-инилокси-32 (S или R)-дигидро-40-O-(2-гидроксиэтил)-рапамицин, и/или
40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]-рапамицин (также называемый CCI779), и/или
40-эпи-(тетразолил)-рапамицин (также называемый АВТ578), и/или
так называемые рапалоги, например, описанные в WO 9802441, WO 0114387 и WO 0364383, АР 23573, АР 23464, АР 23675 или АР 23841, например, АР 23573, и/или
соединения, описанные под названием «TAFA-93», и/или
соединения, описанные под названием «биолимус».
Более предпочтительно ингибитор mTOR выбран из группы, включающей рапамицин и/или
40-O-(2-гидроксиэтил)-рапамицин, и/или
32-дезоксорапамицин, и/или
16-пент-2-инилокси-32-дезоксорапамицин, и/или
16-пент-2-инилокси-32 (S или R)-дигидрорапамицин, и/или
16-пент-2-инилокси-32 (S или R)-дигидро-40-O-(2-гидроксиэтил)-рапамицин, и/или
40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]-рапамицин (также обозначаемый CCI779), и/или
40-эпи-(тетразолил)-рапамицин (также обозначаемый АВТ578), и/или
АР23573, например, 40-O-(2-гидроксиэтил)-рапамицин.
Исходя из наблюдаемой активности установлено, что ингибиторы mTOR могут быть применимы, например, в качестве иммуносупрессантов, например, при лечении острого отторжения аллотрансплантата, а также дополнительно обладают мощными антипролиферативными свойствами, благодаря которым они применимы для химиотерапии рака, в частности, для лечения солидных опухолей, особенно сформированных солидных опухолей.
Установлено, что эндокринные, например, нейроэндокринные опухоли (НЭО), присутствуют в эндокринной системе. Карциноидные опухоли являются особым типом опухолей, и обычно их классифицируют в качестве эндокринных опухолей. Карциноидные опухоли принадлежат к семейству нейроэндокринных опухолей, формируемых из клеток нейроэндокринной системы. В кишечном тракте эти опухоли формируются глубоко в слизистой, растут медленно и прорастают в выстилающую подслизистую оболочку и на поверхность слизистой. Это приводит к формированию мелких плотных узлов, которые выступают в просвет кишечника. Панкреатические нейроэндокринные опухоли (опухоли островковых клеток), которые ранее классифицировали в качестве APUDом (опухолей из клеток системы захвата предшественников аминов и их декарбоксилирования - tumors of the amine precursor uptake and decarboxylation system), к которым относится менее половины всех нейроэндокринных опухолей и только 1-2% от всех панкреатических опухолей. Панкреатические НЭО могут возникнуть либо в поджелудочной железе (опухоли бета-клеток, глюкагономы, нефункционирующие НЭО поджелудочной железы, НЭО поджелудочной железы, вызывающие гиперкальциемию), либо и в поджелудочной железе, и в других частях тела (гастриномы, випомы, соматостатиномы, GRFомы). Гормоны, секретируемые НЭО поджелудочной железы, зависят от происхождения клеток и физиологически вовлечены в сеть аутокринных, паракринных и нейротрансмиттерных контактов. Хотя секреция гормонов происходит не во всех случаях панкреатических НЭО, очевидно «нефункционирующие» (т.е. не секретирующие) панкреатические НЭО склонны к проявлению большей агрессивности наряду с проявлением симптомов, связанных с массой опухоли (см., например, Barakat и др., Endocrine-related cancer 11, 2004, сс.1-18, Tomassetti и др., Ann Oncol 12, 2001, cc.S95-S99).
Все панкреатические НЭО, за исключением 90% опухолей бета-клеток, обладают длительным потенциалом метастазирования. Большинство очевидно злокачественны на момент постановки диагноза, а не менее 60% сформировали метастазы в печень. Наиболее частой причиной смерти от панкреатических НЭО является печеночная недостаточность (Warner R.R.P., Gastroenterology 128, 2005, сс.1668-1684).
В предшествующих исследованиях установлено, что степень 5-летнего выживания в сериях из 83 специальным образом не отобранных пациентов с панкреатическими НЭО составляет 55,3%, что указывает на неудовлетворенную медицинскую потребность в продолжение лечения у пациентов с панкреатическими НЭО, у которых болезнь прогрессирует после 1 или нескольких курсов химиотерапии.
Исторически сложилось, что карциноидные опухоли классифицируют по месту их возникновения при эмбриональном развитии, а именно, из головной кишки (например, бронхиальная, легочная или желудочная карциноидная опухоль), средней кишки (например, карциноидная опухоль тонкой кишки или аппендицита) или задней кишки (например, карциноидная опухоль прямой кишки), см., например, Kulke M., Cancer Treatment Reviews 29, 2003, сс.363-370.
Первичные опухоли головной кишки ограничиваются тимусом, легкими, желудком и двенадцатиперстной кишкой.
Карциноиды средней кишки локализованы в дистальном отделе подвздошной кишки, слепой кишки и проксимального отдела толстой кишки. Интересную подгруппу в этой группе представляют карциноиды аппендицита, которые часто оказываются доброкачественными и редко формируют метастазы. Среди карциноидов средней кишки преобладают злокачественные карциноидные опухоли, особенно при наличии карциноидного синдрома.
Опухоли задней кишки в основном локализованы в дистальном отделе толстой кишки и в прямой кишке.
Экспериментальные данные указывают, что частота встречаемости карциноидных опухолей легких и желудка за последние двадцать лет повысилась.
На основании патогистологических критериев карциноиды могут быть поделены на типичные карциноиды (ТК) и атипичные карциноиды (АК). Карциноидные опухоли занимают широкий спектр нейроэндокринных опухолей от слабо выраженных злокачественных ТК до умеренно выраженных АК и до выраженной крупноклеточной нейроэндокринной карциномы и мелкоклеточной карциномы легких.
Карциноидные опухоли легких, например, включают нейроэндокринную карциному, карциному из клеток Кульчицкого (ККК), бронхиальные карциноидные опухоли, бронхиальные аденомы, типичные карциноиды, атипичные карциноиды, карциноидный синдром, мелкоклеточные карциномы, клетки Кульчицкого, аргентаффинные клетки, легочные карциноиды, нейроэндокринные опухоли легких, (первичные) неоплазмы легких, бронхолегочные карциноидные опухоли, неоплазмы легких, рак легких, внутрибронхиальные образования.
Бронхиальные карциноидные опухоли могут происходить из нейросекреторных клеток слизистой бронхов, и ранее их классифицировали в качестве бронхиальных аденом. Бронхиальные карциноиды в настоящее время классифицируют в качестве слабовыраженных злокачественных неоплазм, поскольку они могут вызвать местное прорастание опухоли, проявляют тенденцию к местным рецидивам и редким метастазам вне грудной полости. Бронхиальные карциноиды принадлежат к нейроэндокринным опухолям, диапазон которых распространяется от бронхиального карциноида с одной стороны до мелкоклеточной карциномы или, возможно, крупноклеточных нейроэндокринных опухолей с другой стороны. Они демонстрируют широкий диапазон клинических и биологических проявлений, включая способность синтезировать и секретировать пептидные гормоны и нейроамины, в частности адренокортикотропный гормон (adrenocorticotropic hormone - АСТН), серотонин, соматостатин и брадикинин.
Бронхиальные карциноидные опухоли могут возникать из клеток Кульчицкого (аргентаффинных клеток) в слизистой бронхов. Предполагают, что преимущественное распространение клеток происходит в месте раздвоения долевого бронха. Эти клетки являются нейросекреторными клетками, которые связаны с системой потребления аминного предшественника и декарбоксилирования (amine precursor uptake and decarboxylation - APUD). Они способны синтезировать серотонин (5-гидрокситриптамин), 5-гидрокситриптофан, АСТН, норадреналин, бомбезин, кальцитонин, антидиуретический гормон (antidiuretic hormone - ADH) и брадикинин.
Крупноклеточная нейроэндокринная карцинома легких описана заново на основании клинико-патологических данных, и показано, что эта форма рака отличается от мелкоклеточной карциномы и имеет плохой прогноз.
Типичные карциноидные опухоли легких представляют наиболее дифференцированный и наименее биологически агрессивный тип легочных нейроэндокринных опухолей. Эти опухоли отличаются медленным ростом и проявляют тенденцию к редкому метастазированию. Атипичные карциноидные опухоли обладают более агрессивной гистологической и клинической картиной. Они метастазируют с довольно высокой скоростью в отличие от типичных карциноидных опухолей. Известно, что карциноидный синдром связан с очень крупными бронхолегочными карциноидными опухолями или наблюдается при метастазировании. Установлено, что карциноидный синдром гораздо реже связан с карциноидами легочного происхождения, чем с карциноидами желудочно-кишечного тракта. Эндокринные синдромы, выявленные в ассоциации с мелкоклеточной карциномой легких, реже выявляются с карциноидными опухолями легких, однако некоторые эндокринные отклонения от нормы свойственны и типичным, и атипичным карциноидным опухолям легких.
Карциноидные опухоли желудочно-кишечного тракта могут проявлять агрессивное биологическое сходство с аденокарциномами, особенно когда они локализованы в толстой кишке, желудке и тонком кишечнике, см., например, Modlin I.M. и др., Gastroenterology 128, 2005, сс.1717-1751. Для карциноидов тонкого кишечника, которые являются наиболее частой причиной карциноидного синдрома из-за метастазирования в печень, формирование метастазов возрастает пропорционально размеру первичной опухоли (Tomassetti и др., 2001, см. выше).
Имеющиеся данные по встречаемости и выживаемости подтверждают, что клинические исследования новых противораковых агентов у пациентов с карциноидными опухолями средней кишки могут обеспечить неудовлетворенную медицинскую потребность у все возрастающей группы пациентов с карциноидами.
Карциноидный синдром вызывается гиперсекрецией многочисленных гормональных продуктов, осуществляемой опухолевыми клетками, включая кинины, простагландины, вещество Р, гастрин, кортикотропин и хромогранин А (см., например, Davis и др., Gynecology & Obstetrics 137, 1973, сс.637-644). Различные эндокринные или нейроэндокринные синдромы могут быть начальными клиническими проявлениями либо типичных, либо атипичных карциноидных опухолей легких. Карциноидный синдром, гиперкортицизм и синдром Кушинга, несоответствующая секреция ADH, повышенная пигментация, вторичная по отношению к избытку меланоцитостимулирующего гормона (МСГ), и эктопическая выработка инсулина, приводящая к гипогликемии, являются некоторыми из эндокринопатий, которые могут быть вызваны карциноидной опухолью легких у пациентов, которые в других отношениях бессимптомны.
К большинству обычных симптомов относятся кровохарканье, кашель, рецидивирующая легочная инфекция, лихорадка, дискомфорт и боль в грудной клетке, одностороннее свистящее дыхание и частое дыхание, гиперемия и диарея. Паранеопластические синдромы встречаются редко, к ним относятся карциноидный синдром, синдром Кушинга и эктопическая секреция рилизинг-фактора гормона роста (соматолиберина).
К другим, реже встречающимся, симптомам, относятся сердечные проявления, вторичные по отношению к фиброзу эндокарда (Jacobsen M.B. и др., Eur Heart J 16, 1995, сс.263-268), которые могут привести к регургитации клапанов (пороку клапанов сердца), с разной степенью выраженности сердечной недостаточности у пациентов с проявлениями заболевания сердца. Свистящее дыхание или симптомы, напоминающие астму, кожные повреждения, напоминающие пеллагру с гиперкератозом, боль в брюшной полости, телеангиэктазии и приступообразное низкое артериальное давление также наблюдают у ряда пациентов. У пациентов с карциноидом легких часто наблюдают следующие симптомы: рецидивирующее воспаление легких, кашель, кровохарканье или боль в грудной клетке. Большинство карциноидных опухолей легких находится около воротных областей органов. Эктопическая секреция кортикотропина из карциноидных опухолей легких также может быть при синдроме Кушинга. В начале курса симптомы обычно эпизодические и могут быть спровоцированы стрессом, катехоламинами и потреблением пищи или алкоголя. При остром пароксизме систолическое кровяное давление обычно падает на 20-30 ммHg. Фиброз эндокарда может вызвать порок клапана сердца, обычно поражая проксимальный отдел трехстворчатого клапана и клапаны легочного ствола и приводя к недостаточности трехстворчатого клапана и вторичной правосторонней сердечной недостаточности.
Предшествующий анализ химиотерапевтического лечения карциноидов показал, что чувствительность этих опухолей к различным цитотоксическим лекарственным средствам низкая, а комбинации лекарственных средств не повышают эффективности лечения. На основании анализа различных комбинированных терапий, включая дакарбазин/фторурацил или 5-фторурацил/эпирубицин, был сделан вывод, что нет возможности рекомендовать специфический химиотерапевтический режим для пациентов с высоко дифференцированными злокачественными эндокринными заболеваниями желудочно-кишечного тракта (Arnold R., Rinke А. и др., Clinical Gastroenterology 19, 2005, сс.649-656). Выраженная устойчивость таких опухолей к современным известным способам лечения указывает на то, что существует насущная потребность в современной медицине в разработке новых способов лечения такой группы пациентов.
В качестве составной части эндокринной системы, которая регулирует гормоны, гипофиз контролирует через секрецию многие другие железы. Будучи «главной железой», гипофиз вырабатывает несколько гормонов, но также действует в качестве посредника между мозгом и другими железами внутренней секреции. Гормоны и гипофиз выполняют многие гомеостатические и специализированные функции, например, рост костей и маточные сокращения.
Нейроны несут сигналы относительно выработки гормонов между гипофизом и гипоталамусом. Обе железы расположены в основании мозга, умещаясь в округлой части кости, и тщательно защищены. Они контактируют через пучок нейронов, называемый воронкой. Действуя совместно, обе железы регулируют все гормоны, которые циркулируют в кровяном русле, контролируя, например, рост и пигментацию волос. Гормоны являются информационными молекулами, действующими на длительные расстояния, которые передают клеткам сигнал о переходе в активное состояние или о пребывании в состоянии покоя. Гипофиз контролирует щитовидку, надпочечники, яичники и семенники, хотя его размер всего лишь с горошину.
Разные части гипофиза выполняют определенные функции. Задняя доля гипофиза, называемая нейрогипофизом, выделяет гормоны вазопрессин и окситоцин, но не образует их. Вазопрессин является антидиуретическим гормоном, который контролирует сорбцию воды почками. Окситоцин является специфическим гормоном, который действует при родах, вызывая мышечные сокращения. Передняя доля гипофиза называется аденогипофизом. Она вырабатывает разные гормоны, например, пролактин, который стимулирует лактацию. Меланоциты побуждают организм вырабатывать меланин в коже и пигмент в волосах. Фолликулостимулирующий гормон определяет, где и когда в ходе развития должны расти волосы. Очень важным является гормон роста, который контролирует рост костей, определяя рост, и он особенно активен в подростковом возрасте. Гормоны также контролируют железы. Щитовидка взаимодействует с тиротропином, надпочечники стимулируются адренокортикотропином, а половые железы подвергаются воздействию лютеинизирующего гормона. Гипофиз ответственен за многие стадии и аспекты процесса созревания (взросления). Опухоли гипофиза обычно доброкачественные и составляют только 10% от всех опухолей мозга. Однако из-за расположения гипофиза (в основании черепа) опухоль гипофиза растет вверх. В итоге многие опухоли гипофиза давят на зрительные нервы, вызывая нарушение зрения. Симптомы изменяются в зависимости от того, какой тип опухоли формируется, и какая часть гипофиза поражена. Опухоли гипофиза могут вызвать симптомы, связанные с избыточной выработкой гормонов гипофиза или с их недостаточной выработкой. Другие симптомы могут быть определены близостью этих опухолей к определенным структурам мозга, например, зрительному нерву, что приводит к потере зрения. Кроме того, у каждого индивидуума симптомы проявляются по-разному и во многом напоминают другие условия или медицинские осложнения.
Наиболее распространенным типом опухоли гипофиза является клинически не проявляющаяся опухоль, поскольку у пациентов нет классических гипофизарных синдромов, вызванных избытком гормонов, например, акромегалии. Эти типы опухолей могут быть обнаружены при случайной оценке какой-либо проблемы. Клинически не проявляющиеся опухоли могут вызвать гипопитуитаризм или недостаточность гипофиза, которые могут привести к недостаточности половой функции, сниженной выработке спермы и прекращению менструального периода, сопровождающемуся утомляемостью.
Другая распространенная опухоль гипофиза называется пролактиномой - доброкачественной опухолью, которая вырабатывает гормон пролактин. Пролактин стимулирует выработку грудного молока после родов. У женщин с пролактиномой менструальный цикл может быть не столь выражен или может отсутствовать, но молоко может вырабатываться.
Одна из редко встречаемых опухолей гипофиза вызывает избыточную выработку гормона роста (гормон необходим для нормального роста детей), которая приводит к акромегалии. У взрослых такие опухоли приводят к избыточному соматическому росту и множеству системных медицинских последствий. Другая редкая опухоль гипофиза приводит к болезни Кушинга - расстройство, которое вызвано избыточной выработкой стероидов.
Множественная эндокринная неоплазия (Multiple endocrine neoplasia type 1 - MEN 1) является относительно редким наследственным заболеванием. У индивидуумов, наследующих ген MEN 1, существует повышенная вероятность развития избыточной активности и увеличения некоторых эндокринных желез. Эндокринными железами, наиболее часто поражаемыми MEN 1, являются паращитовидные железы, поджелудочная железа и гипофиз. Практически у всех индивидуумов, наследующих ген MEN 1, развивается избыточная активность паращитовидных желез (гиперпаратиреоидизм) на некоторой стадии развития. Другие эндокринные железы реже становятся избыточно активными, однако у людей с геном MEN 1 обычно происходит избыточная активность более чем одной эндокринной железы. Избыточная активность в разных эндокринных железах может происходить одновременно или в разное время жизни конкретного человека. Ген MEN 1 может привести к избыточной активности и увеличению размера трех эндокринных желез, перечисленных выше. Люди, наследующие ген MEN 1, проявляют склонность к развитию избыточной выработки гормонов паращитовидной железы, гипофиза и поджелудочной железы (на основании чего врачи по результату измерения определенных гормонов в крови могут судить об избыточной выработке гормонов). Повышенная выработка гормона обычно связана с увеличением размера железы. Увеличение эндокринной железы и избыточной выработки гормона обычно не происходит во всех зонах эндокринной железы в одно и то же время. Некоторые части эндокринных желез с избыточной активностью растут гораздо быстрее и вырабатывают больше гормона по сравнению с другими частями той же железы. Части эндокринной железы, которые растут гораздо быстрее, становятся «образованиями». Эти образования обычно доброкачественные. Доброкачественные образования в эндокринных железах называются аденомами.
Аденомы являются доброкачественными (не раковыми) образованиями и не распространяются в другие части организма. Аденомы гипофиза (опухоли гипофиза, опухоли нервной системы) могут привести к повреждению нервов, нарушению роста и изменениям гормонального баланса. Симптомы аденом гипофиза могут существенно варьировать, в основном в зависимости от того, секретирует опухоль один гормон или несколько разных гормонов. Даже если опухоль не вырабатывает каких-либо гормонов, ее расположение в основании мозга может привести к возникновению тяжелых симптомов. Симптомы могут выражаться, например, в нарушении зрительного восприятия (в двоении изображения или в нерезком изображении), утрате периферийного зрения, внезапной слепоте, головной боли, головокружении, потере сознания, тошноте, слабости, неожиданном изменении массы тела, аменорее, эректильной дисфункции, пониженном сексуальном желании (особенно у мужчин), разрастании костей черепа, рук и ног, понижении тона голоса, изменениях лица (в связи с изменением костей лицевого отдела черепа), более редком расположении зубов, болях в суставах, повышенной потливости, пурпурных следах растяжений на животе, усиленном росте волос, отложении жира в месте перехода шеи в спину, в унынии или депрессии, легком формировании кровоподтеков, сердцебиениях (быстрых или нерегулярных), треморе, повышенном аппетите, чувстве теплоты или жара, нарушениях сна, беспокойстве, частом мочеиспускании, новообразовании на шее спереди (увеличенной щитовидке).
Установлено, что ингибиторы mTOR могут применяться для лечения таких специфических типов опухолей.
В связи с установленными экспериментальными данными настоящее изобретение предусматривает несколько объектов:
1.1 Способ лечения эндокринных опухолей, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.2 Способ подавления роста эндокринных опухолей, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.3 Способ подавления или уничтожения эндокринных опухолей, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.4 Способ индукции регрессии эндокринных опухолей, например, уменьшения их массы, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.5 Способ лечения инвазивности эндокринных опухолей или симптомов, ассоциированных с таким опухолевым ростом, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.6 Способ предупреждения метастатического распространения эндокринных опухолей или предупреждения или подавления роста микрометастазов, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.7 Способ лечения расстройства, ассоциированного с эндокринными опухолями, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ингибитора mTOR.
1.8 Применение ингибитора mTOR для получения лекарственного средства для применения в способе по одному из пп.1.1-1.7, указанному выше.
1.9 Фармацевтическая композиция, включающая ингибитор mTOR совместно по меньшей мере с одним фармацевтически приемлемым эксципиентом, например, соответствующим носителем и/или разбавителем, например, наполнителями, связующими агентами, разрыхлителями, улучшителями прессования агентами скольжения, сахарами или подсластителями, ароматизирующими агентами, консервантами, стабилизаторами, увлажняющими агентами и/или эмульгаторами, растворителями, солями для регуляции осмотического давления и/или буферами, для применения в одном из способов или применении по пунктам 1.1-1.7, указанным выше.
В контексте настоящего изобретения к эндокринным опухолям относятся, например, нейроэндокринные опухоли, панкреатические нейроэндокринные опухоли и опухоли паращитовидных желез, поджелудочной железы и гипофиза.
К карциноидным опухолям в контексте настоящего изобретения относятся, например, типичные и атипичные карциноиды, начиная от типичных слабо выраженных злокачественных опухолей до промежуточных атипичных, выраженной крупноклеточной нейроэндокринной карциномы и мелкоклеточной карциномы легких, например, включая карциноиды, образующиеся из:
- головной кишки, например, бронхиальные, легочные или желудочные карциноиды, например, первичные опухоли головной кишки, сосредоточенные в тимусе, легких, желудке и двенадцатиперстной кишке, например, карциноидные опухоли желудочно-кишечного тракта, например, локализованные в толстой кишке, желудке или тонкой кишке, например, карциноиды тонкой кишки,
- средней кишки, например, карциноиды тонкой кишки или аппендикса, например, локализованные в дистальном отделе подвздошной кишки, в слепой кишке и в проксимальном отделе толстой кишки, или
- задней кишки, например, карциноиды прямой кишки.
К карциноидным опухолям легких в контексте настоящего изобретения относятся нейроэндокринная карцинома, карцинома из клеток Кульчицкого (клетки Кульчицкого, аргентаффинные клетки), бронхиальные карциноидные опухоли, бронхиальные аденомы, например, включая бронхиальные аденомы, например, мелкоклеточную карциному и крупноклеточные нейроэндокринные опухоли, типичные карциноиды или атипичные карциноиды, ассоциированные с крупными бронхолегочными карциноидными опухолями или мелкоклеточными карциномами, легочные карциноиды, нейроэндокринные опухоли легких, крупноклеточная нейроэндокринная карцинома легких, (первичные) неоплазмы легких, бронхолегочные карциноидные опухоли, неоплазмы легких, рак легких, внутрибронхиальные образования.
К нейроэндокринным опухолям поджелудочной железы в контексте настоящего изобретения относятся, например, опухоли островковых клеток, APUDomas, инсулиномы, глюкагономы, нефункционирующие НЭО поджелудочной железы, НЭО поджелудочной железы, ассоциированные с гиперкальциемией, гастриномами, випомами, соматостатиномами, GRFомы.
В контексте настоящего изобретения к симптомам эндокринной или нейроэндокринной опухоли, например, относятся кровохарканье, кашель, рецидивирующая легочная инфекция, лихорадка, дискомфорт и боль в грудной клетке, одностороннее свистящее дыхание и частое дыхание, гиперемия и диарея, карциноидный синдром эндокринных или нейроэндокринных синдромов, например, включая проявления и типичных, и атипичных карциноидных опухолей легких, синдром Кушинга, несоответствующая секреция ADH, повышенная пигментация, вторичная по отношению к избытку MSH, и эктопическая выработка инсулина, приводящая к гипогликемии, эктопическая секреция рилизинг-фактора гормона роста (соматолиберина), эктопическая секреция кортикотропина, сердечные проявления, вторичные по отношению к фиброзу эндокарда (эндокардиальный фиброз), регургитация клапанов (порок клапанов сердца), недостаточность трехстворчатого клапана, вторичная правосторонняя сердечная недостаточна.
В контексте настоящего изобретения к опухолям паращитовидной железы, поджелудочной железы и гипофиза относятся опухоли гипофиза, опухоль нервной системы, например, аденома, множественная эндокринная неоплазия типа 1 (MEN 1).
В контексте настоящего изобретения к симптомам опухоли гипофиза относятся те симптомы, которые ассоциированы с избыточной выработкой гормонов гипофиза, и симптомы, вызванные пониженной выработкой гормонов гипофиза, потеря зрения, клинически не функционирующие опухоли, например, ассоциированные с недостаточностью гипофиза при гипопитуитаризме, например, связанные с нарушением половой функции, пониженной выработкой спермы и прекращением менструального периода, сопровождающимся утомляемостью, пролактинома, доброкачественная опухоль, которая вырабатывает гормон пролактин, акромегалия, например, ассоциированная с избыточным соматическим ростом и множеством системных медицинских последствий, болезнь Кушинга, повреждения нервов, нарушения роста, изменения гормонального баланса, нарушения зрительного восприятия (двоение изображения или нерезкое изображение), утрата периферийного зрения, внезапная слепота, головная боль, головокружение, потеря сознания, тошнота, слабость, неожиданное изменение массы тела, аменорея, эректильная дисфункция, пониженные сексуальные потребности (особенно у мужчин), разрастание костей черепа, рук и ног, понижение тона голоса, изменения лица (в связи с изменением костей лицевого отдела черепа), более редкое расположение зубов, боли в суставах, повышенная потливость, красные следы растяжений на животе, усиленный рост волос, отложение жира в месте перехода шеи в спину, уныние или депрессия, легкое формирование кровоподтеков, сердцебиения (быстрые или нерегулярные), тремор, повышенный аппетит, чувство теплоты или жара, нарушение сна, беспокойство, частое мочеиспускание, новообразование спереди на шее (увеличенная щитовидка).
В настоящем изобретении при упоминании опухолевого заболевания, карциномы или рака, также в качестве альтернативы или дополнительно подразумеваются метастазы в исходном органе или ткани и/или какой-либо другой локализации, независимо от расположения опухоли и/или метастазов.
К расстройствам, связанным с эндокринными опухолями, относятся симптомы эндокринных или нейроэндокринных опухолей и симптомы опухолей гипофиза, например, указанные выше.
К расстройствам также относятся заболевания.
Ингибитор mTOR может применяться, например, в способах по описанным пунктам 1.1-1.8, один или в комбинации с одним или несколькими лекарственными веществами по меньшей мере с одним вторым лекарственным веществом.
В настоящем изобретении также предусмотрены следующие объекты:
2.1 Комбинация ингибитора mTOR по меньшей мере с еще одним вторым лекарственным веществом, например, для какого-либо применения, указанного выше в пунктах 1.1-1.8.
2.2 Фармацевтическая комбинация, включающая ингибитор mTOR в комбинации по меньшей мере с одним вторым лекарственным веществом, например, для какого-либо применения, указанного выше в пунктах 1.1-1.8.
2.3 Фармацевтическая комбинация, включающая ингибитор mTOR в комбинации по меньшей мере с одним вторым лекарственным веществом, и один или несколько фармацевтически приемлемых эксципиентов, например, для какого-либо применения, указанного выше в пунктах 1.1-1.8.
2.4 Применение ингибитора mTOR для получения лекарственного средства для применения в комбинации со вторым лекарственным веществом, например, для какого-либо применения, указанного выше в пунктах 1.1-1.8.
2.5 Какой-либо способ по указанным выше пунктам 1.1-1.8, включающий совместное, сопутствующее или последовательное введение терапевтически эффективного количества ингибитора mTOR и по меньшей мере одного второго лекарственного вещества, например, в форме фармацевтической комбинации или композиции.
2.6 Ингибитор mTOR в комбинации по меньшей мере с еще одним вторым лекарственным веществом для приготовления лекарственного средства, например, для применения в каком-либо из способов, указанных выше в пунктах 1.1-1.8.
2.7 Какой-либо способ, указанный выше в пунктах 2.1-2.6, в котором ингибитор mTOR вводят периодически.
К комбинациям относятся фиксированные комбинации, в которых ингибитор mTOR и по меньшей мере одно второе лекарственное вещество находятся в едином составе, наборы, в которых ингибитор mTOR и по меньшей мере одно второе лекарственное вещество в разных составах упакованы в одну и туже упаковку, например, вместе с инструкцией по совместному введению, свободные комбинации, в которых ингибитор mTOR и по меньшей мере второе лекарственное вещество упакованы раздельно, но инструкции по совместному или последовательному введению приводятся.
В другом объекте настоящего изобретения предусмотрены
2.8 Фармацевтическая упаковка, включающая первое лекарственное вещество, являющееся ингибитором mTOR, и по меньшей мере второе лекарственное вещество, вместе с инструкциями по совместному введению.
2.9 Фармацевтическая упаковка, включающая ингибитор mTOR вместе с инструкциями по совместному введению, и по меньшей мере с одним вторым лекарственным веществом.
2.10 Фармацевтическая упаковка, включающая по меньшей мере одно второе лекарственное вещество вместе с инструкциями по совместному введению с ингибитором mTOR, например, для применения в каком-либо из способов, указанных выше в пунктах 1.1-1.8.
Лечение комбинациями согласно настоящему изобретению может предусматривать улучшения по сравнению с лечением единственным лекарственным средством.
В другом объекте настоящего изобретения предусмотрены, например, для применения в каком-либо из способов, указанных выше в пунктах 1.1-1.8:
2.11 Фармацевтическая комбинация, включающая количество ингибитора mTOR и количество второго лекарственного вещества, в которой указанные количества достаточны для индукции синергетического терапевтического эффекта.
2.12 Способ улучшения терапевтического применения ингибитора mTOR, заключающийся в совместном введении, например, одновременном или последовательном, терапевтически эффективного количества ингибитора mTOR и второго лекарственного вещества.
2.13 Способ улучшения терапевтического применения второго лекарственного вещества, заключающийся в совместном введении, например, одновременном или последовательном, терапевтически эффективного количества ингибитора mTOR и второго лекарственного вещества.
В приведенном выше способе 2.11-2.13 действие ингибитора mTOR или второго лекарственного вещества может быть повышено по сравнению с лечением одним лекарственным средством, например, комбинированное лечение может привести к синергетическим эффектам или может преодолеть устойчивость в отношении ингибитора mTOR или химиотерапевтического агента, например, при применении в каком-либо из способов по описанным выше пунктам 1.1-1.8.
(Фармацевтическая) комбинация, например, композиция, приведенная выше в пунктах 2.1-2.13, включает:
а) первый агент, являющийся ингибитором mTOR, и
б) второе лекарственное вещество, выступающее в качестве сопутствующего агента и являющегося химиотерапевтическим агентом, например, агентом, описанным в настоящем изобретении выше или ниже.
Лечение расстройств (заболеваний) по настоящему изобретению включает профилактику (предупреждение).
Для такого лечения соответствующая доза, безусловно, может варьировать в зависимости, например, от химической природы и данных по фармакокинетике применяемого соединения, индивидуальных особенностей организма, способа введения, а также от природы и тяжести состояний, подвергаемых лечению, Однако, в целом, для получения удовлетворительных результатов лечения у крупных млекопитающих, например, у людей, диапазоны доз включают
- примерно от 0,0001 г до примерно 1,5 г, например, 0,001-1,5 г,
- примерно от 0,001 мг/кг массы тела до примерно 20 мг/кг массы тела, например, от 0,01 мг/кг массы тела до 20 мг/кг массы тела,
например, при введении в виде разделенных дозировок до 4 раз в сутки.
В способе, применении или комбинации, фармацевтической комбинации или фармацевтической композиции, предусмотренных в настоящем изобретении, ингибитор mTOR, например, рапамицин или производное рапамицина, могут быть введены соответствующим образом, например, в дозировках, известных для ингибиторов mTOR, каким-либо способом введения, например, внутрь, например, перорально или парентерально. Например, эверолимус может быть введен, например, перорально, в дозировках 0,1-15 мг, например, 0,1-10 мг, например, 0,1 мг, 0,25 мг, 0,5 мг, 0,75 мг, 1 мг, 2,5 мг, 5 мг или 10 мг, более предпочтительно от 0,5 мг до 10 мг, например, в форме (дисперсных) таблеток, например, включающих эверолимус в форме твердых дисперсий, например, недельная дозировка может включать до 70 мг, например, 10-70, например, 30-50 мг, в зависимости от заболевания, подвергаемого лечению. Рапамицин или, например, темсиролимус, может быть введен парентерально в близких диапазонах доз.
Второе лекарственное вещество может вводиться соответствующей комбинированной терапией, например, согласно обычному способу, например, аналогичному введению, показанному для специфического лекарственного вещества при монотерапии.
Второе лекарственное вещество согласно настоящему изобретению может быть введено каким-либо обычным способом, например, внутрь, например, включая назальное, буккальное, ректальное введение, парентерально, например, включая внутривенное, внутриартериальное, внутримышечное, внутрисердечное, подкожное введение, внутрикостную инфузию, чрезкожное введение (путем диффузии через интактную кожу), введение через слизистую (путем диффузии через мембрану слизистой), введение ингаляцией, местное введение, например, включая надкожное, интраназальное, интратрахеальное введение, внутрибрюшинное (инфузией или инъекцией в брюшную полость), эпидуральное (перидуральное) введение (инъекция или инфузия в эпидуральную область), интратекальное введение (инфузией или инъекцией в спинномозговую жидкость), введение в стекловидное тело (введение через глаз), или через медицинские устройства, например, для локальной доставки, например, для локального высвобождения, например, через стенты, например, в форме таблеток с покрытием или без покрытия, капсул, (инъекционных) растворов, растворов для инфузии, твердых растворов, суспензий, дисперсий, твердых дисперсий, например, в форме ампул, флаконов, в форме мазей, гелей, паст, порошков для ингаляции, пены, настоек, помады для губ, капель, спрея или суппозиториев.
Второе лекарственное вещество по настоящему изобретению может быть введено в форме фармацевтически приемлемой соли или в свободной форме, необязательно в форме сольвата. Фармацевтические композиции по настоящему изобретению могут быть получены обычными способами или способами, близкими им, например перемешиванием, гранулированием, нанесением покрытия, растворения или лиофилизации. Отдельные дозированные формы могут содержать, например, примерно от 0,1 мг до примерно 1500 мг, например, от 1 мг до примерно 1000 мг. Описанные выше фармацевтические композиции, включающие комбинацию настоящего изобретения, и фармацевтические композиции, включающие второе лекарственное вещество, могут быть получены соответствующим образом, например, традиционными способами или способом, описанным в настоящем изобретении для фармацевтической композиции настоящего изобретения.
В контексте настоящего изобретения понятие «второе вещество» означает либо ингибитор mTOR, отличный от первого лекарственного вещества, или химиотерапевтический агент, отличающийся от ингибитора mTOR, предпочтительно, какой-либо химиотерапевтический агент, отличный от ингибитора mTOR.
Например, второе лекарственное вещество в контексте настоящего изобретения может быть, например,
- противоопухолевым лекарственным средством, предпочтительно агентом против эндокринной опухоли,
- противовоспалительным, и/или иммуномодулирующим, и/или антиаллергическим лекарственным средством,
- комбинацией противоопухолевого лекарственного средства с противовоспалительным и/или антиаллергическим лекарственным средством, и/или иммуномодулирующим лекарственным средством, и/или антиаллергическим лекарственным средством.
Ко второму лекарственному веществу относятся агенты, применимые для лечения симптомов, связанных с корциноидными опухолями, например, карциноид-ассоциированной гонореи (например, ципрогептадин), карциноид-ассоциированного свистящего дыхания (например, агенты бронходилататоры), карциноид-ассоциированной сердечной недостаточностью (например, агенты диуретики, ингибиторы серотонина).
Другой объект настоящего изобретения предусматривает:
3. Какой-либо способ, комбинацию, фармацевтическую комбинацию или применение по указанным выше пунктам 1.1-1.9 и 2.1-2.13, в которых ингибитор mTOR выбран из рапамицина или производного рапамицина, например,
рапамицин и/или
40-O-(2-гидроксиэтил)-рапамицин (также называемый эверолимусом), и/или
32-дезоксорапамицин, и/или
16-пент-2-инилокси-32-дезоксорапамицин, и/или
16-пент-2-инилокси-32(S или R)-дигидро-рапамицин, и/или
16-пент-2-инилокси-32(S или R)-дигидро-40-O-(2-гидроксиэтил)-рапамицин, и/или
40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]-рапамицин (также называемый CCI779), и/или
40-эпи-(тетразолил)-рапамицин (также называемый АВТ578), и/или
так называемые рапалоги, например, описанные в WO 9802441, WO 0114387 и WO 0364383, АР 23573, АР 23464, АР 23675 или АР 23841, например, АР 23573, и/или
соединения, описанные под названием «ТАFА-93», и/или
соединения, описанные под названием «биолимус»,
например, 40-O-(2-гидроксиэтил)-рапамицин (также называемый «соединением А»).
В предпочтительном объекте настоящего изобретения предусмотрены какие-либо способ, комбинация, фармацевтическая комбинация, фармацевтическая композиция или применение, указанные выше в пунктах 1.1-1.9 и 2.1-2.13, для лечения нейроэндокринных опухолей.
В другом предпочтительном объекте настоящего изобретения предусмотрены какие-либо способ, комбинация, фармацевтическая комбинация, фармацевтическая композиция или применение, указанные выше в пунктах 1.1-1.9 и 2.1-2.13, для лечения карциноидных опухолей.
В еще одном предпочтительном объекте настоящего изобретения предусмотрены какие-либо способ, комбинация, фармацевтическая комбинация, фармацевтическая композиция или применение, показанные выше по пунктам 1.1-1.9 и 2.1-2.13, для лечения карциноидных опухолей гипофиза.
К противоопухолевым лекарственным средствам, которые обычно применяют в качестве части комбинации с ингибитором mTOR, например, применимым согласно настоящему изобретению, например, относятся:
i. стероид, например, преднизон,
ii. ингибитор аденозинкиназы, который нацеливает, разрушает или ингибирует метаболизм нуклеиновых оснований, нуклеозидов, нуклеотидов и нуклеиновых кислот, например, 5-лодотуберцидин, который также известен под названием 7Н-пирроло[2,3-d]пиримидин-4-амин, 5-иодо-7-β-D-рибофуранозил-(9Cl).
iii. адъювант, который усиливает связь 5-FU-TS, а также соединение, которое нацеливает, разрушает или ингибирует щелочную фосфатазу, например, лейковорин, левамизоль.
iv. антагонист коры надпочечников, который нацеливает, разрушает или ингибирует активность коры надпочечников и изменяет периферический метаболизм кортикостероидов, что приводит к снижению 17-гидроксикортикостероидов, например, митотан.
v. ингибитор метаболического пути АКТ, например, соединение, которое нацеливает, разрушает или ингибирует Akt, также называемое протеинкиназой В (ПКВ), например, дегуэлин, который также известен под названием 3Н-бис[1]бензопирано[3,4-b:6',5'-е]пиран-7(7аН)-он, 13,13а-дигидро-9,10-диметокси-3,3-диметил-, (7aS, 13aS)-(9Cl); и трицирибин, также называемый 1,4,5,6,8-пентаазааценафтилен-3-амин, 1,5-дигидро-5-метил-1-β-D-рибофуранозил-(9Cl).
vi. алкилирующий агент, который вызывает алкилирование ДНК и приводит к разрывам в молекулах ДНК, а также перекрестное связывание двойных цепей, в результате происходит нарушение репликации ДНК и транскрипции РНК, например, хлорамбуцил, циклофосфан, дакарбазин, ломустин, прокарбазин, например, в форме гидрохлорида, тиотепа, мелфалан, темозоломид (продукт TEMODAR®), кармустин, ифосфамид, митомицин, альтрепамин, бусульфан, маклоретамин гидрохлорид, нитрозомочевина (BCNU или продукт Gliadel), стрептозоцин, эстрамустин. Циклофосфан может быть введен, например, в коммерческой форме, например, продукта CYCLOSTIN®, и ифосфамид в виде продукта HOLOXAN®.
vii. ингибитор ангиогенеза, который нацеливает, разрушает или ингибирует формирование новых кровеносных сосудов, например, нацеливает метионинаминипептидазу-2 (MetAP-2), воспалительный белок-1 макрофага (MIP-1 альфа), CCL5, TGF-бета, липоксигеназу, циклооксигеназу и топоизомеразу, или который непрямым способом нацеливает р21, р53, CDK2 и синтез коллагена, например, включая фумагилин, который также называется 2,4,6,8-декатетраенодиевой кислотой, моно[(3R,4S,5S,6R)-5-метокси-4-[(2R,3R)-2-метил-3-(3-метил-2-бутенил)оксиранил]-1-оксаспиро[2.5]окт-6-ил] сложный эфир, (2Е,4Е,6Е,8Е)-(9Cl), шиконин, также известный под названием 1,4-нафталенедион, 5,8-дигидрокси-2-[(1R)-1-гидрокси-4-метил-3-пентенил]-(9Cl); траниласт, также известный под названием бензойной кислоты, 2-[[3-(3,4-диметоксифенил)-1-оксо-2-пропенил]амино]-(9Cl), урсоловая кислота, сурамин, бенгамид или его производное, талидомид, TNP-470.
viii. анти-андроген, который блокирует действие андрогенов надпочечников и семенников, которые стимулируют рост нормальных и злокачественных тканей простаты, например, нилутамид, бикалутамид (продукт CASODEX®), который может быть переработан, например, согласно описанию в патенте US 4636505.
ix. анти-эстроген, который выступает антагонистом по отношению к действию эстрогенов на уровне рецептора эстрогена, например, включая ингибитор ароматазы, который ингибирует выработку эстрогена, т.е. конверсию субстратов андростенедиона и тестостерона в эстрон и эстрадиол, соответственно, например, включая атаместан, экземестан, форместан, аминоглутетимид, роглетимид, пиродоглутетимид, трилостан, тестолактон, котоконазол, ворозол, фадрозол, анастрозол, летрозол, торемифен, бикалутамид, флутамид, тамоксифен, тамоксифен цитрат, фульвестрант, ралоксифен, ралоксифен гидрохлорид. Тамоксифен может быть, например, введен в форме коммерческих продуктов, например, продукта NOLVADEX®, и ралоксифен гидрохлорид в форме коммерческого продукта EVISTA®. Фульвестрант может быть переработан согласно описанной методике в US 4659516 и выпускается в виде коммерческого продукта FASLODEX®.
х. анти-гиперкальцеимический агент, который применяют для лечения гиперкальциемии, например, гидрат нитрата галлия (III), и динатриевая соль памидроновой кислоты.
xi. антиметаболит, который ингибирует или прерывает синтез ДНК, что приводит к гибели клетки, например, 6-меркаптопурин, цитарабин, флударабин, флексуридин, фторурацил, 5-фторурацил (5-ФУ), флоксуридин (5-FUdR), капецитабин, ральтитрексед, метотрексат, кладрибин, гемцитабин, гемцитабин гидрохлорид, тиогуанин, 6-тиогуанин, гидроксимочевина, ДНN-деметилирующие агенты, например, 5-азацитидин и децитабин, эдатрексат, антагонисты фолиевой кислоты, например, мететрексед. Капецитабин и гемцитабин могут вводиться, например, в форме коммерческого продукта, например, XELODA® и GEMZAR®.
xii. индуктор апоптоза, который индуцирует серии естественных событий в клетке, которые приводят к ее гибели, например, селективной индукции X-связанного ингибитора млекопитающих апоптического белка XIAP, или, например, снижению регуляции BCL-xL, например, этанол, 2-[[3-(2,3-дихлорфенокси)пропил]амино]-(9Cl), гамбоджиевая кислота (кислота из плодов гарцинии камбоджийской), эмбелин, который также называется 2,5-циклогексадиен-1,4-дион, 2,5-дигидрокси-3-ундецил-(9Cl), триоксид мышьяка.
xiii. ингибитор киназы семейства авроры, который нацеливает, разрушает или ингибирует более поздние стадии клеточного цикла относительно контрольной точки G2/M на всем пути от начала и до конца митоза, например, бинуклеин 2, также называемый метанимидамином, N'-[1-(3-хлор-4-фторфенил)-4-циано-1Н-пиразол-5-ил]-N,N-диметил-(9Cl).
xiv. ингибитор тирозинкиназы Брутона (ВТК), который нацеливает, разрушает или ингибирует развитие В-клеток человека и грызунов, например, терриевая кислота.
xv. ингибитор кальциеневрина, который нацеливает, разрушает или ингибирует метаболический путь активации Т-клеток, например, циперметрин, который также называют циклопропанкарбоновой кислотой, 3-(2,2-дихлороэтенил)-2,2-диметил-, циано(3-феноксифенил)метиловый сложный эфир (9Cl), дельтаметрин, также называемый циклопропанкарбоновой кислотой, 3-(2,2-дибромэтенил)-2,2-диметил-(S)-циано(3-феноксифенил)метиловый сложный эфир, (1R,3R)-(9Cl), фенвалерат, также называемый бензолуксусная кислота, 4-хло-α-(1-метилэтил)-, циано(3-феноксифенил)метиловый сложный эфир (9Cl), и тирфостин 8, но исключая циклоспорин или FK506.
xvi. ингибитор СаМ киназы, который нацеливает, разрушает или подавляет СаМ киназы, составляющие семейство структурно родственных ферментов, к которым относится киназа фосфорилазы, легкая цепь миозинкиназы и СаМ киназы I-IV, например, 5-изохинолинсульфоновая кислота, 4-[(2S)-2-[(5-изохинолилсульфонил)метиламино]-3-оксо-3-(4-фенил-1-пиперазинил)пропил]фенил сложный эфир (9CI), бензолсульфонамид, N-[2-[[[3-(4-хлорфенил)-2-пропенил]метил]амино]метил]фенил]-N-(2-гидроксиэтил)-4-метокси-(9Cl).
xvii. ингибитор CD45 тирозинфосфатазы, который нацеливает, разрушает или ингибирует дефосфорилирование регуляторных остатков pTyr в тирозиновых протеинкиназах семейства Src, которые принимают участие в лечении различных воспалительных и иммунных заболеваний, например, фосфоновая кислота, [[2-(4-бромфенокси)-5-нитрофенил]гидроксиметил]-(9Cl).
xviii. ингибитор CDC25 фосфатазы, который нацеливает, разрушает или ингибирует избыточно экспрессируемые дефосфорилирующие циклин-зависимые киназы в опухолях, например, 1,4-нафталендион, 2,3-бис[(2-гидроэтил)тио]-(9Cl).
xix. ингибитор СНК киназы, который нацеливает, разрушает или ингибирует избыточную экспрессию антиапоптического белка Bc1-2, например, дебромогимениалдизин. Мишенями ингибитора СНК киназы являются СНК1 и/или СНК2.
хх. контролирующий агент для регулирования генистеин, оломуцина и/или тирфостинов, например, диадзеин, который также называют 4Н-1-бензопирен-4-он, 7-гидрокси-3-(4-гидроксифенил)-(9Cl), изо-оломуцин и тирфостин 1.
xxi. ингибитор циклооксигеназы, например, ингибиторы Сох-2, которые нацеливают, разрушают или ингибируют фермент сох-2 (циклооксигеназу-2), например, 1H-индол-3-ацетамид, 1-(4-хлорбензоил)-5-метокси-2-метил-N-(2-фенилэтил)-(9Cl), 5-алкил-замещенная 2-ариламинофенилуксусная кислота и ее производные, например, целекоксиб (продукт CELEBREX®), рофекоксиб (продукт VIOXX®), эторикоксиб, вальдекоксиб или 5-алкил-2-ариламинофенилуксусная кислота, например, 5-метил-2-(2'-хлор-6'-фторанилино)фенилуксусная кислота, лумиракоксиб и целекоксиб.
xxii. ингибитор киназы cRAF, который нацеливает, разрушает или ингибирует повышенную регуляцию Е-селектина и сосудистую адгезионную молекулу-1, индицируемую TNF, например, 3-(3,5-дибромо-4-гидроксибензилиден)-5-иодо-1,3-дигидроиндол-2-он, и бензамид, 3-(диметиламино)-N-[3-[(4-гидроксибензоил)амино]-4-метилфенил]-(9Сl). Киназы Raf играют важную роль в качестве внеклеточных сигнал-регулирующих киназ в клеточной дифференциации, пролиферации и апоптозе. К мишеням ингибитора киназы cRAF относится, но им перечень не ограничивается, RAF1.
xxiii. ингибитор циклин-зависимой киназы, который нацеливает, разрушает или ингибирует циклин-зависимую киназу, играющую роль в регуляции клеточного цикла млекопитающих, например, N9-изопропил-оломуцин, оломуцин, пурваланол В, также называемый бензойная кислота, 2-хлор-4-[[2-[[(1R)-1-(гидроксиметил)-2-метилпропил]амино]-9-(1-метилэтил)-9Н-пурин-6-ил]амино]-(9Cl), роасковитин, индирубин, который также называется 2Н-индол-2-он, 3-(1,3-дигидро-3-оксо-2Н-индол-2-илиден)-1,3-дигидро-(9Cl), кенпауллон, который также называется индол [3,2-d][1]бензазипин-6(5Н)-он, 9-бром-7,12-дигидро-(9CI), пурваланол А, который также называется 1-бутанолом, 2-[[6-[(3-хлорфенил)амино]-9-(1-метилэтил)-9Н-пурин-2-ил]амино]-3-метил-, (2R)-(9Cl), индирубин-3'-монооксим. Развитие клеточного цикла регулируется серией последовательных событии, к которым относятся активирование и последующее инактивирование циклин-зависимых киназ (cyclin dependent kinases - Cdk) и циклинов. Киназы Cdk являются группой сериновых/треониновых киназ, которые формируют активные гетеродимерные комплексы путем связывания с их регуляторными субъединицами - циклинами. Примерами мишеней ингибитора циклин-зависимой киназы являются, но ими не ограничиваются, CDK, AHR, CDK1, CDK2, CDK5, CDK4/6, GSR3бета и ERK.
xxiv. ингибитор цистеиновой протеазы, который нацеливает, разрушает или ингибирует цистеиновую протеазу, играющую решающую роль в обновлении клеток млекопитающих и апоптозе, например, 4-морфолинкарбоксамид, N-[(1S)-3-фтор-2-оксо-1-(2-фенилэтил)пропил]амино]-2-оксо-1-(фенилметил)этил]-(9Cl).
xxv. интеркалятор ДНК, который связывается с ДНК и ингибирует синтез ДНК, РНК и белка, например, пликамицин, дактиномицин.
xxvi. прерыватель цепи ДНК, который вызывает расщепление цепи ДНК и приводит к подавлению синтеза ДНК, РНК и белка, например, блеомицин.
xxvii. ингибитор Е3 лигазы, который нацеливает, разрушает или ингибирует Е3 лигазу, подавляющую перенос убихитиновых цепей на белки, помечая их для разрушения в протеосоме, например, N-((3,3,3-трифтор-2-трифторметил)пропионил)сульфаниламид.
xxviii. эндокринный гормон, который за счет воздействия преимущественно на гипофиз вызывает подавление гормонов у самцов, причем совокупный эффект заключается в снижении тестостерона до уровня кастрации, а у самок подавляется синтез и овариального эстрогена, и андрогена, например, лейпролид, мегестрол, мегестрол ацетат.
xxix. соединения, которые нацеливают, разрушают или ингибируют действие эпидермального фактора роста семейства рецепторных тирозинкиназ (EGFR, ErbB2, ErbB3, ErbB4 в виде гомо- и гетеродимеров), например, белки и антитела, которые ингибируют представителей семейства EGF рецепторной тирозинкиназы, например, рецептор EGF, ErbB2, ErbB3 и ErbB4, или связывают EGF или EGF-родственные лиганды, и, в частности, те соединения, белки или моноклональные антитела, которые в целом и конкретно описаны в WO 9702266, например, соединение из примера 39, EP 0564409, WO 9903854, EP 0520722, EP 0566226, EP 0787722, EP 0837063, US 5747498, WO 9810767, WO 9730034, WO 9749688, WO 9738983 и, особенно, WO 9630347, например, соединение СР 358774, WO 9633980, например, соединение ZD 1839, и WO 9503283, например, соединение ZM 105180, например, включая трастузумаб (продукт HERCEPTIN®), сетуксимаб, ирессу, OSI-774, CI-1033, ЕКВ-569, GW-2016, Е1.1, Е2.4, Е2.5, Е6.2, Е6.4, Е2.11, Е6.3 или Е7.6.3, производные 7Н-пирроло-[2,3-d]пиримидина, например, описанные в WO 03013541, эрлотиниб, гефитиниб. Эрлотиниб может быть введен в форме коммерческого продукта, например, продукта TARCEVA®, и гефитиниб, например, продукт IRESSA®, моноклональные антитела человека против рецептора эпидермального фактора роста, включая ABX-EGFR.
ххх. ингибитор EGFR, PDGFR тирозинкиназы, например, ингибиторы EGFR-киназы, включая тирфостин 23, тирфостин 25, t тирфостин 47, тирфостин 51 и тирфостин AG 825, 2-пропенамид, 2-циано-3-(3,4-дигидроксифенил)-N-фенил-(2Е)-(9Сl), тирфостин Ag 1478, лавендустин А, 3-пиридинацетонитрил, α-[(3,5-дихлорфенил)метилен]-, (αZ)-(9Cl), примером ингибитора EGFR, PDGFR-тирозинкиназы, например, является тирфостин 46. К ингибиторам PDGFR-тирозинкиназы относится тирфостин 46. К мишеням ингибитора EGFR киназы относятся гуанилилциклаза (GC-C) HER2, EGFR, PTK и тубулин.
xxxi. ингибитор фарнезилтрансферазы, который нацеливает, разрушает или ингибирует белок Ras, например, а-гидроксифарнезилфосфоновая кислота, бутановая кислота, 2-[[(2S)-2-[[(2S,3S)-2-[[(2R)-2-амино-3-меркаптопропил]амино]-3-метилпентил]окси]-1-оксо-3-фенилпропил]амино]-4-(метилсульфонил)-1-метилениловый сложный эфир, (2S)-(9Cl), манумицин A, L-744832 или DK8G557, типифарниб (R115777), SCH66336 (лонафарбин), BMS-214662,
xxxii. ингибитор Flk-1-киназы, который нацеливает, разрушает или ингибирует активность Flk-1 тирозинкиназы, например, 2-пропенамид, 2-циано-3-[4-гидрокси-3,5-бис(1-метилэтил)фенил]-N-(3-фенилпропил)-(2Е)-(9Cl). Мишенью ингибитора Flk-1-киназы является, но им не ограничивается, KDR.
xxxiii. ингибитор гликогенсинтазы-киназы 3 (GSK3), который нацеливает, разрушает или ингибирует гликогенсинтазу-киназу-3 (GSK3), например, индирубин-3'-монооксим. Гликогенсинтаза-киназа-3 (GSK-3, тау-протеинкиназа I), высоко консервативная повсеместно экспрессируемая серин/треониновая киназа, участвует в каскадах сигнальной трансдукции во многих клеточных процессах. Установлено, что данная протеинкиназа участвует в регуляции множества разных клеточных функций, включая синтез белка, клеточную пролиферацию, сборку/разобщение микротрубочек и апоптоз.
xxxiv. ингибитор гистондеацетилазы (HDAC), который ингибирует гистондеацетилазу и проявляет антипролиферативное действие, например, соединения, описанные в WO 0222577, особенно N-гидрокси-3-[4-[[(2-гидроксиэтил)[2-(1Н-индол-3-ил)этил]-амино]метил]фенил]-2Е-2-пропенамид и N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)-этил]-амино]метил]фенил]-2Е-2-пропенамид и его фармацевтически приемлемые соли, субероиланилид-гидроксаминовая кислота (SAHA), сложный эфир пиридин-3-илметила и [4-(2-амино-фенилкарбамоил)-бензил]-карбаминовой кислоты и его производные, масляная кислота, пироксамид, трихостатин А, оксамфлатин, апицидин, депсипептид, депудецин, трапоксин, токсин НС, который также называется цикло[L-аланил-D-аланил-(□S,2S)-□-амино-□-оксооксиранеоктаноил-D-пролил] (9CI), фенилбутират натрия, субероиловая бис-гидроксамовая кислота, трихостатин A, BMS-27275, пироксамид, FR-901228, вальпроевая кислота.
xxxv. ингибитор HSP90, который нацеливает, разрушает или ингибирует присущую HSP90 АТФазную активность, разрушает, нацеливает или ингибирует HSP90 зависимые белки через убихитин-протеосомный метаболический путь. Соединения, нацеливающие, разрушающие или ингибирующие свойственную HSP90 АТФазную активность, особенно соединения, белки или антитела, которые ингибируют АТФазную активность HSP90, например, 17-аллиламино,17-деметоксигелданамицин (17AAG), производное гелданамицина, другие гелданамицин-родственные соединение, радикол и HDAC ингибиторы. Другими примерами ингибитора HSP90 являются гелданамицин, 17-деметокси-17-(2-пропениламино)-(9Cl). К потенциальным непрямым мишеням ингибитора HSP90 относятся FLT3, BCR-ABL, CHK1, CYP3A5*3 и/или NQ01*2.
xxxvi. ингибитор 1-каппа В-альфа киназы (IKK), который нацеливает, разрушает или ингибирует NF-каппаВ, например, 2-пропеннитрил, 3-[(4-метилфенил)сульфонил]-(2Е)-(9Cl).
xxxvii. ингибитор тирозинкиназы инсулинового рецептора, который модулирует активности фосфатидилинозитол 3-киназы, микротрубочки-ассоциированный белок и S6 киназы, например, гидрокси-2-нафталенилметилфосфоновая кислота, LY294002.
xxxviii. ингибитор c-Jun N-концевой киназы (JNK), который нацеливает, разрушает или ингибирует Jun N-концевую киназу, например, пиразолеантрон и/или эпигаллокатехин галлат. Jun N-концевая киназа (JNK), серин-направленная протеинкиназа, участвует в фосфорилировании и активации c-Jun и ATF2 и играет существенную роль в метаболизме, росте, клеточной дифференциации и апоптозе. Мишенью для ингибитора JNK киназы является, но ею не ограничивается, DNMT.
xxxix. агент, связывающий микротрубочки, который действует путем разрушения сети микротрубочек, важной для митоза и функционирования клетки в интерфазе, например, винбластин, винбластин сульфат, алколоиды винки, например, винкристин, винкристин сульфат, виндезин, винорелбин, таксаны, например, доцетаксел, паклитаксел, дискодермолиды, кохицин, эпотилоны и их производные, например, эпотилон В или его производные. Паклитаксел известен под торговой маркой TAXOL®, доцетаксел - под торговой маркой TAXOTERE®, винбластин сульфат - под торговой маркой VINBLASTIN R.P®, а винкристин сульфат - под торговой маркой FARMISTIN®. К этим агентам также относятся формы дженерики паклитаксела и различные дозированные формы папклитаксела. К формам дженерикам паклитаксела относится, но им перечень форм не ограничивается, бетаксолол гидрохлорид. К различным дозированным формам паклитаксела относятся, но ими не ограничиваются, альбуминовые частицы паклитаксела, коммерческими продуктами которых являются ABRAXANE®; ONXOL®, CYTOTAX®. Дискодермолид может быть получен, например, согласно описанию в US 5010099. К ним также относятся производные эпотолина, которые описаны в US 6194181, WO 98/0121, WO 9825929, WO 9808849, WO 9943653, WO 9822461 и WO 0031247. Особенно предпочтительными являются эпотилон А и/или В.
xl. ингибитор киназы митоген-активированного белка (MAP), который нацеливает, разрушает или ингибирует митоген-активированный белок, например, бензолсульфонамид, N-[2-[[[3-(4-хлорфенил)-2-пропенил]метил]амино]метил]фенил]-N-(2-гидроксиэтил)-4-метокси-(9Cl). Киназы митоген-активированного белка (MAP) являются группой сериновых/треониновых протеинкиназ, которые активируются в ответ на различные внеклеточные стимулы и опосредуют сигнальную трансдукцию с поверхности клетки в ядро. Они регулируют несколько физиологических и патологических клеточных процессов, в том числе воспаление, гибель клеток от апоптоза, онкогенную трансформацию, распространение опухолевых клеток и метастазов.
xli. ингибитор MDM2, который нацеливает, разрушает или ингибирует взаимодействие MDM2 и супрессора опухоли р53, например, транс-4-иодо, 4'-боранил-халкон.
xlii. ингибитор МЕК, который нацеливает, разрушает или ингибирует киназную активность МЕК МАР-киназы, например, продукт Nexavar® (сорафениб тозилат), бутандинитрил, бис[амино[2-аминофенил)тио]метилен]-(9Cl). Мишенью ингибитора МЕК является, но им перечень не ограничивается, ERK. Непрямой мишенью ингибитора МЕК является, но им перечень не ограничивается, циклин D1.
xliii. ингибитор матричной металлопротеиназы (matrix metalloproteinase inhibitor - ММР); который нацеливает, разрушает или ингибирует класс ферментов протеаз, которые избирательно катализируют гидролиз полипептидных связей, включая ферменты ММР-2 и ММР-9, которые участвуют в активации утраты тканевой структуры вокруг опухолей и способствуют росту опухоли, ангиогенезу и метастазированию, например, актинонин, который также называют бутандиамид, N-4-гидрокси-N1-[(1S)-1-[[(2S)-2-(гидроксиметил)-1-пирролидинил]карбонил]-2-метилпропил]-2-пентил-, (2R)-(9Cl), эпигаллокатехин галлат, ингибиторы пептидомиметика и непептидоиметика коллагена; производные тетрациклина, например, ингибитор гидроксаматного пептидомиметика батимастат, и их доступные для перорального введения аналоги маримастат, приномастат, метастат, неовастат, таномастат, ТАА211, BMS-279251, BAY 12-9566, MMI270B или AAJ996. Мишенью ингибитора ММР является, но ею перечень не ограничивается, полипептиддеформилаза.
xliv. ингибитор NGFR-тирозинкиназы, который нацеливает, разрушает или ингибирует p140c-trk фосфорилирование тирозина, зависимое от фактора роста нервов, например, тирфостин AG 879. К мишеням ингибитора NGFR-тирозинкиназы относятся, но ими не ограничиваются, HER2, FLK1, FAK, TrkA и/или TrkC. Непрямая мишень ингибирует экспрессию RAF1.
xlv. ингибитор р38 MAP киназы, включая ингибитор киназы SAPK2/p38, который нацеливает, разрушает или ингибирует р38-МАРК, являющийся представителем семейства МАРК, например, фенол, 4-[4-(4-фторфенитл)-5-(4-пиридинил)-1Н-имидазол-2-ил]-(9Сl). Примерами ингибиторов SAPK2/p38 киназы являются, но ими не ограничиваются, бензамид, 3-(диметиламино)-N-[3-[(4-гидроксибензоил)амино]-4-метилфенил]-(9Cl). Представителем семейства МАРК является серин/треониновая киназа, активированная фосфорилированием остатков тирозина и треонина. Эта киназа фосфорилируется и активируется многими стрессовыми и воспалительными клеточными стимулами, и предположительно участвует в регуляции клеточных ответов, например, в апоптозе и воспалительных реакциях.
x1vi. ингибитор р56 тирозинкиназы, который нацеливает, разрушает или ингибирует р56 тирозинкиназу - специфичный лимфотический фермент семейства тирозинкиназ src, принципиально важный для развития и активации Т-клеток, например, дамнакантал, который также называется 2-антраценкарбоксальдегид, 9,10-дигидро-3-гидрокси-1 метокси-9,10-диоксо-(9Cl), тирфостин 46. Мишенью ингибитора р56 тирозинкиназы является, но им перечень не ограничивается, Lck. Ингибитор Lck связан с цитоплазматическими доменами CD4, CD8 и бета-цепью рецептора ИЛ-2 и предположительно участвует в самых ранних стадиях TCR-опосредованной активации Т-клеток.
x1vii. ингибитор PDGFR-тирозинкиназ, который нацеливает, разрушает или ингибирует активность c-Kit-рецепторных тирозинкиназ (часть семейства PDGFR), а именно нацеливающий, разрушающий или ингибирующий активность представителей семейства c-Kit-рецепторных тирозинкиназ, особенно ингибирование рецептора c-Kit. К примерам мишеней ингибитора PDGFR-тирозинкиназы относятся, но ими не ограничиваются, PDGFR, FLT3 и/или с-KIT, например, тирфостин AG 1296, тирфостин 9, 1,3-бутадиен-1,1,3-трикарбонитрил,2-амино-4-(1Н-индол-5-ил)-(9Cl), производное N-фенил-2-пиримидинамина, например, иматиниб, продукт IRESSA®. PDGF играет центральную роль в регуляции клеточной пролиферации, хемотаксиса и выживании здоровых клеток, а также при различных болезненных состояниях, например, раке, атеросклерозе, фиброзном заболевании. Семейство PDGF состоит из димерных изоформ (PDGF-AA, PDGF-BB, PDGF-AB, PDGF-CC и PDGF-DD), которые влияют на клеточные процессы дифференциальным связыванием с двумя рецепторными тирозинкиназами. PDGFR-α и PDGFR-β имеют молекулярную массу ~170 и 180 кДа, соответственно.
xlviii. ингибитор фосфатидилинозитол-3-киназы, который нацеливает, разрушает или ингибирует PI 3-киназу, например, вортманнин, который также называется 3Н-фуро[4,3,2-de]индено[4,5-h]-2-бензопиран-3,6,9-трион, 11-(ацетилокси)-1,6b,7,8,9а,10,11,11b-октагидро-1-(метоксиметил)-9а,11b-диметил-, (1S,6bR,9aS,11R,11bR)-(9Cl), 8-фенил-2-(морфолин-4-ил)-хромен-4-он, кверцетин, кверцетин дигидрат. Установлено, что активность PI 3-киназы возрастает в ответ на ряд гормональных стимулов и стимулов фактора роста, включая инсулин, тромбоцитарный фактор роста, инсулиноподобный фактор роста, эпидермальный фактор роста, колониестимулирующий фактор и фактор роста гепатоцитов, и участвуют в процессах, связанных с клеточным ростом и трансформацией. Примером мишени ингибитора фосфатидилинозитол 3-киназы является, но им не ограничивается, Pi3K.
xlix. ингибитор фосфатазы, который нацеливает, разрушает или ингибирует фосфатазу, например, кантаридиевая кислота, кантаридин и L-лейцинамид, N-[4-(2-карбоэтинил)бензоил]глицил-L-α-глутамил-(Е)-(9Сl). Фосфатазы удаляют фосфорильную группу и восстанавливают белок до его первоначального дефосфорилированного состояния. Таким образом, цикл фосфорилирования-дефосфорилирования может рассматриваться в качестве молекулярного механизма «включения-выключения».
l. агент, содержащий платину, который подавляет синтез ДНК за счет формирования межнитевой и вненитевой поперечных сшивок в молекулах ДНК, например, карбоплатин, цисплатин, оксалиплатин, сатраплатин и агенты, содержащие платину, например, ZD0473. Карбоплатин может быть введен, например, в коммерческой форме, например, в форме продукта CARBOPLAT®, а оксалиплатин в форме продукта ELOXATIN®.
li. ингибитор протеинфосфатазы, включающий РР1- и РР2-ингибитор, и ингибитор тирозинфосфатазы, который нацеливает, разрушает или ингибирует протеинфосфатазу. Примерами РР1- и РР2-ингибиторов являются кантаридиевая кислота и/или кантаридин. К примерам ингибитора тирозинфосфатазы относятся, но ими не ограничиваются, L-P-бромтетрамизол оксалат, 2(5Н)-фуранон,4-гидрокси-5-(гидроксиметил)-3-(1-оксогексадецил)-, (5R)-(9Cl), и бензилфосфоновая кислота.
В контексте настоящего изобретения понятие «РР1- или РР2-ингибитор» относится к соединению, которое нацеливает, разрушает или ингибирует Ser/Thr протеинфосфатазы. Фосфатаза типа I, к которой относится РР1, может ингибироваться двумя теплостойкими белками, называемыми ингибитор-1 (I-1) и ингибитор-2 (I-2). Они предпочтительно дефосфорилируют субъединицу протеинкиназы. Фосфатазы типа II подразделяются на классы фосфатаз спонтанного действия (РР2А), Са2+-зависимые (РР2 В) и Mg2+-зависимые (РР2С).
В контексте настоящего изобретения понятие «ингибитор тирозинфосфатазы» относится к соединениям, которые нацеливают, разрушают или ингибируют тирозинфосфатазу. Протеин-тирозиновые фосфатазы (Protein tyrosine phosphatases - РТР) относительно недавно добавлены к семейству фосфатаз. Они удаляют фосфатные группы с фосфорилированных остатков тирозина в белках. РТР проявляют разнообразные структурные свойства и играют важную роль в регуляции клеточной пролиферации, дифференциации, адгезии клеток и подвижности клеток, а также в обеспечении цитоскелета. К примерам мишеней ингибитора тирозинфосфатазы относятся, но ими не ограничиваются, щелочная фосфатаза (ALP), гепараназы, РТРаза и/или фосфатаза простатовой кислоты.
lii. ингибитор ПКС и ингибитор ПКС дельта-киназы. В контексте настоящего изобретения понятие «ингибитор ПКС» относится к соединению, которое нацеливает, разрушает или ингибирует протеинкиназу С и ее изозимы. Протеинкиназа С (ПКС), распространенный фосфолипидзависимый фермент, участвует в сигнальной трансдукции, связанной с клеточной пролиферацией, дифференциацией и апоптозом. Примерами мишеней ингибитора ПКС являются, но ими не ограничиваются, МАРК и/или NF-каппа В. Примерами ингибитора ПКС являются, но ими не ограничиваются, 1-Н-пирроло-2,5-дион,3-[1-[3-(диметиламино)пропил]-1Н-индол-3-ил]-4-(1Н-индол-3-ил)-(9Cl), бисиндолилмалеимид IX, сфингозин, также обозначаемый 4-октадецен-1,3-дтол, 2-амино-, (2S,3R,4E)-(9Cl), стауроспорин, также называемый 9,13-эпокси-1Н,9Н-дииндоло[1,2,3-gh:3',2',1'-lm]пирроло[3,4-j][1,7]бензидиазонин-1-он, производные стауроспорина, например, описанные в EP 0296110, например, мидостаурин, 2,3,10,11,12,13-гексагидро-10-метокси-9-метил-11-(метиламине)-, (9S,10R,11R,13R)-(9Cl), тирфостин 51 и гиперицин, также называемый фенантро[1,10,9,8-opqra]перилен-7,14-дион, 1,3,4,6,8,13-гексагидро-10,11-диметил-, стереоизомер (6Cl,7Cl,8Cl,9Cl), UCN-01, сафингол, BAY 43-9006, бриостатин 1, перифозин, илмофозин, RO 318220 и RO 320432, GO 6976, Isis 3521; LY333531/LY379196. В контексте настоящего изобретения понятие «ингибитор РКС дельта-киназы» относится к соединению, которое нацеливает, разрушает или ингибирует дельта-изоцимы РКС. Дельта-изоцимы являются традиционными РКС изоцимами и являются Ca2+-зависимыми. Примером ингибитора РКС дельта-киназы является, но им не ограничивается, роттлерин, который также называется 2-пропен-1-он, 1-[6-[(3-ацетил-2,4,6-тригидрокси-5-метилфенил)метил]-5,7-дигидрокси-2,2-диметил-2Н-1-бензопиран-8-ил]-3-фенил-, (2Е)-(9Cl).
1iii. ингибитор синтеза полиамина, который нацеливает, разрушает или ингибирует полиаминный спермидин, например, DMFO, который также называется (-)-2-дифторметилорнитино N1, N12-диэтилспермином 4HCl. Полиаминный спермидин и спермин являются жизненно важными для клеточной пролиферации, хотя точный механизм их действия не установлен. Опухолевые клетки обладают измененным повышенным полиаминным гомеостатом, выражаемым в повышенной активности биосинтеза ферментов и в повышенных полиаминных пулах.
liv. протеосомный ингибитор, который нацеливает, разрушает или ингибирует протеосомы, например, аклациномицин А, глиотоксин, PS-341, MLN 341, бортезомин, велкад. Примерами мишеней протеосомного ингибитора являются, но ими не ограничиваются, O(2)(-)-генерирующая НАДФН оксидаза, NF-каппаВ и/или фарнезилтрансфераза, геранилтрансфераза I.
lv. ингибитор РТР1В, который нацеливает, разрушает или ингибирует РТР1В, ингибитор протеинтирозинкиназы, например, L-лейцинамид, N-[4-(2-карбоксиэтенил)бензоил]глицил-L-α-глутамил-, (Е)-(9Cl).
lvi. ингибитор протеинтирозинкиназы, включая ингибитор тирозинкиназы семейства SRC, ингибитор Syk тирозинкиназы и ингибитор JAK-2 и/или JAK-3 тирозинкиназы.
В контексте настоящего изобретения понятие «ингибитор протеинкиназы» относится к соединению, которое нацеливает, разрушает или ингибирует тирозиновые протеинкиназы. Тирозиновые протеинкиназы (ТПК) играют ключевую роль в регуляции клеточной пролиферации, дифференциации, метаболизме, миграции и выживании. Их классифицируют на рецепторные ТПК и не рецепторные ТПК. Рецепторные ТПК содержат одну полипептидную цепь с мембранным сегментом. Внеклеточный конец этого сегмента содержит в высокой степени аффинный лиганд-связывающий домен, а цитоплазматический конец этого сегмента содержит каталитическое ядро и регуляторные последовательности. К примерам мишеней ингибитора тирозинкиназы относятся, но ими не ограничиваются, ERK1, ERK2, тирозинкиназа Брутона (Btk), JAK2, ERK 1/2, PDGFR и/или FLT3. К примерам непрямых мишеней относятся, но ими не ограничиваются, TNFaльфa, NO, PGE2, IRAK, iNOS, ICAM-1 и/или Е-селектин. К примерам ингибитора тирозинкиназы относятся, но ими не ограничиваются, тирфостин AG 126, тирфостин Ag 1288, тирфостин Ag 1295, гелданамицин и генистеин.
К нерецепторным тирозинкиназам относятся представители семейств Src, Tec, JAK, Fes, Abl, FAK, Csk и Syk. Они локализованы в цитоплазме, а также в ядре. Нерецепторные тирозинкиназы проявляют выраженную киназную регуляцию, фосфорилирование субстрата и функцию. Нарушение регуляции этих киназ также связаны с несколькими заболеваниями человека.
В контексте настоящего изобретения понятие «ингибитор тирозинкиназы семейства SRC» относится к соединению, которое нацеливает, разрушает или ингибирует SRC. К примерам ингибиторов тирозинкиназы семейства SRC относятся, но ими не ограничиваются, РР1, также называемый 1Н-пиразоло[3,4-d]пиримидин-4-амин, 1-(1,1-диметилэтил)-3-(1-нафталенил)-(9Сl) и РР2, который также называется 1Н-пиразоло[3,4-d]пиримидин-4-амин, 3-(4-хлорфенил)-1-(1,1-диметилэтил)-(9Cl).
В контексте настоящего изобретения понятие «ингибитор тирозинкиназы Syk» относится к соединению, которое нацеливает, разрушает или ингибирует Syk. К примерам мишеней для ингибитора тирозинкиназы Syk относятся, но ими не ограничиваются, Syk, STAT3 и/или STAT5. К примерам ингибиторов тирозинкиназы Syk относятся, но ими не ограничиваются, пицеатаннол, который также называется 1,2-бензолдиол, 4-[(1Е)-2-(3,5-дигидроксифенил)этенил]-(9Cl).
В контексте настоящего изобретения понятие «ингибитор тирозинкиназы Janus (JAK-2 и/или JAK-3)» относится к соединению, которое нацеливает, разрушает или ингибирует тирозинкиназу janus. Установлено, что ингибиторы тирозинкиназы janus являются выраженными анти-лейкозными агентами с антитромбозными, антиаллергическими и иммуносупрессивными свойствами. К мишеням ингибитора JAK-2 и/или JAK-3 тирозинкиназы относятся, но ими не ограничиваются, JAK2, JAK3, STAT3. К непрямым мишеням ингибитора JAK-2 и/или JAK-3 тирозинкиназы относится, но им не ограничивается, CDK2. К примерам ингибитора JAK-2 и/или JAK-3 тирозинкиназы относятся, но ими не ограничиваются, тирфостин AG 490 и 2-нафтилвинилкетон.
Соединения, которые нацеливают, разрушают или ингибируют активность представителей семейства с-Abl и продукты их генной гибридизации, например, PD180970, AG957 или NSC 680410.
lvii. ретиноид, который нацеливает, разрушает или ингибирует ретиноид-зависимые рецепторы, например, изотретиноин, третиноин.
lviii. ингибитор элонгации PHN-полимеразы II, который нацеливает, разрушает или ингибирует инсулин-стимулируемую ядерную и цитозольную p70S6 киназу в клетках СНО, который нацеливает, разрушает или ингибирует транскрипцию PHN-полимеразы II, которая может быть зависимой от казеинкиназы II, и нацеливает, разрушает или ингибирует распад семенных пузырьков в ооцитах быка, например, 5,6-дихлор-1-бета-D-рибофуранозилбензимидазол.
lvix. ингибитор серин/треониновой киназы, который ингибирует серин/треониновые киназы, например, 2-аминопурин, также называемый 1Н-пурин-2-амин(9Cl). Примером мишени ингибитора серин/треониновой киназы является, но ею не ограничивается, днРНК-зависимая протеинкиназа. К примерам непрямых мишеней ингибитора серин/треониновых киназ относятся, но ими не ограничиваются, МСР-1, NF-каппаВ, elF2альфа, СОХ2, RANTES, IL8, CYP2A5, IGF-1, CYP2B1, CYP2B2, CYP2H1, ALAS-1, HIF-1, эритропоэтин и/или CYP1A1.
lx. ингибитор биосинтеза стиролов, который ингибирует биосинтез стиролов, например, холестерина, например, тербинадин. К примерам мишеней для ингибиторов биосинтеза стиролов относятся, но ими не ограничиваются, скваленэпоксидаза и CYP2D6.
lxl. ингибитор топоизомеразы, а именно ингибитор топоизомеразы I и ингибитор топоизомеразы II. К примерам ингибитора топоизомеразы I относятся, но ими не ограничиваются, топотекан, гиматекан, иринотекан, камптотекан и его аналоги, 9-нитрокамптотецин и макромолекулярный конъюгат камптотецина PNU-166148 (соединение А1 в WO 9917804), 10-гидроксикамптотецин ацетат, этопосид, идарубицин гидрохлорид, иринотекан гидрохлорид, тенипозид, топотекан, топотекан гидрохлорид, доксорубицин, эпирубицин, эпирубицин гидрохлорид, митоксантрон, митаксантрон гидрохлорид, даунорубицин, даунорубицин гидрохлорид, дасатиниб (BMS-354825). Иринотекан может быть введен, например, в коммерческой форме, например, продукт CAMPTOSAR®. Топотекан может быть введен, например, в коммерческой форме, например, продукт HYCAMTIN®. К понятию «ингибитор топоизомеразы II» в контексте настоящего изобретения относятся, но ими перечень не ограничивается, антрациклины, например, доксорубицин, в том числе липосомальная форма, например, продукт CAELYX®, даунорубицин, в том числе липосомальная форма, например, продукт DAUNOSOME®, эпирубицин, идарубицин и неморубицин, антрахиноны митоксантрон и лозоксантрон и подофиллотоксины этопозид и тенипозид. Коммерческой формой этопозида является продукт ETOPOPHOS®, тенипозида - продукт VM 26-BRISTOL®, доксорубицина - продукт ADRIBLASTIN® или продукт ADRIAMYCIN®, эпирубицин - продукт FARMORUBICIN®, идарубицин - продукт ZAVEDOS® и митоксантрон - продукт NOVANTRON®.
1xii. ингибитор VEGFR-тирозинкиназы, который нацеливает, разрушает и/или ингибирует известные факторы ангиогенного роста и цитокины, участвующие в модуляции нормального и патологического ангиогенеза. Представители семейства VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D) и соответствующие им рецепторные тирозинкиназы [VEGFR-1 (Flt-1), VEGFR-2 (F1k-1, KDR) и VEGFR-3 (Flt-4)] играют наиважнейшую и непременную роль в регуляции многоядерных ангиогенных и лимфоангиогенных процессов. Примером ингибитора VEGFR-тирозинкиназы является 3-(4-диметиламинобензилиденил)-2-индолинон. Соединения, которые нацеливают, разрушают или ингибируют активность VEGFR, особенно те соединения, белки или антитела, которые ингибируют VEGF-рецепторную тирозинкиназу, ингибируют VEGF-рецептор или связываются с VEGF, и особенно те соединения, белки и моноклональные антитела, которые в общем и конкретно описаны в WO 9835958, например, 1-(4-хлоранилино)-4-(4-пиридилметил)фталазин или его фармацевтически приемлемая соль, например, сукцинат, или в WO 0009495, WO 0027820, WO 0059509, WO 9811223, WO 0027819 и ЕР 0769947, например, описанные M.Prewett и др., Cancer Research 59, 1999, сс.5209-5218, F.Yuan и др. в Proc. Natl. Acad. Sci. USA, 93, 1996, сс.14765-14770, Z.Zhu и др., Cancer Res. 58, 1998, сс.3209-3214, J.Mordenti и др., Toxicologic Pathology, 27, 1999, сс.14-21, WO 0037502, WO 9410202, ангиостатин, описанные М.S.O'Reilly и др., Cell 79, 1994, сс.315-328; эндостатин, описанный М.S.O'Reilly и др., Cell 88, 1997, сс.277-285, амиды антраниловой кислоты, ZD4190, ZD6474, SU5416, SU6668, или анти-VEGF антитела или анти-VEGF-рецепторные антитела, например, RhuMab (бевацизумаб). Понятие «антитело» означает интактные моноклональные антитела, поликлональные антитела, полиспецифичные антитела, сформированные по меньшей мере двумя интактными антителами, и фрагменты антител, длина которых достаточна для обеспечения соответствующей биологической активности. Примером VEGF-R2-ингибитора, например, является акситиниб.
lxiii. агонист гонадорелина, например, абареликс, гозерелин, гозерелин ацетат,
lxiv. соединение, индуцирующее процессы клеточной дифференциации, например, ретиноевая кислота, альфа-, гамма- или 8-токоферол или альфа-, гамма или 8-токотриенол.
lxv. бисфосфонат, например, этридоновая, клодроновая, тилудроновая кислоты, включая этридоновую, клодроновую, тилудроновую, памидроновую, аледроновую, ибандроновую, ризедроновую и золедроновую кислоты.
lxvi. ингибитор гепараназы, который предупреждает разрушение геперан сульфата, например, PI-88.
lxvii. модификатор биологического ответа, предпочтительно алимфокин или интерфероны, например, интерферон альфа.
lxviii. ингибитор теломеразы, например, теломестатин.
lxix. медиаторы, например, ингибиторы катехол-O-метилтрансферазы, например, энтакапон.
lxx. испинезиб, перметрексед (Alimta®), сунитиниб (SU11248), диэтилстилбестрол (DES), BMS224818 (LEA29Y),
lxxi. соматостатин или аналог соматостатина, например, октреотид (продукты Sandostatin® или Sandostatin LAR®).
lxxii. антагонисты рецептора гормона роста, например, пегвизомант, филграстим или пегфилграстим или интерферон альфа.
Лечение рака, например, лечение эндокринных опухолей, с помощью ингибитора mTOR, необязательно в комбинации с противоопухолевым лекарственным средством, например, указанным в настоящем изобретении, может проводиться наряду с радиотерапией. Лечение эндокринных опухолей ингибитором mTOR необязательно в комбинации с противоопухолевым лекарственным средством, может быть второй линией лечения, например, после лечения другим противоопухолевым лекарственным средством.
К предпочтительным противоопухолевым средствам, применяемым в качестве второго лекарственного средства при лечении эндокринных опухолей, например, относятся 5-фторурацил, дакарбазин, стрептозотоцин, ингибитор рецепторной тирозинкиназы, к спектру активности которого относятся PDGFR, C-kit и VEGF-рецептор, например, SU011248, антагонисты рецептора гормона роста, например, пегвизомант, филграстим или пегфилграстим, интерферон альфа или аналог соматостатина, например, октреотид.
Предпочтительно вторым лекарственным веществом является соматостатин или аналог соматостатина, например, октреотид, известный под коммерческими названиями Sandostatin® или Sandostatin LAR®.
Противовоспалительные и/или иммуномодулирующие лекарственные средства, применение которых считается полезным в комбинации с ингибитором mTOR, например, считается полезным согласно настоящему изобретению, например, включают
- медиаторы, например, ингибиторы, кальциневрина, например, циклоспорин A, FK 506,
- аскомицины, обладающие иммуносупрессивными свойствами, например, АВТ-281, ASM981,
- кортикостериоды, циклофосфан, азатиопрен, лефлуномид, мизорибин,
- микофенольная кислота или соль, например, микофенолятмофетил натрия,
- 15-дезоксиспергуалин или его иммуносупрессивный гомолог, аналог или производное,
- медиаторы, например, ингибиторы активности bcr-abl-тирозинкиназы,
- медиаторы, например, ингибиторы активности c-kit рецепторной тирозинкиназы,
- медиаторы, например, ингибиторы активности PDGF-рецепторной тирозинкиназы, например, продукт Gleevec (иматиниб),
- медиаторы, например, ингибиторы активности р38 МАР-киназы,
- медиаторы, например, ингибиторы активности VEGF-рецепторной тирозинкиназы,
- медиаторы, например, ингибиторы активности РКС, например, описанные в WO 0238561 или WO 0382859, например, соединение из примеров 56 или 70,
- медиаторы, например, ингибиторы активности JAK3-киназы, например, N-бензил-3,4-дигидроксибензилиденцианамид α-циано-(3,4-дигидрокси)-]N-бензилциннамамид (тирфостин AG 490), продигиозин 25-С (PNU 156804), [4-(4'-гидроксифенил)-амино-6,7-диметоксихиназолин] (WHI-Р131), [4-(3'-бром-4'-гидроксифенил)-амино-6,7-диметоксихиназолин] (WHI-P154), [4-(3',5'-дибром-4'-гидроксифенил)-амино-6,7-диметоксихиназолин] WHI-P97, KRX-211, 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-(1]пиримидин-4-ил)-амино]-пиперидин-1-ил}-3-оксопропионитрил в свободной форме или в форме фармацевтически приемлемой соли, например, моноцитрата (также называемого СР-690, 550) или соединения, описанного в WO 2004052359 или WO 2005066156,
- медиаторы, например, агонисты или модуляторы активности рецептора S1P, например, FTY720 необязательно фосфорилированный или его аналог, например, 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол необязательно фосфорилированный или 1-{4-[1-(4-циклогексил-3-трифторметил-бензилоксиимино)-этил]-2-этил-бензил}-азетидин-3-карбоновая кислота или ее фармацевтически приемлемые соли,
- иммуносупрессивные моноклональные антитела, например, моноклональные антитела к рецепторам лейкоцитов, например, BIys/BAFF рецептору, МНС, CD2, CD3, CD4, CD7, CD8, CD25, CD28, CD40, CD45, CD52, CD58, CD80, CD86, рецептору IL-12, рецептору IL-17, рецептору IL-23 или к их лигандам,
- другие иммуносупрессивные соединения, например, рекомбинантные связывающие молекулы, имеющие по меньшей мере часть внеклеточного домена CTLA4 или его мутанта, например по меньшей мере внеклеточную часть CTLA4 его мутанта, соединенного с белковой последовательностью, не являющейся последовательностью CTLA4, например, CTLA4Ig (например, с номером в каталоге коллекции АТСС 68629) или его мутантом, например, LEA29Y,
- медиаторы, например, ингибиторы активностей адгезивных молекул, например, антагонисты LFA-1, антагонисты ICAM-1 или -3, антагонисты VCAM-4 или VLA-4,
- медиаторы, например, антагонисты активности CCR9,
- медиаторы, например, ингибиторы активности MIF,
- 5-аминосалицилатные (5-ASA) агенты, например, сульфасалазин, продукты Azulfidine®, Asacol®, Dipentum®, Pentasa®, Rowasa®, Canasa®, Colazal®, например, лекарственные средства, содержащие мезаламин, например, мезаланин в комбинации с гепарином,
- медиаторы, например, ингибиторы активности TNF-альфа, например, включая антитела, которые связываются с TNF-альфа, например, инфликсимаб (продукт Remicade®), талидомид, леналидомид,
- оксид азота высвобождающие нестероидной природы противовоспалительные лекарственные средства (nitric oxide releasing non-steriodal anti-inlammatory drugs - NSAID), например, включая COX-ингибирующие NO-поставляющие лекарственные средства (including СОХ-inhibiting NO-donating - INOD),
- фосфодиэстераза, например, медиаторы, например, ингибиторы активности PDE4B,
- медиаторы, например, ингибиторы активности каспазы,
- медиаторы, например, агонисты G-белка сцепленного рецептора 1 (GPBAR1),
- медиаторы, например, ингибиторы активности керамидкиназы,
- «полифункциональные противовоспалительные» лекарственные средства ('multi-functional anti-inflammatory' drugs - MFAID), например, ингибиторы цитозольной фосфолипазы А2 (cytosolic phoshpholipase A2 - cPLA2), например, ингибиторы заякоренной в мембране фосфолипазы A2, связанные с глюкозаминоглюканами,
- антибиотики, например, пенициллины, цефалоспорины, эритромицины, тетрациклины, сульфамиды, например, сульфадиазин, сульфизоксазол, сульфоны, например, дапсон; плевромутилины, фторхинолоны, например, ментронидазол, хинолоны, например, ципрофлоксацин; левофлоксацин; пробиотики и бактерии-комменсалы, например, Lactobacillus, Lactobacillus reuteri,
- противовирусные лекарственные средства, например, рибивирин, видарабин, ацикловир, ганцикловир, занамивир, озельтамивир фосфат, фамцикловир, атазанавир, амантадин, диданозин, эфавиренз, фоскартен, индинавир, ламивудин, нелфинавир, ритонавир, сахинавир, ставудин, валацикловир, вальганцикловир, зидовудин.
К противовоспалительным лекарственным средствам, применение которых оценено в качестве полезного в комбинации с ингибитором mTOR, например, оценено в качестве полезного согласно настоящему изобретению, относятся, например, противовоспалительные агенты нестероидной природы (non-steroidal antiinflammatory agents - NSAID), например, производные пропионовой кислоты (альминопрофен, беноксапрофен, буклоксовая кислота, капрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота and и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин, аклофенак, клиданак, диклофенак, фенклофенак, фенклокзиевая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенамовой кислоты (флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота), производные бифенилкарбоновой кислоты (дифлунизол и флуфенизол), оксикамы (изоксикам, пироксикам, судоксикам и теноксикам и теноксикан), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пирозолоны (апазон, бензиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон, ингибиторы циклооксигеназы-2 (cyclooxygenase-2 - СОХ-2), например, целекоксиб, ингибиторы фосфодиэстеразы IV типа (phosphodiesterase type IV - PDE-IV); антагонисты хемокинных рецепторов, особенно CCR-1, CCR-2 и CCR-3, агенты, снижающие уровень холестерина, например, ингибиторы HMG-CoA-редуктазы (ловастанин, симвастатин и правастатин, флувастатин, аторвастатин и другие статины), секвестранты (холестирамин и колестипол), никотиновая кислота, производные фенофибровой кислоты (гемфиброзил, клофибрат, фенофибрат и бензафибрат) и пробукол; антихолинергические агенты, например, мускариновые антагонисты (ипратропиум бромид); другие соединения, например, теофиллин, сульфасалазин и аминосалицилаты, например, 5-аминосалициловая кислота, и их пролекарства, антиревматические агенты.
К противоаллергическим лекарственным средствам, применение которых оценено в качестве полезного в комбинации с ингибитором mTOR, например, оценено в качестве полезного согласно настоящему изобретению, относятся, например, антигистамины (антагонисты H1-гистамина), например, бромфенирамин, хлорфенирамин, дексхлорфенирамин, трипролидин, клемастин, дифенгидрамин, дифенилпиралин, трипеленнамин, гидроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолин, фенирамин, пириламин, астемизол, терфенадин, лоратадин, цетиризин, фексофенадин, дезкарбоэтоксилоратадин и нестероидные антиастматические агенты, например, β2-агонисты (тербуталин, метапротеренол, фенотерол, изоэтарин, альбутерол, битолтерол, салметерол и пирбутерол), теофиллин, кромолин натрия, атропин, бромид ипратропия, антагонисты лейкотриена (зафиркуласт, монтелукаст, пранкуласт, иралукаст, побилукаст, SKB-106,203), ингибиторы биосинтеза лейкотриена (зилейтон, BAY-1005), бронходилаторы, антиастматические агенты (стабилизаторы тучных клеток).
В каждом случае в настоящем изобретении при цитировании патентных заявок или научных публикаций сущность, связанная с соединениями, упоминаемыми в настоящем изобретении в виде ссылки, также относится, например, к их фармацевтически приемлемым агентам, соответствующим рацематам, диастериоизомерам, энантиомерам, таутомерам, а также соответствующим кристаллическим модификациям указанных выше соединений, например, сольватов, гидратов и полиморф, описанных в настоящем изобретении. Соединения, применимые в качестве действующих ингредиентов в комбинациях настоящего изобретения, могут быть приготовлены и введены согласно описанному в цитируемых документах или в описании продукта, соответственно. Кроме того, в рамки охвата настоящего изобретения входит комбинация более чем двух отдельных действующих ингредиентов, указанных выше, т.е. фармацевтическая комбинация в рамках охвата настоящего изобретения может включать три действующих ингредиента или более. Кроме того, и действующий агент, и сопутствующий агент не являются идентичными ингредиентами.
Структуру лекарственных веществ, обозначенных кодовыми номерами, обычными или торговыми названиями, можно почерпнуть в Интернете, известном справочнике «The Merck Index» или в базах данных, например, Patents International, например, IMS World Publications, или из публикаций, указанных в настоящем изобретении выше и ниже. Соответственно их содержание указано в настоящем изобретении в виде ссылок.
Применение ингибиторов mTOR для лечения эндокринных опухолей может быть показано in vitro, в экспериментах с применением животных, а также в клинических исследованиях, например, согласно способам, описанным в настоящем изобретении.
А. Исследование in vitro
А.1 Антипролиферативное действие в комбинации с другими агентами
Клетки, например, клетки линии А549, устойчивые к соединению А (IC50 выражается в диапазоне, ниже наномолярных значений) против клеток линий КВ-31 и НСТ116 с относительной устойчивостью к соединению А (IC50 выражается в микромолярном диапазоне), вносят в 96-луночные планшеты (1500 клеток/лунку в 100 мкл среды) и инкубируют в течение 24 ч. Затем делают серии двукратных разведений каждого соединения (ингибитор mTOR, отличающийся от соединения А или известного химиотерапевтического агента) в отдельных пробирках (начиная с 8-кратной величины IC50 каждого соединения) отдельно или в парных комбинациях, и разведения вносят в лунки.
Затем клетки повторно инкубируют в течение 3 суток. Окрашивание метиленовым синим проводят на 4 сутки и определяют количество связанного красителя (пропорционально количеству выживших клеток, связывающих краситель). Затем определяют величину IC50, используя программу Calcusyn, которая предусматривает измерение взаимодействия, а именно так называемого неисключительного комбинаторного индекса (combination index - CI), где: CI~1 = взаимодействие примерно можно оценить в качестве аддитивного, 0,85-0,9 = слабо выраженный синергизм, <0,85 = синергизм. В данном исследовании ингибиторы mTOR, например соединение А проявляет интересное антипролиферативное действие в комбинации с другим химиотерапевтическим агентом, например, описанным выше, например, в комбинации с сомастатином или аналогом сомастатина.
Б. Исследование in vitro
Статус фосфорилирования расположенных ниже маркеров S6 (ингибирование активности S6K1) применяют в качестве показателя, отражающего немедленное фармакодинамическое действие ингибитора mTOR, например, в исследовании p70S6 киназы 1 (S6K1), см., например, WO 2005064343.
Карциноидная эффективность может быть определена измерением хромогранина А, который также гиперсекретируют карциноидные клетки, см., например, Davis и др., Gynecology & Obstetrics 137, 1973, сс.637-644.
В. Исследования in vitro
Соединение А может восстанавливать действие эндокринных агентов, например, ингибиторов эстрогена и/или ингибиторов ароматазы, в клетках, которые устойчивы к лечению эндокринными агентами.
В нескольких исследованиях используют измененную активность Akt киназы в качестве важного механизма, с помощью которого опухоли груди становятся нечувствительными к эндокринной терапии.
Г. Клинические исследования
В клинических исследованиях пациентов с карциноидом или раком островковых клеток подавление активности S6K1 и снижение хромогранина А можно наблюдать при введении либо одного соединения А, либо комбинации продукта Sandostatin LAR® (30 мг ежедневно) с соединением А (5 мг ежедневно). Оценку ответа можно проводить каждые 12 недель. Длительность исследования: 6 месяцев.
Также наблюдают синергетические эффекты такой комбинации.
Дальнейшие клинические исследования проводят с применением соединения А в количестве 5 или 10 мг/сутки (5-70 мг в неделю) в виде монотерапии и в комбинированной терапии, например, вместе с 30 мг продукта Sandostatin LAR® в сутки.
Рандомизированное двойное слепое плацебо-контролируемое исследование соединения А проводят на 420 пациентах, которые получают продукт Sandostatin LAR® для лечения прогрессирующих карциноидных опухолей средней кишки. После завершения исходной терапии продуктом Sandostatin LAR® пациентов рандомизируют для введения соединения А в дозе 10 мг/сутки или для введения плацебо. Первичная оценка касается выживания без прогрессирования заболевания. Вторичная оценка включает общее выживание, карциноид-ассоциированные симптомы гиперемии и диареи, данные фармакокинетики и фармакодинамики. Для эффективности оценки прогрессирование и ответ оценивают по критериям RECIST. Из-за природы эндокринных опухолей все пациенты должны пройти сканирование трехфазной компьютерной томографией или ЯМР. Сканирования повторяют каждые два месяца. Цель: соединение А в комбинации с продуктом Sandostatin LAR® для лечения сформировавшейся прогрессирующей опухоли средней кишки (карциноидной опухоли).
Исследовали соединение А в дозе 10 мг/сутки на группе из 100 пациентов с незначительно развившимися (метастатическими или без метастазов) нейроэндокринными опухолями поджелудочной железы (опухолью островковых клеток) после неудачи цитотоксической химиотерапии в качестве монотерапии с плацебо-контролем. Первоочередная задача заключалась в определении степени ответа. Группа из 44 пациентов, подвергаемых постоянному лечению продуктом Sandostatin LAR®, предназначенным для секреторных опухолей поджелудочной железы, помимо продукта Sandostatin LAR® также лечили соединением А в дозе 10 мг в сутки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2447891C2 |
| ЛЕЧЕНИЕ ТУБЕРОЗНОГО СКЛЕРОЗА | 2007 |
|
RU2473343C2 |
| КОМБИНАЦИИ ИНГИБИТОРА HSP90 | 2009 |
|
RU2519673C2 |
| КОМБИНАЦИИ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2449788C2 |
| КОМБИНАЦИЯ ИНГИБИТОРА ФОСФАТИДИЛИНОЗИТОЛ-3-КИНАЗЫ (Р13К) И ИНГИБИТОРА mTOR | 2009 |
|
RU2538683C2 |
| КОМБИНАЦИЯ, ВКЛЮЧАЮЩАЯ КОМПЛЕКСОН ЖЕЛЕЗА И ПРОТИВООПУХОЛЕВЫЙ АГЕНТ, И ЕЕ ПРИМЕНЕНИЕ | 2007 |
|
RU2469721C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ИНГИБИТОРЫ Bcr-Abl/c-Kit/PDGF-R TK, ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2452492C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2659725C2 |
| КОМБИНАЦИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2322981C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2665138C2 |
Предложена группа изобретений, которые относятся к медицине, а именно к онкологии. Предложено применение 40-O-(2-гидроксиэтил)-рапамицина для лечения панкреатических нейроэндокринных опухолей и лечения инвазивности панкреатических эндокринных опухолей или симптомов, ассоциированных с таким опухолевым ростом. Также предложена фармацевтическая композиция, включающая 40-O-(2-гидроксиэтил)-рапамицин вместе с, но меньшей мере, одним фармацевтически приемлемым эксципиентом для лечения панкреатических нейроэндокринных опухолей. При этом опухолями могут быть опухоли островковых клеток, апудомы, инсулиномы, глюкагономы, нефункционирующей ПЭО поджелудочной железы, ПЭО поджелудочной железы, ассоциированной с гиперкальциемией гастриномы, випомы, соматостатиномы, GRFомы. Применение 40-O-(2-гидроксиэтил)-рапамицина может осуществляться для запущенных опухолей после неудачного применения цитотоксической химиотерапии в качестве монотерапии, и доза 40-O-(2-гидроксиэтил)-рапамицина составляет 10 мг/в день. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения может осуществляться с, по меньшей мере, одной второй лекарственной субстанцией, где такой субстанцией может являться соматостатин или аналог соматостатина или октреотид. Применение этого препарата, в том числе, в составе фармацевтической композиции эффективно для лечения панкреатических нейроэндокринных опухолей и лечения инвазивности панкреатических эндокринных опухолей или симптомов, ассоциированных с таким опухолевым ростом. 3 н. и 11 з.п. ф-лы.
1. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения панкреатических нейроэндокринных опухолей.
2. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.1, где опухолями являются опухоли островковых клеток, апудомы, инсулиномы, глюкагономы, нефункционирующей НЭО поджелудочной железы, НЭО поджелудочной железы, ассоциированной с гиперкальциемией гастриномы, випомы, соматостатиномы, GRFомы.
3. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.1, где опухолями являются запущенные опухоли после неудачного применения цитотоксической химиотерапии в качестве монотерапии и доза, 40-O-(2-гидроксиэтил)-рапамицина составляет 10 мг/в день.
4. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.3, где опухолью является опухоль островковых клеток.
5. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.1, где рост опухоли подавляется.
6. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.1, где опухоль подавляется или контролируется.
7. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.1, где индуцируется регрессия опухоли.
8. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения инвазивности панкреатических эндокринных опухолей или симптомов, ассоциированных с таким опухолевым ростом.
9. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.8, где предупреждение метастатического распространения является предупреждением или подавлением роста микрометастазов.
10. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по пп.1, 2, 4-8 в комбинации с, по меньшей мере, одной второй лекарственной субстанцией.
11. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.10, где, по меньшей мере, одной второй лекарственной субстанцией является соматостатин или аналог соматостатина.
12. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.11, где, по меньшей мере, одной второй лекарственной субстанцией является октреотид.
13. Применение 40-O-(2-гидроксиэтил)-рапамицина для лечения по п.3, в комбинации с октреотидом, где опухолью является секреторная панкреатическая опухоль.
14. Фармацевтическая композиция, включающая 40-O-(2-гидроксиэтил)-рапамицин вместе с, по меньшей мере, одним фармацевтически приемлемым эксципиентом для лечения панкреатических нейроэндокринных опухолей.
| ПЕРЕКОМПОНУЕМАЯ АВТОМАТИЧЕСКАЯ ЛИНИЯ | 1995 |
|
RU2080975C1 |
| WO 2005082411 A1, 09.09.2005 | |||
| СПОСОБ ПОЛУЧЕНИЯ DL-АЛЬФА-ТОКОФЕРОЛА ИЛИ ЕГО АЦЕТАТА | 1994 |
|
RU2098416C1 |
| WO 9705167 A1, 13.02.1997 | |||
| US 5538739 A, 23.07.1996 | |||
| ДЕДОВ И.И | |||
| Эндокринология | |||
| - М.: Медицина, 2000, с.560. | |||
Авторы
Даты
2013-07-20—Публикация
2006-11-20—Подача