Ссылки на предшествующие заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США, № 60/518534, поданной 6 ноября 2003; предварительной заявки на патент США, № 60/5557116, поданной 26 марта 2004; предварительной заявки на патент США, № 60/598899, поданной 4 августа 2004; и предварительной заявки на патент США, № 60/622455, поданной 27 октября 2004, описание которых включено в настоящее описание посредством ссылки.
1. Предшествующий уровень техники
Настоящее изобретение относится к лекарственному соединению, а в частности к конъюгатам “лекарственное средство-линкер-лиганд”, к соединениям лекарственное средство-линкер и к конъюгатам “лекарственное средство-лиганд”, к композициям, включающим вышеперечисленные соединения и конъюгаты, и к способам их применения для лечения рака, аутоиммунного заболевания или инфекционного заболевания. Настоящее изобретение также относится к конъюгатам “антитело-лекарственное средство”, к композициям, включающим эти конъюгаты, и к способам их применения для лечения рака, аутоиммунного заболевания и инфекционного заболевания. Настоящее изобретение также относится к способам применения соединений, представляющих собой конъюгаты “антитело-лекарственное средство” для in vitro, in situ и in vivo диагностики или обработки клеток млекопитающих или для лечения патологических состояний.
2. Предшествующий уровень техники
Уже много лет проводятся интенсивные исследования по улучшению доставки лекарственных средств и других агентов в клетки, ткани и опухоли-мишени в целях достижения максимальной эффективности при минимальной токсичности. Хотя было предпринято множество попыток разработать эффективные способы доставки биологически активных молекул в клетки, как in vivo, так и in vitro, однако ни одна из них не дала удовлетворительных результатов. Оптимизация конъюгирования лекарственного средства с его внутриклеточной мишенью, а также минимизация внутриклеточного перераспределения лекарственного средства, например, в соседние клетки часто представляет определенные трудности или является неэффективной.
Большинство современных средств, парентерально вводимых пациенту, не нацелены на мишень, что приводит к их системной доставке в клетки и ткани организма, в которых присутствие этих средств не требуется и часто является нежелательным. В результате эти лекарственные средства вызывают нежелательные побочные эффекты, что часто приводит к ограничению доз лекарственного средства (например, химиотерапевтического (противоракового) средства, цитотоксического средства, ингибитора ферментов и противовирусных или противомикробных средств), предназначенных для введения. Хотя пероральное введение лекарственных средств, по сравнению с парентеральным введением, считается удобным и экономичным способом введения, однако и в этом случае проблема неспецифического токсического воздействия лекарственного средства, после его попадания в систему кровообращения, на нормальные клетки остается актуальной. Другие проблемы, возникающие при пероральном введении, связаны с биодоступностью вводимого лекарственного средства и его задержкой в кишечнике, что приводит к дополнительному воздействию лекарственного средства на кишечник, а следовательно, и к повышению риска токсического воздействия на кишечник. В соответствии с этим главной целью настоящего изобретения является разработка способов специфической доставки агентов в клетки и ткани. Преимущества такого лечения заключаются в возможности предотвращения общих физиологических эффектов, связанных с нежелательной доставкой указанных агентов в другие клетки и ткани, такие как неинфицированные клетки. Внутриклеточная доставка может быть достигнута способами, которые обеспечивают аккумуляцию или присутствие активных агентов, то есть активных метаболитов, внутри клеток.
Была разработана терапия с использованием моноклональных антител для целенаправленного лечения пациентов, страдающих раком, иммунологическими и ангиогенными расстройствами.
Использование конъюгатов “антитело-лекарственное средство” в целях локальной доставки цитотоксических или цитостатических агентов, например лекарственных средств для уничтожения или подавления опухолевых клеток при лечении рака (Syrigos & Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz & Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США № 4975278), теоретически позволяет осуществлять направленную доставку лекарственного средства в опухоли и обеспечивать их аккумуляцию внутри клеток, тогда как системное введение этих неконъюгированных лекарственных средств может приводить к продуцированию уровней токсичности, которые являются неприемлемыми для нормальных клеток, а также недостаточными для опухолевых клеток, которые необходимо уничтожить (Baldwin et al., 1986, Lancet pp. (Mar. 15, 1986):603-05; Thorpe, 1985, “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review” in Monoclonal Antobodies 84:Biological And Clinical Applications, A. Pinchera et al. (eds.), p. 475-506). Таким образом, желательно, чтобы максимальная эффективность сочеталась с минимальной токсичностью. Сообщалось, что в этой стратегии могут быть использованы как поликлональные, так и моноклональные антитела (Rowland et al., 1986, Cancer Immunol. Immunother. 21:183-87). Лекарственными средствами, используемыми в этих способах, являются дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., 1986, см. выше). Токсинами, используемыми в конъюгатах “антитело-токсин”, являются бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, и небольшие молекулы-токсины, такие как гельданамицин (Kerr et al., 1997, Bioconjugate Chem. 8(6):781-784; Mandler et al., (2000) Jour of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут оказывать свое цитоктоксическое и цитостатическое действие в соответствии с механизмами, включающими связывание с тубулином, связывание с ДНК или ингибирование топоизомеразы (Meyer D.L. & Senter P.D. “Recent Advances in Antibody Drug Conjugates for Cancer Therapy” in Annual Report in Medicinal Chemistry, Vol. 38(2003) Chapter 23, 229-237). Некоторые цитотоксические лекарственные средства, при их конъюгировании с крупными антителами или лигандами белков-рецепторов, имеют тенденцию к потере активности или уменьшению активности.
Зевалин (Zevalin®) (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат “антитело-радиоизотоп”, состоящий из мышиного моноклонального антитела IgG1-каппа, направленного против антигена CD20, присутствующего на поверхности нормальных и злокачественных В-лимфоцитов, и радиоактивных изотопов 111In или 90Y, связанных с хелатообразующим комплексом “тиомочевина-линкер” (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя зевалин обладает активностью против В-клеточной не-ходжкинской лимфомы (НХЛ), однако его введение приводит к тяжелой и хронической цитопении у большинства пациентов. В 2000 г. было дано разрешение на применение препарата милотарг (Mylotarg®) (гемтузумаб озогамицин, Wyeth Pharmaceuticals), то есть конъюгата “антитело-лекарственное средство”, состоящего из антитела против человеческого CD33, связанного с калихеамицином, для лечения острого миелоидного лейкоза путем инъекции указанного препарата (Drugs of the Future (2000) 25(7):686; патенты США № 4970198; 5079233; 5585989; 5606040; 5693762, 5739116, 5767285, 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат “антитело-лекарственное средство”, состоящий из антитела против человеческого C242, связанного посредством дисульфидного линкера SPP с майтанзиноидным лекарственным средством, DM1, был использован в испытаниях фазы II для лечения раковых опухолей, экспрессирующих CanAg, таких как раковые опухоли толстой кишки, поджелудочной железы, желудка и т.п. MLN-2704 (Millenium Pharm., BZL Biologics, Immunogen Inc.), конъюгат “антитело-лекарственное средство”, состоящий из моноклонального антитела против мембраносвязанного антигена предстательной железы (PSMA), присоединенного к майтанзиноидному лекарственному средству, DM1, находится на стадии исследования его возможного применения для лечения опухолей предстательной железы. Это майтанзиноидное лекарственное средство, DM1, было конъюгировано с мышиным моноклональным антителом ТА.1 посредством не-дисульфидного линкера, SMCC (Chari et al. (1992) Cancer Research 52:127-131). Сообщалось, что указанный конъюгат был в 200 раз менее эффективным, чем соответствующий конъюгат, связанный посредством дисульфидного линкера. В этой работе линкер SMCC рассматривается как “не-расщепляемый”.
Из морского моллюска Dolabella auricularia было выделено несколько короткоцепочечных пептидных соединений, и было обнаружено, что они обладают биологической активностью (Pettit et al. (1993) Tetrahedron 49:9151; Nakamura et al. (1995) Tetrahedron Letters 36:5059-5062; Sone et al. (1995) Jour. Org. Chem. 60:4474). Были также получены аналоги этих соединений, и было обнаружено, что некоторые из них обладают биологической активностью (обзор см. Pettit et al. (1998) Anti-Cancer Drug Design 13:243-277). Так, например, ауристатин Е (патент США № 5635483) представляет собой синтетический аналог натурального морского продукта доластатина 10, т.е. агент, который ингибирует полимеризацию тубулина путем связывания с таким же доменом на тубулине, как и противораковое лекарственное средство винкристин (G.R. Pettit (1997) Prog. Chem. Org. Nat. Prod. 70:1-79). Доластатин 10, ауристатин РЕ и ауристатин Е представляют собой линейные пептиды, имеющие четыре аминокислоты, три из которых являются уникальными для соединений класса доластатинов, и С-концевой амид.
Ауристатиновые пептиды, ауристатин Е (АЕ) и монометилауристатин (ММАЕ), т.е. синтетические аналоги доластатина, были конъюгированы: (i) с химерными моноклональными антителами cBR96 (специфическими к антигену Lewis Y на карциномах); (ii) с сАС10, который является специфичным к CD30, присутствующему на гематологических злокачественных опухолях (Klussman et al. (2004) Bioconjugate Chemistry 15(4):765-773; Doronina et al. (2003) Nature Biotechnology 21(7):778-784; “Monomethylvaline Compounds Capable of Conjugation to Ligands”; Francisco et al. (2003) Blood 102(4):1458-1465; публикация заявки США 2004/0018194); (iii) с антителами против CD20, такими как ритуксан® (WO 04/032828), используемым для лечения CD20-экспрессирующих раковых опухолей и иммунных расстройств; (iv) с анти-EphB2 антителом 2Н9 и с анти-IL-8 антителом, используемым для лечения рака толстой кишки (Mao et al. (2004) Cancer Research 64(3):781-788)); (v) с антителом против Е-селектина (Bhaskar et al. (2003) Cancer Res. 63:6387-6394) и (vi) с другими анти-CD30 антителами (WO 03/043583).
Ауристатин Е, конъюгированный с моноклональными антителами, описан в работе Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, опубликованной 28 марта 2004.
Вопреки in vitro-данным, полученным в клинических исследованиях соединений класса долостатинов и их аналогов, дозы, необходимые для достижения терапевтического эффекта, продуцируют значительную общую токсичность, что снижает их эффективность. В соответствии с этим необходимость в разработке производных доластатина/ауристатина, обладающих значительно меньшей токсичностью, но ценной терапевтической активностью, остается актуальной. Таким образом, настоящее изобретение направлено на устранение этих и других ограничений и проблем, которые до сих пор остаются нерешенными.
Тирозинкиназные рецепторы семейства ErbB являются важными медиаторами роста, дифференцировки и выживания клеток. Это семейство рецепторов включает четыре различных члена, включая рецептор эпидермального фактора роста (EGFR, ErbB1, HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Панель анти-ErbB2 антител была охарактеризована с использованием клеточной линии человеческих опухолей молочной железы SCBR3 (Hudziak et al. (1989) Mol. Cell. Biol. 9(3):1165-1172. Максимальное ингибирование достигалось с использованием антитела, называемого 4D5, которое на 56% ингибировало пролиферацию клеток. В этом анализе другие антитела в данной панели антител снижали пролиферацию клеток в меньшей степени. Кроме того, было обнаружено, что антитело 4D5 сенсибилизирует ErbB2-сверхэкспрессирующие клеточные линии опухоли молочной железы с продуцированием цитотоксических эффектов TNF-α (патент США № 5677171). Анти-ErbB2 антитела, обсуждаемые Hudziak et al., были дополнительно охарактеризованы Fendly et al. (1990), Cancer Research 50:1550-1558; Kotts et al. (1990) In vitro 26(3):59А; Sarup et al. (1991) Growth Regulation 1:72-82; Shepard et al. J. (1991) Clin. Immunol. 11(3):117-127; Kumar et al. (1991) Mol. Cell. Biol. 11(2):979-986; Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263; Pietras et al. (1994) Oncogene 9:1829-1838; Vitetta et al. (1994) Cancer Research 54:5301-5309; Silwkowski et al. (1994) J. Biol. Chem. 269(20):14661-14665; Scott et al. (1991) J. Biol. Chem. 266:14300-5; D'souza et al. Proc. Natl. Acad. Sci. (1994) 91:7202-7206; Lewis et al. (1996) Cancer Research 56:1457-1465 и Schaefer et al. (1997) Oncogene 15:1385-1394.
Другие анти-ErbB2 антитела, обладающие различными свойствами, описаны Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. Proc. Natl. Acad. Sci., USA, 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); в WO94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Handcock et al. (1991) Cancer Res. 51:4575-4580; Shawver et al. (1994) Cancer Res. 54:1367-1373; Arteaga et al. (1994) Cancer Res. 54:3758-3765; Harwerth et al. (1992) J. Biol. Chem. 267:15160-15167; в патенте США № 5783186 и Klapper et al. (1997) Oncogene 14:2099-2109.
Скрининг на гомологию позволил идентифицировать два других члена семейства рецепторов ErbB, а именно ErbB3 (патент США № 5183884; патент США № 5480968; KraU.S. et al. (1989) Proc. Natl. Acad. Sci., USA, 86:9193-9197) и ErbB4 (EP 599274; Plowman et al. (1993) Proc. Natl. Acad. Sci., USA, 90:1746-1750; и Plowman et al. (1993) Nature 366:473-475). Оба эти рецептора обнаруживали повышенную экспрессию, по крайней мере, на некоторых клеточных линиях рака молочной железы.
Герцептин® (трастузумаб) представляет собой рекомбинантное ДНК “гуманизованное” моноклональное антитело, которое в клеточном анализе селективно и с высокой аффинностью (Kd=5 нМ) связывалось с внеклеточным доменом белка-рецептора человеческого эпидермального фактора роста -2, HER2 (ErbB2) (патент США № 5821337; патент США № 6054297; патент США № 6407213; патент США № 6639055; Coussens L. et al. (1985) Science 230:1132-9; Slamon D.J. et al. (1989) Science 244:707-12). Трастузумаб представляет собой антитело IgG1-каппа, которое содержит каркасные области человеческого антитела и гипервариабельные области (комплементарность-определяющие области) мышиного антитела (4D5), которое связывается с HER2. Трастузумаб связывается с антигеном HER2 и, тем самым, ингибирует рост раковых клеток. Поскольку трастузумаб является гуманизованным антителом, то это минимизирует любой НАМА-ответ у пациентов. Гуманизованное антитело против HER2 было продуцировано в суспензионной культуре клеток млекопитающих (клеток яичника китайского хомячка, СНО). Протоонкоген HER2 (или с-erbB2) кодирует трансмембранный рецепторный белок размером 185 кДа, структура которого является родственной структуре рецептора эпидермального фактора роста. Сверхэкспрессия белка HER2 наблюдается в 25%-30% первичных опухолей молочной железы и может быть определена путем иммуногистохимической оценки фиксированных опухолевых срезов (Press M.F. et al. (1993) Cancer Res. 53:4960-70). Анализы, проведенные in vitro и на животных, показали, что трастузумаб ингибирует пролиферацию человеческих опухолевых клеток, которые сверхэкспрессируют HER2 (Hudziak R.M. et al. (1989) Mol. Cell. Biol. 9:1165-72; Lewis G.D. et al. (1993) Cancer Immunol. Immunother; 37:255-63; Baselga J. et al. (1998) Cancer Res. 58:2825-2831). Трастузумаб является медиатором антитело-зависимой клеточной цитотоксичности, ADCC (Hotaling T.E. et al. (1996) [abstract]. Proc. Annual. Meeting Am. Assoc. Cancer Res; 37:471; Pegram M.D. et al. (1997) [abstract] Proc. Am. Assoc. Cancer Res; 38:602). In vitro было показано, что опосредуемая трастузумабом ADCC наблюдается преимущественно на HER2-сверхэкспрессирующих раковых клетках по сравнению с раковыми клетками, которые не обнаруживают сверхэкспрессию HER2. Герцептин® представляет собой единственное средство, которое показано для лечения пациентов, страдающих раковыми опухолями молочной железы с метастазами, которые сверхэкспрессируют белок HER2, и для пациентов, проходивших один или несколько курсов химиотерапии по поводу рака с метастазами. Герцептин® в комбинации с паклитакселом показан для лечения пациентов, страдающих раковыми опухолями молочной железы с метастазами, которые сверхэкспрессируют белок HER2, и для пациентов, не проходивших курса химиотерапии по поводу рака с метастазами. Герцептин® является клинически активным у пациентов с ErbB2-сверхэкспрессирующими раковыми метастазирующими опухолями молочной железы, где указанные пациенты, перед противораковой терапией, проходили интенсивный курс лечения (Baselga et al. (1996) J. Clin. Oncol. 14:737-744).
Мышиное моноклональное анти-HER2 антитело ингибирует рост клеточных линий рака молочной железы, при котором наблюдается сверхэкспрессия HER2 на уровне 2+ и 3+ (1-2×106 рецепторов HER2 на клетку), но это антитело не обладало активностью по отношению к клеткам, которые экспрессировали низкие уровни HER2 (Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263). Принимая во внимание эти наблюдения, антитело 4D5 было гуманизовано (huMab4D5-8, rhuMab HER2, патент США № 5821337; Carter et al. (1992) Proc. Natl. Acad. Sci., USA, 89:4285-4289) и протестировано у пациентов с раковыми опухолями молочной железы, которые сверхэкспрессировали HER2, но при этом прогрессировали после проведения стандартной химиотерапии (Cobleigh et al. (1999) J. Clin. Oncol. 17:2639-2648).
Хотя получение герцептина является выдающимся научным достижением в лечении пациентов с ErbB2-сверхэкспрессирующими раковыми опухолями молочной железы, которые были предварительно подвергнуты интенсивной противораковой терапии, однако некоторые пациенты этой группы не обнаруживали какого-либо ответа или обнаруживали лишь незначительный ответ на лечение герцептином.
Поэтому остается актуальной необходимость в разработке других, имеющих важное клиническое значение способов HER2-направленной противораковой терапии пациентов с HER2-сверхэкспрессирующими опухолями или с другими заболеваниями, ассоциированными с экспрессией HER2, которые не поддаются или плохо поддаются лечению герцептином.
Любые работы, цитируемые в настоящей заявке, не должны рассматриваться как прототипы настоящего изобретения.
3. Описание сущности изобретения
В одном из своих аспектов настоящее изобретение относится к соединениям “лекарственное средство-линкер-лиганд”, имеющим формулу Ia:
или к их фармацевтически приемлемым солям или сольватам,
где: L представляет собой лигандный компонент;
-Аа-Ww-Yy- представляет собой линкерный компонент (LU), где в указанном линкерном компоненте:
-А- представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
-Y- означает спейсерный компонент,
у равно 0, 1 или 2;
р составляет в пределах от 1 примерно до 20; и
-D представляет собой компонент “лекарственное средство”, имеющее формулы DE и DF;
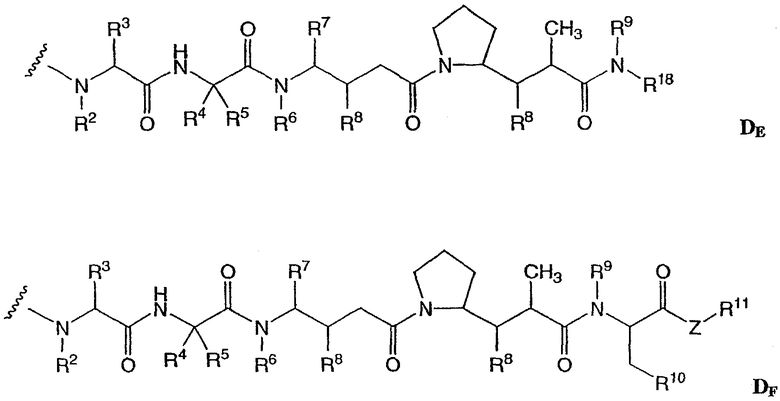
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН, где n равно целому числу от 0 до 6; и
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла).
В другом своем аспекте настоящее изобретение относится к лекарственным соединениям формулы Ib:
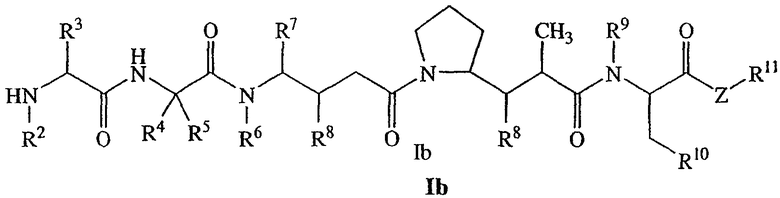
или к их фармацевтически приемлемым солям или сольватам,
где: R2 выбран из водорода и С1-С8алкила;
R3 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла), где R5 выбран из Н и метила, либо R4 и R5, взятые вместе с атомом углерода, с которым они связаны, образуют кольцо формулы -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арильной группы или С3-С8гетероцикла;
Z представляет собой -О-, -S-, -NH- или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН, и
n равно целому числу от 0 до 6.
Соединения формулы (Ib) могут быть использованы для лечения рака, аутоиммунного заболевания или инфекционного заболевания у пациента, либо они могут быть использованы в качестве промежуточного соединения для синтеза конъюгатов “лекарственное средство-линкер”, “лекарственное средство-линкер-лиганд” и “лекарственное средство-лиганд”, в которых указанное лекарственное средство является отщепляемым компонентом.
В другом своем аспекте настоящее изобретение относится к композициям, включающим эффективное количество конъюгата “лекарственное средство-линкер-лиганд” и фармацевтически приемлемый носитель или наполнитель.
В другом своем аспекте настоящее изобретение относится к фармацевтическим композициям, включающим эффективное количество соединения “лекарственное средство-линкер” и фармацевтически приемлемый носитель или наполнитель.
В еще одном своем аспекте настоящее изобретение относится к композициям, включающим эффективное количество конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”, и фармацевтически приемлемый носитель или наполнитель.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лизиса размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В другом своем аспекте настоящее изобретение относится к лекарственному соединению, которое может быть использовано в качестве промежуточного соединения для синтеза соединения “лекарственное средство-линкер”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В другом своем аспекте настоящее изобретение относится к соединению “лекарственное средство-линкер”, которое может быть использовано в качестве промежуточного соединения для синтеза конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к соединениям формулы Ia':
или к их фармацевтически приемлемым солям или сольватам,
где: Ab-представляет собой антитело, включая антитело, которое связывается с CD30, CD40, CD70 и антигеном Lewis-Y;
А представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y означает спейсерный компонент,
у равно 0, 1 или 2,
р составляет в пределах от 1 примерно до 20; и
D представляет собой компонент “лекарственное средство”, выбранный из соединений формул DE и DF;
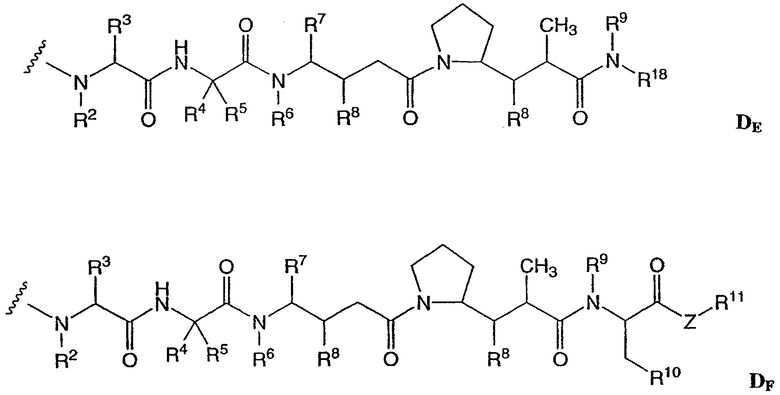
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН, и
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла); и
n равно целому числу от 0 до 6.
В одном из вариантов изобретения Ab не является антителом, которое связывается с рецептором ErbB или которое связывается с одним или с несколькими рецепторами (1)-(35), таким как:
(1) BMPR1B (рецептор белка морфогенеза кости типа IB, Genbank рег. № NM_001203);
(2) Е16 (LAT1, SLC7A5, Genbank рег. № NM_003486);
(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы, Genbank рег. № NM_012449);
(4) 0772Р (СА125, MUC16, Genbank рег. № AF361486);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, Genbank рег. № NM_005823);
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II, Genbank рег. № NM_006424);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен (семафорин) 5В, Genbank рег. № АВ040878);
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, кДНК RIKEN 2700050C12, кДНК гена RIKEN 2700050C12, Genbank рег. № AY358628);
(9) ETBR (рецептор эндотелина типа В, Genbank рег. № AY275463);
(10) MSG783 (RNF124, гипотетический белок FLJ20315, Genbank рег. № NM_017763);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы, Genbank рег. № AF455138);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М, Genbank рег. № NM_017636);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы, Genbank рег. № NP_003203 или NM_003212);
(14) CD21 (CR2 (рецептор комплемента 2), или C3DR (C3d/рецептор вируса Эпштейна-Барра), или Hs.73792, Genbank рег. № M26004);
(15) CD79b (IGb (бета-белок, связанный с иммуноглобулином), В29, Genbank рег. № NM_000626);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C, Genbank рег. № NM_030764);
(17) HER2 (Genbank рег. № M11730);
(18) NCA (Genbank рег. № М18728);
(19) MDP (Genbank рег. № BC017023);
(20) IL20Rα (Genbank рег. № AF184971);
(21) Brevican (Genbank рег. № AF229053);
(22) Ephb2R (Genbank рег. № NM_004442);
(23) ASLG659 (Genbank рег. № AX092328);
(24) PSCA (Genbank рег. № AJ297436);
(25) GEDA (Genbank рег. № AY260763);
(26) BAFF-R (Genbank рег. № NP_443177.1);
(27) CD22 (Genbank рег. № NP-001762.1);
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок, В-клетко-специфический белок, который ковалентно взаимодействует с Ig бета (CD79B) и образует комплекс с молекулами IgM на поверхности клеток, передавая сигнал, участвующий в дифференцировке В-клеток, Genbank рег. № NP_001774.1);
(29) CXCR5 (рецептор 1 лимфомы Беркитта, рецептор, связанный с G-белком и активируемый хемокином CXCL13, обеспечивает миграцию лимфоцитов и гуморальную защиту, а также играет определенную роль в инфицировании вирусом ВИЧ-2 и, вероятно, в развитии СПИД'а, лимфомы, миеломы и лейкоза, Genbank рег. № NP_001707.1);
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Ia), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам, Genbank рег. № NP_002111.1);
(31) Р2Х5 (ионный канал -5, открываемый лигандом пуринергического рецептора Р2Х; ионный канал, открываемый внеклеточным АТР, может участвовать в синаптической передаче и в нейрогенезе, а его дефицит может играть определенную роль в патофизиологии идиопатической дисфункции мочевого пузыря, Genbank рег. № NP_002552.2);
(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2, Genbank рег. № NP_001773.1);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок, относящийся к семейству белков с богатыми лейцином повторами (LRR), типа I, который регулирует активацию и апоптоз В-клеток, и потеря функции этого белка ассоциируется с прогрессированием у пациентов системной красной волчанки, Genbank рег. № NP_005573.1);
(34) FCRH1 (Fc-рецептор-подобный белок 1, предполагаемый рецептор для Fc-домена иммуноглобулина, который содержит Ig-подобные домены типа С2 и домены ITAM и может играть определенную роль в дифференцировке В-лимфоцитов, Genbank рег. № NP_443170.1);
(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2, предполагаемый иммунорецептор, который, возможно, играет определенную роль в развитии В-клеток и в лимфомагенезе; причем в некоторых злокачественных В-клетках наблюдается нарушение регуляции гена посредством транслокации, Genbank рег. № NP_112571.1).
В еще одном своем аспекте настоящее изобретение относится к фармацевтическим композициям, включающим эффективное количество конъюгата “лекарственное средство-линкер-антитело” и фармацевтически приемлемый носитель или наполнитель.
В еще одном своем аспекте настоящее изобретение относится к композициям, включающим эффективное количество конъюгата “лекарственное средство-антитело”, где указанное лекарственное средство (часть) отщепляется от указанного конъюгата “лекарственное средство-антитело”, и фармацевтически приемлемый носитель или наполнитель.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер -антитело”.
В другом своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам предотвращения размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-антитело”.
В другом своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-антитело”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В другом своем аспекте настоящее изобретение относится к лекарственному соединению, которое может быть использовано в качестве промежуточного соединения для синтеза соединения “лекарственное средство-линкер”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-антитело”.
В другом своем аспекте настоящее изобретение относится к соединению “лекарственное средство-линкер”, которое может быть использовано в качестве промежуточного соединения для синтеза конъюгата “лекарственное средство-линкер-антитело”.
В одном из своих аспектов настоящее изобретение относится к конъюгатам “лекарственное средство-линкер-антитело” (также называемым конъюгатами “антитело-лекарственное средство”), имеющим формулу Ic:
или к их фармацевтически приемлемым солям или сольватам,
где: Ab-представляет собой антитело, которое связывается с одним или несколькими антигенами (1)-(35), такими как:
(1) BMPR1B (рецептор белка морфогенеза кости типа IB, Genbank рег. № NM_001203);
(2) Е16 (LAT1, SLC7A5, Genbank рег. № NM_003486);
(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы, Genbank рег. № NM_012449);
(4) 0772Р (СА125, MUC16, Genbank рег. № AF361486);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, Genbank рег. № NM_005823);
(6) Napi3b (NAPI-3B, NpTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II, Genbank рег. № NM_006424);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен (семафорин) 5В, Genbank рег. № АВ040878);
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, кДНК RIKEN 2700050C12, кДНК гена RIKEN 2700050C12, Genbank рег. № AY358628);
(9) ETBR (рецептор эндотелина типа В, Genbank рег. № AY275463);
(10) MSG783 (RNF124, гипотетический белок FLJ20315, Genbank рег. № NM_017763);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы, Genbank рег. № AF455138);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М, Genbank рег. № NM_017636);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы, Genbank рег. № NP_003203 или NM_003212);
(14) CD21 (CR2 (рецептор комплемента 2), или C3DR (C3d/рецептор вируса Эпштейна-Барра), или Hs.73792, Genbank рег. № M26004);
(15) CD79b (IGb (бета-белок, связанный с иммуноглобулином), В29, Genbank рег. № NM_000626);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C, Genbank рег. № NM_030764);
(17) HER2 (Genbank рег. № M11730);
(18) NCA (Genbank рег. № М18728);
(19) MDP (Genbank рег. № BC017023);
(20) IL20Rα (Genbank рег. № AF184971);
(21) Brevican (Genbank рег. № AF229053);
(22) Ephb2R (Genbank рег. № NM_004442);
(23) ASLG659 (Genbank рег. № AX092328);
(24) PSCA (Genbank рег. № AJ297436);
(25) GEDA (Genbank рег. № AY260763);
(26) BAFF-R (Genbank рег. № NP_443177.1);
(27) CD22 (Genbank рег. № NP-001762.1);
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок, В-клетко-специфический белок, который ковалентно взаимодействует с Ig бета (CD79B) и образует комплекс с молекулами IgM на поверхности клеток, передавая сигнал, участвующий в дифференцировке В-клеток, Genbank рег. № NP_001774.1);
(29) CXCR5 (рецептор 1 лимфомы Беркитта, рецептор, связанный с G-белком и активируемый хемокином CXCL13, обеспечивает миграцию лимфоцитов и гуморальную защиту, а также играет определенную роль в инфицировании вирусом ВИЧ-2 и, вероятно, в развитии СПИД'а, лимфомы, миеломы и лейкоза, Genbank рег. № NP_001707.1);
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Ia), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам, Genbank рег. № NP_002111.1);
(31) Р2Х5 (ионный канал -5, открываемый лигандом пуринергического рецептора Р2Х; ионный канал, открываемый внеклеточным АТР, может участвовать в синаптической передаче и в нейрогенезе, а его дефицит может играть определенную роль в патофизиологии идиопатической дисфункции мочевого пузыря, Genbank рег. № NP_002552.2);
(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2, Genbank рег. № NP_001773.1);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок, относящийся к семейству белков с богатыми лейцином повторами (LRR), типа I, который регулирует активацию и апоптоз В-клеток, и потеря функции этого белка ассоциируется с прогрессированием у пациентов системной красной волчанки, Genbank рег. № NP_005573.1);
(34) FCRH1 (Fc-рецептор-подобный белок 1, предполагаемый рецептор для Fc-домена иммуноглобулина, который содержит Ig-подобные домены типа С2 и домены ITAM и может играть определенную роль в дифференцировке В-лимфоцитов, Genbank рег. № NP_443170.1);
(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2, предполагаемый иммунорецептор, который, возможно, играет определенную роль в развитии В-клеток и в лимфомагенезе; причем в некоторых злокачественных В-клетках наблюдается нарушение регуляции гена посредством транслокации, Genbank рег. № NP_112571.1).
А представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y означает спейсерный компонент,
у равно 0, 1 или 2;
р составляет в пределах от 1 примерно до 20; и
D представляет собой лекарственное средство, выбранное из соединений формул DE и DF;
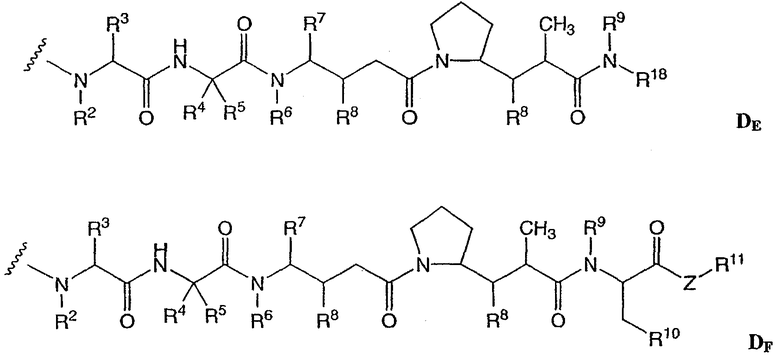
где: волнистая линия в формулах DE и DF означает сайт ковалентного связывания с А, W или Y и где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н и С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН, и
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла); и
n равно целому числу от 0 до 6.
В другом аспекте изобретения антитело в конъюгате “антитело-лекарственное средство” (ADC) согласно изобретению специфически связывается с рецептором, кодируемым геном ErbB2.
В другом аспекте изобретения антитело в конъюгате “антитело-лекарственное средство” представляет собой гуманизованное антитело, выбранное из huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (трастузумаб).
В другом своем аспекте настоящее изобретение относится к изделию, содержащему соединение в виде конъюгата “антитело-лекарственное средство” согласно изобретению; контейнер и вкладыш, вложенный в упаковку, или этикетку на упаковке, указывающие, что данное соединение может быть использовано для лечения раковой опухоли, характеризующейся сверхэкспрессией рецептора ErbB2.
В другом своем аспекте настоящее изобретение относится к способу лечения рака у млекопитающего, где указанный рак характеризуется сверхэкспрессией рецептора ErbB2 и не поддается или плохо поддается лечению анти-ErbB2 антителом и где указанный способ включает введение указанному млекопитающему терапевтически эффективного количества конъюгата “антитело-лекарственное средство” согласно изобретению.
В другом аспекте настоящего изобретения значительное количество указанной молекулы лекарственного средства не отщепляется от антитела до тех пор, пока указанное соединение-конъюгат “антитело-лекарственное средство” не проникнет в клетку, имеющую на своей поверхности рецептор, являющийся специфичным для данного антитела, присутствующего в указанном конъюгате “антитело-лекарственное средство”, и указанная молекула лекарственного средства отщепляется от указанного антитела лишь тогда, когда конъюгат “антитело-лекарственное средство” проникнет в указанную клетку.
В другом аспекте настоящего изобретения биодоступность соединения-конъюгата “антитело-лекарственное средство” или внутриклеточного метаболита указанного соединения в организме млекопитающего является лучше, чем биодоступность лекарственного соединения, содержащего молекулу лекарственного средства, присутствующего в соединении-конъюгате “антитело-лекарственное средство”, или лучше, чем биодоступность аналога соединения, не содержащего молекулу лекарственного средства.
В другом аспекте настоящего изобретения указанная молекула лекарственного средства представляет собой молекулу, которая в организме млекопитающего подвергается внутриклеточному отщеплению от антитела, являющегося компонентом данного соединения или внутриклеточного метаболита данного соединения.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество соединения-конъюгата “антитело-лекарственное средство” согласно изобретению или его фармацевтически приемлемой соли и фармацевтически приемлемый разбавитель, носитель или наполнитель. Указанная композиция может дополнительно содержать терапевтически эффективное количество химиотерапевтического агента, такого как тубулин-образующий ингибитор, ингибитор топоизомеразы и ДНК-связывающий агент.
В другом своем аспекте настоящее изобретение относится к способу лизиса или ингибирования пролиферации опухолевых или раковых клеток, включающему обработку опухолевых или раковых клеток определенным количеством соединения-конъюгата “антитело-лекарственное средство” согласно изобретению или его фармацевтически приемлемой соли или сольвата, которое является эффективным для лизиса или ингибирования пролиферации указанных опухолевых или раковых клеток.
В другом своем аспекте настоящее изобретение относится к способу ингибирования пролиферации клеток, включающему обработку клеток млекопитающего, присутствующих в среде для культивирования клеток, соединением-конъюгатом “антитело-лекарственное средство” согласно изобретению, где указанное соединение-конъюгат “антитело-лекарственное средство” проникает в клетку, а затем лекарственное средство отщепляется от указанного соединения-конъюгата “антитело-лекарственное средство”, в результате чего происходит ингибирование пролиферации клеток.
В другом своем аспекте настоящее изобретение относится к способу лечения рака, включающему введение пациенту композиции, содержащей соединение-конъюгат “антитело-лекарственное средство” и фармацевтически приемлемый разбавитель, носитель или наполнитель.
В другом своем аспекте настоящее изобретение относится к анализу для обнаружения раковых клеток, включающему:
(а) обработку клеток соединением-конъюгатом “антитело-лекарственное средство” согласно изобретению и
(b) определение степени связывания соединения-конъюгата “антитело-лекарственное средство” с указанными клетками.
Для лучшего понимания настоящего изобретения ниже приводится подробное описание примеров его осуществления, проиллюстрированного на прилагаемом графическом материале и схемах. Представленное ниже обсуждение носит лишь описательный, иллюстративный и репрезентативный характер и не должно рассматриваться как ограничение объема прилагаемой ниже формулы изобретения.
Краткое описание графического материала
На фиг.1 проиллюстрирован эффективный анализ in vivo, проводимый с помощью введения одной дозы сАС10-mcMMAF в подкожные ксенотрансплантаты ALCL Karpas-299.
На фиг.2 проиллюстрирован эффективный анализ in vivo, проводимый путем введения одной дозы сАС10-mcMMAF в подкожный L540cy. Это исследование проводили на 4 мышах группы, не подвергаемой обработке, и на 10 мышах в каждой группе обработки.
На фиг.3а и 3b проиллюстрирована in vivo эффективность cBR96-mcMMAF в подкожном L2987. Заштрихованные треугольники на фиг.3а и стрелки на фиг.3b указывают на дни проведения терапии.
На фиг.4а и 4b проиллюстрирована in vitro активность конъюгатов “антитело сАС10-лекарственное средство”, направленная против CD30+-клеточных линий.
На фиг.5а и 5b проиллюстрирована in vitro активность конъюгатов “антитело cBR96-лекарственное средство”, направленная против Ley+-клеточных линий.
На фиг.6а и 6b проиллюстрирована in vitro активность конъюгатов “антитело c1F6-лекарственное средство”, направленная против CD70+-клеточных линий карциномы почек.
На фиг.7 проиллюстрирован in vitro анализ на пролиферацию клеток с использованием клеток SK-BR-3, обработанных конъюгатами “антитело-лекарственное средство” (ADC): -●- трастузумаб-МС-vc-РАВ-MMAF, 3,8 MMAF/Ab, -o-трастузумаб-МС-MMAF, 4,1 MMAF/Ab, и -Δ-трастузумаб-МС-MMAF, 4,8 MMAF/Ab, измеренные в относительных единицах флуоресценции (RLU) по отношению к концентрации ADC (мкг/мл). Н=трастузумаб, где Н присоединен посредством цистеина [cys].
На фиг.8 проиллюстрирован in vitro анализ на пролиферацию клеток с использованием клеток ВТ-474, обработанных ADC: -●- трастузумаб-МС-vc-РАВ-MMAF, 3,8 MMAF/Ab, -o-трастузумаб-МС-MMAF, 4,1 MMAF/Ab, и -Δ- трастузумаб-МС-MMAF, 4,8 MMAF/Ab.
На фиг.9 проиллюстрирован in vitro анализ на пролиферацию клеток с использованием клеток MCF-7, обработанных ADC: -●- трастузумаб-МС-vc-РАВ-MMAF, 3,8 MMAF/Ab, -o-трастузумаб-МС-(N-Me)-vc-PAB-MMAF, 3,9 MMAF/Ab, и -Δ- трастузумаб-МС-MMAF, 4,1 MMAF/Ab.
На фиг.10 проиллюстрирован in vitro анализ на пролиферацию клеток с использованием клеток MDA-MB-468, обработанных ADC: -●- трастузумаб-МС-vc-РАВ-MMAE, 4,1 MMAE/Ab, -o- трастузумаб-МС-vc-РАВ-MMAE, 3,3 MMAE/Ab, и -Δ- трастузумаб-МС-vc-РАВ-MMAF, 3,7 MMAF/Ab.
На фиг.11 проиллюстрировано исследование по выведению концентраций из плазмы после введения Н-МС-vc-РАВ-MMAF-TEG и Н-МС-vc-РАВ-MMAF крысам Sprague-Dawley: вводимая доза составляла 2 мг ADC на кг массы тела крысы. Концентрации общего антитела и ADC измеряли в зависимости от времени (Н=трастузумаб).
На фиг.12 проиллюстрировано исследование по выведению концентраций из плазмы после введения Н-МС-vc-MMAE собакоподобным обезьянам в различных дозах: 0,5; 1,5; 2,5; 3,0 мг/кг в дни 1 и 21. Концентрации общего антитела и ADC измеряли в зависимости от времени (Н=трастузумаб).
На фиг.13 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER2 Fo5, которым на день 0 вводили: носитель, трастузумаб-МС-vc-РАВ-ММАЕ (1250 мкг/м2) и трастузумаб-МС-vc-РАВ-MMAF (555 мкг/м2) (Н=трастузумаб).
На фиг.14 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER2 Fo5, которым на день 0 вводили: 10 мг/кг (660 мкг/м2) трастузумаб-МС-ММАЕ и 1250 мкг/м2 трастузумаб-МС-vc-РАВ-ММАЕ.
На фиг.15 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER2 Fo5, которым на день 0 вводили: носитель и 650 мкг/м2 трастузумаб-МС-MMAF.
На фиг.16 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER2 Fo5, которым на день 0 вводили: носитель и 350 мкг/м2 четырех конъюгатов трастузумаб-МС-MMAF, где отношение MMAF/трастузумаб (Н) составляло 2, 4, 5,9 и 6.
На фиг.17 проиллюстрировано изменение средней массы тела, с величиной ошибки, для групп животных (крыс) (среднее ± ср. кв. от.) после введения носителя, трастузумаб-МС-val-cit-MMAF, трастузумаб-МС(Ме)-val-cit-РАВ-MMAF, трастузумаб-МС-MMAF и трастузумаб-МС-val-cit-РАВ-MMAF.
На фиг.18 проиллюстрировано изменение средней массы тела для групп животных (крыс) (среднее ± ср. кв. от.) после введения 9,94 мг/кг Н-МС-vc-MMAF, 24,90 мг/кг Н-МС-vc-MMAF, 10,69 мг/кг Н-МС(Ме)-vc-РАВ-MMAF, 26,78 мг/кг Н-МС(Ме)-vc-РАВ-MMAF, 10,17 мг/кг Н-МС-MMAF, 25,50 мг/кг Н-МС-MMAF и 21,85 мг/кг Н-МС-vc-РАВ-MMAF. Н=трастузумаб. В каждом конъюгате линкер МС связан посредством цистеина трастузумаба.
На фиг.19 проиллюстрировано изменение средней массы тела, с величиной ошибки, для групп крыс Sprague-Dawley (среднее ± ср. кв. от.) после введения трастузумаб(Н)-МС-MMAF в дозах 2105, 3158 и 4210 мкг/м2. В каждом конъюгате линкер МС связан посредством цистеина трастузумаба.
4. Подробное описание репрезентативных вариантов осуществления изобретения
4.1. Определения и сокращения
Если это не оговорено особо, то используемые здесь термины и выражения имеют следующие значения.
Используемый заявителями термин “торговые знаки” независимо означает защищенный торговым знаком готовый продукт, непатентованное лекарственное средство и активный(е) ингредиент(ы) продукта, защищенный(ые) торговым знаком.
Используемый здесь термин “антитело” применяется в самом широком смысле, а в частности охватывает интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные, по меньшей мере, из двух интактных антител, и фрагменты антител, при условии, что они обладают нужной биологической активностью. Антитело представляет собой белок, который генерируется иммунной системой и который способен распознавать специфический антиген и связывается с этим антигеном. Что касается структуры антитела, то оно обычно представляет собой Y-образный белок, состоящий из четырех аминокислотных цепей, двух тяжелых и двух легких цепей. Каждое антитело имеет, главным образом, две области: вариабельную область и константную область. Вариабельная область, расположенная на концах ветвей Y, связывается и взаимодействует с антигеном-мишенью. Эта вариабельная область включает гипервариабельную область (комплементарность-определяющую область, CDR), которая распознает специфический сайт связывания на конкретном антигене и связывается с ним. Константная область, расположенная на “хвосте” Y, распознается иммунной системой и взаимодействует с этой иммунной системой (Janeway C. Travers, P., Walport M. Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Антиген-мишень обычно имеет множество сайтов связывания, так называемых эпитопов, распознаваемых CDR на множестве антител. Каждое антитело, которое специфически связывается с другим эпитопом, имеет структуру, отличающуюся от структуры другого антитела. Таким образом, один антиген может иметь более чем одно соответствующее ему антитело.
Используемый здесь термин “антитело” также означает полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, то есть молекулы, содержащей антигенсвязывающий сайт, который иммуноспецифически связывается с антигеном представляющей интерес мишени или ее части, где указанными мишенями являются, но не ограничиваются ими, раковые клетки или клетки, которые продуцируют аутоиммунные антитела, ассоциированные с аутоиммунным заболеванием. Описанными здесь иммуноглобулинами могут быть молекулы иммуноглобулина любого типа (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса. Иммуноглобулины могут происходить от молекул любых видов. Однако в одном из аспектов изобретения иммуноглобулином является человеческий, мышиный или кроличий иммуноглобулин. В другом аспекте изобретения указанными антителами являются поликлональные, моноклональные, биспецифические, человеческие, гуманизованные или химерные антитела, одноцепочечные антитела, Fv-, Fab-, F(ab')-, F(ab')2-фрагменты, фрагменты, продуцируемые библиотекой экспрессируемых Fab-фрагментов, антиидиотипические (анти-Id) антитела, CDR и эпитоп-связывающие фрагменты любого из вышеперечисленных антител, которые иммуноспецифически связываются с антигенами раковых клеток, вирусными антигенами или микробными антигенами.
Используемый здесь термин “моноклональное антитело” означает антитело, полученное от популяции, в основном, гомогенных антител, то есть отдельных антител, входящих в данную популяцию и являющихся идентичными за исключением возможных природных мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются в высокой степени специфическими и направлены против одной антигенной детерминанты. Кроме того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо своей специфичности, моноклональные антитела обладают тем преимуществом, что они могут быть синтезированы так, чтобы они не содержали примесей других антител. Термин “моноклональный” указывает на тип антитела, полученного, по существу, от гомогенной популяции антител, но этот термин не означает, что данное антитело должно быть продуцировано каким-либо конкретным методом. Так, например, моноклональные антитела согласно изобретению могут быть получены с помощью гибридомной технологии, впервые описанной Kohler et al. (1975) Nature 256:495, или методами рекомбинантных ДНК (см. патент США № 4816567). “Моноклональные антитела” могут быть также выделены из фаговых библиотек антител методами, описанными, например, Clackson et al. (1991) Nature 352:624-628 и Marks et al. (1991) J. Mol. Biol. 222:581-597.
Используемые здесь моноклональные антитела включают, в частности, “химерные” антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу антител, а остальная(ые) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, происходящих от другого вида или принадлежащих к другому классу или подклассу антител, а также включают фрагменты таких антител, при условии, что они обладают нужной биологической активностью (патент США № 4816567 и Morrison et al. (1984) Proc. Natl. Acad. Sci., USA, 81:6851-6855).
Для продуцирования моноклональных антител (MAb) были применены различные методы. В гибридомной технологии, применяемой к клонированным клеточным линиям, которые продуцируют антитело одного типа, используются клетки различных видов, включая мышей, хомячков, крыс и человека. Другой метод получения MAb предусматривает применение техники генной инженерии, включая методы рекомбинантных ДНК. Моноклональными антителами, полученными такими методами, являются, среди прочих, химерные антитела и гуманизованные антитела. Химерное антитело объединяет области, кодируемые ДНК и происходящие от более чем одного вида. Так, например, химерное антитело может происходить от вариабельной области мышиного антитела и константной области человеческого антитела. Гуманизованное антитело происходит преимущественно от человеческого антитела, даже если оно содержит области не-человеческого антитела. Подобно химерному антителу, гуманизованное антитело может содержать полностью человеческую константную область. Однако, в отличие от химерного антитела, его вариабельная область может частично происходить от человеческого антитела. Не-человеческие синтетические части гуманизованного антитела часто происходят от CDR мышиных антител. В любом случае эти области играют решающую роль в распознавании антителом специфического антигена и в его связывании с этим антигеном.
Как уже отмечалось, могут быть использованы мышиные антитела. Хотя мышиные антитела могут быть использованы в диагностике и в непродолжительных курсах терапии, однако их введение человеку в течение длительного периода времени приводит к увеличению риска продуцирования у человека нежелательного иммуногенного ответа. Таким ответом является вырабатывание человеческого антимышиного антитела (НАМА), которое продуцируется в том случае, когда человеческая иммунная система распознает мышиное антитело как чужеродное и атакует его. НАМА-ответ может вызывать токсический шок или даже приводить к смерти.
Химерные и гуманизованные антитела позволяют снижать вероятность НАМА-ответа путем минимизации не-человеческих частей введенных антител. Кроме того, химерные и гуманизованные антитела имеют то преимущество, что они активируют вторичные иммунные ответы у человека, такие как антитело-зависимая клеточная цитотоксичность.
“Фрагменты антител” содержат часть интактного антитела, а предпочтительно его антигенсвязывающую или вариабельную область. Примерами фрагментов антител являются Fab-, Fab'-, F(ab')2 и Fv-фрагменты; диатела; линейные антитела; одноцепочечные молекулы антител и мультиспецифические антитела, происходящие от фрагмента(ов) антитела.
“Интактное” антитело представляет собой антитело, содержащее антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, СН1, СН2 и СН3. Константные домены могут представлять собой константные домены нативной последовательности (например, константные домены человеческой нативной последовательности) или их варианты аминокислотных последовательностей.
Интактное антитело может иметь одно или несколько “эффекторных” функций”, которые означают биологические активности, приписываемые Fc-области (Fc-области нативной последовательности или Fc-области варианта аминокислотной последовательности) антитела. Примерами эффекторных функций антител являются связывание с C1q; комплемент-зависимая цитотоксичность; связывание с Fc-рецептором; антитело-зависимая клеточно-опосредуемая цитотоксичность (ADCC); фагоцитоз; ингибирование рецепторов клеточной поверхности (например, В-клеточного рецептора; BCR) и т.п.
Интактные антитела, в зависимости от аминокислотной последовательности константного домена их тяжелых цепей, могут быть отнесены к различным “классам”. Существует пять главных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из этих классов могут быть подразделены на “подклассы” (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, называются α, δ, ε, γ и µ соответственно. Структуры субъединиц и трехмерные конфигурации иммуноглобулинов различных классов хорошо известны.
Используемые здесь термины “ErbB2” и “HER2” являются взаимозаменяемыми и означают человеческий белок HER2, описанный, например, Semba et al. Proc. Natl. Acad. Sci., USA, 82:6497-6501 (1985) и Yamamoto et al. (1986) Nature, 319:230-234 (Genbank рег. № Х03363). Термин “erbB2” означает ген, кодирующий человеческий ErbB2, а “neu” означает ген, кодирующий крысиный p185neu. Предпочтительным ErbB2 является человеческий ErbB2 с нативной последовательностью.
Антитела против рецепторов ErbB являются коммерчески доступными и могут быть получены из различных источников, включая, например, Santa Cruz Biotechnology, Inc., California, USA.
“Лиганд ErbB” означает полипептид, который связывается с рецептором ErbB и/или активирует этот рецептор. Лигандом ErbB может быть человеческий лиганд ErbB, имеющий нативную последовательность, такой как эпидермальный фактор роста (EGF) (Savage et al. (1972) J. Biol. Chem. 247:7612-7621); трансформирующий фактор роста-альфа (TGF-α) (Marquardt et al. (1984) Science 223:1079-1082); амфирегулин, также известный как шванома или аутокринный фактор роста кератиноцитов (Shoyab et al. (1989) Science 243:1074-1076; Kimura et al. Nature, 348:257-260 (1990) и Cook et al. Mol. Cell. Biol. 11:2547-2557 (1991)); бетацеллюлин (Shing et al. Science, 259:1604-1607 (1993) & Sasada et al., Biochem. Biophys. Res. Commun., 190:1173 (1993)); гепарин-связывающий эпидермальный фактор роста (HB-EGF) (Higashiyama et al., Science, 251:936-939 (1991)); эпирегулин (Toyoda et al., J. Biol. Chem. 270:7495-7500 (1995) & Komurasaki et al. Oncogene, 15:2841-2848 (1997)); герегулин (см. ниже); нейрегулин-2 (NRG-2) (Caraway et al. Nature 387:512-516 (1997)); нейрегулин-3 (NRG-3) (Zhang et al., Proc. Natl. Acad. Sci., 94:9562-9567 (1997)); нейрегулин-4 (NRG-4) (Harari et al., Oncogene 18:2681-89 (1999)) или крипто (CR-1) (Kannan et al., J. Biol. Chem. 272(6):3330-3335 (1997)). Лигандами ErbB, которые связываются с EGFR, являются EGF, TGF-α, амфирегулин, бетацеллюлин, HB-EGF и эпирегулин. Лигандами ErbB, которые связываются с ErbB3, являются герегулины. Лигандами ErbB, способными связываться с ErbB4, являются бетацеллюлин, эпирегулин, HB-EGF, NRG-2, NRG-3, NRG-4 и герегулины. Лигандом ErbB может быть также синтетический лиганд ErbB. Такой синтетический лиганд может быть специфичным к конкретному рецептору ErbB, либо он может распознавать конкретные комплексы рецепторов ErbB. Примером синтетического лиганда является синтетический герегулин/химера “EGF-бирегулин” (см., например, работу Jones et al. (1999) FEBS Letters, 447:227-231, которая вводится в настоящее описание посредством ссылки).
“Герегулин” (HRG) означает полипептид, кодируемый продуктом гена герегулина, описанного в патенте США № 5641869 или Marchionni et al., Nature, 362:312-318 (1993). Примерами герегулинов являются герегулин-α, герегулин-β1, герегулин-β2 и герегулин-β3 (Holmes et al. Science, 256:1205-1210 (1992) и патент США № 5641869); фактор дифференцировки neu (NDF) (Peles et al. Cell 69:205-216 (1992)); фактор, индуцирующий рецептор ацетилхолина (ARIA) (Falls et al. (1993) Cell 72:801-815); факторы роста глиальных клеток (GGF) (Marchionni et al., Nature 362:312-318 (1993)); фактор, происходящий от афферентных и мотонейронов (SMDF) (Ho et al., J. Biol. Chem. 270:14523-14532 (1995)); γ-герегулин (Shaefer et al., Oncogene, 15:1385-1394 (1997)). Указанный термин включает биологически активные фрагменты и/или варианты аминокислотных последовательностей нативного полипептида HRG, такие как фрагмент EGF-подобного домена (например, HRGβ1177-244).
“Гетероолигомер ErbB” представляет собой нековалентно связанный олигомер, включающий, по крайней мере, два различных рецептора ErbB. “Димер ErbB” представляет собой нековалентно связанный олигомер, включающий, по крайней мере, два различных рецептора ErbB. Такие комплексы могут образовываться в том случае, если клетка, экспрессирующая два или более рецепторов ErbB, подвергается воздействию лиганда ErbB. Олигомеры ErbB, такие как димеры ErbB, могут быть выделены путем иммунопреципитации и проанализированы с помощью электрофореза в ПААГ с ДСН, как описано, например, у Sliwkowski et al. J. Biol. Chem., 269(20):14661-14665 (1994). Примерами таких гетероолигомеров ErbB являются комплексы EGFR-ErbB2 (называемые также HER1/HER2), ErbB2-ErbB3 (HER2/HER3) и ErbB3-ErbB4 (HER3/HER4). Кроме того, гетероолигомер ErbB может содержать два или более рецепторов ErbB2, объединенных с другими рецепторами ErbB, такими как ErbB3, ErbB4 или EGFR (ErbB1). В состав такого гетероолигомера могут входить и другие белки, такие как субъединица рецептора цитокинов (например, gp130).
Полипептид с “нативной последовательностью” представляет собой полипептид, который имеет такую же аминокислотную последовательность, как и полипептид, например, природный рецептор опухолеассоциированного антигена. Такие полипептиды с нативной последовательностью могут быть выделены из природных источников, либо они могут быть получены рекомбинантными методами или методами синтеза. Так, например, полипептид с нативной последовательностью может иметь аминокислотную последовательность природного человеческого полипептида, мышиного полипептида или полипептида, происходящего от млекопитающих любого другого вида.
Термин “вариант аминокислотной последовательности” означает полипептиды, имеющие аминокислотные последовательности, которые до некоторой степени отличаются от нативных полипептидных последовательностей. Обычно варианты аминокислотных последовательностей, по меньшей мере, примерно на 70% гомологичны, по меньшей мере, одному связывающемуся с рецептором домену нативного лиганда или, по меньшей мере, одному связывающемуся с лигандом домену нативного рецептора, такому как опухолеассоциированный антиген, а предпочтительно они могут быть, по меньшей мере, примерно на 80%, а более предпочтительно, по меньшей мере, примерно на 90%, гомологичны доменам, связывающимся с таким рецептором или с лигандом. Варианты аминокислотных последовательностей имеют замены, делеции и/или инсерции в некоторых положениях нативной аминокислотной последовательности.
“Идентичность последовательности” определяется как процент остатков в варианте аминокислотной последовательности, которые являются идентичными после выравнивания последовательностей и включения в них пробелов, если это необходимо для достижения максимального процента идентичности последовательностей. Методы и компьютерные программы для такого выравнивания хорошо известны специалистам. Одной из таких компьютерных программ является “Align 2”, разработанная Genentech, Inc. и поданная вместе с документацией для пользователя в Ведомство по охране авторского права, Вашингтон, DC 20559, 10 декабря 1991.
“Антитело-зависимая клеточная цитотоксичность” и “ADCC” означает клеточно-опосредуемую реакцию, при которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcRs) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связанное антитело на клетке-мишени, что приводит к лизису данной клетки-мишени. Первичные клетки, опосредующие ADCC, то есть NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные экспрессии FcR на гемопоэтических клетках систематизированы в таблице 3 на странице 464 Ravetch & Kinet (1991) Annu. Rev. Immunol. 9:457-92. Для оценки ADCC-активности представляющей интерес молекулы может быть проведен анализ на ADCC in vitro, такой как анализ, описанный в патентах США № 5500362 или 5821337. Подходящими эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, на мышиной модели, такой как модель, описанная Clynes et al., Proc. Natl. Acad. Sci., USA, 95:652-656 (1998).
Термины “Fc-рецептор” или “FcR” используются для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является человеческий FcR с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывается с антителом IgG (гамма-рецептор), и рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторами FcγRII являются FcγRIIA (“активирующий рецептор”) и FcγRIIB (“ингибирующий рецептор”), которые имеют аналогичные аминокислотные последовательности, отличающиеся, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене активирующий мотив иммунорецептора на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене ингибирующий мотив иммунорецептора на основе тирозина (ITIM) (см. обзор М. Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR описаны у Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994) и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Используемый здесь термин “FcR” также охватывает и другие FcR, включая FcR, которые будут идентифицированы в будущем. Этот термин также включает рецептор, имеющийся у новорожденных, FcRn, который является ответственным за передачу материнских IgG плоду (Guyer et al., J. Immunol., 117:587 (1976) и Kim et al., J. Immunol., 24:249 (1994)).
“Комплемент-зависимая цитотоксичность” или “CDC” означает способность молекулы подвергать лизису мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, с антителом), образующей комплекс с когнатным антигеном. Для оценки активации комплемента может быть проведен анализ на CDC, например, как описано Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996).
Термин “вариабельный” относится к некоторым частям вариабельных доменов, которые имеют значительные отличия в последовательностях различных антител и участвуют в связывании каждого конкретного антитела с его конкретным антигеном, а также определяют специфичность каждого конкретного антитела по отношению к его конкретному антигену. Однако вариабельность неравномерно распределяется по всем вариабельным доменам антител. Она концентрируется в трех сегментах, называемых гипервариабельными областями, присутствующими в вариабельных доменах как легкой, так и тяжелой цепи. Наиболее высококонсервативные части вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен нативной тяжелой и легкой цепей содержит четыре FR, имеющие, главным образом, β-складчатую конфигурацию и соединенные тремя гипервариабельными областями, которые образуют петли, соединяющие, а в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются в непосредственной близости друг от друга посредством FR и, вместе с гипервариабельными областями другой цепи, участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC).
Используемый здесь термин “гипервариабельная область” означает аминокислотные остатки антитела, которые являются ответственными за связывание с антигеном. Такая гипервариабельная область обычно содержит аминокислотные остатки, происходящие от “гипервариабельной области” или “CDR” (комплементарность-определяющей области) (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al., см. выше), и/или остатки, происходящие от “гипервариабельной петли” (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia & Lesk (1987) J. Mol. Biol., 196:901-917). Остатки “каркасной области” или “FR” представляют собой остатки вариабельного домена, не являющиеся остатками определенной здесь гипервариабельной области.
В результате гидролиза антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых “Fab”-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и один оставшийся “Fc”-фрагмент, название которого указывает на его способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта и способен к перекрестному связыванию с антигеном.
“Fv” представляет собой минимальный фрагмент антитела, содержащий полноразмерный антиген-распознающий сайт и антигенсвязывающий сайт. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, жестко связанных друг с другом нековалентной связью. Эта область имеет такую конфигурацию, при которой три гипервариабельные области каждого вариабельного домена взаимодействуют друг с другом таким образом, что образуют антигенсвязывающий сайт на поверхности димера VH-VL. В целом, шесть гипервариабельных областей сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные к антигену) обладает способностью распознавать антиген и связываться с ним, хотя и с меньшей аффинностью, чем весь сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов тем, что они имеют несколько дополнительных остатков у карбокси-конца СН1-домена тяжелой цепи, включая один или несколько цистеинов, происходящих от шарнирной области антитела. Используемое здесь обозначение Fab'-SH означает Fab', в котором цистеиновый(е) остаток(ки) константных доменов имеет(ют), по меньшей мере, одну свободную тиоловую группу. F(ab')2-фрагменты антитела по своей природе продуцируются как пары Fab'-фрагментов, между которыми расположены цистеины шарнирной области. Также известны и другие химические связи, соединяющие фрагменты антитела.
“Легкие цепи” антител, происходящих от позвоночных любого вида, могут быть отнесены к одному из двух различных типов цепей, называемых каппа (k) и лямбда (λ), исходя из аминокислотных последовательностей их константных доменов.
“Одноцепочечный Fv-фрагмент” или “scFv-фрагмент” антител включает домены VH и VL антитела, где указанные домены присутствуют в одной полипептидной цепи. Предпочтительно, полипептид Fv, кроме того, содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование scFv со структурой, необходимой для связывания с антигеном. Описание scFv можно найти у Plückthun в работе The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg & Moore eds., Springer-Verlag, New York, p.269-315 (1994).
Термин “диатела” означает небольшие фрагменты антител с двумя антигенсвязывающими сайтами, где указанные фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной той же полипептидной цепи (VH-VL). Если линкер является слишком коротким для образования пары между двумя доменами на одной и той же цепи, то домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта. Диатела более подробно описаны, например, в ЕР 404097; в WO 93/11161 и у Hollinger et al. (1993) Proc. Natl. Acad. Sci., USA, 90:6444-6448.
“Гуманизованные формы” не-человеческих антител (например, антител грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую от не-человеческого иммуноглобулина. По большей части гуманизованные антитела представляют собой человеческие иммуноглобулины (антитело реципиента), в которых остатки, происходящие от гипервариабельной области данного антитела-реципиента, заменены остатками, происходящими от гипервариабельной области не-человеческого антитела (донорного антитела), такого как мышиное антитело, крысиное антитело, кроличье антитело или антитело приматов, не являющихся человеком, где указанные антитела обладают нужной специфичностью, аффинностью и связывающей способностью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина заменены соответствующими не-человеческими остатками. Кроме того, гуманизованные антитела могут содержать остатки, не обнаруженные в антителе реципиента или в антителе донора. Эти модификации вводят для улучшения свойств антитела. В общих чертах гуманизованное антитело может содержать, в основном, все или, по меньшей мере, один, а обычно два вариабельных домена, в которых все или почти все гипервариабельные петли соответствуют гипервариабельным петлям не-человеческого иммуноглобулина и все или почти все FR представляют собой FR с человеческой иммуноглобулиновой последовательностью. Гуманизованное антитело также содержит, но необязательно, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно области человеческого иммуноглобулина. Более подробное описание см. у Jones et al. (1986) Nature, 321:522-525; Riechmann et al. (1998) Nature 332:323-329 и у Presta (1992) Curr. Op. Struct. Biol., 2:593-596.
Гуманизованными анти-ErbB2 антителами являются huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (HERCEPTIN®), описанные в Таблице 3 патента США № 5821337, который полностью вводится в настоящее описание посредством ссылки; и гуманизованные антитела 520С9 (WO 93/21319) и 2С4, описанные ниже.
“Выделенное” антитело представляет собой антитело, которое было идентифицировано и выделено и/или очищено от компонентов его природного окружения. Загрязняющими компонентами его природного окружения являются материалы, негативно влияющие на диагностическую или терапевтическую эффективность антитела, и такими компонентами могут быть ферменты, гормоны и другие белковые или не-белковые растворенные вещества. В предпочтительных вариантах изобретения указанное антитело может быть очищено (1) на более чем 95% по массе антитела, как может быть определено методом Лаури, а более предпочтительно более чем на 99% по массе антитела, (2) до степени, достаточной для введения, по меньшей мере, 15 остатков у N-концевой или внутренней части аминокислотной последовательности, с использованием секвенатора, снабженного центрифужным сосудом, или (3) до гомогенности с помощью электрофореза в ДСН-ПААГ в восстанавливающих или невосстанавливающих условиях с окрашиванием кумасси синим или предпочтительно серебром. Термин “выделенное антитело” включает антитело in situ в рекомбинантных клетках, если отсутствует, по меньшей мере, один природный компонент этого антитела. Однако обычно выделенное антитело может быть получено, по меньшей мере, в одной стадии очистки.
Антитело, которое “связывается” с представляющим интерес антигеном, способно связываться с указанным антигеном с аффинностью, которая является достаточной для того, чтобы это антитело могло быть использовано в целях доставки в клетку, экспрессирующую этот антиген.
Антитело, которое “индуцирует апоптоз”, представляет собой антитело, которое индуцирует запрограммированную клеточную гибель, как было определено по связыванию с аннексином V, фрагментации ДНК, сморщиванию клеток, расширению эндоплазматического ретикулума, фрагментации клеток и/или по образованию мембранных везикул (называемых апоптотическими тельцами). Такой клеткой является опухолевая клетка, например клетка молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почек, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. Для оценки клеточных событий, ассоциированных с апоптозом, существуют различные методы. Так, например, транслокация фосфатидилсерина (PS) может быть определена по связыванию с аннексином; фрагментация ДНК может быть оценена по образованию ДНК-лэддера; а конденсация ядра/хроматина вместе с фрагментацией ДНК может быть оценена по любому увеличению гиподиплоидных клеток.
Термин “нарушение или расстройство” означает любое состояние, симптомы которого могут быть ослаблены в результате лечения согласно изобретению. Такими расстройствами или нарушениями являются хронические и острые расстройства или заболевания, включая патологические состояния, которые могут приводить к развитию у млекопитающего рассматриваемого расстройства или нарушения. Неограничивающими примерами расстройств, подвергаемых лечению в соответствии с настоящим изобретением, являются доброкачественные и злокачественные опухоли; лейкозы и лимфоидные злокачественные опухоли, а в частности рак молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почек, толстой кишки, щитовидной железы, поджелудочной железы, предстательной железы или мочевого пузыря; нарушения, связанные с поражением нервных клеток, глиальных клеток, астроцитов, гипоталамических клеток и других железистых клеток, макрофагов, эпителиальных клеток, стромальных клеток и бластоцелиальных клеток, и воспалительные, ангиогенные и иммунологические расстройства или нарушения.
Термин “терапевтически эффективное количество” означает количество лекарственного средства, эффективное для лечения заболевания или расстройства у млекопитающего. В случае рака такое терапевтически эффективное количество лекарственного средства может снижать число раковых клеток и размер опухолевых клеток; ингибировать (то есть замедлять до некоторой степени, а предпочтительно прекращать) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть замедлять до некоторой степени, а предпочтительно прекращать) развитие метастазов опухоли; ингибировать, до некоторой степени, рост опухоли; и/или ослаблять, до некоторой степени, один или несколько симптомов, ассоциированных с раком. Лекарственное средство, до некоторой степени, может предотвращать рост раковых клеток и/или уничтожать раковые клетки, и оно может быть цитостатическим и/или цитотоксическим. Эффективность противораковой терапии может быть оценена, например, путем определения времени до начала прогрессирования заболевания (ТТР) и/или определения скорости ответа (RR).
Термин “значительное количество” означает большую часть, то есть >50% от всей популяции, всего сбора или всего образца.
Термин “внутриклеточный метаболит” означает соединение, образующееся в результате внутриклеточных метаболических процессов или реакций, которым подвергается конъюгат “антитело-лекарственное средство” (ADC). Такими метаболическими процессами или реакциями могут быть ферментативная реакция, такая как протеолитическое расщепление пептидного линкера ADC или гидролиз функциональной группы, такой как гидразоновая группа, сложноэфирная группа или амидная группа. Внутриклеточными метаболитами являются, но не ограничиваются ими, антитела и свободные лекарственные средства, которые подвергаются внутриклеточному расщеплению после доставки в клетку, диффузии в клетке, поглощения клеткой или транспорта в клетку.
Термины “расщепленный внутри клетки” и “внутриклеточное расщепление” относятся к внутриклеточному метаболическому процессу или реакции, которым подвергается конъюгат “лекарственное средство-лиганд”, конъюгат “лекарственное средство-линкер-лиганд”, конъюгат “антитело-лекарственное средство” (ADC) или т.п., в результате чего ковалентная связь, например линкер, между компонентом “лекарственное средство” (D) и антителом (Ab) расщепляется, что приводит к отщеплению свободного лекарственного средства от антитела внутри клетки. Таким образом, молекулы, отщепленные от конъюгата “лекарственное средство-лиганд”, конъюгата “лекарственное средство-линкер-лиганд” или ADC, являются внутриклеточными метаболитами.
Термин “биодоступность” означает системную биодоступность (то есть уровни в крови/плазме) для данного количества лекарственного средства, вводимого пациенту. “Биодоступность” является абсолютным термином, который определяет такие параметры, как время действия (скорость) и общее количество (уровень) лекарственного средства, которое высвобождается из введенной лекарственной формы и поступает в общий кровоток.
Термин “цитотоксическая активность” означает цитолитический, цитостатический или антипролиферативный эффект соединения типа конъюгата “антитело-лекарственное средство” или его внутриклеточного метаболита. Цитотоксическая активность может быть выражена как величина IC50, которая представляет собой концентрацию (молярную или массовую) на единицу объема, при которой выживает половина клеток.
Термины “рак” и “раковый” означают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нарушением регуляции клеточного роста. Термин “опухоль” включает одну или несколько раковых клеток. Примерами рака являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз или лимфоидные злокачественные опухоли. Более конкретными примерами таких раковых опухолей являются плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, не-мелкоклеточный рак легких (“НМКРЛ”), аденокарциному легких и плоскоклеточную карциному легких, рак брюшной полости, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной кишки, карцинома эндометрия или матки, карцинома слюнной железы, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарцинома, карцинома заднего прохода, карцинома пениса, а также рак головы и шеи.
“Раковая опухоль, экспрессирующая ErbB2” представляет собой опухоль, на поверхности клеток которой продуцируются определенные уровни ErbB2, достаточные для того, чтобы анти-ErbB2 антитело могло связываться с ErbB2 и оказывало терапевтическое противораковое действие.
Рак, “характеризующийся избыточной активацией” рецептора ErbB2, представляет собой рак, при котором степень активации рецептора ErbB2 в раковых клетках значительно превышает степень активации такого рецептора в не-раковых клетках ткани того же самого типа. Такая избыточная активация может быть результатом сверхэкспрессии ErbB2 рецептора и/или присутствия уровней, превышающих нормальный уровень, лиганда ErbB2, доступного для активации ErbB2-рецептора в раковых клетках. Такая избыточная активация может приводить к появлению злокачественных раковых клеток и/или может быть вызвана раковыми клетками. В некоторых вариантах изобретения может быть проведен диагностический или прогностический анализ рака для того, чтобы определить, происходит ли амплификация и/или сверхэкспрессия ErbB2-рецептора, приводящая к такой избыточной активации ErbB2-рецептора. Альтернативно или дополнительно может быть проведен диагностический или прогностический анализ рака для того, чтобы определить, происходит ли амплификация и/или сверхэкспрессия лиганда ErbB2 в раковой опухоли, которая вызывает избыточную активацию данного рецептора. В субпопуляции таких раковых опухолей избыточная активация данного рецептора может быть обусловлена аутокринным механизмом стимуляции.
Раковая опухоль, “сверхэкспрессирующая” ErbB2-рецептор, представляет собой раковую опухоль, которая, на поверхности своих клеток, имеет значительно более высокие уровни ErbB2-рецептора по сравнению с не-раковыми клетками ткани того же типа. Такая сверхэкспрессия может быть обусловлена амплификацией или повышенной транскрипцией или трансляцией гена. Сверхэкспрессия ErbB2-рецептора может быть определена в диагностическом или прогностическом анализе путем детекции повышенных уровней белка ErbB2, присутствующего на поверхности клетки (например, с помощью иммуногистохимического анализа; ИГХ). Альтернативно или дополнительно могут быть измерены уровни ErbB2-кодирующей нуклеиновой кислоты в клетке, например, путем флуоресцентной гибридизации in situ (FISH; см. WO 98/45479), саузерн-блоттинга или полимеразной цепной реакции (ПЦР), такой как количественная ПЦР в реальном времени (RT-PCR). Сверхэкспрессия лиганда ErbB2 может быть определена в диагностическом анализе путем измерения уровней лиганда (или нуклеиновой кислоты, кодирующей этот лиганд) у пациента, например, путем биопсии опухоли или с помощью различных диагностических анализов, таких как ИГХ, FISH, саузерн-блоттинг, ПЦР или in vivo анализы, описанные выше. Могут быть также проведены исследования на сверхэкспрессию ErbB2-рецептора путем измерения уровня “слущивающегося” антигена (например, внеклеточного домена ErbB2) в биологической жидкости, такой как сыворотка (см., например, патент США № 4933294; WO 91/05264; патент США № 5401638 и Sias et al. (1990) J. Immunol. Methods, 132:73-80). Помимо вышеуказанных анализов, специалистам-практикам известны и различные другие анализы in vivo. Так, например, клетки в организме пациента могут быть обработаны антителом, которое необязательно помечено детектируемой меткой, например радиоактивным изотопом, а связывание антитела с клетками пациента может быть оценено, например, путем внешнего сканирования на радиоактивность или путем анализа биоптата, взятого у пациента, предварительно обработанного антителом.
Опухоли, сверхэкспрессирующие HER2, оценивают по иммуногистохимической шкале, соответствующей числу копий экспрессируемых молекул HER2 на клетку, и такая оценка может быть проведена с помощью биохимического анализа, где баллы этой шкалы означают: 0=0-10000 копий/клетку; 1+=по меньшей мере, примерно 200000 копий/клетку; 2+=по меньшей мере, примерно 500000 копий/клетку; 3+=примерно 1-2 х 106 копий/клетку. Сверхэкспрессия HER2 на уровне 3+, которая приводит к лиганд-независимой активации тирозинкиназы (Hudziak et al. (1987) Proc. Natl. Acad. Sci., USA, 84:7159-7163), наблюдается приблизительно у 30% пациентов с раком молочной железы, и у этих пациентов наблюдается снижение продолжительности безрецидивного периода и продолжительности жизни в целом (Slamon et al. (1989) Science, 244:707-712; Slamon et al. (1987) Science, 235:177-182).
И наоборот, рак, который “не характеризуется сверхэкспрессией ErbB2-рецептора”, определяется как рак, при котором согласно диагностическому анализу не экспрессируются уровни ErbB2-рецептора, превышающие нормальные уровни этого рецептора, по сравнению с не-раковыми клетками ткани того же типа.
Используемый здесь термин “цитотоксический агент” означает вещество, которое ингибирует или предотвращает функционирование клеток и/или вызывает деструкцию клеток. Этот термин включает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32Р, 60C и радиоактивные изотопы Lu), химиотерапевтические агенты и токсины, такие как небольшие молекулы токсинов или ферментативно активные токсины, происходящие от бактерий, грибов, растений или животных, включая их синтетические аналоги и производные. В одном из аспектов изобретения этот термин не включает радиоактивные изотопы.
“Химиотерапевтический агент” представляет собой химическое соединение, которое может быть использовано для лечения рака. Примерами химиотерапевтических агентов являются алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкисульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; TLK 286 (TELCYTATM); ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его адозелизиновые, карзелизиновые и бизелезиновые синтетические аналоги); подофилотоксин; подофилиновая кислота; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая его синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, экстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; бифосфонаты, такие как клодронат; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, а в частности калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)) и антрациклины, такие как аннамицин, AD 32, алькарубицин, даунорубицин, дексразоксан, DX-52-1, эпирубицин, GPX-100, идарубицин, KRN5500, меногарил, динемицин, включая динемицин А, эсперамицин, неокарзиностатиновый хромофор и родственные хромопротеиновые энедииновые антибиотики-хромофоры, аклациномизины, кактиномицин, аутрамицин, азасерин, блеомицины, актиномицины, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролино-доксорубицин, липосомный доксорубицин и дезоксидоксорубицин), эзорубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин и зорубицин; аналоги фолиевой кислоты, такие как деноптерин, птероптерин и треметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн и тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин и флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан и тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан и трилостан; средство, восполняющее недостаток фолиевой кислоты, такое как фолиновая кислота (лейковорин); ацеглатон; противоопухолевые антагонисты фолатов, такие как ALIMTA®, пеметрексед LY231514, ингибиторы дигидрофолат-редуктазы, такие как метотрексат, антиметаболиты, такие как 5-фторурацил (5-FU) и его пролекарства, такие как UFT, S-1 и капецитабин, ингибиторы тимидилат-синтазы, ингибиторы глицинамид-рибонуклеотид-формилтрансферазы, такие как ралтитрексед (TOMUDEXRM, TDX); ингибиторы дигидропиримидин-дегидрогеназы, такие как энилурацил; гликозид альдофосфамида; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дофофамин; демесольцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенаузоновая кислота; триазихон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепа; таксоиды и таксаны, например паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANETM, не содержащий кремофора препарат паклитаксела из наночастиц, полученный на основе альбумина (American Pharmaceutical Partners, Schaumberg, Illinois) и доксетаксел TAXOTERE® (Rhone-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; платина; аналоги платины или аналоги, полученные на основе платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин (VELBAN®); этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); винкаалкалоиды; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, оксиды или производные всех вышеуказанных соединений, а также комбинации двух или более вышеуказанных соединений, такие как СНОР, где данная аббревиатура означает комбинацию терапевтических средств, таких как циклофосфамид, доксорубицин, винкристин и преднизолон, и FOLFOX, где данная аббревиатура означает комбинацию терапевтических средств, таких как оксалиплатин (ELOXATINTM), 5-FU и лейковорин.
В объем данного термина входят также антигормональные средства, регулирующие или ингибирующие действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; ингибиторы ароматазы, которые ингибируют фермент ароматазу и регулируют продуцирование эстрогенов в коре надпочечника, такие как 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, эксеместан AROMASIN®, форместанин, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (нуклеозидный цитозиновый аналог 1,3-диоксолана); антисмысловые олигонуклеотиды, а в частности олигонуклеотиды, ингибирующие экспрессию генов путей передачи сигнала, участвующих в пролиферации нежелательных клеток, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; rIL-2 PROLEUKIN®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX® и фармацевтически приемлемые соли, кислоты или производные всех вышеперечисленных соединений.
Используемый здесь термин “EGFR-лекарственное средство” означает терапевтический агент, который связывается с EGFR и, необязательно, ингибирует активацию EGFR. Примерами таких агентов являются антитела и небольшие молекулы, которые связываются с EGFR. Примерами антител, которые связываются с EGFR, являются MAb 579 (АТСС CRL НВ 8506), MAb 455 (АТСС CRL НВ 8507), MAb 225 (АТСС CRL 8508), MAb 528 (АТСС CRL 8509) (см. патент США № 4943533, Mendelsohn et al.) и их варианты, такие как химерное антитело 225 (С225 или цетуксимаб; ERBITUX®) и реконструированное человеческое антитело 225 (Н225) (см. WO 96/40210, Imclone Systems Inc.); антитела, которые связываются с мутантным EGFR типа II (патент США № 5212290); гуманизованные и химерные антитела, которые связываются с EGFR, как описано в патенте США № 5891996; и человеческие антитела, которые связываются с EGFR, такие как ABX-EGF (см. WO 98/50433, Abgenix). Антитело против EGFR может быть конъюгировано с цитотоксическим агентом, образуя, тем самым, иммуноконъюгат (см., например, ЕР 659439А2, Merck Patent GmbH). Примерами небольших молекул, которые связываются с EGFR, являются ZD1839 или Gefitinib (IRESSATM, Astra Zeneca), эрлотиниб-HCl (CP-358774, TARCEVATM; Genentech/OSI) и AG1478, AG1571 (SU 5271; Sugen).
“Ингибитор тирозинкиназы” представляет собой молекулу, которая до определенной степени ингибирует тирозинкиназную активность тирозинкиназы, такую как рецептор ErbB2. Примерами таких ингибиторов являются “EGFR-лекарственные средства”, описанные в предыдущем абзаце, а также хиназолины, такие как PD 153035, 4-(3-хлоранилино)хиназолин, пиридопиримидины, пиримидопиримидины, пирролопиримидины, такие как CGP 59326, CGP 60261 и CGP 62706, и пиразолопиримидины, 4-(фениламино)-7Н-пирроло[2,3-d]пиримидины, куркумин (диферулоилметан, 4,5-бис(4-фторанилино)фталамид), тирфостины, содержащие нитротиофеновые группы; PD-0183805 (Warner-Lambert); антисмысловые молекулы (например, молекулы, которые связываются с ErbB-кодирующей нуклеиновой кислотой); хиноксалины (патент США № 5804396); трифостины (патент США № 5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); ингибиторы пэн-ErbB, такие как CI-1033 (Pfizer); Affinitac (ISIS 3521; Isis/Lilly); мезилат иматиниба (Gleevac; Novartis); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); Семаксаниб (Sugen); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone) или соединения, описанные в нижеследующих публикациях патентов и патентных заявок: в патенте США № 5804396; WO 99/09016 (American Cyanamid); WO 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc.); WO 96/33978 (Zeneca); WO 96/3397 (Zeneca) и WO 96/33980 (Zeneca).
Термин “антиангиогенный агент” означает соединение, которое блокирует развитие кровеносных сосудов или в некоторой степени препятствует такому развитию. Таким антиангиогенным фактором может быть, например, небольшая молекула или антитело, которые связываются с фактором роста или с рецептором фактора роста, участвующими в стимуляции ангиогенеза. В одном из вариантов изобретения указанным антиангиогенным фактором является антитело, которое связывается с васкулярным эндотелиальным фактором роста (VEGF).
Термин “цитокин” является общим термином, относящимся к белкам, которые высвобождаются одной клеточной популяцией и которые действуют на другие клетки как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и стандартные полипептидные гормоны. Помимо вышеуказанных определений, понятие “цитокины” также включает гормоны роста, такие как человеческий гормон роста, N-метионильный человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоид-стимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов, фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухоли-α и -β; мюллеровский ингибирующий фактор; пептид, ассоциированный с мышиным гонадотропином; ингибин; активин; васкулярный эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); факторы роста нервных тканей, такие как NGF-β; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I или -II; эритропоэтин (EPO); факторы, индуцирующие остеогенез; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарный-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухоли, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и лиганд кit (KL). Используемый здесь термин “цитокин” включает белки, происходящие от природных источников или от рекомбинантной клеточной культуры, и биологически активные эквиваленты цитокинов с нативной последовательностью.
Используемый в данной заявке термин “пролекарство” означает предшественник или производное фармацевтически активного вещества, которые, по сравнению с родительским лекарственным средством, являются менее цитотоксичными по отношению к опухолевым клеткам и способны ферментативно или гидролитически активироваться или превращаться в более активную зрелую форму. См., например, Wilman, “Prodrugs in Cancer Chemotherapy” Biochemical Society Transactions, 14, p.375-382, 615th Meeting Belfast (1986) и Stella et al. “Prodrugs: A Chemical Approach to Targeted Drug Delivery”, Directed Drug Delivery, Borchardt et al., (ed.), p.247-267, Humana Press (1985). Пролекарствами согласно изобретению являются, но не ограничиваются ими, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, лекарственные средства, модифицированные D-аминокислотой, гликозилированные пролекарства, β-лактам-содержащие пролекарства; пролекарства, необязательно содержащие замещенный феноксиацетамид, или пролекарства, необязательно содержащие замещенный фенилацетамид; 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примерами цитотоксических лекарственных средств, которые могут быть дериватизированы с получением пролекарственной формы для ее использования в настоящем изобретении, являются, но не ограничиваются ими, химиотерапевтические агенты, описанные выше.
“Липосома” представляет собой небольшую везикулу, состоящую из липидов различных типов, фосфолипидов и/или поверхностно-активного вещества, которые могут быть использованы для доставки лекарственного средства (например, включая анти-CD30, анти-CD40, анти-CD70 антитела или антитела против Lewis-Y и, необязательно, химиотерапевтический агент) млекопитающему. Компоненты липосомы обычно расположены так, что они образуют бислой, аналогичный липидному бислою в биологических мембранах. Используемый здесь термин “вкладыш в упаковку” означает инструкции, которые обычно вложены в предназначенные для продажи упаковки терапевтических продуктов и в которых имеется информация, касающаяся показаний, способа применения, дозы, способа введения, противопоказаний и/или предупреждений относительно применения таких терапевтических продуктов.
“Выделенная” молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена, по меньшей мере, от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты, кодирующей антитело. Выделенная молекула нуклеиновой кислоты, по своей форме или структуре, отличается от молекулы, встречающейся в природе. Поэтому выделенные молекулы нуклеиновой кислоты отличаются от молекул нуклеиновой кислоты, содержащихся в природных клетках. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют антитело, где, например, указанная молекула нуклеиновой кислоты находится в хромосоме в положении, отличающемся от ее положения в природных клетках.
Термин “регуляторные последовательности” означает ДНК-последовательности, необходимые для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Регуляторными последовательностями, подходящими для прокариотов, являются, например, промотор, необязательно, операторная последовательность и сайт связывания с рибосомой. Известно, что в эукариотических клетках используются промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является “функционально связанной”, если она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Так, например, ДНК для пре-последовательности или секреторной лидерной последовательности функционально присоединена к ДНК, кодирующей полипептид, если он экспрессируется в форме белка-предшественника, который участвует в секреции полипептида; либо промотор или энхансер функционально присоединен к кодирующей последовательности, если он влияет на транскрипцию последовательности; либо сайт связывания с рибосомой функционально присоединен к кодирующей последовательности, если расположение этого сайта облегчает трансляцию. В общих чертах термин “функционально связанный” означает, что ДНК-последовательности являются смежными, а в случае секреторной лидерной последовательности они являются смежными и находятся в одной и той же рамке считывания. Однако энхансеры не должны быть смежными с присоединяемой последовательностью. Присоединение может быть осуществлено путем лигирования в подходящих рестрикционных сайтах. Если такие сайты отсутствуют, то в соответствии со стандартной практикой могут быть использованы синтетические олигонуклеотидные адаптеры или линкеры.
Используемые здесь термины “клетка”, “клеточная линия” и “клеточная культура” являются взаимозаменяемыми, и все они включают потомство этих клеток. Так, например, слова “трансформанты” и “трансформированные клетки” включают первичные клетки и происходящие от них культуры без указания числа пересевов. Следует отметить, что все потомство не может быть точно идентичным по составу ДНК, что обусловлено искусственно введенными или самопроизвольными мутациями. Эти термины также включают мутантное потомство, которое имеет такую же функцию или биологическую активность, которая была установлена при скрининге исходной трансформированной клетки. Более точное определение этих терминов будет понятно из контекста нижеследующего описания.
Используемый здесь термин “аутоиммунное заболевание” означает заболевания или расстройства, возникающие в собственных тканях индивидуума и направленные против этих тканей, либо сопровождающие их заболевания или их симптомы, либо состояния, развивающиеся на основе этих расстройств. Примерами аутоиммунных заболеваний или расстройств являются, но не ограничиваются ими, артрит (ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, псориазный артрит и анкилозирующий спондилит), псориаз, дерматиты, включая атопический дерматит; хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу; полимиозит/дерматомиозит, токсический эпидермальный некроз, системная склеродермия и склероз; реакции, ассоциированные с воспалительным заболеванием кишечника (ВЗК) (болезнь Крона, язвенный колит) и ВЗК с сопровождающей гангренозной пиодермией, узелковой эритемой, первичным склерозирующим холангитом и/или эписклеритом; респираторный дистресс-синдром, включая респираторный дистресс-синдром взрослых (РДСВ); менингит, IgE-опосредованные заболевания, такие как анафилаксический и аллергический ринит, энцефалит, такой как энцефалит Расмуссена; увеит; колит, такой как гистологически диагностированный колит и коллагенозный колит; гломерулонефрит (ГН), такой как мембранный ГН, идиопатический мембранный ГН, мембранный пролиферативный ГН (МПГН), включая гломерулонефрит типа I и типа II и быстро прогрессирующий ГН; аллергические состояния, экзема, астма, состояния, ассоциированные с инфильтрацией Т-клеток и хроническими воспалительными реакциями; атеросклероз; аутоиммунный миокардит; состояния, ассоциированные с нарушением лейкоцитарной адгезии; системная красная волчанка (СКВ), такая как кожная СКВ, волчанка (включая нефрит, церебрит, детская волчанка, не-почечная волчанка, дискоидная волчанка, алопеция); ювенильный сахарный диабет; рассеянный склероз (PC), такой как спинально-офтальмический PC; аллергический энцефаломиелит; иммунные реакции, ассоциированные с острой и замедленной гиперчувствительностью, опосредуемой цитокинами и Т-лимфоцитами; туберкулез; саркоидоз; гранулематоз, включая гранулематоз Вегенера, агранулоцитоз, васкулиты (включая, васкулиты крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (артрит Такаясу)), васкулиты средних сосудов (включая болезнь Кавазаки и узелковый полиартериит), васкулиты ЦНС и ANCA-ассоциированный васкулит, такой как васкулит или синдром Черга-Штраусса (CSS)); апластическая анемия; положительная анемия Кумбса; анемия Даймонда-Блекфана; иммунная гемолитическая анемия, включая аутоиммунную гемолитическую анемию (АИГА); пернициозная анемия; истинная эритроцитарная аплазия (ИЭА); заболевания, ассоциированные с дефицитом фактора VIII; гемофилия А; аутоиммунная нейтропения; панцитопения; лейкопения; заболевания, ассоциированные с лейкоцитарным диапедезом; воспалительные расстройства ЦНС; синдром поражения множества органов; тяжелая миастения; заболевания, опосредуемые комплексом “антиген-антитело”; болезнь гломерулярных базальных мембран, катализируемая реакцией “антитело-антиген”; синдром, ассоциированный с вырабатыванием антител против фосфолипидов; аллергический неврит; болезнь Бехчета; синдром Каслмана; синдром Гудпасчера; миастенический синдром Ламберта-Итона; синдром Рейно; синдром Сьегрена; синдром Стивенса-Джонсона; отторжение трансплантата твердых органов (включая реакции на предварительное введение высоких титров тест-ангигеновых реактивных антител, на отложение IgA в тканях и на отторжение трансплантата почки, трансплантата печени, трансплантата тонкой кишки, трансплантата сердца и т.п.); реакция “трансплантат против хозяина” (GVHD); буллезный пемфигоид; пузырчатка (включая вульгарную пузырчатку, листовидную пузырчатку и пемфигоид слизистых оболочек, напоминающий пузырчатку); аутоиммунные полиэндокринопатии; болезнь Райтера; синдром “негнущегося человека”; иммунокомплексный нефрит; IgM-полиневропатии или IgM-опосредуемая невропатия; идиопатическая тромбоцитопеническая пурпура (ИТП); тромботическая тромбоцитопеническая пурпура (ТТП); тромбоцитопения (развивающаяся, например, у пациентов с инфарктом миокарда), включая аутоиммунную тромбоцитопению; аутоиммунное заболевание яичек и яичника, включая аутоиммунный орхит и оофорит; первичный гипотереоз; аутоиммунные эндокринные заболевания, включая аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото); подострый тиреоидит; идиопатический гипотиреоз; болезнь Аддисона; болезнь Грейвса; аутоиммунные полигландулярные синдромы (или синдромы полигландулярной эндокринопатии); диабет типа I, также называемый инсулинзависимым сахарным диабетом (ИЗСД), включая ИЗСД у детей и синдром Шихана; аутоиммунный гепатит, лимфоидный интерстициальный пневмонит (HIV), облитерирующий бронхоилит (не передающийся), в отличие от NSIP; синдром Гийена-Барре; болезнь Бергера (IgA-нефропатия), первичный билиарный цирроз; кишечные спру (глютеновая энтеропатия); трудноизлечимое спру с обширными очагами герпетиформного дерматита; криоглобулинемия; амилотрофический боковой склероз (АБС; болезнь Луи Герига); ишемическая болезнь сердца; аутоиммунное заболевание внутреннего уха (АЗВУ); аутоиммунное облысение; синдром “пляшущих глаз” (СПГ); полихондрит, такой как трудноизлечимый полихондрит; легочно-альвеолярный протеиноз; амилоидоз; гигантоклеточный гепатит; склерит; моноклональная гаммапатия неясной/неизвестной этиологии (MGUS); периферическая невропатия, паранеопластический синдром; “каналопатии”, такие как эпилепсия, мигрень, аритмия, мышечные расстройства, глухота, слепота, периодический паралич, “каналопатии” ЦНС, аутизм, воспалительная миопатия и очаговый сегментарный гломерулосклероз (ОСГС).
“Алкил” представляет собой С1-С18углеводород, содержащий нормальный, вторичный, третичный атом углерода или атом углерода в кольце. Примерами являются метил (Ме, -СН3), этил (Et, -СН2СН3), 1-пропил (n-Pr, н-пропил, -СН2СН2СН3), 2-пропил (i-Pr, изопропил, СН2(СН3)2), 1-бутил (n-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (i-Bu, изобутил, -СН2СН(СН3)2), 2-бутил (s-Bu, втор-бутил, СН(СН3)СН2СН3), 2-метил-2-пропил (t-Bu, трет-бутил, С(СН3)3), 1-пентил (н-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2(СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3).
“Алкенил” представляет собой С2-С18углеводород, содержащий нормальный, вторичный, третичный атом углерода или атом углерода в кольце, по меньшей мере, с одной ненасыщенной связью, т.е. углерод-углеродной связью и с sp 2-двойной связью. Примерами являются, но не ограничиваются ими, этилен или винил (-СН=СН2), аллил (-СН2СН=СН2), циклопентенил (-С5Н7) и 5-гексенил (-СН2СН2СН2СН2СН=СН2).
“Алкинил” представляет собой С2-С18углеводород, содержащий нормальный, вторичный, третичный атом углерода или атом углерода на кольце, по меньшей мере, с одной ненасыщенной связью, т.е. с углерод-углеродной связью и с sp-тройной связью. Примерами являются, но не ограничиваются ими, ацетилен (-С≡СН) и пропаргил (-СН2С≡СН).
“Алкилен” представляет собой насыщенный, разветвленный, одноцепочечный или циклический углеводородный радикал, состоящий из 1-18 атомов углерода и имеющий два одновалентных радикальных центра, образованных в результате удаления двух атомов водорода у двух одинаковых или различных атомов углерода исходного алкана. Типичными алкиленовыми радикалами являются, но не ограничиваются ими, метилен (-СН2-), 1,2-этил (-СН2СН2-), 1,3-пропил (-СН2СН2СН2-), 1,4-бутил (-СН2СН2СН2СН2-) и т.п.
“Алкенилен” представляет собой ненасыщенный, разветвленный, одноцепочечный или циклический углеводородный радикал, состоящий из 2-18 атомов углерода и имеющий два одновалентных радикальных центра, образованных в результате удаления двух атомов водорода у двух одинаковых или различных атомов углерода исходного алкана. Типичными алкениленовыми радикалами являются, но не ограничиваются ими, 1,2-этилен (-СН=СН-).
“Алкинилен” представляет собой ненасыщенный, разветвленный, одноцепочечный или циклический углеводородный радикал, состоящий из 2-18 атомов углерода и имеющий два одновалентных радикальных центра, образованных в результате удаления двух атомов водорода у двух одинаковых или различных атомов углерода исходного алкина. Типичными алкиниленовыми радикалами являются, но не ограничиваются ими, ацетилен (-С≡С-), пропаргил (-СН2С≡С-) и 4-пентинил (-СН2СН2СН2С≡СН-).
“Арил” представляет собой одновалентный ароматический углеводородный радикал, состоящий из 6-20 атомов углерода и образующийся в результате удаления одного атома водорода у одного атома углерода исходной ароматической системы. Некоторые арильные группы в репрезентативных структурах обозначены как “Ar”. Типичными арильными группами являются, но не ограничиваются ими, радикалы, происходящие от бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п.
“Арилалкил” представляет собой ациклический алкильный радикал, в котором один из атомов водорода, связанных с атомом углерода, обычно концевой атом углерода или sp 3-атом углерода, заменен арильным радикалом. Типичными арилалкильными группами являются, но не ограничиваются ими, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Арилалкильная группа содержит от 6 до 20 атомов углерода; так, например, алкильная часть, включая алканильную, алкенильную или алкинильную части арилалкильной группы, имеет 1-6 атомов углерода, а арильная часть имеет 5-14 атомов углерода.
“Гетероарилалкил” представляет собой ациклический алкильный радикал, в котором один из атомов водорода, связанных с атомом углерода, обычно концевой атом углерода или sp 3-атом углерода, заменен гетероарильным радикалом. Типичными гетероарилалкильными группами являются, но не ограничиваются ими, 2-бензимидазолилметил, 2-фурилэтил и т.п. Гетероарилалкильная группа имеет от 6 до 20 атомов углерода; так, например, алкильная часть, включая алканильную, алкенильную или алкинильную части гетероарилалкильной группы, имеет 1-6 атомов углерода, а гетероарильная часть имеет 5-14 атомов углерода и 1-3 гетероатома, выбранных из N, О, Р и S. Гетероарильная часть гетероарилалкильной группы может представлять собой моноцикл, имеющий от 3 до 7 членов на кольце (2-6 атомов углерода), или бицикл, имеющий от 7 до 10 членов на кольце (4-9 атомов углерода и 1-3 гетероатома, выбранных из N, О, Р и S), например бицикло [4,5]-, [5,5]-, [5,6]- или [6,6]-систему.
Термины “замещенный алкил”, “замещенный арил” и “замещенный арилалкил” означают алкил, арил и арилалкил соответственно, в которых один или несколько атомов водорода независимо замещены заместителем. Типичными заместителями являются, но не ограничиваются ими, -Х-, -R, -О-, -OR, -SR, -S-, -NR2, -NR3, =NR, -СХ3, -CN, -OCN, -SCN, -N=С=О, -NCS, -NO, -NO2, =N2, -N3, NC(=О)R, С(=О)R, -С(=О)NR2, -SO3 -, -SO3H, -S(=О)2R, -OS(=О)2OR, -S(=O)2NR, -S(=О)R, -ОР(=О)(OR)2, -Р(=О)(OR)2, -РО3 -, -РО3Н2, -С(=О)R, -С(=О)Х, -С(=S)R, -CO2R, -СО2 -, -С(=S)OR, -С(=О)SR, -С(=S)SR, -С(=О)NR2, -С(=S)NR2, -С(=NR)NR2, где каждый Х независимо представляет собой галоген: F, Cl, Br или I, а каждый R независимо представляет собой Н, С2-С18алкил, С6-С20арил, С3-С14гетероцикл, защитную группу или группу пролекарства. Алкиленовая, алкениленовая и алкиниленовая группы, описанные выше, могут быть также замещены аналогичным образом.
“Гетероарил” и “гетероцикл” представляют собой циклическую систему, в которой один или несколько атомов на кольце представляют собой гетероатомы, например, атомы азота, кислорода и серы. Гетероциклический радикал содержит 1-20 атомов углерода и 1-3 гетероатома, выбранных из N, О, Р и S. Гетероцикл может представлять собой моноцикл, имеющий от 3 до 7 членов на кольце (2-6 атомов углерода и 1-3 гетероатома, выбранных из N, О, Р и S), или бицикл, имеющий от 7 до 10 членов на кольце (4-9 атомов углерода и 1-3 гетероатома, выбранных из N, О, Р и S), например бицикло [4,5]-, [5,5]-, [5,6]- или [6,6]-систему.
Гетероциклы описаны у Paquette, Leo A.; “Principles of Modern Heterocyclic Chemistry” (W.A. Benjamin, New York, 1968), а в частности в главах 1, 3, 4, 6, 7 и 9; в “The Chemistry of Heterocyclic Compounds, A series of Monographs” (John Wiley & Sons, New York, 1950 to present), а в частности в томах 13, 14, 16, 19 и 28; и в J. Am. Chem. Soc. (1960) 82:5566.
Примерами гетероциклов является, например, но не ограничиваются ими, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, окисленный серой тетрагидротиофенил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталинил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6Н-1,2,5-тиадиазинил, 2Н,6Н-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксантинил, 2Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3Н-индолил, 1Н-индазолил, пуринил, 4Н-хинолизинил, фталазинил, нафтеридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4аН-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил.
Неограничивающими примерами связанных через углерод гетероциклов являются гетероциклы, связанные в положении 2, 3, 4, 5 или 6 пиридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, в положении 2, 4 или 5 оксазола, имидазола или тиазола, в положении 3, 4 или 5 изоксазола, пиразола или изотиазола, в положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Более типичными связанными через углерод гетероциклами являются 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил.
Неограничивающими примерами связанных через азот гетероциклов являются гетероциклы, связанные в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1Н-индазола; в положении 2 изоиндола или изоиндолина, в положении 4 морфолина и в положении 9 карбазола или β-карболина. Наиболее типичными связанными через азот гетероциклами являются 1-азиридил, 1-азетидил, 2-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил.
“Карбоцикл” представляет собой насыщенное или ненасыщенное моноциклическое кольцо, имеющее 3-7 атомов углерода, или бициклическое кольцо, имеющее 7-12 атомов углерода. Моноциклические карбоциклы имеют 3-6 атомов углерода на кольце, а обычно 5 или 6 атомов углерода на кольце. Бициклические карбоциклы имеют 7-12 атомов углерода на кольце, например, в виде бицикло-[4,5]-, -[5,5]-, -[5,6]- или [6,6]-системы, либо 9 или 10 атомов углерода на кольце, в виде бицикло-[5,6]- или [6,6]-системы. Примерами моноциклических карбоциклов являются циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил и циклооктил.
Термины “линкер”, “линкерный компонент” или “связь” означают химическую группу, содержащую ковалентную связь или цепь атомов, которые ковалентно связывают антитело с молекулой лекарственного средства. В различных вариантах изобретения линкер обозначен LU. Линкером является двувалентный радикал, такой как алкилдиил, арилдиил, гетероарилдиил, такие группы, как -(CR2)nO(CR2)n-, повторяющиеся звенья алкилокси (например, полиэтиленокси, ПЭГ, полиметиленокси) и алкиламино (например, полиэтиленамино, JeffamineTM), и двухосновный сложный эфир и амиды, включая сукцинат, сукцинамид, дигликолят, малонат и капроамид.
Термин “хиральный” относится к молекулам, которые не совмещаются наложением с его зеркально отображенным аналогом, а термин “ахиральный” относится к молекулам, которые совмещаются наложением с его зеркально отображенным аналогом.
Термин “стереоизомеры” означает соединения, которые имеют идентичную химическую структуру, но отличаются пространственным расположением атомов или групп.
Термин “диастереомер” означает стереоизомер с одним или несколькими хиральными центрами, молекулы которого не являются зеркальным отображением друг друга. Диастереомеры имеют различные физические свойства, например температуры плавления, точки кипения, спектральные свойства и реакционную способность. Смеси диастереомеров могут быть разделены высокоразрешающими аналитическими методами, такими как электрофорез и хроматография.
Термин “энантиомеры” означает два стереоизомера соединения, зеркальные отображения которых не совмещаются друг с другом.
Определения и обозначения используемых здесь стереохимических терминов в общих чертах приводятся у S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel E.& Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, то есть они способны вращать плоскость плоскополяризованного света. В описании оптически активного соединения префиксы D и L или R и S используются для обозначения абсолютной конфигурации молекулы относительно его (их) хирального(ых) центра(ов). Префиксы d и l или (+) и (-) используются для обозначения знака вращения плоскополяризованного света данным соединением, а (-) или l означает, что данное соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальным отображением друг друга. Специфический стереоизомер может также называться энантиомером, а смесь таких изомеров часто называется энантиомерной смесью. Смесь 50:50 энантиомеров называется рацемической смесью или рацематом, который может образовываться в том случае, если в химической реакции или в химическом процессе отсутствует стереоселективность или стереоспецифичность. Термины “рацемическая смесь” и “рацемат” означают эквимолярную смесь двух энантиомерных молекул, не обладающих оптической активностью.
Примерами “пациента” являются, но не ограничиваются ими, человек, крыса, мышь, морская свинка, обезьяна, свинья, коза, корова, лошадь, собака, кошка, птица и домашняя птица. В репрезентативном варианте изобретения пациентом является человек.
Термин “арил” означает карбоциклическую ароматическую группу. Примерами арильных групп являются, но не ограничиваются ими, фенил, нафтил и антраценил. Карбоциклическая ароматическая группа или гетероциклическая ароматическая группа могут быть незамещенными или могут быть замещены одной или несколькими группами, включая, но не ограничиваясь ими, -С1-С8алкил, -О-(С1-С8алкил), арил, -С(О)R', -ОС(О)R', -С(О)OR', -С(О)NH2, -С(О)NHR', -С(О)N(R')2, -NHC(О)R', -S(О)2R', -S(О)R', -ОН, галоген, N3, -NH2-, -NH(R'), -N(R')2 и -CN, где каждый из R' независимо выбран из Н, -С1-С8алкила и арила.
Используемый здесь термин “С1-С8алкил” означает прямой или разветвленный, насыщенный или ненасыщенный углеводород, имеющий от 1 до 8 атомов углерода. Репрезентативными “С1-С8алкильными” группами являются, но не ограничиваются ими, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил и н-децил, а разветвленными С1-С8алкилами являются, но не ограничиваются ими, изопропил, втор-бутил, изобутил, трет-бутил, изопентил, 2-метилбутил; ненасыщенными С1-С8алкилами являются, но не ограничиваются ими, винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил, 1-гексил, 2-гексил, 3-гексил, ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинин, 3-метил-1-бутинил, метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил, 2,2-диметилпентил, 2,3-диметилпентил, 3,3-диметилпентил, 2,3,4-триметилпентил, 3-метилгексил, 2,2-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 3,5-диметилгексил, 2,4-диметилпентил, 2-метилгептил, 3-метилгептил, н-гептил, изогептил, н-октил и изооктил. С1-С8алкильная группа может быть незамещенной или может быть замещена одной или несколькими группами, включая, но не ограничиваясь ими, -С1-С8алкил, -О-(С1-С8алкил), -арил, -С(О)R', -ОС(О)R', -С(О)OR', -С(О)NH2, -С(О)NHR', -С(О)N(R')2, -NHC(О)R', -SO3R', -S(О)2R', -S(О)R', -ОН, галоген, N3, -NH2-, -NH(R'), -N(R')2 и -CN, где каждый из R' независимо выбран из Н, -С1-С8алкила и арила.
Термин “С3-С8карбоцикл” означает 3-, 4-, 5-, 6-, 7- или 8-членное насыщенное или ненасыщенное неароматическое карбоциклическое кольцо. Репрезентативными С3-С8карбоциклами являются, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклопентадиенил, циклогексил, циклогексенил, -1,3-циклогексадиенил, -1,4-циклогексадиенил, циклогептил, -1,3-циклогептадиенил, -1,3,5-циклогептатриенил, циклооктил и циклооктадиенил. С3-С8карбоциклическая группа может быть незамещенной или может быть замещена одной или несколькими группами, включая, но не ограничиваясь ими, -С1-С8алкил, -О-(С1-С8алкил)-, арил, -С(О)R', -ОС(О)R', -С(О)OR', -С(О)NH2, -С(О)NHR', -С(О)N(R')2, -NHC(О)R', -S(О)2R', -S(О)R', -ОН, галоген, N3, -NH2-, NH(R'), -N(R')2 и -CN, где каждый из R' независимо выбран из Н, -С1-С8алкила и арила.
Термин “С3-С8карбоцикло” означает С3-С8карбоциклическую группу, определенную выше, где один из атомов водорода карбоциклической группы заменен связью.
Термин “С1-С10алкилен” означает прямую насыщенную углеводородную группу формулы -(СН2)1-10-. Примерами С1-С10алкилена являются метилен, этилен, пропилен, бутилен, пентилен, гексилен, гептилен, октилен, нонилен и декален.
Термин “арилен” означает арильную группу, которая имеет две ковалентные связи и может присутствовать в орто-, мета- или пара-конфигурациях, как показано в нижеследующих структурах:
где фенильная группа может быть незамещенной или может быть замещена одной-четырьмя группами, включая, но не ограничиваясь ими, -С1-С8алкил, -О-(С1-С8алкил)-, арил, -С(О)R', -ОС(О)R', -С(О)OR', -С(О)NH2, -С(О)NHR', -С(О)N(R')2, -NHC(О)R', -S(О)2R', -S(О)R', -ОН, галоген, N3, -NH2-, -NH(R'), -N(R')2 и -CN, где каждый из R' независимо выбран из Н, -С1-С8алкила и арила.
Термин “С3-С8гетероцикл” означает ароматический или неароматический С3-С8карбоцикл, в котором один-четыре атома углерода на кольце независимо замещены гетероатомом, выбранным из группы, состоящей из О, S и N. Репрезентативными примерами С3-С8гетероцикла являются, но не ограничиваются ими, бензофуранил, бензотиофен, индолил, бензопиразолил, кумаринил, изохинолинил, пирролил, тиофенил, фуранил, тиазолил, имидазолил, пиразолил, триазолил, хинолинил, пиримидинил, пиридинил, пиридонил, пиразинил, пиридазинил, изотиазолил, изоксазолил и тетразолил. С3-С8гетероцикл может быть незамещенным, либо он может быть замещен 1-7 группами, включая, но не ограничиваясь ими, -С1-С8алкил, -О-(С1-С8алкил)-, -арил, -С(О)R', -ОС(О)R', -С(О)OR', -С(О)NH2, -С(О)NHR', -С(О)N(R')2, -NHC(О)R', -S(О)2R', -S(О)R', -ОН, галоген, N3, -NH2-, -NH(R'), -N(R')2 и -CN, где каждый из R' независимо выбран из Н, -С1-С8алкила и арила.
Термин “С3-С8гетероцикло” означает С3-С8гетероциклическую группу, определенную выше, где один из атомов водорода гетероциклической группы заменен связью. С3-С8гетероцикло может быть незамещенным или может быть замещен 1-6 группами, включая, но не ограничиваясь ими, -С1-С8алкил, -О-(С1-С8алкил)-, -арил, -С(О)R', -ОС(О)R', -С(О)OR', -С(О)NH2, -С(О)NHR', -С(О)N(R')2, -NHC(О)R', -S(О)2R', -S(О)R', -ОН, галоген, N3, -NH2-, -NH(R'), -N(R')2 и -CN, где каждый из R' независимо выбран из Н, -С1-С8алкила и арила.
Термин “репрезентативное соединение” означает лекарственное соединение или соединение “лекарственное средство-линкер”.
Термин “репрезентативный конъюгат” означает конъюгат “лекарственное средство-лиганд”, в котором лекарственное средство отщепляется от указанного конъюгата “лекарственное средство-лиганд” или конъюгата “лекарственное средство-линкер-лиганд”.
В некоторых вариантах изобретения указанные репрезентативные соединения и конъюгаты присутствуют в выделенной или в очищенной форме. Используемый здесь термин “выделенный” означает компонент, отделенный от других компонентов (а) природного источника, такого как клетка или клеточная культура растения или животного, или (b) синтетической органической химической реакционной смеси. Используемый здесь термин “очищенный” означает, что после выделения данный изолят содержит, по меньшей мере, 95%, а в другом аспекте изобретения, по меньшей мере, 98% репрезентативного соединения или репрезентативного конъюгата по массе изолята.
Примерами “гидроксильных защитных групп” являются, но не ограничиваются ими, метоксиметиловый эфир, 2-метоксиэтоксиметиловый эфир, тетрагидропираниловый эфир, бензиловый эфир, п-метоксибензиловый эфир, триметилсилиловый эфир, триэтилсилиловый эфир, триизопропилсилиловый эфир, трет-бутилдиметилсилиловый эфир, трифенилметилсилиловый эфир, сложный эфир уксусной кислоты, замещенные сложные эфиры уксусной кислоты, пивалоат, бензоат, метансульфонат и п-толуолсульфонат.
Термин “уходящая группа” означает функциональную группу, которая может быть замещена другой функциональной группой. Такие уходящие группы хорошо известны специалистам, и примерами этих групп являются, но не ограничиваются ими, галогенид (например, хлорид, бромид, иодид), метансульфонил (мезил), п-толуолсульфонил (тозил), трифторметилсульфонил (трифлат) и трифторметилсульфонат.
Используемый здесь термин “фармацевтически приемлемая соль” означает фармацевтически приемлемые органические или неорганические соли репрезентативного соединения или репрезентативного конъюгата. Указанные репрезентативные соединения и репрезентативные конъюгаты содержат, по меньшей мере, одну аминогруппу, и эта аминогруппа может образовывать соответствующие кислотно-аддитивные соли. Примерами таких солей являются, но не ограничиваются ими, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Термин “фармацевтически приемлемая соль” может включать и другую молекулу, такую как ион ацетата, ион сукцината или другой противоион. Такой противоион может представлять собой любую органическую или неорганическую молекулу, которая стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может иметь в своей структуре более чем один заряженный атом. В случае если множество заряженных атомов являются частью фармацевтически приемлемой соли, то такая соль может иметь множество противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
Термины “фармацевтически приемлемый сольват” или “сольват” означает комплекс одной или нескольких молекул растворителя и соединений настоящего изобретения, например репрезентативного соединения или репрезентативного конъюгата. Примерами растворителей, которые образуют фармацевтически приемлемые сольваты, являются, но не ограничиваются ими, вода, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусная кислота и этаноламин.
Сокращения, используемые в настоящем описании, имеют нижеследующие значения: АЕ означает ауристатин Е; Вос означает N-(трет-бутоксикарбонил), cit означает цитруллин, dap означает долапроин, DCC означает 1,3-дициклогексилкарбодиимид, DCM (ДХМ) означает дихлорметан, DEA означает диэтиламин, DEAD означает диэтилазодикарбоксилат, DEPC означает диэтилфосфорилцианидат, DIAD означает диизопропилазодикарбоксилат, DIEA означает N,N-диизопропилэтиламин, dil означает долаизолейцин, DMAP означает 4-диметиламинопиридин, DME означает диметиловый эфир этиленгликоля (или 1,2-диметоксиэтан), DMF (ДМФ) означает N,N-диметилформамид, DMSO (ДМСО) означает диметилсульфоксид, doe означает долафенин, dov означает N,N-диметилвалин, DNTB означает 5,5'-дитиобис(2-нитробензойную кислоту), DTPA означает диэтилентриаминопентауксусную кислоту, DTT означает дитиотреитол, EDCI означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, EEDQ означает 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, ES-MS означает масс-спектрометрию электрораспылением, EtOAc означает этилацетат, Fmoc означает N-(9-флуоренилметоксикарбонил), gly означает глицин, HATU означает гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, HOBt означает 1-гидроксибензотриазол, HPLC (ВЭЖХ) означает жидкостную хроматографию высокого давления, ile означает изолейцин, lys означает лизин, MeCN (CH3CN) означает ацетонитрил, MeOH означает метанол, Mtr означает 4-анизилдифенилметил (или 4-метокситритил), nor (нор) означает (1S,2R)-(+)-норэфедрин, РАВ означает п-аминобензил, PBS означает забуференный фосфатом физиологический раствор (рН 7,4), PEG (ПЭГ) означает полиэтиленгликоль, Ph означает фенил, Pnp означает п-нитрофенил, МС означает 6-малеимидокапроил, phe означает L-фенилаланин, PyBrop означает гексафторфосфат бром-трис-пирролидинофосфония, SEC означает эксклюзионную хроматографию, Su означает сукцинимид, TBTU означает тетрафторборат О-бензотриазол-1-ил-N,N,N,N-тетраметилурония, TFA означает трифторуксусную кислоту, TLC (ТСХ) означает тонкослойную хроматографию, UV (УФ) означает ультрафиолетовое излучение, а val означает валин.
Сокращения, используемые в настоящем описании для линкеров, имеют нижеследующие значения: Val-Cit означает валин-цитруллин, дипептидный сайт в расщепляемом протеазой линкере; РАВ означает п-аминобензилкарбамоил; (Ме)vc означает N-метил-валин-цитруллин, где линкерная пептидная связь была модифицирована так, чтобы она предотвращала расщепление этого линкера катепсином В; МС(ПЭГ)6-ОН означает малеимидокапроил-полиэтиленгликоль; SPP означает N-сукцинимидил-4-(2-пиридилтио)пентаноат, а SMCC означает N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат.
Термины “лечить” или “лечение”, если в контексте описания они не имеют какого-либо иного смысла, означают терапевтическое лечение и профилактические или превентивные меры, которые направлены на предупреждение или замедление (ослабление) у индивидуума нежелательного физиологического изменения или расстройства, такого как развитие или прогрессирование рака. В соответствии с настоящим изобретением благоприятными или желательными клиническими эффектами являются, но не ограничиваются ими, ослабление симптомов, снижение тяжести заболевания, стабильное (то есть не ухудшающееся) состояние, задержка или замедление прогрессирования заболевания, уменьшение или временное облегчение симптомов заболевания и ремиссия (частичная или полная), независимо от того, являются ли эти симптомы детектируемыми или недетектируемыми. Термин “лечение” может также означать увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни при отсутствии лечения. Термин “индивидуумы, нуждающиеся в лечении” относится к индивидуумам, уже страдающим данным состоянием или расстройством, а также к индивидуумам, имеющим предрасположенность к данному состоянию или расстройству, или к индивидуумам, которые нуждаются в предупреждении данного состояния или расстройства.
Что касается рака, то термин “лечение” включает любые или все из нижеперечисленных эффектов, таких как предупреждение роста опухолевых клеток, раковых клеток или опухоли; предотвращение репликации опухолевых клеток или раковых клеток, снижение общей опухолевой массы или уменьшение числа раковых клеток и ослабление одного или нескольких симптомов, ассоциированных с данным заболеванием.
Что касается аутоиммунного заболевания, то термин “лечение” включает любые или все из нижеперечисленных эффектов, таких как предотвращение репликации клеток, ассоциированных с аутоиммунным заболеванием, включая, но не ограничиваясь ими, клетки, продуцирующие аутоиммунное антитело; снижение титра аутоиммунных антител и ослабление одного или нескольких симптомов аутоиммунного заболевания.
Что касается инфекционного заболевания, то термин “лечение” включает любые или все из нижеперечисленных эффектов, таких как предотвращение роста, размножения или репликации патогенов, вызывающих инфекционное заболевание и ослабление одного или нескольких симптомов инфекционного заболевания.
Сокращения, используемые в настоящем описании для цитотоксических лекарственных средств, имеют нижеследующие значения: ММАЕ означает монометил-ауристатин Е (мол. масса (MW 718); MMAF означает N-метилвалин-валин-долаизолейцин-долапроин-фенилаланин (MW 731,5); MMAF-DMEAEA означает MMAF с DMAEA (диметиламиноэтиламином), имеющий амидную связь с С-концевым фенилаланином (MW 801,5); MMAF-TEG означает MMAF с тетраэтиленгликолем, этерифицированным фенилаланином; MMAF-NtBu означает N-трет-бутил, присоединенный в виде амида к С-концу MMAF; AEVB означает валерилбензилгидразон ауристатина Е, связанный кислотным лабильным линкером с С-концом АЕ (MW 732), а AFP означает моноамид п-фенилендиамина с С-концевым фенилаланином ауристатина F (MW 732).
4.2. Соединения согласно изобретению
4.2.1. Соединение формулы (Ia)
В одном из своих аспектов настоящее изобретение относится к конъюгатам “лекарственное средство-линкер-лиганд”, имеющим формулу Ia:
или к их фармацевтически приемлемым солям или сольватам,
где: L представляет собой лигандный компонент;
-Аа-Ww-Yy- представляет собой линкерный компонент (LU), где в указанном линкерном компоненте:
-А- представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
-Y- означает спейсерный компонент,
у равно 0, 1 или 2;
р составляет в пределах от 1 примерно до 20; и
-D представляет собой компонент “лекарственное средство”, имеющий формулы DE и DF;
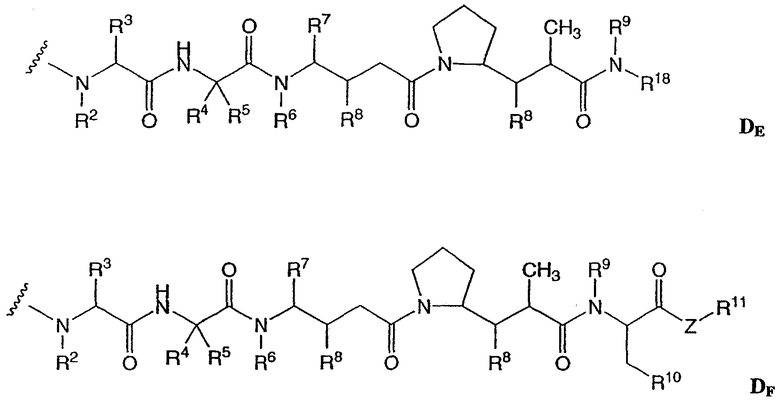
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, -(СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН;
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла); и
где n равно целому числу от 0 до 6.
В другом своем варианте настоящее изобретение относится к лекарственным соединениям формулы Ib:
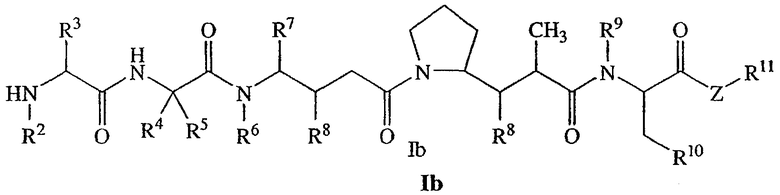
или к их фармацевтически приемлемым солям или сольватам,
где: R2 выбран из водорода и С1-С8алкила;
R3 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, арила, -С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и -С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из водорода, -С1-С8алкила, -С3-С8карбоцикла, -арила, -С1-С8алкиларила, -С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла), где R5 выбран из Н и метила либо R4 и R5, взятые вместе с атомом углерода, с которым они связаны, образуют кольцо формулы -(CRaRb)n-, где Ra и Rb независимо выбраны из -Н, -С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и -С1-С8алкила;
R7 выбран из Н, -С1-С8алкила, -С3-С8карбоцикла, -арила, -С1-С8алкиларила, -С1-С8алкил-(С3-С8карбоцикла), -С3-С8гетероцикла и -С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, -С1-С8алкила, -С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и -С1-С8алкила;
R10 выбран из арильной группы или -С3-С8гетероцикла;
Z представляет собой -О-, -S-, -NH- или -NR12, где R12 представляет собой -С1-С8алкил;
R11 выбран из Н, -С1-С20алкила, -арила, -С3-С8гетероцикла, -(R13O)m-R14 или -(R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой -С2-С8-алкил;
R14 представляет собой Н или -С1-С8алкил;
каждый из R15 независимо представляет собой Н, -СООН, -(СН2)n-N(R16)2, -(СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, -С1-С8алкил или -(СН2)n-СООН, и
n равно целому числу от 0 до 6.
В еще одном своем варианте настоящее изобретение относится к конъюгатам “лекарственное средство-линкер-лиганд” формулы Ia':
или к их фармацевтически приемлемым солям или сольватам,
где: Ab представляет собой антитело;
А представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y означает спейсерный компонент,
у равно 0, 1 или 2,
р составляет в пределах от 1 примерно до 20; и
D представляет собой лекарственное средство, выбранное из соединений формул DE и DF:
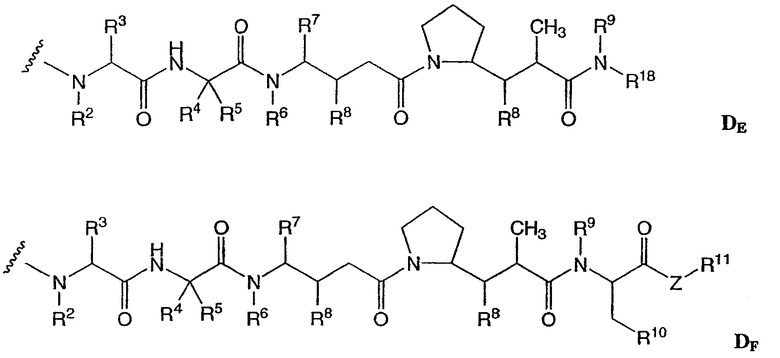
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН;
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла); и
n равно целому числу от 0 до 6.
Ab представляет собой антитело, ковалентно связанное с одним или несколькими молекулами лекарственного средства. Антителом Ab является антитело, которое связывается с CD30, CD40, CD70 и антигеном Lewis-Y. В другом варианте изобретения Ab не включает антитело, которое связывается с ErbB-рецептором или с одним или несколькими из рецепторов (1)-(35), такими как:
(1) BMPR1B (рецептор белка морфогенеза кости типа IB, Genbank рег. № NM_001203);
(2) Е16 (LAT1, SLC7A5, Genbank рег. № NM_003486);
(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы, Genbank рег. № NM_012449);
(4) 0772Р (СА125, MUC16, Genbank рег. № AF361486);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, Genbank рег. № NM_005823);
(6) Napi3b (NAPI-3B, NpTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II, Genbank рег. № NM_006424);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТК) и короткий цитоплазматический домен (семафорин) 5В, Genbank рег. № АВ040878);
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, кДНК RIKEN 2700050C12, кДНК гена RIKEN 2700050C12, Genbank рег. № AY358628);
(9) ETBR (рецептор эндотелина типа В, Genbank рег. № AY275463);
(10) MSG783 (RNF124, гипотетический белок FLJ20315, Genbank рег. № NM_017763);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы, Genbank рег. № AF455138);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М, Genbank рег. № NM_017636);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы, Genbank рег. № NP_003203 или NM_003212);
(14) CD21 (CR2 (рецептор комплемента 2), или C3DR (C3d/рецептор вируса Эпштейна-Барра), или Hs.73792, Genbank рег. № M26004);
(15) CD79b (IGb (бета-белок, связанный с иммуноглобулином), В29, Genbank рег. № NM_000626);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C, Genbank рег. № NM_030764);
(17) HER2 (Genbank рег. № M11730);
(18) NCA (Genbank рег. № М18728);
(19) MDP (Genbank рег. № BC017023);
(20) IL20Rα (Genbank рег. № AF184971);
(21) Brevican (Genbank рег. № AF229053);
(22) Ephb2R (Genbank рег. № NM_004442);
(23) ASLG659 (Genbank рег. № AX092328);
(24) PSCA (Genbank рег. № AJ297436);
(25) GEDA (Genbank рег. № AY260763);
(26) BAFF-R (Genbank рег. № NP_443177.1);
(27) CD22 (Genbank рег. № NP-001762.1);
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок, В-клеткоспецифический белок, который ковалентно взаимодействует с Ig бета (CD79B) и образует комплекс с молекулами IgM на поверхности клеток, передавая сигнал, участвующий в дифференцировке В-клеток, Genbank рег. № NP_001774.1);
(29) CXCR5 (рецептор 1 лимфомы Беркитта, связанный с G-белком рецептор, который активируется хемокином CXCL13, обеспечивает миграцию лимфоцитов и гуморальную защиту, а также играет определенную роль в инфицировании вирусом ВИЧ-2 и, вероятно, в развитии СПИД'а, лимфомы, миеломы и лейкоза, Genbank рег. № NP_001707.1);
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Ia), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам, Genbank рег. № NP_002111.1);
(31) Р2Х5 (ионный канал, открываемый лигандом пуринергического рецептора Р2Х 5; ионный канал, открываемый внеклеточным АТР, может участвовать в синаптической передаче и в нейрогенезе, а его дефицит может играть определенную роль в патофизиологии идиопатической дисфункции мочевого пузыря, Genbank рег. № NP_002552.2);
(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2, Genbank рег. № NP_001773.1);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок семейства богатых лейцином повторов (LRR) типа I, который регулирует активацию и апоптоз В-клеток, и потеря его функции ассоциируется с прогрессированием заболевания у пациентов с системной красной волчанкой, Genbank рег. № NP_005573.1);
(34) FCRH1 (Fc-рецептор-подобный белок 1, предполагаемый рецептор для Fc-домена иммуноглобулина, который содержит Ig-подобные домены типа С2 и домены ITAM, может играть определенную роль в дифференцировке В-лимфоцитов, Genbank рег. № NP_443170.1); и/или
(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2, предполагаемый иммунорецептор, который возможно играет определенную роль в развитии В-клеток и лимфомагенезе; в некоторых злокачественных В-клетках наблюдается нарушение регуляции гена посредством транслокации, Genbank рег. № NP_112571.1).
В одном из вариантов изобретения -Ww- представляет собой Val-Cit.
В другом варианте изобретения R3, R4 и R7 независимо представляют собой изопропил или втор-бутил, а R5 представляет собой -Н. В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, R5 представляет собой -Н, R7 представляет собой втор-бутил. В еще одном варианте изобретения каждый из R2 и R6 представляет собой метил, а R9 представляет собой -Н.
В другом варианте изобретения каждый R8 представляет собой -OCH3.
В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, каждый из R2 и R6 представляет собой метил, R5 представляет собой Н, R7 представляет собой втор-бутил, каждый из R8 представляет собой -OCH3, а R9 представляет собой -Н.
В одном из вариантов изобретения Z представляет собой -О- или -NH-.
В одном из вариантов изобретения R10 представляет собой арил.
В репрезентативном варианте изобретения R10 представляет собой фенил.
В репрезентативном варианте изобретения если Z представляет собой -О-, то R11 представляет собой Н, метил или трет-бутил.
В одном из вариантов изобретения если Z представляет собой -NH, то R11 представляет собой СН(R15)2, где R15 представляет собой -(СН2)n-N(R16)2, а R16 представляет собой -С1-С8алкил или -(СН2)n-СООН.
В другом варианте изобретения если Z представляет собой NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-SO3H.
В одном из аспектов изобретения Ab представляет собой сАС10, cBR96, cS2C6, c1F6, c2F2, hAc10, hBR96, hS2C6, h1F6 и h2F2.
Репрезентативные варианты соединений формулы Ia имеют следующие структуры:
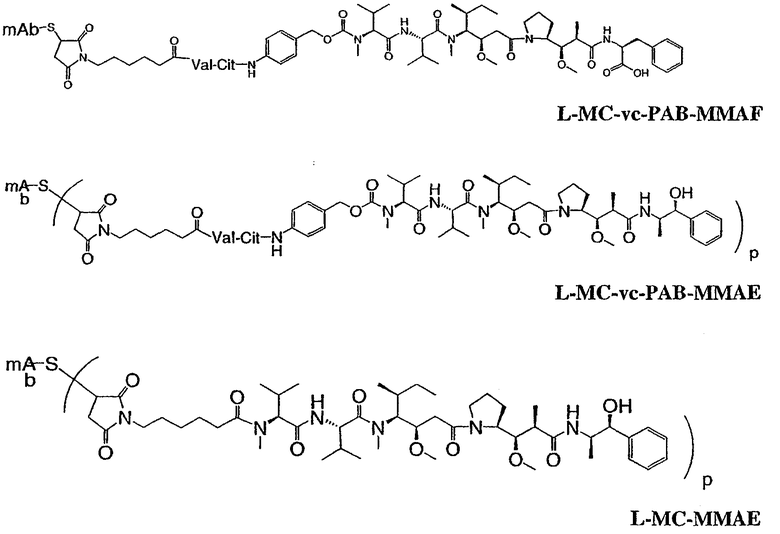
или
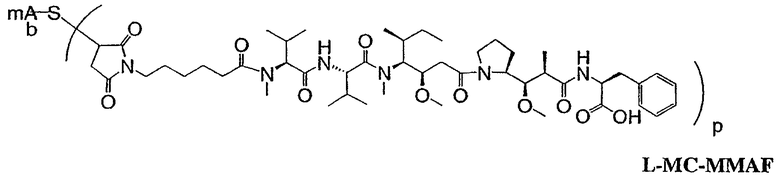
где L представляет собой антитело, Val представляет собой валин, а Cit представляет собой цитруллин.
Нагрузка лекарственного средства определяется числом р, то есть средним числом молекул лекарственного средства на антитело в молекуле (например, соединения формулы Ia, Ia' и Ic). Нагрузка лекарственного средства может составлять от 1 до 20 молекул лекарственного средства (D) на лиганд (например, Ab или mAb). Композиции соединений формул Ia и Ia' включают наборы антител, конъюгированных 1-20 молекулами лекарственных средств. Среднее число молекул лекарственных средств на антитело в препарате, полученном с помощью реакции конъюгирования, может быть определено стандартными методами, такими как масс-спектроскопия, ELISA-анализ и ВЭЖХ. Количественное распределение конъюгатов “лиганд-лекарственное средство” может быть также выражено символом р. В некоторых случаях выделение, очистка и идентификация гомогенных конъюгатов “лиганд-лекарственное средство”, где р имеет определенную величину, от гомогенных конъюгатов “лиганд-лекарственное средство” с другой нагрузкой лекарственного средства могут быть достигнуты такими методами, как обращенно-фазовая ВЭЖХ или электрофорез.
4.2.2. СОЕДИНЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ФОРМУЛЫ (Ib)
В другом своем аспекте настоящее изобретение относится к лекарственным соединениям формулы (Ib):
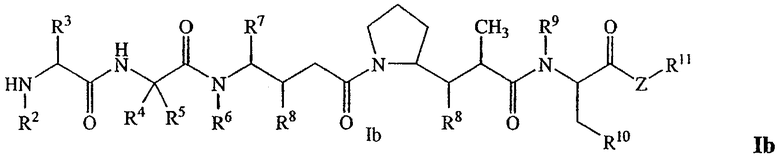
или к их фармацевтически приемлемым солям или сольватам,
где: R2 выбран из водорода и -С1-С8алкила;
R3 выбран из водорода, -С1-С8алкила, -С3-С8карбоцикла, арила, -С1-С8алкиларила, -С1-С8алкил-(С3-С8карбоцикла), -С3-С8гетероцикла и -С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из водорода, -С1-С8алкила, -С3-С8карбоцикла, арила, -С1-С8алкиларила, -С1-С8алкил-(С3-С8карбоцикла), -С3-С8гетероцикла и -С1-С8алкил-(С3-С8гетероцикла), где R5 выбран из Н и метила либо R4 и R5, взятые вместе с атомом углерода, с которым они связаны, образуют кольцо формулы -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, -С1-С8алкила и -С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из -Н и -С1-С8алкила;
R7 выбран из -Н, -С1-С8алкила, -С3-С8карбоцикла, -арила, -С1-С8алкиларила, -С1-С8алкил-(С3-С8карбоцикла), -С3-С8гетероцикла и -С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из -Н, -ОН, -С1-С8алкила, -С3-С8карбоцикла и -О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арильной группы или -С3-С8гетероцикла;
Z представляет собой -О-, -S-, -NH- или -NR12, где R12 представляет собой -С1-С8алкил;
R11 выбран из Н, -С1-С20алкила, арила, -С3-С8гетероцикла, -(R13O)m-R14 или -(R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой -С2-С8-алкил;
R14 представляет собой Н или -С1-С8алкил;
каждый из R15 независимо представляет собой Н, -СООН, -(СН2)n-N(R16)2, -(СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой -Н, -С1-С8алкил или -(СН2)n-СООН, и
n равно целому числу от 0 до 6.
В одном из вариантов изобретения R3, R4 и R7 независимо представляют собой изопропил или втор-бутил, а R5 представляет собой -Н. В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, R5 представляет собой -Н, R7 представляет собой втор-бутил.
В другом варианте изобретения каждый из R2 и R6 представляет собой метил, а R9 представляет собой -Н.
В еще одном варианте изобретения каждый R8 представляет собой -OCH3.
В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, каждый из R2 и R6 представляет собой метил, R5 представляет собой -Н, R7 представляет собой втор-бутил, каждый из R8 представляет собой -OCH3, а R9 представляет собой -Н.
В одном из вариантов изобретения Z представляет собой -О- или -NH-.
В одном из вариантов изобретения R10 представляет собой арил.
В репрезентативном варианте изобретения R10 представляет собой фенил.
В репрезентативном варианте изобретения, если Z представляет собой -О-, то R11 представляет собой Н, метил или трет-бутил.
В одном из вариантов изобретения если Z представляет собой -NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-N(R16)2, а R16 представляет собой -С1-С8алкил или -(СН2)n-СООН.
В другом варианте изобретения если Z представляет собой NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-SO3H.
Репрезентативными соединениями формулы (Ib), каждое из которых может быть использовано в качестве молекулы лекарственного средства (D) в ADC, являются соединения, имеющие следующие структуры:
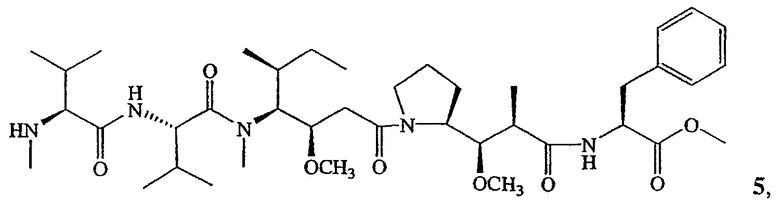
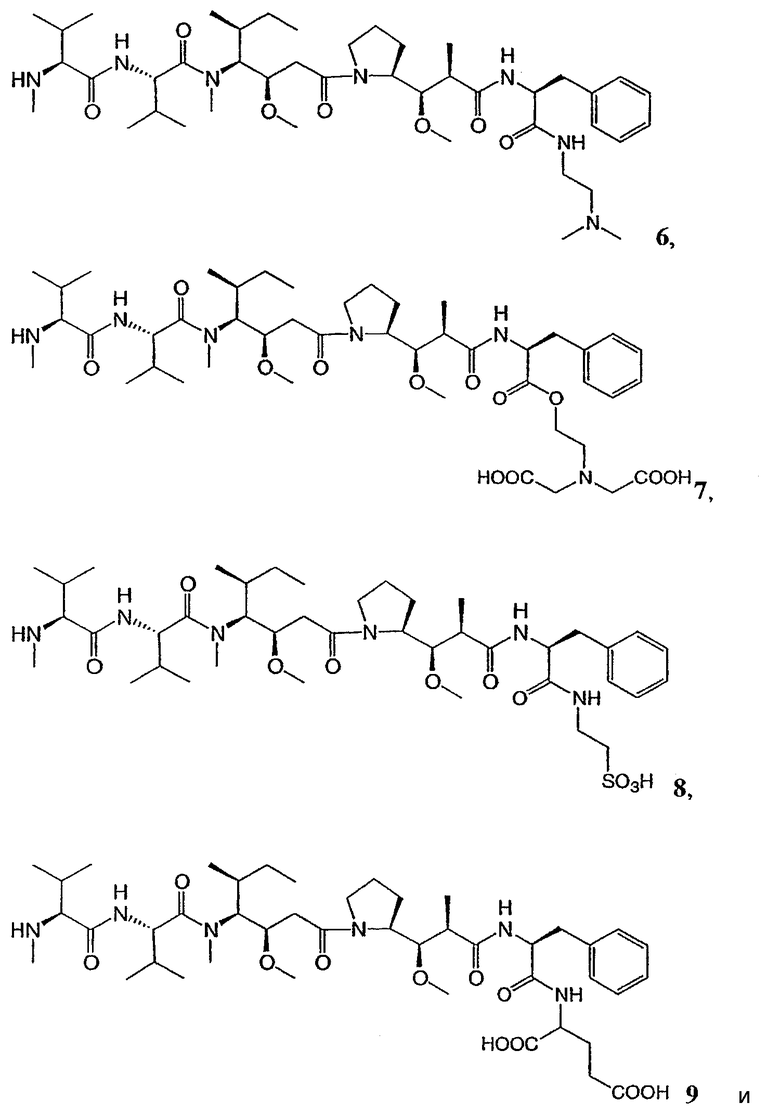
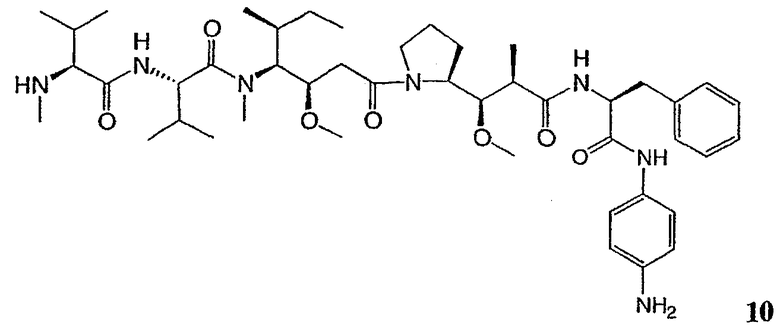
и их фармацевтически приемлемые соли или сольваты.
СОЕДИНЕНИЯ ФОРМУЛЫ (Ic)
В другом своем аспекте настоящее изобретение относится к соединениям-конъюгатам “антитело-лекарственное средство” (ADC) формулы Ic:
содержащим антитело, ковалентно связанное с одним или несколькими компонентами (молекулами) лекарственного средства. Указанные соединения в виде конъюгата “антитело-лекарственное средство” включают их фармацевтически приемлемые соли или сольваты.
В соединениях формулы Ic:
Ab представляет собой антитело, которое связывается с одним или несколькими рецепторами опухолеассоциированного антигена, такими как рецепторы (1)-(35):
(1) BMPR1B (рецептор белка морфогенеза кости типа IB, Genbank рег. № NM_001203);
(2) Е16 (LAT1, SLC7A5, Genbank рег. № NM_003486);
(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы, Genbank рег. № NM_012449);
(4) 0772Р (СА125, MUC16, Genbank рег. № AF361486);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, Genbank рег. № NM_005823);
(6) Napi3b (NAPI-3B, NpTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II, Genbank рег. № NM_006424);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен (семафорин) 5В, Genbank рег. № АВ040878);
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, кДНК RIKEN 2700050C12, кДНК гена RIKEN 2700050C12, Genbank рег. № AY358628);
(9) ETBR (рецептор эндотелина типа В, Genbank рег. № AY275463);
(10) MSG783 (RNF124, гипотетический белок FLJ20315, Genbank рег. № NM_017763);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы, Genbank рег. № AF455138);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М, Genbank рег. № NM_017636);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы, Genbank рег. № NP_003203 или NM_003212);
(14) CD21 (CR2 (рецептор комплемента 2), или C3DR (C3d/рецептор вируса Эпштейна-Барра), или Hs.73792, Genbank рег. № M26004);
(15) CD79b (CD79B, CD79β, IGb (бета-белок, связанный с иммуноглобулином), В29, Genbank рег. № NM_000626);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C, Genbank рег. № NM_030764);
(17) HER2 (Genbank рег. № M11730);
(18) NCA (Genbank рег. № М18728);
(19) MDP (Genbank рег. № BC017023);
(20) IL20Rα (Genbank рег. № AF184971);
(21) Brevican (Genbank рег. № AF229053);
(22) Ephb2R (Genbank рег. № NM_004442);
(23) ASLG659 (Genbank рег. № AX092328);
(24) PSCA (Genbank рег. № AJ297436);
(25) GEDA (Genbank рег. № AY260763);
(26) BAFF-R (рецептор фактора активации В-клеток, рецептор BLys 3, BR3, NP_443177.1);
(27) CD22 (В-клеточный рецептор, изоформа CD22-В, NP-001762.1);
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок, В-клетко-специфический белок, который ковалентно взаимодействует с Ig бета (CD79B) и образует комплекс с молекулами IgM на поверхности клеток, передавая сигнал, участвующий в дифференцировке В-клеток, Genbank рег. № NP_001774.1);
(29) CXCR5 (рецептор 1 лимфомы Беркитта, рецептор, связанный с G-белком и активируемый хемокином CXCL13, обеспечивает миграцию лимфоцитов и гуморальную защиту, а также играет определенную роль в инфицировании вирусом ВИЧ-2 и, вероятно, в развитии СПИД'а, лимфомы, миеломы и лейкоза, Genbank рег. № NP_001707.1);
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Ia), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам, Genbank рег. № NP_002111.1);
(31) Р2Х5 (ионный канал -5, открываемый лигандом пуринергического рецептора Р2Х; ионный канал, открываемый внеклеточным АТР, может участвовать в синаптической передаче и в нейрогенезе, а его дефицит может играть определенную роль в патофизиологии идиопатической дисфункции мочевого пузыря, Genbank рег. № NP_002552.2);
(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2, Genbank рег. № NP_001773.1);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок, относящийся к семейству белков с богатыми лейцином повторами (LRR), типа I, который регулирует активацию и апоптоз В-клеток, и потеря функции этого белка ассоциируется с прогрессированием у пациентов системной красной волчанки, Genbank рег. № NP_005573.1);
(34) FCRH1 (Fc-рецептор-подобный белок 1, предполагаемый рецептор для Fc-домена иммуноглобулина, который содержит Ig-подобные домены типа С2 и домены ITAM и может играть определенную роль в дифференцировке В-лимфоцитов, Genbank рег. № NP_443170.1); и
(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2, предполагаемый иммунорецептор, который, возможно, играет определенную роль в развитии В-клеток и в лимфомагенезе; причем в некоторых злокачественных В-клетках наблюдается нарушение регуляции гена посредством транслокации, Genbank рег. № NP_112571.1).
А представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y означает спейсерный компонент,
у равно 0, 1 или 2,
р составляет в пределах от 1 примерно до 8; и
D представляет собой лекарственное средство, выбранное из соединений формул DE и DF:
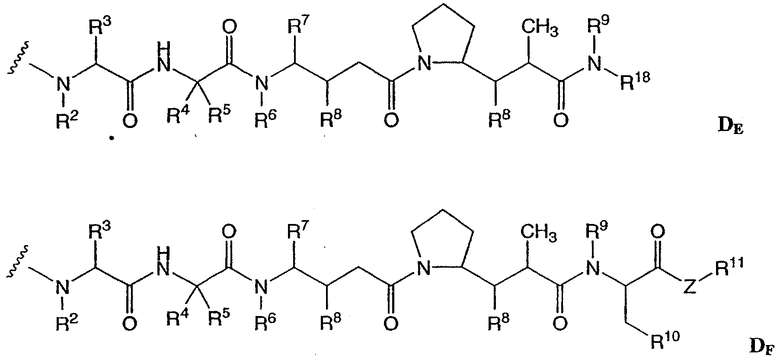
где волнистая линия в DE и DF означает сайт ковалентного связывания с А, W или Y и где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или -(R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, -(СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН,
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла); и
n равно целому числу от 0 до 6.
В одном из вариантов изобретения -Ww- представляет собой -Val-Cit.
В другом варианте изобретения R3, R4 и R7 независимо представляют собой изопропил или втор-бутил, а R5 представляет собой -Н. В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, R5 представляет собой -Н, R7 представляет собой втор-бутил.
В еще одном варианте изобретения каждый из R2 и R6 представляет собой метил, а R9 представляет собой -Н.
В другом варианте изобретения каждый R8 представляет собой -OCH3.
В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, каждый из R2 и R6 представляет собой метил, R5 представляет собой -Н, R7 представляет собой втор-бутил, каждый из R8 представляет собой -OCH3, а R9 представляет собой -Н.
В одном из вариантов изобретения Z представляет собой -О- или -NH-.
В одном из вариантов изобретения R10 представляет собой арил.
В репрезентативном варианте изобретения R10 представляет собой фенил.
В репрезентативном варианте изобретения, если Z представляет собой -О-, то R11 представляет собой -Н, метил или трет-бутил.
В одном из вариантов изобретения если Z представляет собой -NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-N(R16)2, а R16 представляет собой С1-С8алкил или -(СН2)n-СООН.
В другом варианте изобретения если Z представляет собой -NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-SO3H.
Репрезентативные варианты ADC формулы Ic имеют следующие структуры:
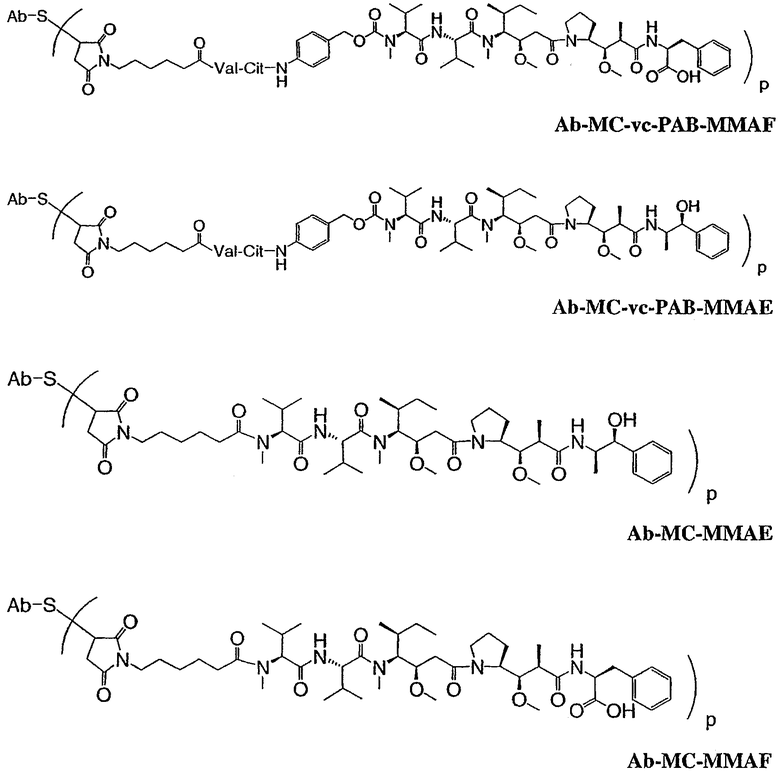
где Ab представляет собой антитело, которое связывается с одним или несколькими рецепторами опухолеассоциированного антигена (1)-(35); Val представляет собой валин, а Cit представляет собой цитруллин.
Нагрузка лекарственного средства определяется числом р, то есть средним числом молекул лекарственного средства на антитело молекуле формулы I. Нагрузка лекарственного средства может составлять от 1 до 20 молекул лекарственного средства (D) на антитело (Ab или mAb). Композиции ADC формулы I включают наборы антител, конъюгированных с 1-20 молекулами лекарственных средств. Среднее число молекул лекарственных средств на антитело в препаратах ADC, полученных с помощью реакции конъюгирования, может быть определено стандартными методами, такими как спектроскопия в УФ-диапазоне/в видимом диапазоне спектра, масс-спектроскопия, ELISA-анализ и ВЭЖХ. Количественное распределение ADC может быть также выражено символом р. В некоторых случаях выделение, очистка и идентификация гомогенных конъюгатов ADC, где р имеет определенную величину, от конъюгатов ADC с другой нагрузкой лекарственного средства могут быть достигнуты такими методами, как обращенно-фазовая ВЭЖХ или электрофорез.
Для некоторых конъюгатов “антитело-лекарственное средство” р может быть ограничен числом сайтов связывания на антителе. Так, например, если сайтом присоединения является тиол цистеина, как определено выше в репрезентативных вариантах изобретения, то антитело может иметь только одну или несколько тиоловых групп цистеина, или оно может иметь только одну или несколько достаточно реакционноспособных тиоловых групп, посредством которых может быть присоединен линкер.
Обычно, в процессе реакции конъюгирования, с антителом может быть конъюгировано менее чем теоретически максимальное количество молекул лекарственного средства. Антитело может содержать, например, много лизиновых остатков, которые не реагируют с промежуточным соединением “лекарственное средство-линкер” или с линкерным реагентом. С линкерным реагентом, реагирующим с амином, могут взаимодействовать лишь наиболее реакционноспособные группы лизина. Вообще говоря, антитела не содержат много, если они вообще присутствуют, свободных и реакционноспособных тиоловых групп цистеина, которые могут быть связаны с молекулой лекарственного средства. Большинство тиоловых групп цистеиновых остатков в антителах соединений согласно изобретению присутствует в виде дисульфидных мостиков и должно восстанавливаться под действием восстановителя, такого как дитиотреитол (ДТТ). Кроме того, для выявления реакционноспособных нуклеофильных групп, таких как лизиновые или цистеиновые группы, такое антитело должно быть помещено в денатурирующие условия. Нагрузка (отношение лекарственное средство/антитело) ADC может регулироваться несколькими различными способами, включая: (i) ограничение молярного избытка промежуточного соединения “лекарственное средство-линкер” или линкерного реагента по отношению к антителу, (ii) ограничения времени или температуры реакции конъюгирования и (iii) создание частичных или ограничивающих восстановительных условий для модификации тиоловой группы цистеина.
Следует отметить, что в том случае, если с промежуточным соединением “лекарственное средство-линкер” или с линкерным реагентом, за которым расположена молекула лекарственного средства, реагирует более, чем одна нуклеофильная группа, то полученный продукт представляет собой смесь соединений ADC с соответствующим распределением одной или нескольких молекул лекарственного средства, присоединенных к антителу. Среднее число молекул лекарственного средства на антитело может быть вычислено с помощью ELISA-анализа указанной смеси с применением двух антител, одно из которых (“второе” антитело) является специфичным к антителу, а другое является специфичным к лекарственному средству. Отдельные молекулы ADC могут быть идентифицированы в смеси с помощью масс-спектроскопии и разделены с помощью ВЭЖХ, например гидрофобной хроматографии (“Effect of drug loading on the pharmacology, pharmacokinetics and toxicity of an anti-CD30 antibody-drug conjugate”, Hamblett K.J. et al., Abstract № 624, American Association for Cancer Research; 2004 Annual Meeting, March 27-31, 2004, Proccedings of the AACR, Volume 45, March 2004; “Controlling the Location of Drug Attachement in Antibody-Drug Conjugates”, Alley S.C. et al. Abstract № 627, American Association for Cancer Research; 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004). Таким образом, гомогенный ADC с одной величиной нагрузки может быть выделен из смеси конъюгатов путем электрофореза или хроматографии.
4.3. Линкерный компонент
“Линкерный компонент” (LU) представляет собой бифункциональное соединение, которое может быть использовано для связывания молекулы лекарственного средства и лиганда с образованием конъюгатов “лекарственное средство-линкер-лиганд” или которое может быть использовано для получения иммуноконъюгатов, направленных против опухолеассоциированных антигенов. Такие иммуноконъюгаты могут обеспечивать селективную доставку токсических лекарственных средств в опухолевые клетки. В одном из вариантов изобретения линкерный компонент соединения “лекарственное средство-линкер” и конъюгата “лекарственное средство-линкер-лиганд” имеет формулу:
-Aa--Ww--Yy-
где: -А- представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый -W- независимо представляет собой аминокислотный компонент,
w независимо равно целому числу от 0 до 12,
-Y- означает спейсерный компонент,
у равно 0, 1 или 2.
В конъюгате “лекарственное средство-линкер-лиганд” линкер способен связывать молекулу лекарственного средства и лиганд.
4.3.1. Удлиняющий компонент
Удлиняющий компонент (-А-), если он присутствует, способен связывать лигандный компонент с аминокислотным компонентом (-W-). В этом случае лиганд (L) имеет функциональную группу, которая может образовывать связь с функциональной группой удлиняющего компонента. Подходящими функциональными группами, которые могут присутствовать на лиганде и которые могут быть либо природными, либо химически синтезированными, являются, но не ограничиваются ими, сульфгидрил (-SH), амино, гидроксил, карбокси, аномерная гидроксильная группа углевода и карбоксил. В одном аспекте изобретения функциональными группами лиганда являются сульфгидрил и амино. Сульфгидрильные группы могут образовываться путем восстановления внутримолекулярной дисульфидной связи лиганда. Альтернативно сульфгидрильные группы могут образовываться посредством взаимодействия аминогруппы лизиновой молекулы лиганда в присутствии 2-иминотиолана (реагента Траута) или другого сульфгидрил-образующего реагента.
В одном из вариантов изобретения указанный удлиняющий компонент образует связь с атомом серы лигандного компонента. Этот атом серы может происходить от сульфгидрильной группы лиганда. Репрезентативный удлиняющий компонент данного варианта настоящего изобретения обозначен квадратными скобками в формулах IIIa и IIIb, где L-, -W-, -Y-, -D, w и y определены выше, а R17 выбран из -С1-С10алкилена, -С3-С8карбоцикло-, -О-(С1-С8алкила)-, арилена, -С1-С10алкиленарилена, -арилен-С1-С10алкилена, -С1-С10алкилен-(С3-С8карбоцикло)-, -(С3-С8карбоцикло)-С1-С10алкилена, -С3-С8гетероцикло, -С1-С10алкилен-(С3-С8гетероцикло)-, -(С3-С8гетероцикло)-С1-С10алкилена, -(СН2СН2О)r и -(СН2СН2О)r-СН2-; и r означает целое число от 1 до 10. Следует отметить, что все репрезентативные варианты соединений формулы Ia, таких как III-VI, которые, даже если это не указано конкретно, содержат от 1 до 20 молекул лекарственного средства, связаны с лигандом (р=1-20).
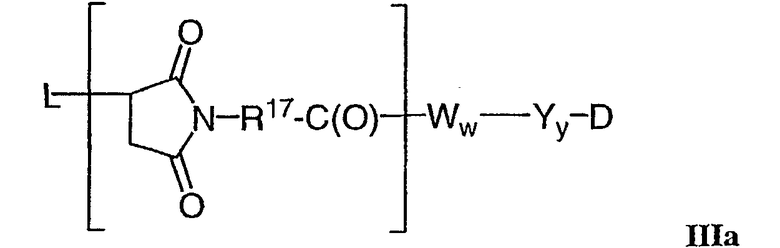
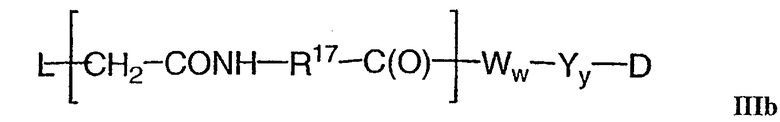
Репрезентативным примером удлиняющего компонента является компонент формулы IIIa, где R17 представляет собой -(СН2)5-:
Другим репрезентативным примером удлиняющего компонента является компонент формулы IIIa, где R17 представляет собой -(СН2СН2О)r-СН2-, а r равно 2:
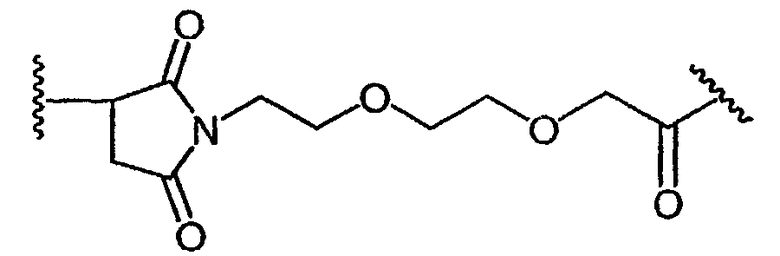
Еще одним репрезентативным примером удлиняющего компонента является компонент формулы IIIb, где R17 представляет собой -(СН2)5-:
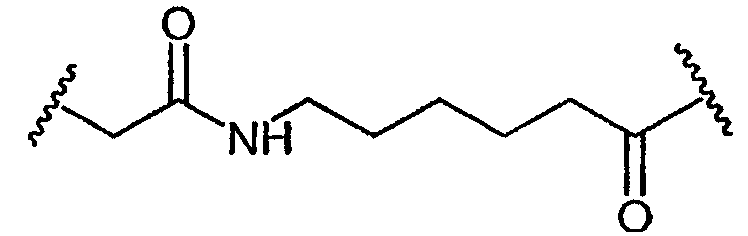
В другом варианте изобретения удлиняющий компонент связан с лигандным компонентом посредством дисульфидной связи между атомом серы лигандного компонента и атомом серы удлиняющего компонента. Репрезентативный удлиняющий компонент данного варианта настоящего изобретения обозначен квадратными скобками в формуле IV, где R17, L-, -W-, -Y-, -D, w и y определены выше.
В еще одном варианте изобретения реакционноспособная группа указанного удлиняющего компонента содержит реактивный сайт, который может образовывать связь с первичной или вторичной аминогруппой лиганда. Примерами таких реактивных сайтов являются, но не ограничиваются ими, активированные сложные эфиры, такие как сукцинимидоэфиры, 4-нитрофениловые эфиры, пентафторфениловые эфиры, тетрафторфениловые эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты. Репрезентативный удлиняющий компонент данного варианта настоящего изобретения обозначен квадратными скобками в формулах Va и Vb, где R17, L-, -W-, -Y-, -D, w и y определены выше;
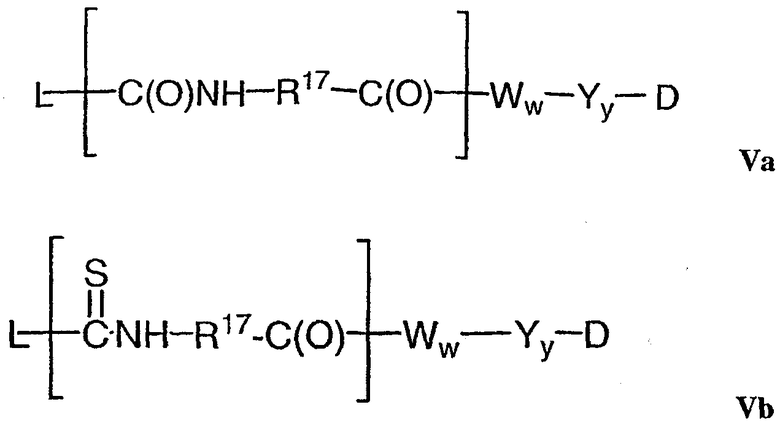
В еще одном варианте изобретения реакционноспособная группа указанного удлиняющего компонента содержит реактивный сайт, способный реагировать с модифицированной углеводной группой (-СНО), которая может присутствовать на лиганде. Так, например, углевод может быть слабо окислен таким реагентом, как периодат натрия, а полученная группа (-СНО) окисленного углевода может быть конденсирована с удлиняющим компонентом, содержащим функциональную группу, такую как гидразид, оксим, первичный или вторичный амин, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид, описанные у Kaneko T. et al. (1991) Bioconjugate Chem. 2:133-41. Репрезентативный удлиняющий компонент данного варианта настоящего изобретения обозначен квадратными скобками в формулах VIa, VIb и VIc, где -R17, L-, -W-, -Y-, -D, w и y определены выше.
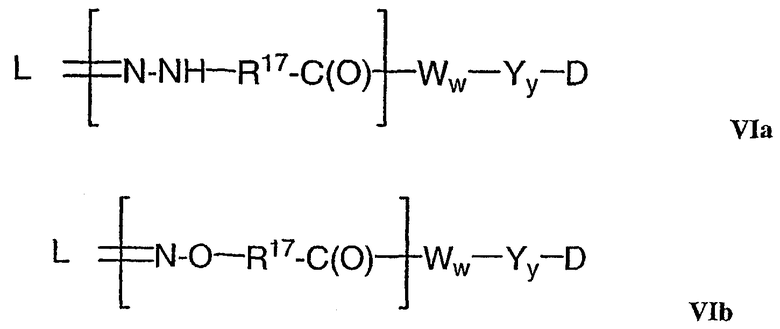
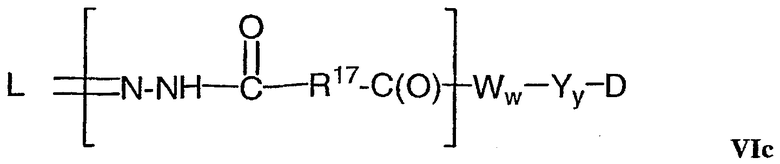
4.3.2. Аминокислотный компонент
Аминокислотный компонент (-W-), если он присутствует, связывает удлиняющий компонент со спейсерным элементом, если такой спейсерный компонент присутствует, связывает указанный удлиняющий компонент с молекулой лекарственного средства, если указанный спейсерный компонент отсутствует, и связывает лигандный компонент с молекулой лекарственного средства, если указанный удлиняющий компонент и спейсерный компонент отсутствуют.
Ww- представляет собой дипептидный, трипептидный, тетрапептидный, пентапептидный, гексапептидный, гептапептидный, октапептидный, нонапептидный, декапептидный, ундекапептидный или додекапептидный компонент. Каждый из компонентов -W- независимо имеет формулу, представленную ниже в квадратных скобках, а w означает целое число от 0 до 12:
где R19 представляет собой водород, метил, изопропил, изобутил, втор-бутил, бензил, п-гидроксибензил, -СН2ОН, -СН(ОН)СН3, -CH2CH2SCH3, -CH2CONH2, -СН2СООН, -CH2CH2CONH2, -СН2СН2СООН, -(СН2)3NHC(=NH)NH2, -(СН2)3NH2, -(СН2)3NHCOCH3, -(СН2)3NHCHO, -(СН2)4NHC(=NH)NH2, -(СН2)4NH2, -(СН2)4NHCOCH3, -(СН2)4NHCHO, -(СН2)3NHCONH2, -(СН2)4NHCONH2, -СН2СН2СН(ОН)CH2NH2, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, фенил, циклогексил.
Аминокислотный компонент может быть ферментативно расщеплен одним или несколькими ферментами, включая опухолеассоциированную протеазу, с высвобождением молекулы лекарственного средства (-D), которая, В одном из вариантов изобретения после высвобождения подвергается протонированию in vivo с образованием лекарственного средства (D). Репрезентативные компоненты Ww представлены формулами (VII)-(IX):
где R20 и R21 имеют следующие значения:
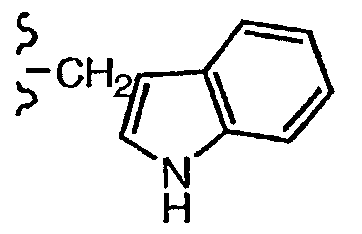
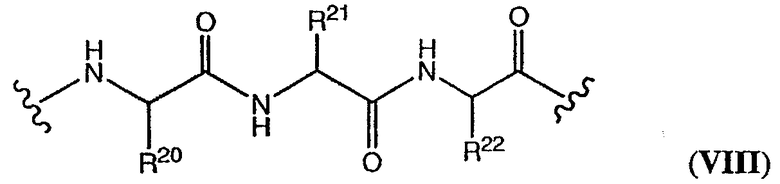
где R20, R21 и R22 имеют следующие значения:
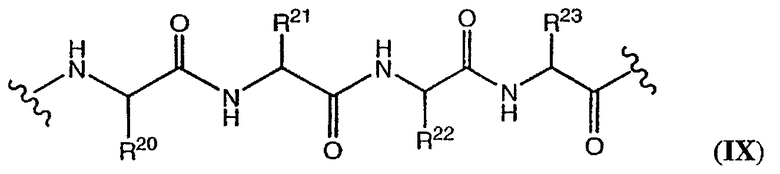
где R20, R21, R22 и R23 имеют следующие значения:
Репрезентативными аминокислотными компонентами являются, но не ограничиваются ими, компоненты формулы (VII), где: R20 представляет собой бензил, а R21 представляет собой -(СН2)4NH2; R20 представляет собой изопропил, а R21 представляет собой -(СН2)4NH2; R20 представляет собой изопропил, а R21 представляет собой -(СН2)3NHCONH2. Другим репрезентативным аминокислотным компонентом является компонент формулы (VIII), где R20 представляет собой бензил, R21 представляет собой бензил, а R22 представляет собой -(СН2)4NH2.
Подходящие компоненты -Ww- могут быть получены и оптимизированы по их селективности в отношении ферментативного расщепления конкретными ферментами, например опухолеассоциированной протеазой. В одном из вариантов изобретения компонентом -Ww- является компонент, отщепление которого катализируется катепсином В, С и D или плазмин-протеазой.
В одном из вариантов изобретения компонент -Ww- представляет собой дипептид, трипептид, тетрапептид или пентапептид.
Если R19, R20, R21, R22 или R23 не являются водородом, то атом углерода, через который связаны R19, R20, R21, R22 или R23, является хиральным.
Каждый атом углерода, через который связаны R19, R20, R21, R22 или R23, независимо имеет (S)- или (R)-конфигурацию.
В одном из вариантов аминокислотного компонента указанным аминокислотным компонентом является валин-цитруллин. В другом варианте аминокислотный компонент представляет собой фенилаланин-лизин (то есть fk). В другом варианте аминокислотного компонента указанным аминокислотным компонентом является N-метилвалин-цитруллин. В еще одном аспекте аминокислотный компонент представляет собой 5-аминовалериановую кислоту, гомофенилаланин-лизин, тетраизохинолинкарбоксилат-лизин, циклогексилаланин-лизин, изонипекотиновую кислоту-лизин, бета-аланин-лизин, глицин-серин-валин-глутамин и изонипекотиновую кислоту.
В некоторых вариантах изобретения аминокислотный компонент может содержать природные аминокислоты. В других вариантах изобретения аминокислотный компонент может содержать неприродные аминокислоты.
4.3.3. Спейсерный компонент
Спейсерный компонент (-Y-), если он присутствует, связывает аминокислотный компонент с молекулой лекарственного средства, если такой аминокислотный компонент присутствует. Альтернативно указанный спейсерный компонент связывает удлиняющий компонент с молекулой лекарственного средства, если такой аминокислотный компонент отсутствует. Указанный спейсерный компонент также связывает молекулу лекарственного средства с лигандным компонентом, если отсутствует как аминокислотный компонент, так и удлиняющий компонент.
Спейсерными компонентами являются компоненты двух общих типов: самоэлиминирующиеся и не-самоэлиминирующиеся. Не-самоэлиминирующийся спейсерный компонент представляет собой компонент, где весь спейсерный компонент или его часть остается связанным с молекулой лекарственного средства после отщепления, а в частности ферментативного отщепления аминокислотного компонента от конъюгата “лекарственное средство-линкер-лиганд” или от соединения “лекарственное средство-линкер”. Примерами не-самоэлиминирующегося спейсерного компонента являются, но не ограничиваются ими, глицин-глициновый спейсерный компонент и глициновый спейсерный компонент (оба они представлены на схеме 1) (см. ниже). Если репрезентативное соединение, содержащее глицин-глициновый спейсерный компонент или глициновый спейсерный компонент, подвергается ферментативному расщеплению посредством опухолеассоциированной протеазы, ассоциированной с раковыми клетками протеазы или ассоциированной с лимфоцитами протеазы, то молекула глицин-глицин-лекарственное средство или молекула глицин-лекарственное средство отщепляется от L-Aa-Ww. В одном из вариантов изобретения независимая реакция гидролиза происходит в клетках-мишенях и приводит к расщеплению связи в молекуле глицин-лекарственное средство с высвобождением лекарственного средства.
В другом варианте изобретения -Yy- представляет собой п-аминобензиловый спирт (РАВ) (см. схемы 2 и 3), фениленовая часть которого замещена Qm, где Q представляет собой -С1-С8алкил, -О-(С1-С8алкил), галоген, нитро или циано, а m равно целому числу от 0 от 4.
Схема 1
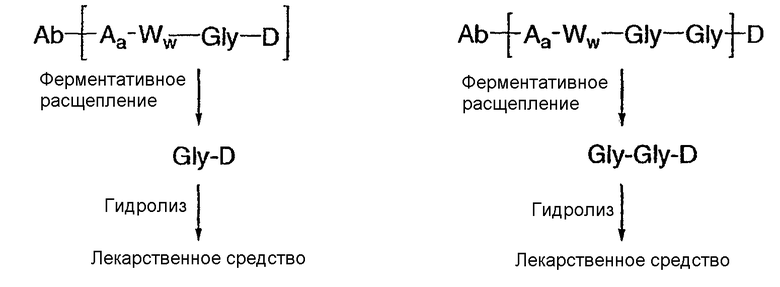
В одном из вариантов изобретения не-самоэлиминирующийся спейсерный компонент (-Y-) представляет собой -Gly-Gly-. В другом варианте изобретения не-самоэлиминирующийся спейсерный компонент (-Y-) представляет собой -Gly-.
В одном из своих вариантов настоящее изобретение относится к соединению “лекарственное средство-линкер” или конъюгату “лекарственное средство-линкер-лиганд”, где спейсерный компонент отсутствует (у=0), или к их фармацевтически приемлемой соли или сольвату.
Альтернативно, репрезентативное соединение, содержащее самоэлиминирующийся спейсерный компонент, может высвобождать -D, и при этом не требуется проведения отдельной стадии гидролиза. В этом варианте -Y- представляет собой группу РАВ, которая связана с Ww через атом азота аминогруппы РАВ и которая непосредственно связана с -D через карбонатную, карбаматную или эфирную группу. Не ограничиваясь какой-либо конкретной теорией или механизмом, авторы представляют ниже схему 2, на которой проиллюстрирован возможный механизм отщепления лекарственного средства от группы РАВ, которая непосредственно присоединена к -D через карбаматную или карбонатную группу, и этот механизм описан в работе Toki et al., (2002) J.Org.Chem.67:1866-1872.
Схема 2
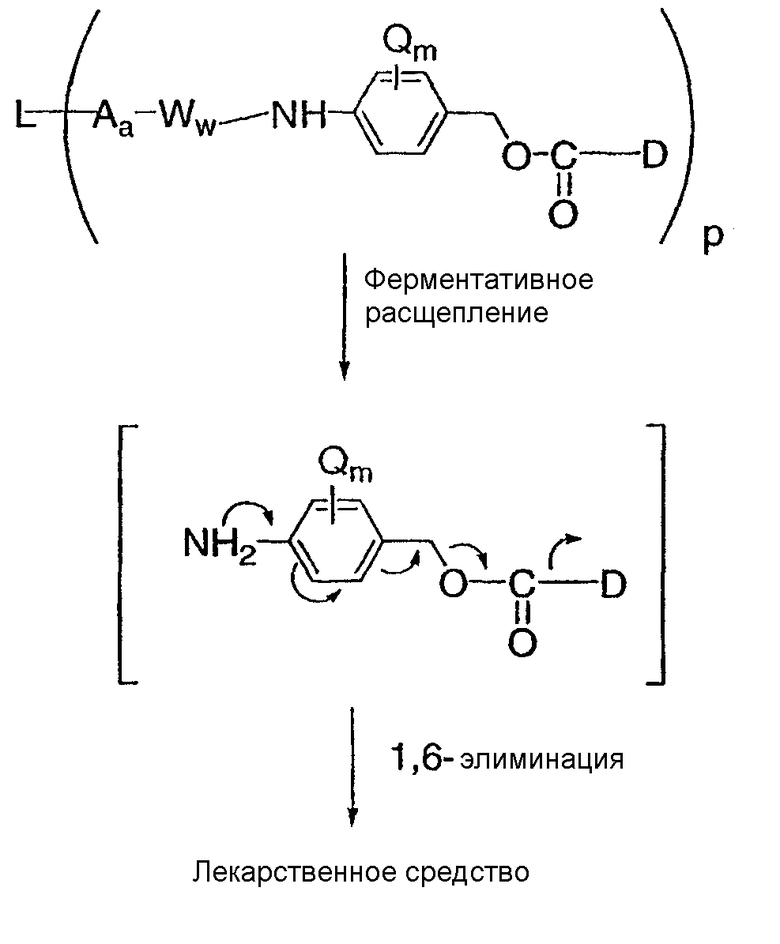
где Q представляет собой С1-С8алкил, -О(С1-С8алкил), галоген, нитро или циано; m представляет собой целое число от 0 до 4, а р составляет примерно от 1 до 20.
Не ограничиваясь какой-либо конкретной теорией или механизмом, авторы представляют ниже схему 3, на которой проиллюстрирован возможный механизм отщепления лекарственного средства от группы РАВ, которая присоединена к -D посредством эфирной или аминовой связи.
Схема 3
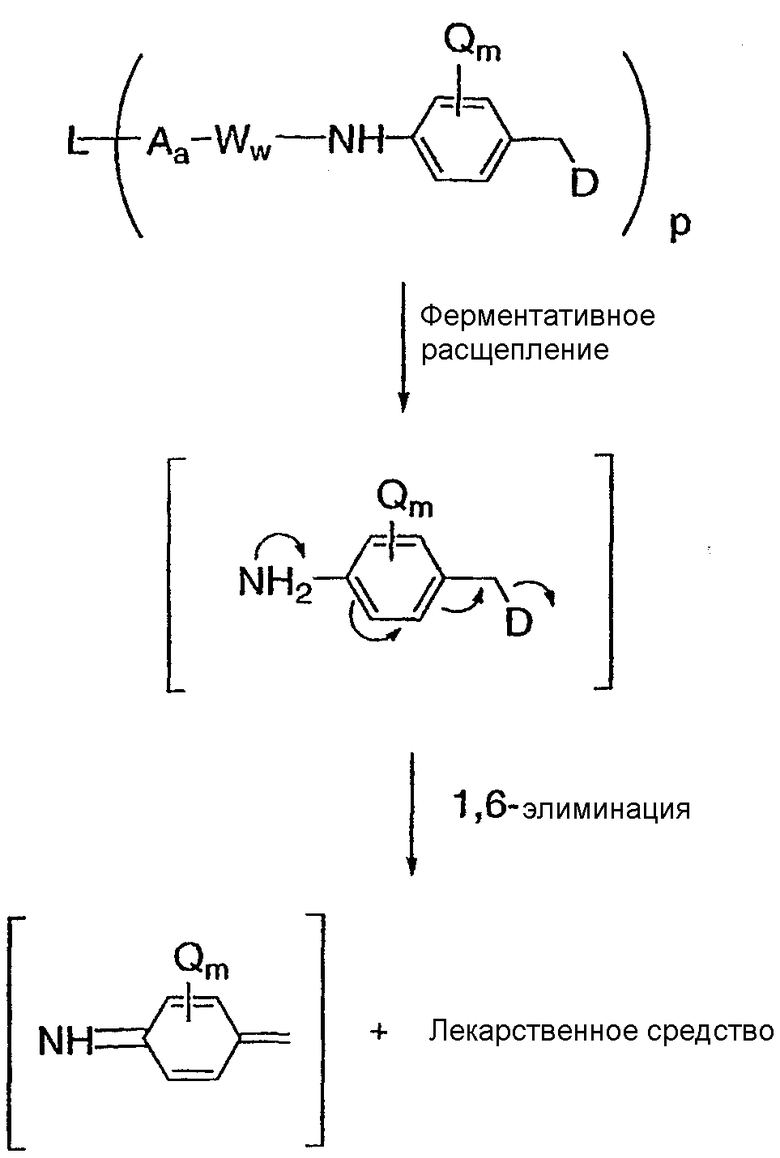
где Q представляет собой -С1-С8алкил, -О(С1-С8алкил), галоген, нитро или циано; m представляет собой целое число от 0 до 4, а р составляет примерно от 1 до 20.
Другими примерами самоэлиминирующихся спейсеров являются, но не ограничиваются ими, ароматические соединения, которые, по своим электронным свойствам, аналогичны группе РАВ, такие как производные 2-аминоимидазол-5-метанола (Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237) и орто- или пара-аминобензилацетали. Могут быть также использованы спейсеры, которые подвергаются циклизации после гидролиза амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al., Chemistry Biology, 1995, 2, 223), соответствующим образом замещенные бицикло[2.2.1]- и бицикло[2.2.2]-циклические системы (Storm et al., J. Amer. Chem. Soc. 1972, 94, 5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry et al., J. Org. Chem., 1990, 55, 5867). Элиминирующиеся амин-содержащие лекарственные средства, которые замещены в α-положении глицина (Kingsbury et al., J. Med. Chem. 1984, 27, 1447), также являются примерами самоэлиминирующихся спейсеров, используемых в репрезентативных соединениях.
В одном из вариантов изобретения спейсерный компонент представляет собой разветвленный бис(гидроксиметил)стирол (BHMS), показанный на схеме 4, и может быть использован для включения и высвобождения множества лекарственных средств.
Схема 4
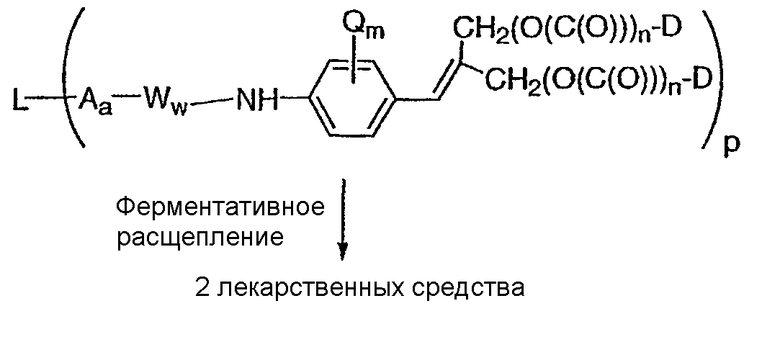
где Q представляет собой -С1-С8алкил, -О(С1-С8алкил), галоген, нитро или циано; m представляет собой целое число от 0 до 4, n составляет 0 или 1, а р составляет примерно от 1 до 20.
В одном из вариантов изобретения молекулы -D являются одинаковыми. В другом варианте изобретения молекулы -D являются различными.
В одном аспекте изобретения спейсерные компоненты (-Yy-) представлены формулами (Х)-(XII):
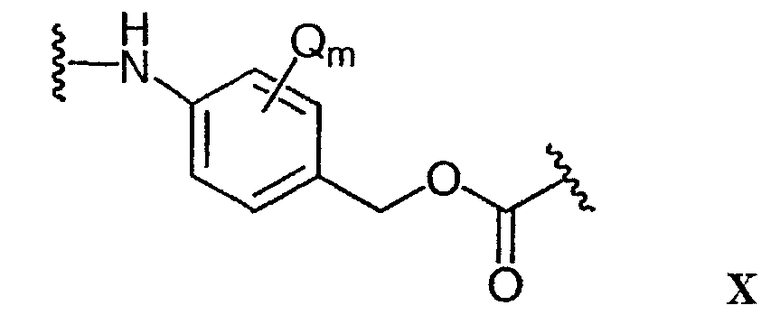
где Q представляет собой -С1-С8алкил, -О(С1-С8алкил), галоген, нитро или циано; а m равно целому числу от 0 до 4;
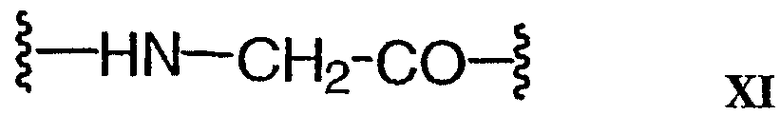
и
Вариантами соединений-конъюгатов “антитело-лекарственное средство” формул 1а' и Ic являются:
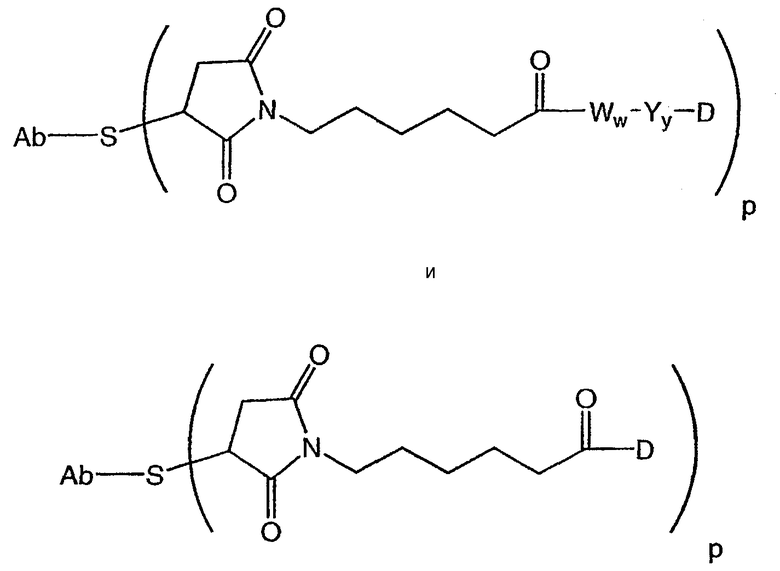
где каждый из w и у равен 0.
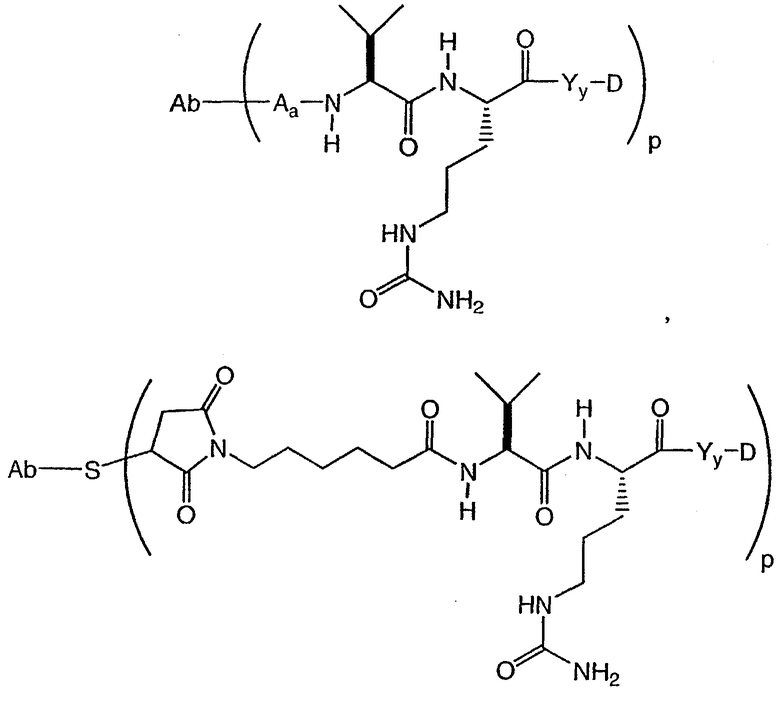 и
и
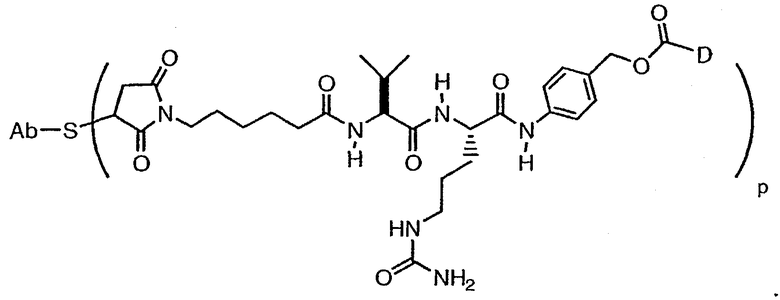
4.4. Компонент “лекарственное средство” (молекула)
Молекула лекарственного средства (D) конъюгатов “антитело-лекарственное средство” (ADC) относится к типу доластатина/ауристатина (патенты США № 5635483; 5780588), которые, как было показано, негативно влияют на динамику образования микрососудов, на гидролиз GTP и деление ядер и клеток (Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противораковой (патент США № 5663149) и противогрибковой активностью (Pettit et al. (1998) Antimicrob. Agents. Chemother. 42:2961-2965).
D представляет собой компонент “лекарственное средство” (молекулу), имеющую атом азота, который может образовывать связь со спейсерным компонентом, если у=1 или 2, с С-концевой карбоксильной группой аминокислотного компонента, если у=0, с карбоксильной группой удлиняющего компонента, если w и у =0, и с карбоксильной группой компонента “лекарственное средство”, если а, w и у=0. Следует отметить, что термины компонент “лекарственное средство” и “молекула лекарственного средства” являются синонимами и взаимозаменяемыми терминами.
В одном из вариантов изобретения -D представляет собой соединение формул DE или DF:
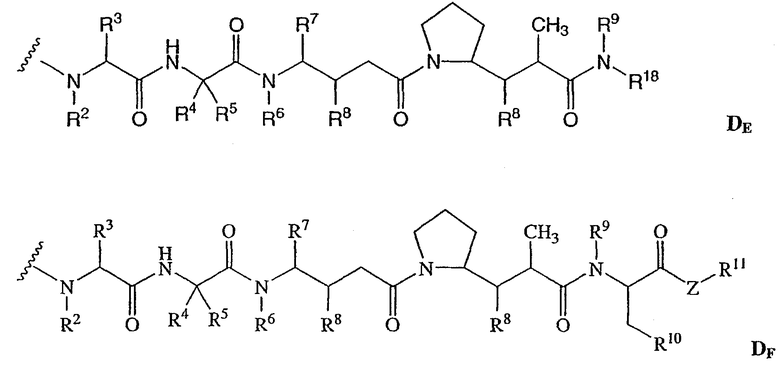
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, -(СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН,
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла); и
n равно целому числу от 0 до 6.
В одном из вариантов изобретения R3, R4 и R7 независимо представляют собой изопропил или втор-бутил, а R5 представляет собой -Н. В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, R5 представляет собой -Н, а R7 представляет собой втор-бутил.
В другом варианте изобретения каждый из R2 и R6 представляет собой метил, а R9 представляет собой -Н.
В еще одном варианте изобретения каждый из R8 представляет собой -OCH3.
В репрезентативном варианте изобретения каждый из R3 и R4 представляет собой изопропил, каждый из R2 и R6 представляет собой метил, R5 представляет собой Н, R7 представляет собой втор-бутил, каждый из R8 представляет собой -OCH3, а R9 представляет собой -Н.
В одном из вариантов изобретения Z представляет собой -О- или -NH-.
В одном из вариантов изобретения R10 представляет собой арил.
В репрезентативном варианте изобретения R10 представляет собой фенил.
В репрезентативном варианте изобретения, если Z представляет собой -О-, то R11 представляет собой Н, метил или трет-бутил.
В одном из вариантов изобретения если Z представляет собой -NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-N(R16)2, а R16 представляет собой -С1-С8алкил или -(СН2)n-СООН.
В другом варианте изобретения если Z представляет собой -NH, то R11 представляет собой -СН(R15)2, где R15 представляет собой -(СН2)n-SO3H.
Репрезентативными компонентами “лекарственное средство” (-D) являются молекулы лекарственного средства, имеющие следующие структуры:
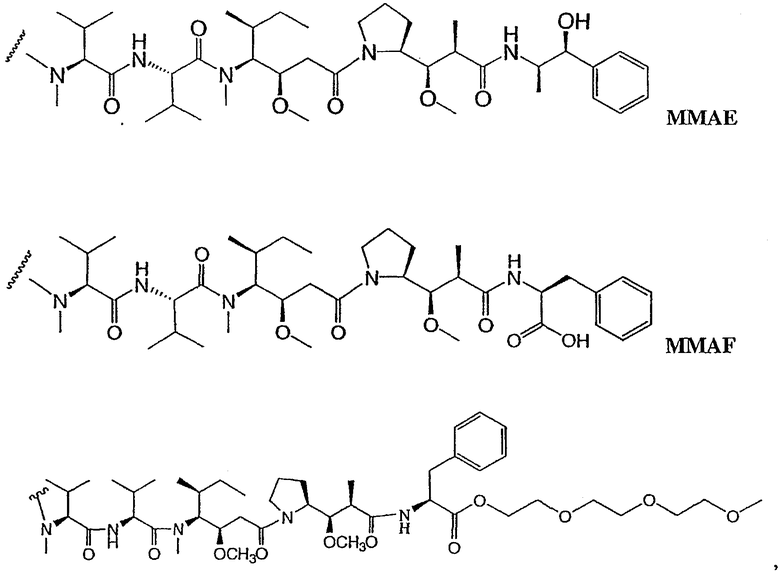
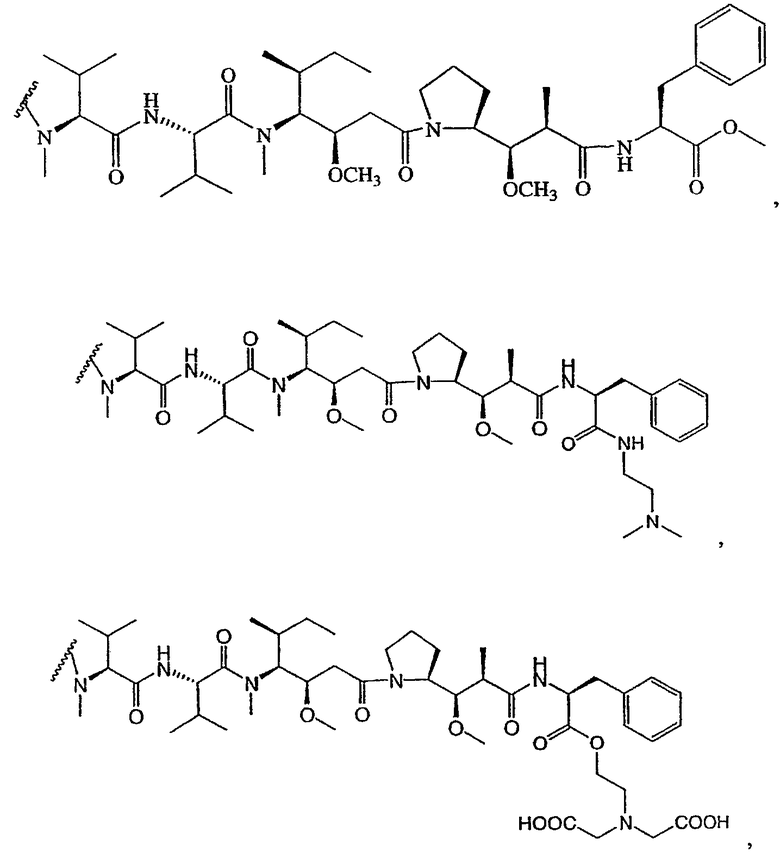
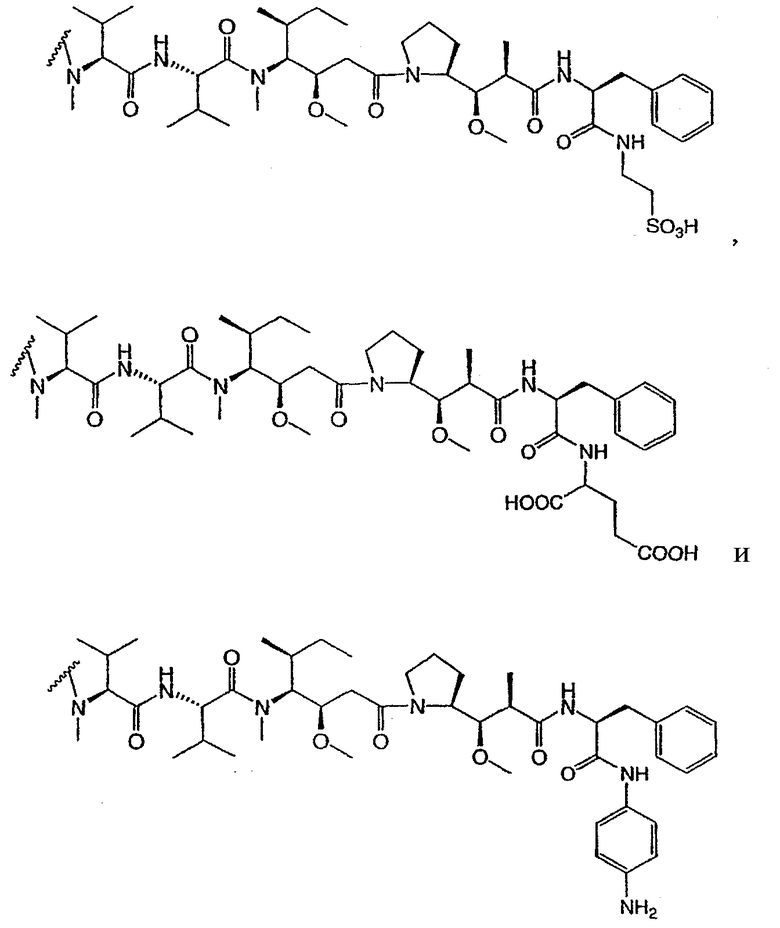
и их фармацевтически приемлемые соли или сольваты.
В одном из аспектов изобретения гидрофильные группы, такие как, без ограничения, сложные эфиры триэтиленгликоля (ТЭГ), как показано выше, могут быть присоединены к компоненту “лекарственное средство”, представленному R11. Не претендуя на какую-либо конкретную теорию, авторы считают, что гидрофильные группы способствуют интернализации и препятствуют агломерации компонента “лекарственное средство”.
4.5. Лигандный компонент
В объем лигандного компонента (L-) входит любой компонент лиганда (L), который связывается, или посредством реакции ассоциируется, или образует комплексы с рецептором, антигеном или с другой восприимчивой молекулой, ассоциированными с данной популяцией клеток-мишеней. Лиганд представляет собой молекулу, которая связывается, образует комплексы или реагирует с частью клеточной популяции, анализируемой на терапевтическую или какую-либо другую биологическую модификацию. В одном из аспектов изобретения лигандный компонент доставляет компонент “лекарственное средство” к конкретной популяции клеток-мишеней, с которыми реагирует этот лигандный компонент. Такими лигандами являются, но не ограничиваются ими, высокомолекулярные белки, такие как, например, полноразмерные антитела, фрагменты антител, белки с более низкой молекулярной массой, полипептиды или пептиды, лектины, гликопротеины, вещества, не являющиеся пептидами, витамины, молекулы, переносящие микроэлементы (такие как, но не ограничивающиеся ими, трансферин), или любая другая молекула или любое другое вещество, связывающиеся с клеткой.
Лигандный компонент может образовывать связь с удлиняющим компонентом, аминокислотным компонентом, спейсерным компонентом или с компонентом “лекарственное средство”. Лигандный компонент может образовывать связь с линкерным компонентом через гетероатом данного лиганда. Гетероатомами, которые могут присутствовать на лигандном компоненте, являются сера (В одном из вариантов изобретения происходящая от сульфгидрильной группы лиганда), кислород (В одном из вариантов изобретения происходящий от карбонильной, карбоксильной или гидроксильной группы лиганда) и азот (В одном из вариантов изобретения происходящий от первичной или вторичной аминогруппы лиганда). Эти гетероатомы могут присутствовать на лиганде в его природном состоянии, например в природном антителе, либо они могут быть введены в лиганд путем химической модификации.
В одном из вариантов изобретения лиганд имеет сульфгидрильную группу, и этот лиганд присоединен к линкеру через атом серы сульфгидрильной группы.
В еще одном аспекте изобретения лиганд имеет один или несколько лизиновых остатков, которые могут быть химически модифицированы с введением в них одной или нескольких сульфгидрильных групп. Указанный лигандный компонент связан с линкерным компонентом через атом серы сульфгидрильной группы. Реагентами, которые могут быть использованы для модификации лизинов, являются, но не ограничиваются ими, N-сукцинимидил-S-ацетилтиоацетат (SATA) и гидрохлорид 2-иминотиолана (реагент Траута).
В другом варианте изобретения лиганд может иметь одну или несколько углеводных групп, которые могут быть химически модифицированы с введением в них одной или нескольких сульфгидрильных групп. Указанный лигандный компонент связан с линкерным компонентом, таким как удлиняющий компонент, через атом серы сульфгидрильной группы.
В еще одном варианте изобретения лиганд может иметь одну или несколько углеводных групп, которые могут быть окислены с образованием альдегидной группы (-СНО) (см., например, Laguzza et al., J. Med. Chem. 1989, 32(3), 548-55). Соответствующий альдегид может образовывать связь с реактивным сайтом на удлиняющем компоненте. Реактивными сайтами на удлиняющем компоненте, которые могут взаимодействовать с карбонильной группой на лиганде, являются, но не ограничиваются ими, гидразин и гидроксиламин. Другие протоколы по проведению модификации белков для присоединения к компонентам “лекарственное средство” или для связывания с этими компонентами описаны в работе Coligan et al., Current Protocols in Protein Science, vol. 2, John Wiley & Sons (2002), которая вводится в настоящее описание посредством ссылки.
Подходящими для использования не-иммунореактивными белковыми, полипептидными или пептидными лигандами являются, но не ограничиваются ими, трансферин, эпидермальные факторы роста (“EGF”), бомбезин, гастрин, гастрин-высвобождающий пептид, тромбоцитарный фактор роста, IL-2, IL-6, трансформирующие факторы роста (“TGF”), такие как TGF-α и TGF-β, вакцинный фактор роста (“VGF”), инсулин и инсулиноподобные факторы роста I и II, лектины и апопротеин, происходящий от липопротеина низкой плотности.
Подходящими для использования поликлональными антителами являются гетерогенные популяции молекул антител, выделенных из сыворотки иммунизованных животных. Для продуцирования поликлональных антител против представляющего интерес антигена могут быть проведены различные процедуры, хорошо известные специалистам. Так, например, для продуцирования поликлональных антител различные животные-хозяева могут быть иммунизованы путем инъекции представляющего интерес антигена или его производного, и такими животными являются, но не ограничиваются ими, кролики, мыши, крысы и морские свинки. Для повышения иммунного ответа могут быть использованы различные адъюванты, в зависимости от вида хозяина, и такими адъювантами являются, но не ограничиваются ими, адъювант Фрейнда (полный или неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы-плюроники, полианионы, пептиды, масляные эмульсии, гемоцианины лимфы улитки, динитрофенол и потенциально эффективные для человека адъюванты, такие как BCG (бацилла Calmette-Guerin) и Corynebacterium parvum. Такие адъюванты также хорошо известны специалистам.
Подходящими для использования моноклональными антителами являются гомогенные популяции антител, направленных против конкретных антигенных детерминант (например, антигена раковых клеток, вирусного антигена, микробного антигена, белка, пептида, углевода, химического вещества, нуклеиновой кислоты или их фрагментов). Моноклональное антитело (mAb) против представляющего интерес антигена может быть получено любым известным методом продуцирования молекул антитела стабильными клеточными линиями в культуре. Такими методами являются, но не ограничиваются ими, гибридомная технология, впервые описанная Köhler & Milstein (1975, Nature 256, 495-497), технология получения В-клеточных человеческих гибридом (Kozbor et al., 1983, Immunology Today 4:72) и EBV-гибридомная технология (Cole et al., 1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., p.77-96). Такими антителами могут быть иммуноглобулины любого класса, включая IgG, IgM, IgE, IgA и IgD и любого подкласса. Гибридома, продуцирующая моноклональные антитела (mAb), применяемые в настоящем изобретении, может быть культивирована in vitro или in vivo.
Подходящими для использования моноклональными антителами являются, но не ограничиваются ими, человеческие моноклональные антитела, гуманизованные моноклональные антитела, фрагменты антител или химерные моноклональные антитела “человек-мышь” (или других видов). Человеческие моноклональные антитела могут быть получены любыми различными методами, известными специалистам (например, Teng et al., 1983, Proc. Natl. Acad. Sci., USA, 80, 7308-7312; Kozbor et al., 1983, Immunology Today 4, 72-79 & Olsson et al., 1982, Meth Enzymol. 92, 3-16).
Указанным антителом может быть также биспецифическое антитело. Методы получения биспецифических антител известны специалистам. Традиционное продуцирование полноразмерных биспецифических антител основано на ко-экспрессии двух пар “тяжелая цепь-легкая цепь” иммуноглобулина, где две цепи обладают различными специфичностями (Milstein et al., 1983, Nature 305:537-539). Из-за присутствия рандомизированного набора тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) продуцируют потенциальную смесь из десяти различных молекул антител, из которых только одна молекула имеет “правильную” биспецифическую структуру. Аналогичные процедуры описаны в публикации Международной заявки № WO 93/08829 и у Traunecker et al. EMBO J. 10:3655-3659 (1991).
В соответствии с другим подходом вариабельные домены антитела с нужной специфичностью связывания (сайты связывания антитело-антиген) присоединяют к последовательностям константного домена иммуноглобулина. Предпочтительным гибридом является гибрид с константным доменом тяжелой цепи иммуноглобулина, содержащий, по меньшей мере, часть шарнирной области, СН2- и СН3-области. При этом предпочтительно, чтобы этот гидрид имел первую константную область тяжелой цепи (СН1), содержащую сайт, необходимый для связывания легкой цепи и присутствующий, по меньшей мере, в одном из гибридов. Нуклеиновые кислоты с последовательностями, кодирующими гибриды тяжелой цепи иммуноглобулина, и если это необходимо, легкой цепи иммуноглобулина, встраивают в отдельные экспрессионные векторы и котрансфецируют в подходящий организм-хозяин. Это позволяет обеспечивать высокую гибкость при коррекции соотношений трех полипептидных фрагментов в тех вариантах осуществления изобретения, в которых имеются неравные отношения трех полипептидных цепей, используемых в данной конструкции, и получать оптимальные выходы. Однако кодирующие последовательности для двух или всех трех полипептидных цепей могут быть встроены в один экспрессионный вектор, если экспрессия, по меньшей мере, двух полипептидных цепей в равных отношениях дает высокие выходы или если эти отношения не имеют большого значения.
В одном из вариантов этого подхода биспецифические антитела имеют гибридную тяжелую цепь иммуноглобулина с первой специфичностью связывания на одной ветви и гибридную пару тяжелая цепь-легкая цепь иммуноглобулина (обеспечивающую вторую специфичность связывания) на другой ветви. Такая асимметричная структура облегчает отделение нужного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, поскольку такое облегчение разделения обусловлено присутствием легкой цепи иммуноглобулина только в одной половине биспецифической молекулы (см. публикацию Международной заявки № WO94/04690, которая во всей своей полноте вводится в настоящее описание посредством ссылки).
Более подробное описание получения биспецифических антител можно найти, например, у Suresh et al., Methods in Enzymology, 1986, 121:210; Rodrigues et al., 1993, J. of Immunology 151:6954-6961; Carter et al., 1992, Bio/Technology 10:163-167; Carter et al., 1995, J. of Hematotherapy 4:463-470; Merchant et al., 1998, Nature Biotechnology 16:677-681. С применением таких методов могут быть получены биспецифические антитела, предназначенные для лечения или профилактики указанных здесь заболеваний.
Бифункциональные антитела также описаны в публикации Европейской патентной заявки № ЕРА 0105360. Как описано в этой публикации, гибридные или бифункциональные антитела могут быть получены биологическими методами, то есть методами слияния клеток, или химическими методами, а в частности с использованием перекрестно-сшивающих агентов или реагентов, образующих дисульфидные мостики, и эти антитела могут представлять собой целые антитела или их фрагменты. Методы получения таких гибридных антител описаны, например, в публикации Международной заявки № WO 83/03679 и в публикации Европейской патентной заявки № ЕРА 0217577, каждая из которых вводится в настоящее описание посредством ссылки.
Антитело может представлять собой функционально активный фрагмент, производное или аналог антитела, которые иммуноспецифически связываются с антигенами раковых клеток, вирусными антигенами, микробными антигенами или с другими антителами, связанными с опухолевыми клетками или с матриксом. В соответствии с этим термин “функционально активный” означает, что данный фрагмент, производное или аналог обладают способностью вырабатывать анти-антиидиотипические антитела, которые распознают тот же самый антиген, что и антитело, от которого происходят данные фрагмент, производное или аналог. В частности, в репрезентативном варианте изобретения антигенность идиотипа молекулы иммуноглобулина может быть повышена путем делеции каркасных последовательностей и последовательностей CDR, которые находятся со стороны С-конца по отношению к последовательности CDR, специфически распознающей данный антиген. Для того чтобы определить, какие последовательности CDR связываются с антигеном, могут быть проведены анализы на связывание с антигеном с использованием синтетических пептидов, содержащих последовательности CDR, любым известным методом, обычно применяемым специалистами для анализа на связывание (например, анализ с использованием программы BIA CORE) (см., например, Kabat et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md; Kabat E. et al., 1980, J. of Immunology 125(3):961-969).
Другими подходящими антителами являются фрагменты антител, такие как, но не ограничивающиеся ими, F(ab')2-фрагменты, которые содержат вариабельную область, константную область легкой цепи и СН1-домен тяжелой цепи и которые могут быть продуцированы путем гидролиза молекулы антитела пепсином, и Fab-фрагменты, которые могут быть продуцированы путем восстановления дисульфидных мостиков F(ab')2-фрагментов. Другими подходящими антителами являются димеры тяжелой и легкой цепей антител, или их любой минимальный фрагмент, такой как Fv, или одноцепочечные антитела (scAb) (например, как описано в патенте США № 4946778; Bird, 1988, Science 242:423-42; Huston et al., 1998, Proc. Natl. Acad. Sci., USA, 85:5879-5883 и Ward et al., 1989, Nature 334:544-54), или любая другая молекула с такой же специфичностью, как и данное антитело.
Кроме того, подходящими антителами являются рекомбинантные антитела, такие как химерное и гуманизованные моноклональные антитела, содержащие человеческие и не-человеческие части, которые могут быть получены с применением стандартных методов рекомбинантных ДНК. Химерное антитело представляет собой молекулу, в которой различные части происходят от животных различных видов, а именно части, содержащие вариабельную область, происходящую от константных областей мышиного моноклонального антитела и человеческого иммуноглобулина (см., например, Cabilly et al., патент США № 4816567 и Boss et al., патент США № 4816397, которые во всей своей полноте вводятся в настоящее описание посредством ссылки). Гуманизованные антитела представляют собой молекулы антител, происходящие от животных, не являющихся человеком, и имеющие одну или несколько гипервариабельных областей (комплементарность-определяющих областей, CDR), происходящих от животных, не являющихся человеком, и каркасную область, происходящую от молекулы человеческого иммуноглобулина (см., например, Queen, патент США № 5585089, который во всей своей полноте вводится в настоящее описание посредством ссылки). Такие химерные и гуманизованные моноклональные антитела могут быть продуцированы методами рекомбинантных ДНК, известными специалистам, например методами, описанными в публикации Международной заявки № WO 87/02671; в публикации Европейской патентной заявки № 184187; в публикации Европейской патентной заявки № 171496; в публикации Европейской патентной заявки № 173494; в публикации Международной заявки № WO 86/01533; в патенте США № 4816567; в публикации Европейской патентной заявки № 12023; Berter et al., 1988, Science 240:1041-1043; Liu et al., 1987, Proc. Natl. Acad. Sci., USA, 84:3439-3443; Liu et al., 1987, J. Immunol. 139:3521-3526; Sun et al., 1987, Proc. Natl. Acad. Sci., USA, 84:214-218; Nishimura et al., 1987, Cancer Res. 47:999-1005; Wood et al., 1985, Nature 314:446-449; и Shaw et al., 1988, J. Natl. Cancer Inst. 80:1553-1559; Morrison, 1985, Science 229:1202-1207; Oi et al., 1986, BioTechnology 4:214; в патенте США № 5225539; у Jones et al., 1986, Nature 321:552-525; у Verhoeyan et al. (1988) Science 239:1534 и у Beidler et al., 1988, J. Immunol. 141:4053-4060, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Полноразмерные человеческие антитела являются особенно предпочтительными, и они могут быть продуцированы у трансгенной мыши, которая неспособна экспрессировать эндогенные гены тяжелой и легкой цепей иммуноглобулина, но способна экспрессировать гены тяжелой и легкой цепей человеческого иммуноглобулина. Трансгенных мышей иммунизируют выбранным антигеном, например целым полипептидом согласно изобретению или его частью, обычным способом. Моноклональные антитела, направленные против данного антигена, могут быть получены с применением стандартной гибридомной технологии. Трансгены человеческого иммуноглобулина, присутствующие у трансгенных мышей, перегруппировываются в процессе дифференцировки В-клеток, а затем происходит переключение класса иммуноглобулинов и соматическая мутация. Таким образом, применение такой техники позволяет продуцировать терапевтически эффективные антитела IgG, IgA, IgM и IgE. Общий обзор этой технологии продуцирования человеческих антител можно найти у Lonberg и Huszar (1995, Int. Rev. Immunol. 13:65-93).
Подробное обсуждение такой технологии продуцирования человеческих антител и человеческих моноклональных антител, а также протоколы продуцирования таких антител можно найти, например, в патентах США № 5625126, 5633425, 5569825, 5661016, 5545806, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки. Другие человеческие антитела могут поставляться, например, фирмами Abgenix, Inc. (Freemont, CA) и Genpharm (San Jose, CA).
Полноразмерные человеческие антитела, распознающие выбранный эпитоп, могут быть продуцированы методом, называемым “направленный отбор”. В этом методе выбранное не-человеческое моноклональное антитело, например мышиное антитело, используется для направленного отбора полноразмерного человеческого антитела, распознающего тот же самый эпитоп (Jespers et al. (1994) Biotechnology 12:899-903). Человеческие антитела могут быть также продуцированы различными известными методами, включая библиотеки фагового представления (Hoogenboom & Winter, J. Mol. Biol. 227:381 (1991); Marks et al., J. Mol. Biol. 222:581 (1991); Quan M.P. & Carter P. 2002. The rise of monoclonal antibodies as therapeutics. In Anti-IgE and Allergic Disease, Jardieu P.M. & Fick Jr. R.B. eds, Marcel Dekker, New York, NY, Chapter 20, p.427-469).
В других вариантах изобретения антитело представляет собой гибридный белок антитела, либо его функционально активный фрагмент, в котором, например, антитело связано посредством ковалентной связи (например, пептидной связи) либо у N-конца, либо у С-конца, с аминокислотной последовательностью другого белка (или его части, предпочтительно, имеющей, по меньшей мере, 10, 20 или 50 аминокислот), который не является антителом. При этом антитело или его фрагмент, предпочтительно, ковалентно связаны с другим белком у N-конца константного домена.
Понятие “антитела” включает аналоги и производные, которые являются модифицированными, то есть путем ковалентного связывания молекулы любого типа, при условии, что такое ковалентное связывание позволяет данному антителу сохранять свою иммуноспецифичность связывания с антигеном. Так, например, производными и аналогами антител являются, но не ограничиваются ими, производные и аналоги, которые были дополнительно модифицированы, например, путем гликозилирования, ацетилирования, пэгилирования, фосфорилирования, амидирования, дериватизации известными защитными/блокирующими группами, протеолитического расщепления, связывания с клеточным антителом или с другим белком и т.п. Любая из множества химических модификаций может быть проведена известными методами, включая, но не ограничиваясь ими, специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез в присутствии туникамицина и т.п. Кроме того, такой аналог или такое производное может содержать одну или несколько не-природных аминокислот.
Понятие “антитела” включает антитела, имеющие модификации (например, замены, делеции или добавления) в аминокислотных остатках, которые взаимодействуют с Fc-рецепторами. В частности, антителами являются антитела, имеющие модификации в аминокислотных остатках, идентифицированных как остатки, участвующие во взаимодействии между антителом против Fc-домена и FcRn-рецептором (см., например, публикацию Международной заявки № WO 97/34631, которая во всей своей полноте вводится в настоящее описание посредством ссылки). Антитела, обладающие иммуноспецифичностью к антигену раковых клеток, могут поставляться, например, фирмой Genentech (San Francisco, CA), либо они могут быть продуцированы любым методом, известным специалистам, таким как, например, метод химического синтеза или экспрессии рекомбинантных ДНК. Нуклеотидная последовательность, кодирующая антитела, обладающие иммуноспецифичностью к антигену раковой клетки, может быть получена, например, из базы данных Genbank или подобной ей базы данных методами, описанными в литературе, или путем рутинного клонирования и секвенирования.
В конкретном варианте изобретения для лечения или профилактики рака могут быть использованы известные антитела. Антитела, обладающие иммуноспецифичностью к антигену раковой клетки, могут быть получены из коммерческих источников, либо они могут быть продуцированы любыми методами, известными специалистам, такими как, например, методы экспрессии рекомбинантных ДНК. Нуклеотидная последовательность, кодирующая антитела, обладающие иммуноспецифичностью к антигену раковой клетки, может быть получена, например, из базы данных Genbank или подобной ей базы данных методами, описанными в литературе, или путем рутинного клонирования и секвенирования. Примерами антител, которые могут быть использованы для лечения рака, являются, но не ограничиваются ими, гуманизованное моноклональное антитело против HER2, герцептин® (трастузумаб; Genentech) для лечения пациентов с раком молочной железы, дающим метастазы; антитело ритуксан® (ритуксимаб; Genentech), которое является химерным моноклональным антителом против CD20, предназначенным для лечения пациентов с не-ходжкинской лимфомой; антитело OvaRex (AltaRex Corporation, MA), которое является мышиным антителом, предназначенным для лечения рака яичника; антитело Panorex (Glaxo Wellcome, NC), которое представляет собой мышиное антитело IgG2a, предназначенное для лечения рака ободочной кишки; антитело Cetuximab Erbitux (Imclone Systems Inc., NY), которое представляет собой химерное антитело IgG против EGFR, предназначенное для лечения раковой опухоли, позитивной по экспрессии эпидермального фактора роста, такой как рак головы и шеи; антитело Витаксин (MedImmune, Inc., MD), которое представляет собой гуманизованное антитело для лечения саркомы; антитело Campath I/H (Leukosite, MA), которое представляет собой гуманизованное антитело IgG1, предназначенное для лечения хронического лимфоцитарного лейкоза (ХЛЛ); антитело Smart MI95 (Protein Design Labs, Inc., CA), которое представляет собой анти-CD33 антитело IgG, предназначенное для лечения острого миелоидного лейкоза (ОМЛ); антитело LymphoCide (Immunomedics, Inc., NJ), которое представляет собой гуманизованное анти-CD22 антитело IgG, предназначенное для лечения не-ходжкинской лимфомы; антитело Smart ID10 (Protein Design Labs, Inc., CA), которое представляет собой анти-HLA-DR антитело, предназначенное для лечения не-ходжкинской лимфомы; антитело Oncolym (Techniclone, Inc., CA), которое представляет собой радиоактивно меченное анти-HLA-Dr10 антитело, предназначенное для лечения не-ходжкинской лимфомы; антитело Allomune (BioTransplant, CA), которое представляет собой гуманизованное анти-CD2 mAb, предназначенное для лечения болезни Ходжкина или не-ходжкинской лимфомы; антитело Авастин (Genentech, Inc., CA), которое представляет собой гуманизованное анти-VEGF антитело, предназначенное для лечения рака легких и рака ободочной кишки; антитело Epratuzumab (Immunomedics, Inc., NJ и Amgen, CA), которое представляет собой анти-CD22 антитело, предназначенное для лечения не-ходжкинской лимфомы; и антитело CEAcide (Immunomedics, NJ), которое представляет собой анти-СЕА антитело, предназначенное для лечения рака ободочной кишки.
Другими антителами, которые могут быть использованы для лечения рака, являются, но не ограничиваются ими, антитела против следующих антигенов, таких как: СА125 (рак яичника), СА15-3 (карцинома), СА19-9 (карцинома), L6 (карцинома), Lewis Y (карцинома), Lewis X (карцинома), альфа-фетопротеин (карцинома), СА242 (рак ободочной кишки), щелочная фосфатаза плаценты (карцинома), антиген, специфичный для предстательной железы (рак предстательной железы), кислая фосфатаза предстательной железы (рак предстательной железы), эпидермальный фактор роста (карцинома), MAGE-1 (карцинома), MAGE-2 (карцинома), MAGE-3 (карцинома), MAGE-4 (карцинома), антитрансферриновый рецептор (карцинома), р97 (меланома), MUC1-KLH (рак молочной железы), СЕА (рак ободочной кишки), gp100 (меланома), MART1 (меланома), PSA (рак предстательной железы), рецептор IL-2 (Т-клеточный лейкоз и Т-клеточная лимфома), CD20 (не-ходжкинская лимфома), CD52 (лейкоз), CD33 (лейкоз), CD22 (лимфома), человеческий хорионический гонадотропин (карцинома), CD38 (множественная миелома), CD40 (лимфома), муцин (карцинома), Р21 (карцинома), MPG (меланома) и онкогенный продукт Neu (карцинома). Некоторыми специфическими и эффективными антителами являются, но не ограничиваются ими, mAb BR96 (Trail P.A., Willner D. Lasch S.J. Henderson A.J. Hofstead, S.J. Casazza A.M. Firestone, R.A. Hellstrom, I., Hellstrom, K.E., “Cure of Xenografted Human Carcinomas by BR96-Doxorubicin Immunoconjugates” Science 1993, 261, 212-215), BR64 (Trail P.A., Willner D. Knipe J. Henderson A.J. Lasch, S.J. Zoeckler, M.E., Trailsmith M.D. Doyle, T.W. King, H.D., Casazza, A.M. Braslawsky, G.R. Brown J.P. Hofstead, S.J. (Greenfield R.S. Firestone, R.A. Mosure K. Kadow, D.F., Yang, M.B. Hellstrom, K.E. & Hellstrom, I. “Effect of Linker Variation on the Stability, Potency and Efficacy of Carcinoma-reactive BR64-Doxorubicin Immunoconjugates” Cancer Research 1997, 57, 100-105), mAbs против антигена CD40, такие как mAb S2C6 (Francisco, J.A., Donaldson K.L. Chace D. Siegall, C.B. & Wahl A.F. “Agonistic properties and in vivo antitumor activity of the anti-CD40 antibody, SGN-14” Cancer Res. 2000, 60, 3225-3231), mAbs против антигена CD70, такие как mAb 1F6 и mAb 2F2, и mAb против антигена CD30, такие как АС10 (Bowen M.A., Olsen K.J. Cheng, L. Avilla, D., & Podack, E.R. “Functional effects of CD30 on a large granular lymphoma cell line YT” J. Immunol., 151, 5896-5906, 1993; Wahl et al., 2002 Cancer Res. 62(13):3736-42). Могут быть также использованы и многие другие интернализующие антитела, связывающиеся с опухолеассоциированными антигенами, и эти антитела описаны в литературе (Franke A.E., Sievers E.L. & Scheinberg D.A., “Cell surface receptor-targeted therapy of acute myeloid leukemia: а review “Cancer Biother Radiopharm. 2000, 15, 459-76; Murray J.L. “Monoclonal antibody treatment of solid tumors: а coming of age” Semin Oncol. 2000, 27, 64-70; Breitling F. & Dubel S. Recombinant Antibodies, John Wiley & Sons, New York, 1998).
В некоторых вариантах изобретения указанным антителом не является трастузумаб (полноразмерное гуманизованное антитело против HER2 (MW 145167)), герцептин-F(ab')2 (происходящий из ферментативно расщепленного анти-HER2 антитела, MW 100000), 4D5 (полноразмерное мышиное анти-HER2 антитело, продуцируемое гибридомой), rhu4D5 (временно экспрессируемое полноразмерное гуманизованное антитело), rhuFab4D5 (рекомбинантный гуманизованный Fab, MW 47738), 4D5Fc8 (полноразмерное мышиное анти-HER2 антитело с мутированным FcRn-связывающим доменом) или Hg (“безшарнирное” полноразмерное гуманизованное антитело 4D5, в котором цистеины шарнирной области тяжелой цепи были мутированы в серины и которое было экспрессировано в E.coli (а поэтому оно является негликозилированным)).
В другом конкретном варианте изобретения известные антитела, предназначенные для лечения или профилактики аутоиммунного заболевания, используются в соответствии с композициями и способами согласно изобретению. Антитела, обладающие иммуноспецифичностью к антигену клетки, ответственной за продуцирование аутоиммунных антител, могут быть получены от любой организации (например, Научно-исследовательского института или компании), либо они могут быть продуцированы любым известным методом, таким как, например, химический синтез или экспрессия рекомбинантных ДНК. В другом варианте изобретения подходящие антитела представляют собой иммуноспецифические антитела, предназначенные для лечения аутоиммунных заболеваний, и такими антителами являются, но не ограничиваются ими, антинуклеарное антитело, анти-дцДНК антитело, анти-оцДНК антитело, антитело IgM и IgG против кардиолипина, антитело IgM и IgG против фосфолипида, анти-SM антитело, антимитохондриальное антитело, антитело, специфичное для щитовидной железы, микросомальное антитело, антитело против тироглобулина, анти-SCL-70 антитело, анти-Jo антитело; анти-U1RNP антитело; анти-La/SSB антитело; анти-SSA антитело; анти-SSB антитело; антитело против перитальных клеток; антитело против гистонов; анти-RNP антитело; антитело против C-ANCA; антитело против P-ANCA; антитело против центромеров; антитело против фибрилларина и анти-GBM антитело.
В некоторых вариантах изобретения подходящие для использования антитела могут связываться как с рецептором, так и с рецепторным комплексом, экспрессируемым на активированном лимфоците. Рецептор или рецепторный комплекс может содержать член суперсемейства генов иммуноглобулина, член суперсемейства рецепторов TNF, интегрин, цитокиновый рецептор, хемокиновый рецептор, белок главного комплекса гистосовместимости, лектин или комплемент-регулирующий белок. Неограничивающими примерами подходящих членов суперсемейства иммуноглобулина являются CD2, CD3, CD4, CD8, CD19, CD22, CD28, CD79, CD90, CD152/CTLA-4, PD-1 и ICOS. Неограничивающими примерами подходящих членов суперсемейства рецепторов TNF являются CD27, CD40, CD95/Fas, CD134/ОХ40, CD137/4-IBB, TNF-R1, TNFR-2, RANK, TACI, ВСМА, остеопротегерин, Аро2/TRAIL-R1, TRAIL-R2, TRAIL-R3, TRAIL-R4 и АРО-3. Неограничивающими примерами подходящих интегринов являются CD11a, CD11b, CD11c, CD18, CD29, CD41, CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, CD103 и CD104. Неограничивающими примерами подходящих лектинов являются лектин С-типа, S-типа и I-типа.
В одном из вариантов изобретения указанный лиганд связывается с активированными лимфоцитами, ассоциированными с аутоиммунным заболеванием.
В другом конкретном варианте изобретения подходящими лигандами, иммуноспецифичными к вирусному или микробному антигену, являются моноклональные антитела. Такими антителами могут быть химерные, гуманизованные или человеческие моноклональные антитела. Используемый здесь термин “вирусный антиген” включает, но не ограничивается ими, любой вирусный пептид, полипептид, белок (например, gp120 ВИЧ, nef ВИЧ, гликопротеин F RSV, нейраминидаза вируса гриппа, гемаглютинин вируса гриппа, tax HTLV, гликопротеин вируса простого герпеса (например, gB, gC, gD и gE) и поверхностный антиген вируса гепатита В), которые способны вырабатывать иммунный ответ. Используемый здесь термин “микробный антиген” включает, но не ограничивается ими, любую молекулу микробного пептида, полипептида, белка, сахарида, полисахарида или липида (например, полипептид бактерий, грибков, патогенных простейших или дрожжей, включая, например, ЛПС и капсулярный полисахарид 5/8), которая способна вырабатывать иммунный ответ.
Антитела, которые являются иммуноспецифичными к вирусному или микробному антигену, могут поставляться от коммерческих фирм, например от BD Bioscience (San Francisco, CA), Chemicon International Inc. (Temecula, CA) или Vector Laboratories, Inc. (Burlingame, CA), или могут быть получены любым известным методом, таким как, например, метод химического синтеза или экспрессия методом рекомбинантных ДНК. Нуклеотидная последовательность, кодирующая антитела, которые являются иммуноспецифичными к вирусному или микробному антигену, может быть получена, например, из базы данных Genbank или из подобной ей базы данных и методом, описанным в литературе, либо она может быть получена путем рутинного клонирования и секвенирования.
В конкретном варианте изобретения подходящими лигандами являются лиганды, которые могут быть использованы для лечения или предупреждения вирусной или микробной инфекции в соответствии с описанными здесь способами. Примерами антител, которые могут быть использованы для лечения вирусных инфекций или микробных инфекций, являются, но не ограничиваются ими, антитело SYNAGIS (MedImmune, Inc., MD), которое представляет собой гуманизованное моноклональное антитело против респираторно-синцитиального вируса (RSV), предназначенное для лечения пациентов с RSV-инфекцией; антитело PRO542 (Progenics), которое представляет собой гибридное анти-CD4 антитело, предназначенное для лечения ВИЧ-инфекции; антитело OSTAVIR (Protein Design Labs., Inc., CA), которое представляет собой человеческое антитело, предназначенное для лечения инфекции, вызываемой вирусом гепатита В; антитело PROTOVIR (Protein Design Labs., Inc. CA), которое представляет собой гуманизованное антитело IgG1, предназначенное для лечения инфекции, вызываемой цитомегаловирусом (CMV), и антитела против ЛПС.
Другими антителами, подходящими для лечения инфекционных заболеваний, являются, но не ограничиваются ими, антитела против антигенов, происходящих от патогенных штаммов бактерий (Streptococcus pyogenes, Streptococcus pneumoniae, Neisseria gonorrhoeae, Neisseria meningitidis, Corynebacterium diphtheriae, Clostridium botulinum, Clostridium perfringens, Clostridium tetani, Hemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenas, Klebsiella rhinoscleromotis, Staphylococc aureus, Vibrio colerae, Escherichia coli, Pseudomonas aeruginosa, Campylobacter (Vibrio) fetus, Aeromonas hydrophila, Bacillus cereus, Edwardsiella tarda, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Salmonella typhimurium, Treponema pallidum, Treponema pertenue, Treponema carateneum, Borrelia vincentii, Borrelia burgdorferi, Leptospira icterohemorrhagie, Mycobacterium tuberculosis, Pneumocystis carinii, Francisella tularensis, Brucella abortus, Brucella suis, Brucella melitensis, Mycoplasma spp., Rickettsia prowazeki, Rickettsia tsutsugumushi, Chlamydia spp.); патогенных грибков (Coccidioides immitis, Aspergillus fumigatus, Candida albicans, Blastomyces dermatitidis, Cryptococcus neoformans, Histoplasma capsulatum); простейших (Entomoeba histolytica, Toxoplasma gondii, Trichomonas tenas, Trichomonas hominis, Trichomonas vaginalis, Tryoanosoma gambiense, Trypanosoma rhodesiense, Trypanosoma cruzi, Leishmania donovani, Leishmania tropica, Leishmania braziliensis, Pneumocystis pneumonia, Plasmodium vivax, Plasmodium falciparum, Plasmodium malaria); или гельминтов (Enterobius vermicularis, Trichuris trichiura, Ascaris lumbricoides, Trichinella spiralis, Strongyloides stercoralis, Schistosoma japonicum, Schistosoma mansoni, Schistosoma haematobium и анкилостомы).
Другими антителами, которые могут быть использованы в настоящем изобретении для лечения вирусного заболевания, являются, но не ограничиваются ими, антитела против антигенов патогенных вирусов, включая, например, но не ограничиваясь ими, поксвирусы, герпесвирусы, вирус простого герпеса 1, вирус простого герпеса 2, аденовирусы, паповавирусы, энтеровирусы, пикорнавирусы, парвовирусы, реовирусы, ретровирусы, вирусы гриппа, вирусы парагриппа, вирус паротита (свинки), вирус кори, респираторно-синцитиальный вирус, вирус краснухи, арбовирусы, рабдовирусы, аренавирусы, вирус гепатита А, вирус гепатита В, вирус гепатита С, вирус гепатита Е, вирус не-А/не-В гепатита, риновирусы, коронавирусы, ротавирусы и вирус иммунодефицита человека.
Для выявления эффективных клеточных мишеней в целях диагностики и терапии рака исследователями была сделана попытка идентифицировать трансмембранные или какие-либо другие опухолеассоциированные полипептиды, которые специфически экспрессируются на поверхности одной или нескольких раковых клеток конкретного(ых) типа(ов) по сравнению с одной или несколькими нормальными не-раковыми клетками. В большинстве случаев такие опухолеассоциированные полипептиды в избытке экспрессируются на поверхности раковых клеток, а не на поверхности не-раковых клеток. Идентификация таких опухолеассоциированных полипептидов антигенов клеточной поверхности позволит осуществлять специфическую деструкцию раковых клеток-мишеней путем терапии с использованием антитела.
Антителами, которые представляют собой Ab в конъюгатах “антитело-лекарственное средство” формулы Ic (ADC) и которые могут быть использованы для лечения рака, являются, но не ограничиваются ими, антитела против опухолеассоциированных антигенов (ТАА). Такие опухолеассоциированные антигены известны специалистам и могут быть получены для продуцирования антител с применением методов и данных, хорошо известных специалистам. Примерами ТАА являются (1)-(35), но не ограничиваются ими, ТАА (1)-(35), перечисленные ниже. Для удобства данные, относящиеся ко всем этим известным антигенам, представлены ниже и включают названия, альтернативные названия, регистрационные номера Genbank и первичный(е) источник(и). Опухолеассоциированные антигены, на которые направлены антитела, включают все варианты аминокислотных последовательностей и изоформ, имеющих последовательности, которые, по меньшей мере, примерно на 70%, 80%, 85%, 90% или 95% идентичны последовательностям, идентифицированным в соответствующем списке последовательностей (SEQ ID NO:1-35), или последовательностям, идентифицированным в цитируемых работах. В некоторых вариантах изобретения ТАА, имеющие варианты аминокислотных последовательностей, обладают, по существу, такими же биологическими свойствами или характеристиками, как и ТАА, имеющий последовательность, представленную в соответствующем списке последовательностей (SEQ ID NO:1-35). Так, например, ТАА, имеющий модифицированную последовательность, по существу, способен специфически связываться с антителом, которое специфически связывается с ТАА, имеющим соответствующую последовательность, указанную в списке последовательностей. Эти последовательности и конкретно цитируемые здесь описания во всей своей полноте вводятся в настоящее описание посредством ссылки.
Опухолеассоциированные антигены (1)-(35)
(1) BMPR1B (рецептор белка морфогенеза кости типа IB, Genbank рег. № NM_001203, ten Dijke P. et al., Science 264 (5155):101-104 (1994), Oncogene 14(11):1377-1382 (1997)); WO2004063362 (п.2 формулы изобретения); WO2003042661 (п.12 формулы изобретения); US2003134790-AI (страницы 38-39); WO2002102235 (п.13 формулы изобретения; страница 296); WO2003055443 (страницы 91-92); WO200299122 (пример 2; страницы 528-530); WO2003029421 (п.6 формулы изобретения); WO2003024392 (п.2 формулы изобретения; фиг.112); WO200298358 (п.1 формулы изобретения; страница 183); WO200254940 (страница 100-101); WO200259377 (страница 349-350); WO200230268 (п.27 формулы изобретения; страница 376); WO200148204 (пример; фиг.4); NP_001194 рецептор белка морфогенеза кости типа IB/pid =NP_001194.1. Перекрестные ссылки: MIM:603248; NP_001194.1; NM_001203_1; 502 аминокислоты:



(2) Е16 (LAT1, SLC7A5, Genbank рег. № NM_003486); Biochem. Biophys. Res. Commun. 255(2), 283-288 (1999), Nature 395 (6699):288-291 (1998), Gaugitsch H.W. et al., (1992) J. Biol. Chem. 267(16):11267-11273); WO2004048938 (пример 2); WO2004032842 (пример IV); WO2003042661 (п.12 формулы изобретения); WO2003016475 (п.1 формулы изобретения); WO200278524 (пример 2); WO200299074 (п.19 формулы изобретения; страницы 127-129); WO200286443 (п.27 формулы изобретения, страницы 222, 393); WO2003003906 (п.10 формулы изобретения; страница 293); WO200264798 (п.33 формулы изобретения; страницы 93-95); WO200014228 (п.5 формулы изобретения; страницы 133-136); US2003224454 (фиг.3); WO2003025138 (п.12 формулы изобретения; страница 150); NP_003477 член 5 семейства растворимых носителей 7 (переносчик катионных аминокислот, у+система) член 5/pid=NP_003477.3-Homo sapiens. Перекрестные ссылки: MIM:600182; NP_03477.3; NM_015923; NM_003486_1, 507 аминокислот:

(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы, Genbank рег. № NM_012449; Cancer Res. 61(15), 5857-5860 (2001) Hubert R.S., et al. (1999) Proc. Natl. Acad. Sci., USA, 96(25):14523-14528); WO2004065577 (п.6 формулы изобретения); WO2004027049 (Фиг.1L); ЕР1394274 (пример 11); WO2004016225 (п.2 формулы изобретения); WO20030442661 (п.12 формулы изобретения); US2003157089 (пример 5); US2003185830 (пример 5); US2003064397 (фиг.2); WO200289747 (пример 5; страницы 618-619); WO2003022995 (пример 9; фиг.13А, пример 53, страница 173, пример 2; фиг.2А); NP_036581, шестидоменный эпителиальный антиген предстательной железы. Перекрестные ссылки: MIM:604415; NP_036581.1; NM_012449_1, 339 аминокислот:

(4) 0772Р (СА125, MUC16, Genbank рег. № AF361486 J. Biol. Chem. 276(29):27371-27375 (2001)); WO2004045553 (п.14 формулы изобретения); WO200292836 (п.6 формулы изобретения; фиг.12); WO200283866 (п.15 формулы изобретения; страницы 116-121); US2003124140 (пример 16); US2003091580 (п.6 формулы изобретения); WO200206317 (п.6; страницы 400-408). Перекрестные ссылки: GI:34501467; AAK74120.3; AF361486_1, 6995 аминокислот:

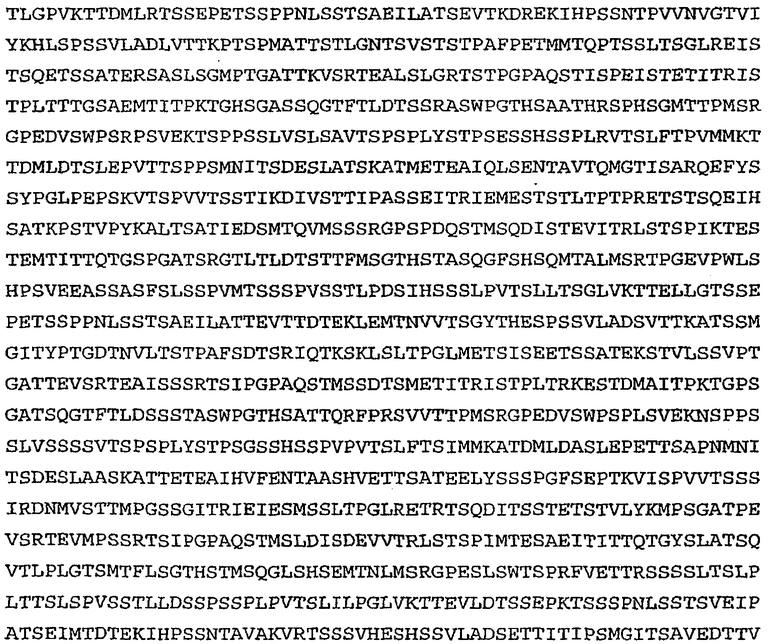


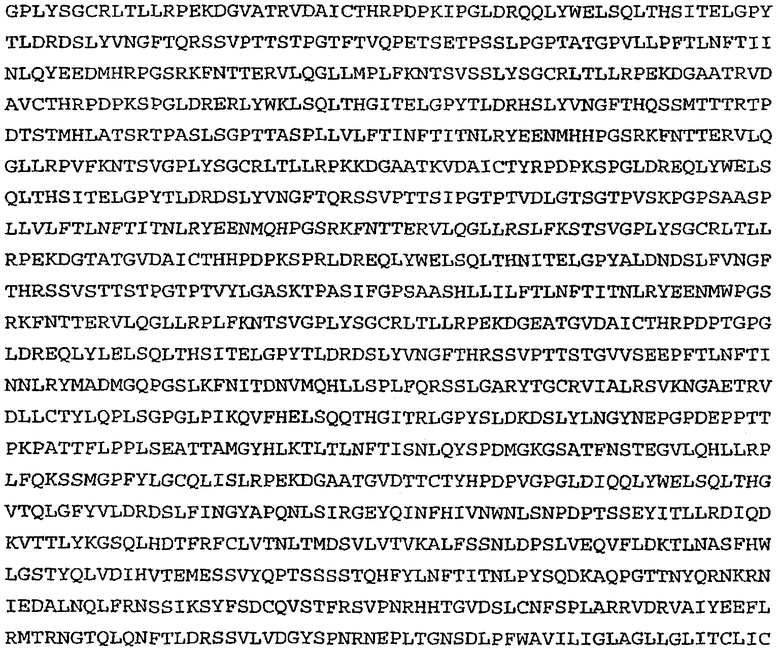
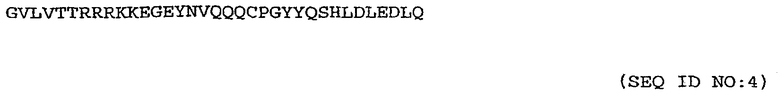
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, Genbank рег. № NM_005823, Yamaguchi N. et al., Biol. Chem. 269(2), 805-808 (1994), Proc. Natl. Acad. Sci., USA, 96(20):11531-11536 (1999) Proc. Natl. Acad. Sci., USA, 93(1):136-140 (1996), J. Biol. Chem. 270(37):21984-21990 (1995)); WO2003101283 (п.14 формулы изобретения); WO2002102235 (п.13 формулы изобретения; страницы 287-288); WO2002101075 (п.4 формулы изобретения; страницы 308-309); WO200271928 (страницы 320-321); WO9410312 (страницы 52-57). Перекрестные ссылки: MIM:601051; NP_005814.2; NM_005823_1; 622 аминокислоты:

(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II, Genbank рег. № NM_006424; J. Biol. Chem. 277(22):19665-19672 (2002), Genomics 62(2):281-284 (1999), Feild J.A. et al. (1999) Biochem. Biophys. Res. Commun. 258(3):578-582); WO2004022778 (п.2 формулы изобретения); ЕР1394274 (пример 11); WO2002102235 (п.13 формулы изобретения; страница 326); ЕР875569 (п.1 формулы изобретения; страницы 17-19); WO200157188 (п.20 формулы изобретения; страница 329); WO2004032842 (пример IV); WO200175177 (п.24 формулы изобретения; страницы 139-140). Перекрестные ссылки: MIM:604217; NP_006415.1; NM_006424_1, 690 аминокислот:


(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен (семафорин) 5В, Genbank рег. № АВ040878, Nagase T. et al., (2000) DNA Res. 7(2):143-150); WO2004000997 (п.1 формулы изобретения); WO2003003984 (п.1 формулы изобретения); WO200206339 (п.1 формулы изобретения; страница 50); WO200188133 (п.1 формулы изобретения; страницы 41-43, 48-58); WO2003054152 (п.20 формулы изобретения); WO2003101400 (п.1 формулы изобретения); рег. № Q9P283; EMBL; AB040878; BAA95969.1 Genew; HGNC:10737; 1093 аминокислоты:
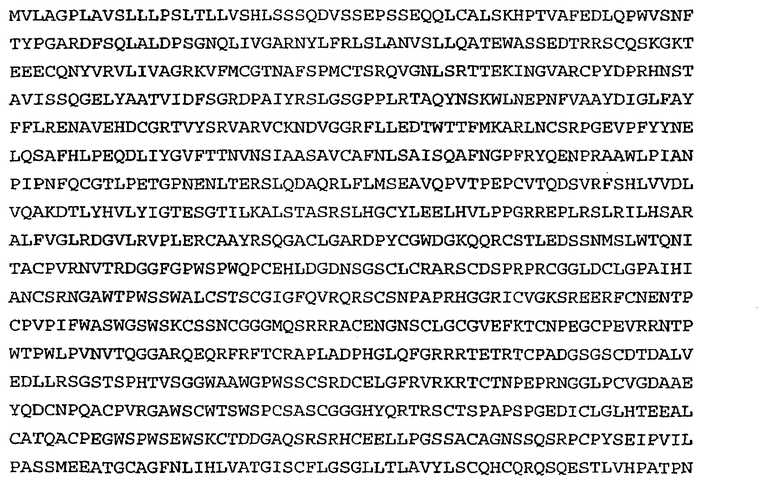

(8) PSCA hlg (2700050C12Rik, C530008O16Rik, кДНК RIKEN 2700050C12, кДНК гена RIKEN 2700050C12, Genbank рег. № AY358628); US2003129192 (п.2 формулы изобретения); US2004044180 (п.12 формулы изобретения); US2004044179 (п.11 формулы изобретения); US2003096961 (п.11 формулы изобретения); US2003232056 (пример 5); WO2003105758 (п.12 формулы изобретения); US2003206918 (пример 5); ЕР1347046 (п.1 формулы изобретения); WO2003025148 (п.20 формулы изобретения). Перекрестные ссылки: GI:37182378; AAQ88991.1; AY358628_1; 141 аминокислота:

(9) ETBR (рецептор эндотелина типа В, Genbank рег. № AY275463; Nakamuta M., et al. Biochem. Biophys. Res. Commun. 177, 34-39,1991; Ogawa Y., et al. Biochem. Biophys. Res. Commun. 178, 248-255, 1991; Arai H., et al. Jpn. Circ. J. 56, 1303-1307, 1992; Arai H., et al. J. Biol. Chem. 268, 3463-3470,1993; Sakamoto A., Yanagisawa M., et al. Biochem. Biophys. Res. Commun. 178, 656-663, 1991; Elshourbagy N.A., et al. J. Biol. Chem. 268, 3873-3879, 1993; Haendler В., et al. J. Cardiovasc. Pharmacol. 20, s1-S4, 1992; Tsutsumi M., et al. Gene 228, 43-49, 1999; Strausberg R.L., et al. Proc. Natl. Acad. Sci. USA. 99, 16899-16903, 2002; Bourgeois C, et al. J. Clin. Endocrinol. Metab. 82, 3116-3123, 1997; Okamoto Y., et al. Biol. Chem. 272, 21589-21596, 1997; Verheij J.B., et al. Am. J. Med. Genet. 108, 223-225, 2002; Hofstra R.M.W., et al. Eur. J. Hum. Genet. 5, 180-185,1997; Puffenberger EG., et al. Cell 79, 1257-1266, 1994; Attie Т., et al. Hum. Mol. Genet. 4, 2407-2409, 1995; Auricchio A., et al. Hum. Mol. Genet. 5:351-354, 1996; Amiel J., et al. Hum. Mol. Genet. 5, 355-357, 1996; Hofstra R.M.W., et al. Nat. Genet. 12, 445-447,1996; Svensson P.J., et al. Hum. Genet. 103, 145-148, 1998; Fuchs S., et al. Mol. Med. 7, 115-124, 2001; Pingault V., et al. (2002) Hum. Genet. Ill, 198-206; WO2004045516 (п.1 формулы изобретения); WO2004048938 (пример 2); WO2004040000 (п.151 формулы изобретения); WO2003087768 (п.1 формулы изобретения); WO2003016475 (п.1 формулы изобретения); WO2003016475 (п.1 формулы изобретения); WO200261087 (фиг.1); WO2003016494 (фиг.6); WO2003025138 (п.12 формулы изобретения; страница 144); WO200198351 (п.1 формулы изобретения; страницы 124-125); ЕР522868 (п.8 формулы изобретения; фиг.2); WO200177172 (п.1 формулы изобретения; страницы 297-299); US2003109676; US6518404 (фиг.3); US5773223 (п.1а формулы изобретения; столбец 31-34); WO2004001004, 442 аминокислоты:

(10) MSG783 (RNF124, гипотетический белок FLJ20315, Genbank рег. № NM_017763); WO2003104275 (п.1 формулы изобретения); WO2004046342 (пример 2); WO20030442661 (п.12 формулы изобретения); WO2003083074 (п.14 формулы изобретения; страница 61); WO2003018621 (п.1 формулы изобретения); WO2003024392 (п.2 формулы изобретения; фиг.93); WO200166689 (пример 6). Перекрестные ссылки: LocusID:54894; NP_060233.2; NM_017763_1, 783 аминокислоты:

(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы, Genbank рег. № AF455138; Lab. Invest. 82(11):1573-1582 (2002)); WO2003087306; US2003064397 (п.1 формулы изобретения; фиг.1); WO200272596 (п.13 формулы изобретения; страницы 54-55); WO200172962 (п.1 формулы изобретения; фиг.4В); WO2003104270 (п.11 формулы изобретения); WO2003104270 (п.16 формулы изобретения); US2004005598 (п.22 формулы изобретения); WO2003042661 (п.12 формулы изобретения); US2003060612 (п.12 формулы изобретения; фиг.10); WO200226822 (п.23 формулы изобретения; фиг.2); WO200216429 (п.12 формулы изобретения; фиг.10). Перекрестные ссылки: GI:22655488, AAN04080.1; AF455138_1, 490 аминокислот:

(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М, Genbank рег. № NM_017636; Xu X.Z. et al., Proc. Natl. Acad. Sci., USA, 98(19):10692-10697 (2001), Cell 109 (3):397-407 (2002), J. Biol. Chem. 278(33):30813-30820 (2003)); US2003143557 (п.4 формулы изобретения); WO200040614 (п.14 формулы изобретения; страницы 100-103); WO200210382 (п.1 формулы изобретения; фиг.9А); WO2003042661 (п.12); WO200230268 (п.27 формулы изобретения; страница 391); US2003219806 (п.4 формулы изобретения); WO200162794 (п.14 формулы изобретения; фиг.1A-D). Перекрестные ссылки: MIM:606936; NP_060106.2; NM_017636_1, 1214 аминокислот:



(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы, Genbank рег. № NP_003203 или NM_003212, Ciccodicola A. et al., EMBO J. 8(7):1987-1991 (1989), Am. J. Hum. Genet. 49(3):555-565 (1991)); US2003224411 (п.1 формулы изобретения); WO2003083041 (пример 1); WO2003034984 (п.12 формулы изобретения); WO200288170 (п.2 формулы изобретения; страницы 52-53); WO2003024392 (п.2 формулы изобретения; фиг.58); WO200216413 (п.1 формулы изобретения; страницы 94-95, 105); WO200222808 (п.2 формулы изобретения; фиг.1); US5854399 (пример 2; столбцы 17-18); US5792616 (фиг.2). Перекрестные ссылки: MIM:187395; NP_003203.1; NM_003212_1, 188 аминокислот:

(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барра) или Hs.73792, Genbank рег. № M26004; Fujisaku et al. (1989) J. Biol. Chem. 264(4):2118-2125); Weis J.J. et al., J. Exp. Med. 167, 1047-1066, 1988; Moore M., et al., Proc. Natl. Acad. Sci., USA, 84, 9194-9198, 1987; Barel M., et al., Mol. Immunol. 35, 1025-1031, 1998; Weis J.J. et al. Proc. Natl. Acad. Sci., USA, 83, 5639-5643, 1986; Sihna S.K. et al. (1993) J. Immunol. 150, 5311-5320; WO2004045520 (пример 4); US2004005538 (пример 1); WO2003062401 (п.9 формулы изобретения); WO2004045520 (пример 4); WO9102536 (фиг.9.1-9.9); WO2004020595 (п.1 формулы изобретения); регистрационные номера: P20023; Q13866; Q14212, EMBL; M26004; AAA35786.1, 1033 аминокислоты:

(15) CD79b (CD79B, CD79β, IGb (бета-белок, связанный с иммуноглобулином), В29, Genbank рег. № NM_000626 или 11038674, Proc. Natl. Acad. Sci., USA, (2003) 100(7):4126-4131, Blood (2002) 100(9):3068-3076, Muller et al., (1992) Eur. J. Immunol. 22(6):1621-1625); WO2004016225 (п.2 формулы изобретения; фиг.140); WO2003087768, US2004101874 (п.1 формулы изобретения, страница 102); WO2003062401 (п.9 формулы изобретения); WO200278524 (пример 2); US2002150573 (п.1 формулы изобретения, страница 15); US5644033, WO2003048202 (п.1 формулы изобретения, страницы 306 и 309); WO99/558658, US6534482 (п.13 формулы изобретения; фиг.17А/В); WO200055351 (п.11 формулы изобретения, страницы 1145-1146). Перекрестные ссылки: MIM:147245; NP_000617.1; NM_000626_1; 229 аминокислот:

(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C, Genbank рег. № NM_030764, Genome Res. 13(10):2265-2270 (2003), Immunogenetics 54(2):87-95 (2002), Blood 99 (8):2662-2669 (2002), Proc. Natl. Acad. Sci., USA, 98(17):9772-9777 (2001), Xu M.J. et al. (2001) Biochem. Biophys. Res. Commun. 280(3):768-775; WO2004016225 (п.2 формулы изобретения); WO2003077836; WO200138490 (п.5 формулы изобретения; фиг.18D-1-18D-2); WO2003097803 (п.12 формулы изобретения); WO2003089624 (п.25 формулы изобретения). Перекрестные ссылки: MIM:606509; NP_110391.2; NM_030764_1, 508 аминокислот:


(17) HER2 (ErbB2, Genbank рег. № M11730, Coussens L. et al. Science (1985) 230(4730):1132-1139); Yamamoto T. et al., Nature 319, 230-234, 1986; Semba K. et al., Proc. Natl. Acad. Sci., USA, 82, 6497-6501, 1985; Swiercz J.M. et al. J. Cell. Biol. 165, 869-880, 2004; Kuhns J.J. et al., J. Biol. Chem. 274, 36422-36427, 1999; Cho H.S. et al. Nature 421, 756-760, 2003; Ehsani A. et al., (1993) Genomics 15, 426-429; WO2004048938 (пример 2); WO2004027049 (фиг.1I); WO2004009622; WO2003081210; WO2003089904 (п.9 формулы изобретения); WO2003016475 (п.1 формулы изобретения); US2003118592; WO2003008537 (п.1 формулы изобретения); WO2003055439 (п.формулы изобретения 29; фиг.1А-В); WO2003025228 (п.37 формулы изобретения; фиг.5С); WO200222636 (пример 13; страницы 95-107); WO200212341 (п.68 формулы изобретения; фиг.7); WO200213847 (страницы 71-74); WO200214503 (страницы 114-117); WO200153463 (п.2 формулы изобретения; страницы 41-46); WO200141787 (страница 15); WO200044899 (п.52 формулы изобретения; фиг.7); WO200020579 (п.3 формулы изобретения; фиг.2); US5869445 (п.3 формулы изобретения; столбцы 31-38); WO9630514 (п.2 формулы изобретения; страницы 56-61); ЕР1439393 (п.7 формулы изобретения); WO2004043361 (п.7 формулы изобретения); WO2004022709; WO200100244 (пример 3; фиг.4); рег. № PO4626; EMBL; M11767; AAA35808.1. EMBL; М11761; ААА35808.1. 1255 аминокислот:

(18) NCA (CEACAM6, Genbank рег. № М18728); Barnett T., et al., Genomics 3, 59-66, 1988; Tawaragi Y. et al., Biochem. Biophys. Res. Commun. 150, 89-96, 1988; Strausberg R.L. et al. Proc. Natl. Acad. Sci., USA, 99:16899-16903, 2002; WO2004063709, EP1439393 (п.7 формулы изобретения); WO2004044178 (пример 4); WO2004031238; WO20030442661 (п.12 формулы изобретения); WO200278524 (пример 2); WO200286443 (п.27 формулы изобретения; страница 427); WO200260317 (п.2 формулы изобретения); рег. № P40199; Q14920; EMBL; М29541; ААА59915.1, EMBL; М18728; 344 аминокислоты:

(19) MDP (DPEP1, Genbank рег. № BC017023, Proc. Natl. Acad. Sci., USA, 99(26):16899-16903 (2002)); WO2003016475 (п.1 формулы изобретения); WO200264798 (п.33 формулы изобретения; страницы 85-87); JPO5003790 (фиг.6-8); WO9946284 (фиг.9). Перекрестные ссылки: MIM:179780; ААН17023.1; BC017023_1, 411 аминокислота:

(20) IL20Rα (IL20Ra, ZCYTOR7, Genbank рег. № AF184971); Clark H.F. et al., Genome Res. 13, 2265-2270, 2203; Mungall A.J. et al., Nature 425, 805-811, 2003; Blumberg H. et al., Cell 104, 9-19, 2001; Dumoutier L., et al., J. Immunol. 167, 3545-3549, 2001; Parrish-Novak J. et al., J. Biol. Chem. 277, 47517-47523, 2002; Pletnev S. et al., (2003) Biochemistry 42:12617-12624; Sheikh F. et al. (2004) J. Immunol. 172, 2006-2010; ЕР139274 (пример 11); US2004005320 (пример 5); WO2003029262 (страницы 74-75); WO2003002717 (п.2 формулы изобретения; страница 63); WO200222153 (страницы 45-47); WO2003002717 (п.2 формулы), US2002042366 (страницы 20-21); WO200146261 (страницы 57-59); WO200146232 (страницы 63-65); WO9837193 (п.1 формулы изобретения; страницы 55-59); рег. № Q9UHF4; Q6UWA9; Q96SH8; EMBL; AF184971; AAF01320.1, 553 аминокислоты:

(21) Brevican (BCAN, BEHAB, Genbank рег. № AF229053); Gary S.C. et al., Gene 256, 139-147, 2000; Clark H.F. et al. Genome Res. 13, 2265-2270, 2203; Strausberg R.L. et al. Proc. Natl. Acad. Sci., USA, 99, 16899-16903, 2002; US2003186372 (п.11 формулы изобретения); US2003186373 (п.11 формулы изобретения); US2003119131 (п.1 формулы изобретения; фиг.52); US2003119122 (п.1 формулы изобретения; фиг.52); US2003119126 (п.1 формулы изобретения); US2003119121 (п.1 формулы изобретения; фиг.52); US2003119129 (п.1 формулы изобретения); US2003119130 (п.1 формулы изобретения); US2003119128 (п.1 формулы изобретения; фиг.52); US2003119125 (п.1 формулы изобретения); WO2003016475 (п.1 формулы изобретения); WO200202634 (п.1 формулы изобретения); 911 аминокислот:
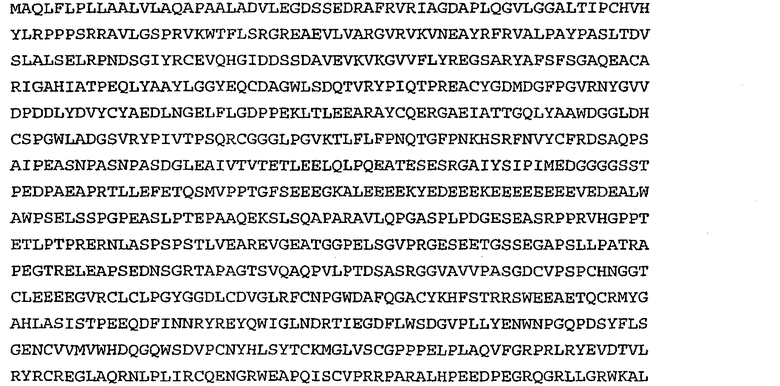

(22) EphB2R (DRT, ERK, Hek5, EPHT3, Tyro5, Genbank рег. № NM_004442); Chan J. & Watt V.M. Oncogene 6(6), 1057-1061 (1991) Oncogene 10(5):897-905 (1995), Annu. Rev. Neurosci. 21:309-345 (1998), Int. Rev. Cytol. 196:177-244 (2000)); WO2003042661 (п.12 формулы изобретения); WO200053216 (п.1 формулы изобретения; страница 41); WO2004065576 (п.1 формулы изобретения); WO2004020583 (п.9 формулы изобретения); WO2003004529 (страницы 128-132); WO200053216 (п.1 формулы изобретения; страница 42). Перекрестные ссылки: MIM:600997; NP_004433.2; NM_004442_1, 987 аминокислот:


(23) ASLG659 (B7h, Genbank рег. № AX092328), US20040101899 (п.2 формулы изобретения); WO2003104399 (п.11 формулы изобретения); WO2004000221 (фиг.3); US2003165504 (п.1 формулы изобретения); US2003124140 (пример 2); US2003065143 (фиг.60); WO2002102235 (п.13 формулы изобретения; страница 299); US2003091580 (пример 2); WO200210187 (п.6 формулы изобретения; фиг.10); WO2001194641 (п.12 формулы изобретения; фиг.7b); WO200202624 (п.13 формулы изобретения, фиг.1А-1В); US2002034749 (п.54 формулы изобретения; страницы 45-46); WO200206317 (пример 2; страницы 320-321; п.34 формулы изобретения; страницы 321-322); WO200271928 (страницы 468-469); WO200202587 (пример 1, фиг.1); WO200140269 (пример 3; страницы 190-192); WO200036107 (пример 2; страницы 205-207); WO2004053079 (п.12 формулы изобретения); WO2003004989 (п.1 формулы изобретения); WO200271928 (страницы 233-234, 452-453); WO0116318; 282 аминокислоты:

(24) PSCA (предшественник антигена стволовых клеток предстательной железы, Genbank рег. № AJ297436); Reiter R.E. et al., Proc. Natl. Acad. Sci., USA, 95, 1735-1740, 1998; Gu Z., et al., Oncogene 19, 1288-1296, 2000; Biochem. Biophys. Res. Commun. (2000)275(3):783-788; WO2004022709; ЕР1394274 (пример 11); US2004018553 (п.17 формулы изобретения); WO2003008537 (п.1 формулы изобретения); WO200281646 (п.1 формулы изобретения; страница 164); WO2003003906 (п.10 формулы изобретения; страница 288); WO200140309 (пример 1; фиг.17); US2001055751 (пример 1; фиг.1b); WO20032752 (п.18 формулы изобретения; фиг.1); WO9851805 (п.17 формулы изобретения; страница 97); WO9851824 (п.10 формулы изобретения; страница 94); WO98440403 (п.2 формулы изобретения; фиг.1В); рег. № O43653; EMBL; AF043498; AAC39607.1, 123 аминокислоты

(25) GEDA (Genbank рег. № AY260763); белок, подобный партнеру “гибрид HMGIC липомы AAP14954-Homo sapiens: Вид: Homo sapiens (человек) WO2003054152 (п.20 формулы изобретения); WO2003000842 (п.1 формулы изобретения); WO2003023013 (пример 3, п.20 формулы изобретения); US2003194704 (п.45 формулы изобретения). Перекрестные ссылки: GI:30102449; AAP14954.1; AY260763_1, 236 аминокислот

(26) BAFF-R (рецептор фактора активации В-клеток, рецептор BLyS 3, BR3, Genbank рег. № NP_443177.1); NP_443177 BAFF receptor/pid=NP_443177.1-Homo sapiens Thompson J.S. et al. Science 293 (5537), 2108-2111 (2001); WO2004058309; WO2004011611; WO2003045422 (пример; страницы 32-33); WO2003014294 (п.35 формулы изобретения; фиг.6В); WO2003035846 (п.70 формулы изобретения; страницы 615-616); WO200294852 (столбцы 136-137); WO200238766 (п.3 формулы изобретения; страница 133); WO200224909 (пример 3; фиг.3). Перекрестные ссылки: MIM:606269; NP_443177.1; NM_052945_1, 184 аминокислоты

(27) CD22 (В-клеточный рецептор CD22, изоформа В, Genbank рег. № NP-001762.1); Stamenkovic I. and Seed B., Nature 345 (6270), 74-77 (1990); US2003157113; US2003118592; WO2003062401 (п.9 формулы изобретения); WO2003072036 (п.1 формулы изобретения; фиг.1); WO200278524 (пример 2). Перекрестные ссылки: MIM:107266; NP_001762.1; NM_001771_1, 847 аминокислот:



(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок, В-клетко-специфический белок, который ковалентно взаимодействует с Ig бета (CD79B) и образует комплекс с молекулами IgM на поверхности клеток, передавая сигнал, участвующий в дифференцировке В-клеток) PROTEIN SEQUENCE Full mpggpgv...dvqlekp (1..226; 226 аминокислот), pI: 4.84, MW:25028 TM: 2[P] Gene Chromosome: 19q13.2, рег. № NP_001774.1; WO2003088808, US20030228319, WO2003062401 (п.9 формулы изобретения); US2002150573 (п.4 формулы изобретения, страницы 13-14); WO99558658 (п.13 формулы изобретения, фиг.16); WO9207574 (фиг.1); US5644033; Ha et al., (1992) J. Immunol. 148(5):1526-1531; Mueller et al., (1992) Eur. J. Biochem. 22:1621-1625; Hashimoto et al., (1994) Immunogenetics 40(4):287-295; Preud'homme et al., (1992) Clin. Exp. Immunol. 90(1):141-146; Yu et al. (1992) J. Immunol. 148(2) 633-637; Sakaguchi et al. (1988) EMBO J. 7(11):3457-3464; 226 аминокислот:

(29) CXCR5 (рецептор 1 лимфомы Беркитта, рецептор, связанный с G-белком и активируемый хемокином CXCL13, обеспечивает миграцию лимфоцитов и гуморальную защиту, а также играет определенную роль в инфицировании вирусом ВИЧ-2 и, вероятно, в развитии СПИД'а, лимфомы, миеломы и лейкоза) PROTEIN SEQUENCE Full mnypltl...atslttf (1..372, 372 аминокислоты), pI:8.54 MW:41959 TM: 7[P] Gene Chromosome: 11q23.3, Genbank рег. № NP_001707.1, WO200404000; WO2004015426; US2003105292 (пример 2); US6555339 (пример 2); WO200261087 (фиг.1); WO200157188 (п.20 формулы изобретения; страница 269); WO200172830 (страницы 12-13); WO200022129 (пример 1, страницы 152-153, пример 2, страницы 254-256); WO9928468 (п.1 формулы изобретения, страница 38); US5440021 (пример 2, столбцы 49-52); WO9428931 (страницы 56-58); WO9217497 (п.7 формулы изобретения; фиг.5); Dobner et al. (1992) Eur. J. Immunol. 22:2795-2799; Barella et al., (1995) Biochem. J. 309:773-779; 372 аминокислоты:

(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Ia), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам) PROTEIN SEQUENCE Full mgsgwvp...vllpqsc (1...273; 273 аминокислоты, pI:6.56 MW:30820 TM:1[P] Gene Chromosome: 6р21.3, Genbank рег. № NP_002111.1; Tonnelle et al. (1985) EMBO J. 4(11):2839-2847; Jonsson et al., (1989) Immunogenetics 29(6):411-413; Beck et al. (1992) J. Mol. Biol. 228:433-441; Strausberg et al. (2002) Proc. Natl. Acad. Sci., USA, 99:16899-16903; Servenius et al. (1987) J. Biol. Chem. 262:8759-8766; Beck et al., (1996) J. Mol. Biol. 255:1-13; Naruse et al., (2002) Tissue Antigens 59:512-519; WO9958658 (п.13 формулы изобретения; фиг.15); US6153408 (столбцы 35-38); US5976551 (столбцы 168-170); US6011146 (столбцы 145-146); Kashara et al., (1989) Immunogenetics 30(1):66-68; Larhammar et al. (1985) J. Biol. Chem. 260(26):14111-14119; 273 аминокислоты:


(31) Р2Х5 (ионный канал -5, открываемый лигандом пуринергического рецептора Р2Х; ионный канал, открываемый внеклеточным АТР, может участвовать в синаптической передаче и в нейрогенезе, а его дефицит может играть определенную роль в патофизиологии идиопатической дисфункции мочевого пузыря) PROTEIN SEQUENCE Full mgqagck...lephrst (1..422; 422 аминокислоты), pI:7.63; MW 47206 TM:1[P] Gene Chromosome: 17р13.3, Рег. № NP_002552.2; Le et al. (1997) FEBS Lett. 418(1-2):195-199; WO2004047749; WO2003072035 (п.10 формулы изобретения); Touchman et al. (2000) Genome Res. 10:165-173; WO200222660 (п.20 формулы изобретения); WO2003093444 (п.1 формулы изобретения); WO2003087768 (п.1 формулы изобретения); WO2003029277 (страница 82); 422 аминокислоты:


(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2) PROTEIN SEQUENCE Full maeaity...tafrfpd (1..359; 359 аминокислот), pI: 8.66, MW:40255 TM:1[P] Gene Chromosome: 9р13.3, рег. № NP_001773.1; WO2004042346 (п.65 формулы изобретения); WO2003026493 (страницы 51-52, 57-58); WO200075655 (страницы 105-106); Von Hoegen et al. (1990) J. Immunol. 144(12):4870-4877; Strausberg et al. (2002) Proc. Natl. Acad. Sci., USA, 99:16899-16903; 359 аминокислот:

(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок, относящийся к семейству белков с богатыми лейцином повторами (LRR), типа I, который регулирует активацию и апоптоз В-клеток, и потеря функции этого белка ассоциируется с прогрессированием у пациентов системной красной волчанки) PROTEIN SEQUENCES Full mafdvsc...rwkyqhi (1..661; 661 аминокислота), pI:6.20, MW:74147 TM 1[P] Gene Chromosome 5q12, Genbank рег. № NP_005573.1; US2002193567; WO9707198 (п.11 формулы изобретения; страницы 39-42); Miura et al. (1996) Genomic 38(3):299-304; Miura et al., (1998) Blood 92:2815-2822; WO2003083047; WO9744452 (п.8 формулы изобретения; страницы 57-61); WO200012130 (страницы 24-26); 661 аминокислота:

(34) FCRH1 (Fc-рецептор-подобный белок 1, предполагаемый рецептор для Fc-домена иммуноглобулина, который содержит Ig-подобные домены типа С2 и домены ITAM и может играть определенную роль в дифференцировке В-лимфоцитов) PROTEIN SEQUENCE Full mlprlll...vdyedam (1..429; 429 аминокислот), pI:5.28, MW:46925 TM:1[P] Gene Chromosome: 1q21-1q22, Genbank рег. № NP_443170.1); WO2003077836; WO2001384090 (п.6 формулы изобретения, фиг.18Е-1-18-Е2); Davis et al. (2001) Proc. Natl. Acad. Sci., USA, 98(17):9772-9777; WO2003089624 (п.8 формулы изобретения); ЕР1347046 (п.1 формулы изобретения); WO2003089624 (п.7 формулы изобретения); 429 аминокислот:


(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2, предполагаемый иммунорецептор, который, возможно, играет определенную роль в развитии В-клеток и в лимфомагенезе; причем в некоторых злокачественных В-клетках наблюдается нарушение регуляции гена посредством транслокации) PROTEIN SEQUENCE Full mllwvil...assaphr (1..977; 977 аминокислот), pI:6.88, MW:106468 TM:1[P] Gene Chromosome: 1q21, Genbank рег. № NP_112571.1; WO2003024392 (п.2 формулы изобретения; фиг.97); Nakayama et al., (2000) Biochem. Biophys. Res. Commun. 277(1):124-127; WO2003077836; WO200138490 (п.3 формулы изобретения; фиг.18В-1-18В-2); 977 аминокислот:

См. также: WO04/045516 (3 июня 2004); WO03/000113 (3 января 2003); WO02/016429 (28 февраля 2002); WO02/16581 (28 февраля 2002); WO03/024392 (27 марта 2003); WO04/016225 (26 февраля 2004); WO01/40309 (7 июня 2001) и предварительную заявку на патент США, рег. № 60/520842 “COMPOSITIONS AND METHODS FOR THE TREATMENT OF TUMOR OF HEMATOPOIETIC ORIGIN”, поданную 17 ноября 2003, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
В одном из вариантов изобретения конъюгат “лиганд-линкер-лекарственное средство” имеет формулу IIIa, где лиганд представляет собой антитело Ab, включая антитело, которое связывается, по меньшей мере, с одним из антигенов CD30, CD40, CD70, Lewis Y, w=0, y=0, а D имеет формулу Ib. Репрезентативными конъюгатами формулы IIIa являются конъюгаты, в которых R17 представляет собой -(СН2)5-. Настоящее изобретение включает также такие конъюгаты формулы IIIa, в которых D имеет структуру соединения 2 в примере 3 и его сложных эфиров. Настоящее изобретение включает также конъюгаты формулы IIIa, содержащие примерно от 3 до 8, а в одном из аспектов, примерно от 3 до 5 молекул лекарственного средства D, то есть конъюгаты формулы Ia, где р имеет величину, составляющую в пределах примерно от 3 до 8, например примерно 3-5. В объем соединений согласно изобретению входят также конъюгаты, имеющие комбинации структурных признаков, указанных в данном параграфе.
В другом варианте изобретения конъюгат “лиганд-линкер-лекарственное средство” имеет формулу IIIa, где лиганд представляет собой антитело Ab, включая антитело, которое связывается с одним из антигенов CD30, CD40, CD70, Lewis Y, w=1, y=0, а D имеет формулу Ib. Настоящее изобретение также включает такие конъюгаты формулы IIIa, в которых R17 представляет собой -(СН2)5-. Настоящее изобретение также включает такие конъюгаты формулы IIIa, в которых W представляет собой Val-Cit и/или в которых D имеет структуру соединения 2, описанную в примере 3, и его сложных эфиров. Настоящее изобретение также включает конъюгаты формулы IIIa, содержащие примерно от 3 до 8, а предпочтительно примерно от 3 до 5 молекул лекарственного средства D, то есть конъюгаты формулы Ia, где р имеет величину, составляющую в пределах примерно от 3 до 8, например примерно 3-5. Репрезентативными конъюгатами также являются конъюгаты, имеющие комбинации структурных признаков, указанных в данном параграфе.
В другом варианте изобретения конъюгат “лиганд-линкер-лекарственное средство” имеет формулу IIIa, где лиганд представляет собой антитело Ab, включая антитело, которое связывается с одним из антигенов CD30, CD40, CD70, Lewis Y, w=1, y=1, а D имеет формулу Ib. Настоящее изобретение также включает такие конъюгаты формулы IIIa, в которых R17 представляет собой -(СН2)5-. Настоящее изобретение также включает такие конъюгаты формулы IIIa, в которых W представляет собой Val-Cit, Y имеет формулу Х; D имеет структуру соединения 2, описанную в примере 3, и его сложных эфиров; р составляет примерно от 3 до 8, а предпочтительно примерно от 3 до 5 молекул лекарственного средства D. В объем соединений согласно изобретению входят также конъюгаты, имеющие комбинации структурных признаков, указанных в данном параграфе.
В другом своем варианте настоящее изобретение относится к конъюгату “антитело-лекарственное средство” (ADC) или к его фармацевтически приемлемой соли или сольвату, где Ab представляет собой антитело, которое связывается с одним из опухолеассоциированных антигенов (1)-(35), указанных выше (“соединение ТАА”).
В другом своем варианте настоящее изобретение относится к соединению ТАА или к его фармацевтически приемлемой соли или сольвату, которые присутствуют в выделенной и очищенной форме.
В другом своем варианте настоящее изобретение относится к способу предотвращения или ингибирования размножения опухолевых или раковых клеток, включающему введение пациенту, например человеку, страдающему гиперпролиферативным расстройством, соединения ТАА или его фармацевтически приемлемой соли или сольвата в количестве, эффективном для предотвращения или ингибирования размножения опухолевых или раковых клеток.
В другом своем варианте настоящее изобретение относится к способу лечения рака, включающему введение пациенту, например человеку, страдающему гиперпролиферативным расстройством, соединения ТАА или его фармацевтически приемлемой соли или сольвата в количестве, эффективном для лечении рака, отдельно или в сочетании с эффективным количеством другого противоракового средства.
В другом своем варианте настоящее изобретение относится к способу лечения аутоиммунного заболевания, включающему введение пациенту, например человеку, страдающему гиперпролиферативным расстройством, соединения ТАА или его фармацевтически приемлемой соли или сольвата в количестве, эффективном для лечения аутоиммунного заболевания.
Антитела, подходящие для их применения в настоящем изобретении, могут быть получены любым известным методом синтеза антител, а в частности методом химического синтеза или экспрессии рекомбинантных ДНК, а предпочтительно методом экспрессии рекомбинантных ДНК.
4.5.1. Продуцирование рекомбинантных антител
Антитела согласно изобретению могут быть получены любым известным методом синтеза антител, а в частности методом химического синтеза или экспрессии рекомбинантных ДНК.
Для рекомбинантной экспрессии антител или их фрагментов, производных или аналогов необходимо сконструировать нуклеиновую кислоту, кодирующую такое антитело. Если нуклеотидная последовательность для данного антитела является известной, то сборка нуклеиновой кислоты, кодирующей такое антитело, может быть осуществлена из химически синтезированных олигонуклеотидов (например, как описано у Kutmeier et al., 1994, BioTechniques 17:242), и такая сборка включает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, отжиг и лигирование этих олигонуклеотидов, а затем амплификацию лигированных олигонуклеотидов, например, с помощью ПЦР.
Альтернативно, молекула нуклеиновой кислоты, кодирующая антитело, может быть получена из подходящего источника. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, не является коммерчески доступным, но при этом известна последовательность антитела, то нуклеиновая кислота, кодирующая антитело, может быть получена из подходящего источника (например, из библиотеки кДНК антител или из библиотеки кДНК, продуцированной из любой ткани или любых клеток, экспрессирующих иммуноглобулин), например, с помощью ПЦР-амплификации с использованием синтетических праймеров, гибридизирующихся с 3'- и 5'-концами последовательности, или путем клонирования с использованием олигонуклеотидного зонда, специфичного к конкретной генной последовательности.
Если антитело, которое специфически распознает конкретный антиген (или источник библиотеки кДНК для клонирования нуклеиновой кислоты, кодирующей такой иммуноглобулин), не является коммерчески доступным, то антитела, специфичные к данному антителу, могут быть получены любым известным методом, например путем иммунизации пациента или подходящего животного-модели, такого как кролик или мышь, для продуцирования поликлональных антител либо более предпочтительно путем генерирования моноклональных антител, например, как описано Kohler и Milstein (1975, Nature 256:495-497) или как описано Kozbor et al. (1983, Immunology Today 4:72) или Cole et al. (1985 in Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., p.77-96). Альтернативно, клон, кодирующий, по меньшей мере, Fab-фрагмент антитела, может быть получен путем скрининга Fab-экспрессирующих библиотек (например, как описано Huse et al., 1989, Science 246:1275-1281) на клоны Fab-фрагментов, связывающихся со специфическим антигеном, или путем скрининга библиотек антител (см., например, Clackson et al., 1991, Nature 352:624; Hane et al. 1997, Proc. Natl. Acad. Sci., USA, 94:4937).
После получения последовательности нуклеиновой кислоты, кодирующей, по меньшей мере, вариабельный домен антитела, она может быть введена в вектор, содержащий нуклеотидную последовательность, кодирующую константные области антитела (см., например, публикации Международных заявок № WO86/05807; WO89/01036 и патент США № 5122464). Векторы, содержащие полноразмерную легкую или тяжелую цепь и позволяющие экспрессировать полноразмерную молекулу антитела, являются коммерчески доступными. Затем нуклеиновая кислота, кодирующая антитело, может быть использована для введения нуклеотидных замен или делеций, необходимых для замены (или делеции) одного или нескольких цистеиновых остатков вариабельной области, участвующих в образовании внутрицепьевой дисульфидной связи, на аминокислотный остаток, который не содержит сульфгидрильную группу. Такие модификации могут быть проведены любыми известными методами введения специфических мутаций или делеций в нуклеотидную последовательность, и такими методами являются, но не ограничиваются ими, например, метод химического мутагенеза и сайт-направленного мутагенеза in vitro (Hutchinson et al. 1978, J. Biol. Chem. 253:6551).
Кроме того, могут быть применены методы, разработанные для продуцирования “химерных антител” (Morrison et al. 1984, Proc. Natl. Acad. Sci. 81:851-855; Neuberger et al., 1984, Nature 312:604-608; Takeda et al., 1985, Nature 314:452-454) путем сплайсинга генов молекулы мышиного антитела, обладающей соответствующей специфичностью к антигену, вместе с генами молекулы человеческого антитела, обладающей соответствующей биологической активностью. Химерным антителом является молекула, в которой различные части происходят от животных различных видов, такие как части, имеющие вариабельную область, происходящую от мышиного моноклонального антитела, и константную область человеческого иммуноглобулина, например гуманизованное антитело.
Альтернативно, для продуцирования одноцепочечных антител могут быть адаптированы известные методы, применяемые для получения таких антител (патент США № 4694778; Bird, 1988, Science 242:423-42; Huston et al., 1988, Proc. Natl. Acad. Sci., USA, 85:5879-5883 и Ward et al., 1989, Nature 334:544-54). Одноцепочечные антитела продуцируют путем связывания фрагментов Fv-области тяжелой и легкой цепей посредством аминокислотного мостика, в результате чего образуется одноцепочечный полипептид. Могут быть также применены методы сборки функциональных Fv-фрагментов в E.coli (Skerra et al., 1988, Science 242:1038-1041).
Фрагменты антител, распознающие специфические эпитопы, могут быть продуцированы известными методами. Так, например, такими фрагментами являются, но не ограничиваются ими, F(ab')2-фрагменты, которые могут быть продуцированы путем гидролиза молекулы антитела пепсином, и Fab-фрагменты, которые могут быть продуцированы путем восстановления дисульфидных мостиков F(ab')2-фрагментов.
После получения последовательности нуклеиновой кислоты, кодирующей антитело, может быть получен вектор для продуцирования антитела хорошо известными методами рекомбинантных ДНК. Для конструирования экспрессионных векторов, содержащих последовательности, кодирующие антитела и соответствующие сигналы регуляции транскрипции и трансляции, могут быть применены методы, хорошо известные специалистам. Такими методами являются, например, методы рекомбинантных ДНК in vitro, методы синтеза и методы генетической рекомбинации in vivo. См., например, методы, описанные в руководстве Sambrook et al. (1990, Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, NY) и Ausubel et al. (eds., 1998, Current Protocols in Molecular Biology, John Wiley & Sons, NY).
Экспрессионный вектор, содержащий нуклеотидную последовательность антитела, или сама нуклеотидная последовательность антитела могут быть перенесены в клетку-хозяина стандартными методами (например, путем электропорации, липосомной трансфекции и преципитации фосфатом кальция), после чего трансфецированные клетки могут быть культивированы стандартными методами продуцирования антител. В конкретных вариантах осуществления изобретения экспрессия антитела регулируется конститутивным, индуцибельным или тканеспецифическим промотором.
Клетками-хозяевами, используемыми для экспрессии рекомбинантного антитела, могут быть либо бактериальные клетки, такие как Escherichia coli, или предпочтительно эукариотические клетки, в частности клетки, подходящие для экспрессии полноразмерной рекомбинантной молекулы иммуноглобулина. В частности, эффективной системой экспрессии иммуноглобулинов являются клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО) в комбинации с вектором, таким как промоторный элемент основного предраннего гена, происходящий от человеческого цитомегаловируса (Foecking et al., 198, Gene 45:101; Cockett et al., 1990, BioTechnology 8:2).
Для экспрессии иммуноглобулинов (антител) могут быть использованы различные системы “хозяин-экспрессионный вектор”. Такие системы “хозяин-экспрессионный вектор” представляют собой носители, посредством которых последовательности, кодирующие антитела, могут быть продуцированы, а затем очищены, однако такими системами могут быть также клетки, которые, при их трансформации или трансфекции соответствующими нуклеотидными кодирующими последовательностями, экспрессируют молекулу иммуноглобулина (антитела) in situ. Такими клетками являются, но не ограничиваются ими, микроорганизмы, такие как бактерии (например, E.coli и B. subtilis), трансформированные векторами, экспрессирующими рекомбинантную бактериофаговую ДНК, плазмидную ДНК или космидную ДНК и содержащими последовательности, кодирующие иммуноглобулин; дрожжи (например, Saccharomyces Pichia), трансформированные рекомбинантными векторами для экспрессии в дрожжах, содержащими последовательности, кодирующие иммуноглобулин; клеточные системы насекомых, инфицированные рекомбинантными вирусными экспрессионными векторами (например, бакуловирусами), содержащими последовательности, кодирующие иммуноглобулин; клеточные системы насекомых, инфицированные рекомбинантными вирусными экспрессионными векторами (например, вирусом мозаики цветной капусты (CaMV) и вирусом мозаики табака (TMV)) или трансформированные рекомбинантными плазмидными экспрессионными векторами (например, плазмидой Ti), содержащими последовательности, кодирующие иммуноглобулин; или клеточные системы млекопитающих (например, клетки COS, СНО, ВН, 293, 293Т, 3Т3), содержащие рекомбинантные экспрессионные конструкции, включающие промоторы, происходящие от генома клеток млекопитающих (например, промотор металлотионеина) или от вирусов млекопитающих (например, поздний промотор аденовируса; промотор 7.5К вируса коровьей оспы).
В бактериальных системах ряд экспрессионных векторов может быть выбран преимущественно в зависимости от цели применения экспрессируемого антитела. Так, например, если продуцируются большие количества такого белка, то желательно, чтобы векторы, которые направлены на экспрессию высоких уровней продуктов гибридного белка, могли быть легко очищены. Такими векторами являются, но не ограничиваются ими, экспрессионный вектор pUR278 E.coli (Ruther et al., 1983, EMBO J. 2:1791), в котором антитело-кодирующая последовательность может быть отдельно лигирована в вектор, в одной и той же рамке считывания, с кодирующей областью lac Z, так, чтобы в результате этого продуцировался гибридный белок; векторы pIN (Inouye & Inouye, 1985, Nucleic Acids Res. 13:3101-3109; Van Heeke & Schuster 1989, J. Biol. Chem. 24:5503-5509) и т.п. Для экспрессии чужеродных полипептидов в виде гибридных белков с глутатион-S-трансферазой (GST) могут быть использованы векторы pGEX. В общих чертах такие гибридные белки являются растворимыми и могут быть легко очищены от лизированных клеток путем адсорбции и связывания со сферами-матрицами, покрытыми глутатион-агарозой, с последующим элюированием в присутствии свободного глутатиона. Векторы pGEX конструируют так, чтобы они включали сайты расщепления тромбином или протеазой фактора Ха, в результате чего нужный клонированный генный продукт может высвобождаться из молекулы GST.
В системе насекомых в качестве вектора для экспрессии чужеродных генов применяется вирус ядерного полиэдроза Autographa californica (AcNPV) или аналогичный вирус Drosophila Melanogaster. Этот вирус продуцируется в клетках Spodoptera frugiperda. Последовательность, кодирующая антитело, может быть клонирована отдельно во второстепенные области (например, в область гена полиэдрина) вируса и помещена под контроль промотора AcNPV (например, промотора полиэдрина).
В клетках-хозяевах млекопитающих может быть использован ряд экспрессионных систем на основе вирусов. В тех случаях когда в качестве экспрессионного вектора используется аденовирус, представляющая интерес антитело-кодирующая последовательность может быть лигирована с комплексом, регулирующим транскрипцию/трансляцию аденовируса, например, с поздним промотором и трехкомпонентной лидерной последовательностью. Затем этот химерный ген может быть встроен в геном аденовируса путем in vitro или in vivo рекомбинации. Встраивание во второстепенную область вирусного генома (например, область Е1 или Е3) приводит к образованию рекомбинантного вируса, который является жизнеспособным и может экспрессировать молекулу иммуноглобулина в инфицированных хозяевах (см., например, Logan & Shenk, 1984, Proc. Natl. Acad. Sci., USA, 81:355-359). Для эффективной трансляции встроенных антитело-кодирующих последовательностей могут также потребоваться специфические сигналы инициации. Такими сигналами являются инициирующий кодон ATG и смежные последовательности. Кроме того, для гарантии трансляции всей вставки инициирующий кодон должен находиться в той же самой рамке считывания, что и нужная кодирующая последовательность. Эти экзогенные сигналы регуляции трансляции и инициирующие кодоны могут происходить от различных источников, то есть они могут быть природными и синтетическими. Эффективность экспрессии может быть увеличена путем включения соответствующих энхансерных элементов транскрипции, терминаторов транскрипции и т.п. (см. Bittner et al., 1987, Methods in Enzymol. 153:51-544).
Кроме того, для модуляции экспрессии встроенных последовательностей или для модификации и специфического процессинга нужного генного продукта может быть выбран соответствующий штамм клетки-хозяина. Такие модификации (например, гликозилирование) и процессинг (например, отщепление) белковых продуктов могут играть важную роль в функционировании белка. Различные клетки-хозяева обладают характерными и специфическими механизмами посттрансляционного процессинга и модификации белков и генных продуктов. Для гарантии осуществления нужной модификации и процессинга экспрессируемого чужеродного белка могут быть выбраны соответствующие клеточные линии или системы-хозяева. Для достижения этой цели могут быть использованы эукариотические клетки-хозяева, обладающие клеточным механизмом для соответствующего процессинга первичного транскрипта, для гликозилирования и фосфорилирования генного продукта. Такими клетками-хозяевами млекопитающих являются, но не ограничиваются ими, СНО, VERY, ВН, HeLa, COS, MDCK, 293, 293Т, 3Т3, WI38, BT483, Hs578T, НТВ2, BT20 и T47D, CRL7030 и Hs578Bst.
Для продолжительного высокоэффективного продуцирования рекомбинантных белков предпочтительной является стабильная экспрессия. Так, например, могут быть сконструированы клеточные линии, стабильно экспрессирующие антитело. Для этого вместо экспрессионных векторов, содержащих вирусные ориджины репликации, могут быть использованы клетки-хозяева, трансформированные ДНК, находящейся под контролем соответствующих элементов регуляции экспрессии (например, последовательностей промотора, энхансера, терминаторов транскрипции, сайтов полиаденилирования и т.п.) и селективного маркера. После введения чужеродной ДНК сконструированные клетки могут быть помещены на 1-2 дня в обогащенную среду для роста, а затем эта среда может быть заменена селективной средой. Селективный маркер в рекомбинантной плазмиде сообщает резистентность к агенту, выбранному для отбора, и позволяет клеткам стабильно интегрировать эту плазмиду в свои хромосомы и расти с образованием локусов, которые, в свою очередь, могут быть клонированы и амплифицированы в клеточные линии. Этот метод может преимущественно применяться для конструирования клеточных линий, экспрессирующих антитело. Такие сконструированные клеточные линии могут быть особенно эффективными для скрининга и оценки опухолевых антигенов, которые прямо или опосредованно взаимодействуют с антителом.
Различные системы отбора, включая, но не ограничиваются ими, ген тимидин-киназы вируса простого герпеса (Wigler et al., 1977, Cell 11:223), гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska & Szybalska, 192, Proc. Natl. Acad. Sci. USA, 48:202) и аденин-фосфорибозилтрансферазы (Lowy et al., 1980, Cell 22:817), могут применяться в tk-, hgprt- или aprt-клетках соответственно. Кроме того, резистентность к антиметаболитам может быть использована в качестве основы для отбора на следующие гены: DHFR, который сообщает резистентность к метотрексату (Wigler et al., Proc. Natl. Acad. Sci., USA, 77:357; O'Hare et al., 1981, Proc. Natl. Acad. Sci., USA, 78:1527); gpt, который сообщает резистентность к микофеноловой кислоте (Mulligan & Berg, 1981, Proc. Natl. Acad. Sci., USA, 78:2072); neo, который сообщает резистентность к аминогликозиду G-418 (Clinical Pharmacy 12:488-505; Wu & Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, 1993, Science 260:926-932 & Morgan & Anderson, 1993, Ann. Rev. Biochem. 62:191-217; May, 1993, TIB TECH 11(5):155-217), и hygro, который сообщает резистентность к гигромицину (Santerre et al., 1984, Gene 30:147). Хорошо известные методы, применяемые в технике рекомбинантных ДНК, описаны у Ausubel et al. (eds. 1993, Current Protocols in Molecular Biology, John Wiley & Sons, NY; Kriegler, 1990, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY и в главах 12 и 13 руководства Dracopoli et al. (eds), 1994, Current Protocols in Human Genetics, John Wiley & Sons, NY; Colberre-Garapin et al., 1981, J. Mol. Biol. 150:1).
Уровни экспрессии антитела могут быть повышены путем амплификации вектора (обзор см., например, Bebbington & Hentschel, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol. 3 (Academic Press, New York, 1987)). Если маркер в векторной системе, экспрессирующей антитело, является амплифицируемым, то по мере увеличения уровня ингибитора, присутствующего в культуре клетки-хозяина, будет увеличиваться число копий маркерного гена. Поскольку амплифицируемая область ассоциируется с нуклеотидной последовательностью антитела, то будет также увеличиваться уровень продуцирования данного антитела (Crouse et al., Mol. Cell. Biol. 3:257).
Клетка-хозяин может быть ко-трансфецирована двумя экспрессионными векторами, первым вектором, кодирующим полипептид тяжелой цепи, и вторым вектором, кодирующим полипептид легкой цепи. Эти два вектора могут содержать идентичные селективные маркеры, которые позволяют осуществлять экспрессию полипептидов тяжелой и легкой цепей. Альтернативно, для кодирования полипептидов тяжелой и легкой цепей может быть использован один и тот же вектор. В этих случаях, во избежание избыточного продуцирования токсичной свободной тяжелой цепи, легкая цепь должна быть расположена перед тяжелой цепью (Proudfoot, 1986, Nature 322:52; Kohler, 1980, Proc. Natl. Acad. Sci., USA, 77:2197). Кодирующие последовательности тяжелой и легкой цепей могут содержать кДНК или геномную ДНК.
После рекомбинантной экспрессии антитела оно может быть очищено любым известным методом, применяемым для очистки антител, например путем хроматографии (ионообменной, аффинной, а в частности хроматографии по сродству к специфическому антигену на колонке с белком А, и эксклюзионной хроматографии), центрифугирования, разделения исходя из различной растворимости или любыми другими стандартными методами очистки белков.
В еще одном репрезентативном примере данное антитело является моноклональным антителом.
В любом случае гибридные антитела могут иметь двойную специфичность предпочтительно благодаря присутствию одного или нескольких сайтов связывания, специфичных к нужному гаптену, или одного или нескольких сайтов связывания, специфичных к антигену-мишени, например к антигену, ассоциированному с опухолью, с аутоиммунным заболеванием, с инфекционным микроорганизмом или с другим патологическим состоянием.
4.5.2. Продуцирование антител
Продуцирование антител будет проиллюстрировано ниже на антителах против CD30, однако для каждого специалиста очевидно, что аналогичным образом могут быть продуцированы и модифицированы антитела против других членов семейства рецепторов TNF. Использование CD30 для продуцирования антител приводится лишь в иллюстративных целях и не имеет конкретных ограничений.
Антиген CD30, используемый для продуцирования антител, может, например, иметь растворимую форму внеклеточного домена CD30 или его части, содержащую нужный эпитоп. Альтернативно, для генерирования антител могут быть использованы клетки, экспрессирующие CD30 на своей поверхности (например, L540 (клеточная линия, происходящая от ходжкинской лимфомы, с Т-клеточным фенотипом) и L428, (клеточная линия, происходящая от ходжкинской лимфомы, с В-клеточным фенотипом)). Специалистам известны и другие формы CD30, которые могут быть использованы для продуцирования антител.
В другом репрезентативном варианте изобретения антиген ErbB2, используемый для продуцирования антител, может, например, иметь растворимую форму внеклеточного домена ErbB2 или его части, содержащей нужный эпитоп. Альтернативно, для генерирования антител могут быть использованы клетки, экспрессирующие ErbB2 на своей поверхности (например, трансформированные клетки NIH-3Т3, экспрессирующие избыточные уровни ErbB2; или клеточная линия карциномы, такая как клетки SK-BR-3, см. Stancovski et al., Proc. Natl. Acad. Sci. USA, 88:8691-8695 (1991)). Специалистам известны и другие формы ErbB2, которые могут быть использованы для продуцирования антител.
(i) Поликлональные антитела
Поликлональные антитела предпочтительно вырабатываются у животных после множества подкожных (s.c.) или внутрибрюшинных (i.p.) инъекций соответствующего антигена и адъюванта. Они могут использоваться для конъюгирования соответствующего антигена с белком, который является иммуногенным для видов, подвергаемых иммунизации, например с гемоцианином лимфы улитки, сывороточным альбумином, бычьим тироглобулином или соевым ингибитором трипсина с использованием бифункционального или дериватизирующего агента, например малеимидобензоилсульфосукцинимидоэфира (конъюгированного посредством цистеиновых остатков), N-гидроксисукцинимида (посредством лизиновых остатков), глутаральдегида, ангидрида янтарной кислоты, SOCl2 или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизируют антигеном, иммуногенными конъюгатами или дериватами путем объединения, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей соответственно) с 3 объемами полного адъюванта Фрейнда и путем подкожной инъекции раствора во множество участков. Через месяц животных повторно иммунизируют во множество участков путем подкожной инъекции 1/5-1/10 от первоначального количества пептида или конъюгата в полном адъюванте Фрейнда. Через 7-14 дней у животных берут кровь и анализируют сыворотку на титр антител. Затем животных повторно иммунизируют до достижения плато титра. Повторную иммунизацию животных предпочтительно осуществляют путем инъекции конъюгата того же самого антигена, но конъюгированного с другим белком и/или посредством другого перекрестно-сшивающего реагента. Конъюгаты могут быть также получены в рекомбинантной клеточной культуре в виде гибридных белков. Кроме того, для усиления иммунного ответа могут быть также использованы агрегирующие агенты, такие как квасцы.
(ii) Моноклональные антитела
Моноклональные антитела получают из популяции, по существу, гомогенных антител, то есть отдельных антител, составляющих данную популяцию, которые являются идентичными, за исключением антител, имеющих природные мутации, которые могут присутствовать в небольших количествах. Таким образом, прилагательное “моноклональный” указывает на тип антитела, которое не является смесью дискретных антител.
Так, например, моноклональные антитела могут быть получены с применением гибридомной технологии Kohler et al. Nature, 256:495 (1975), либо они могут быть получены методами рекомбинантных ДНК (патент США № 4816567).
Для получения гибридом мышь или другое подходящее животное-хозяин, такое как хомячок, иммунизируют, как описано выше, для вырабатывания у них лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты подвергают слиянию с миеломными клетками с использованием подходящего агента для слияния, такого как полиэтиленгликоль, в результате чего образуются гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и культивируют в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание не-слитых родительских миеломных клеток. Так, например, если родительские миеломные клетки не содержат фермента гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT или HPRT), то культуральная среда для получения гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда НАТ), то есть вещества, предупреждающие рост HGPRT-дефицитных клеток.
Предпочтительными миеломными клетками являются клетки, которые способны подвергаться эффективному слиянию, поддерживать стабильное продуцирование высоких уровней антител выбранными антитело-продуцирующими клетками и являются чувствительными к среде, такой как среда НАТ. Из этих клеток предпочтительными миеломными клеточными линиями являются мышиные миеломные линии, такие как клеточные линии, происходящие от клеток мышиных опухолей МОРС-21 и МРС-11, имеющихся в институте Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или Х63-Ag8-653, имеющиеся в Американской коллекции типовых культур, Rockville, Maryland USA. Для продуцирования человеческих моноклональных антител также используются человеческие миеломные клеточные линии и гетеромиеломные клеточные линии “мышь-человек” (Kozbor J. Immunol., 133:3001 (1984) & Brodeur et al., Monoclonal Antibody Production Techniques and Applications, p.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду для роста гибридомных клеток анализируют на продуцирование моноклональных антител против антигена. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют предпочтительно путем иммунопреципитации или путем проведения in vitro анализа на связывание, такого как радиоиммуноанализ (РИА) или твердофазный иммунноферментный анализ (ELISA). Аффинность связывания моноклонального антитела может быть, например, определена с помощью анализа Скэтчарда, описанного Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела с нужной специфичностью, аффинностью и/или активностью, клоны могут быть субклонированы путем проведения процедур лимитирующего разведения и культивированы стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)). Подходящими культуральными средами, предназначенными для достижения данной цели, являются, например, среда D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в качестве асцитных опухолей у животных.
Моноклональные антитела, секретированные субклонами, соответствующим образом выделяют из культуральной среды, асцитной жидкости или сыворотки путем проведения стандартных процедур очистки антител, таких как, например, хроматография на белке А-сефарозе, хроматография на гидроксиапатитах, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Предпочтительным источником такой ДНК служат гибридомные клетки. После выделения эта ДНК может быть встроена в экспрессионные векторы, которые затем трансфецируют в клетки-хозяева, такие как клетки E.coli, обезьяньи клетки COS, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые в иных случаях не продуцируют белок антитела, в результате чего в этих рекомбинантных клетках-хозяевах синтезируются моноклональные антитела. Обсуждение рекомбинантной экспрессии антитело-кодирующей ДНК в бактериях можно найти в статьях Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) и Plückthun, Immunol. Revs., 130:151-188 (1992).
В другом варианте изобретения моноклональные антитела или фрагменты антител могут быть выделены из фаговой библиотеки антител, созданной методами, описанными McCafferty et al., Nature, 348:552-554 (1990). В работе Clackson et al. Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991) описано выделение мышиных и человеческих антител соответственно с использованием фаговых библиотек. В более поздних публикациях описано продуцирование высокоаффинных (порядка нМ) человеческих антител посредством перестановки генов цепей антитела (Marks et al. Bio/Technology, 10:779-783 (1992)), а также путем комбинированного инфицирования и рекомбинации in vivo, применяемой в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al. Nuc. Acids. Res. 21:2265-2266 (1993)). Таким образом, эти методы являются приемлемой альтернативой традиционной гибридомной технологии, применяемой для выделения моноклональных антител.
ДНК может быть также модифицирована, например, путем замены последовательности, кодирующей константные домены тяжелой цепи и легкой цепи человеческого антитела, гомологичными последовательностями мышиных антител (патент США № 4816567 и Morrison et al. (1984) Proc. Natl. Acad. Sci. USA 81:6851) или путем ковалентного присоединения к кодирующей последовательности для иммуноглобулина всей или части кодирующей последовательности для не-иммуноглобулирового полипептида.
Обычно такие не-иммуноглобулировые полипептиды используют для замены константных доменов антитела либо их используют для замены вариабельных доменов одного антигенсвязывающего сайта, для получения химерного бивалентного антитела, обладающего специфичностью к одному антигену, или другого антигенсвязывающего сайта, обладающего специфичностью к другому антигену.
(iii) Гуманизованные антитела
Гуманизованное антитело может иметь один или несколько введенных в него аминокислотных остатков, происходящих от источника, не являющегося человеком. Эти не-человеческие аминокислотные остатки часто называют “импортными” остатками, которые обычно берут из “импортного” вариабельного домена. Гуманизация может быть осуществлена, в основном, методом Винтера (Winter) и сотрудниками (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoyen et al., Science 239:1534-1536 (1988)) путем замены последовательностей гипервариабельной области соответствующими последовательностями человеческого антитела. В соответствии с этим такие “гуманизованные” антитела представляют собой химерные антитела (патент США № 4816567), в которых, в основном, меньшая часть, по сравнению с вариабельным доменом интактного человеческого антитела, заменена соответствующей последовательностью от не-человеческого антитела. Фактически гуманизованные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки каркасной области (FR) заменены остатками, происходящими от аналогичных участков антител грызунов.
Для снижения антигенности при создании гуманизованных антител очень важно выбрать вариабельные домены как легкой, так и тяжелой цепи человеческого антитела. В соответствии с так называемым методом “подгонки” последовательность вариабельного домена антитела грызуна скринируют по всей библиотеке известных последовательностей вариабельных доменов человеческого антитела. Затем человеческую последовательность, которая является наиболее схожей с последовательностью грызунов, берут в качестве человеческой каркасной области (FR) для создания гуманизованного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol. 196:901 (1987)). В другом методе используют конкретную каркасную область, происходящую от консенсусной последовательности всех человеческих антител конкретной подгруппы легких и тяжелых цепей. Эта же самая каркасная область может быть использована для нескольких различных гуманизованных антител (Carter et al., Proc. Natl. Acad. Sci., USA, 89:4285 (1992); Presta et al., J. Immunol, 151:2623 (1993)).
В другом варианте изобретения антитела могут быть гуманизованы с сохранением высокой аффинности по отношению к данному антигену и других благоприятных биологических свойств. Гуманизованные антитела могут быть получены путем анализа исходных последовательностей и различных концептуальных гуманизованных продуктов с использованием трехмерных моделей родительских и гуманизованных последовательностей. Трехмерные иммуноглобулиновые модели являются общедоступными и хорошо известны специалистам. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры отобранных последовательностей-кандидатов иммуноглобулинов. Исследование этих представлений позволяет проанализировать вероятную роль данных остатков в функционировании последовательностей иммуноглобулина-кандидата, то есть остатков, которые влияют на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом, остатки FR могут быть выбраны из реципиентных и “импортных” последовательностей и объединены, в результате чего может быть получено желаемое антитело с нужными свойствами, такими как повышенная аффинность по отношению к мишени-антигену(ам). В общих чертах остатки гипервариабельной области непосредственно влияют на связывание с антигеном, а в основном участвуют в таком связывании.
Были рассмотрены различные формы гуманизованного антитела. Так, например, гуманизованным антителом может быть фрагмент антитела, такой как Fab. Альтернативно, гуманизованное антитело может быть интактным антителом, таким как интактное антитело IgG1.
В примерах описано продуцирование репрезентативного гуманизованного антитела против ErbB2. Такое гуманизованное антитело может, например, содержать остатки гипервариабельной области не-человеческого антитела, веденные в вариабельный домен тяжелой цепи человеческого антитела, и может дополнительно содержать замену в каркасной области (FR) в положении, выбранном из группы, состоящей из 69Н, 71Н и 73Н, согласно системе нумерации вариабельных доменов, описанной Кэбетом (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). В одном из вариантов изобретения гуманизованное антитело включает замены FR в двух или всех положениях 69Н, 71Н и 73Н. В другом примере описано получение очищенного антитела трастузумаба из препарата HERCEPTIN®.
(iv) Человеческие антитела
В качестве альтернативы гуманизации могут быть продуцированы человеческие антитела. Так, например, в настоящее время могут быть получены трансгенные животные (например, мыши), которые будут способны после иммунизации продуцировать полный репертуар человеческих антител без продуцирования эндогенного иммуноглобулина. Так, например, сообщалось, что гомозиготная делеция гена области стыка в тяжелой цепи (JH) антитела у химерных и мутантных мышей зародышевой линии приводит к полному ингибированию продуцирования эндогенного антитела. Перенос набора генов иммуноглобулина человеческой зародышевой линии таким мутантным мышам зародышевой линии может приводить к продуцированию человеческих антител после стимуляции антигеном. См., например, Jakobovits et al., Proc. Natl. Acad. Sci., USA, 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggerman et al., Year in Immuno, 7:33 (1993) и патенты США № 5591669, 5589369 и 5545807.
Альтернативно, для продуцирования человеческих антител и фрагментов антител in vitro из набора генов вариабельного домена (V) иммуноглобулина, происходящего от неиммунизованных доноров, может быть применена технология фагового представления (McCafferty et al. Nature 348:552-553 (1990)). В соответствии с этой технологией гены домена V антитела клонируют с сохранением рамки считывания в ген основного или минорного белка оболочки нитчатого бактериофага, такого как М13 или fd, и представляют в качестве функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку нитеобразная частица содержит копию одноцепочечной ДНК фагового генома, то отбор на основе функциональных свойств антитела также позволяет проводить отбор гена, кодирующего антитело, обладающее этими свойствами. Таким образом, фаг имитирует некоторые свойства В-клеток. Фаговое представление может быть осуществлено в различных форматах; см., например, обзор в работе Johnson, Kevin S. и Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для осуществления фагового представления может быть использовано несколько источников V-генных сегментов. Clackson et al., Nature, 352:624-628 (1991) выделили другой набор разнообразных антител против оксазолона из небольшой рандомизированный комбинаторной библиотеки генов V, происходящих из селезенки иммунизованных мышей. При этом может быть сконструирован набор генов V от неиммунизованных людей-доноров, а затем могут быть выделены антитела против набора различных антигенов (включая аутоантигены), в основном, в соответствии с методами, описанными Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США № 5565332 и 5573905. Как обсуждалось выше, человеческие антитела могут также продуцироваться in vitro активированными В-клетками (см. патенты США № 5567610 и 5229275). Человеческие анти-CD30 антитела описаны в заявке на патент США, рег. № 10/338366.
(v) Фрагменты антител
Для получения фрагментов антител были разработаны различные методы. Традиционно эти фрагменты образуются в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты могут продуцироваться непосредственно рекомбинантными клетками-хозяевами. Так, например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab'-SH-фрагменты могут быть непосредственно выделены из E.coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантной клетки-хозяина. Специалистам известны и другие методы получения фрагментов антител. В других вариантах изобретения выбранным антителом является одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патент США № 5571894 и патент США № 5587458. Фрагментом антитела может быть также “одноцепочечное антитело”, например антитело, описанное в патенте США № 5641870. Такие одноцепочечные фрагменты антител могут быть моноспецифическими или биспецифическими.
(vi) Биспецифические антитела
Биспецифическими антителами являются антитела, которые обладают специфичностью связывания, по меньшей мере, с двумя различными эпитопами. Репрезентативные биспецифические антитела могут связываться с двумя различными эпитопами белка CD30. Альтернативно, ветвь антитела против CD30 может быть объединена с ветвью, которая связывается с Fc-рецепторами для IgG (FcγR), такими как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), так, чтобы клеточные защитные механизмы были сфокусированы в клетках, экспрессирующих CD30. Биспецифические антитела могут быть также использованы для определение локализации цитотоксических агентов в клетках, экспрессирующих CD30.
Традиционное продуцирование полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулина, где две цепи обладают различной специфичностью (Millstein et al., Nature, 305:537-539 (1983)). Эти гибридомы (квадромы), из-за рандомизированного набора тяжелой и легкой цепей иммуноглобулина, продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна молекула имеет “правильную” биспецифическую структуру. Очистка такой “правильной” молекулы, которую обычно осуществляют путем постадийного проведения аффинной хроматографии, достаточно затруднена и дает низкий выход продукта. Аналогичные процедуры описаны в WO 93/08829 и у Traunecker et al., EMBO J., 10:3655-3659 (1991). В соответствии с другим подходом вариабельные домены антитела с нужными специфичностями связывания (объединенные сайты “антитело-антиген”) присоединяют к последовательностям константного домена иммуноглобулина. Такое слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнирной области, СН2 и СН3. При этом предпочтительно, чтобы этот гибрид имел первую константную область тяжелой цепи (СН1), содержащую сайт, необходимый для связывания с легкой цепью, присутствующей, по меньшей мере, в одном из гибридов. ДНК, кодирующая гибриды тяжелой цепи иммуноглобулина и, если это необходимо, легкой цепи иммуноглобулина, встраивают в отдельные экспрессионные векторы и ко-трансфецируют в подходящий организм-хозяин. Это обеспечивает высокую степень гибкости при коррекции соотношений трех полипептидных фрагментов в тех вариантах изобретения, в которых неравные содержания трех полипептидных цепей, используемых в данной конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессионный вектор, если экспрессия, по меньшей мере, двух полипептидных цепей при равном соотношении дает высокие выходы или если такие соотношения не имеют решающего значения.
В одном из вариантов такого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина, имеющей первую специфичность связывания, в одной ветви, и гибридной пары “тяжелая цепь-легкая цепь” иммуноглобулина (обеспечивающей вторую специфичность связывания), в другой ветви. Было обнаружено, что эта асимметричная структура облегчает отделение нужного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой способ его выделения. Этот способ описан в WO 94/04690. Более подробное описание получения биспецифических антител см., например, у Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии со вторым подходом, описанным в патенте США № 5731168, граница между парой молекул антитела может быть сконструирована в целях максимизации процента гетеродимеров, выделенных из рекомбинантной клеточной культуры. Такая граница предпочтительно содержит, по меньшей мере, часть домена СН3 константного домена антитела. В этом методе небольшие боковые цепи одной или нескольких аминокислот в пограничной области первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозина или триптофана). В пограничной области второй молекулы антитела создают компенсирующие “полости”, имеющие размер, идентичный или аналогичный размеру более крупной(ых) боковой(ых) цепи(ей), путем замены крупных боковых цепей аминокислот более мелкими боковыми цепями (например, аланина или треонина). Это позволяет увеличить выход гетеродимеров по отношению к другим нежелательным конечным продуктам, таким как гомодимеры.
Методы продуцирования биспецифических антител из фрагментов антител были также описаны в литературе. Так, например, биспецифические антитела могут быть получены путем химического связывания. В работе Brennan et al., Science, 229:81 (1985) описана процедура, в которой интактные антитела подвергают протеолитическому расщеплению с образованием F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии агента, образующего дитиоловый комплекс, такого как арсенит натрия, для стабилизации смежных дитиолов и предотвращения образования межмолекулярной дисульфидной связи. Затем полученные Fab'-фрагменты превращают в производные тионитробензоата (TNB). После этого одно из производных Fab'-TNB снова превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB, в результате чего получают биспецифическое антитело. Такие продуцированные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Последние достижения в данной области позволяют проводить прямое выделение из E.coli фрагментов Fab'-SH, которые могут быть химически связаны с образованием биспецифических антител. В работе Shalaby et al., J. Exp. Med. 175:217-225 (1992) описано продуцирование полностью гуманизованной молекулы F(ab')2 биспецифического антитела. Каждый Fab'-фрагмент был отдельно секретирован из E.coli и подвергнут прямому химическому связыванию in vitro с образованием биспецифического антитела.
Были также описаны другие методы получения и выделения фрагментов биспецифического антитела непосредственно из рекомбинантной клеточной культуры. Так, например, биспецифические антитела были продуцированы с использованием “лейциновых молний”. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии, происходящие от белков Fos и Jun, были присоединены к Fab'-частям двух других антител путем лигирования генов. Гомодимеры антитела были восстановлены в шарнирной области с образованием мономеров, а затем снова окислены с образованием гетеродимеров антитела. Этот метод может быть также использован для продуцирования гомодимеров антитела. Технология “диател”, описанная Hollinger et al., Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993), обеспечивает альтернативный механизм получения фрагментов биспецифического антитела. Эти фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) посредством линкера, который является слишком коротким для создания пары между двумя доменами одной и той же цепи. В соответствии с этим VH- и VL-домены одного фрагмента вынуждены спариваться с комплементарными VL- и VH-доменами другого фрагмента, образуя тем самым два антигенсвязывающих сайта. Также была описана другая стратегия получения фрагментов биспецифического антитела с использованием одноцепочечных Fv(sFv)-димеров. См. Gruber et al., J. Immunol., 152:5368 (1994).
Рассматриваются также антитела с более чем двумя валентностями. Так, например, могут быть получены и триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
(vii) Другие модификации аминокислотных последовательностей
В настоящей заявке рассматриваются модификации аминокислотных последовательностей антител. Так, например, может оказаться желательным повышение аффинности связывания и/или других биологических свойств данного антитела. Варианты аминокислотных последовательностей таких антител получают путем введения соответствующих нуклеотидных замен в нуклеиновую кислоту антитела или путем пептидного синтеза. Такие модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. При этом в конечной конструкции могут присутствовать любые комбинации делеций, инсерций и замен, при условии, что эта конечная конструкции будет обладать нужными свойствами. Аминокислотные замены также могут влиять на посттрансляционные процессы антитела, такие как изменение числа или положения сайтов гликозилирования.
Метод, который применяется для идентификации некоторых остатков или областей антитела и который позволяет определять локализацию мутагенеза, называется “аланин-сканирующим мутагенезом” и описан Cunningham & Wells, Science 244:1081-1085 (1989). В этом методе остаток или группу нужных остатков идентифицируют (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином) для влияние на взаимодействие этих аминокислот с антигеном. Затем локализацию аминокислот, проявляющих функциональную чувствительность к таким заменам, уточняют путем введения дополнительных или других вариантов у данного положения замены или вместо данной замены. Так, например, место введения аминокислотной замены может быть определено заранее, тогда как природа мутации per se необязательно должна быть определена заранее. Например, для анализа эффективности мутации в данном сайте Ala-сканирующий или неспецифический мутагенез проводят в нужном кодоне или в нужной области и варианты экспрессированного антитела скринируют на нужную активность.
Вставками в аминокислотные последовательности являются вставки у амино- и/или карбокси-концов, образующие гибриды, имеющие длину от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности, состоящие из одного или множества аминокислотных остатков. Примерами концевых инсерций являются антитело с N-концевым метионильным остатком или антитело, присоединенное к цитотоксическому полипептиду. Другими инсерционными вариантами молекулы антитела являются гибриды N- или С-концов антитела с ферментом (например, для ADEPT) или с полипептидом, который способствует увеличению полужизни данного антитела в сыворотке.
Вариантом другого типа является вариант замены аминокислоты. Эти варианты имеют, по крайней мере, один аминокислотный остаток в молекуле антитела, замененный другим остатком. Сайтами, представляющими наибольший интерес для мутагенеза, проводимого путем замены, являются гипервариабельные области, но могут также рассматриваться и замены в FR.
Значительные изменения биологических свойств антитела могут быть достигнуты путем выбора замен, которые оказывают значительное влияние на (а) структуру полипептидного остова в области замены, например складчатую и спиральную конформацию, (b) заряд или гидрофобность молекулы в нужном сайте или (с) объем боковой цепи. Природные остатки подразделяются на нижеследующие группы по общим свойствам боковых цепей:
(1) гидрофобные остатки: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные остатки: Cys, Ser, Thr;
(3) кислотные остатки: Asp, Glu;
(4) основные остатки: Asn, Gln, His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro и
(6) ароматические остатки: Trp, Tyr, Phe.
Не-консервативные замены приводят к заменам члена одного из этих классов членом другого класса.
Особенно предпочтительным типом варианта замены является замена одного или нескольких остатков гипервариабельной области родительского антитела (например, гуманизованного или человеческого антитела). В общих чертах полученные варианты, выбранные для дальнейшей разработки, будут способствовать улучшению биологических свойств по сравнению с родительским антителом, от которого они происходят. Стандартный способ генерирования таких вариантов с заменами предусматривает созревание аффинности с применением метода фагового представления. Для этого несколько положений гипервариабельной области (например, 6-7 положений) подвергают мутации для генерирования аминокислотных замен в каждом положении. Генерированные таким образом варианты антитела будут представлены как моновалентные молекулы на частицах нитчатого фага в виде гибридов с продуктом гена III, упакованных в каждой частице фага М13. Затем варианты, представленные на фаге, скринируют на их биологическую активность (например, аффинность связывания), как описано в настоящей заявке. Для идентификации сайтов гипервариабельной области, являющихся кандидатами на модификацию, может быть осуществлен аланин-сканирующий мутагенез, который позволяет идентифицировать остатки гипервариабельной области, играющие существенную роль в связывании с антигеном. Альтернативно или дополнительно, может оказаться полезным проанализировать кристаллическую структуру комплекса антиген-антитело для идентификации контактных участков между антителом и антигеном. Такие контактные остатки и соседние остатки являются кандидатами на замену, осуществляемую в соответствии с разработанным здесь способом. После генерирования таких вариантов панель этих вариантов подвергают скринингу, описанному в настоящей заявке, и антитела, обнаруживающие превосходные свойства в одном или нескольких релевантных анализах, могут быть выбраны для дальнейшего исследования.
При этом может оказаться желательным модифицировать антитело настоящего изобретения с точки зрения их эффекторной функции, например, для усиления антиген-зависимой клеточно-опосредованной цитотоксичности (ADCC) и/или комплемент-зависимой цитотоксичности (CDC) антитела. Это может быть достигнуто путем введения одной или нескольких аминокислотных замен в Fc-область антитела. Альтернативно или дополнительно, в эту Fc-область может(гут) быть введен(ы) цистеиновый(е) остаток(ки), что будет способствовать образованию межцепьевой дисульфидной связи в этой области. Генерированное таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или повышенной комплемент-зависимой цитотоксичностью (ADCC). См. Caron et al. J. Exp. Med. 176:1191-1195 (1992) и Shopes, B.J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью могут быть также получены с использованием гетеробифункциональных перекрестно-сшивающих агентов, описанных Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно, может быть сконструировано антитело, которое имеет две Fc-области, а поэтому может обладать повышенной способностью к комплемент-зависимому лизису и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989).
Для увеличения полужизни антитела в сыворотке в данное антитело (а в частности, фрагмент антитела) может быть введен рецептор-связыващий эпитоп спасения, как описано, например, в патенте США № 5739277. Используемый здесь термин “рецептор-связыващий эпитоп спасения” означает эпитоп Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), которая ответственна за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
(viii) Варианты гликозилирования
Антитела в ADC согласно изобретению могут быть гликозилированы в консервативных положениях в их константных областях (Jefferis & Lund (1997) Chem. Immunol. 65:111-128; Wright & Morrison (1997) TibTECH 15:26-32). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белка (Boyd et al. (1996) Mol. Immunol. 32:1311-1318; Wittwe & Howard (1990) Biochem. 29:4175-4180) и на внутримолекулярное взаимодействие между частями гликопротеина, которое может влиять на конформацию и презентированную трехмерную поверхность данного гликопротеина (Hefferis & Lund, см. выше; Wyss & Wagner (1996) Current Opin. Biotech. 7:409-416). Олигосахариды могут также служить для направления данного гликопротеина к некоторым молекулам, имеющим специфические распознающие структуры. Так, например, сообщалось, что в негалактозилированном IgG олигосахаридная часть “выпадает“ из пространства между СН2, и концевые N-ацетилглюкозаминовые остатки становятся доступными для связывания с белком, связывающимся с маннозой (Malhorta et al. (1995) Nature Med. 1:237-243). Удаление, под действием гликопептидазы, олигосахаридов из САМРАТН-1Н (рекомбинантного гуманизованного мышиного моноклонального антитела IgG1, распознающего антиген CDw52 человеческих лимфоцитов), продуцированного в клетках яичника китайского хомячка (СНО), приводило к полному прекращению комплемент-зависимого лизиса (CMCL) (Boyd et al. (1996) Mol. Immunol. 32:1311-1318), тогда как селективное удаление остатков сиаловой кислоты под действием нейраминидазы не приводило к потере DMCL. Также сообщалось, что гликозилирование антител влияет на антитело-зависимую клеточную цитотоксичность (ADCC). В частности, сообщалось, что клетки СНО с тетрациклин-регулируемой экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), т.е. гликозилтрансферазы, катализирующей образование GlcNAc, разделяющего последовательность напополам, имеет повышенную ADCC-активность (Umana et al. (1999) Mature Biotech. 17:176-180).
Гликозилирование антител обычно является либо N-связанным, либо О-связанным. N-связанное гликозилирование означает присоединение углеводной группы к боковой цепи аспарагинового остатка. Трипептидные последовательности “аспарагин-Х-серин” и “аспарагин-Х-треонин”, где Х обозначает любую аминокислоту, за исключением пролина, представляют собой последовательности распознавания для ферментативного присоединения углеводной части к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде способствует созданию потенциального сайта гликозилирования. О-связанное гликозилирование означает присоединение одного из сахаров, таких как N-ацетилгалактозамин, галактоза или ксилоза, к гидроксиаминокислоте, главным образом, к серину или треонину, хотя ими могут быть также 5-гидроксипролин или 5-гидроксилизин.
Вариантами гликозилирования антител являются варианты, в которых изменен тип гликозилирования антитела. Под таким “изменением” подразумевается делеция одной или нескольких углеводных групп, присутствующих в антителе, добавление одной или нескольких углеводных групп к антителу, изменение состава гликозилирования (типа гликозилирования), степени гликозилирования и т.п.
Присоединение сайтов гликозилирования к антителу обычно осуществляют путем такой модификации аминокислотной последовательности, в результате которой эта аминокислотная последовательность будет содержать одну или несколько вышеописанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Такая модификация может быть также осуществлена путем добавления одного или нескольких сериновых или треониновых остатков к последовательности или их замены в последовательности исходного антитела (для сайтов О-связанного гликозилирования). Аналогичным образом, удаление сайтов гликозилирования может быть осуществлено путем модификации аминокислот в природных сайтах гликозилирования антитела.
Аминокислотную последовательность обычно модифицируют путем изменения кодирующей ее последовательности нуклеиновой кислоты. Такими методами являются, но не ограничиваются ими, выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или проведение олигонуклеотид-опосредуемого (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кластерного мутагенеза ранее полученного варианта или немодифицированного варианта антитела.
Гликозилирование (включая тип гликозилирования) антител может быть также изменено без проведения модификации аминокислотной последовательности или кодирующей ее нуклеотидной последовательности. Гликозилирование, главным образом, зависит от клетки-хозяина, используемой для экспрессии антитела. Поскольку клетки, используемые для экспрессии рекомбинантных гликопротеинов, например антител, являющихся потенциальными терапевтическими средствами, редко являются природными клетками, то можно ожидать значительного изменения типа гликозилирования антител. См., например, Hse et al., (1997) J. Biol. Chem. 272:9062-9070. Помимо выбора клеток-хозяев факторами, влияющими на гликозилирование в процессе рекомбинантного продуцирования антител, являются характер роста, состав среды, плотность культуры, оксигенирование, рН, схемы очистки и т.п. Для изменения типа гликозилирования, достигаемого в конкретном организме-хозяине, были предложены различные методы, включая введение или сверхэкспрессию некоторых ферментов, участвующих в продуцировании олигосахаридов (патенты США № 5047335; 5510261; 5278299). Гликозилирование (или гликозилирование определенного типа) гликопротеина может быть предотвращено, например, с использованием эндогликозидазы Н (эндо-Н). Кроме того, рекомбинантная клетка-хозяин может быть генетически сконструирована, например она может быть сделана дефектной по процессингу полисахаридов некоторых типов. Эти и аналогичные методы хорошо известны специалистам.
Структура гликозилирования антител может быть легко проанализирована стандартными методами углеводного анализа, включая хроматографию на лектине, ЯМР, масс-спектрометрию, ВЭЖХ, ГФХ, анализ моносахаридного состава, постадийный ферментативный гидролиз и НРАЕС-PAD, в которых применяется анионообменная хроматография с высоким рН для разделения олигосахаридов на основе их заряда. Методы высвобождения олигосахаридов, применяемые в аналитических целях, также известны, и такими методами являются, но не ограничиваются ими, ферментативная обработка (обычно осуществляемая с использованием пептид-N-гликозидазы F/эндо-β-галактозидазы), элиминация, главным образом, О-связанных структур в жестких щелочных условиях и химические методы высвобождения N- и О-связанных олигосахаридов с использованием безводного гидразина.
4.5.2а. Скрининг на конъюгаты “антитело-лекарственное средство” (ADC)
Трансгенные животные и клеточные линии являются особенно подходящими для скрининга на конъюгаты “антитело-лекарственное средство” (ADC), которые могут быть использованы для профилактического или терапевтического лечения заболеваний или расстройств, ассоциированных со сверхэкспрессией белков, включая антигены Lewis Y, CD30, CD40 и CD70. Трансгенные животные и клеточные линии являются особенно подходящими для скрининга на конъюгаты “антитело-лекарственное средство” (ADC), которые могут быть использованы для профилактического или терапевтического лечения заболеваний или расстройств, ассоциированных со сверхэкспрессией HER2 (US6632979). Скрининг на эффективный ADC может включать введение трансгенным животным ADC-кандидата в различных интервалах доз и анализ эффективности(ей) ADC в лечении рассматриваемого заболевания и расстройства в различные промежутки времени. Альтернативно или дополнительно, лекарственное средство может быть введено до обработки или одновременно с обработкой индуцирующим заболевание фактором, если он применяется. ADC-кандидат может быть скринирован постадийно и отдельно или одновременно в среде или в формате высокоэффективного скрининга. Скорость, с которой может быть скринирован ADC на возможность его эффективного применения для профилактического или терапевтического лечения заболеваний или расстройств, ограничивается лишь скоростью синтеза или методом скрининга, включая детекцию/измерение/анализ данных.
В одном из вариантов изобретения способ скрининга включает (а) трансплантацию клеток из стабильной клеточной линии рака почек животному, не являющемуся человеком, (b) введение ADC-кандидата животному, не являющемуся человеком, и (с) определение способности указанного кандидата ингибировать образование опухолей из трансплантированной клеточной линии.
Другим вариантом изобретения является способ скрининга, включающий (а) контактирование клеток, происходящих от стабильной клеточной линии болезни Ходжкина, с ADC-кандидатом и (b) оценку способности такого ADC-кандидата блокировать активацию лиганда CD40.
Другим вариантом изобретения является способ скрининга, включающий (а) контактирование клеток, происходящих от стабильной клеточной линии болезни Ходжкина, с ADC-кандидатом и (b) оценку способности такого ADC-кандидата индуцировать клеточную гибель. В одном из вариантов изобретения проводят оценку способности ADC-кандидата индуцировать апоптоз.
Одним из вариантов изобретения является способ скрининга, включающий (а) трансплантацию клеток из стабильной раковой клеточной линии животному, не являющемуся человеком, (b) введение ADC-кандидата животному, не являющемуся человеком, и (с) определение способности указанного кандидата ингибировать образование опухолей в трансплантированной клеточной линии. Настоящее изобретение также относится к способу скрининга ADC-кандидатов на возможность их применения для лечения заболевания или расстройства, характеризующегося сверхэкспрессией HER2, где указанный способ включает (а) контактирование клеток, происходящих от стабильной клеточной линии рака молочной железы, с кандидатом на лекарственное средство и (b) оценку способности такого ADC-кандидата ингибировать рост стабильной клеточной линии.
Другим вариантом изобретения является способ скрининга, включающий (а) контактирование клеток, происходящих от стабильной раковой клеточной линии, с ADC-кандидатом и (b) оценку способности такого ADC-кандидата блокировать активацию лиганда HER2. В одном из вариантов изобретения проводят оценку способности ADC-кандидата блокировать связывание с герегулином. В другом варианте изобретения проводят оценку способности ADC-кандидата блокировать стимулированное лигандом фосфорилирование тирозина.
Другим вариантом изобретения является способ скрининга, включающий (а) контактирование клеток, происходящих от стабильной раковой клеточной линии, с ADC-кандидатом и (b) оценку способности такого ADC-кандидата индуцировать клеточную гибель. В одном из вариантов изобретения проводят оценку способности ADC-кандидата индуцировать апоптоз.
Другим вариантом изобретения является способ скрининга, включающий (а) введение ADC-кандидата трансгенному млекопитающему, не являющемуся человеком, у которого в клетках молочной железы наблюдается сверхэкспрессия нативного человеческого белка HER2 или его фрагмента, где у указанного трансгенного животного наблюдается стабильная интеграция в геном последовательности нуклеиновой кислоты, кодирующей нативный человеческий белок HER2 или его фрагмент, обладающий биологической активностью нативного человеческого HER2, и функционально связанной к последовательностям регуляции транскрипции, направляющим ее экспрессию в молочную железу, и развивается опухоль молочной железы, не восприимчивая или плохо восприимчивая к обработке анти-HER2 антителом; или введение указанного кандидата млекопитающему, не являющемуся человеком, у которого имеется опухоль, развившаяся из трансплантированных клеток, взятых от указанного трансгенного млекопитающего, не являющегося человеком; и (b) оценку воздействия указанного ADC-кандидата на рассматриваемое заболевание или расстройство. Указанными заболеваниями или расстройствами могут быть, но не ограничиваются ими, рак, ассоциирующийся со сверхэкспрессией HER2, такой как рак молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почек, толстой кишки, щитовидной железы, поджелудочной железы и мочевого пузыря. Указанным раком предпочтительно является рак молочной железы, при котором HER2 экспрессируется в количестве, по меньшей мере, примерно 500000 копий на клетку, а более предпочтительно, по меньшей мере, примерно 2000000 копий на клетку. ADC-кандидаты могут быть, например, оценены на их способность индуцировать клеточную гибель и/или апоптоз аналитическими методами, хорошо известными специалистам и описанными ниже.
В одном из вариантов изобретения ADC-кандидат скринируют путем введения трансгенному животному в различных дозах и оценки физиологического ответа животного на данные соединения в зависимости от времени. Введение может быть осуществлено перорально или путем подходящей инъекции, в зависимости от химической природы оцениваемого соединения. В некоторых случаях может оказаться желательным вводить данное соединение в комбинации с кофакторами, которые должны повышать эффективность данного соединения. Если для скрининга соединений, которые могут быть использованы для лечения различных расстройств, применяются клеточные линии, происходящие от рассматриваемых трансгенных животных, то тестируемые соединения добавляют в среду для культивирования клеток через соответствующий промежуток времени и проводят оценку клеточного ответа на данное соединение в течение определенного интервала времени с помощью соответствующих биохимических и/или гистологических анализов. В некоторых случаях может оказаться желательным добавление представляющего интерес соединения в культуральную среду в комбинации с кофакторами, которые должны повышать эффективность данного соединения.
Таким образом, в настоящем изобретении рассматриваются анализы, проводимые для идентификации ADC, который специфически направлен на белок-мишень и связывается с ним, причем присутствие этого белка коррелирует с аномальной клеточной функцией, а при патогенезе пролиферации и/или дифференцировки клеток его присутствие каузативно связано с развитием опухоли.
Для идентификации ADC, который блокирует активацию лиганда рецептора ErbB (например, ErbB2), может быть проведена оценка способности указанного соединения блокировать связывание лиганда ErbB с клетками, экспрессирующими рецептор ErbB (ErbB2) (например, при конъюгировании с другим рецептором ErbB, с которым представляющий интерес рецептор ErbB образует гетероолигомер ErbB). Так, например, клетки, выделенные из трансгенного животного, у которого сверхэкспрессируется HER2, и трансфецированные для экспрессии другого рецептора ErbB (с которым HER2 образует гетероолигомер), могут быть инкубированы, то есть культивированы с ADC, а затем обработаны меченным лигандом ErbB. После этого может быть проведена оценка способности указанного соединения блокировать связывание лиганда с рецептором ErbB в гетероолигомере ErbB.
Так, например, ингибирование связывания герегулина (HRG) с клеточными линиями опухоли молочной железы, сверхэкспрессирующими HER2 и развившимися у не являющихся человеком трансгенных млекопитающих (например, мышей) под действием ADC-кандидата согласно изобретению, может быть осуществлено с использованием монослойных культур на льду в формате 24-луночных планшетов. Моноклональные антитела против ErbB2 могут быть добавлены в каждую лунку и инкубированы в течение 30 минут. Затем может быть добавлен 125I-меченный rHRGβ1177-224 (25000 имп/мин), и инкубирование может быть продолжено в течение 4-16 часов. После этого могут быть построены кривые “доза-ответ”, и для представляющего интерес соединения может быть вычислена величина IC50 (цитотоксическая активность).
Альтернативно или дополнительно, может быть оценена способность ADC блокировать стимулированное лигандом ErbB фосфорилирование тирозина рецептора ErbB, присутствующего в гетероолигомере ErbB. Так, например, клеточные линии, развившиеся у трансгенных животных согласно изобретению, могут быть инкубированы с тестированным ADC, а затем они могут быть проанализированы на зависимую от лиганда ErbB активность фосфорилирования тирозина с использованием моноклонального антитела против фосфотирозина (которое является, но необязательно, конъюгированным с детектируемой меткой). Для определения активации рецептора ErbB и блокирования этой активации данным соединением также может быть применен анализ на активацию киназного рецептора, описанный в патенте США № 5766863.
В одном из вариантов изобретения может быть проведен скрининг на ADC, который ингибирует HRG-стимуляцию фосфорилирования тирозина р180 в клетках MCF7, в основном, как описано ниже. Так, например, клеточная линия, продуцированная у HER2-трансгенного животного, может быть культивирована в 24-луночных планшетах, и в каждую лунку может быть добавлено соединение с последующим инкубированием в течение 30 минут при комнатной температуре, после чего в каждую лунку может быть добавлен rHRGβ1177-224 до конечной концентрации 0,2 нМ, и инкубирование может быть продолжено в течение примерно 8 минут. Затем из каждой лунки отсасывают среду, после чего реакция может быть прекращена добавлением 100 мкл ДСН-буфера для образца (5% ДСН, 25 мМ DTT и 25 мМ Трис-HCl, pH 6,8). Каждый образец (25 мкл) может быть подвергнут электрофорезу в 4-12% градиентном геле (Novex), а затем он может быть электрофоретически перенесен на поливинилидендифторидную мембрану. После этого иммуноблоты антител против фосфотирозина (при 1 мкг/мл) могут быть проявлены и интенсивность преобладающей реакционно-активной полосы при Mr ~ 180000 может быть количественно оценена с помощью отражательной денситометрии. Альтернативным методом оценки ингибирования фосфорилирования рецептора является анализ KIRA (на активацию киназного рецептора), описанный Sadick et al. (1998) Jour. of Pharm. and Biomed. Anal. Некоторые из хорошо идентифицированных моноклональных антител против HER2, которые, как известно, ингибируют HRG-стимуляцию фосфорилирования тирозина р180, могут быть использованы в этом анализе в качестве позитивного контроля. Затем может быть построена кривая “доза-ответ” для ингибирования HRG-стимуляции фосфорилирования тирозина р180, которое может быть оценено с помощью отражательной денситометрии, после чего может быть вычислена IC50 для представляющего интерес соединения.
Может быть также проведена оценка на опухоль-ингибирующее действие тестируемого ADC на клеточные линии, происходящие от HER2-трансгенного животного, например, в основном, как описано Schaefer et al. (1997) Oncogene 15:1385-1394. В соответствии с этим анализом клетки могут быть обработаны тестируемым соединением в различных концентрациях в течение 4 дней и окрашены кристаллическим фиолетовым или красителем аламаровым синим, обладающим окислительно-восстановительным действием. Посредством инкубирования с данным соединением можно продемонстрировать опухоль-ингибирующее действие на данную клеточную линию, аналогичное действию моноклонального антитела 2С4 на клетки MDA-MB-175 (Schaefer et al., см. выше). В другом варианте изобретения экзогенный HRG не оказывает значительного обратного действия на такое ингибирование.
Для идентификации опухоль-ингибирующих соединений, которые специфически нацелены на представляющий интерес антиген, может быть проведен скрининг на соединения, ингибирующие рост раковых клеток, сверхэкспрессирующих представляющий интерес антиген и происходящих от трансгенных животных, и такой скрининг-анализ описан в патенте США № 5677171. В соответствии с этим анализом раковые клетки, сверхэкспрессирующие представляющий интерес антиген, культивируют в смеси 1:1 среды F12 и DMEM, в которую были добавлены 10% фетальная бычья сыворотка, глутамин и пенициллин-стрептомицин. Затем клетки высевают при плотности 20000 клеток в 35 мм-чашку для культивирования клеток (2 мл/35 мм-чашку) и добавляют тестируемое соединение в различных концентрациях. Через шесть дней подсчитывают число клеток по сравнению с необработанными клетками с использованием электронного счетчика клеток COULTERTM. Соединения, которые ингибируют рост клеток примерно на 20-100% или примерно на 50-100%, могут быть отобраны как соединения, ингибирующие рост клеток.
Для отбора соединений, которые индуцируют клеточную гибель, может быть проведена оценка на утрату целостности мембраны, на что указывает, например, поглощение PI, трипанового синего или 7AAD по сравнению с контролем. В анализе на поглощение PI используются клетки, выделенные из представляющей интерес опухолевой ткани трансгенного животного. В соответствии с этим анализом клетки культивируют в смеси модифицированной по способу Дульбекко среды Игла (D-МЕМ):среды Хэмса F-12 (50:50), в которую были добавлены 10% термоинактивированный FBS (Hyclone) и 2 мМ L-глутамина. Таким образом, этот анализ осуществляют в отсутствие комплемента и иммунных эффекторных клеток. Затем клетки высевают в чашки размером 100 × 20 мм при плотности 3 × 106 на чашку и оставляют на ночь для слияния. После этого среду удаляют и заменяют лишь одной свежей средой либо средой, содержащей различные концентрации соединения. Клетки инкубируют в течение 3 дней. После каждой обработки монослои промывают PBS и отделяют путем трипсинизации. После этого клетки центрифугируют при 1200 об/мин в течение 5 минут при 4°С и осадок ресуспендируют в 3 мл холодного Ca2+-связывающего буфера (10 мМ Hepes, рН 7,4, 140 мМ NaCl, 2,5 мМ CaCl2) и разделяют на 35 мм-аликвоты, которые распределяют по 12 × 75 мл пробиркам с сетчатым фильтром (1 мл на пробирку, 3 пробирки на группу обработки) для удаления скоплений клеток. Затем в пробирки добавляют PI (10 мкг/мл). Образцы могут быть проанализированы на проточном цитометре FACSCANTM и с использованием компьютерной программы FACSCONVERTTM CellQuest (Becton Dickinson). Соединения, которые индуцируют статистически значимые уровни клеточной гибели, как было определено по поглощению PI, могут быть отобраны как соединения, индуцирующие клеточную гибель.
Для отбора соединений, которые индуцируют апоптоз, осуществляют анализ на связывание с аннексином с использованием клеток, полученных из представляющей интерес опухолевой ткани трансгенных животных. Затем клетки культивируют и высевают в чашки, как описано в предыдущем абзаце. Затем среду удаляют и заменяют лишь одной свежей средой либо средой, содержащей 10 мкг/мл конъюгата “антитело-лекарственное средство” (ADC). После инкубирования в течение 3 дней монослои промывают PBS и отделяют путем трипсинизации. Затем клетки центрифугируют, ресуспендируют в Ca2+-связывающем буфере и разделяют на аликвоты, как обсуждается выше в описании анализа на клеточную гибель. После этого в пробирки добавляют меченный аннексин (например, аннексин V-ФИТЦ) (1 мкг/мл). Образцы могут быть проанализированы на проточном цитометре FACSCANTM и с использованием компьютерной программы FACSCONVERTTM CellQuest (Becton Dickinson). Соединения, которые индуцируют статистически значимые уровни связывания с аннексином, по сравнению с контролем, отбирают как соединения, индуцирующие апоптоз.
4.5.3. Анализы на пролиферацию клеток in vitro
В общих чертах цитотоксическую или цитостатическую активность конъюгата “антитело-лекарственное средство” (ADC) измеряют путем обработки клеток млекопитающих, имеющих рецепторные белки, антителом конъюгата ADC в среде для культивирования клеток; культивирования клеток в течение периода времени примерно от 6 часов до 5 дней; и определения жизнеспособности клеток. Такие in vitro анализы с использованием клеток применяют для оценки жизнеспособности (пролиферации), цитотоксичности и индуцирования апоптоза (активации каспазы) клеток под действием ADC согласно изобретению.
In vitro-эффективность конъюгатов “антитело-лекарственное средство” измеряют с помощью анализа на пролиферацию клеток (пример 18, фиг.7-10). Анализ на жизнеспособность клеток на основе люминесценции (CellTiter-Glo®) является коммерчески доступным (Promega Corp., Madison, WI) и представляет собой однородный анализ, проводимый методом рекомбинантной экспрессии люциферазы Coleoptera (патенты США № 5583024; 5674713 и 5700670). Этот анализ на пролиферацию клеток позволяет определить число жизнеспособных клеток в культуре исходя из количественной оценки присутствующего АТР, который является индикатором метаболически активных клеток (Crouch et al. (1993) J. Immunol. Meth. 160:81-88, патент США № 6602677). Анализ CellTiter-Glo® был проведен в формате 96-луночного планшета, что позволяет осуществлять автоматический высокоэффективный скрининг (HTS) (Cree et al. (1995) AntiCancer Drugs 6:398-404). Однородная аналитическая процедура предусматривает добавление одного реагента (реагента CellTiter-Glo®) непосредственно в клетки, культивированные в среде с добавлением сыворотки. При этом не требуется проведения стадий промывки клеток, удаления среды и множества стадий пипетирования. Эта система позволяет детектировать, по меньшей мере, 15 клеток/лунку в 384-луночном планшете через 10 минут после добавления реагента и смешивания. Эти клетки могут быть непрерывно обработаны ADC, или они могут быть обработаны и отделены от ADC. В общих чертах обработка клеток в течение непродолжительного периода времени, то есть в течение 3 часов, дает такой же эффект, как и непрерывная обработка клеток.
Однородный анализ, осуществляемый в формате “добавление-смешивание-измерение”, приводит к лизису клеток и к генерированию люминесцентного сигнала, пропорционального количеству присутствующего АТР. Количество АТР прямо пропорционально числу клеток, присутствующих в культуре. В анализе CellTiter-Glo® генерируется люминесцентный сигнал типа “свечения”, продуцируемый люциферазной реакцией, которая имеет время полужизни более чем пять часов, в зависимости от типа клеток и используемой среды. Жизнеспособные клетки определяют в относительных единицах люминесценции (RLU). Субстрат, люциферин жуков, подвергается окислительному декарбоксилированию под действием рекомбинантной люциферазы светляков с одновременным превращением АТР в АМР и генерированием фотонов. Продолжительное время полужизни люциферазы позволяет избежать необходимости использования инжекторов для ввода реагентов и обеспечивает возможность осуществления непрерывной или периодической обработки множества планшетов. Такой анализ на пролиферацию клеток может быть проведен в различных многолуночных планшетах, например в 96-луночном или в 384-луночном планшете. Данные могут быть зарегистрированы с помощью люминометра или визуализирующей камеры на основе ПЗС. Выход люминесценции представлен в относительных световых единицах (RLU), измеряемых в зависимости от времени.
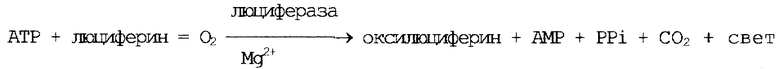
Антипролиферативные эффекты конъюгатов “антитело-лекарственное средство” измеряют по пролиферации клеток в описанном выше in vitro анализе на цитолиз клеток четырех различных клеточных линий опухолей молочной железы (фиг.7-10). Для клеток SK-BR-3 и ВТ-474, в которых, как известно, наблюдается сверхэкспрессия белка рецептора HER2, были определены величины IC50. В таблице 2а представлены измерения эффективности (IC50) репрезентативных конъюгатов “антитело-лекарственное средство” в анализе на пролиферацию клеток SK-BR-3. В таблице 2b представлены измерения эффективности (IC50) репрезентативных конъюгатов “антитело-лекарственное средство” в анализе на пролиферацию клеток ВТ-474.
Конъюгаты “антитело-лекарственное средство”: трастузумаб-МС-vc-РАВ-MMAF, 3.8 MMAF/Ab, трастузумаб-МС-(N-Ме)vc-РАВ-MMAF, 3.9 MMAF/Ab, трастузумаб-МС-MMAF, 4.1 MMAF/Ab; трастузумаб-МС-vc-РАВ-MMAE, 4.1 MMAE/Ab; трастузумаб-МС-vc-РАВ-MMAE, 3.3 MMAE/Ab; и трастузумаб-МС-vc-РАВ-MMAF, 3.7 MMAF/Ab не ингибируют пролиферацию клеток MCF-7 (фиг.9).
Конъюгаты “антитело-лекарственное средство”: трастузумаб-МС-vc-РАВ-MMAE, 4.1 MMAE/Ab, трастузумаб-МС-vc-РАВ-MMAE, 3.3 MMAE/Ab; трастузумаб-МС-vc-РАВ-MMAF, 3.7 MMAF/Ab; трастузумаб-МС-vc-РАВ-MMAF, 3.8 MMAF/Ab; трастузумаб-МС-(N-Ме)vc-РАВ-MMAF, 3.9 MMAF/Ab; и трастузумаб-МС-MMAF, 4.1 MMAF/Ab не ингибируют пролиферацию клеток MDA-MB-468 (фиг.10).
Клетки MCF-7 и MDA-MB-468 не сверхэкспрессируют белок рецептора HER2. Отсюда следует, что конъюгаты “анти-HER2 антитело-лекарственное средство” согласно изобретению обладают селективностью в отношении ингибирования клеток, которые экспрессируют HER2.
Таблица 2а
Клетки SK-BR-3
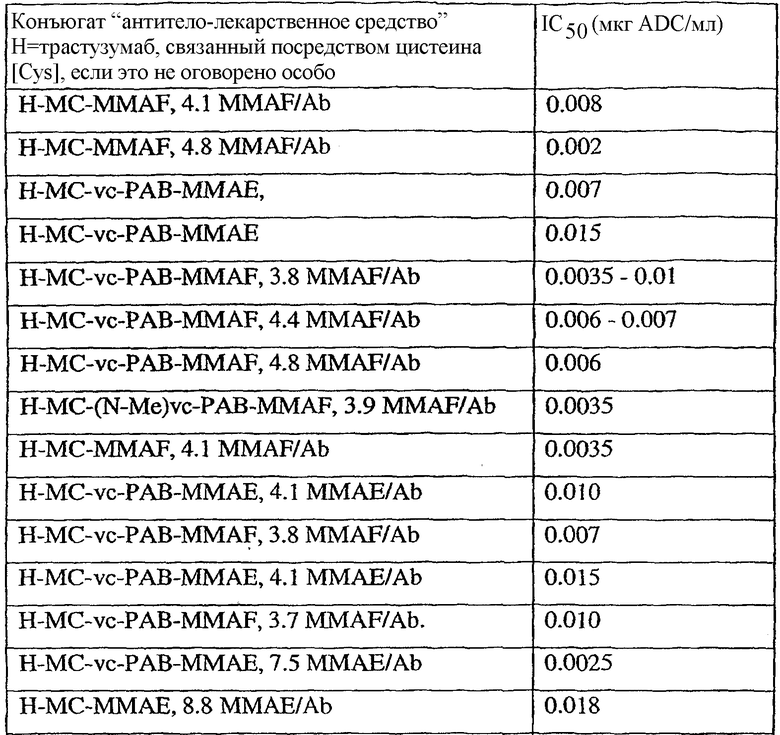
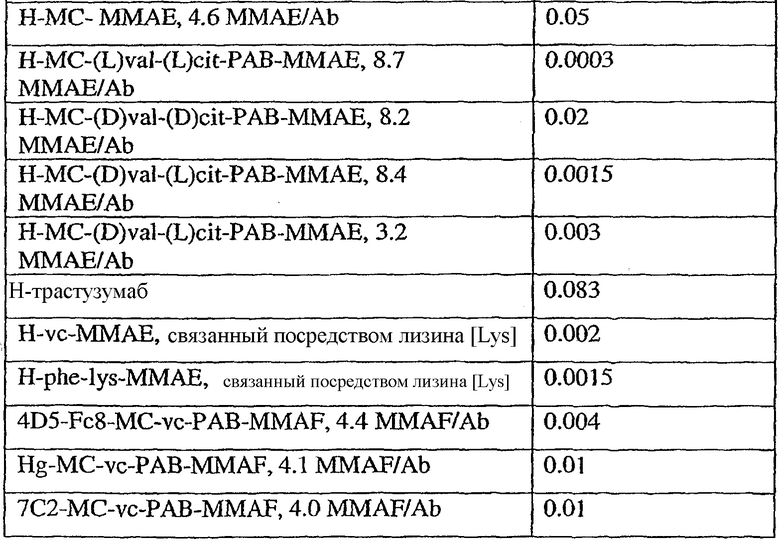

Таблица 2b
Клетки BT474
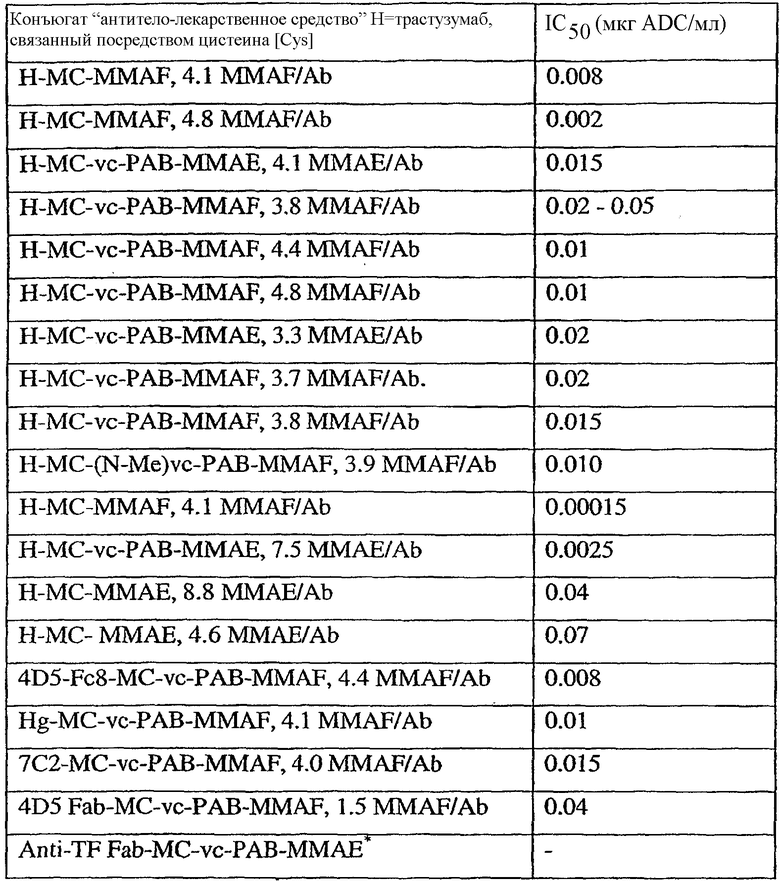
Н=трастузумаб.
7С2=мышиное антитело против HER2, которое связывается с эпитопом, отличающимся от эпитопа, с которым связывается трастузумаб.
Fc8=мутант, который не связывается с FcRn.
Hg=“Не содержащее шарнирной области” полноразмерное гуманизованное антитело 4D5, в котором цистеины шарнирной области тяжелой цепи заменены серинами. Это антитело было экспрессировано в E.coli (а поэтому оно является негликозилированным).
Анти-TF Fab=фрагмент антитела против тканевого фактора.
* активность против клеток MDA-MB-468.
Удивительными и неожиданными оказались результаты, полученные для активности ADC, направленной против пролиферации клеток in vitro, и представленные в таблицах 2а и 2b, которые в общих чертах показали, что ADC с низким средним содержанием молекул лекарственного средства по отношению к антителу обладал значительной эффективностью, например IC50 <0,1 мкг ADC/мл. Эти результаты позволяют предположить, что по крайней мере, для ADC с трастузумабом, оптимальное отношение молекул лекарственного средства к молекулам антитела может составлять менее чем 8 или даже примерно 2-5.
4.5.4. In vivo выведение ADC из плазмы и его стабильность
Фармакокинетику выведения ADC из плазмы и его стабильность исследовали на крысах и собакоподобных обезьянах. Концентрацию в плазме определяли в течение определенного периода времени. В таблице 2с представлены фармакокинетические данные для конъюгатов “антитело-лекарственное средство” и других доз образцов у крыс. Крысы являются неспецифическими моделями для вырабатывания антител против рецептора ErbB, поскольку пока неизвестно, экспрессируются ли у них белки рецептора HER2.
Таблица 2с
Фармакокинетика у крыс
Н=трастузумаб, связанный посредством цистеина [Cys], если это не оговорено особо; доза 2 мг/кг, если это не указано конкретно
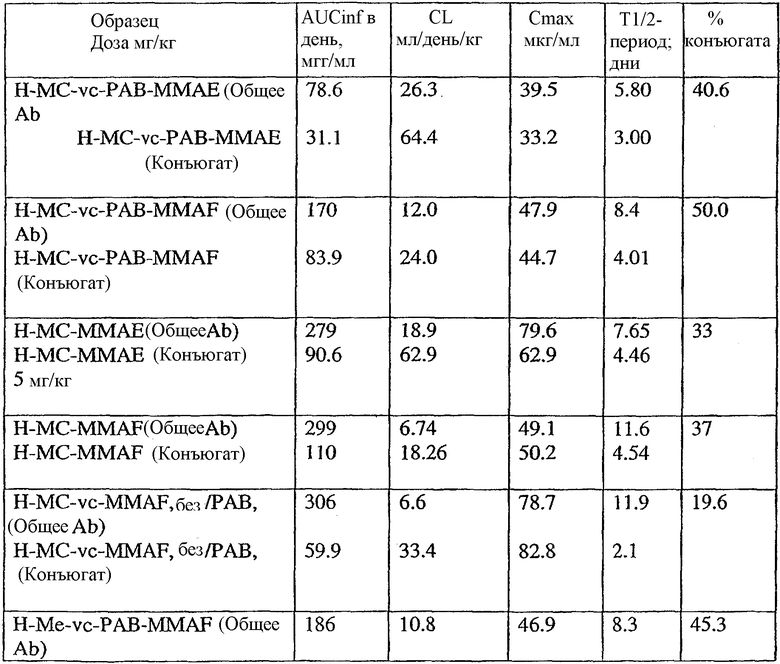

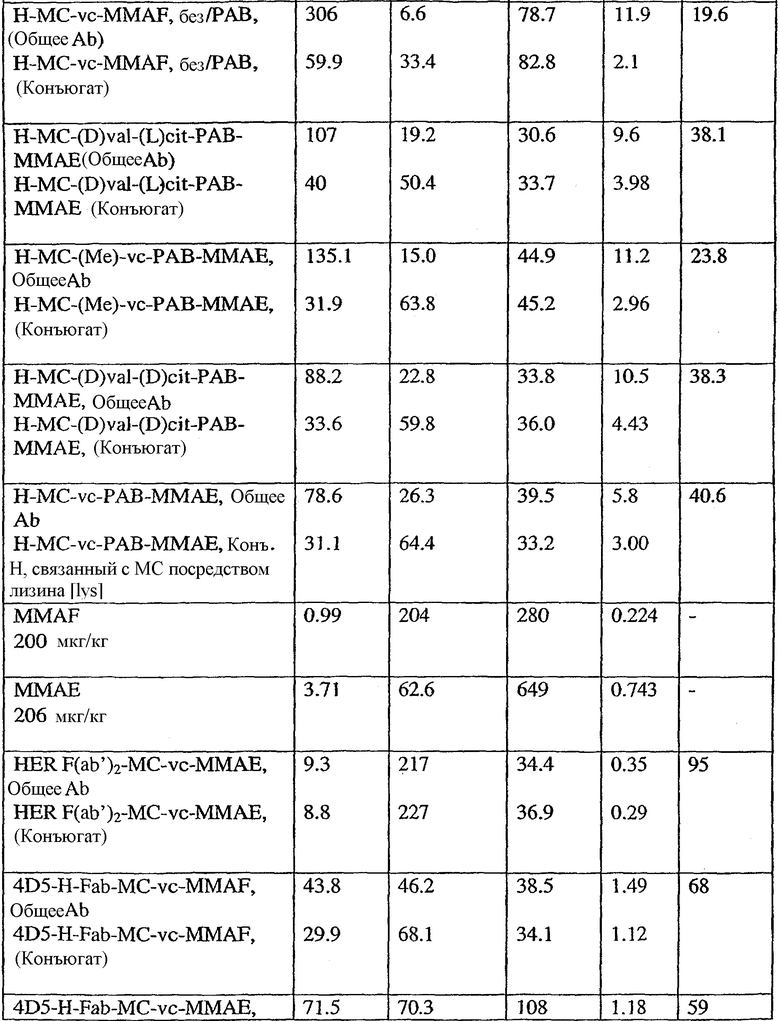

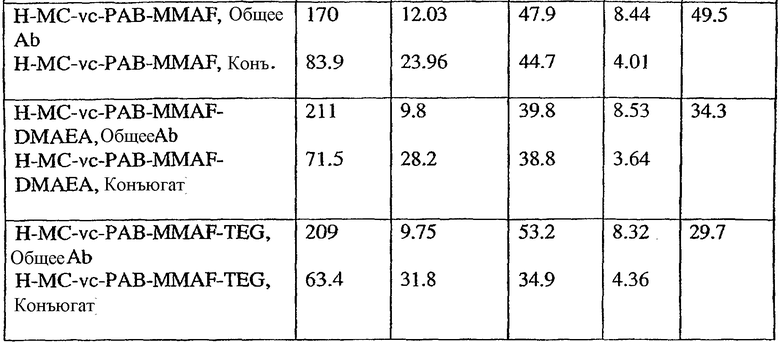
AUCinf представляет собой площадь под кривой зависимости концентрации в плазме от времени введения дозы до бесконечности и является мерой общего воздействия измеряемой молекулы (лекарственного средства, ADC). CL определяют как объем плазмы, очищенной от измеряемой молекулы в единицу времени, и выражают как величину, нормализованную по массе тела. Т1/2-период означает время полужизни лекарственного средства в организме, измеренное в фазе его элиминации. % конъюгата означает относительное количество ADC по сравнению с общим количеством детектируемого антитела в отдельных тестах на иммуноаффинность с помощью ELISA (“Analytical Methods for Biotechnology Products”, Ferraiolo et al, p.85-98 in Pharmacokinetics of Drugs (1994) P.G. Welling & L.P. Balant, Eds., Handbook of Experimental Pharmacology, Vol. 110, Springer-Verlag). % конъюгата вычисляют по формуле: AUCinf ADC : AUCinf общего Ab, и этот % является общим показателем стабильности линкера, хотя, фактически, такими показателями могут быть и другие факторы и механизмы.
На фиг.11 представлен график выведения исследуемой концентрации из плазмы после введения крысам Sprague-Dawley конъюгатов “антитело-лекарственное средство”: Н-МС-vc-РАВ-MMAF-TEG и Н-МС-vc-РАВ-MMAF. Концентрации общего антитела и ADC измеряли в зависимости от времени.
На фиг.12 представлен график двухстадийного выведения исследуемой концентрации из плазмы, где ADC вводили при различных дозах и концентрациях общего антитела и измеряли в зависимости от времени.
Эффективность in vivo
In vivo эффективность ADC согласно изобретению измеряли на мышиной модели с трансгенным эксплантатом, экспрессирующим высокие уровни HER2. Аллотрансплантат культивировали у трансгенных, MMTV-инфицированных мышей Fo5, которые являются невосприимчивыми или плохо восприимчивыми в терапии герцептином®. Мышей один раз обрабатывали ADC и проводили мониторинг в течение 3-6 недель для определения периода времени, проходящего до увеличения объема опухоли в два раза, log количества уничтоженных клеток; и степени уменьшения объема опухоли. Затем строили график “доза-ответ” и проводили эксперименты с использованием множества доз.
Опухоли легко развивались у трансгенных мышей, которые экспрессировали активированную мутацией форму neu, крысиного гомолога HER2, однако HER2, который сверхэкспрессируется в раковой опухоли молочной железы, не был мутированным, а поэтому образование опухоли протекало гораздо менее интенсивно у трансгенных мышей, у которых наблюдалась сверхэкспрессия немутированного HER2 (Webster et al., (1994) Semin. Cancer Biol. 5:69-76).
Для ускорения образования опухоли с немутированным HER2 получали трансгенных мышей с использованием плазмидной кДНК, кодирующей HER2, в которой вышерасположенный ATG был делетирован для предупреждения инициации трансляции в таких вышерасположенных кодонах ATG, что так или иначе должно снижать частоту инициации трансляции от нижерасположенного аутентичного инициирующего кодона HER2 (см., например, Child et al. (1999) J. Biol. Chem. 274:24335-24341). Кроме того, к 5'-концу был добавлен химерный интрон, что также должно увеличивать уровень экспрессии, как уже сообщалось ранее (Neuberger & Williams (1998) Nucleic Acids Res. 16:6713; Buchman & Berg (1988) Mol. Cell. Biol. 8:4395; Brinster et al. (1988) Proc. Natl. Acad. Sci., USA, 85:836). Этот химерный интрон происходит от вектора Promega, вектора pCI-neo, используемого для экспрессии у млекопитающих (890-1022 п.н.). 3'-конец кДНК фланкирован экзонами 4 и 5 человеческого гормона роста и последовательностями полиаденилирования. Кроме того, были использованы мыши FVB, поскольку этот штамм является более восприимчивым к развитию опухоли. Для гарантии тканеспецифической экспрессии HER2 в молочной железе был использован промотор, происходящий от MMTV-LTR. Для повышения восприимчивости к образованию опухоли животным давали корм AIN 76A (Rao et al. (1997) Breast Cancer Res. and Treatment 45:149-158).
Таблица 2d
Измерение опухоли у бестимусных мышей с моделью аллотрансплантата опухоли молочной железы MMTV-HER2-Fo5;
одна доза в день 1 (Т=0), если это не указано конкретно;
Н=трастузумаб, связанный посредством цистеина [Cys], если это не оговорено особо.
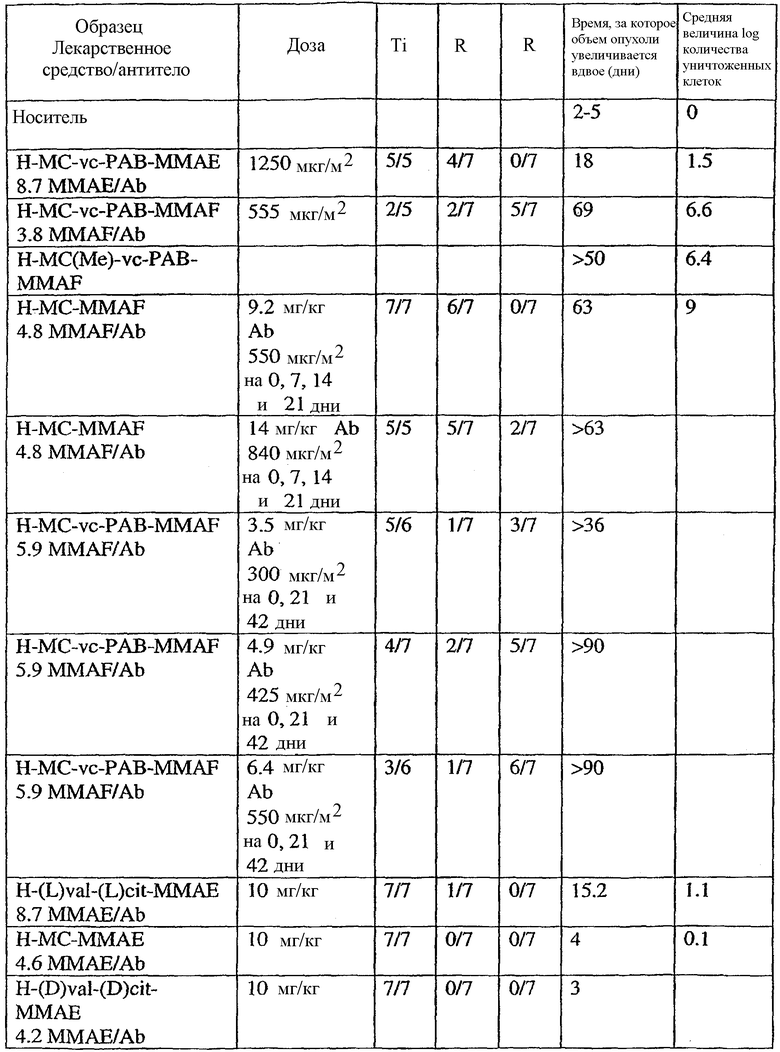
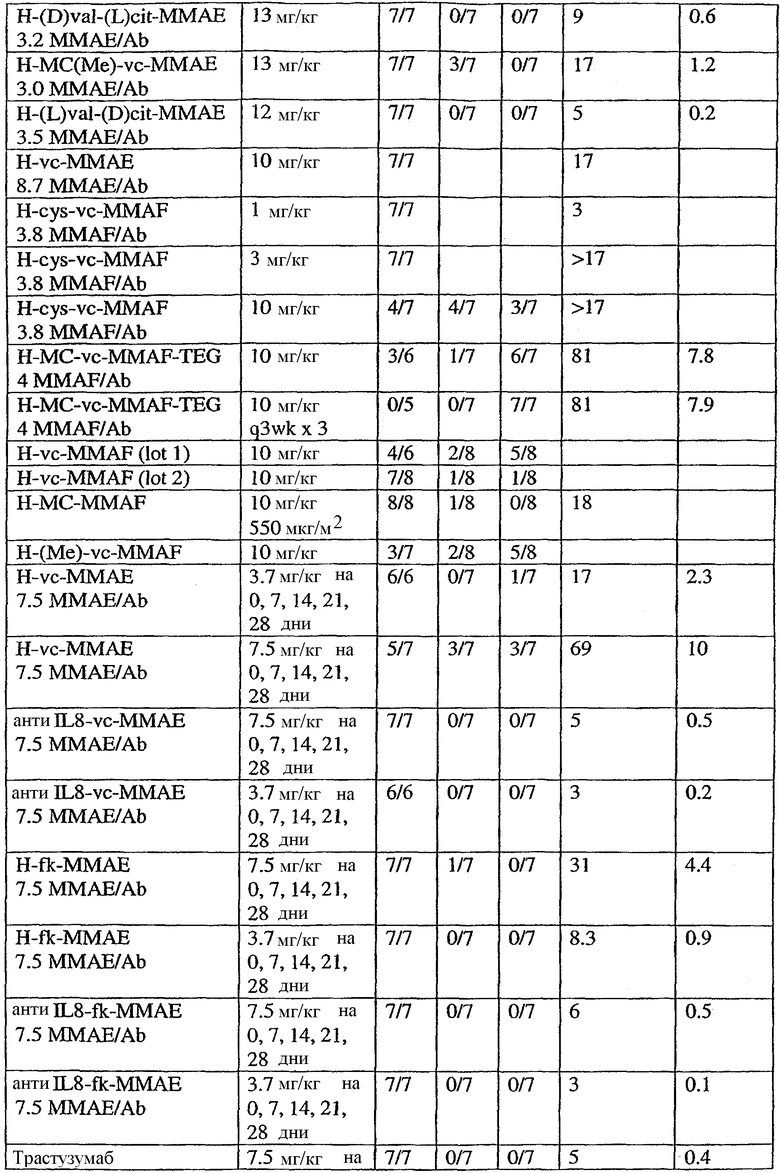
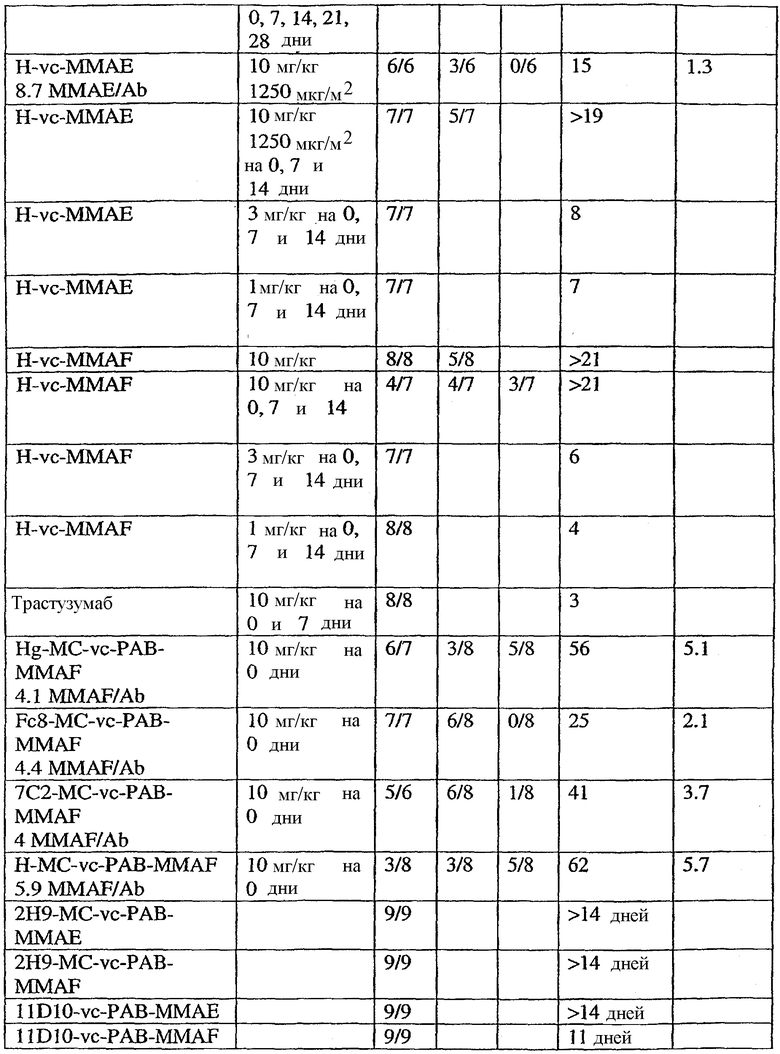
7С2=мышиное антитело против HER2, которое связывается с эпитопом, отличающимся от эпитопа, с которым связывается трастузумаб.
Fc8=мутант, который не связывается с FcRn.
Hg=“Не содержащее шарнирной области” полноразмерное гуманизованное антитело 4D5, в котором цистеины шарнирной области тяжелой цепи заменены серинами. Это антитело было экспрессировано в E.coli (а поэтому оно является негликозилированным).
2Н9=анти-EphB2R антитело
11D10=анти-0772Р антитело.
Термин “Ti” означает число животных с опухолью в исследуемой группе при Т=0 : общее число животных в группе. Термин HR означает число животных, у которых достигалась частичная ремиссия опухоли : число животных с опухолью в группе при Т=0. Термин CR означает число животных, у которых достигалась полная ремиссия опухоли : число животных с опухолью в группе при Т=0. Термин log числа уничтоженных клеток означает время в днях, за которое объем опухоли увеличивается в два раза - время в днях, за которое объем опухоли увеличивается в два раза у контрольной группы, деленное на 3,32 × время, за которое объем опухоли увеличивается в два раза у контрольных животных (которым была введена доза носителя). Величину log числа уничтоженных клеток вычисляют с учетом времени замедления роста опухоли в результате обработки и времени увеличения объема опухоли вдвое в контрольной группе. Противоопухолевую активность ADC классифицировали по величинам log числа уничтоженных клеток, а именно:
Отсутствие активности=0
На фиг.13 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER1 Fo5, которым на день 0 вводили: носитель, трастузумаб-МС-vc-РАВ-МААЕ (1250 мкг/м2) и трастузумаб-МС-vc-РАВ-MAAF (555 мкг/м2) (Н=трастузумаб). Рост опухолей замедлялся после обработки ADC по сравнению с уровнем роста у контрольной группы (носитель). На фиг.14 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER2 Fo5, которым на день 0 вводили: 10 мг/кг (660 мкг/м2) конъюгата трастузумаб-МС-ММАЕ и 1250 мкг/м2 конъюгата трастузумаб-МС-vc-РАВ-ММАЕ. На фиг.15 проиллюстрировано изменение среднего объема опухоли в зависимости от времени у бестимусных “голых” мышей с аллотрансплантатами опухолей молочной железы MMTV-HER2 Fo5, которым вводили 650 мкг/м2 трастузумаб-МС-MMAF. В таблице 2d и на фиг.13-15 показано, что ADC обладает сильной противоопухолевой активностью в аллотрансплантате HER2-позитивной опухоли (Fo5), которая первоначально развивалась у MMTV-HER2-трансгенной мыши. У этой модели отдельно взятое антитело (например, трастузумаб) не обладало значимой противоопухолевой активностью (Erickson et al., патент США № 6632979). Как проиллюстрировано на фиг.13-15, после обработки ADC рост опухолей замедлялся по сравнению с уровнем роста у контрольной группы (носитель).
Удивительными и неожиданными оказались результаты, полученные для противоопухолевой in vivo активности ADC, проиллюстрированной в таблице 2d, которые в общих чертах показали, что ADC с низким средним содержанием молекул лекарственного средства по отношению к антителу, обладало заметной эффективностью, например, после обработки ADC, время увеличения объема опухоли вдвое составляло >15 дней, а средняя величина log числа уничтоженных клеток составляет >1,0. На фиг.16 проиллюстрировано, что для конъюгата “антитело-лекарственное средство”, то есть трастузумаб-МС-vc-РАВ-MMAF, средний объем опухоли снижался и не увеличивался, когда отношение MMAF:трастузумаб составляло 2 и 4, тогда как при отношении 5,9 и 6 опухоль прогрессировала, но скорость ее прогрессирования была ниже, чем у группы, которой вводили носитель (буфер). Скорость прогрессирования опухоли у этих мышей с моделью ксенотрансплантата в группе, которой вводили носитель, и в группе, которой вводили трастузумаб, была примерно одинаковой, то есть составляла 3 дня. Эти результаты позволяют предположить, что, по крайней мере, для ADC с трастузумабом, оптимальное отношение молекул лекарственного средства к антителу должно составлять менее чем 8 и может составлять примерно от 2 до 4.
4.5.5. Токсичность у грызунов
Конъюгаты “антитело-лекарственное средство” и ADC-негативный контроль (“носитель”) оценивали на острую токсичность для крысиной модели. Токсичность ADC оценивали путем обработки самцов и самок крыс Sprague-Dawley, которым был введен ADC, и последующего исследования и анализа его влияния на различные органы. Эмпирические наблюдения включали оценку изменения массы тела и признаков поражения и кровотечения. Оценку клинических параметров патологии (химический и гематологический анализ сыворотки), гистопатологический анализ и аутопсию проводили на животных после введения дозы.
Считается, что потеря массы или изменение массы животных, которым вводили ADC, по сравнению с животными, которым вводили только носитель, является приблизительным и общим показателем системной или местной токсичности. На фиг.17-19 проиллюстрировано влияние различных ADC и контроля (носитель) на массы тела крыс.
Гепатотоксичность измеряли по увеличению уровней ферментов в печени, по увеличению числа митотических и апоптотических признаков и степени некроза гепатоцитов. Гематолимфоидная токсичность наблюдалась по истощению лейкоцитов, первичных гранулоцитов (нейтрофилов) и/или тромбоцитов и по поражению лимфоидных органов, то есть по атрофии или апоптотической активности. На токсичность могут также указывать поражения желудочно-кишечного тракта, такие как увеличение числа митотических и апоптотических признаков и дегенеративный энтероколит.
Ферментами-показателями исследуемых поражений печени являются:
AST (аспартатаминотрансфераза):
- локализация: цитоплазма, печень, сердце, скелетная мышца, почки;
- отношение печень:плазма=7000:1;
- Т1/2: 17 часов;
ALT (аланинаминотрансфераза):
-локализация: цитоплазма, печень, почки, сердце, скелетная мышца;
- отношение печень:плазма=3000:1;
- Т1/2: 42 часа; суточное изменение;
GGT (γ-глутамилтрансфераза):
- локализация: плазматическая мембрана клеток с высокой секреторной или абсорбционной способностью; печень, почки, тонкий кишечник;
- плохой прогноз поражения печени; содержание этого фермента обычно повышается при заболеваниях желчных протоков.
Профили токсичности конъюгатов трастузумаб-МС-val-cit-MMAF, трастузумаб-МС(Ме)-val-cit-РАВ-MMAF, трастузумаб-МС-MMAF и трастузумаб-МС-val-cit-РАВ-MMAF исследовали у самок крыс Sprague-Dawley (пример 19). Гуманизованное антитело трастузумаб не обнаруживало заметного связывания с крысиной тканью, и какая-либо его токсичность должна рассматриваться как неспецифическая. Варианты MMAF при дозах 840 и 2105 мкг/м2 были сравнимы с конъюгатом трастузумаб-МС-val-cit-РАВ-MMAF при дозе 2105 мкг/м2.
У животных в группах 1, 2, 3, 4, 6 и 7 (носитель, 9,94 и 24,90 мг/кг трастузумаб-МС-val-cit-MMAF, 10,69 мг/кг трастузумаб-МС(Ме)-val-cit-РАВ-MMAF и 10,17 и 25,50 мг/кг трастузумаб-МС-MMAF соответственно) наблюдалось увеличение массы тела во время исследования. Животные в группах 5 и 8 (26,78 мг/кг трастузумаб-МС(Ме)-val-cit-PAB-MMAF и 21,15 мг/кг трастузумаб-MC-val-cit-PAB-MMAF соответственно) теряли вес во время исследования. На день 5 проведения исследования изменение массы тела животных в группах 2, 6 и 7 значительно не отличалось от изменения массы тела животных группы 1. Изменение массы тела животных в группах 3, 4, 5 и 8 статистически отличалось от изменения массы тела у животных в группе 1 (пример 19).
Крысы, обработанные конъюгатом “трастузумаб-МС-MMAF” (группы 6 и 7), при обеих дозах, не отличались от контрольных животных, обработанных носителем, то есть в данной модели этот конъюгат обнаруживал наиболее высокий профиль безопасности. Крысы, обработанные конъюгатом “трастузумаб-МС-val-cit-MMAF” (без самоэлиминирующейся группы РАВ; группы 2 и 3), обнаруживали дозозависимое изменение, типичное для MMAF-конъюгатов; при этом степень изменений была меньше по сравнению с действием полноразмерного конъюгата “МС-val-cit-РАВ-MMAF” (группа 8). Число тромбоцитов на 5-й день составляло приблизительно 30% от базовых значений для животных группы 3 (высокая доза “трастузумаб-МС-val-cit-MMAF”) в отличие от животных группы 8, у которых число тромбоцитов составляло 15% (высокая доза “трастузумаб-МС-val-cit-РАВ-MMAF”). Дозозависимое увеличение уровня ферментов AST и ALT или билирубина в печени и степень тромбоцитопении были наиболее заметными у животных, обработанных конъюгатом “трастузумаб-МС(Ме)-val-cit-РАВ-MMAF” (группы 4 и 5), а у животных группы 5 (группы, которой вводили высокие дозы), на 5-й день, уровни ALT приблизительно в 10 раз превышали базовые значения, а число тромбоцитов на время аутопсии было снижено примерно на 90%.
Самкам крыс Sprague-Dawley также вводили высокие дозы (пример 19, эксперимент с высокими дозами: группы 2, 3, 4) конъюгата “трастузумаб-МС-MMAF” и носителя (контрольная группа 1). В этом случае наблюдались слабые сигналы токсичности, включая дозозависимое увеличение уровней ферментов ALT, AST и GGT в печени. На 5-й день у животных в группе, которой вводили самую высокую дозу, наблюдалось 2-кратное увеличение уровня ALT и 5-кратное увеличение уровня AST; при этом также увеличивался уровень GGT (6 ед./л). На 12-й день уровни ферментов имели тенденцию к нормализации. На 5-й день у групп для всех трех доз наблюдался слабый гранулоцитоз, но при этом у всех животных число тромбоцитов почти не изменялось. Морфологические изменения были слабыми, то есть гистологический анализ печени, селезенки, тимуса, тонкого кишечника и костного мозга животных, обработанных дозой 4210 мкг/м2 (группа 2), не выявил значительных изменений. Слегка повышенная апоптотическая и митотическая активность наблюдалась в тимусе и в печени соответственно у животных, обработанных дозой 5500 мкг/м2 (группа 3). Костный мозг имел нормальные клетки, но обнаруживал гранулоцитарную гиперплазию, что соответствовало абсолютному гранулоцитозу, наблюдаемому при подсчете формульных элементов крови у этих животных. У животных группы 4, которым вводили самую высокую дозу, наблюдались те же самые качественные признаки, однако, по сравнению с животными группы 3, митотическая активность в печени была несколько повышенной. Кроме того, в селезенке и в печени этих животных наблюдался экстрамедуллярный гемопоэз.
EphB2R представляет собой тирозинкиназный рецептор TM типа 1, причем мышиный и человеческий рецепторы EphB2R имеют высокую степень гомологии, и этот рецептор сверхэкспрессируется в клетках рака толстой кишки. 2Н9 представляет собой антитело против EphB2R. Взятое отдельно антитело не оказывает какого-либо воздействия на рост опухоли, тогда как конъюгат “2Н9-val-cit-ММАЕ” уничтожает EphB2R-экспрессирующие клетки и обнаруживает эффективность у мышей с моделью ксенотрансплантата человеческой опухоли толстой кишки CXF1103 (Mao et al. (2004) Cancer Res. 64:781-788). 2Н9 и 7С2 представляют собой мышиные антитела IgG1 против HER2. Конъюгаты 2Н9-МС-val-cit-PAB-MMAF (3.7 MMAF/Ab), 7С2-МС-val-cit-РАВ-MMAF (4 MMAF/Ab) и трастузумаб-МС-val-cit-PAB-MMAF (5.9 MMAF/Ab) имеют сравнимые профили токсичности. Различия в структурах каждого иммуноконъюгата или лекарственного компонента такого иммуноконъюгата могут влиять на фармакокинетику и в конечном счете на профиль безопасности. Гуманизованное антитело трастузумаб не обнаруживает какого-либо заметного связывания с крысиной тканью, а поэтому любая его токсичность должна рассматриваться как неспецифическая.
Уровень токсичности/степень безопасности, исследуемые у собакоподобных обезьян
Аналогично исследованию уровня токсичности/степени безопасности у крыс были проведены исследования на собакоподобных обезьянах, которые включали обработку животных ADC с последующим измерением уровня ферментов в печени, а также оценку и анализ их влияния на различные органы. Общие наблюдения включали оценку изменения массы тела и признаков поражения и кровотечения. Оценку клинических параметров патологии (химический и гематологический анализ сыворотки), гистопатологический анализ и аутопсию проводили на животных после введения дозы (пример 19).
Конъюгат “антитело-лекарственное средство”, Н-МС-vc-РАВ-ММАЕ (Н=трастузумаб, присоединенный посредством цистеина) не обнаруживал признаков какой-либо токсичности в печени при любой из тестируемых доз. После введения одной дозы 1100 мг/м2 наблюдалось истощение гранулоцитов периферической крови, а через 14 дней после введения этой дозы наблюдалось их полное восстановление. Конъюгат “антитело-лекарственное средство”, Н-МС-vc-РАВ-ММАЕ, обнаруживал увеличение уровней ферментов в печени при дозах 550 (кратковременное) и 880 мг/м2, при этом не наблюдалось каких-либо признаков гранулоцитопении и дозозависимого кратковременного (группы 2 и 3) снижения числа тромбоцитов.
4.6. Синтез соединений согласно изобретению
Репрезентативные соединения и конъюгаты могут быть получены путем проведения процедур синтеза, описанных ниже в схемах 5-16. Как будет более подробно описано ниже, репрезентативные соединения или конъюгаты могут быть легко получены с использованием линкера, имеющего реактивный сайт связывания с лекарственным средством и лигандом. В одном из аспектов изобретения линкер имеет реактивный сайт, который содержит электрофильную группу, взаимодействующую с нуклеофильной группой, присутствующей на лиганде, таком как, но не ограничивающимся им, антитело. Подходящими нуклеофильными группами на антителе являются, но не ограничиваются ими, сульфгидрильная, гидроксильная и аминогруппы. Гетероатом нуклеофильной группы антитела взаимодействует с электрофильной группой на линкере и образует ковалентную связь с линкерным компонентом. Подходящими электрофильными группами являются, но не ограничиваются ими, малеимидная и галогенацетамидная группы. Указанная электрофильная группа обеспечивает подходящий сайт для связывания с антителом.
В другом варианте изобретения линкер имеет реактивный сайт, который содержит нуклеофильную группу, взаимодействующую с электрофильной группой, присутствующей на антителе. Подходящими электрофильными группами на антителе являются, но не ограничиваются ими, карбонильные группы альдегида и кетона. Гетероатом нуклеофильной группы линкера может взаимодействовать с электрофильной группой на антителе и образует ковалентную связь с антителом. Подходящими нуклеофильными группами на линкере являются, но не ограничиваются ими, гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид. Указанная электрофильная группа на антителе обеспечивает подходящий сайт для связывания с линкером.
Функциональные группы карбоновой кислоты и функциональные группы хлорформиата также являются подходящими реактивными сайтами для связывания с линкером, поскольку они могут взаимодействовать со вторичными аминогруппами лекарственного средства и образовывать амидную связь. В качестве реактивного сайта также может быть использована карбонатная функциональная группа на линкере, такая как, но не ограничивающаяся ею, п-нитрофенилкарбонат, который может взаимодействовать с аминогруппой лекарственного средства, такой как, но не ограничивающейся ею, N-метилвалин, и образовывать карбаматную связь. Обычно пептидные лекарственные средства могут быть получены посредством образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, методом синтеза в растворе (см. E. Schröder & K. Lübke, “The Peptides”, volume 1, p.76-136, 1965, Academic Press), который является хорошо известным методом, применяемым в области пептидного синтеза.
Синтез репрезентативного удлиняющего компонента, имеющего электрофильную малеимидную группу, проиллюстрирован ниже на схемах 8-9. Общие методы синтеза, применяемые для синтеза линкера, описаны на схеме 10. На схеме 11 представлена конструкция линкерного компонента, имеющего группу Val-Cit, электрофильную малеимидную группу и самоэлиминирующуюся спейсерную группу РАВ. На схеме 12 проиллюстрирован синтез линкера, имеющего группу Phe-Lys, электрофильную малеимидную группу с самоэлиминирующейся спейсерной группой РАВ и без нее. На схеме 13 проиллюстрирован общий метод синтеза соединения “лекарственное средство-линкер”, а на схеме 14 представлен альтернативный метод получения соединения “лекарственное средство-линкер”. На схеме 15 представлен синтез разветвленного линкера, содержащего группу BHMS. На схеме 16 проиллюстрирован метод присоединения антитела к соединению “лекарственное средство-линкер” с образованием конъюгата “лекарственное средство-линкер-антитело”, а на схеме 14 проиллюстрирован синтез конъюгатов “лекарственное средство-линкер-антитело”, имеющих, например, но не ограничивающихся ими, 2 или 4 молекулы лекарственного средства на антитело.
Как будет более подробно описано ниже, репрезентативные конъюгаты обычно получают с использованием линкера, имеющего два или более реактивных сайта для связывания с лекарственным средством и лигандом. В одном из аспектов изобретения линкер имеет реактивный сайт, который содержит электрофильную группу, взаимодействующую с нуклеофильной группой, присутствующей на лиганде, таком как антитело. Подходящими нуклеофильными группами на антителе являются, но не ограничиваются ими, сульфгидрильная, гидроксильная и амногруппы. Гетероатом нуклеофильной группы антитела взаимодействует с электрофильной группой на линкере и образует ковалентную связь с линкерным компонентом. Подходящими электрофильными группами являются, но не ограничиваются ими, малеимидная и галогенацетамидная группы. Указанная электрофильная группа обеспечивает подходящий сайт для связывания с антителом.
В другом варианте изобретения линкер имеет реактивный сайт, который содержит нуклеофильную группу, взаимодействующую с электрофильной группой, присутствующей на лиганде, таком как антитело. Подходящими электрофильными группами на антителе являются, но не ограничиваются ими, карбонильные группы альдегида и кетона. Гетероатом нуклеофильной группы линкера может взаимодействовать с электрофильной группой на антителе и образует ковалентную связь с антителом. Подходящими нуклеофильными группами на линкере являются, но не ограничиваются ими, гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и аридгидразид. Указанная электрофильная группа на антителе обеспечивает подходящий сайт для связывания с линкером.
4.6.1 Синтез лекарственного средства
Обычно пептидные лекарственные средства могут быть получены путем образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, методом синтеза в растворе (см. E. Schröder & K. Lübke, “The Peptides”, volume 1, p.76-136, 1965, Academic Press), который является хорошо известным методом, применяемым в области пептидного синтеза.
Лекарственные средства ауристатин/доластатин могут быть получены общими методами, описанными в патенте США № 5635483, в патенте США № 5780588; у Pettit et al., (1989) J. Am. Chem. Soc. 111:5463-5465; у Pettit et al. (1998) Anti-Cancer Drug Design 13:243-277 и у Pettit et al. (1996) J. Chem. Soc. Perkin Trans. 15:859-863.
В одном из вариантов осуществления изобретения лекарственное средство получают путем объединения приблизительно стехиометрического эквивалента дипептида и трипептида, а предпочтительно путем проведения реакции в одном сосуде в подходящих условиях конденсации. Этот метод проиллюстрирован ниже в схемах 5-7.
На схеме 5 проиллюстрирован синтез N-концевой трипептидной молекулы F, которая является подходящим промежуточным соединением для синтеза лекарственных соединений формулы 1b.
Схема 5
Как проиллюстрировано на схеме 5, защищенную аминокислоту А (где PG представляет собой аминовую защитную группу, R4 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, -О-(С1-С8алкила), арила, алкиларила, алкил-(С3-С8карбоцикла), С3-С8гетероцикла, алкил(С3-С8гетероцикла), где R5 выбран из Н и метила; либо R4 и R5, взятые вместе с атомом углерода, с которым они связаны, образуют кольцо, имеющее формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из водорода, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6) подвергают реакции сочетания с трет-бутиловым эфиром В (где R6 выбран из -Н и -С1-С8алкила, а R7 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, -О-(С1-С8алкила), арила, алкиларила, алкил-(С3-С8карбоцикла), С3-С8гетероцикла и алкил-(С3-С8гетероцикла)) в подходящих условиях проведения реакции сочетания, например, в присутствии PyBrop и диизопропилэтиламина или с использованием DCC (см., например, Miyazaki K. et al., Chem. Pharm. Bull. 1995, 43(10), 1706-1718).
Подходящие защитные группы PG и подходящие методы синтеза для защиты аминогруппы защитной группой хорошо известны специалистам. См., например, Greene T.W. и Wuts P.G.M., Protective Groups in Organic Synthesis, 2nd Edition, 1991, John Wiley & Sons. Репрезентативными защищенными аминокислотами А являются PG-Ile, а в частности PG-Val, а другими подходящими защищенными аминокислотами являются, но не ограничиваются ими, PG-циклогексилглицин, PG-циклогексилаланин, PG-аминоциклопропан-1-карбоновая кислота, PG-аминоизомасляная кислота, PG-фенилаланин, PG-фенилглицин и PG-трет-бутилглицин. Z представляет собой репрезентативную защитную группу. Fmoc представляет собой другую репрезентативную защитную группу. Репрезентативным трет-бутиловым эфиром В является трет-бутиловый эфир долаизолейцина.
Дипептид С может быть очищен, например, с помощью хроматографии, а затем он может быть подвергнут реакции снятия защиты, например, с использованием Н2 и 10% Pd-C в этаноле, если PG представляет собой бензилоксикарбонил, или с использованием диэтиламина для удаления защитной группы Fmoc. Полученный амин D легко образует пептидную связь с аминокислотой ВВ (где R1 выбран из -Н, -С1-С8алкила и -С3-С8карбоцикла, R2 выбран из -Н и -С1-С8алкила; либо R1 и R2, взятые вместе с атомом азота, с которым они связаны, образуют кольцо формулы -(CRaRb)n, где Ra и Rb независимо выбраны из -Н, -С1-С8алкила и -С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6, а R3 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, -О-(С1-С8алкила), арила, алкиларила, алкил-(С3-С8карбоцикла), С3-С8гетероцикла и алкил-(С3-С8гетероцикла)). Репрезентативными N,N-диалкиламинокислотами являются аминокислоты ВВ, такие как коммерчески доступный N,N-диметилвалин. Другие N,N-диалкиламинокислоты могут быть получены путем восстановительного бис-алкилирования в соответствии со стандартными процедурами (см., например, Bowman R.E. Stroud H.H. J. Chem. Soc. 1950, 1342-1340). Fmoc-Me-L-Val и Fmoc-Me-L-глицин являются двумя репрезентативными аминокислотами ВВ, которые могут быть использованы для синтеза N-моноалкильных производных. Амин D и аминокислоту ВВ подвергают взаимодействию в присутствии реагента сочетания DEPC и триэтиламина в качестве основания и получают трипептид Е. Затем С-концевую защитную группу Е удаляют с использованием HCl, в результате чего получают трипептидное соединение формулы F.
Иллюстративный метод проведения реакции сочетания с использованием DEPC и реакции сочетания с использованием PyBrop, представленных на схеме 5, описан ниже в общей процедуре А и общей процедуре В соответственно. Иллюстративная методика снятия защиты с Z-защищенного амина посредством каталитического гидрирования описана ниже в общей процедуре С.
Общая процедура А: Пептидный синтез с использованием DEPC. N-защищенную или N,N-дизамещенную аминокислоту или пептид D (1,0 экв.) и амин ВВ (1,1 экв.) разбавляют апротонным органическим растворителем, таким как дихлорметан (0,1-0,5 М). Затем добавляют органическое основание, такое как триэтиламин или диизопропилэтиламин (1,5 экв.), после чего добавляют DEPC (1,1 экв.). Полученный раствор перемешивают предпочтительно в атмосфере аргона в течение периода времени до 12 часов и при этом проводят мониторинг с помощью ВЭЖХ или ТСХ. Растворитель удаляют в вакууме при комнатной температуре и неочищенный продукт очищают с помощью, например, ВЭЖХ или колоночной флеш-хроматографии (на колонке с силикагелем). Соответствующие фракции объединяют и концентрируют в вакууме с получением трипептида Е, который сушат в вакууме в течение ночи.
Общая процедура В: Пептидный синтез с использованием PyBrop. Аминокислоту В (1,0 экв.), необязательно имеющую карбоксильную защитную группу, разбавляют апротонным органическим растворителем, таким как дихлорметан или DME, и получают раствор с концентрацией от 0,5 до 1,0 мМ, после чего добавляют диизопропилэтиламин (1,5 экв.) Затем одной порцией добавляют Fmoc- или Z-защищенную аминокислоту А (1,1 экв.) в виде твердого вещества, после чего к полученной смеси добавляют PyBrop (1,2 экв.). Мониторинг реакции проводят с помощью ТСХ или ВЭЖХ с последующей обработкой, аналогичной обработке, описанной в общей процедуре А.
Общая процедура С: Удаление защитной Z-группы посредством каталитического гидрирования. Z-защищенную аминокислоту или Z-защищенный пептид С разбавляют этанолом и получают раствор с концентрацией от 0,5 до 1,0 мМ в подходящем сосуде, таком как круглодонная колба с толстыми стенками. Затем добавляют 10%-ный палладий на угле (5-10% мас./мас.) и реакционную смесь помещают в атмосферу водорода. Мониторинг реакции проводят с помощью ВЭЖХ, и обычно реакция завершается через 1-2 ч. Реакционную смесь фильтруют через предварительно промытый слой целита, а затем, после фильтрации, целит снова промывают полярным органическим растворителем, таким как метанол. Раствор элюента концентрируют в вакууме с получением остатка, который разбавляют органическим растворителем, а предпочтительно толуолом. Затем органический растворитель удаляют в вакууме и получают амин С без защитной группы.
На схеме 6 проиллюстрирован метод, используемый для получения С-концевого дипептида формулы К, и метод, используемый в реакции сочетания дипептида формулы К с трипептидом формулы F с получением соединений лекарственного средства формулы 1b.
Схема 6
Дипептид К может быть легко получен путем конденсации модифицированной аминокислоты Вос-долапроина G (см., например, Pettit, G.R., et al., Synthesis, 1996, 719-725) с амином формулы Н с использованием конденсирующих агентов, хорошо известных специалистам в области пептидной химии, таких как, например, DEPC, в присутствии триэтиламина, как показано на схеме 5.
Дипептид формулы К может быть затем подвергнут реакции сочетания с трипептидом формулы F в соответствии с общей процедурой D с получением Fmoc-защищенных соединений лекарственного средства формулы L, у которых согласно общей процедуре Е может быть затем удалена защитная группа, в результате чего могут быть получены соединения лекарственного средства формулы (Ib).
Общая процедура D: Синтез лекарственного средства. Смесь дипептида К (1,0 экв.) и трипептида F (1 экв.) разбавляют апротонным органическим растворителем, таким как дихлорметан, с получением 0,1М раствора, а затем добавляют сильную кислоту, такую как трифторуксусная кислота (1/2, об./об.), и полученную смесь перемешивают в атмосфере азота в течение двух часов при 0°С. Мониторинг реакции может быть проведен с помощью ТСХ или предпочтительно ВЭЖХ. Растворитель удаляют в вакууме и полученный остаток сушат путем двойной азеотропной перегонки предпочтительно с использованием толуола. Полученный остаток сушат в условиях высокого вакуума в течение 12 часов, а затем разбавляют апротонным органическим растворителем, таким как дихлорметан. После этого добавляют органическое основание, такое как триэтиламин или диизопропилэтиламин (1,5 экв.), а затем, в зависимости от химических функциональных групп остатка, добавляют либо PyBrop (1,2 экв.), либо DEPC (1,2 экв.). Мониторинг реакции проводят с помощью ТСХ или ВЭЖХ и после завершения реакции реакционную смесь подвергают обработке, аналогичной или идентичной обработке, описанной в общей процедуре А.
Общая процедура Е: Удаление Fmoc с использованием диэтиламина. Fmoc-защищенное лекарственное средство L разбавляют апротонным органическим растворителем, таким как дихлорметан, и к полученному раствору добавляют диэтиламин (1/2, об./об.). Мониторинг прохождения реакции проводят с помощью ТСХ или ВЭЖХ, и обычно реакция завершается через 2 часа. Реакционную смесь концентрируют в вакууме и полученный остаток сушат путем азеотропной перегонки предпочтительно с использованием толуола, а затем сушат в условиях высокого вакуума с получением лекарственного средства 1b, имеющего аминогруппу со снятой защитой.
На схеме 7 проиллюстрирован метод, применяемый для получения MMAF-производных формулы (Ib).
Схема 7
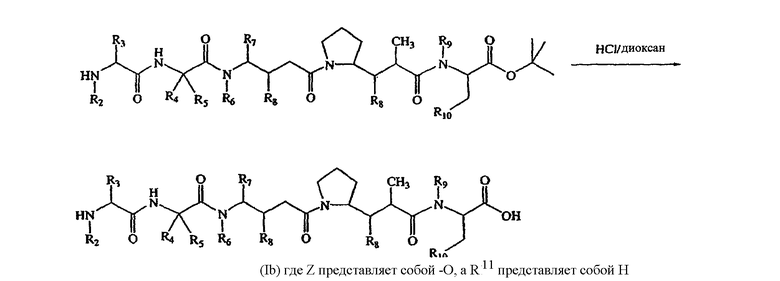
Дипептид О может быть легко получен путем конденсации модифицированной аминокислоты Вос-долапроина G (см., например, Pettit, G.R., et al., Synthesis, 1996, 719-725) с защищенной аминокислотой формулы М с использованием конденсирующих агентов, хорошо известных специалистам в области пептидной химии, таких как, например, DEPC, в присутствии триэтиламина, как показано на схемах 5 и 6.
Дипептид формулы О может быть затем подвергнут реакции сочетания с трипептидом формулы F в соответствии с общей процедурой D с получением Fmoc-защищенных MMAF-соединений формулы Р, у которых согласно общей процедуре Е может быть затем удалена защитная группа, в результате чего могут быть получены MMAF-соединения лекарственного средства формулы (Ib).
Так, например, вышеописанные методы являются подходящими для получения лекарственных средств, которые могут быть использованы в настоящем изобретении.
4.6.2. Синтез конъюгата “лекарственное средство-линкер”
Для получения соединения “лекарственное средство-линкер” согласно изобретению лекарственное средство подвергают взаимодействию с реактивным сайтом на линкере. В общих чертах линкер может иметь структуру:
где присутствуют спейсерный компонент (-Y-) и удлиняющий компонент (-А-). Альтернативно, линкер может иметь структуру:
где отсутствует спейсерный компонент (-Y-).
Линкер может также иметь структуру:
где отсутствуют удлиняющий компонент (-А-) и спейсерный компонент (-Y-).
Линкер может также иметь структуру:
где отсутствуют аминокислотный компонент (W) и спейсерный компонент (Y).
В общих чертах подходящий линкер имеет аминокислотный компонент, присоединенный к необязательному удлиняющему компоненту и необязательному спейсерному компоненту. Реактивный сайт 1 присутствует на конце спейсера, а реактивный сайт 2 присутствует на конце удлиняющего компонента. Если спейсерный компонент отсутствует, то реактивный сайт 1 присутствует у С-конца аминокислотного компонента.
В репрезентативном варианте настоящего изобретения реактивный сайт № 1 подвергается реакции с атомом азота лекарственного средства, а реактивный сайт № 2 подвергается реакции с сульфгидрильной группой на лиганде. Реактивные сайты 1 и 2 могут реагировать с различными функциональными группами.
В одном из аспектов изобретения реактивный сайт № 1 представляет собой  .
.
В другом аспекте изобретения реактивный сайт № 1 представляет собой:
В еще одном аспекте изобретения реактивный сайт № 1 представляет собой п-нитрофенилкарбонат, имеющий формулу:
В одном из аспектов изобретения реактивный сайт № 2 представляет собой тиол-акцептирующую группу. Подходящими тиол-акцептирующмими группами являются галогенацетамидные группы, имеющие формулу:
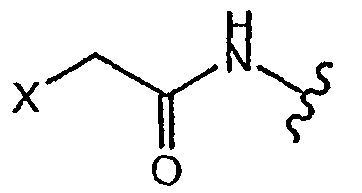
где Х представляет собой уходящую группу, предпочтительно О-мезил, О-тозил, -Cl, -Br или -I; или малеимидную группу, имеющую формулу:
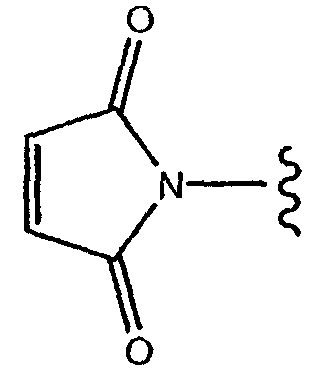
Используемые линкеры могут быть получены из коммерчески доступных источников, таких как Molecular Biosciences Inc. (Boulder, CO), или они могут быть получены, как описано ниже в схемах 8-10.
Схема 8
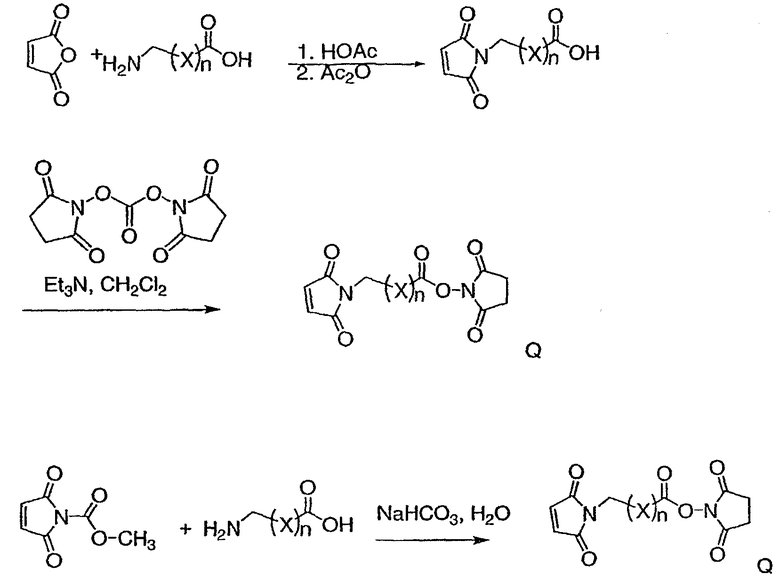
где Х представляет собой -СН2- или -СН2ОСН2-; а n равно целому числу от 0 до 10, если Х представляет собой -СН2-; или от 1 до 10, если Х представляет собой -СН2ОСН2-.
В методе, проиллюстрированном на схеме 9, малеимид подвергают взаимодействию с гликолем в условиях реакции Мицунобу, в результате чего получают удлиняющий компонент “полиэтиленгликоль-малеимид” (см., например, Walker M.A. J. Org. Chem. 1995, 60, 5352-5), а затем в реактивный сайт вводят п-нитрофенилкарбонатную группу.
Схема 9
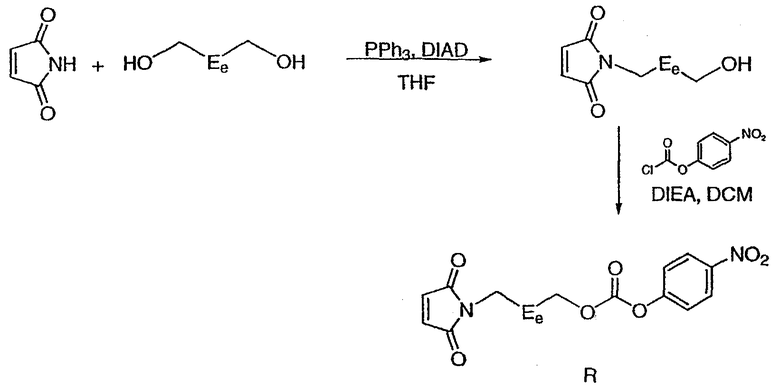
где Е представляет собой -СН2- или -СН2ОСН2-; а е равно целому числу от 0 до 8.
Альтернативно, ПЭГ-малеимидный и ПЭГ-галогенацетамидный удлиняющие компоненты могут быть получены, как описано Frisch et al. Bioconjugate Chem. 1996, 7, 180-186. На схеме 10 проиллюстрирован общий синтез репрезентативного линкерного компонента, содержащего малеимидную удлиняющую группу и, необязательно, самоэлиминирующийся спейсер, представляющий собой п-аминобензиловый эфир.
Схема 10
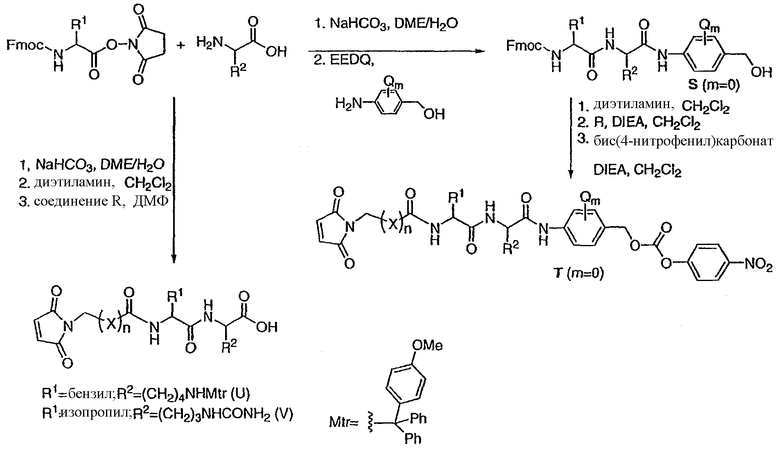
где Q представляет собой -С1-С8алкил, -О-(С1-С8алкил), -галоген, -нитро или -циано; m равно целому числу от 0 до 4, а n равно целому числу от 0 до 10.
Используемые удлиняющие компоненты могут быть введены в линкер с применением коммерчески доступных промежуточных соединений, поставляемых Molecular Biosciences (Boulder, CO), как описано ниже в соответствии с известными методами органического синтеза. Удлиняющие компоненты формулы (IIIa) могут быть введены в линкер путем взаимодействия нижеследующих промежуточных соединений с N-концом аминокислотного компонента, как показано на схемах 11 и 12.
где n равно целому числу от 1 до 10, а Т представляет собой -Н или -SO3Na;
где n равно целому числу от 0 до 3;
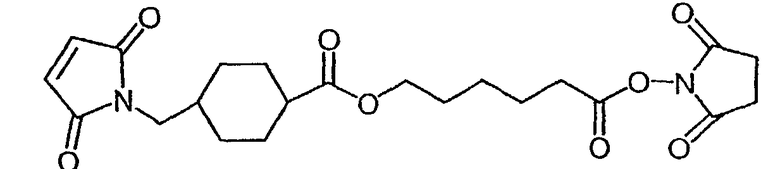 и
и
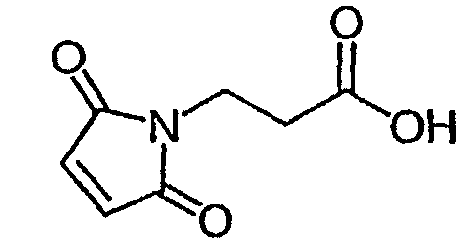 .
.
Удлиняющие компоненты формулы (IIIb) могут быть введены в линкер путем взаимодействия нижеследующих промежуточных соединений с N-концом аминокислотного компонента:
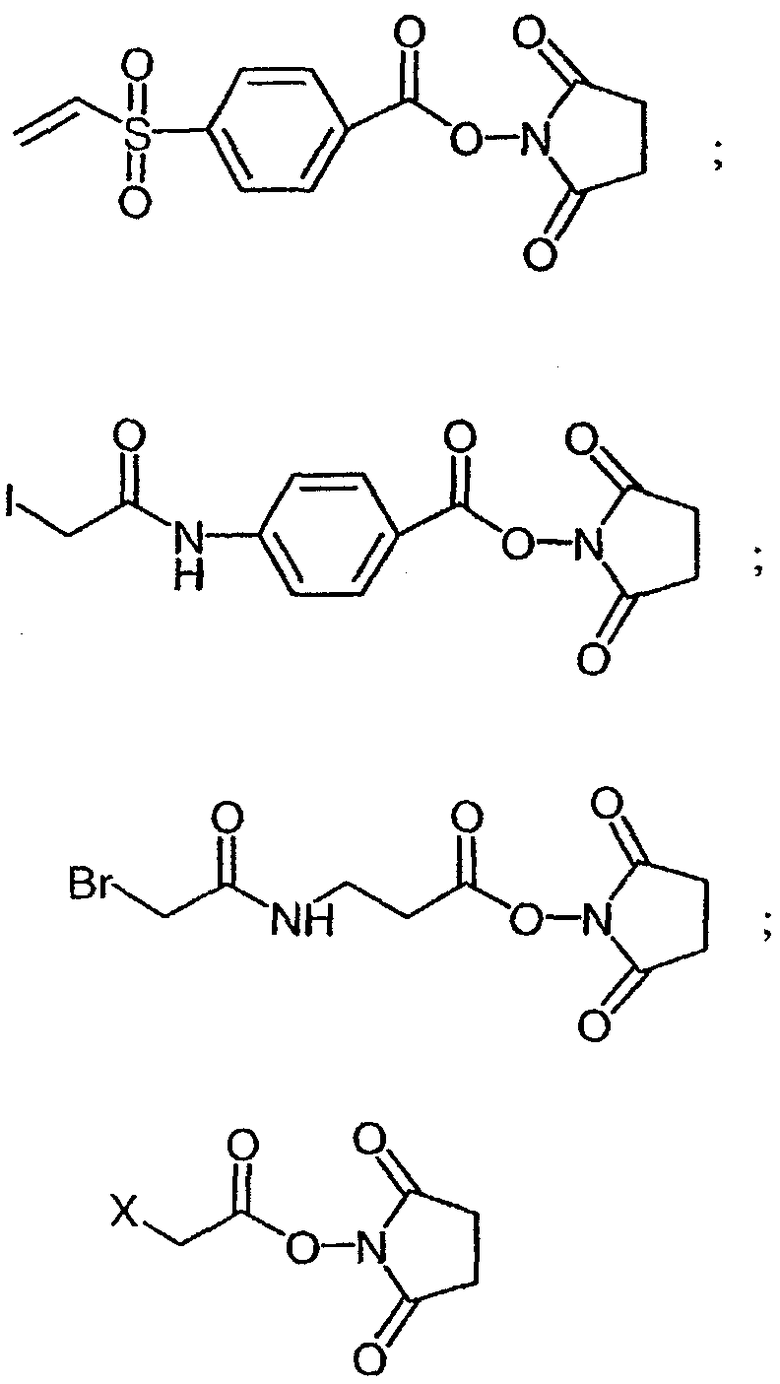
где Х представляет собой Br или I; и
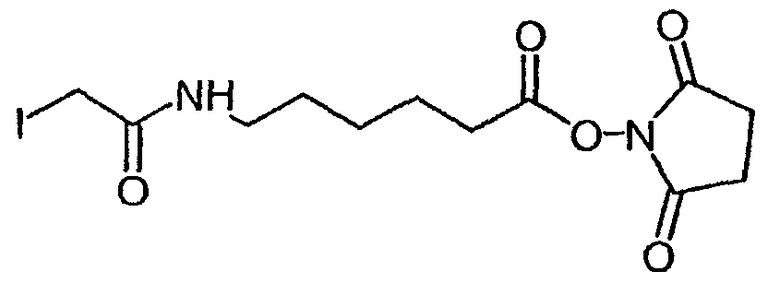
Удлиняющие компоненты формулы (IV) могут быть введены в линкер путем взаимодействия нижеследующих промежуточных соединений с N-концом аминокислотного компонента:
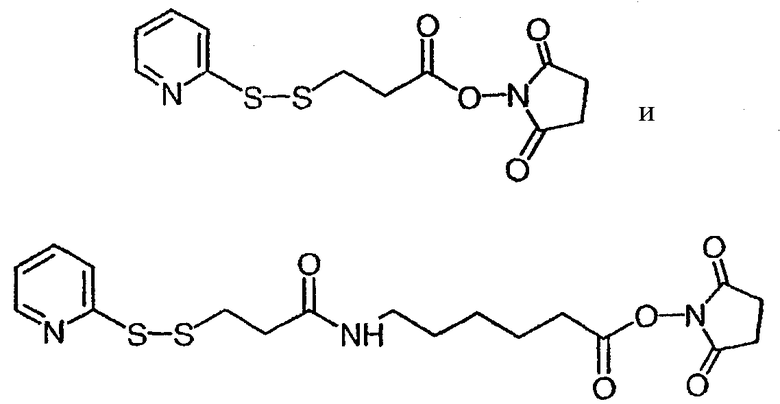
Удлиняющие компоненты формулы (Va) могут быть введены в линкер путем взаимодействия нижеследующих промежуточных соединений с N-концом аминокислотного компонента:
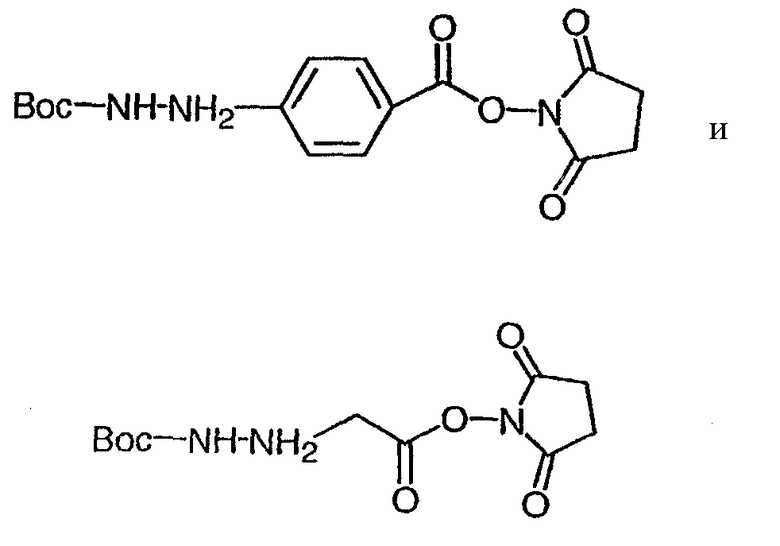
Другие используемые удлиняющие компоненты могут быть синтезированы известными методами. Удлиняющие аминоокси-компоненты представленной ниже формулы могут быть получены путем обработки алкилгалогенидов N-Вос-гидроксиламином в соответствии с процедурами, описанными Jones D.S. et al. Tetrahedron Letters, 2000, 41(10), 1531-1533 и Gilon C. et al., Tetrahedron, 1967, 23(11), 4441-4447.
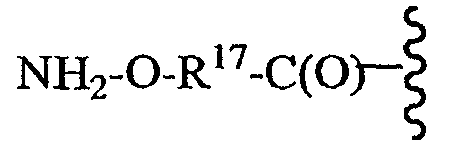
где R17 выбран из -С1-С10алкилена, -С3-С8карбоцикло, -О-(С1-С8алкила), арилена, -С1-С10алкиленарилена, арилен-С1-С10алкилена, -С1-С10алкилен-(С3-С8карбоцикло)-, -(С3-С8карбоцикло)-С1-С10алкилена, -С3-С8гетероцикло, -С1-С10алкилен-(С3-С8гетероцикло)-, -(С3-С8гетероцикло)-С1-С10алкилена, -(СН2СН2О)r-, -(СН2СН2О)r-СН2-; а r равно целому числу от 1 до 10.
Изотиоцианатные удлиняющие компоненты представленной ниже формулы могут быть получены из хлорангидридов изотиоцианатокарбоновой кислоты, как описано у Angew. Chem. 1975, 87(14):517.
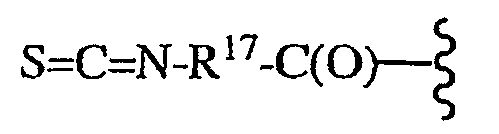
где R17 является таким, как он определен в описании изобретения.
На схеме 11 проиллюстрирован метод получения дипептидного линкера val-cit, имеющего малеимидный удлиняющий компонент и, необязательно, самоэлиминирующийся спейсер, представляющий собой п-аминобензил.
Схема 11
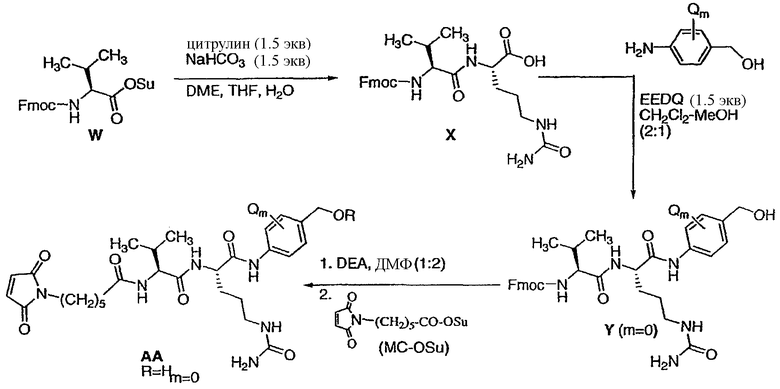
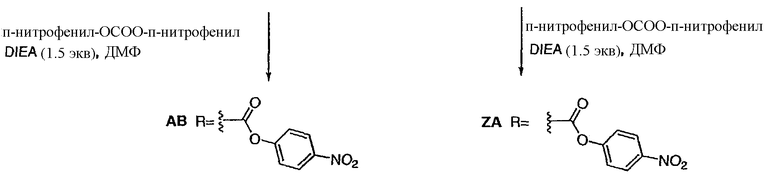
где Q представляет собой -С1-С8алкил, -О-(С1-С8алкил), -галоген, -нитро или -циано; а m равно целому числу от 0 до 4.
На схеме 12 проиллюстрирован синтез Phe-Lys(Mtr)-дипептидного линкерного компонента, имеющего малеимидный удлиняющий компонент и п-аминобензиловый самоэлиминирующийся спейсерный компонент. Исходный материал AD (Lys(Mtr)) является коммерчески доступным (Bachem, Torrance, CA), либо он может быть получен, как описано Dubowchik et al. Tetrahedron Letters, (1997) 38:5257-60.
Схема 12
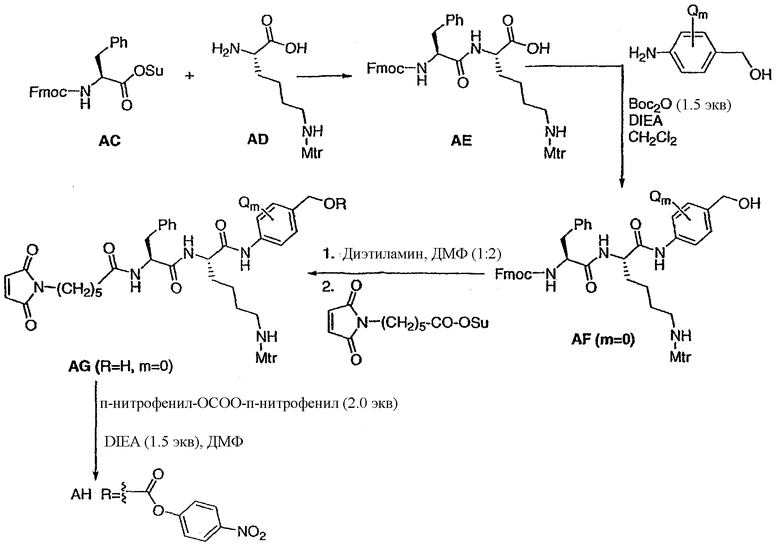
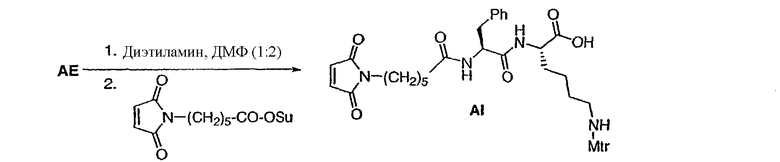
где Q представляет собой -С1-С8алкил, -О-(С1-С8алкил), -галоген, -нитро или -циано; а m равно целому числу от 0 до 4.
Как показано на Схеме 13, линкер может быть подвергнут взаимодействию с аминогруппой соединения лекарственного средства формулы (Ib) с образованием соединения “лекарственное средство-линкер”, которое содержит амидную или карбаматную группу, связывающую компонент “лекарственное средство” с компонентом “линкер”. Если реактивным сайтом № 1 является карбоновокислотная группа, как в линкере AJ, то реакция сочетания может быть осуществлена с использованием HATU или PyBrop и соответствующего аминового основания с получением соединения “лекарственное средство-линкер” АК, содержащего амидную связь между компонентом “лекарственное средство” и компонентом “линкер”. Если реактивным сайтом № 1 является карбонат, как в линкере AL, то линкер может быть присоединен к лекарственному средству с использованием HOBt в смеси ДМФ/пиридин с получением соединения “лекарственное средство-линкер” АМ, содержащего карбаматную связь между компонентом “лекарственное средство” и компонентом “линкер”.
Альтернативно, если реактивным сайтом №1 является хорошая уходящая группа, такая как в линкере AN, то линкер может быть присоединен к аминогруппе лекарственного средства путем проведения реакции нуклеофильного замещения, в результате чего может быть получено соединение “лекарственное средство-линкер”, имеющее аминовую связь (AO) между компонентом “лекарственное средство” и компонентом “линкер”.
Репрезентативные методы, применяемые для присоединения лекарственного средства к лиганду, с получением соединения “лекарственное средство-линкер”, описаны в схеме 13 и проиллюстрированы в общих процедурах G-H.
Схема 13
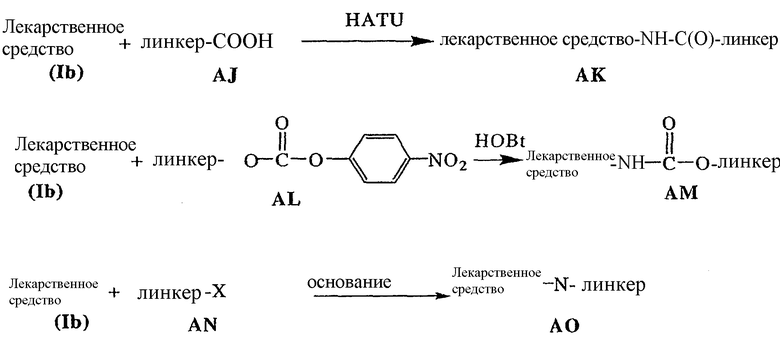
Общая процедура G: Образование амида с использованием HATU. Лекарственное средство (Ib) (1,0 экв.) и N-защищенный линкер, содержащий карбоновокислотный реактивный сайт (1,0 экв.), разбавляют подходящим органическим растворителем, таким как дихлорметан, и полученный раствор обрабатывают HATU (1,5 экв.) и органическим основанием, предпочтительно пиридином (1,5 экв). Реакционную смесь перемешивают в инертной атмосфере, предпочтительно в атмосфере аргона, 6 часов, в течение которых проводят мониторинг реакционной смеси с помощью ВЭЖХ. Реакционную смесь концентрируют и полученный остаток очищают с помощью ВЭЖХ с получением амида формулы АК.
Процедура Н: Образование карбамата с использованием HOBt. Смесь линкера AL, имеющего п-нитрофенилкарбонатный реактивный сайт (1,1 экв.) и лекарственное средство (1b) (1,0 экв.), разбавляют апротонным органическим растворителем, таким как ДМФ, с получением раствора, имеющего концентрацию 50-100 мМ, и полученный раствор обрабатывают HOBt (2,0 экв.) и помещают в инертную атмосферу, предпочтительно в атмосферу аргона. Реакционную смесь перемешивают в течение 15 минут, а затем добавляют органическое основание, такое как пиридин (1/4, об./об.), и проводят мониторинг реакции с помощью ВЭЖХ. Поглощение линкера обычно происходит за 16 часов. Затем реакционную смесь концентрируют в вакууме и полученный остаток очищают, например, с помощью ВЭЖХ, с получением карбамата AM.
Альтернативный метод получения соединений “лекарственное средство-линкер” проиллюстрирован на схеме 14. В соответствии с методом, проиллюстрированным на схеме 14, лекарственное средство присоединяют к части линкерного компонента (например, ZA), к которому не присоединен удлиняющий компонент. В результате может быть получено промежуточное соединение АР, которое имеет аминокислотный компонент, содержащий Fmoc-защищенную N-концевую группу. Затем группу Fmoc удаляют, после чего полученное аминовое промежуточное соединение AQ присоединяют к удлиняющему компоненту посредством реакции сочетания, катализируемой с использованием PyBrop или DEPC. Конструирование соединений “лекарственное средство-линкер”, содержащих либо бромацетамидный удлиняющий компонент AR, либо ПЭГ-малеимидный удлиняющий компонент AS, проиллюстрировано на схеме 14.
Схема 14
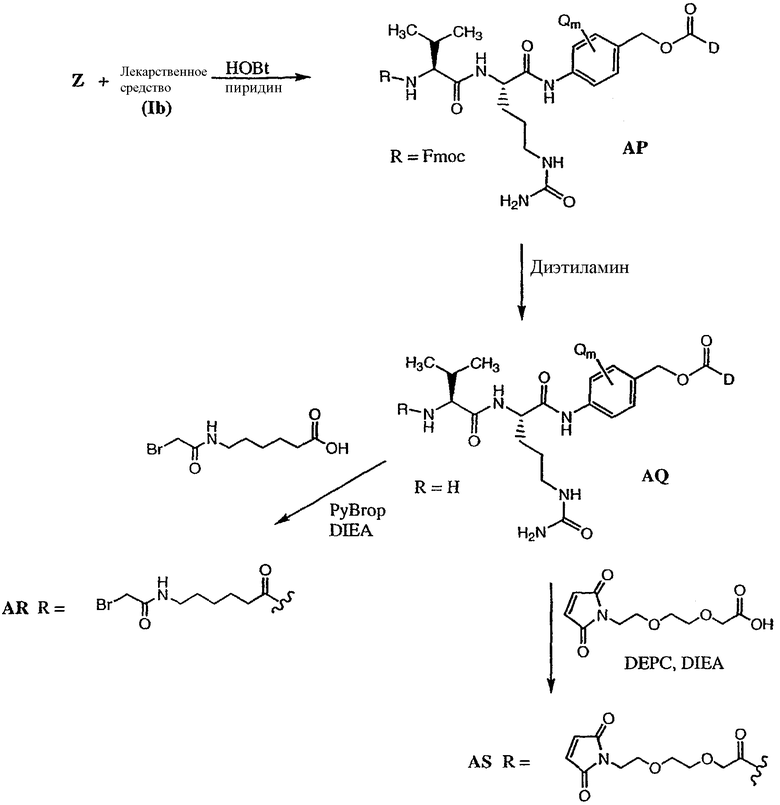 М!
М!
где Q представляет собой -С1-С8алкил, -О-(С1-С8алкил), -галоген, -нитро или -циано; а m равно целому числу от 0 до 4.
Методика, применяемая для получения линкерного компонента, содержащего спейсер с разветвленной цепью, проиллюстрирована на схеме 15.
Схема 15
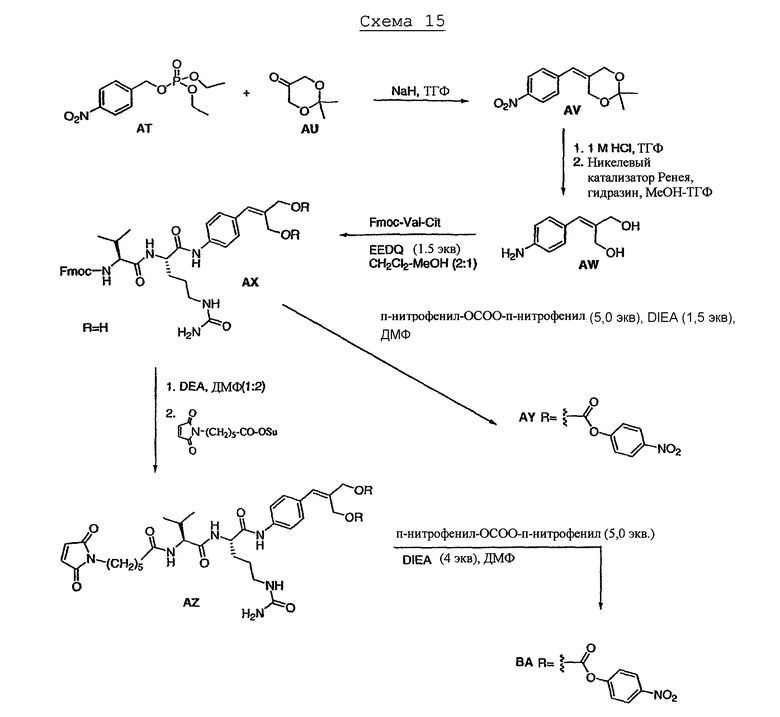
На схеме 15 проиллюстрирован синтез дипептидного линкера val-cit, имеющего малеимидный удлиняющий компонент и бис(4-гидроксиметил)стироловый (BHMS) компонент. Синтез промежуточного соединения BHMS (AW) был усовершенствован по сравнению с синтезом, описанным ранее в литературе (см. публикацию Международной заявки № WO 9813059, Firestone et al. & Crozet M.P.; Archaimbault G.; Vanelle P.; Nouguier R. Tetrahedron Lett. (1985) 26:5133-5134), и в этом синтезе в качестве исходных материалов используется коммерчески доступный диэтил-(4-нитробензил)фосфонат (АТ) и коммерчески доступный 2,2-диметил-1,3-диоксан-5-он (AU). Линкеры AY и ВА могут быть получены из промежуточного соединения AW в соответствии с методикой, проиллюстрированной на схеме 9.
4.6.3. Дендритные линкеры
Линкером может быть линкер дендритного типа, используемый для ковалентного связывания более чем одной молекулы лекарственного средства с лигандом, таким как, но не ограничивающимся им, антитело, посредством ветвящейся многофункциональной линкерной молекулы (Sun et al. (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al. (2003) Bioorganic & Medicinal Chemistry 11:1761-1768). Дендритные линкеры позволяют увеличивать молярное отношение лекарственного средства к антителу, то есть нагрузку, которая соответствует эффективности конъюгата “лекарственное средство-линкер-лиганд”. Таким образом, если сконструированное на основе цистеина антитело содержит только одну реакционноспособную тиоловую группу цистеина, то посредством дендритного линкера может быть присоединено большое количество молекул лекарственного средства.
В нижеследующих репрезентативных вариантах реагенты дендритного линкера позволяют образовывать конъюгаты с девятью нуклеофильными реагентами молекулы лекарственного средства посредством взаимодействия с хлорэтильными функциональными группами азотного аналога горчичного газа:
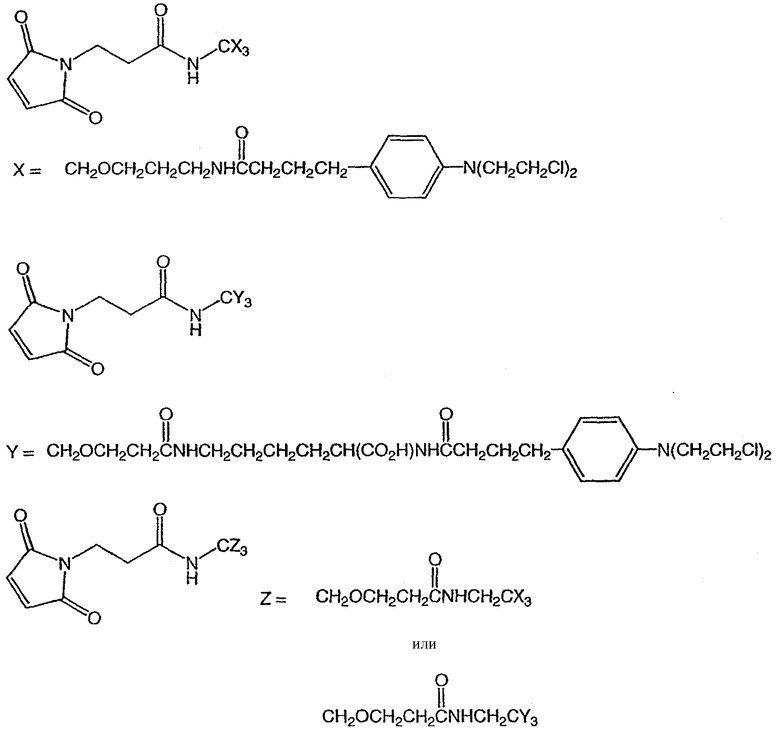
4.6.4. Конъюгирование молекул лекарственного средства с антителами
На схеме 16 проиллюстрирована методика, применяемая для получения конъюгатов “лекарственное средство-линкер-лиганд”, имеющих примерно от 2 до 4 молекул лекарственного средства на антитело. Антитело обрабатывают восстановителем, таким как дитиотреитол (ДТТ) для восстановления некоторых или всех цистеиновых дисульфидных остатков с образованием в высокой степени нуклеофильных тиоловых групп цистеина (-CH2SH). Такое частично восстановленное антитело подвергают реакции с соединениями “лекарственное средство-линкер” или с линкерными реагентами, то есть с их электрофильными функциональными группами, такими как малеимид или α-галогенкарбонил, в соответствии с методом конъюгирования, описанным на стр.766 Klussman et al. (2004) Bioconjugate Chemistry 15(4):765-773.
Схема 16

Так, например, антитело, например АС10, растворенное в 500 мМ борате натрия и 500 мМ хлорида натрия при рН 8,0, обрабатывают избытком 100 мМ дитиотреитола (ДТТ). После инкубирования при 37ºС в течение 30 минут буфер заменяют путем элюирования на смоле Сефадекс G25 и элюируют PBS с 1 мМ DTPA. Отношение тиол/Ab вычисляют путем определения концентрации восстановленного антитела исходя из оптической плотности при 280 нм раствора и концентрации тиола посредством реакции с DTNB (Aldrich, Milwaukee, WI) и определения оптической плотности при 412 нМ. Восстановленное антитело растворяют в PBS и охлаждают на льду. Конъюгат “лекарственное средство-линкер”, например МС-val-cit-РАВ-ММАЕ в ДМСО, растворенный в ацетонитриле и воде в известных концентрациях, добавляют к охлажденному восстановленному антителу в PBS. Примерно через один час для гашения реакции и “кэпирования” непрореагировавших тиоловых групп антитела добавляют избыток малеимида. Реакционную смесь концентрируют путем ультрафильтрации на центрифуге и ADC, например АС10-МС-vc-РАВ-ММАЕ, очищают, обессоливают путем элюирования через смолу G25 в PBS, фильтруют через 0,2 мкм-фильтры в стерильных условиях и замораживают для хранения.
Были получены различные конъюгаты “антитело-лекарственное средство” (ADC) с различными линкерами и молекулами лекарственного средства, ММАЕ и MMAF. В нижеследующей таблице представлены репрезентативные группы ADC, которые были получены в соответствии с протоколом, описанным в примере 27, и охарактеризованы с помощью ВЭЖХ и анализа на загрузку лекарственного средства.
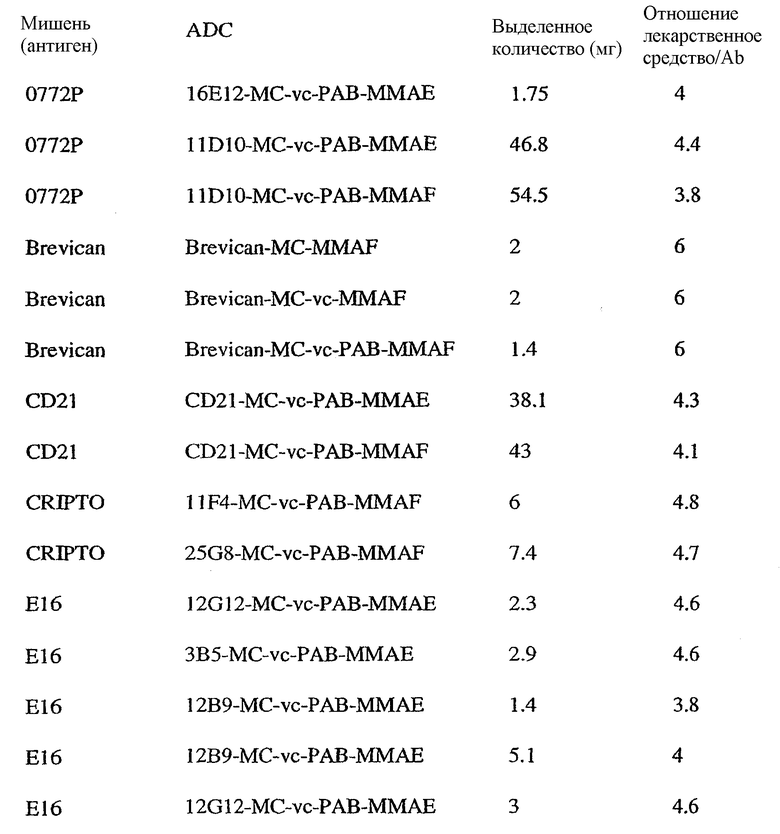

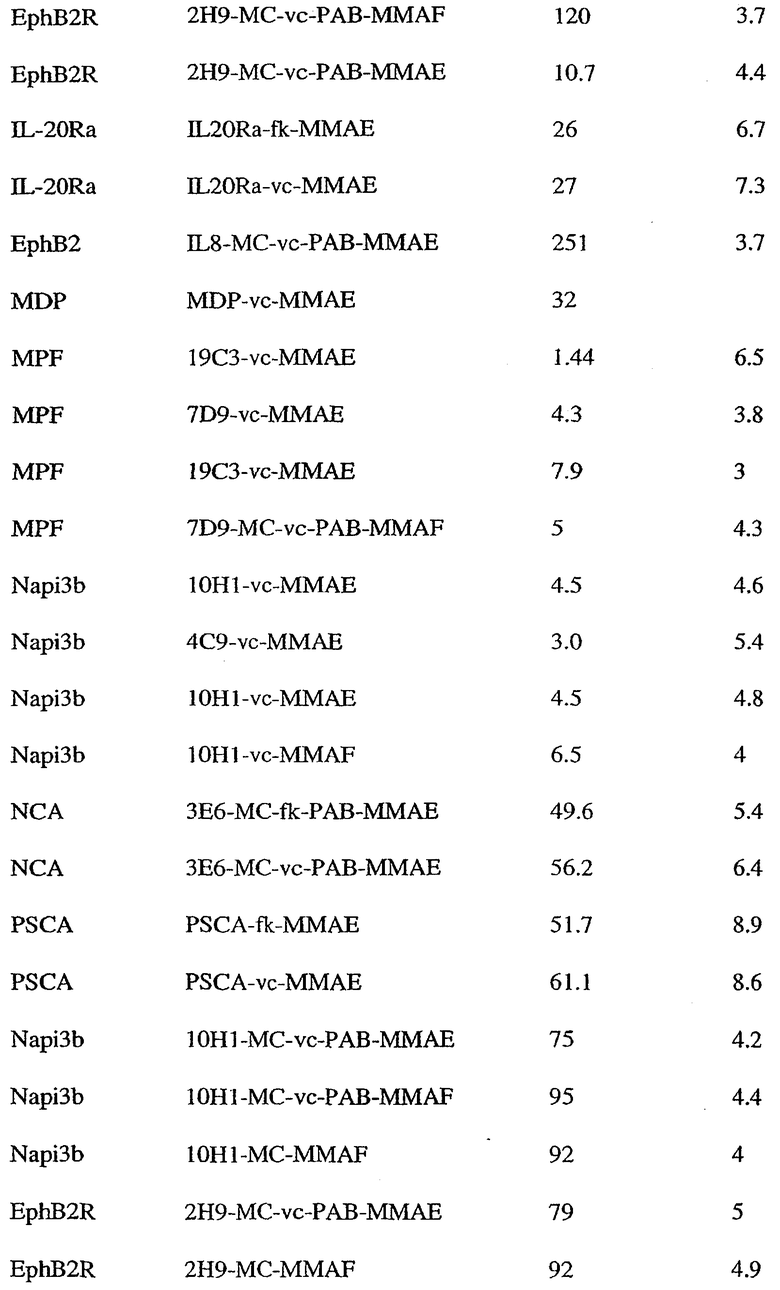
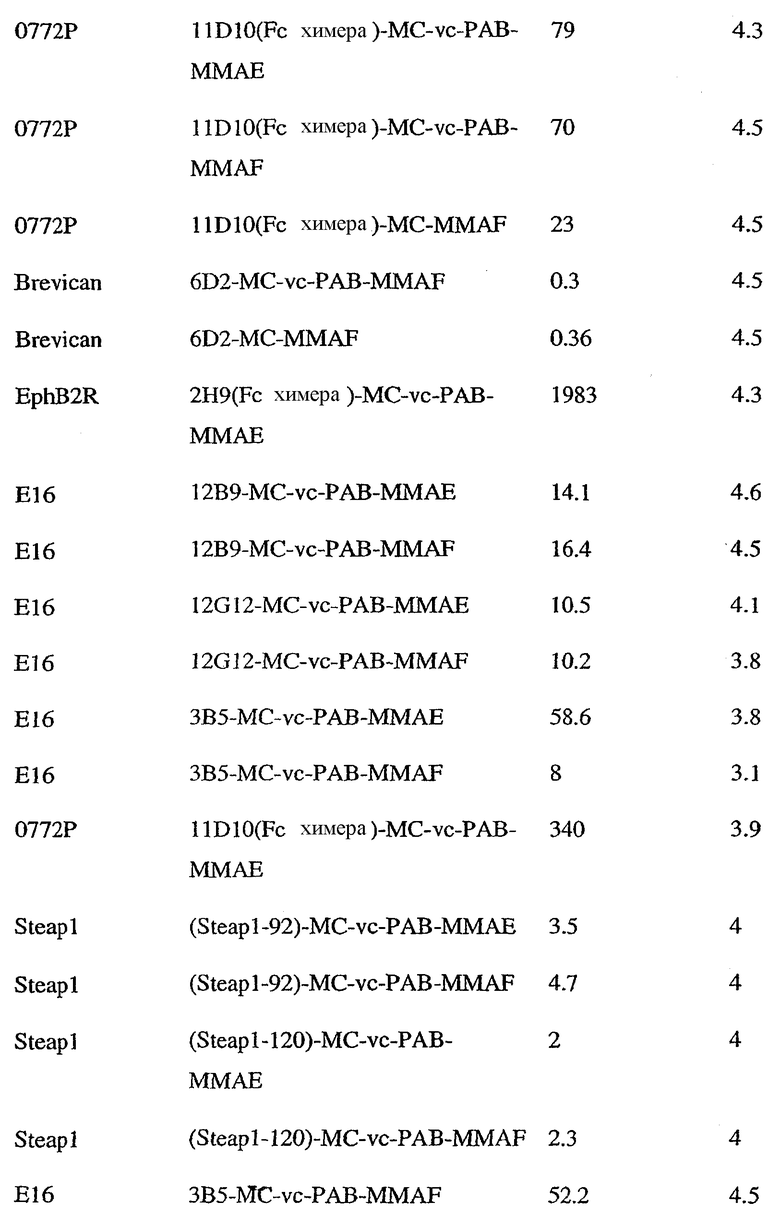
4.7. Композиции и способы введения
В другом своем варианте настоящее изобретение относится к композиции, включающей эффективное количество репрезентативного соединения и/или репрезентативного конъюгата и фармацевтически приемлемого носителя или наполнителя. Для удобства компоненты “лекарственное средство” и соединения “лекарственное средство-линкер” будут называться репрезентативными соединениями, а конъюгаты “лекарственное средство-лиганд” и “лекарственное средство-линкер-лиганд” будут называться репрезентативными конъюгатами. Указанные композиции могут быть использованы для введения животным и человеку.
Композиции согласно изобретению могут быть получены в любой форме, которая позволяет вводить эти композиции пациенту. Так, например, композиция может иметь твердую, жидкую или газообразную (аэрозоль) форму. Типичными способами введения являются, но не ограничиваются ими, пероральное, местное, парентеральное, подъязычное, ректальное, вагинальное, внутриглазное, внутриопухолевое и интраназальное введение. Парентеральное введение включает подкожные, внутривенные, внутримышечные и интрастернальные инъекции или вливания. В одном из аспектов изобретения композиции вводят парентерально. В другом аспекте изобретения репрезентативные соединения и/или репрезентативные конъюгаты или композиции вводят внутривенно.
Фармацевтические композиции могут быть приготовлены так, чтобы после их введения пациенту репрезентативные соединения и/или репрезентативные конъюгаты становились биодоступными. Композиции могут быть приготовлены в виде одной или нескольких унифицированных лекарственных форм, например в виде таблетки, которая может представлять собой разовую унифицированную лекарственную форму, и контейнера, содержащего репрезентативное соединение и/или репрезентативный конъюгат в виде аэрозоля, который может содержать множество унифицированных лекарственных форм.
Материалы, используемые для получения фармацевтических композиций, могут быть нетоксичными в используемых количествах. Для каждого специалиста очевидно, что оптимальная доза активного(ых) ингредиента(ов) в фармацевтической композиции зависит от ряда факторов. Такими факторами являются, но не ограничиваются ими, тип животного (например, человек), конкретная форма репрезентативного соединения или конъюгата, способ введения и используемая композиция.
Фармацевтически приемлемый носитель или наполнитель может быть твердым веществом, что позволяет получать композиции, например, в форме таблетки или порошка. Носитель может быть жидким, а поэтому содержащие его композиции могут быть, например, приготовлены в форме сиропа для перорального введения или раствора для инъекций. Кроме того, носитель может быть газообразным или порошкообразным и использован для приготовления аэрозольной композиции, применяемой, например, для введения путем ингаляции.
Для перорального введения композицию предпочтительно приготавливают в твердой или жидкой форме, которыми могут быть полутвердые, полужидкие, суспензионные и гелевые формы, которые включены здесь в формах, рассматриваемых как твердые или жидкие.
Твердая композиция для перорального введения может быть приготовлена в виде порошка, гранул, спрессованных таблеток, драже, капсул, жевательной резинки, облатки или т.п. Такая твердая композиция обычно содержит один или несколько инертных разбавителей. Кроме того, в этой композиции могут присутствовать один или несколько нижеследующих агентов: связующие агенты, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза или желатин; наполнители, такие как крахмал, лактоза или декстрины; дезинтегрирующие агенты, такие как альгиновая кислота, альгинат натрия, примогель, кукурузный крахмал и т.п.; замасливатели, такие как стеарат магния или стеротекс; вещества, увеличивающие скольжение, такие как коллоидальная двуокись кремния; подсластители, такие как сахароза или сахарин; отдушка, такая как перечная мята, метилсалицилат или апельсиновая отдушка; и краситель.
Если композиция приготовлена в форме капсулы, например в форме желатиновой капсулы, то она, помимо вышеуказанных материалов, может содержать жидкий носитель, такой как полиэтиленгликоль, циклодекстрин или жирное масло.
Композиция может быть приготовлена в форме жидкости, например эликсира, сиропа, раствора, эмульсии или суспензии. Такая жидкость может быть использована для перорального введения или для доставки путем инъекции. Композиция для перорального введения может содержать один или несколько таких агентов, как подсластитель, консерванты, краситель/окрашивающее вещество и интенсификатор вкуса и аромата. В композицию, предназначенную для введения путем инъекции, могут быть включены один или несколько таких агентов, как поверхностно-активное вещество, консервант, смачивающее вещество, диспергирующий агент, суспендирующий агент, буфер, стабилизатор и агент, придающий изотоничность.
Жидкие композиции, независимо от того, являются ли они растворами, суспензиями или имеют другую форму, могут также включать один или несколько из следующих агентов, а именно стерильные разбавители, такие как вода для инъекции, солевой раствор, а предпочтительно физиологический раствор, раствор Рингера, изотонический хлорид натрия, жирные масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, циклодекстрин, пропиленгликоль или другие растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислоты или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты; и агенты для коррекции тоничности, такие как хлорид натрия или декстроза. Композиция для парентерального введения может быть заключена в ампулу, в одноразовый шприц или в сосуд для многократного приема, изготовленный из стекла, пластика или другого материала. Репрезентативным адъювантом является физиологический раствор. Композиция для инъекций является предпочтительно стерильной.
Количество репрезентативного соединения и/или репрезентативного конъюгата, которое является эффективным для лечения конкретного расстройства или состояния, зависит от природы этого расстройства или состояния и может быть определено стандартными клиническими методами. Кроме того, могут быть проведены, но необязательно, in vitro или in vivo анализы для определения оптимальных уровней доз. Точная доза, используемая в этих композициях, также зависит от способа введения, тяжести заболевания или расстройства и должна быть назначена лечащим врачом для каждого пациента индивидуально.
Композиции содержат определенное количество репрезентативного соединения и/или репрезентативного конъюгата, эффективное для получения соответствующей дозы. Обычно такое количество составляет, по меньшей мере, примерно 0,01% репрезентативного соединения и/или репрезентативного конъюгата по массе данной композиции. Для перорального введения это количество может варьироваться в пределах примерно от 0,1% до 80% по массе композиции. В одном из аспектов изобретения композиции для перорального введения могут содержать примерно от 4% до 50% репрезентативного соединения и/или репрезентативного конъюгата по массе композиции. В еще одном аспекте композиции согласно изобретению приготавливают так, чтобы унифицированная лекарственная форма для парентерального введения содержала примерно от 0,01 до 2 мас.% репрезентативного соединения и/или репрезентативного конъюгата.
Композиция для внутривенного введения может содержать примерно от 0,01 до 100 мг репрезентативного соединения и/или репрезентативного конъюгата на кг массы тела животного. В одном из аспектов изобретения такая композиция может содержать примерно от 1 до 100 мг репрезентативного соединения и/или репрезентативного конъюгата на кг массы тела животного. В другом аспекте изобретения вводимое количество репрезентативного соединения и/или репрезентативного конъюгата составляет в пределах примерно от 0,1 до 25 мг/кг массы тела животного.
Обычно доза репрезентативного соединения и/или репрезентативного конъюгата, вводимая пациенту, составляет примерно от 0,01 до 2000 мг/кг массы тела животного. В одном из аспектов изобретения доза, вводимая пациенту, составляет примерно от 0,01 до 10 мг/кг массы тела животного, в другом аспекте изобретения доза, вводимая пациенту, составляет примерно от 0,1 до 250 мг/кг массы тела животного, В еще одном аспекте изобретения доза, вводимая пациенту, составляет примерно от 0,1 до 20 мг/кг массы тела животного, В еще одном аспекте изобретения вводимая доза составляет примерно от 0,1 до 10 мг/кг массы тела животного, а в другом аспекте изобретения вводимая доза составляет примерно от 1 до 10 мг/кг массы тела животного.
Репрезентативные соединения и/или репрезентативный конъюгат или композиции могут быть введены стандартными способами, например вливанием или инъекцией ударной дозы, посредством абсорбции через эпителий или выстилку слизистой оболочки (например, через слизистую полости рта, прямой кишки, тонкой кишки и т.п.). Такое введение может быть системным или местным. Известны различные системы доставки, например инкапсулирование в липосомы, микрочастицы, микрокапсулы, капсулы и т.п., и эти системы могут быть использованы для введения репрезентативного соединения и/или репрезентативного конъюгата или композиции. В некоторых вариантах изобретения пациенту может быть введено более чем одно репрезентативное соединение и/или репрезентативный конъюгат или композиция.
В конкретных вариантах изобретения может оказаться желательным локальное введение одного или нескольких репрезентативных соединений и/или репрезентативных конъюгатов или композиций в участок организма, нуждающийся в лечении. Это может быть достигнуто такими способами, но не ограничивающимися ими, как, например, местное вливание во время хирургической операции; наружное нанесение, например, в виде повязки на рану после хирургической операции; инъекция; введение через катетер; введение посредством суппозитория или введение имплантата, где указанный имплантат состоит из пористого, непористого или гелеобразного материала, включая мембраны, такие как сиаластические мембраны или волокна. В одном из вариантов изобретения введение может быть осуществлено путем прямой инъекции в данную область (или в первичную область) локализации рака, опухоли либо неопластической или пред-неопластической ткани. В другом варианте изобретения введение может быть осуществлено путем прямой инъекции в данную область (или в первичную область) манифестации симптомов аутоиммунного заболевания.
В некоторых вариантах изобретения может оказаться желательным введение одного или нескольких репрезентативных соединений и/или репрезентативных конъюгатов или композиций в центральную нервную систему любым подходящим способом, включая интравентрикулярную и интратекальную инъекцию. Интравентрикулярная инъекция может быть более легко введена через интравентрикулярный катетер, например, присоединенный к резервуару Оммайя.
Может быть также осуществлено пульмональное введение, например, с помощью ингалятора или распылителя, либо путем получения препарата с использованием распыляющего агента, либо путем перфузии во фторуглероде или в синтетическом поверхностно-активном веществе, подходящем для введения в легкие.
В еще одном варианте изобретения репрезентативные соединения и/или репрезентативные конъюгаты или композиции могут быть введены с помощью системы для регулируемой доставки, такой как, но не ограничивающейся ими, насос или различные полимерные материалы. В другом варианте изобретения система для регулируемой доставки может быть помещена в непосредственной близости от мишени, на которую направлены репрезентативные соединения и/или репрезентативные конъюгаты или композиции, например в головной мозг, при этом может потребоваться только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, см. выше, vol.2, p.115-138 (1984)). Могут быть использованы и другие системы для регулируемой доставки, обсуждаемые Langer (Science 249:1527-1533 (1990)).
Термин “носитель” означает разбавитель, адъювант или наполнитель, в сочетании с которыми вводят репрезентативное соединение и/или репрезентативный конъюгат. Такими фармацевтическими носителями могут быть жидкости, такие как вода и масло, включая вазелиновое масло, животное и растительное масло или синтетическое масло, такое как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Носителями могут быть физиологический раствор, аравийская камедь, желатин, крахмальная паста, тальк, кератин, коллоидальный диоксид кремния, мочевина и т.п. Кроме того, могут быть использованы добавки, стабилизирующие агенты, загустители, замасливатели и красители. В одном из вариантов изобретения репрезентативное соединение и/или репрезентативный конъюгат или композиции и фармацевтически приемлемые носители, вводимые пациенту, являются стерильными. При внутривенном введении репрезентативных соединений и/или репрезентативных конъюгатов подходящим носителем является вода. В качестве жидких носителей, а в частности для получения растворов для инъекций, могут быть также использованы физиологические растворы и водные растворы декстрозы и глицерина. Подходящими фармацевтическими носителями также являются наполнители, такие как крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое сепарированное молоко, глицерин, пропиленгликоль, вода, этанол и т.п. Композиции согласно изобретению, если это необходимо, могут также содержать небольшие количества смачивающих или эмульгирующих агентов или рН-забуферивающих агентов.
Композиции согласно изобретению могут быть приготовлены в виде растворов, суспензий, эмульсий, таблеток, драже, гранул, капсул, капсул, содержащих жидкости, порошков, препаратов пролонгированного высвобождения, суппозиториев, эмульсий, аэрозолей, спреев, суспензий или любой другой формы, подходящей для такого применения. Другие примеры подходящих фармацевтических носителей описаны в руководстве E.W. Martin “Remington's Pharmaceutical Sciences”.
В одном из вариантов изобретения репрезентативные соединения и/или репрезентативные конъюгаты приготавливают в соответствии с рутинными процедурами в виде фармацевтической композиции, адаптированной для внутривенного введения животным, а в частности человеку. Обычно носителями или наполнителями для внутривенного введения являются стерильные изотонические водные буферные растворы. Если это необходимо, то такие композиции могут также включать солюбилизирующий агент. Композиции для внутривенного введения могут, но необязательно, содержать местное анестезирующее вещество, такие как лигнокаин, для ослабления боли в месте инъекции. Обычно ингредиенты добавляют либо отдельно, либо в смеси в виде унифицированной лекарственной формы, например в виде сухого лиофилизованного порошка или безводного концентрата в герметично запаянном контейнере, таком как ампула или саше, на котором указано количество активного вещества. Если репрезентативные соединения и/или репрезентативный конъюгат вводят путем инфузии, то они могут быть разлиты, например, во флаконы, содержащие стерильную воду или физиологический раствор фармацевтической чистоты. Если репрезентативные соединения и/или репрезентативный конъюгат вводят путем инъекции, то может быть получена ампула со стерильной водой для инъекций, либо может быть приготовлен физиологический раствор для инъекций так, чтобы указанные ингредиенты могли бы быть смешаны до их введения.
Композиции для пероральной доставки могут быть получены, например, в форме таблеток, пастилок, водных или масляных суспензий, гранул, порошков, эмульсий, капсул, сиропов или эликсиров. Перорально вводимые композиции могут содержать один или несколько необязательных агентов, например подслащивающие вещества, такие как фруктоза, аспартам или сахарин; отдушки, такие как перечная мята, винтергреновое масло, вишневое масло; красители; и консерванты, для придания таким фармацевтическим препаратам приемлемых вкусовых качеств. Кроме того, если композиции имеют форму таблеток или драже, то на них может быть нанесено покрытие для замедления дезинтеграции и абсорбции в желудочно-кишечном тракте и, тем самым, для обеспечения их действия в течение длительного периода времени. Для перорально вводимых соединений также подходящими являются селективно проницаемые мембраны, окружающие осмотически активные стимулирующие соединения. В этих мембранах жидкость из среды, окружающей капсулу, пропитывают стимулирующим соединением, которое набухает и вытесняет агент или композицию через мембранное отверстие. Эти мембраны для доставки могут обеспечивать, в основном, профиль доставки нулевого порядка, в отличие от импульсного профиля препаратов немедленного высвобождения. Для замедления времени доставки может быть использовано такое вещество, как моностеарат глицерина или стеарат глицерина.
Композиции могут быть предназначены для местного применения, и в этом случае может быть использован носитель в виде раствора, эмульсии, мази или гелевой основы. Композиция для чрескожного введения может быть получена в форме чрескожного пластыря или устройства для ионтофореза. Композиции для местного применения могут содержать концентрацию репрезентативного соединения и/или репрезентативного конъюгата, составляющую примерно от 0,05% до 50% мас./об. (массы на единицу объема композиции), а в другом аспекте - от 0,1% до 10% мас./об.
Композиция может быть введена ректально, например в форме суппозиториев, которые расплавляются в прямой кишке и высвобождают репрезентативное соединение и/или репрезентативный конъюгат.
Данная композиции может включать различные материалы, которые модифицируют физическую форму твердого или жидкого унифицированного лекарственного препарата. Так, например, данная композиция может включать материалы, которые образуют оболочку, покрывающую активные ингредиенты. Материалы, которые образуют покрытие, являются обычно инертными и могут быть выбраны, например, из сахара, шеллака и других агентов для энтеросолюбильного покрытия. Альтернативно, активные ингредиенты могут быть заключены в желатиновую капсулу.
Композиции могут состоять из газообразных унифицированных лекарственных форм, например они могут представлять собой аэрозоль. Термин “аэрозоль” используется для обозначения различных систем, от коллоидальных систем до систем, состоящих из герметичных упаковок. Доставка может быть осуществлена с помощью ожиженного или сжатого газа или с помощью подходящей системы насосов, дозирующих высвобождение активных ингредиентов.
Композиции согласно изобретению, независимо от того, присутствуют ли они в твердой, жидкой или газообразной форме, могут включать фармакологический агент, используемый для лечения рака, аутоиммунного заболевания или инфекционного заболевания.
4.8. Терапевтическое применение репрезентативных конъюгатов
Репрезентативные соединения и/или репрезентативные конъюгаты могут быть использованы для лечения рака, аутоиммунного заболевания или инфекционного заболевания у пациента.
4.8.1. Лечение рака
Репрезентативные соединения и/или репрезентативные конъюгаты могут быть использованы для ингибирования размножения опухолевых или раковых клеток, индуцирования апоптоза в опухолевых или раковых клетках или для лечения рака у пациента. Репрезентативные соединения и/или репрезентативные конъюгаты могут быть использованы соответственно в различных способах лечения рака у животных. Конъюгат “лекарственное средство-линкер-лиганд” может быть использован для доставки лекарственного средства или компонента “лекарственное средство” в опухолевую или раковую клетку. Не претендуя на какую-либо конкретную теорию, можно лишь отметить, что В одном из вариантов изобретения лигандный компонент репрезентативного конъюгата связывается или ассоциируется с антигеном раковых клеток или опухолевых клеток, и этот репрезентативный конъюгат может поглощаться опухолевой или раковой клеткой посредством опосредуемого рецептором эндоцитоза. Антиген может быть присоединен к опухолевой или раковой клетке, либо он может представлять собой белок внеклеточного матрикса, ассоциированный с опухолевой клеткой или раковой клеткой. После внедрения в клетку один или несколько специфических пептидных последовательностей в линкерном компоненте гидролитически расщепляется одной или несколькими протеазами опухолевой или раковой клетки, что приводит к высвобождению лекарственного средства или соединения “лекарственное средство-линкер”. Затем высвобождаемое лекарственное средство или соединение “лекарственное средство-линкер” свободно мигрирует в клетку и индуцирует цитотоксическую или цитостатическую активность. В альтернативном варианте изобретения лекарственное средство или компонент “лекарственное средство” отщепляется от репрезентативного конъюгата и попадает во внешнюю среду опухолевой или раковой клетки, а затем лекарственное средство или соединение “лекарственное средство-линкер” проникает в клетку.
В одном из вариантов изобретения лигандный компонент связывается с опухолевой или раковой клеткой.
В другом варианте изобретения лигандный компонент связывается с антигеном опухолевой или раковой клетки, который находится на поверхности этой опухолевой или раковой клетки.
В другом варианте изобретения лигандный компонент связывается с антигеном опухолевой или раковой клетки, который представляет собой белок внеклеточного матрикса, ассоциированный с опухолевой клеткой или с раковой клеткой.
Специфичность лигандного компонента для конкретных опухолевых или раковых клеток может играть важную роль в определении типа опухолевых или раковых клеток, которые лучше всего поддаются эффективному уничтожению. Так, например, репрезентативные конъюгаты, содержащие лиганд BR96, могут быть использованы для лечения антиген-позитивных карцином, включая карциномы легких, молочной железы, яичника и поджелудочной железы. Репрезентативные конъюгаты, содержащие лиганд, типа антитела против CD30 или против CD40, могут быть использованы для лечения гематологических злокачественных заболеваний.
Другими конкретными типами раковых заболеваний, которые могут поддаваться лечению репрезентативными конъюгатами, являются, но не ограничиваются ими, раковые заболевания, указанные в таблице 3.
Таблица 3
Солидные опухоли, включая, но не ограничиваясь ими:
рабдомиосаркома
Рак крови, включая, но не ограничиваясь ими:
Репрезентативные конъюгаты обеспечивают доставку соединений к опухолевым или раковым клеткам, специфичным к конъюгированию, что приводит к снижению общей токсичности этих соединений. Линкерные компоненты стабилизируют репрезентативные конъюгаты в крови, которые, тем не менее, расщепляются опухоль-специфическими протеазами клетки, высвобождая лекарственное средство.
4.8.2. Комплексная терапия рака
Раковые заболевания, включая, но не ограничиваясь ими, опухоли, метастазы или другие заболевания или расстройства, характеризующиеся неконтролируемым ростом клеток, могут быть подвергнуты лечению либо могут предупреждаться путем введения репрезентативного конъюгата и/или репрезентативного соединения.
В других вариантах изобретения описаны способы лечения или профилактики рака, включающие введение пациенту, нуждающемуся в этом, эффективного количества репрезентативного конъюгата и химиотерапевтического средства. В одном из вариантов изобретения таким химиотерапевтическим средством является средство, которое, как было обнаружено, не является эффективным для лечения рака. В другом варианте изобретения таким химиотерапевтическим средством является средство, которое, как было обнаружено, является эффективным для лечения рака. Репрезентативные конъюгаты могут быть введены пациенту, который также подвергался хирургической операции в целях радикального лечения рака.
В одном из вариантов изобретения дополнительным способом лечения рака является лучевая терапия.
В конкретном варианте изобретения репрезентативный конъюгат вводят одновременно с химиотерапевтическим средством или одновременно с проведением лучевой терапии. В другом конкретном варианте изобретения введение химиотерапевтического средства или проведения лучевой терапии осуществляют до или после введения репрезентативных конъюгатов, например в одном из аспектов такое введение осуществляют, по крайней мере, за/через один час, пять часов, 12 часов, один день, одну неделю, один месяц до/после введения репрезентативного конъюгата, а в других аспектах - за/через несколько месяцев (например, за три месяца) до/после введения этого конъюгата.
Химиотерапевтическое средство может быть введено в несколько сеансов. При этом может быть введено одно из химиотерапевтических средств, перечисленных в таблице 4, или их комбинация. Что касается лучевой терапии, то протокол проведения такой лучевой терапии зависит от типа рака, подвергаемого лечению. Примерами такой лучевой терапии являются, но не ограничиваются ими, рентгенотерапия, а в частности для лечения глубоких опухолей может применяться излучение высокой энергии в несколько мегавольт (излучение с энергией более чем 1 МВ), а для лечения рака кожи может применяться электронное излучение и рентгеновское излучение в несколько ортовольт. Может быть также применено гамма-излучение, испускаемое радиоизотопами, такими как радиоактивные изотопы радия, кобальта и других элементов.
Кроме того, способы лечения рака с использованием репрезентативного соединения и/или репрезентативного конъюгата могут служить в качестве альтернативы химиотерапии или лучевой терапии в тех случаях, когда такая химиотерапия или лучевая терапия является или может быть слишком токсичной, например вызывает неприемлемые или непереносимые побочные эффекты у индивидуума, подвергаемого лечению. Животное, нуждающееся в лечении, может быть, но необязательно, подвергнуто другому лечению рака, такому как хирургическая операция, лучевая терапия или химиотерапия, в зависимости от того, какая из этих терапий, как было установлено специалистами, является приемлемой или переносимой.
Репрезентативные соединения и/или репрезентативные конъюгаты могут быть также использованы в in vivo или ex vivo способах лечения, применяемых для лечения некоторых видов рака, включая, но не ограничиваясь ими, лейкозы и лимфомы, где такое лечение включает введение аутологичных трансплантатов стволовых клеток. Такое лечение может быть осуществлено путем проведения многостадийных процедур, в которых аутологичные гемопоэтические стволовые клетки животного собирают и очищают от всех раковых клеток, а затем остаточную популяцию клеток костного мозга животного подвергают обработке путем введения высокой дозы репрезентативного соединения и/или репрезентативного конъюгата с одновременным проведением или без проведения лучевой терапии высокими дозами и трансплантат стволовых клеток снова вводят животному. После восстановления функции костного мозга и выздоровления животного проводят поддерживающую терапию.
4.8.3. Комплексная терапия рака с использованием множества лекарственных средств
Ниже рассматриваются способы лечения рака, включающие введение пациенту, нуждающемуся в этом, эффективного количества репрезентативного конъюгата и другого терапевтического агента, который является противораковым средством. Подходящими противораковыми средствами являются, но не ограничиваются ими, метотрексат, таксол, L-аспарагиназа, меркаптопурин, тиогуанин, гидроксимочевина, цитарабин, циклофосфамид, ифосфамид, нитрозомочевина, цисплатин, карбоплатин, митомицин, дакарбазин, прокарбизин, топотекан, азотные аналоги горчичного газа, цитоксан, этопозид, 5-фторурацил, BCNU, иринотекан, капмтотецины, блеомицин, доксорубицин, идарубицин, даунорубицин, дактиномицин, пликамицин, митоксантрон, аспарагиназа, винбластин, винкристин, винорелбин, паклитаксел и доцетаксел. В одном из аспектов изобретения противораковыми средствами являются, но не ограничиваются ими, лекарственные средства, перечисленные в таблице 4.
ифосфамид
трофосфамид
хлорамбуцил
мелфалан
ломустин (CCNU)
треосульфан
карбоплатин
винбластин
виндезин
винорелбин
доцетаксол
тенипозид
топотекан
9-аминокамптотецин
камптотецин
криснатол
триметрексат
тиазофурин
рибавирин
EICAR
дефероксамин
флоксуридин
доксифлуридин
ратитрексед
арабинозид цитозина
флударабин
тиогуанин
ралоксифен
мегестрол
ацетат лейпролида
бикалутамид
СВ 1093
КН 1060
фталоцианин
фотосенсибилизатор Pc4
деметоксигипокрелин А (2ВА-2-DMHA)
интерферон-γ
фактор некроза опухоли
велкад
ревамид
таламид
дактиномицин
блеомицин В2
пепломицин
доксорубицин (адриамицин)
идарубицин
эпирубицин
пирарубицин
зорубицин
митоксантрон
4.8.4. Лечение аутоиммунных заболеваний
Репрезентативные конъюгаты могут быть использованы для предотвращения или ингибирования размножения клеток, которые индуцируют аутоиммунное заболевание, или для лечения аутоиммунного заболевания. Репрезентативные конъюгаты могут быть использованы соответственно в различных способах лечения аутоиммунного заболевания у пациента. Конъюгаты “лекарственное средство-линкер-лиганд” могут быть использованы для доставки лекарственного средства в клетку-мишень. Не претендуя на какую-либо конкретную теорию, можно лишь отметить, что В одном из вариантов изобретения конъюгат “лекарственное средство-линкер-лиганд” связывается с антигеном на поверхности клетки-мишени, и такой репрезентативный конъюгат может поглощаться клеткой-мишенью посредством опосредуемого рецептором эндоцитоза. После внедрения в клетку одна или несколько специфических пептидных последовательностей в линкерном компоненте ферментативно или гидролитически расщепляется с высвобождением лекарственного средства. Затем высвобождаемое лекарственное средство свободно мигрирует в цитозоль и индуцирует цитотоксическую или цитостатическую активность. В альтернативном варианте изобретения лекарственное средство отщепляется от репрезентативного конъюгата и попадает во внешнюю среду клетки-мишени, после чего оно проникает в клетку.
В одном из вариантов изобретения лигандный компонент связывается с аутоиммунным антигеном. В одном из аспектов изобретения антиген присутствует на поверхности клетки, участвующей в индуцировании аутоиммунного состояния.
В другом варианте изобретения лигандный компонент связывается с аутоиммунным антигеном, присутствующим на поверхности клетки.
В одном из вариантов изобретения лиганд связывается с активированными лимфоцитами, которые ассоциируются с аутоиммунным патологическим состоянием.
В другом варианте изобретения репрезентативные конъюгаты предотвращают или ингибируют размножение клеток, продуцирующих аутоиммунное антитело, ассоциированное с конкретным аутоиммунным заболеванием.
Конкретными типами аутоиммунных заболеваний, которые могут быть подвергнуты лечению репрезентативными конъюгатами, являются но не ограничиваются ими, расстройства, ассоциированные с Th2-лимфоцитами (например, атопический дерматит, атопическая астма, риноконъюнктивит, аллергический ринит, синдром Омена, системный склероз и реакция “трансплантат против хозяина”); расстройства, ассоциированные с Th1-лимфоцитами (например, ревматоидный артрит, рассеянный склероз, псориаз, синдром Сьегрена, тиреоидит Хашимото, болезнь Грейвса, первичный билиарный цирроз, гранулематоз Вегенера и туберкулез); расстройства, ассоциированные с активированными В-лимфоцитами (например, системная красная волчанка, синдром Гудпасчера, ревматоидный артрит и диабет типа I); и расстройства, перечисленные в Таблице 5.
4.8.5. Комплексная терапия аутоиммунных заболеваний с использованием множества лекарственных средств
Ниже рассматриваются способы лечения аутоиммунного заболевания, включающие введение пациенту, нуждающемуся в этом, эффективного количества репрезентативного конъюгата и другого терапевтического агента, который является известным средством для лечения аутоиммунного заболевания. В одном из вариантов изобретения такими средствами против аутоиммунных заболеваний являются, но не ограничиваются ими, средства, перечисленные в таблице 6.
4.8.6. Лечение инфекционных заболеваний
Репрезентативные конъюгаты могут быть использованы для предотвращения или ингибирования размножения клеток, которые индуцируют инфекционное заболевание, или для лечения инфекционного заболевания. Репрезентативные конъюгаты могут быть использованы соответственно в различных способах лечения инфекционного заболевания у пациента. Конъюгаты “лекарственное средство-линкер-лиганд” могут быть использованы для доставки лекарственного средства в клетку-мишень. В одном из вариантов изобретения лигандный компонент связывается с инфицированной клеткой.
В одном из вариантов изобретения указанные конъюгаты предотвращают или ингибируют размножение клеток, индуцирующих конкретное инфекционное заболевание.
Конкретными типами инфекционных заболеваний, которые могут быть подвергнуты лечению репрезентативными конъюгатами, являются, но не ограничиваются ими, заболевания, перечисленные в таблице 7.
Системные грибковые заболевания:
Риккетсиозные заболевания:
Болезни, вызываемые паразитами:
Вирусные заболевания:
4.8.8. Комплексная терапия инфекционных заболеваний с использованием множества лекарственных средств
Ниже рассматриваются способы лечения инфекционного заболевания, включающие введение пациенту, нуждающемуся в этом, эффективного количества репрезентативного конъюгата и другого терапевтического средства, которое является противоинфекционным средством. В одном из вариантов изобретения такими противоинфекционными средствами являются, но не ограничиваются ими, средства, перечисленные в таблице 8.
Аминогликозиды:
Макролиды:
Тетрациклины:
Хинолоны:
Фторхинолоны:
Полипептиды:
Сульфонамиды:
Другие антибактериальные средства:
Противовирусные средства:
Общие противовирусные средства:
Лекарственные средства для лечения ВИЧ-инфекций:
5. Примеры
Пример 1-Получение соединения АВ
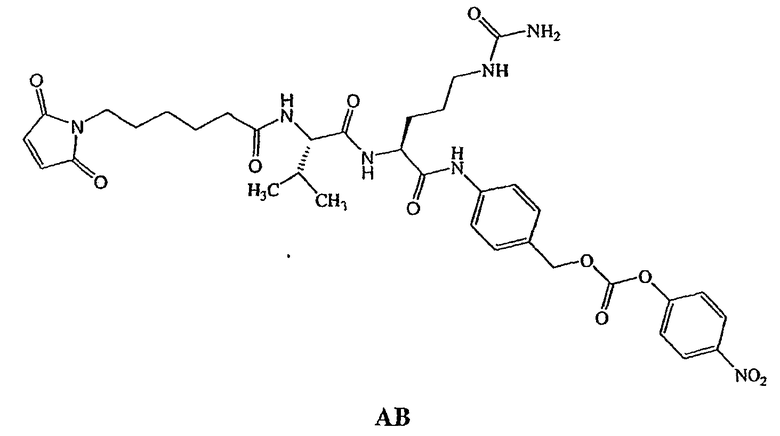
Fmoc-val-cit-РАВ-ОН (14,61 г, 24,3 ммоль, 1,0 экв., патент США № 6214345, Firestone et al.) разбавляли ДМФ (120 мл, 0,2 М) и к этому раствору добавляли диэтиламин (60 мл). Мониторинг реакции проводили с помощью ВЭЖХ, и было обнаружено, что реакция завершалась через 2 часа. Реакционную смесь концентрировали и полученный остаток осаждали этилацетатом (прибл. 100 мл), обрабатывая ультразвуком в течение 10 минут. После этого добавляли эфир (200 мл) и осадок снова обрабатывали ультразвуком в течение 5 минут. Раствор оставляли на 30 минут без перемешивания, а затем фильтровали и сушили в условиях высокого вакуума с получением Val-cit-PAB-OH, который использовали в следующей стадии без дополнительной очистки. Выход: 8,84 г (96%). Конъюгат val-cit-PAB-OH (8,0 г, 21 ммоль) разбавляли ДМФ (110 мл) и полученный раствор обрабатывали МС-OSu (Willner et al. (1993) Bioconjugate Chem. 4:521; 6,5 г, 21 ммоль, 1,0 экв.). Реакция завершалась через 2 часа, на что указывала ВЭЖХ. Реакционную смесь концентрировали и полученное масло осаждали этилацетатом (50 мл). После обработки ультразвуком в течение 15 минут добавляли эфир (400 мл) и смесь снова обрабатывали ультразвуком до полного разрушения всех крупных частиц. После этого раствор фильтровали и твердое вещество сушили с получением не совсем белого твердого промежуточного соединения. Выход: 11,63 г (96%); ES-MS m/z 757,9 [M-H].
Fmoc-val-cit-РАВ-ОН (14,61 г, 24,3 ммоль, 1,0 экв., патент США № 6214345, Firestone et al.) разбавляли ДМФ (120 мл, 0,2 М) и к этому раствору добавляли диэтиламин (60 мл). Мониторинг реакции проводили с помощью ВЭЖХ, и было обнаружено, что реакция завершалась через 2 часа. Реакционную смесь концентрировали и полученный остаток осаждали этилацетатом (прибл. 100 мл), обрабатывая ультразвуком в течение 10 минут. После этого добавляли эфир (200 мл) и осадок снова обрабатывали ультразвуком в течение 5 минут. Раствор оставляли на 30 минут без перемешивания, а затем фильтровали и сушили в условиях высокого вакуума с получением Val-cit-PAB-OH, который использовали в следующей стадии без дополнительной очистки. Выход: 8,84 г (96%). Конъюгат val-cit-PAB-OH (8,0 г, 21 ммоль) разбавляли ДМФ (110 мл) и полученный раствор обрабатывали МС-OSu (Willner et al. (1993) Bioconjugate Chem. 4:521; 6,5 г, 21 ммоль, 1,0 экв.). Реакция завершалась через 2 часа, на что указывала ВЭЖХ. Реакционную смесь концентрировали и полученное масло осаждали этилацетатом (50 мл). После обработки ультразвуком в течение 15 минут добавляли эфир (400 мл) и смесь снова обрабатывали ультразвуком до полного разрушения всех крупных частиц. После этого раствор фильтровали и твердое вещество сушили с получением не совсем белого твердого промежуточного соединения. Выход: 11,63 г (96%); ES-MS m/z 757,9 [M-H].
Не совсем белое твердое промежуточное соединение (8,0 г, 14,0 ммоль) разбавляли ДМФ (120 мл, 0,12 М) и к полученному раствору добавляли бис(4-нитрофенил)карбонат (8,5 г, 28,0 ммоль, 2,0 экв.) и DIEA (3,66 мл, 21,0 ммоль, 1,5 экв.). Реакция завершалась через 1 час, на что указывала ВЭЖХ. Реакционную смесь концентрировали с получением масла, которое осаждали EtOAc, а затем растирали с EtOAc (прибл. 25 мл). Затем растворенное вещество снова осаждали эфиром (прибл. 200 мл) и растирали в течение 15 минут. Твердое вещество фильтровали и сушили в условиях высокого вакуума, в результате чего получали соединение АВ, которое имело чистоту 93%, на что указывала ВЭЖХ, и использовали в следующей стадии без дополнительной очистки. Выход: 9,7 г (94%).
Пример 2-Получение соединения 1
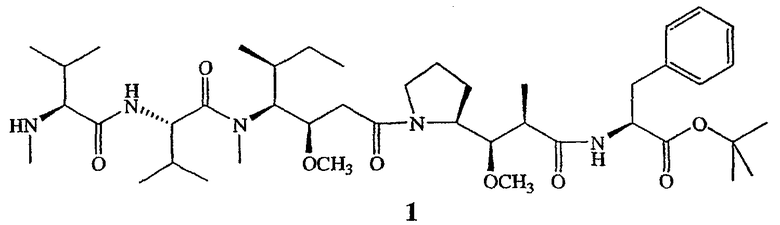
HCl-соль трет-бутилового эфира фенилаланина (868 мг, 3 ммоль), N-Boc-долапроина (668 мг, 1 экв.), DEPC (820 мкл, 1,5 экв.) и DIEA (1,2 мл) разбавляли дихлорметаном (3 мл). После выдерживания в течение 2 часов (ч) при комнатной температуре (примерно 28°С) реакционную смесь разбавляли дихлорметаном (20 мл) и последовательно промывали насыщенным водным (вод.) NaHCO3 (2 × 10 мл) и насыщенным водным NaCl (2 × 10 мл). Органический слой отделяли и концентрировали. Полученный остаток ресуспендировали в этилацетате и очищали флеш-хроматографией в этилацетате. Соответствующие фракции объединяли и концентрировали с получением дипептида в виде белого твердого вещества: 684 мг (64%). ES-MS m/z 491,3 [M+H]+.
Для селективного отщепления Вос в присутствии трет-бутилового эфира вышеуказанный дипептид (500 мг, 1,28 ммоль) разбавляли диоксаном (2 мл). Затем добавляли 4М HCl/диоксан (960 мкл, 3 экв.) и реакционную смесь перемешивали в течение ночи при комнатной температуре. ОФ-ВЭЖХ показала почти полное удаление защитной группы Вос с минимальным уровнем расщепления трет-бутилового эфира. Полученную смесь охлаждали в ледяной бане и добавляли триэтиламин (500 мкл). Через 10 минут смесь вынимали из охлаждающей бани, разбавляли дихлорметаном (20 мл) и последовательно промывали насыщенным водным NaHCO3 (2 × 10 мл) и насыщенным водным NaCl (2 × 10 мл). Органический слой концентрировали и получали желтую пену: 287 мг (57%). Промежуточное соединение использовали без дополнительной очистки.
Трипептид Fmoc-Meval-val-dil-O-t-Bu (полученный, как описано в заявке WO 02/088172, озаглавленной “Pentapeptide Compounds and Uses Related Thereto”; 0,73 ммоль), обрабатывали TFA (3 мл) и дихлорметаном (3 мл) в течение 2 часов при комнатной температуре. Смесь концентрировали досуха, а остаток выпаривали с толуолом (3 × 20 мл) и сушили в вакууме в течение ночи. Остаток разбавляли дихлорметаном (5 мл) и добавляли к дипептиду с удаленными защитными группами (287 мг, 0,73 ммоль), а затем добавляли DIEA (550 мкл, 4 экв.) и DEPC (201 мкл, 1,1 экв.). После выдерживания в течение 2 часов при комнатной температуре реакционную смесь разбавляли этилацетатом (50 мл) и последовательно промывали 10% водной лимонной кислотой (2 × 20 мл), насыщенным водным NaHCO3 (2 × 10 мл) и насыщенным водным NaCl (10 мл). Органический слой отделяли и концентрировали. Полученный остаток ресуспендировали в этилацетате и очищали флеш-хроматографией в этилацетате. Соответствующие фракции объединяли и концентрировали с получением Fmoc-Meval-val-dil-dap-phe-O-t-Bu в виде белого твердого вещества: 533 мг (71%). Rf 0,4 (EtOAc). ES-MS m/z 1010,6 [M+H]+.
Полученный продукт (200 мг, 0,2 ммоль) разбавляли дихлорметаном (3 мл) и диэтиламином (1 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем растворители удаляли и получали масло, которое очищали флеш-хроматографией на силикагеле в ступенчатом градиенте 0-10% МеОН в дихлорметане, в результате чего получали соединение 1 в виде белого твердого вещества: 137 мг (87%). Rf 0,3 (10% МеОН/CH2Cl2). ES-MS m/z 788,6 [M+H]+.
Пример 3-Получение соединения 2
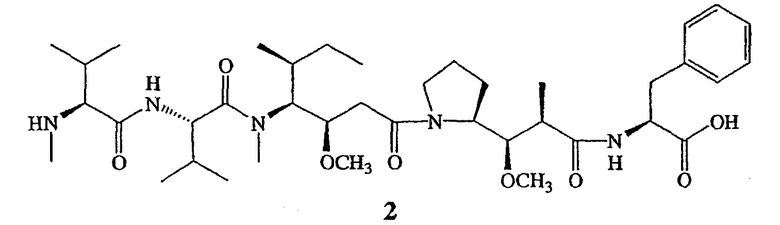
Соединение 2 получали из соединения 1 (30 мг, 0,038 ммоль) путем обработки 4М HCl в диоксане (4 мл) в течение 7 часов при комнатной температуре. Растворитель удаляли и остаток сушили в вакууме в течение ночи с получением соединения 2 в виде гидроскопичного белого твердого вещества: 35 мг (120%, вычислено для HCl-соли). ES-MS m/z 732,56 [M+H]+.
Пример 4-Получение соединения 3
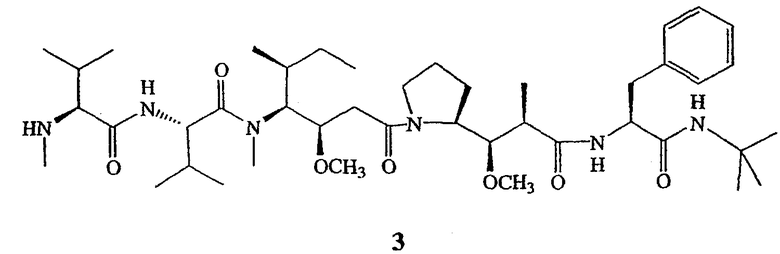
Fmoc-Meval-val-dil-dap-phe-O-t-Bu (пример 2, 50 мг) обрабатывали 4М HCl в диоксане (4 мл) в течение 16 часов при комнатной температуре. Растворитель удаляли и остаток сушили в вакууме в течение ночи с получением 50 мг промежуточного соединения в виде гидроскопичного белого твердого вещества.
Белое твердое промежуточное соединение (20 мг, 0,02 ммоль) разбавляли дихлорметаном (1 мл), добавляли DEPC (5 мкл, 0,03 ммоль, 1,5 экв.), а затем добавляли DIEA (11 мкл, 0,06 ммоль, 3 экв.) и трет-бутиламин (3,2 мкл, 0,03 ммоль, 1,5 экв.). После выдерживания в течение 2 часов при комнатной температуре реакция не была завершена, на что указывала ОФ-ВЭЖХ. Затем снова добавляли DEPC (10 мкл) и трет-бутиламин (5 мкл) и реакционную смесь перемешивали еще 4 ч. Затем реакционную смесь разбавляли дихлорметаном (15 мл) и последовательно промывали водой (5 мл), 0,1М вод. HCl (10 мл) и насыщенным водным NaCl (10 мл). Органический слой отделяли и концентрировали. Полученный остаток разбавляли дихлорметаном и очищали флеш-хроматографией в ступенчатом градиенте 0-5% МеОН в дихлорметане. Соответствующие фракции объединяли и концентрировали с получением Fmoc-защищенного промежуточного соединения в виде белого твердого вещества: 7,3 мг (36%). Rf 0,75 (10% МеОН/CH2Cl2).
Fmoc-защищенное промежуточное соединение разбавляли дихлорметаном (0,5 мл) и обрабатывали диэтиламином (0,5 мл) в течение 3 часов при комнатной температуре. Реакционную смесь концентрировали досуха. Продукт выделяли флеш-хроматографией на силикагеле в ступенчатом градиенте 0-10% МеОН в дихлорметане, в результате чего получали соединение 3 в виде белого твердого вещества: 4 мг (70%). Rf 0,2 (10% МеОН/CH2Cl2). ES-MS m/z 787 [M+H]+, 809 [M+Na]+.
Пример 5-Получение соединения 4
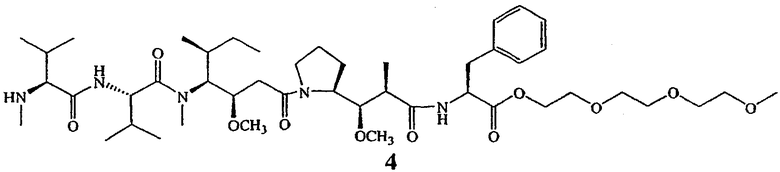
Boc-L-фенилаланин (265 мг, 1 ммоль, 1 экв.) и монометиловый эфир триэтиленгликоля (164 мкл, 1 ммоль, 1 экв.) разбавляли дихлорметаном (5 мл). После этого добавляли DCC (412 мг, 2 ммоль, 2 экв.), а затем DMAP (10 мг). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок отфильтровывали. Растворитель удаляли в вакууме и остаток разбавляли этилацетатом, а затем очищали флеш-хроматографией на силикагеле в этилацетате. Фракции, содержащие нужный продукт, объединяли, концентрировали и сушили в вакууме с получением белого твердого вещества: 377 мг (91%). Rf 0,5 (EtOAc). ES-MS m/z 434 [M+Na]+.
Удаление защитной группы Вос проводили путем обработки вышеуказанного продукта в диоксане (10 мл) смесью 4М HCl/диоксана (6 мл) в течение 6 часов при комнатной температуре. Растворитель удаляли в вакууме и остаток сушили в вакууме с получением белого твердого вещества.
HCl-соль фенилаланина-монометилэтилового эфира триэтиленгликоля (236 мг, 0,458 ммоль, 1 экв.) и N-Boc-долапроин (158 мг, 0,55 ммоль, 1,2 экв.) разбавляли дихлорметаном (3 мл). К смеси добавляли DEPC (125 мкл, 1,5 экв.), а затем DIEA (250 мкл, 3 экв.). После выдерживания в течение 2 часов при комнатной температуре реакционную смесь разбавляли этилацетатом (30 мл) и последовательно промывали насыщенным водным NaHCO3 (2 × 10 мл), 10% водной лимонной кислотой (2 × 10 мл) и насыщенным водным NaCl (10 мл). Органический слой отделяли и концентрировали. Полученный остаток ресуспендировали в этилацетате и очищали флеш-хроматографией на силикагеле в этилацетате. Соответствующие фракции объединяли и концентрировали с получением промежуточного соединения в виде белой пены: 131 мг (50%). Rf 0,25 (EtOAc). ES-MS m/z 581,3 [M+H]+.
Удаление защитной группы Вос проводили в дихлорметане (2 мл) и TFA (0,5 мл) при комнатной температуре в течение 2 ч. Затем растворитель удаляли в вакууме и остаток выпаривали с толуолом (3 × 25 мл), после чего сушили в вакууме с получением 138 мг TFA-соли дипептида.
Fmoc-Meval-val-dil-OH (пример 2, 147 мг, 0,23 ммоль, 1 экв.) и TFA-соль дипептида (138 мг) разбавляли дихлорметаном (2 мл). К смеси добавляли DEPC (63 мкл, 1,5 экв.), а затем DIEA (160 мкл, 4 экв.). После выдерживания в течение 2 часов при комнатной температуре реакционную смесь разбавляли дихлорметаном (30 мл) и последовательно промывали 10%-ной водной лимонной кислотой (2 × 20 мл) и насыщенным водным NaCl (20 мл). Органический слой отделяли и концентрировали. Полученный остаток ресуспендировали в дихлорметане и очищали флеш-хроматографией на силикагеле в ступенчатом градиенте 0-5% МеОН в дихлорметане. Соответствующие фракции объединяли и концентрировали с получением белой пены: 205 мг (81%). Rf 0,4 (10% МеОН/CH2Cl2). ES-MS m/z 1100,6 [M+H]+, 1122,4 [M+Na]+.
Защитную группу Fmoc удаляли путем обработки диэтиламином (2 мл) в дихлорметане (6 мл). После выдерживания в течение 6 часов при комнатной температуре растворитель удаляли в вакууме и полученный продукт выделяли флеш-хроматографией на силикагеле в ступенчатом градиенте 0-10% МеОН в дихлорметане. Соответствующие фракции объединяли и концентрировали. После выпаривания из смеси дихлорметан/гексан, 1:1, получали соединение 4 в виде белой пены: 133 мг (80%). Rf 0,15 (10% МеОН/CH2Cl2). ES-MS m/z 878,6 [M+H]+.
Пример 6-Получение соединения 5
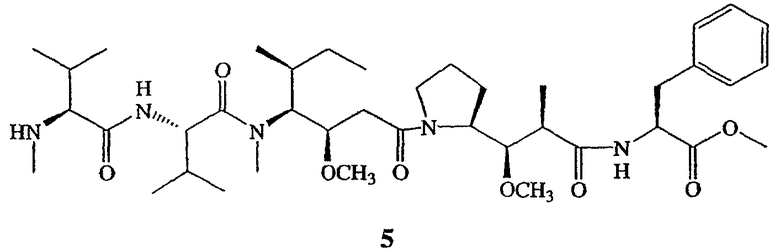
Fmoc-Meval-val-dil-OH (пример 2, 0,50 г, 0,78 ммоль) и dap-phe-OMe-HCl (0,3 г, 0,78 ммоль, полученный, как описано Pettit G.R. et al., Anti-Cancer Drug Design 1998, 13, 243-277) растворяли в CH2Cl2 (10 мл), а затем добавляли диизопропилэтиламин (0,30 мл, 1,71 ммоль, 2,2 экв.). Затем добавляли DEPC (0,20 мл, 1,17, 1,5 экв.) и смесь выдерживали в атмосфере аргона. Реакция завершалась через 1 час, на что указывала ВЭЖХ. Смесь концентрировали с получением масла и очищали хроматографией на SiO2 (на колонке размером 300 × 25 мм), элюируя 100%-ным EtOAc. Продукт выделяли в виде белого пенистого твердого вещества. Выход: 0,65 г (87%). ES-MS m/z 968,35 [M+H]+, 991,34 [M+Na]+; УФ λмакс 215, 265 нм.
Fmoc-защищенный пептид (0,14 г, 0,14 ммоль) в метиленхлориде (5 мл) обрабатывали диэтиламином (2 мл) и смесь выдерживали при комнатной температуре в течение 2 ч. После этого реакция была завершена, на что указывала ВЭЖХ, и реакционную смесь концентрировали с получением масла, растворяли в 2 мл ДМСО и инжектировали в препаративную ВЭЖХ-колонку (колонка С12-RP, 5 мкм, 100А, линейный градиент MeCN в воде (содержащей 0,1% TFA), 40 минут при 10-100%, а затем 20 минут при 100%, при скорости потока 25 мл/мин). Фракции, содержащие продукт, выпаривали и получали соль трифторуксусной кислоты в виде белого порошка. Выход: 0,126 г (98%). Rf 0,28 (100% EtOAc); ES-MS m/z 746,59 [M+H]+, 768,51 [M+Na]+; УФ λмакс 215 нм.
Пример 7-Получение соединения 6
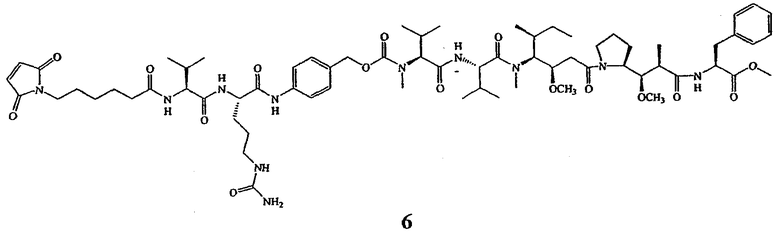
Трифторацетатную соль соединения 5 (0,11 г, 0,13 ммоль), соединение АВ (0,103 г, 0,14 ммоль, 1,1 экв.) и HOBt (3,4 мг, 26 мкмоль, 0,2 экв.) суспендировали в ДМФ/пиридине (2 мл/0,5 мл соответственно). Затем добавляли диизопропилэтиламин (22,5 мкл, 0,13 ммоль, 1,0 экв.) и желтый раствор перемешивали в атмосфере аргона. Через 3 часа добавляли еще 1,0 экв. DIEA. Еще через 24 часа в реакционную смесь добавляли 0,5 экв. активированного линкера. Реакция завершалась через 40 часов. Содержимое сосуда выпаривали, растворяли в ДМСО и инжектировали в препаративную ВЭЖХ-колонку (колонка С12-RP, 5 мкм, 100А, линейный градиент MeCN в воде (содержащей 0,1% TFA), 40 минут при 10-100%, а затем 20 минут при 100%, при скорости потока 50 мл/мин). Нужные фракции выпаривали и получали продукт в виде желтого масла. Затем добавляли метиленхлорид (прибл. 2 мл) и избыток эфира, в результате чего получали соединение 6 в виде белого осадка, который фильтровали и сушили. Выход: 90 мг (52%). ES-MS m/z 1344,32 [M+H]+, 1366,29 [M+Na]+; УФ λмакс 215, 248 нм.
Пример 8-Получение соединения 7
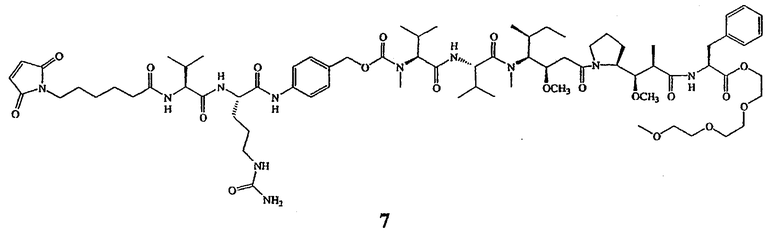
Соединение 4 (133 мг, 0,13 ммоль, 1 экв.), соединение АВ (123 мг, 0,167 ммоль, 1,1 экв.) и HOBt (4 мг, 0,2 экв.) разбавляли ДМФ (1,5 мл). Через 2 минуты добавляли пиридин (5 мл) и проводили мониторинг реакции с помощью ОФ-ВЭЖХ. Было обнаружено, что реакция завершалась через 18 ч. Реакционную смесь разбавляли дихлорметаном (20 мл) и последовательно промывали 10%-ной водной лимонной кислотой (2 × 10 мл), водой (10 мл) и насыщенным водным NaCl (10 мл). Органический слой отделяли и концентрировали. Полученный остаток ресуспендировали в дихлорметане и очищали флеш-хроматографией на силикагеле в ступенчатом градиенте 0-10% МеОН в дихлорметане. Соответствующие фракции объединяли и концентрировали с получением соединения 7 в виде белой пены: 46 мг (21%). Rf 0,15 (10% МеОН/CH2Cl2). ES-MS m/z 1476,94 [M+H]+.
Пример 9-Получение трет-бутилового эфира МС-val-cit-PAB-MMAF 8
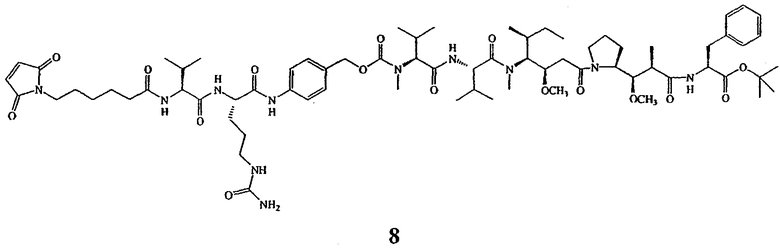
Соединение 1 (83 мг, 0,11 ммоль), соединение АВ (85 мг, 0,12 ммоль, 1,1 экв.) и HOBt (2,8 мг, 21 мкмоль, 0,2 экв.) растворяли в сухом ДМФ (1,5 мл) и пиридине (0,3 мл) в атмосфере аргона. Через 30 часов реакция была, по существу, завершена, на что указывала ВЭЖХ. Затем смесь упаривали, растворяли в минимальном количестве ДМСО и очищали препаративной ВЭЖХ (колонка С12-RP, 5 мкм, 100А, линейный градиент MeCN в воде (содержащей 0,1% TFA), 40 минут при 10-100%, а затем 20 минут при 100%, при скорости потока 25 мл/мин) с получением соединения 8 в виде белого твердого вещества. Выход: 103 мг (71%). ES-MS m/z 1387,06 [M+H]+, 1409,04 [M+Na]+; УФ λмакс 205, 248 нм.
Пример 10-Получение МС-val-cit-PAB-MMAF 9
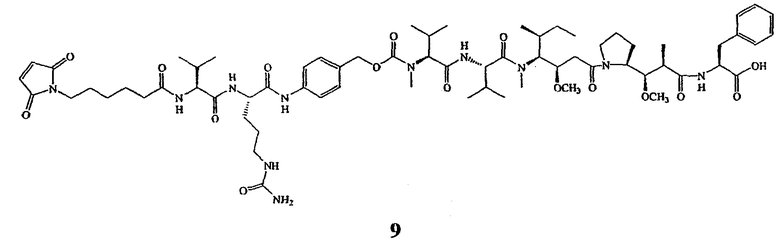
Соединение 8 (45 мг, 32 мкмоль) суспендировали в метиленхлориде (6 мл), а затем добавляли TFA (3 мл). Полученный раствор выдерживали в течение 2 ч. Реакционную смесь концентрировали в вакууме и очищали препаративной ВЭЖХ (колонка С12-RP, 5 мкм, 100А, линейный градиент MeCN в воде (содержащей 0,1% TFA), 40 минут при 10-100%, а затем 20 минут при 100%, при скорости потока 25 мл/мин). Нужные фракции концентрировали и получали малеимидокапроил-валин-цитруллин-п-гидроксиметиламинобензол-MMAF (MC-val-cit-PAB-MMAF) 9 в виде не совсем белого твердого вещества. Выход: 11 мг (25%). ES-MS m/z 1330,29 [M+H]+, 1352,24 [M+Na]+; УФ λмакс 205, 248 нм.
Пример 11-Получение трет-бутиламида МС-val-cit-PAB-MMAF 10
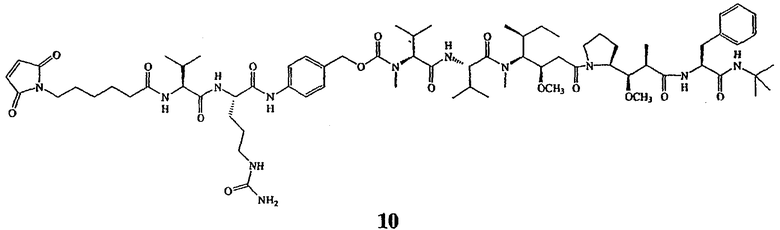
Соединение 3 (217 мг, 0,276 ммоль, 1,0 экв.), соединение АВ (204 мг, 0,276 ммоль, 1,0 экв.) и HOBt (11 мг, 0,0828 ммоль, 0,3 экв.) разбавляли смесью пиридин/ДМФ (6 мл). К этой смеси добавляли DIEA (0,048 мл) и смесь перемешивали в течение примерно 16 часов. Летучие органические вещества выпаривали в вакууме. Неочищенный остаток очищали с помощью Chromatotron® (радиальной тонкослойной хроматографии) со ступенчатым градиентом 0-5-10% метанола в ДХМ с получением трет-бутиламида МС-val-cit-PAB-MMAF 10. Выход: 172 мг (45%). ES-MS m/z 1386,33 [M+H]+, 1408,36 [M+Na]+; УФ λмакс 215, 248 нм.
Пример 12-Получение АС10-МС-ММАЕ путем конъюгирования АС10 с МС-MMAE
АС10, растворенный в 500 мМ бората натрия и 500 мМ хлорида натрия, при рН 8,0, обрабатывали избытком 100 мМ дитиотреитола (DTT). После инкубирования при 37°С в течение 30 минут буфер заменяли путем элюирования на смоле Сефадекс G25 и элюировали PBS с 1 мМ DTPA. Величину тиола/Ab оценивали путем определения концентрации восстановленного антитела при оптической плотности раствора 280 нм, определения концентрации тиола путем проведения реакции с DTNB (Aldrich, Milwaukee, WI) и определения концентрации при оптической плотности 412 нм. Восстановленное антитело, растворенное в PBS, охлаждали на льду.
Реагент “лекарственное средство-линкер”, малеимидокапроил-монометилауристатин Е, т.е. МС-MMAE, растворенный в ДМСО, разбавляли в ацетонитриле и воде при известной концентрации и добавляли к охлажденному восстановленному антителу АС10 в PBS. Примерно через один час для гашения реакции и для “кэпирования” каких-либо непрореагировавших тиоловых групп антитела добавляли избыток малеимида. Реакционную смесь концентрировали путем ультрафильтрации на центрифуге и АС10-МС-MMAE очищали и обессоливали путем элюирования смолой G25 в PBS, затем фильтровали через 0,2 мкм-фильтры в стерильных условиях и замораживали для последующего хранения.
Пример 13-Получение АС10-МС-MMAF путем конъюгирования АС10 с МС-MMAF
АС10-МС-MMAF получали путем конъюгирования АС10 с МС-MMAF в соответствии с процедурой, описанной в примере 12.
Пример 14-Получение АС10-МС-val-cit-PAB-ММАЕ путем конъюгирования АС10 с МС-val-cit-PAB-MMAE
АС10-МС-val-cit-PAB-MMAE получали путем конъюгирования АС10 с МС-val-cit-PAB-MMAE в соответствии с процедурой, описанной в примере 12.
Пример 15-Получение АС10-МС-val-cit-PAB-MMAF путем конъюгирования АС10 с МС-val-cit-PAB-MMAF (9)
АС10-МС-val-cit-PAB-MMAF получали путем конъюгирования АС10 с МС-val-cit-PAB-MMAF (9) в соответствии с процедурой, описанной в примере 12.
Пример 16-Определение цитотоксичности отобранных соединений
Цитотоксическая активность MMAF и соединений 1-5 может быть оценена на Lewis Y-позитивных клеточных линиях OVCAR-3 и на Lewis Y-позитивных клеточных линиях карциномы молочной железы Н3396, карциномы легких L2987 и карциномы толстой кишки LS174t. Для оценки цитотоксичности соединений 1-5 клетки могут быть засеяны при плотности приблизительно 5-10000 на лунку в 150 мкл культуральной среды, а затем в начале анализа они могут быть обработаны соответствующими дозами соединений 1-5 с четырьмя повторениями. Анализы на цитотоксичность обычно проводят в течение 96 часов после добавления тестируемых соединений. По окончании культивирования в последние 4-6 часов инкубирования в каждую лунку может быть добавлено 50 мкл резазуринового красителя для оценки жизнеспособности клеток. Восстановление красителя может быть определено с помощью флуоресцентной спектрометрии при длине волны возбуждения и длине волны излучения 535 нм и 590 нм соответственно. Для проведения анализа степень восстановления резазурина обработанными клетками можно сравнить со степенью восстановления резазурина необработанными контрольными клетками.
В 1-часовых анализах на цитотоксичность анализируемые клетки обрабатывали лекарственным средством в течение 1 часа, а затем промывали; в результате чего цитотоксический эффект может быть определен после инкубирования в течение 96 часов.
Пример 17-Анализ на in vitro цитотоксичность выбранных соединений
В таблице 10 проиллюстрировано цитотоксическое действие сАС10-конъюгатов и соединений 7-10 на CD30+-клеточную линию Karpas 299, проанализированное, как описано в общей процедуре 1. Представлены данные для двух отдельных экспериментов. Было обнаружено, что сАС10-конъюгаты и соединения 7-9 обладают несколько большей активностью, чем конъюгат сАС10-val-cit-ММАЕ.
В других экспериментах конъюгат BR96-val-cit-ММАЕ обладал, по меньшей мере, в 250 раз большей эффективностью, чем свободный MMAF.
Общая процедура I-Определение цитотоксичности. Для оценки цитотоксичности репрезентативных конъюгатов 7-10 клетки были засеяны при плотности приблизительно 5-10000 на лунку в 150 мкл культуральной среды, а затем в начале анализа их обрабатывали соответствующими дозами репрезентативных конъюгатов 7-10 с четырьмя повторениями. Анализы на цитотоксичность проводили в течение 96 часов после добавления тестируемых соединений. По окончании культивирования, в последние 4-6 часов инкубирования, в каждую лунку может быть добавлено 50 мкл резазуринового красителя для оценки жизнеспособности клеток. Восстановление красителя было определено с помощью флуоресцентной спектрометрии при длине волны возбуждения и длине волны излучения 535 нм и 590 нм соответственно. Для проведения анализа степень восстановления резазурина обработанными клетками сравнивали со степенью восстановления резазурина необработанными контрольными клетками.
Пример 18-Анализ на in vitro пролиферацию клеток
Эффективность ADC может быть измерена с помощью анализа на пролиферацию клеток в соответствии с нижеследующим протоколом (Promega Corp. Technical Bulletin TB288; Mendoza et al. (2002) Cancer Res. 62:5485-5488).
1. Аликвоту 100 мкл клеточной культуры, содержащей примерно 104 клеток (SKBR-3, BT474, MCF7 или MDA-MB-468) в среде, осаждали в каждую лунку 96-луночного планшета с непрозрачными стенками.
2. Получали контрольные лунки, содержащие среду и не содержащие клеток.
3. В экспериментальные лунки добавляли ADC и проводили инкубирование в течение 3-5 дней.
4. Планшеты уравновешивали до комнатной температуры в течение примерно 30 минут.
5. В каждую лунку добавляли объем реагента CellTiter-Glo, равный объему клеточной присутствующей культуральной среды.
6. Содержимое лунок смешивали в течение 2 минут на орбитальном шейкере для индуцирования лизиса клеток.
7. Планшет инкубировали при комнатной температуре в течение 10 минут для стабилизации люминесцентного сигнала.
8. Люминесценцию регистрировали и представляли на графиках как RLU=относительные единицы люминесценции.
Пример 19-Выведение конъюгатов и антитела из плазмы крыс
Фармакокинетику выведения конъюгатов “антитело-лекарственное средство” и общего антитела из плазмы исследовали на крысах Sprague-Dawley (Charles River Laboratories, масса тела каждой крысы составляла 250-275 г). Животным вводили бустер-дозу путем инъекции в хвостовую вену (инъекция IV). Приблизительно 300 мкл цельной крови собирали с помощью канюли через яремную вену или путем хвостовой пункции в сосуды с литием/антикоагулянтом гепарином через следующие промежутки времени: 0 (до введения дозы), через 10 и 30 минут; через 1, 2, 4, 8, 24 и 36 часов; и через 2, 3, 4, 7, 14, 21 и 28 дней после введения дозы. Общий титр антитела измеряли с помощью ELISA с использованием ECD/GxhuFc-HRP. Уровень конъюгата “антитело-лекарственное средство” измеряли посредством ELISA с помощью ММАЕ/MMAF/ECD-Bio/SA-HRP.
Пример 20-Выведение конъюгатов и антитела из плазмы обезьян
Фармакокинетика выведения из плазмы конъюгатов “антитело-лекарственное средство” и общего количества антитела может быть исследована на собакоподобных обезьянах. На фиг.12 проиллюстрировано двухстадийное исследование выведения концентраций из плазмы после введения Н-МС-vc-MMAE собакоподобным обезьянам в различных дозах: 0,5; 1,5; 2,5; и 3,0 мг/кг в дни 1 и 21. Концентрации общего антитела и ADC измеряли в зависимости от времени (Н=трастузумаб).
Пример 21-Определение объема опухоли in vivo у трансгенных мышей с эксплантатом
Животные, подходящие для трансгенных экспериментов, могут быть получены из стандартных коммерчески доступных источников, таких как Taconic (Germantown, NY). Для этих экспериментов подходящими являются животные многих видов, но предпочтительными являются самки мышей FVB, поскольку они наиболее чувствительны к образованию опухолей. Самцы FVB могут быть использованы для спаривания, а выведенная популяция вазоэктомизированных мышей CD.1 может быть использована для стимуляции псевдобеременности. Вазоэктомизированные мыши могут быть получены из любого коммерчески доступного источника. Животные-родоначальники могут быть скрещены либо с мышами FVB, либо с мышами 129/BL6 х FVB, гетерозиготными по р53. Мыши, гетерозиготные по аллелю р53, могут быть использованы как потенциальные животные с повышенной способностью к образованию опухолей. Некоторые опухоли F1 происходят от смешанных видов. Опухоли мышей-родоначальников могут быть только типа FVB.
Животные, имеющие опухоли (аллотрансплантат, культивированный у трансгенных mmtv-мышей Fo5), могут быть обработаны одной или несколькими дозами ADC путем внутривенной (i.v.) инъекции. Объем опухоли может быть определен через различные периоды времени после инъекции.
Пример 22-Синтез МС-MMAF через трет-бутиловый эфир
Синтез 1:
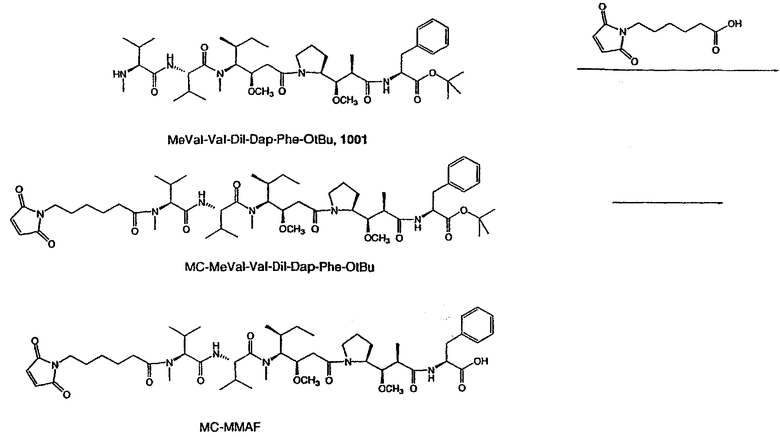
MeVal-Val-Dil-Dap-Phe-OtBu (соединение 1, 128,6 мг, 0,163 ммоль) суспендировали в CH2Cl2 (0,500 мл). После этого добавляли 6-малеимидокапроновую кислоту (68,9 мг, 0,326 ммоль) и 1,3-диизопропилкарбодиимид (0,0505 мл, 0,326 ммоль), а затем пиридин (0,500 мл). Реакционную смесь оставляли на 1 час для перемешивания. ВЭЖХ-анализ указывал на полное израсходование исходного соединения 1. Летучие органические вещества выпаривали при пониженном давлении. Продукт выделяли с помощью колоночной флеш-хроматографии в ступенчатом градиенте 0-5% метанола в CH2Cl2. Всего было получено 96 мг чистого МС-MeVal-Val-Dil-Dap-Phe-OtBu (12) (выход 60%). ES-MS m/z 981,26 [M+H]+; 1003,47 [M+Na]+; 979,65 [M-H]-.
МС-MeVal-Val-Dil-Dap-Phe-OtBu (соединение 12, 74 мг, 0,0754 ммоль) суспендировали в CH2Cl2 (2,0 мл) и TFA (1 мл) при комнатной температуре. Через 2,5 часа ВЭЖХ-анализ указывал на полное израсходование исходного соединения. Летучие органические вещества выпаривали при пониженном давлении и продукт выделяли с помощью препаративной ОФ-ВЭЖХ на колонке Phenomenex C12 Synergi Max-RP 80A (250 × 21,20 мм). Элюент: линейный градиент 10%-90% MeCN/0,05% TFA (вод.) в течение 30 минут, а затем изократная смесь 90% MeCN/0,05% TFA (вод.) в течение еще 20 минут. ES-MS m/z 925,33 [M+H]+; 947,30 [M+Na]+; 923,45 [M-H]-.
Пример 23а-Синтез МС-MMAF (11) через диметоксибензиловый эфир
Синтез 2:
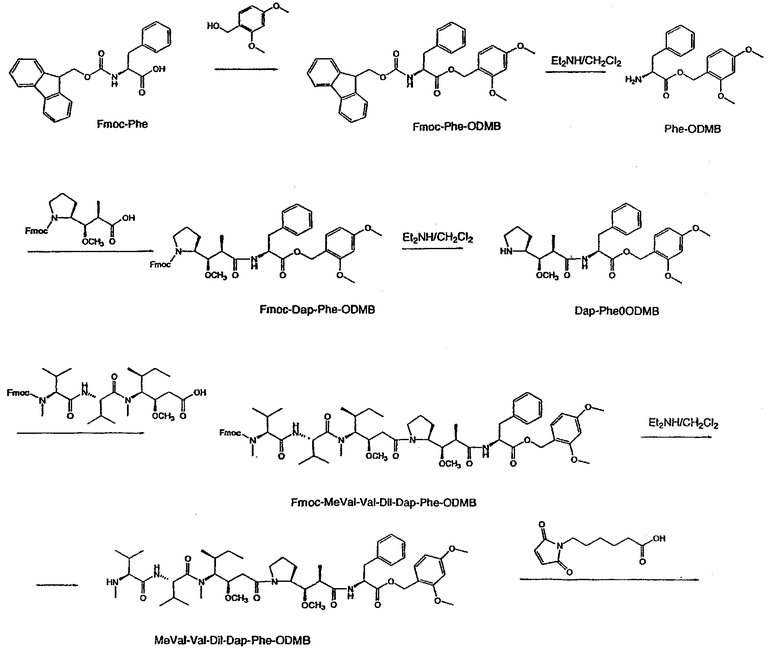
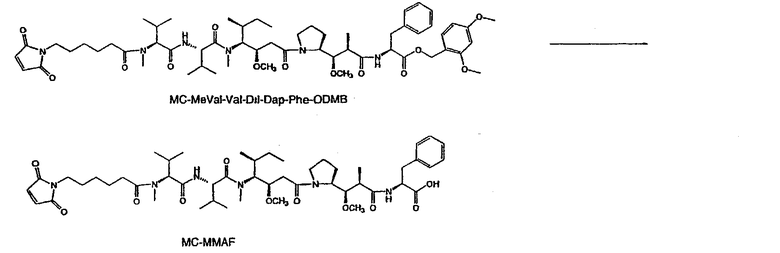
Получение Fmoc-L-фенилаланин-2,4-диметоксибензилового эфира (Fmoc-Phe-ODMB)
В трехгорлую 5-литровую круглодонную колбу загружали Fmoc-L-фенилаланин (200 г, 516 ммоль, Bachem), 2,4-диметоксибензиловый спирт (95,4 г, 567 ммоль, Aldrich) и CH2Cl2 (2,0 л). К полученной суспензии в течение 20 минут в атмосфере N2 добавляли трет-бутилацеталь N,N-диметилформамида (155 мл, 586 ммоль, Fluka), в результате чего образовывался прозрачный раствор. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего ТСХ-анализ (0,42, гептан/EtOAc=2:1) указывал на завершение реакции. Реакционную смесь концентрировали при пониженном давлении и получали светло-желтое масло, которое снова растворяли в CH2Cl2 (200 мл) и очищали на короткой колонке с силикагелем (25 см × 25 см, CH2Cl2) с получением бесцветной пены (250 г). К полученной пене добавляли MeCN (1 л), который полностью растворял данную партию реакционной смеси. Затем смесь концентрировали досуха и снова растворяли в MeCN (1 л) и полученную суспензию перемешивали в течение 1 часа и фильтровали, после чего осадок на фильтре промывали MeCN (2 × 200 мл) и получали Fmoc-L-фенилаланин-2,4-диметоксибензиловый эфир в виде белого твердого вещества (113,58 г, 41%, 95,5% AUC в соответствии с ВЭЖХ-анализом). Данные: ВЭЖХ.
Получение L-фенилаланин-2,4-диметоксибензилового эфира (Phe-ODMB)
В 500-миллилитровую круглодонную колбу загружали Fmoc-L-фенилаланин-2,4-диметоксибензиловый эфир (26,00 г, 48,3 ммоль), CH2Cl2 (150 мл) и диэтиламин (75 мл, Acros). Смесь перемешивали при комнатной температуре и за прохождением реакции следили с помощью ВЭЖХ. Через 4 часа смесь концентрировали (температура бани <30°С). Остаток ресуспендировали в CH2Cl2 (200 мл) и концентрировали. Эту процедуру повторяли еще один раз. К остатку добавляли МеОН (20 мл), что приводило к образованию геля. Этот остаток разбавляли CH2Cl2 (200 мл), концентрировали и мутное масло выдерживали в вакууме в течение ночи. Остаток суспендировали в CH2Cl2 (100 мл), а затем добавляли толуол (120 мл). Смесь концентрировали и остаток выдерживали в вакууме в течение ночи. Данные: ВЭЖХ, 1Н-ЯМР.
Получение Fmoc-долапроина (Fmoc-Dap)
Вос-долапроин (58,8 г, 0,205 моль) суспендировали в 4 н. HCl в 1,4-диоксане (256 мл, 1,02 моль, Aldrich). После перемешивания в течение 1,5 часа ТСХ-анализ указывал на завершение реакции (10% МеОН/CH2Cl2), и смесь концентрировали почти досуха. Затем загружали еще 50 мл 1,4-диоксана и смесь концентрировали досуха и сушили в вакууме в течение ночи. Полученное белое твердое вещество растворяли в H2O (400 мл) и переносили в трехлитровую трехгорлую круглодонную колбу, снабженную механической мешалкой и датчиком температуры. Затем в течение 1 минуты добавляли N,N-диизопропилэтиламин (214,3 мл, 1,23 моль, Acros), что приводило к повышению температуры от 20,5 до 28,2°С (внутренней). Смесь охлаждали в ледяной бане и добавляли 1,4-диоксан (400 мл). После этого через капельную воронку в течение 15 минут добавляли раствор Fmoc-OSu (89,90 г, 0,267 моль, Advanced ChemTech) в 1,4-диоксане (400 мл), поддерживая температуру реакционной смеси ниже 9°С. Смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 19 часов, после чего смесь концентрировали на роторном испарителе с получением водной взвеси (390 г). Эту суспензию разбавляли H2O (750 мл) и Et2O (750 мл), что приводило к обильному выпадению белого осадка. Слои разделяли, выдерживая твердые вещества вместе с органическим слоем. Водный слой подкисляли концентрированной HCl (30 мл) и экстрагировали EtOAc (3 × 500 мл). Объединенные экстракты сушили над MgSO4, фильтровали и концентрировали с получением 59,25 г желтого масла А. Экстракт Et2O один раз экстрагировали насыщенным NaHCO3 (200 мл), выдерживая твердые вещества вместе с водным слоем. Водную суспензию подкисляли концентрированной HCl (50 мл) и экстрагировали Et2O (50 мл), выдерживая твердые вещества вместе с органическим слоем. Органический слой фильтровали и концентрировали с получением 32,33 г желтого масла В. Два вещества в виде масла (А и В) объединяли и очищали с помощью флеш-хроматографии на силикагеле, элюируя CH2Cl2 (3,5 л), а затем 3% МеОН/CH2Cl2 (9 л), в результате чего получали 68,23 г Fmoc-долапроина в виде белой пены (81%, чистота 97,5%, ВЭЖХ (AUC)).
Получение Fmoc-Dap-Phe-ODMB
Неочищенный Phe-ODMB (48,3 ммоль) суспендировали в безводном ДМФ (105 мл, Acros) в течение 5 минут, а затем добавляли Fmoc-Dap (19,80 г, 48,3 ммоль). Смесь охлаждали в ледяной бане и добавляли TBTU (17,08 г, 53,20 ммоль, Matrix Innovations). Затем в течение 3 минут шприцем добавляли N,N-диизопропилэтиламин (25,3 мл, 145,0 ммоль, Acros). Через 1 час ледяную баню удаляли и смесь оставляли на 30 минут для нагревания. Затем смесь выливали в воду (1 л) и экстрагировали этилацетатом (300 мл). После разделения слоев водный слой снова экстрагировали этилацетатом (2 × 150 мл). Объединенные органические слои промывали насыщенным раствором соли (150 мл), сушили (MgSO4) и фильтровали (через фильтровальную бумагу) для удаления нерастворившихся веществ (неорганических веществ и некоторого количества дибензофульвена). После концентрирования остаток (41 г) адсорбировали на двуокиси кремния (41 г) и очищали хроматографией (на колонке 22 см × 8 см; 65% гептан/EtOAc (2,5 л); 33% гептан/EtOAc (3,8 л), в результате чего получали 29,4 г продукта в виде белой пены (86%, чистота 92%, ВЭЖХ).
Данные: ВЭЖХ, 1Н-ЯМР, ТСХ (1:1 EtOAc/гептан, Rf=0,33, ванилиновый красный).
Получение Dap-Phe-ODMB
В 1-литровую круглодонную колбу загружали Fmoc-Dap-Phe-ODMB (27,66 г), CH2Cl2 (122 мл) и диэтиламин (61 мл, Acros). Раствор перемешивали при комнатной температуре и за прохождением реакции следили с помощью ВЭЖХ. Через 7 часов смесь концентрировали (температура бани <30°С). Остаток ресуспендировали в CH2Cl2 (300 мл) и концентрировали. Эту процедуру повторяли два раза. К остатку добавляли МеОН (20 мл) и CH2Cl2 (300 мл) и раствор концентрировали. Остаток суспендировали в CH2Cl2 (100 мл) и толуоле (400 мл), затем концентрировали и остаток выдерживали в вакууме в течение ночи, в результате чего получали кремообразный остаток.
Данные: ВЭЖХ, 1Н-ЯМР, МС.
Получение Fmoc-MeVal-Val-Dil-Dap-Phe-ODMB
Неочищенный Dap-Phe-ODMB (39,1 ммоль) суспендировали в безводном ДМФ (135 мл, Acros) в течение 5 минут, а затем добавляли Fmoc-MeVal-Val-Dil-ОН (24,94 г, 39,1 ммоль, см. получение соединения примера 2). Смесь охлаждали в ледяной бане и добавляли TBTU (13,81 г, 43,0 ммоль, Matrix Innovations). Затем в течение 2 минут шприцем добавляли N,N-диизопропилэтиламин (20,5 мл, 117,3 ммоль, Acros). Через 1 час ледяную баню удаляли и смесь оставляли на 30 минут для нагревания. Затем смесь выливали в воду (1,5 л) и разбавляли этилацетатом (480 мл). После выдерживания в течение 15 минут слои разделяли и водный слой экстрагировали этилацетатом (300 мл). Объединенные органические слои промывали насыщенным раствором соли (200 мл), сушили (MgSO4) и фильтровали (через фильтровальную бумагу) для удаления нерастворившихся веществ (неорганических веществ и некоторого количества дибензофульвена). После концентрирования остаток (49 г) соскабливали со стенок колбы и адсорбировали на двуокиси кремния (49 г), а затем очищали хроматографией (на колонке 15 см × 10 см; 2:1 EtOAc/гептан (3 л); EtOAc (5 л); 250 мл-фракции), в результате чего получали 31,84 г Fmoc-MeVal-Val-Dil-Dap-Phe-ODMB в виде белой пены (73%, чистота 93%, ВЭЖХ (AUC)).
Данные: ВЭЖХ, ТСХ (2:1 EtOAc/гептан, Rf=0,21, ванилиновый красный).
Получение MeVal-Val-Dil-Dap-Phe-ODMB
В 1-литровую круглодонную колбу загружали Fmoc-MeVal-Val-Dil-Dap-Phe-ODMB (28,66 г), CH2Cl2 (80 мл) и диэтиламин (40 мл). Раствор перемешивали при комнатной температуре в течение ночи, а затем концентрировали при пониженном давлении. Остаток адсорбировали на двуокиси кремния (30 г), а затем очищали флеш-хроматографией (на колонке 15 см × 8 см; 2% МеОН/ДХМ (2 л), 3% МеОН/ДХМ (1 л), 6% МеОН/ДХМ (4 л); 250 мл-фракции), в результате чего получали 15,88 г MeVal-Val-Dil-Dap-Phe-ODMB в виде белой пены (69%, чистота 96%, ВЭЖХ (AUC)).
Данные: ВЭЖХ, ТСХ (6% МеОН/ДХМ, Rf=0,24, ванилиновый красный).
Получение МС-MeVal-Val-Dil-Dap-Phe-ODMB
В 50-миллилитровую круглодонную колбу загружали MeVal-Val-Dil-Dap-Phe-ODMB (750 мг, 0,85 ммоль), безводный ДМФ (4 мл), малеимидокапроновую кислоту (180 мг, 0,85 ммоль) и TBTU (300 мг, 0,93 ммоль, Matrix Innovations) при комнатной температуре. Затем шприцем добавляли N,N-диизопропилэтиламин (450 мкл, 2,57 ммоль). Через 1,5 часа смесь выливали в воду (50 мл) и разбавляли этилацетатом (30 мл). Для облегчения разделения добавляли NaCl. После разделения слоев водный слой экстрагировали этилацетатом (25 мл). Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали. Полученное масло (1 г) очищали флеш-хроматографией (100 мл двуокиси кремния; 25% гептан/EtOAc (100 мл), 10% гептан/EtOAc (200 мл), EtOAc (1,5 л)), в результате чего получали МС-MeVal-Val-Dil-Dap-Phe-ODMB (13) в виде белой пены (521 мг, 57%, чистота 94%, ВЭЖХ (AUC)).
Данные: 1Н-ЯМР, ВЭЖХ.
Получение МС-MeVal-Val-Dil-Dap-Phe-OH (MC-MMAF)(11)
В 50-миллилитровую круглодонную колбу загружали МС-MeVal-Val-Dil-Dap-Phe-ODMB (соединение 13, 428 мг, 0,39 ммоль) и растворяли в 2,5% TFA/CH2Cl2 (20 мл). Через 2 минуты раствор приобретал розовато-пурпурный цвет. Мониторинг реакции проводили с помощью ВЭЖХ и ТСХ (6% МеОН/ДХМ, KMnO4-окрашивание). Через 40 минут добавляли три капли воды и мутную розовато-пурпурную смесь концентрировали с получением 521 мг розового остатка. После очистки хроматографией (15% IPA/ДХМ) получали 270 мг МС-MMAF (73%, чистота 92%, ВЭЖХ) в виде белого твердого вещества.
Пример 23b-Синтез аналога mc-MMAF
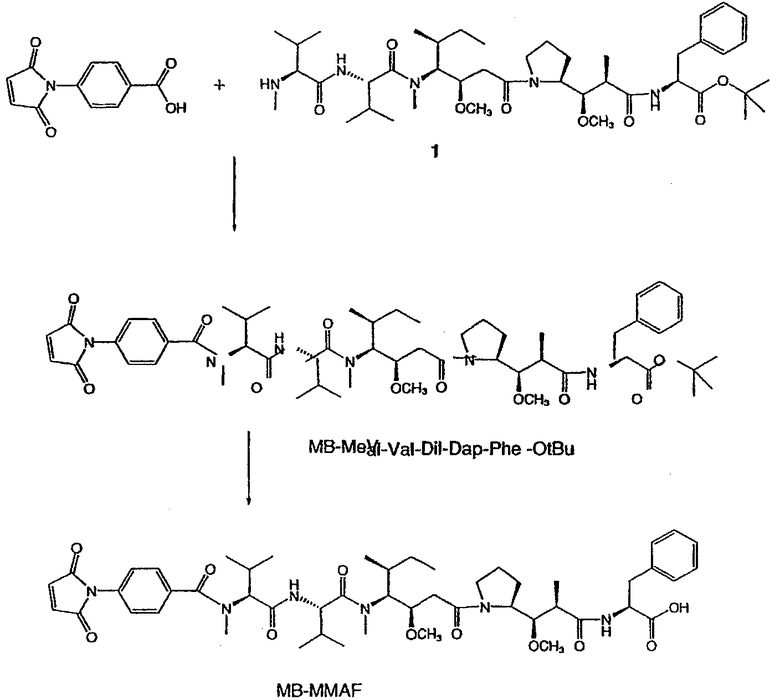
MeVal-Val-Dil-Dap-Phe-OtBu (соединение 1, 35 мг, 0,044 ммоль) суспендировали в ДМФ (0,250 мл). После этого добавляли 4-(2,5-диоксо-2,5-дигидропиррол-1-ил)бензойную кислоту (11 мг, 0,049 ммоль) и HATU (17 мг, 0,044 ммоль), а затем DIEA (0,031 мл, 0,17 ммоль). Эту реакционную смесь оставляли на 2 часа для перемешивания. ВЭЖХ-анализ показал полное израсходование исходного соединения 1.
Продукт выделяли с помощью препаративной ОФ-ВЭЖХ на колонке с Phenomenex C12 Synergi Max-RP 80A (250 × 21,20 мм). Элюент: линейный градиент 10%-80% MeCN/0,05% TFA (вод.) в течение 8 минут, затем изократная смесь 80% MeCN/0,05% TFA (вод.) в течение еще 12 минут. Было выделено всего 20 мг чистого продукта (14) (0,02 ммоль, выход 46%). ES-MS m/z 987,85 [M+H]+; 1019,41 [M+Na]+; 985,54 [M-H]-.
МВ-MeVal-Val-Dil-Dap-Phe-OtBu (соединение 14, 38 мг, 0,0385 ммоль) суспендировали в CH2Cl2 (2,0 мл) и TFA (1 мл). Смесь перемешивали в течение 2 часов, а затем летучие органические вещества выпаривали при пониженном давлении. Продукт очищали с помощью препаративной ОФ-ВЭЖХ на колонке с Phenomenex C12 Synergi Max-RP 80A (250 × 21,20 мм). Элюент: линейный градиент 10%-80% MeCN/0,05% TFA (вод.) в течение 8 минут, а затем изократная смесь 90% MeCN/0,05% TFA (вод.) в течение еще 12 минут. Было выделено всего 14,4 мг МВ-MMAF-продукта (0,015 ммоль, выход 40%). ES-MS m/z 930,96 [M+H]+, 952,98 [M+Na]+; 929,37 [M-H]-.
Пример 23с-Получение МС-MeVal-Cit-PAB-MMAF (16)
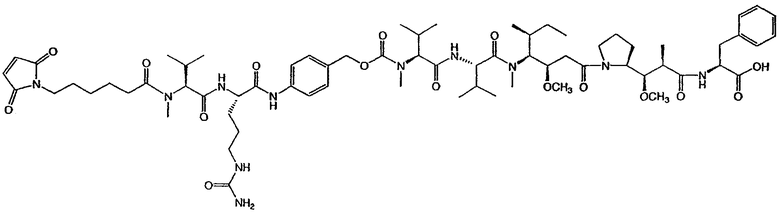
К суспензии Fmoc-MeVal-OH (3,03 г, 8,57 ммоль) и N,N'-дисукцимидилкарбоната (3,29 г, 12,86 ммоль) в CH2Cl2 (80 мл) при комнатной температуре добавляли DIEA (4,48 мл, 25,71 ммоль). Эту реакционную смесь оставляли на 3 часа для перемешивания, а затем выливали в делительную воронку и органическую смесь экстрагировали 0,1М HCl (вод.). Неочищенный органический остаток концентрировали при пониженном давлении и продукт выделяли колоночной флеш-хроматографией на силикагеле с использованием линейного градиента 20-100% этилацетат/гексан. Всего было получено 2,18 г чистого Fmoc-MeVal-OSu (4,80 ммоль, выход 56%).
К суспензии Fmoc-MeVal-OSu (2,18 г, 4,84 ммоль) в DME (13 мл) и ТГФ (6,5 мл) при комнатной температуре добавляли раствор L-цитруллина (0,85 г, 4,84 ммоль) и NaHCO3 (0,41 г, 4,84 ммоль) в H2O (13 мл). Суспензию оставляли на 16 часов при комнатной температуре для перемешивания, а затем экстрагировали смесью трет-BuOH/CHCl3/H2O и подкисляли 1М HCl до рН 2,3. Органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток растирали с диэтиловым эфиром и получали 2,01 г Fmoc-MeVal-Cit-СООН, который был использован без дополнительной очистки.
Неочищенный Fmoc-MeVal-Cit-СООН суспендировали в 2:1 CH2Cl2/МеОН (100 мл) и к этой суспензии добавляли п-аминобензиловый спирт (0,97 г, 7,9 ммоль) и EEDQ (1,95 г, 7,9 ммоль). Эту суспензию оставляли на 125 часов для перемешивания, а затем летучие органические вещества удаляли при пониженном давлении и остаток очищали колоночной флеш-хроматографией на силикагеле с использованием 10% МеОН/CH2Cl2. В результате получали чистый Fmoc-MeVal-Cit-РАВ-ОН (0,55 г, 0,896 ммоль, выход 18,5%), ES-MS m/z 616,48 [M+H]+.
К суспензии Fmoc-MeVal-Cit-РАВ-ОН (0,55 г, 0,896 ммоль) в CH2Cl2 (40 мл) добавляли STRATOSPHERESTM (связанные с пиперазином-смолой) (>5 ммоль/г, 150 мг). После перемешивания при комнатной температуре в течение 16 часов смесь фильтровали через целит (предварительно промытый МеОН) и концентрировали при пониженном давлении. Остаток растирали с диэтиловым эфиром и гексаном. Полученное твердое вещество, MeVal-Cit-РАВ-ОН, суспендировали в CH2Cl2 (20 мл), а затем к суспензии добавляли МС-OSu (0,28 г, 0,896 ммоль), DIEA (0,17 мл, 0,99 ммоль) и ДМФ (15 мл). Эту суспензию перемешивали в течение 16 часов, однако ЖВХД-анализ реакционной смеси указывал на незавершенную реакцию, а поэтому суспензию концентрировали при пониженном давлении до объема 6 мл, а затем добавляли 10% раствор NaHCO3 (водный) и суспензию перемешивали еще 16 часов. Растворитель удаляли при пониженном давлении и остаток очищали колоночной флеш-хроматографией на силикагеле в градиенте 0-10% МеОН/CH2Cl2, в результате чего получали 42 мг (0,072 ммоль, выход 8%) МС-MeVal-Cit-РАВ-ОН.
К суспензии МС-MeVal-Cit-РАВ-ОН (2,37 г, 4,04 ммоль) и бис(нитрофенил)карбоната (2,59 г, 8,52 ммоль) в CH2Cl2 (10 мл) добавляли DIEA (1,06 мл, 6,06 ммоль). Эту суспензию перемешивали в течение 5,5 ч, концентрировали при пониженном давлении и очищали путем растирания с диэтиловым эфиром. МС-MeVal-Cit-PAB-OCO-pNP (147 мг, 0,196 ммоль) суспендировали в растворе пиридина/ДМФ (1:5) (3 мл) и к суспензии добавляли HOBt (5 мг, 0,039 ммоль), DIEA (0,17 мл, 0,978 ммоль) и MMAF (соединение 2, 150 мг, 0,205 ммоль). Эту реакционную смесь перемешивали в течение 16 часов при комнатной температуре, а затем очищали препаративной ОФ-ВЭЖХ (× 3) на колонке с Phenomenex C12 Synergi Max-RP 80A (250 × 21,20 мм). Элюент: линейный градиент 10%-90% MeCN/0,05% TFA (вод.) в течение 30 минут, затем изократная смесь 90% MeCN/0,05% TFA (вод.) в течение еще 20 минут. МС-MeVal-Cit-PAB-MMAF (16) получали в виде желтоватого твердого вещества (24,5 мг, 0,0182, выход 0,45%). ES-MS m/z 1344,95 [M+H]+; 1366,94 [M+Na]+.
Пример 23d-Получение сукцинимидоэфира суберил-Val-Cit-PAB-MMAF (17)
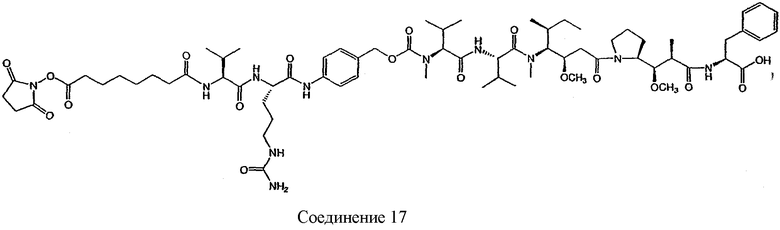
Соединение I (300 мг, 0,38 ммоль), Fmoc-Val-Cit-PAB-pNP (436 мг, 0,57 ммоль, 1,5 экв.) суспендировали в безводном пиридине, а затем добавляли 5 мл HOBt (10 мг, 0,076 ммоль, 0,2 экв.) и DIEA (199 мкл, 1,14 ммоль, 3 экв.). Реакционную смесь обрабатывали ультразвуком в течение 10 минут, а затем перемешивали при комнатной температуре в течение ночи. Пиридин удаляли при пониженном давлении и остаток ресуспендировали в CH2Cl2. Смесь разделяли флеш-хроматографией на силикагеле в ступенчатом градиенте МеОН, от 0 до 10%, в CH2Cl2. Фракции, содержащие продукт, объединяли, концентрировали, сушили в вакууме в течение ночи и получали 317 мг (выход 59%) Fmoc-Val-Cit-PAB-MMAF-OtBu. ES-MS m/z 1415,8 [M+H]+.
Fmoc-Val-Cit-PAB-MMAF-OtBu (100 мг) перемешивали в 20% TFA/CH2Cl2 (10 мл) в течение 2 часов. Смесь разбавляли CH2Cl2 (50 мл). Органический слой последовательно промывали водой (2 × 30 мл) и насыщенным раствором соли (1 × 30 мл). Органическую фазу концентрировали и загружали на слой силикагеля в 10% МеОН/CH2Cl2. Продукт элюировали 30% МеОН/CH2Cl2. После сушки в вакууме в течение ночи получали Fmoc-Val-Cit-PAB-MMAF в виде белого твердого вещества, 38 мг, выход 40%. ES-MS m/z 1357,7 [M-H]-.
Fmoc-Val-Cit-PAB-MMAF, 67 мг, суспендировали в CH2Cl2 (2 мл), диэтиламине (2 мл) и ДМФ (2 мл). Смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток выпаривали вместе с пиридином (2 мл), а затем с толуолом (2 × 5 мл) и сушили в вакууме. Val-Cit-PAB-MMAF получали в виде коричневатого масла и использовали без дополнительной очистки.
Весь Val-Cit-PAB-MMAF, полученный из 67 мг Fmoc-Val-Cit-PAB-MMAF, суспендировали в пиридине (2 мл) и добавляли к раствору дисукцинимидилсуберата (74 мг, 0,2 ммоль, 4 экв.) в пиридине (1 мл). Реакционную смесь перемешивали при комнатной температуре. Через 3 часа добавляли эфир (20 мл). Осадок собирали и промывали дополнительным количеством эфира. Красноватое твердое вещество суспендировали в 30% МеОН/CH2Cl2 и фильтровали через слой силикагеля с использованием в качестве элюента 30% МеОН/CH2Cl2. Соединение 17 получали в виде белого твердого вещества (20 мг, выход 29%). ES-MS m/z 1388,5 [M-H]-.
Пример 24-In vivo эффективность mcMMAF-конъюгатов “антитело-лекарственное средство”
Эффективность сАС10-mcMMAF в ALCL-ксенотрансплантатах Karpas-299. Для оценки in vivo эффективности конъюгата сАС10-mcMMAF, содержащего, в среднем, 4 молекулы лекарственного средства на антитело (сАС10-mcF4), человеческие ALCL-клетки Karpas-299 подкожно имплантировали иммунодефицитным мышам С.В-17 SCID (5 × 106 клеток на мышь). Объем опухоли вычисляли по формуле (0,5 × L × W2), где из двух двунаправленных измерений один из L и W является более длинным, а другой более коротким. Когда средний объем опухоли исследуемых животных достигал приблизительно 100 мм3 (в пределах от 48 до 162), мышей разделяли на 3 группы (5 мышей на группу), а этих мышей либо не подвергали обработке, либо им в хвостовую вену делали одну внутривенную инъекцию 1 мг/кг или 2 мг/кг сАС10-mcF4 (фиг.1). Опухоли у необработанных мышей росли быстро, и через 7 дней после начала проведения эксперимента их средний объем достигал >1000 мм3. В противоположность этому у всех сАС10-mcF4-обработанных мышей наблюдалось быстрое уменьшение размера опухоли, причем у 3 из 5 мышей группы, получавших дозу 1 мг/кг, и у 5 из 5 мышей группы, получавших дозу 2 мг/кг, наблюдался полный противоопухолевый ответ. У одной из мышей с абсолютной отвечаемостью в группе, получавшей дозу 2 мг/кг, все же наблюдался рецидив опухоли примерно через 4 недели после начала терапии, однако у остальных мышей этой группы, т.е. у 4 из 5 мышей, не обнаруживалось каких-либо детектируемых опухолей, а у 3 мышей с абсолютной отвечаемостью в группе, получавшей дозу 1 мг/кг, опухолей не наблюдалось через 10 недель после начала терапии.
Эффективность cBR96-mcMMAF в NSCLC-ксенотрансплантатах L2987. cBR96 представляет собой химерное антитело, которое распознает антиген LeY. Для оценки in vivo эффективности конъюгата cBR96-mcMMAF, содержащего 4 молекулы лекарственного средства на антитело (cBR96-mcF4), бестимусным (“голым”) мышам имплантировали фрагменты опухоли не-мелкоклеточного рака легких (NSCLC) L2987. Когда средний объем опухоли достигал приблизительно 100 мм3, мышей разделяли на 3 группы: одну группу, которую не подвергали обработке, и 2 группы обработки. Для проведения терапии, как показано на фиг.3а, мышам, через каждые 4 дня, вводили cBR96-mcF4, в дозе 3 мг/кг или 10 мг/кг/инъекцию, всего 4 инъекции (q4d×4). Как показано на фиг.3b, мышам, через каждые 4 дня, вводили cBR96-mF4 или несвязывающийся контрольный конъюгат сАС10-mcF4 в дозе 10 мг/кг/инъекцию, всего 4 инъекции (q4d×4). Как показано на фиг.3а и 3b, BR96-mcF4 обеспечивал заметное замедление роста опухоли по сравнению с контролем.
На фиг.2 проиллюстрирован in vivo анализ на эффективность одной дозы сАС10-mcMMAF в подкожном L540CY. Эти исследования проводили на 4 мышах необработанной группы и 10 мышах в каждой из групп обработки.
Пример 25-In vitro эффективность МС-MMAF-конъюгатов “антитело-лекарственное средство”
Активность конъюгатов “сАС10-антитело-лекарственное средство” против CD30 + -клеточных линий. На фиг.4а и 16b представлены кривые “доза-ответ”, построенные по данным репрезентативного эксперимента, в котором культуры клеток Karpas-299 (анапластической крупноклеточной лимфомы) и L428 (ходжкинской лимфомы) инкубировали с серийно разведенным сАС10-mcMMAF (фиг.4а) или сАС10-vcMMAF (фиг.4b) в течение 96 часов. Культуры метили 50 мкМ резазурина [10-оксида 7-гидрокси-3Н-феноксазин-3-она] в течение 4 часов и измеряли интенсивность флуоресценции. Эти данные преобразовывали с помощью программы GraphPad Prism version 4.00 в соответствии с процедурой построения 4-параметрической кривой доза-ответ. Величины IC50 определяли как концентрацию, при которой рост клеток снижался на 50% по сравнению с необработанной контрольной культурой. Каждую концентрацию тестировали с четырьмя повторениями.
Активность конъюгатов “cBR96-антитело-лекарственное средство” против LeY+ -клеточных линий. На фиг.5а и 5b представлены кривые “доза-ответ”, построенные по данным репрезентативного эксперимента, в котором культуры клеток Н3396 (карциномы молочной железы) и L2987 (не-мелкоклеточной карциномы легких) инкубировали с серийно разведенным cBR96-mcMMAF (фиг.5а) или cBR96-vcMMAF (фиг.5b) в течение 96 часов. Культуры метили 50 мкМ резазурина в течение 4 часов и измеряли интенсивность флуоресценции. Эти данные преобразовывали с помощью программы GraphPad Prism version 4.00 в соответствии с процедурой построения 4-параметрической кривой доза-ответ. Величины IC50 определяли как концентрацию, при которой рост клеток снижался на 50% по сравнению с необработанной контрольной культурой. Каждую концентрацию тестировали с четырьмя повторениями.
Активность конъюгатов “антитело c1F6-лекарственное средство” против CD70 + -клеточных линий карциномы почек. На фиг.6а и 6b представлены крывые “доза-ответ”, построенные по данным репрезентативного эксперимента, в котором культуры клеток Caki-1 и 786-О инкубировали с серийно разведенным c1F6-mcMMAF (фиг.6а) или c1F6-vcMMAF (фиг.6b) в течение 96 часов. Культуры метили 50 мкМ резазурина в течение 4 часов и измеряли интенсивность флуоресценции. Эти данные преобразовывали с помощью программы GraphPad Prism version 4.00 в соответствии с процедурой построения 4-параметрической кривой доза-ответ. Величины IC50 определяли как концентрацию, при которой рост клеток снижался на 50% по сравнению с необработанной контрольной культурой. Каждую концентрацию тестировали с четырьмя повторениями.
Пример 26-Очистка трастузумаба
Содержимое одного сосуда, составляющее 440 мг антитела герцептин® (huMAb4D5-8, rhuMAb HER2, патент США № 5821337), растворяли в 50 мл буфера MES (25 мМ MES, 50 мМ NaCl, рН 5,6) и загружали на катионообменную колонку (сефароза S, 15 см × 1,7 см), которую затем уравновешивали в том же самом буфере. Затем колонку промывали тем же самым буфером (5 колоночными объемами). Трастузумаб элюировали путем доведения концентрации NaCl буфера до 200 мМ. Фракции, содержащие антитело, объединяли, разбавляли до 10 мг/мл и диализовали в буфер, содержащий 50 мМ фосфата калия, 500 мМ NaCl, 2 мМ EDTA, рН 6,5.
Пример 27-Получение конъюгата трастузумаб-МС-ММАЕ путем конъюгирования трастузумаба с МС-ММАЕ
Трастузумаб, растворенный в 500 мМ бората натрия и 500 мМ хлорида натрия при рН 8,0, обрабатывали избытком 100 мМ дитиотреитола (ДТТ). После инкубирования при 37ºС в течение 30 минут буфер заменяли путем элюирования на смоле Сефадекс G25, а затем элюировали PBS с 1 мМ DTPA. Величину тиола/Ab оценивали путем определения концентрации восстановленного антитела при оптической плотности раствора 280 нм и концентрации тиола путем проведения реакции с DTNB (Aldrich, Milwaukee, WI) и определения концентрации при оптической плотности 412 нм. Восстановленное антитело, растворенное в PBS, охлаждали на льду.
Реагент “лекарственное средство-линкер”, малеимидокапроил-монометилауристатин Е (ММАЕ), т.е. МС-MMAE, растворенный в ДМСО, разбавляли в ацетонитриле и в воде при известной концентрации и добавляли к охлажденному восстановленному антителу трастузумабу в PBS. Примерно через один час для гашения реакции и для “кэпирования” каких-либо непрореагировавших тиоловых групп антитела добавляли избыток малеимида. Реакционную смесь концентрировали путем ультрафильтрации на центрифуге и трастузумаб-МС-MMAE очищали и обессоливали путем элюирования смолой G25 в PBS, а затем фильтровали через 0,2 мкм-фильтры в стерильных условиях и замораживали для последующего хранения.
Пример 28-Получение конъюгата трастузумаб-МС-MMAF путем конъюгирования трастузумаба с МС-MMAF
Конъюгат трастузумаб-МС-MMAF получали путем конъюгирования трастузумаба с МС-MMAF в соответствии с процедурой примера 27.
Пример 29-Получение конъюгата трастузумаб-МС-val-cit-РАВ-ММАЕ путем конъюгирования трастузумаба с МС-val-cit-РАВ-ММАЕ
Конъюгат трастузумаб-МС-val-cit-РАВ-ММАЕ получали путем конъюгирования трастузумаба с МС-val-cit-РАВ-ММАЕ в соответствии с процедурой примера 27.
Пример 30-Получение конъюгата трастузумаб-МС-val-cit-РАВ-MMAF путем конъюгирования трастузумаба с МС-val-cit-РАВ-MMAF9
Конъюгат трастузумаб-МС-val-cit-РАВ-MMAF получали путем конъюгирования трастузумаба с МС-val-cit-РАВ-MMAF9 в соответствии с процедурой примера 27.
Пример 31-Токсичность для крыс
Профиль острой токсичности свободных лекарственных средств и ADC оценивали у молодых крыс Sprague-Dawley (весом 75-125 граммов каждая, Charles River Laboratories (Hollister, CA). Животным вводили инъекции на день 1, а затем на день 0, день 3 и день 5 проводили полный химический и гематологический анализы, а на 5-й день проводили полную аутопсию. У всех животных измеряли уровни ферментов в печени, а для трех произвольно взятых животных каждой группы проводили рутинный гистологический анализ следующих тканей: грудной клетки, печени, почек, тимуса, селезенки, толстой и тонкой кишки. Экспериментальными группами были следующие группы:
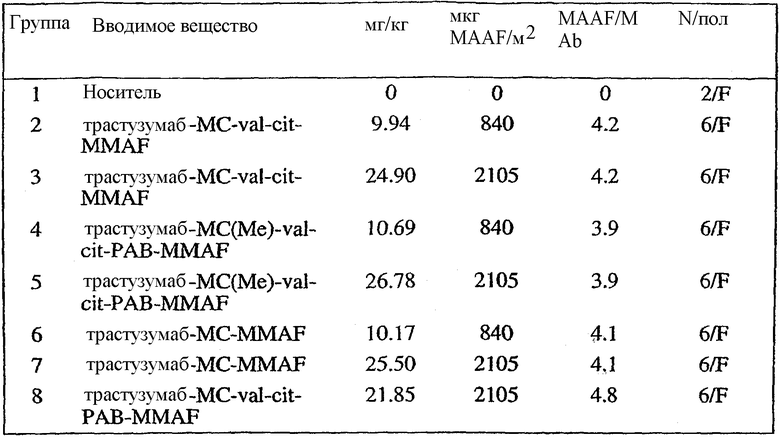
Для конъюгатов трастузумаб-МС-val-cit-MMAF, трастузумаб-МС(Ме)-val-cit-РАВ-MMAF, трастузумаб-МС-MMAF и трастузумаб-МС-val-cit-РАВ-MMAF величину мкг MMAF/м2 вычисляли с использованием массы (Mw) MMAF, равной 731,5, и массы (Mw) герцептина, равной 145167.
Площадь поверхности тела вычисляли по следующей формуле: [{(масса тела в граммах в степени 0,667) × 11,8}/10000] (Guidance for Industry and Reviewers, 2002).
Дозы раствора вводили внутривенно в хвостовую вену в виде одной ударной дозы на 1-й день исследования в дозе 10 мл/кг. Перед введением дозы на 1-й день исследования и ежедневно после ее введения измеряли массу тела животных. Цельную кровь собирали в EDTA-содержащие пробирки для гематологического анализа. Цельную кровь собирали в пробирки-сепараторы сыворотки для клинических биохимических анализов. Пробы крови брали перед введением дозы на день исследования -4, день 3 и день 5. При аутопсии цельную кровь также собирали в пробирки, содержащие натрий-гепарин, и плазму замораживали при -70°С для возможного дальнейшего анализа. При аутопсии брали и помещали в нейтрально забуференный формалин ткани следующих органов: печени, почек, сердца, тимуса, селезенки, головного мозга, грудной клетки и срезов желудочно-кишечного тракта, включая желудок и толстый и тонкий кишечник. Также проводили исследование грудной клетки, тонкого кишечника, толстого кишечника, печени, тимуса, селезенки и почек.
Уровни ферментов сыворотки печени в каждый период времени составляли в пределах, сравнимых с их уровнями у нормальных самок крыс Sprague-Dawley (5- и 95-процентили). Число лейкоцитов и тромбоцитов в каждый период времени составляло в пределах, сравнимых с их числом у нормальных самок крыс Sprague-Dawley (5- и 95-процентили).
Исследования высоких доз проводили на нормальных самках крыс Sprague-Dawley для следующих групп:
У 11 животных проводили рутинный гистологический анализ тканей. Эти животные участвовали в стадии исследований на пределы острой дозозависимой токсичности иммуноконъюгата трастузумаб-МС-MMAF. Животных наблюдали в течение 12 дней после введения дозы.
Пример 32-Токсичность/безопасность для собакоподобных обезьян
Три группы из четырех собакоподобных обезьян Macaca fascicularic (2 самцов и 2 самок), ранее не участвоваших в экспериментах, исследовали на действие конъюгатов трастузумаб-МС-vc-РАВ-ММАЕ и трастузумаб-МС-vc-РАВ-MMAF. Внутривенное введение проводили на 1-й и 22-й день исследований.
1М/1F
День 22
2М/2F
1100 мкг/м2 (3,0 мг/кг) на день 22
2М/2F
550 мкг/м2 (1,5 мг/кг) на день 29
2М/2F
880 мкг/м2 (2,5 мг/кг) на день 36
1М/1F
День 22
2М/2F
1100 мкг/м2 (3,0 мг/кг) на день 22
2М/2F
550 мкг/м2 (1,5 мг/кг) на день 22
2М/2F
880 мкг/м2 (2,5 мг/кг) на день 22
Н=трастузумаб
Дозу выражали как площадь поверхности тела животного, для того чтобы она соответствовала дозам, вводимым животным другого вида, поскольку доза, выраженная в мкг/м2, не зависит от вида животного, а поэтому дозы для разных животных могут сравниваться. Препараты ADC содержали PBS, 5,4 мМ фосфата натрия, 4,2 мМ фосфата калия, 140 мМ хлорида натрия, рН 6,5.
Для гематологического анализа кровь брали через 5 минут, 6 часов, 10 часов и через 1, 3, 5, 7, 14 и 21 день после введения каждой дозы. Число эритроцитов (RBC) и тромбоцитов (PLT) измеряли методом рассеяния света. Число лейкоцитов (WBC) измеряли методом с использованием пероксидазы/базофилов. Число ретикулоцитов измеряли методом рассеяния света с использованием катионного красителя. Число клеток измеряли на аппарате Advia 120. Уровень ALT (аланинаминотрансферазы) и AST (аспартатаминотрансферазы) измеряли в ед./л с использованием УФ/NADH, методики, разработанной Международной Федерацией по клинической химии (IFCC) и осуществляемой на аппарате Olympus AU400, а общий титр антитела измеряли с помощью ELISA с использованием ECD/GxhuFc-HRP. Уровень Ab-конъюгата измеряли с помощью тестов ELISA-ММАЕ/MMAF/ECD-Bio/SA-HRP.
Пример 33-Продуцирование, характеризация и гуманизация моноклонального антитела 4D5 против ErbB2
Мышиное моноклональное антитело 4D5, которое специфически связывается с внеклеточным доменом ErbB2, продуцировали, как описано у Fendly et al. (1990) Cancer Research 50:1550-1558. Вкратце, клетки NIH-3Т3/HER2-3400 (экспрессирующие приблизительно 1 × 105 молекул ErbB2/клетку), продуцированные, как описано у Hudziak et al. Proc. Natl. Acad. Sci. (USA) 84:7159-7163 (1987)), собирали с помощью забуференного фосфатом физиологического раствора (PBS), содержащего 25 мМ EDTA, и использовали для иммунизации мышей BALB/c. Этим мышам i.p. вводили инъекции 107 клеток в 0,5 мл PBS на 0-, 2-, 5- и 7-ю неделю. Мышам с антисывороткой, которая содержала в качестве иммунопреципитата 32Р-меченный ErbB2, на 9-ю и 13-ю недели вводили i.p. инъекции мембранного экстракта ErbB2, очищенного с использованием агглютинина пшеничного зародыша (WGA)- сефарозы. А затем вводили i.v. инъекцию 0,1 мл препарата ErbB2 и спленоциты подвергали слиянию с мышиной миеломной линией Х63-Аg8.653. Супернатанты гибридомы скринировали на связывание с ErbB2 с помощью ELISA и радиоиммунопреципитации.
Картирование и характеризация эпитопов
Эпитоп ErbB2, связанный с моноклональным антителом 4D5, характеризовали с помощью анализа на конкурентное связывание (Fendly et al., Cancer Research 50:1550-1558 (1990)). Исследование перекрестного блокирования проводили путем прямого измерения флуоресценции на интактных клетках с использованием скринирующего устройства PANDEXTM для количественной оценки флуоресценции. Моноклональное антитело конъюгировали с флуоресцеинизотиоционатом (ФИТЦ) в соответствии с хорошо известными процедурами (Wofsy et al. Selected Methods in Cellular Immunology, p.287, Mishel & Schiigi (eds.) San Francisco: W.J. Freeman Co. (1980)). Конфлюентные монослои клеток NIH-3Т3/HER2-3400 трипсинизировали, один раз промывали и ресуспендировали при 1,75 × 106 клеток/мл в холодном PBS, содержащем 0,5% альбумин бычьей сыворотки (BSA) и 0,1% NaN3. Во избежание засорения мембран планшетов PANDEXTM добавляли конечную концентрацию 1% латексных частиц (IDC, Portland, OR). В лунки планшета PANDEXTM добавляли клетки в суспензии, 20 мкл, и 20 мкл очищенных моноклональных антител (100 мкг/мл-0,1 мкг/мл) и смесь инкубировали на льду в течение 30 минут. В каждую лунку добавляли предварительно определенное разведение ФИТЦ-меченного моноклонального антитела в 20 мкл, инкубировали в течение 30 минут, промывали и интенсивность флуоресценции количественно определяли на PANDEXTM. Считалось, что моноклональные антитела имеют общий эпитоп, если каждое антитело блокирует связывание другого антитела на 50% или более по сравнению с нерелевантным контрольным моноклональным антителом. В этом эксперименте моноклональному антителу 4D5 приписывался эпитоп I (аминокислотные остатки примерно от 529 до 625, включая остатки внеклеточного домена ErbB2).
Опухоль-ингибирующие свойства моноклонального антитела 4D5 оценивали на клеточной линии опухоли молочной железы, SK-BR-3 (см. Hudziak et al. (1989) Molec. Cell. Biol. 9(3):1165-1172). Вкратце, клетки SK-BR-3 отделяли с использованием 0,25% (об./об.) трипсина и суспендировали в полной среде при плотности 4 × 105 клеток на мл. Аликвоты 100 мкл (4 × 104 клеток) засевали в 96-луночные планшеты для микроразведения, затем клетки оставляли для адгезии, после чего добавляли 100 мкл одной среды или среды, содержащей моноклональное антитело (в конечной концентрации 5 мкг/мл). Через 72 часа планшеты два раза промывали PBS (рН 7,5), окрашивали кристаллическим фиолетовым (0,5% в метаноле) и анализировали на относительную пролиферацию клеток, как описано у Sugarman et al., (1985) Science 230:943-945. Моноклональное антитело 4D5 ингибировало относительную пролиферацию клеток SK-BR-3 примерно на 56%.
Моноклональное антитело 4D5 также оценивали на его способность ингибировать HRG-стимулированное фосфорилирование тирозина белков, имеющих M r порядка 180000, в лизатах целых клеток MCF7 (Lewis et al. (1996) Cancer Research 56:1457-1465). Сообщалось, что клетки MCF7 экспрессируют все известные ErbB рецепторы, но на относительно низких уровнях. Поскольку ErbB2, ErbB3 и ErbB4 имеют почти одинаковую молекулярную массу, то при проведении Вестерн-блот-анализа клеточных лизатов невозможно определить, который из этих белков фосфорилируется по тирозину. Однако эти клетки являются идеальными для проведения анализов на HRG-стимулированное фосфорилирование по тирозину, поскольку в используемых аналитических условиях, в отсутствие экзогенно добавляемого HRG, эти клетки продуцируют низкие или недетектируемые уровни фосфорилированных по тиразину белков с M r порядка 180000.
Клетки MCF7 высевали в 24-луночные планшеты и в каждую лунку добавляли моноклональные антитела против ErbB2, после чего проводили инкубирование в течение 30 минут при комнатной температуре, а затем в каждую лунку добавляли rHRGβ1177-244 до конечной концентрации 0,2 нМ и инкубирование продолжали 8 минут. Затем из каждой лунки осторожно отсасывали среду и реакцию прекращали добавлением 100 мкл ДСН-буфера для образцов (5% ДСН, 25 мМ ДТТ и 25 мМ Трис-HCl, рН 6,8). Каждый образец (25 мкл) подвергали электрофорезу в 4-12% градиентном геле (Novex), а затем электрофоретически переносили на мембрану из поливинилидендифторида. Иммуноблоты антител против фосфотирозина (4G10, от UBI, используемые в концентрации 1 мкг/мл) проявляли и интенсивность преобладающей реактивной полосы при M r=180000 количественно оценивали с помощью отражательной денситометрии, как описано в литературе (Holmes et al. Science, 256:1205-1210 (1992); Sliwkowski et al. J. Biol. Chem., 269(20):14661-14665 (1994)).
Моноклональное антитело 4D5 обнаруживало значимое ингибирование генерирования HRG-индуцированного сигнала фосфорилирования тирозина при M r 180000. В отсутствие HRG не происходило какой-либо стимуляции фосфорилирования тирозина белков массой M r порядка 180000. Кроме того, это антитело не вступало в перекрестную реакцию с EGFR (Fendly et al., Cancer Research 50:1550-1558 (1990)), ErbB3 или ErbB4. Моноклональное антитело 4D5 обладало способностью блокировать HRG-стимуляцию фосфорилирования тирозина на 50%.
Опухоль-ингибирующие свойства моноклонального антитела 4D5 оценивали на клетках MDA-MB-175 и SK-BR-3 в присутствие или в отсутствие экзогенного rHRGβ1 (см. Schaefer et al. Oncogene 15:1385-1394 (1997)). Уровни ErbB2 в клетках MDA-MB-175 были в 4-6 раз выше, чем уровни, обнаруживаемые в нормальных эпителиальных клетках молочной железы, а рецептор ErbB2-ErbB4 в клетках MDA-MB-175 является конститутивно фосфорилируемым по тирозину. Моноклональное антитело 4D5 способно ингибировать пролиферацию клеток MDA-MB-175 как в присутствии, так и в отсутствие экзогенного HRG. Ингибирование пролиферации клеток под действием 4D5 зависит от уровня экспрессии ErbB2 (Lewis et al. Cancer Immunol. Immunother. 37:255-263 (1993)). Максимально обнаруживаемое ингибирование клеток SK-BR-3 составляло 66%. Однако больший эффект может быть достигнут с использованием экзогенного HRG.
Мышиное моноклональное антитело 4D5 было гуманизовано с применением стратегии “ген-конвертирующего мутагенеза”, описанного в патенте США № 5821337, который во всей своей полноте вводится в настоящее описание посредством ссылки. Гуманизованное моноклональное антитело 4D5, используемое в следующих экспериментах, было обозначено huMAb4D5-8. Это антитело имеет изотип IgG1.
Цитируемые работы
Объем настоящего изобретения не ограничен конкретными вариантами его осуществления, описанными в примерах, которые представлены лишь для иллюстрации нескольких аспектов настоящего изобретения, и в его объем входят любые функционально эквивалентные варианты. Действительно, помимо модификаций, которые были проиллюстрированы и описаны в настоящей заявке, в настоящее изобретение могут быть внесены и другие различные модификации, очевидные специалистам, и такие модификации также входят в объем прилагаемой формулы изобретения.
Все цитируемые здесь работы во всей своей полноте и для всех целей практического применения вводятся в настоящее описание посредством ссылки, так как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно введены во всей своей полноте и для всех целей практического применения посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| Бифункциональные цитотоксические агенты, содержащие CTI фармакофор | 2016 |
|
RU2682645C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АФУКОЗИЛИРОВАННОГО АНТИТЕЛА К CD20 В СОЧЕТАНИИ С КОНЪЮГАТОМ АНТИТЕЛО К CD79b-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2670971C9 |
| Конъюгаты антитело-лекарственное средство и их применение | 2019 |
|
RU2787617C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2553566C2 |
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2626537C2 |
| МОДИФИЦИРОВАННЫЕ АНТИТЕЛА, С КОТОРЫМИ СВЯЗАН МОТИВ, ВКЛЮЧАЮЩИЙ ОСТАТОК ЦИСТЕИНА, КОНЪЮГАТЫ ЭТИХ МОДИФИЦИРОВАННЫХ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2582259C2 |
| КОНЪЮГАТЫ ПРОИЗВОДНОГО АНТРАЦИКЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2523419C2 |
| ЦИТОТОКСИЧЕСКИЕ ПЕПТИДЫ И ИХ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2012 |
|
RU2586885C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2511410C2 |
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2755066C2 |











































































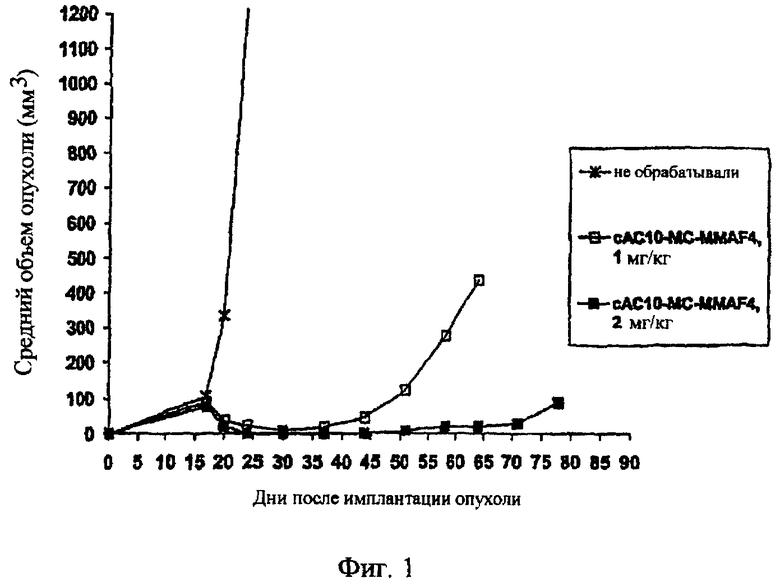
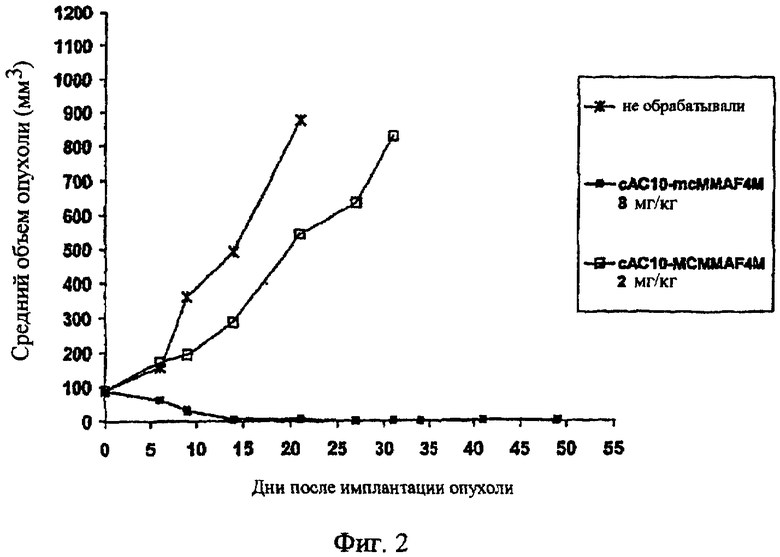
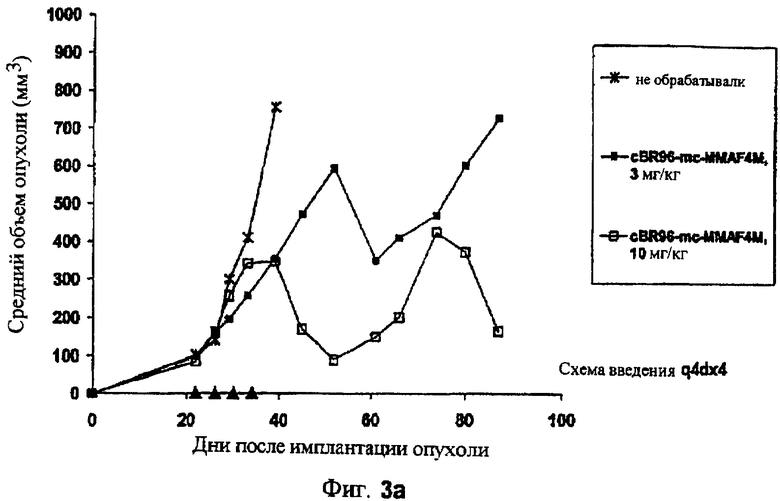
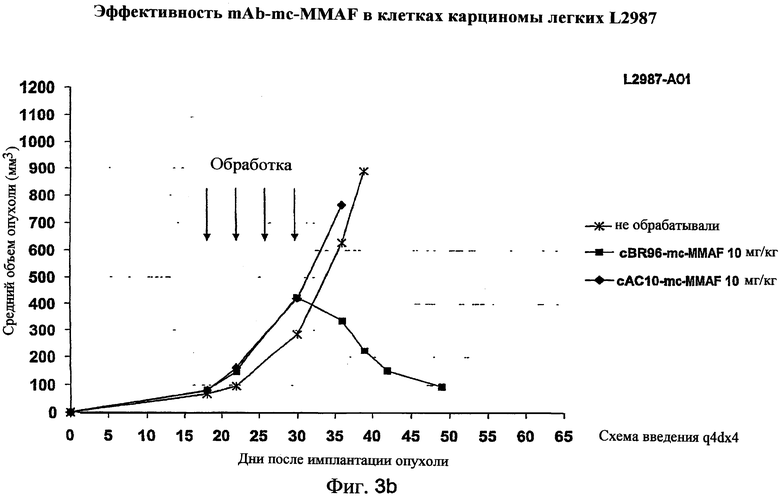
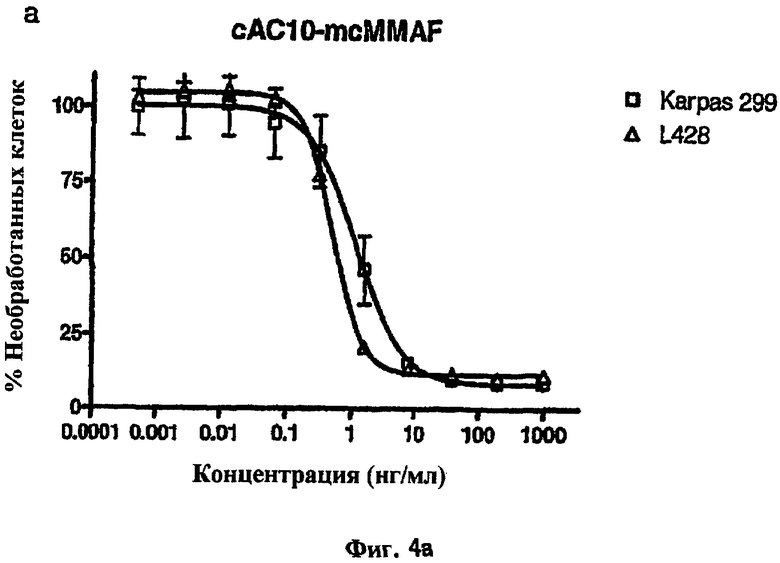
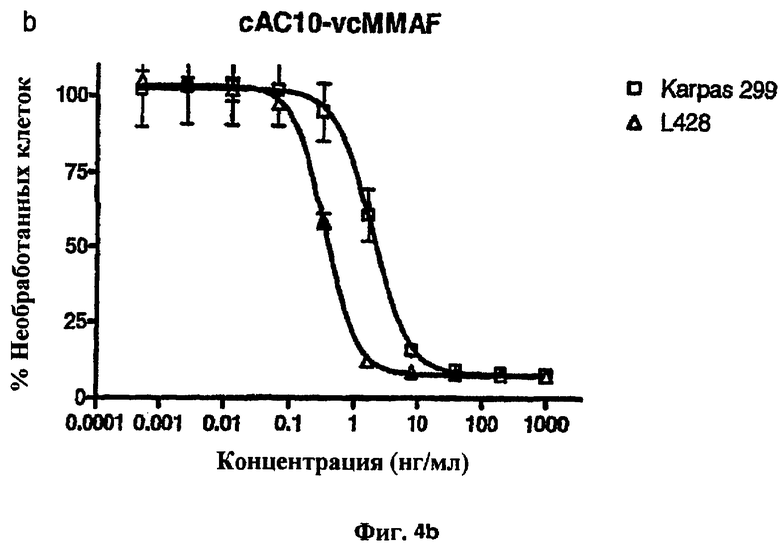
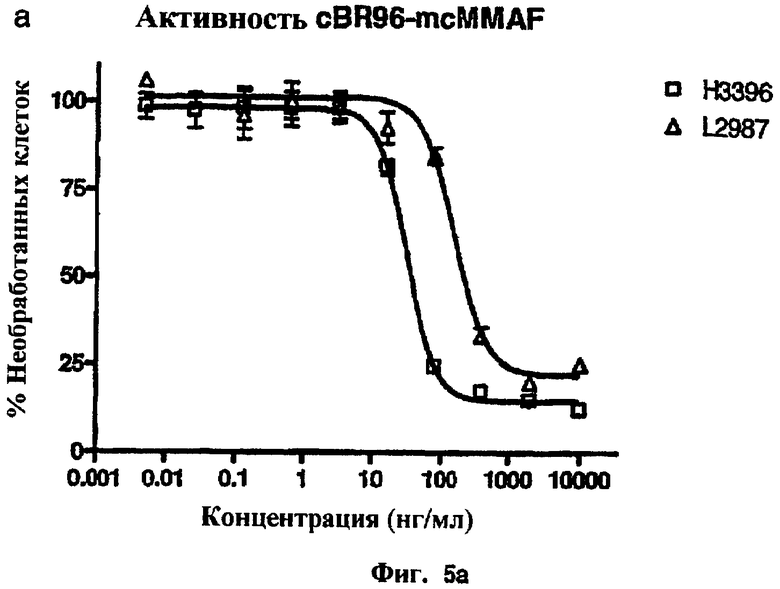
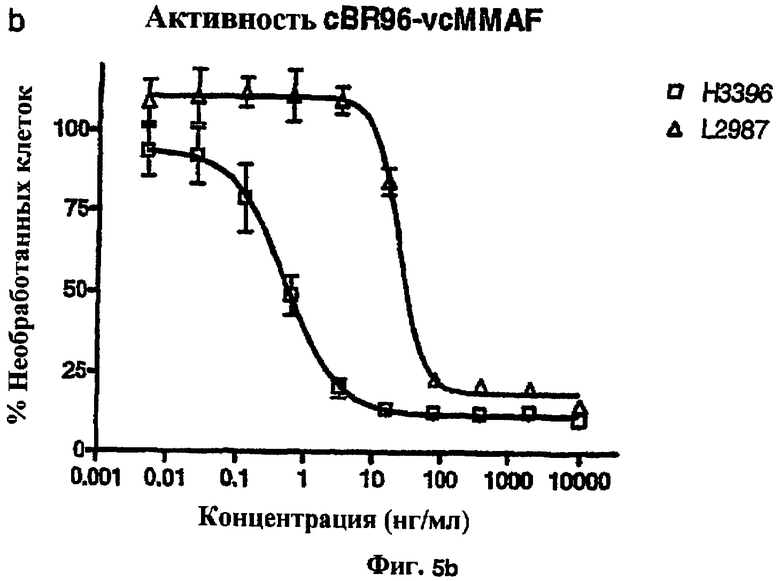
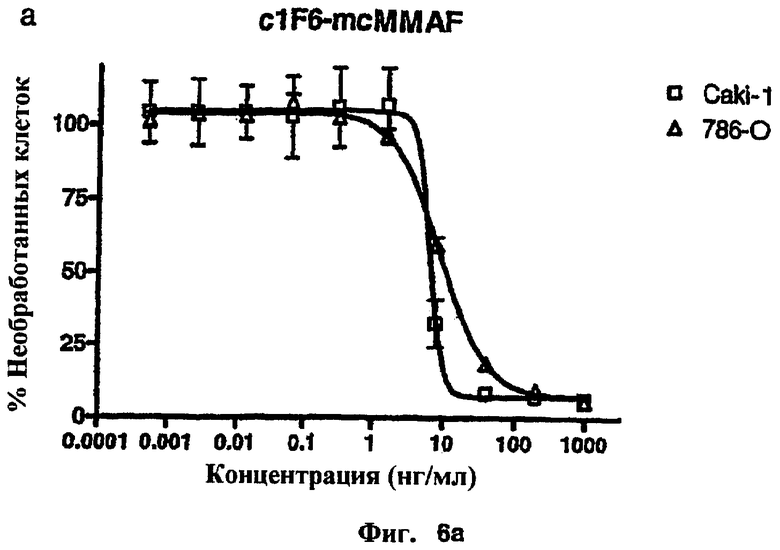
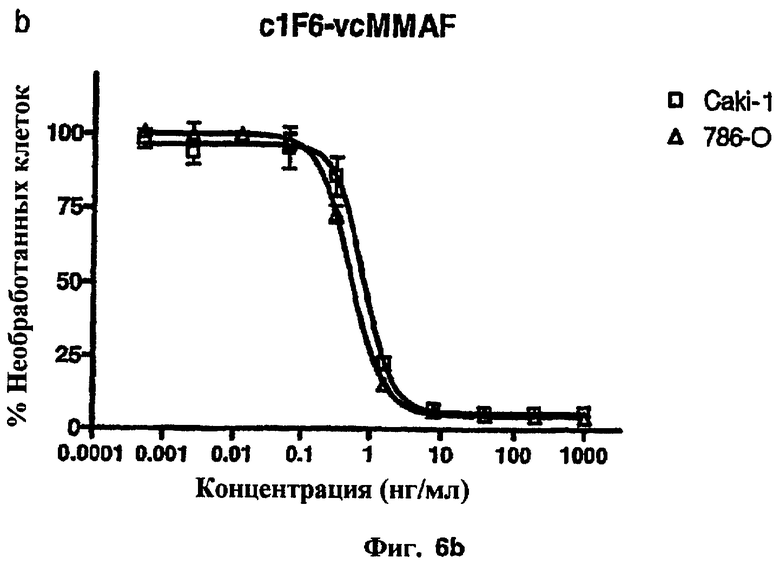
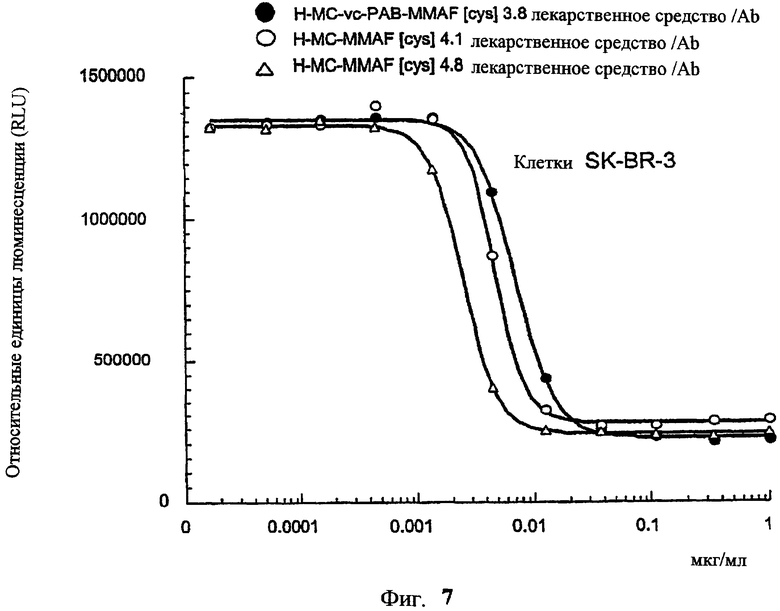
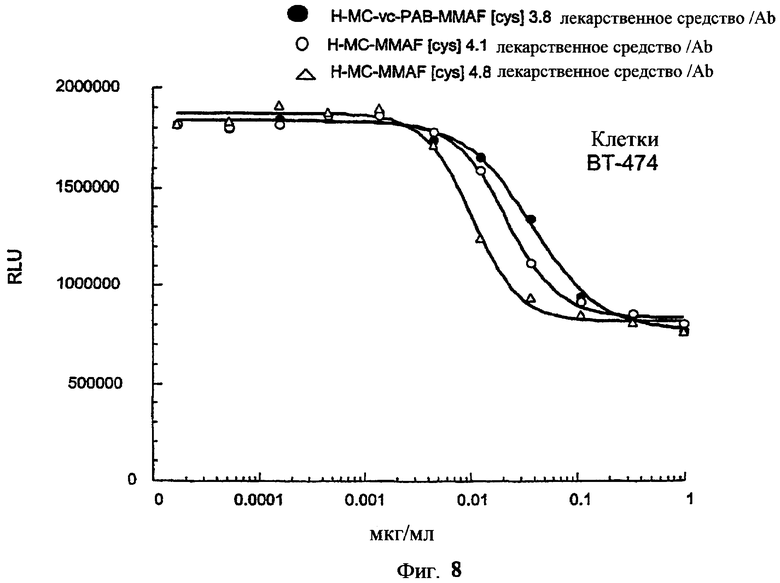
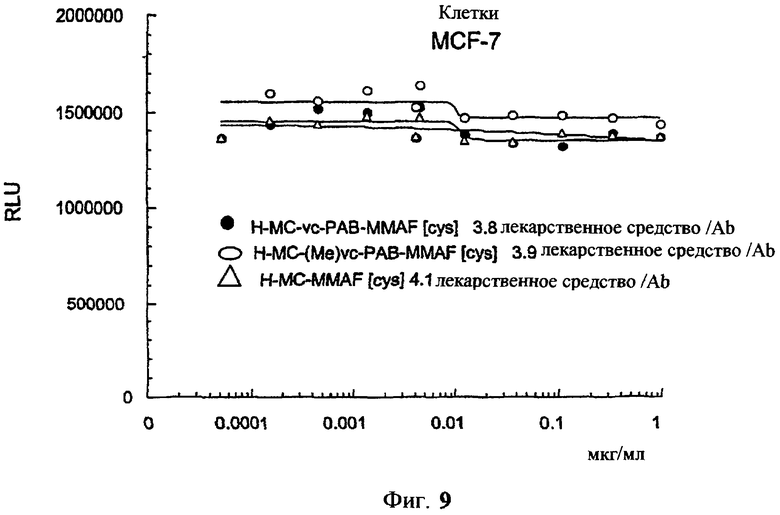
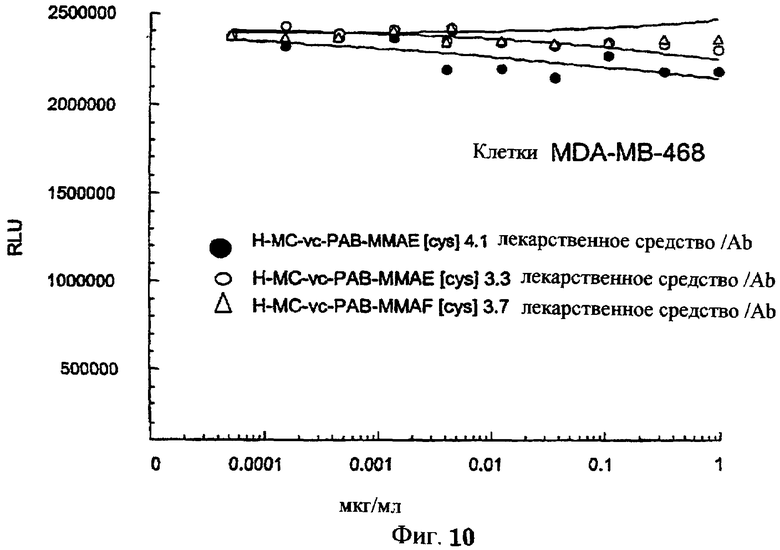
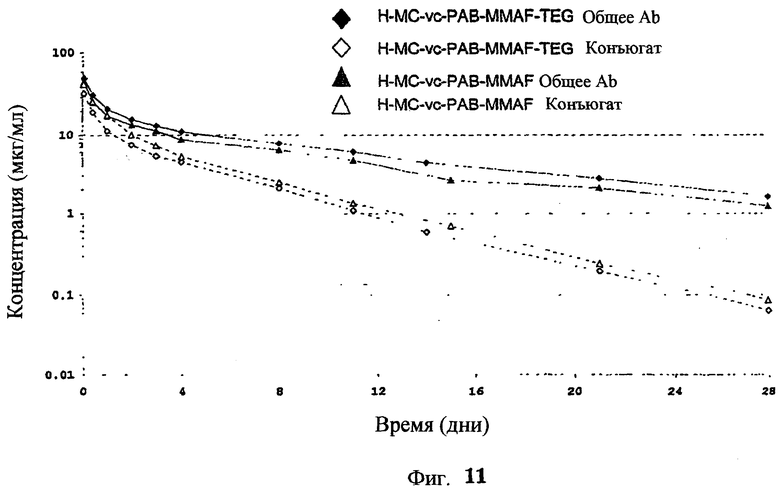
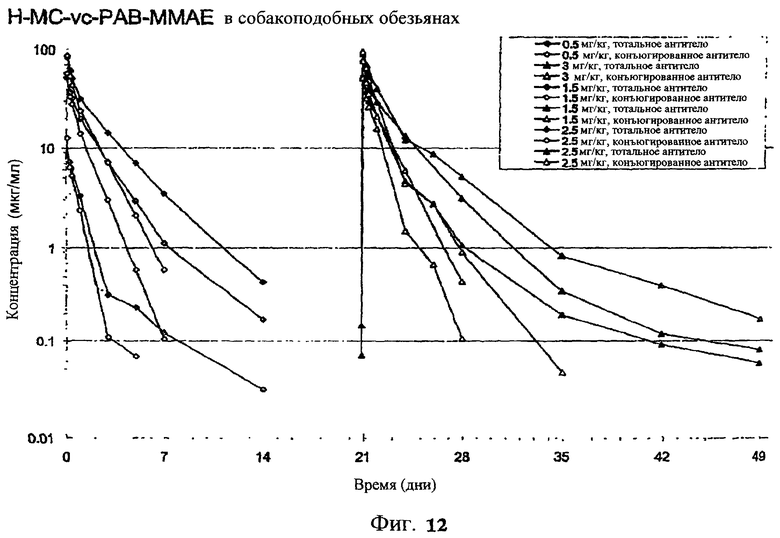
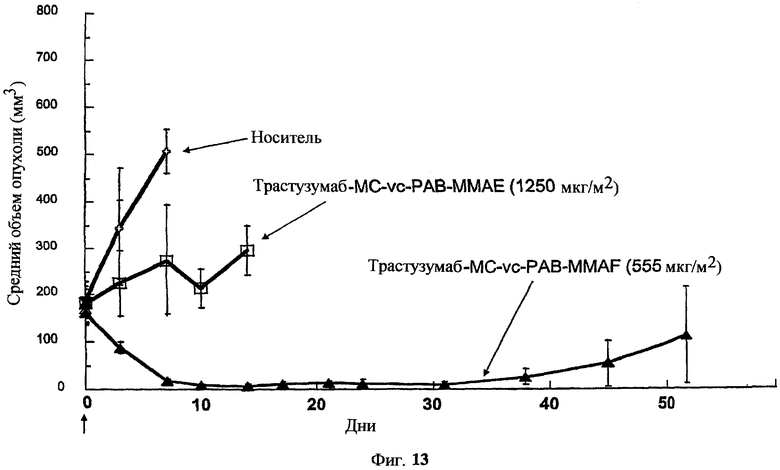
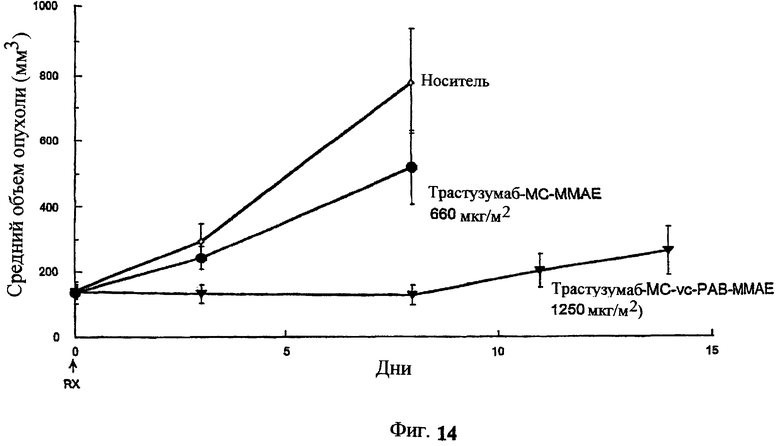
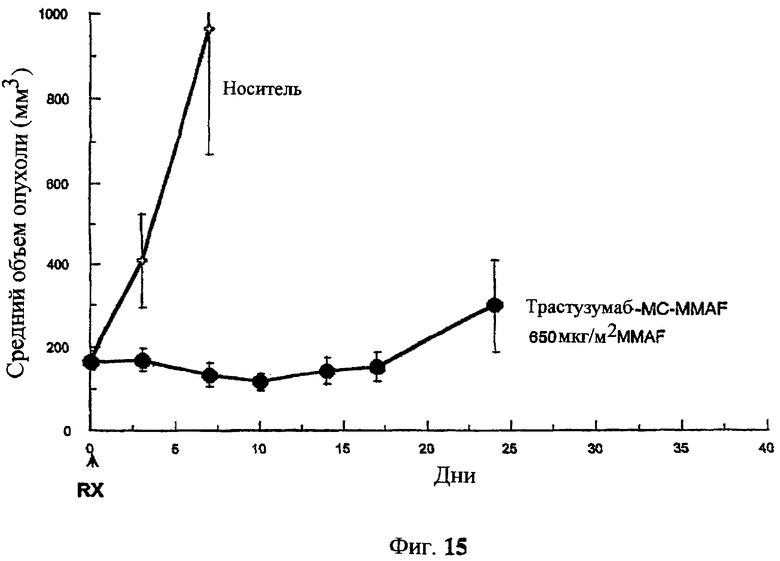
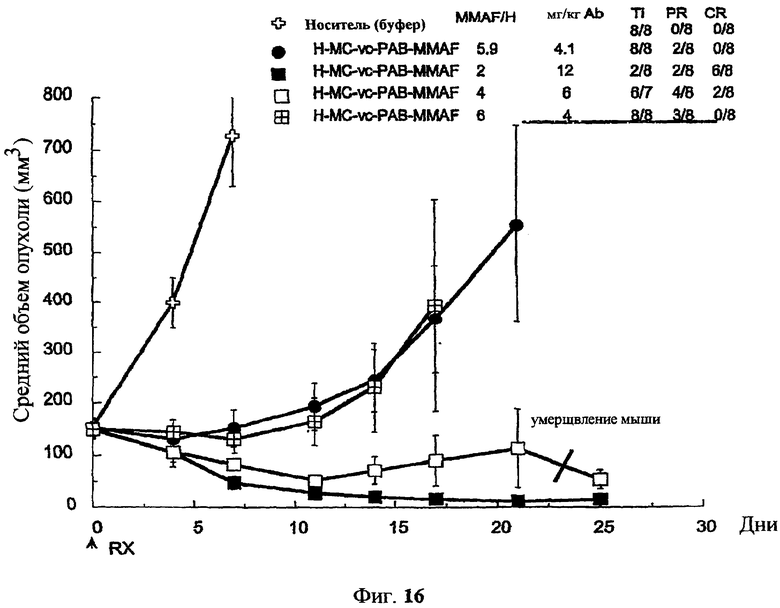
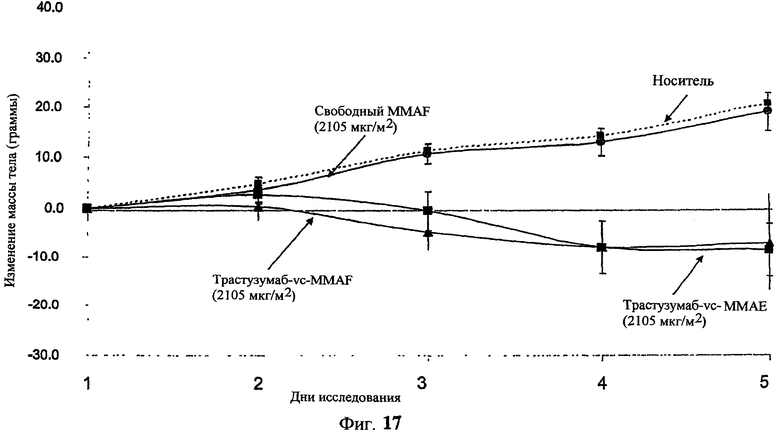
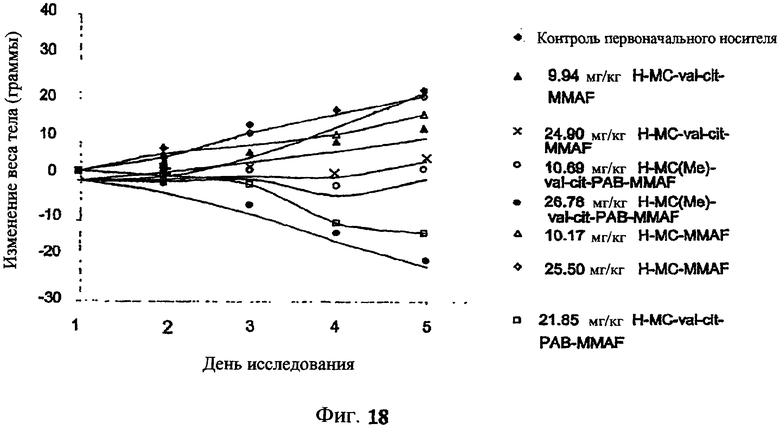
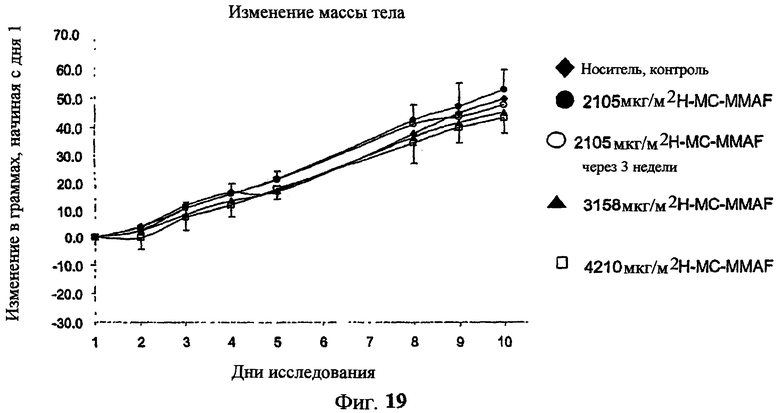
Изобретение относится к ауристатиновым пептидам, включая MeVal-Val-Dil-Dap-норэфедрин (ММАЕ) и MeVal-Val-Dil-Dap-Phe (MMAF), и эти пептиды были присоединены к лигандам посредством различных линкеров, включая малеимидокапроил-val-cit-PAB. Полученные конъюгаты "лиганд -лекарственное средство" являются активными in vitro и in vivo. 22 н. и 96 з.п. ф-лы, 19 ил., 12 табл., 33 пр.
1. Соединение, имеющее формулу DF:
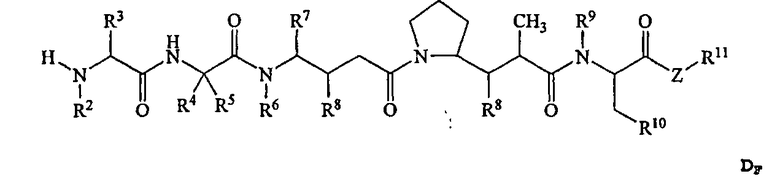
или фармацевтически приемлемая соль соединения DF,
где независимо в каждом положении:
R2 выбран из группы, включающей -Н и -С1-С8алкил;
R3 выбран из группы, включающей -Н и -С1-С8алкил;
R4 выбран из группы, включающей -Н и -С1-С8алкил;
R5 выбран из группы, включающей -Н и метил;
R6 выбран из группы, включающей -Н и -С1-С8алкил;
R7 выбран из группы, включающей -Н и -С1-С8алкил;
R8 представляет собой -O-(С1-С8алкил);
R9 выбран из группы, включающей -Н и -С1-С8алкил;
R10 представляет собой С6-С10арил;
Z представляет собой О или NH;
R11 выбран из группы, включающей -Н, -С1-С20алкил, С6-С10арил и -(R13O)m-R14;
m равно целому числу от 1 до 1000;
R13 представляет собой -С2-С8-алкил;
R14 представляет собой -Н или -С1-С8алкил.
2. Соединение по п.1, имеющее формулу:
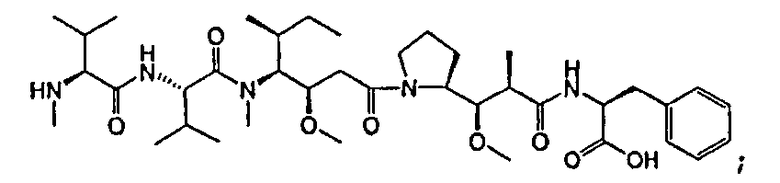
или его фармацевтически приемлемая соль.
3. Соединение или его фармацевтически приемлемая соль по любому из пп.1-2 в выделенной и очищенной форме.
4. Конъюгат, имеющий формулу:
L-(LU-DF)P
или его фармацевтически приемлемая соль;
где L - представляет собой лигандный компонент;
линкерный компонент (LU) имеет формулу:
-Aa-Ww-Yy-,
где -А- представляет собой удлиняющий компонент,
а представляет собой 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
-Y- представляет собой спейсерный компонент,
y равно 0, 1 или 2; и р составляет в пределах от 1 примерно до 20;
DF имеет формулу:
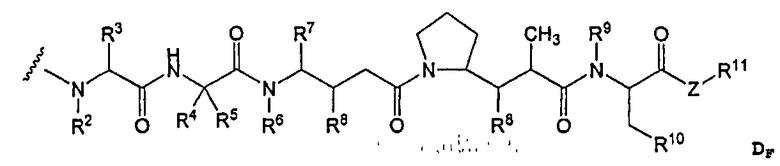
или его фармацевтически приемлемая соль,
где волнистой линией в DF указан сайт ковалентного связывания с лигандным компонентом L, выбранным из группы, включающей белок, полипептид и пептид, через линкерный компонент LU;
независимо в каждом положении:
R2 выбран из группы, включающей Н и С1-С8алкил;
R3 выбран из группы, включающей Н и С1-С8алкил;
R4 выбран из группы, включающей Н и С1-С8алкил;
R5 выбран из группы, включающей Н и метил;
R6 выбран из Н и С1-С8алкила;
R7 выбран из группы, включающей Н и С1-С8алкил;
R8 представляет собой O-(С1-С8алкил);
R9 выбран из группы, включающей Н и С1-С8алкил;
R10 представляет собой С6-С10арил;
Z представляет собой О или NH;
R11 выбран из группы, включающей Н, С1-С20алкил, С6-С10арил и -(R13O)m-R14;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил.
5. Конъюгат, имеющий формулу:
LU-DF
или его фармацевтически приемлемая соль,
где -LU- представляет собой линкерный компонент;
где линкерный компонент (LU) содержит;
-Aa-Ww-Yy-,
где -А- представляет собой удлиняющий компонент,
а равно 0 или 1,
каждый -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
-Y- представляет собой спейсерный компонент, и
y равно 0, 1 или 2;
DF имеет формулу:
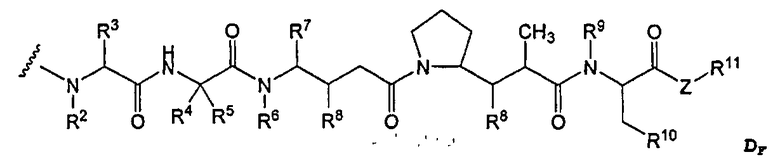
где волнистой линией в DF указан сайт ковалентного связывания с линкерным компонентом LU, и
независимо в каждом положении:
R2 выбран из группы, включающей Н и С1-С8алкил;
R3 выбран из группы, включающей Н и С1-С8алкил;
R4 выбран из группы, включающей Н и С1-С8алкил;
R5 выбран из группы, включающей Н и метил;
R6 выбран из Н и С1-С8алкила;
R7 выбран из группы, включающей Н и С1-С8алкил;
R8 представляет собой O-(С1-С8алкил);
R9 выбран из группы, включающей Н и С1-С8алкил;
R10 представляет собой С6-С10арил;
Z представляет собой О или NH;
R11 выбран из группы, включающей Н, С1-С20алкил, С6-С10арил и -(R13O)m-R14;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил.
6. Конъюгат по п.4, где конъюгат представляет собой конъюгат «антитело-лекарственное средство», имеющий формулу Ia':
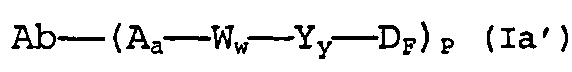
или его фармацевтически приемлемую соль,
где Ab представляет собой антитело,
-Aa-Ww-Yy- представляет собой линкерный компонент,
А представляет собой удлиняющий компонент,
а равно 0 или 1,
каждый W независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y представляет собой спейсерный компонент,
y равно 0, 1 или 2, и
p составляет в пределах от 1 примерно до 20.
7. Конъюгат «антитело-лекарственное средство» по п.6, где присутствует каждый из a, w и y, или а равно 1 и каждый из w и y равен 0,
или его фармацевтически приемлемая соль.
8. Конъюгат «антитело-лекарственное средство» по п.6, имеющий формулу:
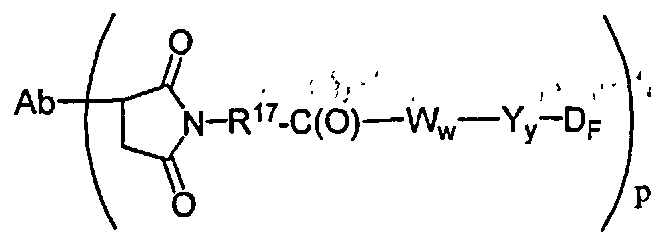
или его фармацевтически приемлемая соль,
где L представляет собой антитело и R17 представляет собой С1-С10алкилен-, -С3-С8карбоцикло-, -O-(С1-С8алкил)-, -арилен-, -С1-С10алкиленарилен-, -арилен-C1-С10алкилен-, -С1-С10алкилен-(С3-С8-карбоцикло)-, -(С3-С8карбоцикло)-С1-С10алкилен-, -С3-С8гетероцикло-, -С1-С10алкилен-(С3-С8гетероцикло)-, -(С3-С8гетероцикло)-С1-С10алкилен-, -(CH2CH2O)r- и - (CH2CH2O)r-СН2-; и r представляет собой целое число от 1 до 10.
9. Конъюгат «антитело-лекарственное средство» по п.6 или его фармацевтически приемлемая соль, в котором антитело присоединено к линкерному компоненту или к соединению DF через цистеиновый остаток антитела.
10. Конъюгат «антитело-лекарственное средство» по п.9 или его фармацевтически приемлемая соль, в котором p равен от 2 до 5.
11. Конъюгат «антитело-лекарственное средство» по п.9, имеющий формулу:
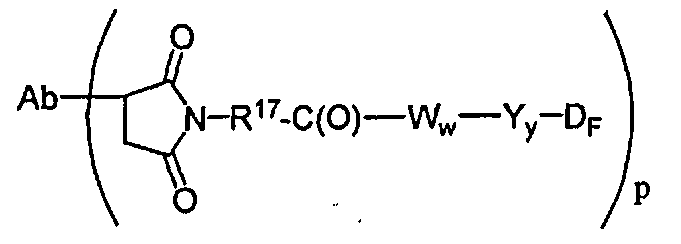
или его фармацевтически приемлемая соль,
где L представляет собой антитело и R17 представляет собой С1-С10алкилен-, -С3-С8карбоцикло-, -O-(С1-С8алкил)-, -арилен-, -С1-С10алкиленарилен-, -арилен-C1-С10алкилен-, -С1-С10алкилен-(С3-С8-карбоцикло)-, -(С3-С8карбоцикло)-С1-С10алкилен-, -С3-С8гетероцикло-, -С1-С10алкилен-(С3-С8гетероцикло)-, -(С3-С8гетероцикло)-С1-С10алкилен-, -(CH2CH2O)r- и -(CH2CH2O)r-СН2-; и r представляет собой целое число от 1 до 10.
12. Конъюгат «антитело-лекарственное средство» по п.8, имеющий формулу:
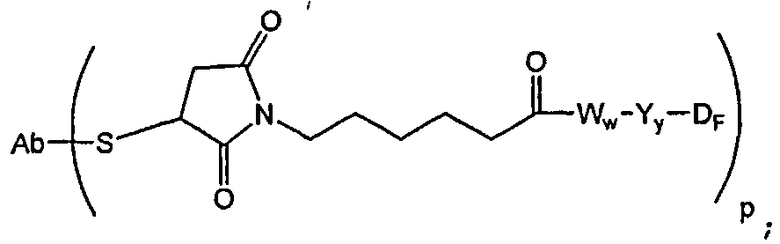
или его фармацевтически приемлемая соль.
13. Конъюгат «антитело-лекарственное средство» по п.11, имеющий формулу:
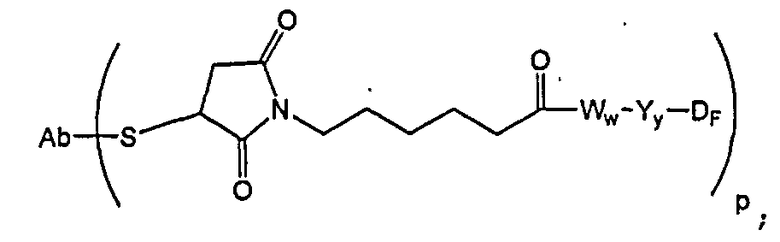
или его фармацевтически приемлемая соль,
где каждый из w и у равен 0.
14. Конъюгат «антитело-лекарственное средство» по п.6 или его фармацевтически приемлемая соль, где w представляет собой целое число от 2 до 12.
15. Конъюгат «антитело-лекарственное средство» по п.14 или его фармацевтически приемлемая соль, где w равно 2.
16. Конъюгат «антитело-лекарственное средство» по п.15 или его фармацевтически приемлемая соль, где Ww представляет собой -валин-цитруллин-, -фенилаланин-лизин- или -N-метилвалин-цитруллин-.
17. Конъюгат «антитело-лекарственное средство» по п.8 или его фармацевтически приемлемая соль, где Ww представляет собой 5-аминовалериановую кислоту, гомофенилаланин лизин, тетраизохинолинкарбоксилат лизина, циклогексилаланин лизин, изонипекотиновую кислоту лизина, бета-аланин лизин, глицин серии валин глутамин или изонипекотиновую кислоту.
18. Конъюгат «антитело-лекарственное средство» по п.16, имеющий формулу:
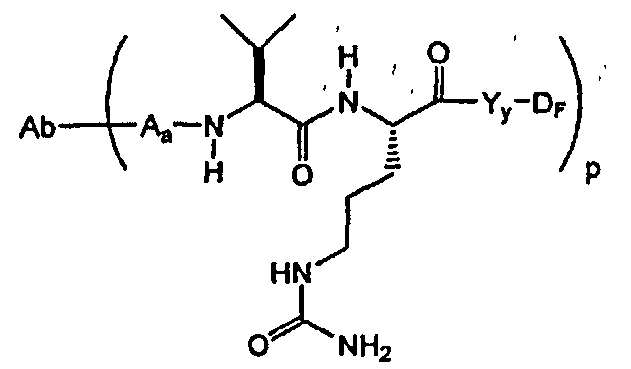
или его фармацевтически приемлемая соль.
19. Конъюгат «антитело-лекарственное средство» по п.16, имеющий формулу:
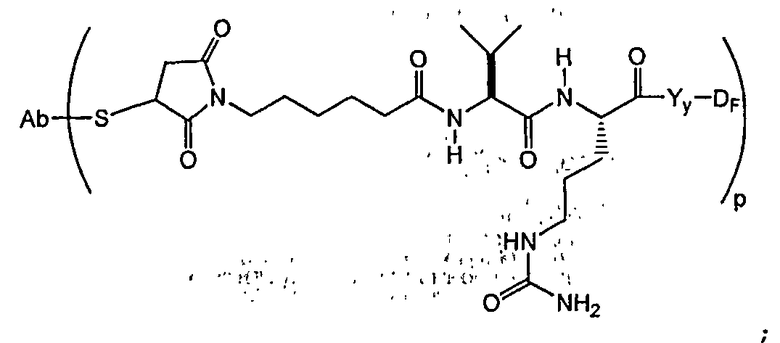
или его фармацевтически приемлемая соль.
20. Конъюгат «антитело-лекарственное средство» по п.16, имеющий формулу:
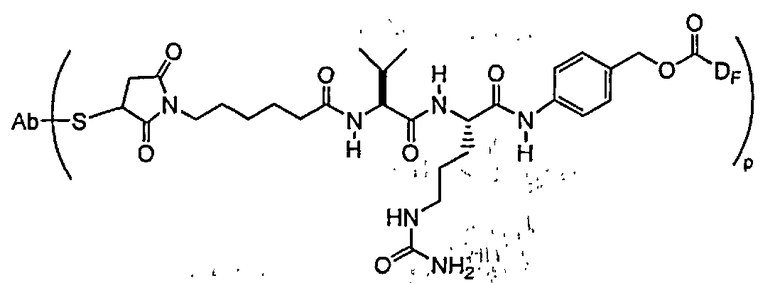
или его фармацевтически приемлемая соль.
21. Конъюгат «антитело-лекарственное средство» по любому из пп.6-8 и 12-20, где DF имеет формулу:
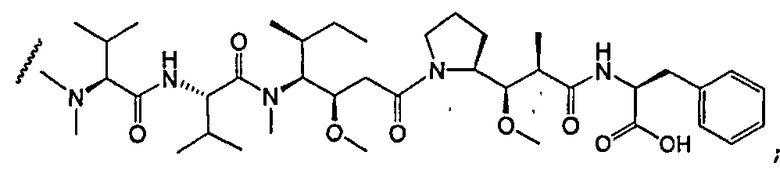
или его фармацевтически приемлемая соль.
22. Конъюгат «антитело-лекарственное средство» по п.6 или его фармацевтически приемлемая соль, где антитело выбрано из группы, состоящей из моноклонального антитела;
биспецифического антитела, химерного антитела, гуманизированного антитела, диатела и фрагмента антитела.
23. Конъюгат «антитело-лекарственное средство» по п.6, имеющий формулу:
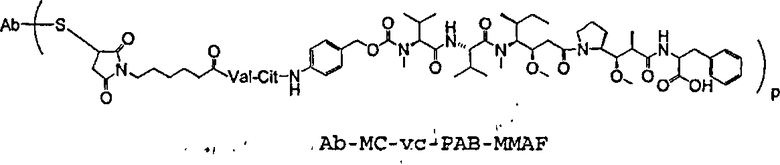
или
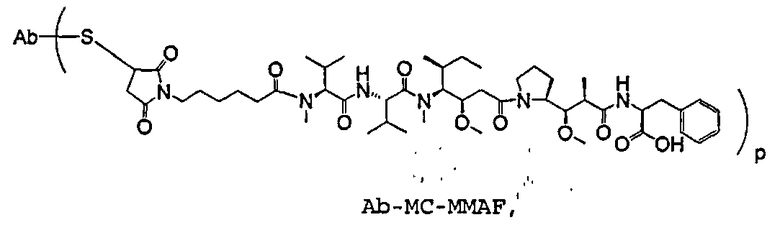
или его фармацевтически приемлемая соль,
где Ab представляет собой антитело, Val представляет собой валин и Cit представляет собой цитруллин.
24. Конъюгат "антитело-лекарственное средство" по п.23 или его фармацевтически приемлемая соль, где антитело связывается с CD30, CD20, CD33 или антигеном Lewis Y.
25. Фармацевтическая композиция для лечения рака, содержащая эффективное количество конъюгата по любому из пп.4 и 6-24 или его фармацевтически приемлемой соли и фармацевтически приемлемый разбавитель, носитель или наполнитель.
26. Применение конъюгата по любому из пп.4 и 6-24 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака.
27. Применение по п.26, где рак представляет собой лимфому.
28. Применение по п.26, где рак представляет собой рак молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почек, толстой кишки, ободочной кишки, щитовидной железы, поджелудочной железы, предстательной железы или мочевого пузыря.
29. Способ лечения рака, предусматривающий введение количества конъюгата «антитело-лекарственное средство» по любому из пп.4 и 6-24 или его фармацевтически приемлемой соли, где указанное количество является эффективным для лечения рака, причем антитело конъюгата «антитело-лекарственное средство» связывается с антигеном, экспрессируемым раковой клеткой.
30. Применение по п.26, где рак представляет собой рак молочной железы.
31. Применение по п.26, где рак представляет собой рак почек.
32. Конъюгат или его фармацевтически приемлемая соль по любому из пп.4-24 в выделенной и очищенной форме.
33. Конъюгат «антитело-лекарственное средство», содержащий антитело, ковалентно присоединенное к одной или нескольким молекулам лекарственного средства, где конъюгат «антитело-лекарственное средство» имеет формулу Ic:
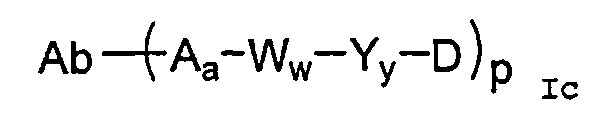
или его фармацевтически приемлемая соль,
где Ab представляет собой антитело, которое связывается с одним или несколькими ассоциированными с опухолью антигенами (1)-(35):
(1) BMPR1B (рецептор белка морфогенеза кости типа IB);
(2) E16 (LAT1, SLC7A5);
(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы);
(4) 0772P (CA125, MUC16);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин);
(6) Napi3b (NAPI-3B, NpTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II);
(7) Sema 5b (FLJ10372, KIAA1445; Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен (семафорин) 5 В);
(8) PSCA nlg (2700050C12Rik, C530008016Rik, кДНК RIKEN 2700050С12, кДНК гена RIKEN 2700050С12);
(9) ETBR (рецептор эндотелина типа В);
(10) MSG783 (RNF124, гипотетический белок FLJ20315);
(11) STEAP2 (HGNC-8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы);
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барра) или Hs.73792);
(15) CD79b (IGb (бета-белок, связанный с иммуноглобулином), В29);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C);
(17) HER2;
(18) NCA;
(19) MDP;
(20) IL20Rα;
(21) Brevican;
(22) Ephb2R;
(23) ASLG659;
(24) PSCA;
(25) GEDA;
(26) BAFF-R;
(27) CD22;
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок);
(29) CXCR5 (рецептор 1 лимфомы Беркитта);
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Iа), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам);
(31) Р2Х5 (ионный канал 5, открываемый лигандом пуринергического рецептора Р2Х);
(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок, относящийся к семейству белков с богатыми лейцином повторами (LRR), типа I);
(34) FCRH1 (Fc-рецептор-подобный белок: 1); и
(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2),
А представляет собой удлиняющий компонент,
а равно 0 или 1,
каждый W независимо представляет, собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y представляет собой спейсерный компонент,
y равно 0, 1 или 2,
p составляет в пределах от 1 примерно до 20, и
D представляет собой молекулу лекарственного средства, выбранную из группы, состоящей из формул DE и DF:
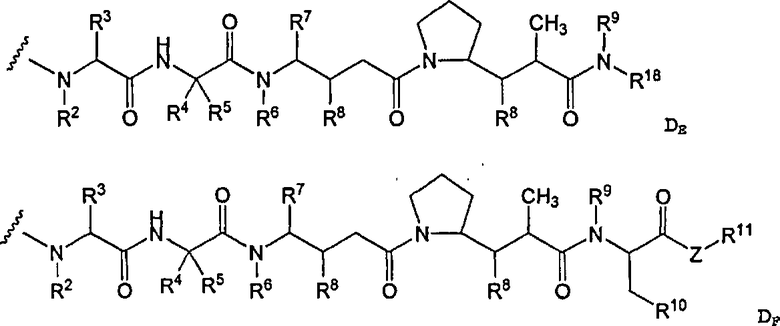
где волнистая линия в DE и DF обозначает сайты ковалентного присоединения к A, W или Y, и независимо в каждом положении:
R2 выбран из группы, включающей Н и С1-С8алкил;
R3 выбран из группы, включающей Н и С1-С8алкил;
R4 выбран из группы, включающей Н и С1-С8алкил;
R5 выбран из группы, включающей Н и метил;
R6 выбран из группы, включающей Н и С1-С8алкил;
R7 выбран из группы, включающей Н и С1-С8алкил;
R8 независимо выбран из группы, включающей Н, ОН, С1-С8алкил и O-(С1-С8алкил);
R9 выбран из группы, включающей Н и С1-С8алкил;
R10 представляет собой С6-С10арил;
Z представляет собой О или NH;
R11 выбран из группы, включающей Н, С1-С20алкил, С6-С10арил, и -(R13O)m-R14;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил; и
R18 представляет собой -C(R8)2-C(R8)2-C6-С10арил.
34. Конъюгат «антитело-лекарственное средство» по п.33, в котором D имеет формулу DE:
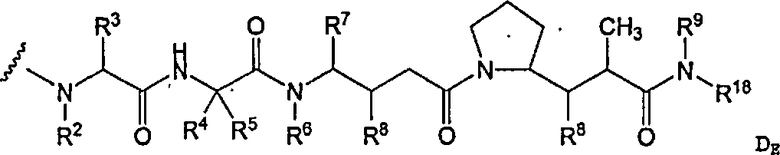
или его фармацевтически приемлемая соль.
35. Конъюгат «антитело-лекарственное средство» по п.33, в котором D имеет формулу DF:
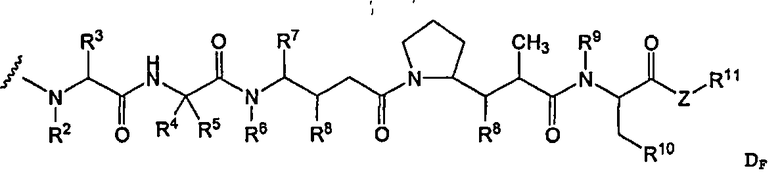
или его фармацевтически приемлемая соль.
36. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где антитело присоединено к молекуле лекарственного средства через цистеиновый остаток антитела.
37. Конъюгат «антитело-лекарственное средство» по п.36 или его фармацевтически приемлемая соль, где p составляет от 1 до 4.
38. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где p составляет от 2 до 8.
39. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где p составляет от 2 до 5.
40. Конъюгат «антитело-лекарственное средство» по п.36, имеющий формулу:
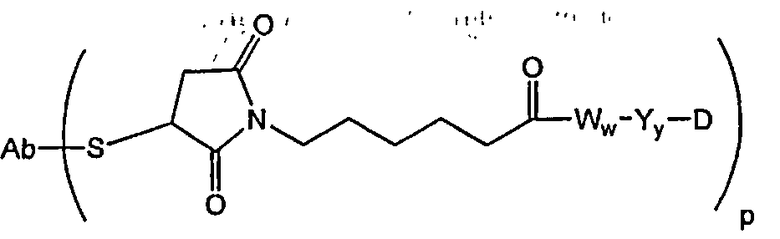
или его фармацевтически приемлемая соль.
41. Конъюгат «антитело-лекарственное средство» по п.40, где каждый из w и у равен 0, имеющий формулу:
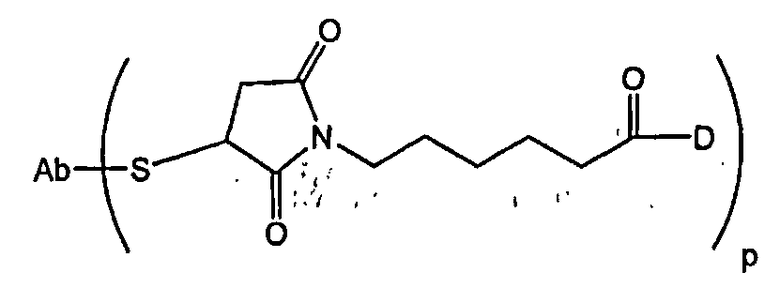
или его фармацевтически приемлемая соль.
42. Конъюгат «антитело-лекарственное средство» по п.41 или его фармацевтически приемлемая соль, где D имеет формулу DE.
43. Конъюгат «антитело-лекарственное средство» по п.42, в котором формула DE имеет формулу:
или его фармацевтически приемлемая соль.
44. Конъюгат «антитело-лекарственное средство» по п.41 или его фармацевтически приемлемая соль, где D имеет формулу DF.
45. Конъюгат «антитело-лекарственное средство» по п.44, в котором формула DF имеет формулу:
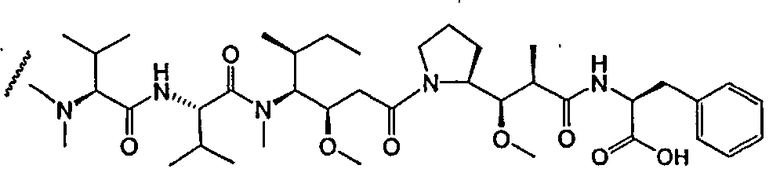
или его фармацевтически приемлемая соль.
46. Конъюгат «антитело-лекарственное средство» по п.33, имеющий формулу:
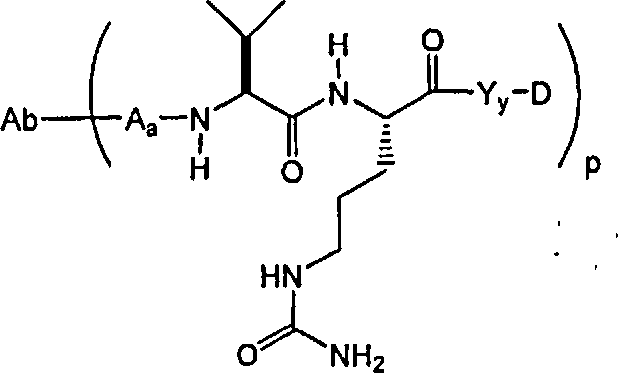
или его фармацевтически приемлемая соль.
47. Конъюгат «антитело-лекарственное средство» по п.46, имеющий формулу:
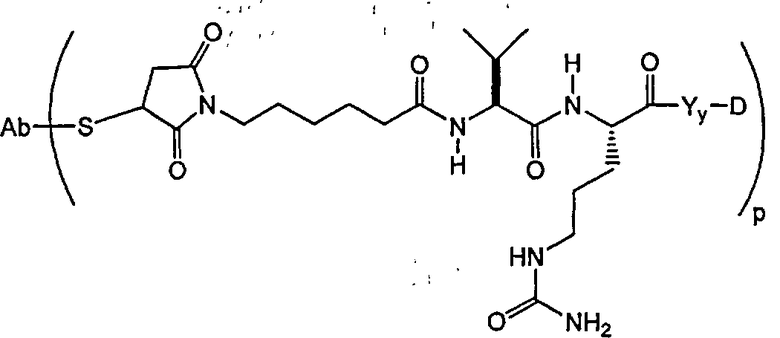
или его фармацевтически приемлемая соль.
48. Конъюгат «антитело-лекарственное средство» по п.47, имеющий формулу:
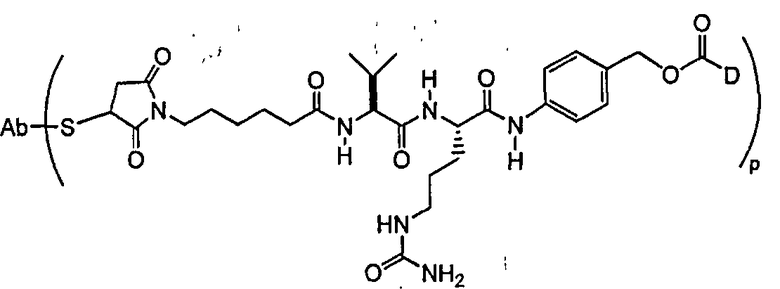
или его фармацевтически приемлемая соль.
49. Конъюгат «антитело-лекарственное средство» по п.48 или его фармацевтически приемлемая соль, где D имеет формулу DE.
50. Конъюгат «антитело-лекарственное средство» по п.49, в котором формула DE имеет формулу:
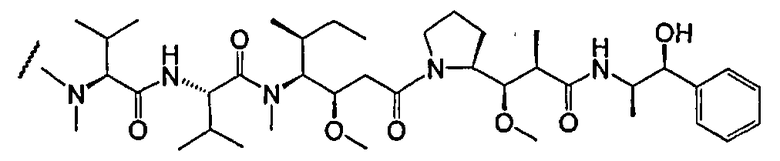
или его фармацевтически приемлемая соль.
51. Конъюгат «антитело-лекарственное средство» по п.47 или его фармацевтически приемлемая соль, в котором D имеет формулу DF.
52. Конъюгат «антитело-лекарственное средство» по п.51, в котором формула DF имеет формулу:
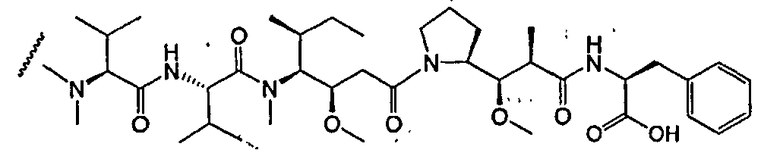
или его фармацевтически приемлемая соль.
53. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где w представляет собой целое число от 2 до 12.
54. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где w равно 2.
55. Конъюгат «антитело-лекарственное средство» по п.35 или его фармацевтически приемлемая соль, где Ww представляет собой -валин-цитруллин-.
56. Конъюгат «антитело-лекарственное средство» по п.33, в котором D выбран из группы, состоящей из формул:
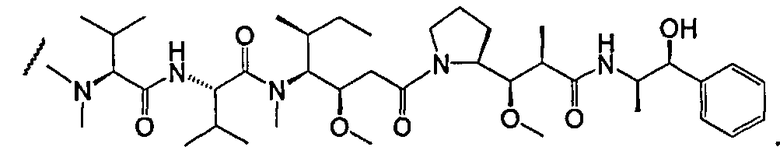
и
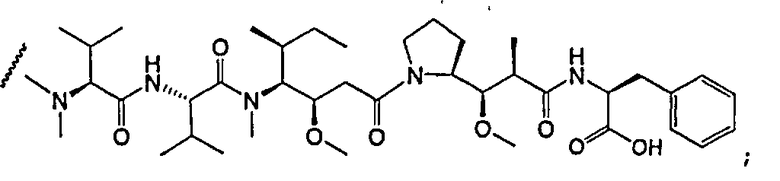
или его фармацевтически приемлемая соль.
57. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где антитело специфически связывается с рецептором HER2.
58. Конъюгат «антитело-лекарственное средство» по п.57 или его фармацевтически приемлемая соль, который специфически связывается с внеклеточным доменом рецептора HER2 и ингибирует рост опухолевых клеток, которые сверхэкспрессируют рецептор HER2.
59. Конъюгат «антитело-лекарственное средство» по п.33 или его фармацевтически приемлемая соль, где антитело выбрано из группы, состоящей из моноклонального антитела, биспецифического антитела, химерного антитела, гуманизированного антитела и фрагмента антитела.
60. Конъюгат «антитело-лекарственное средство» по п.59 или его фармацевтически приемлемая соль, где фрагмент антитела представляет собой Fab-фрагмент.
61. Конъюгат «антитело-лекарственное средство» по п.59 или его фармацевтически приемлемая соль, где гуманизированное антитело выбрано из группы, состоящей из huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (трастузумаб).
62. Конъюгат «антитело-лекарственное средство» по п.61 или его фармацевтически приемлемая соль, где антитело представляет собой huMAb4D5-8 (трастузумаб).
63. Конъюгат «антитело-лекарственное средство» по п.33, имеющий формулу:
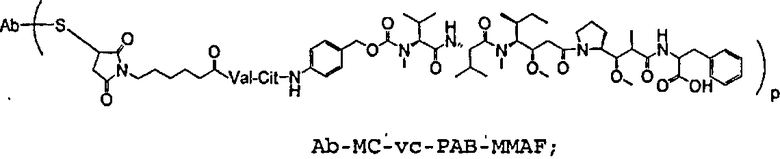
или его фармацевтически приемлемая соль,
где Val представляет собой валин и Cit представляет собой цитруллин.
64. Конъюгат «антитело-лекарственное средство» по п.63 или его фармацевтически приемлемая соль, где антитело представляет собой huMAb4D5-8 (трастузумаб).
65. Фармацевтическая композиция для лечения рака, содержащая эффективное количество конъюгата «антитело-лекарственное средство» по любому из пп.33-64 или его фармацевтически приемлемой соли и фармацевтически приемлемый разбавитель, носитель или наполнитель.
66. Способ лизиса или ингибирования пролиферации опухолевых или раковых клеток, включающий обработку опухолевых или раковых клеток количеством конъюгата "антитело-лекарственное средство" по любому из пп.33-64, где указанное количество является эффективным для лизиса или ингибирования пролиферации опухолевых или раковых клеток.
67. Способ лечения рака, включающий введение количества конъюгата "антитело-лекарственное средство" по любому из пп.33-64, где указанное количество является эффективным для лечения рака.
68. Способ по п.67, где рак выбран из группы, состоящей из рака молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почек, толстой кишки, ободочной кишки, щитовидной железы, поджелудочной железы, предстательной железы и мочевого пузыря.
69. Способ по п.67, где рак представляет собой лимфому.
70. Способ по п.69, где лимфома представляет собой неходжкинскую лимфому.
71. Способ ингибирования клеточной пролиферации, включащий:
обработку клеток млекопитающих в клеточной культуральной среде конъюгатом "антитело-лекарственное средство" по любому из пп.33-64 или его фармацевтически приемлемой солью и
измерение цитотоксической активности конъюгата "антитело-лекарственное средство" или его фармацевтически приемлемой соли.
72. Способ лечения рака, включающий введение эффективного количества композиции конъюгата "антитело-лекарственное средство" по любому из пп.33-64 или его фармацевтически приемлемой соли и фармацевтически приемлемого разбавителя, носителя или наполнителя.
73. Способ по п.72, где конъюгат «антитело-лекарственное средство» или его фармацевтически приемлемая соль специфически связывается с рецептором, кодируемым геном EbrB2.
74. Способ по п.72, в котором количество конъюгата «антитело-лекарственное средство» или его фармацевтически приемлемой соли, вводимое пациенту, составляет в пределах от примерно 0,1 до примерно 10 мг/кг веса тела пациента.
75. Способ по п.72, где конъюгат «антитело-лекарственное средство» или его фармацевтически приемлемая соль вводится с интервалами примерно в три недели.
76. Способ по п.72, где указанный конъюгат «антитело-лекарственное средство» или его фармацевтически приемлемую соль приготавливают вместе с фармацевтически приемлемым парентеральным носителем и вводят парентерально.
77. Способ по п.72, в котором указанный конъюгат «антитело-лекарственное средство» или его фармацевтически приемлемую соль приготавливают в виде инъекционной формы лекарственного средства.
78. Способ по п.72, в котором указанный конъюгат «антитело-лекарственное средство» или его фармацевтически приемлемую соль вводят внутривенно.
79. Способ по п.72, дополнительно включающий введение второго антитела, которое связывается с опухоль-ассоциированным антигеном, выбранным из (1)-(35):
(1) BMPR1B (рецептор белка морфогенеза кости типа IB);
(2) E16 (LAT1, SLC7A5);
(3) STEAP1 (шестидоменный трансмембранный эпителиальный антиген предстательной железы);
(4) 0772Р (СА125, MUC16);
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин);
(6) Napi3b (NAPI-3B, NpTIIb, SLC34A2, член 2 семейства растворимых носителей 34 (фосфат натрия), натрий-зависимый фосфат-переносящий белок 3b типа II);
(7) Sema 5b (FLJ 10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, сема-домен, семидоменные повторы тромбоспондина (типа 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен (семафорин) 5В);
(8) PSCA hlg (2700050C12Rik, C530008016Rik, кДНК RIKEN 2700050С12, кДНК гена RIKEN 2700050С12);
(9) ETBR (рецептор эндотелина типа В);
(10) MSG783 (RNF124, гипотетический белок FLJ20315);
(11) STEAP2 (HGNC-8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, ассоциированный с раком предстательной железы, белок 1, ассоциированный с раком предстательной железы, шестидоменный трансмембранный эпителиальный антиген предстательной железы 2, шестидоменный трансмембранный белок предстательной железы);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, потенциал-зависимый катионный канал транзиентного рецептора, член 4 подсемейства М);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, происходящий от тератокарциномы);
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барра) или Hs.73792);
(15) CD79b (IGb (бета-белок, связанный с иммуноглобулином), В29);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок 1а, содержащий домен SH2), SPAP1B, SPAP1C);
(17) HER2;
(18) NCA;
(19) MDP;
(20) IL20Rα;
(21) Brevican;
(22) Ephb2R;
(23) ASLG659;
(24) PSCA;
(25) GEDA;
(26) BAFF-R;
(27) CD22;
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа-белок);
(29) CXCR5 (рецептор 1 лимфомы Беркитта);
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген Iа), которая связывается с пептидами и презентирует их CD4+-Т-лимфоцитам);
(31) Р2Х5 (ионный канал 5, открываемый лигандом пуринергического рецептора Р2Х);
(32) CD72 (антиген CD72 линии В-клеточной дифференцировки, Lyb-2);
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок, относящийся к семейству белков с богатыми лейцином повторами (LRR), типа I);
(34) FCRH1 (Fc-рецептор-подобный белок, 1); и
(35) IRTA2 (ассоциированный с транслокацией рецептор суперсемейства иммуноглобулина 2).
80. Способ ингибирования роста опухолевых клеток, которые сверхэкспрессируют опухоль-ассоциированный антиген, предусматривающий введение конъюгата «антитело-лекарственное средство» по любому из пп.33-64 или его фармацевтически приемлемой соли, который специфически связывается с указанным опухоль-ассоциированным антигеном, и химиотерапевтического агента, где каждый из указанного конъюгата «антитело-лекарственное средство» или его фармацевтически приемлемой соли и химиотерапевтического агента вводятся в количествах, эффективных для ингибирования роста опухолевых клеток.
81. Способ по п.80, где указанный конъюгат «антитело-лекарственное средство» или его фармацевтически приемлемая соль сообщает опухолевым клеткам чувствительность к указанному химиотерапевтическому агенту.
82. Способ лечения человека, восприимчивого к заболеванию, или человека, у которого было диагностировано заболевание, характеризующееся сверхэкспрессией рецептора ErbB2, где указанный способ включает введение эффективного количества комбинации конъюгата "антитело-лекарственное средство", или его фармацевтически приемлемой соли по любому из пп.33-64 и химиотерапевтического агента.
83. Анализ для обнаружения раковых клеток, включающий:
обработку клеток конъюгатом "антитело-лекарственное средство" или его фармацевтически приемлемой солью по любому из пп.33-64 и
определение степени связывания конъюгата "антитело-лекарственное средство" или его фармацевтически приемлемой соли с клетками.
84. Анализ по п.83, где клетки являются клетками опухоли молочной железы.
85. Анализ по п.83, где степень связывания определяют путем измерения уровней нуклеиновой кислоты, кодирующей опухоль-ассоциированный антиген, посредством флуоресцентой in situ гибридизации (FISH).
86. Анализ по п.83, где степень связывания определяют иммуногистохимическим методом (IHC).
87. Изделие, содержащее:
конъюгат "антитело-лекарственное средство" или его фармацевтически приемлемую соль по любому из пп.33-64;
контейнер; и
вкладыш, вложенный в упаковку, или этикетку на упаковке, указывающие, что конъюгат "антитело-лекарственное средство" или его фармацевтически приемлемая соль могут быть использованы для лечения рака.
88. Изделие по п.87, где указанный вкладыш в упаковку или этикетка указывает, что конъюгат "антитело-лекарственное средство" или его фармацевтически приемлемая соль могут быть использованы для лечения рака, характеризующегося сверхэкспрессией рецептора ErbB2.
89. Изделие по п.87, где рак представляет собой рак молочной железы.
90. Способ лечения рака у млекопитающего, где рак характеризуется сверхэкспрессией рецептора ErbB2 (HER2) и является невосприимчивым или плохо восприимчивым к лечению антителом против ЕrbВ2, и где указанный способ предусматривает введение млекопитающему терапевтически эффективного количества конъюгата "антитело-лекарственное средство" по любому из пп.33-64 или его фармацевтически приемлемой соли.
91. Применение конъюгата «антитело-лекарственное средство» по любому из пп.33-64 или его фармацевтически приемлемой соли в производстве лекарственного средства для лизиса или ингибирования пролиферации опухолевых клеток или раковых клеток.
92. Применение конъюгата «антитело-лекарственное средство» по любому из пп.33-64 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения гиперпролиферативного нарушения.
93. Применение по п.92, где гиперпролиферативное нарушение представляет собой рак, выбранный из группы, состоящей из рака молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почек, толстой кишки, ободочной кишки, щитовидной железы, поджелудочной железы, предстательной железы и мочевого пузыря.
94. Применение по п.92, где рак представляет собой рак молочной жедезы.
95. Применение по п.92, где рак представляет собой лимфому.
96. Соединение, имеющее формулу:
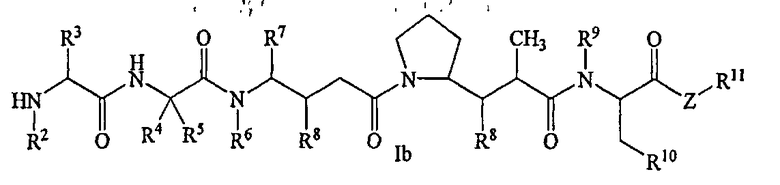
где R2 выбран из группы, включающей -Н и С1-С8алкил;
R3 выбран из группы, включающей -Н и С1-С8алкил;
R4 выбран из группы, включающей -Н и С1-С8алкил;
где R5 выбран из группы, включающей Н и метил;
R6 выбран из группы, включающей -Н и С1-С8алкил;
R7 выбран из группы, включающей -Н и С1-С8алкил;
R8 представляет собой O-(С1-С8алкил);
R9 выбран из группы, включающей -Н и С1-С8алкил;
R10 представляет собой С6-С10арил;
Z представляет собой -NH-;
R11 выбран из группы, включающей -Н, С1-С20алкил, С6-С10арил и -(R13O)m-R14;
m равно целому числу от 1 до 1000;
R13 представляет собой -С2-С8-алкил;
R14 представляет собой -Н или С1-С8алкил;
или его фармацевтически приемлемая соль.
97. Соединение, имеющее формулу:
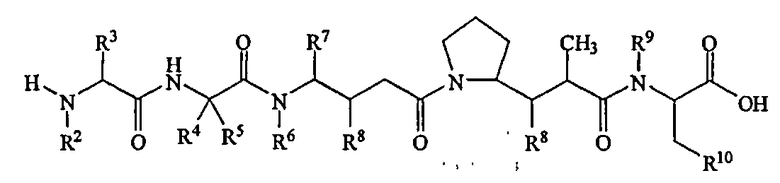
где независимо в каждом положении:
R2 выбран из группы, включающей -Н и -С1-С8алкил;
R3 выбран из группы, включающей -Н и -С1-С8алкил;
R4 выбран из группы, включающей -Н и =C1-С8алкил;
где R5 выбран из группы, включающей Н и метил;
R6 выбран из группы, включающей -Н и -С1-С8алкил;
R7 выбран из группы, включающей -Н и -С1-С8алкил;
R8 представляет собой -О-(С1-С8алкил);
R9 выбран из группы, включающей -Н и -С1-С8алкил;
R10 представляет собой С6-С10арил;
или его фармацевтически приемлемая соль.
98. Соединение, имеющее формулу:
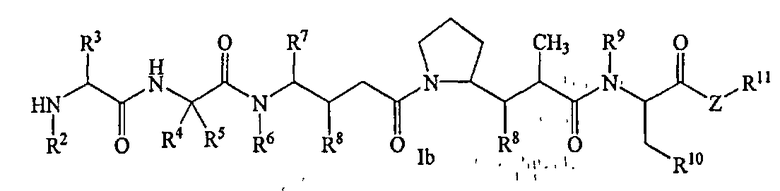
где R2 выбран из группы, включающей -Н и С1-С8алкил;
R3 выбран из группы, включающей -Н и С1-С8алкил;
R4 выбран из группы, включающей -Н и С1-С8алкил;
где R5 выбран из группы, включающей -Н и метил;
R6 выбран из группы, включающей -Н и -С1-С8алкил;
R7 выбран из группы, включающей -Н и -С1-С8алкил;
R8 представляет собой -O-(С1-С8алкил);
R9 выбран из группы, включающей -Н и -С1-С8алкил;
R10 представляет собой С6-С10арил;
Z представляет собой -О-;
R11 выбран из группы, включающей -Н, С1-С20алкил, С6-С10арил и -(R13O)m-R14;
m равно целому числу от 1 до 1000;
R13 представляет собой -С2-С8-алкил;
R14 представляет собой -Н или С1-С8алкил;
или его фармацевтически приемлемая соль.
99. Соединение по любому из пп.96-98 или его фармацевтически приемлемая соль в выделенной и очищенной форме.
100. Конъюгат «антитело-лекарственное средство» по п.33, имеющий формулу:
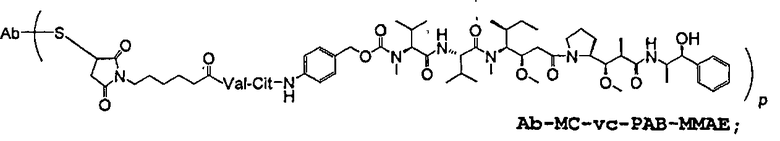
или его фармацевтически приемлемая соль, где Val представляет собой валин, и Cit представляет собой цитруллин.
101. Конъюгат «антитело-лекарственное средство» по п.33, имеющий формулу:
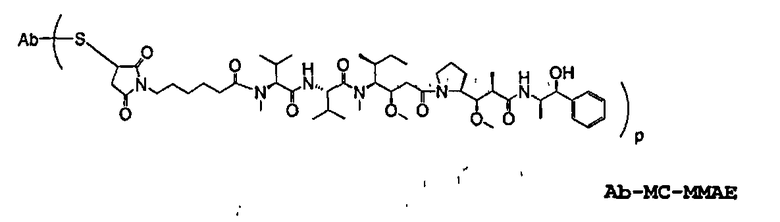
или его фармацевтически приемлемая соль.
102. Конъюгат «антитело-лекарственное средство» по п.33, имеющий формулу:
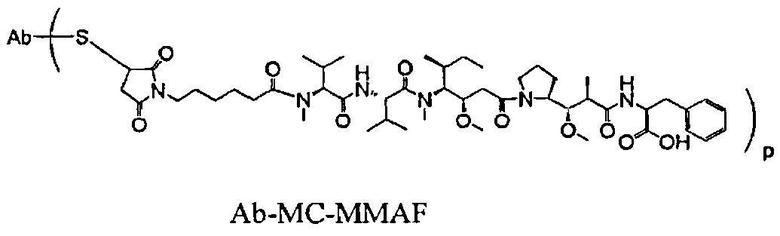
или его фармацевтически приемлемая соль.
103. Способ по п.67, где рак представляет собой рак, выбранный из группы, включающей рак молочной железы, яичников, почек, предстательной железы и печени.
104. Способ по п.67, где рак представляет собой гемопоэтический рак.
105. Способ по п.104, где гемопоэтический рак представляет собой неходжкинскую лимфому.
106. Конъюгат «антитело-лекарственное средство» по п.23, где антитело связано с CD70.
107. Соединение по любому из пп.1 и 96-98 или его фармацевтически приемлемая соль, где каждый R2 и R6 представляет собой метил, и R9 представляет собой -Н.
108. Конъюгат по любому из пп.4-20 и 22 или его фармацевтически приемлемая соль, где каждый R2 и R6 представляет собой метил, и R9 представляет собой -Н.
109. Соединение по любому из пп.1 и 96-98 или его фармацевтически приемлемая соль, где каждый R2 и R6 представляет собой метил, R5 представляет собой -Н, R7 представляет собой втор-бутил, в каждом случае R8 представляет собой -ОСН3, и R9 представляет собой -Н.
110. Конъюгат по любому из пп.4-20, 22 и 24 или его фармацевтически приемлемая соль, где каждый R2 и R6 представляет собой метил, R5 представляет собой -Н, R7 представляет собой втор-бутил, в каждом случае R8 представляет собой -ОСН3, и R9 представляет собой -Н.
111. Конъюгат «антитело-лекарственное средство» по п.6, имеющий формулу:
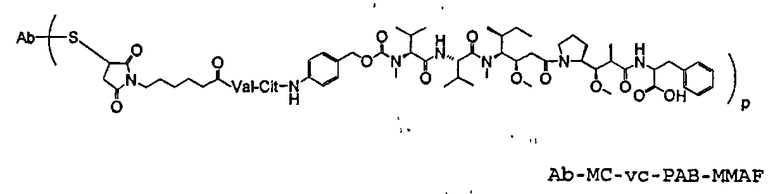
или его фармацевтически приемлемая соль, где Ab представляет собой антитело, Val представляет собой валин, и Cit представляет собой цитруллин.
112. Конъюгат «антитело-лекарственное средство» по п.6, имеющий формулу:
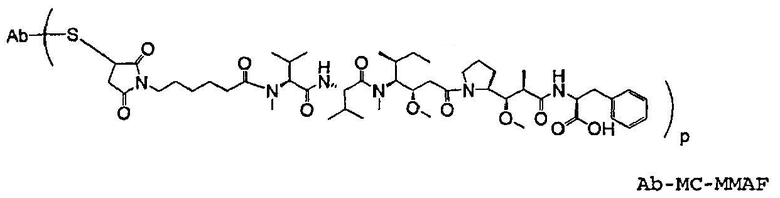
или его фармацевтически приемлемая соль, где Ab представляет собой антитело, Val представляет собой валин, и Cit представляет собой цитруллин.
113. Конъюгат «антитело-лекарственное средство» по п.9 или его фармацевтически приемлемая соль, где p равно от 1 до 4.
114. Конъюгат «антитело-лекарственное средство» по п.9 или его фармацевтически приемлемая соль, где p равно от 2 до 8.
115. Конъюгат по любому из пп.33-42, 44, 46-49, 51, 53-55, 57-62 и 64 или его фармацевтически приемлемая соль, где R2 и R6 каждый представляет собой метил, и R9 представляет собой -Н.
116. Конъюгат по любому из пп.33-42, 44, 46-49, 51, 53-55, 57-62 и 64 или его фармацевтически приемлемая соль.
117. Соединение по любому из пп.1, 96 и 98, или его фармацевтически приемлемая соль, где R11 выбран из группы, включающей Н, С1-С20алкил и (R13O)m-R14.
118. Конъюгат по любому из пп.4-20, 22 и 24, или его фармацевтически приемлемая соль, где R11 выбран из группы, включающей Н, С1-С20алкил и (R13O)m-R14.
| US 5767237 A, 16.06.1998 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 2004032828 A2, 22.04.2004 | |||
| WO 2002088172 A2, 30.04.2002 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| DORONINA S.О | |||
| ET AL | |||
| Development of potent monoclonal antibody auristatin conjugates for cancer therapy | |||
| NATURE BIOTECHNOLOGY | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| FRANCISCO J.A | |||
| ET AL | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2012-04-20—Публикация
2004-11-05—Подача