Предлагаемое изобретение относится к области биоорганической и медицинской химии, в частности к способу получения нового потенциально биологически активного производного бетулоновой кислоты - метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты, имеющего формулу (1). Соединение 1 представляет собой метиловый эфир бетулоновой кислоты, содержащей у углеродного атома C-2 спироциклопентановый фрагмент с вицинальными (цис-, трансконфигурация) CH2NO2- и CH2Cl-заместителями.
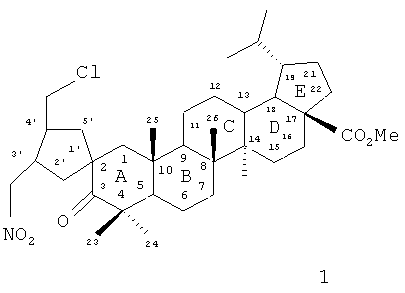
Пентациклические тритерпеноиды лупанового ряда (бетулин, бетулоновая и бетулиновая кислоты) составляют очень важный для медицинской химии класс соединений с широким спектром биологического и фармакологического действия. Особый интерес к этим соединениям вызван их противоопухолевыми и противовирусными анти-ВИЧ свойствами [Г.А.Толстиков, О.Б.Флехтер, Э.Э.Шульц, Л.А.Балтина, А.Г.Толстиков. Химия в интересах устойчивого развития. 2005, 13, 1-30; О.Б.Флехтер, Е.И.Бореко, Л.Р.Нигматуллина, Е.В.Третьякова, Н.И.Павлова, Л.А.Балтина, С.Н.Николаева, О.В.Савинова, В.Ф.Еремин, Ф.З.Галин, Г.А.Толстиков. Биоорган. химия. 2004, 30, 89-98]. На сегодняшний день наряду с нативными лупановыми терпеноидами все большее применение получают их производные, синтезированные трансформацией функциональных групп при углеродных атомах C-3, C-17 и C-20 или структурной модификацией колец терпенового остова. Синтетические трансформации бетулоновой и бетулиновой кислот и систематические исследования новых соединений по взаимосвязи структура-активность позволили получить вещества, превосходящие по своей фармакологической значимости исходные терпеноиды [P.Yogeeswari, D.Sriram. Current Medicinal Chemistry. 2005, 12, 657-666; R.Mukherjee, V.Kumar, S.K.Srivastava, S.K.Agarwal, A.C.Burman. Anti-Cancer agents in Med. Chem. 2006, 6, 271-279]. Так, структурная модификация бетулоновой кислоты и ее производных с формированием в кольце A 2-циано-1,3-енонового фрагмента привела к открытию группы перспективных соединений с более выраженными по сравнению с бетулиновой и бетулоновой кислотами противораковыми и противовоспалительными свойствами [T.Honda, K.T.Liby, X.Su, Ch.Sundararajan, Y.Honda, N.Suh, R.Risingsong, Ch.R.Williams, D.B.Royce, M.B.Sporn, G.W.Gribble. Bioorg. Med. Chem. Lett., 2006, 15, №16(24), 6306-6309; Y-J.You, Y.Kim, N-H.Nam, B-Z.Ahn. Bioorg. Med. Chem. Lett., 2003, 13, 3137-3140]. О представителях лупановых тритерпеноидов, содержащих в кольце A спироциклические группы, в литературе не сообщалось. Вместе с тем наличие спирофрагментов в молекулах различных природных и синтетических биологически активных веществ оказывает существенное влияние на их биологические свойства [D.L.Wright, J.P.Schulte II, М.А.Page. Org. Lett. 2000, 2, №13, 1847-1850; G.Lesma, N.Landoni, T.Pilati, A.Sacchetti, A.Silvani. J.Org. Chem. 2009, 74, 8098-8105; Y.Yamamoto, T.Hashimoto, K.Hattori, M.Kikuchi, H.Nishiyama. Org. Lett. 2006, 8, №16, 3565-3568; J.C.Hodges, W.Wang, F.Riley. J. Org. Chem. 2004, 69, 2504-2508].
При конструировании в молекуле спирогруппы часто используют субстраты с геминальными диаллильными заместителями, которые легко вступают в реакцию радикальной циклоизомеризации [J.C.Tripp, C.H.Schiesser, D.P.Curran. J. Am. Chem. Soc. 2005, 127, 5518-5527; T.Taniguchi, H.Ishibashi. Org. Lett. 2010, 12, №1, 124-126] или циклоизомеризации под действием комплексов переходных металлов [Y.Yamamoto, Y.Nakagai, N.Ohkoshi, K.Itoh. J. Am. Chem. Soc. 2001, 123, 6372-6380; S.Okamoto, T.Livinghouse, Organometallics. 2000, 19, №8, 1449-1451; S.Okamoto, T.Livinghouse. J. Am. Chem. Soc. 2000, 122, 1223-1224]. Особенно интересны трансформации таких соединений с образованием спироциклов в присутствии катализаторов Шрока или Граббса [D.L.Wright, J.P.Schulte II, M.A.Page. Org. Lett. 2000, 2, №13, 1847-1850; M.K.Gurjar, S.V.Ravindranadt, K.Sankar, S.Karmakar, J.Cherian, M.S.Chorghade. Org. Biomol. Chem. 2003, 1, 1366-1373].
Так, в работе [M.K.Gurjar, S.V.Ravindranadt, K.Sankar, S.Karmakar, J.Cherian, M.S.Chorghade. Org. Biomol. Chem. 2003, 1, 1366-1373] предложен способ получения спироциклопентильных производных, в частности 3-деокси-1,2:5,6-ди-O-изопропилиден-α-D-рибо-гексафураноза-3-спиро-3-циклопентена (2) воздействием на 3-деокси-1,2:5,6-ди-O-изопропилиден-3,3-C-диаллил-α-D-рибогексафуранозу (3) катализатором Граббса в CH2Cl2 при комнатной температуре по схеме:
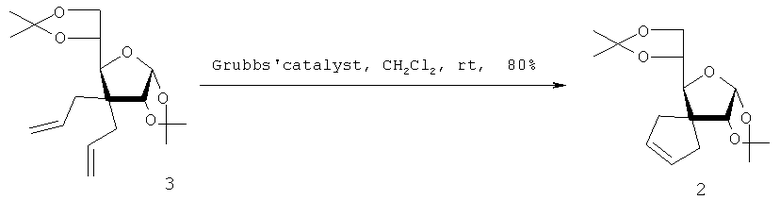
С использованием этого способа были успешно получены моно- и бис-спироциклопентенилзамещенные углеводы и спироциклопентенилпроизводные пролина. Однако этот способ предполагает применение дорогостоящего Ru-содержащего катализатора.
В кратком сообщении описана радикальная нитроциклизация ациклических 1,6-диенов, в частности производного малоновой кислоты 4 в присутствии Fe(NO3)3·9H2O, FeCl3, в ТГФ при нагревании с получением смеси соединений 5 и 6 [T.Taniguchi, H.Ishibashi. Org. Lett. 2010, 12, №1, 124-126].
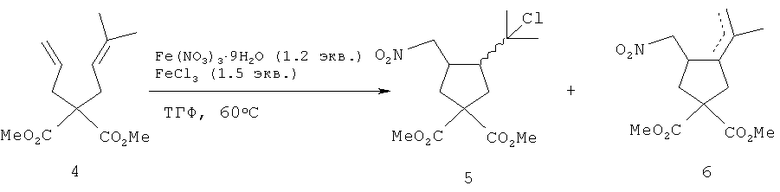
В реакции использованы нетоксичные доступные соли железа, продукты циклизации получены с хорошим выходом. Однако способ был использован только для синтеза замещенных циклопентанов. О возможности применения этого способа для получения спироциклов, в том числе спироциклопентановых производных лупановых терпеноидов, в работе не сообщалось.
Предлагается способ получения метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты (1).
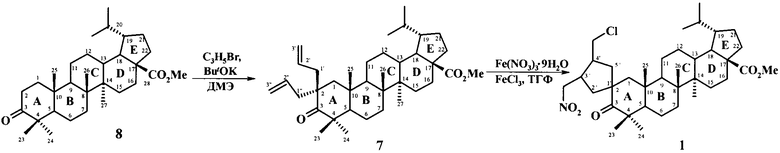
Предлагаемый способ получения соединения 1 заключается в получении на первой стадии метилового эфира 2,2-диаллил-3-оксолупан-28-овой кислоты (ДБК) 7 путем взаимодействия метилдигидробетулоната (БК) 8 с большим мольным избытком трет-бутилата калия (ButOK) и аллила бромистого при мольном соотношении реагентов - БК: ButOK: аллил бромид = 1:3-4 (преимущественно 4):2, в диметоксиэтане (ДМЕ) при комнатной температуре с последующим выделением и очисткой продукта 7 методом колоночной хроматографии на SiO2. На второй стадии получали целевой метиловый эфир 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты 1 путем радикальной циклоизомеризации продукта 7 под действием Fe(NO3)3·9Н2O, FeCl3, при мольном соотношении соединения 7 и солей железа - ДБК: Fe(NO3)3·9H2O: FeCl3 = 1:1.2:1.5 при кипячении реагентов в тетрагидрофуране (ТГФ) в течение 3-7 часов, преимущественно 3 часа, с последующей очисткой продукта 1 методом колоночной хроматографии на SiO2. Выход соединения 1 в расчете на метилдигидробетулонат 8 составил 40%. Бетулоновую кислоту получали по известному способу [Г.А.Толстиков, М.И.Горяев, Х.О.Ким, Р.А.Хегай. Журн. прикл. химии, 1967, 40, 920-922] с последующим ее гидрированием [L.Pohjala, S.Alakurtti, Т.Ahola, J.YliKauhaluoma, P.Tammela. J. Nat. Prod. 2009, 72, 1917-1926] и диазотированием до метилового эфира 8 по общему методу [К.Вейгант, Г.Хильгетаг. Методы эксперимента в органической химии. - М.: Химия, 1969, 548].
Преимущества предлагаемого способа
Получены новые производные пентациклических терпеноидов лупанового ряда, содержащие в кольце A геминальный диаллильный заместитель или спироциклопентановую группу.
Способ отличается селективностью, простотой проведения эксперимента и применением недорогих, экологичных и нетоксичных реагентов Fe(NO3)3·9H2O, FeCl3, не приводящих к образованию вредных и побочных продуктов.
Изобретение поясняется примерами
Пример 1. Получение метилового эфира 2,2-диаллил-3-оксолупан-28-овой кислоты (7) в присутствии 4-кратного избытка ButOK.
При перемешивании к раствору 0.10 г (0.20 ммоль) соединения 8 в 2.5 мл сухого ДМЭ при комнатной температуре прибавили 0.09 г (0.85 ммоль) OKt-Bu. Через 1 час прибавили раствор аллилбромид 0.05 г (0.40 ммоль) в 1 мл сухого ДМЭ. Реакционную смесь перемешивали еще 2 ч (контроль ТСХ), затем добавили 2 мл H2O и экстрагировали EtOAc (4×10 мл). Объединенные EtOAc экстракты сушили MgSO4. Остаток упарили и хроматографировали на колонке SiO2 (элюент гексан-EtOAc, 30→1). Выход 0.07 г (65%) соединения 7, бесцветные кристаллы т.пл. 180-182°C (EtOH), [α]D 20+12.80° (с 3.70, CHCl3). Найдено (%): C, 80.07; H, 10.15. C37H58O3. Вычислено (%): C, 80.67; H, 10.61. ИК-спектр, ν/см-1: 1720 (C=O), 1750 (COOMe). Спектр ЯМР 1H (δ, м.д., J/Гц): 0.70, 0.94, 1.00, 1.08, 1.16 (все c, по 3H, H(26), H(27), H(24), H(25), H(23)); 0.77, 0.87 (оба д, по 3H, H(30), H(29), J=6.4, J=6.8); 1.08 (м, 1Н, Ha(12)); 1.20 (м, 1H, Ha(15); 1Н, Ha(21)); 1.25 (м, 1Н, Ha(11); 1Н, Ha(22)); 1.38 (м, 1Н, Нб(15); 1Н, Hа(16); 1Н, H(9)); 1.40 (м, 2Н, H(7)); 1.43 (м, 2Н, H(6)); 1.49 (м, 1Н, Нб(11)); 1.65 (м, 1Н, H(5); 1Н, Н(18)); 1.73 (м, 1Н, Нб(12)); 1.82 (м, 1Н, Н(20)); 1.83 (м, 1Н, Нб(21); 1H, Нб(22)); 2.11 (д, 2Н, H(1), J=16.0); 2.21 (м, 1Н, H(13)); 2.25 (м, 1H, Н(19); 1Н, Нб(16)); 2.25 (м, 2Н, Hа(1'), Hа(1'')); 2.44 (дд, 2Н, Нб(1'), Нб(1''), J=14.8, 6.0); 3.67 (с, 3H, ОМе); 5.01-5.09 (м, 4Н, Н(3'), H(3'')); 5.58, 5.71 (оба м, 2Н, H(2'), H(2'')). Спектр ЯМР 13С (δ, м.д.): 14.57 (C(30)); 14.69 (C(27)); 15.38 (C(26)); 17.34 (C(25)); 20.26 (C(6)); 21.78 (C(11)); 22.75 (C(29)); 22.95 (C(24)); 23.19 (C(12)); 27.02 (C(20)); 29.62 (C(15)); 29.77 (C(23)); 30.54 (C(21)); 31.99 (C(16)); 33.09 (C(7)); 36.72 (C(10)); 37.29 (C(22)); 38.27 (C(13)); 40.52 (C(8)); 42.10 (C(1'')); 42.64 (C(14)); 44.14 (C(1')); 46.18 (C(2)); 46.79 (C(19)); 48.69 (C(4)); 48.86 (C(18)); 49.51 (C(9)); 50.64 (C(1)); 51.19 (OMe); 51.61 (C(5)); 56.99 (C(17)); 118.27 (C(3'')); 118.38 (C(3')); 133.39 (C(2')); 134.89 (C(2'')); 176.82 (C(28)); 219.79 (C(3)). Масс-спектр, m/z 573.51 [M+Na]+, 589.45 [M+K]+. C37H58O3.
Пример 2. Получение метилового эфира 2,2-диаллил-3-оксолупан-28-овой кислоты (7) в присутствии 3-кратного избытка ButOK.
При перемешивании к раствору 0.10 г (0.21 ммоль) соединения 8 в 2.5 мл сухого ДМЭ при комнатной температуре прибавили 0.07 г (0.63 ммоль) KOt-Bu. Через 1 час прибавили раствор аллилбромид 0.05 г (0.40 ммоль) в 1 мл сухого ДМЭ. Реакционную смесь перемешивали еще 2 ч (контроль ТСХ), затем добавили 2 мл H2O и экстрагировали EtOAc (4×10 мл). Объединенные EtOAc экстракты сушили MgSO4. Остаток упарили и хроматографировали на колонке SiO2 (элюент гексан-EtOAc, 30→1). Выход 0.05 г (45%) соединения 7.
Пример 3. Получение метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты (1) при кипячении в течение 3 ч.
К раствору 0.10 г (0.18 ммоль) соединения 6 в 3 мл ТГФ при перемешивании добавили 0.04 г (0.27 ммоль) FeCl3 и 0.09 г (0.22 ммоль) Fe(NO3)3·9H2O и кипятили 3 ч (контроль ТСХ). После охлаждения реакционную массу разбавили EtOAc (5 мл), отфильтровали, остаток упарили и хроматографировали на колонке SiO2 (элюент CHCl3) выделили смесь диастереомеров 0.07 г (63%), повторная хроматография на SiO2 (элюент гексан: EtOAc, 30→1) позволила получить индивидуальное соединение 1 с выходом 50%. Белые кристаллы т.пл. 160-162°C (EtOH), [α]D 20+30.30° (с 1.12, CHCl3). Найдено (%): C, 70.03; H, 9.72; С1, 5.66; N, 2.52. C37H58ClNO5. Вычислено (%): C, 70.28; H, 9.25; С1, 5.61; N, 2.22. ИК-спектр, ν/см-1: 1760 (С=O). Спектр ЯМР 1H (δ, м.д., J/Гц): 0.71, 0.95, 0.99, 1.10, 1.12 (все c, по 3H, H(25), H(26), H(27), H(24), H(23)); 0.77, 0.88 (оба д, по 3H, H(30), H(29), J=6.0); 1.18 (м, 1Н, Ha(15)); 1.19 (м, 1Н, Hа(21)); 1.22 (м, 1Н, Hа(12)); 1.24 (м, 1Н, Hа(22)); 1.36 (м, 1Н, Hа(11)); 1.37 (м, 1Н, Hа(16); 1Н, Нб(15); 2Н, H(5)); 1.39 (м, 1Н, H(18)); 1.43 (м, 2Н, H(6)); 1.44 (м, 2Н, H(7)); 1.50 (д, 1Н, Hа(1), 2J=13.0); 1.51 (м, 1Н, Нб(11)); 1.56 (м, 1Н, H(9)); 1.60 (м, 1Н, Hа(2')); 1.73 (м, 1Н, Нб(12); 1Н, Hа(5')); 1.82 (м, 1Н, Нб(20); 1Н, Нб(21); 1Н, Нб(22)); 2.02 (м, 1Н, Нб(5')); 2.04 (д, 1Н, Нб(1), 2J=13.0); 2.24 (м, 1Н, H(19)); 2.25 (м, 1Н, Нб(16)); 2.27 (м, 1Н, H(13)); 2.43 (дд, 1Н, Нб(2'), 2J=13.0, 3J=8.0); 2.71 (секст, 1Н, Н(4'), 3J=8.0); 3.01 (секст, 1Н, H(3'), 3J=8.0); 3.53 (дд, 2Н, CH2Cl, 2J=14.0, 3J=7.0); 3.67 (с, 3H, ОМе); 4.46, 4.65 (оба дд, 2Н, CH2NO2, 2J=13.0, 3J=8.0). Спектр ЯМР 13C (5, м.д.): 14.53 (C(27)); 14.69 (C(30)); 15.50 (C(26)); 15.75 (C(25)); 20.36 (C(6)); 21.87 (C(11)); 22.56 (C(24)); 22.96 (C(29)); 27.02 (C(12)); 29.58 (C(21)); 29.69 (C(15)); 29.76 (C(20)); 30.25 (C(23)); 32.00 (C(16)); 33.08 (C(7)); 37.28 (C(22)); 37.97 (C(3')); 38.23 (C(13)); 40.46 (C(2)); 40.48 (C(8)); 42.66 (C(14)); 43.13 (C(4')); 44.13 (C(19)); 44.45 (CH2Cl); 45.00 (C(2')); 45.87 (C(4)); 48.10 (C(5')); 48.36 (C(5)); 48.83 (C(18)); 51.21 (OMe); 51.52 (C(10)); 53.21 (C(9)); 55.93 (C(1)); 56.98 (C(17)); 75.81 (CH2NO2); 176.81 (C(28)); 221.23 (C(3)). Масс-спектр, m/z 654.98 [M+Na]+, 670.96 [M+K]+. C37H58ClNO5.
Пример 4. Получение метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты (1) при кипячении в течение 7 ч.
К раствору 0.10 г (0.18 ммоль) соединения 6 в 3 мл ТГФ при перемешивании добавили 0.04 г (0.27 ммоль) FeCl3 и 0.09 г (0.22 ммоль) Fe(NO3)3·9H2O и кипятили 7 ч (контроль ТСХ). После охлаждения реакционную массу разбавили EtOAc (5 мл), отфильтровали, остаток упарили и хроматографировали на колонке SiO2 (элюент CHCl3), выделили смесь диастереомеров 0.04 г (32%) соединения 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3-ГИДРОКСИМИНОПРОИЗВОДНЫЕ 2,3-СЕКОЛУПАНОВОГО ТИПА, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА А И ВИЧ-1 | 2011 |
|
RU2475476C1 |
| СПОСОБ ПОЛУЧЕНИЯ (2RS)-2,5,7,8-ТЕТРАМЕТИЛ-2-[(4RS,8RS)-4,8,12-ТРИМЕТИЛТРИДЕЦИЛ]-ХРОМАН-6-ИЛ-N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-ГЛИЦИНАТА | 2008 |
|
RU2440366C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИПЕПТИДОВ ЛУПАНОВОГО РЯДА | 2007 |
|
RU2357973C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ | 2012 |
|
RU2551647C2 |
| Способ получения N-[3-оксо-20(29)лупен-28-оил]-ω-аминокислот | 2019 |
|
RU2684288C1 |
| Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина] | 2019 |
|
RU2694904C1 |
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ ВИРУСНОЙ ИНФЕКЦИИ | 2012 |
|
RU2612530C2 |
| ПРОИЗВОДНЫЕ 1-(4-БЕНЗИЛПИПЕРАЗИН-1-ИЛ)-3-ФЕНИЛПРОПЕНОНА И ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ РЕЦЕПТОРОВ ХЕМОКИНА (CCR-1) | 2003 |
|
RU2347782C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 3-АРИЛ-5-ХЛОРИЗОКСАЗОЛОВ | 2015 |
|
RU2637927C2 |
Изобретение относится к области биоорганической и медицинской химии, в частности к способу получения нового потенциально биологически активного производного бетулоновой кислоты - метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты. Соединение представляет собой метиловый эфир бетулоновой кислоты, содержащей у углеродного атома С-2 спироциклопентановый фрагмент с вицинальными (цис-, трансконфигурация) CH2NO2- и CH2Cl-заместителями. Способ его получения заключается в получении на первой стадии метилового эфира 2,2-диаллил-3-оксолупан-28-овой кислоты (ДБК) путем взаимодействия метилдигидробетулоната (БК) с большим мольным избытком трет-бутилата калия (ButOK) и аллила бромистого при мольном соотношении реагентов - БК: ButOK: аллил бромид = 1:3-4 (преимущественно 4):2, в диметоксиэтане при комнатной температуре с последующим выделением и очисткой полученного продукта методом колоночной хроматографии на SiO2, который затем подвергают радикальной циклоизомеризации под действием Fe(NO3)3·9H2O, FeCl3, при мольном соотношении 2,2-диаллилпроизводного и солей железа - ДБК: Fe(NO3)3·9H2O:FeCl3=1:1.2:1.5 при кипячении реагентов в тетрагидрофуране в течение 3-7 часов, преимущественно 3 часа, с последующей очисткой полученного метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты методом колоночной хроматографии на SiO2 хроматографии на SiO2. Выход соединения в расчете на метилдигидробетулонат составил 40%. Способ отличается селективностью, простотой проведения эксперимента и применением недорогих, экологичных и нетоксичных реагентов Fe(NO3)3·9H2O, FeCl3, не приводящих к образованию вредных и побочных продуктов. 4 пр.
Способ получения метилового эфира 3-оксо-3'-(нитрометил)-4'-(хлорметил)-спиро[лупан-2,1'-циклопентан]-28-овой кислоты формулы 1:
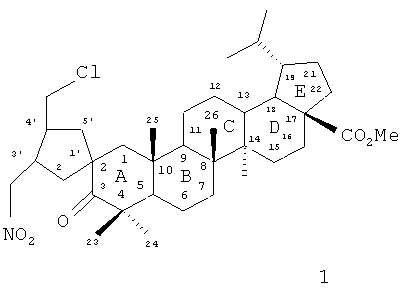
отличающийся тем, что метилдигидробетулонат (БК) подвергают взаимодействию с бромистым аллилом и избытком трет-бутилата калия при мольном соотношении реагентов БК : ButOK : аллил бромид, равном 1:3-4:2, в диметоксиэтане при комнатной температуре с последующим выделением и очисткой методом колоночной хроматографии на SiO2 метилового эфира 2,2-диаллил-3-оксолупан-28-овой кислоты (ДБК), который подвергают на следующей стадии циклоизомеризации под действием Fe(NO3)3·9H2O и FeCl3, при мольном соотношении реагентов ДБК : Fe(NO3)3·9H2O : FeCl3, равном 1:1,2:1,5, при кипячении реагентов в тетрагидрофуране в течение 3 ч с последующей очисткой соединения 1 методом колоночной хроматографии на SiO2.
| TANIGUCHI T | |||
| et al | |||
| Org | |||
| Lett | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ТОЛСТИКОВ Г.А | |||
| и др | |||
| - Журн | |||
| прикл | |||
| химии, 1967, 40, с.920-922 | |||
| ТОЛСТИКОВ Г.А | |||
| и др | |||
| Химия в интересах устойчивого развития, 2005, 13, с.1-30 | |||
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛОНОВОЙ КИСЛОТЫ | 2007 |
|
RU2333916C1 |
Авторы
Даты
2012-04-27—Публикация
2010-11-08—Подача