Изобретение относится к новым химическим соединениям класса А-секотритерпеноидов.
Известна высокая перспективность лупановых тритерпеноидов для медицины, подтвержденная результатами многочисленных исследований, касающихся синтеза и изучения биологической активности производных бетулина и бетулиновой кислоты [Бетулин и его производные. Химия и биологическая активность / Г.А.Толстиков, О.Б.Флехтер, Э.Э.Шульц, Л.А.Балтина, Г.А.Толстиков // Химия в интересах устойчивого развития. - 2005. - №1. - С.1-30; Терпеноиды ряда лупана - биологическая активность и фармакологические перспективы. II. Полусинтетические производные лупана / Т.Г.Толстикова, И.В.Сорокина, Г.А.Толстиков, А.Г.Толстиков, О.Б.Флехтер // Биоорганическая химия. - 2006. - Т.32. - №3. - С.291-307; Birch bark research and development / P.A.Krasutsky // Natural Product Reports - 2006. - Vol.23. - №6. - С.919-942; Pharmacological properties of the ubiquitous natural product betulin / S.Alakurtti, T.Mäkelä, S.Koskimies, J.Yli-Kauhaluoma // European Journal of Pharmaceutical Sciences. - 2006. - V.29. - №1. - P.1-13]. При этом существенная доля исследований затрагивает изучение ингибирующей активности полусинтетических тритерпеноидов в отношении оболочечных вирусов, в т.ч. ВИЧ-1, вирусов герпеса и гриппа. А-Секоинтермедиаты химической и микробной трансформации тритерпеноидов лупанового типа зачастую проявляют более высокую биологическую активность по сравнению с исходными циклическими соединениями [Preparation and antibacterial activity of di-, tri- and tetraoic acids derived from 3,4-secolupane / I.Valterová, J.I.Klinot, A.Vystrčil // Collection of Czechoslovak Chemical Communications - 1983. - V.48. - Р.649-661; Microbial transformations of two lupane-type triterpenes and anti-tumor-promoting effects of the transformation products / T.Akihisa, Y.Takamine, K.Yoshizumi, H.Tokuda, Y.Kimura, M.Ukiya, T.Nakahara, T.Yokochi, E.Ichiishi, H. Nishino // Journal of Natural Products. - 2002. - V.65. - P.278-282]. Известны 2,3-секотритерпеноиды, эффективно ингибирующие ВИЧ-1, вирусы герпеса простого, вируса везикулярного стоматита [Synthesis of dammarane-type triterpene derivatives and their ability to inhibit HIV and HCV proteases / Y.Wei, C.-M.Maa, M.Hattori // Bioorganic & Medicinal Chemistry - 2009. - V.17. - P.3003-3010; Синтез и противовирусная активность 2,3-секопроизводных бетулоновой кислоты / И.А.Толмачева, В.В.Гришко, Е.И.Бореко, О.В.Савинова, Н.И.Павлова // Химия природных соединения. - 2009. - №5. - С.566-568; Противовирусная активность лупановых и 19β,28-эпокси-18α-олеанановых 2,3-секотритерпеновых гидразонов / H.В.Галайко, И.А.Толмачева, В.В.Гришко, Л.В.Волкова, E.H.Перевозчикова, С.А.Пестерева // Биоорганическая химия. - 2010. - Т.36. - №4. - С.556-562].
Аналогами описываемых соединений по структуре являются не обладающий противовирусной активностью 28-метил-28-оксо-1-циано-2,3-секолуп-20(29)-ен-3-аль [Синтез лупановых и 19β,28-эпокси-18α-олеанановых 2,3-секопроизводных на основе бетулина / И.А.Толмачева, А.В.Назаров, О.А.Майорова, В.В.Гришко // Химия природных соединений. - 2008. - №5. - С.491-494] и 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овая кислота, проявляющая противовирусную активность в отношении вируса герпеса простого типа I в культуре клеток рабдомиосаркомы (ЕС50 0,9 мкг/мл) [Патент RU №2410390 2,3-Секо-производные бетулиновой кислоты. Опубл. 27.01.2011 БИ №3]. Однако высокий уровень цитотоксической активности (максимальная подавляющая концентрация - 12,5 мкг/мл) не позволяет рассматривать 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овую кислоту в качестве перспективного противовирусного агента.
Задачей изобретения является синтез новых тритерпеновых производных, проявляющих противовирусную активность, для расширения сырьевой базы противовирусных средств, а также перспективных в качестве ключевых интермедиатов для получения новых биологически активных соединений.
Для решения поставленной задачи синтезированы
1. Лупановые А-секотритерпеноиды общей формулы
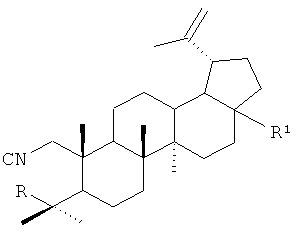 ,
,
где R=НСО, R1=CONHCH2CH2COOC2H5 или R=НСО, R1=тиазол-2-ил, R=R1=CONHCH2CH2COOC2H5, или R=CH2ОСОСН3, R1=СООСН3 или R=CH2OCOCH2CH2COOH, R1=СООСН3 или R=CH2OCOCH2C(СН3)2СООН, R1=СООСН3 или R=CH2OCOCH2C(СН3)2СН2СООН, R1=СООСН3.
2. Соединения по п.1, проявляющие ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С).
3. Соединение по п.1, где R=R1=CONHCH2CH2COOC2H5, проявляющее ингибирующую активность в отношении ВИЧ-1.
Получены соединения общей формулы, где R=НСО, R1=CONHCH2CH2COOC2H5 (соединение I); R=НСО, R1=тиазол-2-ил (соединение II); R=R1=CONHCH2CH2COOC2H5 (соединение III); R=CH2OCOCH3, R1=СООСН3 (соединение IV); R=CH2OCOCH2CH2COOH, R1=СООСН3 (соединение V); R=CH2OCOCH2C(СН3)2СООН, R1=СООСН3 (соединение VI) и R=CH2OCOCH2C(СН3)2СН2СООН, R1=СООСН3 (соединение VII), которые представляют собой мелкокристаллические вещества белого цвета.
Указанные соединения хорошо растворимы в хлороформе, дихлорметане, четыреххлористом углероде, этиловом спирте, бензоле, толуоле, диметилсульфоксиде, плохо растворимы в гексане и не растворимы в воде.
Синтез соединений I-III проводили способом, включающим взаимодействие хлорангидридов 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой (для соединений I и II) или 1-циано-2,3-секолуп-20(29)-ен-3,28-диовой (для соединения III) кислот в безводном дихлорметане с соответствующими аминопроизводными в присутствии триэтиламина. Синтез соединений IV-VII проводили путем этерификации метилового эфира 3-гидрокси-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты в присутствии 4-диметиламинопи-ридина и ангидрида уксусной (для соединения IV), янтарной (для соединения V), 2,2-диметилянтарной (для соединения VI) или 3,3-диметилглутаровой (для соединения VII) кислот.
Структура заявляемых соединений подтверждена методами ИК и ЯМР спектроскопии. Спектральные характеристики соединений I-VII приведены в таблице 1. ИК-спектры (ν, см-1) регистрировали на ИК-Фурье-спектрометре IFS 66/S Bruker (Германия) в пасте с вазелиновым маслом. Спектры 1Н- и 13С-ЯМР (δ, м.д.; J, Гц) записывали для растворов в CDCl3 на спектрометре Varian Mercury+ (США) при рабочей частоте прибора 300,0 МГц, внутренний стандарт - гексаметилдисилоксан. Пороговое значение температуры в точке плавления при скорости нагрева 1°С/мин определяли на приборе OptiMelt МРА100 (США). ТСХ-анализ проводили на пластинах Sorbfil (Россия) в системе гексан-этилацетат. Обнаружение веществ осуществляли обработкой 5% H2SO4 с последующим прогреванием пластины при 95-100°C в течение 2-3 мин. Для колоночной хроматографии использовали силикагель 60-200 µm марки Merck (Германия), элюент для каждого соединения подбирали индивидуально.
Заявляемые соединения проявляют противовирусную активность (изучена на культурах клеток) в отношении вирусов герпеса простого I типа (ВГП-1) и вируса иммунодефицита человека I типа (ВИЧ-1).
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами 1-9 и результатами исследований, приведенными в таблицах 1 и 2.
Пример 1. Получение этил-N-[1-циано-2,3-секолуп-20(29)-ен-3-аль-28-оил]-β-аланината (соединение I).
К раствору 1,1 ммоль 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты в 10 мл безводного хлористого метилена в атмосфере аргона добавляли 2,2 ммоль (0,2 мл) оксалилхлорида. Реакционную смесь перемешивали при комнатной температуре 6 ч. Растворитель отгоняли досуха в вакууме водоструйного насоса при температуре водяной бани 30°C. К остатку добавляли 10 мл безводного хлористого метилена, растворитель отгоняли. Процедуру повторяли трижды. К суспензии полученного таким образом хлорангидрида 2,3-секокислоты в 10 мл безводного дихлорметана в атмосфере аргона добавляли 1,2 ммоль гидрохлорида этилового эфира β-аланина и 2,4 ммоль (0,34 мл) триэтиламина. Реакционную смесь в течение 4-6 ч перемешивали при комнатной температуре. Контроль за ходом реакции осуществляли методом ТСХ. Растворитель упаривали, остаток очищали с помощью колоночной хроматографии на силикагеле. Выход 43%. Rf 0,7 (гексан:этилацетат - 7:3). Т. пл. 80,2°C (гексан:этилацетат).
Пример 2. N-[1-Циано-2,3-секолуп-20(29)-ен-3-аль-28-оил]-2-аминотиазол (соединение II) получали по методике, описанной в примере 1, добавляя триэтиламин в количестве 1,2 ммоль (0,17 мл). Выход 40%. Rf 0,2 (гексан:этилацетат - 7:3). Т.пл. 151,4°C (гексан:этилацетат).
Пример 3. Диэтил-N,N'-(1-циано-2,3-секолуп-20(29)-ен-3,28-диоил)ди-β-аланинат (соединение III) получали по методике, описанной в примере 1, добавляя триэтиламин в количестве 3,6 ммоль (0,51 мл). Выход 52%. Rf 0,3 (хлороформ-этилацетат - 10:1). Т.пл. 83,8° (гексан:этилацетат).  (с 0,6; хлороформ).
(с 0,6; хлороформ).
Пример 4. Получение метилового эфира 3-O-ацетил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты (соединение IV).
Смесь 0,5 ммоль метилового эфира 3-гидрокси-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты, 0,5 ммоль 4-диметиламинопиридина и 1,5 ммоль уксусного ангидрида кипятили в 5 мл безводного пиридина при 95°С. Ход реакции контролировали методом ТСХ. Реакционную смесь разбавляли 20%-ным раствором соляной кислоты и экстрагировали этилацетатом (3×20 мл). Органический слой сушили над безводным сульфатом магния, растворитель упаривали, остаток очищали с помощью колоночной хроматографии на силикагеле, элюент гексан:этилацетат - 7:1. Выход 71%. Rf 0,44 (гексан-этилацетат - 7:3). Т.пл. 150,7°C (гексан-этилацетат). 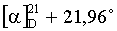 (с 0,5; хлороформ).
(с 0,5; хлороформ).
Пример 5. Метиловый эфир 3-O-сукцинил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты (соединение V) получали по методике, описанной в примере 4. Выход 27%. Rf 0,13 (гексан:этилацетат - 1:1). Т.пл. 61,9°C.
Пример 6. Метиловый эфир 3-O-3',3'-диметилсукцинил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты (соединение VI) получали по методике, описанной в примере 4. Выход 40%. Rf 0,25 (гексан:этилацетат - 7:3). Т.пл. 68,7°С.
Пример 7. Метиловый эфир 3-O-3',3'-диметилглутарил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты (соединение VII) получали по методике, описанной в примере 4. Выход 55%. Rf 0,25 (гексан:этилацетат - 1:1). Т.пл. 66,4°С.
Пример 8. Исследование противовирусной активности в отношении вируса герпеса простого I типа.
При проведении исследований использовали перевиваемую культуру клеток рабдомиосаркомы (RD) и вирус герпеса простого I типа (ВГП-1, штамм 1С). Монослойную культуру клеток RD, выращенную в лунках пластиковой 96-луночной панели, отмывали от ростовой среды, инфицировали 0,01-0,001 ТЦИД50/клетка ВГП-1 путем нанесения на клетки разведений вируссодержащей суспензии в объеме 0,1 мл на 1 ч при 37°C. Затем жидкость удаляли и клетки покрывали средой поддержки (среда DMEM), содержащей различные концентрации исследуемых веществ. Водонерастворимые вещества предварительно растворяли в 10% этаноле. При последующем разведении использовали DMEM. Содержание этанола в конечных концентрациях веществ для исследования не превышало 1%. На каждую концентрацию изучаемого вещества использовали по 2-4 лунки с культурой клеток, инфицированной одним разведением вируса. Для изучения противовирусных свойств каждого вещества использовали 3-4 разведения вируса. После 48 ч инкубации при 37°C регистрировали морфологические изменения монослоя клеток (цитопатическое действие (ЦПД) вируса, увеличение ×80). На основе наличия/отсутствия ЦПД вируса в лунках с разными концентрациями вещества вычисляли титр вируса. Первичным критерием противовирусного действия считали наличие различий в сравнении с контролем вируса. На основе значений титра вируса вычисляли среднеэффективную концентрацию вещества (ЕС50). Рассчитывали также отношение максимально переносимой концентрации (МПК) соединения к ЕС50. МПК определяли как максимальную концентрацию вещества, не оказывающую влияния на морфологию неокрашенной культуры клеток за период инкубации (48 ч).
Установлено, что соединения I-VII обладают способностью подавлять репродукцию ВГП-1 в диапазонах концентраций от МПК до 1/4 МПК со снижением титра вируса, достигающим у соединений V-VII более 2,2 lg ТЦИД50/мл. Вычисленные значения ЕС50, а также отношения МПК/ЕС50 приведены в таблице 2.
Пример 9. Методика исследования противовирусной активности в отношении ВИЧ-1.
Испытания проводили на перевиваемой суспензионной Т-лимфобластоидной линии клеток человека МТ-4 (плотность 4-5×105 клеток/мл) на питательной среде RPMI-1640 Sigma-Aldrich (США). В качестве инфекционного агента использовали высокорепликативный изолят ВИЧ-1zmb с титром 6,0 Ig ТЦД50. Определение наличия анти-ВИЧ активности проводили с помощью формазанового теста в МТТ-варианте. Исходный раствор препарата (5,0 мг/мл) готовили ex tempore путем растворения в 10% этаноле. Базовый раствор титровали в лунках 96-луночной панели с 5-кратным шагом, после чего в лунки последовательно вносили клетки и вирус (терапевтическая схема). Конечный объем реакционной смеси составлял 200 мкл/лунку. Контролями служили необработанные препаратом ВИЧ-инфицированные клетки (контроль вируса) и необработанные препаратом неинфицированные клетки (контроль клеток). Панели инкубировали в атмосфере, содержащей 5% CO2 при 37°C. Учет результатов осуществляли через 72 ч. В качестве позитивного контроля на анти-ВИЧ активность в каждой серии экспериментов использовали коммерческий препарат азидотимидина, который титровали параллельно с исследуемым образцом.
Методика базируется на определении интенсивности образования формазанового продукта при внесении в клеточную культуру реагента МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид). После 3-часовой экспозиции при 37°C надосадок удаляли, а образовавшийся формазановый продукт растворяли в диметилсульфоксиде, затем проводили измерение интенсивности развившегося окрашивания на спектрофотометре Plate Reader DAS A3 (Италия) при длине волны 550/630 нм. Результаты теста учитывали путем определения индекса защиты клеток, который в положительных случаях должен быть не ниже 50%. Вычисляли ЕС50 препарата и соотношение МПК/ЕС50, характеризующее широту спектра его нетоксических эффективных концентраций.
Установлено, что соединение III обладает способностью подавлять репродукцию ВИЧ-1 в диапазонах концентраций от 1/5 МПК до 1/125 МПК (таблица 2). Полученные результаты подтверждены с помощью методики непрямой иммунофлуоресценции.
Заявляемые соединения могут быть использованы для разработки противовирусных средств и в качестве ключевых интермедиатов для получения новых биологически активных соединений.
Данные ИК, ЯМР 1H и 13С спектров соединений I-VII
(6,39÷1,17)
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ ЕН-НИТРИЛА В А-ПЕНТАЦИКЛЕ | 2012 |
|
RU2496785C1 |
| 3-ГИДРОКСИМИНОПРОИЗВОДНЫЕ 2,3-СЕКОЛУПАНОВОГО ТИПА, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА А И ВИЧ-1 | 2011 |
|
RU2475476C1 |
| А-СЕКОТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ МЕТИЛКЕТОНА | 2013 |
|
RU2537840C1 |
| ТРИТЕРПЕНОВЫЕ АМИДЫ ЛУПАНОВОГО ТИПА С ФРАГМЕНТОМ 2-АМИНОБУТАН-1-ОЛА, ПРОЯВЛЯЮЩИЕ ВИРУСИНГИБИРУЮЩУЮ И ВИРУЛИЦИДНУЮ АКТИВНОСТЬ | 2017 |
|
RU2664804C1 |
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2682669C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2686100C1 |
| ИНГИБИТОР РЕПРОДУКЦИИ ВИЧ-1 И ВИРУСА ГРИППА А | 2012 |
|
RU2477134C1 |
| СЛОЖНЫЕ ЭФИРЫ НУКЛЕОЗИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2126417C1 |
| Замещенные спироандростен-17, 6'[1,3,4]тиадиазины, обладающие противовирусной активностью | 2021 |
|
RU2750639C1 |
Описываются лупановые А-секотритерпеноиды общей формулы
 ,
,
где R=HCO, R1=CONHCH2CH2COOC2H5 или R=HCO, R1=тиазол-2-ил, R=R1=CONHCH2CH2COOC2H5, или R=CH2OCOCH3, R1=СООСН3 или R=CH2OCOCH2CH2COOH, R1=СООСН3 или R=CH2OCOCH2C(СН3)2СООН, R1=СООСН3 или R=CH2OCOCH2C(СН3)2СН2СООН, R1=СООСН3 проявляют противовирусную активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С). Соединение с R=R1=CONHCH2CH2COOC2H5 сочетает противовирусную активность в отношении вируса герпеса с анти-ВИЧ активностью. Соединения перспективны для разработки противовирусных средств и в качестве ключевых интермедиатов для получения новых биологически активных соединений. 2 з.п.ф-лы, 9 пр., 2 табл.
1. Лупановые А-секотритерпеноиды общей формулы:
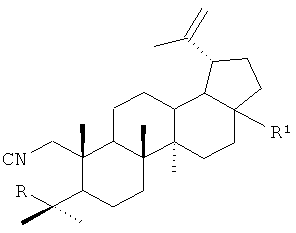
где R=НСО, R1=CONHCH2CH2COOC2H5 или R=НСО, R1=тиазол-2-ил, R=R1=CONHCH2CH2COOC2H5, или R=CH2OCOCH3, R1=СООСН3 или R=CH2OCOCH2CH2COOH, R1=СООСН3 или R=CH2OCOCH2C(СН3)2СООН, R1=СООСН3 или R=CH2OCOCH2C(СН3)2СН2СООН, R1=СООСН3.
2. Соединения по п.1, проявляющие ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С).
3. Соединение по п.1, где R=R1=CONHCH2CH2COOC2H5, проявляющее ингибирующую активность в отношении ВИЧ-1.
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| Y.Wei et al | |||
| Bioorganic & Med | |||
| Chem | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| ГАЛАЙКО Н.В | |||
| и др | |||
| Биоорг | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ТОЛМАЧЕВА И.А | |||
| и др | |||
| Хим | |||
| Природ | |||
| соед | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2012-12-20—Публикация
2011-10-07—Подача