Область техники
Изобретение относится к области органической химии, связанной с синтезом производных изоксазола, а именно к способам получения 3-арил-5-хлоризоксазолов общей формулы
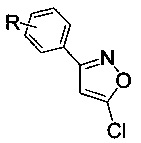
где R=Н, 3-Cl, 3-Br, 3-NO2, 4-Cl, 4-Br, 4-F, 4-NO2, 2-NO2,
которые могут быть использованы в лекарственных препаратах в качестве действующего вещества, проявляющего антинематодные, антигельминтные свойства [Gibbons, L.K. US Patent 3781438, 1973; J.B. Carr, H.G. Durham, D.K. Hass. J. Med. Chem., 1977, 20, 934], a также в качестве прекурсоров в органическом синтезе [Ф.А. Лахвич, Е.В. Королева, А.А. Ахрем, Химия гетероцикл. соедин., 1989, №4, 435-453; Baraldi P.G., Barco A., Benetti S., Pollini G.P., Simoni D. The Use of Isoxazoles as 1,3 Dicarbonyl Equivalents in Organic Synthesis. Synthesis. 1987, 857;  , M., Flasik, R., Khan, A.F., Spina, M., Mihovilovic, M.D., Stanetty, P. Eur. J. Org. Chem. 2006, 3283-3307].
, M., Flasik, R., Khan, A.F., Spina, M., Mihovilovic, M.D., Stanetty, P. Eur. J. Org. Chem. 2006, 3283-3307].
Уровень техники
Известен способ получения 3-арил-5-хлоризоксазолов, заключающийся во взаимодействии 3-арилизоксазолонов с 5 экв. оксохлорида фосфора в присутствии триэтиламина в течение 1.5 ч при 120°С [Gibbons, L.K. US Patent 3781438, 1973]. Недостатками данного способа являются труднодоступность исходных соединений и низкие выходы целевых продуктов.
Известен способ получения 3-(4-нитрофенил)-5-хлоризоксазола взаимодействием 1,1-дихлор-2-фенилциклопропана с нитратом натрия в серной кислоте при мольном соотношении субстрат:реагент:кислота 1:2:30 при 0°С [Сагинова Л.Г., Альхамдан М., Петросян B.C. Вестник Моск. Универ., Сер. 2. Химия. 1998, 39, №5, с. 339-343]. Недостатками данного способа являются ограниченность области применения реакции и невозможность получить незамещенный в ароматическом кольце 3-фенил-5-хлоризоксазол.
Известен способ получения 3-(4-нитрофенил)-5-хлоризоксазола в результате обработки 1,1-дихлор-2-фенилциклопропана смесью азотной и серной кислот при комнатной температуре [Lin, S.Т., Lin, L.Н., Yao, Y.F. Tetrahedron Lett. 1992, 33, 3155-3156]. Недостатками данного способа являются ограниченность области применения реакции циклопропанами, ароматическое кольцо которых содержит сильный электроноакцепторный заместитель (NO2, CN), и невозможность получить незамещенный в ароматическом кольце 3-фенил-5-хлоризоксазол.
Известен способ получения 3-арил-5-хлоризоксазолов с использованием аддукта нитрозилхлорида и триоксида серы для нитрозирования 2-арил-1,1-дихлорциклопропанов в хлористом метилене при комнатной температуре в течение 1-48 ч при мольном соотношении реагентов, равном 1:1.2-2 [О.Б. Бондаренко, А.Ю. Гаврилова, Д.С. Муродов, Н.С. Зефиров, Н.В. Зык. Журнал органической химии, 2013, 49, Вып. 2, стр. 198]. Недостатками данного способа являются длительность проведения реакции для соединений, содержащих акцепторные заместители в ароматическом кольце, и невысокие выходы целевых продуктов в случае донорных заместителей из-за протекающих побочных процессов.
Наиболее близким к предлагаемому изобретению по сущности и достигаемому результату является способ получения 3-арил-5-хлоризоксазолов взаимодействием 2-арил-1,1-дихлорциклопропанов с тетрафторборатом нитрозония в ацетонитриле при комнатной температуре [Lin, S.-T., Kuo, S.-H., Yang, F.-M. J. Org. Chem. 1997, 62, 5229-5231]. Недостатками данного способа являются высокая стоимость нитрозирующего реагента, а также плохая воспроизводимость результатов (необходимость более длительного времени для проведения реакции и более низкие выходы, не соответствующие заявленным в работе).
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка технологичного способа синтеза 3-арил-5-хлоризоксазолов из дешевых и доступных реагентов, который позволяет достигать высоких выходов целевых изоксазолов.
Новизной предлагаемого изобретения является применение в качестве нитрозирующего реагента в реакции с 2-арил-1,1-дихлорциклопропанами нитрозилсерной кислоты, являющейся дешевым, широко используемым в производственных схемах, коммерчески доступным реагентом.
Главным результатом является получение 3-арил-5-хлоризоксазолов с высокими выходами и высокой чистотой продукта.
Поставленный результат достигается заявленным способом получения замещенных 3-арил-5-хлоризоксазолов общей формулы
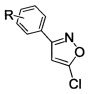
где R - H, 3-Cl, 3-Br, 3-NO2, 4-Cl, 4-Br, 4-F, 4-NO2, 2-NO2,
взаимодействием 2-арил-1,1-дихлорциклопропанов общей формулы
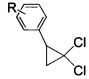
где R имеют указанные значения,
с нитрозирующим агентом, в качестве которого используют нитрозилсерную кислоту, при этом взаимодействие проводят в нитрометане при температуре 75-80°С. Предпочтительно смешивать 2.0-2.5 мас.% нитрозилсерной кислоты и 97.5-98.0 мас.% нитрометана, при этом на 1 моль 2-арил-1,1-дихлорциклопропана добавляют 2.5-3.0 моля нитрозилсерной кислоты, а время проведения реакции составляет 2,5-3,5 часа.
Сущностью способа является реакция присоединения нитрозоний катиона, генерируемого из нитрозилсерной кислоты в заявленных условиях проведения реакции, по ArC-CCl2 связи циклопропанового кольца с последующей гетероциклизацией в 3-арил-5-хлоризоксазол.
Реакция основана на ранее неизвестных свойствах нитрозилсерной кислоты. Реакция является неизвестной, так как в литературе отсутствуют сведения о взаимодействии нитрозилсерной кислоты с 2-арил-1,1-дихлорциклопропанами и родственными им соединениями. Взаимодействие становится возможным благодаря высокой реакционной способности нитрозилсерной кислоты, а также высокой лабильности циклопропанового кольца. Описанные в литературе реакции расщепления циклопропанового кольца под действием нитрозоний катиона могут протекать также в присутствии NaNO3/H2SO4, HNO3/H2SO4, NOCl⋅2SO3, NOBF4, но преимуществами данного способа синтеза 3-арил-5-хлоризоксазолов являются дешевизна и доступность нитрозилсерной кислоты, а также высокие выходы заявляемых соединений.
Проведенные исследования показали, что обязательным условием протекания реакции является использование в качестве растворителя нитрометана, при проведении реакции в хлористом метилене или хлороформе данное превращение не имело места. Для достижения высокого выхода образующихся 3-арил-5-хлоризоксазолов необходимо использовать 2.5-3.0 моля нитрозилсерной кислоты на 1 моль 2-арил-1,1-дихлорциклопропана, а также необходимо поддерживать температуру в ходе реакции в интервале 75-80°С. Несоблюдение этих условий приводит к значительному снижению выходов заявленных изоксазолов за счет неполной конверсии исходного 2-арил-1,1-дихлорциклопропана.
Строение синтезированных соединений подтверждено результатами ЯМР-спектроскопии, масс-спектрометрии и физико-химическими константами, для неописанных соединений приведены результаты элементного анализа.
Осуществление изобретения
Изобретение иллюстрируется следующими примерами.
Пример 1
Синтез 3-фенил-5-хлоризоксазола (1а)
В реакционную колбу с магнитной мешалкой помещали 0.056 г (0.3 ммоль) 2-фенил-1,1-дихлорциклопропана, 4 мл CH3NO2 и 0.100 г (0.8 ммоль) нитрозилсерной кислоты и перемешивали содержимое в течение трех часов на водяной бане при температуре 75-80°С. Затем реакционную смесь пропускали через колонку-фильтр с силикагелем, промывали хлороформом, раствор упаривали на роторном испарителе. Получали 0.042 г (77%) 1а в виде бесцветных кристаллов. Т.пл. 47-48°С (46-48°С [Gibbons, L.K. US Patent 3781438, 1973]). Rf 0.63 (EtOAc - петролейный эфир, 1:10). Спектр ЯМР 1Н, δ, м.д.: 6.45 с (1H), 7.45 м (3Н), 7.75 м (2Н). Спектр ЯМР 13С, δ, м.д.: 99.6 (НС=CCl), 126.6 (2СН), 128.2 (C1-is), 129.0 (2СН), 130.6 (С4), 155.1 (НС=CCl), 164.2 (C=N).
Пример 2
Синтез 3-фенил-5-хлоризоксазола (1а) при 20°С
Из 0.056 г (0.3 ммоль) 2-фенил-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты после взаимодействия в 4 мл CH3NO2 при 20°С в течение 48 ч в результате хроматографического разделения на колонке (SiO2 40/100, элюент - этилацетат/петролейный эфир, 1:10) выдели 0.035 г (63%) 2-фенил-1,1-дихлорциклопропана и 0.014 г (25%) 1а.
Пример 3
Синтез 3-фенил-5-хлоризоксазола (1а) при 50°С
Из 0.056 г (0.3 ммоль) 2-фенил-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты после взаимодействия в 4 мл CH3NO2 при 50°С в течение 3 ч в результате хроматографического разделения на колонке (SiO2 40/100, элюент - этилацетат/петролейный эфир, 1:10) выдели 0.026 г (47%) 2-фенил-1,1-дихлорциклопропана и 0.018 г (33%) 1а.
Пример 4
Синтез 3-фенил-5-хлоризоксазола (1а) при 75-80°С в течение 2 ч
Из 0.056 г (0.3 ммоль) 2-фенил-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты после взаимодействия в 4 мл CH3NO2 при 75-80°С в течение 2 ч в результате хроматографического разделения на колонке (SiO2 40/100, элюент - этилацетат/петролейный эфир, 1:10) выдели 0.011 г (20%) 2-фенил-1,1-дихлорциклопропана и 0.036 г (67%) 1а.
Пример 5
Синтез 3-(4-хлорфенил)-5-хлоризоксазола (1б)
Из 0.070 г (0.3 ммоль) 2-(4-хлорфенил)-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.61 г (95%) 1б в виде бесцветных кристаллов. Т.пл. 107°С (106-107°С [Gibbons, L.K. US Patent 3781438, 1973]). Rf 0.71 (EtOAc - петролейный эфир, 1:5). Спектр ЯМР 1Н, δ, м.д.: 6.46 с (1Н, НС=CCl), 7.43 д (2Н, СНар, 3J 8.3 Гц), 7.69 д (2Н, СНар, 3J 8.3 Гц). Спектр ЯМР 13С, δ, м.д.: 99.5 (НС=CCl), 126.6 (C-is), 127.9 (2СН), 129.3 (2СН), 136.7 (С-Cl), 155.4 (НС=CCl), 163.2 (C=N). Масс-спектр, m/z (Iотн, %): [M]+ 213 (48), 178 (100, [М-Cl]+), 150 (60, [М-Cl-СО]+), 123 (20, [М-Cl-СО-HCN]+), 111 (20, C6H4Cl+), 75 (23, С6Н3+).
Пример 6
Синтез 3-(4-хлорфенил)-5-хлоризоксазола (1б)
Из 0.070 г (0.3 ммоль) 2-(4-хлорфенил)-1,1-дихлорциклопропана и 0.057 г (0.45 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после хроматографического разделения на колонке (SiO2 40/100, элюент - этилацетат/петролейный эфир, 1:10) выдели 0.032 г (46%) 2-(4-хлорфенил)-1,1-дихлорциклопропана и 0.035 г (54%) 1б.
Пример 7
Синтез 3-(3-бромфенил)-5-хлоризоксазола (1в)
Из 0.079 г (0.3 ммоль) 2-(3-бромфенил)-1,1-дихлорциклопропана и 0.114 г (0.9 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.074 г (95%) 1в. Rf 0.48 (EtOAc - петролейный эфир, 1:10`). Спектр ЯМР 1Н, δ, м.д.: 6.48, с (1Н) 7.34 т (1H, С5Нар, 3J 7.9 Гц), 7.60 д.д.д (1H, С4,6 Нар, 3J 7.9, 4J 1.9, 4J 1.0 Гц), 7.68 д.д.д (1Н, С4,6 Нар, 3J 7.9, 4J 1.9, 4J 1.0 Гц), 7.91 тр (1Н, С2Нар, 4J 1.9 Гц) Спектр ЯМР 13С, δ, м.д.: 99.6 (НС=CCl), 123.1 (С-Br), 125.2 (СН), 129.6 (СН), 130.1 (C-is), 130.6 (СН), 133.6 (СН), 155.6 (НС=CCl), 163.0 (C=N).
Пример 8
Синтез 3-(3-нитрофенил)-5-хлоризоксазола (1 г)
Из 0.070 г (0.3 ммоль) 2-(3-нитрофенил)-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.057 г (85%) 1в в виде бесцветных кристаллов. Т.пл. 143°С (147°С [О.Б. Бондаренко, А.Ю. Гаврилова, Д.С. Муродов, Н.В. Зык, Н.С. Зефиров, Журн. Орган. химии, 2013, 49, 198]). Rf 0.64 (EtOAc - петролейный эфир, 1:5`). Спектр ЯМР 1Н, δ, м.д.: 6.62 с (1Н, НС=CCl), 7.69 т (1H, С5Нар, 3J 8.0 Гц), 8.15 д.т (1H, С4,6Нар, 3J 8.0, 4J 1.2 Гц), 8.33 д.д.д (1Н, С4,6Нар, 3J 8.0, 4J 1.2, 4J 2.0 Гц), 8.59 т (1Н, С2Нар, 4J 2.0 Гц). Спектр ЯМР 13С, δ, м.д.: 99.7 (НС=CCl), 121.7 (СН), 125.1 (СН), 129.9 (C-is), 130.3 (СН), 132.2 (СН), 148.7 (C-NO2), 156.3 (НС=CCl), 162.3 (C=N). ИК-спектр (пленка), ν, см-1: 1540, 1360 (NO2). Масс-спектр, m/z (Iотн, %): [М]+ 224 (21), 189 (100, М+-CI), 143 (75, M+-CI-NO2), 115 (14, M+-CI-NO2-СО), 88 (10), 76 (48), 63 (10), 50 (23), 28 (22). C9H5ClN2O3. Найдено, %: С 48.21; Н 2.34; N 12.31. C9H5ClN2O3. Вычислено, %: С 48.11; Н 2.23; N 12.47.
Пример 9
Синтез 3-(3-хлорфенил)-5-хлоризоксазола (1д)
Из 0.042 г (0.2 ммоль) 2-(3-хлорфенил)-1,1-дихлорциклопропана и 0.076 г (0.6 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.039 г (90%) 1д в виде бесцветных кристаллов. Спектр ЯМР 1Н, δ, м.д.: 6.40 с (1Н), 7.42 д (1Н, 3J 8.5 Гц), 7.46 тр (1H, 3J 8.5 Гц), 7.66 д (1Н, 3J 8.5 Гц), 7.77 с (1H).
Пример 10
Синтез 3-(4-бромфенил)-5-хлоризоксазола (1е)
Из 0.079 г (0.3 ммоль) 2-(4-бромфенил)-1,1-дихлорциклопропана и 0.114 г (0.9 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.057 г (8 5%) 1е в виде желтоватых кристаллов. Т.пл. 108°С. Rf 0.55 (EtOAc - петролейный эфир, 1:5). Спектр ЯМР 1Н, δ, м.д.: 6.48 с (1Н, НС-CCl), 7.63 д (2Н, СНар, 3J 8.8 Гц), 7.66 д (2Н, СНар, 3J 8.8 Гц). Спектр ЯМР 13С, δ, м.д.: 99.5 (НС=CCl), 125.0 (С-Br), 127.1 (C1-is), 128.1 (2СН), 132.3 (2СН), 155.5 (НС=CCl), 163.3 (C=N). Масс-спектр, m/z (Iотн, %): [M+] 257, 259 (33), 222, 224 (100, [М-Cl]+), 194, 196 (40, [М-Cl-СО]+), 154, 156 (16, [М-C3H2NOCl]+=[C6H3Br]+), 115 (49, [C6H4C2HN]+), 102 (34, [C6H4CN]+), 88 (29, [С6Н4С]+), 75 (76, [С6Н3]+), 63 (41, [С5Н3]+), 50 (83, [С4Н2]+). C9H5BrClNO. Вычислено: М 258.50.
Пример 11
Синтез 3-(4-фторфенил)-5-хлоризоксазола (1ж)
Из 0.500 г (2.4 ммоль) 2-(4-фторфенил)-1,1-дихлорциклопропана и 0.750 г (6.0 ммоль) нитрозилсерной кислоты в 15 мл CH3NO2 в условиях, описанных в примере 1 (75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.266 г (56%) 1ж в виде бесцветных кристаллов. Т.пл. 70-72°С. 1Н ЯМР (CDCl3), δ, м.д.: 6.48 с (1Н, НС=CCl), 7.18 т (2Н, СНаром, 3JH-H 8.8 Гц, 3JH-F 8.8 Гц), 7.77 д (2Н, СНаром, 3JH-H 8.3 Гц, 3JH-F 5.3 Гц). Спектр ЯМР 13С, δ, м.д.: 99.5 (НС=CCl), 164.3 д (FC=Capом 1J=211.4), 128.7 д (2СН 3JC-F=9.2), 116.2 д (2СН 2JC-F=22.1), 124.4 (Cis), 155.3 (ClC=СН), 162.8 (C=N). Найдено, %: С, 54.47, Н, 3.06, N, 6.89, C9H5ClNO. Вычислено, %: С, 54.71, Н, 2.55, N, 7.09.
Пример 12
Синтез 3-(4-нитрофенил)-5-хлоризоксазола (1з)
Из 0.07 г (0.3 ммоль) 2-(4-нитрофенил)-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.053 г (76%) 1з в виде желтоватых кристаллов. Т.пл. 170°С (169.9-171.3°С [Lin S.T., Lin L.N., Yao Y.F. Tetrahedron Lett. 1992, 33, 3155]). Rf 0.69 (EtOAc - петролейный эфир, 1:5). Спектр ЯМР 1H, δ, м.д.: 6.60 с (1Н, НС=CCl), 7.98 д (2Н, СНар, 3J 8.8 Гц), 8.36 д (2Н, СНар, 3J 8.8 Гц). Спектр ЯМР 13С, δ, м.д.: 99.9 (НС=ССl), 124.3 (2СН), 127.6 (2СН), 134.1 (C-is), 149.1 (C-NO2), 156.4 (НС=ССl), 162.3 (C=N).
Пример 13
Синтез 3-(2-нитрофенил)-5-хлоризоксазола (1и)
Из 0.07 г (0.3 ммоль) 2-(2-нитрофенил)-1,1-дихлорциклопропана и 0.100 г (0.8 ммоль) нитрозилсерной кислоты в условиях, описанных в примере 1 (4 мл CH3NO2, 75-80°С, 3 ч), после пропускания через колонку-фильтр и упаривания растворителя получали 0.065 г (93%) 1е в виде желтоватых кристаллов. Rf 0.38 (EtOAc - петролейный эфир, 1:7). Спектр ЯМР 1Н, δ, м.д.: 6.33 с (1Н, НС-ССl), 7.67-7.77 м (3Н, СНар), 8.07 д (1Н, СНар, 3J 8.6 Гц). Спектр ЯМР 13С, δ, м.д.: 102.1 (НС=ССl), 123.5 (C-is), 124.8 (СН), 131.2 (СН), 131.6 (СН), 133.3 (СН), 148.3 (C-NO2), 155.2 (НС=CCl), 161.9 (C=N). Найдено, %: С 48.04; Н 2.45; N 12.31. C9H5ClN2O3. Вычислено, %: С 48.11; Н 2.23; N 12.47.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3,5-ДИАРИЛИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2021 |
|
RU2801861C2 |
| 3-АРИЛ-5-ФТОРИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2684322C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНПРОИЗВОДНЫХ АРОМАТИЧЕСКИХ И ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2019 |
|
RU2711558C1 |
| Замещенные 4-(азол-1-илметил)-1-фенил-5,5-диалкилспиро-[2.5]октан-4-олы, способ их получения (варианты), фунгицидная и рострегуляторная композиции на их основе | 2016 |
|
RU2648240C1 |
| Способ получения 5-арил-4-тиоксо-3,4,5,6-тетрагидро-2H-пиридо[3,2-e][1,3]тиазин-7(8H)-онов | 2024 |
|
RU2831154C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1Н-БЕНЗО[F]ХРОМЕН-2-ИЛ(АРИЛ)КЕТОНОВ | 2015 |
|
RU2633368C2 |
| ФОТОХРОМНЫЕ ПОЛИМЕРЫ ДЛЯ ТРЕХМЕРНОЙ ОПЕРАТИВНОЙ ОПТИЧЕСКОЙ ПАМЯТИ | 2004 |
|
RU2345997C2 |
| ФОТОУПРАВЛЯЕМЫЕ ФОТОХРОМНЫЕ ЭЛЕКТРОЛЮМИНЕСЦИРУЮЩИЕ И ЭЛЕКТРОПРОВОДЯЩИЕ ПОЛИМЕРЫ ДЛЯ ФОТОНИКИ | 2004 |
|
RU2345998C2 |
| ЗАМЕЩЕННЫЕ 1-(1-ТРЕТ-БУТИЛ-1Н-ИМИДАЗОЛ-4-ИЛ)-1Н-1,2,3-ТРИАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2015 |
|
RU2591206C1 |
| Способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов | 2022 |
|
RU2792619C1 |
Изобретение относится к области органической химии, связанной с синтезом производных изоксазола, а именно к способу получения замещенных 3-арил-5-хлоризоксазолов общей формулы (I), где R - H, 3-Cl, 3-Br, 3-NO2, 4-Cl, 4-Br, 4-F, 4-NO2, 2-NO2. Способ осуществляют взаимодействием 2-арил-1,1-дихлорциклопропанов общей формулы (а), где R имеют указанные значения, с нитрозирующим агентом, в качестве которого используют нитрозилсерную кислоту. Взаимодействие проводят в нитрометане при температуре 75-80°С, при смешивании 2.0-2.5 мас.% нитрозилсерной кислоты и 97.5-98.0 мас.% нитрометана. При этом на 1 моль 2-арил-1,1-дихлорциклопропана добавляют 2.5-3.0 моля нитрозилсерной кислоты, время проведения реакции составляет 2,5-3,5 ч. Технический результат – получение 3-арил-5-хлоризоксазолов с высокими выходами и высокой чистотой продукта. 3 з.п. ф-лы, 13 пр.
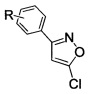 (I),
(I), 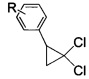 (а)
(а)
1. Способ получения замещенных 3-арил-5-хлоризоксазолов общей формулы
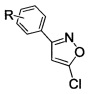
где R=H, 3-Cl, 3-Br, 3-NO2, 4-Cl, 4-Br, 4-F, 4-NO2, 2-NO2,
взаимодействием 2-арил-1,1-дихлорциклопропанов общей формулы
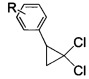
где R имеют указанные значения,
с нитрозирующим агентом, отличающийся тем, что в качестве нитрозирующего агента используют нитрозилсерную кислоту, при этом взаимодействие проводят в нитрометане при температуре 75-80°С.
2. Способ по п. 1, отличающийся тем, что смешивают 2.0-2.5 мас.% нитрозилсерной кислоты и 97.5-98.0 мас.% нитрометана.
3. Способ по п. 1, отличающийся тем, что на 1 моль 2-арил-1,1-дихлорциклопропана добавляют 2.5-3.0 моля нитрозилсерной кислоты.
4. Способ по п. 1, отличающийся тем, что время проведения реакции составляет 2,5-3,5 ч.
| БОНДАРЕНКО О.Б., ГАВРИЛОВА А.Ю.: "Превращение гем-дихлорарилциклопропанов в реакции с NOCl*2SO 3 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| КУЗНЕЦОВА Л.И | |||
| и др.: "Нитрозилсерная кислота в синтезе изоксазолов", ТРЕТЬЯ ВСЕРОССИЙСКАЯ НАУЧНАЯ КОНФЕРЕНЦИЯ (С МЕЖДУНАРОДНЫМ УЧАСТИЕМ): "УСПЕХИ СИНТЕЗА И КОМПЛЕКСООБРАЗОВАНИЯ", Тезисы докладов, Москва, Российский университет дружбы народов, 2014, с.201 | |||
| US 3781438 A1, 25.12.1973. | |||
Авторы
Даты
2017-12-08—Публикация
2015-12-14—Подача