Это изобретение относится к лиофилизированным инъецируемым фармацевтическим композициям полусинтетических алкалоидов vinca (барвинка), которые являются стабильными при комнатной температуре.
В общих чертах, клинический интерес к алкалоидам vinca возник примерно 40 лет назад. С тех пор эти соединения широко используются в качестве противораковых агентов.
Винбластин и винкристин впервые выделили из листьев Catharanthus roseus G. Don или Vinca rosea L. Эти алкалоиды представляют собой димеры, состоящие из двух индольных звеньев: катарантина и виндолина. Винбластин и винкристин впервые появились в продаже во Франции в 1963 и 1964 гг., соответственно, под торговыми названиями VELBE® и ONCOVIN®. Исследования синтеза, проведенные на винбластине, привели к получению виндезина, первого искусственного производного и источника фармацевтического препарата ELDISINE (1983).
Что касается Poitier и др., то им авторы изобретения обязаны вторым искусственным медицинским производным с бис-индольной структурой. Оно представляет собой винорелбин - молекулу, которая получена полусинтетическим путем на основе применения катарантина и виндолина и которая обладает мощными противоопухолевыми свойствами. Винорелбин впервые зарегистрирован во Франции в 1989 г. под торговым названием NAVELBINE® фирмой Pierre Fabre Medicament для лечения немелкоклеточного рака легкого, затем для лечения метастатического рака молочной железы в 1992 г. Пероральная форма была зарегистрирована во Франции в 2001 г.
Эти противораковые лекарственные средства имеются в форме либо готового к применению раствора (ONCOVIN®, NAVELBINE®), либо в порошковой форме (VELBE®, ELDISINE®). Они должны храниться в холодильнике при температуре от 2°C до 8°C во время транспортировки и хранения.
Несколько лет назад создали новое семейство посредством химических реакций в сверхкислотной среде. Полусинтетическое двухфтористое производное винфлунин находится в настоящее время на стадии клинической разработки.
Так же, как и винорелбин, винфлунин получают из ангидровинбластина, который сам получают в результате биомиметической реакции сочетания между катарантином и виндолином.
По причинам, относящимся к растворимости в воде, винфлунин образуется в форме водорастворимой соли. Например, дитартрат выделяют после лиофилизации водного раствора этой соли.
Винфлунина дитартрат представляет собой белый или практически белый порошок, который следует хранить при отрицательной температуре, ниже -15°C, в атмосфере инертного газа, такого как азот или аргон. Это верно также и для винорелбина дитартрата.
Заявка настоящего заявителя на патент Франции №2863891 ("Фармацевтическая композиция винфлунина для парентерального введения, получение и применение") сосредоточена на стабилизирующем эффекте растворения водорастворимой соли винфлунина в водной среде. Один из пунктов ее формулы изобретения относится к хорошей стабильности композиции в течение по меньшей мере 36 месяцев при 5±3°C.
Неожиданно это изобретение позволило стабилизировать водорастворимые соли винфлунина и винорелбина несмотря на то, что они находятся в порошкообразном состоянии. Поэтому стало возможным их хранение при комнатной температуре и не ниже -15°C, как упомянуто выше.
Это изобретение основано на стабильных препаратах лиофилизированных полусинтетических производных алкалоида vinca в присутствии по меньшей мере одного углевода, такого как моносахариды, восстановленные или невосстановленные, олигосахариды или полисахариды, такие как инулин, более предпочтительно на стабильных препаратах водорастворимых солей полусинтетических производных алкалоида vinca и еще более предпочтительно на стабильных препаратах лиофилизированных водорастворимых солей винфлунина и винорелбина в присутствии дисахаридов, в частности сахарозы, трегалозы или лактозы.
Относительное соотношение полусинтетических производных алкалоида vinca и углевода может варьировать от 1/1 до 1/20, в частности от 1/1 до 1/10 (мас./мас.).
Предпочтительно, стабильные препараты лиофилизированных полусинтетических производных алкалоида vinca в присутствии по меньшей мере одного углевода, такого как моносахариды, восстановленные или невосстановленные, олигосахариды или полисахариды, такие как инулин, могут содержать буферную систему с pH от 3 до 4, в частности, с pH, равным 3,5, с целью поддержания pH раствора, полученного после того, как лиофилизированный продукт перерастворяют в воде для инъецируемых препаратов при значении, которое увеличивает хорошую стабильность активного ингредиента.
В качестве неограничивающего примера эта буферная система состоит из уксусной кислоты и ацетата натрия, лимонной кислоты и цитрата натрия, винной кислоты и соды. Их молярность составляет от 0,005 М до 0,5 М, и в частности от 0,05 М до 0,2 М.
Нетоксичность этих исходных веществ при парентеральном введении делает возможным применение этих лиофилизированных продуктов в виде инъецируемых лекарственных средств при лечении рака.
Композиции, приведенные ниже в качестве неограничивающих примеров, и результаты по их стабильности, по сравнению с таковыми для исходного вещества, служат для иллюстрации данного изобретения.
Растворы, состав которых представлен в таблице 1 ниже, приготавливали, затем лиофилизировали.
Пример 1:
Использовали следующую технологию изготовления:
1) последовательно растворяют при перемешивании сахарозу и винфлунина дитартрат в основной части уксусной кислоты/0,1 М натрий-ацетатного буферного раствора, pH=3,5, необходимой для изготовления,
2) доводят до конечного объема уксусной кислотой/0,1 М натрий-ацетатным буферным раствором, pH=3,5, и полученный раствор гомогенизируют,
3) стерилизуют раствор путем фильтрации на гидрофильной 0,22 мкм поливинилиденфторидной мембране и распределяют в стеклянные пузырьки I типа,
4) осуществляют операции лиофилизации в следующих условиях:
замораживание продукта при -48°C,
первичная сушка при 0,100 мбар (10 Па) в течение 37 ч при скорости 0,03°C/мин,
вторичная сушка при 0,010 мбар (1 Па) в течение 16 ч при 20°C,
5) пузырьки закупоривают и завинчивают крышки.
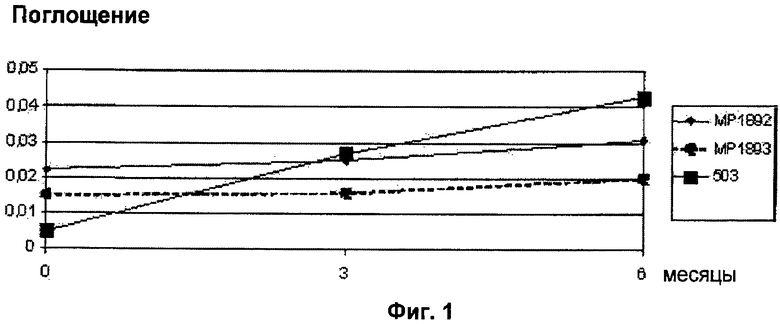
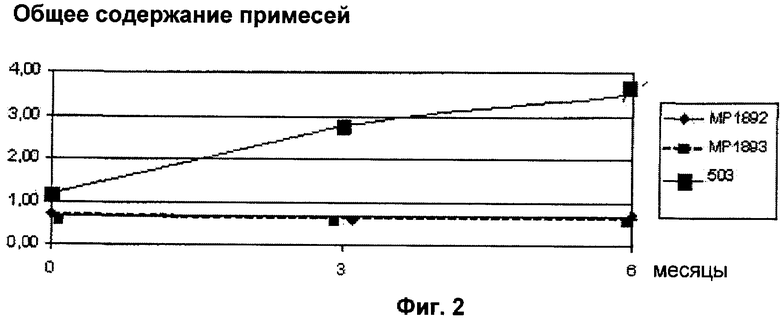
Полученные лиофилизированные продукты хранили в течение 6 месяцев при 25°C и относительной влажности (RH) 60% вместе с одной партией исходного вещества, винфлунина дитартрата (партия 503).
Появление примесей, соответствующих продуктам деградации, отслеживали путем регистрации изменений в:
- поглощении при 420 нм восстановленного раствора через 6 месяцев при 25°C и 60% относительной влажности, показанном на Фиг.1;
- общих примесях через 6 месяцев при 25°C и 60% относительной влажности, выраженных в виде процента и показанных на Фиг.2.
Сахароза оказывает неоспоримый стабилизирующий эффект. Этот эффект тем больше, чем выше содержание сахарозы, как видно по результатам поглощения при 420 нм.
Следует отметить, что эти совершенно неожиданные превосходные результаты могут быть дополнительно улучшены. Винфлунина дитартрат представляет собой молекулу, которая чувствительна к окислению.
Специалисту в данной области очень хорошо известно, что объединение инертного газа, такого как азот или аргон, или гидрофильного антиоксидантного агента, такого как аскорбиновая кислота и ее производные, солей сернистой кислоты, таких как сульфит натрия и тиольные производные, могут увеличивать эту стабильность.
Защита, придаваемая лиофилизированному винфлунину углеводами, такими как моносахариды, восстановленные или невосстановленные, олигосахариды или полисахариды, такие как инулин, и в частности, дисахаридами, не обнаружена с другими эксципиентами, традиционно используемыми в качестве структурирующих агентов для инъецируемых лиофилизированных продуктов.
Представленные ниже композиции лиофилизировали.
Пример 2:
Лиофилизированные продукты хранили в течение 1 месяца при 5°C, 25°C - 60% RH, а также при 40°C - 75% RH. Последнее условие было чрезвычайно важным условием для усиления обнаруженных различий.
Общее содержание примесей измеряли с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) и представляли в виде процента относительно винфлунина. Результаты, показанные в таблице ниже, представляют собой вычисленные различия между измерениями при 25°C - 60% RH, 40°C - 75% RH и измерениями при 5°C.
Результаты, полученные для композиции МР1762 (трегалоза), являются хорошими и идентичными при 25°C - 60% RH и 5°С.
Результаты, полученные для композиции МР1766 (поливидон), являются явно не подходящими.
Все эти результаты, особенно результаты, полученные для 6 месяцев хранения при 25°C - 60% RH, сводятся к возможности для разработчика фармацевтических препаратов выпускать противораковые композиции со сроком годности более 18 месяцев при комнатной температуре, который устраняет ограничение по транспортировке и хранению препаратов при температуре от 2°C до 8°C.
Предпочтительно, композиция по изобретению содержит свыше 50 мг винфлунина на одну дозу.
В предпочтительном воплощении композиция по изобретению может содержать свыше 50 мг винфлунина на одну дозу, например 100 мг или 250 мг. С этой точки зрения приготовление раствора перед лиофилизацией остается таким же, изменяется только объем распределяемого раствора: 4 мл и 10 мл для ранее упомянутых доз 100 мг и 250 мг винфлунина.
Растворы, состав которых представлен в таблице ниже, приготавливали, затем лиофилизировали.
Пример 3:
Полученные лиофилизированные продукты хранили в течение 1 месяца при 25°C - 60% RH и 30°C - 65% RH и в течение 2 месяцев при 5°C и 25°C - 60% RH.
Общее содержание примесей измеряли с помощью ВЭЖХ и представляли относительно первоначальной величины.
В одних и тех же условиях хранения исходное вещество винорелбина дитартрат демонстрирует изменение уровня примесей в результате деградации, которое означает, что продукт следует хранить при Т менее -15°C (среднее изменение равно +0,3% через 3 месяца при 5°C).
Полученные результаты являются чрезвычайно благоприятными с точки зрения хранения при комнатной температуре винорелбина, присутствующего в дитартратной форме и лиофилизированного в присутствии углевода.
Композиция по данному изобретению также может содержать количество винорелбина на одну дозу, меньшее или равное 20 мг, например 10 мг и 50 мг. Приготовление раствора перед лиофилизацией остается точно таким же и изменяется только объем для распределения: 1 мл и 5 мл для вышеупомянутых доз 10 мг и 50 мг, имеющихся в продаже.
В одном конкретном воплощении изобретения фармацевтическую композицию согласно данному изобретению вводят путем инфузии внутривенным путем после растворения в воде для инъецируемых препаратов и разведения в растворах для инфузии, таких как растворы 0,9% хлорида натрия или 5% глюкозы.
Это изобретение также относится к фармацевтической композиции для применения в качестве лекарственного средства, особенно при лечении рака, предпочтительно путем парентерального введения, преимущественно внутривенным путем посредством инфузии, и еще более предпочтительно во время химиотерапии в качестве антибластомного и противоопухолевого агента.
Это изобретение также относится к применению композиции по изобретению для изготовления лекарственного средства, предназначенного для парентерального введения, преимущественно внутривенным путем посредством инфузии, преимущественно для лечения рака.
Парентеральное введение, а именно внутривенным путем, фармацевтической композиции винфлунина или винорелбина согласно данному изобретению делает возможным лечение видов рака, которые чувствительны к эффекту винфлунина или винорелбина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ВИНФЛУНИНА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2004 |
|
RU2362557C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ВОДОРАСТВОРИМУЮ СОЛЬ ВИНФЛУНИНА | 2008 |
|
RU2462248C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА ВИНФЛУНИНА ДИТАРТРАТА | 2006 |
|
RU2426735C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ВОДОРАСТВОРИМОЙ СОЛИ ВИНОРЕЛБИНА | 2008 |
|
RU2476208C2 |
| ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ КАТАРАНТИНА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРЕКУРСОРОВ ДИМЕРНЫХ АЛКАЛОИДОВ VINCA | 2007 |
|
RU2448957C2 |
| БЕЗВОДНЫЕ КРИСТАЛЛИЧЕСКИЕ СОЛИ ВИНФЛУНИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВА, И СПОСОБ ОЧИСТКИ ВИНФЛУНИНА | 2008 |
|
RU2456291C2 |
| СТАБИЛЬНАЯ ТВЕРДАЯ ДИСПЕРСИЯ ПРОИЗВОДНОГО ВИНКА-АЛКАЛОИДА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2005 |
|
RU2412687C2 |
| ВИНОРЕЛБИНА МОНОТАРТРАТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2730521C2 |
| ПРЕПАРАТЫ | 2006 |
|
RU2429845C2 |
| ЛИОФИЛИЗИРОВАННЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ВАГИНАЛЬНОЙ ДОСТАВКИ | 2017 |
|
RU2753864C2 |
Изобретение относится к фармацевтической промышленности, в частности к композиции, содержащей стабильную при комнатной температуре лиофилизированную соль винфлунина или винорелбина. Фармацевтическая композиция, включающая водорастворимую соль винфлунина или винорелбина, стабильную при комнатной температуре, где указанная соль находится в лиофилизированной форме, полученной в присутствии по меньшей мере одного углевода при определенном pH и соотношении водорастворимой соли винфлунина или винорелбина и углевода. Вышеописанная композиция является стабильной. 8 з.п. ф-лы, 2 ил., 6 табл., 3 пр.
1. Фармацевтическая композиция, включающая водорастворимую соль винфлунина или винорелбина, стабильную при комнатной температуре, где указанная соль находится в лиофилизированной форме, полученной в присутствии по меньшей мере одного углевода при pH от 3 до 4, и относительное соотношение водорастворимой соли винфлунина или винорелбина и углевода составляет от 1/1 до 1/20.
2. Композиция по п.1, где водорастворимая соль представляет собой дитартрат винфлунина или дитартрат винорелбина.
3. Композиция по п.1, содержащая, в дополнение к углеводу(ам) в качестве эксципиентов для лиофилизации, по меньшей мере одну буферную систему.
4. Композиция по п.1, где углевод(ы) выбран(ы) из моносахаридов, восстановленных или невосстановленных, олигосахаридов или полисахаридов, таких как инулин, в частности дисахаридов.
5. Композиция по п.4 где углевод(ы) выбран(ы) из сахарозы, трегалозы и лактозы.
6. Композиция по п.3, где буферная система, выбранная для контроля pH, имеет значение от 3 до 4 и молярность от 0,005 до 0,5 М.
7. Композиция по п.6, где буферная система имеет значение pH в области 3,5, и молярность от 0,05 до 0,2 М.
8. Композиция по п.1, которая получена и упакована в атмосфере инертного газа и/или с включением в ее состав гидрофильного антиокиданта.
9. Композиция по п.1, которая находится в форме, подходящей для введения внутривенным путем посредством инфузии.
| EP 0392717 A1, 17.10.1990 | |||
| WO 03072082 A1, 04.09.2003 | |||
| FR 2863891 A1, 24.06.2005 | |||
| WO 2006099258 A1, 21.09.2006 | |||
| Двуствольная автоматическая пушка газоотводного типа | 2021 |
|
RU2761990C1 |
Авторы
Даты
2012-05-10—Публикация
2007-12-28—Подача