Изобретение относится к области медицины и ветеринарии, в частности трансплантологии.
При развитии стеноза трахеи, вызванного злокачественными новообразованиями, инфекционными заболеваниями, послеоперационными осложнениями или травмой, возникает необходимость в резекции значительных участков органа. В ряде случаев невозможно формирование первичного анастомоза и требуется замена дефекта трансплантатом.
Для восстановления целостности трахеи использовались различные протезы и ткани: замещение трахеальных дефектов аутологичными тканями, такими как надкостница, тонкая кишка, мышцы, пищевод, ткани бронха и аорты. Эти способы оказались малоэффективными и не позволяли формировать полноценный каркас трахеи. Кроме того, эти трансплантаты в дальнейшем замещались соединительной тканью, блокирующей воздухопроводящие пути [Grillo НС. Tracheal replacement: a critical review. Ann. Thorac. Surg.. - 2002. - Vol.73. - P.1995-2004].
Известны аллотрансплантаты для замещения дефектов трахеи, содержащие эпителий и хрящевые кольца, которые являлись мишенями для отторжения. Для предотвращения отторжения аллотрансплантата требуется проведение длительной неспецифической иммуносупрессивной терапии, вызывающей ряд побочных эффектов. В большинстве случаев после прекращения иммуносупрессивной терапии наблюдалось отторжение трансплантированных тканей [М. Sykes Immune evasion by chimeric trachea. N. Engl. J. Med. -. 2010 - Vol.362. - P.172-174].
В качестве прототипа заявляемого способа получения матрикса трахеи для аллогенной трансплантации предлагается способ с использованием трупной трахеи, детергентов и энзимов [Р. Macchiarini at al. Clinical transplantation of a tissue-engineered airway. Lancet 2008; 372:2023-2030]. Для снижения иммуногенности и удаления молекул главного комплекса гистосовместимости МНС I и II классов образец трахеи выдерживали в дистиллированной воде в течение 72 часов, затем проводили децеллюляризацию путем инкубирования трахеи в смеси 4% раствора натрия деоксихолата и 2000 ед. дезоксирибонуклеазы в 1 mM/л натрия хлорида, 25 циклов в течение 6 недель.
Недостатки прототипа: 1) не обеспечивает стерильность трансплантата, что может привести к гнойно-септическим осложнениям и к последующему отторжению трансплантата; 2) длительность обработки трансплантата трахеи (6 недель) не позволяет использовать его у больных с острой дыхательной недостаточностью, обусловленной дефектом или обтурацией трахеи; 3) нарушает структуру хрящевой ткани.
Задачей заявляемого изобретения является разработка способа получения стерильного матрикса трахеи для аллогенной трансплантации в более короткие сроки (2-3 недели).
Заявляемый способ предусматривает следующие стадии:
а) механическое очищение донорской трупной трахеи от соединительной и жировой тканей;
б) децеллюляризация донорской трахеи.
Способ осуществляется следующим образом: образцы трахеи механически очищают от жировой и соединительной тканей, промывают дистиллированной водой. С целью децеллюляризации трахею инкубируют в 5% растворе перхлората натрия (NaClO4) в течение 14-21 суток, при этом растворы обновляют каждые 72 часа. Затем образцы трахеи отмывают физиологическим раствором.
Пример 1. Оценка макро- и микроструктуры иммуногистохимических особенностей трасплантата
Исследования проведены на мышах линии C57BL/6 весом 22-25 г. У мышей линии C57BL/6 под эфирным наркозом удаляли трахею и механически освобождали от слизи, мышечных элементов, жировой и соединительной тканей; затем промывали дистиллированной водой. С целью децеллюляризации образцы трахеи инкубировали в 5% растворе NaClO4 в течение 14 суток. Раствор обновляли каждые 72 часа. Затем образцы отмывали физиологическим раствором и проводили морфологическое и иммуногистохимическое исследования. Экспрессию антигенов МНС I и II классов, а также дифференцировочных антигенов натуральных киллеров определяли на отпечатках и криостатных срезах образцов трахеи. Для этих целей использовали антитела NK 1.1 - РЕ, МНС I-FITC и МНС II-FITC фирмы Coltag. Световую и флюоресцентную микроскопию проводили с использованием фотовидеосистемы фирмы Zeiss и программы Axiovision 2.
Как показано на фиг.1, обработка 5% раствором NaClO4 не приводит к выраженным нарушениям структуры хрящевой и соединительной тканей трахеи.
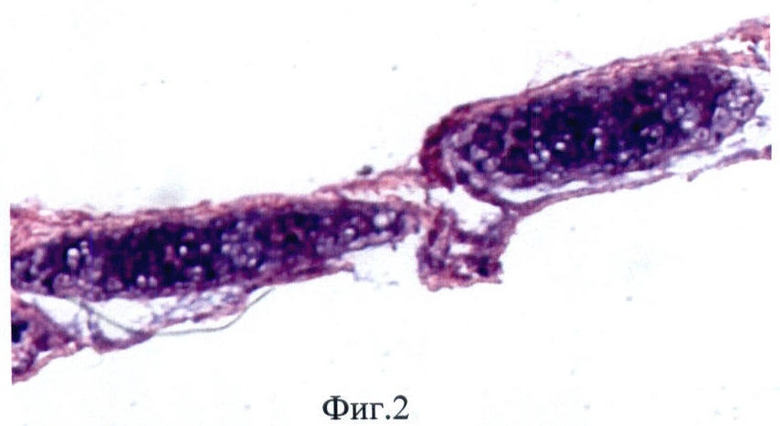
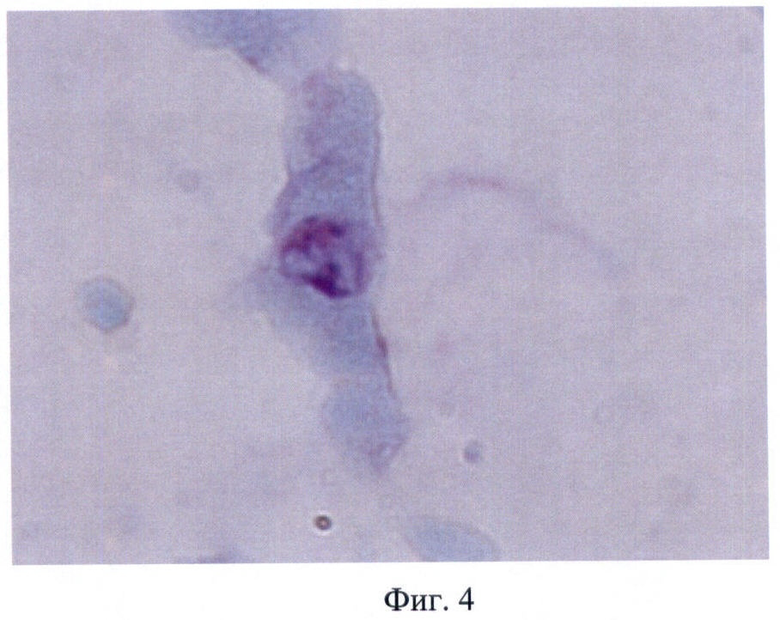
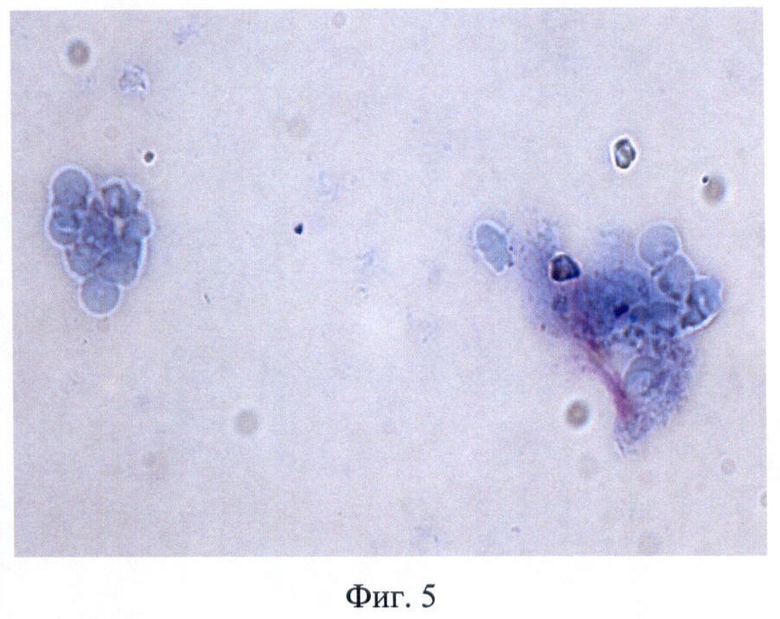
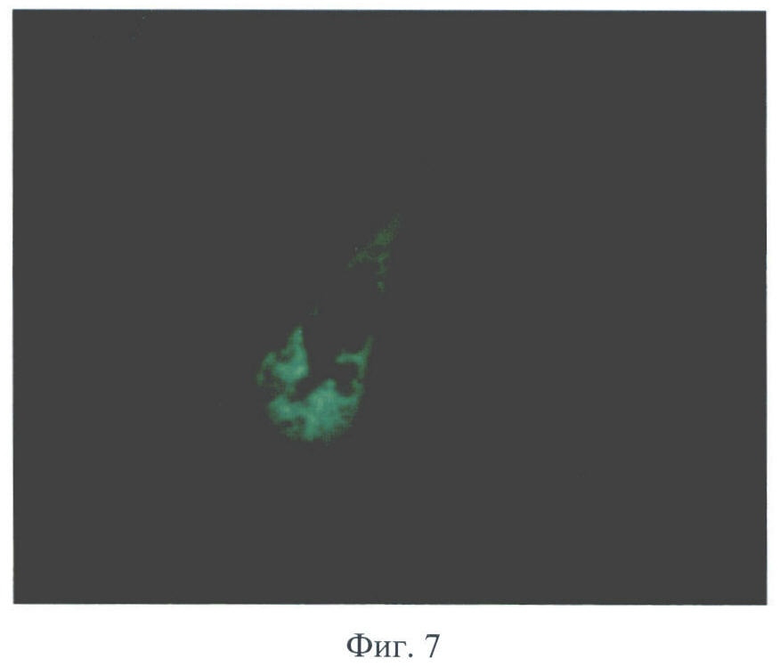
В заявляемом способе получения матрикса трахеи для аллогенной трансплантации образцы сохраняли свою макроструктуру и эластичность. При использовании заявляемого способа наблюдали полное разрушение структуры слизистой оболочки, в то время как хрящевая ткань сохраняла свою структуру, а в хондроцитах определяли невакуолизированную цитоплазму и ядро (Фиг.2, 3). Показано, что после обработки слизистой оболочки 5% раствором NaClO4 были обнаружены лишь отдельные полуразрушенные клетки с вакуолизированной цитоплазмой и безъядерные клеточные фрагменты (Фиг.4, 5). При иммунофлюоресцентном исследовании выявлено, что после воздействия 5% раствора NaClO4 в отпечатках трахеи не обнаружено специфической реакции на антигены гистосовместимости МНС I класса, определяли лишь единичные МНС II-положительные клетки (Фиг.6, 7).
Пример 2. Оценка гетеротопной аллогенной трасплантации матрикса трахеи у мышей
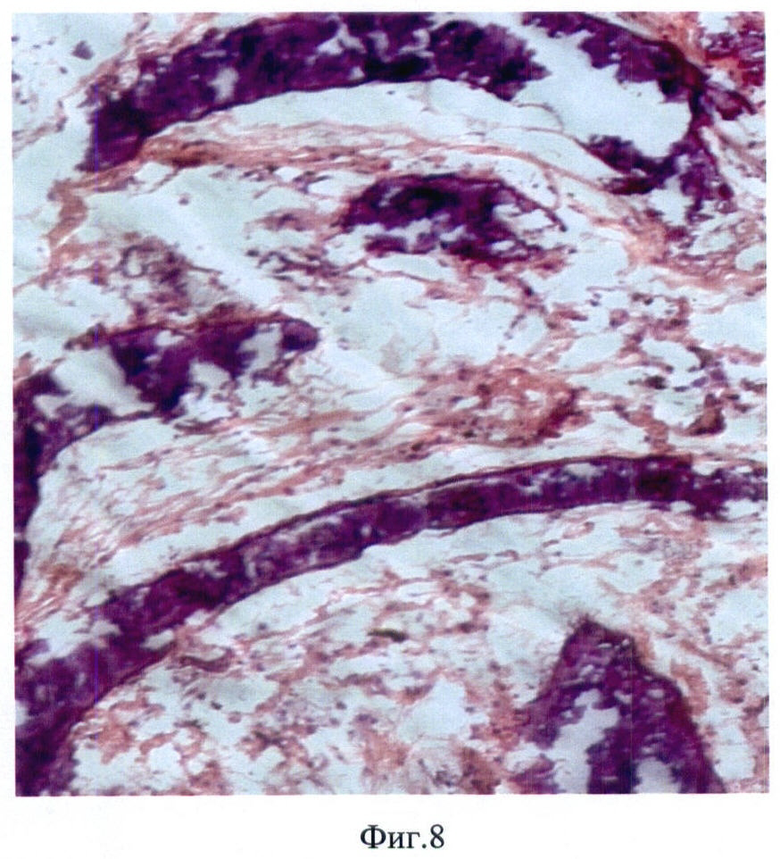
Подготовку трансплантатов осуществляли, как описано в примере 1. Далее у мышей реципиентов линии Balb/c в дорзолатеральной области грудной клетки формировали подкожный карман, в который помещали трансплантат. Через 28 суток трансплантат извлекали и проводили гистологическое исследование. Световую микроскопию проводили с использованием фото-видеосистемы фирмы Zeiss (Германия) и программы Axiovision 2. Гистологическое исследование извлеченного трансплантата позволило установить, что в нем сохранялись хрящевые полукольца и соединительная ткань (Фиг.8, 9).
Пример 3. Оценка гетеротопной аллогенной трасплантации матрикса трахеи у собак
Подготовку образцов донорской трахеи человека осуществляли, как описано в примере 1, но обработка трахеи длилась 21 сутки. Далее у собаки-реципиента в области паховой складки делали дугообразный разрез кожи и формировали межмышечный карман, в который помещали матрикс донорской трахеи, полученный заявляемым способом.
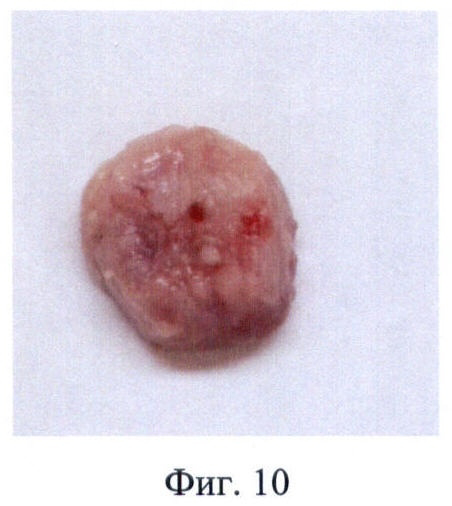
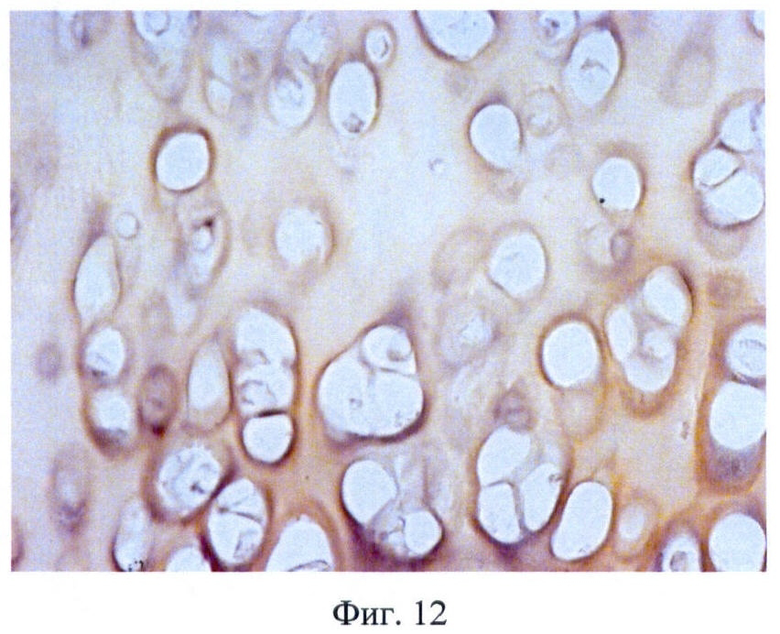
У животного после имплантации трахеи, обработанной по заявляемому способу, не наблюдалось симптомов общей или местной воспалительных реакций. Через 28 суток трансплантат извлекали и проводили гистологическое исследование. Трансплантат сохранил свою форму, хрящевую основу и эластичность (Фиг.10). При гистологическом исследовании было установлено, что микроструктура образца трахеи, обработанной по заявляемому способу, полностью сохранена: целостность хрящевой и мембранозной частей трахеи не претерпела существенных изменений, признаки отторжения тканей отсутствуют (Фиг.11, 12).
Технический результат
Заявляемый способ получения матрикса трахеи для аллогенной трансплантации обеспечивает в короткие сроки (2-3 недели) снижение иммуногенности, стерильность, сохранение макроструктуры и эластичности трахеи.
Изобретение иллюстрировано следующими фигурами:
Фиг.1 - трахея мыши после обработки 5% раствором NaClO4, микрофотография, ув. 100.
Фиг.2 - срез трахеи после обработки 5% раствором NaClO4, окр. гематоксилин-эозин, микрофотография, ув. 100.
Фиг.3 - срез трахеи после обработки 5% раствором NaClO4, окр. гематоксилин-эозин, микрофотография, ув. 900.
Фиг.4 - отпечаток трахеи мыши после обработки 5% раствором NaClO4, живые клетки, окр. по Романовскому-Гимза, микрофотография, ув. 900.
Фиг.5 - отпечаток трахеи мыши после обработки 5% раствором NaClO4, живые клетки, окр. по Романовскому-Гимза, микрофотография. Ув. 400.
Фиг.6 - отпечаток трахеи мыши после обработки 5% раствором NaClO4, окр. антителами МНС I-FITC, иммунофлюоресценция, микрофотография, ув. 400.
Фиг.7 - отпечаток трахеи мыши после обработки 5% раствором NaClO4, окр. антителами МНС II-FITC, иммунофлюоресценция, микрофотография, ув. 900.
Фиг.8 - аллотрансплантат трахеи после инкубации в 5% растворе NaClO4, окраска гематоксилин-эозин, микрофотография, ув. 200.
Фиг.9 - аллотрансплантат трахеи после инкубации в 5% растворе NaClO4, окраска гематоксилин-эозин, микрофотография, ув. 400.
Фиг.10 - Матрикс трахеи человека после инкубации в 5% растворе NaClO4, удаленный через 30 суток после трансплантации собаке, макрофотография.
Фиг.11 - матрикс трахеи человека после инкубации в 5% растворе NaClO4, удаленный через 30 суток после трансплантации собаке, окраска гематоксилин-эозин, микрофотография, ув. 100.
Фиг.12 - матрикс трахеи человека после инкубации в 5% растворе NaClO4, удаленный через 30 суток после трансплантации собаке, окраска гематоксилин-эозин, микрофотография, ув. 400.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРАХЕОБРОНХИАЛЬНОГО БИОИМПЛАНТА | 2011 |
|
RU2458635C1 |
| БИОИМПЛАНТАТ С МНОГОФУНКЦИОНАЛЬНЫМ БИОАКТИВНЫМ НАНОСТРУКТУРИРОВАННЫМ ПОКРЫТИЕМ | 2012 |
|
RU2482882C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОИНЖЕНЕРНОЙ КОНСТРУКЦИИ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ | 2012 |
|
RU2482881C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ДЕРМЫ ДЛЯ ПОСЛЕДУЮЩЕЙ РЕКОНСТРУКЦИИ ОБШИРНЫХ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2018 |
|
RU2704489C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТА ТОНКОЙ КИШКИ ПОСРЕДСТВОМ ПРИМЕНЕНИЯ АЛЛОГЕННОГО ДЕЦЕЛЛЮЛЯРИЗИРОВАННОГО БИОМАТЕРИАЛА | 2024 |
|
RU2821237C1 |
| Способ получения биоимплантата для замещения сегментарных дефектов трахеи | 2015 |
|
RU2612528C1 |
| ТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ СОЕДИНИТЕЛЬНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2330675C2 |
| СПОСОБ СОЗДАНИЯ БИОИНЖЕНЕРНОГО КАРКАСА ЛЕГКОГО КРЫСЫ | 2013 |
|
RU2547799C1 |
| ПРИМЕНЕНИЕ РАЗМНОЖЕННЫХ ПОПУЛЯЦИЙ ГЕМАТОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК/КЛЕТОК-ПРЕДШЕСТВЕННИКОВ | 2016 |
|
RU2747728C2 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |





Изобретение относится к области медицины и ветеринарии, в частности к трансплантологии. Для получения матрикса трахеи для аллогенной трансплантации используют донорскую трахею. Образец трахеи механически очищают от жировой и соединительной ткани, промывают дистиллированной водой, инкубируют в течение 14-21 суток в 5% растворе NaClO4, обновляя раствор каждые 72 часа, промывают физиологическим раствором. Способ обеспечивает получение стерильного матрикса трахеи для аллогенной трансплантации в короткие сроки с сохранением макроструктуры и эластичности трахеи и снижением иммуногенности. 12 ил., 3 пр.
Способ получения матрикса трахеи для аллогенной трансплантации, включающий использование донорской трахеи, отличающийся тем, что образец трахеи механически очищают от жировой и соединительной ткани, промывают дистиллированной водой, инкубируют в течение 14-21 сут в 5%-ном растворе NaClO4, обновляя раствор каждые 72 ч, промывают физиологическим раствором.
| MACCHIARINI P | |||
| et al | |||
| Clinical transplantation of a tissue-engineered airway | |||
| Lancet | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| (реферат), [он-лайн], [найдено 02.06.2011], найдено из базы данных PubMed | |||
| СПОСОБ ДОНОРСКОГО ЗАБОРА ТИРЕОТРАХЕАЛЬНОГО ТРАНСПЛАНТАТА | 2007 |
|
RU2328984C1 |
| US 2004022826 A1, 05.02.2004 | |||
| DE 3409372 A1, 19.09.1985 | |||
| GILBERT T.W | |||
| et al | |||
| Decellularization of tissues and organs, | |||
Авторы
Даты
2012-06-20—Публикация
2010-11-17—Подача