Изобретение относится к области медицины, конкретно к комбинации Ацетилсалициловой кислоты и производного 3-гидроксипиридина (варианты), обладающей антиагрегантной, липидрегулирующей и гастропротекторной активностями, фармацевтической композиции на основе этой комбинации. В качестве производного 3-гидроксипиридина предлагается Этилметилгидроксипиридина малат или Этилметилгидроксипиридина сукцинат.
В настоящее время профилактика и лечение нарушений процессов тромбообразования занимает одно из ведущих мест в терапии ишемической болезни сердца, инсультов, патологий, связанных с усиленным тромбообразованием. За счет агрегации тромбоцитов антиагреганты более эффективно, чем антикоагулянты, предотвращают образование тромбов в артериальных сосудах. Эффективность антиагрегантов при венозных тромбозах существенно ниже.
Наиболее широкое распространение на практике получили ацетилсалициловая кислота и производные тиенопиридина - клопидогрель и тиклопидин (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.466-468). Эти препараты имеют различный механизм проявления антиагрегантной активности.
Свойство тромбоцитов агрегировать друг с другом с образованием ядра, вокруг которого формируется тромб, во многих случаях является причиной сужения сосудов и даже закупорки неповрежденных сосудов, если их эндотелий по каким-либо причинам нарушается. В норме скорость агрегации тромбоцитов определяется соотношением двух простагландинов - простациклина эндотелия и тромбоксана тромбоцитов. Простациклин, угнетающий адгезию тромбоцитов, не образуется в атеросклеротических бляшках, чем и объясняется ускоренное тромбообразование на их поверхности. В этой связи терапевтический эффект различных антиагрегантов при таких заболеваниях несомненен.
Антиагреганты применяют для профилактики послеоперационных тромбозов, в комплесном лечении тромбофлебитов, при нарушениях мозгового кровообращения, для предупреждения тромбоэмболических осложнений при ишемической болезни сердца и инфаркте миокарда (Регистр лекарственных средств России РЛС-пациент, вып. №3, ООО «РЛС-2002», с.626-629).
В 1970-х гг. было установлено, что применяющаяся издавна в качестве противовоспалительного средства Ацетилсалициловая кислота (АСК) обладает антиагрегантной и антитромбатической активностью, связанной с ее способностью ингибировать агрегацию (склеивание) тромбоцитов.
Исследование молекулярного механизма антитромбатического действия АСК показало, что оно связано, в основном, с влиянием на биосинтез и метаболизм простагландинов. Вызываемая АСК необратимая блокада циклооксигеназы простагландинов (в течение всего периода жизни тромбоцитов) приводит к подавлению биосинтеза тромбоксана А2, являющегося высокоактивным эндогенным противоагрегационным и тромбогенным фактором.
По опубликованным в зарубежной медицинской литературе данным, у больных ишемической болезнью сердца, перенесших инфаркт миокарда, или нестабильной стенокардией АСК в малых дозах (50-125 мг в сутки) приводит к значительному уменьшению риска повторных инфарктов миокарда, инсультов и внезапной сердечной смерти. Высокая эффективность обнаружена также в предупреждении осложнений у больных с острым коронарным синдромом, после инсульта и при преходящих нарушениях мозгового кровообращения, в предупреждении развития послеоперационных тромбозов при тромбофлебитах, тромбозов сосудов сетчатки и при опасности других тромбоэмболических процессов (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.466-467).
Одним из неприятных побочных действий АСК является то, что при длительном применении АСК могут возникнуть желудочные кровотечения, может поражаться слизистая оболочка не только желудка, но и двенадцатиперстной кишки (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.165).
Делалась попытка усилить эффективность препаратов для лечения патологии, вызванной агрегацией тромбоцитов, в котором действующие начала представляют собой Аспирин и Клопидогрель (новый (середина 1990-х гг.) антиагрегант, считающийся в настоящее время одним из лучших препаратов, применяемых для профилактики тромбообразования у больных ишемической болезнью сердца (после инфаркта миокарда), при атеросклерозе мозговых и периферических сосудов (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.468)), (патент РФ №2184547). Данный препарат предлагается для лечения устойчивой или неустойчивой стенокардии, расстройств сердечно-сосудистой и черепно-сосудистой систем или расстройств, которые возникают при использовании сосудистых протезов или аортокоронарных шунтирований. Недостатком данной комбинации является достаточное количество противопоказаний, обусловленных ограничением применения препаратов, входящих в состав данной комбинации (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.165, 466-468). Кроме того, эта комбинация не обладает липидрегулирующей активностью.
В терапии ишемической болезни сердца и инсультов немаловажное значение имеет также нормализация липидного обмена. Одним из способов воздействия на развившиеся нарушения липидного обмена является медикаментозная терапия.
За последние годы появилось несколько гиполипидемических препаратов с различными механизмами коррекции липидного гомеостаза. К последним могут быть отнесены никотиновая кислота, статины, пробукол и др. (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.444-445, 448-453).
Сделана попытка объединить антитромбатическую и липидрегулирующую активности. Так, предложена комбинация Клопидогреля и Симвастатина или Правастатина (патент РФ №2176504), применение которой рекомендуется для лечения стабильной или нестабильной стенокардии, рецидива стеноза после ангиопластики, эндартерэктомии или при установке металлических эндососудистых протезов. Недостатком данной комбинации является достаточное количество противопоказаний применения, обусловленных ограничением применения препаратов, входящих в состав данной комбинации (М.Д.Машковский. Лекарственные средства, М., ООО "Новая волна", 2002, т.I, стр.444-445, 448-453), а также высокая стоимость препарата из-за использования импортных субстанций.
Поэтому весьма актуальным является поиск и разработка новых оригинальных препаратов, сочетающих в себе антиагрегантную и липидрегулирующую активность и обладающих менее выраженными побочными эффектами.
Поставленная цель достигается комбинацией АСК и производного 3-гидроксипиридина, являющегося синтетическим антиоксидантом. В качестве производного 3-гидроксипиридина комбинация содержит Этилметилгидроксипиридина малат или Этилметилгидроксипиридина сукцинат.
Получение комбинаций АСК и производного 3-гидроксипиридина осуществляют известным способом.
Пример 1. Получение комбинации АСК и Этилметилгидроксипиридина малата.
В смесителе первоначально смешивают 50.00 кг Этилметилгидроксипиридина малата, 14,00 кг сахара молочного, 8,00 кг крахмала картофельного. Порошки перемешивают в течение 10-12 минут, затем прибавляют 15,0 кг 10%-ного раствора пласдона К-90. Смесь перемешивают до равномерного увлажнения. Увлажненную массу протирают через сито с диаметром отверстий 1,25 мм. Гранулы сушат при температуре 45-50°С до содержания влаги 1,5±0,5%.
Высушенные гранулы протирают через сито с диаметром отверстий 1 мм и передают для опудривания.
Получают 216,97 кг сухого гранулята, содержащего 146,70 кг Этилметилгидроксипиридина малата. Выход на стадии составляет 98.4%.
В смесителе смешивают АСК - 37,50 кг, крахмал кукурузный - 17,50 кг и целлюлозу микрокристаллическую - 20,00 кг. Смесь порошков II передают на опудривание.
Получают 221,40 кг смеси II, содержащей 112,50 кг АСК. Выход на стадии составляет 98,4%, считая на АСК.
В смеситель загружают 216,97 кг сухого гранулята Этилметилгидроксипиридина малата и 221,40 кг смеси порошков II и опудривают смесью 1,48 кг кремния диоксида коллоидного, 2,95 кг стеарата магния и массу передают на капсулирование.
Получают 442,20 кг смеси порошков для капсулирования, содержащей 147,40 кг Этилметилгидроксипиридина малата и 110,55 кг АСК, которую передают на стадию наполнения капсул. Выход на стадии составляет 99,86%.
Наполнение твердых желатиновых капсул порошком для капсулирования производят на автоматической капсулонаполняющей машине. Для наполнения используют капсулы №2. Масса 20 капсул с содержимым должна быть 7,692 г±10%.
Масса содержимого капсулы должна быть 0,3 г±10% с пределами отклонений от 0,27 до 0,33 г.
Пример 2. Получение комбинации АСК и Этилметилгидроксипиридина сукцината.
В смесителе первоначально смешивают 50,00 кг Этилметилгидроксипиридина сукцината, 12,60 кг сахара молочного, 7,20 кг крахмала картофельного. Порошки перемешивают в течение 10-12 минут, затем прибавляют 13,50 кг 10%-ного раствора пласдона К-90. Смесь перемешивают до равномерного увлажнения. Увлажненную массу протирают через сито с диаметром отверстий 1,25 мм. Гранулы сушат при температуре 45-50°С до содержания влаги 1,5±0,5%.
Высушенные гранулы протирают через сито с диаметром отверстий 1 мм и передают для опудривания.
Получают 216,21 кг сухого гранулята, содержащего 146,70 кг Этилметилгидроксипиридина сукцината. Выход на стадии составляет 97,9%.
В смесителе смешивают АСК - 37,50 кг, крахмал кукурузный - 15,80 кг и целлюлозу микрокристаллическую - 22,00 кг. Смесь порошков II передают на опудривание.
Получают 221,20 кг смеси II, содержащей 112,51 кт АСК. Выход на стадии составляет 97,9%, считая на АСК.
В смеситель загружают 216,21 кг сухого гранулята Этилметилгидроксипиридина сукцината и 221,20 кг смеси порошков II и опудривают смесью 1,47 кг кремния диоксида коллоидного, 3,00 кг стеарата магния и массу передают на капсулирование.
Получают 442,10 кг смеси порошков для капсулирования, содержащей 147,45 кг Этилметилгидроксипиридина сукцината и 110,50 кг АСК, которую передают на стадию наполнения капсул. Выход на стадии составляет 99,88%.
Наполнение твердых желатиновых капсул порошком для капсулирования производят на автоматической капсулонаполняющей машине. Для наполнения используют капсулы №2. Масса 20 капсул с содержимым должна быть 7,692 г±10%.
Масса содержимого капсулы должна быть 0,3 г±10% с пределами отклонений от 0,27 до 0,33 г.
Предметом настоящего исследования явилось сравнительное изучение антиагрегантной активности АСК, а также комбинации АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипиридина сукцинат в капсульной лекарственной форме, а также сравнительное изучение липидрегулирующей активности Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината и комбинации АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипиридина сукцинат в капсульной лекарственной форме.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали капсулы препаратов
АСК+Этилметилгидроксипиридина малат или
АСК+Этилметилгидроксипиридина сукцинат. Состав на одну капсулу: АСК 0,075 г, Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината 0,1 г, а также вспомогательные вещества - сахар молочный (лактоза), крахмал картофельный, крахмал кукурузный экструзионный 1500, пласдон К-90, целлюлоза микрокристаллическая, магния стеарат, аэросил (кремния диоксид коллоидный). Масса содержимого капсулы 0,3 г. Содержимое капсул представляет собой порошок или гранулы белого цвета с желтоватым или кремоватым оттенком. Капсулы кремового цвета №0.
В первой части исследования по изучению антиагрегантной активности опыты проводились на нелинейных белых крысах массой 250-300 г с использованием схемы эксперимента, изложенной в работе Yoichi Niitsu (Yoichi Niitsu, Atsuhiro Sugidachi, Taketoshi Ogawa, Josef A. Jakubowski, Masami Hashimoto, Takashi Isobe, Kenichi Otsuguro, Fumitoshi Asai Repeat oral dosing of prasugel, a novel P2Y12 receptor ingibitor, results in cumulative and potent antiplatelet and antitrombotic activity in several animal species// European Journal of Pharmacology v.579, 2008, p.276-282). Для акклиматизации животные содержались в виварии в течение 14 дней до начала эксперимента при 18-22°С и влажности 50-60% в стандартных клетках при 12-часовом режиме освещения день-ночь на стандартном пищевом рационе и воде в соответствии с нормами, утвержденными МЗ РФ
Животных делили на 3 группы по 8 голов в каждой.
1. Интактный контроль (животным в течение 3 суток перорально вводили дистиллированную воду).
2. АСК (животным в течение 3 суток перорально вводили раствор АСК в дозе 30 мг/кг).
3. АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипириднна сукцинат (животным в течение 3 суток перорально вводили суспензию АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипиридина сукцинат в дозе 30 мг по АСК/кг).
Суточная доза была близка к максимальной терапевтической суточной для человека (75 мг/60-70 кг веса) с учетом межвидового переноса доз для крыс, составляющего 1:7. Кроме того, выбранная доза для АСК соответствовала оптимальной для аналогичных исследований в ранее цитированной работе.
Вещества вводили внутрижелудочно в 2,0 мл 4%-ного крахмального геля в течение 3 дней. Число животных в каждой группе было одинаковым (8 крыс). Через 4 часа после последнего введения животных декапитировали, кровь собирали в тефлоновую посуду, содержащую 0,13 М цитрата натрия в соотношении 1:9, центрифугировали при 200 g за 7 мин и супернатант, представляющий собой богатую тромбоцитами плазму (БТП), использовали для изучения процесса АДФ-индуцированной агрегации тромбоцитов. Для получения обедненной тромбоцитами плазмы (ОТП) использовали повторное центрифугирование при 2000 g за 15 мин.
При проведении анализа использовали метод, основанный на анализе флуктуаций светопропускания образца суспензии, вызванных изменениями числа частиц в оптическом канале устройства в богатой тромбоцитами плазме после добавления индуктора агрегации - раствора АДФ - метод Борна/O'Браена (Габбасов З.А., Попов Е.Г., Гаврилов И.Ю., Позин Е.Я., Маркосян Р.А. Новый высокочувствительный метод анализа агрегации тромбоцитов. Лабораторное дело, 1989, №10, с.15-18. Габбасов З.А., Попов Е.Г., Гаврилов И.Ю., Позин Е.Я., Маркосян Р.А. Новый методический подход к исследованию агрегации тромбоцитов in vitro. Бюллетень экспериментальной биологии и медицины, 1989, №10, с.437-439).
Анализ проводили на разработанном в ГКНЦ компьютеризированном анализаторе агрегации тромбоцитов. В опыте в термостатируемую при 37°С кювету, содержащую микромешалку, вводили 0,3 мл БТП, проводили калибровку с помощью ОТП. Далее к 0,3 мл БТП добавляли 10 мкл 155 мкМ раствора АДФ до конечной концентрации 5 мкМ и регистрировали изменение светопропускания, пропорциональное проценту агрегации, рассчитываемое в соответствии с разработанной программой.
Во второй части исследования по изучению липидрегулирующей активности исследования проводили на нелинейных белых крысах-самцах с исходной массой 220-250 г, полученных из питомника. Для акклиматизации животные содержались в виварии в течение 14 дней до начала эксперимента при 18-22°С и влажности 50-60% в стандартных клетках при 12-часовом режиме освещения день-ночь на стандартном пищевом рационе и воде в соответствии с нормами, утвержденными МЗ РФ. За 18 часов перед забоем крыс лишали корма, вода оставалась в достаточном количестве.
Животных делили на 4 группы по 8 голов в каждой.
1. Интактный контроль (животным в течение 3 суток перорально вводили дистиллированную воду).
2. Атерогенная диета.
3. Атерогенная диета+Этилметилгидроксипиридина малат или Этилметилгидроксипиридина сукцинат (животным в течение 10 суток перорально давали атерогенную диету и вводили раствор Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината в дозе 10 мг/кг).
4. Атерогенная диета+(АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипиридина сукцинат) (животным в течение 10 суток перорально давали атерогенную диету и вводили суспензию АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипиридина сукцинат в дозе 10 мг по Этилметилгидроксипиридина малату или Этилметилгидроксипиридина сукцинату/кг).
Суточная доза была близка к терапевтической суточной для человека (100 мг/60-70 кг веса) с учетом межвидового переноса доз для крыс, составляющего 1:7.
Вещества вводили внутрижелудочно в 2,0 мл 4%-ного крахмального геля в течение 10 дней. Число животных в каждой группе было одинаковым (8 крыс).
Гиполипидемическую активность оценивали по степени торможения индуцированной гиперлипидемии (Парфентьева Е.П., Василенко Ю.К., Лисевицкая Л.И. и др. Влияние урсоловой кислоты на некоторые показатели липидного обмена при экспериментальном атеросклерозе. - Вопр. мед. Химии, 1980, №2, с.174-179), анализируя следующие биохимические показатели в сыворотке крови:
- общий холестерин (ХС-общий),
- холестерин ЛПВП (ХС-ЛПВП),
- холестерин ЛПНП (ХС-ЛПНП),
- холестерин ЛПОНП (ХС-ЛПОНП),
- триглицериды (ТГ).
Определение содержания общего холестерина
Содержание ХС в сыворотке крови определяли методом Илька (Родионова Л.П. Модификация метода определения содержания триглицеридов в сыворотке крови. - Лаб. Дело, 1980, №5, с.297-299) - зиматическим колориметрическим методом. Принцип метода заключается в том, что присутствующие в плазме или сыворотке крови эфиры холестерина гидролизуются холестеролэстеразой. При этом образуется свободный холестерин. Образовавшийся и имеющийся в плазме или сыворотке крови холестерин окисляется кислородом воздуха под действием холестеролоксидазы с образованием эквимолярного количества перекиси водорода. Под действием пероксидазы (POD) перекись водорода окисляет хромогенный субстрат с образованием окрашенного продукта. Интенсивность окраски пропорциональна концентрации холестерина в пробе.
Определение концентрации общего холестерина в сыворотке и плазме крови проводили с помощью набора реагентов CHOLESTEROL"E-D" фирмы «Витал Диагностикс СПб».
Состав набора
№1. Буфер: фосфатный буфер - 100 ммоль/л; фенол - 20 ммоль/л.
№2. Лиофилизат холестеролэстераза - 400 U/л, холестеролоксидаза - 250 U/л, пероксидаза (POD) - 500 U/л.
№3. Стандартный раствор холестерина: 5,17 моль/л (200 мг/100 мл).
При проведении анализа смесь лиофилизированных ферментов растворяют в буферном растворе №1, раствор выдерживают при комнатной температуре 20-30 мин. В пробирку помещают 2 мл полученного реагента, добавляют 0,02 мл сыворотки или плазмы (опытная проба). Одновременно приготавливают калибровочную и контрольную пробы. Для этого к 2 мл реагента добавляют 0,02 мл калибровочного раствора холестерина (калибровочная проба) или 0,02 мл дистиллированной воды (контрольная проба). Реакционную смесь тщательно перемешивают и инкубируют не менее 5 минут при комнатной температуре (20-25°С) или при 37°С.
Далее измеряют оптическую плотность опытной и калибровочной проб против контрольной пробы в кюветах с толщиной поглощающего слоя 5 мм (1 см) при длине волны 500 нм.
Расчет концентрации холестерина проводят по формуле:
С=Ео/Ест*5,17[ммоль/л] или С=Ео/Ест*200[мг/100 мл]
где Ео и Ест - экстинкции образца и стандарта, измеренные относительно контрольной пробы.
Определение концентрации липопротеидов высокой плотности
ХС-ЛПВП оценивали в супернатанте после гепарин-марганцевой преципитации ЛПОНП+ЛПНП (Кейтс М. Техника липидологии. - М., Мир, 1975, с.74-76).
В принципе метода лежит то, что хиломикроны, липопротеиды очень низкой плотности (ХС-ЛПОНП) и липопротеиды низкой плотности осаждаются при добавлении к образцу фосфорно-вольфрамовой кислоты и солей Mg и удаляются центрифугированием. После центрифугирования в супернатанте остаются только липопротеиды высокой плотности (ХС-ЛПВП), концентрация которых определяется так же, как концентрация общего холестерина.
Определение концентрации липопротеидов высокой плотности в сыворотке и плазме крови проводили с помощью набора реагентов CHOLESTEROL"FL-E" фирмы «Витал Диагностикс СПб».
Состав набора
№1. Осаждающий реагент - фосфорно-вольфрамовая кислота - 55 ммоль/л, магния хлорид - 25 ммоль/л.
Ход определения. В пробирку помещают 0,15 мл исследуемой плазмы или сыворотки, затем 0,3 мл осаждающего реагента, хорошо перемешивают и оставляют на 10 мин при комнатной температуре. Центрифугируют 10 мин при 4000 об/мин при температуре 4-6°С. Прозрачный супернатант используют для определения концентрации липопротеидов высокой плотности при помощи реактивов и методики для определения концентрации общего холестерина.
Определение содержания триглицеридов
Триглицериды или нейтральные жиры представляют собой сложные эфиры глицерина и трех остатков жирных кислот, чаще всего, с 16 или 18 атомами углерода. Точный состав жирно-кислотных остатков может колебаться в определенных пределах и зависит, главным образом, от характера питания. Поэтому говорят о триглицериде не как об индивидуальном химическом веществе, а как о группе родственных соединений. Это осложняет выражение результатов анализа в весовых единицам, т.е. в г/л или мг/100 мл, так как существующие аналитические методы позволяют определять количество молекул триглицеридов, но молекулярная масса в разных образцах может быть несколько отличной. Другая аналитическая сложность вызвана нестойкостью сложноэфирной связи, которая легко распадается в щелочной среде, а также под действием ферментов сыворотки или микроорганизмов.
Содержание в сыворотке крови ТГ определяли общепринятым методом (Родионова Л.П. Модификация метода определения содержания триглицеридов в сыворотке крови. - Лаб. Дело, 1980, №5, с.297-299). В работе применен метод определения концентрации триглицеридов в сыворотке и плазме крови с помощью набора реагентов TRIGLYCERIDES "Е-D" фирмы «Витал Диагностикс СПб».
Принцип метода состоит в том, что триглицериды под действием фермента липазы расщепляются на глицерин и жирные кислоты. Далее глицерин в присутствии АТФ и фермента глицерокиназы превращается в глицерид-3-фосфат, который под действием кислорода и фермента глицерофосфатоксидазы превращается в диоксиацетон фосфат, при этом образуется перекись водорода. Перекись водорода воздействует на 4-аминоантипирин и 4-хлорфенол в присутствии пероксидазы, при этом образуется хинонимин. Концентрация хинонимина, определяемая фотометрически, пропорциональна концентрации триглицеридов в пробе.
Состав набора
№1. Буфер TRIS буфер - 50 ммоль/л, рН 7,5, 4-хлорфенол - 4 ммоль/л, Mg - 1 ммоль/л.
№2. Лиофилизат АТФ 2 ммоль/л, Пероксидаза 5000 U/л, Липаза - 150 U/л, Глицерокиназа - 1200 U/л, Глицерофосфатоксидаза - 4000 U/л, 4-аминоантипирин - 0,4 ммоль/л.
№3. Стандартный раствор 250 мг/100 мл.
При проведении анализа смесь лиофилизированных ферментов и реактивов (№2) растворяют в буферном растворе №1, раствор выдерживают при комнатной температуре 20-30 мин. В пробирку помещают 2 мл полученного реагента, добавляют 0,02 мл сыворотки или плазмы (опытная проба). Одновременно приготавливают калибровочную и контрольную пробы. Для этого к 2 мл реагента добавляют 0,02 мл калибровочного раствора триглицеридов (калибровочная проба) или 0,02 мл дистиллированной воды (контрольная проба). Реакционную смесь тщательно перемешивают и инкубируют не менее 5 минут при комнатной температуре (20-25°С). Далее измеряют оптическую плотность опытной и калибровочной проб против контрольной пробы в кюветах с толщиной поглощающего слоя 5 мм (1 см) при длине волны 505 нм.
Расчет концентрации триглицеридов проводят по формуле:
С=(Ео/Ест*2,85)-0,11 [ммоль/л] или С=(Ео/Ест*250)-10 [мг/100 мл]
где Ео и Ест - экстинкции образца и стандарта, измеренные относительно контрольной пробы.
0,11 ммоль/л и 10 мг/100 мл поправка на содержание свободного глицерина в сыворотке (плазме) крови.
Определение содержания холестерина липопротеидов низкой плотности и холестерина липопротеидов очень низкой плотности
Определение ХС-ЛПНП проводили путем расчета по формуле (Грибанов Г.А., Сергеев С.А. Экспресс-микроанализ общих липидов сыворотки крови и их фракций. - Вопр. мед. Химии, 1975, т.21, №6, с.652-655). Зная количество холестерина ЛПВП, можно, используя формулу, предложенную Rifkind (Грибанов Г.А., Сергеев С.А. Экспресс-микроанализ общих липидов сыворотки крови и их фракций. - Вопр. мед. Химии, 1975, т.21, №6, с.652-655), рассчитать содержание холестерина (ХС) в ЛПОНП и ЛПНП:
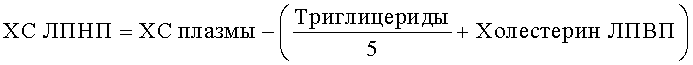
Содержание холестерина ЛПОНП рассчитывали по формуле:
ХЛ-ЛПОНП=Триглицериды/5.
Расчет коэффициента атерогенности
Холестериновый коэффициент атерогенности (Кхс) рассчитывали по (Родионова Л.П. Модификация метода определения содержания триглицеридов в сыворотке крови. - Лаб. Дело, 1980, №5, с.297-299). Для оценки влияния изученных препаратов на соотношение атерогенных и антиатерогенных липопротеидов крови вычисляли индекс атерогенности по формуле:
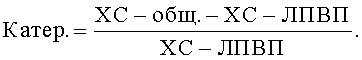
Постановка эксперимента
Гиперлипидемию индуцировали у беспородных крыс-самцов массой 220-250 г атерогенным рационом, содержавшим в масляной суспензии 10% холестерина и 1% холевой кислоты (из расчета 1,0 мл жировой нагрузки на 100 г массы тела) (Федеральное руководство по использованию лекарственных средств (формулярная система), вып.4, под ред. А.Г.Гучалина, А.И.Вялкова, Ю.Б.Белоусова, В.В.Яснецова, М., 2003, с.106-112).
Экспериментальным животным вводили жировую суспензию (зондом, внутрижелудочно) в течение 10 дней и одновременно внутрижелудочно вводили исследованные препараты (в 2%-ном крахмальном геле) в дозе 10,0 мг Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината/кг и комбинацию АСК+Этилметилгидроксипиридина малат или АСК+Этилметилгидроксипиридина сукцинат в той же дозе по Этилметилгидроксипиридина малату или Этилметилгидроксипиридина сукцинату.
Полученные данные обрабатывались общепринятым методом с использованием в качестве критерия различия средних двух выборок t критерия Стьюдента. Разница между результатами считалась достоверной при уровне значимости Р<0,05 (Плохинский Н.А. Биометрия, Новосибирск, 1961). В таблицах приведены средние арифметические значения параметров агрегации для каждой группы животных и их стандартные ошибки.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Полученные данные по изучению антиагрегантной активности препаратов in vivo представлены в таблице 1. Как следует из результатов, приведенных в таблице, у животных контрольной группы степень максимальной АДФ-индуцированной агрегации тромбоцитов колеблется от 41 до 62%, составляя в среднем 46,3±2,5% (n=8).
При 3-кратном введении АСК через 4 часа после последнего введения интенсивность АДФ-индуцнрованной агрегации существенно снижалась и колебалась от 23 до 50%, составляя в среднем 35,6±3,1% с t-критерием Стьюдента 2,69 в сравнении с контрольной группой, что соответствует уровню вероятности различий более 95%.
Аналогично при введении комбинации АСК+Этилметилгидроксипиридина малат наблюдается снижение интенсивности АДФ-индуцированной агрегации с колебаниями от 17 до 46%, в среднем до 32,4±3,2% с t-критерием Стьюдента 3,42 в сравнении с контрольной группой, что соответствует уровню вероятности различий более 95%.
Комбинация АСК+Этилметилгидроксипиридина сукцинат также обладала антиагрегантной активностью.
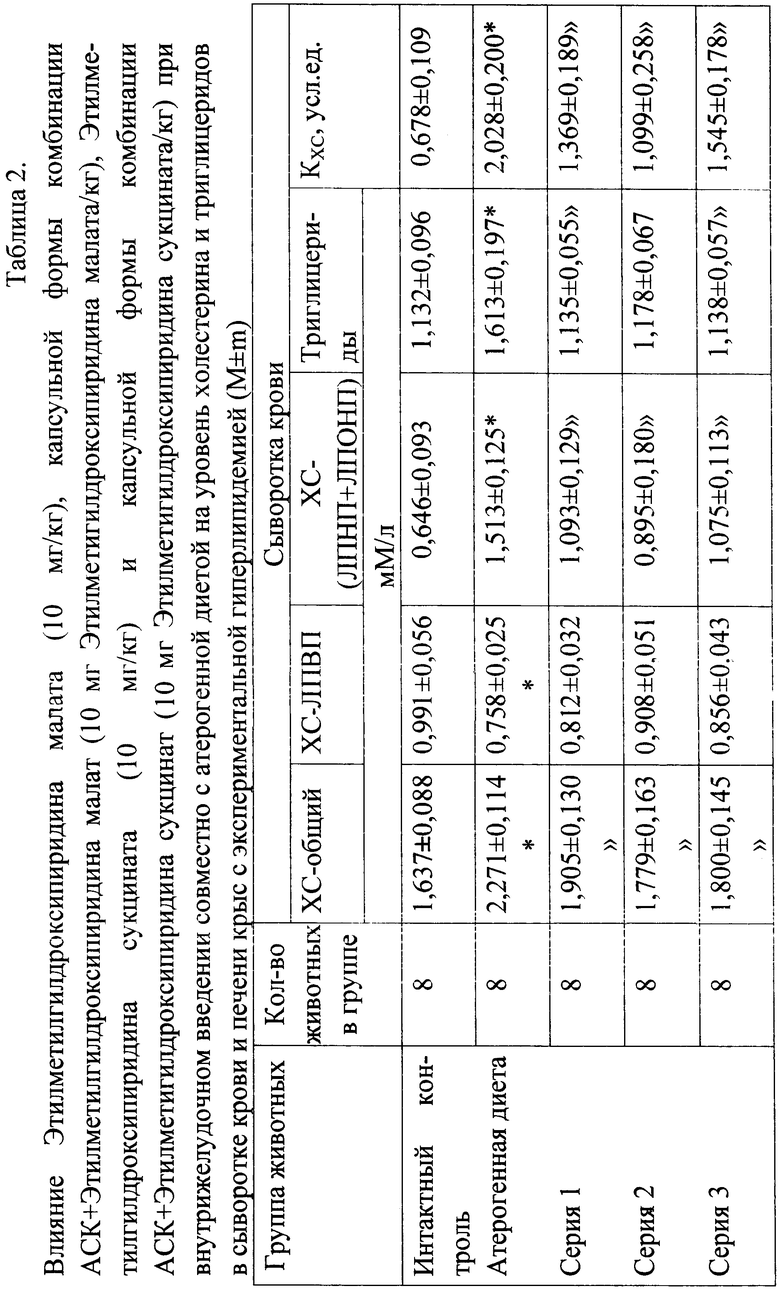
Полученные данные по изучению липидрегулирующей активности Этилметилгидроксипиридина малата и комбинации АСК+Этилметилгидроксипиридина малат in vivo при 10-дневном введении с атерогенной диетой в дозе 10 мг Этилметилгидроксипиридина малата/кг представлены в таблице 2.
Как следует из результатов, приведенных в таблице, у животных контрольной группы при атерогенной диете гиперлипидемия приводит к достоверному повышению уровня ТГ и общего ХС в сыворотке крови крыс, причем наблюдаемая гиперхолестеринемия развилась за счет атерогенных фракций липопротеидов на фоне снижения уровня ХС-ЛПВП. Индекс атерогенности возрос до 2,028±0,200, превышая этот показатель группы интактных животных в 3 раза. Введение экспериментальным животным Этилметилгидроксипиридина малата в виде субстанции в дозе 10 мг/кг в течение 10 дней замедлило развитие патологического процесса - снизился уровень общего холестерина (в 1,2 раза), ТГ (в 1,56 раза) и ХС в составе атерогенных фракций липопротеидов (в 1,38 раза). За счет повышения уровня ХС-ЛПВП величина коэффициента атерогенности снизилась в 1,5 раза.
Как следует из представленных в таблице 2 данных, как и в предыдущем случае, при введении животным комбинации АСК+Этилметилгидроксипиридина малат в дозе 10 мг (Этилметилгидроксипиридина малата)/кг в течение 10 дней в такой же степени, как и введение при монотерапии Этилметилгидроксипиридина малата в виде субстанции в дозе 10 мг/кг также в течение 10 дней замедлило развитие патологического процесса - снизился уровень общего холестерина в 1,3 раза, ТГ - в 1,43 раза и ХС в составе атерогенных фракций липопротеидов - в 1,50 раза. Величина коэффициента атерогенности снизилась в 1,50 раза.
Аналогичным действием обладал и Этилметилгидроксипиридина сукцинат, а также комбинация АСК+Этилметилгидроксипиридина сукцинат в дозе 10 мг (сукцината)/кг.



Проведено изучение фармакокинетики препаратов АСК+Этилметилгидроксипиридина малат и АСК+Этилметилгидроксипиридина сукцинат после однократного введения кроликам per os в дозе 25 мг/кг (для АСК) и 33 мг/кг (для Этилметилгидроксипиридина малата и Этилметилгидроксипиридина сукцината).
Препараты: АСК+Этилметилгидроксипиридина малат и АСК+Этилметилгидроксипиридина сукцинат, капсулы, содержащие 75 мг АСК и 100 мг Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината.
Исследования проводили на кроликах-самцах породы Шиншилла с массой тела 3,0±0,2 кг. Животные содержались в стандартных клетках при 12-часовом режиме освещения и свободном доступе к корму и воде.
После перорального введения препарата кровь отбирали из краевой вены уха кролика через дискретные интервалы времени. Пробы крови выдерживали при комнатной температуре до образования сгустка, после чего образцы центрифугировали в течение 10 мин при n=2500 об/час и отбирали по 1 мл сыворотки. До анализа пробы сыворотки хранили при температуре минус 18°С.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АСК В СЫВОРОТКЕ КРОВИ
Фармакокинетику АСК изучали на протяжении 2 часов после однократного введения капсул per os в дозе 25 мг/кг (0,25; 0,5; 0,75; 1; 1.5; 2 час после введения препарата).
К 0,2 мл сыворотки крови, полученной обычным способом, добавляли 100 мкл 4%-ной Н3РO4, энергично встряхивали на «Vortex» в течение 3 сек и приливали 0,4 мл ацетонитрила. В течение 15 сек смесь интенсивно перемешивали на «Vortex» и затем центрифугировали 10 мин при 5000 об/час. Органический слой отбирали и 50 мкл вводили в хроматографическую колонку.
Хроматографическое разделение проводили при температуре 30°С на колонке Nucleosil C18, 5 мкм, 150×4,0 мм (БиоХим МАК, Россия), защищенной предколонкой 10×4 мм того же зернения. В качестве элюента была использована смесь Н2О, 80%-ной Н3РO4 и ацетонитрила в соотношении 370:450:90 (мл), рН-2,5. Скорость элюирования - 1 мл/час. Детектирование осуществляли при λ-237 нм. Время удерживания АСК в этих условиях составило 11±0,2 мин. Так как установлена линейная зависимость между концентрацией АСК в интервале 0,01 мкг/мл - 10 мкг/мл и высотой хроматографического пика, концентрацию этого соединения в пробах определяли методом абсолютной калибровки по калибровочной кривой. Предел обнаружения составлял 0,01 мкг/мл.
Количественное определения Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината в сыворотке крови кроликов
Фармакокинетику препаратов изучали на протяжении 6 часов после однократного введения капсул per os в дозе 33 мг/кг (0,25; 0,5; 0,75; 1; 2; 3; 4, 6 час после введения препарата).
Во все образцы сыворотки крови (объем 0,2 мл), включая нулевую и стандарт (0,1 мкг/мл препарата), добавляли 100 мкл 10%-ного раствора трихлоруксусной кислоты для осаждения сывороточных белков. Смесь энергично встряхивали на вибромиксере «Вортекс» в течение 2 мин, затем центрифугировали 5 мин при 5000 об/мин, 50 мкл надосадочной жидкости вводили в хроматографическую колонку.
Для количественного определения препарата в сыворотке крови применяли метод ВЭЖХ со спектрофотометрической детекцией. Детектирование осуществляли при λ-296 нм. Хроматографическое разделение проводили при температуре 40°С на колонке Диасфер С16, 5 мкм, 250×4,0 мм (БиоХим МАК, Россия), защищенной предколонкой 10×4 мм того же зернения. Элюент состоял из 0,01М NH4H2PO4 (82%), ацетонитрила (18%) с добавлением 30 мг/л ионопарного реагента октилсульфоната натрия для лучшего удерживания препарата на колонке, рН-3,0 доводили фосфорной кислотой. Скорость элюирования - 1 мл/мин. Предел обнаружения - 0,01 мкг/мл. Время удерживания препарата при этих условиях 5,8±0,3 мин. Так как установлена линейная зависимость между концентрацией препарата в интервале 0,01 мкг/мл - 10 мкг/мл и высотой хроматографического пика, концентрацию этого соединения в пробах определяли методом абсолютной калибровки по калибровочной кривой.
Анализ фармакокинетаческих данных проводили с использованием внемодельного метода интегральных моментов по компьютерной программе ASKID. При этом рассчитывались следующие индивидуальные фармакокинетические параметры:
AUC - площадь под фармакокинетической кривой (0-6 час), мкг*час/мл;
Cmax - максимальная концентрация вещества в сыворотке крови, мкг/мл;
Tmax - время достижения Cmax, час;
MRT - среднее время удерживания препарата в организме, час.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В нулевой точке (перед вводом препарата) исследование проб крови у всех кроликов не выявило присутствия в сыворотке АСК. В последующие сроки наблюдения в пробах крови было обнаружено достаточное для анализа количество АСК. Значения концентрации АСК в дискретные интервалы времени после введения капсул исследуемого препарата приведены в таблице 4.
Индивидуальные и средние значения основных фармакокинетических параметров, характеризующие АСК, приведены в табл.5.
В нулевой точке (перед вводом препарата) исследование проб крови у всех кроликов не выявило присутствия в сыворотке Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината. В последующие сроки наблюдения в пробах крови было обнаружено достаточное для анализа количество препаратов. Значения концентрации Этилметилгидроксипиридина малата в дискретные интервалы времени после введения капсул исследуемого препарата приведены в таблице 6. Табл.7 содержит индивидуальные и средние значения основных фармакокинетических параметров, характеризующих препарат.
Результаты теста кинетики высвобождения действующих веществ из препарата АСК+Этилметилгидроксипиридина малат и АСК+Этилметилгидроксипиридина сукцинат капсулы 75 мг+100 мг.
Среда растворения - ацетатный буферный раствор с рН 4,5, объем среды растворения - 500 мл, скорость вращения корзинки - 100 об/мин, время растворения - 45 мин. Метод количественного определения - ВЭЖХ.
Условия хроматографирования: - хроматографическая колонка из нержавеющей стали размером 150×4 мм Simmetry С18 (Waters США), заполненная обращенно-фазовым сорбентом с размером частиц 5 мкм, или аналогичная при условии выполнения теста "Проверка пригодности хроматографической системы":
Как следует из результатов теста, в первые 15 мин высвобождение действующих веществ из препарата находится на уровне 95-97%, что позволяет считать кинетику растворения компонентов препарата эквивалентной, а действие малотоксичных производных 3-гидроксипиридина обеспечивающим защитный эффект от раздражающего действия АСК на слизистую оболочку желудка и двенадцатиперстной кишки. Также в силу того, что Этилметилгидроксипиридина малат и Этилметилгидроксипиридина сукцинат обладают гораздо меньшей токсичностью (патент РФ №2377237), чем известные препараты с атерогентной и липидрегулирующей активностью, также менее токсичны заявляемые комбинации известных препаратов с вышеназванной активностью.
Исследование фармакокинетики препаратов (АСК+Этилметилгидроксипиридина малат и АСК+Этилметилгидроксипиридина сукцинат) на животных показало, что уровень максимальной концентрации АСК в крови достигается через 0,58 часа после однократного введения капсул per os; период полувыведения (Т1/2β) - 0,6 часа; уровень максимальной концентрации производного этилметилгидроксипиридина в крови достигается через 0,54 часа; период полувыведения (T1/2β) - 1,52 часа.
Полученные результаты свидетельствуют об отсутствии изменения фармакокинетических параметров отдельных компонентов препарата, включенных в комбинацию, что подтверждается эквивалентной кинетикой растворения компонентов препарата.
Результаты исследования гастропротекторной активности комбинации АСК+Этилметилгидроксипиридина малат представлены в таблицах 9 и 10.
Близкие результаты получены и для комбинации АСК+Этилметилгидроксипиридина сукцинат.
Как следует из результатов эксперимента, тяжесть поражения слизистой оболочки желудка при пероральном введении мышам АСК (200 мг/кг) существенно превышает тяжесть поражения органа, наблюдаемую при стресс-опосредованной, спиртопреднизолоновой и диклофенакмелоксикамовой экспериментальной патологии. В слизистой оболочке желудка у мышей к концу третьих суток наблюдения выявились не только многочисленные эрозии, но и язвенные дефекты.
АСК+Этилметилгидроксипиридина малат и АСК+Этилметилгидроксипиридина сукцинат оказывали существенное гепатопротекторное действие, выражавшееся в снижении тяжести поражения, частоты и множественности поражения слизистой, существенном уменьшении величины язвенного индекса, ограничении числа язвенных и эрозивных дефектов. Интенсивность поражения слизистой 12-перстной кишки была несколько ниже. В слизистой органа не выявлялись язвенные образования, но число эрозий было значительным. В связи с этим все интегральные показатели, в основном, определялись интенсивностью эрозивного процесса. Комбинация АСК и производного 3-гидроксипиридина статистически достоверно снижал тяжесть поражения и среднее число эрозий.
Таким образом, доказано, что комбинация АСК и производного 3-гидроксипиридина, в качестве которого предлагается Этилметилгидроксипиридина малат или Этилметилгидроксипиридина сукцинат, обладает антиагрегантной, липидрегулируещей и гастропротекторной активностями. Кроме того, данная комбинация в силу того, что Этилметилгидроксипиридина малат и Этилметилгидроксипиридина сукцинат обладают гораздо меньшей токсичностью (патент РФ №2377237), чем известные препараты с атерогентной и липидрегулирующей активностью, также менее токсична, чем заявляемые комбинации известных препаратов с вышеназванной активностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ И ЛИПИДРЕГУЛИРУЮЩЕЙ АКТИВНОСТЯМИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2461379C2 |
| 2-ЭТИЛ-6-МЕТИЛ-3-ГИДРОКСИПИРИДИНИЙГИДРОКСИБУТАНДИОАТ, ОБЛАДАЮЩИЙ ПРОТИВОИШЕМИЧЕСКОЙ, ЦЕРЕБРОПРОТЕКТОРНОЙ, НЕЙРОТРОПНОЙ И ЛИПИДРЕГУЛИРУЕМОЙ АКТИВНОСТЯМИ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2008 |
|
RU2377237C1 |
| ПРОТИВОИШЕМИЧЕСКОЕ И АНТИАТЕРОСКЛЕРОТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1998 |
|
RU2144822C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАММА-L-ГЛУТАМИЛГИСТАМИНА, ПРИМЕНЕНИЕ ГАММА-L-ГЛУТАМИЛГИСТАМИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2141968C1 |
| Новое производное 3-гидроксипиридина, обладающее липидрегулирующей активностью | 2020 |
|
RU2743923C1 |
| АНТИГИПЕРЛИПИДЕМИЧЕСКОЕ СРЕДСТВО (ВАРИАНТЫ) | 2002 |
|
RU2228746C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА | 2011 |
|
RU2468789C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГИПОЛИПИДЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2268714C1 |
| Средство, проявляющее гепатопротекторную, липидрегулирующую, противоишемическую и нейротропную активность | 2018 |
|
RU2705575C1 |
| СПОСОБ ПРОФИЛАКТИКИ НАРУШЕНИЙ ЛИПИДНОГО ОБМЕНА | 2009 |
|
RU2423123C1 |
Предложена твердая дозированная фармацевтическая композиция, содержащая комбинацию Ацетилсалициловой кислоты и Этилметилгидроксипиридина малата или Этилметилгидроксипиридина сукцината, обладающая антиагрегантной, липидрегулируещей и гастропротекторной активностями. Показано значительное увеличение срока хранения твердой лекарственной формы. Результаты фармакологического и фармакокинетического изучения новой композиции делают ее перспективной в производстве твердых дозированных лекарственных препаратов для профилактики и лечения ожирения, патологических состояний сердечно-сосудистой системы, профилактики ишемических нарушений с выраженным атеросклерозом, перенесенного инфаркта, ишемического инсульта, заболеваний периферических артерий. 10 табл.
Твердая дозированная фармацевтическая композиция, содержащая комбинацию ацетилсалициловой кислоты и этилметилгидроксипиридина малата или этилметилгидроксипиридина сукцината, обладающая антиагрегантной, липидрегулирующей и гастропротекторной активностями.
| НАЧКИНА Э.И | |||
| Влияние мексидола и альфа-токоферола на некоторые показатели гомеостаза при введении ацетилсалициловой кислоты в эксперименте | |||
| Автореф | |||
| дисс | |||
| на соиск | |||
| уч | |||
| степ | |||
| канд | |||
| мед | |||
| наук | |||
| - Саранск, 2003, с.1-22, с.6 строки 3-6, 27-29, с.19 строки 7-13, с.20 строки 15-21, выводы 1,5, практические рекомендации | |||
| РЛС ЭНЦИКЛОПЕДИЯ ЛЕКАРСТВ | |||
| - М.: |
Авторы
Даты
2012-06-20—Публикация
2010-12-09—Подача