Данная заявка претендует на приоритет предварительной заявки на патент США № 60/691920.
Область изобретения
Изобретение относится к способам лечения рака костей, в частности метастатического рака костей, путем введения антагониста IGF-IR и/или PDGFRα. Изобретение также относится к антителам, которые связываются с PDGFRα человека и нейтрализуют активацию рецептора. Дополнительно изобретение относится к способам нейтрализации активации PDGFRα и к способам лечения млекопитающего с неопластическими заболеваниями с использованием антител по отдельности или в сочетании с другими агентами.
Предпосылки создания изобретения
Рак предстательной железы представляет собой наиболее распространенный вид рака среди мужчин, при этом ежегодно в Соединенных Штатах Америки появляется около 220000 новых случаев заболевания и 29000 смертей. Существенная часть мужчин, у которых диагностирован рак предстательной железы, имеет метастатическое заболевание. В дальнейшем метастазы, в конечном счете, развиваются у множества других пациентов с раком предстательной железы несмотря на хирургическое лечение и лучевую терапию. Кости являются наиболее обычным местом появления метастазов при раке предстательной железы, а также часто местом метастазов при раке молочной железы и раке легких. Большинство метастазов при раке предстательной железы является андроген-зависимыми, так что имеется быстрая ответная реакция на хирургическую или медицинскую кастрацию, но фактически у всех пациентов опухоль в конечном счете становится андроген-независимой, приводя к значительной заболеваемости и смертности. При появлении метастазов в костях доступная в настоящее время терапия имеет ограниченное действие. Наиболее эффективная одобренная терапия, описанная для метастатического рака предстательной железы (введение доцетаксела), увеличивает среднее время жизни приблизительно на три месяца (Petrylak et al., 2004, N.Engl. J.Med. 351:1513; Tannock et al., 2004, N.Engl. J.Med. 351: 1502). Соответственно срочно требуется новая терапия для метастатического рака костей.
Рецептор инсулиноподобного фактора роста (IGF-IR) представляет собой повсеместный трансмембранный рецептор тирозинкиназы, который является неотъемлемым для нормального эмбрионального и постнатального роста и развития. IGF-IR располагается на поверхности клетки большинства клеточных типов и служит в качестве сигнальной молекулы для факторов роста IGF-I и IGF-II (обобщенно называемые далее IGFs). IGF-IR может стимулировать пролиферацию клеток, дифференциацию клеток, изменения размера клеток и защищать клетки от апоптоза. Также рассматривалось, что он является квазиобязательным для трансформации клетки (обзор Adamd et al., Cell. Moll.Life. Sci. 57:1050-93 (2000); Baserga Oncogene 19: 5574-81 (2000)). Сообщалось о высоких уровнях экспрессии IGF-IR в образцах тканей в костных метастазах при раке предстательной железы. Кости содержат наиболее большой запас IGFs в организме.
IGF-IR представляет собой предварительно сформированный гетеротетрамер, содержащий две альфа- и две бета-цепи, связанные дисульфидными связями. Субъединицы рецептора синтезируются как часть единой полипептидной цепи в 180 кДа, которая затем протеолитически перерабатывается в альфа- (130 кДа) и бета- (95 кДа) субъединицы. Полная альфа-цепь является внеклеточной и содержит сайт для лигандного связывания. Бета-цепь содержит тренсмембранный домен, домен тирозинкиназы и С-концевое удлинение, которое необходимо для дифференциации и трансформации клеток, но несущественно для митогенной передачи сигнала и защиты от апоптоза.
IGF-IR чрезвычайно схож с рецептором инсулина (IR), в частности, в рамках последовательности бета-цепи (70% гомологичность). Вследствие такой гомологии недавние исследования продемонстрировали, что данные рецепторы могут образовывать гибриды, содержащие один димер IR и один димер IGF-IR (Pandini et al., Clin.Canc.Res. 5:1935-19 (1999)). Образование гибридов происходит как в нормальных, так и в трансформированных клетках, и содержание гибрида зависит от концентрации двух гомодимерных рецепторов (IR и IGF-IR) внутри клетки. Хотя гибридные рецепторы состоят из пар IR и IGF-IR, гибриды связываются селективно с IGF с аффинностью, подобной аффиности для IGF-IR, и лишь слабо связывают инсулин (Siddle and Sons, The IGF System. Humana Press, pp. 199-225, 1999). Следовательно, данные гибриды могут связывать IGF и преобразовывать сигналы как в нормальных, так и в трансформированных клетках.
Второй рецептор IGF, IGF-IIR, или манноза-6-фосфатный (М6Р) рецептор, также связывает лиганд IGF-II с высокой аффинностью, но не имеет тирозинкиназной активности. Поскольку он приводит к деградации IGF-II, то рассматривается как агент, ослабляющий IGF-II, антагонизируя действие данного лиганда, промотирующее рост. Потеря IGF-II в опухолевых клетках может усиливать потенциал роста за счет высвобождения его антагонизирующего действия на связывание IGF-II с IGF-IR (Byrd et al., J.Biol.Chem. 274:24408-16 (1999)).
Альфа- и бета-рецепторы тромбоцитарного фактора роста (PDGFRα и PDGFRβ) представляют собой рецепторы тирозинкиназ типа III. PDGFRα является решающим для развития и осуществления важных функций в период полового созревания. Например, мыши, гомозиготные в отношении нулевой мутации, умирают в процессе эмбриогенеза. На более поздних стадиях развития PDGFRα экспрессируется во многих мезинхимальных структурах, где смежные эпителиальные клетки продуцируют тромбоцитарные факторы роста (PDGFRs). Образцы тканей нормальной и гиперплазированной предстательной железы дают отрицательный тест в отношении PDGFRα, тогда как первичные опухоли предстательной железы и скелетная масса от подходящих субъектов экспрессируют PDGFRα. Кроме того, для линий клеток предстательной железы, полученных из разных мест метастазов, PDGFRα обнаруживается в полученных из костных метастазов клетках РС3, но не в клеточных линиях, полученных из метастазов в лимфатические узлы (LNCaP) и мозг (DU-145).
Семейство тромбоцитарных факторов роста состоит из пяти различных дисульфидно-связанных димеров PDGF-AA, -BB, -AB, -CC и -DD, которые действуют посредством PDGFRα и PDGFRβ. Данные факторы роста представляют собой димерные молекулы, состоящие из дисульфидно-связанных полипептидных цепей, которые связываются с двумя рецепторными белками одновременно и индуцируют димеризацию рецептора, автофосфорилирование и внутриклеточную передачу сигнала. PDGFRα и PDGFRβ являются структурно подобными и могут образовывать гетеродимеры, а также гомодимеры. Поскольку PDGFRβ не связывает с высокой аффинностью цепь PDGF-A, PDGF-AA активирует только αα димеры рецепторов, тогда как PDGF-AB и PDGF-СС активирует гетеродимеры рецепторов αα и αβ.
Краткое изложение сущности изобретения
Данное изобретение относится к лечению первичных и метастатических костных опухолей, включая опухоли, происходящие от предстательной железы, молочной железы или легких, экспрессирующих рецептор инсулиноподобного фактора роста-I (IGF-IR) и/или альфа-рецептор тромбоцитарного фактора роста (PDGFRα).
Опухоли, предназначенные для лечения, могут представлять собой гормон/андроген зависимые или гормон/андроген независимые, которые могут иметь происхождение, например, из предстательной железы, молочной железы или легкого.
Изобретение относится к способам лечения субъекта, имеющего костную опухоль, и к способам ингибирования роста костной опухоли. Способы включают введение эффективного количества антагониста IGF-IR или эффективного количества антагониста PDGFRα. Антагонисты рецепторов включают антитела и фрагменты антител, а также внутриклеточные ингибиторы, представляющие собой небольшие молекулы.
Изобретение относится к антителам против IGF-IR или против PDGFRα, которые связываются с рецептором-мишенью и ингибируют связывание лиганда. Изобретение также относится к антителам и другим антагонистам, которые нейтрализуют активацию IGF-IR или PDGFRα. Кроме того, некоторые антитела промотируют понижающее регулирование их рецепторов-мишеней, например, путем интернализации и/или деградации. Соответственно антитела и антагонисты, представляющие собой небольшие молекулы, функционируют для ингибирования активации сигнальных молекул в прямом направлении, таких как Akt, p42/p44 и MAPK.
Способы включают применение антагонистов IGF-IR или PDGFRα по отдельности, в сочетании друг с другом или в сочетании с другими лекарственными средствами против рака, такими как химиотерапия и лучевая терапия.
Изобретение также относится к антителам и фрагментам антител, которые связываются с PDGFRα, а также нуклеотидам и клетке-хозяину для продуцирования данных антител. Антитела блокируют связывание лиганда и нейтрализуют активацию рецептора. Изобретение также относится к применению антител по отдельности, в сочетании с другими антагонистами рецептора или противоопухолевыми агентами или в виде конъюгатов для лечения новообразования. Антитела против PDGFRα используют для лечения, например, опухолей яичников, опухолей молочной железы, опухолей легких, гепатоклеточных опухолей, опухолей стромальных клеток желудочно-кишечного тракта, меланом, почечно-клеточных карцином, опухолей предстательной железы и саркомы мягких тканей.
Описание фигур
На фиг.1 показан рост подкожных ксенотрансплантатов опухолей LuCaP 35V у кастрированных мышей SCID во время периода лечения, начатого, когда опухоли достигали 150-200 мм3. Полоса А: необработанный контроль; полоса В: животные получали в течение четырех недель только доцетаксел (или 10 мг/кг, или 20 мг/кг) сам по себе или в сочетании с антителами против IGF-IR (40 мг/кг IMC-A12); полоса С: уровни PSA в сыворотке крови у не получавших и получавших лечение мышей SCID, имеющих подкожные ксенотрансплантированные опухоли LuCaP 35V. Мыши, получавшие лечение, получали только доцетаксел (20 мг/кг) или доцетаксел (или 10 мг/кг, или 20 мг/кг) в сочетании с антителами против IGF-IR (40 мг/кг IMC-A12). Лечение начинали, когда опухоли достигали 150-200 мм3, и прекращали через четыре недели.
На фиг.2 показаны суспензии отдельных клеток ксенотрансплантатов опухолей LuCaP 35V, обработанных только доцетакселом (10 мг/кг) (полоса А) или в сочетании с антителами против IGF-IR (40 мг/кг IMC-A12) (полоса В). Поле, помеченное R1, соответствует апоптическим клеткам с фрагментированной ДНК (повышенное введение метки FITC).
На фиг.3 показан синтез ДНК (поглощение BrDu) в ксенотрансплантатах опухолей после окончания лечения доцетакселом (10 мг/кг или 20 мг/кг) по отдельности или в сочетании с антителами против IGF-IR (40 мг/кг IMC-A12).
На фиг.4 показана дифференциальная экспрессия генов, связанных с агрессивностью опухоли предстательной железы (TUBB), устойчивостью к антиандрогенной терапии (BIRC 5) и индукцией апоптоза (IGFBP3) в опухолевых клетках предстательной железы в качестве ответной реакции на лечение доцетакселом и А12 и только доцетакселом.
На фиг.5 показаны уровни А12 в сыворотке крови после прекращения лечения.
На фиг.6 показана масса тела (мера общей цитотоксичности) не болевших животных, которые получали постоянно доцетаксел (или 10 мг/кг, или 20 мг/кг) по отдельности или в сочетании с антителами против IGF-IR (40 мг/кг IMC-A12).
На фиг.7 показан эффект лечения с использованием антитела против IGF-IR (IMC-A12) на ксенотрансплантат-продуцированном PSA у мышей SCID, которым были привиты клетки LuCaP 23.1.
На фиг.8 показана серия рентгеновских снимков мышей SCID, которым были привиты клетки LuCaP 23.1. Мыши А-12 получали 40 мг/кг IMC-A12 внутрибрюшинно три раза в неделю в течение шести недель. Рентгеновские снимки были сделаны в момент смерти.
На фиг.9 показаны уровни PSA (а) и иллюстративные рентгеновские снимки (b) мышей SCID с ксенотрансплантатами клеток LuCaP 23.1 предстательной железы человека внутри большой берцовой кости.
На фиг.10 показано действие жидкости, выделенной из костного мозга человека, на активность Akt в клетках рака предстательной железы. Лизаты клеток подвергали SDS-PAGE. Для вестерн-блот анализа мембраны блотировали антителами, нацеленными на фосфо-Akt (Ser-473, cell signaling Technology), PDGFRα (R&D Systems) и актином (Sigma). Первичное связывание антитела обнаруживали с использованием HRP-конъюгированного белка А или белка G (Sigma).
На фиг.11 показана индукция и ингибирование АКТ-фосфорилирования в клетках PC3-ML. Полоса А показывает ингибирование посредством AG-1296 доза-зависимым образом фосфорилирования Akt в клетках, подвергнутых действию PDFG-BB. Полоса В показывает фосфорилирование Akt с помощью костного аспирата и ингибирование с использованием 20 мкМ AG-1296. Полоса С показывает эффективность аспирата костного мозга в отношении индуцирования фосфорилирования Akt по сравнению с эффективностью комбинации 100 пг/мл PDGF-AA и 100 пг/мл PDGF-ВВ. На полосе D проведено сравнение по величине фосфорилирования Akt аспиратом костного мозга, ингибирование индуцированного костным мозгом фосфорилирования Akt с помощью AG-1296 и фосфорилирования Akt, индуцированного посредством PDGF-AA+ PDGF-ВВ.
На фиг.12 показано ингибирование фосфорилирования Akt в клетках PC3-ML посредством антагонистов PDGFRα. Полоса А показывает доза-зависимое действие моноклонального антитела IMC-3G3 на фосфорилирование Akt, индуцированное 30 нг/мл PDGF-ВВ. Полосы В и С дают возможность сравнения действия IMC-3G3 и AG-1296 на индуцированное костным мозгом фосфорилирование Akt. Полоса D показывает, что ингибирование фосфорилирования Akt зависит от времени предварительной инкубации IMC-3G3.
На фиг.13 показано связывание антитела с PDGFRα. А: непосредственное связывание антитела против PDGFRα с иммобилизованным внеклеточным доменом PDGFRα. В: ингибирование связывания [125I]PDGF-AA с иммобилизованным PDGFRα.
На фиг.14 показано специфическое ингибирование фосфорилирования PDGFRα и эффекторных молекул в прямом направлении.
На фиг.15 показано ингибирование посредством mAbs стимулированного PDGF-AA внедрения [3Н]тимидина в клетки РАЕ Rα.
На фиг.16 показано ингибирование индуцированной PDGF-AA активации эффекторных молекул в прямом направлении в клетках SKLMS-1 (A) и U118(B).
На фиг.17 показано ингибирование посредством mAbs стимулированного PDGF-AA внедрения [3Н]тимидина в клетки U118 (А) и SKLMS-1 (В). Ингибирование стимулированного PDGF-ВВ внедрения [3Н]тимидина также показано для клеток SKLMS-1 (С) и U118 (D).
На фиг.18 показано доза-зависимое действие при обработке развитых ксенотрансплантатов опухолей U118 (глиобластома, полоса А) и SKLMS-1 (лейомиосаркома, полоса В) у бестимусных мышей.
На фиг.19 показано уменьшение фосфорилирования PDGFRα in vivo в опухолях U118, обработанных антителом против PDGFRα, по сравнению с обработкой неспецифическим IgG человека.
На фиг.20 показаны векторы экспрессии GS, использованные для клонирования полученных из гибридомы генов вариабельных областей VH и VK человека и экспрессии полных тяжелых (IgG1) и легких цепей белков. Два вектора были рекомбинированы, как объяснено в примерах, и объединенный вектор был трансфектирован в клетки NS20.
Подробное описание изобретения
Настоящее изобретение относится к лечению костных опухолей с использованием антител или фрагментов антител, которые связываются с рецептором инсулиноподобного фактора роста (IGF-IR). Эндокринная экспрессия IGF-I в первую очередь регулируется гормоном роста, и он продуцируется в печени, но другие типы тканей также способны экспрессировать IGF-I, включая кости, которые содержат большой запас факторов роста. В зависимости от типа опухолевых клеток, IGF-I вовлекается в эндокринное, паракринное и/или аутокринное регулирование (Yu, H. and Rohan, J., J.natl. Cancer Inst., 92: 1472-89 (2000)).
Установлено, что антитела, которые связывают IGF-IR, полезны при терапии для лечения костных опухолей, которые экспрессируют IGF-IR. Антитела можно использовать сами по себе или в сочетании с другими видами лечения рака, в частности с химиотерапией. Анти-IGF-IR терапия, сама по себе или в сочетании с терапией с использованием одного или более противораковых агентов (таких, например, как химиотерапия или лучевая терапия), имеет значительную терапевтическую эффективность. Подавление роста опухоли часто сопровождается увеличением апоптоза и сохраняется после прерывания всего лечения, а опухоли у животных, которых лечили только с использованием химиотерапии, опять начинают расти.
Также было установлено, что PDGFRα играет важную роль в росте костных опухолей. Например, некоторые опухолевые клеточные линии, которые экспрессируют PDGFRα, предпочтительно метастазируют в кость. Такие клеточные линии проявляют повышенную активацию PDGFRα и фосфорилирование сигнальных молекул в прямом направлении в ответ на растворимые факторы, присутствующие в костном мозге. Активация PDGFRα костного мозга уменьшается или полностью ингибируется антагонистами PDGFRα, и фосфорилирование сигнальных молекул в прямом направлении, которые обычно активируются посредством передачи сигнала через PDGFRα и другие рецепторные системы тирозинкиназы, снижается в значительной степени. Некоторые данные позволяют предположить, что путь выживаемости PI3K/Akt активируется путем передачи сигнала с помощью PDGFRα не только за счет лигандов, которые непосредственно активируют PDGFRα, но также и факторов, присутствующих в костном мозге, которые вызывают трансактивацию рецептора.
Первичные костные опухоли, предназначенные для лечения согласно изобретению, включают, но не ограничиваются указанным, остеосаркомы, хондросаркомы, фибросаркомы и гемангиосаркомы. Примечательно, что злокачественные вторичные (метастатические) опухоли являются намного более обычными, чем первичные костные опухоли. Метастатические костные опухоли, предназначенные для лечения согласно изобретению, могут возникать из множества источников, наиболее обычными из которых являются раковые заболевания предстательной железы, молочной железы или легких. Источник метастатического рака костей обычно будет очевиден из истории болезни пациента. Опухоли могут быть остеобластными или остеолитическими. Опухоли в момент появления могут быть зависимыми от стимуляции IGF-IR, или они могут переходить в IGF-IR-зависимые. Например, раковые заболевания предстательной железы или метастазы раковых заболеваний предстательной железы, которые первоначально являются гормон/андроген-зависимыми и с которыми можно бороться физическими или химическими методами лечения, которые подавляют продуцирование андрогена или гормона, могут стать гормон/анроген независимыми благодаря повышенной чувствительности к стимуляции посредством IGF-IR. Более того, в дополнение к разработке лечения для гормон/андроген-независимых опухолей, данное изобретение можно использовать для лечения гормон/андроген-зависимых костных опухолей без уверенности на подавление продуцирования андрогена или гормона, например, путем совместного применения антител против IGF-IR вместе с противоопухолевыми агентами. Такие опухоли могли бы включать метастатические костные опухоли, которые стимулируются IGF-IR в IGF-обогащенной окружающей среде кости, которые могут быть чувствительными к гормональной стимуляции, но недостаточно чувствительными для роста без вовлечения IGF. Удаление гормонов может не требоваться для таких опухолей.
Костные опухоли, которые являются PDGF-зависимыми, также можно лечить в соответствии с изобретением, а также опухоли, которые являются зависимыми от «костного мозга». Зависимые от костного мозга опухоли проявляют активацию PDGFRα в качестве ответной реакции на растворимые факторы, присутствующие в костном мозге. Например, как проиллюстрировано в данном изобретении, метастатическая экспрессирующая PDGFRα раковая клеточная линия человека претерпевает активацию PDGFRα и фосфорилирование Akt+ при воздействии аспирата костного мозга. Антитело против PDGFRα, а также небольшие молекулы, являющиеся антагонистами PDGFRα, ингибируют активацию PDGFRα и фосфорилирование Akt+ для данной клеточной линии. Растворимые факторы костного мозга, которые активируют PDGFRα, включают, но не ограничиваются указанным, PDGF-АА и -ВВ.
Хотя такая зависимость от костного мозга включает передачу сигнала через PDGFRα, она может не включать только связывание PDGFRα лигандом PDGFRα. Например, как проиллюстрировано в данном описании, отмечено, что активация PDGFRα определенными лигандами (PDGF-АА или -ВВ) слабее, чем активация аспиратом костного мозга. Более того, наблюдается, что в присутствии аспирата костного мозга фосфорилирование Akt+ уменьшается при увеличении времени инкубации. Совместно данные результаты позволяют предположить, что помимо ответной реакции на связывание PDGF, PDGFRα может трансактивироваться (фосфорилироваться) другими элементами сигнальной трансдукции (например, другими тирозинкиназами рецепторов), чувствительными к другим компонентам костного мозга. В любом случае, в клеточной линии, подходящей для метастатического роста в кости (т.е. клеточная линия, которая предпочтительно метастазирует в кости), наблюдается зависимая от костного мозга активация PDGFRα, которая ингибируется антагонистами PDGFRα. Помимо этого, лечение с использованием антагониста PDGFRα ингибирует индуцированную костным мозгом стимуляцию противоапоптического пути PI3K/Akt и митоген-активированную протеинкиназу (МАРK).
Костные опухоли, предназначенные для лечения с использованием антагониста PDGFRα, могут возникать в качестве метастазов раковых клеток предстательной железы и, как и выше, могут быть гормонально/андроген зависимыми или перейти в гормонально/андроген независимые. Такие опухоли могут также возникать в качестве метастазов на рак, отличный от рака предстательной железы. Специалист в данной области будет способен легко диагностировать такие состояния и нарушения с использованием известных обычных исследований.
Термин «лечение» означает любое лечение заболевания у животного и включает (1) профилактику возникновения заболевания у млекопитающего, которое может быть предрасположенным к заболеванию, но у которого еще не наблюдается заболевания или не проявляются симптомы заболевания; например предотвращение начала клинических симптомов; (2) ингибирование заболевания, например остановку его развития; или (3) оказание помощи при заболевании, например вызов регрессии симптомов заболевания. Ингибирование роста опухоли включает замедление или остановку роста, а также регрессию опухоли. Выражение «эффективное количество для лечения заболевания» означает то количество, которое при введении нуждающемуся в этом млекопитающему является достаточным для лечения данного заболевания, как определено выше. Антагонист IGF-IR и антагонист PDGFRα по данному изобретению можно вводить по отдельности, в сочетании друг с другом или в сочетании с одним или несколькими противоопухолевыми агентами, такими как, например, химиотерапевтический агент или радиологический агент.
В одном из вариантов осуществления изобретения может оказаться желательным определение уровня экспрессии IGF-IR и/или PDGFRα в опухоли, предназначенной для лечения. В таких случаях берут биопсийную пробу опухоли и анализируют ее методами, хорошо известными в данной области. В другом варианте осуществления изобретения антагонист IGF-IR или антагонист PDGFRα применяют на основании того, что соответствующий рецептор обычно экспрессируется или активируется в определенном типе опухоли или без исключений начинает экспрессироваться или активироваться по мере прогрессирования заболевания.
Антагонист IGF-IR может представлять собой внеклеточный антагонист или внутриклеточный антагонист, и можно использовать более одного антагониста. Внеклеточные антагонисты включают, но не ограничиваются указанным, белки или другие биологические молекулы, которые связываются с IGF-IR или одним или несколькими его лигандами (например, IGF-I и IGF-II являются природными лигандами IGF-IR). В варианте осуществления изобретения внеклеточный антагонист ингибирует связывание IGF-IR с его лигандами. В одном варианте осуществления антагонист представляет собой антитело против IGF-IR, такое как, например, IMC-A12. В другом варианте осуществления антагонист представляет собой растворимый лиганд-связывающий фрагмент IGF-IR. Внутриклеточные антагонисты IGF-IR могут представлять собой биологические молекулы, но обычно представляют собой небольшие молекулы. Примеры включают, но не ограничиваются указанным, ингибитор тирозинкиназы AG1024 (Calbiochem), ингибитор киназы рецептора инсулиноподобного фактора роста-I NVP-AEW541 (Novartis), ингибитор рецептора инсулиноподобного фактора роста-I/инсулина BMS-554417 (Bristol Myers Squibb). Следует понимать, что используемые небольшие молекулы для применения в данном изобретении представляют собой ингибиторы IGF-IR, но они не должны быть полностью специфичными в отношении IGF-IR.
Антитела против IGF-IR для использования в соответствии с настоящим изобретением проявляют одно или несколько из следующих свойств:
1) антитела связываются с внешним доменом IGF-IR и ингибируют связывание IGF-I или IGF-II с IGF-IR. Ингибирование может быть определено, например, путем анализа непосредственного связывания с использованием очищенных или мембранно-связанных рецепторов. В данном варианте осуществления антитела по настоящему изобретению или их фрагменты предпочтительно связывают IGF-IR по меньшей мере также сильно, как и природные лиганды IGF-IR (IGF-I и IGF-II).
2) Антитела нейтрализуют IGF-IR. Связывание лиганда, например IGF-I и IGF-II, с внешним, внеклеточным доменом IGF-IR стимулирует автофосфорилирование бета-субъединицы и сигнальных молекул, включая МАРK, Akt и IRS-1, в прямом направлении.
Нейтрализация IGF-IR включает ингибирование, снижение, дезактивацию и/или нарушение одной или нескольких данных видов активности, обычно связанных с сигнальной трансдукцией. Нейтрализация может быть определена in vivo, ex vivo или in vitro с использованием, например, тканей, культивированных клеток или очищенных клеточных компонентов. Нейтрализация включает ингибирование гетеродимеров IGF-IR/IR, а также гомодимеров IGF-IR. Таким образом, нейтрализация IGF-IR имеет множество действий, включая ингибирование, снижение, дезактивацию и/или нарушение роста (пролиферации и дифференциации), ангиогенез (восстановление кровеносных сосудов, инвазия и метастазы) и подвижность клеток и метастазы (адгезия и инвазивность клеток).
Одной мерой нейтрализации IGF-IR является ингибирование тирозинкиназной активности рецептора. Ингибирование тирозинкиназы может быть определено с использованием хорошо известных способов, например путем измерения уровня автофосфорилирования рекомбинантного рецептора киназы и/или фосфорилирования природных или синтетических субстратов. Таким образом, анализы фосфорилирования могут использоваться для определения нейтрализующих антител в контексте настоящего изобретения. Фосфорилирование может быть обнаружено, например, с использованием антитела, специфического в отношении фосфотирозина в анализе ELISA или вестерн-блоте. Некоторые анализы активности тирозинкиназы описаны в Panek et al., J.Pharmacol. Exp.Thera. 283:1433-44 (1997), и Batley et al., Life Sci., 62:143-50 (1998). Антитела по изобретению вызывают уменьшение фосфорилирования тирозина IGF-IR по крайней мере примерно на 75%, предпочтительно по крайней мере примерно на 85% и более предпочтительно по крайней мере примерно на 90% в клетках, которые дают ответную реакцию на лиганд.
Другой мерой нейтрализации IGF-IR является ингибирование фосфорилирования субстратов IGF-IR в прямом направлении. Соответственно может быть измерен уровень фосфорилирования МАРK, Akt или IRS-1. Фосфорилирование снижается по крайней мере примерно на 40% и может снижаться по крайней мере примерно на 60% или по крайней мере примерно на 80%.
Кроме того, способы обнаружения экспрессии белка можно использовать для определения нейтрализации IGF-IR, при которых измеряемые белки регулируются путем тирозинкиназной активности IGF-IR. Данные способы включают иммуногистохимический (IHC) для обнаружения экспрессии белка, флуоресцентный in situ гибридизации (FISH) для обнаружения амплификации гена, анализы конкурентного связывания радиоактивных лигандов, методы блоттинга на твердых матрицах, такие как нозерн- и саузерн-блоты, полимеразно-цепная реакция обратной транскриптазы (PCR) и ELISA. См., например, Grandis et al., Cancer, 78:1284-92 (1996); Shimizu et al., Japan J. Cancer Res., 85:567-71 (1994); Sauter et al., Am. J. Path., 148:1047-53 (1996); Collins, Glia 15:289-96 (1995); Radinsky et al., Clin. Cancer Res. 1:19-31 (1995); Petrides et al., Cancer Res. 50:3934-39 (1990); Hoffinann et al., Anticancer Res. 17:4419-26 (1997); Wikstrand et al., Cancer Res. 55:3140-48 (1995).
Анализы ex vivo также можно использовать для определения нейтрализации IGF-IR. Например, ингибирование тирозинкиназы рецептора можно наблюдать путем митогенных анализов с использованием клеточных линий, стимулированных с помощью лиганда рецептора в присутствии и в отсутствие ингибитора. Линия MCF7 рака молочной железы (Американская коллекция типовых культур (АТСС), Rockville, MD) представляет собой такую клеточную линию, которая экспрессирует IGF-IR и стимулируется посредством IGF-I или IGF-II. Другой способ включает тестирование в отношении ингибирования роста экспрессирующих IGF-IR опухолевых клеток или клеток, трансфектированных для того, чтобы экспрессировать IGF-IR. Ингибирование также можно наблюдать с использованием опухолевых моделей, например клеток опухолей человека, введенных мыши.
Антитела по настоящему изобретению не ограничены каким-либо конкретным механизмом нейтрализации IGF-IR. Антитела против IGF-IR по настоящему изобретению могут связываться с внешней стороны с поверхностным клеточным рецептором IGF-IR, блокировать связывание лиганда (например, IGF-I или IGF-II) и последующую сигнальную трансдукцию, опосредованную через связанную с рецептором тирозинкиназу, и предотвращать фосфорилирование IGF-IR или других белков в прямом направлении в каскаде сигнальной трансдукции.
3) Антитела оказывают отрицательную негативную модуляцию IGF-IR. Количество IGF-IR, присутствующее на поверхности клетки, зависит от продуцирования, интернализации и разложения рецепторного белка. Количество IGF-IR, присутствующее на поверхности клетки, может быть измерено косвенно путем обнаружения интернализации рецептора или молекулы, связанной с рецептором. Например, интернализация рецептора может быть измерена путем контактирования клеток, которые экспрессируют IGF-IR, с меченым антителом. Мембранно-связанное антитело затем отделяют, собирают и считывают радиоактивность. Интернализованное антитело определяют посредством лизирования клеток и обнаружения метки в лизатах.
Другой способ заключается в прямом измерении количества рецептора, присутствующего на клетках после обработки с помощью антитела против IGF-IR или другого вещества, например с помощью анализа клеток, окрашенных в отношении поверхностной экспрессии IGF-IR, с использованием клеточного сортинга с возбуждением флуоресценции. Окрашенные клетки инкубируют при 37°С и измеряют интенсивность флуоресценции во времени. В качестве контроля часть окрашенных клеток можно инкубировать при 4°С (условия, при которых прекращается интернализация рецептора).
IGF-IR на клеточной поверхности может быть обнаружен и измерен с использованием другого антитела, которое является специфическим по отношению к IGF-IR и которое не блокирует или не конкурирует в связывании с тестируемым антителом (Burtrum et al. Cancer Res. 63: 8912-21 (2003)). Обработка клетки, экспрессирующей IGF-IR, антителом по изобретению приводит к снижению IGF-IR на клеточной поверхности. В предпочтительном варианте осуществления снижение в качестве ответной реакции на обработку антителом по изобретению составляет по крайней мере примерно 70%, более предпочтительно по крайней мере примерно 80% и еще более предпочтительно по крайней мере примерно 90%. Значительное снижение может наблюдаться по меньшей мере в течение четырех часов.
Другой мерой снижения модулирования является уменьшение общего рецепторного белка, присутствующего в клетке, и она отражает разрушение внутренних рецепторов. Соответственно обработка клеток (в особенности раковых клеток) антителами по изобретению приводит к снижению общего клеточного IGF-IR. В предпочтительном варианте осуществления снижение составляет по крайней мере примерно 70%, более предпочтительно по крайней мере примерно 80% и еще более предпочтительно по крайней мере примерно 90%.
Для лечения людей антитела согласно данному изобретению предпочтительно являются антителами человека. Альтернативно, антитела могут быть антителами приматов, не являющихся людьми, или других млекопитающих или представлять собой гуманизованные или химерные антитела. В одном из вариантов осуществления изобретения антитело против IGF-IR включает один, два, три, четыре, пять и/или шесть гипервариабельных участка (CDR), выбранных из группы, состоящей из SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:45, SEQ ID NO:47 и SEQ ID NO:49 (CDR1H, CDR2H, CDR3H, CDR1L, CDR2L, CDRL3 соответственно). В другом варианте осуществления антитело против IGF-IR включает один, два, три, четыре, пять и/или шесть гипервариабельных участка (CDR), выбранных из группы, состоящей из SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:55, SEQ ID NO:57 и SEQ ID NO:59 (CDR1H, CDR2H, CDR3H, CDR1L, CDR2L, CDRL3 соответственно). Предпочтительно антитела (или их фрагменты) по настоящему изобретению имеют тяжелые цепи CDR, включающие SEQ ID NO:35, SEQ ID NO:37 и SEQ ID NO:39. Альтернативно и также предпочтительно, настоящие антитела, включая их фрагменты, имеют легкие цепи CDR, включающие SEQ ID NO:45, SEQ ID NO:47 и SEQ ID NO:49 или SEQ ID NO:55, SEQ ID NO:57 и SEQ ID NO:59. Одно такое антитело против IGF-IR представляет собой антитело IMC-A12 (WO 2005016970) IgG1 человека, имеющее вариабельный домен тяжелой цепи, представленный SEQ ID NO:41, и вариабельный домен легкой цепи, представленный SEQ ID NO:51. Другое предпочтительное антитело человека представляет собой IMC-2F8 (WO 2005016970), имеющее вариабельный домен тяжелой цепи идентично IMC-A12 и вариабельный домен легкой цепи, представленный SEQ ID NO:61. Полезные антитела дополнительно включают антитела против IGF-IR, которые конкурируют с IMC-A12 или IMC-2F8 за связывание с IGF-IR, а также антитела, которые связываются с другими эпитопами (т.е. антитела, которые связываются с другими эпитопами и проявляют свойства, как описано ранее, такие как блокирование лиганда, интерналиция рецептора и т.д., но не конкурируют с IMC-A12 или IMC-2F8).
В соответствии с изобретением антагонисты PDGFRα также можно использовать для лечения. Антагонист PDGFRα может представлять собой внеклеточный антагонист, или внутриклеточный антагонист, и можно использовать более одного антагониста. Внеклеточные антагонисты включают, но не ограничиваются указанным, белки или другие биологические молекулы, которые связываются с PDGFRα или одним или несколькими его лигандами (например, PDGF-АА, -АВ, -ВВ, -СС). В одном из вариантов осуществления данного изобретения внеклеточный антагонист ингибирует связывание PDGFRα с его лигандами. В одном варианте осуществления антагонист представляет собой антитело против PDGFRα, такое как, например, IMC-3G3. В другом варианте осуществления связывающий белок представляет собой растворимый лиганд, связывающий фрагмент PDGFRα. Внутриклеточные антагонисты PDGFRα могут представлять собой биологические молекулы, но обычно представляют собой небольшие молекулы. В одном варианте осуществления внутриклеточный антагонист PDGFRα представляет собой AG1296. AG1296 (Calbiochem) представляет собой ингибитор PDGFα, PDGFβ и с-KIT и также реагирует с Flt3. Другие небольшие молекулы, мишенью которых являются PDGFR, включают STI-571 (иматиниб мезилат, Gleevec®, Novartis) и SU11248 (сунитиниб малат, SUTENT®, Pfizer).
В одном из вариантов осуществления изобретения антитело против PDGFRα включает один, два, три, четыре, пять и/или шесть гипервариабельных участка (CDR), выбранных из группы, состоящей из SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14 (CDR1H, CDR2H, CDR3H, CDR1L, CDR2L, CDRL3 соответственно). Предпочтительно антитела (или их фрагменты) по настоящему изобретению имеют участки CDR, включающие SEQ ID NO:2, SEQ ID NO:4 и SEQ ID NO:6. Альтернативно и также предпочтительно, настоящие антитела или их фрагменты имеют участки CDR, включающие SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14. Последовательности аминокислот в CDR указаны ниже в таблице 1.
Участки CDR в IMC-3G3
В другом варианте осуществления антитело против PDGFRα или его фрагмент имеет вариабельную область тяжелой цепи человека, представленную SEQ ID NO:8, и/или вариабельную область легкой цепи человека, представленную SEQ ID NO:16. IMC-3G3 представляет собой такое антитело, и оно проиллюстрировано в настоящем изобретении.
Предпочтительно антитела или и фрагменты по настоящему изобретению нейтрализуют PDGFRα. Связывание лиганда, например PDGF-АА, PDGF-АВ, PDGF-ВВ или PDGF-СС, с внеклеточным доменом PDGFRα стимулирует димеризацию рецептора, автофосфорилирование, активацию внутреннего, цитоплазматического тирозинкиназного домена и инициирование множества сигналов трансдукции, путем трансактивации вовлеченных в регулирование синтеза ДНК (активация гена), и продвижение или деление клеточного цикла. Антитела против PDGFRα обычно блокируют связывание лиганда и/или димеризацию рецептора и ингибируют одно или несколько из фосфорилирования, активации активности тирозинкиназы и сигнальной трансдукции. Антитела против PDGFRα по настоящему изобретению могут быть специфическими по отношению к внеклеточной лиганд-связывающей области PDGFRα и предотвращают связывание лиганда PDGFRα. Предпочтительно такие антитела против PDGFRα или их фрагменты связывают PDGFRα по крайней мере также прочно, как и природные лиганды PDGFRα. Альтернативно или дополнительно антитела могут быть специфическими в отношении области мономера рецептора, который в противном случае образует границу раздела димера рецептора. Такие антитела блокируют образование димера посредством связывания лиганда, ходя связывание лиганда с мономером рецептора может или не может блокироваться.
Как описано выше в отношении антител против IGF-IR, нейтрализация рецептора может быть определена множеством способов in vivo, in vitro и ex vivo. В одном варианте осуществления изобретения антитела против PDGFRα уменьшают фосфорилирование PDGFRα по крайней мере примерно на 75%. В других вариантах осуществления фосфорилирование снижается по крайней мере примерно на 85% или по крайней мере примерно на 90%. В одном из вариантов осуществления в результате ингибирования сигнальной трансдукции PDGFRα фосфорилирование или компонент пути сигнальной трансдукции в прямом направлении (например, Akt, p42/p44 и т.д.) снижается по крайней мере примерно на 40%, по крайней мере примерно на 60% или по крайней мере примерно на 80%. Нейтрализация рецептора может быть определена с использованием определенных лигандов (например, PDGF-АА, -АВ, -ВВ, -СС), смесей таких лигандов или препаратов, таких как аспираты костного мозга, которые включают разные PDGF наряду с другими стимулирующими факторами роста.
Нейтрализация PDGFRα включает ингибирование, снижение, дезактивацию и/или нарушение одной или нескольких данных видов активности, обычно связанных с сигнальной трансдукцией. Таким образом, нейтрализация PDGFRα имеет множество действий, включая ингибирование, снижение, дезактивацию и/или нарушение роста (пролиферации и дифференциации), ангиогенез (восстановление кровеносных сосудов, инвазия и метастазы) и подвижность клеток и метастазы (адгезия и инвазивность клеток).
Анализы ex vivo, как описано выше, также можно использовать для определения нейтрализации PDGFRα. Например клетки лейомиосаркомы человека SKLMS-1 (Американская коллекция типовых культур (АТСС), Rockville, MD; ATCC HTB-88TM) или клетки глиобластомы U118 (ATCC HTB-15TM), стимулированные PDGF-АА, можно использовать для анализа ингибирования PDGFRα. Ингибирование роста может быть оценено с использованием опухолевых клеток человека, экспрессирующих PDGFRα, инъецированных мышам SCID.
Настоящее изобретение не ограничено каким-либо конкретным механизмом нейтрализации PDGFRα. Антитела против PDGFRα по настоящему изобретению связываются на поверхности с клеточным поверхностным рецептором PDGFRα, блокируют связывание лиганда (например, PDGF-АА, PDGF-АВ, PDGF-ВВ, PDGF-СС), ингибируют фосфорилирование PDGFRα, ингибируют сигнальную трансдукцию, опосредованную рецептор-связанной тирозинкиназой и модулируют активность компонентов сигнальной трансдукции в прямом направлении. Комплекс рецептор-антитело также может быть интернализирован и разрушен, приводя к отрицательной негативной модуляции клеточного поверхностного рецептора. Матриксные металлопротеазы, которые действуют при инвазии и метастазах опухолевых клеток, также могут быть подавлены с помощью антител по настоящему изобретению. Более того, антитела по настоящему изобретению могут оказывать ингибирующее действие на продуцирование фактора роста и ангиогенез.
Как описано выше, антагонисты PDGFRα по изобретению можно использовать для лечения костных опухолей, включая метастатические костные опухоли. Другие типы опухолей, которые экспрессируют PDGFRα и могут подвергаться лечению согласно изобретению, включают, но не ограничиваются указанным, опухоли яичников, опухоли молочной железы, опухоли легких, гепатоклеточные опухоли, опухоли стромальных клеток желудочно-кишечного тракта, меланому, почечно-клеточную карциному, опухоли предстательной железы и саркому мягких тканей. Саркома мягких тканей возникает в таких тканях, как жир, мышцы, нервы, сухожилия и кровеносные и лимфатические сосуды. Обычно, опухолевые клетки сверхэкспрессируют PDGFRα. Экспрессия PDGFRα может быть определена, например, гистохимически или анализом РНК. Например, анализ по методу Скэтчарда (Scatchard) связывания радиоактивно меченного IMC-3G3 с клетками U118 и опухолевыми клетками SKLMS-1 показывает, что число молекул PDGFRα на клетках составляет примерно 500 и 2500 соответственно.
Антагонисты PDGFRα функционируют путем ингибирования сигнальной трансдукции посредством PDGFRα, экспрессируемого на самих опухолевых клетках, или путем ингибирования PDGFRα, экспрессированного на окружающих стромальных клетках, которые в противном случае подвергаются паракринной стимуляции посредством PDGFRα, экспрессированного из опухолевых клеток. Таким образом, такие антитела, как IMC-3G3 и другие антагонисты PDGFRα, могут использоваться для лечения опухолей, для которых характерна аутокринная и/или паракринная стимуляция PDGFRα.
Фрагменты антител согласно изобретению можно продуцировать путем расщепления целого антитела или путем экспрессии ДНК, кодирующей данный фрагмент. Фрагменты антител могут быть получены способами, описанными Lamoyi et al., J. Immunol. Methods, 56: 235-243 (1983), and Parham, J. Immunol. 131: 2895-2902 (1983). Такие фрагменты могут содержать один или оба фрагмента Fab или фрагмент F(ab')2. Такие фрагменты также могут содержать одноцепочечные фрагменты вариабельных областей антител, т.е. scFv, диатела или другие фрагменты антител. Способы продуцирования таких функциональных эквивалентов описаны в заявке РСТ WO 93/21319; заявке на европейский патент No. EP 239400; заявке PCT WO 89/09622; заявке на европейский патент EP 338745 и заявке на европейский патент EP 332424.
Предпочтительные клетки-хозяева для трансформации векторов и экспрессии антител по настоящему изобретению представляют собой клетки млекопитающих, например клетки COS-7, клетки яичника китайского хомячка (СНО) и клеточные линии лимфоидного происхождения, такие как лимфома, миелома (например, NS0) или клетки гибридомы. Альтернативно можно использовать другие эукариотические хозяева, такие как дрожжи.
Когда генную конструкцию желательно экспрессировать в дрожжах, подходящим селекционным геном для использования в дрожжах является ген trp1, присутствующий в плазмиде Yrp7 дрожжей. Stinchcomb et al., Nature, 282: 39 (1979); Kingsman et al., Gene, 7: 141 (1979). Ген trp1 обеспечивает селекционный маркер для мутантного штамма дрожжей, не обладающего способностью к росту в присутствии триптофана, например АТСС № 44076 или РЕР4-1. Jones, Genetics, 85: 12 (1977). Присутствие повреждения trp1 в геноме дрожжевой клетки-хозяина затем обеспечивает эффективное окружение для обнаружения трансформации по росту в отсутствие триптофана. Аналогично, Leu2-дефицитные штаммы дрожжей (АТСС 20622 или 38626) дополняют известными плазмидами, содержащими ген Leu2.
Трансформированные клетки-хозяева культивируют способами, известными в данной области, в жидкой среде, содержащей усвояемые источники углерода (углеводы, такие как глюкоза или лактоза), азота (аминокислоты, пептиды, белки и продукты их разложения, такие как пептоны, соли аммония или тому подобные) и неорганические соли (сульфаты, фосфаты и/или карбонаты натрия, калия, магния и кальция). Среда, кроме того, содержит, например, промотирующие рост вещества, такие как микроэлементы, например железо, цинк, марганец и тому подобные.
Высокоаффинные антитела против PDGFRα и IGF-IR согласно настоящему изобретению могут быть выделены из библиотеки фагового дисплея, сконструированной из генов вариабельных областей тяжелой цепи и легкой цепи человека. Например, вариабельный домен по изобретению может быть получен из лимфоцита периферической крови, который содержит перестроенный ген вариабельной области. Альтернативно, части вариабельного домена, такие как области CDR и FW, могут быть получены из различных источников и рекомбинированы. Дополнительно, части вариабельных доменов (например, области FW) могут представлять собой синтетические консенсусные последовательности.
Антитела и фрагменты антител по настоящему изобретению могут быть получены, например, из природных антител или библиотек фаговых дисплеев Fab scFv. Понятно, что при получении отдельного домена антитела из антитела, включающего домен VH и VL, могут быть желательны некоторые замещения аминокислот вне CDR для усиления связывания, экспрессии или растворимости. Например, может оказаться желательной модификация аминокислотных остатков, которые в противном случае будут скрыты в области стыка VH-VL.
Кроме того, антитела и фрагменты антител по изобретению могут быть получены с помощью стандартных гибридомных методов (Harlow & Lane, ed., Antibodies: A Laboratory manual, Cold Spring Harbor, 211-213 (1998), который включен в данное описание в качестве ссылки) с использованием трансгенных мышей (например, мышей КМ от Medarex, San Jose, Calif.), которые продуцируют тяжелые гамма- и легкие каппа-цепи иммуноглобулина человека. В предпочтительном варианте осуществления существенная часть генома, продуцирующего антитело человека, вводится в геном мыши, и он становится дефицитным в продуцировании эндогенных мышиных антител. Можно провести иммунизацию таких мышей подкожно (s.c.) с использованием PDGFRα (обычно в полном адъюванте Фрейнда) при необходимости с повторной иммунизацией. Методы иммунизации хорошо известны в данной области.
Белок, используемый для идентификации связывающих IGF-IR антител по изобретению, предпочтительно представляет собой IGF-IR и более предпочтительно внеклеточный домен IGF-IR. Белок, используемый для идентификации связывающих PDGFRα антител по изобретению, предпочтительно представляет собой PDGFRα и более предпочтительно внеклеточный домен PDGFRα. Такие внеклеточные домены могут быть в свободном виде или конъюгированными с другими молекулами.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим описанные выше антитела или их фрагменты. Подробности, касающиеся антитела IMC-А12 против IGF-IR, описаны в WO 2005016970. В таблице 2 указаны последовательности нуклеиновых кислот для IMC-3G3.
Последовательности нуклеотидов, кодирующие участки CDR в IMC-3G3
ДНК, кодирующие антитела человека, могут быть получены путем рекомбинации ДНК, кодирующей постоянные области и вариабельные области человека, отличающиеся от CDR, полученные главным образом или исключительно из соответствующих областей антитела человека, и ДНК, кодирующей CDR, полученные из человека (SEQ ID NOS:1, 3 и 5 для вариабельного домена тяжелой цепи CDR и SEQ ID NOS:9, 11 и 13 для вариабельного домена легкой цепи CDR)
Подходящие источники ДНК, которые кодируют фрагменты антител, включают любую клетку, такую как гибридомы и клетки селезенки, которые экспрессируют антитело полной длины. Фрагменты можно использовать сами по себе в качестве эквивалентов антител или их можно рекомбинировать в эквиваленты, как описано выше. Делеции ДНК и рекомбинации, описанные в данном разделе, можно проводить известными способами, например, такими как описанные в перечисленных выше публикациях относительно эквивалентов антител, и/или другими стандартными методами рекомбинантных ДНК, такими как описаны ниже. Другим источником ДНК являются одноцепочечные антитела, получаемые из библиотеки фагового дисплея, как известно в данной области.
Дополнительно настоящее изобретение относится к векторам экспрессии, содержащим ранее описанные последовательности полинуклеотидов, функционально связанные с последовательностью экспрессии, промотор и последовательность-энхансер. Разработано множество векторов экспрессии для эффективного синтеза полипетида антител в прокариотических, таких как бактерии, и эукариотических системах, включая, но не ограничиваясь указанным, системы клеточных культур дрожжей и млекопитающих. Векторы по настоящему изобретению могут включать сегменты хромосомных, нехромосомных и синтетических последовательностей ДНК.
Можно использовать любой подходящий вектор экспрессии. Например, прокариотические векторы клонирования включают плазмиды E.coli, такие как colE1, pCR1, pBR322, pMB9, pUC, pKSM и RP4. Прокариотические векторы также включают производные фаговой ДНК, такие как М13 и другие нитевидные фаги с одноцепочечной ДНК. Примером вектора, используемого для дрожжей, является плазмида 2µ. Подходящие векторы для экспрессии в клетках млекопитающих включают хорошо известные производные SV40, аденовируса, последовательности ДНК, полученные из ретровируса и «челночные» векторы, полученные из комбинации функциональных векторов млекопитающих, таких как описанные выше, и функциональных плазмид и ДНК фагов.
Дополнительные эукариотические векторы экспрессии известны в данной области (например, P.J.Southern and P. Berg, J. Mol. Appl. Genet., 1, 327-341 (1982); Subramani et al., Mol. Cell. Biol., 1: 854-864 (1981); Kaufmann and Sharp, "Amplification And Expression of Sequences Cotransfected with a Modular Dihydrofolate Reductase Complementary DNA Gene", J. Mol. Biol. 159, 601-621 (1982); Kaufmann and Sharp, Mol. Cell. Biol. 159, 601-664 (1982); Scahill et al., "Expression And Characterization Of The Product Of A Human Immune Interferon DNA Gene In Chinese Hamster Ovary Cells," Proc. Nat'l. Acad. Sci. USA 80, 4654-4659 (1983); Urlaub and Chasin, Proc. Nat'l Acad. Sci. USA 77, 4216-4220 (1980)).
Векторы экспрессии, используемые в настоящем изобретении, содержат по крайней мере одну контрольную последовательность экспрессии, которая функционально связана с последовательностью ДНК или фрагментом, который должен экспрессироваться. Контрольную последовательность вставляют в вектор для контроля и регулирования экспрессии клонированной последовательности ДНК. Примерами полезных контрольных последовательностей экспрессии являются система lac, система trp, система tac, система trc, основная операторная и промоторная области фага лямбда, контрольная область fd белка оболочки вируса, гликолитические промоторы дрожжей, например промотор для 3-фосфоглицераткиназы, промоторы кислой фосфатазы дрожжей, например Pho5, промоторы альфа-сопряженных факторов дрожжей и промоторы, полученные из полиомы, аденовируса, ретровируса и обезьяньего вируса, например ранние и поздние промоторы или SV40, и другие последовательности, известные для контроля экспрессии генов прокариотических или эукариотических клеток и их вирусов или их сочетаний.
Настоящее изобретение также относится к рекомбинантным клеткам-хозяевам, содержащим ранее описанные векторы экспрессии. Антитела по настоящему изобретению могут экспрессироваться в клеточных линиях, отличных от гибридом. Нуклеиновые кислоты, которые включают последовательность, кодирующую полипептид согласно изобретению, можно использовать для трансформации подходящей клетки-хозяина млекопитающего.
Клеточные линии, имеющие особое предпочтение, отбирают на основе высокого уровня экспрессии, значительной экспрессии представляющего интерес белка и минимального загрязнения белками хозяина. Клеточные линии млекопитающих, доступные в качестве хозяев для экспрессии, хорошо известны в данной области и включают многие иммортализованные клеточные линии, такие как, но не ограничиваясь указанным, клетки NS0, клетки яичника китайского хомяка (СНО), клетки почек детенышей хомячка (ВНК) и многие другие. Подходящие дополнительные эукариотические клетки включают дрожжи и другие грибы. Полезные прокариотические хозяева включают, например, E. coli, такие как E. coli SG-936, E. coli HB 101, E. coli W3110, E. coli X1776, E. coli X2282, E. coli DEI и E. coli MRC1, Pseudomonas, Bacillus, такие как Bacillus subtilis, и Streptomyces.
Настоящие рекомбинантные клетки-хозяев можно использовать для продуцирования антитела или его фрагмента путем культивирования клеток в условиях, допускающих экспрессию антитела или его фрагмента, и очистки антитела или его фрагмента, от клеток-хозяев или среды, окружающей клетку-хозяина. Нацеливание экспрессируемого антитела или его фрагмента для выделения в рекомбинантных клетках-хозяевах может быть облегчено путем вставки сигнальной или секреторной лидерной последовательности, кодирующей пептид (см. Shokri et al., Appl Microbiol Biotechnol. 60(6):654-64 (2003), Nielsen et al., Prot. Eng. 10:1-6 (1997), и von Heinje et al., Nucl. Acids Res. 14:4683-4690 (1986)) на 5' конце рассматриваемого гена, кодирующего антитело. Такие секреторные лидерные пептидные элементы могут быть получены или из прокариотических, или из эукариотических последовательностей. Соответственно, является подходящим, чтобы используемые секреторные лидерные пептиды представляли собой аминокислоты, присоединенные к N-концу полипептида для непосредственного движения полипептида из цитозоля клетки-хозяина и секреции в среду.
Антитела по данному изобретению могут быть связаны с дополнительными аминокислотными остатками. Такие аминокислотные остатки могут представлять собой пептидную метку, возможно, для облегчения выделения. Также подразумеваются другие аминокислотные остатки для хоминга антител к определенным органам или тканям.
В другом варианте осуществления антитело по настоящему изобретению получают путем экспрессии нуклеиновой кислоты, кодирующей антитело в трансгенном животном, так что такое антитело экспрессируется и может быть выделено. Например, антитело может экспрессироваться в ткани специфическим образом, что облегчает выделение и очистку. В одном таком варианте осуществления антитело по изобретению экспрессируется в железе млекопитающего для секреции в период лактации. Трансгенные животные включают, но не ограничиваются указанным, мышей, козу и кролика.
Антитела, которые можно использовать согласно изобретению, включают полные иммуноглобулины, антигенсвязывающие фрагменты иммуноглобулинов, а также антигенсвязывающие белки, которые включают антигенсвязывающие домены иммуноглобулинов. Антигенсвязывающие фрагменты иммуноглобулинов включают, например, Fab, Fab' и F(ab')2. Разработаны другие форматы антитела, которые сохраняют специфичность связывания, но обладают другими характеристиками, которые могут оказаться желательными, включая, например, биспецифичность, мультивалентность (более двух сайтов связывания), компактный размер (например, только связывающий домен).
Одноцепочечные антитела не имеют части или всех постоянных доменов целых антител, из которых они получены. Следовательно, они могут преодолевать некоторые проблемы, связанные с применением целых антител. Например, одноцепочечные антитела имеют тенденцию не проявлять некоторые нежелательные взаимодействия между постоянными областями тяжелой цепи и другими биологическими молекулами. Дополнительно, одноцепочечные антитела существенно меньше, чем целые антитела, и могут обладать большей проницаемостью, чем целые антитела, что дает одноцепочечным антителам возможность более эффективной локализации и связывания с целевыми антиген-связывающими сайтами. Кроме того, относительно небольшой размер одноцепочечных антител приводит к тому, что они с меньшей вероятностью вызывают у реципиента нежелательную иммунную ответную реакцию.
Множество одноцепочечных антител, где каждая цепь содержит один домен VH и один домен VL, ковалентно связанные первым пептидным линкером, может быть ковалентно связано с помощью по крайней мере одного или нескольких пептидных линкеров с образованием мультивалентных одноцепочечных антител, которые могут быть моноспецифическими или мультиспецифическими. Каждая цепь мультивалентного одноцепочечного антитела включает вариабельный фрагмент легкой цепи и вариабельный фрагмент тяжелой цепи, и она связана с помощью пептидного линкера с по крайней мере одной другой цепью. Пептидный линкер состоит по крайней мере из пятнадцати остатков аминокислот. Максимальное число остатков аминокислот составляет примерно сто.
Два одноцепочечных антитела могут быть объединены, образуя диатело, также известное как двухвалентный димер. Диатела имеют две цепи и два сайта связывания и также могут быть моноспецифическими или биспецифическими. Каждая цепь диатела включает домен VH, связанный с доменом VL. Домены соединены линкерами, которые являются достаточно короткими для предотвращения образования пар между доменами одной и той же цепи, таким образом управляя образованием пар между комплементарными доменами различных цепей для создания заново двух антиген-связывающих сайтов.
Три одноцепочечных антитела могут быть объединены, образуя триатела, также известные как трехвалентные тримеры. Триатела конструируют с участием аминокислотного конца домена VL или VH, непосредственно связанного с карбоксильным концом домена VL или VH, т.е. без какой-либо линкерной последовательности. Триатело имеет три «головы» Fv с полипептидами, расположенными циклическим образом по типу голова-к-хвосту. Возможная конформация триатела является планарной с тремя сайтами связывания, расположенными на плоскости под углом в 120 градусов между друг другом. Триатела могут быть моноспецифическими, биспецифическими или триспецифическими.
Таким образом, антитела по изобретению и их фрагменты включают, но не ограничиваются указанным, природные антитела, двухвалентные фрагменты, такие как (Fab')2, одновалентные фрагменты, такие как Fab, одноцепочечные антитела, одноцепочечные Fv (scFv), однодоменные антитела, мультивалентные одноцепочечные антитела, диатела, триатела и тому подобные, которые специфическим образом связываются с антигенами.
Антитела против IGF-IR и PDGFRα или фрагменты антитела, которые могут быть интернализованы при связывании с клетками, несущими IGF-IR (WO 2005016970) или PDGFRα, могут быть химически или биосинтетическим связанными с противораковыми агентами. Противораковые агенты, связанные с таким антителом, включают любые агенты, которые разрушают или повреждают опухоль, с которой антитело было связано, или окружение клетки, с которой антитело было связано. Например, противораковый агент представляет собой токсический агент, такой как химиотерапевтический агент или радиоактивный изотоп. Походящие химиотерапевтические агенты известны специалистам в данной области и включают антрациклины (например, дауномицин и доксорубицин), метотрексат, виндезин, неокарциностатин, цисплатин, хлорамбуцил, цитозинарабинозид, 5-фторуридин, мелфалан, рицин и калихеамицин. Химиотерапевтические агенты связывают с антителом с помощью обычных способов (см., например, Hermentin and Seiler, Behring Inst. Mitt. 82: 197-215 (1988)).
Подходящие радиоактивные изотопы для применения в качестве противораковых агентов также известны специалистам в данной области. Например, используют 131I и 211At. Данные изотопы присоединяют к антителу с помощью обычных способов (см., например, Pedley et al., Br.J.Cancer 68, 69-73 (1993)).
Альтернативно, противораковый агент, который присоединен к антителу, представляет собой фермент, который активирует пролекарство. В таком случае применяют пролекарство, которое остается в его неактивной форме до момента достижения сайта-мишени, где оно превращается в цитотоксичную форму. На практике, конъюгат антитело-фермент вводят пациенту и дают ему возможность локализоваться в области, где ткань подвергают лечению. Затем пациенту вводят пролекарство, так что конверсия в цитотоксичное лекарство происходит в области той ткани, которая подвергается лечению.
Другие противоопухолевые агенты включают цитокины, такие как интерлейкин-2 (IL-2), интерлейкин-4 (IL-4) или альфа-фактор некроза опухоли (TNF-α). Антитело направляет цитокин к опухоли так, что происходит опосредованное цитокином повреждение или разрушение опухоли, не затрагивающее другие ткани. Цитокин может быть связан с антителом на ДНК-уровне с использованием обычных методов рекомбинантных ДНК.
В некоторых вариантах осуществления изобретения антитела анти-IGF-IR или анти-PDGFRα вводят в сочетании с одним или несколькими противоопухолевыми агентами. Примеры комбинированной терапии приведены, например, в патенте США № 6217866 (Schlessinger et al.) (Антитела против EGFR в сочетании с противоопухолевыми агентами); WO 99/60023 (Waksal et al.) (Антитела против EGFR в сочетании с облучением). Можно использовать любой подходящий противоопухолевый агент, такой как химиотерапевтический агент, облучение или их комбинация. Противоопухолевый агент может представлять собой алкилирующий агент или антиметаболит. Примеры алкилирующих агентов включают, но не ограничиваются указанным, цисплатин, циклофосфамид, мелфалан и дакарбазид. Примеры антиметаболитов включают, но не ограничиваются указанным, доксорубицин, даунорубицин и паклитаксел, гемцитабин.
Полезные противоопухолевые агенты также включают митотические ингибиторы, такие как таксаны доцетаксел и паклитаксел. Ингибиторы топоизомеразы представляют собой другой класс противоопухолевых агентов, которые можно использовать в сочетании с антителами по изобретению. Они включают ингибиторы топоизомеразы I или топоизомеразы II. Ингибиторы топоизомеразы I включают иринотекан (СРТ-11), аимнокамптотецин, камптотецин, DX-8951f, топотекан. Ингибиторы топоизомеразы II включают этопозид (VP-16) и тенипозид (VM-26). В настоящее время другие вещества проходят оценку ингибирующей активности в отношении топоизомеразы и эффективности в качестве противоопухолевых агентов. В предпочтительном варианте осуществления ингибитор топоизомеразы представляет собой иринотекан (СРТ-11).
В конкретном варианте осуществления данного изобретения антитело против IGF-IR вводят в сочетании с доцетакселом. В другом варианте осуществления данного изобретения антитело против PDGFRα вводят в сочетании с доксорубицином.
В том случае, если противоопухолевым агентом является облучение, источник облучения может быть либо внешним (внешняя лучевая терапия - EBRT), либо внутренним (брахитерапия - ВТ) относительно пациента, подвергаемого лечению. Доза применяемого противоопухолевого агента зависит от множества факторов, включая, например, тип агента, тип и тяжесть опухоли, подвергаемой лечению, и путь применения. Однако следует подчеркнуть, что настоящее изобретение не ограничено какой-либо конкретной дозой.
Лечение с использованием антитела (анти-IGF-IR или анти-PDGFRα) и антитела плюс противоопухолевый агент можно использовать для пациентов, которые получают адъювантную гормональную терапию (например, при раке молочной железы) или андроген-подавляющую терапию (например, при раке предстательной железы).
Антагонисты против IGF-IR и PDGFRα по изобретению можно применять совместно или вводить вместе с антагонистами рецепторов, которые нейтрализуют другие рецепторы, вовлеченные в рост или ангиогенез опухоли. Например, в одном из вариантов осуществления данного изобретения антитело против IGF-IR и антитело против PDGFRα вводят совместно. В одном варианте осуществления, где опухолевая клетка-мишень экспрессирует как IGF-IR, так и PDGFRα, элементы обычной сигнальной трансдукции активируются путем сигнальной трансдукции через каждый из рецепторов. Хотя ингибирование одного рецептора обычно будет приводить к понижению активации обычных компонентов в прямом направлении, ингибирование обоих рецепторов будет дополнительно понижать активацию. В другом варианте осуществления определенные клетки опухоли или окружающей ткани экспрессируют значительные количества одного рецептора, а другие клетки экспрессируют значительные количества второго рецептора. Совместное применение антагонистов снижает рост опухолевых клеток и паракринную стимуляцию окружающих клеток.
Биспецифическое антитело может быть создано в качестве альтернативы совместному применению. Существует множество биспецифических антител, которые сконструированы для введения различных желаемых характеристик. Например, биспецифические диатела имеют минимальный размер. Биспецифические антитела с четырьмя антигенными сайтами связывания (два для каждой специфичности связывания) имеют склонность связывания, аналогичную таковой для соответствующих природных антител. Определенные биспецифические антитела включают области Fc, таким образом сохраняя эффекторные функции (например, комплемент-зависимую цитотоксичность (CDC) и антитело-зависимую клеточную цитотоксичность (ADCC)) природных антител. В WO 01/90192 описываются IgG-подобные тетравалентные антитела. В WO 2006/020258 описывается тетравалентное антитело, которое включает два диатела и сохраняет эффекторные функции.
В другом варианте осуществления антитело против IGF-IR, или антитело против PDGFRα, или другой антагонист используют в сочетании с антагонистом рецептора, который специфически связывается с рецептором эпидермального фактора роста (например, EGFR, Her2/erB2, erbB3, erbB4). Особенно предпочтительными являются антиген-связывающие белки, которые связываются с внеклеточным доменом EGFR и блокируют связывание одного или нескольких его лигандов и/или нейтрализуют индуцированную лигандом активацию EGFR. Антагонисты EGFR также включают антитела, которые связываются с лигандом EGFR и ингибируют связывание EGFR с его лигандом. Лиганды EGFR включают, например, EGF, TNFα, амфирегулин, гепарин-связывающий EGF (НВ-EGF) и бетацеллюлин. Предполагают, что EGF и TNFα являются основными эндогенными лигандами, которые вызывают EGFR-опосредованную стимуляцию, хотя было показано, что TNFα является более эффективным в промотировании ангиогенеза. Антагонисты EGFR также включают вещества, которые ингибируют димеризацию EGFR с другими субъединицами рецептора EGFR (т.е. гомодимеры EGFR) или гетеродимеризацию с другими рецепторами фактора роста (например, HER2). Антагонисты EGFR дополнительно включают биологические молекулы и небольшие молекулы, такие как синтетические ингибиторы киназы, которые воздействуют непосредственно на цитоплазматический домен EGFR, ингибируя EGFR-опосредованную сигнальную трансдукцию. Erbitux® (цетуксимаб) является примером антагониста EGFR, который связывается с EGFR и блокирует связывание с лигандом. Одним из примеров небольших молекул, являющихся антагонистами EGFR, является IRESSATM (ZD1939), который представляет собой производное хиноксалина, которое функционирует в качестве АТФ-миметика для ингибирования EGFR. См. патент США № 5616582 (Zeneca Limited), WO 96/33980 (Zeneca Limited) на стр.4; также см. Rowinsky et al., тезисы 5, представленные на 37 ежегодном симпозиуме ASCO, Сан-Франциско, СА, 12-15 мая 2001 г.; Anido et al., тезисы 1712, представленные на 37 ежегодном симпозиуме ASCO, Сан-Франциско, СА, 12-15 мая 2001 г. Другим примером небольшой молекулы - антагониста EGFR, является Tarceva® (OSI-774), который представляет собой производное 4-(замещенный фениламино)хинозалина [гидрохлорид 6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина], ингибирующее EGFR. См. WO 96/30347 (Pfizer Inc.), например, начиная со стр.2, строка 12, по стр.4, строка 34, и стр.19, строки 14-17. Также см. Moyer et al., Cancer Res., 57: 4838-48 (1997); Pollack et al., J.Pharmacol., 291: 739-48 (1999). Tarceva® может действовать путем ингибирования фосфорилирования EGFR и его расположенных в прямом направлении (5'-3') PI3/Akt и МАР (митоген активированный протеин)киназный путей сигнальной трансдукции, приводя к р27-опосредованной остановке клеточного цикла. См., Hidalgo et al., тезисы 281, представленные на 37 ежегодном симпозиуме ASCO, Сан-Франциско, СА, 12-15 мая 2001 г.
Также сообщалось, что другие небольшие молекулы также ингибируют EGFR, многие из которых, как предполагается, являются специфическими в отношении домена тирозинкиназы в EGFR. Некоторые примеры таких небольших молекул-антагонистов EGFR, описаны в WO 91/116051, WO 96/30347, WO 96/33980, WO 97/27199 (Zeneca Limited), WO 97/30034 (Zeneca Limited), WO 97/42187 (Zeneca Limited), WO 97/49688 (Pfizer Inc.), WO 98/33798 (Warner Lambert Company), WO 00/18761 (American Cyanamid Company) и WO 00/31048 (Warner Lambert Company). Примеры конкретных небольших молекул-антагонистов EGFR включают Cl-1033 (Pfizer), который представляет собой хинозалиновый (N-[4-(3-хлор-4-фтор-фениламино)-7-(3-морфолин-4-ил-пропокси)хиназолин-6-ил]акриламид) ингибитор тирозинкиназ, в частности EGFR, и описан в WO 00/31048 на стр.8, строки 22-6; PKI166 (Novartis), который представляет собой пирролопиримидиновый ингибитор EGFR и описан в WO 97/27199 на страницах 10-12; GW2016 (GlaxoSmithKline), который представляет собой ингибитор EGFR и HER-2; EKB569 (Wyeth), который, как сообщается, ингибирует рост опухолевых клеток, которые сверхэкспрессируют EGFR или HER-2 in vitro и in vivo; AG-1478 (Трифостин), который представляет собой небольшую молекулу хиназолина, которая ингибирует сигналы как от EGFR, так и erbB-2; AG-1478 (Sugen), который представляет собой бисубстратный ингибитор, который также ингибирует протеинкиназу CK2; PD 153035 (Parke-Davis), который, как сообщалось, ингибирует активность EGFR-киназы и рост опухоли, индуцирует апоптоз клеток в культуре и усиливает цитотоксичность цитотоксичных химиотерапевтических агентов; SPM-924 (Schwarz Pharma), который представляет собой ингибитор тирозинкианзы, направленный на лечение рака предстательной железы; СР-546б989 (OSI Pharmaceuticals), который по сообщению является ингибитором ангиогенеза для лечения плотных опухолей; ADL-681, который представляет собой ингибитор EGFR-киназы, предназначенный для лечения рака; PD 158780, который представляет собой пиридопиримидин, который, как сообщается, ингибирует скорость роста ксенотрансплантированных опухолей А4431 у мышей; СР-358б774, который представляет собой хиназолин, который, как сообщалось, ингибирует автофосфорилирование в ксенотрансплантатах HN5 у мышей; ZD1839, который представляет собой хиназолин, который, как сообщалось, обладает противоопухолевый активностью на мышиной модели ксенотрансплантатов, включая рак наружных женских половых органов, NSCLC, предстательной железы, яичников и колоректальный рак; CGP 59326A, который представляет собой пирролопиримидин, который, как сообщалось, ингибирует рост EGFR-положительных ксенотрансплантатов у мышей; PD 165557 (Pfizer); CGP54211 и CGP53353 (Novartis), которые представляют собой дианилинофталимиды. Ингибиторы тирозинкиназы EGFR природного происхождения включают генистеин, гербимицин А, кверцетин и эрбстатин.
Дополнительные небольшие молекулы, которые, как сообщалось, ингибируют EGFR и, следовательно, входят в объем настоящего изобретения, представляют собой трициклические соединения, такие как соединения, описанные в патенте США № 5679683; производные хиназолина, такие как производные, описанные в патенте США № 5616582, и соединения индола, такие как соединения, описанные в патенте США № 5196446.
Другой рецептор, который может представлять собой мишень наряду с IGF-IR и PDGFRα, представляет собой рецептор сосудистого эпителиального фактора роста (VEGFR). В одном из вариантов осуществления настоящего изобретения антитело против IGF-IR и антитело против PDGFRα используют в сочетании с антагонистом VEGFR. В одном варианте осуществления используемые антагонисты специфически связываются с рецептором VEGFR-1/Flt-1. В другом варианте осуществления антагонист VEGFR специфически связывается с рецептором VEGFR-2/KDR. Особенно предпочтительными являются антиген-связывающие белки, которые связываются с внеклеточным доменом VEGFR-1 или VEGFR-2 и блокируют связывание посредством их лигандов (VEGFR-2 стимулируется более сильно посредством VEGF; VEGFR-1 стимулируется более сильно посредством PlGF, но также и VEGF) и/или нейтрализуют индуцированную лигандом активацию. Например, IMC-1121 представляет собой антитело человека, которое связывается с VEGFR-2 и нейтрализует его (WO 03/075840; Zhu). Другим примером является MAb 6.12, которое связывается с растворимым и экспрессируемым на поверхности клетки VEGFR-1. ScFv 6.12 включает VL и VH домены мышиного моноклонального антитела Mab 6.12. Гибридомная клеточная линия, продуцирующая MAb 6.12, депонирована в АТСС под номером РТА-3344 по условиям Будапештского соглашения о депонировании микроорганизмов в целях патентования и его положении (Budapest Treaty). В другом варианте осуществления антагонист VEGFR связывается с лигандом VEGFR и блокирует активацию VEGFR с помощью данного лиганда. Например, Avastin® (бевацизумаб) представляет собой антитело, которое связывает VEGF.
Другие примеры факторов роста, вовлеченных в генез опухолей, представляют собой фактор роста нервов (NGFR) и фактор роста фибробластов (FGFG).
В дополнительном альтернативном варианте осуществления антитела против IGF-IR и PDGFRα можно применять в сочетании с одним или несколькими подходящими адъювантами, такими как, например, цитокины (например, IL-10 и IL-13) или другими иммунными стимуляторами, такими как, но не ограничиваясь указанным, хемокин, связанные с опухолями антигены и пептиды. См., например, Larrivee et al. выше. Однако следует принимать во внимание, что применение только антитела против IGF-IR или против PDGFRα является достаточным для предотвращения, ингибирования или уменьшения прогрессирования опухоли терапевтически эффективным образом.
При комбинированной терапии антитело против IGF-IR или против PDGFRα вводят до, во время или после лечения с использованием другого агента, а также любой их комбинации, т.е. перед и во время, перед и после, во время и после или до, во время и после начала терапии с использованием противоопухолевого агента. Например, антитело можно вводить между 1 и 30 днями, предпочтительно 3 и 20 днями, более предпочтительно между 5 и 12 днями до начала лучевой терапии. В предпочтительном варианте осуществления данного изобретения химиотерапию проводят одновременно, более предпочтительно после терапии с использованием антитела.
В настоящем изобретении для введения антител по изобретению можно использовать любой подходящий способ, и необязательно совместно вводить противоопухолевые агенты и/или антагонисты других рецепторов. Режимы применения противоопухолевого агента, используемые согласно изобретению, включают любой режим, который, как предполагается, является оптимально пригодным для лечения пациента с опухолевым заболеванием. Различные злокачественные новообразования могут потребовать применения специфических противораковых антител и специфических противоопухолевых агентов, которые будут определяться с позиций конкретного пациента. Пути введения включают, например, пероральное, внутривенное, внутрибрюшинное, подкожное или внутримышечное введение. Доза вводимого антагониста зависит от множества факторов, включая, например, тип антагониста, тип и тяжесть опухоли, подвергаемой лечению, и путь введения антагонистов. Однако следует подчеркнуть, что настоящее изобретение не ограничено каким-либо конкретным способом или путем введения.
Специалисту в данной области будет понятно, что дозировки и частота лечения зависят от переносимости его индивидуальным пациентом и от фармакологических и фармакокинетических свойств используемого блокирующего или ингибирующего агента. Идеально, желательно достигать насыщенной фармакокинетики для агента. Доза нагрузки как для антитела против IGF-IR, так и антитела против PDGFRα может колебаться, например, от примерно 10 до примерно 1000 мг/м2, предпочтительно от примерно 200 до примерно 400 мг/м2. Это можно осуществлять с применением нескольких дополнительных суточных или недельных дозировок, колеблющихся, например, от примерно 200 до примерно 400 мг/м2. Проводят контроль побочных эффектов, проявляющихся у пациента, и лечение останавливают, когда такие побочные действия становятся тяжелыми.
Специалисту в данной области также известно, каким образом следует контролировать ход лечения для определения эффективной дозы. Для костных метастазов, являющихся результатом рака предстательной железы, одним из таких способов является контроль уровней PSA. Другие способы контролирования костных метастазов включают сканирование костей скелета и MRI.
Для пациентов, для которых существует риск или проблематичность индуцированной лечением рака потери костной массы (CTIBL) (например, пациенты, которые получают адъювантную гормональную терапию при раке молочной железы или андроген-подавляющую терапию при раке предстательной железы), любое вышеуказанное лечение может быть дополнено введением агентов для предотвращения CTIBL, таких как бисфосфонаты. Бисфосфонаты включают, например, клодронат, ризедронат и золедроновую кислоту.
В тексте данной заявки были приведены ссылки на различные публикации, процитированные тексты, руководства, технические справочники, патенты и патентные заявки. Указания и описания данных публикаций, патентов, патентных заявок и других документов во всей своей полноте включены в данное описание в качестве ссылки с целью более полного описания состояния данной области, к которой относится настоящее изобретение.
Следует понимать и ожидать того, что специалист в данной области может осуществить вариации принципов раскрытого здесь изобретения, и предполагается, что такие модификации должны быть включены в объем настоящего изобретения.
Следующие примеры дополнительно иллюстрируют изобретение, но их не следует рассматривать как ограничивающие каким-либо образом объем изобретения. Подробное описание обычных способов, таких как те, которые используются при конструировании векторов и плазмид и экспрессии антител и фрагментов антител, может быть получено из многочисленных публикаций, включая Sambrook, J. et al., (1989) Molecular Cloning: A Laboratory Manual, 2na ed., Cold Spring Harbor Laboratory Press; Coligan, J. et al. (1994) Current Protocols in Immunology, Wiley & Sons, Incorporated; Enna, S.J. et al. (1991) Current Protocols in Pharmacology, Wiley & Sons, Bonifacino, J.S. et al. (1999) Current Protocols in Cell Biology, Wiley & Sons. Все отмеченные здесь ссылки включены в данное описание во всей своей полноте.
Примеры
Пример 1
Влияние IMC-A12 и доцетаксела на рост опухоли. Частицы опухолей (от 20 до 30 мм3) андроген-независимых (AI) клеток LuCaP 35V имплантировали подкожно (s.c.) кастрированным мышам SCID возрастом 32 недели соответственно, как описано ранее (4). Когда имплантированные опухоли достигали объема 150-200 мм3, животных случайным образом делили на четыре группы для исследования метода лечения. Животные в группе 1 получали лечение в виде доцетаксела в дозе 20 мг/кг. Животные в группе 2 получали доцетаксел в дозе 10 мг/кг. Животные в группе 3 получали комбинированное лечение, состоявшее из 10 мг/кг доцетаксела и 40 мг/кг A12. Животные в группе 4 получали комбинированное лечение, состоявшее из 20 мг/кг доцетаксела и 40 мг/кг A12. Всю обработку животных проводили внутрибрюшинно (i.p.). Доцетаксел вводили один раз в неделю. А12 вводили три раза в неделю. Все животные получали обработку в течение четырех недель, и за ними наблюдали дополнительно в течение четырех недель перед эвтаназией. Опухоли измеряли дважды в неделю и объем опухоли оценивали по формуле: объем = LxW2/2. В соответствии с одобренным протоколом IACUC по работе с животными Университета Вашингтона некоторых животных подвергали эвтаназии в более раннее время, когда опухоль достигала объема 1000 мм3 или когда потеря веса у животных превышала 20% от первоначальной массы тела. Животных взвешивали дважды в неделю. Образцы крови отбирали из глазной пазухи еженедельно. Отделяли сыворотку крови и определяли уровень PSA с использованием общего анализа PSA Imx (Abott Laboratories, Abott Park, IL). BrdU вводили в опухоли за 1 час перед эвтаназией животных для оценки in vivo скорости пролиферации опухолевых клеток.
После эвтаназии опухоли собирали и делили на две равные части. Одну часть опухоли фиксировали в 10% нейтральном буферном формалине (NFB) и заливали парафином. Для иммуногистохимического окрашивания (IHC) делали пятимикронные срезы. Оставшуюся часть опухолей механически разделяли на отдельные клетки, разрубая на мелкие кусочки и фильтруя через нейлоновые сита 70 мкм.
Как показано на фиг.1, ксенотрансплантат LuCaP 35V агрессивно рос в мышах при средней скорости роста 362,0±72,0 мм3/неделю в отсутствие какого-либо лечения. Всех животных в группе без обработки пришлось убить в течение трех недель после начала лечения в экспериментальных группах, поскольку объем опухоли превышал 1000 мм3. Когда животные получали только 40 мкг/кг А12, скорость роста опухоли снижалась до 192,7±35,6 мм3/неделю во время лечения. Когда животным давали доцетаксел в дозе 10 мг/кг, скорость роста опухоли LuCaP 35V снижалась до среднего значения 29,6 ± 6,1 мм3/неделю. Когда доцетаксел давали в сочетании с обработкой А12, скорость роста опухоли LuCaP 35V дополнительно снижалась до среднего значения 7,9 ± 1,0 мм3/неделю (фиг.1,b). Ингибирующее действие доцетаксела в сочетании с А12 сохранялось в течение четырех недель после прекращения обработки. Когда животные получали более высокую дозу доцетаксела (10 мг/кг) в независимости от комбинирования с А12 или без него, объем опухоли не увеличивался во время четырехнедельного периода обработки; напротив, наблюдалась тенденция снижения объема опухолей. Однако в течение четырех недель после окончания обработки снижение объема опухолей продолжалось в группе животных, получавших доцетаксел в сочетании с А12. Напротив, объем опухолей увеличивался со средней скоростью 27,0 ± 16,1 мм3/неделю в группе животных, получавших только доцетаксел. Данные результаты позволили предположить, что при данной дозе доцетаксела комбинированное лечение вместе с А12 может увеличить ингибирующее действие доцетаксела на рост опухоли во время лечения и после прекращения лечения.
PSA представляет собой клинический параметр, обычно используемый для оценки роста опухоли простаты. Уровни PSA в сыворотке крови измеряли у животных во время и после обработки. Как показано на фиг.1,с, у животных, обработанных А2 и доцетакселом или только доцетакселом в дозе 20 мг/кг, не наблюдалось значительных изменений в уровне PSA в сыворотке крови в течение четырехнедельного периода обработки, что согласуется с подавлением роста опухоли. После прекращения обработки было показано, что уровень PSA в сыворотке крови повышается у животных, получавших только доцетаксел, и, напротив, соответствует или даже снижается у животных, обработанных доцетакселом в сочетании с А12. Эти данные соответствуют продолжающемуся ингибированию роста опухоли после лечения у животных, получавших доцетаксел и А12.
Индуцирование апоптоза с помощью доцетаксела в сочетании с антителом против IGF-IR. Комбинированное действие in vivo обработки доцетакселом и А12 на клеточный цикл и выживаемость клеток в конечный момент эксперимента измеряли путем анализа деоксинуклеотидилтрансфераза-опосредованного введения концевой метки (TUNEL) и окрашивания пропидием (PI) с использованием набора Apop-Direct (BD, BioScience), как описано ранее. Кратко, 1х106 клеток из суспензии отдельных клеток фиксировали в 10% нейтральном буферном формалине с последующей обработкой 70% этиловым спиртом при 20°С в течение 30 минут. После нескольких промывок у клеток нарушали проницаемость мембран с использованием 0,1% Triton X-100 и инкубировали с FITC-конъюгированным dUTP и ферментом концевой деоксинуклеотидилтрансферазы (TdT) при 37°С в течение 1 часа с последующим инкубированием с буфером PI/RNase (100 мкг/мл PI, 50 мкг/мл RNase) при комнатной температуре в течение 60 минут. Образцы анализировали методом проточной цитометрии с использованием BD FACscan. Данные анализировали с использованием программного обеспечения CellQuestPRO.
Через четыре недели после прекращения обработки апоптоз обнаруживали для значительного процента опухолей у животных, которые получали доцетаксел (66,7% в группе, получавшей доцетаксел в дозе 10 мг/кг, и 77,8% в группе, получавшей доцетаксел в дозе 20 мг/кг) в сочетании с А12 (фиг.2,b и таблица 1) вне зависимости от использованной дозировки доцетаксела. Среднее число апоптических случаев для данных опухолей происходило в части 15,0±4,3%. Апоптоза в опухолях не обнаруживалось у животных, которые получали только доцетаксел. Вместо этого, большинство (88% в группе, получавшей доцетаксел в дозе 10 мг/кг, и 100% в группе, получавшей доцетаксел в дозе 20 мг/кг) опухолей возобновляло нормальный клеточный цикл (фиг.2, а и таблица 3).
Цикл опухолевых клеток и активность выживания на момент умерщвления
Для дальнейшей оценки способности опухолевых клеток к пролиферации после окончания различных видов обработки парафиновые срезы окрашивали антителом против BrDu. Образцы опухолей фиксировали в 10% NBF, заливали парафином и нарезали на 5 мкм срезы на предметном стекле микроскопа. После депарафинизации и восстановления влагосодержания антигены восстанавливали с использованием 0,01 М лимонной кислоты (рН 6,0) при 95°С в течение 2х5 мин. Предметные стекла оставляли охлаждаться в течение 30 мин, после чего промывали PBS. Эндогенную пероксидазную активность гасили путем инкубирования с 0,3% Н2О2 в метаноле в течение 15 минут. После блокирования 1,5% нормальной козьей сывороткой в PBS, содержащем 0,05% Tween 20 (PBST), в течение 1 часа стекла инкубировали с мышиным антителом против BrDu (1 мкг/мл) в течение 1 часа с последующим последовательным инкубированием с биотинилированным козьим антимышиным IgG в течение 30 минут, меченным пероксидазой авидином в течение 30 минут (Santa Cruz Biotechnology) и диаминобензидином (DAB)/хромогенным субстратом пероксида водорода (Vector Laboratories, Burlingame, CA) в течение 5-10 минут. Все стадии инкубирования проводили при комнатной температуре. Стекла подвергали контрастному окрашиванию с использованием гематоксилина (Sigma) и покрывали пермаунтом (Fisher Scientific, Fair Lawn, New Jersey). Для отрицательного контроля мышиный IgG (Vector Laboratories) использовали вместо первичного антитела против BrDu. Стекла исследовали под микроскопом Zeiss и получали цифровые изображения. Число меченных BrDu ядер и общее число ядер подсчитывали по 10 случайным обзорам для каждого среза. Рассчитывали индекс пролиферации по числу положительных в отношении BrDu ядер, деленному на общее число ядер. Для каждого стекла подсчитывали 10 областей. Окрашивание H&E проводили с использованием гематоксилина и эозина (Richard Allen, Kalamazoo, MI).
У животных, которые получали доцетаксел и А12, поглощение BrDu было существенно ниже, чем у животных, получавших только ту же самую дозу доцетаксела (фиг.3). Эти данные по внедрению BrDu согласуются с вышеуказанными наблюдениями для клеточного цикла и апоптоза, позволяя предположить, что А12 существенно усиливает цитотоксичность доцетаксела.
Дифференциальное регулирование экспрессии гена в опухолях, обработанных доцетакселом в сочетании с антителом против IGF-IR относительно самого доцетаксела. Для определения потенциальных механизмов для существенно усиленного посредством А12 действия доцетаксела исследовали экспрессию IGF-IR во всех собранных опухолях анализом методом иммуногистохимии и проточной цитометрии. Между всеми группами обработки не было различия в поверхностной экспрессии IGF-IR по сравнению с контрольной группой (данные не показаны). Ген экспрессии после обработки исследовали с использованием анализов микрорасположения кДНК в опухолях, полученных от животных, которые получали 20 мг/кг доцетаксела и 20 мг/кг доцетаксела в сочетании с А12. На основании анализов SAM (молекулы, прилипающие к субстрату) было идентифицировано 49 генов в качестве дифференциально экспрессированных в опухолях, где животные получали комбинированное лечение доцетакселом и А12, по сравнению с опухолями, из группы обработки только доцетакселом, при более чем 2-кратном изменении и менее чем 10% уровне ложного обнаружения (FDR) (данные не показаны). Тринадцать генов были идентифицированы в качестве потенциально вовлеченных в регуляцию апоптоза или клеточного цикла (таблица 4). Все 13 генов по крайней мере на 2 порядка различаются между двумя группами обработки и имеют FDR менее 0,02%. Девять генов были отрицательно модулирующими, и четыре гена были положительно регулирующими в опухолях, подвергавшихся лечению доцетакселом и А12, по сравнению с опухолями, подвергавшимися лечению только доцетакселом.
Дифференциальная экспрессия гена в опухолях, обработанных доцетакселом+А12, по сравнению с опухолями, обработанными только доцетакселом
V-myb миелобластоз
Антиапоптоз; развитие
Таксан-резистентный
Таксан-резистентный
V-myc миелоцитоматоз
Для выбранных генов результаты были подтверждены ПЦР в реальном времени RT-ПЦР. Стандартный ПЦР фрагмент целевой кДНК очищали. Для образования стандартных кривых использовали серийные разведения стандартов от 10 нг/мкл до 10-3 пг/мкл. Один мкг общей РНК из каждой группы собранных опухолей использовали для синтеза первой цепи кДНК с использованием системы синтеза Superscript First Strand Synthesis System (Invitrogen). ПЦР в реальном времени RT-ПЦР осуществляли в 20 мкл реакционной смеси, содержащей 1 мкл первой цепи кДНК, специфический набор праймеров и Lightcycler FastSTrand DNA Master Plus SYBR Green c использованием Roche Lightcycler в соответствии с протоколом производителя (Roche, Nutley, NJ). Для продуктов RT-ПЦР проводили анализ кривых плавления с помощью программного обеспечения Lightcycler, версия 3.5. Размеры ампликона были подтверждены методом электрофореза на агарозном геле. Каждый образец анализировали в двухкратной повторности. Результаты показаны на фиг.4.
Было показано, что среди генов отрицательной негативной модуляции TUBB приводит к резистенции к доцетакселу (Tanaka et al., 2004, Int.J. Cancer, 111, 617-26), и было показано, что повышенная экспрессия BIRC5 (сурвивин) связана с агрессивным раком предстательной железы и устойчивостью к антиандрогенной терапии (de Angelis et al., 2004, Int. J.Oncol., 24, 1279-88; Zhang et al., 2005, Oncogene, 24, 2474-82). Кроме того, TUBB представляет собой IGF-IR-регулируемый ген, который вовлечен в IGF-IR опосредованную трансформацию (Loughran et al., 2005, Oncogene, 24, 6185-93). Было показано, что из четырех генов положительной модуляции IGFBP3 ингибирует IGF-лиганд передачу сигнала, а также индуцирует апоптоз в опухолевых клетках предстательной железы лиганд-зависимым образом (Grimberg et al., 2000, J.Cell. Physiol., 183, 1-9).
Уровни А12 в сыворотке крови после лечения. У животных, которые получали доцетаксел в сочетании с А12, измеряли уровни А12 в сыворотке крови. Уровни А12 в сыворотке крови в течение двух недель после прекращения лечения снижались в 100 раз и обнаруживались на очень низком уровне через четыре недели после прекращения лечения (фиг.5).
Общая цитотоксичность. Была исследована цитотоксичность при совместном применении доцетаксела и IMC-A12. Хотя А-12 имеет более чем 95% кросс-реактивность с мышиным IGF-IR у животных, получавших при обработке комбинированные реагенты или только доцетаксел, не наблюдалось аномальной дневной активности или изменений в поведении по сравнению с контрольной группой животных, имеющих опухоли. Не наблюдалось существенного влияния на клетки почек ни в какой из групп обработки как при анализе клеточного цикла, так и при анализе апоптоза (данные не показаны). Не наблюдалось существенных изменений в массе тела для групп обработки (фиг.6).
Терапия антителом против IGF-IR. Эффективность лечения с использованием антител против IGF-IR на метастатический рост раковых клеток предстательной железы в костях оценивали с использованием непосредственной инъекции раковых клеток предстательной железы в большую берцовую кость мышей SCID. При таком способе метастазные опухоли развиваются непосредственно вне зависимости от зависимого от хемотаксиса проникновения из круга кровообращения. Для развития метастазов в костях доступно множество опухолевых линий. Они включают клетки РС-3, LuCaP35 LnCaP, которые вызывают остеолитические поражения, и клетки LuCaP 23.1, которые вызывают остеобластные поражения.
Клетки LuCaP 23.1, которые экспрессируют IGF-IR, имеют степень поглощения окружением кости ~80% и приводят к остеобластным реакциям. В предварительных экспериментах образцы LuCaP 23.1 проявляли существенное разрастание в объеме кости относительно объема ткани (%BV/TV) в опухолях относительно контрольной большой берцовой кости (254-503% от контроля, р=0,024). Все опухоли LuCaP 23.1 в большой берцовой кости проявляли новые костные трабекулы, которые не присутствовали в нормальных образцах, и высокое число опухолевых центров, которые заменяли обычный костный мозг. В некоторых образцах рост опухоли и кости простирался снаружи первоначальной кости. Повышенный % BV/TV для образцов LuCaP 23.1 также наблюдался после кастрации; % BV/TV больших берцовых костей с привитой опухолью составлял 212-354% по сравнению с большими берцовыми костями без опухоли (р=0,024). Результаты, наблюдавшиеся для ксенотрансплантатов LuCaP 23.1 внутри больших берцовых костей, указывают на стимулированное опухолевыми клетками образование кости de novo. Кроме того, опухоли проявляют большое подобие с остеобластными метастазами в костях человека, включая большое число опухолевых центров и повышенное количество минерализованной костной массы.
Для оценки эффективности лечения с использованием IMC-A12 ксенотрансплантаты опухолей LuCaP 23.1 приживляли мышам SCID и дважды в неделю измеряли уровни PSA в сыворотке крови для оценки роста опухолей. Все животные были кастрированы за две недели перед приживлением ксенотрансплантата. Введение IMC-A12 тестируемым мышам начинали, когда уровни PSA в сыворотке крови достигали 5-10 нг/мл (что указывает на развившуюся опухоль). 40 мг/кг IMC-A12 вводили в виде внутрибрюшинной инъекции три раза в неделю в течение шести недель.
Методом двойной рентгеновской абсорбциометрии (PIXOmus Lunar денситометр) была измерена минеральная плотность костей (МПК) пораженной опухолью большой берцовой кости и противоположной большой берцовой кости без опухоли, проведенная на площади 2,5 мм ×2,5 мм в месте инъекции опухолевых клеток, или на соответствующем месте противоположной большой берцовой кости в момент приживления трансплантата. Оценку поражения дважды в неделю проводили путем измерения PSA в сыворотке крови. Всех животных умерщвляли, когда поражения костей в контрольной группе рецидивировали после кастрации на основании уровней PSA в сыворотке крови (LuCaP 35>60 нг/мл, нг/мл, LuCaP 23.1> 500 нг/мл), рентгеновского появления поражений костей или когда у животных появлялись нарушения. За один час перед умерщвлением животным делали инъекцию BrdU для контроля пролиферации опухолевых клеток. Рентгеновские снимки делали перед умерщвлением (Faxitron X-ray MX-20) и МПК обоих больших берцовых костей измеряли в момент умерщвления.
Минеральная плотность костей (МПК)
Уровни PSA в сыворотке крови были существенно ниже у мышей, обработанных IMC-A12 (Фиг.7), и повышение МПК, связанное с ростом остеобластных метастатических опухолей, также существенно понижалось (таблица 5). Измерения МПК для ног, не имевший опухолей, указывало на то, что обработка IMC-A12 не вызывала потери плотности костей (остеопороз). Рентгеновские снимки мышей, получавших и не получавших IMC-A12, показали, что прогрессирование опухоли значительно уменьшалось или предотвращалось у обработанных мышей.
Комбинирование антитела против IGF-IR и доцетаксела для костных метастазов. Мышей SCID кастрировали за 2 недели перед инъекцией опухолей в большую берцовую кость. Костные метастазы генерировали непосредственной инъекцией клеток рака предстательной железы LuCaP 23.1 в большие берцовые кости мышей, что приводило к остеобластным поражениям. Ксенотрансплантаты экспрессировали IGF-IR. Для оценки роста опухоли уровни PSA в сыворотке крови измеряли дважды в неделю. Когда уровни PSA в сыворотке крови достигали 5-10 нг/мл, указывая на развившуюся опухоль, животных случайным образом делили на четыре группы.
В двух группах 40 мг/кг IMC-A12 вводили в виде внутрибрюшинной инъекции три раза в неделю в течение шести недель, одна группа получала IMC-A12+ доцетаксел 20 мг/кг внутрибрюшинно один раз в неделю в течение 6 недель, а вторая группа - IMC-A12+ доцетаксел 10 мг/кг внутрибрюшинно один раз в неделю в течение 6 недель. Контрольные группы получали 10 или 20 мг доцетаксела внутрибрюшинно без IMC-A12.
Животных контролировали путем еженедельного измерения PSA. После окончания обработки продолжали контроль за животными путем измерения PSA до тех пор, пока опухоли в группах, получавших только доцетаксел, не начинали повторно расти. Поскольку величины PSA повышались в группах, получавших только доцетаксел (хотя и с меньшей скоростью, чем для необработанных животных), уровни PSA у мышей, получавших IMC-A12+доцетаксел, выравнивались, а у некоторых животных начинали снижаться. Снижение уровней PSA продолжало наблюдаться даже после прекращения обработки в течение шести недель.
Как указано выше, измерения МПК проводили в момент приживления трансплантата и в момент умерщвления, и рентгеновские снимки получены как раз перед умерщвлением. В группах, получавших IMC-A12+ доцетаксел, наблюдалось незначительное увеличение МПК, или его не наблюдалось, и на рентгеновских снимках видны незначительные или не видны признаки остеобластной активности.
Комбинация антитела против IGF-IR и доцетаксела для костных метастазов. Кусочки опухоли предстательной железы человека LuCaP 23.1 (от 20 до 30 мм3) механически разрушали. 2-5×105 жизнеспособных клеток LuCaP 23.1 вводили в большую берцовую кость мышей SCID возрастом 6-8 недель. 21 мышь случайным образом распределяли на три группы для использования в данном исследовании. После инъекции опухолей еженедельно контролировали уровень PSA в сыворотке крови. Лечение начинали, когда уровни PSA в сыворотке крови достигали 5-10 нг/мл как индикатор роста опухоли. Группа 1 получала контрольный забуференный физиологический раствор. Группа 2 получала 20 мг/кг доцетаксела внутрибрюшинно один раз в неделю в течение 4 недель. Группа 3 получала 20 мг/кг доцетаксела один раз в неделю и 40 мг/кг А12 внутрибрюшинно три раза в неделю в течение 4 недель. Для определения того, является ли ответная реакция на лечение остеобластной или остеолитической, МПК измеряли Dexa-сканированием и рентгеновским исследованием животных в конечный момент лечения.
Доцетаксел сам по себе или доцетаксел в сочетании с А12 существенно ингибировали рост опухоли LuCaP 23.1, что отражается в подавлении уровней PSA в сыворотке крови (фиг.9,а) без существенной разницы между двумя обработками. Однако после прекращения обработки уровень PSA в сыворотке крови начинал повышаться у животных, которые получали только доцетаксел, указывая на повторный рост опухоли; тогда как у животных, получавших комбинированное лечение, продолжало наблюдаться подавление уровней PSA в сыворотке крови, указывая на продолжительный период неподвижности опухоли после лечения. Было показано, что уровни PSA коррелируют с плотностью костей (МПК) и размерами костных опухолей на рентгеновских снимках (фиг.9,b). На пятой неделе средняя плотность костей составляла для контрольных животных, получавших доцетаксел 20 и доцетаксел 20 в сочетании с А12, 0,112±0,01, 0,09±0,02 и 0,05±0,009 (среднее значение ± стандартная ошибка среднего), соответственно. Имелась очевидная тенденция уменьшения плотности костей при лечении.
Пример 2
Фосфорилирование Akt, индуцированное аспиратом костного мозга. Образцы костного мозга от обычных мужчин-доноров (возраст 18-45 лет) получали от Camrex (PoieticsTM Donor Program). Образцы центрифугировали при 1500 об/мин для отделения растворимой и клеточной фаз. Супернатант фильтровали с использованием последовательно фильтров 0,8 мкм и 0,22 мкм. 50 мкл аспирата костного мозга вводили в клетки в 1 мл среды (конечное разведение 1:20).
Для экспериментов, проводившихся в присутствии сыворотки крови, клетки культивировали в среде DMEM, дополненной 10% FBS и 50 мкг/мл гентамицина, в течение 24 часов перед воздействием костного мозга. Для эксперимента в отсутствие сыворотки крови (клетки в безсывороточной среде) клетки промывали дважды PBS, среду для роста заменяли на не содержащую сыворотки среду DMEM и клетки инкубировали в течение 4 часов перед воздействием препаратов костного мозга. Когда использовали, AG-1296, специфический ингибитор рецепторов PDGF (Rice et al., 1999, Amer. J.Path, 213-21), добавляли к культурам за 30 минут перед воздействием аспирата костного мозга. Антитела IMC-3G3 вводили, как описано во время предварительной обработки, как указано далее.
Активацию костным мозгом Akt обнаруживали в клетках РС3-ML, которые экспрессируют PDGFRα, но не в клетках DU-145, которые не содержат рецептор. В одном эксперименте для сведения к минимуму эффекта компонентов сыворотки на активацию Akt клетки предварительно инкубировали в течение 4 часов в не содержащей сыворотки среде. Добавление экстрактов костного мозга приводило к сильному фосфорилированию Akt в клетках РС3-ML, но не в клетках DU-145 (фиг.10,А). Для оценки значимости ответной реакции второй эксперимент проводили с использованием сыворотки. Сильная стимуляция фосфорилирования Akt в клетках РС3-ML аспиратом костного мозга также наблюдалась в присутствии сыворотки (фиг.10,В). Только незначительная ответная реакция проявлялась в клетках DU-145.
Опосредованное PDGFRα фосфорилирование Akt. Предполагается, что остеобласты и остеокласты, которые секретируют как PDGF-АА, так и PDGF-ВВ, обеспечивают свои факторы роста в среду костного мозга. Для определения того, что способность к реагированию на экстракты костного мозга клеток РС3-ML относится к сигнальной трансдукции посредством PDGFRα, клетки РС3-ML подвергали действию аспирата костного мозга в отсутствие и в присутствии 20 мкМ AG-1296. Такая концентрация AG-1296 полностью ингибирует индуцированную PDGF-ВВ активацию Akt (фиг.11,А). AG-1296 ингибировал индуцированную аспиратом костного мозга активацию Akt более чем на 40% (фиг.11,В и D). Это показывает, что передача сигнала PDGFRα отвечает за значительную часть индуцированной костным мозгом активации Akt.
Также был оценен непосредственный вклад PDGF-АА и -ВВ в передачу сигнала посредством PDGFRα относительно других компонентов аспиратов костного мозга. Было определено, что концентрации PDGF-АА и -ВВ в аспиратах костного мозга, полученных от трех разных доноров, колеблются от 400 пг/мл до 2 нг/мл. При используемом 20-кратном разведении аспиратов костного мозга, тестируемые клетки действительно подвергали действию концентраций PDGF-АА и -ВВ в диапазоне между 20 и 100 пг/мл. Соответственно, проводили обработку клеток РС3-ML 100 пг/мл каждого из PDGF-АА и -ВВ. Фосфорилирование Akt составляло менее 10% по сравнению с результатом, полученным для аспиратов костного мозга (фиг.11). Следовательно, оказывается, что активация пути Akt посредством передачи сигнала с помощью PDGFRα может включать лиганды, отличные от PDGF-АА и -ВВ, и/или другой механизм, отличающийся от активации PDGFRα за счет непосредственно связывания лиганда.
Ингибирование фосфорилирования Akt антителом против PDGFRα. Также проводили исследование способности нейтрализующего антитела IMC-3G3, которое является специфическим в отношении PDGFRα человека, ингибировать фосфорилирование Akt в клетках РС3-ML. Время предварительной инкубации 30 минут и концентрация 20 мкг/мл нейтрализовали стимулирующее действие 30 нг/мл PDGF-ВВ (фиг.12,А). Обработка антителом также приводила примерно к 40%-ному ингибированию индуцированного костным мозгом фосфорилирования Akt (фиг.12,В и С). Также наблюдалось, что ингибирующее действие IMC-3G3 на фосфорилирование Akt зависело от продолжительности предварительной инкубации, при этом время инкубации, равное 120 минутам, было существенно более эффективным (фиг.12,D), чем время инкубации, составляющее 30 минут (фиг.12,В и С). Одно из возможных объяснений заключается в том, что IMC-3G3 индуцирует интернализацию PDGFRα и что его ингибирующее действие связано не только с блокированием связывания лиганда, но также с удалением рецептора из плазматической мембраны.
Пример 3
Выделение антител против PDGFRα человека. Моноклональные антитела против PDGFRα человека генерировали стандартными гибридомными методами (Harlow & Lane, ed., Antibodies: A Laboratory Manual, Cold Spring Harbor, 211-213 (1998), который включен в данное описание в качестве ссылки) с использованием трансгенных мышей (Medarex Inc., Sunnyvale, CA), которые экспрессируют тяжелые гамма- и легкие каппа-цепи иммуноглобулина человека. Внеклеточный домен (ECD) PDGFRα человека получали от R&D Systems (Minneapolis, MN). Проводили иммунизацию мышей КМ подкожно (s.c.) 3×107 эндотелиальными клетками аорты свиней, стабильно экспрессирующими PDGFRα. Через 4 недели проводили повторную иммунизацию мышей s.c. 50 мкг ECD PDGFRα в полном адъюванте Фрейнда плюс 3×107 клеток РАЕ Rα, вводимых внутрибрюшинно. Повторную иммунизацию мышей проводили еще два раза с разрывом в 3 недели с использованием 25 мкг ECD PDGFRα в полном адъюванте Фрейнда.
Выделяли спленоциты мышей с высоким связыванием сыворотки и титрами блокирования и сливали их с клетками миеломы. Гибридомные культуры, проявляющие блокирующую активность, субклонировали и антитела, полученные от данных гибридом, очищали хроматографией с использованием белка-G.
Проводили оценку связывания IgG с PDGFRα с использованием анализа непосредственного связывания. ECD PDGFRα в PBS был иммобилизован в 96-луночных планшетах (100 нг/лунку). Затем планшеты промывали PBST (PBS+0,05% Tween 20) и блокировали PBSM (3% молока в PBS, 200 мкл/лунку) в течение 2 часов при 25°С. IgG, разведенный в PBSM, инкубировали с иммобилизованным ECD PDGFRα в течение 1 часа при 25°С и планшеты промывали PBST. Добавляли вторичное антитело (конъюгат козий F(ab')2 против IgG человека-пероксидаза хрена; BioSource International, Camarillo, CA), разведенное 1:5000 в PBSM, на 1 час при 25°С. После этого планшеты промывали PBST, добавляли ТМВ-пероксидазный субстрат (KPK, Gaithersburg, MD) и реакцию останавливали, добавляя 100 мкл 1 моль/л H2SO4. Планшеты считывали при А450 нм с использованием ридера для микропланшетов (Molecular Devices, Sunnyvale, CA).
Блокирование PDGF оценивали с использованием твердофазного анализа блокирования PDGF (см. Duan et al., 1991, J.Biol. Chem., 266: 413-8, включено в данное описание в качестве ссылки). ECD PDGFRα разводили в PBS и наносили на лунку 96-луночных планшетов для микротитрования (Immulon 2HB, плоскодонные 1×12 полоски Removawell облученного связанного с белком полистирола; Dynex Technologies, Chantilly, VA). На каждую лунку наносили 60 нг PDGFRα в течение 3 часов при 25°С в общем объеме 100 мкл. Затем планшеты дважды промывали и блокировали в течение ночи при 4°С с использованием 25 ммоль/л HEPES (pH 7,45), 0,5% желатина, 100 ммоль/л NaCl и 0,1% Tween 20. Затем планшеты нагревали до 25°С в течение 20 минут и промывали один раз связывающим буфером (25 ммоль/л HEPES (pH 7,45), 0,3% желатина, 100 ммоль/л NaCl, 0,01% Tween 20). В каждую лунку добавляли 50 микролитров IgG и инкубировали при 25°С в течение 30 минут. Йодированный PDGF разводили в связывающем буфере и добавляли (50 мкл раствора с концентрацией 1 нмоль/л) в каждую лунку. Планшеты инкубировали в течение 2 часов при 25°С и затем промывали пять раз связывающим буфером. Каждую лунку считывали с помощью счетчика гамма-излучения. Анализ блокирования на основе клеток был проведен как описано Heldin et al., 1988, EMBO J., 7, 1387-93.
Кинетику связывания антитела с PDGFRα измеряли с использованием прибора BIAcore 3000 (BIAcore, Inc., Piscataway, NJ). ECD PDGFRα иммобилизовали на сенсорном чипе и вводили антитело в различных концентрациях. Получали сенсограммы для каждой концентрации и проводили оценку с использованием программы BIA Evaluation 2.0 для определения констант скорости. Константу аффинности, Kd, оценивали из соотношения констант скоростей Koff/Kon.
На фиг.13 показано доза-зависимое связывание моноклонального антитела IMC-3G3 человека с иммобилизованным PDGFRα ECD в анализе ELISA. Концентрация антитела, необходимая для 50% максимального связывания с PDGFRα ECD, составляла 0,06 нмоль/л (таблица 6). Величина ED50 согласуется с Kd для антитела, определенной методом поверхностного плазмонного резонанса на приборе BIAcore (таблица 1). Моноклональное антитело также блокирует связывание [125I]PDGF-BB с иммобилизованным рецептором при IC50, равном 0,43 нмоль/л. Сайты связывания для PDGF-АА и PDGF-ВВ на PDGFRα структурно не совпадают. Эти данные позволяют предположить, что эпитоп 3G3 пространственно перекрывает оба сайта связывания фактора роста.
Характеристики связывания антитела против PDGFRα
(105 моль/л-1 с-1)
(104 с-1)
(109 моль/л)
Ингибирование фосфорилирования рецептора и активации эффекторных молекул в прямом (5'-3') направлении. Действие индуцированной PDGF внутриклеточной передачи сигнала с помощью IMC-3G3 определяли с использованием клеток РАЕ Rα. Клетки высевали в шестилуночные планшеты Фалькона для культур тканей (250000 клеток на лунку) и давали возможность расти в течение ночи. Лунки затем споласкивали и инкубировали в не содержащей сыворотки крови среде. После инкубирования в течение ночи для придания клеткам статического состояния клетки обрабатывали антителами в течение 30 минут при 37°С с последующим добавлением PDGF-АА или PDGF-ВВ и инкубировали дополнительно в течение 10 минут при 37°С. Затем клетки разъединяли и лизировали в 200 мкл лизисного буфера (50 ммоль/л Tris-HCl (pH 8,0), 1% Triton-X-100, 150 ммоль/л NaCl, 1 ммоль/л EDTA, 0,1% SDS, 1 ммоль/л ортованадата натрия и ингибиторы протеазы (Complete Mini, Roche, Manheim, Германия)). Лизаты клеток анализировали методами SDS-PAGE и вестерн-блоттинга с использованием реагентов, усиливающих хемолюминисценцию, и Hiperfilm (Amersham Bioscience).
Была протестирована способность антитела ингибировать индуцированное лигандом фосфорилирование тирозина рецептора. PDGF-АА и PDGF-ВВ увеличивают фосфорилирование тирозина PDGFRα примерно в 5 раз при концентрациях 1 и 3 нмоль/л соответственно. Более высокие концентрации лиганда (10 нмоль/л) приводят к меньшему фосфорилированию рецептора, вероятно, благодаря индуцированному лигандом разрушению. Антитело ингибировало индуцированный PDGF-ВВ рецептор к уровню, близкому к фоновому (фиг.14,А, верхний ряд). Аналогичные данные были получены с использованием PDGF-АА для индуцирования фосфорилирования рецептора.
PDGF преобразует митогенные сигналы и вызывает антиапоптическое действие на экспрессирующие рецепторы клетки посредством эффекторного белка в прямом направлении. Соответственно была протестирована способность моноклонального антитела ингибировать активацию МАРK p44/p42 и Akt (вовлеченные в рост клеток и антиапоптические пути соответственно). Антитело против PDGFRα ингибировало фосфорилирование как МАРK, так и Akt в качестве ответной реакции на PDGF-ВВ (фиг.2,А) и PDGF-АА (не показано). Ингибирование фосфорилирования PDGFRα было доза-зависимым при этом 50%-ное ингибирование достигалось при 0,25 нмоль/л.
Антимитогенная активность. Проводили тестирование способности моноклонального антитела против PDGFRα блокировать индуцированный PDGF-АА митогенез клеток РАЕ Rα. Клетки высевали в 96-лучночные планшеты для культивирования тканевых культур (1×104 клеток на лунку) и выращивали в течение ночи в 100 мкл среды на лунку. Лунки затем ополаскивали не содержащей сыворотки средой и клетки оставляли в отсутствие сыворотки в течение ночи с 75 мкл не содержащей сыворотки среды, добавленной в каждую лунку. Добавляли IgG (25 мкл/лунку) и планшеты инкубировали в течение 30 минут при 37°С. Затем добавляли PDGF-АА или PDGF-ВВ (25 мкл/лунку) и планшеты инкубировали в течение 18-20 часов при 37°С. Планшеты инкубировали дополнительно в течение 4 часов после добавления в каждую лунку 0,25 мкКи [3H] тимидина (25 мкл/лунку). Антитело, PDGF и [3H] тимидин разводили в не содержащей сыворотки среде. Затем клетки промывали PBS плюс 1% бычьего сывороточного альбумина и отсоединяли обработкой трипсином (100 мкл/лунку). Клетки собирали на фильтре и промывали три раза дважды дистиллированной водой с использованием харвестера для клеток МАСН III (Tomtec, Inc., Hamden, CT). После обработки на фильтре вошедшую в ДНК радиоактивность определяли с использованием сцинтилляционного счетчика (Wallac Microbeta, модель 1450).
Когда к клеткам РАЕ Rα в отсутствие сыворотки добавляли IMC-3G3, специфически ингибировалось индуцированное PDGF-АА внедрение тимидина (фиг.15) при ЕС50, равном 8,3 нмоль/л. Антитело также ингибировало индуцированный 3 нмоль/л PDGF-ВВ митогенез клеток РАЕ Rα при ЕС50, составляющем 1,25 нмоль/л (данные не показаны).
Ингибирование роста опухолевых клеточных линий человека, экспрессирующих PDGFRα. Клеточные опухолевые линии человека, экспрессирующие PDGFRα, тестировали для определения воздействия антитела против PDGFRα человека на рост злокачественных новообразований в системах in vitro и in vivo. Две такие клеточные линии, которые экспрессировали PDGFRα, как было определено методом проточной цитометрии, представляют собой SKLMS-1 (лейомиосаркома) и U118 (глиобластома). Данные клеточные линии также дают ответную реакцию на лиганд в митогенных анализах и образуют опухоли у мышей. SKLMS-1 обладает потенциалом не только для паракринной, но и для аутокринной стимуляции. Было показано, что SKLMS-1 экспрессируют белок PDGF-АА, когда растут в культуре с использованием метода количественного сэндвичевого ферментативного иммуноанализа (R&D Systems).
Как можно видеть на фиг.16,А, IMC-3G3 ингибировал фосфорилирование как Akt, так и МАРK в ответ на PDGF-АА стимуляцию клеток SKLMS-1. Ингибирование фосфорилирования Akt составляло 100%, а для МАРK составляло примерно 80%. Антитело также оказалось эффективным ингибитором фосфорилирования клеток U118 (фиг.16,В). Лиганд-индуцированный митогенез опухолевых клеток также блокировался. Когда антитело против PDGFRα добавляли к клеткам U118 в отсутствие сыворотки крови, PDGF-АА индуцированное внедрение тимидина специфически ингибировалось (фиг.17,А) при ЕС50 3,4 нмоль/л. Антитело также ингибировало индуцированный PDGF-АА митогенный ответ клеток SKLMS-1 при ЕС50, составлявшем 5 нмоль/л (фиг.17,В), а также стимулированный PDGF-ВВ митогенный ответ (фиг.17,С). Только частичное ингибирование (40% при 66 нмоль/л; фиг.17,D) стимулированного PDGF-ВВ митогенного ответа наблюдалось для клеток U118. Это можно объяснить экспрессией как PDGFRα, так и PDGFRβ в этих клетках (данные не показаны).
Ингибирование роста ксенотрансплантата опухоли. IMC-3G3 был протестирован in vivo на подкожных моделях ксенотрансплантатов глиобластомы (U118) и лейомиосаркомы (SKLMS-1) у бестимусных «голых» мышей. Подкожные ксенотрансплантаты опухолей получали путем инъекции 10×106 клеток SKLMS-1 или U118, смешанных в Matrigel (Collaborative Research Biochemicals, Bedford, MA) самкам бестимусных «голых» мышей (Crl:NU/NU-nuBR, Charles River Laboratories, Wilmington, MA). Опухолям давали возможность достичь среднего объема опухоли (π/6 × наибольшая длина × перпендикулярная ширина2) примерно в 400 мм3. Мышей случайным образом распределяли на пять групп (n=12), и на продолжении исследования дважды в неделю они получали внутрибрюшинную инъекцию. Мыши в группе 1 получали носитель в качестве контроля (0,9% NaCl, USP для орошения B/Braun). Мышей в группах со 2 по 4 обрабатывали 6, 20 и 60 мг/кг настоящего антитела против PDGFRα. Мышей в группе 5 обрабатывали 60 мг/кг IgG человека (Sigma). Группы, обрабатываемые 6, 20 и 60 мг/кг антитела против PDGFRα или IgG человека, получали нагружаемые дозы в 21,4, 71,4 и 214 мг/кг соответственно. Нагружаемые дозы рассчитывали для достижения устойчивого состояния концентрации в плазме крови от первой дозы (период полувыведения, 7 дней) с использованием режима дозировки дважды в неделю. Объемы опухолей оценивали дважды в неделю и рост опухоли в группе обработки сравнивали с использованием повторных измерений ANOVA.
Как видно на фиг.18,А, IgG человека не оказывает действия на рост глиобластомы по сравнению с мышами, получавшими физиологический раствор (Р=0,74), тогда как антитело против PDGFRα существенно ингибирует рост опухоли в дозах 6 (Р=0,06), 20 (Р=0,03) и 60 (Р=0,004) мг/кг. В конце исследования U118 значения %Т/С [(средний объем опухоли для обработанной 3G3 группы при завершении исследования/средний объем опухоли в начале лечения)/(средний объем опухоли для контрольной группы при завершении исследования/средний объем опухоли в начале лечения)×100] составляли 67%, 63% и 35% для групп, получавших дозировку 3G3, составлявшую 6, 20 и 60 мг/кг соответственно. Более того, регрессия опухоли наблюдалась 4 из 12, 5 из 11 и 10 из 12 животных, в группах обработки 6, 20 и 60 мг/кг. Ни в одной из контрольных групп регрессии не было.
На фиг.18,В показано, что рост лейомиосаркомы также существенно ингибировался при обработке при дозе 6 (Р=0,02), 20 (Р=0,003) и 60 (Р<0,0001) мг/кг. Конечные значения %Т/С составляли 66%, 57% и 31% для групп получавших 6, 20 и 60 мг/кг соответственно в отсутствие регрессии опухолей.
Гистологическое исследование ксенотрансплантатов в конце обработки показало заметное различие в опухолях животных подвергавшихся лечению, по сравнению с опухолями животных, получавших только контрольную терапию. Иссеченные опухоли были зафиксированы в фиксативе QDL при 4°С в течение 24 часов. После герметизации в парафине и получения срезов по 4 мкм зафиксированные в парафине срезы были окрашены с использованием Mayer's H&E (Richard Allen, Kalamazoo, MI).
В группе U118, обработанной наиболее высокой дозой (60 мг/кг), было обнаружено меньше жизнеспособных опухолевых клеток, и было по существу больше областей разбросанных клеток по сравнению с контрольной группой физиологического раствора (фиг.18). Обработанные ксенотрансплантаты SKLMS-1 на 25-й день также показывали снижение количества жизнеспособных опухолевых клеток и клеточную упаковку, сравнимую с группой физиологического раствора (фиг.18).
In vivo ингибирование опосредованной PDGFRα стимуляции линии глиобластомы. Через неделю после обработки антителом против PDGFRα или IgGt человека оценивали уровень рецептора фосфотирозина в опухолях U118. Мышей с развитыми опухолями U118 (500 мм3) обрабатывали при дозированной нагрузке 214 мг/кг в последующие 72 часа при поддерживающей дозе антитела 60 мг/кг. Опухоли получали у мышей через одну неделю (168 часов) после первой инъекции антитела (в момент времени, когда в среднем наблюдалась регрессия опухоли; см. фиг.18,А) и гомогенизировали в лизисном буфере для анализа фосфорилирования (см. выше). Лизаты дважды центрифугировали при 14000 об/мин и определяли концентрацию белка для собранного супернатанта (анализ белка Bio-Rad, Bio-Rad, Hercules, CA). Лизат (4 мг) из каждого образца подвергали иммуноосаждению с использованием антитела против PDGFRα. Иммуноосажденный PDGFRα человека затем иммуноблотировали с использованием или антитела против PDGFR, или антитела против фосфотирозина. На фиг.19 показано, что применение антитела против PDGFRα приводит к снижению уровня PDGFRα-фосфотирозина в данных опухолях относительно IgG человека в качестве контроля.
Конструирование клеточной линии. Во-первых, гены, кодирующие вариабельные домены тяжелой и легкой цепей антитела против PDGFRα человека, были клонированы и секвенированы. Получена серия праймеров от MEDAREX, которая аннелирует к 5' и 3'фланкирующим последовательностям вариабельной области иммуноглобулина человека последовательности в рамках MEDAREX-полученных гибридом. Вариабельную область тяжелой цепи амплифицировали с парой праймеров АВ88 (прямой) и АВ90 (обратный) (таблица 7). Продукты легкой цепи амплифицировали с парой праймеров, содержащей прямой праймер АВ182 и обратный праймер АВ16 (таблица 7). Продукты данных реакций в 0,4 тысячи пар оснований клонировали в вектор ZeroBlunt (Invitrogen) для получения АВ88-1 (VH) и АВ182-3 (VK) и вставки секвенировали с использованием универсальных праймеров Т7 и M13R.
Праймеры для гибридом MEDAREX
Для генерирования векторов плазмиды для экспрессирования полного антитела IgG1, клонированные вариабельные области амплифицированы с помощью ПЦР и лигированы в две стадии в векторы экспрессии, содержащие гены константных областей. Первоначально при ПЦР-амплификации тяжелой цепи использовали 25 нг плазмиды АВ88-1 в качестве матрицы для праймеров IPHF5 (прямой) и IPHR5 (обратный). Во-вторых, в ПЦР-амплификации тяжелой цепи использовали 5 мкл первичной реакционной смеси в качестве матрицы и праймеры OPSIF и IPHR5. Комбинация двух прямых праймеров добавляет последовательность из 57 пар оснований к концу 5' генов иммуноглобулина, кодирующую сигнальную последовательность гена тяжелой цепи мыши из 19 аминокислот (MGWSCIILFLVATATGVHS; SEQ ID NO:24) для эффективного процессинга и секреции иммуноглобулина. Кроме того, прямой праймер OPSIF добавляет консенсусную последовательность Козака (J.Mol.Biol. 196: 947) для эффективной инициации трансляции данных генов в клетки млекопитающих и эндонуклеазный сайт рестрикции 5' HindIII для клонирования амплифицированного продукта в подходящий вектор экспрессии. Обратный праймер тяжелой цепи содержит внутрирамочный сайт Nhel для клонирования в вектор константной области.
ПЦР проводили в две стадии с использованием набора Expand PCR (Boehringer Mannheim Inc.) в соответствии со спецификацией производителя и применением буферной системы Expand в 50 мкл реакциях при следующих условиях циклов:
После двух кругов ПЦР продукт очищали электрофорезом на агарозном геле и клонировали в качестве отщепленного фрагмента HINdIII-Nhel в вектор pDFc (фиг.8), который содержит постоянную область гамма 1 человека.
В первичной ПЦР амплификации легкой цепи использовали 25 нг плазмиды рАВ182-3 и в качестве темплатных праймеров IPLF4 (прямой) и IPLR2 (обратный). Во вторичной ПЦР амплификации легкой цепи использовали 5 мкл первичной реакционной смеси в качестве матрицы и праймеры OPSIF и IPLR2. Как и в случае тяжелой цепи, два прямых праймера обеспечивали сигнальную последовательность секреции. Обратный праймер легкой цепи содержит сайт BsiWI в рамке считывания для клонирования в вектор pLck постоянной области каппа (фиг.8). Реакции ПЦР проводили, как и в случае тяжелой цепи, описанном выше. После двух кругов ПЦР продукт очищали электрофорезом на агарозном геле и клонировали в pLck, который содержит постоянную область каппа легкой цепи человека.
Праймеры для векторов экспрессии VH VK
CCTTTTTCTAGTAGC
CAGCTGCAGCTGCAGGAGTC
AAATTGTGTTGACACAGTC
Для образования вектора унифицированной плазмиды для стабильной трансфекции, кассету экспрессии тяжелой цепи, содержащую промотор CMV, кодирующую область тяжелой цепи и элемент polyA, клонировали в вектор легкой цепи в качестве фрагмента Notl-Sall (фиг.20).
Данная конструкция затем была использована для создания стабильной продуцирующей линии в клетках клеточной линии миеломы NS0. Клетки NS0 были трансфицированы плазмидой экспрессии путем электропорации с использованием BioRad Gene Pulser II. Перед трансфекцией плазмиду ДНК линеаризовали с использованием PvuI, осаждали этанолом и повторно суспендировали при концентрации 0,4 мг/мл (40 мкг в 100 мкл Н2О). Клетки подвергали электропорации вместе с 40 мкг ДНК в конечном объеме 800 мкл при одном импульсе в 250 вольт, 400 мкФ. Клетки после электропорации диспергировали в 50 мкл аликвотах в среде DMEM (JRH Biosciences Inc), содержащей 10% диализованной фетальной телячьей сыворотки (dFCS) (Hyclone, Lot #: AHA 7675) и 2 мМ глутамина (Invitrogen/Life Technologies) в лунках приблизительно восемнадцати 96-луночных планшетов при плотности 5000-10000 клеток на лунку. Отбор для положительных в отношении глутаминсинтетазы (GS) трансфектантов инициировали через 24 часа после добавления не содержащей глутамина DMEM, содержащей 10% dFCS и дополненной дополнителем 1х GS (JRH Biosciences Inc). Клетки культивировали в течение 2-4 недель при 37°С, 5% СО2, предоставляя им возможность роста и развития колоний. Проводили скрининг среди более 300 колоний с использованием анализа ELISA Fc (гамма) против человека (детектирование пероксидазы хрена при А450 нм). Клоны, экспрессирующие антитело (58%), развивали и повторно тестировали на продуктивность после культивации в течение 3-5 дней. Для адаптации клеток к не содержащей сыворотки среде положительные клеточные линии развивали путем добавления равного объема не содержащей сыворотки крови культивационной среды GS-0S при каждом пассаже. Сильно положительные, продуцирующие 25 мкг/мл или более в 3 дня субконфлюенты 24 луночных культур развивали для дальнейшего анализа для завершения адаптации к не содержащей сыворотки среде.
Следует понимать и ожидать того, что специалист в данной области может осуществить вариации принципов раскрытого здесь изобретения, и предполагается, что такие модификации должны быть включены в объем настоящего изобретения.






























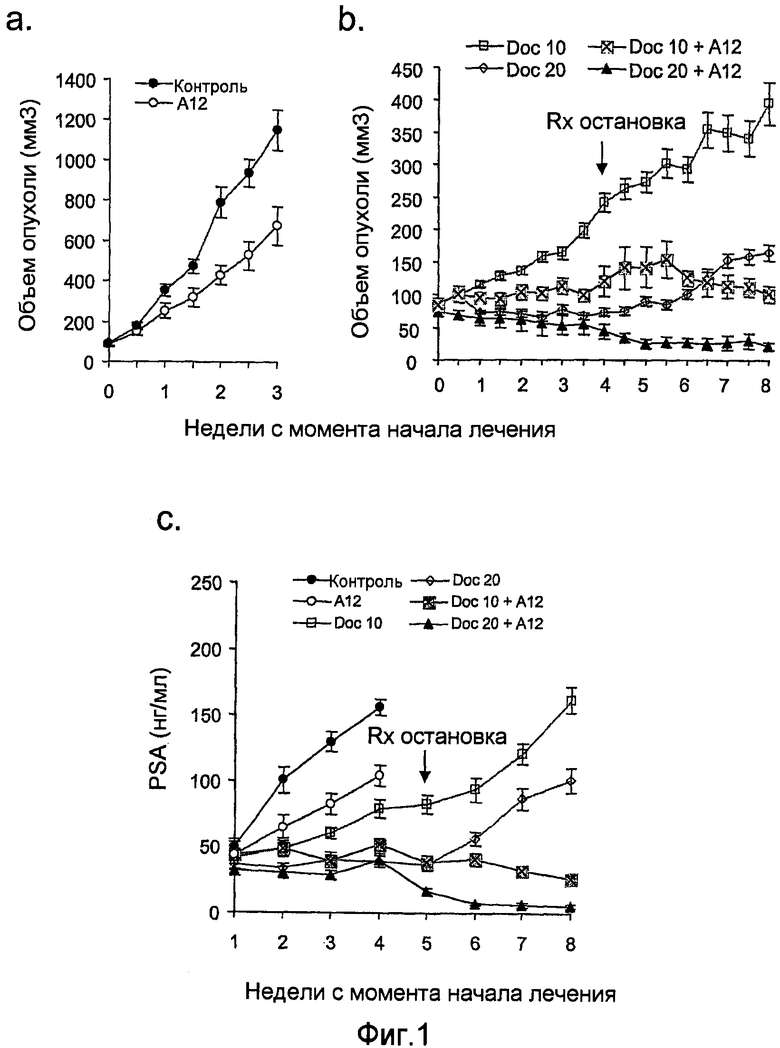
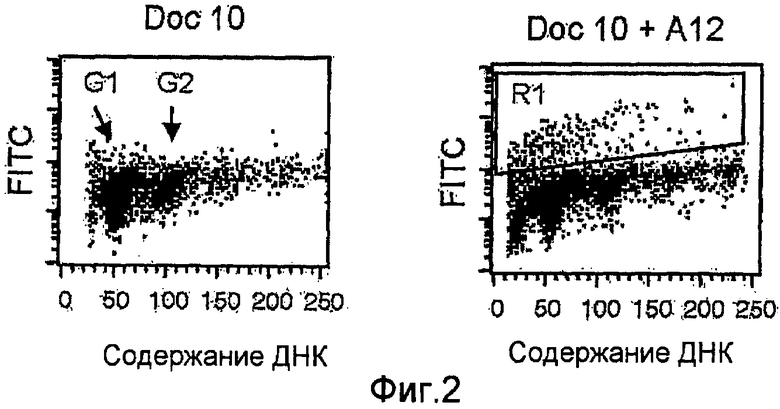
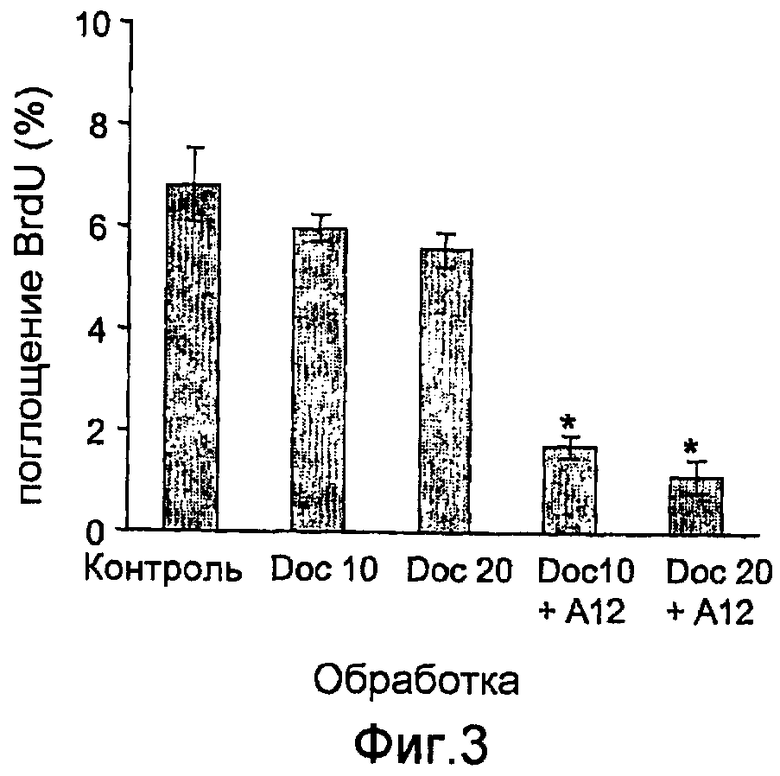
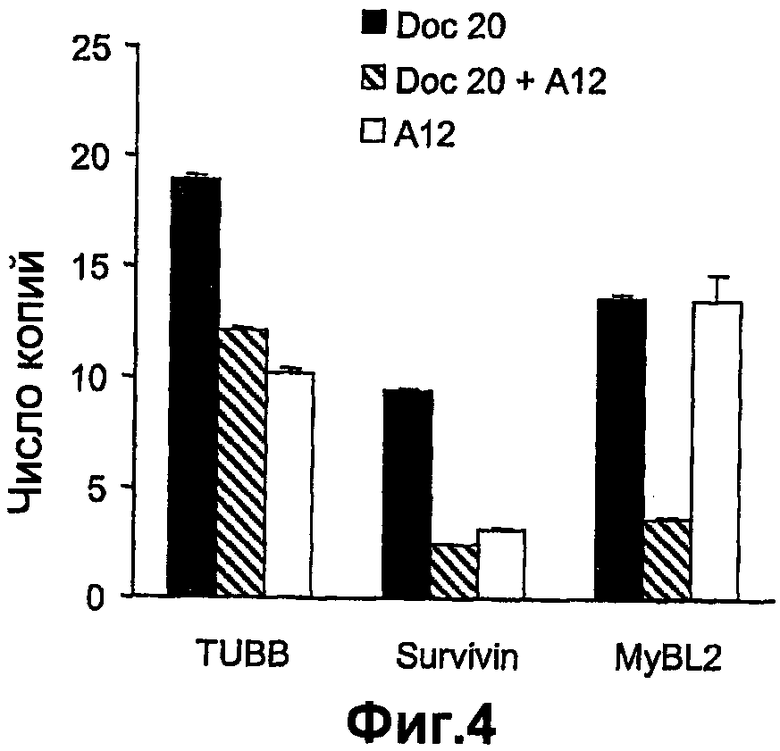
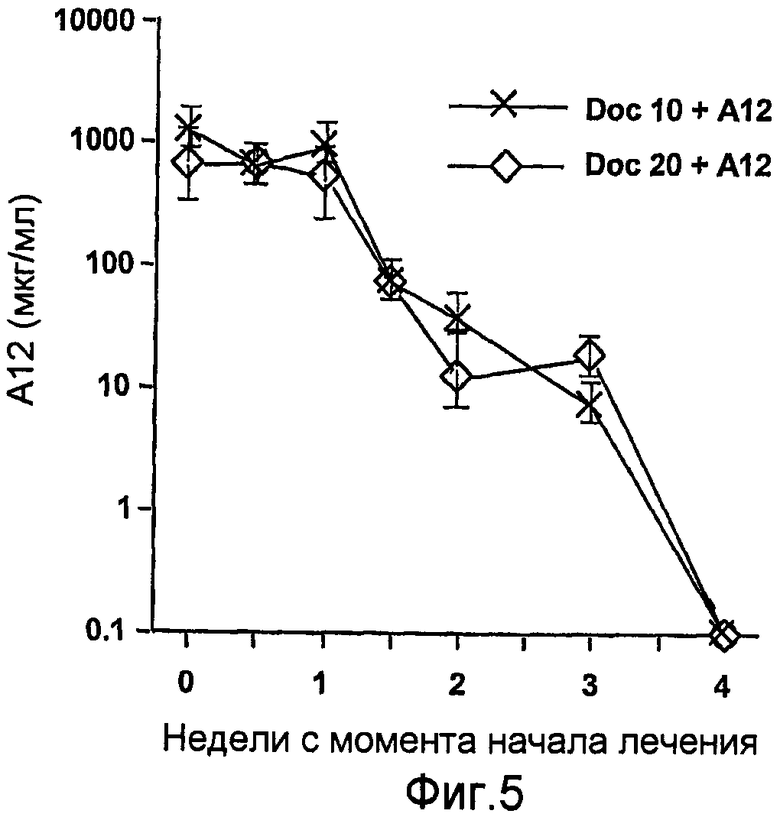
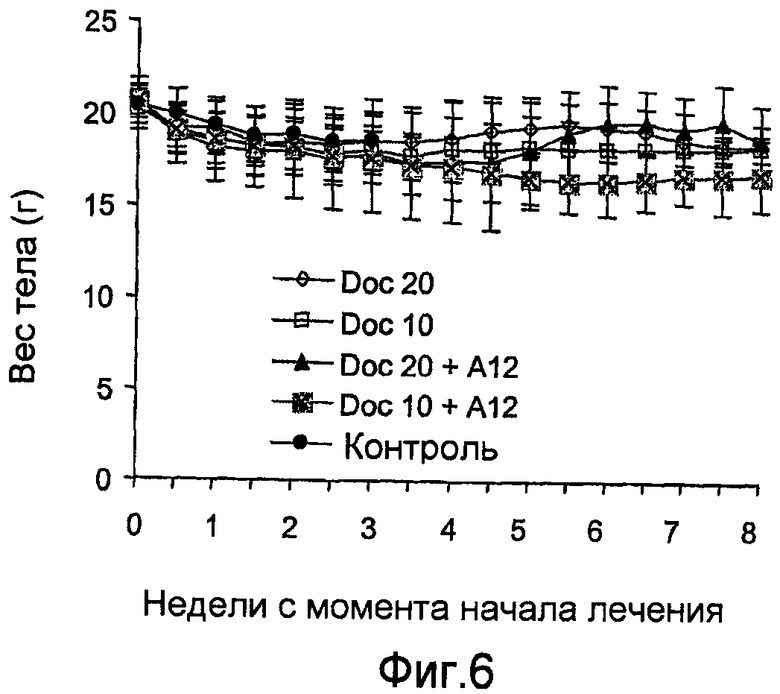
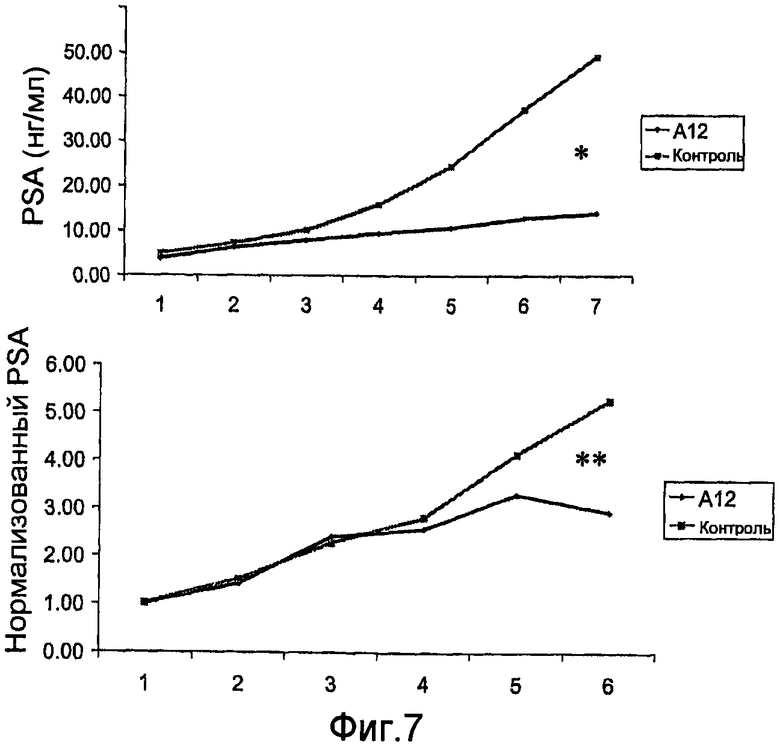
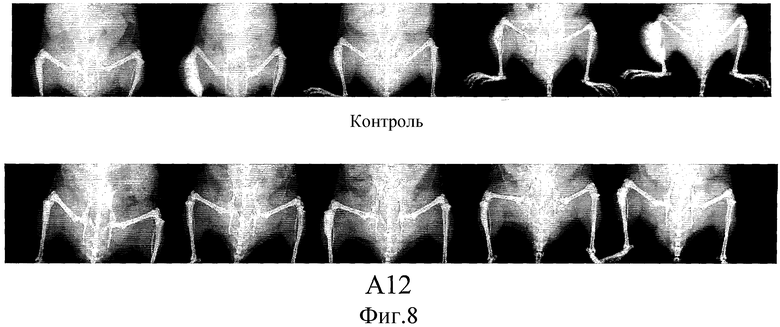
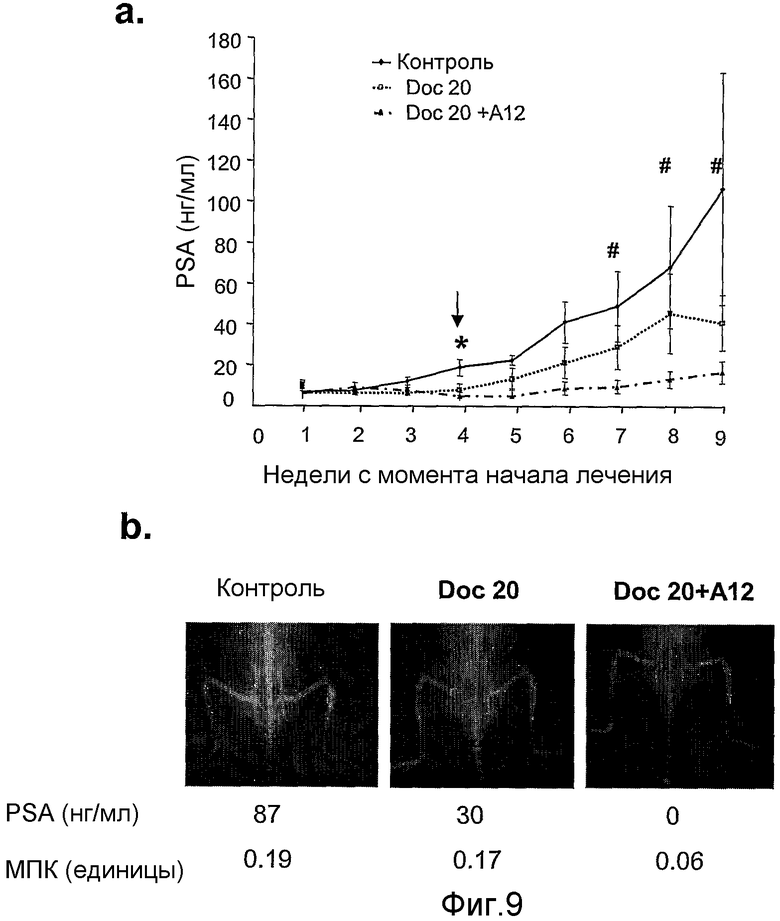
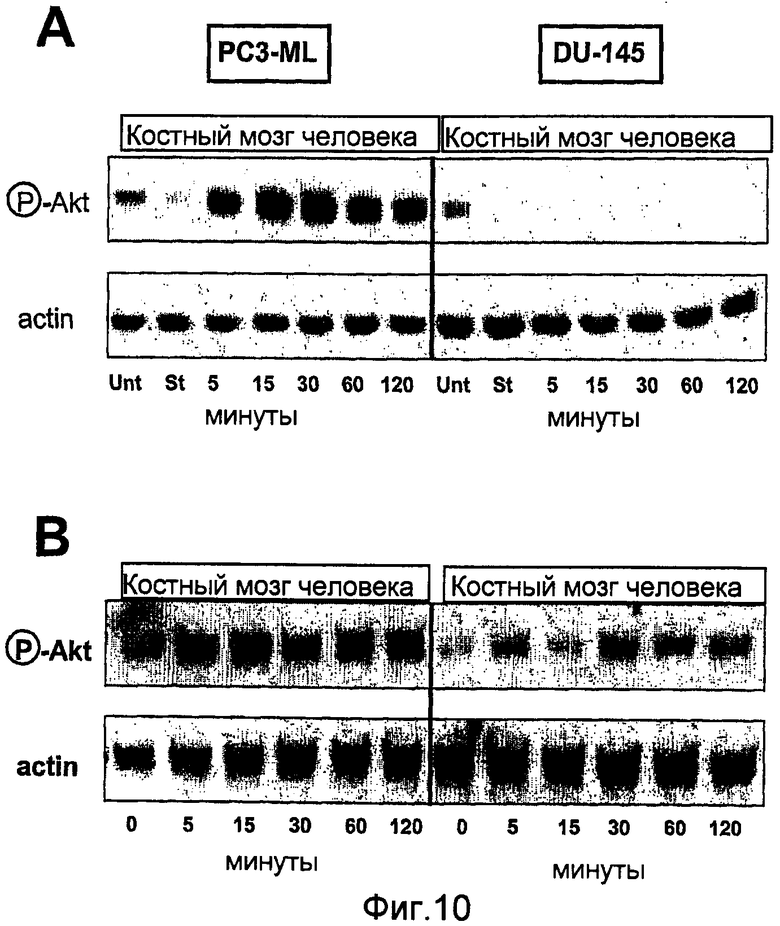
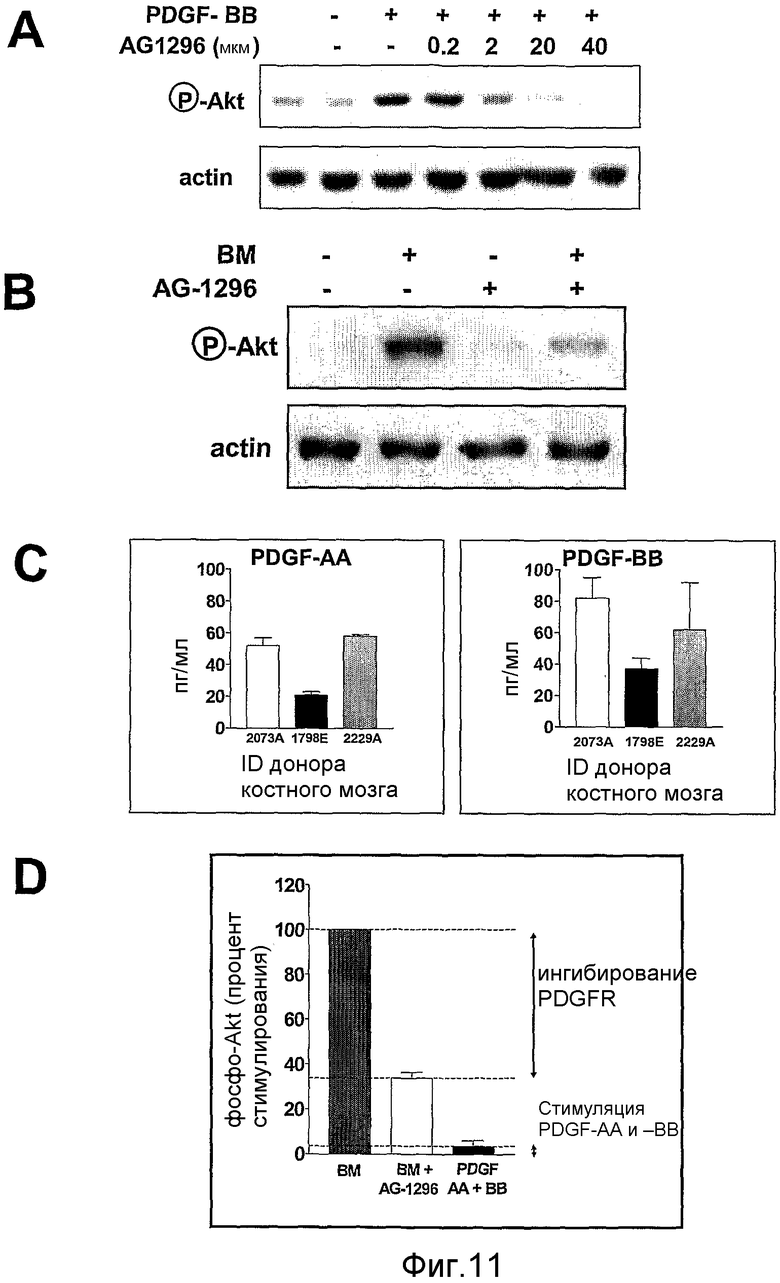
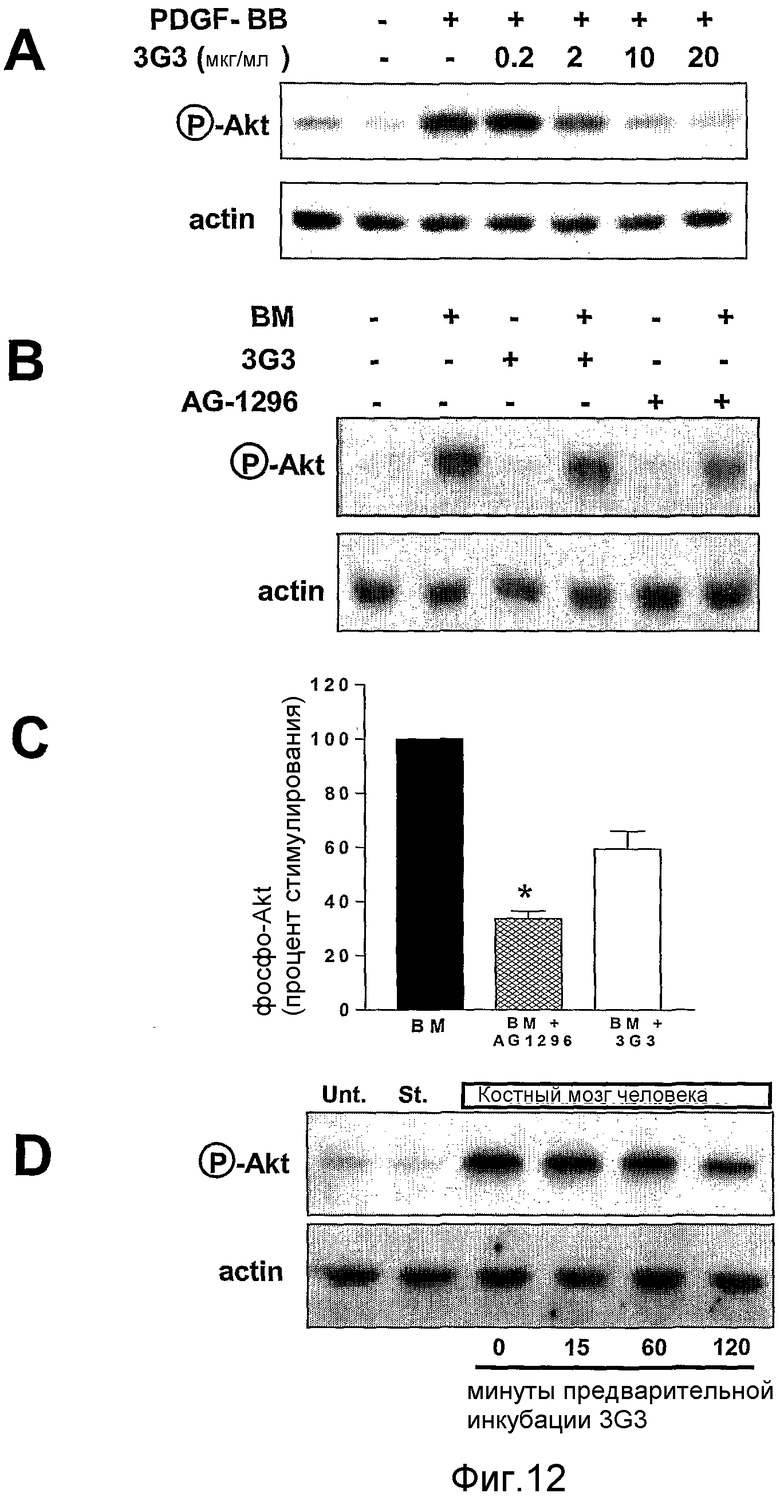
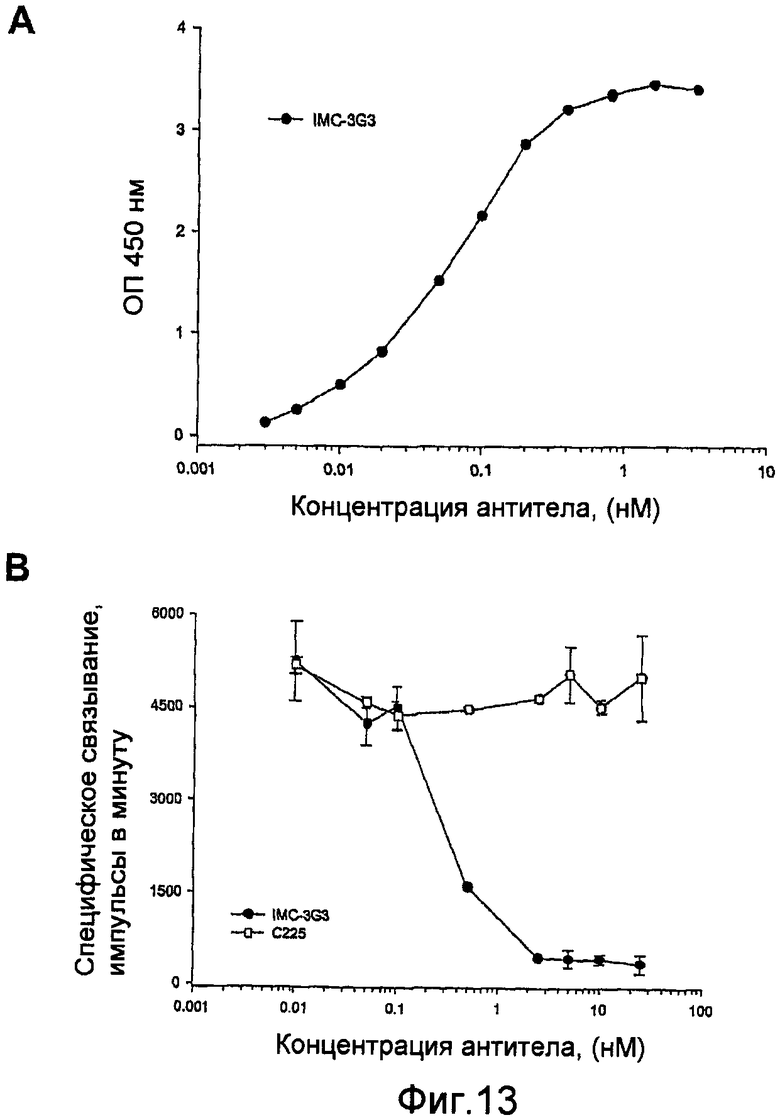
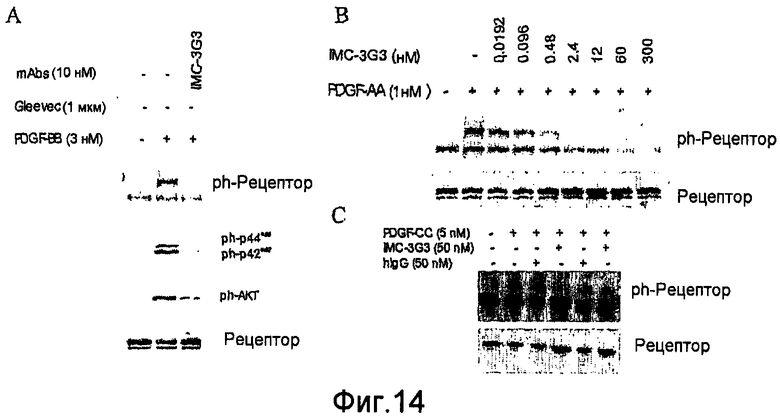
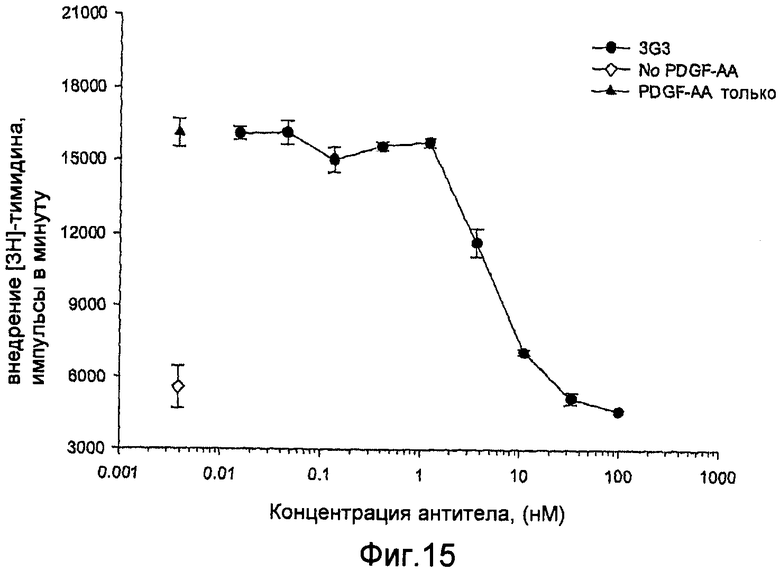
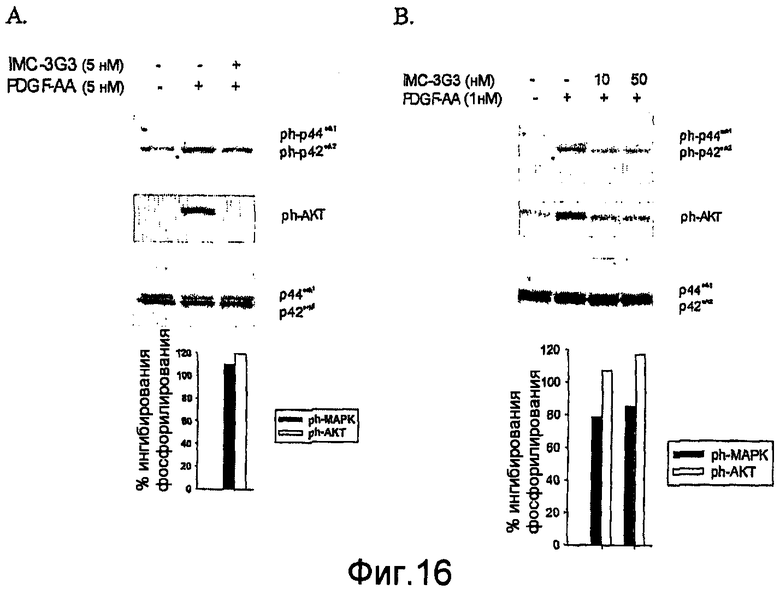
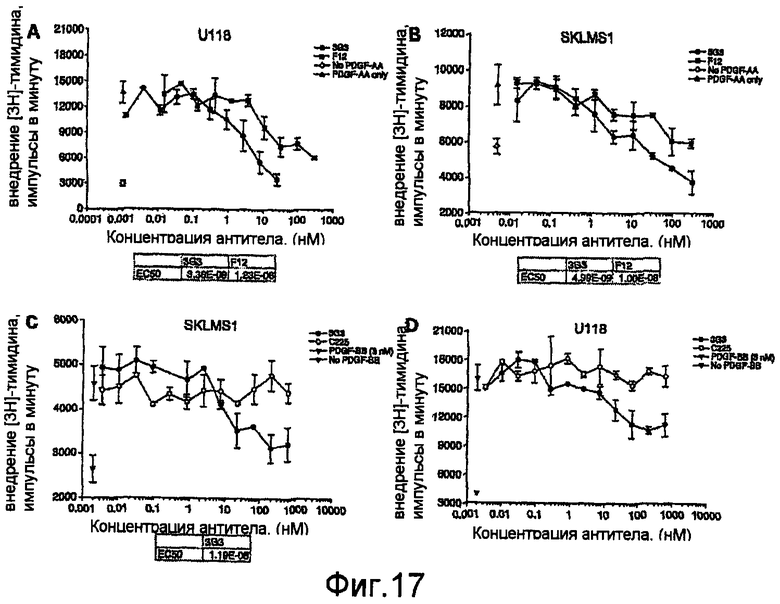
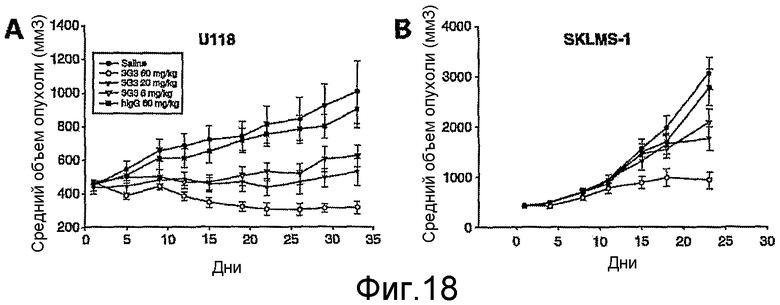
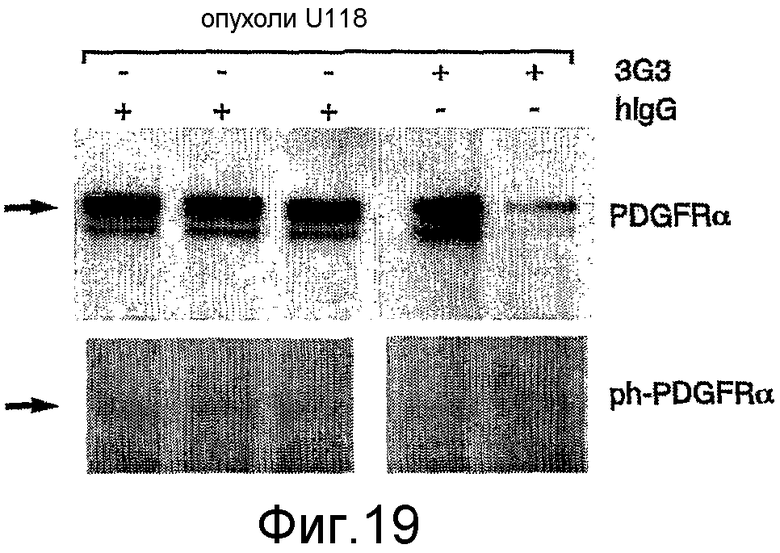

Представлена группа изобретений, которые относятся к медицине, а именно к онкологии. Группа изобретений включает в себя выделенное антитело или фрагмент антитела человека, специфическое в отношении PDGFRα, выделенный полинуклеотид, вектор экспрессии, рекомбинантную клетку, антитело или фрагмент антитела, продуцируемое при культивировании рекомбинантной клетки, а также применение этих антител или их фрагментов для ингибирования роста опухоли, относящейся к лейомиосаркоме и глиобластоме. С помощью изобретения успешно лечат лейомиосаркому и глиобластому за счет использования антител или их фрагментов, которые связываются с PDGFRα человека и нейтрализуют активацию рецепторов, вовлеченных в рост или ангиогенез опухоли. 5 н. и 5 з.п. ф-лы, 20 ил., 8 табл., 3 пр.
1. Выделенное антитело или фрагмент антитела человека, специфическое в отношении PDGFRα, включающее последовательности
SSSYY (SEQ ID NO:2) при CDRH1;
SFFYTGSTYYNPSLRS (SEQ ID NO:4) при CDRH2;
QSTYYYGSGNYYGWFDR (SEQ ID NO:6) при CDRH3;
RASQSVSSYLA (SEQ ID NO:10) при CDRL1;
DASNRAT (SEQ ID NO:12) при CDRL2 и
QQRSNWPPA (SEQ ID NO:14) при CDRL3.
2. Антитело или фрагмент антитела по п.1, которое включает вариабельную область тяжелой цепи, имеющую последовательность
QLQLQESGPGLVKPSETLSLTCTVSGGSINSSSYYWGWLRQSPGK GLEWIGSFFYTGSTYYNPSLRSRLTISVDTSKNQFSLMLSSVTAADTAVY YCARQSTYYYGSGNYYGWFDRWDQGTLVTVSS (SEQ ID NO:8), или
вариабельную область легкой цепи, имеющую последовательность
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRL LIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPA FGQGTKVEIK (SEQ ID NO:16).
3. Антитело или фрагмент антитела по п.1, которое включает вариабельную область тяжелой цепи, имеющую последовательность
QLQLQESGPGLVKPSETLSLTCTVSGGSINSSSYYWGWLRQSPGK GLEWIGSFFYTGSTYYNPSLRSRLTISVDTSKNQFSLMLSSVTAADTAVY YCARQSTYYYGSGNYYGWFDRWDQGTLVTVSS (SEQ ID NO:8), и
вариабельную область легкой цепи, имеющую последовательность
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRL LIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPA
FGQGTKVEIK (SEQ ID NO:16).
4. Антитело или фрагмент антитела по п.1, которое включает тяжелую цепь, имеющую последовательность
MGWSCIILFLVATATGVHSQLQLQESGPGLVKPSETLSLTCTVSGG SINSSSYYWGWLRQSPGKGLEWIGSFFYTGSTYYNPSLRSRLTISVDTSK NQFSLMLSSVTAADTAVYYCARQSTYYYGSGNYYGWFDRWDQGTLVT VSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALT SGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKR VEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVV DVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQ DWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTK NQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSK LTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:31), и
легкую цепь, имеющую последовательность
MGWSCIILFLVATATGVHSEIVLTQSPATLSLSPGERATLSCRASQSVSSY LAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDF AVYYCQQRSNWPPAFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASV VCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTL SKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:33).
5. Антитело или фрагмент антитела по любому из пп.1-4, которое ингибирует связывание PDGFRα с лигандом PDGFRα или которое нейтрализует PDGFRα.
6. Выделенный полинуклеотид, который содержит нуклеотидную последовательность, кодирующее антитело или фрагмент антитела по любому из пп.1-5.
7. Вектор экспрессии, включающий полинуклеотид по п.6, операбельно связанный с элементами контроля экспрессии, для того чтобы могли экспрессироваться кодируемое антитело или его фрагмент.
8. Рекомбинантная клетка, включающая вектор экспрессии по п.7, где рекомбинантная клетка способна продуцировать антитело или его фрагмент по любому из пп.1-5.
9. Антитело или фрагмент антитела, продуцируемое при культивировании рекомбинантной клетки по п.8, где антитело или его фрагмент продуцируется и выделяется из культуры.
10. Применение антитела или его фрагмента по любому из пп.1-5 для ингибирования роста опухоли, где опухоль выбрана из группы, состоящей из лейомиосаркомы и глиобластомы.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| СПОСОБ ЛЕЧЕНИЯ САРКОМ МЯГКИХ ТКАНЕЙ | 2000 |
|
RU2183461C2 |
| СПОСОБ ЛЕЧЕНИЯ МЕТАСТАЗОВ В КОСТИ | 2003 |
|
RU2241452C1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ПОДДУБНАЯ И.В | |||
| Лекарственная терапия злокачественных опухолей (современное состояние и перспективы) // Рус.мед.журн., 1998, т.6, №10, с.621-627 он лайн [найдено в Интернет на (http://www.rmj | |||
| Калоризатор для двигателей | 1923 |
|
SU2145A1 |
Авторы
Даты
2012-07-10—Публикация
2009-04-22—Подача