РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет согласно 35 USC § 119 временной заявки США номер 61/356508, поданной 18 июня 2010 года, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, который был предоставлен в формате ASCII через EFS-Web и включен в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против Axl и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Axl является членом семейства рецепторных тирозинкиназ TAM (Tyro3, Axl и Mer) (O'Bryan et al., 1991; Lai et al., 1991). Первоначально она была идентифицирована в качестве трансформирующего гена при гематологических злокачественных опухолях (O'Bryan et al., 1991; Janssen et al., 1991). Нарушение регуляции Axl или его лиганда Gas6 вовлечено в патогенез различных злокачественных опухолей человека. Сверхэкспрессия Axl была описана при широком наборе злокачественных опухолей человека (Berclaz et al., 2001; Craven et al., 1995; Shieh et al., 2005; Sun et al., 2004; Ito et al., 1999) и связана с инвазивностью и метастазированием при злокачественных опухолях легкого (Shieh et al., 2005), предстательной железы (Sainaghi et al., 2005), молочной железы (Meric et al., 2002; Zhang et al., 2008), желудка (Wu et al., 2002) и поджелудочной железы (Koorstra et al., 2009), почечноклеточном раке (Chung et al., 2003), а также глиобластоме (Hutterer et al., 2008). Недавно путем определения профиля передачи сигнала фосфотирозина активированный белок Axl был выявлен приблизительно в 5% первичных опухолей NSCLC (Rikova et al., 2007). Экспрессия Axl индуцируется направленными и химиотерапевтическими лекарственными средствами, и индуцируемая лекарственным средством экспрессия Axl обеспечивает устойчивость к химиотерапии при остром миелоидном лейкозе (Hong et al., 2008), а также устойчивость к иматинибу и лапатинибу/герцептину при желудочно-кишечных стромальных опухолях (Mehadevan, et al., 2007) и раке молочной железы (Liu et al., 2009), соответственно. Другие публикации, касающиеся Axl и антител против Axl, включают WO2004/039955, WO2009/063965; заявку США номер 61/228915 того же заявителя, поданную 27 июля 2009 года; WO2009/062690; WO2004/008147; 5468634.
Очевидно, продолжает существовать необходимость в средствах, которые обладают клиническими признаками, которые являются оптимальными для разработки лекарственных средств. Изобретение, описанное в настоящем описании, удовлетворяет эту необходимость и обеспечивает другие преимущества.
Все ссылки, цитированные в настоящем описании, включая патентные заявки и публикации, включены в качестве ссылок в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к антителам против Axl и способам их применения.
В одном из аспектов изобретение относится к выделенному антителу, которое связывается с Axl человека, где антитело связывает Axl человека с аффинностью ≤600 пМ, где антитело связывает Axl мыши с аффинностью ≤1 нМ. В некоторых вариантах осуществления антитело стимулирует подавление рецептора Axl. В некоторых вариантах осуществления антитело ингибирует конститутивную активацию Axl. В некоторых вариантах осуществления антитело связывает полипептид, содержащий, по существу состоящий или состоящий из следующей аминокислотной последовательности:
MAWRCPRMGRVPLAWCLALCGWACMAPRGTQAEESPFVGNPGNITGARGLTGTLRCQLQVQGEPPEVHWLRDGQILELADSTQTQVPLGEDEQDDWIVVSQLRITSLQLSDTGQYQCLVFLGHQTFVSQPGYVG (SEQ ID NO:111).
В других вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой антитело человека, гуманизированное или химерное антитело. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, который связывает Axl. В некоторых вариантах осуществления антитело представляет собой антитело человека.
В одном из аспектов изобретение относится к антителу против Axl, где антитело содержит (a) HVR-H1, содержащую GFX1X2X3X4X5X6X7H, где X1 представляет собой S или T; X2 представляет собой L, F или V; X3 представляет собой S, T или R; X4 представляет собой G или S; X5 представляет собой S, H, T или I; X6 представляет собой W или G; X7 представляет собой I или L (SEQ ID NO:112), (b) HVR-H2, содержащую X1X2IX3PX4X5X6X7X8X9X10YYADSVKG, где X1 представляет собой G или A; X2 представляет собой W или G; X3 представляет собой N, S, A или P; X4 представляет собой Y, A или V; X5 представляет собой R, G или S; X6 представляет собой G, R или S; X7 представляет собой Y, S, H или Y; X8 представляет собой A, T или P (SEQ ID NO:113), и/или HVR-H2, содержащую X1X2IX3PX4X5X6X7X8X9X10YYADSVKG, где X1 представляет собой G или A; X2 представляет собой W или G; X3 представляет собой N, S, A или P; X4 представляет собой Y, A или V; X5 представляет собой R, G или S; X6 представляет собой G, R или S; X7 представляет собой Y, S, H или Y; X8 представляет собой A, T или P; X9 представляет собой любую аминокислоту или отсутствует; X10 представляет собой любую аминокислоту или отсутствует (SEQ ID NO:166); (c) HVR-H3, содержащую ARX1X2X3X4X5X6X7X8X9X10X11X12X13MDY, где X1 представляет собой E или W; X2 представляет собой Y или R; X3 представляет собой S, N или P; X4 представляет собой G, D или L; X5 представляет собой W или S; X6 представляет собой G, R, A или S; X7 представляет собой G или S; X8 представляет собой S или отсутствует; X9 представляет собой S, Y или отсутствует; X10 представляет собой V, I или отсутствует; X11 представляет собой G или отсутствует; X12 представляет собой Y или отсутствует; X13 представляет собой A, E или отсутствует (SEQ ID NO:114); (d) HVR-L1, содержащую RASQX1X2X3X4X5X6A, где X1 представляет собой D, I или S; X2 представляет собой V или I; X3 представляет собой S, G или R; X4 представляет собой T, I, N или R; X5 представляет собой A или S; X6 представляет собой V или L (SEQ ID NO:115); (e) HVR-L2, содержащую X1ASX2LX3S, где X1 представляет собой S, A или V; X2 представляет собой F, N или S; X3 представляет собой Y или A (SEQ ID NO:116); и (f) HVR-L3, содержащую QQX1X2X3X4X5X6T, где X1 представляет собой S или A; X2 представляет собой Y, K или N; X3 представляет собой T, S, Y, M, R или A; X4 представляет собой T, N, S или F; X5 представляет собой P или R; X6 представляет собой P, Y, S или L (SEQ ID NO:117).
В другом аспекте изобретение относится к антителу против Axl, где антитело содержит (a) HVR-H1, содержащую GFX1X2X3GX4WIH, где X1 представляет собой T или S, X2 представляет собой F или L, X3 представляет собой T или S, X4 представляет собой H, S или T (SEQ ID NO:118); (b) HVR-H2, содержащую GWIX1PYX2X3X4X5YYADSVKG, где X1 представляет собой S, N или A; X2 представляет собой G, R или S; X3 представляет собой G или R; X4 представляет собой S, Y или H; X5 представляет собой T, A или P (SEQ ID NO:119); (c) HVR-H3, содержащую AREYX1X2WX3X4SX5X6GYX7MDY, где X1 представляет собой S, N или P; X2 представляет собой G или D; X3 представляет собой G, R или A; X4 представляет собой G или S; X5 представляет собой S или Y; X6 представляет собой V или I; X7 представляет собой A или E (SEQ ID NO:120); и (d) HVR-L3, содержащую QQSYX1X2X3X4T, где X1 представляет собой T, S или Y; X2 представляет собой T, N, S или F; X3 представляет собой P или R; X4 представляет собой P, Y или S (SEQ ID NO:121).
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9, (b) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12, и (c) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8.
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:7, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8, и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9.
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12.
В другом аспекте изобретение относится к антителу против Axl, содержащему (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12.
В некоторых вариантах осуществления антитело дополнительно содержит последовательность каркасной области вариабельного домена тяжелой цепи или вариабельного домена легкой цепи, представленную на фигуре 3A-B, 4, 5 или 6.
В одном из аспектов изобретение относится к антителу против Axl, содержащему (a) последовательность VH, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:103; (b) последовательность VL, обладающую по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:104; или (c) последовательность VH как в (a) и последовательность VL как в (b). В некоторых вариантах осуществления антитело содержит последовательность VH SEQ ID NO:103. В некоторых вариантах осуществления антитело содержит последовательность VL SEQ ID NO:104. В некоторых вариантах осуществления антитело содержит последовательность VH SEQ ID NO:103 и последовательность VL SEQ ID NO:104.
В некоторых вариантах осуществления антитело представляет собой полноразмерное антитело IgG1.
Также изобретение относится к выделенной нуклеиновой кислоте, кодирующей любые из антител по изобретению.
Также изобретение относится к клеткам-хозяевам, содержащим нуклеиновые кислоты по изобретению.
Также изобретение относится к способам получения антитела, включающим культивирование клетки-хозяина по изобретению так, чтобы продуцировалось антитело. В некоторых вариантах осуществления способы дополнительно включают выделение антитела из клетки-хозяина.
Изобретение также относится к иммуноконъюгату, содержащему любое из антител против Axl по изобретению и цитотоксическое средство.
Также изобретение относится к фармацевтическому составу, содержащему любое из антител против Axl по изобретению и фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтический состав содержит дополнительное лекарственное средство. В некоторых вариантах осуществления дополнительное лекарственное средство выбрано из антагониста VEGF, антагониста EGFR и химиотерапевтического средства.
Также изобретение относится к любому из антител против Axl, описанных в настоящем описании, для применения в качестве лекарственного средства. В некоторых вариантах осуществления применение представляет собой применение для лечения злокачественной опухоли. В некоторых вариантах осуществления применение представляет собой применение для лечения иммунного расстройства, сердечно-сосудистого расстройства, тромбоза или диабета. В некоторых вариантах осуществления применение представляет собой применение для ингибирования пролиферации клеток. В некоторых вариантах осуществления применение представляет собой применение для стимуляции подавления Axl. В некоторых вариантах осуществления применение представляет собой применение для ингибирования ангиогенеза.
Также изобретение относится к любому из антител против Axl, описанных в настоящем описании, для изготовления лекарственного средства. В некоторых вариантах осуществления лекарственное средство предназначено для лечения злокачественной опухоли. В некоторых вариантах осуществления лекарственное средство предназначено для лечения иммунного расстройства, сердечно-сосудистого расстройства, тромбоза или диабета. В некоторых вариантах осуществления лекарственное средство предназначено для ингибирования пролиферации клеток, ингибирования ангиогенеза, стимуляции подавления Axl, ингибировании метастазов, ингибирования ангиогенеза.
Также изобретение относится к способам лечения индивидуума, имеющего злокачественную опухоль, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании. В некоторых вариантах осуществления способы, кроме того, включают введение индивидууму дополнительного лекарственного средства. В некоторых вариантах осуществления дополнительное лекарственное средство выбрано из группы, состоящей из антагониста VEGF, антагониста EGFR и химиотерапевтического средства.
Также изобретение относится к способам лечения индивидуума, имеющего иммунное нарушение, сердечно-сосудистое нарушение, тромбоз или диабет, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании.
Также изобретение относится к способам ингибирования ангиогенеза, ингибирования пролиферации клеток, стимуляции подавления рецептора Axl или ингибирования метастазирования у индивидуума, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании, для ингибирования ангиогенеза, ингибирования пролиферации клеток, стимуляции подавления рецептора Axl или ингибирования метастазирования.
Также изобретение относится к способам ингибирования конститутивной активации Axl, включающим введение индивидууму эффективного количества любого из антител против Axl, описанных в настоящем описании, для ингибирования конститутивного Axl.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, где у индивидуума развилась устойчивость к лечению антагонистом EGFR, включающим определение того, имеет ли индивидуум экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и введение этим индивидуумам, имеющим активирующую мутацию Axl или амплификацию гена Axl, антагониста EGFR и любого из антител против Axl, описанных в настоящем описании.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и (ii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум проявляет активирующую мутацию Axl или амплификацию гена Axl.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум устойчивость к ингибитору, (ii) исследование индивидуума для определения того, имеет ли индивидуум экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и (iii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум имеет активирующую мутацию Axl или амплификацию гена Axl.
В одном из аспектов изобретение относится к способам оценки антагониста EGFR, включающим: (i) мониторинг группы индивидуумов, подвергаемых лечению антагонистом EGFR, для идентификации индивидуумов, которые проявляют устойчивость к терапевтическому средству, (ii) исследование устойчивых индивидуумов для определения того, имеют ли индивидуумы экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, и (iii) модификацию режима лечения индивидуумов путем включения любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуумы имеют экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl.
В одном из аспектов изобретение относится к способам снижения фосфорилирования EGFR в злокачественной клетке, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка содержит активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения опосредуемой PI3K передачи сигнала в злокачественной клетке, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения опосредуемой EGFR передачи сигнала в злокачественной клетке, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим приведение в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам восстановления чувствительности злокачественной клетки к антагонисту EGFR, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим приведение в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения роста или пролиферации злокачественной клетки, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам усиления апоптоза злокачественной клетки, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет экспрессию Axl, активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам снижения устойчивости злокачественной клетки к антагонисту EGFR, где указанная злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR, и где указанная клетка имеет активирующую мутацию Axl или амплификацию гена Axl, включающим стадию приведения в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В одном из аспектов изобретение относится к способам лечения приобретенной устойчивости к антагонисту EGFR в злокачественной клетке, где указанная клетка имеет активирующую мутацию Axl или амплификацию гена Axl, включающим приведение в контакт клетки с любым из антител против Axl, описанных в настоящем описании, и антагонистом EGFR.
В некоторых вариантах осуществления злокачественная клетка представляет собой клетку любой запускаемой EGFR злокачественной опухоли. В некоторых вариантах осуществления, злокачественная клетка содержит активирующую мутацию EGFR. В некоторых вариантах осуществления злокачественная клетка имеет амплификацию гена EGFR. В некоторых вариантах осуществления амплификация гена EGFR является по меньшей мере 2-кратной. В некоторых вариантах осуществления амплификация Axl является по меньшей мере 2-кратной. В некоторых вариантах осуществления злокачественная клетка содержит мутацию гена EGFR, связанную с увеличенной устойчивостью к антагонисту EGFR. В некоторых вариантах осуществления мутация гена EGFR, связанная с увеличенной устойчивостью к антагонисту EGFR, представляет собой мутацию T790M в EGFR. В некоторых вариантах осуществления антагонист EGFR представляет собой низкомолекулярное терапевтическое средство, терапевтическое средство на основе нуклеиновой кислоты или белковое терапевтическое средство. В некоторых вариантах осуществления антагонист EGFR представляет собой антитело, антисмысловую молекулу или низкомолекулярный ингибитор киназ. В некоторых вариантах осуществления антагонист EGFR представляет собой ингибитор киназ EGFR, выбранный из группы, состоящей из: гефитиниба, эрлотиниба, цетуксимаба, пантинумумаба. В некоторых вариантах осуществления антагонист EGFR представляет собой антитело против EGFR, выбранное из группы, состоящей из: цетуксимаба, панитумумаба. В некоторых вариантах осуществления терапевтическое средство на основе нуклеиновой кислоты представляет собой молекулу миРНК (siRNA).
В одном из аспектов изобретение относится к способам идентификации индивидуума в качестве кандидата для лечения антагонистом EGFR и любым из антител против Axl, описанным в настоящем описании, где указанного индивидуума лечат антагонистом EGFR, и он страдает от злокачественной опухоли, которая имеет приобретенную устойчивость к указанному антагонисту EGFR, включающим детекцию экспрессии Axl, активирующей мутации Axl или амплификации гена Axl в злокачественной клетке от указанного индивидуума.
В одном из аспектов изобретение относится к способам идентификации индивидуума, которого лечат антагонистом EGFR и который имеет риск приобретения устойчивости к указанному антагонисту EGFR, включающим детекцию присутствия экспрессии Axl, активирующей мутации Axl или амплификации гена Axl в злокачественной клетки от указанного индивидуума, где присутствие указанной экспрессии Axl, активирующей мутации Axl или амплификации гена Axl указывает на риск приобретения устойчивости.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, который является устойчивым к лечению антагонистом EGFR, включающим введение индивидууму антагониста EGFR и любого из антител против Axl, описанных в настоящем описании.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, где индивидуум проявляет устойчивость к лечению антагонистом EGFR, включающим определение того, имеет ли индивидуум экспрессию Axl, такую как повышенные уровни и/или активность Axl, и введение индивидуумам, имеющим экспрессию Axl, такую как повышенная активность Axl, антагониста EGFR и любого другого из антител против Axl, описанных в настоящем описании.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с активирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум экспрессию Axl, такую как повышенные уровни и/или активность Axl, и (ii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум проявляет экспрессию Axl, такую как повышенные уровни и/или активность Axl.
В одном из аспектов изобретение относится к способам лечения индивидуума, страдающего злокачественной опухолью, связанной с актирующей мутацией EGFR или амплификацией гена EGFR, включающим: (i) мониторинг индивидуума, подвергаемого лечению антагонистом EGFR, для определения того, проявляет ли индивидуум устойчивость к ингибитору, (ii) исследование индивидуума для определения того, имеет ли индивидуум экспрессию Axl, такую как повышенные уровни и/или активность Axl, и (iii) модификацию режима лечения индивидуума путем включения в него любого из антител против Axl, описанных в настоящем описании, в дополнение к антагонисту EGFR, где индивидуум имеет повышенные уровни и/или активность Axl.
В другом аспекте изобретение относится к способу (i) восстановления чувствительности злокачественной клетки к антагонисту EGFR, (ii) снижения чувствительности злокачественной клетки к антагонисту EGFR, и/или (iii) лечения приобретенной устойчивости к антагонисту EGFR в злокачественной клетке путем приведения в контакт клетки с антагонистом EGFR и любым из антител против Axl, описанных в настоящем описании. В иллюстративных вариантах осуществления злокачественная клетка имеет приобретенную устойчивость к антагонисту EGFR и имеет повышенные уровни активности и/или экспрессии Axl, например, связанные с активирующей мутацией в гене Axl, амплификацией гена Axl, или опосредуемой Gas6 активацией Axl. Способы, описанные в настоящем описании, можно использовать для восстановления чувствительности, снижения устойчивости и/или лечения приобретенной устойчивости злокачественной клетки.
В другом аспекте изобретение относится к способу снижения роста и/или пролиферации злокачественной клетки или усиления апоптоза злокачественной клетки, путем приведения в контакт клетки с антагонистом EGFR и любым из антител против Axl, описанных в настоящем описании. В иллюстративных вариантах осуществления злокачественная клетка приобрела устойчивость к антагонисту EGFR и имеет повышенную активность и/или экспрессию Axl, например, связанную с активирующей мутацией в гене Axl, амплификацией гена Axl или опосредуемой Gas6 активацией Axl.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ.1A-F: Последовательности петли HVR тяжелой цепи и легкой цепи антител против FGFR3. На фигурах показаны последовательности HVR тяжелой цепи, H1, H2 и H3, и последовательности HVR легкой цепи, L1, L2 и L3. Аминокислотные положения пронумерованы согласно системе нумерации Kabat, как описано в настоящем описании.
ФИГ. 2: представлены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи антител против Axl.
ФИГ. 3A-B и 4: представлены акцепторные консенсусные каркасные последовательности человека для применения на практике настоящего изобретения со следующими идентификаторами последовательностей:
Консенсусные каркасные области вариабельной области тяжелой цепи (VH) (ФИГ. 3A-3B)
консенсусная каркасная область VH человека подгруппы I минус CDR по Kabat (SEQ ID NO:131-133 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы I минус удлиненные гипервариабельные области (SEQ ID NO:134-135, 133, 125, 134-136, 125, 134-135, 137 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы II минус CDR по Kabat (SEQ ID NO:138-140 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы II минус удлиненные гипервариабельные области (SEQ ID NO:141-142, 140, 125, 141-143, 125, 141-142, 144 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы II минус удлиненные консенсусная каркасная область VH человека подгруппы III минус CDR по Kabat (SEQ ID NO:145-147 и 125, соответственно, в порядке появления);
консенсусная каркасная область VH человека подгруппы III минус удлиненные гипервариабельные области (SEQ ID NO:122-123, 147, 125, 122-123, 148, 125 и 122-125, соответственно, в порядке появления);
акцепторная каркасная область VH человека минус CDR по Kabat (SEQ ID NO:149, 146, 150 и 125, соответственно, в порядке появления);
акцепторная каркасная область VH человека минус удлиненные гипервариабельные области (SEQ ID NO:122-123, 150, 125, 122-123, 151 и 125, соответственно, в порядке появления);
каркасная область акцептора 2 VH человека минус CDR по Kabat (SEQ ID NO:149, 146, 152 и 125, соответственно, в порядке появления);
каркасная область акцептора 2 VH человека минус удлиненные гипервариабельные области (SEQ ID NO:122-123, 152, 125, 122-123, 153, 125, 122-123, 154 и 125, соответственно, в порядке появления);
Консенсусные каркасные области вариабельной области легкой цепи (VL) (ФИГ. 4)
консенсусная каркасная область VL-каппа человека подгруппы I (SEQ ID NO:126-129, соответственно, в порядке появления);
консенсусная каркасная область VL-каппа человека подгруппы II (SEQ ID NO:155-157 и 129, соответственно, в порядке появления);
консенсусная каркасная область VL-каппа человека подгруппы III (SEQ ID NO:158-160 и 129, соответственно, в порядке появления);
консенсусная каркасная область VL-каппа человека подгруппы IV (SEQ ID NO:161-163 и 129, соответственно, в порядке появления);
ФИГ. 5: представлены последовательности каркасной области легкой (SEQ ID NO:126-127, 164 и 129, соответственно, в порядке появления) и тяжелой цепей (SEQ ID NO:122-123, 154 и 125, соответственно, в порядке появления) huMAb4D5-8. Номера надстрочными знаками/полужирным шрифтом указывают на положения аминокислот согласно Kabat.
ФИГ. 6: представлены модифицированные/вариантные последовательности каркасной области легкой (SEQ ID NO:126-129, соответственно, в порядке появления) и тяжелой цепей (SEQ ID NO:122-125, соответственно, в порядке появления) huMAb4D5-8. Номера надстрочными знаками/полужирным шрифтом указывают на положения аминокислот согласно Kabat.
ФИГ. 7A-H: Охарактеризация mAb против Axl YW327.6S2. A-B. Измерение аффинности YW327.6S2 с использованием BIAcore. Константы ассоциации (kon) и константы диссоциации (koff) вычисляли с использованием модели связывания Ленгмюра "один к одному". Равновесную константу диссоциации (Kd) получали в качестве отношения kon/koff. C. Перекрестная реактивность YW327.6S2. YW327.6S2 перекрестно реагирует с Axl мыши и яванского макака, но не с Tyro3 или Mer. На планшеты наносили антитело против Fc IgG человека, а затем инкубировали с Fc антитела против Axl, Mer, Tyro3 человека, Fc антитела против Axl мыши или яванского макака. После промывания добавляли изотипическое контрольное антитело или YW327.6S2, а затем конъюгированное с HRP антитело против IgG человека. D-E. YW327.6S2 блокирует связывание Gas6 с Axl. Фиг. 7D: ELISA. На планшеты наносили антитело против Fc IgG человека и инкубировали с Fc антитела против Axl человека. После промывания добавляли Gas6 с антителами или без них. Детекцию связывания Gas6 проводили с помощью биотинилированного антитела против Gas6 и конъюгата стрептавидин-HRP. Фиг. 7E: FACS. HUVEC собирали и обрабатывали YW327.6S2 или контрольным антителом, а затем инкубировали с Gas6 в течение 30 минут на льду. Детекцию связывания Gas6 с клеточной поверхностью проводили с помощью биотинилированного антитела против Gas6 и конъюгата стрептавидин-PE. F. YW327.6S2 подавляет экспрессию Axl. Клетки A549 инкубировали с 1 мкг/мл YW327.6S2 в течение указанного времени, и экспрессию Axl на клеточной поверхности определяли с помощью FACS (верхняя панель), и общую экспрессию белка определяли с помощью вестерн-блот анализа (нижняя панель). G. YW327.6S2 ингибирует индуцируемое Gas6 фосфорилирование и передачу сигнала Axl. Клетки H1299 культивировали в бессывороточной среде в течение ночи, предварительно инкубировали с YW327.6S2 в течение 4 ч, и обрабатывали Gas6 в течение 30 минут. Фосфорилированный Axl измеряли с помощью ELISA (верхняя панель), и фосфорилированный Akt измеряли с помощью вестерн-блот-анализа (нижняя панель). H. YW327.6S2 ингибирует рост клеток Baf3Axl. Клетки Baf3Axl выращивали в среде, содержавшей 200 нг/мл Gas6, и обрабатывали YW327.6S2 в указанных концентрациях в течение 72 ч. Жизнеспособность клеток измеряли с помощью анализа CellTiter Glo.
ФИГ. 8A-F: YW327.6S2 ослабляет рост ксенотрансплантата опухоли A549 и усиливает эффект средства против VEGF. A. Кривая роста опухоли. mAb вводили в/б в дозе 10 мг/кг (YW327.6S2 и изотипическое контрольное антитело) или 1 мг/кг (средство против VEGF) два раза в неделю, начиная, когда средний размер опухоли достигал 100 мм3 (0 сутки). Планки погрешности соответствуют стандартной ошибке среднего значения (n=10 для каждой группы в каждом эксперименте). p=0,0003 (YW327.6S2 против контроля), p=10-11 (YW327.6S2 против комбинации). B. Кривая Каплана-Мейера для различных групп обработки. Мышей удаляли из исследования, когда их размер опухоли достигал 800 мм3, и результаты животных, остававшихся в каждой группе (% оставшихся), наносили на график. C. 12A11 усиливает эффект средства против VEGF. 12A11 и средство против VEGF вводили в/б в дозе 30 мг/кг и 1 мг/кг, соответственно, два раза в неделю, начиная, когда средний размер опухоли достигал 100 мм3 (0 сутки). Планки погрешности соответствуют стандартной ошибке среднего значения (n=10 для каждой группы в каждом эксперименте). p=0,006 (12A11 против контроля); p=0,0001 (12A11 против комбинации). D. YW327.6S2 снижает экспрессию Axl. Мышам вводили YW327.6S2 в дозе 10 мг/кг и в указанные моменты времени вырезали опухоли. Клеточные лизаты из опухолей анализировали вестерн-блоттингом в отношении экспрессии Axl. E. YW327.6S2 индуцирует апоптоз. Опухоли, обрабатываемые контролем или YW327.6S2 в течение 2 недель, вырезали и для измерения апоптоза проводили CC3 IHC. F. YW327.6S2 усиливает эффект средства против VEGF в отношении снижения плотности внутриопухолевых сосудов. Опухоли из мышей, которым проводили введение, как указано выше в D, вырезали через 0 и 72 ч после дозирования и сосуды опухоли визуализировали окрашиванием иммуногистохимией с помощью MECA32 и количественно определяли в анализе изображения (выражали в квадратных микрометрах). Для каждой пары вычисляли t-критерий Стьюдента (p<0,05 для контроля против комбинации).
ФИГ. 9A-B: YW327.6S2 усиливает противоопухолевый эффект эрлотиниба и химиотерапии в модели с ксенотрансплантатом A549. A. YW327.6S2 усиливает эффект эрлотиниба. Введение антитела было таким же, как в случае фиг. 2. Эрлотиниб вводили путем перорального принудительного введения в количестве 100 мг/кг/сутки. n=10 для каждой группы. p=1,7×10-9 (YW327.6S2 против контроля), p=2,3×10-10 (YW327.6S2 против комбинации). B. YW327.6S2 усиливает химиотерапию. Введение антитела было таким же, как на фиг.2. Паклитаксел и карбоплатин вводили подкожно в дозе 6,25 мг/кг/сутки в течение 5 суток, и 100 мг/кг для однократной дозы в начале лечения (0 сутки), соответственно. n=10 для каждой группы. p=3×10-5 (YW327.6S2 против контроля), p=10-9 (химиотерапия против контроля), p=10-5 (комбинация против химиотерапии отдельно).
ФИГ. 10A-G: YW327.6S2 снижает рост ксенотрансплантата опухоли MDA-MB-231 путем модулирования стромальных функций опухоли. A и B. YW327.6S2, но не 12A11, снижает рост опухоли MDA-MB-231 и усиливает эффект средства против VEGF. mAb вводили в/б в дозе 20 мг/кг (YW327.6S2 и изотипическое контрольное антитело), 30 мг/кг (12A11) и 2 мг/кг (средство против VEGF), два раза в неделю, начиная, когда средний размер опухоли достигал 100 мм3 (0 сутки). Планки погрешностей соответствуют стандартной ошибке среднего значения (n=10 для каждой группы в каждом эксперименте). p=8,5×10-6 (YW327.6S2 против контроля), p=2,8×10-8 (YW327.6S2 против комбинации), p=0,05 (12A11 против контроля), p=0,145 (средство против VEGF против комбинации). C и D. YW327.6S2 подавляет экспрессию Axl. Мышам, имеющим ксенотрансплантаты опухолей MDA-MB231 (средний размер 500 мм3), вводили mAb в дозе 20 мг/кг, и опухоли вырезали в указанные моменты времени. Клеточные лизаты опухолей использовали в вестерн-блот-анализе для экспрессии Axl. E. YW327.6S2 снижает плотность связанных с опухолью сосудов. Опухоли мышей, которым проводили введение, как указано выше для C, вырезали через 0 ч и 1 неделю после дозирования и сосуды опухоли визуализировали путем окрашивания иммуногистохимией с помощью MECA32 и количественно определяли с помощью анализа изображения (выражали в качестве квадратных микрометров). Для каждой пары вычисляли t-критерий Стьюдента (p<0,05 для YW327.6S2 против контроля, средство против VEGF против контроля и средство против VEGF против комбинации). F. Axl в высокой степени экспрессируется в инфильтрирующих макрофагах первичного рака молочной железы человека. Иммуногистохимию использовали для исследования 79 первичных опухолей. 21% из этих опухолей экспрессируют высокие уровни Axl в инфильтрирующих макрофагах. Макрофаги идентифицировали путем окрашивания с помощью антитела против CD68, и экспрессию Axl на макрофагах определяли с помощью двойной IHC с антителами против Axl/CD68. Использовали серийные срезы. G. YW327.6S2 ингибирует секрецию воспалительных цитокинов/хемокинов из связанных с опухолью макрофагов. Мышам, которые имели ксенотрансплантаты опухолей MDA-MB231 (средний размер 500 мм3), вводили контрольное YW327.6S2 или 12A11 в дозе 20 мг/кг и опухоли вырезали через 1 неделю после введения. Связанные с опухолью макрофаги выделяли путем сортировки положительных по F4/80 клеток и культивировали в течение ночи. Цитокины и хемокины, секретированные в среду, измеряли с использованием набора для анализа цитокинов мыши Bio-Plex.
ФИГ. 11A-B: YW327.6S2 снижает метастазирование клеток рака молочной железы MDA-MB-231 в кость. A. Биолюминесцентная визуализация через 4 недели после инъекции в хвостовую вену опухолевых клеток. Мышам внутрибрюшинно инъецировали (в/б) 200 мкл D-люциферина (Invitrogen) в дозе 25 мг/мл в PBS и их подвергали анестезии в процессе визуализации с использованием изофлурана через носовой конус. Изображения биолюминесценции получали на Photon Imager (Biospace Lab, Париж, Франция), который имеет усиленную телекамеру на базе приборов с зарядовой связью. B. Окрашивание H & E срезов малой берцовой кости. Ткани собирали в конце экспериментов и фиксировали в 4% формальдегиде, нарезали на срезы и окрашивали с помощью H & E. Круг на верхней панели показывает на опухолевые клетки, инвазирующие кость. На нижней панели представлено детальное изображение неопластических клеток в костном мозге.
ФИГ. 12: Иллюстративная последовательность Axl человека RefSeq NM_001699. (SEQ ID NO:165).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
"Акцепторная каркасная область человека" для целей настоящего описания представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), происходящую из каркасной области иммуноглобулина человека или консенсусной каркасной области человека, как определено ниже. Акцепторная каркасная область человека, "происходящая из" каркасной области иммуноглобулина человека или консенсусной последовательности каркасной области человека, может содержать такую же, как и в них, аминокислотную последовательность, или она может содержать изменения аминокислотных последовательностей. В некоторых вариантах осуществления количество изменений аминокислот составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых вариантах осуществления последовательность акцепторной каркасной области VL человека идентична последовательности каркасной области VL иммуноглобулина человека или консенсусной последовательности каркасной области человека.
"Аффинность" относится к силе суммарных общих нековалентных взаимодействий между отдельным участком связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если нет иных указаний, как используют в рамках изобретения, "аффинность связывания" относится к присущей аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антитела и антигена). Аффинность молекулы X в отношении ее партнера Y обычно может быть представлена с помощью константы диссоциации (Kd). Аффинность можно измерять обычными способами, известными в данной области, включая способы, описанные в настоящем описании. Конкретные иллюстративные и типовые варианты осуществления для измерения аффинности связывания описаны ниже.
"Подвергнутое созреванию аффинности" антитело относится к антителу c одним или несколькими изменениями в одной или нескольких гипервариабельных областях (HVR), по сравнению с исходным антителом, которое не обладает такими изменениями, причем такие изменения приводят к увеличению аффинности антитела к антигену.
"Ангиогенное расстройство" относится к любому расстройству регуляции ангиогенеза, включая как не связанные с новообразованиями, так и неопластические состояния. Неопластические состояния включают, но не ограничиваются ими, состояния, описанные ниже (см., например, "злокачественная опухоль"). Не связанные с новообразованиями нарушения включают, но не ограничиваются ими, нежелательную или аберрантную гипертрофию, артрит, ревматоидный артрит (RA), псориаз, псориатические бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, диабетические и другие пролиферативные ретинопатии, включающие ретинопатию недоношенных, ретролентальную фиброплазию, неоваскулярную глаукому, связанную со старением дегенерацию желтого пятна, диабетический отек желтого пятна, неоваскуляризацию роговицы, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, ретинальную/хориоидальную неоваскуляризацию, неоваскуляризацию угла (покраснение радужки), неоваскулярное заболевание глаза, сосудистый рестеноз, артериовенозные мальформации (AVM), менингиому, гемангиому, ангиофиброму, гиперплазии щитовидной железы (включая болезнь Грэйвса), трансплантацию роговицы и других тканей, хроническое воспаление, воспаление легких, острое повреждение легких/ARDS, сепсис, первичную легочную гипертензию, злокачественный легочный выпот, отек головного мозга (например, связанный с острым инсультом/ закрытым повреждением/травмой черепа), воспаление синовиальной оболочки, образование паннуса при RA, миозит оссифицирующий, гипертрофическое образование кости, остеоартрит (OA), рефрактерный асцит, поликистозное заболевание яичника, эндометриоз, заболевания, связанные с жидкостью в третьем пространстве (панкреатит, синдром повышения давления в анатомических структурах, ожоги, заболевание кишечника), фиброму матки, преждевременные роды, хроническое воспаление, такое как IBD (болезнь Крона и язвенный колит), отторжение аллотрансплантата почки, воспалительное заболевание кишечника, нефротический синдром, нежелательный или аберрантный рост тканевой массы (незлокачественный), гемофилический гемартроз, гипертрофический рубец, ингибирование роста волос, синдром Ослера-Вебера, пиогенную гранулему, ретролентальные фиброплазии, склеродерму, трахому, спайки сосудов, синовит, дерматит, предэклампсию, асциты, перикардиальный выпот (такой как перикардиальный выпот, связанный с перикардитом) и плевральный выпот.
"Антиангиогенное средство" относится к соединению, которое блокирует развитие кровеносных сосудов или препятствует ему в некоторой степени. Антиангиогенное средство может представлять собой, например, низкомолекулярное соединение или антитело, которое связывается с фактором роста или рецептором фактора роста, вовлеченным в стимуляцию ангиогенеза. В одном из вариантов осуществления антиангиогенное средство представляет собой антитело, которое связывается с сосудисто-эндотелиальным фактором роста (VEGF), такое как бевацизумаб (AVASTIN®).
Термины "антитело против Axl" и "антитело, которое связывается с Axl", относятся к антителу, которое способно связывать Axl с достаточной аффинностью, чтобы антитело было пригодным в качестве диагностического и/или терапевтического средства при нацеливании на Axl. В одном из вариантов осуществления степень связывания антитела против Axl с неродственным не являющимся Axl белком составляет менее чем приблизительно 10% от связывания антитела с Axl при измерении, например, радиоиммунным анализом (RIA). В определенных вариантах осуществления антитело, которое связывается с Axl, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 M или менее, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). В определенных вариантах осуществления антитело против Axl связывается с эпитопом Axl, который является консервативным среди Axl из различных видов.
Термин "антитело" в рамках изобретения используют в наиболее широком значении, и он охватывает различные структуры антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют желаемую активность связывания антигена.
"Фрагмент антитела" относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается целое антитело. Примеры фрагментов антител включают фрагменты Fv-, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, одноцепочечные молекулы антител (например, scFv) и полиспецифические антитела, образованные фрагментами антител.
"Антитело, которое связывается с тем же эпитопом", что и эталонное антитело относится к антителу, которое блокирует связывание эталонного антитела с его антителом в конкурентном анализе на 50% или более, и, напротив, эталонное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 50% или более. Иллюстративный конкурентный анализ описан в настоящем описании.
Термин "Axl", как используют в рамках изобретения, относится к любому нативному Axl из любого являющегося источником позвоночного, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы), если нет иных указаний. Термин охватывает "полноразмерный" непроцессированный Axl, а также любую форму Axl, которая является результатом процессинга в клетке. Также термин охватывает встречающиеся в природе варианты Axl, например, варианты по сплайсингу или аллельные варианты. Аминокислотная последовательность иллюстративного Axl человека представлена на фиг.12.
"Активация Axl" относится к активации, или фосфорилированию, рецептора Axl. Как правило, активация Axl приводит к передаче сигнала (например, которая вызывается фосфорилированием остатков тирозина внутриклеточного киназного домена Axl в Axl или полипептиде-субстрате). Активация Axl может опосредоваться связыванием лиганда Axl (Gas6) с представляющим интерес рецептором Axl. Связывание Gas6 с Axl может активировать киназный домен Axl и, тем самым, приводит к фосфорилированию остатков тирозина в Axl и/или фосфорилированию остатков тирозина в дополнительном полипептиде(ах)-субстрате.
Термины "злокачественная опухоль" и "злокачественный" относятся физиологическому состоянию у млекопитающих или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом/пролиферацией клеток. Это определение включает доброкачественные и злокачественные опухоли. Примеры злокачественной опухоли включают, но не ограничиваются ими, карциному, лимфому (например, ходжкинскую и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, злокачественную опухоль брюшины, печеночноклеточный рак, желудочно-кишечный рак, рак поджелудочной железы, глиому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, рак толстой и прямой кишки, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, карциному печени, лейкоз и другие лимфопролиферативные нарушения, и различные типы рака головы и шеи.
Термины "клеточно-пролиферативное нарушение" и "пролиферативное нарушение" относятся к нарушениям, которые связаны с некоторой степенью аномальной пролиферации клеток. В одном из вариантов осуществления клеточно-пролиферативное нарушение представляет собой злокачественную опухоль.
"Химиотерапевтическое средство" представляет собой химическое соединение, полезное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (в том числе синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополетин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, иприт урацила; нитрозомочевина, такая как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как эндииновые антибиотики (например, калихеамицин, особенно, калихеамицин гамма1I и калихеамицин омегаI1 (см., например, Nicolaou et al., Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); CDP323, пероральный ингибитор альфа-4 интегрина, динемицин, в том числе динемицин A; эсперамицин; а также хромофор неокарциностатин и сходные хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, декторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (в том числе ADRIAMYCIN®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомную инъекцию доксорубицин-HCl (DOXIL®), липосомальный доксорубицин TLC D-99 (MYOCET®), пегилированный липосомальный доксорубицин (CAELYX®), и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как даноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостаноллон пропионат, мепитиостан, тестолактон; антиадреналовые средства, такие как аминоглутетимид, митотан, трилостан; освежающий раствор на основе фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2'-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин (ELDISINE®, FILLDESIN®), дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепу; таксоид, например, паклитаксел (TAXOL®), сконструированный на основе альбумина препарат из наночастиц паклитаксела (ABRAXANETM) и доцетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; средства на основе платины, такие как цисплатин, оксалиплатин (например, ELOXATIN®) и карбоплатин; средства на основе барвинка, которые предотвращают полимеризацию тубулина при формировании микротрубочек, в том числе винбластин (VELBAN®), винкристин (ONCOVIN®), виндезин (ELDISINE®, FILDESIN®) и винорелбин (NAVELBINE®); этопзид (VP-16); ифосфамид; митоксантрон; лейковорин; новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, в том числе бексаротен (TARGRETIN®); бифосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновая кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности, олигонуклеотиды, которые ингибируют экспрессию генов сигнальных путей, вовлеченных в абберантную клеточную пролиферацию, таких как, например, PKC-alpha, Raf, H-Ras, и ген рецептора эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN®, и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LAUROTECAN®); rmRH (например, ABARELIX®); BAY439006 (сорафениб; Bayer); SU-11248 (сунитиниб, SUTENT®, Pfizer); перифозин, ингибитор COX-2 (например, целекоксиб или эторикоксиб), ингибитор протеасом (например, PS341); бортезомиб (VELCADE®); CCI-779; типифарниб (R11577); орафениб, ABT510; ингибитор Bcl-2, такой как облимерсен натрия (GENASENSE®); пиксантрон; ингибиторы EGFR (см. определение ниже); ингибиторы тирозинкиназы (см. определение ниже); ингибиторы серин-треонинкиназы, такие как рапамицин (сиролимус, RAPAMUNE®); ингибиторы фарнезилтрансферазы, такие как лонафарниб (SCH 6636, SARASARTM); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также сочетания двух или более из указанных выше, такие как CHOP, сокращение для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращение для режима лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Химиотерапевтические средства, как определено в настоящем описании, включают "антигормональные средства" или "эндокринные лекарственные средства", которые действуют посредством регуляции, уменьшения, блокирования или ингибирования воздействия гормонов, которые могут стимулировать рост опухоли. Они сами по себе могут представлять собой гормоны, включая, но не ограничиваясь ими, антиэстрогены со смешанным профилем агонист/антагонист, в том числе, тамоксифен (NOLVADEX®), 4-гидрокситамоксифен, торемифен (FARESTON®), идоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен и селективные модуляторы рецепторов эстрогена (SERM), такие как SERM3; полные антиэстрогены без свойств агонистов, такие как фулвестрант (FASLODEX®) и EM800 (такие средства могут блокировать димеризацию рецепторов эстрогенов (ER), ингибировать связывание ДНК, повышать обновление ER, и/или снижать уровень ER); ингибиторы ароматазы, в том числе стероидные ингибиторы ароматазы, такие как форместан и экземестан (AROMASIN®) и нестероидные ингибиторы ароматазы, такие как анастразол (ARIMIDEX®), летрозол (FEMARA®) и аминоглутетимид, и другие ингибиторы ароматазы, в том числе ворозол (RIVISOR®), ацетат магестрола (MEGASE®), фадрозол, и 4(5)-имидазолы; агонисты лютеинизирующего рилизинг-гормона, в том числе леупролид (LUPRON® и ELIGARD®), гозерелин, бузерелин и триптерелин; половые стероидные гормоны, прогестины, такие как ацетат магестрола и ацетат медроксипрогестерона, эстрогены, такие как диэтилстилбестрол и премарин, и андрогены/ретиноиды, такие как флуоксиместерон, полностью трансретиноевая кислота и фенретинид; онапристон; анти-прогестероны; ингибиторы рецепторов эстрогена (ERD); антиандрогены, такие как флутамид, нилутамид и бикалутамид; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также комбинации двух или более из указанных выше.
Термин "химерное" антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, а остальная часть тяжелой и/или легкой цепи происходит из другого источника или вида.
"Класс" антитела относится к типу константного домена или константной области, которым обладает его тяжелая цепь. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно далее подразделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют отличающимся классам иммуноглобулинов, называются α, δ, ε, γ и µ, соответственно.
Термин "конститутивный", как используют в настоящем описании, например, в отношении активности рецепторной киназы, относится к постоянной активности передачи сигнала рецептором, которая не зависит от присутствия лиганда или других активирующих молекул. В зависимости от природы рецептора, вся активность может быть конститутивной или активность рецептора может, кроме того, увеличиваться путем связывания с другими молекулами (например, лигандами). Клеточные события, которые приводят к активации рецепторов, хорошо известны специалистам в данной области. Например, активация может включать олигомеризацию, например, димеризацию, тримеризацию и т.д., в рецепторные комплексы более высокого порядка. Комплексы могут содержать одну разновидность белка, т.е. они могут представлять собой гомомерный комплекс. Альтернативно, комплексы могут содержать по меньшей мере две различных разновидности белков, т.е. они могут представлять собой гетеромерный комплекс. Образование комплекса может быть вызвано, например, сверхэкспрессией нормальной и мутантных форм рецептора на поверхности клетки. Образование комплекса также может быть вызвано определенной мутацией или мутациями в рецепторе.
Термин "цитостатическое средство" относится к соединению или композиции, которые останавливают рост клетки либо in vitro, либо in vivo. Таким образом, цитостатическое средство может представлять собой средство, которое значительно снижает процент клеток в S-фазе. Следующие примеры цитостатических средств включают средства, которые блокируют прогрессирование клеточного цикла путем индукции остановки в G0/G1 или остановке в M-фазе. Гуманизированное антитело против Her2 трастузумаб (HERCEPTIN®) является примером цитостатического средства, которое индуцирует остановку в G0/G1. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Определенные средства, которые осуществляют остановку в G1, также эффективны для остановки в S-фазе, например, алкилирующие ДНК средства, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дальнейшая информация может быть найдена в Mendelsohn and Israel, eds., The Molecular Basis of Cancer, глава 1 под названием "Cell cycle regulation, oncogenes, and antineoplastic drugs", Murakami et al. (W.B. Saunders, Philadelphia, 1995), например, стр. 13. Таксаны (паклитаксел и доцетаксел) представляют собой лекарственные средства против злокачественной опухоли, полученные из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из тиса европейского, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел обеспечивают сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки, препятствуя деполимеризации, что приводит к ингибированию митоза в клетках.
Термин "цитотоксическое средство", как используют в настоящем описании, относится к веществу, которое ингибирует функционирование клеток, или препятствует ему, и/или вызывает разрушение клеток. Цитотоксические средства включают, но не ограничиваются ими, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические вещества или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие средства), ингибирующие рост средства, ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины из бактерий, грибов, растений или животных, или их фрагменты и/или варианты; и различные противоопухолевые средства или средства против злокачественной опухоли, описанные ниже.
"Эффекторные функции" относятся к видам биологической активности, присущим Fc-области антитела, которые варьируют, в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточно-опосредуемую цитотоксичность (ADCC); фагоцитоз; подавление рецепторов клеточной поверхности (например, B-клеточного рецептора); и активацию B-клеток.
"Эффективное количество" средства, например, фармацевтического состава, относится к количеству, эффективному, в необходимых дозировках и в течение необходимых периодов времени, для достижения терапевтического или профилактического результата.
Термин "Fc-область" в рамках изобретения используют для определения C-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Термин включает Fc-области с нативной последовательностью или вариантные последовательности Fc. В одном из вариантов осуществления Fc-область тяжелой цепи IgG человека обычно располагается от Cys226, или от Pro230, до C-конца тяжелой цепи. Однако C-концевой лизин (Lys447) Fc-области может присутствовать или может не присутствовать. Если нет иных указаний, нумерация аминокислотных остатков в Fc-области или константной области произведена согласно системе нумерации EU, также называемой индексом EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"Каркасная область" или "FR" относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, располагаются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "полноразмерное антитело", "целое антитело" и "интактное антитело" используют в настоящем документе взаимозаменяемо для обозначения антитела, имеющего структуру, по существу сходную со структурой нативного антитела, или имеющего тяжелые цепи, которые содержат Fc-область, как определено в настоящем описании.
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используют взаимозаменяемо, и они относятся к клеткам, в которые встроена экзогенная нуклеиновая кислота, включая потомков таких клеток. Клетки-хозяева включают "трансформантов" и "трансформированные клетки", которые включают первичную трансформированную клетку и ее потомство, без учета количества пассажей. Потомство может не быть полностью идентичным по содержанию нуклеиновых кислот исходной клетки, а может содержать мутации. В этот термин включено мутантное потомство, которое имеет ту же функцию или биологическую активность, по которой осуществляли скрининг или селекцию первоначально трансформированной клетки.
"Антитело человека" представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцированного человеком или клеткой человека, или происходящего из не являющегося человеком источника, в котором используется репертуар антител человека или другие кодирующие антитело человека последовательности. Это определение антитела человека конкретно не включает гуманизированное антитело, содержащее не являющиеся человеческими антигенсвязывающие остатки.
"Консенсусная каркасная область человека" представляет собой каркасную область, которая соответствует наиболее часто встречающимся аминокислотным остаткам при выборе каркасных последовательностей VL или VH иммуноглобулинов человека. Как правило, выбор последовательностей VL или VH иммуноглобулина человека осуществляют из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу согласно Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном из вариантов осуществления для VL подгруппа представляет собой подгруппу каппа I согласно Kabat et al., выше. В одном из вариантов осуществления для VH подгруппа представляет собой подгруппу III согласно Kabat et al., выше.
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из не являющихся человеческими HVR и аминокислотные остатки из FR человека. В определенных вариантах осуществления гуманизированное антитело содержит по существу все из по меньшей мере одного, и, как правило, двух вариабельных доменов, в которых все или по существу все из HVR (например, CDR) соответствуют HVR не являющегося человеческим антитела, и все или по существу все из FR соответствуют FR антитела человека. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящую из антитела человека. "Гуманизированная форма" антитела, например, не являющегося человеческим антитела, относится к антителу, которое было подвергнуто гуманизации.
Термин "гипервариабельная область" или "HVR", как используют в рамках изобретения, относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно определенные петли ("гипервариабельные петли"). Как правило, нативные антитела из четырех цепей содержат шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из "определяющих комплементарность областей" (CDR), причем последние из них обладают наиболее высокой вариабельностью последовательности и/или вовлечены в распознавание антигена. Иллюстративные гипервариабельные петли расположены в аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (H3). (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) встречаются в аминокислотных остатках 24-34 L1, 50-56 L2, 89-97 L3, 31-35B H1, 50-65 H2 и 95-102 H3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также содержат "определяющие специфичность остатки" или "SDR", которые представляют собой остатки, которые контактируют с антигеном. SDR содержатся в областях CDR, называемых укороченными CDR или a-CDR. Иллюстративные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) расположены в аминокислотных остатках 31-34 L1, 50-55 L2, 89-96 L3, 31-35B H1, 50-58 H2 и 95-102 H3. (См. Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008)). Если нет иных указаний, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) пронумерованы в настоящем описании согласно Kabat et al., выше.
"Иммуноконъюгат" представляет собой антитело, конъюгированное с одной или несколькими гетерологичной молекулой(ами), включая, но не ограничиваясь ими, цитотоксическое средство.
"Индивидуумом" или "субъектом" является млекопитающее. Млекопитающие включают, но не ограничиваются ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и не являющихся человеком приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В определенных вариантах осуществления индивидуумом или субъектом является человек.
"Ингибирование роста или пролиферации клеток" означает снижение роста или пролиферации клеток по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100%, и включает индукцию гибели клеток.
"Выделенное" антитело представляет собой антитело, которое отделено от компонента его природного окружения. В некоторых вариантах осуществления антитело является очищенным до чистоты более чем 95% или 99% при определении, например, с помощью электрофореза (например, SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез) или хроматографии (например, ионообменная или обращенно-фазовая ВЭЖХ). Для обзора способов оценки чистоты антитела см., например, Flatman et al., J. Chromatogr. B 848:79-87 (2007).
"Выделенная" нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая отделена от компонента его природного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которая обычно содержит эту молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует внехромосомно или в области хромосомы, которая отличается от ее природного хромосомного расположения.
"Выделенная нуклеиновая кислота, кодирующая антитело против Axl," относится к одной или нескольким молекулам нуклеиновых кислот, кодирующим тяжелую и легкую цепи антитела (или их фрагменты), включая такую молекулу(ы) нуклеиновой кислоты в едином векторе или в различных векторах, и такую молекулу(ы) нуклеиновой кислоты, присутствующую в одной или более областях в клетке-хозяине.
Термин "лиганд-независимый", как используют в рамках изобретения, в отношении, например, активности передачи сигнала рецептором, относится к активности передачи сигнала, которая не зависит от присутствия лиганда. Рецептор, имеющий лиганд-независимую киназную активность, не обязательно исключает связывание лиганда с этим рецептором для обеспечения дополнительной активации киназной активности.
Термин "моноклональное антитело", как используют в рамках изобретения, относится к антителу, полученному из совокупности по существу однородных антител, т.е. отдельные антитела, составляющие совокупность, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных антител-вариантов, например, содержащих встречающиеся в природе мутации или появляющиеся во время получения препарата моноклонального антитела, где такие варианты обычно присутствуют в небольших количествах. В противоположность препаратам поликлональных антител, которые как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, определение "моноклональный" указывает на тот признак антитела, что его получают из по существу гомогенной совокупности антител, и не подразумевает того, что антитело должно быть получено каким-либо конкретным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, можно получать множеством способов, включая, например, способ гибридом, способы рекомбинантных ДНК, технологии фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть локусов иммуноглобулинов человека; такие способы и другие иллюстративные способы получения моноклональных антител описаны в настоящем описании.
"Голое антитело" относится к антителу, которое не конъюгировано с гетерологичной группой (например, цитотоксической группой) или радиоактивной меткой. “Голое” антитело может присутствовать в фармацевтическом составе.
"Нативные антитела" относятся к встречающимся в природе молекулам иммуноглобулинов с отличающимися структурами. Например, нативные IgG-антитела представляют собой гетеротетрамерные гликопротеины массой приблизительно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидной связью. От N-конца к C-концу, каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следуют три константных домена (CH1, CH2 и CH3). Аналогично, от N-конца к C-концу, каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), исходя из аминокислотной последовательности ее константного домена.
Термин "вкладыш в упаковку" используют для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях, и/или предупреждения, касающиеся применения таких терапевтических продуктов.
"Процентную (%) идентичность аминокислотных последовательностей" в отношении последовательности эталонного полипептида определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в последовательности эталонного полипептида, после выравнивания последовательностей и внесения пропусков, если необходимо, для достижения максимальной процентной идентичности последовательностей, и не считая какие-либо консервативные замены частью идентичности последовательностей. Выравнивание для целей определения процентной идентичности аминокислотных последовательностей можно проводить различными способами, которые находятся в пределах специальных знаний, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для проведения выравнивания, включая любые алгоритмы, требуемые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Однако для целей, представленных в настоящем описании, значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была составлена в Genentech, Inc. и исходный текст был представлен с пользовательской документацией в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под U.S. Copyright Registration № TXU510087. Программа ALIGN-2 является общедоступной через Genentech, Inc., South San Francisco, California или ее можно составить из исходного текста. Программа ALIGN-2 должна быть составлена для применения на операционной системе UNIX, предпочтительно, цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
В случаях, когда ALIGN-2 используют для сравнений аминокислотных последовательностей, % идентичность аминокислотных последовательностей для данной аминокислотной последовательности A к, с или против данной аминокислотной последовательности B (что альтернативно может быть сформулировано как данная аминокислотная последовательность A, которая обладает определенной % идентичностью аминокислотной последовательности, содержит % идентичность аминокислотной последовательности, к, с или против данной аминокислотной последовательности B), или вычисляют следующим образом:
100 умножить на частное X/Y,
где X представляет собой число аминокислотных остатков, оцененных как идентичные совпадения программой для выравнивания последовательностей ALIGN-2 при выравнивании этой программой A и B, и где Y представляет собой общее количество аминокислотных остатков в B. Понятно, что когда длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичность аминокислотных последовательностей A к B не равна % идентичности аминокислотных последовательностей B к A. Если конкретно не указано иное, все величины % идентичности аминокислотных последовательностей, используемые в настоящем описании, получают, как описано в предыдущем абзаце с использованием компьютерной программы ALIGN-2.
Термин "фармацевтический состав" относится к препарату, который имеет такую форму, чтобы обеспечить эффективность биологической активности активного ингредиента, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для индивидуума, которому состав будут вводить.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтическом составе, отличному от активного ингредиента, который является нетоксичным для индивидуума. Фармацевтически приемлемый носитель включает, но не ограничивается ими, буфер, эксципиент, стабилизатор или консервант.
Как используют в рамках изобретения, термин "лечение" (и его грамматические варианты, такие как "лечить" или "проведение лечения") относится к клиническому вмешательству в попытках изменения естественного течения у индивидуума, подвергаемого лечению, и его можно проводить либо для профилактики, либо в процессе клинической патологии. Желаемые эффекты лечения включают, но не ограничиваются ими, предупреждение возникновения или рецидива заболевания, смягчение симптомов, уменьшение любых прямых или непрямых патологических следствий заболевания, предупреждение метастазов, снижение скорости прогрессирования заболевания, смягчение или облегчение болезненного состояния, и ремиссию или улучшение прогноза. В некоторых вариантах осуществления антитела по изобретению используют, чтобы отсрочить развитие заболевания или замедлить прогрессирование заболевания.
Термин "опухоль" относится к любому неопластическому росту и пролиферации клеток, как злокачественным, так и доброкачественным, и ко всем предзлокачественным и злокачественным клеткам и тканям. Термины "злокачественная опухоль", "злокачественный," "клеточно-пролиферативное нарушение", "пролиферативное нарушение" и "опухоль" не являются взаимоисключающими в настоящем описании.
Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, имеет сходные структуры, причем каждый домен содержит четыре консервативных каркасных области (FR) и три гипервариабельные области (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., стр. 91 (2007)). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена. Более того, антитела, которые связывают конкретный антиген, можно выделять с использованием VH- или VL-домена из антитела, которое связывает антиген, для скрининга библиотеки комплементарных VL- или VH-доменов, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Термин "вектор", как используют в рамках изобретения, относится к молекуле нуклеиновой кислоты, способной осуществлять размножение другой нуклеиновой кислоты, с которой она связана. Термин включает вектор в качестве самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он введен. Определенные векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называют в настоящем описании "экспрессирующими векторами".
"Консенсусная каркасная область VH подгруппы III" включает консенсусную последовательность, образованную аминокислотными последовательностями областей тяжелой цепи подгруппы III согласно Kabat et al. В одном из вариантов осуществления аминокислотная последовательность консенсусной каркасной области VH подгруппы III содержит по меньшей мере часть или всю из каждой из следующих последовательностей: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:122)-H1-WVRQAPGKGLEWV (SEQ ID NO:123)-H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC (SEQ ID NO:124)-H3-WGQGTLVTVSS (SEQ ID NO:125).
"Консенсусная каркасная область VL подгруппы I" включает консенсусную последовательность, образованную аминокислотными последовательностями вариабельных областей легкой цепи каппа подгруппы I согласно Kabat et al. В одном из вариантов осуществления аминокислотная последовательность консенсусной каркасной области VH подгруппы I содержит по меньшей мере часть или всю из каждой из следующих последовательностей: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:126)-L1-WYQQKPGKAPKLLIY (SEQ ID NO:127)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:128)-L3-FGQGTKVEIK (SEQ ID NO:129).
II. КОМПОЗИЦИИ И СПОСОБЫ
В одном из аспектов изобретение основано, частично, на идентификации различных связывающих Axl молекул (таких как антитела и их фрагменты). Axl представляет собой важную и преимущественную терапевтическую мишень, и изобретение относится к композициям и способам, основанным на связывании агентов с Axl. Связывающие Axl молекулы по изобретению, как описано в настоящем описании, обеспечивают важные терапевтические и диагностические средства для применения в нацеливании на патологические состояния, связанные с экспрессией и/или активностью каскадов передачи сигнала Axl. В определенных вариантах осуществления предусмотрены антитела, которые связываются с Axl. Антитела по изобретению подходят, например, для диагностики или лечения злокачественной опухоли.
A. Иллюстративные антитела против Axl
В одном из аспектов изобретение относится к выделенным антителам, которые связываются с Axl. В определенных вариантах осуществления антитело против Axl связывает Axl человека с аффинностью ≤550 пМ, и в некоторых вариантах осуществления оно связывает Axl мыши с аффинностью ≤1 нМ. В некоторых вариантах осуществления антитело против Axl связывает Axl человека и мыши.
В некоторых вариантах осуществления антитело против Axl индуцирует подавление экспрессии рецептора Axl на поверхности клетки (например, на поверхности опухолевой клетки). В некоторых вариантах осуществления экспрессия Axl на клеточной поверхности снижается до менее чем 80% от экспрессии Axl на клеточной поверхности в отсутствие обработки антителом против Axl. В некоторых вариантах осуществления экспрессия на клеточной поверхности снижается до менее чем 70%, менее чем 60%, менее чем 50% или менее чем 40% от экспрессии Axl на клеточной поверхности в отсутствие обработки антителом против Axl. В некоторых вариантах осуществления общая экспрессия Axl в клетках (например, в опухолевой клетке) снижается до менее чем 80% от всей экспрессии Axl в отсутствии обработки антителом против Axl. В некоторых вариантах осуществления общая экспрессия Axl снижается до менее чем 70%, менее чем 60%, менее чем 50% или менее чем 40% от общей экспрессии Axl в отсутствие обработки антителом против Axl. В некоторых вариантах осуществления подавление экспрессии Axl происходит быстро и длится в течение по меньшей мере 24 часов.
В некоторых вариантах осуществления антитело против Axl ингибирует конститутивную активность Axl.
В некоторых вариантах осуществления антитело против Axl не реагирует в значительной степени перекрестно с Sky или Mer. В некоторых вариантах осуществления антитело против Axl не связывается в значительной степени с Sky или Mer и связывает Axl человека и мыши.
В некоторых вариантах осуществления антитело против Axl ингибирует активность Axl.
В некоторых вариантах осуществления антитело против Axl стимулирует апоптоз клетки, например, опухолевой клетки, такой как клетка опухоли A549. В некоторых вариантах осуществления антитело против Axl ингибирует связывание лиганда Axl (например, Gas6) с Axl. В некоторых вариантах осуществления антитело против Axl ингибирует последующую передачу сигнала Axl. В некоторых вариантах осуществления антитело против Axl ингибирует зависимую от Gas-6 пролиферацию клеток. В некоторых вариантах осуществления антитело против Axl ингибирует экспрессию воспалительных цитокинов из связанных с опухолью макрофагов. В некоторых вариантах осуществления антитело против Axl ингибирует рост и/или метастазирование опухоли путем модулирования функции стромальной опухоли.
В некоторых вариантах осуществления антитело против Axl связывает полипептид, содержащий, по существу состоящий или состоящий из аминокислотной последовательности:
MAWRCPRMGRVPLAWCLALCGWACMAPRGTQAEESPFVGNPGNITGARGLTGTLRCQLQVQGEPPEVHWLRDGQILELADSTQTQVPLGEDEQDDWIVVSQLRITSLQLSDTGQYQCLVFLGHQTFVSQPGYVG (SEQ ID NO:111).
В некоторых вариантах осуществления антитело против Axl связывает полипептид, содержащий, по существу состоящий или состоящий из следующей аминокислотной последовательности:
ITVLPQQPRNLHLVSRQPTELEVAWTPGLSGIYPLTHCTLQAVLSDDGMGIQAGEPDPPEEPLTSQASVPPHQLRLGSLHPHTPYHIRVACTSSQGPSSWTHWL (SEQ ID NO:130).
В некоторых вариантах осуществления антитело связывает полипептид, содержащий, по существу состоящий или состоящий из аминокислот номер 1-122 аминокислотной последовательности зрелого Axl человека.
В некоторых вариантах осуществления антитело связывает полипептид, содержащий, по существу состоящий или состоящий из аминокислот номер 221-234 аминокислотной последовательности зрелого Axl человека.
В некоторых вариантах осуществления антитело против Axl связывает аминокислотную последовательность, имеющую по меньшей мере 70%, 80%, 90%, 95%, 98% идентичность или сходство последовательности с последовательностью
MAWRCPRMGRVPLAWCLALCGWACMAPRGTQAEESPFVGNPGNITGARGLTGTLRCQLQVQGEPPEVHWLRDGQILELADSTQTQVPLGEDEQDDWIVVSQLRITSLQLSDTGQYQCLVFLGHQTFVSQPGYVG (SEQ ID NO:111).
В некоторых вариантах осуществления антитело против Axl связывает аминокислотную последовательность, имеющую по меньшей мере 70%, 80%, 90%, 95%, 98% идентичность или сходство последовательности с последовательностью
ITVLPQQPRNLHLVSRQPTELEVAWTPGLSGIYPLTHCTLQAVLSDDGMGIQAGEPDPPEEPLTSQASVPPHQLRLGSLHPHTPYHIRVACTSSQGPSSWTHWL (SEQ ID NO:130).
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:1; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:2; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:3; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:4; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:5; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:6.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:7; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:8; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:9; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:10; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:11; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:12.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:13; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:14; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:15; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:16; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:17; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:18.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:19; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:20; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:21; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:22; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:23; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:24.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:25; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:26; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:27; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:28; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:29; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:30.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:31; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:32; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:33; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:34; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:35; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:36.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:37; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:38; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:39; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:40; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:41; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:42.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:43; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:44; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:45; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:46; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:47; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:48.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:49; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:50; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:51; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:52; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:53; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:54.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:55; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:56; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:57; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:58; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:59; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:60.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:61; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:62; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:63; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:64; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:65; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:66.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:67; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:68; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:69; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:70; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:71; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:72.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:73; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:74; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:75; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:76; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:77; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:78.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:79; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:80; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:81; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:82; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:83; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:84.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:85; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:86; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:87; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:88; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:89; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:90.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:91; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:92; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:93; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:94; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:95; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:96.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:97; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:98; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:99; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:100; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:101; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:102.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:1; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:2; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:3.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:7; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:8; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:9.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:13; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:14; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:15.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:19; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:20; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:21.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:25; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:26; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:27.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:31; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:32; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:33.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:37; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:38; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:39.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:43; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:44; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:45.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:49; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:50; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:51.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:55; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:56; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:57.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:61; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:62; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:63.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:67; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:68; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:69.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:73; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:74; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:75.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:79; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:80; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:81.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:85; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:86; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:87.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:91; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:92; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:93.
В одном из аспектов изобретение относится к антителу против Axl, содержащему по меньшей мере одну, две или все три последовательности HVR VH, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:97; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:98; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:99.
В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:3. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:15. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:21. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:27. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:33. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:39. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:45. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:51. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:57. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:63. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:69. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:75. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:81. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:87. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:93. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:99.
В другом варианте осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:3 и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:6. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:15, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:18. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:21, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:24. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:27, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:30. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:33, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:36. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:39, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:42. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:45, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:48. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:51, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:54. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:57, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:60. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:63, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:66. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:69, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:72. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:75, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:78. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:81, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:84. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:87, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:90. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:93, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:96. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:99, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:102.
В следующем варианте осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:3, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:6, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:2. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:15, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:18, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:14. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:21, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:24, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:20. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:27, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:30, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:26. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:33, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:36, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:32. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:39, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:42, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:38. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:45, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:48, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:44. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:51, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:54 и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:50. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:57, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:60 и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:56. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:63, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:66 и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:62. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:69, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:72, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:68. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:75, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:78 и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:74. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:81, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:84, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:80. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:87, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:90, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:86. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:93, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:96, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:92. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:99, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:102, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:98.
В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:1; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:2; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:3. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:7; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:13; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:14; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:15. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:19; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:20; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:21. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:25; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:26; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:27. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:31; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:32; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:33. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:37; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:38; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:39. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:43; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:44; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:45. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:49; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:50; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:51. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:55; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:56; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:57. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:61; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:62; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:63. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:67; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:68; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:69. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:73; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:74; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:75. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:79; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:80; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:81. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:85; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:86; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:87. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:91; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:92; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:93. В следующем варианте осуществления антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:97; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:98; и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:99.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:4; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:5; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:6.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:12.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:16; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:17; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:18.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:22; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:23; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:24.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:28; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:29; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:30.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:34; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:35; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:36.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:40; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:41; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:42.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:46; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:47; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:48.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:52; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:53; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:54.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:58; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:59; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:60.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:64; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:65; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:66.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:70; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:71; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:72.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:76; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:77; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:78.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:82; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:83; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:84.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:88; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:89; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:90.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:94; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:95; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:96.
В другом аспекте изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:100; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:101; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:102.
В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:4; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:5; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:6. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:16; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:17; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:18. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:22; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:23; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:24. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:28; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:29; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:30. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:34; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:35; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:36. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:40; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:41; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:42. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:46; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:47; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:48. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:52; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:53; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:54. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:58; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:59; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:60. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:64; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:65; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:66. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:70; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:71; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:72. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:76; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:77; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:78. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:82; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:83; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:84. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:88; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:89; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:90. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:94; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:95; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:96. В одном из вариантов осуществления антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:100; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:101; и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:102.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:1, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:2, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:3; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:4, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:5, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:6.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:7, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:8, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:9; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:10, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:11, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:12.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:13, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:14, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:15; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:16, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:17, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:18.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:19, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:20, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:21; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:22, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:23, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:24.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:25, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:26, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:27; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:28, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:29, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:30.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:31, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:32, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:33; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:34, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:35, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:36.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:37, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:38, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:39; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:40, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:41, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:42.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:43, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:44, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:45; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:46, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:47, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:48.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:49, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:50, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:51; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:52, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:53, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:54.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:55, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:56, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:57; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:58, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:59, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:60.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:61, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:62, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:63; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:64, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:65, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:66.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:67, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:68, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:69; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:70, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:71, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:72.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:73, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:74, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:75; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:76, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:77, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:78.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:79, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:80, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:81; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:82, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:83, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:84.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:85, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:86, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:87; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:88, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:89, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:90.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:91, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:92, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:93; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:94, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:95, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:96.
В другом аспекте антитело по изобретению содержит (a) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:97, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:98, и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO:99; и (b) VL-домен, содержащий по меньшей мере одну, по меньшей мере две, или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:100, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:101, и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:102.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:1; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:2; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:3; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:4; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:5; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:6.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:7; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:8; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:10; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:11; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:12.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:13; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:14; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:15; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:16; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:17; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:18.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:19; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:20; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:21; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:22; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:23; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:24.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:25; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:26; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:27; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:28; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:29; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:30.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:31; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:32; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:33; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:34; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:35; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:36.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:37; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:38; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:39; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:40; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:41; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:42.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:43; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:44; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:45; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:46; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:47; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:48.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:49; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:50; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:51; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:52; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:53; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:54.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:55; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:56; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:57; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:58; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:59; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:60.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:61; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:62; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:63; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:64; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:65; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:66.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:67; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:68; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:69; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:70; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:71; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:72.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:73; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:74; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:75; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:76; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:77; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:78.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:79; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:80; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:81; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:82; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:83; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:84.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:85; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:86; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:87; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:88; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:89; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:90.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:91; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:92; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:93; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:94; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:95; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:96.
В другом аспекте изобретение относится к антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:97; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:98; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:99; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:100; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:101; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:102.
В определенных вариантах осуществления любая одна или несколько аминокислот антитела против Axl, как описано выше, заменены или отсутствуют в следующих положениях HVR:
- в HVR-H1 (SEQ ID NO:7): положения 2, 3, 4, 5, 6, 7, 8, 9 и 10;
- в HVR-H2 (SEQ ID NO:8): положения 1, 2, 4, 6, 7, 8, 9 и 10;
- в HVR-H3 (SEQ ID NO:9): положения 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15;
- в HVR-L1 (SEQ ID NO:10): положения 5, 6, 7, 8, 9 и 10;
- в HVR-L2 (SEQ ID NO:11): положения 1, 4 и 6;
- в HVR-L3 (SEQ ID NO:12): положения 3, 4, 5, 6, 7 и 8.
В определенных вариантах осуществления замены представляют собой консервативные замены, как описано в настоящем описании. В определенных вариантах осуществления любая одна или несколько из следующих замен могут быть внесены в любой комбинации:
- в HVR-H1 (SEQ ID NO:7): S28T; L29F или V: S30T или R; G31S; S32H, T или I; W33G; I34L;
- в HVR-H2 (SEQ ID NO:8): G49A; W50G; N52S, A или P; Y53A или V; R54G или S; G55S или R; Y56S или H; A57T или P;
- в HVR-H3 (SEQ ID NO:9): E95W; Y96R; S97N или P; G98D или L; W99S; G100R, A, или S; G100aS; S100b отсутствует; S100cY или отсутствует; V100dI или отсутствует; G100e или отсутствует; Y100f или отсутствует, A100gE или отсутствует;
- в HVR-L1 (SEQ ID NO:10): D28I или S; V29I; S30G или R; T31I, N или R; A32S; V33L;
- в HVR-L2 (SEQ ID NO:11):S50A или V; F53N или S; Y55A;
- в HVR-L3 (SEQ ID NO:12): S91A; Y92K или N; T93S, Y, M, R или A; T94N, F или S; P95R; P96Y, S или L.
В определенных вариантах осуществления может быть внесена любая одна или несколько из следующих замен в любой комбинации:
- в HVR-H1 (SEQ ID NO:7): S28T; L29F или V: S30T; G31S; S32H, T или I;
- в HVR-H2 (SEQ ID NO:8): N52S или A; R54G или S; G55R; Y56S или H; A57T или P;
- в HVR-H3 (SEQ ID NO:9): S97N или P; G98D; G100S;
- в HVR-L3 (SEQ ID NO:12): T93S или Y; T94N, F или S.
Все возможные комбинации описанных выше замен охватываются консенсусными последовательностями:
- HVR-H1 (SEQ ID NO:112): GFX1X2X3X4X5X6X7H, где X1 представляет собой S или T; X2 представляет собой L, F или V; X3 представляет собой S, T или R; X4 представляет собой G или S; X5 представляет собой S, H, T или I; X6 представляет собой W или G; X7 представляет собой I или L;
- в HVR-H2 (SEQ ID NO:113): X1X2IX3PX4X5X6X7X8YYADSVKG, где X1 представляет собой G или A; X2 представляет собой W или G; X3 представляет собой N, S, A или P; X4 представляет собой Y, A или V; X5 представляет собой R, G или S; X6 представляет собой G, R или S; X7 представляет собой Y, S, H или Y; X8 представляет собой A, T или P; и/или (SEQ ID NO:166): X1X2IX3PX4X5X6X7X8X9X10YYADSVKG, где X1 представляет собой G или A; X2 представляет собой W или G; X3 представляет собой N, S, A или P; X4 представляет собой Y, A или V; X5 представляет собой R, G или S; X6 представляет собой G, R или S; X7 представляет собой Y, S, H или Y; X8 представляет собой A, T или P; X9 представляет собой любую аминокислоту или отсутствует; X10 представляет собой любую аминокислоту или отсутствует;
- в HVR-H3 (SEQ ID NO:114): ARX1X2X3X4X5X6X7X8X9X10X11X12X13MDY, где X1 представляет собой E или W; X2 представляет собой Y или R; X3 представляет собой S, N или P; X4 представляет собой G, D или L; X5 представляет собой W или S; X6 представляет собой G, R, A или S; X7 представляет собой G или S; X8 представляет собой S или отсутствует; X9 представляет собой S, Y или отсутствует; X10 представляет собой V, I или отсутствует; X11 представляет собой G или отсутствует; X12 представляет собой Y или отсутствует; X13 представляет собой A, E или отсутствует;
- в HVR-L1 (SEQ ID NO:115): RASQX1X2X3X4X5X6A, где X1 представляет собой D, I или S; X2 представляет собой V или I; X3 представляет собой S, G или R; X4 представляет собой T, I, N или R; X5 представляет собой A или S; X6 представляет собой V или L;
- в HVR-L2 (SEQ ID NO:116): X1ASX2LX3S, где X1 представляет собой S, A или V; X2 представляет собой F, N или S; X3 представляет собой Y или A;
- в HVR-L3 (SEQ ID NO:117): QQX1X2X3X4X5X6T, где X1 представляет собой S или A; X2 представляет собой Y, K или N; X3 представляет собой T, S, Y, M, R или A; X4 представляет собой T, N, S или F; X5 представляет собой P или R; X6 представляет собой P, Y, S или L.
В некоторых вариантах осуществления предусмотрены следующие консенсусные последовательности:
- в HVR-H1 (SEQ ID NO:118): GFX1X2X3GX4WIH, где X1 представляет собой T или S, X2 представляет собой F или L, X3 представляет собой T или S, X4 представляет собой H, S или T;
- в HVR-H2 (SEQ ID NO:119): GWIX1PYX2X3X4X5YYADSVKG, где X1 представляет собой S, N или A; X2 представляет собой G, R или S; X3 представляет собой G или R; X4 представляет собой S, Y или H; X5 представляет собой T, A или P;
- в HVR-H3 (SEQ ID NO:120): AREYX1X2WX3X4SX5X6GYX7MDY, где X1 представляет собой S, N или P; X2 представляет собой G или D; X3 представляет собой G, R или A; X4 представляет собой G или S; X5 представляет собой S или Y; X6 представляет собой V или I; X7 представляет собой A или E;
- в HVR-L3 (SEQ ID NO:121): QQSYX1X2X3X4T, где X1 представляет собой T, S или Y; X2 представляет собой T, N, S или F; X3 представляет собой P или R; X4 представляет собой P, Y или S.
В другом аспекте антитело против Axl содержит последовательность вариабельного домена (VH) тяжелой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:103, 105, 107 или 109. В определенных вариантах осуществления последовательность VH, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело против Axl, содержащее эту последовательность, сохраняет способность связываться с Axl. В определенных вариантах осуществления всего от 1 до 10 аминокислот заменено, встроено и/или удалено в SEQ ID NO:103, 105, 107 или 109. В определенных вариантах осуществления замены, вставки или делеции находятся в областях вне HVR (т.е. в FR). Необязательно, антитело против Axl содержит последовательность VH SEQ ID NO:103, 105, 107 или 109, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления VH содержит одну, две или или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:1, 7, 13, 19, 25, 31, 37, 43, 49, 55, 61, 67, 73, 79, 85, 91 или 97, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:2, 8, 14, 20, 26, 32, 38, 44, 50, 56, 62, 68, 74, 80, 86, 92 или 98, и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:3, 9, 15, 21, 27, 33, 39, 45, 51, 57, 63, 69, 75, 81, 87, 93 или 99. В конкретном варианте осуществления VH содержит одну, две или три HVR, выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:7, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:8, и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:9.
Другой аспект относится к антителу против Axl, где антитело содержит вариабельный домен легкой цепи (VL), обладающий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:104, 106, 108 или 110. В определенных вариантах осуществления последовательность VL, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело против Axl, содержащее эту последовательность, сохраняет способность связываться с PRO. В определенных вариантах осуществления всего от 1 до 10 аминокислот заменено, встроено и/или удалено в SEQ ID NO:104, 106, 108 или 110. В определенных вариантах осуществления замены, вставки или делеции находятся в областях вне HVR (т.е. в FR). Необязательно, антитело против Axl содержит последовательность VL SEQ ID NO:104, 106, 108 или 110, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления VL содержит одну, две или три HVR, выбранных из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:4, 10, 16, 22, 28, 34, 40, 46, 52, 58, 64, 70, 76, 82, 88, 94 или 100; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:5, 11, 17, 23, 29, 35, 41, 47, 53, 59, 65, 77, 83, 89, 95 или 101; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:6, 12, 18, 24, 30, 36, 42, 48, 54, 60, 66, 72, 78, 84, 90, 96 или 102. В конкретном варианте осуществления VL содержит одну, две или три HVR, выбранных из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:10; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:11; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:12.
Другой аспект относится к антителу против Axl, где антитело содержит VH согласно любому из вариантов осуществления, представленных выше. В некоторых вариантах осуществления антитело дополнительно содержит VL. В одном из вариантов осуществления антитело содержит последовательность VH SEQ ID NO:103. В одном из вариантов осуществления антитело содержит последовательность VH SEQ ID NO:105. В одном из вариантов осуществления антитело содержит последовательность VH SEQ ID NO:107. В одном из вариантов осуществления антитело содержит последовательность VH SEQ ID NO:109.
Другой аспект относится к антителу против Axl, где антитело содержит VL согласно любому из вариантов осуществления, представленных выше. В некоторых вариантах осуществления антитело дополнительно содержит VH. В одном из вариантов осуществления антитело содержит последовательность VL SEQ ID NO:104. В одном из вариантов осуществления антитело содержит последовательность VL SEQ ID NO:106. В одном из вариантов осуществления антитело содержит последовательность VL SEQ ID NO:108. В одном из вариантов осуществления антитело содержит последовательность VL SEQ ID NO:110.
Другой аспект относится к антителу против Axl, где антитело содержит VH согласно любому из вариантов осуществления, представленных выше, и VL согласно любому из вариантов осуществления, представленных выше. В одном из вариантов осуществления антитело содержит последовательности VH и VL SEQ ID NO:103 и SEQ ID NO:104, соответственно, включая посттрансляционные модификации этих последовательностей. В одном из вариантов осуществления антитело содержит последовательности VH и VL SEQ ID NO:105 и SEQ ID NO:106, соответственно, включая посттрансляционные модификации этих последовательностей. В одном из вариантов осуществления антитело содержит последовательности VH и VL SEQ ID NO:107 и SEQ ID NO:108, соответственно, включая посттрансляционные модификации этих последовательностей. В одном из вариантов осуществления антитело содержит последовательности VH и VL SEQ ID NO:109 и SEQ ID NO:110, соответственно, включая посттрансляционные модификации этих последовательностей.
Антитела по изобретению могут содержать любую подходящую последовательность каркасной области вариабельного домена, при условии, что активность связывания с Axl по существу сохраняется. Например, в некоторых вариантах осуществления антитела по изобретению содержат последовательность консенсусной каркасной области тяжелой цепи подгруппы III человека. В одном из вариантов осуществления этих антител, консенсусная последовательность каркасной области содержит замену в положении 71, 73 и/или 78. В некоторых вариантах осуществления этих антител положение 71 представляет собой A, 73 представляет собой T и/или 78 представляет собой A. В одном из вариантов осуществления эти антитела содержат последовательности каркасной области вариабельного домена тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, США) (также упоминаемое в патентах США № 6407213 и 5821337, и Lee et al., J. Mol. Biol. (2004), 340(5): 1073-1093). В одном из вариантов осуществления эти антитела дополнительно содержат консенсусную последовательность каркасной области легкой цепи κI человека. В конкретном варианте осуществления эти антитела содержат последовательности HVR легкой цепи huMAb4D5-8, как описано в патентах США № 6407213 и 5821337. В одном из вариантов осуществления эти антитела содержат последовательности вариабельного домена легкой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, США) (также упоминаемое в патентах США № 6407213 и 5821337, и Lee et al., J. Mol. Biol. (2004), 340(5): 1073-1093). В одном из вариантов осуществления антитело против Axl содержит HVR согласно любому из описанных выше вариантов осуществления, и дополнительно содержит VH и/или VL, содержащую последовательность FR1, FR2, FR3 или FR4, представленную на фигурах 2, 3A-B, 4, 5 или 6.
В следующем аспекте изобретение относится к антителу, которое связывается с тем же эпитопом, что и антитело против Axl, представленное в настоящем описании. Например, в определенных вариантах осуществления предусмотрено антитело, которое связывается с тем же эпитопом, что и антитело против Axl, содержащее последовательность VH SEQ ID NO:103 и последовательность VL SEQ ID NO:104. В определенных вариантах осуществления предусмотрено антитело, которое связывается с тем же эпитопом, что и антитело против Axl, содержащее последовательность VH SEQ ID NO:107 и последовательность VL SEQ ID NO:108. В определенных вариантах осуществления предусмотрено антитело, которое связывается с эпитопом во фрагменте Axl, состоящем из аминокислот
MAWRCPRMGRVPLAWCLALCGWACMAPRGTQAEESPFVGNPGNITGARGLTGTLRCQLQVQGEPPEVHWLRDGQILELADSTQTQVPLGEDEQDDWIVVSQLRITSLQLSDTGQYQCLVFLGHQTFVSQPGYVG (SEQ ID NO:111). В определенных вариантах осуществления предусмотрено антитело, которое связывается с эпитопом во фрагменте Axl, состоящем из аминокислот
ITVLPQQPRNLHLVSRQPTELEVAWTPGLSGIYPLTHCTLQAVLSDDGMGIQAGEPDPPEEPLTSQASVPPHQLRLGSLHPHTPYHIRVACTSSQGPSSWTHWL (SEQ ID NO:130).
В следующем аспекте изобретение относится к антителу, которое конкурирует с антителом против Axl, содержащим последовательность VH SEQ ID NO:103 и последовательность VL SEQ ID NO:104 за связывание с Axl человека. В определенных вариантах осуществления предусмотрено антитело, которое конкурирует с антителом против Axl, содержащим последовательность VH SEQ ID NO:107 и последовательность VL SEQ ID NO:108 за связывание с Axl человека.
В следующем аспекте изобретения антитело против Axl согласно любому из описанных выше вариантов осуществления представляет собой моноклональное антитело, включая химерное, гуманизированное антитело или антитело человека. В одном из вариантов осуществления антитело против Axl представляет собой фрагмент антитела, например, Fv, Fab, Fab', scFv, диатело или F(ab')2-фрагмент. В другом варианте осуществления антитело представляет собой полноразмерное антитело, например, целое IgG-антитело или другой класс или изотип антитела, как определено в настоящем описании.
В следующем аспекте антитело против Axl согласно любому из описанных выше вариантов осуществления может включать любой из признаков, отдельно или в комбинации, как описано в разделах 1-7 ниже.
1. Аффинность антител
В определенных вариантах осуществления антитело, представленное в настоящем описании, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 M или менее, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M).
В одном из вариантов осуществления Kd измеряют с помощью анализа связывания меченного радиоактивной меткой антигена (RIA), проводимого с Fab-версией представляющего интерес антитела и его антигеном, как описано в следующем анализе. Аффинность связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab минимальной концентрацией (125I)-меченного антигена в присутствии серии титров немеченного антигена, с последующей фиксацией связанного антигена на планшете, покрытом антителом против Fab (см., например, Chen, et al., J. Mol. Biol 293:865-881 (1999)). Чтобы установить условия для анализа, на многолуночные планшеты MICROTITER® (Thermo Scientific) наносят в течение ночи 5 мкг/мл фиксирующего антитела против Fab (Cappel Labs) в 50 мМ растворе карбоната натрия (pH 9,6), а затем блокируют с использованием 2% (масс./об.) бычьего сывороточного альбумина в PBS в течение от двух до пяти часов при комнатной температуре (приблизительно 23°C). В неадсорбирующем планшете (Nunc #269620), 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела против VEGF, Fab-12, Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем представляющий интерес Fab инкубируют в течение ночи; однако, инкубацию можно продолжать в течение более длительного периода (например, 65 часов), чтобы убедиться в том, что равновесие достигнуто. После этого смеси переносят на фиксирующий планшет для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют, и планшет промывают восемь раз 0,1% полисорбатом 20 (TWEEN-20®) в PBS. После того, как планшеты высыхают, добавляют 150 мкл/лунка сцинтиллятора (MICROSCINT-20TM; Packard), и проводят подсчет в планшетах с использованием счетчика гамма-импульсов TOPCOUNTTM (Packard) в течение десяти минут. Концентрации каждого из Fab, которые обеспечивают связывание, меньшее или равное 20% от максимального связывания, выбирают для использования в конкурентных анализах связывания.
В соответствии с другим вариантом осуществления Kd измеряют с использованием анализа способом поверхностного плазмонного резонанса с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с чипами CM5 с иммобилизованным на них антигеном при ~10 единицах ответа (RU). В кратком изложении, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIACORE Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/минута для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена инъецируют 1 M этаноламин для блокирования не вступивших в реакцию групп. Для определения показателей кинетики инжектируют двукратные серийные разведения связывающей молекулы (от 0,78 нМ до 500 нМ) в PBS с 0,05% поверхностно-активным веществом полисорбатом 20 (TWEEN-20TM) (PBST) при 25°C со скоростью потока приблизительно 25 мкл/мин. Константу ассоциации (kon) и константу диссоциации (koff) вычисляют с использованием простой модели связывания Ленгмюра "один к одному" (BIACORE Evaluation Software версии 3.2) посредством одновременного приведения в соответствие сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют как соотношение koff/kon. См., например, Chen, Y., et al., J. Mol. Biol. 293:865-881 (1999). Если константа ассоциации антитела превышает 106 M-1 с-1 в анализе способом поверхностного плазмонного резонанса, указанным выше, тогда константу ассоциации можно определять с использованием способа тушения флуоресценции, в котором измеряют повышение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) при 25°С 20 нМ антитела (форма Fab) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена при измерении в спектрофотометре, таком как спектрофотометр с останавливаемой струей (Aviv Instruments) или спектрофотометр SLM-AMINCOTM серии 8000 (Thermo Spectronic) с перемешиваемой кюветой.
2. Фрагменты антител
В определенных вариантах осуществления антитело, представленное в настоящем описании, представляет собой фрагмент антитела. Фрагменты антител включают, но не ограничиваются ими, Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv фрагменты, и другие фрагменты, описанные ниже. Для обзора определенных фрагментов антител см. Hudson et al. Nat. Med. 9: 129-134 (2003). Для обзора фрагментов scFv см., например, Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); см. также WO 93/16185; и патенты США № 5571894 и 5587458. Для обсуждения Fab- и F(ab')2-фрагментов, содержащих связывающие рецептор спасения остатки эпитопа и имеющих увеличенное время полужизни in vivo, см. патент США № 5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или биспецифическими. См., например, EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9: 129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9: 129-134 (2003).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть или весь вариабельный домен легкой цепи антитела или его часть. В определенных вариантах осуществления однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 B1).
Фрагменты антител можно получать различными способами, включая, но не ограничиваясь ими, протеолитическое расщепление интактного антитела, а также продуцирование рекомбинантными клетками-хозяевами (например, E. coli или фагом), как описано в настоящем описании.
3. Химерные и гуманизированные антитела
В определенных вариантах осуществления антитело, представленное в настоящем описании, представляет собой химерное антитело. Определенные химерные антитела описаны, например, в патенте США № 4816567; и Morrison et al., PNAS. USA, 81:6851-6855 (1984)). В одном примере химерное антитело содержит вариабельную область не человека (например, вариабельную область, происходящую из мыши, крысы, хомяка, кролика или не являющегося человеком примата, такого как обезьяна) и константную область человека. В следующем примере химерное антитело представляет собой антитело с "переключенным классом", в котором класс или подкласс изменен относительно класса или подкласса исходного антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В определенных вариантах осуществления химерное антитело представляет собой гуманизированное антитело. Как правило, не являющееся человеческим антитело гуманизируют для снижения иммуногенности у человека при сохранении специфичности и аффинности исходного антитела не человека. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их части) происходят из антитела не человека и FR (или их части) происходят из последовательностей антител человека. Гуманизированное антитело необязательно также содержит по меньшей мере часть константной области человека. В некоторых вариантах осуществления некоторые остатки FR в гуманизированном антителе заменены соответствующими остатками из антитела не человека (например, антитела, из которого происходят остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения рассмотрены, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и, кроме того, описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., PNAS USA 86:10029-10033 (1989); патентах США № 5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36:25-34 (2005) (в которой описана пересадка SDR (a-CDR)); Padlan, Mol. Immunol. 28:489-498 (1991) (в которой описано "изменение поверхности"); Dall'Acqua et al., Methods 36:43-60 (2005) (в которой описана "шаффлинг FR"; и Osbourn et al., Methods 36:61-68 (2005) и Klimka et al. Br. J. Cancer, 83:252-260 (2000) (в которой описан подход "направленной селекции" для шаффлинга FR).
Каркасные области человека, которые можно использовать для гуманизации, включают, но не ограничиваются ими: каркасные области, выбранные с использованием способа "наилучшего соответствия" (см., например, Sims et al. J. Immunol. 151: 2296 (1993)); каркасные области, происходящие из консенсусной последовательности антител человека конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter et al. PNAS USA, 89:4285 (1992); и Presta et al. J. Immunol, 151:2623 (1993)); зрелые (подвергнутые соматической мутации) каркасные области человека или эмбриональные каркасные области человека (см., например, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные области, полученные скринингом библиотек FR (см., например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
4. Антитела человека
В определенных вариантах осуществления антитело, представленное в настоящем описании, представляет собой антитело человека. Антитела человека можно получать с использованием различных способов, известных в данной области. Антитела человека описаны, главным образом, в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Антитела человека можно получать путем введения иммуногена трансгенному животному, модифицированному для продуцирования интактных антител человека или интактных антител с вариабельными областями человека в ответ на нагрузку антигеном. Такие животные, как правило, содержат все локусы иммуноглобулинов человека, которые заменяют эндогенные локусы иммуноглобулинов или которые присутствуют внехромосомно или встроены случайным образом в хромосомы животных, или содержат их часть. У таких трансгенных мышей эндогенные локусы иммуноглобулинов, как правило, инактивированы. Для обзора способов получения антител человека из трансгенных животных см. Lonberg, Nat. Biotech. 23: 1117-1125 (2005). См. также, например, патенты США № 6075181 и 6150584, в которых описана технология XENOMOUSETM; патент США № 5770429, в котором описана технология HUMAB®; патент США № 7041870, в котором описана технология K-M MOUSE® и публикацию патентной заявки США № US 2007/0061900, в которой описана технология VELOCIMOUSE®). Вариабельные области человека из целых антител, полученных с помощью таких животных, можно далее модифицировать, например, путем комбинирования с отличающейся константной областью человека.
Антитела человека также можно получать способами на основе гибридом. Описаны клеточные линии миеломы человека и гетеромиеломы мыши-человека для продуцирования моноклональных антител человека. (См., например, Kozbor J. Immunol, 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147:86 (1991)). Антитела человека, полученные технологией гибридом B-клеток также описаны в Li et. al, PNAS. USA, 103, 3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США № 7189826 (в котором описана продукция моноклональных IgM-антител человека из гибридомных клеточных линий) и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (в которой описаны гибридомы человека-человека). Технология гибридом человека (технология триом) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
Антитела человека также можно получать путем выделения последовательностей вариабельного домена клона Fv, отобранных из библиотек фагового дисплея человека. Затем такие последовательности вариабельного домена можно комбинировать с желаемым константным доменом человека. Способы селекции антител человека из библиотек антител описаны ниже.
5. Происходящие из библиотек антитела
Антитела по изобретению можно выделять скринингом комбинаторных библиотек в отношении антител с желаемой активностью или видами активности. Например, в данной области известно множество способов получения библиотек фагового дисплея и скрининга таких библиотек в отношении антител, обладающих желаемыми характеристиками связывания. Такие способы рассмотрены, например, в Hoogenboom et al., Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) и, кроме того, они описаны, например, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, PNAS. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
В определенных способах фагового дисплея репертуары генов VH и VL по отдельности клонируют полимеразной цепной реакцией (ПЦР) и случайным образом рекомбинируют в фаговых библиотеках, которые затем подвергают скринингу в отношении связывающего антиген фага, как описано в Winter et al., Ann. Rev. Immunol, 12: 433-455 (1994). Фаг, как правило, экспонирует фрагменты антител либо в качестве одноцепочечных Fv-фрагментов (scFv), либо в качестве Fab-фрагментов. Библиотеки из иммунизированных источников обеспечивают высокоаффинные антитела к иммуногену без необходимости в конструировании гибридом. Альтернативно, можно клонировать наивный репертуар (например, из человека) для обеспечения единого источника антител к широкому диапазону несобственных, а также собственных антигенов, без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки также можно получать синтетически клонированием нереаранжированных сегментов V-генов из стволовых клеток и с использованием праймеров для ПЦР, содержащих случайную последовательность, чтобы кодировались высоко вариабельные области CDR3 и чтобы проводить реаранжировку in vitro, как описано Hoogenboom and Winter, J. Mol. Biol, 227: 381-388 (1992). Патентные публикации, описывающие фаговые библиотеки антител человека, включают, например: патент США № 5750373, и публикации патентов США № 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек антител человека, в рамках изобретения считаются антителами человека или фрагментами антител человека.
6. Полиспецифические антитела
В определенных вариантах осуществления антитело, представленное в настоящем описании, представляет собой полиспецифическое антитело, например, биспецифическое антитело. Полиспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания в отношении по меньшей мере двух различных участков. В определенных вариантах осуществления одна из специфичностей связывания направлена на Axl, а другая из них направлена на любой другой антиген. В определенных вариантах осуществления биспецифические антитела могут связываться с двумя различными эпитопами Axl. Биспецифические антитела также можно использовать для локализации цитотоксических средств в клетках, которые экспрессируют Axl. Биспецифические антитела можно получать в качестве полноразмерных антител или фрагментов антител.
Способы получения полиспецифических антител включают, но не ограничиваются ими, рекомбинантную коэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, обладающих различной специфичностью (см. Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829, и Traunecker et al., EMBO J. 10: 3655 (1991)), и конструирование "выступа-в-углублении" (см., например, патент США № 5731168). Полиспецифические антитела также можно получать созданием эффектов электростатической регуляции для получения Fc-гетеродимерных молекул антител (WO 2009/089004A1); сшиванием двух или более антител или фрагментов (см., например, патент США № 4676980, и Brennan et al., Science, 229: 81 (1985)); с использованием лейциновых молний для получения биспецифических антител (см., например, Kostelny et al., J. Immunol, 148(5):1547-1553 (1992)); с использованием технологии "диател" для получения биспецифических фрагментов антител (см., например, Hollinger et al., PNAS USA, 90:6444-6448 (1993)); и с использованием димеров одноцепочечных Fv (sFv) (см., например, Gruber et al., J. Immunol, 152:5368 (1994)); и получением триспецифических антител, как описано, например, в Tutt et al. J. Immunol. 147: 60 (1991).
Также включены сконструированные антитела с тремя или более функциональными участками связывания антигенов, включая "антитела-осьминоги" (см., например, US 2006/0025576 A1).
Антитело или фрагмент, представленные в настоящем описании, также включает "FAb двойного действия" или "DAF", содержащий антигенсвязывающий центр, который связывается с Axl, а также с другим отличающимся антигеном (см., например, US 2008/0069820).
7. Варианты антител
В определенных вариантах осуществления предусмотрены варианты по аминокислотной последовательности антител, представленных в настоящем описании. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты по аминокислотной последовательности антитела можно получать путем внесения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или посредством пептидного синтеза. Такие модификации включают, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечного продукта можно проводить любую комбинацию из делеции, инсерции и замены, при условии что конечная конструкция обладает желаемыми характеристиками, например, связыванием антигена.
a) Варианты с заменой, инсерцией и делецией
В определенных вариантах осуществления предусмотрены варианты антител, имеющие одну или несколько аминокислотных замен. Представляющие интерес участки для мутагенеза с заменами включают HVR и FR. Консервативные замены представлены в таблице 1 под заголовком "консервативные замены". Более существенные изменения представлены в таблице 1 под заголовком "иллюстративные замены", и как дополнительно описано ниже в отношении классов боковых цепей аминокислот. Аминокислотные замены можно вносить в представляющее интерес антитело и продукты подвергать скринингу в отношении желаемой активности, например, сохраненного/улучшенного связывания антигена, сниженной иммуногенности или улучшенной ADCC или CDC.
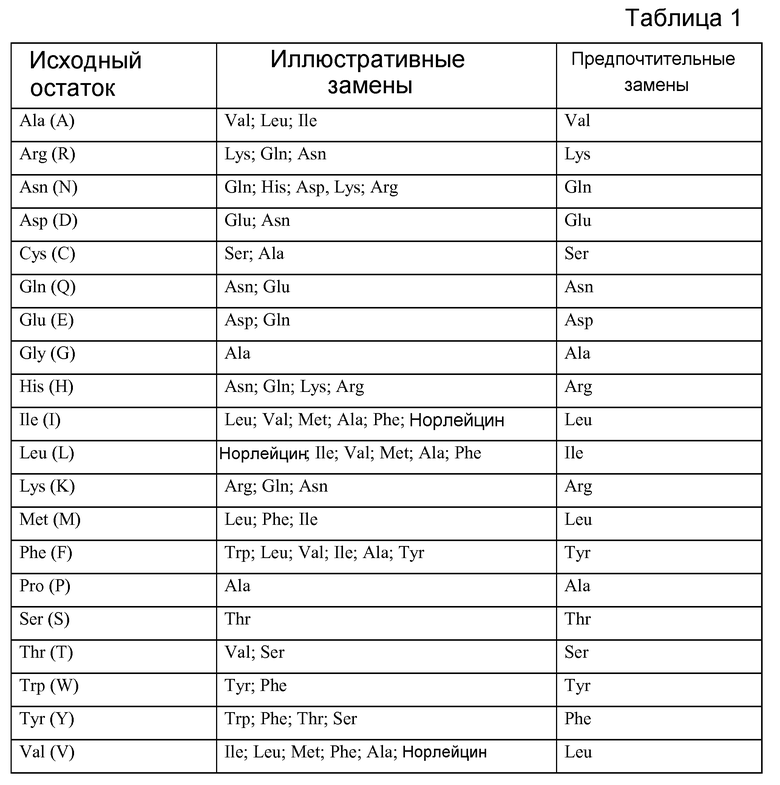
Аминокислоты можно сгруппировать согласно общим свойствам боковых цепей:
(1) гидрофобные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены вовлекают замену члена одного из этих классов членом из другого класса.
Один из типов варианта с заменой вовлекает замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный вариант(ы), выбранный для последующего исследования, имеет модификации (например, улучшения) определенных биологических свойств (например, увеличенную аффинность, сниженную иммуногенность) относительно исходного антитела и/или имеет по существу сохраненные некоторые биологические свойства исходного антитела. Иллюстративный вариант с заменой представляет собой подвергнутое созреванию аффинности антитело, которое можно удобным образом получать, например, с использованием способов созревания аффинности на основе фагового дисплея, таких как способы, описанные в настоящем описании. В кратком изложении, один или несколько остатков HVR подвергают мутации, и варианты антител экспонируются на фаге, и их подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания).
Изменения (например, замены) можно вносить в HVR, например, для повышения аффинности антитела. Такие изменения можно вносить в "горячие точки" HVR, т.е., в остатки, кодируемые кодонами, которые подвергаются мутации с высокой частотой в процессе соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или SDR (a-CDR) и полученный вариант VH или VL тестируют в отношении аффинности связывания. Созревание аффинности посредством конструирования и повторяющейся селекции из вторичных библиотек описано, например, в Hoogenboom et al., Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001)). В некоторых вариантах осуществления созревания аффинности, в вариабельные гены, выбранные для созревания, вносят разнообразие любым из множества способов (например, ПЦР с пониженной точностью, перетасовка цепей или олигонуклеотид-направленный мутагенез). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации каких-либо вариантов антител с желаемой аффинностью. Другой способ внесения разнообразия вовлекает направленные на HVR подходы, в которых рандомизируют несколько остатков HVR (например, 4-6 остатков за один раз). Остатки HVR, вовлеченные в связывание антигена, можно специфично идентифицировать, например, с использованием сканирующего аланином мутагенеза или модулирования. В частности, часто нацеливаются на CDR-H3 и CDR-L3.
В определенных вариантах осуществления замены, вставки или делеции могут встречаться в одной или нескольких HVR при условии, что такие изменения по существу не снижают способность антитела связывать антиген. Например, в HVR можно вносить консервативные изменения (например, консервативные замены, как представлено в настоящем описании), которые по существу не снижают аффинность связывания. Такие изменения могут быть вне "горячих точек" HVR или SDR. В определенных вариантах осуществления вариантов последовательностей VH и VL, представленных выше, каждая HVR является либо неизмененной, либо содержит не более одной, двух или трех аминокислотных замен.
Подходящий способ для идентификации остатков или областей антитела, на которые может быть нацелен мутагенез, называют "сканирующим аланином мутагенезом", как описано Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе выявляют остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют на нейтральную или отрицательно заряженную аминокислоту (наиболее предпочтительно, аланин или полиаланин) для определения, нарушается ли взаимодействие аминокислот с антигеном. Следующие замены можно вносить в положения аминокислот, демонстрирующие функциональную чувствительность к первоначальным заменам. Альтернативно или дополнительно, можно решать кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. На такие контактные остатки и соседние остатки можно осуществлять нацеливание или устранять в качестве кандидатов для замены. Варианты можно подвергать скринингу для определения того, обладают ли они желаемыми свойствами.
Вставки в аминокислотную последовательность включают N- и/или C-концевое слияние длиной в диапазоне от одного остатка до полипептидов, содержащих сто и более остатков, а также вставки внутрь последовательности одного или нескольких аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие варианты молекулы антитела со вставками включают слияние N- или C-конца антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни антитела.
b) Варианты по гликозилированию
В определенных вариантах осуществления антитело, представленное в настоящем описании, изменяют для увеличения или снижения степени, с которой антитело гликозилировано. Добавление или удаление участков гликозилирования в антителе можно удобным образом проводить путем изменения аминокислотной последовательности, так чтобы внести или удалить один или несколько участков гликозилирования.
Когда антитело содержит Fc-область, можно изменять углевод, связанный с ним. Нативные антитела, продуцируемые клетками млекопитающих, как правило, содержат разветвленный биантеннарный олигосахарид, который, как правило, связан N-связью с Asn297 CH2-домена Fc-области. См., например, Wright et al. (1997) TIBTECH 15:26-32. Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в "стебле" биантеннарной олигосахаридной структуры. В некоторых вариантах осуществления модификации олигосахарида в антителе по изобретению можно проводить для получения вариантов антител с определенными улучшенными свойствами.
В одном из вариантов осуществления предусмотрены варианты антител, имеющие углеводную структуру, которая лишена фукозы, присоединенной (непосредственно или косвенно) к Fc-области. Например, количество фукозы в таком антителе может составлять 1%-80%, 1%-65%, 5%-65% или 20%-40%. Количество фукозы определяют путем вычисления среднего количества фукозы в цепи сахара у Asn297, относительно суммы всех гликозильных структур, присоединенных к Asn297 (например, комплексные, гибридные структуры и структуры с высоким содержанием маннозы) при измерении масс-спектрометрей MALDI-TOF, например, как описано в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному приблизительно в положении 297 в Fc-области (нумерация Eu остатков Fc-области); однако Asn297 также может быть расположен приблизительно ±3 аминокислоты выше или ниже положения 297, т.е. между положениями 294 и 300, вследствие небольшого варьирования последовательностей антител. Такие варианты по фукозилированию могут иметь улучшенную функцию ADCC. См., например, публикации патентов США № US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к "дефукозилированным" или "дефицитным по фукозе" вариантам антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 CHO, дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); патентная заявка США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., особенно в примере 11), и клеточные линии с нокаутом, такие как клетки CHO с нокаутом генов альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO2003/085107).
Кроме того, предусмотрены варианты антител с олигосахаридами из двух частей, например, в которых биантеннарный олигосахарид, связанный с Fc-областью антитела, разделен пополам посредством GlcNAc. Такие варианты антител могут иметь сниженное фукозилирование и/или улучшенную функцию ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США № 6602684 (Umana et al.); и US 2005/0123546 (Umana et al.). Также предусмотрены варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Такие варианты антител могут иметь улучшенную функцию CDC. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
с) Варианты Fc-области
В определенных вариантах осуществления одна или несколько аминокислотных модификаций могут быть внесены в Fc-область антитела, представленного в настоящем описании, тем самым получая вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-области IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или нескольких положениях аминокислот.
В определенных вариантах осуществления изобретение относится к варианту антитела, который обладает некоторыми, но не всеми эффекторными функциями, которые делают его желаемым кандидатом для многих применений, в которых важно время полужизни антитела in vivo, но, тем не менее, определенные эффекторные функции (такие как комплементзависимая цитотоксичность и ADCC) являются необязательными или вредоносными. Для подтверждения снижения/устранения видов активности CDC и/или ADCC можно проводить анализы цитотоксичности in vitro и/или in vivo. Например, анализы связывания Fc-рецепторов (FcR) можно проводить, чтобы убедиться, что антитело не связывает FcγR (таким образом, вероятно не имеет активности ADCC), однако сохраняет способность связывать FcRn. Главные опосредующие ADCC клетки, NK-клетки, экспрессируют только Fc(RIII, в то время как моноциты экспрессируют Fc(RI, Fc(RII и Fc(RIII. Экспрессия FcR на кроветворных клетках обобщенно представлена в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры анализов in vitro для оценки активности ADCC представляющей интерес молекулы описаны в патенте США № 5500362 (см., например, Hellstrom, L, et al. Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I., et al., Proc. Natl Acad. Sci. USA 82:1499-1502 (1985); 5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166:1351-1361 (1987)). Альтернативно, можно использовать нерадиоактивные способы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTITM для проточной цитометрии (CellTechnology, Inc. Mountain View, CA); и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно или дополнительно, активность ADCC представляющей интерес молекулы можно оценивать in vivo, например, в модели на животных, такой как модель, описанная в Clynes et al. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Также можно проводить анализы связывания C1q для подтверждения того, что антитело неспособно связывать C1q и, таким образом, лишено активности CDC. См. например, ELISA, связывающая C1q и C3c в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно проводить анализ CDC (см., например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003); и Cragg, M.S. и M.J. Glennie, Blood 103:2738-2743 (2004)). Также можно проводить определение связывания FcRn и выведения/времени полужизни in vivo с использованием способов, известных в данной области (см., например, Petkova, S.B. et al., Int'l. Immunol. 18(12):1759-1769 (2006)).
Антитела со сниженной эффекторной функцией включают антитела с заменой одного или нескольких из остатков Fc-области 238, 265, 269, 270, 297, 327 и 329 (патент США № 6737056). Такие Fc-мутанты включают Fc-мутанты с заменами в двух или более из аминокислотных положений 265, 269, 270, 297 и 327, включая так называемый Fc-мутант "DANA" с заменой остатков 265 и 297 на аланин (патент США № 7332581).
Описаны определенные варианты антител с увеличенным или сниженным связыванием с FcR. (см., например, патент США № 6737056; WO 2004/056312, и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001)).
В определенных вариантах осуществления вариант антитела содержит Fc-область с одной или несколькими аминокислотными заменами, которые улучшают ADCC, например, с заменами в положениях 298, 333 и/или 334 Fc-области (нумерация остатков EU).
В некоторых вариантах осуществления в Fc-область вносят изменения, которые приводят к измененному (т.е., либо увеличенному, либо сниженному) связыванию C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в патенте США № 6194551, WO 99/51642, и Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US2005/0014934A1 (Hinton et al.). Эти антитела содержат Fc-область с одной или несколькими заменами в ней, которые улучшают связывание Fc-области с FcRn. Такие варианты Fc включают варианты с заменами в одном или нескольких остатках Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 Fc-области (патент США № 7371826).
Также см. Duncan & Winter, Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821; и WO 94/29351, касающиеся других примеров вариантов Fc-областей.
d). Варианты антител со встроенным цистеином
В определенных вариантах осуществления может быть желательным создавать антитела со встроенным цистеином, например, "thioMAb", в которых один или несколько остатков антитела заменены остатками цистеина. В конкретных вариантах осуществления замененные остатки находятся в доступных областях антитела. Путем замены этих остатков цистеина, в доступные участки антитела помещают реакционноспособные тиольные группы и их можно использовать для конъюгации антитела с другими группами, такими как группы лекарственных средств или группы линкер-лекарственное средство, с получением иммуноконъюгата, как описано в настоящее описании далее. В определенных вариантах осуществления, любые один или несколько из следующих остатков могут быть заменены цистеином: V205 (нумерация по Kabat) легкой цепи; A118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) Fc-области тяжелой цепи. Антитела со встроенным цистеином можно получать как описано, например, в патенте США № 7521541.
e) Производные антител
В некоторых вариантах осуществления антитело, представленное в настоящем описании, можно далее модифицировать, чтобы оно содержало дополнительные небелковые группы, которые известны в данной области и легко доступны. Группы, пригодные для получения производного антитела, представляют собой растворимые в воде полимеры. Неограничивающие примеры растворимых в воде полимеров включают, но не ограничиваются ими, полиэтиленгликоль (PEG), сополимеры этиленгликоль/пропиленгликоль, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо случайные сополимеры), и декстран или поли(н-винил пирролидон)полиэтиленгликоль, пропропиленгликоль гомополимеры, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропиональдегид полиэтиленгликоля может иметь преимущества при изготовлении вследствие его стабильности в воде. Полимер может иметь любую молекулярную массу, и он может быть разветвленным или неразветвленным. Количество полимеров, связанных с антителом, может варьировать, и если связано более одного полимера, они могут представлять собой одинаковые или разные молекулы. Как правило, количество и/или тип полимеров, используемых для получения производного, можно определять, исходя из соображений, включающих, но не ограничивающихся ими, конкретные свойства или функции антитела, подлежащего усовершенствованию, и того, будет ли производное антитела использовано в терапии в определенных условиях и т.д.
В другом варианте осуществления предусмотрены конъюгаты антитела и небелковой группы, которые можно селективно нагревать под действием радиации. В одном из вариантов осуществления небелковая группа представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Радиация может быть любой длины волны и включает, но не ограничивается ими, длины волн, которые не являются вредоносными для обычных клеток, но которые нагревают небелковую группу до температуры, при которой клетки, находящиеся вблизи структуры антитело-небелковая группа, уничтожаются.
B. Рекомбинантные способы и композиции
Антитела можно получать с использованием рекомбинантных способов и композиций, например, как описано в патенте США № 4816567. В одном из вариантов осуществления предусмотрена выделенная нуклеиновая кислота, кодирующая антитело против Axl, описанное в настоящем описании. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В следующем варианте осуществления предусмотрен один или несколько векторов (например, экспрессирующих векторов), содержащих такую нуклеиновую кислоту. В следующем варианте осуществления предусмотрена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком варианте осуществления клетка-хозяин содержит (например, трансформирована ими): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном из вариантов осуществления клетка-хозяин является эукариотической клеткой, например, клеткой яичника китайского хомячка (CHO) или лимфоидной клеткой (например, клеткой Y0, NS0, Sp20). В одном из вариантов осуществления предусмотрен способ получения антитела против Axl, где способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как описано выше, в условиях, подходящих для экспрессии антитела, и необязательно выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантного продуцирования антитела против Axl нуклеиновую кислоту, кодирующую антитело, например, как описано выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделять и секвенировать с использованием общепринятых методик (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии кодирующих антитело векторов включают прокариотические или эукариотические клетки, описанные в настоящем описании. Например, антитела можно продуцировать в бактериях, в частности, когда гликозилирование и эффекторная функция Fc не требуются. Для экспрессии фрагментов антитела и полипептидов в бактериях, см., например, патенты № 5648237, 5789199 и 5840523 (Также см. Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, в которых описана экспрессия фрагментов антител в E. coli). После экспрессии антитело можно выделять из бактериальной клеточной массы в растворимой фракции и можно далее очищать.
В дополнение к прокариотам, подходящими хозяевами для клонирования или экспрессии кодирующих антитело векторов являются эукариотические микроорганизмы, включая штаммы грибов или дрожжей, в которых каскады гликозилирования являются "гуманизированными", что приводит к продукции антитела с частично или полностью человеческим паттерном гликозилирования. См. Gerngross, Nat. Biotech. 22: 1409-1414 (2004), и Li et al., Nat. Biotech. 24:210-215 (2006).
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (безпозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать вместе с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Также в качестве хозяев можно использовать растительные клеточные культуры. См., патенты США № 5959177, 6040498, 6420548, 7125978 и 6417429 (где описана технология PLANTIBODIESTM для продуцирования антител трансгенными растениями).
В качестве хозяев можно использовать клетки позвоночных. Например, могут быть пригодными клеточные линии млекопитающих, которые адаптированы для роста в суспензии. Другие примеры пригодных клеточных линий млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7); эмбриональная линия почки человека (клетки 293 или 293, как описано, например, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки молодого хомяка (BHK); клетки Сертоли мыши (TM4, как описано Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы буффало (BRL 3A); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (MMT 060562); клетки TRI (Mather et al., Annals N.Y. Acad. Sci 383:44-68 (1982)); клетки MRC 5 и клетки FS4. Другие подходящие клеточные линии млекопитающих включают клетки яичника китайского хомячка (CHO), включающие клетки DHFR- CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 11:4216 (1980)); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Для обзора определенных клеточных линий млекопитающих, пригодных для продукции антител, см., например, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ) pp. 255-268 (2003).
C. Анализы
Антитела против Axl, представленные в настоящем описании, можно идентифицировать, подвергать скринингу или охарактеризовывать по их физическим/химическим свойствам и/или видам биологической активности с помощью различных анализов, известных в данной области.
1. Анализы связывания и другие анализы
В одном из аспектов антитело по изобретению тестируют в отношении его активности связывания антигена, например, известными способами, такими как ELISA, вестерн-блоттинг и т.д.
В другом аспекте можно использовать конкурентные анализы для идентификации антитела, которое конкурирует с одним или несколькими из антител 327.6, 327.6.S2, 327.6.S11, 327.6.S50, 327.6.S52, 327.6.S65, 327.42, 327.42.S8, 327.42.S31, 327.42.S13, 327.42.S43, 327.42.S52, 327.42.S63, 327.42.S73, 327.42.H2, 327.42.H4 и/или 327.42.H20 за связывание с Axl. В определенных вариантах осуществления такое конкурентное антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается 327.6, 327.6.S2, 327.6.S11, 327.6.S50, 327.6.S52, 327.6.S65, 327.42, 327.42.S8, 327.42.S31, 327.42.S13, 327.42.S43, 327.42.S52, 327.42.S63, 327.42.S73, 327.42.H2, 327.42.H4 и/или 327.42.H20. Подробное описание иллюстративных способов картирования эпитопа, с которым связывается антитело, представлено в Morris (1996) "Epitope Mapping Protocols", Methods in Molecular Biology vol, 66 (Humana Press, Totowa, NJ).
В иллюстративном конкурентном анализе иммобилизованный Axl инкубируют в растворе, содержащему первое меченое антитело, которое связывается с Axl (например, 327.6, 327.6.S2, 327.6.S11, 327.6.S50, 327.6.S52, 327.6.S65, 327.42, 327.42.S8, 327.42.S31, 327.42.S13, 327.42.S43, 327.42.S52, 327.42.S63, 327.42.S73, 327.42.H2, 327.42.H4 и/или 327.42.H20) и второе немеченое антитело, которое исследуют в отношении его способности конкурировать с первым антителом за связывание с Axl. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный Axl инкубируют в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубации в условиях, позволяющих связывание первого антитела с Axl, избыток не связавшегося антитела удаляют, и измеряют количество метки, связанной с иммобилизованным Axl. Если количество метки, связанной с иммобилизованным Axl, существенно снижено в тестируемом образце относительно контрольного образца, тогда это указывает на то, что второе антитело является конкурирующим с первым антителом за связывание с Axl. См. Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
2. Анализы активности
В одном из аспектов предусмотрены анализы для идентификации антител против Axl, обладающих биологической активностью. Биологическая активность может включать, например, ингибирование связывания Gas6 с Axl, ингибирование активации Axl, ингибирование последующей молекулярной передачи сигнала Axl, ингибирование экспрессии Axl (например, экспрессия Axl на клеточной поверхности или общая экспрессия Axl в клетке, такой как опухолевая клетка), ингибирование секреции воспалительных цитокинов, стимуляция апоптоза (например, путем ингибирования опосредуемого Gas6 ингибирования апоптоза), ингибирование внутриопухолевых сосудов, ингибирование стромальной активности и/или экспрессии Axl в опухоли и/или ингибирование метастазирования. Также предусмотрены антитела, обладающие такой биологической активностью in vivo и/или in vitro.
В определенных вариантах осуществления антитело по изобретению исследуют в отношении такой биологической активности. В определенных вариантах осуществления антитело исследуют в отношении его способности стимулировать апоптоз in vitro (например, апоптоз опухолевой клетки). Иллюстративные способы определения роста и/или пролиферации, и/или апоптоза клеток включают, например, анализ включения BrdU, анализ с MTT, анализ включения [3H]-тимидина (например, анализ TopCount (PerkinElmer)), анализы жизнеспособности клеток (например, CellTiter-Glo (Promega)), анализы фрагментации ДНК, анализы активации каспазы, анализы исключения триптанового синего, анализы морфологии хроматина и т.п.
В определенных вариантах осуществления антитело исследуют в отношении ингибирования экспрессии Axl, например, с использованием способов, описанных и проиллюстрированных в настоящем описании. В одном из вариантов осуществления антитело против Axl инкубируют с пригодными исследуемыми клетками, например, клетками NSCLC A549 и после подходящего периода времени клеточные лизаты собирают и исследуют в отношении общих уровней Axl. Также можно использовать FACS-анализ для исследования поверхностных уровней рецептора Axl после инкубации с антителами-кандидатами против Axl. В одном из вариантов осуществления образец опухоли исследуют в отношении экспрессии Axl после обработки антителом против Axl.
В определенных вариантах осуществления антитело по изобретению исследуют в отношении его способности ингибировать секрецию воспалительных цитокинов, например, как описано и проиллюстрировано в настоящем описании.
В определенных вариантах осуществления антитело по изобретению исследуют в отношении его способности уменьшать внутриопухолевую сосудистую сеть и/или ингибировать стромальную активность, и/или экспрессию Axl в опухоли, например, как проиллюстрировано в настоящем описании. В некоторых вариантах осуществления стромальная активность Axl в опухоли представляет собой метастазирование или развитие внутриопухолевой сосудистой сети.
В определенных вариантах осуществления антитело по изобретению исследуют в отношении его способности ингибировать рост или пролиферацию клеток in vitro. Анализы ингибирования роста или пролиферации клеток хорошо известны в данной области. В определенных анализах пролиферации клеток, иллюстрируемых анализами "уничтожения клеток", описанными в настоящем описании, измеряют жизнеспособность клеток. Одним таким анализом является люминесцентный анализ жизнеспособности клеток CellTiter-Glo™, который коммерчески доступен от Promega (Madison, WI). В этом анализе определяют число жизнеспособных клеток в культуре на основе количественного определения присутствующего ATP, который является признаком метаболически активных клеток. См, Crouch et al. (1993) J. Immunol. Meth. 160:81-88, патент США № 6602677. Этот анализ можно проводить в формате 96- или 384-лунок, что делает его пригодным для автоматического высокопроизводительного скрининга (HTS), См, Cree et al. (1995) Anticancer Drugs 6:398-404. Методика анализа вовлекает добавление одного реагента (реагент CellTiter-Glo) непосредственно к культивируемым клеткам. Это приводит к лизису клеток и генерированию люминесцентного сигнала вследствие реакции люциферазы. Люминесцентный сигнал пропорционален количеству присутствующего ATP, которое прямо пропорционально количеству жизнеспособных клеток, присутствующих в культуре. Данные можно регистрировать с помощью люминометра или устройства для визуализации с CCD-камерой. Выходные данные люминесценции выражают в качестве относительных световых единиц (RLU).
Другим анализом пролиферации клеток является "MTT"-анализ -колориметрический анализ, в котором измеряют окисление бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия в формазан митохондриальной редуктазой. Подобно анализу CellTiter-Glo™, этот анализ указывает на количество метаболически активных клеток, присутствующих в клеточной культуре. См., например, Mosmann (1983) J, Immunol, Meth, 65:55-63, и Zhang et al., (2005) Cancer Res, 65:3877-3882.
Клетки для применения в любом из указанных выше анализов in vitro включают клетки или клеточные линии, которые естественным образом экспрессируют Axl, или которые сконструированы так, чтобы экспрессировать Axl. Такие клетки включают опухолевые клетки, которые сверхэкспрессируют Axl относительно нормальных клеток того же происхождения. Такие клетки также включают клеточные линии (включая опухолевые клеточные линии), которые экспрессируют Axl, и клеточные линии, которые обычно не экспрессируют Axl, но трансфицированы нуклеиновой кислотой, кодирующей Axl. Иллюстративные клеточные линии, представленные в настоящем описании для применения в любом из описанных выше анализов in vitro включают клеточную линию NSCLC A549, клеточную линию NSCLC H1299, и клеточную линию рака молочной железы MDA-MB231.
В одном из аспектов антитело против Axl исследуют в отношении его способности ингибировать рост или пролиферацию клеток in vivo. В определенных вариантах осуществления антитело против Axl исследуют в отношении его способности ингибировать рост опухоли in vivo. Для такого исследования можно использовать модельные системы in vivo, такие как модели с ксенотрансплантатом. В иллюстративной системе с ксенотрансплантатом опухолевые клетки человека вводят не являющемуся человеком животному с соответствующим образом ослабленным иммунитетом, например, бестимусной мыши "nude". Животному вводят антитело по изобретению. Измеряют способность антитела ингибировать или снижать рост опухоли. В определенных вариантах осуществления описанной выше системы с ксенотрансплантатом, опухолевые клетки человека представляют собой опухолевые клетки из пациента-человека. Такие модели с ксенотрансплантатом коммерчески доступны от Oncotest GmbH (Frieberg, Германия). В определенных вариантах осуществления опухолевые клетки человека представляют собой клетки из опухолевой клеточной линии человека, такой как клетки рака молочной железы MDA-MB-231 или клетки немелкоклеточного рака легкого A549. В определенных вариантах осуществления опухолевые клетки человека вводят не являющегося человеком животному с соответствующим образом сниженным иммунитетом путем подкожной инъекции или путем трансплантации в подходящую область, такую как жировое тело молочной железы.
Понятно, что любой из описанных выше анализов можно проводить с использованием иммуноконъюгата по изобретению вместо или в дополнение к антителу против Axl.
Понятно, что любой из описанных выше анализов можно проводить с использованием антитела против Axl и дополнительного лекарственного средства, такого как антагонист VEGF и/или антагонист EGFR, и/или химиотерапевтическое средство.
D. Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам, содержащим антитело против Axl, конъюгированное с одним или несколькими цитотоксическими средствами, такими как химиотерапевтические средства или лекарственные средства, ингибирующие рост средства, токсины (например, белковые токсины, ферментативно активные токсины бактерий, грибов, растений или животных, или их фрагменты), или с радиоактивными изотопами.
В одном из вариантов осуществления иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или несколькими лекарственными средствами, включая, но не ограничиваясь ими, майтанзиноид (см. патенты США № 5208020, 5416064 и патент Европы EP 0 425 235 B1); ауристатин, такой как группы лекарственного средства на основе монометилауристатина DE и DF (MMAE и MMAF) (см. патенты США № 5635483 и 5780588 и 7498298); доластатин; калихеамицин или его производное (см. патенты США № 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296; Hinman et al., Cancer Res. 53:3336-3342 (1993); и Lode et al., Cancer Res. 58:2925-2928 (1998)); антрациклин, такой как дауномицин или доксорубицин (см. Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchic et al., Bioorg. & Med. Chem. Letters 12: 1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); и патент США № 6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тесетаксел и ортатаксел; трихотецен и CC1065.
В другом варианте осуществления иммуноконъюгат содержит антитело, как описано в настоящем описании, конъюгированное с ферментативно активным токсином или его фрагментом, включая, но не ограничиваясь ими, A-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки-диантаны, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены.
В другом варианте осуществления иммуноконъюгат содержит антитело, как описано в настоящем описании, конъюгированное с радиоактивным атомом, с образованием радиоконъюгата. Для получения радиоконъюгатов доступно множество радиоактивных изотопов. Их примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда для детекции используют радиоконъюгат, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (также известной как магнитно-резонансная томография, mri), такую как вновь йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического средства можно получать с использованием множества бифункциональных связывающих белки веществ, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола), и вторичные активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al. Science 238: 1098 (1987). Меченая углеродом-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радионуклеотида с антителом. См. WO94/11026. Линкер может представлять собой "расщепляемый линкер", способствующий высвобождению цитотоксического лекарственного средства в клетке. Например, можно использовать неустойчивый к действию кислот линкер, чувствительный к пептидазам линкер, фотолабильный линкер, диметиловый линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США № 5208020).
Иммуноконъюгаты или ADC в рамках изобретения прямо предусматривают, но не ограничиваются ими, такие конъюгаты, полученные с помощью сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Rockford, IL., США).
E. Способы и композиции для диагностики и детекции
В определенных вариантах осуществления любое из антител против Axl, представленных в настоящем описании, пригодно для детекции присутствия Axl в биологическом образце. Термин "детекция", как используют в рамках изобретения, охватывает количественную или качественную детекцию. В определенных вариантах осуществления биологический образец содержит клетку или ткань, такую как клетка или ткань молочной железы, поджелудочной железы, пищевода, легкого и/или головного мозга.
В одном из вариантов осуществления предусмотрено антитело против Axl для применения в способе диагностики или детекции. В следующем аспекте предусмотрен способ детекции присутствия Axl в биологическом образце. В определенных вариантах осуществления способ включает приведение в контакт биологического образца с антителом против Axl, как описано в настоящем описании, в условиях, позволяющих связывание антитела против Axl с Axl, и детекцию образования комплекса между антителом против Axl и Axl. Такой способ может представлять собой способ in vitro или in vivo. В одном из вариантов осуществления антитело против Axl используют для выбора индивидуумов, подходящих для терапии антителом против Axl, например, где Axl является биомаркером для выбора пациентов.
Иллюстративные нарушения, которые можно диагностировать с использованием антитела по изобретению, включают злокачественную опухоль (например, злокачественную опухоль молочной железы, легкого, поджелудочной железы, головного мозга, почки, яичника, желудка, лейкоз, злокачественную опухоль эндометрия матки, толстого кишечника, предстательной железы, щитовидной железы, остеосаркому и/или меланому).
В определенных вариантах осуществления предусмотрены меченые антитела против Axl. Метки включают, но не ограничиваются ими, метки или группы, которые подвергают детекции непосредственно (такие как флуоресцентные, хромофорные, электронноплотные, хемилюминесцентные и радиоактивные метки), а также такие группы, как ферменты или лиганды, которые подвергают детекции косвенно, например, посредством ферментативной реакции или молекулярного взаимодействия. Иллюстративные метки включают, но не ограничиваются ими, радиоизотопы 32P, 14C, 125I, 3H и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, сопряженные с ферментом, который использует пероксид водорода для окисления предшественника красителя, такой как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
F. Фармацевтические составы
Фармацевтические составы антитела против Axl, как описано в настоящем описании, получают путем смешивания антитела, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозировках и концентрациях, и включают, но не ограничиваются ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметэтония; хлорид бензалкония, хлорид бензэтония; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG). Иллюстративные фармацевтически приемлемые носители, описанные в настоящем описании, включают средства для интерстициального распределения лекарственного средства, такие как растворимые нейтрально-активные гиалуронидазные гликопротеины (sHASEGP), например, растворимые гиалуронидазные гликопротеины PH-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые иллюстративные sHASEGP и способы их применения, включая rHuPH20, описаны в публикациях патентов США № 2005/0260186 и 2006/0104968. В одном из аспектов sHASEGP комбинируют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Иллюстративные лиофилизированные составы антител описаны в патенте США № 6267958. Водные составы антител включают составы, описанные в патенте США № 6171586 и WO2006/044908, причем последние составы включают гистидин-ацетатный буфер.
Состав, представленный в настоящем описании, также может содержать более одного активного соединения, если необходимо для конкретного показания, подлежащего лечению, предпочтительно, соединения с дополняющими видами активностями, которые не оказывают неблагоприятного эффекта друг на друга. Например, может желательно дополнительное предоставление антагониста EGFR (такого как эрлотиниб), антиангиогенного средства (такого как антагонист VEGF, такой как антитело против VEGF) или химиотерапевтическое средство (такое как таксоид или средство на основе платины). Такие активные ингредиенты подходящим образом присутствуют в комбинации в количествах, которые являются эффективными для предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризации, например, микрокапсулы на основе гидроксиметилцеллюлозы или желатина и микрокапсулы на основе полиметилметакрилата, соответственно, в коллоидные системы для доставки лекарственного средства (например, липосомы, микросферы на основе альбумина, микроэмульсии, наночастицы и нанокапсулы), или в микроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, которые представлены в виде имеющих форму изделий, например, пленок или микрокапсул.
Составы для применения для введения in vivo должны быть стерильными. Этого легко достигать фильтрацией через стерильные фильтрующие мембраны.
G. Терапевтические способы и композиции
Любое из антител против Axl, представленных в настоящем описании, можно использовать в терапевтических способах.
В одном из аспектов предусмотрено антитело против Axl для применения в качестве лекарственного средства. В следующих аспектах предусмотрено антитело против Axl для применения при лечении злокачественной опухоли (например, рак молочной железы, немелкоклеточный рак легкого, рак поджелудочной железы, злокачественная опухоль головного мозга, рак поджелудочной железы, головного мозга, почки, яичника, желудка, лейкоз, рак эндометрия матки, толстого кишечника, предстательной железы, щитовидной железы, печени, остеосаркома и/или меланома). В определенных вариантах осуществления предусмотрено антитело против Axl для применения в способе лечения. В определенных вариантах осуществления изобретение относится к антителу против Axl для применения в способе лечения индивидуума, имеющего злокачественную опухоль, включающем введение индивидууму эффективного количества антитела против Axl. В определенных вариантах осуществления изобретение относится к антителу против Axl для применения в способе лечения индивидуума, имеющего иммунное нарушение (например, аутоиммунное нарушение), сердечно-сосудистое нарушение (например, атеросклероз, гипертензия, тромбоз), инфекционное заболевание (например, вирус Эбола, вирус марбургской болезни) или диабет, включающем введение индивидууму эффективного количества антитела против Axl. В одном из вариантов осуществления способ дополнительно включает введение индивидууму эффективного количества по меньшей мере одного дополнительного лекарственного средства, например, как описано ниже. В других вариантах осуществления изобретение относится к антителу против Axl для применения для ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети), и/или ингибирования стромальной функции опухоли.
В определенных вариантах осуществления изобретение относится к антителу против Axl для применения в способе ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сети) и/или ингибирования стромальной функции опухоли у индивидуума, включающем введение индивидууму эффективного количества антитела против Axl для ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования развития сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети), и/или ингибирования стромальной функции опухоли. "Индивидуумом" согласно любому из описанных выше вариантов осуществления, предпочтительно, является человек.
В следующем аспекте изобретение относится к применению антитела против Axl для изготовления или получения лекарственного средства. В одном из вариантов осуществления лекарственное средство предназначено для лечения злокачественной опухоли (в некоторых вариантах осуществления рак молочной железы, немелкоклеточный рак легкого, рак поджелудочной железы, злокачественная опухоль головного мозга, рак поджелудочной железы, поджелудочной железы, головного мозга, почки, яичника, желудка, лейкоз, рак эндометрия матки, толстого кишечника, предстательной железы, щитовидной железы, печени, остеосаркома и/или меланома). В следующем варианте осуществления лекарственное средство предназначено для применения в способе лечения злокачественной опухоли, включающем введение индивидууму, имеющему злокачественную опухоль, эффективного количества лекарственного средства. В следующем варианте осуществления лекарственное средство предназначено для применения в способе лечения иммунного нарушения (например, аутоиммунного нарушения), сердечно-сосудистого нарушения (например, атеросклероз, гипертензия, тромбоз), инфекционного заболевания (например, вирус Эбола, вирус марбургской болезни) или диабета, включающем введение индивидууму эффективного количества антитела против Axl. В одном таком варианте осуществления способ дополнительно включает введение индивидууму эффективного количества по меньшей мере одного дополнительного лекарственного средства, например, как описано ниже. В следующем варианте осуществления лекарственное средство предназначено для ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети), и/или ингибирования стромальной функции опухоли. В следующем варианте осуществления лекарственное средство предназначено для применения в способе ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети) и/или ингибирования стромальной функции опухоли у индивидуума, включающем введение индивидууму количества лекарственного средства, эффективного для ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети) и/или ингибирования стромальной функции опухоли. "Индивидуумом" согласно любому из описанных выше вариантов осуществления может быть человек.
В следующем аспекте изобретение относится к способу лечения злокачественной опухоли. В одном из вариантов осуществления способ включает введение индивидууму, имеющему такую злокачественную опухоль, эффективного количества антитела против Axl. В одном таком варианте осуществления способ дополнительно включает введение индивидууму эффективного количества по меньшей мере одного дополнительного лекарственного средства, как описано ниже. "Индивидуумом" согласно любому из описанных выше вариантов осуществления может быть человек.
В следующем аспекте изобретение относится к способу лечения иммунного нарушения (например, аутоиммунное нарушение), сердечно-сосудистого нарушения (например, атеросклероз, гипертензия, тромбоз), инфекционного заболевания (например, вирус Эбола, вирус марбургской болезни) или диабета. В одном таком варианте осуществления способ дополнительно включает введение индивидууму эффективного количества по меньшей мере одного дополнительного лекарственного средства, как описано ниже. "Индивидуумом" согласно любому из описанных выше вариантов осуществления может быть человек.
В следующем аспекте изобретение относится к способу ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети), и/или ингибирования стромальной функции опухоли у индивидуума. В одном из вариантов осуществления способ включает введение индивидууму эффективного количества антитела против Axl ингибирования ангиогенеза, ингибирования пролиферации клеток, ингибирования иммунной функции, ингибирования секреции воспалительных цитокинов (например, из связанных с опухолью макрофагов), ингибирования сосудистой сети опухоли (например, внутриопухолевой сосудистой сети или связанной с опухолью сосудистой сети), и/или ингибирования стромальной функции опухоли. В одном из вариантов осуществления "индивидуумом" является человек.
В следующем аспекте изобретение относится к фармацевтическим составам, содержащим любое из антител против Axl, представленных в настоящем описании, например, для применения в любом из описанных выше способов терапии. В одном из вариантов осуществления фармацевтический состав содержит любое из антител против Axl, представленных в настоящем описании, и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтический состав содержит любое из антител против Axl, представленных в настоящем описании, и по меньшей мере одно дополнительное лекарственное средство, например, как описано ниже.
Антитела по изобретению можно использовать при терапии либо отдельно, либо в комбинации с другими средствами. Например, антитело по изобретению можно вводить совместно по меньшей мере с одним дополнительным лекарственным средством. В определенных вариантах осуществления дополнительное лекарственное средство представляет собой антиангиогенное средство. В определенных вариантах осуществления дополнительное лекарственное средство представляет собой антагонист VEGF (в некоторых вариантах осуществления антитело против VEGF, например, бевацизумаб). В определенных вариантах осуществления дополнительное лекарственное средство представляет собой антагонист EGFR (в некоторых вариантах осуществления эрлотиниб). В определенных вариантах осуществления дополнительное лекарственное средство представляет собой химиотерапевтическое средство и/или цитостатическое средство. В определенных вариантах осуществления дополнительное лекарственное средство представляет собой таксоид (например, паклитаксел) и/или средство на основе платины (например, карбоплатин).
Такая комбинированная терапия, указанная выше, охватывает комбинированное введение (где два или более лекарственных средств включены в один и тот же или в отдельные составы), и раздельное введение, в случае которого введение антитела по изобретению может происходить до, одновременно и/или после введения дополнительного лекарственного средства, и/или адъюванта. Антитела по изобретению также можно использовать в комбинации с лучевой терапией.
Антитело по изобретению (или любое дополнительное терапевтическое средство) может быть введено любым подходящим способом, включая парентеральный, внутрилегочный и интраназальный, и если необходимо местное применение, введение внутрь поражения. Парентеральная инфузия включает внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может проводиться любым подходящим путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости от постоянного или однократного введения. Возможны различные схемы введения, которые включают, но ими не ограничиваются, однократное или множественное введение в различные временные точки, болюсное введение, и импульсное введение.
Антитела по изобретению можно изготавливать, дозировать и вводить в соответствии с "надлежащей медицинской практикой". Факторы, учитываемые в этом контексте, включают конкретное подвергаемое лечению нарушение, конкретное подвергаемое лечению млекопитающее, клиническое состояние конкретного пациента, причину нарушения, область доставки средства, способ введения, расписание введения и другие факторы, известные медицинским специалистам. Антитело не должно быть включено в состав с одним или несколькими средствами, в настоящее время используемыми для предупреждения или лечения рассматриваемого нарушения, но необязательно его включают в состав вместе с ними. Эффективное количество таких других средств зависит от антитела, присутствующего в составе, типа нарушения или лечения и других факторов, рассмотренных выше. Как правило, их используют в тех же дозировках и с помощью тех же путей введения, которые описаны в настоящем описании, или в количестве от 1 до 99% от дозировок, описанных в настоящем описании, или в любой дозировке и любым способом, которые эмпирически/клинически определены как подходящие.
Для предупреждения или лечения заболевания подходящая дозировка антитела по изобретению (при использовании отдельно или в комбинации с одним или несколькими другими дополнительными лекарственными средствами) будет зависеть от типа заболевания, подвергаемого лечению, типа антитела, тяжести и течения заболевания, введения антитела в профилактических или терапевтических целях, предшествующей терапии, клинического анамнеза пациента и ответа на антитело, и мнения лечащего врача. Антитело пригодным образом вводят пациенту за один раз или на протяжении серии введений. В зависимости от типа и тяжести заболевания, исходная предполагаемая дозировка для введения пациенту составляет от приблизительно 1 мкг/кг до 40 мг/кг антитела, например, либо посредством одного или нескольких отдельных введений, либо посредством непрерывной инфузии. Одна из типичных суточных дозировок может находиться в диапазоне приблизительно от 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. В случае многократных введений в течение нескольких суток или более, в зависимости от состояния, введение повторяют до возникновения требуемого подавления симптомов заболевания. Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, так чтобы пациент получал от приблизительно двух до приблизительно двадцати, или, например, приблизительно шесть доз антитела). Можно вводить первоначальную более высокую нагрузочную дозу, с последующими одной или несколькими более низкими дозами. Однако могут быть пригодными другие режимы дозирования. Мониторинг хода этой терапии легко проводить с помощью общепринятых способов и анализов.
Понятно, что любой из описанных выше составов и способов терапии можно осуществлять с использованием иммуноконъюгата по изобретению вместо антитела против Axl или в дополнение к антителу против Axl.
H. Изделия
В другом аспекте изобретение относится к изделию, содержащему материалы, подходящие для лечения, профилактики и/или диагностики нарушений, описанных выше. Изделие содержит контейнер и ярлык на контейнере или вкладыш в упаковку, прилагаемый к контейнеру. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешок для внутривенного раствора и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. В контейнере содержится композиция, которая сама по себе или при комбинировании с другой композицией(ями) эффективна для лечения, профилактики и/или диагностики состояния и может иметь отверстие для стерильного доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, проницаемую для иглы для подкожных инъекций). По меньшей мере одно активное вещество в композиции представляет собой антитело по изобретению. На ярлыке или вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния, такого как злокачественная опухоль. Более того, изделие может содержать (a) первый контейнер с композицией, содержащейся в нем, где композиция содержит антитело по изобретению; и (b) второй контейнер с композицией, содержащейся в нем, где композиция содержит дополнительное цитотоксическое средство или другое терапевтическое средство. В этом варианте осуществления изобретения изделие может дополнительно содержать вкладыш в упаковку, на котором указано, что композиции антител можно применять для лечения конкретного состояния. Альтернативно или дополнительно, изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфат-буферный солевой раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любое из описанных выше изделий может включать иммуноконъюгат по изобретению вместо или в дополнение к антителу против Axl.
III. ПРИМЕРЫ
Материалы и способы
Антитела и клеточные линии. Антитела получали от следующих поставщиков: моноклональные антитело (mAb) мыши против Axl человека (Abnova, Тайвань), mAb мыши против фосфо-Akt и поликлональное антитело против Akt (Cell Signaling). Рекомбинантный Gas6 мыши и набор ELISA для фосфо-Axl приобретали от R&D System. Клеточные линии карциномы человека приобретали от ATCC и культивировали в среде PRMI1640, дополненной 10% FBS. Гибридомные моноклональные антитела против Axl человека 12A11 и 3G9 были предоставлены Genentech (см. Li (2009)).
Получение фаговых моноклональных антител против Axl. Для получения антител фаговые библиотеки антител человека с синтетическим разнообразием в выбранных определяющих комплементарность областях (H1, H2, H3), имитирующим природное разнообразие репертуара IgG человека, использовали для пэннинга. Fab-фрагменты экспонировались бивалентно на поверхности частиц бактериофага M13 (Lee et al., 2004). Фаговые библиотеки антител подвергали пэннигу против ECD Axl человека и мыши в альтернативных раундах. Фаговые антитела, которые связывались с Axl ECD-His человека и слитым белком Axl ECD-Fc мыши идентифицировали с помощью ELISA и секвенирования ДНК, и изменяли формат экспрессировавших антитела клонов, чтобы они экспрессировали полноразмерные IgG (Liang et al., 2007). Отдельные клоны временно экспрессировали в клетках млекопитающих и очищали с помощью колонок с белком A (Carter et al., 1992).
Клоны фагов подвергали скринингу в отношении их способности ингибировать Gas6-зависимую пролиферацию клеток Baf3-Axl. Два клона, которые проявляли наиболее высокую эффективность ингибирования пролиферации клеток Baf3Axl, отбирали для созревания аффинности.
Для созревания аффинности фагмида, экспонирующая одновалентный Fab на поверхности бактериофага M13 (Liang et al., 2007) служила в качестве матрицы библиотеки для пересадки вариабельных доменов легкой цепи (VL) и тяжелой цепи (VH) фагового Ab. Для созревания аффинности была выбрана стратегия мягкой рандомизации, как описано (Liang et al., 2007), и для быстрого скрининга высокоаффинных клонов использовали высокопроизводительный одноточечный ELISA с конкурентным фагом, как описано (Sidhu et al., 2004).
Измерение аффинности антител против Axl. Для определения аффинности связывания антител против Axl, использовали измерение путем поверхностного плазмонного резонанса (SRP) с устройством BIAcore™-3000. Для измерения аффинности между антителами против Axl и белком Axl ECD-His человека, IgG против Axl человека улавливали с помощью биосенсорных чипов CM5, на которых было нанесено антитело мыши против IgG человека для достижения приблизительно 250 единиц ответа (RU). Для измерения кинетики двукратные серийные разведения Axl ECD-His человека (440 нМ - 28 нМ) инжектировали в буфере PBT (PBS с 0,05% Tween 20) при 25°C со скоростью потока 30 мкл/мин. Константы ассоциации (kon) и константы диссоциации (koff) вычисляли с использованием простой модели связывания Ленгмюра "один к одному" (BIAcore Evaluation Software версии 3.2). Равновесную константу диссоциации (KD) вычисляли в качестве отношения koff/kon. Для измерения аффинности антител против Axl к слитому белку Axl ECD-Fc мыши, слитый белок Axl ECD мыши-IgG человека улавливали с помощью биосенсорных чипов CM5, на которых было нанесено антитело мыши против IgG человека до достижения приблизительно 150 единиц ответа (RU). Для измерения кинетики двукратные серийные разведения Fab-фрагмента против Axl (200 нМ - 12 нМ) инжектировали в буфере PBST (PBS с 0,05% Tween 20) при 25°C со скоростью потока 30 мкл/мин.
Анализ пролиферации клеток. Клетки высевали в количестве 5000 клеток/лунка в 96-луночные планшеты и обрабатывали mAb против Axl в различных концентрациях в течение 72 часов. Пролиферацию клеток измеряли с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega) согласно инструкциям изготовителя.
ELISA и активированная флуоресценцией сортировка клеток (FACS). Анализы ELISA проводили следующим образом: планшеты, покрытые антителом козы против Fc IgG человека, блокировали 0,5% BSA, PBS, 0,05% Tween 20 (PBST). Для анализа перекрестной реакции покрытые планшеты инкубировали с Axl.Fc человека, Axl.Fc мыши или Mer.Fc человека, Tyro-3.Fc в течение 1 ч при комнатной температуре, промывали четыре раза в PBST, инкубировали с mAb против Axl и конъюгированным с HRP антителом против Ig мыши. Для анализа связывания покрытые планшеты инкубировали с Axl.Fc человека в течение 1 ч при комнатной температуре, промывали четыре раза в PBST, инкубировали с rmGas 6 и mAb против Axl в течение 1 ч при комнатной температуре. Планшеты промывали четыре раза PBST, инкубировали с биотинилированным антителом против mGas6 и стрептавидин-HRP. Секретируемый Ang-2 и DKK3 измеряли с использованием набора R&D ELISA согласно инструкциям изготовителя. Экспрессию Axl на клеточной поверхности определяли с помощью FACS с использованием стандартных способов. В кратком изложении, клетки собирали, окрашивали mAb против Axl (12A11, 10 мкг/мл) в течение 30 мин на льду, промывали два раза PBS, а затем окрашивали конъюгированным с PE вторичным антителом. Для определения антител, блокирующих связывание Gas6 с Axl на клеточной поверхности, клетки собирали, окрашивали mAb против Axl в течение 30 мин и инкубировали с rmGas6 в течение 30 мин на льду. Их промывали два раза PBS и окрашивали биотинилированным антителом против Gas6 и конъюгированным с PE стрептавидином. Образцы анализировали на проточном цитометре BD FACScalibur.
Эксперименты с ксенотрансплантатом. Все исследования проводили в соответствии с "Guide for the Care and Use of Laboratory Animals" (NIH), и они были одобрены Institutional Animal Care and Used Committee (IACUC). Всего 5×106 (A549) или 107 клеток в матригеле (MDA-MB-231) имплантировали подкожно в правый блок мышей “nude” (A549) или SCID (MDA-MB-231), соответственно. Когда средний размер опухоли достигал 100 мм3, мышей случайным образом распределяли на две различных группы введения (n=10 для каждой группы). Антитело против Axl или контрольное антитело IgG1 вводили в дозе 10-30 мг/кг, средство против VEGF вводили в дозе 1-2 мг/кг, путем внутрибрюшинной инъекции (IP) два раза в неделю. Эрлотиниб вводили путем перорального принудительного кормления в дозе 100 мг/кг/сутки. Паклитаксел и карбоплатин вводили подкожно в дозе 6,25 мг/кг/сутки в течение 5 суток, и 100 мг/кг в случае однократной дозы, соответственно, в начале введения. Статистический анализ проводили с использованием двухстороннего Anova для сравнения роста опухоли в различных группах лечения.
Для фармакодинамических (PD) исследований мышам вводили антитела в течение 0, 24, 72 и 168 часов. В каждый момент времени опухоли вырезали, обрабатывали для иммуногистохимического окрашивания и анализа изображений, и использовали для получения клеточных лизатов для вестерн-блот-анализа.
Для исследований метастазирования 5×105 клеток MDA-MB-231, стабильно трансфицированных люциферазным репортерным геном (Li et al., 2009), имплантировали мышам SCID путем инъекции в хвостовую вену. Мониторинг метастазирования опухолевых клеток в различные органы проводили путем биолюминесцентной детекции, как описано (Li et al., 2009).
Иммуногистохимия. Образцы ксенотрансплантата опухоли фиксировали в 10% нейтральном забуференном формалине, обрабатывали, погружали в парафин, и нарезали на срезы толщиной 4 мкм. Затем тонкие срезы обрабатывали первичными антителами к Ki67, расщепленной каспазы 3 и MECA32, а затем биотинилированными вторичными антителами и хромогеном DAB.
Первичную микроматрицу с тканью рака молочной железы человека получали от Cureline Inc, включая протоковые и метастазирующие аденокарциномы. IHC на Axl проводили с использованием моноклонального антитела против Axl, описанного ранее (Li et al., 2009), и макрофаги окрашивали с использованием CD68. Для двойной IHC на Axl/CD68 сначала проводили окрашивание на Axl в дозе 2 мкг/мл с использованием реагентов Vector ABC Elite HRP и субстрата DAB. Затем проводили окрашивание на CD68 в дозе 0,5 мкг/мл, также с использованием реагентов ABC Elite-HRP, но взамен с хромогеном Vector SG (синий/зеленый). Вторую стадию извлечения антигена-мишени проводили между двумя комплексами для извлечения первого комплекса, чтобы избежать перекрестной реактивности двух маркеров.
Измерение плотности сосудов и анализ данных. Образцы опухоли окрашивали MECA32, общим маркером эндотелиальных клеток. Изображения получали с помощью автоматизированной платформы для сканирования предметных стекол Ariol SL-50 (Genetix Ltd.; Hampshire, Великобритания) при конечном увеличении 100x. Специфические для опухоли области экспортировали для анализа в программное обеспечение Metamorph (MDS Analytical Technologies; Ontario, Canada) в качестве отдельных 8-битных изображений. Коричневое DAB-специфическое окрашивание изолировали от контрастного окрашивания гематоксилином с использованием алгоритма нормализации по синему цвету, как описано (Brey et al., 2003). Алгоритм сегментации идентифицировал сосуды и удалял шумы на основе размера и формы. Клетки идентифицировали в качестве либо опухолевых, либо неопухолевых, исходя из размера, формы и плотности окрашивания гематоксилином. Неопухолевые области идентифицировали по плотности неопухолевых клеток против опухолевых клеток. После завершения анализа изображения исследовали вручную для удаления артефактов, ошибочно идентифицированных как сосуды или опухолевые области. Измерение площадей проводили для отдельных сосудов, а также для опухолевых и неопухолевых областей в каждом изображении. Исходные величины, основанные на анализе изображений, анализировали с использованием программного обеспечения JMP 8.0 (SAS Institute, Inc, North Carolina, США). Для сравнения каждой пары средних значений вычисляли t-критерий Стьюдента с p<0,05.
Выделение связанных с опухолью макрофагов (TAM) и детекция секретируемых цитокинов. Опухоли разрезали, измельчали на небольшие фрагменты и инкубировали в среде RPMI1640 с 2,5% FBS, 0,2 единиц/мл Liberase Blendzymes II и 5 единиц/мл DNAsel, (Roche). Опухолевые клетки диссоциировали с использованием диссоциатора MACS (Miltenyi Biotec) и поддерживали в течение 20 минут при комнатной температуре. Для остановки реакции добавляли EDTA (конечная концентрация 0,002%). Приготавливали суспензии отдельных клеток и эритроциты извлекали с использованием буфера для лизиса RBC (eBioscience). Клетки ресуспендировали в количестве 107 клеток/мл в PBS, содержавшем 1% FBS, и инкубировали с 20 □г/мл FcRII, III и IV в течение 20 минут. Добавляли антитело против F4/80-PE (eBioscience) и антитело против CD11c-APC (BD Pharmingen) (0,2 мкг/106 клеток) и инкубировали в течение 30 минут на льду. Положительные по F4/80 и CD11c клетки сортировали с помощью FACSAria (BD Biosciences). Всего 2×105 положительных по F4/80 и CD11c клеток высевали в 96-луночный планшет и культивировали в течение ночи. Культуральную среду собирали и определяли уровни цитокинов и хемокинов с использованием анализа цитокинов мыши Bio-Plex (Bio-Rad) в соответствии с инструкциями изготовителя.
Картирование эпитопа
Плазмидные конструкции Axl-2 (PRK HuAxl(1-134Aa)/HuIgG1Fc), Axl-3 (PRK HuAxl(1-221Aa)/HuIgG1Fc), Axl-4 (PRK HuAxl(1-324Aa)/HuIgG1Fc) и Axl-5 (PRK HuAxl(1-435Aa)/HuIgG1Fc) получали стандартными способами молекулярной биологии. Все плазмиды подтверждали путем прямого секвенирования и/или рестрикционного расщепления. Плазмиды, кодирующие различные части внеклеточного домена Axl (aa1-134, aa1-221, aa1-324, aa1-435) транскрибировали и транслировали in vitro с использованием набора с системой для транскрипции/трансляции Promega L2080 TNT SP6 Quick и использовали в качестве антигенов в ELISA. Части Axl, использованные в этих экспериментах, включали: аминокислоты 1-134 Axl человека (включающие Ig1 Axl):
MAWRCPRMGRVPLAWCLALCGWACMAPRGTQAEESPFVGNPGNITGARGLTGTLRCQLQVQGEPPEVHWLRDGQILELADSTQTQVPLGEDEQDDWIVVSQLRITSLQLSDTGQYQCLVFLGHQTFVSQPGYVG (SEQ ID NO:111),
и аминокислоты 221-324 Axl человека (включающие домен фибронектина Axl):
ITVLPQQPRNLHLVSRQPTELEVAWTPGLSGIYPLTHCTLQAVLSDDGMGIQAGEPDPPEEPLTSQASVPPHQLRLGSLHPHTPYHIRVACTSSQGPSSWTHWL (SEQ ID NO:130).
Конкурентные эксперименты с антителами. Для определения того, конкурируют ли фаговые mab против Axl YW327.6 или YW327.42 с гибридомными mAb против Axl 12A11 и 3G9, клетки A549 совместно окрашивали фаговым антителом против Axl (каждое в количестве 50 мкг/мл) и гибридомным антителом против Axl (каждое в количестве 10 мкг/мл) в течение 30 минут. Клетки промывали два раза PBS и окрашивали антителом против Ig мыши-PE. Образцы анализировали на проточном цитометре BD FACScalibur (BD Biosciences), как описано выше для анализа FACS.
Результаты
Получение происходящего из фага моноклонального антитела, которое блокирует функцию Axl. Для идентификации антител, которые перекрестно реагируют с Axl мыши и человека, авторы настоящего изобретения использовали полученные способом фагового дисплея библиотеки антител с синтетическим разнообразием в выбранных определяющих комплементарность областях, имитирующим природное разнообразие IgG-антител человека (Lee et al., 2004). Фаговые антитела, которые связываются ECD Axl как человека, так и мыши, идентифицировали путем ELISA и секвенирования ДНК, и изменяли формат экспрессирующих антитела клонов, чтобы они экспрессировали полноразмерные IgG (Liang et al., 2007). Затем панель полноразмерных IgG подвергали скринингу в отношении их способности ингибировать Gas6-зависимый рост клеток Baf3Axl (Li et al., 2009), и один из клонов YW327.6 подвергали созреванию аффинности и очищали.
Подвергнутое созреванию аффинности mAb против Axl YW327.6S2 связывается с Axl как человека, так и мыши, с высокой аффинностью с Kd приблизительно 1 нМ и 545 пМ, соответственно, (фиг. 7A-B). В частности Ka составила 1,7×105, kd составила 1,7×104 и KD составила 9,9×10-10. Это антитело также связывается с Axl яванского макак, но не реагирует перекрестно с родственными рецепторами Tyro3 и Mer (фиг. 7C). YW327.6S2 блокирует связывание лиганда Gas6 с Axl, как продемонстрировано как в бесклеточном ELISA, так и на клеточной поверхности с помощью FACS, дозозависимым образом (фиг. 7D-E).
Подвергнутые созреванию аффинности Mab против Axl YW327.6S11, YW327.42S8 и YW327.42S31 также охарактеризовывали. YW327.6S11, YW327.42S8 и YW327.42S31 связывают Axl как человека, так и мыши, с высокой аффинностью. Например, анализ biacore связывания антитела с Axl человека дал следующие результаты:

Эти антитела не реагируют перекрестно с Tyro3 и Mer. YW327.6S2 (и исходное антитело YW327.6) блокирует связывание лиганда Gas6 с Axl, в то время как YW327.42S8 и YW327.42S31 (и исходное Mab YW327.42) не блокируют связывание лиганда Gas6 с Axl.
Анализ эпитопов Axl. Связывание антитела против Axl с различными частями внеклеточного домена Axl человека анализировали с использованием ELISA. Были получены следующие результаты:

YW327.6 связывалось со слитыми конструкциями Axl-Fc, содержавшими аминокислоты 1-134 Axl человека. Напротив, YW327.42 связывало слитую конструкцию Axl-Fc, содержавшую аминокислоты 1-324 Axl человека, но не связывало слитые конструкции Axl-Fc, содержавшие аминокислоты 1-134 и 1-221. Таким образом, авторы настоящего изобретения сделали заключение, что YW327.6 связывает полипептид, состоящий из аминокислот 1-134 Axl человека, и что аминокислоты Axl человека 222-234 требовались для связывания YW327.42. Аминокислоты 1-134 содержат домен Ig1 Axl, и аминокислоты 222-234 содержат домен фибронектина Axl.
Конкурентные эксперименты с гибридомными антителами против Axl. Авторы настоящего изобретения определяли, могут ли антитела YW326.6 и YW327.42 конкурировать за связывание Axl человека с гибридомными антителами против Axl 12A11 и 3G9 (Li, (2009), патентная заявка США под номером 61/228915, поданная 27 июля 2009 года). В экспериментах по конкурентному связыванию антитела с Axl человека антитело YW327.6 не конкурировало за связывание с Axl человека ни с одним из гибридомных антител 12A11 или 3G9, демонстрируя, что эти антитела не распознают одни и те же эпитопы. Антитело YW327.42 конкурировало за связывание Axl человека с гибридомным антителом 12A11, но не конкурировало за связывание с Axl человека с гибридомным антителом 3G9.
YW327.6S2 подавляет экспрессию Axl, ингибирует его активацию, передачу сигнала и Gas6-зависимую пролиферацию клеток Baf3Axl. Для тестирования того, влияет ли YW327.6S2 на биологические функции Axl, авторы настоящего изобретения сначала оценивали его эффект на экспрессию и передачу сигнала Axl. Обработка клеточной линии NSCLC A549 посредством YW327.6S2 привела к быстрому подавлению экспрессии Axl на клеточной поверхности (фиг. 7F, верхняя панель) и это подавление сохранялось в течение 24 ч (фиг. 7F, нижняя панель). Обработка Gas6 клеток H1299 NSCLC индуцировала фосфорилирование Axl, которое ингибировалось, когда клетки предварительно инкубировали с YW327.6S2 (фиг. 7G, верхняя панель). Следовательно, предварительная инкубация клеток H1299 с YW327.6S2 блокирует индуцируемое Gas6 фосфорилирование нижеследующей молекулы передачи сигнала Akt (фиг. 7G, нижняя панель). Подавление экспрессии Axl и инактивация его передачи сигнала с помощью YW327.6S2 эффективно ингибировали Gas6-зависимый рост клеток Baf3Axl с IC50 340 нг/мл (фиг. 7H).
YW327.6S2 снижает рост ксенотрансплантата A549 и усиливает эффект средства против VEGF. В предшествующем исследовании авторы настоящего изобретения показали, что ингибирование Axl либо с помощью РНК-i, либо с помощью обработки гибридомными моноклональными антителами против Axl человека, значительно снижает рост опухоли NSCLC A549 (Li et al., 2009). Таким образом, авторы настоящего изобретения сначала протестировали эффект YW327.6S2 на рост опухоли в этой модели. YW327.6S2 отдельно в количестве 10 мг/кг в режиме дозирования два раза в неделю значительно снижало рост опухоли A549 (фиг. 8A), и этот ингибиторный эффект сравним с эффектом гибридомных антител против Axl человека (фиг. 8C).
Axl экспрессируется на эндотелиальных клетках и усиливает индуцируемое VEGF образование эндотелиальных трубок (Li et al., 2009; Holland et al., 2005); авторы настоящего изобретения протестировали, может ли mAb против Axl усиливать свойство средства против VEGF в отношении подавления роста опухоли (Liang et al., 2006). Антитело против VEGF отдельно и YW327.6S2 отдельно имели сходные эффекты на рост опухоли A549 (фиг. 8A). Комбинация двух антител вместе приводила к усиленному ингибированию роста опухоли по сравнению с каждым из антител отдельно с 30% ингибированием одним средством против 60% ингибирования путем комбинированного лечения (фиг. 8A).
Животным в этом исследовании проводили введение два раза в неделю в течение 60 суток и их наблюдали до 85 суток для исследования замедления роста опухоли (животных устраняли из исследования, когда размер опухоли превышал 800 мм3; в результате токсичности животные устранены не были), YW327.6S2 в комбинации со средством против VEGF значительно замедляло рост опухоли по сравнению с одним средством (фиг. 8A). Отсутствовал повторный рост опухоли в группе комбинированного лечения в течение времени, прошедшего от последний дозы до конца эксперимента (85 сутки), что привело к выживанию всех животных в этой группе в конце эксперимента, как представлено на графике Каплана-Мейера (фиг. 8B).
Гибридомное моноклональное антитело против Axl человека 12A11, которое не реагирует перекрестно с Axl мыши, значительно ослабляло рост ксенотрансплантата опухоли A549 (Li et al., 2009), также оно усиливало эффект средства против VEGF, как показано на фиг. 8C. Это было ожидаемо, поскольку 12A11 прямо ингибирует рост опухолевых клеток и средство против VEGF воздействует на сосудистую сеть опухоли.
YW327.6S2 подавляет экспрессию рецептора и индуцирует апоптоз опухолевых клеток A549. Чтобы начать понимать механизмы, которые опосредуют эффект YW327.6S2 в отношении снижения роста опухоли, авторы настоящего изобретения провели фармакодинамическое исследование. Мышам, имеющим опухоль A549, вводили YW327.6S2 и опухоли вырезали через 0, 24, 72 и 168 ч после дозирования. Вестерн-блот-анализ лизатов опухоли показал, что экспрессия Axl подавлялась через 24 ч после введения антитела и продолжалась в течение 168 ч (фиг. 8D), указывая на то, что эффект YW327.6S2 против роста опухоли частично опосредуется подавлением экспрессии Axl.
Для определения того, имеет ли YW327.6S2 прямой эффект на пролиферацию и апоптоз опухолевых клеток, ксенотрансплантированные опухоли A549 после введения контроля или YW327.6S2 в течение двух недель, вырезали и проводили IHC на расщепленную каспазу 3 (CC3) и на Ki67. Опухоли, в случае которых вводили YW327.6S2, проявляли увеличенную CC3 по сравнению с контролем (фиг. 8E), указывая на то, что YW327.6S2 индуцирует апоптоз опухолевых клеток. Не было значимых отличий в положительных по Ki67 ядрах между опухолями после введения контроля и YW327.6S2, указывая на то, что YW327.6S2 не влияет прямо на пролиферацию опухолевых клеток.
Для исследования того, влияет ли YW327.6S2 на связанную с опухолью сосудистую сеть, авторы настоящего изобретения вводили мышам, имеющим опухоль A549, YW327.6S2 отдельно или в комбинации со средством против VEGF. Опухоли вырезали и окрашивали MECA32, общим эндотелиальным маркером, для исследования внутриопухолевой плотности сосудов. YW327.6S2 отдельно не снижал в значительной степени плотность сосудов по сравнению с контролем, однако комбинация со средством против VEGF приводила к значительному снижению плотности связанной с опухолью сосудистой сети (фиг. 8F). Напротив, 12A11 не имеет значительного эффекта на внутриопухолевую плотность сосудов само по себе или в комбинации со средством против VEGF.
YW327.6S2 усиливает эффект эрлотиниба и химиотерапии. Для исследования того, может ли YW327.6S2 усиливать терапевтический индекс стандартного лечения при NSCLC, авторы настоящего изобретения провели комбинированное введение YW327.6S2 с низкомолекулярным ингибитором (SMI) EGFR эрлотинибом и химиотерапией.
A549 содержит EGFR дикого типа и является только умеренно чувствительным к эрлотинибу (Yauch et al., 2005); таким образом, авторы настоящего изобретения исследовали, может ли mAb против Axl сенсибилизировать эти клетки к SMI EGFR. YW327.6S2 и эрлотиниб при введении в качестве единственного средства приводили к 30% снижению роста опухоли, но в комбинации снижали скорость роста опухоли более чем на 50% (фиг. 9A), указывая на то, что mAb против Axl усиливает противоопухолевый эффект эрлотиниба.
Затем авторы настоящего изобретения исследовали, способно ли mAb против Axl увеличивать терапевтический индекс стандартной химиотерапии против NSCLC. Мышам, имеющим ксенотрансплантаты A549, проводили один курс химиотерапии, состоящий из паклитаксела (6,25 мг/кг/сутки, 5 суток) и карбоплатина (100 мг/кг, одна доза), вводимых в начале лечения (0 сутки, фиг. 9B), Химиотерапия отдельно имеет сходный эффект на рост опухоли с YW327.6S2, вводимым отдельно, и комбинация этих двух способов лечения приводила к усиленному ингибированию роста опухоли (фиг. 9B).
YW327.6S2 снижает плотность сосудов и ингибирует секрецию воспалительных цитокинов из связанных с опухолью макрофагов в модели с ксенотрансплантатом рака молочной железы MDA-MB-231. Поскольку нокдаун Axl с помощью кшРНК (shRNA) имеет только умеренный эффект на рост опухоли ксенотрансплантата MDA-MB-231 (Li et al., 2009), авторы настоящего изобретения задались вопросом, является ли YW327.6S2 эффективным в этой модели. YW327.6S2 отдельно было способно снижать рост опухоли (25%) и имело сходный эффект со средством против VEGF, использованным в качестве единственного средства в этой модели (фиг. 10A). Комбинированная терапия приводит к 50% снижению роста опухоли, что указывает на то, что YW327.6S2 усиливает эффект средства против VEGF (фиг. 10A). Напротив, гибридомное антитело против Axl 12A11 (Li et al., 2009), которое не реагирует перекрестно с Axl мыши, не имело значительного эффекта на рост опухоли в качестве единственного средства в этой модели, также как не влияет средство против VEGF (фиг. 10B). Вестерн-блот-анализ показал, что как YW327.6S2, так и 12A11, подавляют экспрессию Axl в опухолях (фиг. 10C и D). Эти результаты указывают на то, что противоопухолевый эффект YW327.6S2 может быть опосредован модулированием стромальных функций опухоли.
Для дальнейшего исследования того, как YW327.6S2 может модулировать стромальные функции опухоли, авторы настоящего изобретения проводили введение мышам, имеющим опухоль MDA-MB-231, YW327.6S2 отдельно или в комбинации со средством против VEGF. В различные моменты времени после введения антител опухоли вырезали и окрашивали с помощью MECA32 для исследования внутриопухолевой плотности сосудов. Как YW327.6S2, так и средство против VEGF значительно снижали плотность сосудов по сравнению с контролем (фиг. 10E). Кроме того, комбинация двух антител приводила к дальнейшему снижению связанной с опухолью плотности сосудов. Эти результаты указывают на то, что YW327.6S2 снижает рост опухоли MDA-MB-231, частично путем изменения сосудистых функций.
В образцах первичного рака молочной железы человека авторы настоящего изобретения обнаружили, что белок Axl в высокой степени экспрессируется в инфильтрирующих макрофагах (фиг. 10F) и, таким образом, задались вопросом, может ли mAb против Axl YW327.6S2 влиять на функции связанных с опухолью макрофагов (TAM). При ксенотрансплантированных опухолях MDA-MB-231 проводили введение в течение одной недели YW327.6S2, 12A11 или контрольным антителом, и TAM выделяли сортировкой на положительные по F4/80 клетки. Клетки культивировали в бессывороточной среде в течение ночи и супернатант собирали и анализировали в отношении присутствия различных цитокинов и хемокинов. TAM из опухолей после введения YW327.6S2 и 12A11 продуцировали значительно более низкие уровни воспалительных цитокинов и хемокинов по сравнению с TAM после введения контрольного антитела (фиг. 10G). Введение любого из mAb против Axl не влияло на уровни экспрессии Axl на TAM (данные не представлены) в противоположность подавлению этими антителами экспрессии Axl на опухолевых клетках (фиг. 10C и D). Эти результаты указывают на то, что mAb против Axl, наиболее вероятно, модулируют секрецию воспалительных цитокинов/хемокинов из TAM непрямым образом, возможно путем блокирования взаимодействия между опухолевыми и стромальными клетками.
YW327.6S2 снижает метастазирование клеток рака молочной железы MDA-MB-231 в кость. В предшествующем исследовании авторы настоящего изобретения показали, что нокдаун Axl с помощью кшРНК (shRNA) ингибирует метастазирование клеток рака молочной железы MDA-MB-231 в легкое в ортотопной модели (Li et al., 2009), таким образом, авторы настоящего изобретения тестировали, влияет ли YW327.6S2 на метастазирование этих клеток. Клетки MDA-MB-231, стабильно экспрессирующие репортерный ген люциферазы (20), инъецировали через хвостовую вену мышам SCID. Через четыре недели после инъекции сильные люминесцентные сигналы были выявлены в черепно-лицевой области, малой берцовой кости и бедренной кости всех пяти животных в группе введения контрольного антитела. Количество областей, выявленных в контрольных группах, составляет 5, 5, 4, 3 и 1 у каждого из животных, всего 18 (фиг. 11A). У мышей, которым вводили YW327.6S2, количество областей, выявленных с помощью биолюминесценции, было значительно снижено, с 0, 1, 2, 3 и 1 областями у каждого из животных и всего 7 для всей группы (фиг. 11A). Присутствие метастатических очагов в кости подтверждали гистологическим анализом (фиг. 11B). Эти результаты указывают на то, что YW327.6S2 способно снижать метастазирование клеток рака молочной железы MDA-MB-231 в отдаленные органы.
Обсуждение
Авторы настоящего изобретения разработали и охарактеризовали моноклональное антитело человека против Axl (YW327.6S2), которое проявляет перекрестную реактивность между видами и блокирует различные функции Axl при образовании опухоли. Помимо того, что оно является первым описанным полностью гуманизированным блокирующим антителом против Axl, YW327.6S2 не только служит в качестве мощного инструмента для устранения влияния активации/передачи сигнала Axl во множестве аспектов развития и прогрессирования злокачественной опухоли, но также имеет терапевтический потенциал для лечения различных злокачественных опухолей.
Результаты, полученные авторами настоящего изобретения, демонстрируют, что YW327.6S2 блокирует функции Axl путем подавления экспрессии Axl, а также ингибирования связывания лиганда Gas6 с рецептором, что приводит к инактивации Axl и его последующей передачи сигнала (фиг. 7). Способность YW327.6S2 подавлять экспрессию Axl в злокачественных клетках представляет собой важный механизм для его ингибиторных эффектов, поскольку многие злокачественные опухоли экспрессируют конститутивно активированный Axl и более не отвечают на экзогенный Gas6 (Li et al., 2009).
В модели NSCLC A549 YW327.6S2 значительно ослабляло рост опухоли при введении в качестве единственного средства (фиг. 8A). Этот ингибиторный эффект сравним с эффектом гибридомных антител против Axl в этой модели (Li et al (2009); фиг. 8C). YW327.6S2 быстро подавляет экспрессию Axl в ксенотрансплантатах (фиг. 8D) и индуцирует апоптоз опухолевых клеток (фиг. 8E), что, вероятно, является одним из механизмов, который опосредует его ингибиторный эффект на рост опухоли. Предшествующие открытия авторов настоящего изобретения, что Axl модулирует функции эндотелиальных клеток путем регуляции каскадов DKK3 и ангиопоэтин/Tie2 (Li et al., 2009) указали на возможность того, что mAb против Axl может усилить эффект средств против VEGF в отношении снижения роста опухоли. Результаты авторов настоящего изобретения (фиг. 8A и F) согласуются с этой гипотизой, в том, что YW327.6S2 воздействует на сосудистую сеть опухоли путем усиления эффекта средства против VEGF, снижая внутриопухолевую плотность сосудов. Действительно, совместное введение YW327.6S2 и средства против VEGF в модели A549 приводило к остановке роста опухоли, которая поддерживалась в течение по меньшей мере 4 недель после прекращения введения (фиг. 8B). Гибридомное антитело 12A11 также усиливает противоопухолевый эффект средства против VEGF в этой модели (фиг. 8C). Однако в отличие от YW327.6S2, 12A11 не имеет прямого эффекта на сосудистую сеть опухоли; вместо этого, оно непосредственно ингибирует пролиферацию опухолевых клеток и индуцирует апоптоз (Li et al., 2009). Эффект 12A11 на рост опухоли и средства против VEGF на сосудистую сеть обеспечил увеличение эффекта, когда эти два средства использовали вместе.
Низкомолекулярные ингибиторы EGFR, такие как эрлотиниб, эффективные при лечении опухолей NSCLC, которые имеют мутации или амплификацию EGFR (Lynch et al., 2004; Paez et al., 2004; Eberhard et al., 2005; Giaccone et al., 2005; Tsao et al., 2005). Также известно, что обработка клеток рака молочной железы низкомолекулярным ингибитором Her2/EGFR лапатинибом или антителом против Her2 герцептином приводит к индукции экспрессии Axl и, следовательно, приводит к устойчивости злокачественных клеток к этим лекарственным средствам (Liu et al., 2009). Авторы настоящего изобретения недавно открыли, что экспрессия Axl индуцируется в клетках NSCLC HCC827 (клеточная линия, которая имеет как мутацию, так и амплификацию EGFR), которые имеют приобретенную устойчивость к эрлотинибу, и нокдаун Axl в устойчивых клетках восстанавливает их чувствительность к эрлотинибу, что указывает на то, что Axl может играть роль в устойчивости к эрлотинибу в NSCLC. Поскольку клетки A549 содержат EGFR дикого типа и являются только умеренно чувствительными к ингибированию EGFR in vitro (Yauch et al., 2005), авторы настоящего изобретения задались вопросом, может ли mAb против Axl сенсибилизировать эти клетки к эрлотинибу. Результаты авторов настоящего изобретения показали, что YW327.6S2 усиливает эффект эрлотиниба в отношении снижения роста опухоли (фиг. 9A), что указывает на то, что mAb против Axl может увеличивать эффективность ингибиторов EGFR в опухолях, которые являются устойчивыми к ингибированию EGFR отдельно, возможно путем прямого снижения экспрессии Axl в опухолевых клетках.
Системная химиотерапия играет наибольшую роль в моделях лечения NSCLC. Для рецидивирующего или развернутого заболевания, пациенты, которые получали лечение химиотерапией, которая состоит из карбоплатина/паклитаксела, имеют уровень ответа 15% и среднюю выживаемость 10,3 месяцев (Sandley et al., 2006). Результаты авторов настоящего изобретения в модели NSCLC A549 показали, что YW327.6S2 способно усиливать противоопухолевую эффективность карбоплатина/паклитаксела (фиг. 9B), что указывает на то, что блокирование функций Axl может увеличивать терапевтический индекс химиотерапии при этом заболевании. Результаты авторов настоящего изобретения согласуются с недавним отчетом, демонстрирующим, что низкомолекулярный ингибитор Axl действует синергично с цисплатином, подавляя метастазирование в печени в ортотопной модели рака молочной железы 4T1 (Holland et al., 2010).
В модели рака молочной железы MDA-MB-231, YW327.6S2 отдельно способно значительно снижать рост опухоли (фиг. 10A). Гибридомное антитело против Axl, которое не реагирует перекрестно с Axl мыши и, таким образом, воздействует только на опухолевые клетки, не оказывает значительного эффекта на рост опухоли в этой модели (фиг. 10B). Эти результаты указывают на то, что YW327.6S2 вероятно оказывает его противоопухолевый эффект путем воздействия на строму опухоли. Результаты авторов настоящего изобретения демонстрируют, что YW327.6S2 снижает внутриопухолевую плотность сосудов (фиг. 10E) и усиливает эффект средства против VEGF. Посредством его эффекта на сосудистую сеть опухоли YW327.6S2 может влиять на рост опухоли.
Ассоциация между развитием злокачественной опухоли и воспалением давно признана (Balkwill & Mantovani, 2001; Coussens & Werb, 2002). Хроническое воспаление, связанное с инфекцией и раздражением, может приводить к окружающим условиям, которые способствуют геномным повреждениям и возникновению опухоли. Существуют накапливающиеся данные, что TAM играют этиологические роли в прогрессировании опухоли, включая стимуляцию ангиогенеза и ремоделирование матрикса (Balkwill et al., 2005; Pollard, 2004). Полагают, что сигналами, ответственными за это, являются воспалительные цитокины, включая фактор некроза опухоли-α (TNF-α), интерлейкин-6 (IL-6) и множество хемокинов. Эти цитокины и хемокины не только привлекают в конкретные области иммунные клетки, которые стимулируют прогрессирование опухоли, однако также было показано, что их рецепторы экспрессируются на опухолевых клетках, где они могут увеличивать рост и миграцию опухоли (Haghnegahdar et al., 2000). При первичном раке молочной железы человека белок Axl экспрессируется на высоких уровнях на связанных с опухолью макрофагах (TAM) (фиг. 10F). Авторы настоящего изобретения в настоящем описании представили доказательство, что mAb против Axl могут модулировать функции этих клеток через непрямой механизм. Данные авторов настоящего изобретения показали, что введение в случае ксенотрансплантатов MDA-MB-231 либо YW327.6S2, либо 12A11 (которое не реагирует перекрестно с Axl мыши и, таким образом, не должно иметь прямой эффект на TAM) ингибирует секрецию воспалительных цитокинов и хемокинов из TAM (фиг. 10G). Поскольку оказалось, что mAb против Axl не имеют значительного эффекта на экспрессию Axl на TAM, а подавляют экспрессию рецептора на опухолевых клетках, вероятно, что mAb против Axl модулируют секрецию цитокинов/хемокинов из TAM путем блокирования взаимодействия между опухолью и стромальными клетками. Эти результаты согласуются с недавними сообщениями о том, что опухолевые клетки могут стимулировать их рост путем обучения инфильтрирующих лейкоцитов индукции экспрессии Gas6 (Loges et al., 2010); и низкомолекулярный ингибитор Axl снижал экспрессию GM-CSF в клетках опухоли молочной железы 4T1 (Holland et al., 2010).
В предшествующих исследованиях была установлена роль Axl в стимуляции миграции, инвазии и метастазирования опухолевых клеток (Zhang et al., 2008; Li et al., 2009; Tai et al., 2008; Vajkoczy et al., 2006; Gjerdrum et al., 2010). В настоящем описании авторы настоящего изобретения показали, что YW327.6S2 способно снижать метастазирование клеток рака молочной железы MDA-MB-231 в кость. Эти результаты согласуются с предшествующими данными авторов настоящего изобретения, что подавление Axl посредством РНК-I (RNAi) в клетках рака молочной железы ингибирует их метастазирование в легкое в ортотропной модели (Li et al., 2009; Gjerdrum et al., 2010), указывая на то, что это антитело против Axl может иметь терапевтический потенциал не только при лечении опухоли, но также при метастазирующем заболевании.
В заключение, авторы настоящего изобретения разработали моноклональное антитело человека, которое блокирует функции Axl. Это mAb против Axl оказывает его противоопухолевый эффект через множество механизмов, включающих индукцию апоптоза опухолевых клеток, регуляцию ангиогенеза и модулирование функций связанных с опухолью иммунных клеток. Кроме того, это mAb против Axl увеличивает противоопухолевую эффективность средства против VEGF, SMI EGFR, а также химиотерапии, и, таким образом, может представлять собой новый терапевтический подход в клинических условиях, где эти способы лечения являются стандартами.
Неполный список ссылок





Хотя представленное выше изобретения до некоторой степени подробно описано в качестве иллюстрации и примеров для ясности понимания, описание и примеры не следует истолковывать, как ограничивающие объем изобретения. Содержание всех патентных и научных литературных источников, цитированных в настоящем описании, включено в настоящее описание в качестве ссылки в полном объеме.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-LRP6 АНТИТЕЛА | 2011 |
|
RU2587625C2 |
| АНТИТЕЛА ПРОТИВ BV8 И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2559542C2 |
| АНТИТЕЛА ПРОТИВ НЕЙРОПИЛИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2571226C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА И АНТИТЕЛА С СОЗРЕВШЕЙ АФФИННОСТЬЮ ПРОТИВ FcRH5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2748943C2 |
| ЛЕЧЕНИЕ ВИРУСА ГРИППА А H7N9 | 2015 |
|
RU2682049C2 |
| АНТИТЕЛА К JAGGED И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2666990C2 |
| АНТИТЕЛА К PD1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2746409C1 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| АНТИТЕЛА ПРОТИВ FGFR3 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2568066C2 |
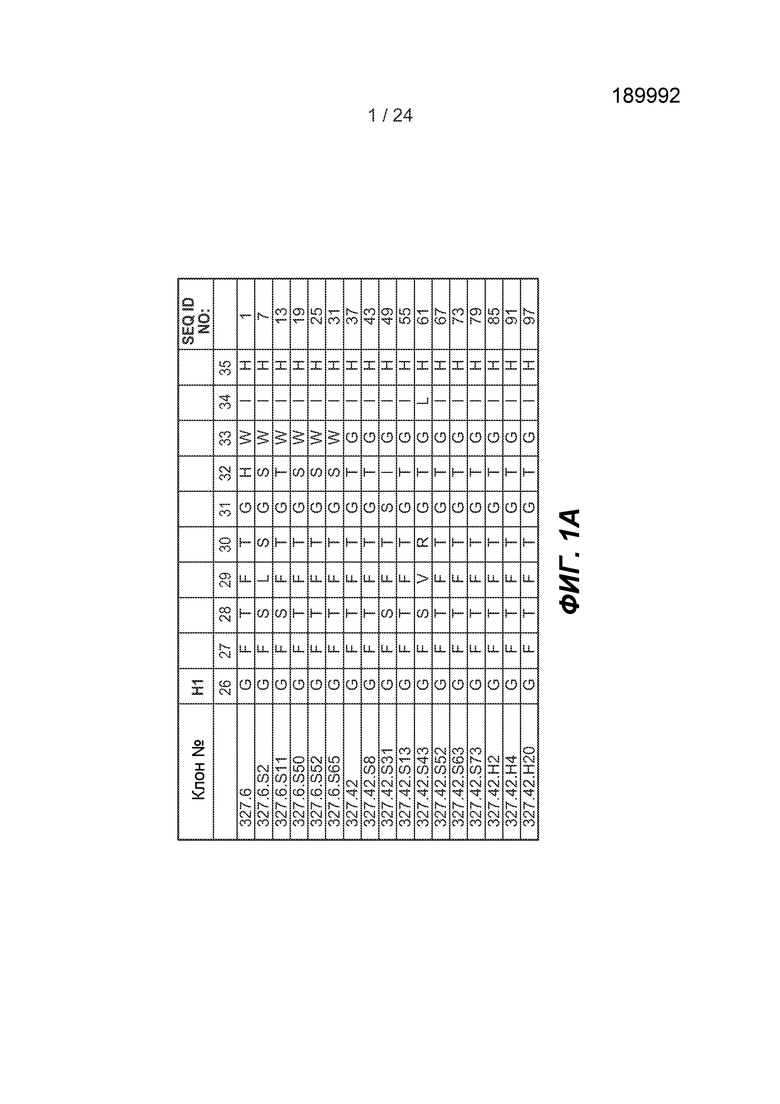


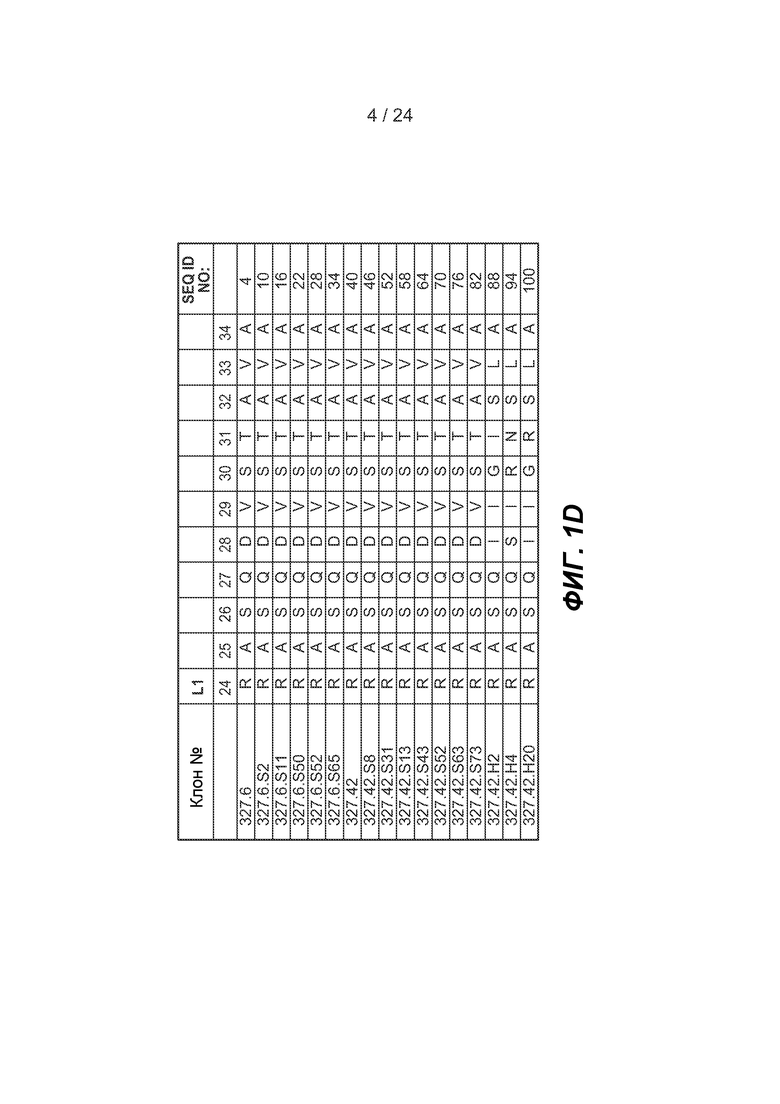
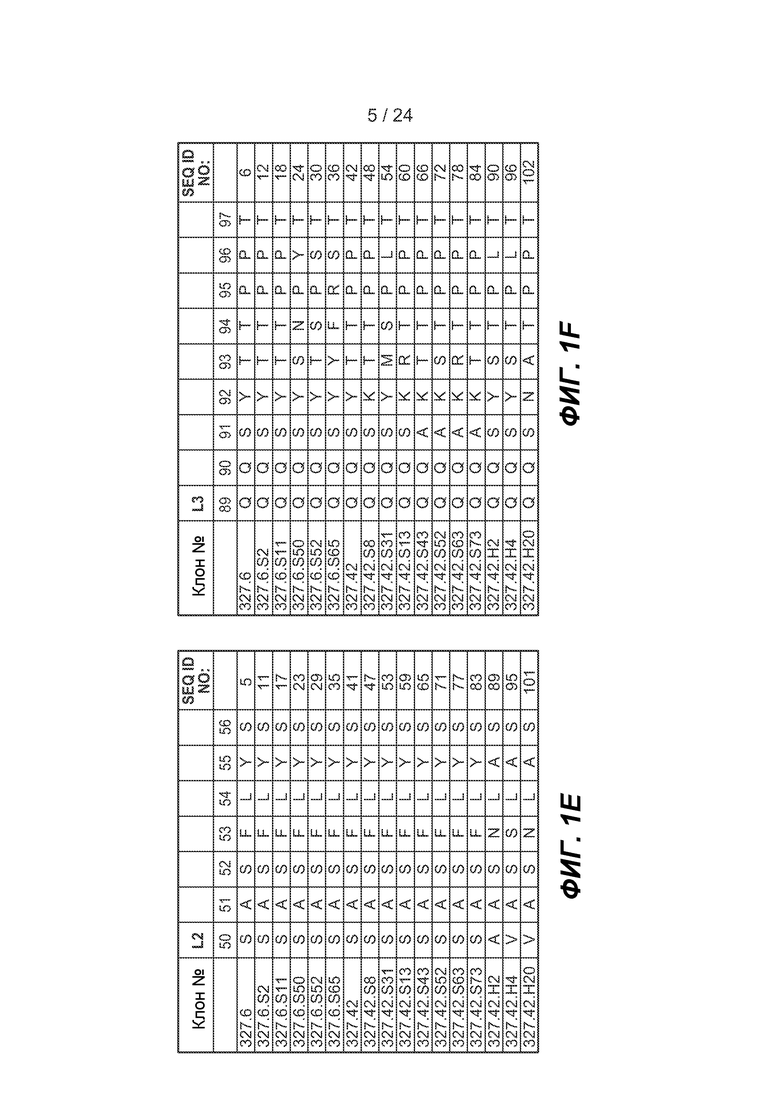


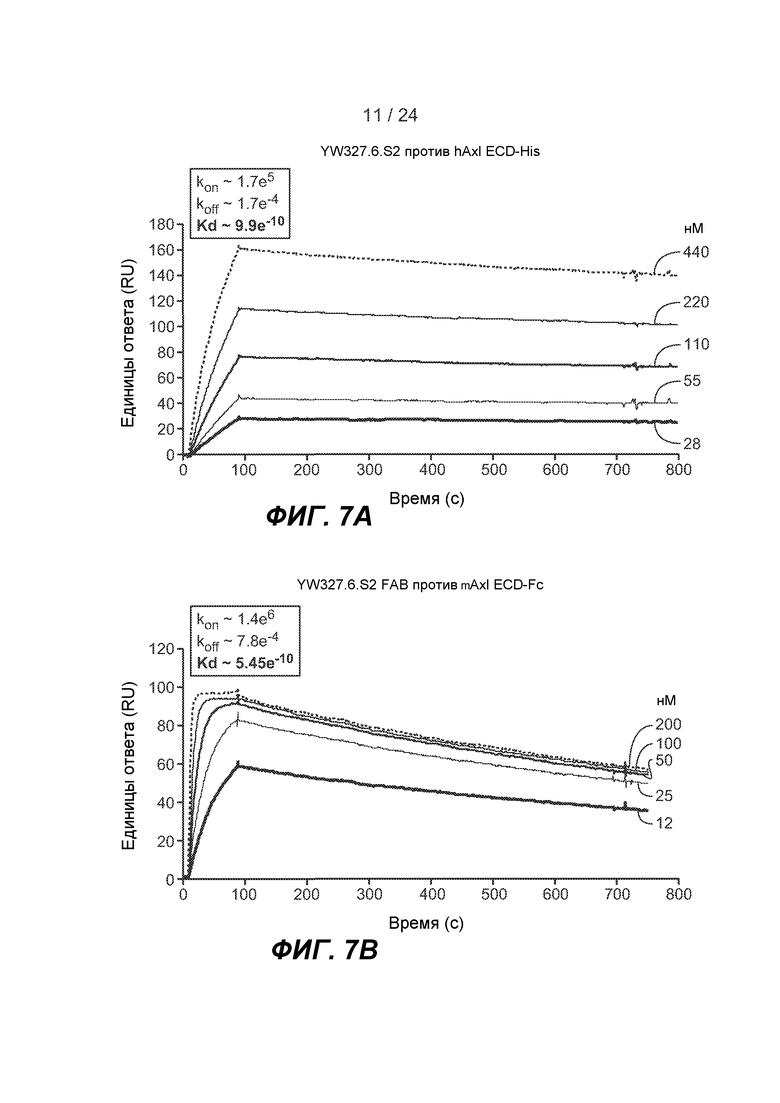
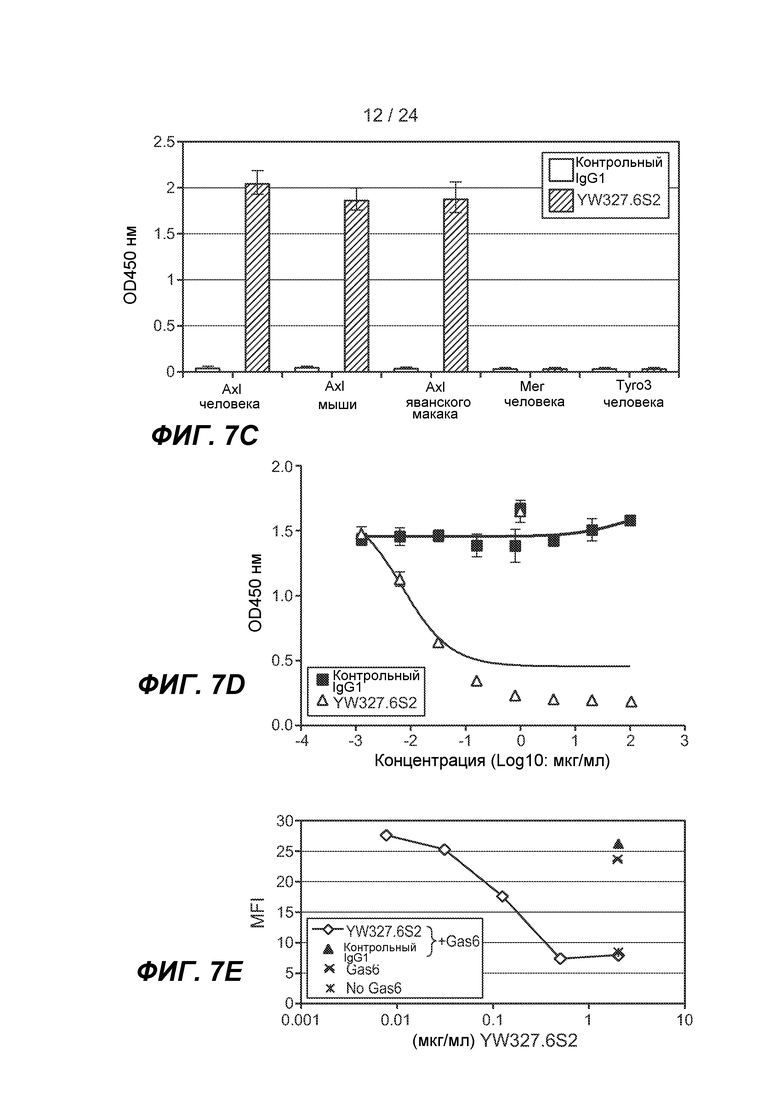
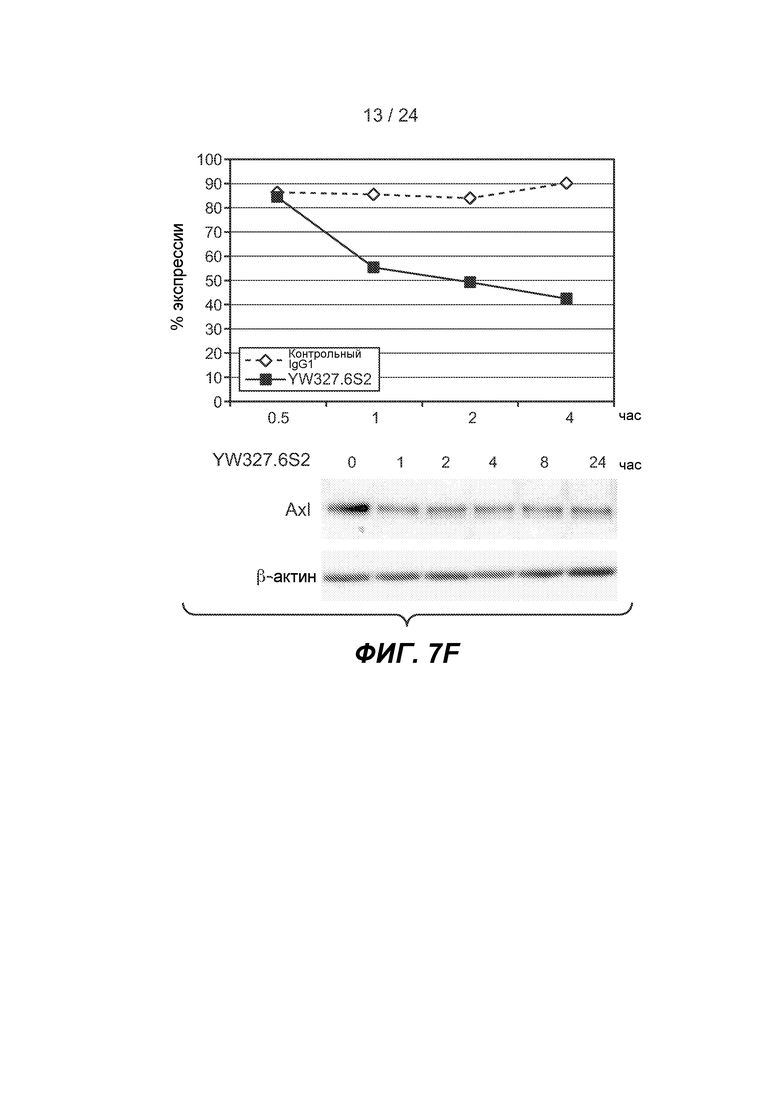
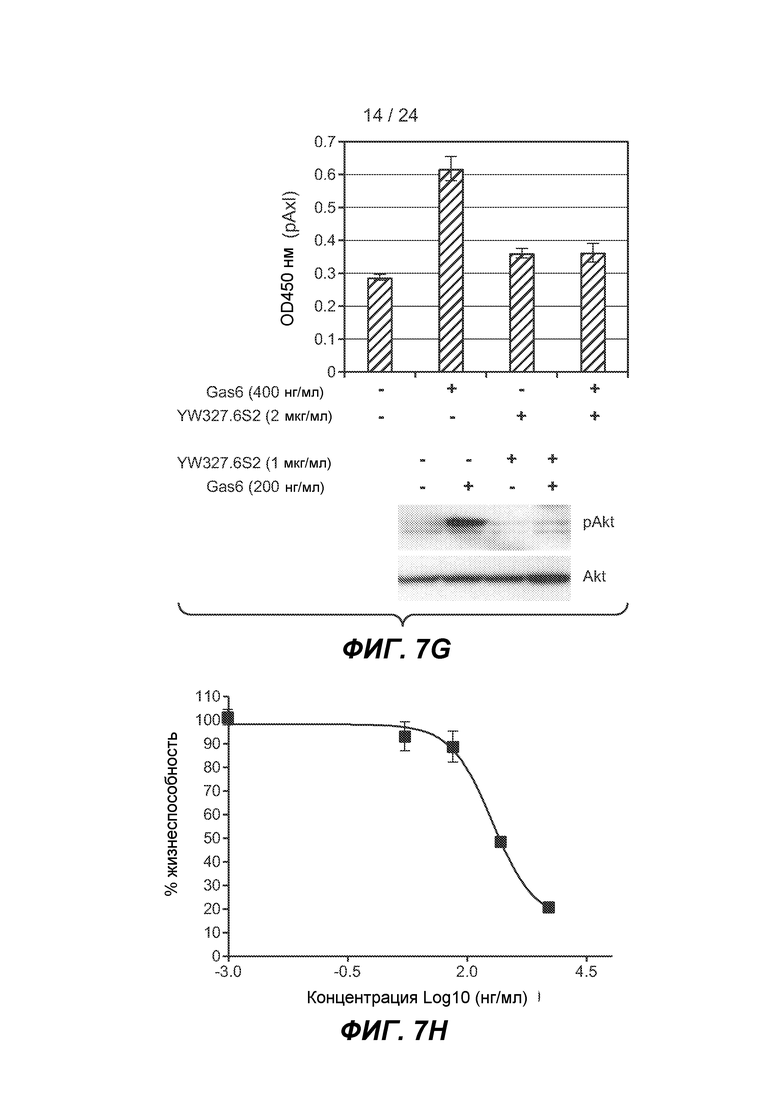
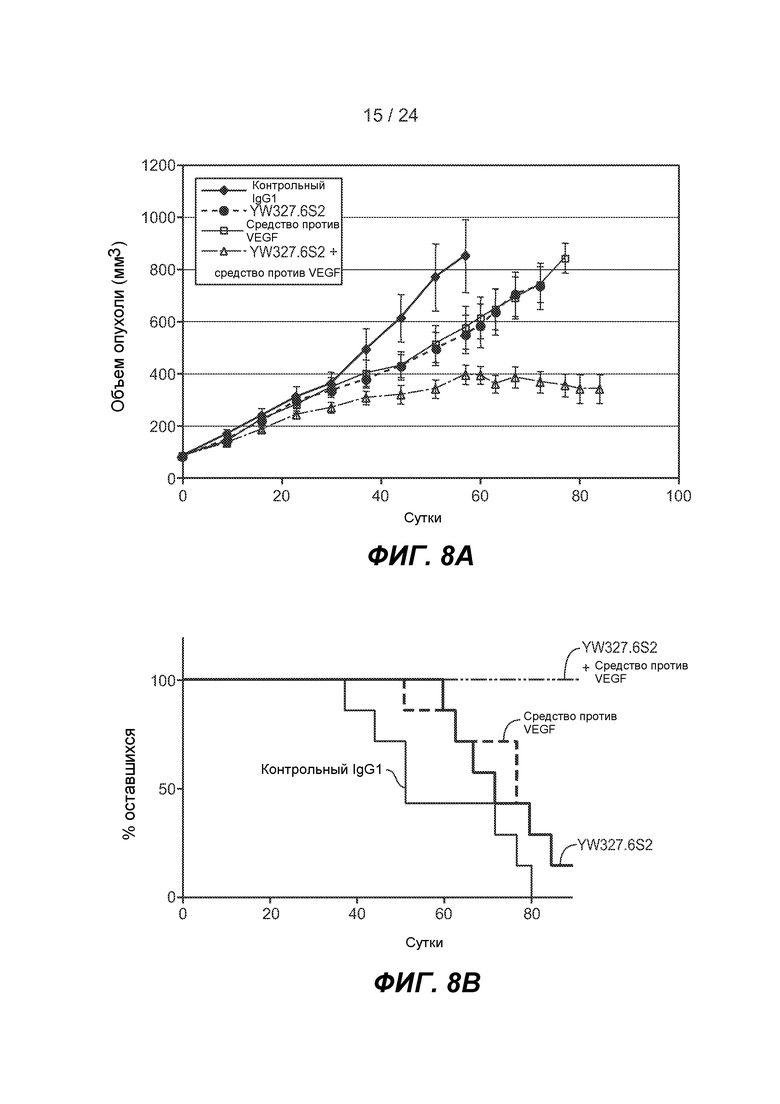
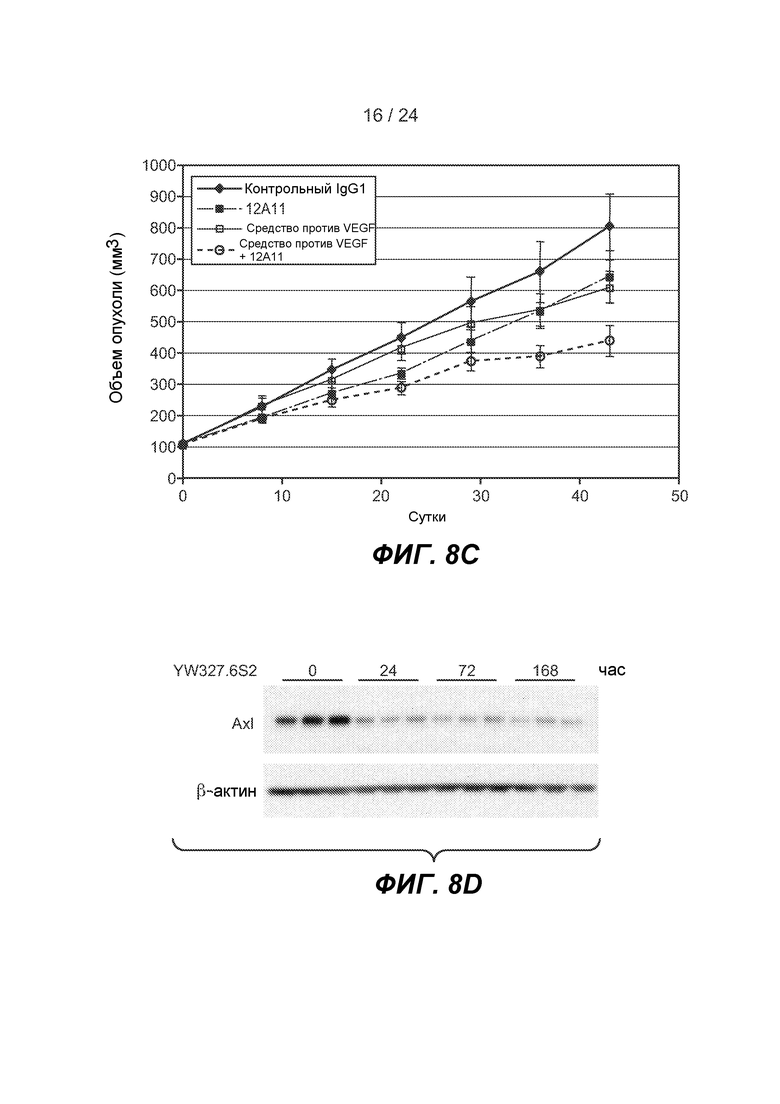
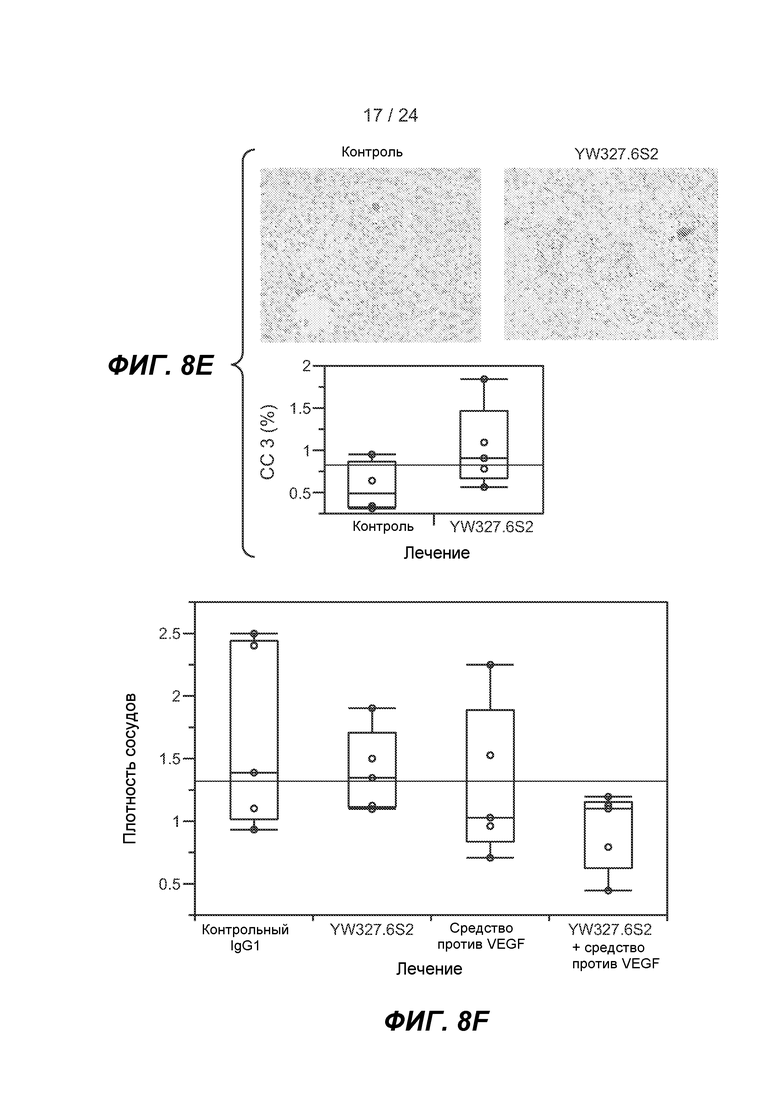
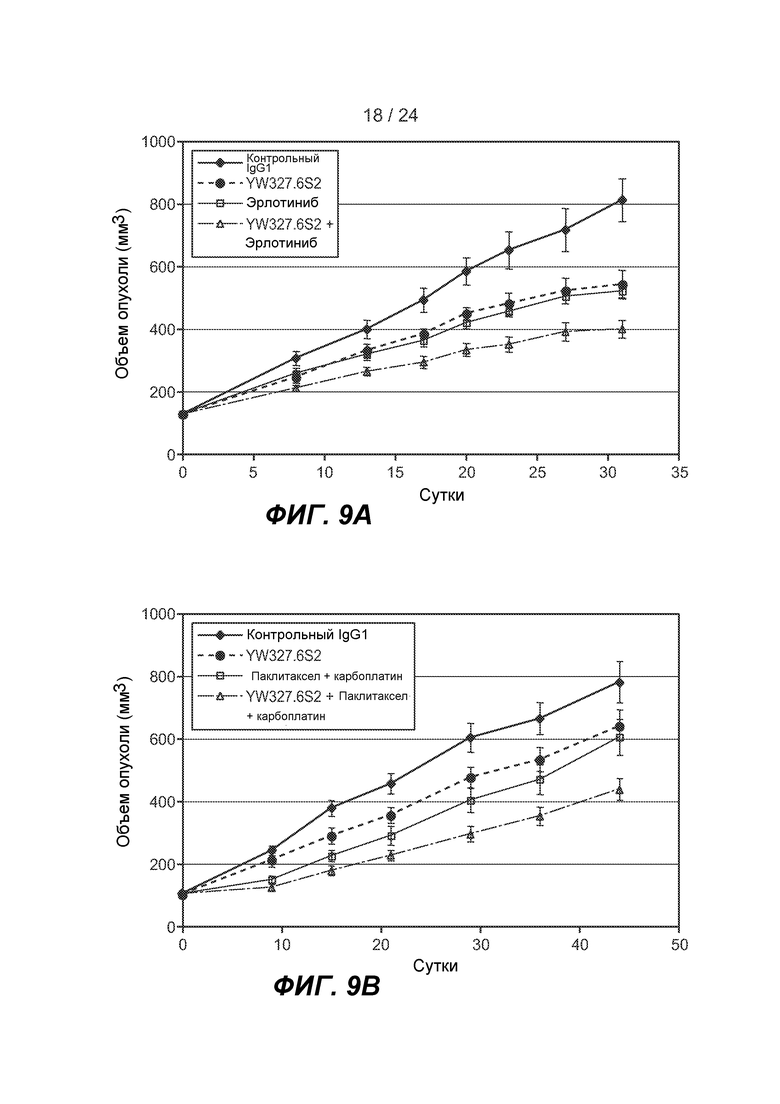
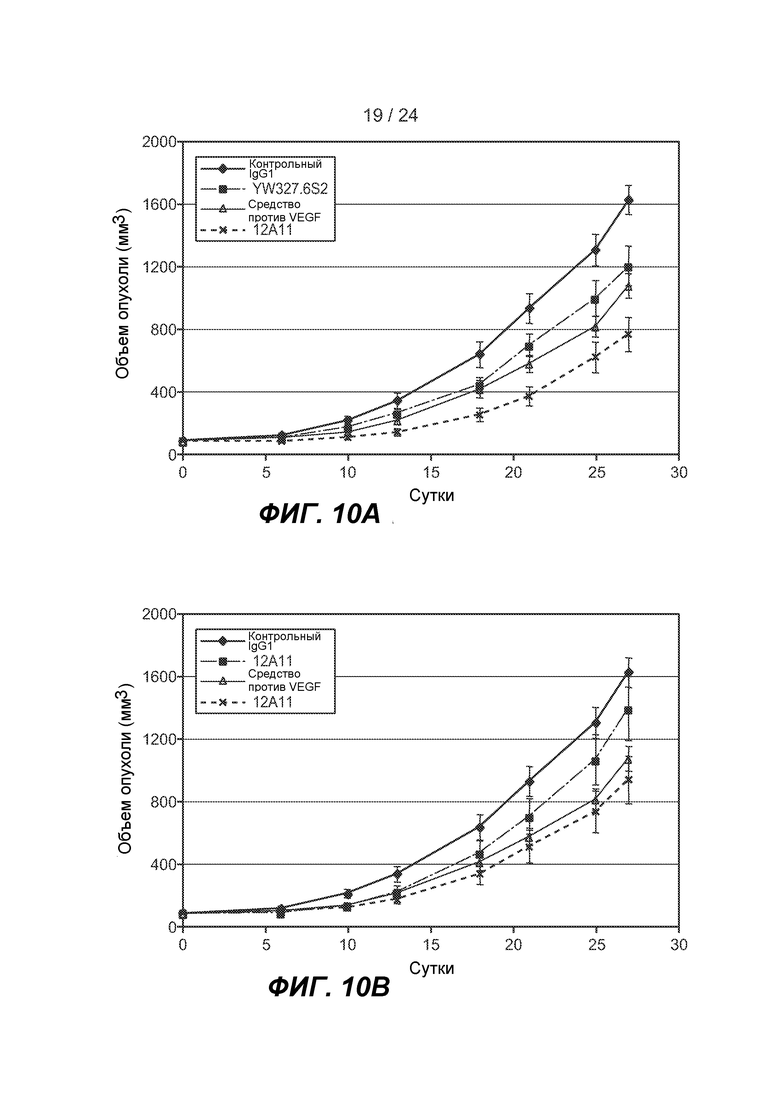
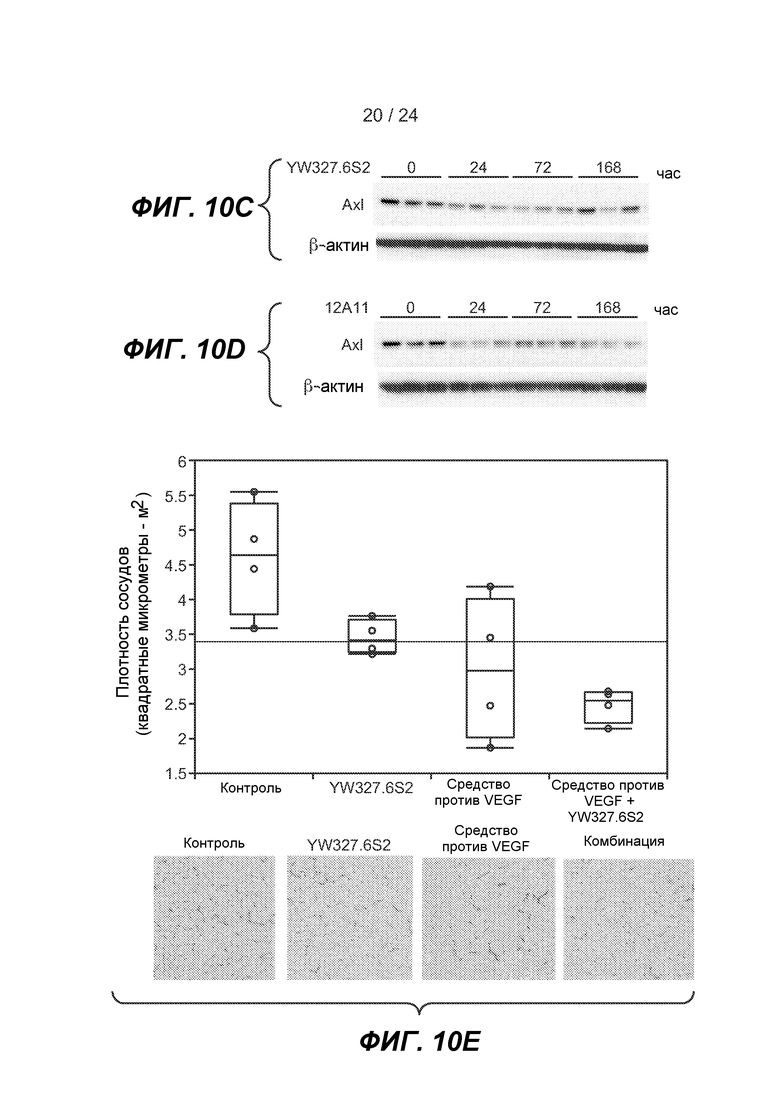

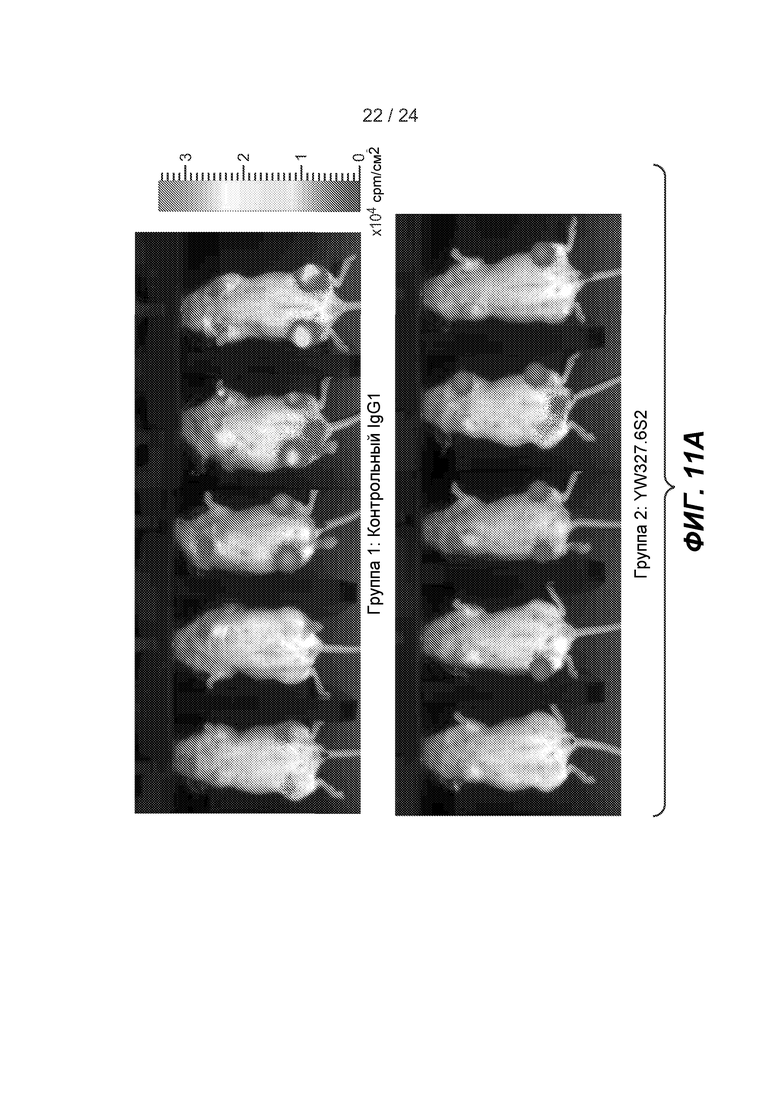
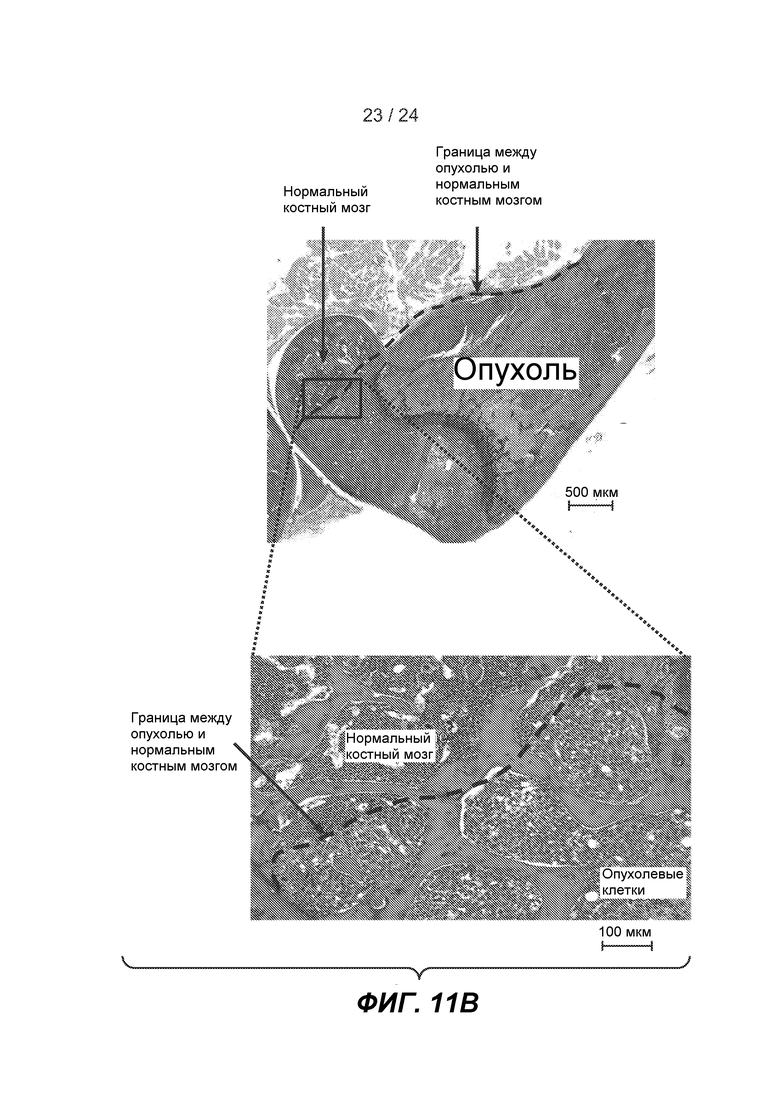


























































Данное изобретение относится к области иммунологии. Предложено выделенное антитело или его фрагмент, которые связываются с Axl человека и охарактеризованные последовательностями гипервариабельных участков (CDR). Также рассмотрены: нуклеиновая кислота; клетка-хозяин и способ получения антитела или его фрагмента по изобретению. Кроме того, представлены: иммуноконъюгат, содержащий антитело или его фрагмент по изобретению и цитотоксическое средство; фармацевтический состав для нацеливания на патологические состояния, связанные с экспрессией и/или активностью каскадов передачи сигнала Axl; и применение антитела или его фрагмента по изобретению для получения лекарственных средств для лечения злокачественной опухоли и для ингибирования конститутивной активации Axl. Настоящее изобретение может найти дальнейшее применение в терапии заболеваний, связанных с Axl. 8 н. и 10 з.п. ф-лы, 12 ил., 1 табл.
1. Выделенное антитело или его фрагмент, которые связываются с Axl человека, где антитело или его фрагмент содержат:
(a) HVR-H1 с аминокислотной последовательностью SEQ ID NO: 7,
(b) HVR-H2 с аминокислотной последовательностью SEQ ID NO: 8 и
(c) HVR-H3 с аминокислотной последовательностью SEQ ID NO: 9,
дополнительно содержащее
(a) HVR-L1 с аминокислотной последовательностью SEQ ID NO: 10;
(b) HVR-L2 с аминокислотной последовательностью SEQ ID NO: 11; и
(c) HVR-L3 с аминокислотной последовательностью SEQ ID NO: 12.
2. Антитело или его фрагмент по п.1, содержащие VH с последовательностью SEQ ID NO: 103 и/или VL с последовательностью SEQ ID NO: 104.
3. Антитело или его фрагмент по любому из пп.1 и 2, которые стимулируют подавление рецептора Axl и/или ингибируют конститутивную активацию Axl.
4. Антитело или его фрагмент по любому из пп.1 и 2, которые связывают полипептид, содержащий, по существу состоящий или состоящий из нижеупомянутой аминокислотной последовательности SEQ ID NO: 111.
5. Антитело или его фрагмент по любому из пп.1 и 2, где антитело представляет собой моноклональное антитело.
6. Антитело или его фрагмент по любому из пп.1 и 2, где антитело представляет собой полноразмерное антитело IgG1.
7. Антитело или его фрагмент по любому из пп.1 и 2, где антитело представляет собой антитело человека, гуманизированное антитело или химерное антитело.
8. Выделенная нуклеиновая кислота, кодирующая антитело или его фрагмент по любому из пп.1 и 2.
9. Клетка-хозяин, содержащая нуклеиновую кислоту по п.8, продуцирующая антитело или его фрагмент по любому из пп.1 и 2.
10. Способ получения антитела или его фрагмента, включающий культивирование клетки-хозяина по п.9, так чтобы продуцировалось антитело или его фрагмент.
11. Способ по п.10, дополнительно включающий выделение антитела или его фрагмента из клетки-хозяина.
12. Иммуноконъюгат, содержащий антитело или его фрагмент по любому из пп.1 и 2 и цитотоксическое средство, где антитело или его фрагмент нацеливают цитотоксическое средство на Axl человека.
13. Фармацевтический состав для нацеливания на патологические состояния, связанные с экспрессией и/или активностью каскадов передачи сигнала Axl, где состав содержит эффективное количество антитела или его фрагмента по любому из пп.1 и 2 и фармацевтически приемлемый носитель.
14. Фармацевтический состав по п.13, дополнительно содержащий дополнительное лекарственное средство, где дополнительное лекарственное средство выбрано из антагониста VEGF, антагониста EGFR и химиотерапевтического средства.
15. Применение антитела или его фрагмент по любому из пп.1 и 2 для получения лекарственного средства для лечения злокачественной опухоли.
16. Применение по п.15, где злокачественная опухоль представляет собой немелкоклеточный рак легкого, рак молочной железы или метастазы в кость.
17. Применение по п.15, дополнительно предусматривающее дополнительное лекарственное средство, где дополнительное лекарственное средство выбрано из группы, состоящей из антагониста VEGF, антагониста EGFR и химиотерапевтического средства.
18. Применение антитела или его фрагмент по любому из пп.1 и 2 для получения лекарственного средства для ингибирования конститутивной активации Axl.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| LI Y | |||
| et al | |||
| "Axl as a potential therapeutic target in cancer: role of Axl in tumor growth, metastasis and angiogenesis", Oncogene, 2009, 28(39): 3442-3455 | |||
| O'BRYAN J.P | |||
| et al | |||
| "Axl, a transforming gene isolated from primary human myeloid leukemia cells, | |||
Авторы
Даты
2016-03-20—Публикация
2011-06-17—Подача