Настоящее изобретение относится к способу получения 1-формамидо-3,5-диметиладамантана, который является важным промежуточным продуктом для приготовления 1-амино-3,5-диметиладамантана, который применяется для лечения болезни Альцгеймера и который известен как средство под названием мемантин. Он продается в Европе (и во многих неевропейских странах) под торговыми наименованиями Axura® и Ebixa® и под названием Namenda® в США.
Получение 1-формамидо-3,5-диметиладамантана, исходя из 1-бром-3,5-диметиладамантана и формамида, уже известно как таковое.
1-Амино-3,5-диметиладамантан как вещество уже известен из патента DE 2 318 461 А1. Его применение для предотвращения и лечения церебральной ишемии описано в патенте ЕР 0 392 059 В1. Соответственно этому синтез 1-формамидо-3,5-диметиладамантана, который применяется для его производства, до сих пор проводится путем галогенирования 1,3-диметиладамантана и последующего формамидирования. После этого 1-формамидо-3,5-диметиладамантан гидролизуют до амина с помощью разбавленной соляной кислоты.
Однако, исходя из 1,3-диметиладамантана, этот способ синтеза требует проведения трех стадий синтеза, чтобы получить мемантин: галогенирования, формамидирования и кислотного гидролиза. Тем самым требуется использование токсичного элементарного хлора или брома в избытке; это обусловливает дополнительные затраты на утилизацию отходов и может вести к образованию нежелательных побочных продуктов.
Таким образом, задачей изобретения является разработка способа формамидирования 1,3-диметиладамантана, который является более простым и который может быть проведен с использованием менее ядовитых или дорогостоящих реагентов.
В международной патентной заявке WO 2006/010362 А1 уже был описан способ получения производных 3,5-замещенного 1-аминоадамантана, в котором производное 1,3-дизамещенного адамантана суспендируют в HNO3 и H2SO4, и которое реагирует с нитрилом после добавления олеума. Напротив, в способе согласно изобретению получение 1-формамидо-3,5-диметиладамантана проходит только в две реакционных стадии путем прямого формамидирования 1,3-диметиладамантана формамидом в концентрированных кислотах.
Предпочтительными являются 30-70%-ная, в особенности 65%-ная азотная кислота, и 90-100%-ная, однако в особенности 95-98%-ная серная кислота. Однако могут быть использованы также 85-100%-ная фосфорная кислота, перхлорная кислота, дисерная кислота или хлорсульфоновая кислота. В общем, реакция протекает при температурах от -40°С до 50°С, однако предпочтительно при 0°С. В способе согласно изобретению достигаются выходы главным образом 40-95%.
Названный способ не только характеризуется исключением использования галогенов, но и имеет также более преимущественный профиль примесей, поскольку он реализуется с высокими выходами и лишь с небольшим количеством побочных продуктов, и тем самым является нечувствительным даже к примесям в исходных материалах. Согласно данным метода газовой хроматографии-масс-спектрометрии (GC-MS) при формамидировании в качестве побочных продуктов могут быть обнаружены только непрореагировавшее исходное вещество, а также 3,5-диметиладамантан-1-ол.
Возможно даже получение исходного материала in situ из дешевых предшественников, так что желаемый конечный продукт может быть получен “one-pot” методом (т.е. в одной колбе без выделения промежуточных продуктов). Тем самым 1,3-диметиладамантан, который должен реагировать с формамидом, может быть получен in situ из углеводорода, имеющего эмпирическую формулу С12Н20, путем катионной перегруппировки при сравнимых реакционных условиях, которые также применимы для реакции формамидирования. Например, получают предшественники с помощью полного гидрирования аценафтена, аценафталина или димера метилциклопентадиена. Затем проводят формамидирование образованного диметиладамантана в кислотных условиях в том же самом реакционном сосуде.
Обработка полностью гидрированного димера метилциклопентадиена концентрированными кислотами позволяет получить исходный материал, то есть 1,3-диметиладамантан, in situ перед формамидированием согласно следующей схеме реакции:
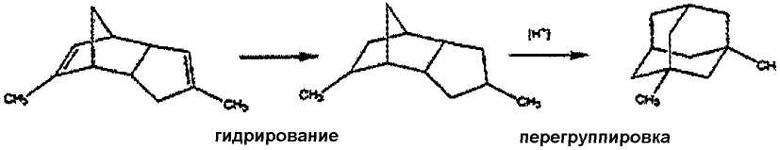
Способ, описанный в международной заявке PCT/DE2005/001304, основывается на генерировании в концентрированных кислотах карбокатионов, которые могут легко взаимодействовать с нуклеофилом, таким как нитрил, и которые превращаются в соответствующие производные 1-амидоадамантана при обработке водой согласно следующей схеме реакции:

Напротив, способ согласно изобретению для получения 1-формамидо-3,5-диметиладамантана позволяет применять более мягкие условия реакции с полным исключением употребления олеума или 100%-ной азотной кислоты. Далее, в качестве нуклеофила используется формамид, и тем самым в качестве реакционного продукта получается 1-формамидо-3,5-диметиладамантан, который может быть гидролизован при значительно более мягких условиях по сравнению с прочими амидами. Так, например, 1-ацетамидо-3,5-диметиладамантан расщепляется при нагревании с NaOH в течение нескольких часов в водной или спиртовой среде или в концентрированной соляной кислоте (36-37%) до свободного 1-амино-3,5-диметиладамантана, тогда как расщепление формамида успешно проходит уже в разбавленной соляной кислоте в течение двух часов при 100°С.
Изобретение конкретизируется следующими примерами.
Пример 1 - Синтез 1-формамидо-3,5-диметиладамантана
К 6,572 г (40 ммоль) 1,3-диметиладамантана при температуре 0°С последовательно добавляют 4 мл 65%-ной технической азотной кислоты и затем в течение трех часов 50 мл 98%-ной технической серной кислоты. Смесь перемешивают в течение ночи при температуре 0°С и затем выливают при температуре 0ºС в 100 мл формамида в круглодонной колбе, которая снабжена хлоркальциевой трубкой для предохранения от влаги воздуха. Эту смесь перемешивают в течение 30 минут при температуре 0°С и в течение 90 минут при комнатной температуре и добавляют 200 мл дихлорметана и 200 мл воды. После разделения фаз органическую фазу промывают водой и 2%-ным раствором NaHCO3, высушивают над Na2SO4 и упаривают на роторном испарителе для удаления растворителей. Маслообразный остаток очищают с помощью хроматографии (SiO2, CHCl3/ацетон, (20:1), Rf=0,39). Получают 7,41 г (89,3%) формамида в виде почти бесцветного твердого вещества.
1Н-ЯМР (CDCl3, тетраметилсилан, 400,13 MГц):δ=0,87 ч./млн, с, 6 H; 1,15 ч./млн, с, 2H; 1,2-1,35 ч./млн, м, 4 Н; 1,35-1,55 ч./млн, м, 4 H; 1,65-1,78 ч./млн, м, 2 H; 2,10-2,27 ч./млн, м, 1 H; 5,90 и 7,21 ч./млн; каждый уш. с, 1 Н; 8,02, 8,20 и 8,27 ч./млн; каждый с, 1 H.
13C-ЯМР (CDCl3, тетраметилсилан, 100,61 MГц):δ=29,46, 30,01, 32,00, 40,21, 41,85, 47,63, 49,94, 51,83, 160,15/162,24 ч./млн.
Масс-спектр; м/ц=207 (М+), 192, 150, 136, 106, 91, 79.
Пример 2 - Гидролиз 1-формамидо-3,5-диметиладамантана до гидрохлорида 1-амино-3,5-диметиладамантана (Мемантина)
Смесь 0,02 ммоль 1-формамидо-3,5-диметиладамантана (4,14 г) и 100 мл 15%-ной соляной кислоты кипятят с обратным холодильником в течение 24 часов. После охлаждения осадок отфильтровывают, растворяют его в метаноле и осаждают добавлением этилацетата (выход 80%).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕМАНТИНА И ПРОМЕЖУТОЧНОГО ПРОДУКТА | 2009 |
|
RU2478611C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДОВ АМИНОПРОИЗВОДНЫХ АДАМАНТАНА | 2010 |
|
RU2440971C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДОВ АМИНОВ АДАМАНТАНОВОГО РЯДА | 2013 |
|
RU2541545C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,5-ДИМЕТИЛАДАМАНТИЛ-1-АМИНА ИЛИ ЕГО СОЛЕЙ | 2005 |
|
RU2309940C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА 1-АМИНО-3,5-ДИМЕТИЛАДАМАНТАНА | 2002 |
|
RU2246482C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИМЕТИЛАДАМАНТАН-5-ОЛА | 2012 |
|
RU2510962C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЦЕТАМИДО-3,5-ДИМЕТИЛАДАМАНТАНА | 2011 |
|
RU2464257C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЦЕТАМИДО-3,5-ДИМЕТИЛАДАМАНТАНА | 2014 |
|
RU2574077C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИМЕТИЛАДАМАНТАНА | 2012 |
|
RU2504533C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ ПРОИЗВОДНЫХ АДАМАНТАНОВ | 2011 |
|
RU2476421C1 |
Изобретение относится к способу получения 1-амино-3,5-диметиладамантана, включающий взаимодействие 1,3-диметиладамантана с формамидом в концентрированных кислотах с получением 1-формамидо-3,5-диметиладамантана, при условии, что не используются ни SO3-содержащая серная кислота, ни 100%-ная азотная кислота, причем концентрированные кислоты представляют собой 30-70% азотную кислоту и 90-100% серную кислоту и дальнейшее превращение 1-формамидо-3,5-диметиладамантана в 1-амино-3,5-диметиладамантан посредством гидролиза с помощью водной соляной кислоты. 2 н. и 1 з.п. ф-лы, 2 пр.
1. Способ получения 1-формамидо-3,5-диметиладамантана прямым формамидированием 1,3-диметиладамантана, отличающийся тем, что названный 1,3-диметиладамантан реагирует с формамидом в концентрированных кислотах при условии, что не используются ни SO3-содержащая серная кислота, ни 100% азотная кислота, причем концентрированные кислоты представляют собой 30-70% азотную кислоту и 90-100% серную кислоту.
2. Способ получения 1-амино-3,5-диметиладамантана, включающий стадии (i) и (ii):
(i) взаимодействие 1,3-диметиладамантана с формамидом в концентрированных кислотах с получением 1-формамидо-3,5-диметиладамантана при условии, что не используются ни SO3-содержащая серная кислота, ни 100% азотная кислота, причем концентрированные кислоты представляют собой 30-70% азотную кислоту и 90-100% серную кислоту;
(ii) превращение 1-формамидо-3,5-диметиладамантана в 1-амино-3,5-диметиладамантан посредством гидролиза.
3. Способ по п.2, отличающийся тем, что гидролиз проводится с помощью водной соляной кислоты.
| Климочкин Ю.Н | |||
| и др | |||
| Синтез алкоксикарбониламино- и ацетиламинопроизводных адамантанового ряда в среде азотной кислоты | |||
| - М.: Наука, Известия Академии Наук СССР, №4, апрель 1988 г | |||
| Гидроприводной насос | 1988 |
|
SU1566075A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ получения 1-ацетаминоадамантана | 1988 |
|
SU1643528A1 |
| RU 2002135270 A, 10.07.2004. | |||
Авторы
Даты
2012-07-10—Публикация
2007-02-20—Подача