Описание изобретения
Настоящая заявка заявляет приоритет временной заявки на патент США № 60/904789, зарегистрированной 5 марта 2007 года.
Область техники, к которой относится изобретение
Настоящее изобретение относится к экстрактам из бактериальных штаммов, пригодным для использования в качестве лечения для таких показаний, как респираторные расстройства, к композициям, содержащим экстракты, и к способам получения экстрактов с использованием сред, которые не вызывают риска появления прионного заболевания.
Уровень техники и сущность изобретения
Настоящее изобретение относится к композициям, содержащим бактериальные экстракты, пригодные для использования при лечении медицинских состояний, таких как респираторные расстройства. Экстракты могут содержать бактериальные лизаты культур, выбранных из следующих видов:
Moraxella (Branhamella) catarrhalis, Moraxella (Moraxella) catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, Staphylococcus Hemolyticus, Enterococcus faecalis, Streptococcus mutans, Streptococcus anginosus, Streptococcus mitis, Streptococcus salivarius (aka. Streptococcus viridans), Neisseria sicca, Hemophilus parainfluenzae, Actinobacillus (Hemophilus) actinomycetemcomitans и Eikenella corrodens.
В некоторых вариантах осуществления экстракты содержат, по меньшей мере, один штамм из каждого из упоминаемого выше видов бактерий, в то время как в других вариантах осуществления один или более конкретных штаммов из тех, которые перечислены выше, могут удаляться или замещаться одним или более различными штаммами. Некоторые варианты осуществления настоящего изобретения содержат экстракт, полученный из каждого из следующих бактериальных штаммов: Moraxella (Branhamella) catarrhalis 3622, Moraxella (Branhamella) catarrhalis 3625, Moraxella (Branhamella) catarrhalis I-045, Haemophilus influenzae 8467, Klebsiella pneumoniae ssp., ozaenae 5050, Klebsiella pneumoniae 204, Klebsiella pneumoniae 5056, Staphylococcus aureus I-049, Staphylococcus aureus I-050, Staphylococcus aureus I-051, Staphylococcus aureus I-052, Staphylococcus aureus I-053, Staphylococcus aureus I-054, Streptococcus (Diplococcus) pneumoniae 7465, Streptococcus (Diplococcus) pneumoniae 7466, Streptococcus (Diplococcus) pneumoniae 7978, Streptococcus (Diplococcus) pneumoniae 10319, Streptococcus pyogenes 8191, Streptococcus sanguinis I-046, Streptococcus sanguinis I-047, Streptococcus sanguinis I-048, Staphylococcus Hemolyticus 11042, Enterococcus faecalis 103015, Streptococcus mutans 10449, Streptococcus anginosus 10713, Streptococcus mitis 12261, Streptococcus salivarius 102503, Neisseria sicca 103345, Haemophilus parainfluenzae 7857, Actinobacillus (Hemophilus) actinomycetemcomitans 52.105, и Eikenella corrodens 10596. Эти штаммы хранятся в соответствии с Будапештским договором. Штаммы, показанные в списке с номером, содержащим I, индексируются Collection Nationale de Culture des Microorganismes Institute Pasteur, 25 rue du Dr. Roux, 75724 Paris, France. Все другие штаммы индексируются National Collection of Type Cultures in London.
В некоторых вариантах осуществления один или более конкретных штаммов, перечисленных выше, могут отсутствовать или замещаться другим штаммом такого же вида или другого вида бактерий. Например, в некоторых вариантах осуществления один или более штаммов из Staphylococcus Hemolyticus 11042, Enterococcus faecalis 103015, Streptococcus mutans 10449, Streptococcus anginosus 10713, Streptococcus mitis 12261, Streptococcus salivarius 102503, Neisseria sicca 103345, Haemophilus parainfluenzae 7857, Actinobacillus (Hemophilus) actinomycetemcomitans 52.105 и Eikenella corrodens 10596, или даже все они, могут отсутствовать. В других вариантах осуществления могут отсутствовать один или более штаммов из Moraxella, Klebsiella, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes или Streptococcus sanguinis. Кроме того, для облегчения гидролизации может также использоваться штамм Lactobacillus или другие штаммы бактерий.
Экстракты могут быть получены способом щелочного лизирования после того, как клетки выращивают до соответствующей оптической плотности в культурной среде. В некоторых вариантах осуществления каждую из бактерий выращивают в среде, которая не вызывает риска появления заболевания, родственного прионному, или риска других заболеваний, которые могут передаваться через проглатывание продуктов, полученных из среды на животной основе. Например, в некоторых вариантах осуществления для выращивания клеток используется среда на растительной основе, такая как среда на основе сои. В других вариантах осуществления для роста клеток может использоваться синтетическая среда. Еще в других вариантах осуществления среда может содержать биологические экстракты, такие как экстракт дрожжей и лошадиная сыворотка, которые также не дают рисков появления таких заболеваний.
Лизаты могут также фильтроваться для удаления нуклеиновых кислот и клеточных остатков больших размеров. Вследствие фильтрации в некоторых вариантах осуществления, количество нуклеиновой кислоты, присутствующей в экстрактах, менее чем 100 мкг/мл. В некоторых вариантах осуществления несолюбилизированные соединения, такие как остатки оболочек клеток, и недостаточно деградированные липополисахариды (LPS) также удаляют фильтрацией. Следовательно, в некоторых вариантах осуществления полученный экстракт содержит растворимые молекулярные компоненты и не содержит значительных количеств нерастворимого материала или материала в виде частиц.
Сахаридные компоненты могут консервироваться в экстрактах, включая липополисахаридные (LPS) компоненты. В течение процесса лизирования сахариды могут химически модифицироваться, например расщепляться на более мелкие структуры или замещаться другими функциональными группами.
Рацемизация аминокислот в течение процесса лизирования также создает D-аминокислоты из существующих в природе L-аминокислот, находящихся в природных белках. D-аминокислоты могут быть полезны при увеличении биологической доступности экстрактов, поскольку белки, состоящие в основном или частично из D-аминокислот, не перевариваются эффективно в кишечнике у млекопитающих. Таким образом, антигенные молекулы в экстрактах, которые химически модифицируются во время лизирования, чтобы они содержали D-аминокислоты, остаются в организме пациента в течение продолжительного времени, делая потенциально возможным более сильное иммуностимулирующее действие.
Хотя бактериальные экстракты используются в литературе для стимулирования иммунной системы против заболеваний дыхательной системы, имеется необходимость в лучшей стандартизации и контроле этих экстрактов, чтобы сделать их более безопасными, более эффективными и более долгодействующими. Например, ранее считалось, что сахаридные компоненты, включая потенциально токсичные липополисахаридные (LPS) компоненты, должны удаляться из бактериальных экстрактов по причинам безопасности. (См., например, патент США № 5424287). Однако настоящее изобретение предусматривает способ, который приводит в результате к химической модификации компонентов LPS, достаточной для того, чтобы сахариды безопасно удерживались. Удерживание этих компонентов может улучшить эффективность, а также обеспечить дополнительные антигены для экстрактов.
Например, авторы обнаружили, что подбор pH и времени лизирования делает возможным достаточное разложение потенциально аллергенных или токсичных компонентов клеточных оболочек. Известные ранее условия лизирования при более низких pH или более коротком времени, в противоположность этому, дают экстракты, в которых компоненты клеточных оболочек и LPS недостаточно модифицируются химически. (См., например, патент GB 2021415 A). Полученные экстракты являются слишком аллергенными, чтобы безопасно вводиться пациентам. В целом, авторы обнаружили, что продукты, лизируемые при слишком низких pH и/или при слишком коротком времени, имеют более высокую токсичность, более низкую экстракцию белка и более низкую фильтруемость.
Способ фильтрации может также влиять на свойства полученного экстракта в некоторых случаях, поскольку размер пор фильтра и, иногда, химические свойства поверхности фильтра, могут изменять типы материалов, которые удаляются и удерживаются. Например, некоторые варианты осуществления настоящего изобретения используют способ фильтрации, который удерживает определенные сахариды, но удаляет другие молекулярные компоненты, такие как нуклеиновые кислоты.
Таким образом, настоящее изобретение предусматривает параметры, которые стандартизуют бактериальные экстракты, чтобы помочь в поддержании соответствующей безопасности и эффективности.
Краткое описание чертежей
Фиг.1. Блок-схема системы проточной фильтрации вдоль потока (TFF) для получения бактериальных экстрактов после лизирования бактерий. Блок-схема показывает две различные конфигурации для фильтров: параллельный режим, где все фильтры работают одновременно, и серпентинный режим, где фильтры конфигурируются в последовательном режиме.
Фиг.2. Продуцирование IL-6 и TNF-α PBMC человека, инкубируемыми с последовательными разбавлениями очищенной смеси экстрактов из примеров 2.2, 3.6, 3.7, 3.8, 3.9 и 3.10.
Фиг.3. Выживание мышей, провоцируемых вирусом H1N1, в течение 3 недель после инфицирования. Тест Мак-Немара: *p=0,023 для исследования при лечении 10 мг по сравнению с контролем.
Фиг.4. Влияние концентрации NaOH, количества биомассы (выраженной в граммах сухой массы на миллилитр) и продолжительности лизирования (в часах) на биологическую активность очищенных экстрактов HAIN 8467 (примеры 2.1, 2.5, 2.8) при биологическом анализе макрофагов грызунов с помощью оксида азота.
Фиг.5. Биологический анализ макрофагов грызунов с помощью оксида азота для очищенной смеси экстрактов Diplococcus pneumonia (пример 3.6).
Фиг.6. Биологическая активность экстрактов примера 3.1 и примера 3.3 (отмеченных как 3a и 3c, соответственно) в биологическом анализе макрофагов грызунов с помощью оксида азота.
Фиг.7. Биологическая активность очищенной смеси экстрактов из примеров 2.2, 3.6, 3.7, 3.8, 3.9 и 3.10 биологическом анализе макрофагов грызунов с помощью оксида азота.
Фиг.8. Влияние экстракта в соответствии с настоящим изобретением на секрецию гистамина из мастоцитов крысы, стимулируемых соединением 48/80.
Фиг.9. Средние общие значения для колониеобразующих единиц (CFU) в тканях (a) мочевого пузыря и (b) почки для различных экспериментальных групп.
Фиг.10. Влияние одного из вариантов осуществления настоящего изобретения на модели инфекции Escherichia coli для штамма мышей, невосприимчивых к LPS. Фигура показывает данные от проточной цитометрии (a) с маркерами CD14 в зависимости от FoxP3 и (b) TCR в зависимости от FoxP3, левые панели показывают необработанные ткани, в то время как правые панели показывают обработанные ткани.
Подробное описание изобретения
Определения
Экстракт. Экстракт, как здесь определено, обозначает материал, полученный после лизирования одного или более бактериальных штаммов. В некоторых случаях экстракт получают только из одного штамма, в то время как в других случаях экстракт представляет собой смесь экстрактов из нескольких различных штаммов.
Щелочное лизирование. Это способ лизирования бактериальных клеток при основных условиях.
Лизат. Как здесь используется, этот термин означает экстракт бактерий, полученный от процедуры лизирования клеток.
Фильтрация. Способ фильтрации, как здесь описано, обозначает прохождение экстракта или смеси экстрактов через один или более фильтров, таких как микрофильтры (то есть микрофильтрацию) или ультрафильтры (то есть ультрафильтрацию). Такая фильтрация может не удалять обязательно 100% компонентов, предназначенных для удаления. В некоторых случаях фильтрацию повторяют за несколько проходов или циклов.
Начальный pH. Этот термин обозначает pH, измеренный при начале процедуры, такой как бактериальное лизирование или фильтрация.
Сахариды. Сахарид, как здесь определено, включает моносахариды, дисахариды, а также сахариды больших размеров, такие как линейные и разветвленные полисахариды. Сахариды также включают замещенные или химически модифицированные сахариды, такие как липополисахариды (LPS), и их химически модифицированные варианты.
D-аминокислоты. Этот термин относится к аминокислотам, которые существуют в правовращательной изомерной форме, в противоположность биосинтетически полученным L-аминокислотам, которые существуют в левовращательной изомерной форме.
Рацемизация. Это термин показывает, по меньшей мере, частичную химическую модификацию L-аминокислот до D-аминокислот.
Среда, которая исключает риск появления заболеваний на прионной основе, обозначает культурную среду, используемую на любой стадии получения экстрактов, которая не содержит материалов, таких как сыворотка или мясные экстракты, взятых от животных, таких как коровы или овцы, или от любого другого животного, которые могут передавать заболевания на прионной основе. Примеры таких сред включают среды на растительной основе или синтетические химически определенные среды, а также среды с использованием лошадиной сыворотки или среды, содержащие материалы, взятые от видов животных, которые не передают прионные заболевания. Примеры заболеваний на прионной основе включают, например, заболевание коровьего бешенства, почесуху и заболевание Крейцфельда-Якоба.
Неживотная среда представляет собой среду, которая не содержит компонентов, полученных от животных. Примеры включают среды на растительной основе (то есть растительные среды), такие как соевая среда, и синтетические среды.
Лечение, как здесь используется, обозначает как лечение текущих инфекций, так, например, и других состояний, а также предотвращение или защиту, например, от развития новых инфекций.
Субъект, как здесь используется, обозначает любой животный субъект, включая субъектов млекопитающих, таких как люди и домашние млекопитающие.
Понятно, что конкретные бактериальные штаммы, идентифицируемые здесь и используемые в настоящем изобретении, могут включать штамм, полученный от исходного депозита, упоминаемого здесь, или его генетического клона, включая штаммы, которые повторно депонированы в более позднее время с различными кодовыми наименованиями депонентов, но которые считаются генетически таким же штаммом как исходная депонированная версия.
Все числа, используемые здесь, являются приблизительными, принимая во внимание ошибки, неизбежные при их измерениях, округление и значимые цифры.
Получение экстрактов
Бактериальные экстракты по настоящему изобретению могут быть получены посредством ферментации с последующим тепловым дезактивированием и щелочным лизированием и фильтрацией. Для каждого штамма, для получения достаточного количества материала, ферментирование культуры может начинаться от рабочей маточной серии с последующей инокуляцией в контейнерах для ферментирования больших размеров.
Используемые среды могут быть одинаковыми для каждого вида. Однако для усиления роста некоторых видов могут вводиться вспомогательные факторы роста. В некоторых вариантах осуществления среду, которая исключает риск появления заболевания на прионной основе, можно использовать для выращивания, по меньшей мере, некоторых или для всех штаммов. Примеры включают неживотные среды, такие как среды на растительной основе и синтетические среды. Другие примеры включают среду, которая включает лошадиную сыворотку или другой животный экстракт, который отбирают у видов животных, которые не вызывают опасности появления прионного заболевания, в противоположность штаммам, выращенным в присутствии бычьей сыворотки или мясных экстрактов, которые могут давать такие риски. В некоторых вариантах осуществления к среде может добавляться дипептид Ala-Gin. Авторы наблюдают, что в некоторых вариантах осуществления дипептид Ala-Gin служит как стимулятор роста для бактериальной культуры.
После ферментации биомасса от каждого штамма или от множества штаммов может дезактивироваться с помощью тепловой обработки, концентрирования и замораживания. Клеточный материал может лизироваться с помощью ионов гидроксида, таких как от NaOH. В некоторых вариантах осуществления может лизироваться концентрация биомассы от 2 до 130 г/л бактериальной сухой массы, такая как от 20 до 120 г/л, или от 5 до 90 г/л, или от 10 до 50 г/л, или от 40 до 90 г/л. (Концентрация биомассы приводится здесь как бактериальная сухая масса на литр лизирования. Концентрацию биомассы измеряют посредством сушки 5 мл материала в малой фарфоровой чашке при 105°C до тех пор, пока он не достигнет постоянной массы, а затем регистрируют массу в граммах на литр). Например, штаммы Haemophilus могут лизироваться при концентрации биомассы 15-90 г/л, такой как от 40 до 90 г/л, например, 40, 50, 60, 70, 80 или 90 г/л или в более узких диапазонах, ограниченных этими концентрациями (то есть 40-50, 70-90, и т.п.). Штаммы Streptococcus, например, могут лизироваться при 10-90 г/л, например, при 10, 20, 30, 40, 50, 60, 70, 80 или 90 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Moraxella могут лизироваться, например, при 5-60 г/л, или при 10-60 г/л, или при 15-40 г/л, например, при 5, 10, 20, 30, 40, 50 или 60 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Klebsiella могут лизироваться, например, при 10-50 г/л, например, 25-50 г/л, или 10, 20, 30, 40 или 50 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Staphylococcus могут лизироваться, например, при 30-90 г/л, например, 30, 40, 50, 60, 70, 80 или 90 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Neisseria могут лизироваться, например, при 5-60 г/л, например, при 5, 10, 20, 30, 40, 50 или 60 г/л, или в более узких диапазонах, ограниченных этими концентрациями.
В некоторых вариантах осуществления для лизирования может использоваться концентрация гидроксида от 0,01 н. до 1,2 н., например, от 0,1 до 1 н., или от 0,05 н. до 0,4 н., например, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35 или 0,4 н., или в более узких диапазонах, ограниченных этими концентрациями, или от 0,5 н. до 1,0 н., например, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 н., или в более узких диапазонах, ограниченных этими концентрациями. Концентрация основания может использоваться с тем, чтобы получить начальный pH 12 или выше, pH более чем 12, pH более чем 12,5, или, например, pH от pH 12,0 до pH 13,4 или от pH 12,6 до 13,4. Например, для штаммов Streptococcus, концентрация гидроксида может составлять 0,1-0,7 н. или 0,2-0,5 н., например, 0,2, 0,3, 0,4 или 0,5 н., или в более узких диапазонах, ограниченных этими концентрациями. Для штаммов Moraxella или Haemophilus, она может составлять 0,05-0,7 н. или 0,15-0,5 н., например, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45 или 0,5 н., или в более узких диапазонах, ограниченных этими концентрациями. Для штаммов Klebsiella или Staphylococcus, она может составлять 0,1-0,7 н. или 0,15-0,4 н., например, 0,15, 0,2, 0,25, 0,3, 0,35, или 0,4 н., или в более узких диапазонах, ограниченных этими концентрациями.
Температура лизирования может составлять от 30 до 60°C, например, от 30-40°C, или от 35-40°C, например, 37°C. Время лизирования может изменяться от 20 часов или от 40 часов до нескольких дней, например, составлять 2, 3, 4, 5, 6, 7, 8, 9 или 10, или даже 15 дней. Например, для штаммов Haemophilius, Streptococcus, Moraxella и Staphylococcus может использоваться время 5-9 дней, а для штаммов Klebsiella и Neisseria, время 7-10 дней. В некоторых вариантах осуществления могут использоваться температуры лизирования 30-40°C или 35-40°C, например, 37°C, для каждого из штаммов, и лизирование может осуществляться в течение периода от 72 до 210 часов (3-9 дней), например, 3 дней, 4, 5, 6, 7, 8 и 9 дней или находиться в пределах часов или дней, ограниченных этими временами (например, 3-4 дня, 8-9 дней и т.п.). Понятно, что эти диапазоны времени включают любую долю от количества дней, часов или минут в них.
В некоторых вариантах осуществления, когда используют более одного штамма из одного и того же бактериального рода, штаммы могут лизироваться вместе или по отдельности. Штаммы могут смешиваться до или после лизирования.
Экстракты могут очищаться с помощью центрифугирования и/или фильтрации. Например, лизаты могут центрифугироваться при 9000×g, затем один или более циклов фильтрации на 0,2-микронном фильтре могут использоваться для очистки экстракта. В некоторых случаях могут использоваться последовательные заходы фильтрации на фильтрах с большими размерами пор с последующей фильтрацией на 0,2-микронном фильтре. Способы ультрафильтрации также могут использоваться, чтобы помочь в экстрагировании растворимых материалов из экстракта, например, рециркулируя пермеат от ультрафильтрации для дополнительной микрофильтрации.
В некоторых вариантах осуществления способ проточной фильтрации вдоль потока (TFF) может использоваться для фильтрования экстрактов и для экстрагирования солюбилизированных молекул из клеточных остатков больших размеров. (См. фиг.1). (См., например, Separations Technology, Pharmaceutical and Biotechnology Applications, Wayne P. Olson, Editor. Interpharm Press, Inc., Buffalo Grove, IL, USA, p.126 to 135 - ISBN:0-935184-72-4). В начале такого способа TFF разбавленный бактериальный лизат может храниться в первом резервуаре. Начинается работа петли микрофильтрации (MF), и продукт прокачивают, и полученный ретентат от MF рециклируют, в то время как пермеат от MF переносят во второй резервуар.
После достижения соответствующего уровня концентрации начинается работа петли ультрафильтрации (UF). Пермеат от UF можно рециркулировать обратно в первый резервуар для непрерывной экстракции солюбилизированного соединения из лизата, в то время как ретентат от UF может храниться во втором резервуаре. В течение непрерывной экстракции объемы в резервуарах 1 и 2 могут устанавливаться с помощью регулирования скоростей потока пермеатов от микрофильтрации и ультрафильтрации.
Несколько таких циклов экстракции могут осуществляться с помощью либо TFF, либо других способов фильтрации. В вариантах осуществления, которые используют TFF, в конце последнего цикла, петля ультрафильтрации может выключаться и петля микрофильтрации может работать одна, и пермеат от MF переносится в резервуар 2.
Петля микрофильтрации может соединяться с фильтрами с размерами пор от 1,2 микрон до 0,1 микрон, такими как фильтры с размерами пор от 0,65 до 0,2 микрон или 0,45 микрон. Поперечный поток может составлять от 1000 литров/часов·м2 (LHM) до 3000 LHM, например, 1500-2500 LHM, или 2000 LHM, при перепаде давления на мембране (TMP) от 0,6 до 2 бар, например, 0,8-1,5 бар, или 1,0 бар. Петля ультрафильтрации может соединяться с фильтрами с размерами пор, соответствующими от 10 КДа до 1000 КДа, например, от 10 КДа до 100 КДа или от 10 КДа до 30 КДа, или от 30 КДа до 100 КДа. Поперечный поток может составлять в пределах между 30 LHM и 1000 LHM, например, 20-500 LHM с TMP от 0,2 до 1,5 бар, например, 0,4-1,2 бар, или 0,5 бар.
5-20 объемов диафильтрации можно использовать для экстрагирования солюбилизированных соединений из бактериальных клеточных оболочек. В некоторых вариантах осуществления используется 8-15 объемов. Следовательно, например, в некоторых вариантах осуществления может использоваться 5-15 циклов фильтрации, в некоторых случаях 8-15 циклов, например, 8, 9, 10, 11, 12, 13, 14 или 15 циклов.
После фильтрации экстракты могут дополнительно концентрироваться или центрифугироваться, если это желательно. Например, может осуществляться дополнительная микрофильтрация с использованием фильтра с более мелкими порами, такого как 0,2-микронный фильтр. После фильтрации выход солюбилизированных белков, измеренный согласно Lowry, может составлять более чем 50% или может составлять более чем 60%, или может составлять от 50 до 90%, или может составлять, например, 60-90%. После фильтрации экстракт может лиофилизироваться перед приготовлением его для использования.
В некоторых вариантах осуществления настоящего изобретения может выбираться группа условий лизирования, применяемых для одного или нескольких бактериальных штаммов. От 40 до 90 г/л, или 40, 50, 60, 70, 80 или 90 г/л Haemophilus influenzae NCTC 8467 может лизироваться в течение 72-200 часов, например, 72, 96, 120, 150 или 200 часов. От 10 до 95 г/л одного или нескольких штаммов Streptococcus, например, 10, 20, 40, 60, 80, 90 или 95 г/л может лизироваться для 72-210 часов, например, 72, 96, 120, 150 или 200 часов. От 15 до 80 г/л одного или нескольких штаммов Diplococcus, например, 15, 20, 30, 40, 50, 60, 70 или 80 г/л, может лизироваться в течение 72-210 часов, например, 72, 96, 120, 150 или 200 часов. От 10 до 50 г/л одного или нескольких штаммов Klebsiella, например, 10, 15, 20, 25, 30, 35, 40, 45 или 50 г/л, может лизироваться в течение 72-210 часов, такие как 72, 96, 120, 150 или 200 часов. От 5 до 60 г/л одного или нескольких штаммов Neisseria, например, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 г/л, может лизироваться в течение 72-210 часов, например, 72, 96, 120, 150 или 200 часов. От 30 до 90 г/л одного или нескольких штаммов Staphilococcus, например, 30, 40, 50, 60, 70, 80, или 90 г/л может лизироваться в течение 72-210 часов, например, 72, 96, 120, 150, 200 часов. В каждом из этих вариантов осуществления лизирование может осуществляться при 35-40°C, например, при 37°C. Кроме того, могут использоваться условия либо "умеренного", либо "сильного" лизирования для каждого штамма, образующего экстракт, или для группы сходных штаммов. Как здесь используется, условия "умеренного" лизирования относятся к концентрации ионов гидроксида от 0,05 до 0,4 н., например, 0,1, 0,2, 0,3 или 0,4 н. вместе с параметрами биомассы, времени и температуры, приведенными чуть выше для каждого типа штамма (например, 35-40°C, 40-90 г/л биомассы и 72-200 часов для Haemophilus influenzae NCTC 8467). Как здесь используется, условия "сильного" лизирования относятся к концентрации ионов гидроксида от 0,5 до 1 н., например, 0,5, 0,6, 0,7, 0,8, 0,9 и 1 н., вместе с параметрами времени, температуры и биомассы для каждого штамма, приведенными чуть выше. В некоторых вариантах осуществления как сильное, так и умеренное лизирование могут осуществляться с получением продуктов, совместно смешанных.
В некоторых вариантах осуществления настоящего изобретения экстракт может быть получен из нескольких бактериальных штаммов, например, по меньшей мере, из одного грам-отрицательного и, по меньшей мере, из одного грам-положительного штамма. Бактериальные штаммы от одинаковых или различных видов могут смешиваться до или после лизирования. В некоторых вариантах осуществления штаммы могут смешиваться, например, для получения 1-40 об.% каждого из них в смеси или 15-30 об.% от каждого рода бактерий. В некоторых вариантах осуществления экстракт может содержать продукты лизирования, например, от 2, 3, 4, 5 или 10 различных генераций бактерий. Например, смесь из 5 генераций может содержать штаммы Haemophilus, Moraxella, Klebsiella, Staphylococcus, Streptococcus, включая Streptococcus sanguinis, pyogenes и pneumoniae. Некоторые штаммы Streptococcus pneumoniae также известны, например, как штаммы Diplococcus. В некоторых таких вариантах осуществления из 5 родов смесь может содержать от 5 до 15 об.% Haemophilus, например, 7-10%, или 7, 8 или 9%; от 5 до 15 об.% Diplococcus, например, 7-10% или 7, 8 или 9%; от 5 до 20 об.% Streptococcus, например, 7-15%, или 8, 9, 10, 11 или 12%; от 10 до 30 об.% Klebsiella, например, 15-25%, или 16, 17, 18, 19, 20, 21, 22, 23 или 24%; от 10 до 30 об.% Staphylococcus, например, 15-25%, или 16, 17, 18, 19, 20, 21, 22, 23 или 24%; и от 20 до 40 об.% Neisseria, например, 25-35%, или 26, 27, 28, 29, 30, 31, 32, 33 или 34%.
Химические свойства бактериальных экстрактов
Некоторые варианты осуществления в соответствии с настоящим изобретением могут содержать, например, 5-75 мг/мл белков, или 10-65 мг/мл, или 20-45 мг/мл, или 5-40 мг/мл, или 5-20 мг/мл, или 5-10 мг/мл, или 6-8 мг/мл белков, или находиться в диапазоне с крайними точками от 5, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70 или 75 мг/мл; 1,5 до 2,5 мг/мл свободных аминокислот (A.A.), или 1,5 до 2 мг/мл, или 2 до 2,5 мг/мл свободных A.A., или находиться в диапазоне с крайними точками от 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5 мг/мл свободных A.A., вычисленных по глутаминовой кислоте (147,1 г/моль); и от 0,3 до 4,5 мг/мл полисахаридов и моносахаридов, или от 0,3 до 4 мг/мл, или от 0,4 до 4 мг/мл, или от 0,5 до 3,5 мг/мл, или от 0,6 до 3 мг/мл или от 0,3 до 1 мг/мл, или находиться в диапазоне с крайними точками от 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0 или 4,5 мг/мл полисахаридов и моносахаридов, так, например, как от 0,4 до 0,5 мг/мл. Например, некоторые варианты осуществления содержат примерно от 6 до 8 мг/мл белков, от 1,5 до 2,5 мг/мл свободных аминокислот (A.A.), вычисленных по глутаминовой кислоте (147,1 г/моль) и/или примерно от 0,4 до 0,5 мг/мл полисахаридов и моносахаридов. Концентрацию белка измеряют с помощью анализа согласно Lowry в соответствии со способом 2 из European Pharmacopoeia 2.5.33. Концентрацию сахара анализируют после кислотного гидролиза и дериватизации в соответствии с D. Herbert et al., Meth. Microbiol. 5B: 266 et seq. (1971). Концентрацию глутамата (глутаминовой кислоты) измеряют посредством преобразования аминокислот в изоиндольные производные и измерения коэффициента поглощения на 340 нм, в соответствии с Roth M., Fluorescence reaction for amino acids, Anal.Chem., 43, 880-882, (1971).
В некоторых вариантах осуществления концентрация эквивалентов LPS, на основе хромогенного исследования с использованием лизата амебоцитов Limulus (LAL), менее чем 1000 нг/мл или менее чем 500 нг/мл, менее чем 200 нг/мл или менее чем 100 нг/мл.
Лизирование бактерий в соответствии с настоящим изобретением может приводить в частичному гидролизу белков, а также к деаминированию, деамидированию и частичной рацемизации аминокислот из L в D. В одном из аналитических исследований экстракта в соответствии с настоящим изобретением наблюдают пики, представляющие, каждый, D-аспарагиновую кислоту, D-глутаминовую кислоту, D-серин, D-метионин, D-гистидин, D-аланин, D-аргинин, D-фенилаланин, D-тирозин, D-лейцин и D-лизин. Процент D-аминокислот этих видов в этом исследовании находится в пределах от 3% до 40%. Следовательно, некоторые варианты осуществления настоящего изобретения делают возможной рацемизацию одного или нескольких соединений из серина, треонина, гистидина, аланина, аргинина, тирозина, фенилаланина, лейцина и лизина, также как и всех упоминаемых выше аминокислот, или любого выбора из более чем одной, но менее чем всех из указанных выше аминокислот, таких, например, как аланин, фенилаланин и лизин. В некоторых вариантах осуществления по меньшей мере, 10% одной или более из указанных выше аминокислот может рацемизироваться из D в L. В других вариантах осуществления может рацемизироваться, по меньшей мере, 40% одной или более из указанных выше аминокислот.
Лизирование бактерий в соответствии с настоящим изобретением может приводить к уменьшению молекулярной массы компонентов молекул от 0 до 300 кДа и от 0 до 100 кДа, или от 0 до 60 кДа, вызванному гидролизом.
Биологические активности бактериальных экстрактов
Экстракты в соответствии с настоящим изобретением могут быть эффективными при лечении пациентов, страдающих от развития медицинских состояний или имеющих риск их появления, таких как респираторные расстройства и аллергические реакции или состояния. Экстракты в соответствии с настоящим изобретением могут быть эффективными при лечении, например, инфекции верхних и нижних дыхательных путей, атопического дерматита, назофарингита, синусита, фарингита, тонзиллита, ларингита, трахеита, ларингофарингита, гриппа, пневмонии, бронхопневмонии, бронхита, инфекций нижних дыхательных путей, аллергического ринита, аллергической астмы, ринита, назофарингита, фарингита, синусита, тонзиллита, ларингита, ларинготрахеита, бронхита, обструктивного легочного заболевания с острой инфекцией нижних дыхательных путей и обструктивного легочного заболевания с тяжелым обострением.
Биологическая активность экстрактов может определяться с помощью нескольких анализов. Например, анализ с помощью мононуклеарных клеток периферической крови (PBMC) исследует продуцирование цитокинов IL-6 из PBMC и может осуществлять скрининг способности экстракта к стимулированию иммунной системы. Например, в некоторых вариантах осуществления измеренная концентрация IL-6 in vitro в супернатантах PBMC, стимулируемых экстрактами по настоящему изобретению, находится в пределах от 2000 пг/мл до 70000 пг/мл, от 2000 пг/мл до 50000 пг/мл, от 2000 пг/мл до 30000 пг/мл, от 2000 пг/мл до 20000 пг/мл, от 2000 пг/мл до 10000 пг/мл, или от 5000 пг/мл до 70000 пг/мл, от 5000 пг/мл до 50000 пг/мл, от 5000 пг/мл до 30000 пг/мл, от 5000 пг/мл до 25000 пг/мл, или от 5000 пг/мл до 10000 пг/мл или от 15000 пг/мл до 25000 пг/мл. Когда LPS используют как контрольный агонист (при 0,01 мкг/мл), полученные значения находится в пределах, в зависимости от донора, от 5000 мкг/мл до 70000 мкг/мл.
Исследование оксида азота у грызунов (NO) измеряет продуцирование NO макрофагами грызунов, которое также указывает на иммунное стимулирование. Например, макрофаги продуцируют NO, чтобы убивать вторгающиеся бактерии. В некоторых вариантах осуществления активность in vitro закиси азота (NO) для вариантов осуществления настоящего изобретения исследуемая при концентрации в пределах от 0,001 мг/мл до 10 мг/мл растворимой сухой массы, обеспечивает максимальную реакцию в пределах от 3 мкМ до 100 мкМ оксида азота или от 3 мкМ до 90 мкМ, от 3 мкМ до 80 мкМ, от 3 мкМ до 70 мкМ, от 3 мкМ до 60 мкМ, от 3 мкМ до 50 мкМ, от 3 мкМ до 40 мкМ, от 3 мкМ до 30 мкМ, от 3 мкМ до 20 мкМ, от 3 мкМ до 10 мкМ, или от 5 мкМ до 80 мкМ, от 5 мкМ до 60 мкМ, от 5 мкМ до 40 мкМ, от 5 мкМ до 20 мкМ или от 10 мкМ до 80 мкМ, от 10 мкМ до 70 мкМ, от 10 мкМ до 50 мкМ, от 10 до 30 мкМ или от 10 мкМ до 15 мкМ, или она находится в диапазоне с крайними точками от 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 мкМ.
Активности, наблюдаемые in vitro на мононуклеарных клетках периферической крови человека и макрофагах грызунов, могут зависеть от таких параметров, как количество сухой массы бактериальной биомассы для лизирования, то есть от "исходного материала" для лизирования, от продолжительности щелочного лизирования и от начального процента NaOH или начального pH, используемого при лизировании.
Сочетание исследований активности in vitro, таких как с помощью PBMC и NO, с определением концентраций LPS, таким как с помощью LAL, также может обеспечить получение информации относительно баланса активности и риска появления токсичности для данного бактериального экстракта.
Экстракты по настоящему изобретению могут также быть активными против аэрозольных инфекций вируса гриппа, таких как инфекция A/PR/8/34 (H1N1). В одном из исследований, например, экстракт в соответствии с настоящим изобретением способен придавать полную иммунную защиту мышам при дозе 10 мг/мышь, если судить по смертности, титрованию вируса в легких, по клиническим симптомах и по титрам антител. В противоположность этому, только 70% контрольных животных пережили инфекцию.
В качестве другого примера, частота выживания за 13 дней после провоцирования, по меньшей мере, 8 мышей, имеющих восприимчивость к LPS дикого типа, Salmonella thyphimurium, составляет, по меньшей мере, 60%, когда этих мышей впервые лечат в течение 10 дней эффективными количествами некоторых вариантов осуществления настоящего изобретения. Доза Salmonella thyphimurium для провоцирования может выбираться так, что нелеченые мыши или мыши, которых лечат водой или пустым контрольным препаратом, содержащим наполнители, но не экстракт, имеют частоту выживания 60% или меньше, например, 50% или меньше. В некоторых случаях частота выживания для мышей, которых лечат экстрактом, составляет, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, или, по меньшей мере, 95%.
Кроме того, варианты осуществления настоящего изобретения могут также ингибировать секрецию гистамина мастоцитами, стимулируемыми соединением 48/80, статистически значимого уровня, как показано подробно ниже. Например, варианты осуществления настоящего изобретения могут показывать значение IC-50 при анализе с помощью мастоцитов, стимулируемых соединением 48/80, например, в пределах между 0,0005 и 0,01 мг/мл, например, между 0,0005 и 0,005 мг/мл или между 0,001 и 0,01 мг/мл, или между 0,002 и 0,008 мг/мл, или между 0,004 и, например, 0,006 мг/мл.
Композиции, содержащие бактериальные экстракты
Смесь лиофилизированных экстрактов может приготавливаться множеством различных способов для возможного введения. Например, могут быть получены пероральные таблетки, капсулы, пилюли, а также жидкие препараты или аэрозоли. Препараты для вливания или инъекции также могут быть получены. Варианты осуществления настоящего изобретения могут приготавливаться, например, как твердые дозированные формы или жидкие дозированные формы. Примеры твердых дозированных форм могут включать, например, таблетки, например, таблетки с покрытием, жевательные таблетки, шипучие таблетки, сублингвальные таблетки, гранулы, порошки или капсулы), содержащие экстракт и, необязательно, одну или несколько пищевых и/или диетических добавок. Твердые дозированные формы могут также содержать разбавители, наполнители и/или другие эксципиенты. Могут добавляться другие компоненты наполнителей, такие как консерванты, красители, ароматизирующие вещества и подсластители. Является также возможным приготовление порошков или препаратов в форме гранул. Жидкие дозированные формы, такие как растворы, сиропы, суспензии или капли, также могут использоваться для перорального способа введения.
Рабочие примеры
Пример 1: Бактериальные культуры
Пример 1.1: Культура Haemophilus Influenzae NCTC 8467
Начальные условия культивирования
Культурные среды приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия: 3 г/л; моногидрогенфосфата натрия: 2 г/л; ацетата натрия: 0,5 г/л; соевого пептона 40 г/л; глюкозы: 6 г/л; инозина: 0,1 г/л; хлорида кальция: 0,02 г/л; хлорида калия: 0,1 г/л; бикарбоната натрия: 0,6 г/л; пирувата натрия: 0,06 г/л; раствора металлов (сульфата меди: 3 мг/л; хлорида железа: 830 мг/л; сульфата цинка: 860 мг/л; серной кислоты: 1,1 мг/л): 0,5 мл/л; гемина: 25 мг/л; NADH (восстановленного тригидрата динатриевой соли β-никотинамидадениндинуклеотида) 25 мг/л. После растворения pH доводят до 7,2. После стерилизации среды малые колбы Эрленмейера индивидуально инокулируют содержанием замороженных флаконов (содержащих по 1,5 мл замороженных бактерий) и инкубируют при 37°C в течение 8 часов. Затем аликвоты этих культур переносят в колбы Эрленмейера больших размеров, содержащие по 150 мл культурных сред, и инкубируют опять при таких же условиях. Другую стадию ферментирования с 1000 мл культурных сред осуществляют при таких же условиях, но с 50 мг/л гемина, и добавляют перед инокуляцией 50 мг/л NADH (OD (оптическая плотность) на 700 нм для 10 мл культуры 1 после 10 часов: 3,7, для 1000 мл культуры после 11 часов: 13,5). Затем все содержимое 1000 мл культуры переносят в ферментер для предварительной ферментации.
Условия культивирования в ферментере для предварительной ферментации
Культурные среды приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия: 3 г/л; моногидрогенфосфата натрия 2 г/л; ацетата натрия: 0,5 г/л; соевого пептона: 40 г/л; глюкозы: 6 г/л; инозина: 0,1 г/л; хлорида кальция: 0,02 г/л; хлорида калия: 0,1 г/л; бикарбоната натрия: 0,6 г/л; пирувата натрия: 0,06 г/л; раствора металлов: 0,5 мл/л; гемина: 1 мг/л; NADH: 10 мг/л, полипропиленгликоля: 0,06-0,10, мл/л. Температуру инкубирования поддерживают при 30°C, при перемешивании и аэрации. pH во время культивирования не поддерживают. Через 13 часов 2 ферментера для предварительной ферментации переносят в ферментер (OD на 700 нм для культуры 1 после 6 часов: 1,53; для культуры 2 после 8,5 часов: 1,90). Культуры из ферментеров для предварительной ферментации переносят при стерильных условиях в ферментеры.
Условия культивирования в ферментерах
Культурные среды приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия: 3 г/л, моногидрогенфосфата натрия: 2 г/л; ацетата натрия 0,5 г/л, соевого пептона 40 г/л; инозина 0,1 г/л; хлорида кальция 0,02 г/л; хлорида калия 0,1 г/л, бикарбоната натрия 0,6 г/л; пирувата натрия: 0,06 г/л; раствора металлов: 5 мл/л; гемина 1,5 мг/л; NADH: 15 мг/л; полипропиленгликоля: 0,02-0,04 мл/л.
После стерилизации к культуре добавляют 15 г/л глюкозы. Температуру инкубирования поддерживают при 35°C при перемешивании и аэрации. pH во время культивирования поддерживают при 6,8. Через 8 часов культуры (OD на 700 нм, для культуры 1 после 7,25 часа: 3,69; для культуры 2 после 8,75 часа: 3,55) дезактивируют посредством тепловой обработки при 90-100°C и переносят в резервуар для сбора. После дезактивации культуры переносят в центрифугу для отделения биомассы от культурной среды и концентрирования. Собранную биомассу хранят в резервуаре, соединенном с центрифугой. Ретентат из центрифуги (1000 л/час) рециклируют в резервуар для хранения, в то время как пермеат эвакуируют. Биомассу концентрируют, а затем собирают в стерильный резервуар. Через 3,25 часа собирают 31,768 г биомассы. OD концентрированной биомассы составляет 237,4 при 700 нм. Биомассу делят на ряд аликвот, содержащих 425 г сухой массы биомассы. Затем аликвоты замораживают при -15°C.
Пример 1.2: Культуры Staphylococcus
Условия культивирования в колбах Эрленмейера
Культурные среды для Staphylococcus aureus 049 (StAu 049), Staphylococcus aureus I-050 (StAu 050), Staphylococcus aureus 1-051 (StAu 051), Staphylococcus aureus I-052 (StAu 052), Staphylococcus aureus I-053 (StAu 053) и Staphylococcus aureus I-054 (StAu 054) приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия, 2 г/л; моногидрогенфосфата натрия, 2 г/л; ацетата натрия, 0,5 г/л; соевого пептона, 40 г/л; глюкозы, 6 г/л. Затем 0,012 л среды инокулируют 1,5 мл замороженных бактерий. Культуру инкубируют при 37°C в течение 7 часов при перемешивании при 180 об./мин и pH 6,9. Осуществляют последовательные стадии культивирования от 12 до 1000 мл.
Условия культивирования в ферментере для предварительной ферментации
Такие же среды, как и на предыдущей стадии, приготавливают для ферментера для предварительной ферментации, но с добавлением полипропиленгликоля 0,06-0,10 мл/л. Среды стерилизуют in situ при 123°C в течение 30 мин. 1000 мл культуры от предыдущей стадии переносят в ферментер для предварительной ферментации при перемешивании и аэрации. Температуру инкубирования поддерживают при 37±2°C. pH не поддерживают во время культивирования. Через 6 часов 2 ферментера для предварительной ферментации переносят в ферментеры.
Культивирование в ферментерах
Культурные среды для StAu 049 приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия, 2 г/л; моногидрогенфосфата натрия, 2 г/л; ацетата натрия, 0,5 г/л; соевого пептона, 40 г/л; полипропиленгликоля, 0,04 мл/л. Среды стерилизуют in situ. Добавляют к культуре глюкозу (14 г/л). Температуру инкубирования поддерживают при 37°C при перемешивании и аэрации. pH поддерживают при 6,4±0,5. Через 7 часов культуры дезактивируют посредством тепловой обработки при 90-100°C и переносят в резервуар для сбора. Затем биомассу отделяют от культурных сред посредством центрифугирования. Биомассу делят на ряд аликвот, содержащих определенное количество сухой массы биомассы.
Сухая масса биомассы в каждой аликвоте составляет StAu 049: 327 г, StAu 050: 297 г, StAu 051: 375 г, StAu 052: 363 г, StAu 053: 446 г и StAu 054: 365 г.
Пример 1.3: Культуры Klebsiella
Начальные условия культивирования
Культурные среды для Klebsiella pneumoniae NCTC 5050 (Klba 5050), Klebsiella pneumoniae NCTC 5056 (Klba 5056) и Klebsiella pneumoniae NCTC 204 (Klba 204) приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия, 2 г/л; моногидрогенфосфата натрия, 2 г/л; ацетата натрия, 0,5 г/л; соевого пептона, 40 г/л; глюкозы, 6 г/л. Затем 0,012 л среды инокулируют 1,5 мл замороженных бактерий. Культуру инкубируют при 37°C в течение 10 часов при перемешивании и начальный pH устанавливают при 6,9. Осуществляют последовательные стадии культивирования от 0,012 до 1,0 литра.
Условия культивирования для Klba 5050 в ферментере для предварительной ферментации
Такие же среды, как для стадии, упоминаемой ранее, приготавливают для ферментера для предварительной ферментации, но с добавлением 0,06 мл/л полипропиленгликоля. Один литр культуры от упоминаемой ранее стадии переносят в ферментер для предварительной ферментации. Температуру инкубирования поддерживают при 37°C при перемешивании и аэрации. pH во время культивирования не поддерживают. Через 6 часов два ферментера для предварительной ферментации переносят в ферментер.
Условия культивирования в ферментерах
Культурные среды для Klba 5050 приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия, 2 г/л; моногидрогенфосфата натрия, 2 г/л; ацетата натрия, 0,5 г/л; соевого пептона, 40 г/л, и полипропиленгликоля, 0,02 мл/л. Среды стерилизуют in situ и добавляют 21 г/л глюкозы. Температуру инкубирования поддерживают при 37°C при перемешивании и аэрации. pH во время культивирования поддерживают при 6,6. Через 8 часов культуры дезактивируют посредством тепловой обработки при 90-100°C и переносят в резервуар для сбора. Затем биомассу отделяют от культурных сред посредством центрифугирования. Сухая масса биомассы в каждой аликвоте составляет Klba 5050: 393 г, Klba 5056: 455 г и Klba 204: 440 г.
Пример 1.4: Культуры Moraxella catarrhalis
Начальные условия культивирования
Культурные среды для Moraxella catarrhalis NCTC 3622 (NeCa 3622); Moraxella catarrhalis NCTC 3625 (NeCa 3625) и Moraxella catarrhalis I-045 (NeCa 045) приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия: 3 г/л; моногидрогенфосфата натрия: 2 г/л; ацетата натрия: 0,5 г/л; соевого пептона: 40 г/л; крахмала: 0,1 г/л; инозина: 0,1 г/л; хлорида кальция: 0,02 г/л; хлорида калия: 0,1 г/л; бикарбоната натрия: 0,6 г/л; пирувата натрия: 0,06 г/л; раствор металлов: 0,5 мл/л (композиция раствора металлов: сульфат меди: 3 мг/л; хлорид железа: 830 мг/л; сульфат цинка: 860 мг/л; серная кислота: 1,1 мг/л); дипептид ALA-GLN (200 мг/мл в 0,9% растворе NaCl): 10 мг/л (для первой стадии культивирования 50 мг/л; для 1-литровой стадии культивирования 10 мг/л). Затем 0,012 л среды инокулируют 1,5 мл замороженных бактерий. Культуру инкубируют при 37°C в течение 10 часов при перемешивании. Начальный pH устанавливают при 7,2. Последовательные стадии культивирования от 0,012 до 1,0 л осуществляют в таких же условиях.
Культивирование в ферментерах для предварительной ферментации
Такие же среды, как для стадии, упоминаемой ранее, приготавливают для ферментеров для предварительной ферментации, но с добавлением полипропиленгликоля, 0,06-0,10 мл/л, и концентрацию ALA-GLN доводят до 4 мг/л. Среды стерилизуют in situ. Один литр культуры от стадии, упоминаемой ранее, переносят в ферментеры для предварительной ферментации. Температуру инкубирования поддерживают при 33°C при перемешивании и аэрации. pH во время культивирования не поддерживают. Через 10 часов 2 ферментера для предварительной ферментации переносят в ферментеры.
Условия культивирования в ферментерах
Такие же среды, как на стадии с колбами Эрленмейера, приготавливают для ферментеров для предварительной ферментации, но с добавлением 0,06 мл/л полипропиленгликоля и без ALA-GLN или глюкозы. Температуру инкубирования поддерживают при 33°C при перемешивании и аэрации. pH во время культивирования не поддерживают. Через 10,5 часа культуры дезактивируют посредством тепловой обработки при 90-100°C и переносят в резервуар для сбора. Затем биомассу отделяют от культурных сред посредством центрифугирования. Сухая масса биомассы в каждой аликвоте составляет NeCa 3622: 361 г, NeCa 3625: 351 г и NeCa 045: 223 г.
Пример 1.5: Культуры Streptococcus
Начальные условия культивирования
Культурные среды для Streptococcus pneumoniae NCTC 7465 (StPn 7465), Streptococcus pneumoniae NCTC 7466 (StPn 7466), Streptococcus pneumoniae NCTC 7978 (StPn 7978), Streptococcus pneumoniae NCTC 10319 (StPn 710319), Streptococcus sanguinis I-046 (StSa 046), Streptococcus sanguinis I-047 (StSa 047), Streptococcus sanguinis I-048 (StSa 048) и Streptococcus Pyogenes NCTC 8191 (StPy 8191) приготавливают посредством растворения в очищенной воде следующих компонентов: хлорида натрия: 2 г/л; моногидрогенфосфата натрия: 2 г/л; ацетата натрия: 0,5 г/л; соевого пептона: 40 г/л; глюкозы: 6 г/л; лошадиной сыворотки: 50 мл/л. После стерилизации 0,012 л среды инокулируют 1,5 мл замороженных бактерий. Культуру инкубируют при 37°C в течение 14 часов при перемешивании. Затем 10 мл этой культуры переносят в колбы, содержащие по 150 мл культурных сред, и инкубируют опять при таких же условиях в течение 10 часов. Конечную стадию осуществляют с помощью таких же условий в колбах больших размеров, содержащих по 1000 мл культурных сред с 20 мл/л лошадиной сыворотки, которую добавляют перед добавлением в ферментер для предварительной ферментации.
Культивирование в ферментерах для предварительной ферментации
Такие же среды, как для стадии, упоминаемой ранее, приготавливают для ферментеров для предварительной ферментации с добавлением полипропиленгликоля 0,06 мл/л и при концентрации лошадиной сыворотки 8 мл/л. Один литр упоминаемой ранее культуры переносят в два ферментера для предварительной ферментации. Температуру инкубирования поддерживают при 30°C при перемешивании. pH во время культивирования не поддерживают. Через 14 часов 2 ферментера для предварительной ферментации переносят в ферментер.
Культивирование в ферментерах
Такие же среды, как на стадии с колбами Эрленмейера, приготавливают для ферментеров для предварительной ферментации, но с добавлением 0,06 мл/л полипропиленгликоля и при концентрации лошадиной сыворотки 1,2 мл/л. Добавляют во время культивирования 15,75 кг глюкозы. Температуру инкубирования поддерживают при 37°C при перемешивании. pH поддерживают при 6,4 с помощью концентрированного KOH. Через 9,25 часа культуры дезактивируют посредством тепловой обработки при 90-100°C и переносят в резервуар для сбора. Затем биомассу отделяют от культурных сред посредством центрифугирования. StSa 046, StSa 047, StSa 048 и StPy 8191 аэрируют стерильным воздухом, и они не требуют добавления лошадиной сыворотки к культуре. Сухая масса биомассы в каждой аликвоте составляет StPn 7465: 134 г, StPn 7466: 142 г StPn 7978: 134 г StPn 10319: 153 г StSa 046: 246 г, StSa 047: 232 г, StSa 048: 353 г и StPy 8191: 269 г.
Пример 2: Бактериальное лизирование
HAIN 8467 Пример 2.1
Аликвоты HAIN 8467 от ферментирования бактериальной биомассы примера 1.1 оттаивают при комнатной температуре и разбавляют насыщенным раствором соли (8 г/л NaCl) до получения 79 г/л сухой массы. Подщелачивание осуществляют с помощью 0,2 M NaOH. Лизирование осуществляют в течение 120 часов при 35-40°C при непрерывном перемешивании. Во время лизирования pH отслеживают с тем, чтобы он не уменьшался более чем на 0,5 единицы pH.
Результаты. 82,2 мг/мл солюбилизированной сухой массы (SDW) и 32,4 мг/мл белков (Prot) и 6,2 мг/мл аминокислот в целом (A.A), вычисленных по глутаминовой кислоте (147,1 г/моль), измеряют с помощью OPA, 2,40 мг/мл восстанавливающих сахаров измеряют с помощью OPA (углеводы).
Концентрацию белка (Prot) измеряют с помощью анализа согласно Lowry (см. European Pharmacopoeia 2.5.33, "total protein - method 2"). Общую концентрацию свободных аминокислот (A.A) измеряют посредством преобразования аминокислот в изоиндольные производные и измерения коэффициента поглощения при 340 нм в соответствии с Roth M., Fluorescence reaction for amino acids, Anal.Chem., 43, 880-882, (1971). Результаты выражают в эквивалентах глутаминовой кислоты. Концентрацию сахара (углеводы) анализируют после кислотного гидролиза и дериватизации в соответствии с D. Herbert et al., Meth. Microbiol. 5B: 266 et seq. (1971).
HAIN 8467 Пример 2.2
Биомассу в соответствии с примером 1.1 разбавляют до 58,2 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 5 дней при 35-40°C при непрерывном перемешивании. (Растворимая сухая масса (SDW): 70,0 мг/мл; белок по Lowry (Prot): 30,0 мг/мл; аминокислоты (A.A): 6,0 мг/мл; углеводы: 2,60 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2), и 2,0 мг/мл (C3): C1: 18,7 мкМ, C2: 20,8 мкМ, C3: 12,1 мкМ.
HAIN 8467 Пример 2.3
Биомассу в соответствии с примером 1.1 разбавляют до 20 г/л. Подщелачивание осуществляют с помощью 0,045M NaOH. Лизирование осуществляют в течение 5 дней при 35-40°C при непрерывном перемешивании. (SDW: 29,99 мг/мл; белок: 4,8 мг/мл; углеводы: 0,2 мг/мл).
HAIN 8467 Пример 2.4 (OP0662L)
Биомассу в соответствии с примером 1.1 разбавляют до 12,5 г/л. Подщелачивание осуществляют с помощью 0,05M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 11,2 мг/мл; белок: <0,2 мг/мл; A.A: 2,0 мг/мл; углеводы: 0,4 мг/мл). Процент D-аминокислот: 15% D-Ala, 9% D-Leu, 45% D-Ser, 21% D-Asx, 15% D-Met, 11% D-Phe, 9% D-Glx.
HAIN 8467 Пример 2.5
Биомассу в соответствии с примером 1.1 разбавляют до 127 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 157,2 мг/мл; белок: 86 мг/мл; A.A: 20,0 мг/мл; углеводы: 4,0 мг/мл). Процент D-аминокислот: 22% D-Ala, 11% D-Leu, 54% D-Ser, 41% D-Asx, 35% D-Met, 32% D-Phe, 29% D-Glx, 6% D-Tyr. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2), и 2,0 мг/мл (C3): C1: 9,1 мкМ, C2: 18,5 мкМ, C3: 3,1 мкМ.
HAIN 8467 Пример 2.6
Биомассу в соответствии с примером 1.1 разбавляют до 12,5 г/л. Подщелачивание осуществляют с помощью 0,05M NaOH. Лизирование осуществляют в течение 3 дней при 35-40°C при непрерывном перемешивании. (SDW: 10,8 мг/мл; белок: меньше чем 0,5 мг/мл; A.A: 2,0 мг/мл; углеводы: 0,4 мг/мл). Процент D-аминокислот: 10% D-Ala, 9% D-Leu, 56% D-Ser, 22% D-Asx, 16% D-Met, 13% D-Phe, 11% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2), и 2,0 мг/мл (C3): C1: 20,2 мкМ, C2: 26,7 мкМ, C3: 4,3 мкМ.
HAIN 8467 Пример 2.7
Биомассу в соответствии с примером 1.1 разбавляют до 127 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 3 дней при 35-40°C при непрерывном перемешивании. (SDW: 168,8 мг/мл; белок: 90 мг/мл; A.A: 22 мг/мл; углеводы: 4,2 мг/мл). Процент D-аминокислот: 36% D-Ala, 8% D-Leu, 9% D-Ser, 44% D-Asx, 42% D-Met, 37% D-Phe, 37% D-Glx, 37% D-Tyr.
HAIN 8467 Пример 2.8
Биомассу в соответствии с примером 1.1 разбавляют до 12,5 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 47,2 мг/мл; белок: меньше чем 0,2 мг/мл; A.A: 4,0 мг/мл; углеводы: 0,2 мг/мл). Процент D-аминокислот: 3% D-Ala, 13% D-Leu, 54% D-Ser, 45% D-Asx, 43% D-Met, 42% D-Phe, 41% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2), и 2,0 мг/мл (C3): C1: 7,5 мкМ, C2: 16,0 мкМ, C3: 8,6 мкМ.
HAIN 8467 Пример 2.9
Биомассу в соответствии с примером 1.1 разбавляют до 127 г/л. Подщелачивание осуществляют с помощью 0,05M NaOH. Лизирование осуществляют в течение 196 часов при 35-40°C при непрерывном перемешивании. Процент D-аминокислот: 14% D-Ala, 5% D-Asx, 11% D-Met, 5% D-Glx.
STPY 8191 Пример 2.10
Одну аликвоту StPy 8191 из примера 1.5, содержащую 269 г бактериального материала, оттаивают при комнатной температуре и разбавляют насыщенным раствором соли (8 г/л NaCl) до получения 59,8 г/л сухой массы. Подщелачивание осуществляют с помощью 0,2M NaOH. Затем лизирование осуществляют в течение 192 часов при 35-40°C при непрерывном перемешивании. Во время лизирования pH отслеживают таким образом, чтобы не было его уменьшения более чем на 0,5 единицы pH. (SDW: 61,92 мг/мл; белок: 31,68 мг/мл; A.A.: 7,2 мг/мл; углеводы: 7,2 мг/мл). Процент D-аминокислот: 22% D-Ala, 11% D-Leu, 54% D-Ser, 41% D-Asx, 35% D-Met, 32% D-Phe, 29% D-Glx, 6% D-Tyr. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2), и 2,0 мг/мл (C3): C1: 4,9 мкМ, C2: 11,8 мкМ, C3: 6,7 мкМ.
STSA 046 Пример 2.11
Биомассу в соответствии с примером 1.5 разбавляют до 30 г/л. Подщелачивание осуществляют с помощью 0,022 н. NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании.
STPY 8191 Пример 2.12
Биомассу в соответствии с примером 1.5 разбавляют до 100 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 120,2 мг/мл; белок: 45,6 мг/мл; A.A: 15,2 мг/мл; углеводы: 2,8 мг/мл). Процент D-аминокислот: 35% D-Ala, 13% D-Leu, 57% D-Ser, 44% D-Asx, 40% D-Met, 39% D-Phe, 43% D-Glx.
STPY 8191 Пример 2.13
Биомассу в соответствии с примером 1.5 разбавляют до 12,7 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 12,5 мг/мл; белок: <0,2 мг/мл; A.A: 0,8 мг/мл; углеводы: 0,1 мг/мл). Процент D-аминокислот: 24% D-Ala, 13% D-Leu, 52% D-Ser, 28% D-Asx, 8% D-Met, 8% D-Phe, 23% D-Glx, 6% D-Tyr.
STPY 8191 Пример 2.14
Биомассу в соответствии с примером 1.5 разбавляют до 100 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 41,4 мг/мл; белок: 3,2 мг/мл; A.A: 4 мг/мл; углеводы: 1,5 мг/мл).
STPY 8191 Пример 2.15
Биомассу в соответствии с примером 1.5 разбавляют до 12,7 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 52,5 мг/мл; белок: 0,8 мг/мл; A.A: 3,2 мг/мл; углеводы: 0,6 мг/мл).
STPY 8191 Пример 2.16
Биомассу в соответствии с примером 1.5 разбавляют до 100 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 147,2 мг/мл; белок: 53,6 мг/мл; A.A: 24,8 мг/мл; углеводы: 5,4 мг/мл). Процент D-аминокислот: 44% D-Ala, 26% D-Leu, 11% D-Ser, 45% D-Asx, 43% D-Met, 42% D-Phe, 46% D-Glx. Продуцирование NOx в мг активной сухой массы/мл: 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 9,7 мкМ, C2: 17,4 мкМ, C3: 2,5 мкМ.
STPY 8191 Пример 2.17
Биомассу в соответствии с примером 1.5 разбавляют до 12,7 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 14,7 мг/мл; белок: 0 мг/мл; A.A: 0,8 мг/мл; углеводы: 0,2 мг/мл). Процент D-аминокислот: 28% D-Ala, 9% D-Ser, 36% D-Asx, 33% D-Met, 32% D-Phe, 31% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 5,8 мкМ, C2: 12,1 мкМ, C3: 6,8 мкМ.
STSA 046 Пример 2.18
Биомассу в соответствии с примером 1 разбавляют до 68 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 90,72 мг/мл; белок: 47,68 мг/мл; A.A: 9,36 мг/мл; углеводы: 2,48 мг/мл).
STSA 047 Пример 2.19
Биомассу в соответствии с примером 1 разбавляют до 68 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании.
STSA 047 Пример 2.20
Биомассу в соответствии с примером 1 разбавляют до 60 г/л. Подщелачивание осуществляют с помощью 0,33M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании.
STSA 048 Пример 2.21
Биомассу в соответствии с примером 1 разбавляют до 62 г/л. Подщелачивание осуществляют с помощью 0,33M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании.
STPY 8191 Пример 2.22
Биомассу в соответствии с примером 1.5 разбавляют до 55 г/л. Подщелачивание осуществляют с помощью 0,33M NaOH. Лизирование осуществляют в течение 4 дней при 35-40°C при непрерывном перемешивании.
STPN 7978 Пример 2.23
Биомассу в соответствии с примером 1.5 разбавляют до 38,7 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 66,4 мг/мл; белок: 25,4 мг/мл; A.A: 6,0 мг/мл; углеводы: 2,5 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 10,2 мкМ, C2: 20,7 мкМ, C3: 20,8 мкМ.
STPN 7978 Пример 2.24
Биомассу в соответствии с примером 1.5 разбавляют до 30 г/л. Подщелачивание осуществляют с помощью 0,022M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 30,4 мг/мл; белок: 2,20 мг/мл; углеводы: 0,40 мг/мл).
STPN 7978 Пример 2.25
Биомассу в соответствии с примером 1.5 разбавляют до 60 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 59 мг/мл; белок: 17 мг/мл; A.A: 7,0 мг/мл; углеводы 1,8 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 9,1 мкМ, C2: 13,4 мкМ, C3: 1,4 мкМ.
STPN 7978 Пример 2.26
Биомассу в соответствии с примером 1.5 разбавляют до 12,5 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 17,8 мг/мл; белок: <0,2 мг/мл; A.A: 2,0 мг/мл; углеводы: 0,7 мг/мл).
STPN 7978 Пример 2.27
Биомассу в соответствии с примером 1.5 разбавляют до 60 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 43,6 мг/мл; белок: 6 мг/мл; A.A: 10 мг/мл; углеводы: 1,5 мг/мл).
STPN 7978 Пример 2.28
Биомассу в соответствии с примером 1.5 разбавляют до 12,5 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 55,4 мг/мл; белок: 2 мг/мл; A.A: 4 мг/мл; углеводы 0,7 мг/мл).
STPN 7978 Пример 2.29
Биомассу в соответствии с примером 1.5 разбавляют до 60 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 118,4 мг/мл; белок: 31 мг/мл; A.A: 19 мг/мл; углеводы: 4,1 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 5,8 мкМ, C2: 12,1 мкМ, C3: 2,8 мкМ.
STPN 7978 Пример 2.30
Биомассу в соответствии с примером 1.5 разбавляют до 12,5 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 18,4 мг/мл; белок: <0,2 мг/мл; A.A: 2 мг/мл; углеводы: 0,5 мг/мл).
STPN 7465 Пример 2.31
Биомассу в соответствии с примером 1.5 разбавляют до 52,5 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 69,4 мг/мл; белок: 32,3 мг/мл; A.A: 6,0 мг/мл; углеводы: 1,7 мг/мл).
STPN 7466 Пример 2.32
Биомассу в соответствии с примером 1.5 разбавляют до 40,0 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 60,6 мг/мл; белок: 29,0 мг/мл; A.A: 6,0 мг/мл; углеводы: 1,50 мг/мл).
STPN 10319 Пример 2.33
Биомассу в соответствии с примером 1.5 разбавляют до 41,2 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 60,4 мг/мл; белок: 28,4 мг/мл; A.A: 6,0 мг/мл; углеводы 1,1 мг/мл).
STSA 046 Пример 2.34
Биомассу в соответствии с примером 1.5 разбавляют до 58,9 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 83,2 мг/мл; белок: 7,2 мг/мл; A.A: 8,39 мг/мл; углеводы: 2,16 мг/мл).
STSA 047 Пример 2.35
Биомассу в соответствии с примером 1.5 разбавляют до 50,4 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 60,64 мг/мл; белок: 27,92 мг/мл; A.A: 7,2 мг/мл; углеводы: 3,52 мг/мл).
STSA 048 Пример 2.36
Биомассу в соответствии с примером 1.5 разбавляют до 66,2 г/л. Подщелачивание осуществляют с помощью 0,25M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 72,96 мг/мл; белок: 36,16 мг/мл; A.A: 7,2 мг/мл; углеводы: 3,28 мг/мл).
NECA I045 Пример 2.37
Одну аликвоту NeCa I045 из примера 1.4, содержащую 223 г бактериального материала, оттаивают при комнатной температуре и разбавляют насыщенным раствором соли (8 г/л NaCl) до получения 22,8 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 192 часов при 35-40°C при непрерывном перемешивании. Во время лизирования pH отслеживают таким образом, чтобы не было его уменьшения более чем на 0,5 единицы pH. (SDW: 41,29 мг/мл; белок: 17,45 мг/мл; A.A.: 3,41 мг/мл; углеводы: 3,4 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 4,2 мкМ, C2: 14,8 мкМ, C3: 13,4 мкМ.
NECA I045 Пример 2.38
Биомассу в соответствии с примером 1.4 разбавляют до 20,5 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 3 дней при 35-40°C при непрерывном перемешивании. (SDW: 36,6 мг/мл; белок: 16,4 мг/мл; A.A: 3,63 мг/мл; углеводы: 0,77 мг/мл).
NECA I045 Пример 2.39
Биомассу в соответствии с примером 1.4 разбавляют до 51,0 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 75,69 мг/мл; белок: 30,8 мг/мл; A.A: 10,8 мг/мл; углеводы: 1,14 мг/мл). Процент D-аминокислот: 40% D-Ala, 45% D-Asx, 42% D-Met, 40% D-Phe, 46% D-Glx, 48% D-Lys. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 4,9 мкМ, C2: 14,3 мкМ, C3: 3,6 мкМ.
NECA I045 Пример 2.40
Биомассу в соответствии с примером 1.4 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 15,08 мг/мл; белок: 7,7 мг/мл; A.A: 1,5 мг/мл; углеводы: 0,28 мг/мл). Процент D-аминокислот: 21% D-Ala, 67% D-Ser, 31% D-Asx, 25% D-Met, 12% D-Lys.
NECA I045 Пример 2.41
Биомассу в соответствии с примером 1.4 разбавляют до 51,0 г/л. Подщелачивание осуществляют при 0,1M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 41,23 мг/мл; белок: 26,2 мг/мл; A.A: 4,6 мг/мл; углеводы: 0,98 мг/мл).
NECA I045 Пример 2.42
Биомассу в соответствии с примером 1.4 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 48,43 мг/мл; белок: 7,7 мг/мл; A.A: 4,3 мг/мл; углеводы: 0,22 мг/мл).
NECA 1045 Пример 2.43
Биомассу в соответствии с примером 1.4 разбавляют до 51,0 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 83,02 мг/мл; белок: 28,9 мг/мл; A.A: 15 мг/мл; углеводы: 1,11 мг/мл). Процент D-аминокислот: 44% D-Ala, 48% D-Ser, 47% D-Asx, 45% D-Met, 43% D-Phe, 50% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 5,1 мкМ, C2: 12,0 мкМ, C3: 7,5 мкМ.
NECA I045 Пример 2.44
Биомассу в соответствии с примером 1.4 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 15,26 мг/мл; белок: 8,6 мг/мл; A.A: 1,8 мг/мл; углеводы 0,22 мг/мл). Процент D-аминокислот: 31% D-Ala, 42% D-Ser, 38% D-Asx, 36% D-Met, 35% D-Phe, 37% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 4,1 мкМ, C2: 13,9 мкМ, C3: 6,0 мкМ.
NECA I045 Пример 2.45
Биомассу в соответствии с примером 1.4 разбавляют до 9 г/л. Подщелачивание осуществляют с помощью 0,066M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 20,62 мг/мл; белок: 5,57 мг/мл; углеводы: 0,06 мг/мл).
NECA NCTC3622 Пример 2.46
Биомассу в соответствии с примером 1.4 разбавляют до 20,1 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 35,69 мг/мл; белок: 14,25 мг/мл; A.A: 3,4 мг/мл; углеводы: 0,71 мг/мл).
NECA NCTC3625 Пример 2.47
Биомассу в соответствии с примером 1.4 разбавляют до 9,7 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 38,83 мг/мл; белок: 15,54 мг/мл; A.A: 3,4 мг/мл; углеводы: 0,95 мг/мл).
KLPN 204 Пример 2.48
Одну аликвоту KLPN 204 из примера 1.3, содержащую 440 г бактериального материала, оттаивают при комнатной температуре и разбавляют насыщенным раствором соли (8 г/л NaCl) до получения 37,7 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 192 часов при 35-40°C при непрерывном перемешивании. Во время лизирования pH отслеживают таким образом, чтобы не было его уменьшения более чем на 0,5 единицы pH. (SDW: 51,77 мг/мл; белок: 27,66 мг/мл; A.A.: 4,2 мг/мл; углеводы: 1,03 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2), и 2,0 мг/мл (C3): C1: 0,6 мкМ, C2: 2,8 мкМ, C3: 1,8 мкМ.
KLPN 204 Пример 2.49
Биомассу в соответствии с примером 1.3 разбавляют до 9 г/л. Подщелачивание осуществляют с помощью 0,013 н. NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 25,71 мг/мл; белок: 4,91 мг/мл; углеводы 0,51 мг/мл).
KLPN 204 Пример 2.50
Биомассу в соответствии с примером 1.3 разбавляют до 99 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 50,63 мг/мл; белок: 15,4 мг/мл; A.A: 2,9 мг/мл; углеводы: 2,1 мг/мл). Процент D-аминокислот: 5% D-Ala, 6% D-Asx.
KLPN 204 Пример 2.51
Биомассу в соответствии с примером 1.3 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 52,69 мг/мл; белок: 5,7 мг/мл; A.A: 2,3 мг/мл; углеводы: 0,3 мг/мл). Процент D-аминокислот: 36% D-Ala, 8% D-Ser, 45% D-Asx, 7% D-Met, 27% D-Phe, 40% D-Glx, 29% D-Lys. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,5 мкМ, C2: 0,8 мкМ, C3: 6,0 мкМ.
KLPN 204 Пример 2.52
Биомассу в соответствии с примером 1.3 разбавляют до 99 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 136,34 мг/мл; белок: 58,9 мг/мл; A.A: 20,6 мг/мл; углеводы: 3,4 мг/мл).
KLPN 204 Пример 2.53
Биомассу в соответствии с примером 1.3 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 18,06 мг/мл; белок: 6,3 мг/мл; A.A: 1,1 мг/мл; углеводы: 0,3 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,5 мкМ, C2: 1,6 мкМ, C3: 1,9 мкМ.
KLPN 204 Пример 2.54
Биомассу в соответствии с примером 1.3 разбавляют до 99 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 58,06 мг/мл; белок: 20 мг/мл; A.A: 4,6 мг/мл; углеводы 2,7 мг/мл).
KLPN 204 Пример 2.55
Биомассу в соответствии с примером 1.3 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 52,57 мг/мл; белок: 5,7 мг/мл; A.A: 4,0 мг/мл; углеводы: 0,3 мг/мл). Процент D-аминокислот: 43% D-Ala, 25% Val, 5% D-Ser, 46% D-Asx, 46% D-Met, 45% D-Phe, 44% D-Glx, 38% D-Lys. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,5 мкМ, C2: 0,6 мкМ, C3: 2,6 мкМ.
KLPN 5056 Пример 2.56
Биомассу в соответствии с примером 1.3 разбавляют до 39,4 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 52,69 мг/мл; белок: 27,83 мг/мл; A.A: 4,0 мг/мл; углеводы: 1,09 мг/мл).
KLPN 5050 Пример 2.57
Биомассу в соответствии с примером 1.3 разбавляют до 34,2 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 48,23 мг/мл; белок: 26,57 мг/мл; A.A: 4,0 мг/мл; углеводы: 1,03 мг/мл).
STAU I051 Пример 2.58
Одну аликвоту StAu I051 из примера 1.2, содержащую 375 г бактериального материала, оттаивают при комнатной температуре и разбавляют насыщенным раствором соли (8 г/л NaCl) до получения 55,2 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 192 часов при 35-40°C при непрерывном перемешивании. Во время лизирования pH должен отслеживаться таким образом, чтобы не было его уменьшения более чем на 0,5 единицы pH. (SDW: 66,4 мг/мл; белок: 34,08 мг/мл; A.A.: 6,4 мг/мл; углеводы: 0,64 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,6 мкМ, C2: 0,8 мкМ, C3: 1,4 мкМ.
STAU I051 Пример 2.59
Биомассу в соответствии с примером 1.2 разбавляют до 51 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 9 дней при 35-40°C при непрерывном перемешивании. (SDW: 65,31 мг/мл; белок: 25,56 мг/мл; A.A: 6,57 мг/мл; углеводы: 0,98 мг/мл).
STAU I051 Пример 2.60
Биомассу в соответствии с примером 1.2 разбавляют до 81 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. (SDW: 137,2 мг/мл; белок: 51,2 мг/мл; A.A: 20,8 мг/мл; углеводы: 1,6 мг/мл). Процент D-аминокислот: 51% D-Ala, 11% D-Ser, 43% D-Asx, 37% D-Met, 35% D-Phe, 43% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,6 мкМ, C2: 0,8 мкМ, C3: 1,3 мкМ.
STAU I051 Пример 2.61
Биомассу в соответствии с примером 1.2 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 55,7 мг/мл; белок: 4,8 мг/мл; A.A: 4,8 мг/мл; углеводы: 0,2 мг/мл).
STAU I051 Пример 2.62
Биомассу в соответствии с примером 1.2 разбавляют до 81 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 130,1 мг/мл; белок: 47,2 мг/мл; A.A: 24,8 мг/мл; углеводы: 1,4 мг/мл).
STAU I051 Пример 2.63
Биомассу в соответствии с примером 1.2 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 18,4 мг/мл; белок: 4,8 мг/мл; A.A: 2,4 мг/мл; углеводы: 0,2 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,5 мкМ, C2: 0,6 мкМ, C3: 1,3 мкМ.
STAU I051 Пример 2.64
Биомассу в соответствии с примером 1.2 разбавляют до 81 г/л. Подщелачивание осуществляют с помощью 0,7M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 134,6 мг/мл; белок: 48 мг/мл; A.A: 25,6 мг/мл; углеводы: 1,5 мг/мл). Процент D-аминокислот: 56% D-Ala, 10% D-Ser, 45% D-Asx, 42% D-Met, 39% D-Phe, 73% D-Tyr, 49% D-Glx. Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,6 мкМ, C2: 0,7 мкМ, C3: 1,1 мкМ.
STAU I051 Пример 2.65
Биомассу в соответствии с примером 1.2 разбавляют до 13 г/л. Подщелачивание осуществляют с помощью 0,1M NaOH. Лизирование осуществляют в течение 10 дней при 35-40°C при непрерывном перемешивании. (SDW: 17,9 мг/мл; белок: 5,6 мг/мл; A.A: 2,4 мг/мл; углеводы: 0,2 мг/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,02 мг/мл (C1), 0,2 мг/мл (C2) и 2,0 мг/мл (C3): C1: 0,5 мкМ, C2: 0,6 мкМ, C3: 3,7 мкМ.
STAU I049 Пример 2.66
Биомассу в соответствии с примером 1.2 разбавляют до 52,8 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 70,08 мг/мл; белок: 34,4 мг/мл; A.A: 6,4 мг/мл; углеводы: 0,64 мг/мл).
STAU I050 Пример 2.67
Биомассу в соответствии с примером 1.2 разбавляют до 47,5 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 64,32 мг/мл; белок: 32,24 мг/мл; A.A: 6,4 мг/мл; углеводы: 0,64 мг/мл).
STAU I050 Пример 2.68
Биомассу в соответствии с примером 1.2 разбавляют до 48,5 г/л. Подщелачивание осуществляют с помощью 0,033M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании.
STAU I052 Пример 2.69
Биомассу в соответствии с примером 1.2 разбавляют до 56,9 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°С при непрерывном перемешивании. (SDW: 62,72 мг/мл; белок: 30,8 мг/мл; A.A: 6,4 мг/мл; углеводы: 0,72 мг/мл).
STAU I053 Пример 2.70
Биомассу в соответствии с примером 1.2 разбавляют до 67,3 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 68,8 мг/мл; белок: 32,24 мг/мл; A.A: 6,4 мг/мл; углеводы: 1,2 мг/мл).
STAU I050 Пример 2.71
Биомассу в соответствии с примером 1.2 разбавляют до 63,6 г/л. Подщелачивание осуществляют с помощью 0,2M NaOH. Лизирование осуществляют в течение 8 дней при 35-40°C при непрерывном перемешивании. (SDW: 68,96 мг/мл; белок: 24,56 мг/мл; A.A: 6,4 мг/мл; углеводы: 2,56 мг/мл).
Пример 3: Очистка лизатов
Пример 3.1: Осветленный экстракт грам-отрицательного и грам-положительного штамма
2 л продукта примера 2.57 и 2 л продукта примера 2.66 смешивают вместе, pH доводят до 12,0 с помощью добавления концентрированной HCl и смесь разбавляют 2 л 8 г/л раствора NaCl. Разбавленную смесь переносят в резервуар для микрофильтрации (MF). Узел для микрофильтрации использует 0,45-микронный фильтр для проточной фильтрации вдоль потока (PALL Procette PES 0,45 микрон) в серпентинном режиме (см. фиг.1). Поперечный поток устанавливают при 2000 л/час·м2 (LHM) и перепад давления на мембране (TMP) при 1,3 бар. Пермеат от микрофильтрации переносят в резервуар для ультрафильтрации (UF).
После того как объем смеси в резервуаре для микрофильтрации достигает половины от начального объема, запускают узел для UF. Узел для микрофильтрации использует 30-кДа фильтр для проточной фильтрации вдоль потока (PALL Centrasette PES 30kD). Поперечный поток устанавливают при 1000 LHM и TMP при 0,5 бар.
Объемы в резервуарах для MF и UF поддерживают при одинаковом уровне. При каждом объеме диафильтрации концентрацию белка измеряют с помощью способа согласно Bradford. [Способ согласно Bradford является стандартным в данной области. Нет необходимости в цитировании источников, за исключением случаев, когда различные пути осуществления способа дают значимо различающиеся результаты]. В резервуаре для UF содержание белка согласно Bradford составляет 26,8 мг/мл после 1 объема диафильтрации (DFV), 34,8 мг/мл после 4 DFV и 37,2 мг/мл после 9 DFV. Поток пермеата от микрофильтрации во время диафильтрации составляет 15 LHM. После 14 объемов диафильтрации UF останавливают и продукт концентрируют в резервуаре для MF. Продукт содержит 15,9 мг/мл белка. Затем продукт разбавляют до 7,4 мг/мл и фильтруют через 0,2-микронный стерильный фильтр. (Солюбилизируемый сухой остаток (SDR): 21,0 мг/мл, белок: 7,4 мг/мл, A.A.: 1,2 мг/мл, глюциды (углеводы): 0,3 мг/мл, хлорид: 4,6 мг/мл). Продуцирование NOx в мг белка по Lowry, мг/мл, 0,03 мг/мл (C1), 0,3 мг/мл (C2) и 3,0 мг/мл (C3): C1: 5,8 мкМ, C2: 11,4 мкМ, C3: 1,2 мкМ.
Пример 3.2: Штамм Klba Mono
4 кг примера 2.57 доводят до pH 12,0 и разбавляют 4 л 8 г/л раствора NaCl. Разбавленный лизат переносят в резервуар для микрофильтрации.
Параметры микрофильтрации представляют собой поперечный поток 2000 LHM, TMP 1,3 бар, порог пропускания: 0,45 мкм. Параметры ультрафильтрации представляют собой поперечный поток 1000 LHM, TMP 0,5 бар, порог пропускания: 30 кДа, количество объемов диафильтрации: 8.
Продукт разбавляют до 7,0 мг/мл и фильтруют через 0,2-микронный стерильный фильтр. (SDR: 18,0 мг/мл, белок: 7,0 мг/мл, A.A.: 0,8 мг/мл, углеводы: 0,3 мг/мл). Продуцирование NOx в мг белка по Lowry/мл, 0,03 мг/мл (C1), 0,3 мг/мл (C2) и 3,0 мг/мл (C3): C1: 5,2 мкМ, C2: 9,8 мкМ, C3: 1,1 мкМ.
Пример 3.3: Штамм Moraxella Mono
2 кг продукта примера 2.37 доводят до pH 10,7 и разбавляют 3 л 8 г/л раствора NaCl. Разбавленный лизат переносят в резервуар для микрофильтрации.
Параметры микрофильтрации представляют собой поперечный поток 2000 LHM, TMP 1,3 бар, порог пропускания: 0,45 мкм. Параметры ультрафильтрации представляют собой поперечный поток 1000 LHM, TMP 0,5 бар, порог пропускания: 30 кДа, количество объемов диафильтрации: 8.
Продукт разбавляют до 7,0 мг/мл и фильтруют через 0,2-микронный стерильный фильтр. (SDR: 19,4 мг/мл, белок: 6,8 мг/мл).
Пример 3.4: Штамм Pneumoniae Mono
5,0 кг продукта из примера 2.32 доводят до pH 12,27 и разбавляют 5,0 литрами 8 г/л раствора NaCl. Разбавленный лизат переносят в резервуар для микрофильтрации.
Параметры микрофильтрации представляют собой поперечный поток 2000 LHM, TMP 1,3 бар, порог пропускания: 0,45 мкм. Параметры ультрафильтрации представляют собой поперечный поток 1000 LHM, TMP 0,5 бар, порог пропускания: 30 кДа, количество объемов диафильтрации: 8.
Продукт разбавляют до 7,0 мг/мл и фильтруют через 0,2-микронный стерильный фильтр. (SDR: 23,3 мг/мл, белок: 4,3 мг/мл).
Пример 3.5
500 мл продукта из примера 2.45, 500 мл продукта из примера 2.47 и 500 мл продукта из примера 2.37 смешивают и центрифугируют при 9000×g. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. pH доводят до 10,5 с помощью HCl.
Пример 3.6
300 мл лизата из примера 2.23, 300 мл продукта из примера 2.31, 300 мл продукта из примера 2.32 и 300 мл продукта из примера 2.33 смешивают и центрифугируют в течение 30 минут при 9000×g. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. pH доводят до 10,5 с помощью HCl. Аналитические результаты: (SDR: 63,60 мг/мл, белок: 23,00 мг/мл, A.A.: 6,00 мг/мл, углеводы: 1,60 мг/мл).
Пример 3.7
300 мл продукта из примера 2.48, 300 мл продукта из примера 2.56, и 300 мл продукта из примера 2.57 смешивают и центрифугируют при 9000×g. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. pH доводят до 10,5 с помощью HCl. (SDR: 50,40 мг/мл, белок: 22,30 мг/мл, A.A.: 4,0 мг/мл, углеводы: 0,97 мг/мл). Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 1,06 мкМ, C2: 3,19 мкМ, C3: 7,62 мкМ.
Пример 3.8
200 мл продукта из примера 2.58, 200 мл продукта из примера 2.66, 200 мл продукта из примера 2.67, 200 мл продукта из примера 2.69, 200 мл продукта из примера 2.70 и 200 мл продукта из примера 2.71 смешивают и центрифугируют при 9000×g. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. pH доводят до 10,5 с помощью HCl. (SDR: 65,12 мг/мл, белок: 24,80 мг/мл, A.A.: 7,2 мг/мл, углеводы: 1,12 мг/мл). Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 0,76 мкМ, C2: 1,16 мкМ, C3: 3,79 мкМ.
Пример 3.9
500 мл продукта из примера 2.46, 500 мл продукта из примера 2.47 и 500 мл продукта из примера 2.37 смешивают и центрифугируют при 9000×g. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. pH доводят до 10,5 с помощью HCl. (SDR: 38,15 мг/мл, белок: 13,5 мг/мл, A.A.: 3,4 мг/мл, углеводы: 0,80 мг/мл). Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 2,25 мкМ, C2: 5,25 мкМ, C3: 14,21 мкМ.
Пример 3.10
500 мл продукта из примера 2.34, 500 мл продукта из примера 2.35, 500 мл продукта из примера 2.36, и 500 мл продукта из Примера 2.10 смешивают и центрифугируют при 9000×g. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. pH доводят до 10,5 с помощью HCl. (SDR: 69,6 мг/мл, белок: 28,00 мг/мл, A.A.: 7,2 мг/мл, углеводы: 2,48 мг/мл). Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 0,95 мкМ, C2: 1,21 мкМ, C3: 4,44 мкМ.
Пример 3.11
10 мл лизата из примера 2.61 и 10 мл продукта из примера 2.27 центрифугируют при 9000×g по отдельности. Супернатанты фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. По 3 мл каждого супернатанта смешивают. pH доводят до 7,2 с помощью HCl. Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 0,34 мкМ, C2: 0,66 мкМ, C3: 1,33 мкМ.
Пример 3.12
10 мл продукта из примера 2.58 и 10 мл продукта из примера 2.61 центрифугируют при 9000×g, по отдельности. Супернатанты фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. 3 мл каждого супернатанта смешивают вместе. pH доводят до 7,6 с помощью HCl. Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 0,40 мкМ, C2: 0,44 мкМ, C3: 0,71 мкМ.
Пример 3.13
10 мл продукта из примера 2.9 и 10 мл продукта из примера 2.8 центрифугируют при 9000×g, по отдельности. Супернатанты фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. 1,5 мл первого лизата (пример 2.9) смешивают с 4,5 мл второго (пример 2.8). pH доводят до 7,2 с помощью HCl. Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 8,7 мкМ, C2: 16,90 мкМ, C3: 21,1 мкМ.
Пример 3.14
10 мл продукта из примера 2.2 и 10 мл продукта из примера 2.8 центрифугируют при 9000×g, по отдельности. Супернатант фильтруют последовательно через фильтры с пористостью 0,8 мкм, 0,45 мкм и 0,2 мкм. 3 мл каждого супернатанта смешивают вместе. pH доводят до 7,5 с помощью HCl. Продуцирование NOx в мг солюбилизированной сухой массы/мл, 0,01 мг/мл (C1), 0,1 мг/мл (C2) и 1,0 мг/мл (C3): C1: 9,2 мкМ, C2: 11,3 мкМ, C3: 17,2 мкМ.
Пример 3.15
13,2 л лизата из примера 2.2, 48,6 л смешанного лизирования из примера 3.9, 36,6 л смешанного лизирования из примера 3.7, 36 л смешанного лизирования из примера 3.8, 14,4 л продукта из примера 3.6 и 18,4 л продукта из примера 3.10 смешивают вместе и разбавляют до 334,4 л 8 г/л раствора NaCl. Раствор очищают с помощью проточной фильтрации вдоль потока в сдвоенной системе петель микрофильтрации и ультрафильтрации, как описано в примере 3.1. (SDW: 21,0 мг/мл; белок: 6,4 мг/мл; A.A: 1,9 мг/мл; углеводы 0,45 мг/мл). Процент D-аминокислот: 42% D-Ala, 12% Leu, 53% D-Ser, 37% D-Asx, 35% D-Met, 32% D-Phe, 28% D-Glx, 8% D-Tyr, 16% Lys. Продуцирование NOx в мг белка по Lowry, мг/мл, 0,03 мг/мл (C1), 0,3 мг/мл (C2) и 3,0 мг/мл (C3): C1: 9,3 мкМ, C2: 14,3 мкМ, C3: 11,5 мкМ.
Пример 4: Сравнительный пример бактериального лизирования при условиях более низкого pH
Пример 4 представляет собой способ, который осуществляют в щелочных условиях вне рамок настоящего изобретения. Концентрации NaOH, используемые для осуществления лизирования бактерий, ниже, чем 0,1%, что приводит к более низким значениям pH.
Смешивают следующие лизаты: 1,18 кг продукта из примера 2.24, 3,0 кг продукта из примера 2.49, 2,95 кг продукта из примера 2.69, 1,08 кг продукта из примера 2.4, 1,51 кг продукта из примера 2.11 и 3,98 кг продукта из примера 2.45. Шесть килограммов смеси разбавляют до 12 кг 8 г/л раствором NaCl и pH доводят до pH 12,0. Параметры микрофильтрации представляют собой: поперечный поток 2000 LHM, TMP 1,3 бар, порог пропускания: 0,45 мкм. Параметры ультрафильтрации представляют собой: поперечный поток 1000 LHM, TMP 0,5 бар, порог пропускания: 30 кДа, количество объемов диафильтрации: 12. (SDR: 19,4 мг/мл, белок: 3,1 мг/мл, A.A.: 2,0 мг/мл, углеводы: 0,1 мг/мл, LAL: 20140 EU/мл). Продуцирование NOx в мг активной сухой массы/мл, 0,03 мг/мл (C1), 0,3 мг/мл (C2) и 3,0 мг/мл (C3): C1: 9,3 мкМ, C2: 14,3 мкМ, C3: 11,5 мкМ.
Пример 5: Лизирование Lactobaccilus helveticus
Аликвоты бактериальной биомассы Lactobacillus helveticus, полученной посредством ферментации на растительной среде, оттаивают при комнатной температуре и разбавляют очищенной водой до получения концентрации сухой массы 80 г/л. Подщелачивание осуществляют с помощью 0,2 M NaOH. Лизирование осуществляют в течение 2 дней при 35-40°C при непрерывном перемешивании. Во время лизирования pH отслеживают таким образом, чтобы не было его уменьшения более чем на 0,5 единицы pH.
Пример 6: Иммунопротекторное действие против аэрозольной инфекции вируса гриппа у мышей
Этот эксперимент имеет целью исследование неспецифичной иммунологической активности определенных вариантов осуществления настоящего изобретения посредством оценки их эффективности против вируса, а именно H1N1. Самок мышей BALB/с в возрасте шести недель покупают у Bundesinstitut für Risikobewertung, Berlin, и используют для всех экспериментов. Животных поддерживают при нормальных условиях при температуре окружающей среды 22°C и относительной влажности 60±5%. Программу освещения устанавливают с циклом свет-темнота 12:12 часов. Животных кормят стандартной пищей из гранул (Altromin 1314, Altromin, Lage, Germany) и снабжают водопроводной водой ad libitum.
Предварительное лечение
В целом 60 мышей делят на 3 группы по 20 мышей каждая, с 2 лечебными группами и 1 контрольной группой. Животных (2 группы) предварительно лечат дозой либо 1 мг, либо 10 мг на мышь ежедневно в течение 10 последовательных дней, либо контролем PBS (1 группа). В конце предварительного лечения всем мышам дают аэрозоль вируса гриппа A/PR/8/34 (H1N1), адаптированного для мышей. LD50 для мышей при использовании этого штамма обычно составляет 10-4,5 для интраназального и 10-1,7 для аэрозольного режима ведения. Дозировку, используемую для провоцирования инфекции, в этих экспериментах выбирают так, чтобы обеспечить получение разбавления, способного вызывать инфекцию вируса гриппа, вызывающую четкие симптомы, но не 100% смертность.
Летальность наблюдают ежедневно в группах по 10 мышей в течение 10 дней. Результаты, представленные на фиг.3, показывают, что доза экстракта 10 мг/мышь при условиях дозирования этого эксперимента могла бы обеспечивать полную защиту против повторной инфекции. В противоположность этому, только 70% контрольных мышей переживают инфекцию вируса гриппа. Выживаемость в группе, принимающей 1 мг/мышь лекарственного средства, составляет 70%.
Клинические симптомы, наблюдаемые у леченых мышей после инфекции вируса гриппа
Группы по 10 мышей, каждая, наблюдают ежедневно относительно клинических симптомов инфекции вируса гриппа. Балльные оценки клинических симптомов показаны в таблице ниже. Животные, которым вводят 10 мг доз экстракта, показывают легкие клинические симптомы через 2 дня и выздоравливают заметно раньше, чем контрольная группа мышей, что указывает на полезное воздействие упомянутых выше доз. Нет значимых различий в клинических балльных оценках между группами, лечеными дозами по 1 мг, и контролями.
+++
+++
1 мг
+++
+++
10 мг
++
+++
+++
+++
+++
Титры антител, ингибирующих гемагглютинирование гриппа, у леченых мышей
Сыворотки собирают на 10 день после провоцирования вирусом гриппа, по 3 мыши в группе, после первого и второго инфицирования. Сыворотки, которые получают от иммунизированных животных, хранят при -20°C. Все сыворотки предварительно обрабатывают разрушающим рецепторы ферментом для удаления неспецифичных ингибиторов. Исследования ингибирования гемагглютинирования гриппа (HI) осуществляют на планшетах для микротитрования с использованием 0,5% куриных эритроцитов и 4 гемагглютинирующих единиц с использованием стандартной процедуры, рекомендованной Всемирной Организацией Здравоохранения (WHO, 2002). Результаты, показывающие средние геометрические значения для титров HI антитела против вируса гриппа A/PR/8/34 (H1N1), представлены в таблице ниже. Нет значимых различий между лечеными группами и контролями после первого инфицирования.
По этой причине мышам дают второе (бустерное) провоцирование инфекции с помощью вируса гриппа A/PR/8/34 через 21 день после первого (первичного) инфицирования. Величина титров антитела увеличивается после провоцирования вирусом A/PR/8/34 (H1N1), как показано выше. Более высокие уровни титров антитела HI наблюдают для дозы OM-85 BV, 10 мг/мышь. В противоположность этому, доза 1 мг/мышь имеет более низкие титры антитела, чем доза лекарственного средства 10 мг/мышь.
Нет значительных различий между лечеными группами и контролями по детектируемому вирусу в легких. Тем не менее, клинические симптомы после аэрозольного инфицирования патогенным для мышей вирусом гриппа A/PR/8/34 у животных, которым вводится доза экстракта в соответствии с настоящим изобретением 10 мг, появляются, по меньшей мере, на один полный день позже, чем у контролей, и экспериментальная группа также выздоравливает заметно раньше, чем контрольные мыши. Однако нет значительных различий в клинических балльных оценках между группами, которых лечат дозами по 1 мг, и контролями, что говорит о том, что влияние экстракта зависит от дозы. Через три дня после первого инфицирования нет значительных различий в уровнях антител, ингибирующих гемагглютинирование гриппа, между лечеными группами и контролями. Однако при втором инфицировании вирусом гриппа A/PR/8/34 через три недели после первого инфицирования наблюдается более высокая и значительная величина индуцирования антител для группы с дозами по 10 мг/мышь.
Этот пример показывает, что экстракт в соответствии с настоящим изобретением при дозировке 10 мг на мышь способен обеспечить защиту против инфекции патогенного для мышей аэрозольного вируса гриппа A/PR/8/34 (H1N1), как определено по множеству параметров. Варианты осуществления настоящего изобретения могут по этой причине активировать in vivo иммунную реакцию против вируса. Поскольку экстракты могут быть в некоторых вариантах осуществления получены исключительно из патогенных бактерий как экстракт, исследуемый в настоящем примере, это говорит о том, что варианты осуществления настоящего изобретения могут активировать природную иммунную систему.
Пример 7: Исследование активности вариантов осуществления настоящего изобретения по измерению оксида азота у грызунов
Самцы мышей в возрасте шести недель C57/BL6 (возраст шесть недель, самцы, качество SPF, Charles Rivier, FR) умерщвляются посредством вдыхания ими СО2. Тазобедренный сустав, бедренную кость и голень задней конечности удаляют. Костный мозг извлекают из просвета позвоночника с помощью инъекции среды Игла, модифицированной Дульбекко (DH), через кость, после отрезания обеих конечных частей. После промывки стволовые клетки повторно суспендируют (40000 клетки/мл) в среде DH, дополненной 20% лошадиной сыворотки и 30% супернатантом клеток L929. Суспензию клеток инкубируют в течение 8 дней в инкубаторе при 37°C при 8% CO2 и в атмосфере, насыщенной влажностью. Затем макрофаги отделяют с помощью PBS со льдом, промывают и повторно суспендируют в среде DH, дополненной 5% фетальной сыворотки теленка (FCS), аминокислотами и антибиотиками (среда DHE). Плотность клеток доводят до 700000 клеток/мл. Водные растворы продуктов последовательно разбавляют в среде DHE, непосредственно в планшетах для микротитрования. Продукты исследуют по три раза, и каждый планшет для микротитрования содержит отрицательный контроль, состоящий из среды. Конечный объем в каждой лунке составляет 100 мкл. 100 мкл суспензии клеток добавляют к разбавленным продуктам, и клетки инкубируют в течение 22 час в инкубаторе при 37°C, при 8% CO2 и в атмосфере, насыщенной влажностью. В конце периода инкубирования 100 мкл супернатанта переносят в другой планшет для микротитрования, и концентрацию нитрита, продуцируемого в каждом супернатанте, определяют посредством осуществления реакции Грисса. 100 мкл реагента Грисса (5 мг/мл сульфаниламида + 0,5 мг/мл гидрохлорида N-(1-нафтил)этилендиамина) в 2,5% водном растворе фосфорной кислоты добавляют в каждую лунку. Планшеты для микротитрования считывают с помощью спектрофотометра (SpectraMax Plus, Molecular Devices) на 562 нм в сравнении с эталоном на 690 нм. Концентрация нитрита пропорциональна содержанию оксида азота, которая образуется. Содержание нитрита определяют на основе стандартных кривых. Результаты приводятся в мкМ оксида азота (NO) как среднее значение ± стандартное отклонение и изображаются на графике как кривая доза-ответ (см. фиг.4-7).
Пример 8: Хромогенное исследование с использованием лизата амебоцитов Limulus (LAL)
Для определения присутствия молекул, подобных эндотоксинам, исследование LAL осуществляют с помощью Chromogenic - LAL Kit от Bio-Whittaker.
Это исследование основано на активировании с помощью липополисахаридов (LPS) или продуктов сравнимой структуры, с помощью ферментативного каскада, присутствующего в LAL. Это ферментативное активирование демонстрируется посредством отщепления хромогена, связанного с пептидом, с помощью протеазы. Ферментативную реакцию осуществляют при 37°C и образование хромогена со временем измеряют на 405 нм. Время, необходимое для получения 0,2 единицы D.O., регистрируют, и эндотоксичную активность вычисляют по отношению к стандарту LPS (стандартные кривые).
Результаты такого примерного эксперимента на экстрактах в соответствии с настоящим изобретением приводятся в таблице ниже в EU (единицах эндотоксинов) по отношению к стандартному препарату E.coli LPS (1 EU соответствует 0,09 нг эквивалента LPS).
Пример 9: Ингибирование секреции гистамина
Модель дегранулирования мастоцитов крысы in vitro (предложена CRO CEREP, catalog number 2006: 771-c, ссылка: Håkanson R., Rönnberg A.L., Sjölund K. Anal. Biochem., 1972 Jun. 47(2): 356-70) используют для исследования пути, по которому один из вариантов осуществления настоящего изобретения (включающего 21 бактериальный штамм) ингибировал бы секрецию гистамина мастоцитами, стимулируемыми соединением 48/80. Протокол и экспериментальные условия вкратце перечисляются в таблицах, ниже:
Протокол
Экспериментальные условия
(0,1 кг/мл)
Анализ и представление результатов
Результаты выражают как процент от контрольной удельной активности: (измеренная удельная активность/контрольная удельная активность)×100, полученный в присутствии исследуемых соединений. Значения IC50 (концентрации, вызывающей половинное максимальное ингибирование контрольной удельной активности) определяют с помощью нелинейного регрессионного анализа кривых ингибирования, генерируемых с помощью средних многократно получаемых значений с использованием уравнения Хилла для подгоночной кривой (Y=D+[(A-D)/(1+(C/C50)nH)], где Y=удельная активность, D=минимальная удельная активность, A=максимальная удельная активность, C=концентрация соединения, C50=IC50 и nH=коэффициент крутизны). Этот анализ осуществляют с использованием программного обеспечения, разработанного Cerep (Hill software), и проверяют с помощью сравнения с данными, генерируемыми коммерческим программным обеспечением SigmaPlot® 4.0 for Windows® (© 1997 by SPSS Inc.).
В каждом эксперименте эталон исследуют одновременно с исследуемым экстрактом для оценки пригодности анализа. Исследуют несколько концентраций (для определения значения IC50) и данные сравнивают с историческими значениями, определяемыми Cerep. Анализ считают надежным, если удовлетворяются критерии пригодности, в соответствии с соответствующей стандартной рабочей процедурой. Значения IC50, определенные для исследуемого экстракта и эталона (измеряют дважды), показаны в таблице ниже. Значения IC50 для эталона находятся в приемлемых пределах от исторических средних ± 0,5 log единицы.
Соответствующие кривые ингибирования, полученные с помощью исследуемого экстракта, показаны на фиг.8.
Результаты показывают, что исследуемый экстракт является потенциальным ингибитором секреции гистамина, индуцируемой мастоцитами, стимулируемыми соединением 48/80.
Пример 10: Влияние одного из вариантов осуществления настоящего изобретения в модели инфекции Escherichia coli на штамме мышей, невосприимчивых к LPS
Вариант осуществления настоящего изобретения исследуют в наблюдаемой in vivo модели бактериальной инфекции E.coli (см. Hopkins et al., Inheritance of susceptibility to induced Escherichia coli bladder and kidney infections in female C3H/HeJ mice., J. Infect. Dis. 2003 Feb. 1; 187(3): 418-23). Мыши C3H/HeJ мутируют относительно гена toll-подобного рецептора (TLR4) и являются невосприимчивыми к агонистам TLR4, таким как LPS. По этой причине эта модель является пригодной для детектирования влияния лекарственных средств, действующих путями, иными, чем TLR4.
Одну группу самок мышей C3H/HeJ в возрасте 10-12 недель (8 мышей) лечат перорально экстрактом, сходным с продуктом примера 3.15, в течение 10 дней перед инфицированием E.coli.
Животных выдерживают при нормальных условиях при температуре окружающей среды 18-26°C и относительной влажности от 30 до 70%. Программу освещения устанавливают на цикл свет-темнота 12:12 часов.
Животных кормят стандартной пищей, производимой Harlan Sprague Dawley (Indianapolis, IN) laboratories. Водопроводной водой обеспечивают ad libitum, если не указано иное.
Леченые животные получают перорально 143 мг лиофилизата (т.е. 25 мг (17,5%) бактериального экстракта и 118 мг (82,5%) носителей) на животное при введении экстракта.
Инокуляция
Мышей инокулируют интравезикально фосфатным буферным солевым раствором (PBS) или уропатогенным штаммом E.coli в соответствии с протоколом минимального инокулирования, что понижает вероятность связанной с обратным потоком инокуляции почек и вызывает инфекции у всех инокулированных животных. Штамм E.coli 1677, выделенный из мочи женщин с лихорадочным UTI, используют в этих экспериментах. Для приготовления инокулума бактерии выращивают из замороженного бульона с помощью 2 пассажей в триптозной питательной среде (Difco Laboratories), промывают PBS и повторно суспендируют до концентраций 2×1010 бактерий/мл. Мышам не дают воды в течение 1 часа и мочу удаляют из их мочевых пузырей непосредственно перед инокуляцией. Десять микролитров бактериального инокулума вливают в мочевой пузырь посредством уретральной катетеризации под изофлурановой анестезией, что приводит к получению дозы 2×108 E.coli на мышь. Животным позволяют восстановиться после анестезии и опять дают воду через 1 час.
Мышей умерщвляют через 10 дней после инокуляции для оценки интенсивности инфицирования мочевого пузыря и почек. Мочевой пузырь и обе почки у каждого животного удаляют, взвешивают и гомогенизируют в стерильном PBS, после чего гомогенаты последовательно наносят на пластины агара Левина с эозином - метиленовым голубым (Difco Laboratories). Количество колоний E.coli на каждой пластине подсчитывают после инкубирования в течение ночи при 37°C и используют для вычисления общего количества бактерий в каждом мочевом пузыре или паре почек.
Точный тест Фишера для наименьшего значимого различия используют для определения статистически значимых различий между средними общими значениями колониеобразующих единиц (CFU) для различных групп мышей (PBS, нелеченая инфицированная группа, и леченая и инфицированная группа). Данные по инфекции мочевого пузыря и почек преобразуют с использованием общего CFU=log10 [(CFU+100)/мг ткань], где CFU представляет собой общее количество колониеобразующих единиц, подсчитанных на образец ткани.
Полученные результаты показаны на фиг.9a и 9b для мочевого пузыря и почек, соответственно. Мышей умерщвляют через 10 дней после инокуляции для оценки интенсивности инфекции мочевого пузыря и почек. Мочевой пузырь и обе почки каждого животного удаляют, взвешивают и гомогенизируют в стерильном PBS, после чего гомогенаты последовательно помещают на пластины агара Левина, окрашенного эозином - метиленовым голубым (Difco Laboratories). Количество колоний E.coli на каждом планшете подсчитывают после инкубирования в течение ночи при 37°C и после добавления 100 CFU к полученным результатам полученную сумму в каждом случае делят на мг ткани [т.е. полное количество CFU=log10 [(CFU+100)/мг ткани] для вычисления среднего общего количества бактерий +/-SEM для мочевых пузырей или почек. Бактериальный экстракт уменьшает с коэффициентом >3 (мочевой пузырь) и >2 (почки) полученные логарифмические значения, указывая на то, что количество культивируемых колоний из мочевого пузыря и почек уменьшается, по меньшей мере, с коэффициентом 1000 и 100, соответственно. Эти результаты демонстрируют иммунологическую активность одного из вариантов осуществления настоящего изобретения.
Пример 11: Влияние варианта осуществления настоящего изобретения на модели грызунов для внутрибрюшинного инфицирования Salmonella typhimurium у мышей C57/BL
Вариант осуществления настоящего изобретения также исследуют на модели грызунов при внутрибрюшинном инфицировании Salmonella typhimurim. Мышей C57BL/6 выдерживают в течение 7 дней перед пероральным лечением. Леченые животные получают 85 мг лиофилизата (т.е. 15 мг (17,5%) бактериального экстракта и 70 мг (82,5%) наполнителей) на животное для одного введения. Эксперимент состоит из одной экспериментальной группы из 20 мышей, леченных экстрактом, сходным с продуктом примера 3.15, и контрольной группы из 20 мышей, леченных контролем, водой. Для лечения экстракт растворяют ежедневно в дистиллированной воде, чтобы иметь одну дозу в конечном объеме 0,5 мл. Этот 0,5-мл объем дают каждой мыши перорально один раз день в течение 10 последовательных дней перед тем, как всех мышей провоцируют внутрибрюшинно штаммом 415 Salmonella typhimurium (I. Mechnikov Institute for Vaccines and Sera, Russian Academy of Medical Sciences).
Экстракт вводят в одной дозе в 85 мг на мышь (т.е. 15 мг активного вещества с 82,5% наполнителей). Мыши в контрольной группе получают симуляцию лечения с использованием перорального введения 0,5 мл воды ежедневно в течение 10 дней. Предварительное провоцирование для подбора дозы находится в пределах от 102 до 105 CFU Salmonellae на мышь. Дозу 104 CFU выбирают как главный эксперимент, поскольку эта доза обеспечивает приблизительно 50% выживших у нелеченых животных.
После провоцирования мышей выдерживают при условиях, стандартных для лабораторных животных. Ежедневное наблюдение и регистрацию умерших осуществляют в течение 21 дня после инфицирования. Антиинфекционная эффективность соединений (см. таблицы, ниже) оценивается в соответствии с частотой выживания (SR) после инфицирования, средней продолжительностью жизни (ADL) после инфицирования, фактором защиты (DF) и с получением индекса эффективности (EI), которые вычисляют для каждой экспериментальной группы. SR берется как процент живых животных в экспериментальной группе на день 21 после инфицирования.
ADL, DF и EI вычисляют с использованием следующих формул:
ADL=(X1+X2+...+Xn):N,
где ADL представляет собой среднюю продолжительность жизни, X1-Xn представляют собой продолжительности жизни после инфицирования для экспериментальных мышей №1-№n, и N представляет собой общее количество животных в экспериментальной группе.
DF=CD:ED,
где DF представляет собой фактор защиты, CD представляет собой процент умерших в контрольной группе и ED представляет собой процент умерших в экспериментальной группе.
EI=[(DF-1): DF]×100%,
где EI представляет собой полученный индекс эффективности и DF представляет собой фактор защиты.
Регистрация смертей в экспериментальной группе в течение 21 дня после инфицирования 104 CFU Salmonella typhimurium.
тельное лечение
Эффективность защиты примера 3.15 на модели мышей C57BL/6 от смертельной инфекции Salmonella thyphimurium
защита
Во время эксперимента становится ясно, что экстракт, видимо, хорошо переносится. В контрольной группе мышей, которых предварительно лечат водой, частота выживания в течение периода наблюдения (21 день) составляет 58% и ADL составляет 15,3 дня. В противоположность этому, все мыши, которые получают экстракт в соответствии с настоящим изобретением, переживают провоцирование. Эти результаты говорят о том, что варианты осуществления настоящего изобретения могли бы быть полезны против определенных бактериальных инфекций у человека.
Пример 12: Влияние варианта осуществления настоящего изобретения на продуцирование регуляторных T-лимфоцитов в слизистой трахеи во время провоцирования аллергеном
Исследуют иммунорегуляторный потенциал одного из вариантов осуществления настоящего изобретения на модели острого аллергического воспаления. Эксперимент осуществляют для определения того, будет ли у крыс PVG введение экстракта в соответствии с настоящим изобретением увеличивать величину пула доступных регуляторных T-лимфоцитов (Treg), у которых хоуминг осуществляется на слизистых, приводя к увеличению количеств Treg в ткани слизистой дыхательных путей во время эпизодического воспаления.
Инбредные крысы PVG скрещиваются и выдерживаются без поступления общих для крыс патогенов. Выбранные случайным образом животные обоего пола в возрасте 8-13 недель используются во всех экспериментах.
Ежедневные последовательные кормления (канюля) осуществляют с помощью 400 мкг лиофилизата/г массы тела (или 400 мг/кг/день). Популяции Treg в тканях дыхательных путей крыс PVG фенотипически идентифицируют в группах для исследований. Фенотипическая характеризация трахеальной ткани крыс требуют размеров групп от 5 до 10 животных, собираемых для получения достаточного количества клеток для анализов. Трахеальные ткани гидролизируют в коллагеназе/ДНКазе с получением суспензии отдельных клеток с последующим проточно-цитометрическим анализом поверхностного экспрессирования CD4, CD25, Foxp3 и TCRαβ. Сначала животные сенсибилизируются с помощью OVA в день ноль (d0) и им скармливают экстракт, сходный с продуктом примера 3.15, или плацебо от d10 до d17; на d18 они провоцируются аэрозольным OVA и полученную реакцию Th-лимфоцитов/Treg (FoxP3) измеряют через 24 час. Для внутриклеточного окрашивания Fox p3, набор для окрашивания анти-мышь/крыса FoxP3-FLR от eBioscience (San Diego, CA) используют так, как описано у производителя. Данные получают на проточном цитометре FACSCalibur (BD Biosciences) и анализируют с использованием программного обеспечения Flowjo (version 4.6.1. Tree Star Inc). OVA получают от Sigma Chemicals Co. (St. Louis, Missouri).
Фиг.10a и 10b показывают оригинальные данные проточной цитометрии (на фиг.10a маркеры представляют собой CD14 по сравнению с FoxP3, и на фиг.10b маркеры представляют собой TCR в зависимости от FoxP3). Клетки получают после от слизистых дыхательных путей у сенсибилизированных OVA крыс (внутрибрюшинно, в день 0) и через 24 часа после провоцирования аэрозолем OVA (день 18). Правые панели на фиг.10a и 10b показывают, что когда животным вводят дозы экстракта перорально от дня 10 до дня 18, имеется увеличение процента положительных по FoxP3 клеток CD4 (и TCR, соответственно), если сравнивать с контролями, показанными на левых панелях (нелеченые животные, сенсибилизированные OVA, и животные, провоцируемые OVA).
Этот пример показывает, что варианты осуществления настоящего изобретения могут иметь терапевтическое значение в случае воспалительного аллергического кризиса.
Дополнительные примеры включают
Экстракт из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, Staphylococcus Hemolyticus, Enterococcus faecalis, Streptococcus mutans, Streptococcus anginosus, Streptococcus mitis, Streptococcus salivarius, Neisseria sicca, Haemophilus parainfluenzae, Actinobacillus (Hemophilus) actinomycetemcomitans и Eikenella corrodens, где во время получения упомянутого экстракта один или более бактериальных штаммов лизируют при pH более чем 12, и экстракт обрабатывают с тем, чтобы удалить нуклеиновые кислоты; и где экстракт не вызывает риска появления прионного заболевания при введении пациенту.
Экстракт по предыдущему параграфу, полученный, по меньшей мере, из одного штамма из каждого из следующих бактериальных видов: Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, Staphylococcus Hemolyticus, Enterococcus faecalis, Streptococcus mutans, Streptococcus anginosus, Streptococcus mitis, Streptococcus salivarius, Neisseria sicca, Haemophilus parainfluenzae, Actinobacillus (Hemophilus) actinomycetemcomitans и Eikenella corrodens.
Экстракт по предыдущему параграфу, полученный из каждого из следующих бактериальных штаммов: Moraxella (Moraxella) catarrhalis 3622, Moraxella (Moraxella) catarrhalis 3625, Moraxella (Moraxella) catarrhalis I-045, Haemophilus influenzae 8467, Klebsiella pneumoniae ssp. ozaenae 5050, Klebsiella pneumoniae ssp. pneumoniae 204, Klebsiella pneumoniae ssp. pneumoniae 5056, Staphylococcus aureus I-049, Staphylococcus aureus I-050, Staphylococcus aureus I-051, Staphylococcus aureus I-052, Staphylococcus aureus I-053, Staphylococcus aureus I-054, Streptococcus pneumoniae 7465, Streptococcus pneumoniae 7466, Streptococcus pneumoniae 7978, Streptococcus pneumoniae 10319, Streptococcus pyogenes 8191, Streptococcus sanguinis I-046, Streptococcus sanguinis I-047, Streptococcus sanguinis I-048, Staphylococcus Hemolyticus 11042, Enterococcus faecalis 103015, Streptococcus mutans 10449, Streptococcus anginosus 10713, Streptococcus mitis 12261, Streptococcus salivarius 102503, Neisseria sicca 103345, Haemophilus parainfluenzae 7857, Actinobacillus (Hemophilus) actinomycetemcomitans 52.105 и Eikenella corrodens 10596.
Экстракт по любому из трех предыдущих параграфов, где экстракт содержит менее чем 100 мкг/мл нуклеиновой кислоты.
Экстракт по любому из трех предыдущих параграфов, где экстракт содержит, по меньшей мере, 0,3 мг/мл сахаридов.
Экстракт по любому из трех предыдущих параграфов, где экстракт содержит 0,3-4,5 мг/мл сахаридов.
Экстракт по любому из предыдущих параграфов, где, по меньшей мере, один сахарид выбирают из группы, состоящей из моносахаридов, дисахаридов и полисахаридов.
Экстракт по предыдущему параграфу, где, по меньшей мере, один полисахарид представляет собой разветвленный полисахарид.
Экстракт по любому из предыдущих параграфов, где, по меньшей мере, один сахарид является химически модифицированным.
Экстракт по любому из предыдущих параграфов, где экстракт содержит 1,5-2,5 мг/мл свободных аминокислот.
Экстракт по любому из параграфов, упомянутых выше, где лизирование осуществляют с помощью pH от 12,6 до 13,4.
Экстракт по любому из предыдущих параграфов, где экстракт обрабатывают с тем, чтобы удалить материал в виде частиц и/или нерастворимые компоненты.
Экстракт по любому из предыдущих параграфов, где каждый бактериальный штамм культивируют в среде, которая не вызывает риска появления прионного заболевания.
Экстракт по любому из предыдущих параграфов, где, по меньшей мере, одна аминокислота, выбранная из аспарагиновой кислоты, глутаминовой кислоты, серина, гистидина, аланина, аргинина, тирозина, метионина, фенилаланина и лизина, является рацемизированной, по меньшей мере, на 10%.
Экстракт по любому из предыдущих параграфов, где свободные аминокислоты экстракта содержат 1-80% D-аминокислот.
Экстракт по любому из предыдущих параграфов, где свободные аминокислоты экстракта содержат 10-45% D-аминокислот.
Экстракт по предыдущему параграфу, где свободные аминокислоты в экстракте содержат 25-35% D-аминокислот.
Экстракт по любому из предыдущих параграфов, где экстракт содержит, по меньшей мере, одну D-аминокислоту, выбранную из D-аспарагиновой кислоты и D-аспарагина, D-глутаминовой кислоты и D-глутамина, D-серина, D-метионина, D-гистидина, D-аланина, D-аргинина, D-фенилаланина, D-тирозина, D-лейцина, D-лизина, D-валина и D-треонина.
Экстракт по предыдущему параграфу, где концентрация любой из D-аминокислот содержит от 1 до 50% концентрации свободных аминокислот.
Экстракт по предыдущему параграфу, где концентрация любой из D-аминокислот содержит от 10 до 40% концентрации свободных аминокислот.
Экстракт по предыдущему параграфу, где концентрация любой из D-аминокислот содержит от 15 до 35% концентрации свободных аминокислот.
Экстракт по любому из предыдущих параграфов, где экстракт содержит 6-75 мг/мл одного или более белков.
Экстракт по предыдущему параграфу, где экстракт содержит 6-8 мг/мл одного или более белков.
Экстракт по любому из предыдущих параграфов, где один или более белков имеют молекулярные массы менее чем 30 кДа.
Экстракт по любому из предыдущих параграфов, где один или более белков имеет молекулярные массы менее чем 10 кДа.
Экстракт по любому из предыдущих параграфов, где частота выживания, по меньшей мере, 8 мышей с восприимчивостью к LPS дикого типа за 13 дней после провоцирования Salmonella thyphimurium составляет, по меньшей мере, 70%, при этом дозу Salmonella thyphimurium выбирают так, что частота выживания, по меньшей мере, 8 контрольных мышей составляет 60% или ниже.
Экстракт по предыдущему параграфу, где частота выживания составляет, по меньшей мере, 80%.
Экстракт по предыдущему параграфу, где частота выживания составляет, по меньшей мере, 90%.
Экстракт по любому из предыдущих параграфов, где экстракт содержит менее чем 5000 нг эквивалентов LPS в соответствии с хромогенным исследованием с использованием лизата амебоцитов Limulus (LAL).
Фармацевтическая композиция, содержащая экстракт по любому из упоминаемых выше параграфов.
Способ лечения субъекта, страдающего от развития респираторного расстройства или имеющего риск его появления, включающий введение эффективного количества любых экстрактов из приведенных выше параграфов указанному субъекту.
Способ по предыдущему параграфу, в котором субъект представляет собой человека или домашнее млекопитающее.
Способ по любому из двух предыдущих параграфов, в котором респираторное расстройство или аллергическое состояние представляет собой инфекции верхних и нижних дыхательных путей, атопический дерматит, назофарингит, синусит, фарингит, тонзиллит, ларингит, трахеит, ларингофарингит, грипп, пневмонию, бронхопневмонию, бронхит, инфекции нижних дыхательных путей, аллергический ринит, аллергическую астму, ринит, назофарингит, фарингит, синусит, тонзиллит, ларингит, ларинготрахеит, бронхит, обструктивное легочное заболевание с острой инфекцией нижних дыхательных путей или обструктивное легочное заболевание с тяжелым обострением.
Способ приготовления экстракта, полученного из одного или нескольких бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, Staphylococcus Hemolyticus, Enterococcus faecalis, Streptococcus mutans, Streptococcus anginosus, Streptococcus mitis, Streptococcus salivarius, Neisseria sicca, Haemophilus parainfluenzae, Actinobacillus (Hemophilus) actinomycetemcomitans и Eikenella corrodens, включающий следующие стадии:
(a) культивирование каждого бактериального штамма в среде, которая не вызывает риска появления прионного заболевания;
(b) лизирование каждого штамма при начальном pH более чем 12 и
(c) прохождение продукта от (b), по меньшей мере, один раз через микрофильтр и, по меньшей мере, один раз через ультрафильтр.
Способ по предыдущему параграфу, в котором экстракт получают, по меньшей мере, из одного штамма каждого из следующих бактериальных видов: Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, Staphylococcus Hemolyticus, Enterococcus faecalis, Streptococcus mutans, Streptococcus anginosus, Streptococcus mitis, Streptococcus salivarius, Neisseria sicca, Haemophilus parainfluenzae, Actinobacillus (Hemophilus) actinomycetemcomitans и Eikenella corrodens.
Способ по предыдущему параграфу, в котором экстракт получают из каждого из следующих бактериальных штаммов: Moraxella (Moraxella) catarrhalis 3622, Moraxella (Moraxella) catarrhalis 3625, Moraxella (Moraxella) catarrhalis I-045, Haemophilus influenzae 8467, Klebsiella pneumoniae ssp. ozaenae 5050, Klebsiella pneumoniae 204, Klebsiella pneumoniae 5056, Staphylococcus aureus I-049, Staphylococcus aureus I-050, Staphylococcus aureus I-051, Staphylococcus aureus I-052, Staphylococcus aureus I-053, Staphylococcus aureus I-054, Streptococcus pneumoniae 7465, Streptococcus pneumoniae 7466, Streptococcus pneumoniae 7978, Streptococcus pneumoniae 10319, Streptococcus pyogenes 8191, Streptococcus sanguinis I-046, Streptococcus sanguinis I-047, Streptococcus sanguinis I-048, Staphylococcus Hemolyticus 11042, Enterococcus faecalis 103015, Streptococcus mutans 10449, Streptococcus anginosus 10713, Streptococcus mitis 12261, Streptococcus salivarius 102503, Neisseria sicca 103345, Haemophilus parainfluenzae 7857, Actinobacillus (Hemophilus) actinomycetemcomitans 52.105 и Eikenella corrodens 10596.
Способ по любому из предыдущих параграфов, в котором лизирование осуществляют при начальном pH более чем 12,5.
Способ по любому из предыдущих параграфов, в котором лизирование осуществляют при начальном pH от 12,6 до 13,4.
Способ по любому из предыдущих параграфов, в котором лизирование осуществляют от 40 часов до 10 дней при температуре 30-60°C.
Способ по любому из предыдущих параграфов, в котором микрофильтр имеет поры размером 0,45 микрон и ультрафильтр имеет поры размером, соответствующим 30 КДа.
Способ по любому из предыдущих параграфов, в котором стадия (c) включает проточную фильтрацию вдоль потока.
Способ по предыдущему параграфу, в котором проточную фильтрацию вдоль потока осуществляют в течение 5-15 циклов.
Способ по любому из предыдущих параграфов, кроме того, включающий прохождение продукта (c) через второй микрофильтр с порами размером 0,2 микрона.
Способ по любому из предыдущих параграфов, в котором стадию (b) осуществляют с 10-120 г/л сухой массы бактериального материала.
Способ по любому из предыдущих параграфов, в котором проточную фильтрацию вдоль потока осуществляют, как приведено на фиг.1.
Способ по любому из предыдущих параграфов, в котором проточную фильтрацию вдоль потока осуществляют, как приведено на фиг.1, в серпентинном режиме.
Продукт, полученный любым из способов по предыдущим параграфам.
Способ лечения субъекта, страдающего от развития респираторного расстройства или имеющего риск его появления, включающий введение эффективного количества любого продукта, полученного по любому из способов по приведенным выше параграфам, указанному субъекту.
Способ по предыдущему параграфу, в котором субъект представляет собой человека или домашнее млекопитающее.
| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИАЛЬНЫЙ ЭКСТРАКТ ПРОТИВ РАССТРОЙСТВ ПИЩЕВАРИТЕЛЬНОГО ИЛИ МОЧЕВОГО ТРАКТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2457848C2 |
| ИММУНОМОДУЛИРУЮЩИЕ ЭКСТРАКТЫ ИЗ БАКТЕРИЙ Lactobacillus И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2500412C2 |
| ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ ГИРАЗЫ И ТОПОИЗОМЕРАЗЫ IV | 2012 |
|
RU2609259C2 |
| СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ БАКТЕРИАЛЬНЫХ ЭКСТРАКТОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2020 |
|
RU2820605C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2484846C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2493870C2 |
| СПОСОБЫ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2666605C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ | 2014 |
|
RU2666540C2 |
| ТВЕРДЫЕ ФОРМЫ ИНГИБИТОРА ГИРАЗЫ (R)-1-ЭТИЛ-3-[6-ФТОР-5[2-(1-ГИДРОКСИ-1-МЕТИЛ-ЭТИЛ) ПИРИМИДИН-5-ИЛ]-7-(ТЕТРАГИДРОФУРАН-2-ИЛ)-1Н-БЕНЗИМИДАЗОЛ-2-ИЛ] МОЧЕВИНЫ | 2012 |
|
RU2625305C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ В-1,4-ГАЛАКТОЗИДАЗЫ BGAA ИЗ STREPTOCOCCUS PNEUMONIAE | 2019 |
|
RU2698460C1 |
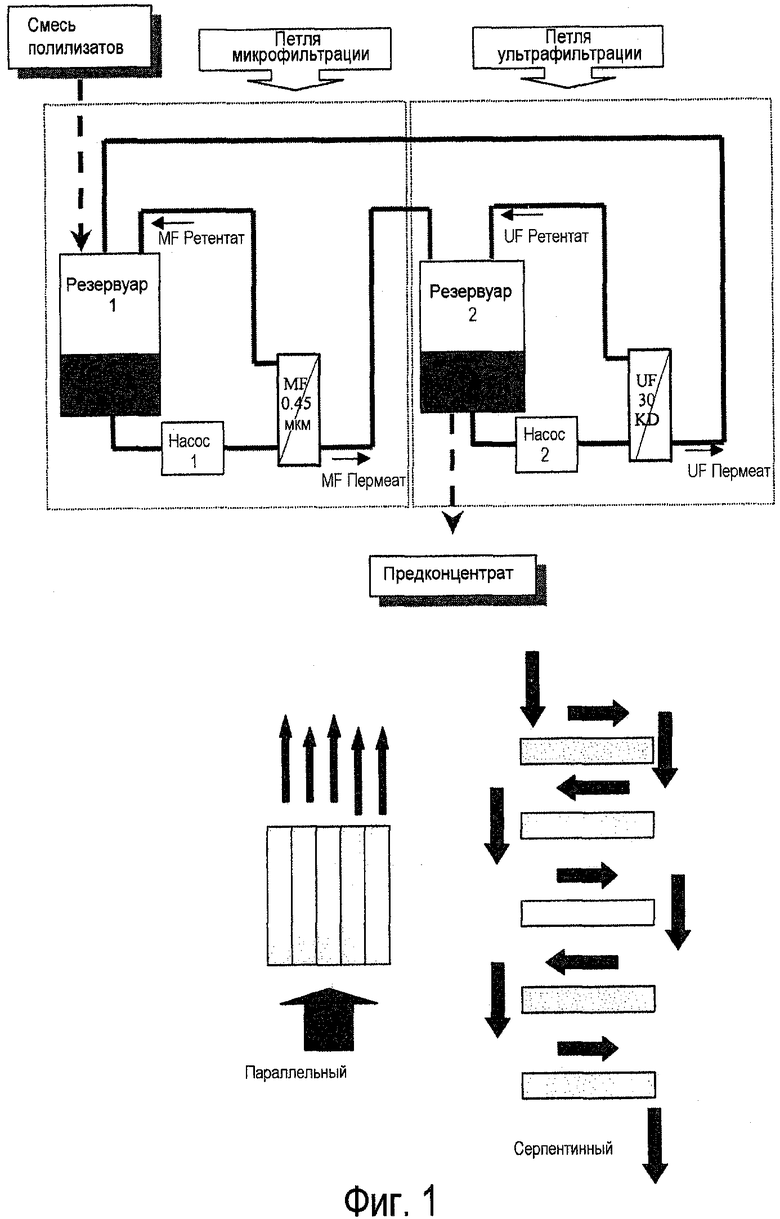
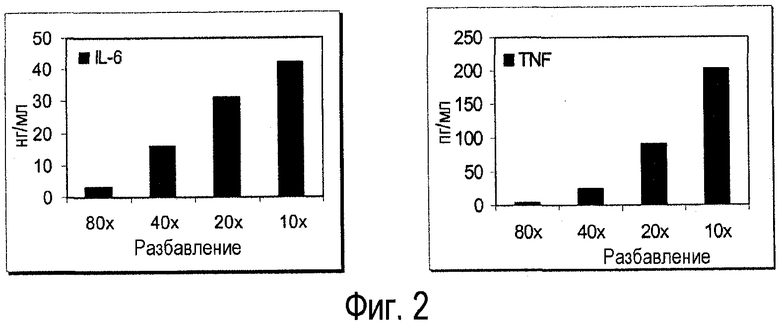
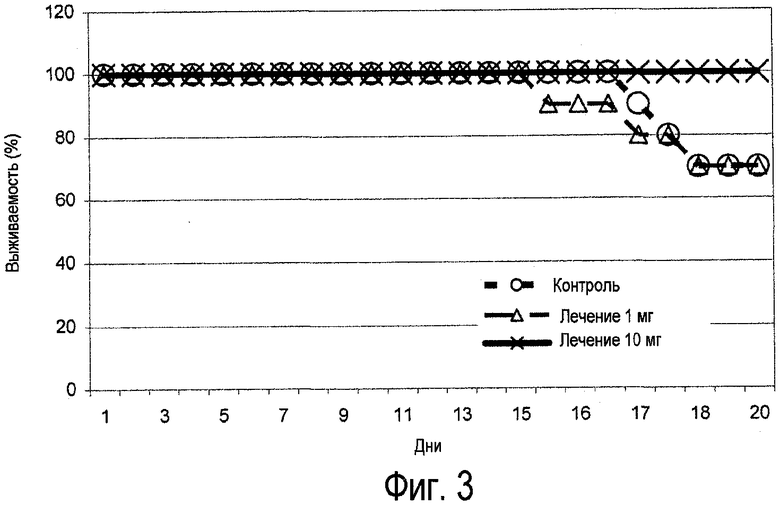
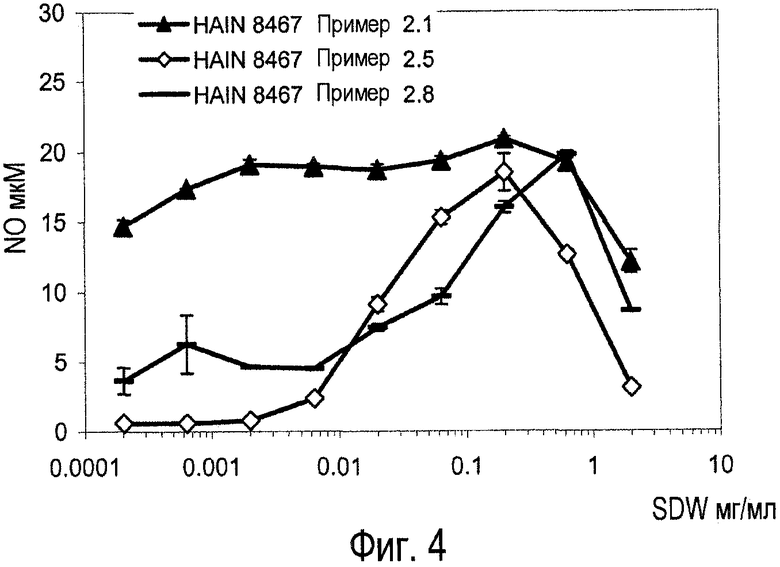
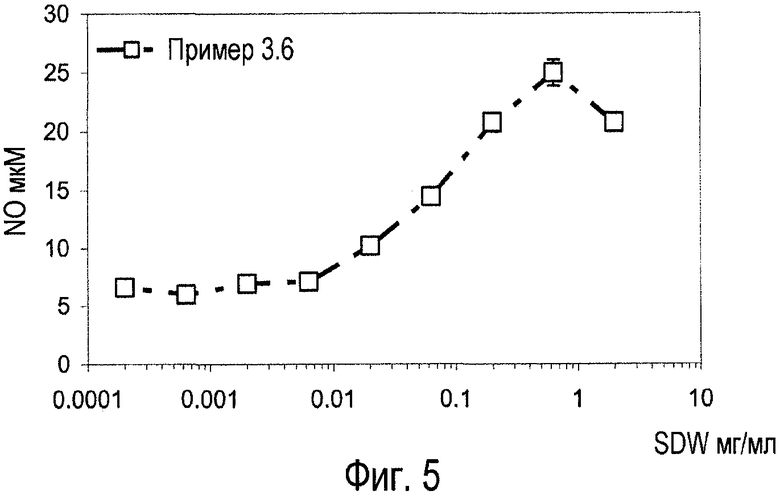
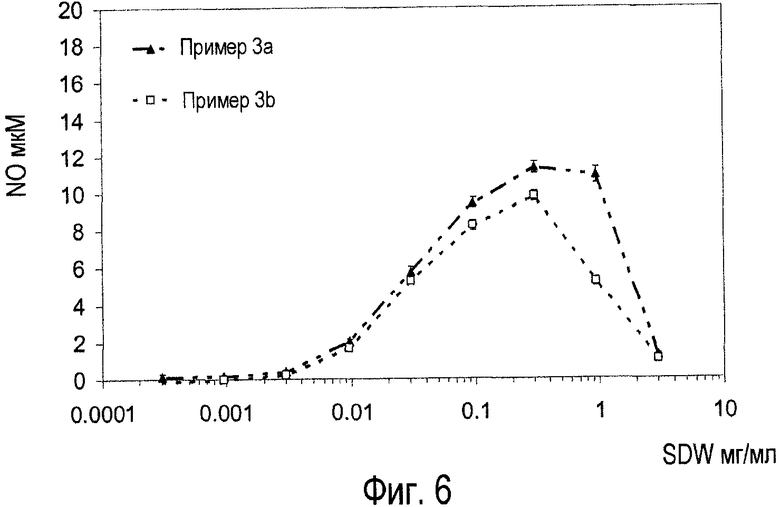
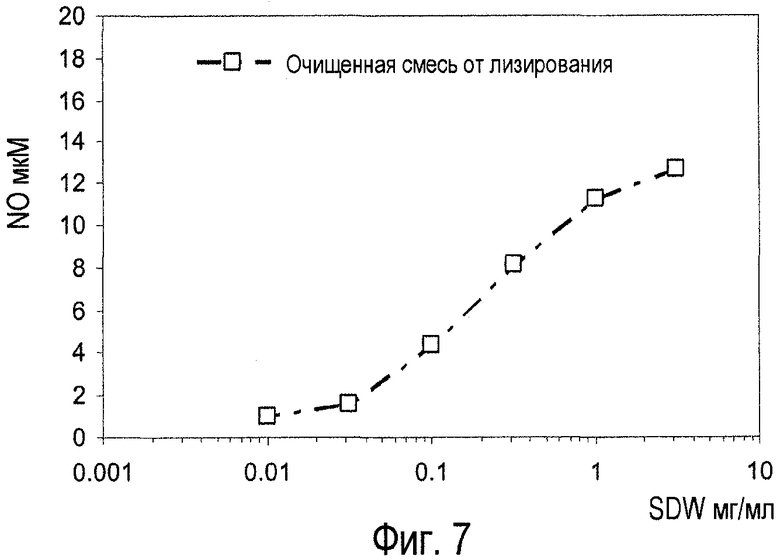
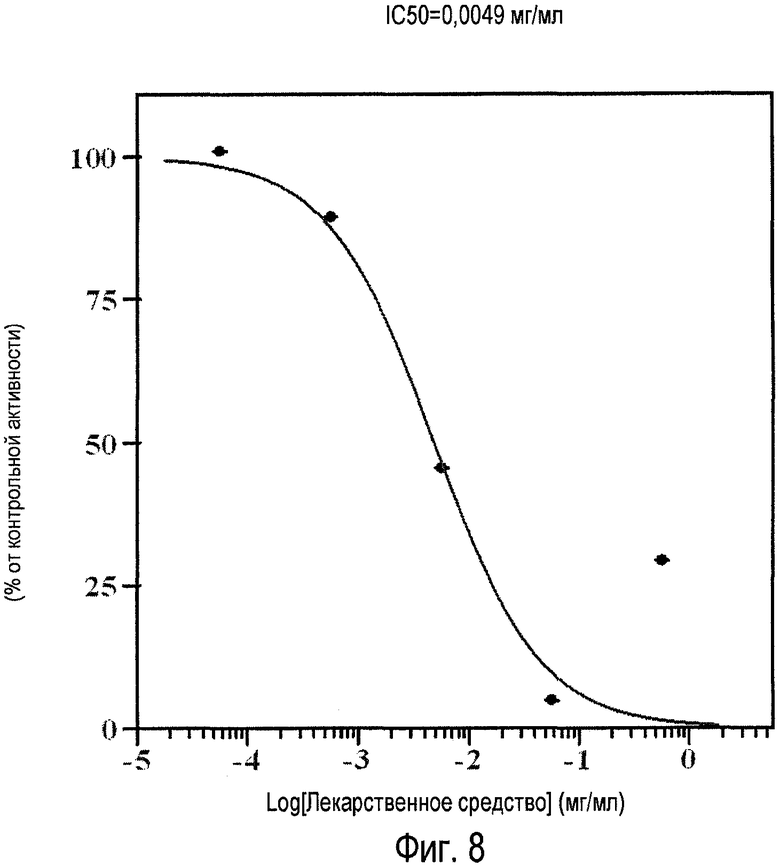
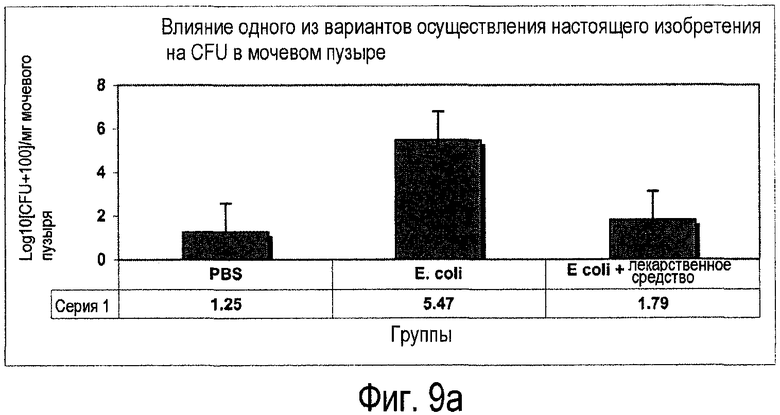
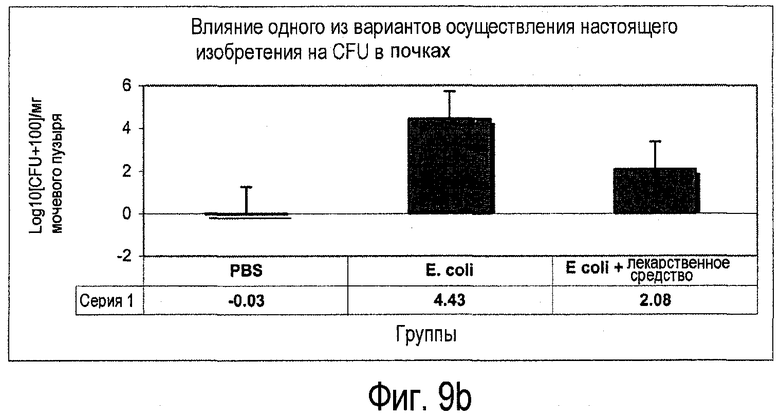
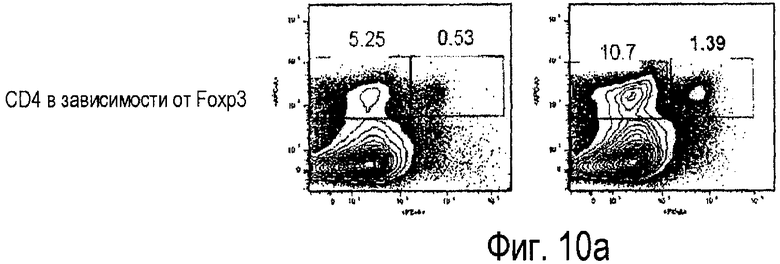
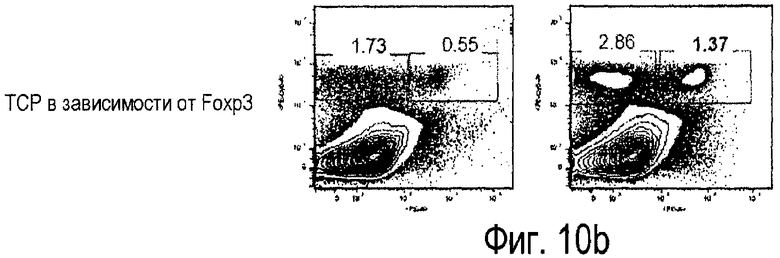
Изобретение относится к области медицины и фармации и представляет собой иммуностимулирующий экстракт из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, где во время приготовления указанного экстракта один или более бактериальных штаммов лизируют при рН более чем 12 и экстракт обрабатывают с тем, чтобы удалить нуклеиновые кислоты; и где экстракт не вызывает появления прионного заболевания при введении пациенту, где экстракт содержит менее чем 100 мкг/мл нуклеиновой кислоты, где экстракт содержит химически модифицированный сахарид, включая химически модифицированный липополисахарид, и где по меньшей мере одна аминокислота, которую выбирают из аспарагиновой кислоты, глутаминовой кислоты, серина, гистидина, аланина, аргинина, тирозина, метионина, фенилаланина и лизина, является рацемизированной, по меньшей мере, на 10%. Изобретение не вызывает риска или исключает риск прионного заболевания при введении пациенту, то есть обеспечивает максимальную безопасность и эффективность, 7 н. и 41 з.п. ф-лы, 12 пр., 10 ил.
1. Иммуностимулирующий экстракт из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, где во время приготовления указанного экстракта один или более бактериальных штаммов лизируют при рН более чем 12 и экстракт обрабатывают с тем, чтобы удалить нуклеиновые кислоты; и где экстракт не вызывает появления прионного заболевания при введении пациенту, где экстракт содержит менее чем 100 мкг/мл нуклеиновой кислоты, где экстракт содержит химически модифицированный сахарид, включая химически модифицированный липополисахарид, и где, по меньшей мере, одна аминокислота, которую выбирают из аспарагиновой кислоты, глутаминовой кислоты, серина, гистидина, аланина, аргинина, тирозина, метионина, фенилаланина и лизина, является рацемизированной, по меньшей мере, на 10%.
2. Экстракт по п.1, полученный из бактерий каждого из следующих родов: Haemophilus, Klebsiella, Staphylococcus, Streptococcus и Neisseria.
3. Экстракт по п.1, полученный, по меньшей мере, из одного штамма каждого из следующих бактериальных видов: Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis.
4. Экстракт по п.1, содержащий продукты бактериального лизиса, полученные из Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus viridans.
5. Экстракт по п.4, полученный из каждого из следующих бактериальных штаммов: Moraxella catarrhalis 3622, Moraxella catarrhalis 3625, Moraxella catarrhalis 1-045, Haemophilus influenzae 8467, Klebsiella pneumoniae ssp.ozaenae 5050, Klebsiella pneumoniae ssp.pneumoniae 204, Klebsiella pneumoniae ssp.pneumoniae 5056, Staphylococcus aureus 1-049, Staphylococcus aureus 1-050, Staphylococcus aureus 1-051, Staphylococcus aureus 1-052, Staphylococcus aureus 1-053, Staphylococcus aureus 1-054, Streptococcus pneumoniae 7465, Streptococcus pneumoniae 7466, Streptococcus pneumoniae 7978, Streptococcus pneumoniae 10319, Streptococcus pyogenes 8191, Streptococcus sanguinis 1-046, Streptococcus sanguinis 1-047 и Streptococcus sanguinis 1-048.
6. Экстракт по любому из пп.1-5, где экстракт содержит, по меньшей мере, 0,3 мг/мл сахаридов.
7. Экстракт по п.6, где экстракт содержит 0,3-4,5 мг/мл сахаридов.
8. Экстракт по п.6, где, по меньшей мере, один сахарид выбирают из группы, состоящей из моносахаридов, дисахаридов и полисахаридов.
9. Экстракт по п.8, где, по меньшей мере, один полисахарид представляет собой разветвленный полисахарид.
10. Экстракт по п.1, где лизирование осуществляют с помощью рН от 12,6 до 13,4.
11. Экстракт по любому из пп.1 -5 или 7-9, где экстракт обрабатывают с тем, чтобы удалить материал в виде частиц и/или нерастворимые компоненты.
12. Экстракт по любому из пп.1-5 или 7-9, где каждый бактериальный штамм культивируют в среде, которая не вызывает риска появления прионного заболевания.
13. Экстракт по любому из пп.1-5 или 7-9, где экстракт содержит 1,5-2,5 мг/мл свободных аминокислот.
14. Экстракт по п.13, где свободные аминокислоты в экстракте содержат 1-80% D-аминокислот.
15. Экстракт по п.14, где свободные аминокислоты в экстракте содержат 10-45% D-аминокислот.
16. Экстракт по п.15, где свободные аминокислоты в экстракте содержат 25-35% D-аминокислот.
17. Экстракт по любому из пп.1-5, 7-9 или 14-16, где экстракт содержит 6-8 мг/мл одного или более белков.
18. Экстракт по п.17, где один или более белков имеют молекулярные массы менее чем 30 кДа.
19. Экстракт по п.18, где один или более белков имеют молекулярные массы менее чем 10 кДа.
20. Экстракт по любому из пп.1-5, 7-9, 14-16, 18 или 19, где экстракт содержит менее чем 5000 нг эквивалентов LPS в соответствии с хромогенным тестом Limulus (LAL) лизата амебоцитов.
21. Экстракт по любому из пп.1-5, 7-9, 14-16, 18 или 19, где частота выживания, по меньшей мере, 8 мышей с восприимчивостью к LPS дикого типа за 13 дней после провоцирования Salmonella thyphimurium составляет, по меньшей мере, 70%, где дозу Salmonella thyphimurium выбирают так, что частота выживания, по меньшей мере, 8 контрольных мышей, которых лечат водой, составляет 60% или ниже, и где экспериментальных и контрольных мышей лечат экстрактом или водой в течение 10 дней перед провоцированием.
22. Экстракт по п.21, где частота выживания составляет, по меньшей мере, 80%.
23. Экстракт по п.22, где частота выживания составляет, по меньшей мере, 90%.
24. Иммуностимулирующая фармацевтическая композиция, содержащая экстракт по любому из пп.1-23.
25. Способ лечения субъекта, страдающего от развития респираторного расстройства или аллергенного состояния или имеющего риск их появления, включающий введение эффективного количества экстракта по любому из пп.1-23 или фармацевтической композиции по п.24 указанному субъекту.
26. Способ по п.25, где субъект представляет собой человека или домашнее млекопитающее.
27. Способ по любому из пп.25 или 26, где респираторное расстройство или аллергенное состояние представляет собой инфекции верхних и нижних дыхательных путей, атопический дерматит, назофарингит, синусит, фарингит, тонзиллит, ларингит, трахеит, ларингофарингит, грипп, пневмонию, бронхопневмонию, бронхит, инфекции нижних дыхательных путей, аллергический ринит, аллергическую астму, ринит, обструктивное легочное заболевание с острой инфекцией нижних дыхательных путей или обструктивное легочное заболевание с тяжелым обострением.
28. Способ лечения или предотвращения бронхита, инфекции дыхательных путей, синусита или назофарингита у субъекта, включающий введение экстракта по п.2 или 4 этому субъекту.
29. Способ приготовления экстракта по любому из пп.1-23, полученного из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, включающий следующие стадии:
(b) культивирование каждого бактериального штамма в среде, которая не вызывает риска появления прионного заболевания;
(c) лизирование каждого штамма при начальном рН более чем 12 и
(d) прохождение продукта от (b), по меньшей мере, один раз через микрофильтр и, по меньшей мере, один раз через ультрафильтр.
30. Способ по п.29, в котором экстракт получают, по меньшей мере, из одного штамма каждого из следующих бактериальных видов: Moraxella catarrhalis, Haemophilius influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis.
31. Способ по п.30, в котором экстракт получают из каждого из следующих бактериальных штаммов: Moraxella catarrhalis 3622, Moraxella catarrhalis 3625, Moraxella catarrhalis 1-045, Haemophilus influenzae 8467, Klebsiella pneumoniae ssp.ozaenae 5050, Klebsiella pneumoniae ssp.pneumoniae 204, Klebsiella pneumoniae ssp.pneumoniae 5056, Staphylococcus aureus 1-049, Staphylococcus aureus 1-050, Staphylococcus aureus 1-051, Staphylococcus aureus 1-052, Staphylococcus aureus 1-053, Staphylococcus aureus 1-054, Streptococcus pneumoniae 7465, Streptococcus pneumoniae 7466, Streptococcus pneumoniae 7978, Streptococcus pneumoniae 10319, Streptococcus pyogenes 8191, Streptococcus sanguinis 1-046, Streptococcus sanguinis 1-047 и Streptococcus sanguinis 1-048.
32. Способ по пп.29, 30 или 31, в котором лизирование осуществляют с помощью начального рН более чем 12,5.
33. Способ по п.32, в котором лизирование осуществляют с помощью начального рН от 12,6 до 13,4.
34. Способ по пп.29, 30 или 31, в котором, по меньшей мере, стадию лизирования осуществляют с помощью начальной концентрации ионов гидроксида от 0,05 до 0,4 н.
35. Способ по пп.29, 30 или 31, в котором, по меньшей мере, стадию лизирования осуществляют с помощью начальной концентрации ионов гидроксида от 0,5 до 1 н.
36. Способ по любому из пп.29-31 или 33, в котором лизирование осуществляют в течение периода от 40 ч до 10 дней при температуре 30-60°С.
37. Способ по п.36, в котором лизирование осуществляют в течение периода от 20 до 240 ч при 30-40°С.
38. Способ по любому из пп.29-31, 33 или 37, в котором микрофильтр имеет поры размером 0,45 мкм и ультрафильтр имеет поры размером, соответствующим 30 кДа.
39. Способ по любому из пп.29-31, 33 или 37, в котором стадия (с) включает проточную фильтрацию вдоль потока.
40. Способ по п.39, в котором проточную фильтрацию вдоль потока осуществляют в течение 5-15 циклов.
41. Способ по любому из пп.29-31, 33, 37 или 40, кроме того, включающий прохождение продукта (с) через второй микрофильтр с порами размером 0,2 мкм.
42. Способ по любому из пп.29-31, 33, 37 или 40, в котором стадию (b) осуществляют с 5-120 г/л сухой массы бактериального материала.
43. Способ по п.42, в котором стадию (b) осуществляют с 5-90 г/л сухой массы бактериального материала.
44. Способ по любому из пп.29-31, 33, 37, 40 или 43, в котором, по меньшей мере, часть штаммов лизируют при умеренных условиях лизирования.
45. Способ по любому из пп.29-31, 33, 37, 40 или 43, в котором, по меньшей мере, часть штаммов лизируют при условиях сильного лизирования.
46. Продукт, представляющий собой иммуностимулирующий экстракт, полученный способом по любому из пп.29-45.
47. Способ лечения субъекта, страдающего от развития респираторного расстройства или аллергенного состояния или имеющего риск их появления, включающий введение эффективного количества любого из продуктов по п.46 этому субъекту.
48. Способ по п.47, где субъект представляет собой человека или домашнее млекопитающее.
| US 5424287 А, 13.06.1995 | |||
| РЕЛЬСОВОЕ СТЫКОВОЕ СОЕДИНЕНИЕ | 1991 |
|
RU2021415C1 |
| US 3532790 A, 06.10.1970 | |||
| US 6264954 A, 24.07.2001. | |||
Авторы
Даты
2012-07-20—Публикация
2008-03-05—Подача