Область изобретения
[001] Настоящее изобретение относится к новым стабильным препаратам бактериального экстракта, обладающим значительно повышенной стабильностью в течение длительного периода времени; к новым способам их получения; к фармацевтическим композитциям на основе этих новых стабилизированных бактериальных экстрактов, а также к новым способам введения и к устройствам для доставки в целях лечения и/или профилактики острых и хронических иммунологических расстройств, возникающих в результате инфекций и/или воспалений.
Предпосылки к созданию изобретения
[002] В настоящее время постоянно растет интерес к разработке фармацевтических композиций, жидких или твердых и стабильных в течение длительного периода времени, которые могут быть введены человеку для лечения инфекций и воспалений, и которые могут быть легко адаптированы к более широким способам введения, таким как пероральное введение, интраназальное введение, интратрахеальное введение, внутрилегочное введение, введение через слизистую, местное введение, трансбуккальное введение и т.п., а также к патологическим состояниям и стадиям (острой стадии, стадии обострений и т.п.) у пациентов.
[003] Бактериальные инфекции часто связаны со многими респираторными заболеваниями, и обычными способами лечения являются лечение антибиотиками. Также обсуждается эффективность антибиотиков при лечении таких патологических состояний и осложнений. Их чрезмерное использование связано с увеличением затрат и с риском повышения резистентности микробов к антибиотикам.
[004] Препараты лизата бактериального экстракта, которые содержат антигены, происходящие от нескольких штаммов бактерий, как было показано, повышают резистентность к инфицированию этими микроорганизмами. Путь, посредством которого эти лизаты бактериального экстракта могут оказывать свое действие, может быть многогранным и еще полностью не изучен. Многочисленные бактериальные экстракты были использованы в качестве иммуностимуляторов и противоопухолевых средств. В качестве примера, авторы указывают на такие препараты, как бацилла Кальметта-Герена (БКГ), полисахарид, бета-1,3-глюкан, вакцина Маруямы и экстракты из Bifidobacterium, L.Lactis, L. fermentum, L. acidophilus и S. Lactis. Считается, что такие экстракты стимулируют иммунную систему различными способами. Одним из важных способов является стимуляция роста лимфоцитов и продуцирования цитокинов. Способность индуцировать продуцирование таких цитокинов очень сильно влияет на иммунную систему.
[005] В частности, заявителем было уже успешно разработано несколько препаратов бактериальных экстрактов для лечения и/или профилактики респираторных заболеваний верхних дыхательных путей. В соответствии с этим, в качестве примера авторы указывают на препарат Broncho-Vaxom®, который представляет собой экстракт бактериального лизата от нескольких патогенов, часто ответственных за инфекции дыхательных путей, как описано, inter alia, в патенте США № 9463209B2. Broncho-Vaxom® представляет собой иммуностимулятор, вводимый в виде капсулы, саше или капель путем энтерально-перорального введения для профилактики и предупреждения инфекций дыхательных путей, рецидивирующих инфекций дыхательных путей, таких как острый бронхит, хронический бронхит, астма, хроническая обструктивная болезнь легких и эмфизема. Как было уже показано, такое введение необходимо для повышения уровня продуцирования TNF-α и интерферона-γ из культивируемых мононуклеарных клеток человеческой периферической крови, для активации альвеолярных макрофагов, и для стимуляции уничтожения бактерий полиморфо-ядерными лейкоцитами. Заявителем были также разработаны экстракты бактерий Lactobacillus и было установлено, что эти экстракты бактериального лизата являются эффективными при их введении в виде капсул посредством энтерально-перорального введения для лечения инфекций, аллергии, аутоиммунных расстройств и воспалений (см. Международную публикацию WO2010/027344).
[006] Постоянное воздействие вдыхаемых вирусов, бактерий и токсинов на поверхности слизистой оболочки, такой как дыхательные пути и легкие, представляет проблему для иммунной системы. Ситуация становится еще хуже, когда хозяин подвергается воздействию вирусной инфекции и впоследствии подвергается суперинфицированию микробами, что приводит к повышению уровня смертности. Соответственно, вторичные бактериальные инфекции после инфицирования вирусом гриппа (H1N1 и т.п.), человеческим риновирусом (HRV), риносинцитиальным вирусом (RV), коронавирусом (CoV, SARS-CoV, MERS-Cov, COVID-19 и т.п.) представляют серьезную проблему при лечении респираторных заболеваний.
[007] Экспериментально, множество исследований in vivo показали, что бактериальный экстракт Broncho-Vaxom®, вводимый энтерально-перорально, обеспечивает защиту у моделей с инфекцией дыхательных путей. В большинстве исследований использовали твердую фармацевтическую форму (лиофилизат), а также жидкий бактериальный экстракт, однако, с ограниченной стабильностью. Такой эксперимент на мышах-моделях in vivo, проводимый с использованием дозы для человека (7 мг сухой массы бактериального экстракта, 40 мг лиофилизата) показал, что такой экстракт был способен усиливать защиту от вторичных бактериальных и/или вирусных инфекций после инфицирования вирусом гриппа (Pasquali et al., Frontiers in Medicine 2014, 1, 41).
[008] Кроме того, функциональный дисбактериоз, вызванный употреблением «вредной пищи», обогащенной жирами, сахарами и белками и приводящий к нарушениям микробиоты (Clarence M. et al., Abstract, March 30 9, 2018 - St-John University, Queens), был нормализован путем введения Broncho-Vaxom® мышам, что сопровождалось уменьшением сопутствующих осложнений и заболеваний.
[009] Таким образом, на протяжении нескольких лет Broncho-Vaxom® вводили энтерально в твердой форме (в виде капсул или саше) для стимуляции иммунной защиты и для профилактики распространенных заболеваний дыхательных путей и связанных с ними осложнений. Защитное действие этих экстрактов бактериальных лизатов, которые были разработаны и созданы для перорального введения, инициирует иммунный ответ в кишечнике (в лимфоидной ткани кишечника, GALT). Эти органы являются чувствителными и к иммунным клеткам и доставляют эти клетки из дыхательных путей в легкие, что позволяет предотвратить и излечивать легочные инфекции. В соответствии с этим, прямого попадания бактериального лизата в легкие не происходит. И наоборот, посредством перехода от энтерально-перорального способа введения к альтернативным «периоральным» путям введения, таким как интраназальное введение, назальное введение, ингаляции, распыление и интратрахеальное введение, антибактериальное действие стабилизированных бактериальных лизатов, как предполагается, оказывает непосредственное влияние на клетки легких или на слизистую носа и ее окружение, где присутствует инфекция. Другими «периоральными» путями, способствующими попаданию в ткань слизистой оболочки, являются подъязычное и трансбуккальное введение, поскольку в этих участках часто возникают инфекции.
[0010] В соответствии с настоящим изобретением, для этих альтернативных «периоральных» способов введения были разработаны новые композиции экстракта бактериальных лизатов, поскольку они лучше подходят к более широким путям распространения возможных инфекций и воспалений. Способность слизистой оболочки различать вредные и безвредные антигены является важным фактором для защиты от патогенов и защиты от повреждений, вызываемых собственными воспалительными реакциями организма.
[0011] Однако до сих пор эти экстракты бактериальных лизатов обычно вводили энтерально-перорально в твердых формах: в виде капсул или саше. Одной из самых основных технических трудностей при переходе на альтернативные пути введения и/или альтернативные фармацевтические композиции является то, что эти бактериальные экстракты имеют некоторую физическую нестабильность, а в частности, способность к осаждению. Такая физическая нестабильность этих бактериальных экстрактов представляет серьезную проблему во время их промышленного приготовления, получения и хранения, и таким образом, она является ограничивающим фактором при разработке альтернативных лекарственных форм и/или альтернативых путей введения, таких как интраназальное введение, внутрилегочное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, местное введение, нанесение на кожу, трансбуккальное введение, подъязычное введение, пероральное введение, внутрилегочное введение, внутрибронхиальное введение или введение в легкие. Важное значение для одобрения Регуляторными органами имеет стабильность композиции, подходящей для этих альтернативных путей и фармацевтических форм, и такая стабильность является важным фактором при успешной разработке терапевтического лекарственного продукта на основе бактериального лизата.
[0012] Следовательно, важно решить любые проблемы, связанные с агрегацией и осаждением этих бактериальных экстрактов, и получить улучшенные стабилизированные растворимые бактериальные экстракты, чтобы, с одной стороны, улучшить производственный технологический процесс, и с другой стороны, обеспечить более широкие пути введения и альтернативные лекарственные формы.
[0013] Важно отметить, что новые стабильные композиции бактериальных экстрактов в настоящее время можно вводить в более точных дозах с помощью конкретных устройств для доставки, подходящих для периорального или перорального введения, а в частности, с помощью конкретных удобных для пользователя устройств для доставки, таких как аэрозоли, назальные спреи, распылители, перья, что позволит обеспечить более строгое выполнение курса лечения и удобство для пациентов. Еще одно существенное преимущество состоит в том, что новый стабильный бактериальный экстракт можно легко вводить перорально в жидких формах пациентам, которые не могут проглатывать таблетку или капсулу, например, младенцы, маленькие дети, особенно в возрасте от 3 месяцев до 6 лет, а также, взрослые, например, некоторые пожилые люди, которые испытывают трудности глотания. Альтернативные формы бактериальных экстрактов, такие как эмульсии, микроэмульсии, дисперсии, кремы и т.п. могут быть предназначены для местного введения или нанесения на кожу как одного из способов введения.
[0014] И наконец, новые стабильные бактериальные экстракты не выпадают в осадок ни при низких температурах, ни при комнатной температуре. Таким образом, фармацевтические препараты на основе бактериальных экстрактов могут быть сохранены как таковые, в нормальных условиях самими пациентами или в аптеках, и не представляют каких-либо рисков засорения любого устройства для доставки лекарственного средства, что, тем самым, позволяет вводить точные дозы бактериальных экстрактов. Такие стабильные бактериальные экстракты также имеют большое преимущество для фармацевтической промышленности с точки зрения хранения промежуточного лекарственного продукта, либо во время производственного процесса, либо во время приготовления конечных фармацевтических препаратов.
Сущность изобретения
[0015] Таким образом, настоящее изобретение относится к композициям бактериальных экстрактов, полученным из грамположительных и/или грамотрицательных бактерий, где указанные композиции обладают повышенной стабильностью и, следовательно, являются подходящими для приготовления разнообразных фармацевтических композиций и разработки способов введения. В частности, новые стабилизированные фармацевтические композиции бактериального экстракта могут быть составлены для назального введения, интраназального введения, интратрахеального введения, введения в слизистую, введения через слизистую, местного введения, трансбуккального введения, подъязычного введения, перорального введения, введения в легкие, внутрибронхиального введения и/или внутрилегочного введения.
[0016] Настоящее изобретение также относится к подходящим лекарственным формам и к системам для доставки новых стабилизированных бактериальных экстрактов согласно изобретению.
[0017] Настоящее изобретение также относится к способу лечения и/или профилактики острых и хронических иммунологических заболеваний, вызываемых инфекциями и/или воспалением и/или новообразованиями и/или дисбактериозом.
[0018] И наконец, настоящее изобретение относится к новому способу получения стабильных бактериальных экстрактов в жидкой, полутвердой или аэрозольной форме либо в виде конечных фармацевтических препаратов перед введением пациентам, либо во время изготовления и/или приготовления составов фармацевтических лекарственных продуктов.
Краткое описание чертежей
[0019] На фигуре 1 представлена диаграмма системы фильтрации в тангенциальном потоке (TFF) для приготовления бактериальных экстрактов после щелочного лизиса. На этой диаграмме показаны две различные конфигурации фильтров: параллельный режим, где все фильтры работают одновременно, и последовательный режим, где фильтры работают в серийном режиме.
[0020] На фигуре 2 представлена диаграмма системы фильтрации в тангенциальном потоке (TFF) для очистки бактериальных экстрактов после щелочного лизиса. На этой диаграмме показаны различные сосуды для неочищенного бактериального экстракта, очищенной фракции, сред для диафильтрации, чистой органической кислоты или концентрированного раствора органической кислоты; два насоса, держатель микрофильтра, держатель нанофильтра/ультрафильтра, клапаны, регуляторы трансмембранного давления (ТМР), пропеллер, рН-электрод и соединение с сосудом для отходов. Может быть использована серия фильтров, соединенных в параллельном режиме, когда все фильтры работают одновременно, или в последовательном режиме, где все фильтры работают в серийном режиме.
[0021] На фигуре 3 представлен протокол эксперимента по суперинфицированию: вирусной инфекцией легких, а затем бактериальной инфекцией легких. Показана схема введения доз бактериального экстракта OM путем перорального введения (группы 2) по сравнению с интраназальным введением (группы 3 и 4) и интраназальным введением физиологического раствора (группа 1).
[0022] На фигуре 4 показаны результаты, полученные после суперинфицирования, и указывающие на то, что интраназальное введение бактериального экстракта ОМ (в дозе А=50 микрограммов и в дозе В=5 микрограммов) приводило к значительному повышению выживаемости по сравнению с выживаемостью животных, которым перорально вводили бактериальный экстракт ОМ (перорально 7 миллиграммов) и физиологический раствор в качестве контроля.
[0023] На фигуре 5 показаны результаты, полученные после суперинфицирования, и указывающие на то, что профилактическое интраназальное введение бактериального экстракта ОМ приводило к значительному снижению заболеваемости и смертности после бактериальной инфекции, вызванной гриппом, и эти результаты были систематизированы здесь вместе с результатами клинической оценки после интраназального введения (i.n.) 5 и 50 микрограммов бактериального экстракта OM по сравнению с пероральным введением (p.o.) 7 миллиграммов бактериального экстракта ОМ и по сравнению с контрольной группой, которой вводили физиологическиий раствор.
[0024] На фигуре 6 представлена фотография, иллюстрирующая различные признаки коморбидности через один день после бактериального инфицирования (на день 8 на схеме на Фигуре 3), наблюдаемого у мышей, получавших 7 миллиграммов бактериального экстракта ОМ перорально (показано здесь как временный грубый шерстяной покров) по сравнению с 50 микрограммами бактериального экстракта ОМ, вводимого интраназально (показаны здоровые животные).
[0025] На фигуре 7 показан протокол эксперимента по суперинфицированию: вирусной инфекцией легких, а затем бактериальной инфекцией легких. На этой фигуре показана схема введения доз бактериального экстракта OM путем интраназального введения (через нос) по сравнению с интратрахеальным введением (i.t.) и введением физиологического раствора в качестве контроля.
[0026] На фигуре 8 представлен график, где показан титр вируса в ткани легких через 5 дней после введения бактериального экстракта ОМ в дозах A (50 микрограммов) и В (5 микрограммов) путем интраназального (i.n.) и интратрахеального (i.t.) введения по сравнению с интраназальным введением (i.n.) и интратрахеальным введением (i.t.) физиологического раствора в качестве контроля.
[0027] На фигуре 9 представлен график, показывающий выживаемость мышей, обработанных путем интраназального введения бактериального экстракта ОМ в дозе 50 микрограммов (в дозе A.I.N) и 5 микрограммов (в дозе B.I.N) или физиологического раствора (I.N.).
[0028] На фигуре 10 представлен график, показывающий, что интраназальное профилактическое лечение бактериальным экстрактом ОМ приводило к значительному снижению заболеваемости и смертности после бактериальной инфекции, вызванной гриппом, и результаты были систематизированы здесь вместе с результатами клинической оценки после интраназального введения 5 микрограммов (доза А), и 50 микрограммов (доза B) бактериального экстракта OM по сравнению с контрольной группой, которой вводили физиологическиий раствор. Клиническая эффективность была пропорциональна дозе.
[0029] На фигуре 11 представлен график, показывающий выживаемость мышей после введения бактериального экстракта ОМ или физиологического раствора путем интратрахеального введения 50 микрограммов (доза A, I.T) и 5 микрограммов (доза B, I.T) бактериального экстракта ОМ.
[0030] На фигуре 12 представлен график, показывающий, что интратрахеальное профилактическое введение бактериального экстракта ОМ приводило к значительному снижению заболеваемости и смертности, и эти результаты были систематизированы здесь вместе с результатами клинической оценки после введения доз 50 микрограммов (доза A, I.T) и 5 микрограммов (доза B, I.T).
[0031] На фигуре 13 показан протокол эксперимента по суперинфицированию: вирусной инфекцией легких, а затем бактериальной инфекцией легких с использованием различных доз и схем лечения, а именно, интраназального введения (через нос) и перорального введения бактериального экстракта ОМ по сравнению с контрольной группой с последующим анализом на инфицирование легких вирусом гриппа. Группы с 1 по 11 описаны в Таблице 6.
[0032] На фигуре 14 представлен график, показывающий титр вируса в ткани легких на 5-й день после инфицирования после профилактического интраназального введения бактериальных экстрактов ОМ по сравнению с пероральным введением.
[0033] На фигуре 15 показан уровень инфицирования человеческим риновирусом (RV16) в человеческих первичных бронхиальных эпителиальных клетках (БЭК), полученных путем биопсии легких здоровых доноров, предварительно обработанных различными стабильными бактериальными экстрактами OM314A. (А) Предварительную обработку клеток БЭК экстрактом OM314A, содержащим органические кислоты или HCl, проводили за 1 день до инфицирования RV-16 с множественностью инфицирования (MOI) 1. Экспрессию мРНК RV-16 использовали в качестве индикатора репликации вируса и выражали как относительное значение (процент, фигура 15A) по сравнению с RV16 (100%). Контроль 1 (0%) представлял собой незараженные клетки. RV16-1 представлял собой клетки БЭК, инфицированные RV16 в течение 24 часов. Столбики представляют среднее±ср. кв. ош. Тестируемые образцы: контроль 1, RV16; Образцы OM314A: HCL; 10 HCL-сentri; масляная кислота; масляная кислота-сentri; пропионовая кислота; пропионовая кислота-сentri; аспарагиновая кислота; аспарагиновая кислота-сentri. Сentri. означает супернатант пары образцов, полученный после центрифугирования и сравниваемый с нецентрифугированной противоположной парой. (B) Человеческие первичные БЭК, позитивные по белку RV16 (n=3), через 24 часа после инфицирования с использованием 3 различных вирусных концентраций. (C) Влияние предварительного инкубирования (24 часа) с различными препаратами OM314A (20 мкл/мл) на окрашивание белка RV16 в БЭК (n=3) через 24 часа после инфицирования MOI=0,1. Столбики представляют среднее±ср. кв. ош.
[0034] Фигура 16: Экспериментальная схема, описывающая протокол, используемый для мониторинга высвобождения интерферона из человеческих БЭК. Клетки высевали на день -2, удаляли сыворотку на день -1, и стимулировали в течение 24 часов образцами OM314A (OM), как показано на фигурах 17 и 18. Клеточные супернатанты собирали в указанные моменты времени для введения доз интерферона-бета и гамма с помощью ELISA.
[0035] Фигура 17: (A) Дозозависимый ответ на секрецию интерферона-бета (IFN-бета) типа 1 человеческими БЭК после 24- часового инкубирования с бактериальным экстрактом OM, нейтрализованным HCL (от 0,1 до 50 микрограммов/мл). Столбики представляют среднее из n=5 доноров±ср. кв. ош. * = р < 0,01 по сравнению с 24 ч. (B) Секреция IFNβ человеческими БЭК (n=3) через 24 часа после инфицирования RV16. (С) Зависимое от концентрации влияние различных препаратов OM314A (Р1, Р2, Р3), OM314B (Р4) и ОМ-314C (Р5) на секрецию IFNβ неинфицированными (n =3) человеческими БЭК. Столбики представляют среднее±ср. кв. ош. для каждого условия.
[0036] Фигура 18: (A) Дозозависимый ответ на секрецию интерферона гамма (IFN-гамма) типа 2 человеческими первичными эпителиальными клетками легких (БЭК) после 24-часового инкубирования с бактериальным экстрактом OM, нейтрализованным HCl (от 0,1 до 50 микрограммов/мл). Столбики представляют среднее из n=5 доноров±ср. кв. ош. * = р < 0,01 по сравнению с 24-часовым контролем. (B) Секреция IFNγ человеческими БЭК (n=3) через 24 часа после инфицирования RV16. (С) Зависимое от концентрации влияние различных препаратов OM314A (Р1, Р2, Р3), OM314B (Р4) и ОМ-314C (Р5) на секрецию IFNγ неинфицированными человеческими БЭК. Столбики представляют среднее±ср. кв. ош. для каждого условия.
[0037] Фигура 19: Показана экспрессия антивирусного β-дефензина-1 человеческими первичными эпителиальными клетками легких (БЭК). А) Показано влияние инфицирования (3 различными концентрациями) на секрецию β-дефензина-1 клетками БЭК (п=3) через 24 часа после инфицирования RV16. (B) Показано зависимое от концентрации влияние стабильного бактериального экстракта OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) на секрецию β- дефензина-1 неинфицированными БЭК (п=3). Столбики представляют среднее±ср. кв. ош. с тремя повторностями для каждого условия.
Фигура 20: Экспрессия вирусного рецептора ICAM-1. (А) Показана экспрессия рецептора ICAM-1 человеческими первичными эпителиальными клетками легких (п=3) через 24 часа после инфицирования RV16. (B) Показано зависимое от концентрации влияние стабильного бактериального экстракта OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) на экспрессию ICAM-1 инфицированными первичными эпителиальными клетками (n=3). Столбики представляют среднее±ср. кв. ош. с тремя повторностями для каждого условия.
[0039] Фигура 21: Показано высвобождение TNF-α, зависящее от ловушко-подобного рецептора (TLR)-4 из дендритных клеток мышиного костного мозга, происходящих от мышей дикого типа (WT, черные столбцы) или мышей с нокаутом по TLR4 (TLR4-/-, белые столбцы)(BMDC). Клетки стимулировали возрастающими разведениями стабильного бактериального экстракта OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) или либо LPS (2 мкг/мл), либо промышленной партией (I.B#1619057) для контролей с использованием того же самого набора разведений. Уровень концентраций TNFα оценивали в супернатантах с помощью ELISA после 16-часового индуцирования и в соответствии с протоколом производителя.
[0040] Фигура 22: Показаны результаты, полученные с помощью линейного дискриминантного анализа (LDA) у контрольных мышей, которым давали обычный корм, а именно, обычный корм с добавлением физиологического раствора (NCD (NCD-контроль)); мышей, которым давали обычный корм, обработанный бактериальным экстрактом лизатов 21 штамма (NCD-BE): контрольных мышей, которым давали корм с высоким содержанием жира, содержащий физиологический раствор (HFD-контроль); и мышей, которым давали корм с высоким содержанием жира, обработанный бактериальным экстрактом лизатов 21 штамма (NCD-BE).
[0041] Фигура 23: (А) Показаны графики для концентрации глюкозы перед кормлением бактериальным экстрактом из лизатов 21 штамма (перед кормлением), (В) после кормления мышей обычным кормом (после NCD), (С) после кормления мышей кормом с высоким содержанием жира (после HFD). Для определения прироста массы тела, мышей взвешивали один раз в неделю. Меру потребления корма оценивали один раз в неделю путем взвешивания гранул в начале и в конце недели. Оценка значимости, указанная большими черными и маленькими звездочками, представляет собой HFD-контроль по сравнению с HFD-L. Мышей, обработанных Plantarum и HFD-контролем, сравнивали с HFD-BE, как показано на графиках с указанием соответствующих величин значимости.
[0042] Фигура 24: Показаны масса тела и потребление корма. (A) Показана масса тела контрольных мышей, которым давали корм с высоким содержанием жира, содержащий физиологический раствор (HFD-контроль), мышей, которым давали корм с высоким содержанием жира, обработанный бактериальным экстрактом из лизатов 21 штамма (HFD-BE), и мышей, которым давали корм с высоким содержанием жира, обработанный L. Plantarum (NCD-L. Plant), где указанные значения выражены в граммах. (B) Показано сравнение потребления корма контрольными животными, которым давали корм с высоким содержанием жира, содержащий физиологическиий раствор (HFD-контроль), и животными, которым давали корм с высоким содержанием жира, обработанный бактериальным экстрактом из лизатов 21 штамма (HFD-BE), где указанные значения выражены в граммах. Для определения прироста массы тела, мышей взвешивали один раз в неделю. Меру потребления корма оценивали один раз в неделю путем взвешивания гранул в начале и в конце недели. Оценка значимости, показанная обведенными звездочками, представляет HFD-контроль по сравнению с HFD-ВЕ. Оценка значимости, показанная обычными звездочками *, представляет HFD-контроль по сравнению с HFD-L. Мыши, обработанные Plantarum, показаны на графиках с указанием соответствующих величин значимости.
[0043] Фигура 25: Показаны результаты тестов на толерантность к инсулину для всех 42 мышей до обработки (перед кормлением) и по окончании 8-недельного периода обработки (после кормления) мышей, которым давали корм с высоким содержанием жира, содержащий физиологический раствор (HFD-контроль), мышей, которым давали корм, содержащий бактериальный экстракт из лизатов 21 штамма (HFD-BE), или мышей, которым давали корм с L. Plantarum (NCD-L. Plant). Оценка значимости, показанная обычными черными звездочками, означает HFD-контроль по сравнению с HFD-BE, как показано на графиках (р <0,0001).
[0044] Фигура 26: Показано влияние бактериального экстракта из 21 бактериального лизата на различные виды кишечных бактерий. Секвенирование и анализ рибосомной РНК 16S осуществляли как описано в Примере 10. A. Clostridiales Lachnospiraceae blautia; B. Clostridia Clostridiales ruminococcaceae GCA-900066225; C. Clsotridiales Ruminococcaceae ruminococcaceae UCG-0101; D. Некультивированная бактерия Bacteroidales Muribaculaceae; E. Бактерии группы Lachnospiraceaeae [Eubacterium] fissicantena; * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001.
[0045] На фигуре 27 представлен спектр шума, указывающий на осадок в растворе (приведенный в качестве типичного примера нестабильного бактериального экстракта).
[0046] На фигуре 28 представлен сглаженный спектр, указывающий на прозрачный раствор (приведенный как типичный пример стабильного бактериального экстракта).
[0047] Фигура 29: Процесс 1 - результаты биоанализа на стабильность показали, что Процесс 1 - E3-нейтрализованный фильтрат (OM314A) проявлял сравнимую биоактивность за счет секреции MIP-3α на THP-1 в течение по меньшей мере 4 месяцев при комнатной температуре (20°C±5°C) или 4°C. Процесс 1 на T0 сравнивали с образцами T4, хранящимися при 4°C и при комнатной температуре (КТ) в течение 4 месяцев.
[0048] Фигура 30: Процесс 2 - результаты биоанализа на стабильность показали, что Процесс 2 - E3-нейтрализованный фильтрат (OM314A) проявлял сравнимую биоактивность за счет секреции MIP-3α на THP-1 в течение по меньшей мере 4 месяцев при комнатной температуре (20°C±5°C) или 4°C. Процесс 2 на T0 сравнивали с образцами T4, хранящимися при 4°C и при комнатной температуре (КТ) в течение 4 месяцев.
[0049] Фигура 31: Процесс 3 - результаты биоанализа на стабильность показали, что Процесс 3 - E3-нейтрализованный фильтрат (OM314A) проявлял сравнимую биоактивность за счет секреции MIP-3α на THP-1 в течение по меньшей мере 5 месяцев при комнатной температуре (20°C±5°C) или 4°C. Процесс 3 на T0 сравнивали с образцами T4, хранящимися при 4°C и при комнатной температуре (КТ) в течение 5 месяцев.
[0050] Фигура 32: Процесс 5 - результаты биоанализа на стабильность показали, что Процесс 5 - E3-нейтрализованный фильтрат (OM314A) проявлял сравнимую биоактивность за счет секреции MIP-3α на THP-1 в течение по меньшей мере 4 месяцев при комнатной температуре (20°C±5°C) или 4°C. Процесс 5 на T0 сравнивали с образцами T5, хранящимися при 4°C и при комнатной температуре (КТ) в течение 4 месяцев.
Подробное описание
[0051] Таким образом, настоящее изобретение относится к стабильному очищенному бактериальному экстракту, получаемому путем щелочного лизиса грамположительных и/или грамотрицательных бактерий и нейтрализации одной или более конкретными органическими кислотами, выбранными из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации, или их фармацевтически приемлемых солей и сложных эфиров, с последующей очисткой путем фильтрации нейтрализованного бактериального экстракта, и доведением до конечного физиологического pH путем добавления органической кислоты, комбинации органических кислот или их солей и сложных эфиров, используемых для указанной нейтрализации.
[0052] Заявителем было обнаружено, что контактирование бактериального экстракта после щелочного лизиса, при котором pH лизата превышает 10 (и варьируется в пределах±0,1), в зависимости от выбранной конкретной органической кислоты, позволяет получить бактериальный экстракт, демонстрирующий удивительно превосходную стабильность. Более конкретно, композиция бактериального экстракта согласно изобретению сохраняла физическую стабильность в течение нескольких месяцев в жидкой форме. Такие новые композиции бактериального экстракта, имеющие повышенную физическую стабильность, могут затем стабильно храниться в жидкой, полутвердой или аэрозольной форме, либо в качестве конечных лекарственных средств для введения пациентам, либо в процессе приготовления или получения фармацевтического лекарственного продукта.
[0053] Используемый здесь термин «стабильная» композиция означает бактериальный экстракт, который по существу сохраняет свою физическую стабильность в жидкой форме, либо во время хранения фармацевтических препаратов или в жидкой форме в качестве промежуточного продукта в процессе приготовления лекарственного средства или композиции. Композиция бактериального экстракта сохраняет свою физическую стабильность в виде фармацевтической композиции, если она не обнаруживает значительное увеличение степени агрегации и/или осаждения при визуальной оценке чистоты, или как было определено с помощью анализа методом рассеяния света, эксклюзионной хроматографии (ЭХ) и динамического рассеяния света. Никакого значительного осаждения или физических изменений при комнатной температуре не наблюдалось при 4°C, -20°C или при -80°C в течение по меньшей мере 3 месяцев, или 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 12 месяцев. Предпочтительно, чтобы степень агрегации и осаждения составляла не более 10%, а более предпочтительно 5%.
[0054] Термин «органическая кислота» означает органическое соединение, которое характеризуется слабыми кислотными свойствами и полностью не диссоциирует в присутствии воды.
[0055] Термины «альтернативные пути введения» обычно относятся к периоральному и пероральному путям и могут включать, inter alia, интраназальное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, местное введение, нанесение на кожу, трансбуккальное введение, пероральное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение.
[0056] Термин «бактериальный экстракт OM314A» означает поливалентный иммуномодулятор, содержащий очищенный бактериальный экстракт или лизат, который был эктрагирован путем щелочного лизиса из одного или более наиболее часто встречающихся бактериальных патогенов верхних дыхательных путей, включая Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis. Предпочтительно, чтобы бактериальный экстракт OM314A мог быть получен путем щелочного лизиса комбинации одного или более из вышеупомянутых бактериальных патогенов, а наиболее предпочтительно, чтобы он содержал восемь указанных выше патогенов. Этот бактериальный экстракт OM314A был приготовлен в виде стабильной композиции согласно изобретению и соответствовал бактериальному экстракту второго поколения, ранее описанному в нескольких научных публикациях и в Международной публикации WO2008/109669. Бактериальный экстракт первого поколения, называемый ниже как «бактериальный экстракт ОМ», вводят пациентам перорально в виде твердых препаратов для проглатывания, таких как капсулы и таблетки, и было показано, что он эффективно предотвращает инфекции дыхательных путей у взрослых и детей. Кроме того, было проведено несколько клинических испытаний и было показано, что энтеральное введение (в полость рта) этого бактериального экстракта OM первого поколения предотвращает аллергическую астму и приступы свистящих хрипов, спровоцированные острыми заболеваниями дыхательных путей у детей при пероральном введении. Указанный бактериальный экстракт ОМ первого поколения в виде фармацевтических препаратов имеется в продаже в твердой форме под торговым знаком Broncho-Vaxom®, а в основном в форме капсул или саше, которые вводят пациентам перорально и в дозе одна капсула в день, содержащая 7 мг лиофилизированного бактериального экстракта для взрослых, и одна капсула в день, содержащая 3,5 мг лиофилизированного бактериального экстракта для детей.
[0057] Таким образом, бактериальный экстракт OM314A означает, в отличие от бактериального экстракта OM первого поколения, лекарственное средство второго поколения, содержащее бактериальный экстракт OM, но стабилизированное так, чтобы его можно было приготовить в любых возможных фармацевтических формах, то есть, в жидкой, газообразной или твердой форме, которая является подходящей для более широких возможных путей введения, включая интраназальное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, местное введение, трансбуккальное введение, пероральное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение.
[0058] Термин «бактериальный экстракт OM314B» означает поливалентную вакцину, получаемую путем щелочного лизиса одного или более видов бактерий, выбранных из бактериальных штаммов Lactobacillus, как описано в Международной публикации WO2010/027344. В частности, стабильный бактериальный экстракт может включать один или более бактериальных штаммов Lactobacillus, выбранных из Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, 15 Lactobacil/us paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus lactis, и/или Lactobacillus delbrueckii. Бактериальный экстракт OM314B был приготовлен в виде стабильной композиции согласно изобретению и соответствует бактериальному экстракту Lactobacillus второго поколения, описанному ранее в Международной публикации WO2010/027344. Бактериальный экстракт OM314B был стабилизированное так, чтобы его можно было приготовить в любых возможных фармацевтических формах, то есть, в жидкой, газообразной или твердой форме, которая является подходящей для более широких возможных путей введения, включая интраназальное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, местное введение, трансбуккальное введение, пероральное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение.
[0059] Следовательно, термин «бактериальный экстракт OM314С» означает стабильной бактериальный экстракт, получаемый путем щелочного лизиса одного или более видов бактериальных штаммов Escherichia coli, описанных в Международной публикации WO2008/109667. Бактериальный экстракт OM314С был получен в форме стабильной композиции согласно изобретению и соответствует бактериальному экстракту Escherichia coli второго поколения, описанному ранее в Международной публикации WO 2008/109667. Бактериальный экстракт OM314C второго поколения был стабилизирован так, чтобы его можно было приготовить в любых возможных фармацевтических формах, то есть, в жидкой, газообразной или твердой форме, которая является подходящей для различных путей введения, включая интраназальное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, нанесение на кожу, трансбуккальное введение, пероральное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение.
[0060] Термин «стабильная композиция бактериального экстракта» означает стабилизированную форму любого лекарственного средства на основе бактериального экстракта, который может быть получен путем экстракции посредством щелочного лизиса, как описано в Международных публикациях WO2008/109669, WO2010/027344 или в WO2008/109667, но который был адаптирован в фармацевтические формы, подходящие для альтернативных путей введения, включая интраназальное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, местное введение, трансбуккальное введение, пероральное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение как описано выше.
[0061] Поэтому, стабильно очищенные бактериальные экстракты согласно изобретению могут содержать бактериальный щелочной лизат любых комбинаций грамположительных и/или грамотрицательных бактерий, обладающих терапевтическими иммуномодулирующими свойствами, которые были стабилизированы и таким образом могут быть приготовлены в виде каких-либо фармацевтических форм для широкого множества путей введения, включая интраназальное введение, интратрахеальное введение, введение в слизистую, введение через слизистую, местное введение, трансбуккальное введение, пероральное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение, как описано выше.
[0062] В соответствии с первым вариантом осуществления изобретения, новые стабильные композиции бактериального экстракта могут содержать бактериальный лизат из одного или нескольких видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, как описано в Международной публикации заявителя № WO2008/109669. Предпочтительно, новая стабильная композиция бактериального экстракта согласно этому варианту осуществления изобретения, указанная ниже, представляет собой стабильную композицию бактериального экстракта OM314A и может быть получена путем щелочного лизиса бактерий следующих видов: Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis.
[0063] В соответствии с этим вариантом осуществления изобретения, эта композиция представляет собой стабильный очищенный бактериальный экстракт, полученный из одного или нескольких видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, где указанный бактериальный экстракт может быть получен посредством щелочного лизиса бактериальных штаммов и нейтрализации одной или более органическими кислотами, выбранными из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинаций или их фармацевтически приемлемых солей и сложных эфиров, с последующей очисткой путем фильтрации нейтрализованного экстракта, и доведением до конечного физиологического pH путем добавления тех же самых органических кислот, или их комбинаций, используемых для указанной нейтрализации.
[0064] Согласно второму варианту осуществления изобретения, стабильную композицию бактериального экстракта получают из одного или нескольких видов бактерий, выбранных из бактериальных штаммов Lactobacillus. В частности, стабильный бактериальный экстракт может включать один или более бактериальных штаммов Lactobacillus, выбранных из Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus lactis, и/или Lactobacillus delbrueckii, как описано в Международной публикации заявителя WO2010/027344.
[0065] Таким образом, согласно этому второму варианту осуществления изобретения, такая композиция представляет собой стабильный очищенный бактериальный экстракт, полученный из одного или нескольких бактериальных штаммов Lactobacillus, где указанный бактериальный экстракт может быть получен посредством щелочного лизиса бактериальных штаммов и нейтрализации одной или более органическими кислотами, выбранными из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации, или их фармацевтически приемлемых солей и сложных эфиров, с последующей очисткой путем фильтрации нейтрализованного экстракта, и доведением до конечного физиологического pH путем добавления тех же самых органических кислот, или их комбинаций, используемых для указанной нейтрализации.
[0066] В третьем варианте осуществления изобретения описан стабильный бактериальный экстракт, полученный из одного или нескольких бактериальных штаммов Escherichia coli, где указанный бактериальный экстракт может быть получен посредством щелочного лизиса указанных бактериальных штаммов и нейтрализации одной или более органическими кислотами, выбранными из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации, или их фармацевтически приемлемых солей и сложных эфиров, с последующей очисткой путем фильтрации нейтрализованного экстракта, и доведением до конечного физиологического pH путем добавления тех же самых органических кислот, или их комбинаций, используемых для указанной нейтрализации. В частности, бактериальный экстракт Escherichia coli может содержать один или более бактериальных штаммов Escherichia coli, как описано в Международной публикации заявителя WO2008/109667.
[0067] Согласно этому третьему варианту, настоящее изобретение относится к стабильному очищенному бактериальному экстракту из одного или более бактериальных штаммов Escherichia coli, где указанный бактериальный экстракт может быть получен посредством щелочного лизиса и нейтрализации одной или более органическими кислотами, выбранными из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации, или их фармацевтически приемлемых солей и сложных эфиров, с последующей очисткой путем фильтрации нейтрализованного экстракта, и доведением до конечного физиологического pH путем добавления тех же самых органических кислот, или их комбинаций, используемых для указанной нейтрализации.
[0068] В вышеупомянутых вариантах осуществления изобретения, бактериальные экстракты содержат по меньшей мере один штамм каждого из вышеуказанных видов бактерий, тогда как в других вариантах осуществления изобретения, один или более конкретных штаммов из приведенного выше списка могут быть удалены или заменены одним или более другими штаммами.
[0069] Как было указано выше, настоящее изобретение не ограничивается приготовлением стабильных композиций бактериального экстракта согласно любым из этих конкретных вариантов осуществления изобретения, поскольку любые другие комбинации грамположительных и/или грамотрицательных бактерий могут быть получены и составлены в соответствии с настоящим изобретением, и также обладают повышенной стабильностью.
[0070] Обычно, бактериальные экстракты получают путем ферментации с последующей термоинактивацией и щелочным лизисом и фильтрацией. Ферментация, щелочной лизис и фильтрация в настоящее время хорошо известны специалистам в данной области и описаны, inter alia, в Международных публикациях WO2008/109667, WO2010/027344 и WO2008/109669.
[0071] Ферментацию обычно проводят путем культивирования каждого бактериального штамма до подходящей оптической плотности в культуральной среде. Для каждого штамма, для получения достаточного количества материала, сбраживаемые культуры могут быть выращены из рабочей партии семян с последующей инокуляцией в более крупные контейнеры для ферментации. Так, например, ферментация может начата с небольшой культуры такой как 0,1-1,0 литра, с последующим инкубированием в течение приблизительно 3-6 часов при температуре от 30 до 40°С, например, при 37°С до достижения оптической плотности (OD) на 700 нм, составляющей от 3,0 до 5,0. После стадии мелкомасштабного культивирования, дополнительные культуры в одном ферментере или в серии более крупных ферментеров могут быть получены при температуре от 30°C до 40°C в течение периода времени от 3 часов до 20 часов, например, в течение 3-10 часов или 8 часов.
[0072] Культуральная среда предпочтительно представляет собой среду, которая не связана с риском развития заболеваний, ассоциированных с прионами (например, коровьего бешенства, скрепи и болезни Крейтцфельда-Якоба) или других заболеваний, и следовательно, не содержит продуктов животного происхождения, таких как сывороточные или мясные экстракты, происходящие от животных, таких как коровы или овцы, или от любого другого животного, которое может передавать заболевания, вызываемые прионами. Так, например, может быть использована среда, не происходящая от животных, такая как растительная среда, например, среда на основе сои или синтетическая или полусинтетическая среда. Альтернативно, может быть использована среда, полученная из лошадиной сыворотки, или среда, содержащая вещества, происходящие от животных, которые не переносят заболевания, вызываемые прионами. Культуральная среда может также включать биологические экстракты, такие как дрожжевой экстракт и лошадиную сыворотку, которые также не представляют какого-либо риска развития этого заболевания. Дополнительные факторы роста могут быть также введены для усиления роста некоторых видов бактерий.
[0073] После ферментации, биомассу от каждого бактериального штамма или от комбинированных бактериальных штаммов обычно инактивируют путем термообработки, концентрируют и замораживают.
[0074] Щелочной лизис применяют для лизиса бактериальных клеток в оснόвных условиях, и такой лизис обычно осуществляют с использованием органического или неорганического основания. Щелочной лизис может быть проаеден на одной бактериальной биомассе или на смеси из бактериальной биомассы или сбраживаемых партий, в оснόвных условиях, обычно с концентрированным раствором гидроксид-ионов, например, NaOH.
[0075] Щелочной лизис может быть предпочтительно проведен при pH более, чем приблизительно 10, с отклонениями pH в пределах ±0,1. Продолжительность лизиса может быть оценена специалистом в данной области, и зависит от исходного количества бактериальной биомассы. Лизис может быть проведен при температуре в пределах от 30 до 60°C, например, при 30-40°C, или 35-40°C, например, при 37°C. Обычно, лизис прекращают, когда все клетки бактерий будут разрушены исходя из визуального наблюдения, как это хорошо известно специалисту в данной области. При использовании более чем одного штамма бактерии одного и того же рода, штаммы могут быть подвергнуты лизису вместе или по отдельности. Таким образом, штаммы можно смешивать до или после лизиса.
[0076] Во время лизиса, бактериальные клетки будут разрушены, а их компоненты будут разлагаться и химически модифицироваться. В частности, рацемизация аминокислот приводит к образованию D-аминокислот из встречающихся в природе L-аминокислот, содержащихся в природных белках. D-аминокислоты могут быть полезными для повышения биодоступности экстрактов, поскольку белки, состоящие в основном или частично из D-аминокислот, неэффективно гидролизуются в кишечнике млекопитающих. Таким образом, антигенные молекулы в экстрактах, которые были химически модифицированы в процессе лизиса, содержат D-аминокислоты, сохраняющиеся в организме пациента в течение более длительного времени, что потенциально позволяет усиливать иммуностимулирующее действие.
[0077] После лизиса, в соответствии с настоящим изобретением, бактериальный лизат был нейтрализован, то есть, рН лизата был скорректирован путем добавления одной или более конкретных органических кислот так, чтобы конечный рН составлял 5-8, 6-8, 6,3-7,8 или 6,5-7,8. Указанные одна или более конкретных органических кислот могут быть выбраны в соответствии с настоящим изобретением из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации, и/или их фармацевтически приемлемых солей и сложных эфиров.
[0078] Затем лизаты очищают путем центрифугирования и/или фильтрации для удаления крупного клеточного дебриса или каких-либо недостаточно разложившихся компонентов, то есть, любого нерастворимого или состоящего из частиц материала так, чтобы получить растворимый бактериальный экстракт. Способы очистки, включая центрифугирование и фильтрацию, хорошо известны специалистам в данной области и применяются для удаления твердых частиц из экстрактов. Так, например, лизаты могут быть центрифугированы при 9000×g с последующим проведением одного или более раундов фильтрации. Обычно, фильтрация может включать прохождение экстракта или смеси экстрактов через один или более фильтров, таких как микрофильтр (то есть, для микрофильтрации) или ультрафильтры (то есть, для ультрафильтрации), и такая фильтрация может быть повторена в несколько раундов или циклов. Так, например, последовательные раунды фильтрации на фильтрах с более крупными порами с последующей микрофильтрацией с использованием фильтра с меньшими порами могут быть осуществлены, например, на 0,2-микронном фильтре. Ультрафильтрация может быть также проведена для облегчения удаления растворимых веществ из экстракта, например, путем рециркуляции пермеата ультрафильтрации для дальнейшей микрофильтрации.
[0079] Для фильтрации экстрактов и для извлечения солюбилизированных молекул из более крупного клеточного дебриса может быть применен метод фильтрации в тангенциальном потоке (TFF). Этот метод хорошо известен специалистам и описан, inter alia, Wayne P. Olson (Separations Technology, Pharmaceutical and Biotechnology Applications, Interpharm Press, Inc., Buffalo Grove, IL, USA, pp. 126-135). Пример способа контурной фильтрации показан ниже на Фигуре 1. В начале проведения такого способа, разведенный бактериальный лизат может храниться в первом резервуаре. Затем может быть начата контурная микрофильтрация (MF) с последующей откачкой продукта. Затем, полученный ретентат MF подвергают рециркуляции, а пермеат MF может быть перенесен во второй резервуар. После достижения подходящей степени концентрирования может быть начата контурная ультрафильтрация (UF). Пермеат UF может быть снова подвергнут рециркуляции в первом резервуаре для непрерывной экстракции солюбилизированных соединений из лизата, в то время как ретентат UF может храниться во втором резервуаре. Во время непрерывной экстракции, объемы в резервуарах 1 и 2 можно корректировать путем регуляции скорости потока пермеатов микрофильтрации и ультрафильтрации. Может быть проведено несколько таких циклов экстракции либо с применением TFF, либо с применением другого метода фильтрации. В тех вариантах, в которых применяется TFF, в конце последнего цикла, контурная ультрафильтрация может быть завершена, и может быть запущена только одна контурная микрофильтрация с последующим переносом пермеата МF в резервуар 2. Контурная микрофильтрация может быть осуществлена с использованием фильтров от 1,2 микрона до 0,1 микрона, например, от 0,65 до 0,2 микрона или 0,45 микрона. Перекрестный поток может составлять 1000 литров/час•м2 (LHM) и 3000 LHM, например, от 1500 до 2500 LHM, или 2000 LHM с трансмембранным давлением (TMP) от 0,6 до 2 бар, например, от 0,8 до 1,5 бар или 1,0 бар. Контурная ультрафильтрация может быть осуществлена с использованием фильтров от 10 кДа до 1000 кДа, например от 10 кДа до 100 кДа, или от 10 кДа до 30 кДа, или от 30 кДа до 100 кДа, или от 30 кДа до 300 кДа, или от 100 кДа до 300 кДа, или от 30 кДа до 1000 кДа, или от 100 кДа до 1000 кДа, или от 300 кДа до 1000 кДа. Перекрестный поток может составлять от 30 LHM до 1000 LHM, например, от 20 до 500 LHM с TMP от 0,2 до 1,5 бар, например, от 0,4 до 1,2 бар или 0,5 бар.
[0080] Для экстракции солюбилизированных соединений из бактериальных клеточных стенок могут быть использованы от 5 до 20 объемов диафильтрации. Средой для диафильтрации может быть вода, рН которой был доведен до 7-11. В некоторых вариантах осуществления изобретения, используются от 8 до 15 объемов. Следовательно, например, в некоторых вариантах осуществления изобретения, может быть проведено от 5 до 15 циклов фильтрации, а в некоторых случаях, от 8 до 15 циклов, например 8, 9, 10, 11, 12, 13, 14 или 15 циклов.
[0081] Помимо удаления любых нерастворимых частиц, такая фильтрация также направлена на удаление любых нуклеиновых кислот. В результате фильтрации, количество нуклеиновой кислоты, присутствующей в бактериальном экстракте, может составлять меньше, чем 100 микрограммов/мл. Однако, сахаридные компоненты, включая моносахариды, дисахариды, а также более крупные сахариды, такие как полисахариды с прямой и разветвленной цепью, а в частности, липополисахаридные (LPS) компоненты могут быть сохранены с помощью фильтрации. Действительно, в процессе лизиса, сахариды (включая компоненты LPS) расщепляются на небольшие структуры или замещаются различными функциональными группами. В связи с этим, хотя ранее считалось, что сахаридные компоненты, включая потенциально токсичные компоненты LPS, следует удалять из бактериальных экстрактов из соображений безопасности (см. патент США № 5424287), однако, заявитель считает, что сахаридные компоненты, включая LPS, могут безопасно сохраняться, поскольку эти компоненты фактически обеспечивают экстракты дополнительными антигенами и, таким образом, повышают терапевтическую эффективность. При желании, экстракты могут быть также дополнительно разведены, концентрированы или центрифугированы.
[0082] После диафильтрации, очищенный щелочью растворимый бактериальный экстракт был дополнительно скорректирован в соответствии с настоящим изобретением путем добавления одной или более определенных органических кислот для нейтрализации лизата. Указанные органические кислоты могут быть выбраны в соответствии с настоящим изобретением из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации, и/или их фармацевтически приемлемых солей и сложных эфиров. Предпочтительно, конечный pH композиции бактериального экстракта может быть доведен до 5-8, 6-8, 6,3-7,8 или 6,5-7,8.
[0083] Такие очищенные растворимые бактериальные экстракты, могут быть, предпочтительно, сохранены и могут хранится в виде жидкости в соответствии с настоящим изобретением, и оставаться прозрачными без какой-либо седиментации или преципитации, и таким образом, сохранять превосходную физическую стабильность. Альтернативно, очищенные бактериальные экстракты могут быть лиофилизованы, если это необходимо, перед их преобразованием в жидкую, газовую или твердую форму для терапевтического применения или для дальнейших процессов получения галеновых препаратов.
[0084] Если бактериальные экстракты хранятся в виде жидких композиций, то они могут храниться при комнатной температуре в течение более длительного периода времени с превосходной физической стабильностью в течение длительного периода времени, сохраняя при этом биологическую активность. Преимущественно, бактериальные экстракты можно хранить при комнатной температуре или при 4°C, -20°C или при -80°C без образования агрегатов и осадка в процессе приготовления или хранения композиции. Таким образом, согласно настоящему изобретению стало возможным значительно снижать образование любых агрегатов, как нерастворимых, так и растворимых в композициях бактериальных экстрактов. Кроме того, наблюдалось не только повышенная физическая стабильность, но также отмечалось, что эти композиции сохраняют превосходную биологическую активность полисахаридов, липополисахаридов, белков, рацемических аминокислот и других биологических компонентов в процессе получения или хранения, без существенного химического разложения или модификации биологических компонентов.
[0085] Композиции бактериальных экстрактов согласно изобретению могут храниться при КТ, или при 4°C, -20°C или при -80°C в течение по меньшей мере 1 месяца, или по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяцев, где указанные композиции не обнаруживают значительного физического изменения в процессе приготовления и/или хранения бактериального экстракта под действием, например, света, температуры, рН, воды или реакции взаимодействия с наполнителем и/или с системой немедленного закрытия контейнера. Кроме того, та же самая композиция бактериального экстракта с известной исходной биологической активностью при ее помещении в те же самые условия хранения может сохранять по меньшей мере исходную биологическую активность. В родственном варианте осуществления изобретения, бактериальный экстракт не достигает указанного срока годности в течение указанного периода хранения.
[0086] Состав и химические свойства этих основных компонентов терапевтически активных растворимых бактериальных экстрактов, полученных таким образом, были точно определены и поддерживались в течение более длительного периода времени в жидких композициях. В частности, как указано выше, количество нуклеиновой кислоты, присутствующей в бактериальном экстракте, составляет менее 100 мкг/мл. Бактериальные экстракты также содержат более чем 0,1 мг/мл полисахаридов, или от 0,1 до 4,5 мг/мл, или от 0,1 до 4 мг/мл, или от 0,1 до 4 мг/мл, или от 0,1 до 3,5 мг/мл, или 0,6 до 3 мг/мл или от 0,3 до 1 мг/мл, или в интервале, начинающимся или заканчивающимся значениями 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, или 4,5 мг/мл полисахаридов, например, от 0,4 до 0,5 мг/мл. Более того, выход солюбилизированных белков может быть определен в растворимом очищенном бактериальном экстракте по методу Лаури и может составлять более, чем 50%, или, например, он может составлять более, чем 60%, или он может составлять от 50 до 90%, или, например, 60-90%. Следовательно, бактериальный экстракт может содержать 5-75 мг/мл белков, или 10-65 мг/мл, или 20-45 мг/мл, или 5-40 мг/мл, или 5-20 мг/мл, или 5-10 мг/мл или 6-8 мг/мл белков или количество белков в интервале, начинающимся или заканчивающимся значениями 5, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70 или 75 мг/мл; от 1,5 до 2,5 мг/мл свободных аминокислот (а.к.), или от 1,5 до 2 мг/мл, или от 2 до 2,5 мг/мл свободных а.к., или в интервале, начинающемся или заканчивающемся значениями 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5 мг/мл свободной а.к. в расчете на глутаминовую кислоту (147,1 г/моль); и от 0,3 до 4,5 мг/мл полисахаридов и моносахаридов, или от 0,3 до 4 мг/мл, или от 0,4 до 4 мг/мл, или от 0,5 до 3,5 мг/мл, или от 0,6 до 3 мг/мл, или от 0,3 до 1 мг/мл или в интервале, начинающимся или заканчивающимся значениями 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0 или 4,5 мг/мл полисахаридов и моносахаридов, например, от 0,4 до 0,5 мг/мл.
[0087] Кроме того, такой лизис приводит к частичному гидролизу белков, а также к дезаминированию, дезамидированию и частичной рацемизации аминокислот из L в D. Рацемизация аминокислот в процессе лизиса способствует образованию D-аминокислот из природных L-аминокислот, содержащихся в природных белках. Аналитические исследования бактериальных экстрактов позволяют определить проценты рацемизации. Наблюдались пики, представляющие D-аспарагиновую кислоту, D-глутаминовую кислоту, D-серин, D-метионин, D-гистидин, D-аланин, D-аргинин, D-фенилаланин, D-тирозин, D-лейцин и D-лизин. Процент D-аминокислот этих видов варьируется от 3% до 40%. Следовательно, была выявлена рацемизация одной или более аминокислот, таких, как серин, треонин, гистидин, аланин, аргинин, тирозин, фенилаланин, лейцин и/или лизин. По меньшей мере 10% одной или более из вышеуказанных аминокислот могут подвергаться рацемизации из D в L. D-аминокислоты могут оказаться полезными для повышения биодоступности экстрактов, поскольку белки, состоящие главным образом или частично из D-аминокислот, неэффективно гидролизуются в кишечнике млекопитающих. Таким образом, антигенные молекулы в экстрактах, которые были химически модифицированы в процессе лизиса и содержат D-аминокислоты, остаются в организме пациента в течение более длительного периода времени, что потенциально позволяет усиливать иммуностимулирующее действие.
[0088] И наконец, лизис бактерий согласно изобретению может приводить к уменьшению молекулярной массы молекул компонентов с 0-300 кДа до 0-100 кДа или до 0-60 кДа из-за гидролиза.
[0089] В качестве примера, бактериальный экстракт может, таким образом, содержать приблизительно от 6 до 8 мг/мл белков, от 1,5 до 2,5 мг/мл аминокислот (а.к.) (как было определено после HCl-гидролиза) и/или приблизительно от 0,4 до 0,5 мг/мл полисахаридов и моносахаридов. Концентрацию белка определяют с помощью анализа Лаури в соответствии с методом 2, описанным в Европейской Фармакопее 2.5.33. Концентрацию сахара определяют после кислотного гидролиза и дериватизации согласно D. Herbert et al., Meth. Microbiol. 5B: 266 et seq. (1971). Концентрацию глутамата (глутаминовой кислоты) определяют путем превращения аминокислот в производные изоиндола и оценки оптической плотности на 340 нм, согласно Roth M., Fluorescence response for amino acid, Anal. Chem., 43, 880-882, (1971).
[0090] Как указано выше, было экспериментально показано, что бактериальный экстракт ОМ, вводимый мышам перорально в твердой форме в дозе, рассчитанной для человека (7 мг сухой массы бактериального экстракта), усиливал защиту от вторичной бактериальной инфекции после инфицирования вирусом гриппа (Pasquali et al, Frontiers in Medicine 2014, 1, 41).
[0091] Введение бактериального экстракта ОМ всегда осуществляли перорально (например, энтерально), а доза для лечения взрослых представляла собой одну капсулу в день, содержащую 7 мг лиофилизированного бактериального экстракта, и одну капсулу в день, содержащую 3,5 мг лиофилизированного бактериального экстракта для детей. Однако, заявителем было обнаружено, что введение бактериального экстракта ОМ альтернативными периоральными неэнтеральными путями введения, такими как интраназальное введение, интратрехеальное введение, введение в слизистую, введение через слизистую, местное введение, трансбуккальное введение, подъязычное введение, введение в легкие, внутрибронхиальное введение и/или внутрилегочное введение, обеспечивает сильный иммунный ответ и является более эффективным для устранения возможных инфекций и/или воспалений.
[0092] Важно отметить, что наблюдаемые превосходные терапевтические эффекты этих новых периоральных путей введения позволяют существенно снизить дозу лекарственного средства на основе бактериального экстракта. Схемы введения доз можно разделить на две части, то есть, на схему ежедневной периоральной дозы для лечения взрослых, содержащей 3,5 мг лиофилизированного бактериального экстракта и 1,75 мг лиофилизированного бактериального экстракта для детей. Заявителем уже было продемонстрировано, что эти новые периоральные пути введения обеспечивают более высокую терапевтическую эффективность при более низких дозах.
[0093] Кроме того, заявителем было показано, что эти новые периоральные пути введения бактериального экстракта, либо стабилизированной композиции бактериального экстракта, как описано выше, либо нестабилизированной композиции, дают более сильный иммунный ответ в дыхательных путях и в легких, а также дают сильные иммунные ответы на дистальных участках, таких как тонкий кишечник и т.п.
[0094] В частности, периоральное введение бактериальных экстрактов (либо в стабильной композиции, либо нет) позволяет обеспечивать защиту пациентов от острых и хронических иммунологических расстройств в результате инфекции и/или воспалений и/или новообразований и/или дисбактериоза. Периоральные пути введения являются, таким образом, особенно эффективными и полезными в способах лечения и/или профилактики этих патологий и расстройств, которые обычно обостряют патологические состояния и повышают риск развития хронических патологий.
[0095] Согласно настоящему изобретению, инфекции могут включать инфекции верхних и нижних дыхательных путей и/или связанные с ними осложнения, включая аллергический ринит; ринит; назофарингит; синусит; фарингит; тонзилит; ларингит; трахеит; ларингофарингит; грипп; инфекцию, вызываемую респираторно-синцитиальным вирусом, человеческим риновирусом (HRV), риносинцитиальным вирусом (RV), коронавирусом (CoV, SARS-CoV, MERS-Cov, COVID-19 и т.п.); круп; пневмонию; гиперчувствительный пневмонит; бронхопневмонию; бронхит; бронхиолит; пневмонию; обструктивную болезнь легких с острой инфекцией нижних дыхательных путей; обструктивную болезнь легких с острыми инфекциями верхних дыхательных путей; или заболевания с нарушением движения эпителиальных ресничек и/или нарушением выведения слизи. Инфекции могут также включать вторичные инфекции, не-респираторные вирусные инфекции, не-респираторные бактериальные инфекции, системные инфекции, такие как сепсис, септический шок и индуцированные вирусом осложнения.
[0096] Согласно настоящему изобретению, воспаления могут включать аллергические/атопические респираторные и не- респираторные симптомы, атопический дерматит, острый и/или хронический ассоциированный дерматит, анафилаксический шок и пищевые аллергии. Указанные воспаления могут также включать кожные заболевания, воспаления кожи, такие как экзема, розацея, атопический дерматит, псориаз, включая фотоповреждение (например, воспаление, вызванное солнечным светом, и покраснение кожи), атрофию кожи, диспигментацию кожи (пэтчи/пятна), фотодерматит (эритему: воспаление и покраснение кожи), телеангиэктазию, куперозный или актинический кератоз, а также воспаления, включающие преобладающие аутоиммунные признаки, вызываемые Т-хелперными клетками 2 и выбранные из болезни Грейвса, болезни Хашимото, склеродермии, заболеваний, ассоциированных с Ig4 или пузырчатки и воспаления, включающие эозинофильные признаки, выбранные из эозинофильного цистита, эозинофильного эзофагита, эозинофильного фасциита, эозинофильного гастроэнтерита, гиперэозинофильного синдрома, эозинофильного гранулематоза с полиангиитом, эозинофильной астмой или эозинофильной пневмонией.
[0097] Согласно настоящему изобретению, расстройства, связанные с дисбактериозом, могут включать астму, диабет, диабет типа 2, аутоиммунные заболевания, заболевания, ассоциированные с низким содержанием клетчатки, атопический дерматит, острый и/или хронический ассоциированный дерматит, псориаз, воспалительные заболевания кишечника, колит, язвенный колит, болезнь Крона, ожирение, метаболические заболевания или расстройства, печеночную недостаточность, NASH, NAFLD, фиброз печени, почечную недостаточность, заболевания, связанные с низким содержанием клетчатки.
[0098] И наконец, новообразование может включать неопластические признаки с иммунологическими нарушениями, такими как мастоцитоз, лейкоз тучных клеток, опухоли, вызываемые специфичностью к Т-хелперным клеткам 2, и/или опухоли, подавляющие иммунитет.
[0099] Таким образом, в своем первом аспекте, настоящее изобретение относится к очищенному бактериальному экстракту, полученному путем щелочного лизиса одного или более видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, где указанный бактериальный экстракт содержит менее, чем 100 микрограммов/мл нуклеиновых кислот, для применения в способе лечения и/или профилактики острых и хронических иммунологических заболеваний, вызываемых инфекциям и/или воспалениями, и/или новообразованиями, и/или дисбактериозом у индивидуума, где указанный очищенный растворимый бактериальный экстракт, независимо от того присутствует ли он в стабильной композиции или нет, вводят индивидууму периоральными путями, а в частности, путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, путем нанесения на кожу, трансбуккально, подъязычно, в легкие, внутрибронхиально и/или внутрилегочно, а также в дозе, меньшей, чем доза, используемая для энтерального (перорального) введения.
[00100] Настоящее изобретение также относится к очищенному бактериальному экстракту, получаемому путем щелочного лизиса одного или более видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, где указанный бактериальный экстракт содержит менее, чем 100 микрограммов/мл нуклеиновых кислот, для применения в способе лечения и/или профилактики инфекций, выбранных из инфекций верхних и нижних дыхательных путей и/или ассоциированных с ними осложнений, включая аллергический ринит, ринит, назофарингит, синусит, фарингит, тонзилит, ларингит, трахеит, ларингофарингит, грипп, инфекцию, вызываемую респираторно-синцитиальным вирусом, человеческим риновирусом (HRV), риносинцитиальным вирусом (RV), коронавирусом (CoV, SARS-CoV, MERS-Cov, COVID-19 и т.п.), круп, пневмонию, гиперчувствительный пневмонит, бронхопневмонию, бронхит, бронхиолит, пневмонию, обструктивную болезнь легких с острой инфекцией нижних дыхательных путей, обструктивную болезнь легких с острыми инфекциями верхних дыхательных путей или заболевания с нарушением движения эпителиальных ресничек и/или нарушением выведения слизи, вторичные инфекции, не-респираторные вирусные инфекции, не-респираторные бактериальные инфекции, системные инфекции, такие как сепсис, септический шок и индуцированные вирусом осложнения у индивидуума, где указанный очищенный растворимый бактериальный экстракт, независимо от того присутствует ли он в стабильной композиции или нет, вводят индивидууму периоральными путями, а в частности, путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, путем нанесения на кожу, трансбуккально, подъязычно, в легкие, внутрибронхиально и/или внутрилегочно.
[00101] Настоящее изобретение также относится к очищенному бактериальному экстракту, полученному путем щелочного лизиса одного или более видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, где указанный бактериальный экстракт содержит менее, чем 100 микрограммов/мл нуклеиновых кислот, для применения в способе лечения и/или профилактики воспалений, выбранных из аллергических/атопических респираторных и не-респираторных симптомов, атопического дерматита, острого и/или хронического ассоциированного дерматита, анафилаксического шока и пищевых аллергий, кожных заболеваний, воспалений кожи, таких как экзема, розацея, атопический дерматит, псориаз, включая фотоповреждение (например, воспаление, вызванное солнечным светом, и покраснение кожи), атрофию кожи, диспигментацию кожи (пэтчи/пятна), фотодерматит (эритему: воспаление и покраснение кожи), телеангиэктазию, куперозный или актинический кератоз; а также воспалений, выбранных из преобладающих аутоиммунных признаков, вызываемых Т-хелперными клетками 2, и выбранных из болезни Грейвса, болезни Хашимото, склеродермии, заболеваний, ассоциированных с Ig4, или пузырчатки; и воспалений, включающих эозинофильные признаки, выбранные из эозинофильного цистита, эозинофильного эзофагита, эозинофильного фасциита, эозинофильного гастроэнтерита, гиперэозинофильного синдрома, эозинофильного гранулематоза с полиангиитом, эозинофильной астмой или эозинофильной пневмонией, у индивидуума, где указанный очищенный растворимый бактериальный экстракт, независимо от того присутствует ли он в стабильной композиции или нет, вводят индивидууму периоральными путями, а в частности, путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, путем нанесения на кожу, трансбуккально, подъязычно, в легкие, внутрибронхиально и/или внутрилегочно.
[00102] Настоящее изобретение также относится к очищенному бактериальному экстракту, полученному путем щелочного лизиса одного или более видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, где указанный бактериальный экстракт содержит менее, чем 100 микрограммов/мл нуклеиновых кислот, для применения в способе лечения и/или профилактики расстройств, ассоциированных с дисбактериозом и выбранных из астмы, диабета, диабета типа 2, аутоиммунных заболеваний, заболеваний, ассоциированных с низким содержанием клетчатки, атопического дерматита, острого и/или хронического ассоциированного дерматита, псориаза, воспалительного заболевания кишечника, колита, язвенного колита, болезни Крона, ожирения, метаболических заболеваний или расстройств, печеночной недостаточности, NASH, NAFLD, фиброза печени, почечной недостаточности или заболеваний, связанных с низким содержанием клетчатки, у индивидуума, где указанный очищенный растворимый бактериальный экстракт, независимо от того присутствует ли он в стабильной композиции или нет, вводят индивидууму периоральными путями, а в частности, путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, путем нанесения на кожу, трансбуккально, подъязычно, в легкие, внутрибронхиально и/или внутрилегочно.
[00103] И наконец, настоящее изобретение также относится к очищенному бактериальному экстракту, полученному путем щелочного лизиса одного или более видов бактерий, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis, где указанный бактериальный экстракт содержит менее, чем 100 микрограммов/мл нуклеиновых кислот, для применения в способе лечения и/или профилактики новообразований, выбранных из неопластических признаков с иммунологическими нарушениями, такими как мастоцитоз, лейкоз тучных клеток, опухоли, вызываемые специфичностью к Т-хелперным клеткам 2, и/или опухоли, подавляющие иммунитет у индивидуума, где указанный очищенный растворимый бактериальный экстракт, независимо от того присутствует ли он в стабильной композиции или нет, вводят индивидууму периоральными путями, а в частности, путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, путем нанесения на кожу, трансбуккально, подъязычно, в легкие, внутрибронхиально и/или внутрилегочно.
[00104] Согласно этому первому аспекту изобретения, экстракты содержат по меньшей мере один штамм каждого из вышеуказанных видов бактерий. Альтернативно, один или более конкретных штаммов из приведенного выше списка могут быть удалены или заменены одним или более другими штаммами. В случае предпочтительного периорального бактериального экстракта ОМ, эти экстракты получают из восьми бактериальных патогенов верхних дыхательных путей, а именно, Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis. Бактериальный экстракт в соответствии с этим аспектом может также представлять собой периоральный бактериальный экстракт OM314A, то есть, бактериальный экстракт OM в стабилизированной форме, вводимый периорально.
[00105] Бактериальный экстракт ОМ может быть получен путем щелочного лизиса, предпочтительно при рН более, чем 10, из одного или более видов бактерий, а именно, Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, и последующей очистки так, чтобы он содержал менее, чем 100 микрограммов/мл нуклеиновой кислоты, по меньшей мере, 0,3 мг/мл сахаридов, от 6 до 8 мг/мл белков, имеющих молекулярную массу менее 30 кДа, от 1,5 до 2,5 мг/мл аминокислот (оцененных после HCl-гидролиза) в эквивалентах глутаминовой кислоты (147 г/моль), где от 1 до 80% указанных аминокислот были рацемизированы из L в D, и где указанные одна или более рацемических аминокислот выбраны из аспарагиновой кислоты, аспарагина, глутаминовой кислоты, глутамина, серина, метионина, гистидина, аланина, аргинина, фенилаланина, тирозина, лейцина, лизина, валина и треонина. Дополнительные описания свойств экстрактов и подходящих способов их получения представлены ниже, а также в Международной публикации WO2008/109669, содержание которой в полном объеме включено в настоящую заявку посредством ссылки.
[00106] В соответствии с первым своим аспектом, настоящее изобретение также относится к способу лечения и/или профилактики инфекций верхних и нижних дыхательных путей, осложнений, ассоциированных с этими инфекциями, и/или вторичных инфекций, дисбактериоза и/или расстройств, связанных с дисбактериозом, где указанный периоральный бактериальный экстракт OM, независимо от того, является ли он стабилизированным или нет, вводят индивидууму путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, местно, трансбуккально, подъязычно, в легкие, внутрибронхиально или внутрилегочно и в дозе, составляющей от 0,005 мг до 1 мг в день, то есть, в более низких дозах, чем при энтерально-пероральном введении, и такая доза эффективно обеспечивала оптимальную защиту. Предпочтительно, бактериальный экстракт согласно этому аспекту представляет собой бактериальный экстракт ОМ или стабилизированную форму бактериального экстракта ОМ314А. Кроме того, согласно этому аспекту изобретения, вторичные инфекции, которые могут быть подвергнуты лечению и/или профилактике, могут представлять собой не-респираторные вирусные инфекции.
[00107] В нижеследующих примерах, заявителем было ясно продемонстрировано, что интраназальное введение бактериального экстракта OM согласно этому первому аспекту изобретения существенно снижает титр вируса в ткани легких после инфицирования вирусом гриппа и снижает заболеваемость и смертность суперинфицированных животных по сравнению с пероральным введением и в гораздо меньшей дозе. Действительно, было показано, что интраназальное или интратрахеальное введение в качестве профилактического лечения было более эффектиным, чем энтеральное введение. Интраназальное введение представляет собой эффективное профилактическое лечение гриппа у этой мышиной модели, и было показано, что такой защитный эффект зависит от дозы. Заявителем было также продемонстрировано, что интратрахеальное или интраназальное прямое введение очищенного бактериального экстракта в соответствии с этим первым аспектом изобретения активирует изоформы крупной цепи этих двух гликозаминогликанов, что тем самым подтверждает, что этот бактериальный экстракт участвует в новых полезных механизмах, таких как снижение воспаления и повышение уровня презентации антигена.
[00108] В соответствии с этим первым аспектом, настоящее изобретение также относится к способу лечения и/или профилактики острых и хронических иммунологических заболеваний, вызываемых инфекциями и/или воспалениями и/или новообразованиями и/или дисбактериозом, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00109] В частности, настоящее изобретение относится к способу лечения и/или профилактики инфекций, выбранных из инфекций верхних и нижних дыхательных путей и/или ассоциированных с ними осложнений, включая аллергический ринит, ринит, назофарингит, синусит, фарингит, тонзилит, ларингит, трахеит, ларингофарингит, грипп, инфекцию, вызываемую респираторно-синцитиальным вирусом, человеческим риновирусом (HRV), риносинцитиальным вирусом (RV), коронавирусом (CoV, SARS-CoV, MERS-Cov, COVID-19 и т.п.), круп, пневмонию, гиперчувствительный пневмонит, бронхопневмонию, бронхит, бронхиолит, пневмонию, обструктивную болезнь легких с острой инфекцией нижних дыхательных путей, обструктивную болезнь легких с острыми инфекциями верхних дыхательных путей или заболевания с нарушением движения эпителиальных ресничек и/или нарушением выведения слизи, вторичные инфекции, не-респираторные вирусные инфекции, не-респираторные бактериальные инфекции, системные инфекции, такие как сепсис, септический шок или индуцированные вирусом осложнения, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00110] Настоящее изобретение также относится к способу лечения и/или профилактики иммунологических заболеваний, включая, но не ограничиваясь ими, дисбаланс между иммунным ответом на Т-хелперы 1, Т-хелперы 17 и Т-хелперы 2; дисбаланс регуляторных Т-клеток, гиперчувствительность типа 2, иммуносупрессию, эозинофилию, аллергию и атопию, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00111] Настоящее изобретение также относится к способу лечения и/или профилактики воспалений, включая аллергические/атопические респираторные и не-респираторные симптомы, атопический дерматит, острый и/или хронический ассоциированный дерматит, анафилаксический шок и пищевые аллергии, кожные болезни, воспаления кожи, такие как экзема, розацея, атопический дерматит, псориаз, включая фотоповреждение (например, воспаление, вызванное солнечным светом, и покраснение кожи), атрофию кожи, диспигментацию кожи (пэтчи/пятна), фотодерматит (эритему: воспаление и покраснение кожи), телеангиэктазию, куперозный или актинический кератоз, а также воспаления, включающие преобладающие аутоиммунные признаки, вызываемые Т-хелперными клетками 2, и выбранные из болезни Грейвса, болезни Хашимото, склеродермии, заболеваний, ассоциированных с Ig4 или пузырчатки, или воспаления, включающие эозинофильные признаки, выбранные из эозинофильного цистита, эозинофильного эзофагита, эозинофильного фасциита, эозинофильного гастроэнтерита, гиперэозинофильного синдрома, эозинофильного гранулематоза с полиангиитом, эозинофильной астмой или эозинофильной пневмонией, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00112] Настоящее изобретение также относится к способу лечения и/или профилактики расстройств, ассоциированных с дисбактериозом, и выбранных из заболеваний, включая астму, диабет, диабет типа 2, аутоиммунные заболевания, заболевания, ассоциированные с низким содержанием клетчатки, атопический дерматит, острый и/или хронический ассоциированный дерматит, псориаз, воспалительные заболевания кишечника, колит, язвенный колит, болезнь Крона, ожирение, метаболические заболевания или расстройства, печеночную недостаточность, NASH, NAFLD, фиброз печени, почечную недостаточность или заболевания, связанные с низким содержанием клетчатки, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00113] Настоящее изобретение также относится к способу лечения и/или профилактики иммунологических расстройств, включая, но не ограничиваясь ими, дисбаланс между иммунным ответом на Т-хелперы 1, Т-хелперы 17 и Т-хелперы 2; дисбаланс регуляторных Т-клеток, гиперчувствительность типа 2, иммуносупрессию, эозинофилию, аллергию и атопию, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00114] И наконец, настоящее изобретение относится к способу лечения и/или профилактики новообразований, выбранных из неопластических признаков с иммунологическими нарушениями, такими как мастоцитоз, лейкоз тучных клеток, опухоли, вызываемые специфичностью к Т-хелперным клеткам 2, и/или опухоли, подавляющие иммунитет у индивидуума, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта ОМ или стабилизированной формы OM314A.
[00115] Согласно своему второму аспекту, настоящее изобретение также относится к бактериальному экстракту, получаемому путем щелочного лизиса из одного или более видов бактерий, выбранных из бактериальных штаммов Lactobacillus, для использования в способе лечения и/или профилактики острых и хронических иммунологических расстройств, вызываемых инфекциями и/или воспалением, и/или новообразованиями, и/или дисбактериозом, как описано выше, у индивидуума, где бактериальный экстракт Lactobacillus, независимо от того присутствует ли он в стабильной композиции или нет, вводят индивидууму периоральными путями, а в частности, путем интратрахеальной ингаляции, интраназально, в слизистую оболочку, через слизистую оболочку, путем нанесения на кожу, трансбуккально, подъязычно, в легкие, внутрибронхиально и/или внутрилегочно, и в дозе, меньшей, чем доза, используемая для энтерально-перорального введения. Бактериальный экстракт может предпочтительно содержать один или более бактериальных штаммов Lactobacillus, выбранных из штаммов, включающих один или более из Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus lactis, и Lactobacillus delbrueckii. В соответствии с этим аспектом, предпочтительно, периоральный бактериальный экстракт представляет собой бактериальный экстракт, который получают путем щелочного лизиса из одного или более видов бактерий, выбранных из бактериальных штаммов Lactobacillus, как описано выше, или его стабилизированную форму, то есть, бактериальный экстракт OM314B.
[00116] Согласно этому второму аспекту, настоящее изобретение также относится к способу лечения и/или профилактики острых и хронических иммунологических расстройств, вызываемых инфекциями и/или воспалением, и/или новообразованиями, и/или дисбактериозом, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus.
[00117] Таким образом, настоящее изобретение, в частности, относится к способу лечения и/или профилактики инфекций, выбранных из инфекций верхних и нижних дыхательных путей и/или ассоциированных с ними осложнений, включая аллергический ринит, ринит, назофарингит, синусит, фарингит, тонзилит, ларингит, трахеит, ларингофарингит, грипп, инфекцию, вызываемую респираторно-синцитиальным вирусом, человеческим риновирусом (HRV), риносинцитиальным вирусом (RV), коронавирусом (CoV, SARS-CoV, MERS-Cov, COVID-19 и т.п.), круп, пневмонию, гиперчувствительный пневмонит, бронхопневмонию, бронхит, бронхиолит, пневмонию, обструктивную болезнь легких с острой инфекцией нижних дыхательных путей, обструктивную болезнь легких с острыми инфекциями верхних дыхательных путей или заболевания с нарушением движения эпителиальных ресничек и/или нарушением выведения слизи, вторичные инфекции, не-респираторные вирусные инфекции, не-респираторные бактериальные инфекции, системные инфекции, такие как сепсис, септический шок и индуцированные вирусом осложнения, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus.
[00118] Настоящее изобретение также относится к способу лечения и/или профилактики иммунологических расстройств, включая, но не ограничиваясь ими, дисбаланс между иммунным ответом на Т-хелперы 1, Т-хелперы 17 и Т-хелперы 2; дисбаланс регуляторных Т-клеток, гиперчувствительность типа 2, иммуносупрессию, эозинофилию, аллергию и атопию, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus.
[00119] Настоящее изобретение также относится к способу лечения и/или профилактики воспалений, выбранных из аллергических/атопических респираторных и не-респираторных симптомов, атопического дерматита, острого и/или хронического ассоциированного дерматита, анафилаксического шока или пищевых аллергий, кожных болезней, воспалений кожи, таких как экзема, розацея, атопический дерматит, псориаз, включая фотоповреждение (например, воспаление, вызванное солнечным светом, и покраснение кожи), атрофию кожи, диспигментацию кожи (пэтчи/пятна), фотодерматит (эритему: воспаление и покраснение кожи), телеангиэктазию, куперозный или актинический кератоз; а также воспалений, выбранных из преобладающих аутоиммунных признаков, вызываемых Т-хелперными клетками 2, и выбранных из болезни Грейвса, болезни Хашимото, склеродермии, заболеваний, ассоциированных с Ig4, или пузырчатки; или воспалений, включающих эозинофильные признаки, выбранные из эозинофильного цистита, эозинофильного эзофагита, эозинофильного фасциита, эозинофильного гастроэнтерита, гиперэозинофильного синдрома, эозинофильного гранулематоза с полиангиитом, эозинофильной астмой или эозинофильной пневмонией, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus.
[00120] Настоящее изобретение также относится к способу лечения и/или профилактики расстройств, ассоциированных с дисбактериозом, и выбранных из заболеваний, включая астму, диабет, диабет типа 2, аутоиммунные заболевания, заболевания, ассоциированные с низким содержанием клетчатки, атопический дерматит, острый и/или хронический ассоциированный дерматит, псориаз, воспалительные заболевания кишечника, колит, язвенный колит, болезнь Крона, ожирение, метаболические заболевания или расстройства, печеночную недостаточность, NASH, NAFLD, фиброз печени, почечную недостаточность или заболевания, связанные с низким содержанием клетчатки, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus.
[00121] Настоящее изобретение также относится к способу лечения и/или профилактики новообразований, включая неопластические признаки с иммунологическими расстройствами, такими как мастоцитоз, лейкоз тучных клеток, опухоли, вызываемые специфичностью к Т-хелперным клеткам 2, и/или опухоли, подавляющие иммунитет, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus.
[00122] Стабильные бактериальные экстракты, получаемые путем щелочного лизиса из одного или более видов бактерий, выбранных из бактериальных штаммов Lactobacillus, являются особенно полезными для лечения и/или профилактики ринита и/или аллергического ринита, который имеет тривиальное название «симптомы простуды с заложенным носом или насморком».
[00123] Согласно предпочтительному варианту своего второго аспекта, настоящее изобретение также относится к способу лечения и/или профилактики острых и хронических иммунологических расстройств, вызываемых инфекциями и/или воспалением, и/или новообразованиями, и/или дисбактериозом, как описано выше, где указанный способ включает периоральное введение терапевтически эффективного количества бактериального экстракта Lactobacillus, получаемого путем щелочного лизиса из одного или более видов бактерий, выбранных из бактериальных штаммов Lactobacillus. Предпочтительный бактериальный экстракт Lactobacillus включает один или более бактериальных штаммов, выбранных из одного или более из Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus lactis, и Lactobacillus delbrueckii. Наиболее предпочтительно, бактериальный экстракт Lactobacillus представляет собой стабилизированный бактериальный экстракт OM314B, описанный выше.
[00124] Стабильный бактериальный экстракт Lactobacillus согласно этому второму аспекту вводят периорально, а в частности, посредством интратрахеальной ингаляции или интраназального введения, и в дозе, меньшей, чем доза, используемая для энтерально-перорального введения.
[00125] Учитывая прямую и непрямую противовирусную, неспецифическую активность бактериальных экстрактов OM и новых стабильных бактериальных экстрактов OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) на поверхности эпителиальных клеток, продемонстрированную in vivo со снижением титра вирусов в клетках и вырабатыванием противовирусных антител против вирусов, которыми являются, но не ограничиваясь ими, H1N1, RSV, а также in vitro эффективность против человеческого RV (как показано на примере индуцирования IFN, β-дефензинов, сопровождаемого снижением уровня вирусного рецептора ICAM-1, подтверждая тем самым индуцирование посредством экстрактов OM и новых стабильных OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) потери прикрепления (вплоть до полной потери) вируса к эпителиальным клеткам, можно ожидать, что такие периоральные пути введения особенно полезны и эффективны в способах лечения и/или профилактики инфекций верхних и нижних дыхательных путей, таких как ринит, аллергический ринит, назофарингит, синусит, фарингит, тонзилит, ларингит, трахеит, ларингофарингит, грипп, инфекция, вызываемая респираторно-синцитиальным вирусом, вторичные бактериальные инфекции, вызываемые вирусной инфекцией гриппа (H1N1 и т.п.), риновирусом человека (HRV), риносинцитиальным вирусом (RV), коронавирусом (CoV, SARS-CoV, MERS-Cov, COVID-19 и т.п.), круп, пневмония, бронхопневмония, бронхит, бронхиолит, обструктивная болезнь легких с острой инфекцией нижних дыхательных путей, обструктивная болезнь легких с острыми инфекциями верхних дыхательных путей, заболевания с нарушением движения эпителиальных ресничек и/или нарушением выведения слизи.
[00126] Эти очищенные бактериальные экстракты могут быть стабилизированы, как описано выше, и, таким образом, введены в виде стабильных композиций бактериальных экстрактов в твердой, полутвердой, жидкой или аэрозольной формах.
[00127] Также рассматриваются фармацевтические композиции, содержащие стабилизированные бактериальные экстракты и фармацевтически приемлемый эксципиент. Эти фармацевтические композиции могут быть стабилизированы и могут храниться в виде жидких композиций в течение нескольких месяцев и могут быть введены пациентам в жидких или парообразных формах. Альтернативно, они могут быть лиофилизованы и/или могут храниться до их превращения в жидкие или аэрозольные фармацевтические препараты.
[00128] Стабильные фармацевтические композиции согласно изобретению являются особенно подходящими для их применения в способе лечения и/или профилактики острых и хронических иммунологических расстройств, вызываемых инфекциями и/или воспалением и/или новообразованиями и/или дисбактериозом, как описано выше.
[00129] Поскольку эти фармацевтические композиции остаются стабильными в течение нескольких месяцев в любых формах, таких, как жидкие, газообразные или аэрозольные, полутвердые или твердые формы, то они могут быть приготовлены для введения интраназально, интратрахеально, в слизистую оболочку, через слизистую оболочку, местно, трансбуккально, подъязычно, перорально, в легкие, внутрибронхиально и/или внутрилегочно. Предпочтительно, их можно вводить индивидууму путем интратрахеальной ингаляции или интраназально или через слизистую.
[00130] Особенно предпочтительными являются фармацевтические композиции, которые представляют собой жидкость или аэрозоль и приготовлены в виде спрея, капель, коллоидного раствора, тумана, аэрозоля или распыленного пара. Такими предпочтительными фармацевтическими композициями могут быть жидкие или полутвердые композиции, такие как эмульсии, микроэмульсии, водные дисперсии, масла, молочко, бальзамы, пены, водные или масляные лосьоны, водные или масляные гели, кремы, растворы, водно-спиртовые растворы, гидрогликолевые растворы, гидрогели, сыворотки, мази, муссы, пасты или трансдермальные пластыри. В некоторых других предпочтительных вариантах осуществления изобретения, указанная композиция является твердой и приготовлена в виде порошка или измельчаемой таблетки.
[00131] При приготовлении жидких, полутвердых, твердых и аэрозольных лекарственных средств, вышеупомянутые вещества могут быть соответствующим образом использованы, если это необходимо, вместе с любыми добавками, такими как носители, связующие вещества, отдушки, ароматизаторы, подсластители, красители, антисептики, антиоксиданты, стабилизирующие агенты и поверхностно-активные вещества.
[00132] В предпочтительном варианте осуществления изобретения, фармацевтическую композицию на основе бактериального экстракта вводят интраназально, и эта композиция может быть приготовлена в форме, выбранной из эмульсии, суспензии, коллоидной формы, тумана, аэрозоля, распыленного пара или спрея, назального тампона, порошка, мази, крема, лосьона, геля, пасты, жидкой мази, раствора, настойки, пластыря или полоски.
[00133] В другом предпочтительном варианте осуществления изобретения, фармацевтическая композиция на основе бактериального экстракта может быть введена перорально и может присутствовать в контейнере с одной дозой или в контейнере для однократного приема, таком как пластиковая бутыль с дозой для однократного приема, аналогичная пластиковым бутылям с физиологической жидкостью, используемой в качестве капель для сухого глаза, или в виде ампул с дозой для однократного приема. Жидкие композиции на основе бактериального экстракта для перорального введения в соответствии с этим предпочтительным вариантом осуществления изобретения представляют собой стабильные композиции и могут храниться в указанных контейнерах с дозой для однократного приема в виде нейтрализованой (с рН, близким к 7) жидкой композиции в течение длительных периодов времени.
[00134] Для приготовления фармацевтических композиций согласно изобретению, бактериальные экстракты могут быть смешаны с фармацевтически приемлемым носителем, адъювантом и/или наполнителем в соответствии с общепринятыми методами фармацевтического компаундирования. Фармацевтически приемлемые носители включают любые стандартные фармацевтические носители, такие как забуференный фосфатом физиологический раствор, вода и эмульсии, такие как эмульсия масло/вода или вода/масло, и различные типы смачивающих агентов. Бактериальные экстракты могут дополнительно содержать твердые фармацевтические наполнители, такие как крахмал, целлюлоза, тальк, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, сухое сепарированное молоко и т.п. Жидкие и полутвердые наполнители могут быть выбраны из глицерина, пропиленгликоля, воды, этанола и различных масел, включая вазелиновое масло, масла животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п.. Жидкими носителями, а в частности, для инъецируемых растворов, являются вода, физиологический раствор, водная декстроза и гликоли. Примеры носителей, стабилизаторов и адъювантов можно найти в руководстве Remington's Pharmaceutical Sciences, под редакцией E.W. Martin (Mack Publishing Company, 18-е изд., 1990). Эти фармацевтические композиции могут также включать стабилизаторы и консерванты.
[00135] В одном из предпочтительных вариантов осуществления изобретения, фармацевтическая композиция может быть приготовлена в виде измельчаемой таблетки. Таблетку можно принимать целиком или можно слегка раздавить, например, надавливая пальцем, и разбрызгать соответствующий носитель. Измельчаемую таблетку можно приготовить методом прямого прессования и с использованием наполнителей, соблюдая при этом осторожность, чтобы не повредить покрытие отдельных субъединиц. Подходящими наполнителями для приготовления измельчаемых таблеток являются наполнители, которые обычно используются для жевательных таблеток, включая моно- и дисахариды, спирты ряда сахаров и т.п. или их комбинации. Примерами наполнителей являются маннит, сорбит, ксилит, мальтит, лактоза, сахароза, мальтоза или их комбинации. В матрицу для прессования могут быть также включены необязательные фармацевтические наполнители, такие как разбавители, лубриканты, вещества, способствующие скольжению, ароматизаторы, красители и т.п., или их комбинации, содержащие по меньшей мере одно из вышеперечисленных веществ. Измельчаемые таблетки могут быть приготовлены с применением способов производства таблеток, известных специалистам-фармацевтам.
[00136] Композиция бактериального экстракта может также присутствовать в коллоидной форме, включающей, например, галогенид металла, а наиболее предпочтительно, галогенид серебра. Один или более бактериальных экстрактов и адъювант могут быть включены в коллоидную частицу или инкапсулированы в нее. Альтернативно или дополнительно, один или более бактериальных экстрактов и адъювант могут быть нанесены на поверхность коллоидной частицы. Способы, с помощью которых активный агент и адъювант наносят на частицу, зависят от свойств экстрактов, адъювантов и коллоидных частиц. Так, например, белки легко адсорбируются или присоединяются к гидрофобным частицам посредством гидрофобных взаимодействий с поверхностью частиц и вытесняют часть нейтрального эмульгатора.
[00137] Настоящее изобретение частично основано на неожиданном обнаружении того факта, что использование системы для периоральной доставки описанных выше бактериальных экстрактов обеспечивает значительно более высокие титры антител и усиленный иммунный ответ, а также безопасный и эффективный подход для повышения иммуногенности различных антигенов, используемых в профилактических и в терапевтических фармацевтических композициях.
[00138] Подходящие дозы согласно изобретению, описанные здесь в различных вариантах осуществления изобретения, будут варьироваться в зависимости от состояния здоровья, возраста и вида индивидуума и могут быть легко определены специалистами в данной области. Однако, в соответствии с настоящим изобретением, общие суточные дозы были значительно снижены и могут составлять в пределах от 0,005 до 1 мг, предпочтительно от 0,05 до 0,5 мг, а наиболее предпочтительно от 0,1 до 0,3 мг, и они могут быть введены в виде разовых или дробных доз, и, кроме того, верхний предел также может быть превышен, если это будет необходимо по соответствующии показаниям. Преимущественно, дозы, вводимые периорально, меньше (например, половинные дозы), чем дозы, вводимые перорально-энтерально.
[00139] Еще в одном своем аспекте, настоящее изобретение относится к устройству для доставки композиций бактериальных экстрактов согласно изобретению. Кроме того, настоящее изобретение также относится к устройству для доставки в целях его использования в способе лечения и/или профилактики инфекций верхних и нижних дыхательных путей, ассоциированных с ними осложнений, и/или вторичных инфекций, дисбактериоза и/или расстройств, связанных с дисбактериозом.
[00140] В соответствии с настоящим изобретением, композиции бактериального экстракта могут быть введены интраназально или интратрахеально, с помощью устройства для назальной инсуффляции, интраназального ингалятора, устройства для интраназального распыления, распылителя, флакона для назального спрея, контейнера для стандартной дозы, насоса, капельницы, флакона для выдавливания, аэрозольного распылителя, дозирующего ингалятора (MDI), ингаляторов под давлением для введения дозы, инсуффляторов, двунаправленных устройств, ампул с дозами, носовых подушечек, носовых губок и носовых капсул.
[00141] Назальные спреи могут быть жидкими или твердыми. Композиции бактериального экстракта могут быть введены в аэрозольной или в неаэрозольной форме. Устройство для интраназальной доставки может иметь шкалу для введения точной эффективной дозы в носовую полость. Устройство для доставки в носовую полость может быть предназначено для доставки одной унифицированной дозы или множества унифицированных доз.
[00142] Если композиции бактериального экстракта вводят в виде аэрозолей, то они могут быть приготовлены с применением стандартных способов. Так, например, аэрозольный спрей может быть распылен из находящегося под давлением контейнера с подходящим пропеллентом, таким как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, углеводороды, сжатый воздух, азот, диоксид углерода или другой подходящий газ. Унифицированная лекарственная форма может быть определена с помощью клапана для доставки отмеренного количества. Распылительные дозаторы с насосом могут выдавать отмеренную дозу или дозу, имеющую определенный размер частиц или капель. Аэрозоль может представлять собой суспензию или дисперсию капель жидкости или твердого порошка в воздухе (или в газе). Жидкие капли могут быть образованы из растворов, суспензий и дисперсий лекарственного средства в жидкости, такой как вода или безводный растворитель. Аэрозоли могут быть получены в любом подходящем устройстве, таком как MDI, аэрозольный распылитель или распылитель тумана.
[00143] Аэрозоль согласно изобретению можно вдувать или вдыхать с помощью подходящего механического устройства. Такое устройство может включать, например, резервуар и распылитель, который представляет собой устройство, адаптированное для выпуска фармацевтической дозы в форме спрея. Ряд доз для введения может содержаться в резервуаре, необязательно в жидком растворе или суспензии, или в виде композиции из твердых частиц, такой как смесь твердых частиц.
[00144] Распылители создают поток воздуха с высокой скоростью, который заставляет терапевтическое средство в форме жидкости распыляться в виде тумана. Терапевтическое средство приготовливают в жидкой форме, такой как раствор или жидкая суспензия частиц подходящего размера. Эти частицы являются микронизированными. Термин «микронизированный» определяется как наличие приблизительно 90% или более частиц с диаметром менее, чем приблизительно 10 мкм. Подходящие аэрозольные распылители являются коммерчески доступными и поставляются, например, компанией PARI GmbH (Штернберг, Германия). Другими аэрозольными распылителями являются Respimat (Boehringer Ingelheim) и устройства, описанные, например, в патентах США №№ 7568480 и 6123068 и в WO 97/12687.
[00145] Устройства DPI могут быть использованы для введения композиции бактериального экстракта в форме сыпучего порошка, который может быть диспергирован в потоке воздуха у пациента во время вдоха. Также могут быть использованы устройства DPI, имеющие внешний источник энергии. Для получения сыпучего порошка, композиция бактериального экстракта может быть объединена с подходящим наполнителем (например, с лактозой). Комбинация сухих порошков может быть приготовлена, например, путем объединения сухой лактозы, имеющей частицы размером приблизительно от 1 мкм до 100 мкм, с микронизированными частицами бензодиазепина, и сухого смешивания. Альтернативно, бензодиазепин может быть приготовлен без наполнителей. Композицию загружают в дозатор для сухих порошков или в ингаляционные кассеты или капсулы для их использования вместе с устройством для доставки сухих порошков. Примерами устройств DPI, имеющихся в продаже, являются Diskhaler (GlaxoSmith line, Research Triangle Park, NC) (патент США № 5035237); Diskus (GlaxoSmithKline) (патент США № 6378519; Turbuhaler (AstraZeneca, Wilmington, Del.) (Патент США № 4524769); и Rotahaler (GlaxoSmithKline) (патент США № 4353365).
[00146] Устройства MDI могут быть использованы для выпуска отмеренного количества композиции бактериального экстракта с использованием сжатого газобразного пропеллента. Композиции для введения с помощью MDI включают раствор или суспензию композиции бактериального экстракта в ожиженном пропелленте. Примерами пропеллентов являются гидрофторалкланы (HFA), такие как 1,1, 1,2-тетрафторэтан (HFA 134a) и 1,1,1,2,3,3,3-гептафтор-н-пропан (HFA 227) и хлорфторуглероды, такие как CC13F. Дополнительными компонентами композиций HFA для введения с помощью MDI являются сорастворители, такие как этанол, пентан, вода; и поверхностно-активные вещества, такие как триолеат сорбитана, олеиновая кислота, лецитин и глицерин. Композицию бактериального экстракта загружают в аэрозольный баллончик, который составляет часть устройства MDI.
[00147] Композиция бактериального экстракта может быть доставлена в носовую полость в виде порошка, такого как микросферы, через носовой инсуффлятор. Композиция бактериального экстракта может абсорбироваться на твердой поверхности, например на носителе. Порошок или микросферы могут быть введены в виде сухой, воздушно-дозируемой форме. Порошок или микросферы можно хранить в контейнере инсуффлятора. Альтернативно, порошок или микросферы могут быть введены в капсулу, такую как желатиновая капсула, или в виде другой унифицированной дозы, адаптированной для интраназального введения.
[00148] Композицию бактериального экстракта доставляют с помощью аппликатора для интраназального спрея. Композиция может быть помещена в дозирующее устройство для интраназального спрея или в распылитель и может быть нанесена путем ее распыления в ноздри индивидуума для доставки на слизистую оболочку ноздрей. Для достижения желаемых системных или локализованных уровней терапевтического эффекта используется достаточное количество такой композиции.
[00149] Композиция бактериального экстракта может быть также введена интратрахеально, путем пероральной ингаляции в дыхательные пути, то есть, в легкие. Такое интратрахеальное введение требует аэрозолизации твердого вещества или жидкости и доставки аэрозоля в легкие через рот и горло. Частицы лекарственного средства могут быть введены в легкие в виде сухих порошковых аэрозолей или жидких аэрозолей. Сухие порошковые аэрозоли обычно вводят в легкие с помощью устройств для ингаляции сухих порошков (DPI). Сухие порошковые ингаляторы могут включать ингаляторы для сухих порошков, приводимые в действие посредством вдоха, например, как описано в патенте США No. 7434579. Ингаляторы с отмеренными дозами содержат лекарственное средство, суспендированное в пропелленте, в смеси пропеллентов или в смеси растворителей, пропеллентов и/или других наполнителей в компактных аэрозольных дозаторах под давлением. Продукт MDI может выделять до нескольких сотен отмеренных доз лекарственного средства. При каждом срабатывании может выделяться от нескольких микрограммов (мкг) до нескольких миллиграммов (мг) активных ингредиентов, доставляемых в объеме обычно от 25 до 100 микролитров.
[00150] Как описано выше, другим типом устройства для диспергирования жидких аэрозолей является распылитель, в котором используется струя, вибрирующая сетка или другие средства для распыления суспензии, содержащей частицы лекарственного средства.
[00151] Композиции бактериального экстракта согласно изобретению могут дополнительно содержать адъюванты, усилители проницаемости и/или растворители. Так, например, для интраназальной доставки, усилитель проницаемости может быть использован для улучшения проникновения композиции через слизистую оболочку носа. Соединения, содержащие одну или более, чем одну гидроксильную группу, могут быть использованы в качестве усилителей проницаемости. Некоторые из этих соединений, содержащих гидроксильные группы, также могут служить в композиции в качестве растворителей. Неограничивающими примерами соединений, которые содержат гидроксильные группы, и которые могут быть использованы в качестве усилителей проницаемости, являются спирты (такие как этанол), диолы (такие как пропиленгликоль, также известный как 1,2-пропандиол; 1,3-пропандиол; бутиленгликоль, включая 1,3-бутандиол, 1,2-бутандиол, 2,3-бутандиол и 1,4-бутандиол; гексиленгликоль; дипропиленгликоль; 1,5-пентандиол; 1,2-пентандиол; 1,8-октандиол; этогексадиол; п-ментан-3,8-диол; 2-метил-2,4-пентандиол); триолы (такие как глицерин), полиолы (такие как подходящие полимеры, содержащие множество гидроксильных групп, включая полиэтиленгликоли или ПЭГ, полипропиленгликоли, полисорбаты и сложные эфиры сорбитана; и подходящие спирты ряда сахаров), циклиты (такие как пинитол, инсоитол), циклические диолы (например, циклогександиол), ароматические диолы (такие как гидрохинон, бисфенол А, резорцин и катехол).
[00152] Для специалиста в данной области будет очевидно, что описанные здесь методы могут быть также применимы и к другим усилителям проницаемости. Неограничивающими примерами других усилителей проницаемости, используемых в настоящем изобретении, являются простые и сложные эфиры с длинной цепью, которые, в целом, были признаны безопасными (GRAS) в различных сборниках фармакопеи. Они могут включать простые эфиры, и алифатические, ненасыщенные или насыщенные сложные эфиры. Неограничивающими примерами таких сложных эфиров являются изопропилмиристат, миристилмиристат, октилпальмитат и т.п. Неограничивающими примерами других усилителей проницаемости являются спирты (например, спирты с короткой и длинной цепью), многоатомные спирты, амины и амиды, мочевины, аминокислоты и их сложные эфиры, амиды, пирролидон и его производные, терпены, жирные кислоты и их сложные эфиры, макроциклические соединения, сульфоксиды, тензиды, хлорид бензилдиметиламмония, бромид цетилтриметиламмония, цинеол, кокамидопропилбетаин, кокамидопропилгидроксисультаин, хлорид додецилпиридиния, додециламин, сульфонат гексадецилтриметиламмиака-пропана, лимонен, линолевая кислота (ОА), линоленовая кислота (LA), ментол, метиллаурат, метилпирролидон, N-децил-2-пирролидон, NLS, сульфат никотина, нонил-1,3-диоксолан, бромид октилтриметиламмония, олеилбетаин, РР, додециловый эфир полиэтиленгликоля, монолаурат полиоксиэтиленсорбитана (Твин 20 или полисорбат 20), SLA, олеат натрия, лаурилсульфат натрия, октилсульфат натрия (SOS), монолаурат сорбитана (S20), тетракаин и тритон X-100. Эти усилители должны быть пригодными. Специалисту в данной области будет также очевидно, что следует избегать применения веществ, которые несовместимы со слизистой оболочкой или раздражает ее.
[00153] Примеры фармацевтически приемлемых растворителей или наполнителей, которые могут быть использованы в композиции согласно изобретению, можно найти в справочных руководствах, таких как Справочник по фармацевтическим наполнителям (Fifth Edition, Pharmaceutical Press, London and American Pharmacists Association, Washington, 2006). Неограничивающими примерами фармацевтически приемлемых растворителей, которые могут быть использованы в композиции согласно изобретению, являются, но не ограничиваются ими, пропиленгликоль (также известный как 1,2-дигидроксипропан, 2-гидроксипропанол, метилэтиленгликоль, метилгликоль или пропан-1,2-диол), этанол, метанол, пропанол, изопропанол, бутанол, глицерин, полиэтиленгликоль (ПЭГ), гликоль, кремофор EL или любые формы полиэтоксилированного касторового масла, дипропиленгликоль, диметилизосорбид, пропиленкарбонат, N-метилпирролидон, гликофурол, тетраэтиленгликоль, сложные эфиры пропиленгликоля и жирных кислот и их смеси.
[00154] Особенно предпочтительными являются композиции бактериального экстракта или фармацевтические композиции, содержащие указанные компоненты, для их применения в способе лечения и/или профилактики инфекций верхних и нижних дыхательных путей, и ассоциированных с ними осложнений и/или вторичных инфекций, дисбактериоз и/или расстройств, ассоциированных с дисбактериозом, где указанные композиции вводят индивидууму путем интратрахеальной ингаляции или интраназального введения через слизистую.
[00155] Вероятно, что интраназально введенный бактериальный экстракт воздействует на носовую лимфоидную ткань (NALT) или кишечную лимфоидную ткань (GALT) с последующим переносом B- и T-клеток и макрофагов тонкого кишечника в лимфоидную ткань бронхов, и это может вызывать имунный ответ против этих патогенов в дыхательных путях.
[00156] Настоящее изобретение также относится к способу лечения, профилактики или ослабления вирусных инфекций и/или индуцированных вирусом осложнений аллергических заболеваний или расстройств, таких как астма, хроническая обструктивная болезнь легких и аллергия или аутоиммунное заболевание, где указанный способ включает периоральное введение индивидууму терапевтически эффективного количества стабильного бактериального экстракта согласно изобретению.
[00157] Астма может представлять собой астму, резистентную к стероидам, нейтрофильную астму или неаллергическую астму. Аллергическое заболевание или расстройство может представлять собой эозинофильное заболевание или расстройство, а в частности заболевание или расстройство, выбранное из группы, состоящей из узелков, эозинофилии, эозинофильного ревматизма, дерматита и отеков (NERDS).
[00158] Настоящее изобретение относится к способу лечения и/или профилактики аллергического заболевания или расстройства, или для улучшения состояния здоровья индивидуума, страдающего аллергическим заболеванием или расстройством, включая, но не ограничиваясь ими, аллергическое заболевание или расстройство, выбранное из группы, состоящей из астмы, ринита, дерматита, реакций на лекарственные средства, эозинофильных заболеваний или расстройств, пищеводной и желудочно-кишечной аллергии, где указанный способ включает периоральное введение индивидууму терапевтически эффективного количества стабильного бактериального экстракта согласно изобретению.
[00159] И наконец, настоящее изобретение относится к новому способу экстракции для получения бактериальных экстрактов с повышенной стабильностью. Способ приготовления бактериального экстракта с повышенной стабильностью включает следующие стадии:
а. культивирования бактериального штамма каждого вида в подходящей культуральной среде,
b. лизиса каждого штамма при исходном рН предпочтительно более, чем 10, с отклонениями рН в пределах±0,1,
c. снижения pH экстракта(ов), полученного(ых) на стадии (b), на 1 или 2 единицы путем добавления одной или более органических кислот, выбранных из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты, их комбинации или их фармацевтически приемлемых солей и сложных эфиров,
d. пропускания продукта стадии (c) по меньшей мере один раз через микрофильтр и удерживания продукта на ультрафильтре для получения очищенного растворимого экстракта,
е. доведения pH до конечного значения приблизительно 7 (± 1,0) путем добавления органических кислот или их комбинаций, используемых на стадии (b), и
f. добавления фармацевтически приемлемого наполнителя или носителя.
[00160] Согласно первому аспекту настоящего изобретения, бактериальный экстракт получают из одного или нескольких видов бактерий, выбранных из: Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и/или Streptococcus sanguinis. Предпочтительно, бактериальный экстракт согласно этому аспекту получают из восьми бактериальных патогенов верхних дыхательных путей, а именно, Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, по аналогии с получением лекарственного средства на основе бактериального экстракта ОМ первого поколения.
[00161] Согласно второму аспекту настоящего изобретения, бактериальный экстракт получают из одного или более видов бактерий, выбранных из бактериальных штаммов Lactobacillus, таких, как, например, Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus lactis и Lactobacillus delbrueckii.
[00162] Согласно третьему аспекту настоящего изобретения, бактериальный экстракт получают из одного или более бактериальных штаммов Escherichia coli, как описано в Международной публикации № WO2008/109667.
[00163] Лизис может быть проведен в течение периода времени от 40 часов до 10 дней при температуре до 60°C. В этом способе может быть также использован 0,45 мкм-микрофильтр и 30 кДа-ультрафильтр. Кроме того, стадия (c) этого способа включает фильтрацию в тангенциальном потоке, где фильтрация в тангенциальном потоке может быть осуществлена за 5-15 циклов.
[00164] Кроме того, настоящее изобретение относится к продуктам композиции бактериального экстракта и/или к фармацевтическим композициям, которые могут быть получены вышеописанным способом.
ПРИМЕРЫ
Пример 1: Способ стабилизации щелочного экстракта
Пример 1.1: Добавление органических кислот для приготовления стабильных бактериальных экстрактов (OM314A). Сначала было проведено предварительное определение количеств кислоты, необходимых для подкисления до pH 5,0 щелочного бактериального экстракта OM314A, и количества 1н NaOH для доведения pH до 7,0.
25 мл щелочного концентрата OM314A вносили в пробирки Falcon емкостью 50 мл. Исходный pH обычно составляет около 10,5. После определения исходного pH, в пробирку вставляли небольшую магнитную мешалку и начинали перемешивание со скоростью 600 об/мин. Требуемое количество постадийно вводили в небольших количествах до достижения рН 5,0 (5,0±0,2). Затем регистрировали объем и массу каждой выбранной органической кислоты. После этого, кислотный экстракт центрифугировали 5 минут при 5000×g и супернатант фильтровали через 0,2 мкм-фильтр. Затем, pH стабилизированного бактериального экстракта доводили до pH 7,0±0,2 с использованием 1н NaOH, и регистрировали объем используемого 1н NaOH.
Во второй серии получения препаратов, 35 мл щелочного концентрата OM314A доводили от pH 10,5 до pH 5,0 (5,0±0,2), постепенно добавляя необходимое количество каждой выбранной органической кислоты в небольших количествах до достижения pH 5,0 (5,0±0,2). Затем регистрировали объем и массу кислоты. После этого, кислотный экстракт центрифугировали 5 минут при 5000× g и супернатант фильтровали через 0,2 мкм-фильтр. Затем, pH стабилизированного бактериального экстракта доводили до pH 7,5±0,2 с использованием 1н NaOH, и регистрировали объем используемого 1н NaOH. Аналогичную процедуру осуществляли в стерильном шкафу с ламинарным потоком для получения стерильных образцов стабилизированного бактериального экстракта.
25 мл или 35 мл концентрата щелочного бактериального экстракта OM314A вводили в пробирки Falcon емкостью 50 мл. Каждую кислоту добавляли на основе заранее определенного объема или путем взвешивания, как было определено в предварительных измерениях. Сначала проводили подкисление до pH 5,0, но при этом образовывался осадок. Во второй стадии, pH доводили до 7,0±0,2 и 7,5±0,2, соответственно. Некоторые растворы, доведенные до pH 5 с помощью органических кислот и дополнительно доведенные до pH 7,0 и, соответственно, до 7,5, оставались прозрачными и стабильными в течение всего периода наблюдения при комнатной температуре, но не при 4-8°C, где через несколько недель хранения образовывался осадок.
В нижеследующей Таблице 1 систематизированы данные по органическим кислотам и объемам, используемым для доведения pH до 7,5 для 35 мл раствора бактериального экстракта OM314A.
Таблица 1:
Пример 1.2. Удаление неорганических катионов
Для удаления неорганических двухвалентных катионов, присутствующих в стабилизированном органической кислотой экстракте OM314A, как описано ранее в примере 7.1, добавляли 25 мг оксалата аммония (1 мг/мл). При этом образовывался осадок с большой мутностью. Осадок центрифугировали 5 минут при 5000× g, и прозрачный супернатант фильтровали на 0,2 мкм-фильтре. Прозрачный образец доводили до pH 7,0±0,1 с использованием 1н NaOH. Сложность процесса заключается в увеличении масштаба, что требует проведения центрифугирования. Кроме того, оксалат может не подходить для интраназальных или периоральных композиций.
Пример 1.3. Одновременное удаление небольших молекул и неорганических солей и концентрирование высокомолекулярной фракции бактериального экстракта, стабилизированного органической кислотой.
Щелочные бактериальные экстракты с pH от 10,0 до 11,0 были добавлены в устройство для очистки, схематически изображенное на Фигуре 2, где показана диаграмма с соединениями между 4 сосудами, 2 насосами, двумя фильтрами, двумя трансмембранными клапанами давления (клапанами регулятора давления TMP1 и TMP2) и четырьмя поворотными клапанами. Трансмембранное давление (TMP): Среднее приложенное давление от сырья до фильтрата на фильтрующей мембране. TMP [бар] = [(давление в ретентате+давление в фильтрате)/2] - давление в фильтрате. Клапаны TMP1 и TMP2 создают давление на стороне фильтрата в фильтра, что позволчет регулировать трансмембранное давление (TMP) до соответствующего значения. Микрофильтрация: в таком устройстве, этот фильтр обычно имеет размер пор 0,45-0,2 мкм, используется для удаления частиц и позволяет пропускать через поры фильтра растворимое вещество (не содержащее крупных частиц).
Ультрафильтрация или нанофильтрация: эти фильтры имеют очень маленькие отверстия с соответствующим диапазоном отсечки (пороговое значение: размер пор, выраженный в молекулярной массе в Дальтонах (1 Да=1 единица массы, 1 кДа=1000 единиц массы). 10 кДа-фильтр задерживает вещество с размером больше, чем поры или молекулы размером более 10 кДа.
(http://www.merckmillipore.com/CH/de/ps-learning-centers/ultrafiltration-learning-center/optimization-process-simulation/d_eb.qB.ZWQAAAFAUV8ENHoL, nav?ReferrerURL=https%3A%2F%2Fwww.google. com%2F#tmp).
Пример 1.4. Пример пятистадийного способа получения стабилизированного бактериального экстракта, содержащего введенные органические кислоты согласно изобретению (Фигура 2)
Стадия 1: Щелочной бактериальный экстракт (pH от 10 до 11), содержащий стенки бактериальных клеток, фрагменты клеточных стенок и растворимое вещество, добавляли в сосуд 2 (Фигура 2), подсоединенный к насосу 1 и 0,45 мкм-фильтру для микрофильтрации вместе с 0,45 мкм-пермеатом, введенным в сосуд 3 (Фигура 2). Сосуд 3 соединен с насосом 2 (Фигура 2) и с 10 кД-нанофильтром для ультрафильтрации (кД), который отправляет пермеат 10 кД обратно в сосуд 2. Пермеат, содержащий небольшие молекулы и разбавленный гидроксид натрия, использовали для непрерывной экстракции в сосуде 2 (Фигура 2) активных водорастворимых компонентов бактериального экстракта.
Половина первоначального объема бактериального экстракта в сосуде 2 была подвергнута микрофильтрации, и пермеат 0,45 мкм проходил в сосуд 3.
Стадия 2. Затем было подключено второе фильтрующее устройство (насос 2), и пермеат 10 кДа, поступающий из сосуда 5 в сосуд 3, возвращался в сосуд 2 с помощью клапана 3. Была проведена непрерывная экстракция растворимых бактериальных компонентов неочищенного бактериального экстракта, находящегося в сосуде 2, для экстракции пермеата 10 кД, что в сумме составляло 10 исходных объемов бактериального экстракта.
Стадия 3: Эту стадию проводиои для удаления низкомолекулярных компонентов, присутствующих в сосуде 3, а затем начинали процесс диафильтрации путем подсоединения сосуда 1 к насосу 1 с тонкой коррецией регулирования TMP1 для поддержания объема в сосуде 2 на постоянном уровне. Сосуд 1 содержал воду, pH которой был доведен до 10,8-11,0 с использованием гидроксида натрия в качестве среды для диафильтрации. В процессе диафильтрации, сосуд 3 с пермеатами после ультрафильтрации подсоединяли к устройству для отходов с использованием клапана 3 и TMP2 регулировали до достижения оптимальной скорости потока. Для удаления нежелательных низкомолекулярных компонентов, присутствующих в очищенном бактериальном экстракте в сосуде 3, требовалось всего пять объемов среды для диафильтрации.
Стадия 4: Стадию концентрирования очищенного экстракта, присутствующего в сосуде 3, осуществляли после отсоединения сосуда 1 и насоса 1. Очищенную фракцию экстракта в сосуде 3 концентрировали до половины первоначального объема, при этом пермеат утилизировали через клапан 3.
Стадия 5: Концентрированную очищенную бактериальную фракцию стабилизировали путем добавления органической кислоты с образованием солей органической кислоты. Этот процесс осуществляли после закрытия насоса 2 и клапана 2. Предварительно определенный объем чистой жидкой органической кислоты или, соответственно, твердых органических кислот, предварительно определенный объем концентрированного раствора органической кислоты переносили из сосуда 4 в сосуд 3 через клапан 4 для доведения pH до 7,5±0,2. Для коррекции pH, во время добавления органической кислоты включали пропеллер и pH регулировали с помощью pH-электрода, установленного в сосуде 3.
Стадия 6: Сосуд 3, содержащий концентрированную очищенную бактериальную фракцию в форме соли органической кислоты при pH 7,5, стерилизовали на одной линии с использованием стерильного 0,2 мкм-фильтрующего устройства, установленного на стерильных линиях, соединенных со стерилизованным сосудом 5 (стерильным пакетом или термостерилизованным сосудом из нержавеющей стали).
В зависимости от конечного использования жидкой композиции и пути введения (интраназального, ингаляции в виде аэрозоля или твердого вещества) подавали дополнительную концентрацию с использованием насоса 2 и проводили ультрафильтрацию на фильтре, соединенном с устройством для отходов через клапан 3 до достижения 25% от начального объема. Присутствие соли органической кислоты позволило получить высококонцентрированную очищенную фракцию, обеспечивающую процесс распылительной сушки, и прямое использование в виде капель жидкости и аэрозолей.
Продукты с аналогичным pH (7,5±0,5) были получены с использованием различных органических кислот, образующих включенные в экстракт соли.
Тот же самый процесс был повторен с использованием, соответственно, полисульфоновых 3 кД-, 10 кД-, 30 кД-, 100 кД-, 300 кД-фильтров в тангенциальном потоке, а также полых волокон с использованием отсечки 10 кД, 30 кД, 100 кД, 300 кД в качестве альтернативной конструкции фильтра в тангенциальном потоке.
Процесс был сначала осуществлен в лабораторном масштабе 1 л путем проведения стадии концентрирования (от 2-кратной концентрации до достижения 500 мл и до 5-кратной концентрации, и до достижения объема 200 мл), после чего, нежелательные небольшие молекулы смывали путем проведения стадии диафильтрации с использованием водного раствора NaOH при pH от 10,5 до pH 11,0, и нужный ретентат после ультрафильтрации дополнительно 2-кратно концентрировали. Затем добавляли органические кислоты для образования солей при pH 7,5±0,5 с положительно заряженными группами, присутствующими в экстракте, для стабилизации препарата. Аналогичным образом, концентрирование высокомолекулярных фракций осуществляли путем проведения стадии концентрирования на фильтрах для ультрафильтрациив целях удаления низкомолекулярных фракций с использованием различных пороговых значений, соответственно, на 3 кД-, 10 кД-, 30 кД-, 100 кД-, 300 кД-, 1000 кД-фильтрах для соответствующей ультрафильтрации.
Органические кислоты, перечисленные ниже в Таблице, были добавлены с конечным значением pH 7,5±0,5. Включенные соли органических кислот положительно заряженной растворимой высокомолекулярной фракции бактериального экстракта удерживались внутри высокомолекулярной фракции во время всего процесса.
Аналогичная процедура была проведена в объеме 10 л, 100 л и, наконец, 400 л для приготовления опытных и промышленных партий с использованием порогового значения 10 кДа.
Предпочтительно, низвомолекулярные соли и молекулы могут быть удалены путем ультрафильтрации с получением концентрированной высокомолекулярной фракции, которая усиливает противовирусные свойства бактериального экстракта. 500 мл бактериального экстракта при рН 10,8 добавляли в лабораторную систему для ультрафильтрации, подсоединенную к полисульфоновому 10 кДа-фильтру для ультрафильтрации. После 4-кратного концентрирования начального объема 500 мл до приблизительно 120-140 мл проводили диафильтрацию с использованием NaOH-воды при pH 11±0,2. После 5 объемов диафильтрации, ретентат концентрировали до 100 мл, а конечный объем доводили до 125 мл путем добавления воды перед добавлением различных органических кислот в аликвотах по 10 мл.
Этот способ применяли к различным бактериальным экстрактам, таким как очищенные фракции щелочного экстракта ОМ, очищенные фракции грамположительных бактерий щелочных экстрактов Staphylococcus, Streptococcus, Bifidobacterium, Lactobacillus, а также очищенные фракции грамотрицательных бактерий щелочных экстрактов штаммов Escherichia coli, Klebsiella, Branhamella, Hemophilus. Ниже в Таблице 2 перечислены органические кислоты, которые были использованы для доведения pH до 7,5. Очищенные фракции бактериальных щелочных экстрактов после удаления низкомолекулярных компонентов доводили до pH 7,5 с использованием нижеследующих органических кислот и оценивали их стабильность.
Таблица 2:
Пример 1.5: Одновременное удаление небольших молекул и неорганических солей и концентрирование высокомолекулярной фракции бактериального экстракта Lactobacillus fermentum (OM314B), стабилизированного органической кислотой.
1 литр щелочного бактериального экстракта Lactobacillus fermentum при pH 10,5±0,3 добавляли в систему для ультрафильтрации, снабженную 0,45 мкм-микрофильтром и вторым фильтром для ультрафильтрации с отсечкой 10 кДальтон. Бактериальный экстракт очищали с использованием обоих фильтров, как описано в примере 7,3 и на Фигуре 1. После первой стадии концентрирования проводили непрерывную экстракцию с использованием 10 объемов пермеата 10 кДа в качестве среды для экстракции.
Затем проводили диафильтрацию 5 объемами раствора NaOH в воде с доведением pH до 10.
Последнюю стадию 4-кратного концентрирования проводили перед добавлением различных органических кислот, образующих включенные в экстракт соли.
Этот процесс осуществляли в масштабе 1 л сначала путем проведения стадии концентрирования (от 5-кратной концентрации до достижения приблизительно 200 мл), после чего, нежелательные небольшие молекулы смывали путем проведения стадии диафильтрации с использованием 5 объемов водного раствора NaOH при pH 10,5. Затем добавляли органические кислоты для образования солей с положительно заряженными группами, присутствующих в экстракте, для стабилизации препарата. Аналогичным образом, концентрирование высокомолекулярных фракций осуществляли путем проведения стадии концентрирования на фильтрах для ультрафильтрации для удаления низкомолекулярных фракций с использованием различных пороговых значений, соответственно, на полисульфоновых 3 кД-, 10 кД-, 30 кД-, 100 кД-, 300 кД-фильтрах для соответствующей ультрафильтрации.
Органические кислоты, перечисленные ниже в Таблице, были добавлены с конечным значением pH 7,5±0,2. Включенные соли органических кислот положительно заряженной растворимой высокомолекулярной фракции бактериального экстракта удерживались внутри этой высокомолекулярной фракции во время всего процесса.
В других примерах, этот процесс повторяли с использованием нижеследующих пороговых значений полисульфонового фильтра для ультрафильтрации, соответственно, 3 кД, 30 кД, 100 кД, 300 кД.
В другом примере, удаление низкомолекулярных солей и молекул проводили путем ультрафильтрации с получением концентрированной высокомолекулярной фракции, которая усиливала противовирусные свойства экстракта Lactobacillus fermentum. 500 мл щелочного экстракта Lactobacillus fermentum при pH 10,8 добавляли в лабораторную систему для ультрафильтрации, подсоединенную к полисульфоновому 10 кД-фильтру для ультрафильтрации. После 4-кратного концентрирования исходного объема 500 мл до приблизительно 120-140 мл проводили диафильтрацию с использованием NaOH-воды при pH от 10,8 до 11,0. После диафильтрации 5 объемов, высокомолекулярную фракцию (ретентат) концентрировали до 100 мл, а конечный объем доводили до 125 мл путем добавления воды, а затем добавления различных органических кислот в аликвотах по 10 мл для оценки физической стабильности и противовирусной активности.
Ниже в Таблице 3 перечислены органические кислоты, используемые для доведения pH до 7,5 для фракций экстракта Lactobacillus fermentum > 10 кДальтон.
Таблица 3:
В других примерах, этот процесс повторяли с использованием полых 0,45 мкм- и 0,2 мкм-волокон для микрофильтрации и полых волокон для ультрафильтрации с отсечкой 30 кД и 100 кД в качестве альтернативы конструкции фильтра в тангенциальном потоке, но с большей скоростью потока и за более короткое время проведения этого процесса.
Аналогичную процедуру проводили в объеме 10 л, 100 л и, наконец, 400 л для приготовления опытных и промышленных партий с использованием порога отсечки 10 кД.
Пример 1.6. Способ получения Lactobacillus fermentum I 3929p (OM314B) и аналитическая характеризация
Пример 1.6.1. Способ 4 получения Lactobacillus fermentum I 3929p
Лизис: Биомассу Lactobacilus fermentum I 3929p оттаивали в течение ночи при комнатной температуре. Проводимый лизис представлял собой лизис общей массы 2 кг, включая 25 г общей сухой массы после сушки (RS) на 1 кг культуры для лизиса. Необходимое количество биомассы (в зависимости от результата RS биомассы) помещали в минисосуд объемом 2500 мл (эталон: Semadeni n° 6863), и 2 кг QSP приготавливали с предварительно нагретой очищенной водой при температуре 40°C±5°C. Затем pH этого раствора доводили до 10,0±0,1 с использованием 10н NaOH (pH: 9,98, полученный путем добавления 2,8 мл 10 н NaOH).
После щелочного лизиса, культуру переносили в теплое помещение с температурой 40°C±1°C при перемешивании (при вихревом перемешивании продукта на 1 см-фильтре). После проведения лизиса в течение 4 часов±5 минут, pH регулировали (pH в конце лизиса: 9,28).
На этой стадии отбирали образец, соответствующий лизату в конце лизиса (называемый «процесс 4-E1-лизат»).
Фильтрация 1: Установка для фильтрации продукта была подготовлена как показано на диаграмме (Фигура 2). Система фильтрации состоит из 2 контуров фильтрации. Первый фильтр для микрофильтрации (называемый MF) состоял из резервуара (сосуда 2 на фигуре 2), насоса (насоса 1 на фигуре 2) и системы фильтрации с точкой отсечки 0,45 мкм (микрофильтра на фигуре 2). Второй контур для ультрафильтрации (называемый UF) состоял из резервуара (сосуда 3 на фигуре 2), насоса (насоса 2 на фигуре 2) и системы фильтрации с точкой отсечки 30 кДа (фильтра для ультрафильтрации на фигуре 2). Фильтрацию осуществляли в лабораторном масштабе с рабочим объемом 2000 мл.
Перед запуском этого процесса, система фильтрации была проверена на воспроизводимость для нескольких партий. Чтобы проверить правильность фильтруемости продукта, в системе фильтрации была проведена нормализованная оценка на водопроницаемость (NWP).
Лизат, используемый для получения, перемешивали до получения вихревого 1 см-продукта. Температура продукта была понижена до комнатной, до тех пор, пока не начинался процесс фильтрации. В этом процессе не проводили коррекцию исходного pH, а поэтому процесс фильтрации начинали немедленно.
Начальная стадия концентрирования: Продукт, используемый на первой стадии фильтрации, имел следующие параметры: отсутствие регуляции pH после лизиса (pH: 9,28), температура 38°C, перемешивание до получения вихревого 1 см-продукта.
Контурный насос MF (насос 1 на фигуре. 2) был запущен на 40% от скорости этого процесса, для того, чтобы заполнить систему продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре MF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяет кондиционировать гидрофильную систему фильтрации, удаляя пузырьки воздуха, присутствующие в системе.
Когда скорость потока и давление были стабильными, система фильтрации считалась кондиционированной. Затем открывали клапан контура MF с пермеатом для проведения начального концентрирования продукта с коэффициентом концентрации 0,5 (давление на входе: 270 мбар, скорость потока пермеата: 75 мл/мин). Во время первоначального концентрирования, скорость насоса (насоса 1 на фигуре 2) постепенно увеличивали до 100% (100 об/мин, что соответствует 600 мл/мин) от скорости процесса.
Параллельно с этой стадией кондиционировали контур для UF. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% от скорости процесса для загрузки системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
Диафильтрация: Когда был достигнут коэффициент концентрации, равный половине (0,5×), устройство UF с пермеатом открывали для запуска диафильтрации продукта (давление на входе: 793 мбар, скорость потока пермеата: 53 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапаном 1 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 1060 мбар, скорость потока пермеата: 47 мл/мин.). Во время диафильтрации, скорость насоса для ультрафильтрации (насос 2 на фигуре 2) была установлена так, чтобы поток пермеата при UF был равен потоку пермеата при MF. Действительно, объем резервуара для MF (сосуда 2 на фигуре 2) должен был оставаться максимально стабильным во время стадии диафильтрации.
Диафильтрацию проводили циклически. По окончании первоначального концентрирования, в резервуаре для MF присутствовал определенный объем (сосуд 2 на фигуре 2). После прохождения этого объема через систему фильтрации MF был реализован один цикл. В этом процессе, для диафильтрации потребовалось 5 циклов.
Конечное концентрирование: По окончании 5 циклов диафильтрации, насос для UF был остановлен. Когда давление на входе MF начинало увеличиваться, то насос для MF был остановлен. По окончании этой первой стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм.
Фильтрация 2: Представляющий интерес продукт собирали (масса: 996,0 г), а затем подвергали второй стадии из 5 циклов очистки на UF-контуре с отсечкой 30 кДа (сосуд 3, насос 2 и фильтр для ультрафильтрации на фигуре 2). 30 кДа-пермеат был удален через открытый клапан в отсек для отходов (фигура 2). Объем 30 кДа-ретентата поддерживали постоянным во время этой второй стадии фильтрации для очистки путем добавления 0,001 н раствора NaOH при pH 10,0 для диафильтрации. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% скорости процесса для заполнения системы продуктом.
После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
После кондиционирования системы фильтрации, устройство UF с пермеатом открывали для начала фильтрации 2 продукта (давление на входе: 640 мбар, скорость потока пермеата: 108 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапанами 2 и 3 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 900 мбар, скорость потока пермеата: 134 мл/мин.).
Во время стадии фильтрации 2, объем резервуара для UF (сосуд 3 на фигуре 2) должен был оставаться как можно более стабильным. Таким образом, по мере того, как уровень в резервуаре для UF (сосуд 3 на фигуре 2) снижался, в него добавляли 0,001 М раствор NaOH. Эти 5 циклов, соответствующие объему добавленного 0,001 М раствора для диафильтрации NaOH, были эквивалентны 5-кратному объему собранного представляющего интерес продукта (5 циклов диафильтрации).
По окончании второй стадии фильтрации собирали конечный продукт (масса: 951,4 г), а затем его разделяли на 2 равные части. По окончании этой второй стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм и более 30 кДа.
На этой стадии отбирали образец, соответствующий фильтрату до нейтрализации (называемый «процесс 4-E2-фильтрат»).
Затем первую часть фильтрата нейтрализовали 1%-ной пропионовой кислотой при pH 7,0±0,2 (pH: 7,13, доведенный путем добавления 0,5 мл 1%-ной пропионовой кислоты), а затем стерилизовали в биозащитном шкафу посредством фильтрации через полиэфирсульфоновую стерилизующую 0,2 мкм-мембрану (PES 0,2 мкм).
На этой стадии отбирали образец, соответствующий нейтрализованному фильтрату по окончании процесса (называемый «процесс 4-E3-нейтрализованный фильтрат (пропионовая кислота)» OM314B).
В это время, вторую часть фильтрата разделяли на 9 равных частей. После этого, каждую из этих частей нейтрализовали при 7,0±0,2 путем добавления 2,5% соляной кислоты (pH: 7,07) или органических кислот (OM314B): муравьиной кислоты 1/100 (pH: 7,16), уксусной кислоты 1/100 (pH: 7,16), 3-гидроксибутановой кислоты 1/100 (pH: 7,14), аспарагиновой кислоты 0,1% (pH: 7,18), молочной кислоты 1/50 (pH: 7,09), глутаминовой кислоты 0,1% (pH: 7,14), пировиноградной кислоты 1/100 (pH: 7,16), аскорбиновой кислоты 0,1% (pH: 7,18)).
И, наконец, различные продукты стерилизовали в биозащитном шкафу посредством фильтрации на полиэфирсульфоновой (PES) стерилизующей 0,2 мкм-мембране.
На этой стадии отбирали образец, соответствующий различным нейтрализованным фильтратам по окончании процесса (называемого «процесс 4-E3-нейтрализованный фильтрат (название кислоты)».
Таблица 4: Систематизированный список кодов образцов:
Пример 1.6.2. Аналитические методы характеризации
а) Метод определения сухой массы (лизата)
Определение сухого остатка лизата проводили путем осушения галогеном по принципу термогравиметрии: в начале процедуры измерения определяли массу образца, а затем образец быстро нагревали с помощью встроенного галогенового нагревателя и испаряли влагу. Во время сушки, образец непрерывно взвешивали на этом устройстве. По окончании сушки указывали массу сухого остатка.
Было точно определено, что масса лизата (М) составляла от 2 до 5 г. При этом, были использованы следующие параметры: режим нагрева: поступательный; режим остановки: постоянная масса; конечная температура: 105°C. По окончании анализа был автоматически распечатан бланк регистрации массы, где была указана конечная масса полученного остатка (m). Сухой остаток (выраженный в мг/г) = (м/М) × 1000. Измерения проводили непосредственно на образце (на всем образце) и после центрифугирования в течение 5 минут при 5000 × g (в супернатанте).
b) Метод определения сухой массы (фильтрата)
Сухую массу фильтрата определяли согласно Ph.Eur 2.2.32 с использованием приблизительно 5 г фильтрата, осушенного в течение 16 часов при 105°C (в печи). Результаты выражали в мг/г.
с) метод Лаури
Этот анализ был основан на реакции белков со щелочным раствором тартрата меди и реагентом Фолина (на основе Ph. Eur. 2.5.33). Было проведено две стадии, которые давали колориметрическую реакцию: реакцию между белками и медью в щелочной среде и последующее восстановление реагента Фолина белком, обработанным медью. Белки эффективно восстанавливали реагент Фолина с образованием восстановленных молекул, которые имели характерный синий цвет с максимальной оптической плотностью на 750 нм. Результаты представлены на стандартной кривой по отношению к белку альбумина бычьей сыворотка (BSA).
Получение образцов: 1,9 мл фосфатного буфера с pH 11 (3,55 г Na2HPO4 и 41 мл 0,1 М NaOH на 1 л воды) добавляли к 100 мкл каждого образца и встряхивали. Приготовление BSA-стандарта: раствор BSA разводили фосфатным буфером для построения стандартной кривой по 6 точкам от 0 до 420 мкг/мл. Процедура: 20 мкл образцов и стандартных растворов загружали в 96-луночный микропланшет. В каждую лунку сразу добавляли 25 мкл реагента A (из набора Bio-Rad® Лаури) и инкубировали 10 минут при комнатной температуре. Затем добавляли 200 мкл реагента B (из набора Bio-Rad® Лаури), перемешивали и инкубировали 20 минут при комнатной температуре. Оптическую плотность измеряли на 750 нм после смешивания. Результаты: Концентрации белка вычисляли по стандартной кривой: Концентрация белка (мг/мл) = [(y - b)/a] * разведение образца, где y=оптическая плотность образца; a=наклон калибровочной кривой; b=ордината в начале калибровочной кривой и результаты, выраженные в мг белка/мл.
d) Метод определения общего сахара
Углеводы, при их нагревании с антроном в серусодержащей среде, образуют хромофор, поглощающий на длине волны 625 нм.
Получение стандарта глюкозы: D-глюкозу солюбилизировали и разводили очищенной водой для построения стандартной кривой по 5 точкам от 0 до 100 (мкг/мл). Процедура: 0,1 мл исследуемого раствора (то есть, концентрата) и 0,9 мл очищенной воды добавляли в пробирку, помещенную на ледяную баню. Затем добавляли 5,0 мл реагента антрона (160 мг антрона в 100 мл 85% серной кислоты) и интенсивно встряхивали. Растворы нагревали 15 минут на кипящей водяной бане, а затем охлаждали на ледяной бане, время от времени встряхивая. Растворы оставляли на 15 минут при комнатной температуре. Пробирки встряхивали, и раствор переносили в измерительную ячейку и оставляли на 30 минут при комнатной температуре, после чего измеряли оптическую плотность на 625 нм. Результаты: Концентрации углеводов вычисляли по стандартной кривой: Содержание углеводов (мг/мл) = [(y - b)/a]* 10)/(1000), где y=оптическая плотность образца; a=наклон калибровочной кривой; b=ордината в начале калибровочной кривой и результаты, выраженные в мг углеводов/мл.
е) Анализ общей РНК
Очистку и анализ общей РНК проводили на основе данных набора RNeasy® Mini в соответствии с рекомендациями поставщика. Вкратце, 600 мкл бактериального экстракта переносили в центрифужную колонку RNeasy® и центрифугировали в течение 15 секунд при 8000× g. Затем, 700 мкл буфера RW1 добавляли в колонку RNeasy® и центрифугировали в течение 15 секунд при 8000 × g для промывки мембраны центрифужной колонки. Эту стадию повторяли два раза с 500 мкл буфера RPE и последовательно центрифугировали в течение 15 секунд при 8000× g и в течение 2 минут при 8000× g. Во избежание любого возможного переноса буферного RPE, центрифужную колонку центрифугировали на полной скорости в течение 1 минуты. Для элюирования РНК, в мембрану центрифужной колонки непосредственно добавляли 30 мкл воды, не содержащей РНКазы, и эту колонку центрифугировали в течение 1 минуты при 8000× g. Общую очищенную РНК детектировали на 260 нм с помощью спектрофотометра NanoDrop (ThermoFischer).
f) Анализ общей ДНК
Очистку и анализ общей ДНК проводили на основе данных набора DNeasy® для крови и ткани в соответствии с рекомендациями поставщика. Вкратце, 600 мкл бактериального экстракта переносили в центрифужную колонку DNeasy® Mini и центрифугировали в течение 1 минуты при 6000× g. Затем 500 мкл буфера AW1 добавляли в колонку DNeasy® Mini и центрифугировали в течение 1 минуты при 6000× g. После этого добавляли 500 мкл буфера AW2 и центрифужную колонку центрифугировали в течение 3 минут при 20000× g для сушки ДНК-мембраны. 100 мкл буфера AE добавляли на мембрану DNeasy®, инкубировали в течение 1 минуты и центрифугировали в течение 1 минуты при 6000× g для элюирования ДНК. Для достижения максимального выхода ДНК, элюирование повторяли еще один раз. Очищенную общую ДНК детектировали на 260 нм на спектрофотометре NanoDrop.
g) Анализ лизата с помощью лимулюс-теста с амебоцитами LAL
Анализ на эндотоксины проводили на основе данных набора по определению количества хромогенного эндотоксина Pierce™ в соответствии с рекомендациями поставщика. Все образцы разводили до 1:10 для того, чтобы естественный цвет этого образца не влиял на показания оптической плотности. Вкратце, стандартные растворы эндотоксина (в пределах 0,1-1,0 ЭЕ/мл) приготовливали из исходного раствора эндотоксина (10 ЭЕ/мл). 50 мкл стандарта эндотоксина, контроль (воду без эндотоксина) и образцы помещали в лунку. Затем добавляли 50 мкл разведенного реагента лизата амебоцитов и планшет инкубировали в течение 15 минут при 37°C. После этого добавляли 100 мкл хромогенного раствора субстрата на лунку и инкубировали при 37°C в течение 6 минут. Ровно через 6 минут добавляли 50 мкл блокирующего раствора (25% уксусной кислоты). Оптическую плотность измеряли на 405 нм сразу после завершения анализа.
h) Метод определения аминокислот:
Определение D- и L-аминокислот осуществляли с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ). После гидролиза образцов в микроволновой печи, аминокислоты дериватизировали с использованием о-фталальдегида вместе с хиральной тиоловой группой N-изобутирил-L-цистеина. Детектирование проводили с помощью УФ на 338 нм (Brückner, H., T. Westhauser, H. Godel. Liquid chromatographic determination of D- and L-amino acids by derivatization with 0-phthaldialdehyde and N-isobutyryl-L-cysteine. J. Chromatography A, 1995, 711, 201-21).
Стандартные растворы были приготовлены с различными аминокислотами: аспарагиновой кислотой (Asp), серином (Ser), глутаминовой кислотой (Glu), гистидином (His), аргинином (Arg), треонином (Thr), аланином (Ala), тирозином (Tyr), валином (Val), метионином (Met), лизином (Lys), изолейцином (Ile), лейцином (Leu), фенилаланином (Phe), глицином (Gly), цистином (Cys)) в концентрации 2,5 мкмоль/мл в 0,01н соляной кислоте (HCl). Эти растворы раводили до 0,5 мкмоль/мл с использованием 0,1 М буфера на основе тетрабората-декагидрата натрия при pH 9,2. В пробирке, 2,0 мл растворов образцов добавляли к 2,0 мл воды, 240 мкл 1-додекантиола и 8 мл 25% HCl. Затем эти растворы гидролизовали в микроволновой печи при 180°C, 1320 Вт в течение 15 минут. Растворы оставляли при комнатной температуре и фильтровали при 5 мкм. 50,0 мкл выпаривали досуха и разводили 100 мкл 0,01 н HCl. Образцы и стандартные растворы сохраняли в ВЭЖХ-системе при 10°C и вводили в следующем режиме: 5,0 мкл 0,1 М буфера на основе тетрабората-декагидрата натрия при pH 9,2, 2,0 мкл раствора для дериватизации (23 мг фталдиалегида и 50 мг N-изобутирил-L-цистеина, солюбилизированного в 1,0 мл метанола), 2,0 мкл образца или стандартного раствора забирали с помощью автоматического пробоотборника, смешивали 5 раз и вводили. ВЭЖХ-колонка представляла собой Supelcosil C18, 5 мкм, 4,6 × 250 мм, с предварительной колонкой Supelco LC 18, 5 мкм, 4,6 × 20 мм. Для элюирования использовали градиент 23 мМ ацетата натрия, доведенного до pH 5,9 (элюент A), и смеси метанола-ацетонитрила (12:1, об./об.) (элюент B). Затем использовали градиент от 4% B до 33% B, 45 минут, после чего использовали градиент до 56% B в течение 30 минут (и стадию промывки до 85% B) при скорости потока 1 мл/мин. Свободные аминокислоты также тестировали отдельно для каждого образца без проведения стадии гидролиза HCl, с использованием непосредственно раствора E2-фильтрата в сосудах для ВЭЖХ, и в отсутствии гидролиза свободные аминокислоты не обнаруживались.
i) Результаты спектрофотометрии, полученные во время оценки стабильности
Растворы нейтрализованного фильтрата стабилизировали при комнатной температуре (20°C±5°C) или при 4°C. В каждый момент времени, оптическую плотность растворов регистрировали на 300-700 нм. Профиль спектра оценивали визуально, как шумовой спектр (например, на фигуре 27 указано осаждение в растворе) или сглаженный спектр (например, Фигура 27). Оптическую плотность регистрировали на 320 нм для количественной оценки.
j) Результаты на момент выхода:
Все растворы E2-фильтрата замораживали после обработки и оттаивали при 4°C в течение ночи перед анализом.
Пример 1.6.3. Аналитическая характеризация конечных образцов Lactobacillus fermentum I 3929p Процесса 4 после их получения (T0)
Таблица 5: Результаты для образцов Процесса 4
ND=не детектировали; * LAL на эндотоксин: предел детектирования=0,1 ЭЕ/мл; ** ДНК: предел детектирования=3,60 мкг/мл, предел количественной оценки=12,01 мкг/мл; *** РНК: предел детектирования=4,29 мкг/мл, предел количественной оценки=14,32 мкг/мл.
Таблица 6: Процесс 4 - Общие аминокислоты
(мкмоль/мл)
Таблица 7: Процесс 4 - оценка стабильности раствора путем измерения оптической плотности
Abs: оптическая плотность на 320 нм; RT: комнатная температура (20°C +/- 5°C); Оценка: визуальная оценка спектра
Промышленная партия, описанная в WO 2008/109669 (OM-13-BV) и нейтрализованная соляной кислотой (промышленная партия HCL 1619064), давала осадок, выпадающий уже на Т0 сразу после нейтрализации. Процесс 4 - E4 - нейтрализованные фильтраты были физически стабильными при 4°C или при комнатной температуре в течение по меньшей мере 6 месяцев. Они рассматриваются как стабильные в этих условиях в течение 12 месяцев.
Результаты для Mip3-альфа (CCL20), полученные во время стабилизации:
Лиганд хемокина 20 (мотив С-С) (CCL20) или хемокин, регулируемый активацией печени (LARC), или воспалительный белок-3 макрофагов (MIP-3-альфа, CCL20) представляют собой небольшой цитокин, принадлежащий к семейству хемокинов СС. Он оказывает сильное хемотаксическое действие на лимфоциты и слабо притягивает нейтрофилы. CCL20 участвует в образовании и функционировании лимфоидных тканей слизистой оболочки посредством химического притягивания лимфоцитов и дендритных клеток к эпителиальным клеткам, окружающим эти ткани. CCL20 оказывает действие на свои клетки-мишени посредством связывания и активации хемокинового рецептора CCR6.
Клеточная линия THP-1 была приобретена из коллекции ATCC, #TIB-202. Клеточная линия THP-1 была получена из периферической крови годовалого ребенка мужского пола с острым моноцитарным лейкозом. Сосуды с рабочим банком клеток THP-1 использовали в этом биоанализе как макрофагоподобные клетки после дифференцировки.
Растворы нейтрализованного фильтрата стабилизировали при комнатной температуре (20°C±5°C) или при 4°C. Образцы были взяты в различные моменты времени и заморожены для дальнейшего биоанализа. Все растворы (на T0 и во время оценки стабильности) перед анализом размораживали при 4°C в течение ночи.
Дифференцировка: Клетки ТНР-1 дифференцировали с использованием форбола 12-миристата 13-ацетата (РМА) до конечной концентрации 100 нг/мл РМА в суспензии клеток (1×106 клеток/мл). 100,0 мкл/лунку суспензии клеток РМА распределяли по всем лункам 96-луночного планшета для культивирования клеток. Клетки инкубировали 72 часа при 37°C.
Стимуляция: Серийное разведение в 10 точках (3,16-кратное серийное разведение) проводили культуральной средой в планшете с глубокими лунками: от 2 мкг/мл до 0,06 мкг/мл PAM3CSK4 (эталонный позитивный контроль для секреции MIP-3α). Серийное разведение в 6 точках (3,16-кратное серийное разведение) проводили культуральной средой в планшете с глубокими лунками: 200 мкл тестируемого образца в первой лунке плпншета с глубокими лунками+400 мкл культуральной среды, а затем 190 мкл разводили 410 мкл культуральной среды (3,16-кратно). 100 мкл/массу супернатантов удаляли из планшета с клетками. 100,0 мкл/массу культуральной среды распределяли по всем лункам планшета с клетками. Планшет инкубировали 24 часа при 37°C.
Сбор супернатанта: Собирали 75 мкл супернатанта из каждой лунки, и этот супернатант распределяли по 96-луночному микропланшету PP. Планшет герметично закрывали и хранили в морозильной камере со сверхнизкой степенью замораживания до проведения ELISA-анализа. ELISA-анализ: Лунки микропланшета покрывали 100,0 мкл/лунку антитела против человеческого MIP-3α (антитела для захвата). Планшет закрывали герметической фольгой и соответствующим образом инкубировали. После завершения инкубирования, стадии промывки проводили с помощью автоматического устройства для промывки микропланшетов. В день проведения стадии насыщения, планшет с супернатантом оттаивали при +4°C. Стадия насыщения: Добавляли 250,0 мкл/лунку реагента-разбавителя (1% BSA в PBS), и планшеты инкубировали, если это необходимо. На стадии насыщения приготовливали серийные разведения супернатантов и стандартов MIP-3α. Стандартную кривую строили для каждого ELISA-планшета. После завершения инкубирования проводили стадии промывки, и образцы распределяли по лункам, а затем планшеты инкубировали, если это необходимо. После завершения инкубирования проводили стадии промывки, и распределяли биотинилированное козье антитело против человеческого MIP-3α (стадия для детектирующего антитела). При необходимости, планшеты инкубировали. После завершения инкубирования проводили стадии промывки и распределяли конъюгат стрептавидин-ПХ. При необходимости, планшеты инкубировали. После завершения инкубирования проводили стадии промывки, добавляли субстрат фермента, и ОП считывали на длине волны 450 нм. Обработку данных для контроля и коррекцию на длине волны 540 нм осуществляли в соответствии с рекомендациями поставщиков наборов для ELISA. Процесс 4 - результаты биоанализа на стабильность показали, что процесс 4 - E3 - нейтрализованный фильтрат был стабильным в течение по меньшей мере 1 месяца при комнатной температуре (20°C±5°C) или 4°C.
Пример 1.7. Смесь полищелочных лизатов 18 штаммов E. coli .
Пример 1.7.1. Процесс 5 для смеси полищелочных лизатов 18 штаммов E. coli (OM314C)
Щелочной лизис: Часть щелочного лизата смеси из 18 штаммов E. coli, как было описано в WO2008/109667, получали промышленным способом и хранили в миниконтейнере емкостью 2500 мл (эталон: Semadeni n° 6863).
На этой стадии отбирали образец, соответствующий лизату по окончании лизиса (называемый «процесс 5-E1-лизат»).
Фильтрация 1 : Установка для фильтрации продукта была подготовлена как показано на диаграмме (Фигура 2). Система фильтрации состоит из 2 контуров фильтрации. Первый фильтр для микрофильтрации (называемый MF), состоял из резервуара (сосуда 2 на фигуре 2), насоса (насоса 1 на фигуре 2) и системы фильтрации с точкой отсечки 0,45 мкм (микрофильтра на фигуре 2). Второй контур для ультрафильтрации (называемый UF) состоял из резервуара (сосуда 3 на фигуре 2), насоса (насоса 2 на фигуре 2) и системы фильтрации с точкой отсечки 30 кДа (фильтра для ультрафильтрации на фигуре 2). Фильтрацию осуществляли в лабораторном масштабе с рабочим объемом 2000 мл.
Перед запуском этого процесса, система фильтрации была проверена на воспроизводимость для нескольких партий. Чтобы проверить правильность фильтруемости продукта, в системе фильтрации была проведена нормализованная оценка на водопроницаемость (NWP).
Лизат, используемый для получения, сначала разводили 4 раза очищенной водой (500,8 г лизата и 1502,7 г очищенной воды). Продукт перемешивали до получения вихревого 1 см-продукта. Температуру продукта понижали до комнатной, до тех пор, пока не начинался процесс фильтрации. В этом процессе, рН доводили до 10,5-10,8 (pH 10,68, скорректированный путем добавленя 2,1 мл чистой пировиноградной кислоты).
Начальная стадия концентрирования : Продукт, используемый на первой стадии фильтрации, имел следующие параметры: (pH: 10,68, температура 29°C, перемешивание до получения вихревого 1 см-продукта). Контурный насос MF (насос 1 на фигуре 2) был запущен на 40% скорости для этого процесса, для того, чтобы заполнить систему продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре MF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяет кондиционировать гидрофильную систему фильтрации, удаляя пузырьки воздуха, присутствующие в системе.
Когда скорость потока и давление были стабильными, система фильтрации считалась кондиционированной. Затем открывали клапан контура MF с пермеатом для проведения начального концентрирования продукта с коэффициентом концентрации 0,5 (давление на входе: 200 мбар, скорость потока пермеата: 89 мл/мин). Во время первоначального концентрирования, скорость насоса (насоса 1 на фигуре 2) постепенно увеличивали до 100% (100 об/мин, что соответствует 600 мл/мин) от скорости процесса.
Параллельно с этой стадией кондиционировали контур для UF. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% от скорости процесса для загрузки системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
Диафильтрация: Когда был достигнут коэффициент концентрации, равный 0,5, устройство UF с пермеатом открывали для запуска диафильтрации продукта (давление на входе: 786 мбар, скорость потока пермеата: 80 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапаном 1 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 950 мбар, скорость потока пермеата: 60 мл/мин.).
Во время диафильтрации, скорость насоса для ультрафильтрации (насоса 2 на фигуре 2) была установлена так, чтобы поток пермеата при UF был равен потоку пермеата при MF. Действительно, объем резервуара для MF (сосуда 2 на фигуре 2) должен был оставаться максимально стабильным во время стадии диафильтрации.
Диафильтрацию проводили циклически. По окончании первоначального концентрирования, в резервуаре для MF присутствовал определенный объем (сосуд 2 на фигуре 2). После прохождения этого объема через систему фильтрации MF был реализован один цикл. В этом процессе, для диафильтрации потребовалось 5 циклов.
Конечное концентрирование: По окончании 5 циклов диафильтрации, насос для UF был остановлен. Когда давление на входе MF начинало увеличиваться, то насос для MF был остановлен. По окончании этой первой стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм.
Фильтрация 2: Представляющий интерес продукт собирали (масса: 1146,3 г), а затем подвергали второй стадии из 5 циклов очистки на UF-контуре с отсечкой 30 кДа (сосуд 3, насос 2 и фильтр для ультрафильтрации на фигуре 2). Пермеат был удален в отходы как указано на фигуре 2. Постоянный объем поддерживали во время этой второй стадии фильтрации для очистки путем добавления 0,001 н раствора NaOH при pH 10,0.
Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% скорости процесса для заполнения системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
После кондиционирования системы фильтрации, устройство UF с пермеатом открывали для начала фильтрации 2 продукта (давление на входе: 650 мбар, скорость потока пермеата: 76 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапанами 2 и 3 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 960 мбар, скорость потока пермеата: 105 мл/мин.).
Во время стадии фильтрации 2, объем резервуара для UF (сосуд 3 на фигуре 2) должен был оставаться как можно более стабильным. Таким образом, по мере того, как уровень в резервуаре для UF (сосуд 3 на фигуре 2) снижался, в него добавляли раствор NaOH. Эти 5 циклов, соответствующие объему добавленного раствора NaOH, были эквивалентны 5-кратному объему собранного представляющего интерес продукта.
По окончании 2-ой стадии фильтрации собирали конечный продукт (масса: 1042,7 г), а затем его разделяли на 2 равные части. По окончании этой второй стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм и более 30 кДа. На этой стадии отбирали образец, соответствующий фильтрату до нейтрализации (называемый «процесс 5-E2-фильтрат»).
Затем первую часть фильтрата нейтрализовали пировиноградной кислотой 1/100 при pH 7,0±0,2 (pH: 7,08, доведенный путем добавления 3 мл пировиноградной кислоты 1/100), а затем стерилизовали в биозащитном шкафу посредством фильтрации через полиэфирсульфоновую стерилизующую 0,2 мкм-мембрану (PES 0,2 мкм).
На этой стадии отбирали образец, соответствующий нейтрализованному фильтрату по окончании процесса (называемый «процесс 5-E3-нейтрализованный фильтрат (пировиноградная кислота)», OM314С).
В это время, вторую часть фильтрата разделяли на 9 равных частей. После этого, каждую из этих частей нейтрализовали при 7,0±0,2 путем добавления 0,25% соляной кислоты (pH: 7,09) или органических кислот (OM314С): муравьиной кислоты 1/100 (pH: 7,11), уксусной кислоты 1/100 (pH: 6,97), 3-гидроксибутановой кислоты 1/100 (pH: 7,03), 0,1% аспарагиновой кислоты (pH: 7,09), молочной кислоты 1/100 (pH: 7,15), 0,1% глутаминовой кислоты (pH: 7,10), пропионовой кислоты 1/100 (pH: 7,10), чистой аскорбиновой кислоты (pH: 7,04)). И наконец, различные продукты стерилизовали в биозащитном шкафу посредством фильтрации на полиэфирсульфоновой (PES) стерилизующей 0,2 мкм-мембране.
На этой стадии отбирали образец, соответствующий различным нейтрализованным фильтратам по окончании процесса (называемого «процесс 5-E4-нейтрализованный фильтрат (название кислоты)».
Таблица 8: Систематизированный список кодов образцов:
Пример 1.7.2. Аналитическая характеризация
Методы анализа описаны в 1.6.2.
Аналитическая характеризация конечных образцов Процесса 5 после их получения (T0)
Растворы E2-фильтрата замораживали после обработки и оттаивали при 4°C в течение ночи перед анализом.
Таблица 9: Процесс 5 - Результаты анализов
ND=не детектировали; * LAL на эндотоксин: предел детектирования=0,1 ЭЕ/мл; ** ДНК: предел детектирования=3,60 мкг/мл, предел количественной оценки=12,01 мкг/мл; *** РНК: предел детектирования=4,29 мкг/мл, предел количественной оценки=14,32 мкг/мл
Таблица 10: Процесс 5 - Общие аминокислоты после HCl-гидролиза
а) Результаты спектрофотометрической оценки, полученные во время анализа на стабильность
Таблица 11: Процесс 5 - стабильность раствора, оцененная путем измерения оптической плотности
Abs: оптическая плотность на 320 нм; RT: комнатная температура (20°C±5°C); Оценка: визуальная оценка спектра
Промышленная партия, описанная в WO 2008/109669 (OM-13-BV) и нейтрализованная соляной кислотой, давала осадок, выпадающий уже на Т0. За исключением аскорбиновой кислоты, Процесс 5 - E4 - нейтрализованные фильтраты были физически стабильными при 4°C или комнатной температуре в течение по меньшей мере 6 месяцев. Они рассматриваются как стабильные в этих условиях в течение 12 месяцев.
Результаты для Mip3-альфа (CCL20), полученные во время стабилизации:
Фигура 32: Результаты бионализа Процесса 5 во время анализа на стабильность показали, что Процесс 5 - E3 - нейтрализованный фильтрат обладал сравнимой биоактивностью в отношении секреции MIP3-альфа на ТНР-1 по меньшей мере в течение 5 месяцев при комнатной температуре (20°C±5°C) или при 4°C. Образцы Процесса 5 на Т0 сравнивали с образцами на Т5, хранящимися при 4°C и при комнатной температуре (КТ) в течение 4 месяцев.
Пример 1.8. Процесс 3: Щелочной лизат Streptococcus pn. 7466 (OM314A)
Пример 1.8.1. Процесс 3: Streptococcus pn. 7466
Щелочной лизис: 2794 кг биомассы Streptococcus pneunomiae 7466 (партия 1418123 - блоки 34 и 35) оттаивали в течение ночи при комнатной температуре в сосуде для лизиса. Затем добавляли 240 г 10 н NaOH и 4293 г раствора NaCl в концентраци 8 г/л с получением общей массы лизиса 7327 г. Культуру после щелочного лизиса переносили в теплое помещение при 37°C±2,5°C при перемешивании (150±5 об/мин) в течение 8 дней. После лизиса в течение 3 часов±30 минут регулировали OD J0. Образец 100-кратно разводили и данные считывали на спектрофотометре на 700 нм (считываемая OD: 0,258 и конечная OD: 25,8). Каждый рабочий день проводили перемешивание (150 об/мин±5 об/мин) в теплом помещении (37,0°C±2,5°C) и регулировали pH (J1 pH: 12,63/J2 pH: 12,62/J5 pH: 12,59/J6 pH: 12,65/J7, pH:12,69/J8, pH: 12,71). Если значение pH не входило в рабочий диапазон, то необходимо было его скорректировать путем добавления 10н NaOH (J1: 10 мл 10н NaOH/J2: 10 мл 10н NaOH/J5: 10 мл 10н NaOH/J6: 10 мл 10н NaOH/J7: 10 мл 10н NaOH).
По окончании лизиса регулировали OD J8. Образец раводили 5 раз и считывали на спектрофотометре на 700 нм (считываемая OD: 0,092 и конечная OD: 0,46). OD-дельта между J0 и J8 должна превышать 12,8 (OD-дельта: 25,34).
Часть этого лизата Streptococcus pneunomiae 7466 была восстановлена и хранилась в миниконтейнере емкостью 2500 мл (эталон: Semadeni n° 6863). На этой стадии отбирали образец, соответствующий лизату по окончании лизиса (называемый «процесс 3-E1-лизат»).
Фильтрация 1: Установка для фильтрации продукта была подготовлена как показано на диаграмме (Фигура 2). Система фильтрации состоит из 2 контуров фильтрации. Первый фильтр для микрофильтрации (называемый MF) состоял из резервуара (сосуда 2 на фигуре 2), насоса (насоса 1 на фигуре 2) и системы фильтрации с точкой отсечки 0,45 мкм (микрофильтра на фигуре 2). Второй контур для ультрафильтрации (называемый UF) состоял из резервуара (сосуда 3 на фигуре 2), насоса (насоса 2 на фигуре 2) и системы фильтрации с точкой отсечки 10 кДа (фильтра для ультрафильтрации на фигуре 2). Фильтрацию осуществляли в лабораторном масштабе с рабочим объемом 2000 мл.
Перед запуском этого процесса, система фильтрации была проверена на воспроизводимость для нескольких партий. Чтобы проверить правильность фильтруемости продукта, в системе фильтрации была проведена нормализованная оценка на водопроницаемость (NWP).
Лизат, используемый для получения, сначала разводили 4 раза очищенной водой (1000,0 г лизата и 1000,0 г очищенной воды). Продукт перемешивали до получения вихревого 1 см-продукта. Температуру продукта понижали до комнатной, до тех пор, пока не начинался процесс фильтрации. В этом процессе, рН доводили до 10,5-10,8 (pH 10,68, скорректированный путем добавления 15 мл чистой 3-гидроксибутановой кислоты).
Начальная стадия концентрирования: Продукт, используемый на первой стадии фильтрации, имел следующие параметры: (pH: 10,68), температура 29°C, перемешивание до получения вихревого 1 см-продукта. Контурный насос MF (насос 1 на фигуре 2) был запущен на 40% скорости для этого процесса, для того, чтобы заполнить систему продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре MF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяет кондиционировать гидрофильную систему фильтрации, удаляя пузырьки воздуха, присутствующие в системе.
Когда скорость потока и давление были стабильными, система фильтрации считалась кондиционированной. Затем открывали клапан контура MF с пермеатом для проведения начального концентрирования продукта с коэффициентом концентрации 0,5 (давление на входе: 210 мбар, скорость потока пермеата: 50 мл/мин). Во время первоначального концентрирования, скорость насоса (насоса 1 на фигуре 2) постепенно увеличивали до 100% (100 об/мин, что соответствует 600 мл/мин) от скорости процесса.
Параллельно с этой стадией кондиционировали контур для UF. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% от скорости процесса для загрузки системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
Диафильтрация: Когда был достигнут коэффициент концентрации, равный 0,5, устройство UF с пермеатом открывали для запуска диафильтрации продукта (давление на входе: 680 мбар, скорость потока пермеата: 47 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапаном 1 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 995 мбар, скорость потока пермеата: 46 мл/мин.).
Во время диафильтрации, скорость насоса для ультрафильтрации (насоса 2 на фигуре 2) была установлена так, чтобы поток пермеата при UF был равен потоку пермеата при MF. Действительно, объем резервуара для MF (сосуда 2 на фигуре 2) должен оставаться максимально стабильным во время стадии диафильтрации.
Диафильтрацию проводили циклически. По окончании первоначального концентрирования, в резервуаре для MF присутствовал определенный объем (сосуд 2 на фигуре 2). После прохождения этого объема через систему фильтрации MF был реализован один цикл. В этом процессе, для диафильтрации потребовалось 5 циклов.
Конечное концентрирование: По окончании 5 циклов диафильтрации, насос для UF был остановлен. Когда давление на входе MF начинало увеличиваться, то насос для MF был остановлен. По окончании этой первой стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм.
Фильтрация 2: Представляющий интерес продукт собирали (масса: 945,7 г), а затем подвергали второй стадии из 5 циклов очистки на UF-контуре с отсечкой 10 кДа (сосуд 3, насос 2 и фильтр для ультрафильтрации на фигуре 2). Пермеат был удален в отходы как указано на фигуре 2. Постоянный объем поддерживали во время этой второй стадии фильтрации для очистки путем добавления 0,001 н раствора NaOH при pH 10,0.
Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% скорости процесса для заполнения системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
После кондиционирования системы фильтрации, устройство UF с пермеатом открывали для начала фильтрации 2 продукта (давление на входе: 690 мбар, скорость потока пермеата: 37 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапанами 2 и 3 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 945 мбар, скорость потока пермеата: 52 мл/мин.).
Во время стадии фильтрации 2, объем резервуара для UF (сосуд 3 на фигуре 2) должен оставаться как можно более стабильным. Таким образом, по мере того, как уровень в резервуаре для UF (сосуд 3 на фигуре 2) снижался, в него добавляли раствор NaOH. Эти 5 циклов, соответствующие объему добавленного раствора NaOH, были эквивалентны 5-кратному объему собранного представляющего интерес продукта.
По окончании 2-ой стадии фильтрации собирали конечный продукт (масса: 931,7 г), а затем его разделяли на 2 равные части. По окончании этой второй стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм и более 30 кДа.
На этой стадии отбирали образец, соответствующий фильтрату до нейтрализации (называемый «процесс 3-E2-фильтрат»).
Затем первую часть фильтрата нейтрализовали 3-гидроксибутановой кислотой при pH 7,0±0,2 (pH: 7,25, доведенный путем добавления 10 мл 3-гидроксибутановой кислоты 1/100), а затем стерилизовали в биозащитном шкафу посредством фильтрации через полиэфирсульфоновую стерилизующую 0,2 мкм-мембрану (PES 0,2 мкм).
На этой стадии отбирали образец, соответствующий нейтрализованному фильтрату по окончании процесса (называемый «процесс 5-E3-нейтрализованный фильтрат (3-гидроксибутановая кислота)»).
В это время, вторую часть фильтрата разделяли на 9 равных частей. После этого, каждую из этих частей нейтрализовали при 7,0±0,2 путем добавления 2,5% соляной кислоты (pH: 7,19) или органических кислот (OM314А): муравьиной кислоты 1/100 (pH: 7,16), уксусной кислоты 1/100 (pH: 7,16), пировиноградной кислоты 1/100 (pH: 7,14), аспарагиновой кислоты (pH: 7,19), молочной кислоты 1/100 (pH: 7,06), 0,1% глутаминовой кислоты (pH: 7,13), пропионовой кислоты 1/100 (pH: 7,20), чистой аскорбиновой кислоты (pH: 7,20)). И, наконец, различные продукты стерилизовали в биозащитном шкафу посредством фильтрации на полиэфирсульфоновой (PES) стерилизующей 0,2 мкм-мембране.
На этой стадии отбирали образец, соответствующий различным нейтрализованным фильтратам по окончании процесса (называемого «процесс 3-E4-нейтрализованный фильтрат (название кислоты)».
Таблица 12: Систематизированный список кодов образцов:
Пример 1.8.2. Аналитическая характеризация
Методы анализа описаны в 1.6.2.
Аналитическая характеризация конечных образцов Процесса 3 после их получения (T0)
Растворы E2-фильтрата замораживали после обработки и оттаивали при 4°C в течение ночи перед анализом.
Результаты при получении (Т0):
Таблица 13: Процесс 3 - Результаты анализов
ND=не детектировали; * LAL на эндотоксин: предел детектирования=0,1 ЭЕ/мл; ** ДНК: предел детектирования=3,60 мкг/мл, предел количественной оценки=12,01 мкг/мл; *** РНК: предел детектирования=4,29 мкг/мл, предел количественной оценки=14,32 мкг/мл.
Таблица 14: Процесс 3 - Общие аминокислоты после HCl-гидролиза
а) Результаты спектрофотометрической оценки, полученные во время анализа на стабильность
Таблица 15: Процесс 3 - стабильность раствора, оцененная путем измерения оптической плотности
Abs: оптическая плотность на 320 нм; RT: комнатная температура (20°C±5°C); Оценка: визуальная оценка спектра.
Промышленная партия 1619064, описанная в WO 2008/109669, была нейтрализована соляной кислотой и давала осадок, выпадающий уже на Т0. За исключением аскорбиновой кислоты, Процесс 3 - E4 - нейтрализованные фильтраты были физически стабильными при 4°C или комнатной температуре в течение по меньшей мере 3 месяцев.
b) Результаты для Mip3-альфа (CCL20), полученные во время стабилизации:
Фигура 31: Результаты бионализа Процесса 3 во время анализа на стабильность показали, что Процесс 3-E3-нейтрализованный фильтрат обладал сравнимой биоактивностью в отношении секреции MIP-3α на ТНР-1 по меньшей мере в течение 5 месяцев при комнатной температуре (20°C±5°C) или при 4°C. Образцы Процесса 3 на Т0 сравнивали с образцами на Т5, хранящимися при 4°C и при комнатной температуре (КТ) в течение 5 месяцев.
Пример 1.9. Стабильный бактериальный экстракт полилизата 21 штамма (OM314A)
Пример 1.9.1. Процесс 1 для стабилизации композиции бактериального экстракта полилизата 21 штамма
Лизис: Часть полилизата 21 штамма была выделена при продуцировании и хранилась в миниконтейнере емкостью 2500 мл (эталон: Semadeni n° 6863).
На этой стадии отбирали образец, соответствующий лизату в конце лизиса (называемый «Процесс 1-E1-лизат»).
Фильтрация 1: Установка для фильтрации продукта была подготовлена как показано на диаграмме (Фигура 2). Система фильтрации состоит из 2 контуров фильтрации. Первый фильтр для микрофильтрации (называемый MF) состоял из резервуара (сосуда 2 на фигуре 2), насоса (насоса 1 на фигуре 2) и системы фильтрации с точкой отсечки 0,45 мкм (микрофильтра на фигуре 2). Второй контур для ультрафильтрации (называемый UF) состоял из резервуара (сосуда 3 на фигуре 2), насоса (насоса 2 на фигуре 2) и системы фильтрации с точкой отсечки 10 кДа (фильтра для ультрафильтрации на фигуре 2). Фильтрацию осуществляли в лабораторном масштабе с рабочим объемом 2000 мл.
Перед запуском этого процесса, система фильтрации была проверена на воспроизводимость для нескольких партий. Чтобы проверить правильность фильтруемости продукта, в системе фильтрации была проведена NWP (нормализованная оценка на водопроницаемость).
Лизат, используемый для получения, сначала разводили 2 раза очищенной водой (1000,6 г лизата и 999,9 г очищенной воды). Продукт перемешивали до получения вихревого 1 см-продукта. Температуру продукта понижали до комнатной до тех пор, пока не начинался процесс фильтрации. В этом процессе, рН доводили до 10,5-10,8 (pH 10,77, скорректированный путем добавления чистой аспарагиновой кислоты).
Начальная стадия концентрирования: Продукт, используемый на первой стадии фильтрации, имел следующие параметры: (pH: 10,77), температура 25°C, перемешивание до получения вихревого 1 см-продукта. Контурный насос MF (насос 1 на фигуре 2) был запущен на 40% скорости для этого процесса, для того, чтобы заполнить систему продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре MF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяет кондиционировать гидрофильную систему фильтрации, удаляя пузырьки воздуха, присутствующие в системе.
Когда скорость потока и давление были стабильными, система фильтрации считалась кондиционированной. Затем открывали клапан контура MF с пермеатом для проведения начального концентрирования продукта с коэффициентом концентрации 0,5 (давление на входе: 300 мбар, скорость потока пермеата: 43 мл/мин). Во время первоначального концентрирования, скорость насоса (насоса 1 на фигуре 2) постепенно увеличивали до 100% (100 об/мин, что соответствует 600 мл/мин) от скорости процесса.
Параллельно с этой стадией кондиционировали контур для UF. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% от скорости процесса для загрузки системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
Диафильтрация: Когда был достигнут коэффициент концентрации, равный 0,5, устройство UF с пермеатом открывали для запуска диафильтрации продукта (давление на входе: 730 мбар, скорость потока пермеата: 58 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапаном 1 (на фигуре 2), должно быть установлено на 850 мбар (давление на входе: 1010 мбар, скорость потока пермеата: 58 мл/мин.).
Во время диафильтрации, скорость насоса для ультрафильтрации (насоса 2 на фигуре 2) была установлена так, чтобы поток пермеата при UF был равен потоку пермеата при MF. Действительно, объем резервуара для MF (сосуда 2 на фигуре 2) должен был оставаться максимально стабильным во время стадии диафильтрации.
Диафильтрацию проводили циклически. По окончании первоначального концентрирования, в резервуаре для MF присутствовал определенный объем (сосуд 2 на фигуре 2). После прохождения этого объема через систему фильтрации MF был реализован один цикл. В этом процессе, для диафильтрации потребовалось 5 циклов.
Конечное концентрирование: По окончании 5 циклов диафильтрации, насос для UF был остановлен. Когда давление на входе MF начинало увеличиваться, то насос для MF был остановлен. По окончании этой первой стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм.
Фильтрация 2: Представляющий интерес продукт собирали (масса: 1232,7 г), а затем подвергали второй стадии из 5 циклов очистки на UF-контуре с отсечкой 10 кДа (сосуд 3, насос 2 и фильтр для ультрафильтрации на фигуре 2). Пермеат был удален в отходы как указано на фигуре 2. Постоянный объем поддерживали во время этой второй стадии фильтрации для очистки путем добавления 0,001 н раствора NaOH при pH 10,0.
Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% скорости процесса для заполнения системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
После кондиционирования системы фильтрации, устройство UF с пермеатом открывали для начала фильтрации 2 продукта (давление на входе: 655 мбар, скорость потока пермеата: 37 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапанами 2 и 3 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 917 мбар, скорость потока пермеата: 57 мл/мин.).
Во время стадии фильтрации 2, объем резервуара для UF (сосуд 3 на фигуре 2) должен был оставаться как можно более стабильным. Таким образом, по мере того, как уровень в резервуаре для UF (сосуд 3 на фигуре 2) снижался, в него добавляли раствор NaOH. Эти 5 циклов, соответствующие объему добавленного раствора NaOH, были эквивалентны 5-кратному объему собранного представляющего интерес продукта.
По окончании 2-ой стадии фильтрации собирали конечный продукт (масса: 1237,0 г), а затем его разделяли на 2 равные части. По окончании этой второй стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм и более 10 кДа.
На этой стадии отбирали образец, соответствующий фильтрату до нейтрализации (называемый «процесс 1-E2-фильтрат»).
Затем первую часть фильтрата нейтрализовали 0,1% аспарагиновой кислотой при pH 7,2±0,2 (pH: 7,20, доведенный путем добавления 65 мл 0,1% аспарагиновой кислоты), а затем стерилизовали в биозащитном шкафу посредством фильтрации через полиэфирсульфоновую стерилизующую (PES) 0,2 мкм-мембрану.
На этой стадии отбирали образец, соответствующий нейтрализованному фильтрату по окончании процесса (называемый «процесс 1-E3-нейтрализованный фильтрат (аспарагиновая кислота)» ОМ314А).
В это время, вторую часть фильтрата разделяли на 9 равных частей. После этого, каждую из этих частей нейтрализовали при 7,2±0,2 путем добавления 0,25% соляной кислоты (pH: 7,19) или органических кислот (OM314А): муравьиной кислоты 1/100 (pH: 7,16), уксусной кислоты 1/100 (pH: 7,20), пировиноградной кислоты (pH: 7,12), 3-гидроксибутановой кислоты 1/100 (pH: 7,17), молочной кислоты 1/100 (pH: 7,19), 0,1% глутаминовой кислоты (pH: 7,09), пропионовой кислоты 1/100 (pH: 7,11), чистой аскорбиновой кислоты (pH: 7,20)). И наконец, различные продукты стерилизовали в биозащитном шкафу посредством фильтрации на полиэфирсульфоновой (PES) стерилизующей 0,2 мкм-мембране.
На этой стадии отбирали образец, соответствующий различным нейтрализованным фильтратам по окончании процесса (называемого «процесс 1-E4-нейтрализованный фильтрат (название кислоты)», ОМ314А).
Таблица 16: Систематизированный список образцов:
Пример 1.9.2. Аналитическая характеризация
Методы анализа описаны в 1.6.2.
а) Результаты при получении
Растворы E2-фильтрата замораживали после обработки и оттаивали при 4°C в течение ночи перед анализом.
Таблица 17: Процесс 1 - Результаты анализов
ND=не детектировали; * LAL на эндотоксин: предел детектирования=0,1 ЭЕ/мл; ** ДНК: предел детектирования=3,60 мкг/мл, предел количественной оценки=12,01 мкг/мл; *** РНК: предел детектирования=4,29 мкг/мл, предел количественной оценки=14,32 мкг/мл.
Таблица 18: Процесс 1 - Общие аминокислоты после кислотного гидролиза
Результаты спектрофотометрической оценки, полученные во время анализа на стабильность
Таблица 19: Процесс 1 - стабильность раствора, оцененная путем измерения оптической плотности
Abs: оптическая плотность на 320 нм; RT: комнатная температура (20°C±5°C); Оценка: визуальная оценка спектра
Промышленная партия 1619064, описанная в WO 2008/109669, была нейтрализована соляной кислотой и давала осадок, выпадающий уже на Т0. За исключением аскорбиновой кислоты, Процесс 1 - E4 - нейтрализованные фильтраты были физически стабильными при 4°C или комнатной температуре в течение по меньшей мере 3 месяцев.
b) Результаты для Mip3-альфа (CCL20), полученные во время стабилизации:
Фигура 29: Результаты бионализа Процесса 1 во время анализа на стабильность показали, что Процесс 1-E3-нейтрализованный фильтрат обладал сравнимой биоактивностью в отношении секреции MIP-3α на ТНР-1 по меньшей мере в течение 4 месяцев при комнатной температуре (20°C±5°C) или при 4°C. Образцы Процесса 1 на Т0 сравнивали с образцами на Т4, хранящимися при 4°C и при комнатной температуре (КТ) в течение 4 месяцев.
Пример 1.9. Haemophilus inflenzae 8467 (OM314A)
Пример 1.10.1 Процесс 2: Haemophilus influenzae 8467
Лизис: 13396 кг биомассы Haemophilus influenza 8467 (партия 1419110 - блоки 10, 11, 12 и 13) оттаивали в течение ночи при комнатной температуре в сосуде для лизиса. Затем добавляли 692 г 10н NaOH и 12920 г раствора NaCl в концентраци 8 г/л с получением общей массы лизиса 27008 г. Культуру после щелочного лизиса переносили в теплое помещение при 37°C±2,5°C при перемешивании со скоростью 150±5 об/мин в течение 5 дней. После лизиса в течение 3 часов±30 минут регулировали OD J0. Образец 200-кратно разводили и данные считывали на спектрофотометре на 700 нм (считываемая OD: 0,273 и конечная OD: 54,6). Каждый рабочий день проводили перемешивание (150 об/мин±5 об/мин) в теплом помещении при комнатной температуре (37,0°C±2,5°C) и регулировали pH (J1 pH: 11,87/J2 pH: 11,74/J5 pH: 11,45). Если значение pH не входило в рабочий диапазон, то необходимо было его скорректировать путем добавления 10н NaOH (J1: 20 мл 10н NaOH/J2: 20 мл 10н NaOH). По окончании лизиса регулировали OD J8. Образец раводили 100 раз и считывали на спектрофотометре на 700 нм (считываемая OD: 0,169 и конечная OD: 16,9). OD-дельта между J0 и J5 должна превышать 13,1 (OD-дельта: 37,7). Часть этого лизата Haemophilus influenza 8467 была восстановлена и хранилась в миниконтейнере емкостью 2500 мл (эталон: Semadeni n° 6863). На этой стадии отбирали образец, соответствующий лизату по окончании лизиса (называемый «процесс 2-E1-лизат»).
Фильтрация 1: Установка для фильтрации продукта была подготовлена как показано на диаграмме (Фигура 2). Система фильтрации состоит из 2 контуров фильтрации. Первый фильтр для микрофильтрации (называемый MF) состоял из резервуара (сосуда 2 на фигуре 2), насоса (насоса 1 на фигуре 2) и системы фильтрации с точкой отсечки 0,45 мкм (микрофильтра на фигуре 2). Второй контур для ультрафильтрации (называемый UF) состоял из резервуара (сосуда 3 на фигуре 2), насоса (насоса 2 на фигуре 2) и системы фильтрации с точкой отсечки 10 кДа (фильтра для ультрафильтрации на фигуре 2). Фильтрацию осуществляли в лабораторном масштабе с рабочим объемом 2000 мл.
Перед запуском этого процесса, система фильтрации была проверена на воспроизводимость для нескольких партий. Чтобы проверить правильность фильтруемости продукта, в системе фильтрации была проведена NWP (нормализованная оценка на водопроницаемость).
Лизат, используемый для получения, сначала разводили 4 раза очищенной водой (499,9 г лизата и 1500,2 г очищенной воды). Продукт перемешивали до получения вихревого 1 см-продукта. Температуру продукта понижали до комнатной до тех пор, пока не начинался процесс фильтрации. В этом процессе, рН не корректировали, а поэтому процесс фильтрации начинали сразу.
Начальная стадия концентрирования: Продукт, используемый на первой стадии фильтрации, имел следующие параметры: (pH: 11,23), температура 32°C, перемешивание до получения вихревого 1 см-продукта. Контурный насос MF (насос 1 на фигуре 2) был запущен на 40% скорости для этого процесса, для того, чтобы заполнить систему продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре MF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяет кондиционировать гидрофильную систему фильтрации, удаляя пузырьки воздуха, присутствующие в системе.
Когда скорость потока и давление были стабильными, система фильтрации считалась кондиционированной. Затем открывали клапан контура MF с пермеатом для проведения начального концентрирования продукта с коэффициентом концентрации 0,5 (давление на входе: 325 мбар, скорость потока пермеата: 45 мл/мин). Во время первоначального концентрирования, скорость насоса (насоса 1 на фигуре 2) постепенно увеличивали до 100% (100 об/мин, что соответствует 600 мл/мин) от скорости процесса.
Параллельно с этой стадией кондиционировали контур для UF. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% от скорости процесса для загрузки системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
Диафильтрация: Когда был достигнут коэффициент концентрации, равный 0,5, устройство UF с пермеатом открывали для запуска диафильтрации продукта (давление на входе: 880 мбар, скорость потока пермеата: 63 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапаном 1 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 1163 мбар, скорость потока пермеата: 68 мл/мин.).
Во время диафильтрации, скорость насоса для ультрафильтрации (насоса 2 на фигуре 2) была установлена так, чтобы поток пермеата при UF был равен потоку пермеата при MF. Действительно, объем резервуара для MF (сосуда 2 на фигуре 2) должен был оставаться максимально стабильным во время стадии диафильтрации.
Диафильтрацию проводили циклически. По окончании первоначального концентрирования, в резервуаре для MF присутствовал определенный объем (сосуд 2 на фигуре 2). После прохождения этого объема через систему фильтрации MF был реализован один цикл. В этом процессе, для диафильтрации потребовалось 5 циклов.
Конечное концентрирование: По окончании 5 циклов диафильтрации, насос для UF был остановлен. Когда давление на входе MF начинало увеличиваться, то насос для MF был остановлен. По окончании этой первой стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм.
Фильтрация 2: Представляющий интерес продукт собирали (масса: 1039,1 г), а затем подвергали второй стадии из 5 циклов очистки на UF-контуре с отсечкой 10 кДа (сосуд 3, насос 2 и фильтр для ультрафильтрации на фигуре 2). Пермеат был удален в отходы как указано на фигуре 2. Постоянный объем поддерживали во время этой второй стадии фильтрации для очистки путем добавления 0,001 н раствора NaOH при pH 10,0.
Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% скорости процесса для заполнения системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
После кондиционирования системы фильтрации, устройство UF с пермеатом открывали для начала фильтрации 2 продукта (давление на входе: 650 мбар, скорость потока пермеата: 44 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапанами 2 и 3 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 960 мбар, скорость потока пермеата: 72 мл/мин.).
Во время стадии фильтрации 2, объем резервуара для UF (сосуд 3 на фигуре 2) должен был оставаться как можно более стабильным. Таким образом, по мере того, как уровень в резервуаре для UF (сосуд 3 на фигуре 2) снижался, в него добавляли раствор NaOH. Эти 5 циклов, соответствующие объему добавленного раствора NaOH, были эквивалентны 5-кратному объему собранного представляющего интерес продукта.
По окончании 2-ой стадии фильтрации собирали конечный продукт (масса: 1033,9 г), а затем его разделяли на 2 равные части. По окончании этой второй стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм и более 10 кДа.
На этой стадии отбирали образец, соответствующий фильтрату до нейтрализации (называемый «процесс 2-E2-фильтрат»).
Затем первую часть фильтрата нейтрализовали пропионовой кислотой 1/100 при pH 7,2±0,2 (pH 7,18, доведенный путем добавления 4,2 мл пропионовой кислоты 1/100), и стерилизовали в биозащитном шкафу путем фильтрации через полиэфирсульфоновую стерилизующую 0,2 мкм-мембрану (PES 0,2 мкм).
На этой стадии отбирали образец, соответствующий нейтрализованному фильтрату по окончании процесса (называемый «процесс 2-E3-нейтрализованный фильтрат (пропионовая кислота)» ОМ314А).
В это время, вторую часть фильтрата разделяли на 9 равных частей. После этого, каждую из этих частей нейтрализовали при 7,2±0,2 путем добавления 0,25% соляной кислоты (pH: 7,09) или органических кислот (OM314А): муравьиной кислоты 1/100 (pH: 7,13), уксусной кислоты 1/100 (pH: 7,20), пировиноградной кислоты 1/100 (pH: 7,15), 0,1% аспарагиновой кислоты (pH: 7,12), молочной кислоты 1/100 (pH: 7,19), 0,1% глутаминовой кислоты (pH: 7,21), 3-гидроксибутановой кислоты 1/100 (pH: 7,16), чистой аскорбиновой кислоты (pH: 7,25)). И наконец, различные продукты стерилизовали в биозащитном шкафу посредством фильтрации на полиэфирсульфоновой (PES) стерилизующей 0,2 мкм-мембране.
На этой стадии отбирали образец, соответствующий различным нейтрализованным фильтратам по окончании процесса (называемого «процесс 2-E4-нейтрализованный фильтрат (название кислоты)».
Таблица 20: Систематизированный список кодов образцов:
Пример 1.10.2. Аналитическая характеризация
Методы анализа описаны в 1.6.2.
Результаты при получении (Т0):
Растворы E2-фильтрата замораживали после обработки и оттаивали при 4°C в течение ночи перед анализом.
Таблица 21: Процесс 2 - Результаты анализов
ND=не детектировали; * LAL на эндотоксин: предел детектирования=0,1 ЭЕ/мл; ** ДНК: предел детектирования=3,60 мкг/мл, предел количественной оценки=12,01 мкг/мл; *** РНК: предел детектирования=4,29 мкг/мл, предел количественной оценки=14,32 мкг/мл.
Таблица 22: Процесс 2 - Общие аминокислоты после кислотного гидролиза
a) Результаты для Mip3-альфа (CCL20), полученные во время стабилизации:
Фигура 30: Результаты бионализа Процесса 2 во время анализа на стабильность показали, что Процесс 2-E3-нейтрализованный фильтрат обладал сравнимой биоактивностью в отношении секреции MIP-3α на ТНР-1 по меньшей мере в течение 4 месяцев при комнатной температуре (20°C±5°C) или при 4°C. Образцы Процесса 2 на Т0 были сравнимы с образцами на Т4, хранящимися при 4°C и при комнатной температуре (КТ) в течение 4 месяцев.
Пример 1.11-30 кДа-экстракт бактериального лизата 21 штамма (BE30kD, OM314A)
Пример 1.11.1. Процесс 6: 30 кДа-экстракт бактериального лизата 21 штамма (BE30kD, OM314A)
Лизис: Часть бактериального полилизата 21 штамма (промышленная партия 1619064, описанная как лизат 21 штамма в WO 2008/109669) была выделена при продуцировании и хранилась в миниконтейнере емкостью 2500 мл (эталон: Semadeni n° 6863).
Фильтрация 1: Установка для фильтрации продукта была подготовлена как показано на диаграмме (Фигура 2). Система фильтрации состоит из 2 контуров фильтрации. Первый фильтр для микрофильтрации (называемый MF), состоял из резервуара (сосуда 2 на фигуре 2), насоса (насоса 1 на фигуре 2) и системы фильтрации с точкой отсечки 0,45 мкм (микрофильтра на фигуре 2). Второй контур для ультрафильтрации (называемый UF) состоял из резервуара (сосуда 3 на фигуре 2), насоса (насоса 2 на фигуре 2) и системы фильтрации с точкой отсечки 30 кДа (фильтра для ультрафильтрации на фигуре 2). Фильтрацию осуществляли в лабораторном масштабе с рабочим объемом 2000 мл.
Перед запуском этого процесса, система фильтрации была проверена на воспроизводимость для нескольких партий. Чтобы проверить правильность фильтруемости продукта, в системе фильтрации была проведена NWP (нормализованная оценка на водопроницаемость).
Лизат, используемый для получения, сначала разводили 2 раза очищенной водой (1000,2 г лизата и 1000,1 г очищенной воды). Продукт перемешивали до получения вихревого 1 см-продукта. Температуру продукта понижали до комнатной до тех пор, пока не начинался процесс фильтрации. В этом процессе, рН доводили до 10,5-10,8 (pH 10,73, скорректированный путем добавления чистой аспарагиновой кислоты).
Начальная стадия концентрирования: Продукт, используемый на первой стадии фильтрации, имел следующие параметры: (pH: 10,73), температура 25°C, перемешивание до получения вихревого 1 см-продукта. Контурный насос MF (насос 1 на фигуре 2) был запущен на 40% скорости для этого процесса для того, чтобы заполнить систему продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре MF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяет кондиционировать гидрофильную систему фильтрации, удаляя пузырьки воздуха, присутствующие в системе.
Когда скорость потока и давление были стабильными, система фильтрации считалась кондиционированной. Затем открывали клапан контура MF с пермеатом для проведения начального концентрирования продукта с коэффициентом концентрации 0,5 (давление на входе: 235 мбар, скорость потока пермеата: 52 мл/мин). Во время первоначального концентрирования, скорость насоса (насоса 1 на фигуре 2) постепенно увеличивали до 100% (100 об/мин, что соответствует 600 мл/мин) от скорости процесса.
Параллельно с этой стадией кондиционировали контур для UF. Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% от скорости процесса для загрузки системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
Диафильтрация: Когда был достигнут коэффициент концентрации, равный 0,5, устройство UF с пермеатом открывали для запуска диафильтрации продукта (давление на входе: 734 мбар, скорость потока пермеата: 52 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапаном 1 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 1010 мбар, скорость потока пермеата: 48 мл/мин.).
Во время диафильтрации, скорость насоса для ультрафильтрации (насоса 2 на фигуре 2) была установлена так, чтобы поток пермеата при UF был равен потоку пермеата при MF. Действительно, объем резервуара для MF (сосуда 2 на фигуре 2) должен был оставаться максимально стабильным во время стадии диафильтрации.
Диафильтрацию проводили циклически. По окончании первоначального концентрирования, в резервуаре для MF присутствовал определенный объем (сосуд 2 на фигуре 2). После прохождения этого объема через систему фильтрации MF был реализован один цикл. В этом процессе, для диафильтрации потребовалось 5 циклов.
Конечное концентрирование: По окончании 5 циклов диафильтрации, насос для UF был остановлен. Когда давление на входе MF начинало увеличиваться, то насос для MF был остановлен. По окончании этой первой стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм.
Фильтрация 2: Представляющий интерес продукт собирали (масса: 1179,6 г), а затем подвергали второй стадии из 5 циклов очистки на UF-контуре с отсечкой 30 кДа (сосуд 3, насос 2 и фильтр для ультрафильтрации на фигуре 2). Пермеат был удален в отходы как указано на фигуре 2. Постоянный объем поддерживали во время этой второй стадии фильтрации для очистки путем добавления 0,001 н раствора NaOH при pH 10,3.
Насос контура для UF (насос 2 на фигуре 2) был запущен на 40% скорости процесса для заполнения системы продуктом. После завершения этой стадии начинали рециркуляцию продукта в контуре для UF, и скорость насоса регулярно увеличивали до 75% от скорости процесса. Рециркуляция позволяла кондиционировать гидрофильную систему фильтрации с удалением пузырьков воздуха, присутствующих в системе.
После кондиционирования системы фильтрации, устройство UF с пермеатом открывали для начала фильтрации 2 продукта (давление на входе: 670 мбар, скорость потока пермеата: 67 мл/мин). Для оптимальной экстракции продукта, TMP MF (трансмембранное давление), которое регулировалось клапанами 2 и 3 на фигуре 2, должно быть установлено на 850 мбар (давление на входе: 920 мбар, скорость потока пермеата: 88 мл/мин.).
Во время стадии фильтрации 2, объем резервуара для UF (сосуд 3 на фигуре 2) должен был оставаться как можно более стабильным. Таким образом, по мере того, как уровень в резервуаре для UF (сосуд 3 на фигуре 2) снижался, в него добавляли раствор NaOH. Эти 5 циклов, соответствующие объему добавленного раствора NaOH, были эквивалентны 5-кратному объему собранного представляющего интерес продукта.
По окончании 2-ой стадии фильтрации собирали конечный продукт (масса: 1070,5 г). По окончании этой второй стадии фильтрации, представляющий интерес продукт содержал элементы размером менее 0,45 мкм и более 30 кДа.
Затем фильтрат нейтрализовали 0,1% аспарагиновой кислотой при pH 7,2±0,2 (pH: 7,19, доведенный путем добавления 180 мл 0,1% аспарагиновой кислоты), а затем стерилизовали в биозащитном шкафу посредством фильтрации через полиэфирсульфоновую стерилизующую 0,2 мкм-мембрану (PES 0,2 мкм).
На этой стадии отбирали образец, соответствующий нейтрализованному фильтрату по окончании процесса (называемый «процесс 6-E3-нейтрализованный фильтрат (аспарагиновая кислота)» ОМ314А).
Пример 2: Стабильные композиции для интраназального введения, интратрахеального введения, введения путем ингаляции и периорального введения.
Пример 2.1: Интраназальная композиция стабилизированного бактериального экстракта OM314A.
Высокомолекулярную фракцию (>10 кД) бактериального экстракта OM314A, стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 5 мг сухой массы/мл (в интервале от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций) и стерилизовали фильтрацией на 0,2 мкм-фильтре. Конечный раствор добавляли в сосуд с медицинским устройством для интраназального распыления (10 мл, в интервале от 1 до 25 мл) с типичной дозой 0,05 мл, содержащей 0,25 мг стабилизированного органической кислотой бактериального экстракта OM (в интервале от 0,025 до 0,1 мл на дозу).
Терапевтическая доза: с использованием этих композиций может быть получена разовая суточная доза, а также вводимая 2 раза в день доза от 0,025 до 0,1 мл на прием, содержащая от 0,05 до 1 мг экстракта.
Пример 2.2: Композиция стабилизированного бактериального экстракта Lactobacillus fermentum 20 (OM314B) для интраназального введения
Высокомолекулярную фракцию (>10 кДа) бактериального экстракта Lactobacillus fermentum (OM314В), стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 5 мг сухой массы/мл (в пределах от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций) и стерилизовали фильтрацией на 0,2 мкм-фильтре. Конечный раствор добавляли в сосуд с медицинским устройством для интраназального распыления (10 мл, в пределах от 1 до 25 мл) с типичной дозой 0,05 мл, содержащей 0,25 мг стабилизированного органической кислотой очищенного бактериального экстракта Lactobacillus fermentum (в пределах от 0,025 до 0,1 мл на дозу).
Терапевтическая доза: с использованием этих композиций может быть получена разовая суточная доза, а также вводимая 2 раза в день доза от 0,025 до 0,1 мл на прием, содержащая от 0,05 до 1 мг экстракта.
Пример 2.3: Композиция стабилизированного бактериального экстракта Escherichia coli (OM314С) для интраназального введения
Высокомолекулярную фракцию (>10 кДа) бактериального экстракта Escherichia coli, стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 5 мг сухой массы/мл (в пределах от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций) и стерилизовали фильтрацией на 0,2 мкм-фильтре. Конечный раствор добавляли в сосуд с медицинским устройством для интраназального распыления (10 мл, в пределах от 1 до 25 мл) с типичной дозой 0,05 мл, содержащей 0,25 мг стабилизированного органической кислотой очищенного бактериального экстракта Escherichia coli (в пределах от 0,025 до 0,1 мл на дозу).
Терапевтическая доза: с использованием этих композиций может быть получена разовая суточная доза, а также вводимая 2 раза в день доза от 0,025 до 0,1 мл на прием, содержащая от 0,05 до 1 мг экстракта.
Пример 2.4: Композиция стабилизированного бактериями экстракта OM314A для ингаляции, вводимая в виде жидкого капельного спрея.
Высокомолекулярную фракцию (>10 кД) бактериального экстракта OM314А, стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 5 мг сухой массы/мл (в пределах от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций) и стерилизовали фильтрацией на 0,2 мкм-фильтре. Конечный раствор добавляли в сосуд с медицинским устройством для ингаляции спрея (10 мл, в пределах от 1 до 25 мл) с типичной дозой 0,1 мл, содержащей 0,5 мг стабилизированного органической кислотой бактериального экстракта ОМ (в пределах от 0,05 до 0,4 мл на дозу).
Терапевтическая доза: с использованием этих композиций может быть получена разовая суточная доза, а также вводимая 2 раза в день доза от 0,05 до 0,4 мл на прием, содержащая от 0,05 до 8 мг экстракта.
Пример 2.5: Композиция стабилизированного бактериального экстракта Lactobacillus fermentum (OM314В) для ингаляции, вводимая в виде жидкого капельного спрея.
Высокомолекулярную фракцию (>10 кД) бактериального экстракта Lactobacillus fermentum (OM314В), стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 5 мг сухой массы/мл (в пределах от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций) и стерилизовали фильтрацией на 0,2 мкм-фильтре. Конечный раствор добавляли в сосуд с медицинским устройством для ингаляции спрея (10 мл, в пределах от 1 до 25 мл) с типичной дозой 0,1 мл, содержащей 0,5 мг стабилизированного органической кислотой очищенного бактериального экстракта Lactobacillus fermentum (в пределах от 0,05 до 0,4 мл на дозу).
Терапевтическая доза: с использованием этих композиций может быть получена разовая суточная доза, а также вводимая 2 раза в день доза от 0,05 до 0,4 мл на прием, содержащая от 0,05 до 8 мг экстракта.
Пример 2.6: Композиция стабилизированного бактериального экстракта OM314A в виде твердых частиц, вводимая путем ингаляции
Высокомолекулярную фракцию (>10 кД) бактериального экстракта OM314А, стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 10 мг сухой массы/мл (в пределах от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций), добавляли один или более наполнителей из списка* и стерилизовали фильтрацией на 0,2 мкм-фильтре. В одном примере, раствор 10 мг/мл бактериального экстракта смешивали с маннитом (25 мг/мл), лактозой (25 мг/мл) и стеаратом магния (1 мг/мл).
После распылительной сушки, порошок спрессовывали в таблетки (таблетки по 12 мг). Измельчаемые таблетки были помещены в медицинское устройство (размер частиц от 1 до 7 мкм), а доза для ингаляции таблетки 12 мг содержала 2 мг бактериального экстракта.
Типичными наполнителями для ингаляции являются, но не ограничиваются ими: лактоза, глюкоза, маннит, трегалоза, стеарат магния, DPPC, DSPC, DMPC, холестерин, лейцин, трилейцин, полоксамер, соли желчных кислот, хитозан, триметилхитозан, PLGA (для обзора см. G. Pilcer, K. Amighi, International Journal of Pharmaceutics, 2010, 392, 1-19).
Пример 2.7: Композиция стабилизированного бактериального экстракта Lactobacillus fermentum (OM314В) в виде твердых частиц, вводимая путем ингаляции
Высокомолекулярную фракцию (>10 кД) бактериального экстракта Lactobacillus fermentum (OM314В), стабилизированного органической кислотой, доводили до pH 7,5 при конечной концентрации 10 мг сухой массы/мл (в пределах от 1 до 20 мг/мл) с использованием стерильного физиологического раствора (0,9% NaCl в воде для инъекций), добавляли один или более наполнителей из списка* и стерилизовали фильтрацией на 0,2 мкм-фильтре. В одном примере, раствор 10 мг/мл бактериального экстракта смешивали с маннитом (25 мг/мл), лактозой (25 мг/мл) и стеаратом магния (1 мг/мл).
После распылительной сушки, порошок спрессовывали в таблетки (таблетки по 12 мг). Измельчаемые таблетки были помещены в медицинское устройство (размер частиц от 1 до 7 мкм), а доза для ингаляции таблетки 12 мг содержала 2 мг бактериального экстракта.
Типичными наполнителями для ингаляции являются, но не ограничиваются ими: лактоза, глюкоза, маннит, трегалоза, стеарат магния, DPPC, DSPC, DMPC, холестерин, лейцин, трилейцин, полоксамер, соли желчных кислот, хитозан, триметилхитозан, PLGA (для обзора см. G. Pilcer, K. Amighi, International Journal of Pharmaceutics, 2010, 392, 1-19).
ПРИМЕР 3: Подтверждение более высокой стабильности новых композиций бактериального экстракта.
Экстракты, полученные как описано в Примерах 1.1, 1.2, 1.3, 1.4 и композиции в соответствии с примерами 2.1, 2.2, 2.3, 2.4, 2.5, доводили до рН 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6 с использованием различных органических кислот, выбранных из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты и их комбинаций.
Стабильность 10 бактериальных экстрактов, хранившихся при 5°C±3°C и при комнатной температуре от 20°C до 25°C, визуально наблюдали на наличие осадка в различные моменты времени, начиная со дня 0 (через 15-120 минут после корректировки pH) и через 30, 60, 90, 180, 360 дней.
Количественную оценку осуществляли с помощью спектрофотометрии в видимой области спектра путем измерения оптической плотности на 550, 600, 650, 700 нм, определенной в различные моменты времени со дня 0 (через 15-120 минут после корректировки pH) и через 30, 60, 90, 180, 360 дней. Спектрофотометрию проводили с использованием водного образца.
Стабильность, выражаемая как изменение оптической плотности, зависит от способа, от используемой органической кислоты или комбинации органических кислот, а также от конечного значения pH.
ПРИМЕР 4: Профилактическая и терапевтическая эффективность интраназального введения ОМ по сравнению с его пероральным введением животному с моделью сублетальной бактериальной инфекции после первичного инфицирования вирусом гриппа.
Стабильная периоральная форма бактериального экстракта OM (бактериального экстракта из лизатов 21 штамма) была получена для немедленного приема в целях экспериментального тестирования периорального введения бактериального экстракта OM на животных-моделях. Эта периоральная форма для немедленного приема была стабильной в течение длительного периода времени, но результаты, давали очевидные и подтвержденные значительные терапевтические преимущества периоральных введений.
Эффективность интраназального введения бактериального экстракта ОМ для немедленного периорального приема в отношении снижения титра вируса в ткани легких после инфицирования вирусом гриппа и (2) снижения заболеваемости и смертности суперинфицированных животных (животных, получавших сублетальную вирусную инфекцию гриппа с последующей сублетальной бактериальной инфекцией), сравнивали с эффективностью перорального введения бактериального экстракта OM (фигура 3).
Самок мышей BALB/C (8-недельных, Charles River Laboratories) анестезировали путем внутрибрюшинной инъекции кетамина и ксилазола и интраназально инокулировали 100 БОЕ штамма вируса гриппа A/штамма Пуэрто-Рико 8/34 в объеме 50 мкл PBS. На 6-й день после инфицирования гриппом было начато культивирование заквасочных бактериальных культур с последующим их размножением до логарифмической фазы роста на 7-й день после заражения гриппом.
Для перорального введения, 320 мкл концентрата ОМ вводили через зонд с получением 360 мг/кг активного вещества лиофилизата ОМ на животное/день, что позволяло ежедневно вводить 7,2 мг активного вещества на мышь (фигура 3). Для интраназального введения ЛПС (в рамках создания модели ХОБЛ), используемая доза составляла 7 микрограммов ЛПС на дозу, вводимую в нос. В литературе сообщалось, что введение 1 микрограмма ЛПС в нос обеспечивало защиту от аллергического воспаления. График испытаний кратко изложен в нижеследующей таблице 23:
Таблица 23:
штамм гриппа H1N1 PR/8/34)
Статистический анализ проводили с использованием программы GraphPad Prism версии 5.0d. Вирусную нагрузку оценивали с помощью t-критерия Стьюдента. Был проведен двухфакторный анализ ANOVA для определения массы тела, температуры и клинических параметров.
Были построены кривые сравнения по выживаемости. В целом, обработка бактериальным экстрактом OM защищала мышей с моделью суперинфекции от заболеваемости и смертности. Этот защитный эффект был наиболее заметен при интраназальном введении, что свидетельствует о том, что введение бактериального экстракта ОМ через слизистую может значительно улучшить его эффективность (фигуры 4 и 5) и устранить сопутствующую патологию после вторичной бактериальной инфекции (фигура 6).
ПРИМЕР 5: Профилактическая эффективность интраназального и интратрахеального введения бактериального экстракта ОМ животному с моделью сублетальной бактериальной инфекции после первичного инфицирования вирусом гриппа.
Это исследование, описанное на Фигуре 7, доказало эффективность интраназального и интратрахеального введения бактериального экстракта OM (бактериального экстракта из лизатов 21 штамма) в качестве профилактического лечения для (1) снижения титра вируса в ткани легких после инфицирования вирусом гриппа (Фигура 8), и (2) снижения заболеваемости и смертности суперинфицированных животных (животных, инфицированных сублетальной дозой вируса гриппа с последующим сублетальным бактериальным инфицированием), о чем свидетельствуют клинические оценки (фигуры 10 и 12). Были протестированы две различные дозы бактериального экстракта OM: доза A (50 микрограммов активного ингредиента на введение) и доза B (5 микрограммов активного ингредиента на введение).
Самок мышей BALB/c (8-недельных, Charles River Laboratories) внутрибрюшинно анестезировали инъекцией кетамина и ксилазола и интраназально инокулировали 100 БОЕ штамма гриппа A/Пуэрто-Рико8/34 в объеме PBS.
Мышей разделяли на 6 групп по 15 животных в каждой. Группе 1 вводили капли физиологического раствора интраназально (i.n.) на дни 7, 5 и 3 (профилактический контроль). Группе 2 вводили профилактическую дозу А бактериального экстракта ОМ интраназально на дни 7, 5 и 3. Группе 2 вводили профилактическую дозу B бактериального экстракта ОМ интраназально (i.n.) на дни -7, -5 и -3. Группе 4 вводили физиологическиий раствор в виде спрея интратрахеально (i.t.) на дни -7, -5 и -3. Группе 5 вводили профилактическую дозу А бактериального экстракта ОМ интратрахеально на дни -7, -5 и -3. Группе 6 вводили профилактическую дозу B бактериального экстракта ОМ интратрахеально на дни -7, -5 и -3.
Бактериальный экстракт ОМ вводили вместе с 50 микрограммами активного ингредиента (доза А, содержащая 2,2 микролитра концентрата бактериального экстракта ОМ) и с 5 микрограммами активного ингредиента (доза В, содержащая 0,22 микролитра концентрата бактериального экстракта ОМ) на мышь/на момент времени.
На 6-й день после инфицирования вирусом гриппа было начато культивирование заквасочных бактериальных культур с последующим их размножением до логарифмической фазы роста на 7-й день после заражения гриппом.
Протокол исследования и схема введения доз показаны на Фигуре 7, а также в нижеследующей таблице 24.
Таблица 24:
летальности через 2 или 3 дня до полного выздоровления животных (всех оставшихся животных).
Животных анестезировали путем внутрибрюшинной инъекции кетамина и ксилазола, и бактериальный экстракт ОМ, разведенный в физиологическом растворе, вводили интраназально или интратрахеально либо вместе с 50 микрограммами активного ингредиента (доза А, содержащая 2,2 микролитра концентрата бактериального экстракта ОМ), либо вместе с 5 микрограммами активного ингредиента (доза B, содержащая 0,22 микролитра концентрата бактериального экстракта OM) в общем объеме 50 микролитров.
Животных анестезировали путем внутрибрюшинной инъекции кетамина и ксилазола, и бактериальный экстракт ОМ, разведенный в физиологическом растворе, вводили интраназально или интратрахеально либо вместе с 50 микрограммами активного ингредиента (доза А, содержащая 2,2 микролитра концентрата бактериального экстракта ОМ), либо вместе с 5 микрограммами активного ингредиента (доза B, содержащая 0,22 микролитра концентрата бактериального экстракта OM) в общем объеме 50 микролитров.
Статистический анализ проводили с использованием программы GraphPad Prism версии 5.0d. Вирусную нагрузку оценивали с помощью t-критерия Стьюдента. Был проведен двухфакторный анализ ANOVA для определения массы тела, температуры и клинических параметров.
Были построены кривые сравнения по выживаемости (фигуры 8 и 10).
Профилактическое лечение животных путем интраназального введения бактериального экстракта OM (доза B OM, I.N. 5 микрограммов и доза A OM I.N. 50 микрограммов) приводило к снижению титра вируса в ткани легких, оцененному через 5 дней после инфицирования PR8 (фигура 8). Это снижение было еще более преобладающим при дозе 50 микрограммов бактериального экстракта ОМ, вводимого интраназально, в то время как при интратрахеальном введении, 5 микрограммов было достаточно для удаления вирусных частиц.
Подобно результатам, полученным для титров вирусов, профилактическое интраназальное введение бактериального экстракта ОМ приводило к значительному снижению заболеваемости и смертности после бактериальной инфекции, вызываемой вирусом гриппа. 50 микрограммов дозы бактериального экстракта ОМ, вводимой в нос, давало 90% выживаемостиь (доза А ОМ I.N.), 5 микрограммов дозы бактериального экстракта ОМ, вводимой в нос, давало 40% выживаемостиь (доза В ОМ I.N.), тогда как интраназальное введение физиологического раствора в качестве контроля (физиологическиий раствор, I.N.) не обеспечивало защиту животных, которые умерли на 6-й день после инфицирования (фигура 9). По сравнению с результатами по выживаемости, клиническая оценка по смертности и потеря массы тела были значительно ниже у животных, получавших дозу 50 микрограммов бактериального экстракта OM, по сравнению с животными, получавшими физиологический раствор (фигура 9). Соответственно, у животных, получавших дозу 50 микрограммов бактериального экстракта ОМ, и у животных получавших дозу 5 микрограммов, эта клиническая оценка была лучше, а потеря массы была ниже по сравнению с контрольными животными, получавшими физиологическиий раствор, но в случае интраназальной дозы 5 микрограммов, эффективность этой дозы была ниже.
У животных, которым проводили профилактическую интратрахеальную обработку бактериальным экстрактом OM в дозе 5 микрограммов, наблюдалось наибольшее снижение титра вируса в ткани легких, измеренного через 5 дней после инфицирования PR8, по сравнению с титром вируса, обнаруженным у животных, обработанных контрольным физиологическим раствором интратрахеально (фигура 8). Что касается заболеваемости и смертности, то интратрахеальная обработка бактериальным экстрактом OM в дозе 50 микрограммов (в дозе A OM, I.T.), и в дозе 5 микрограммов (в дозе B OM, I.T.) приводила к повышению выживаемости (на 70%) по сравнению с контрольными животными, получавшими физиологический раствор (30%); при этом, эффект был пропорционален полученной дозе, вплоть до 10-го дня (фигура 11). В совокупности, клиническая оценка в баллах была одинаково низкой для животных, которым интратрахеально вводили бактериальный экстракт ОМ в дозе 50 микрограммов и 5 микрограммов по сравнению с контрольной группой, которой вводили физиологический раствор (фигура 12).
В целом, профилактическое введение бактериального экстракта ОМ через нос приводило к значительному снижению заболеваемости и смертности суперинфицированных животных и к снижению титра вируса в ткани легких после инфицирования вирусом гриппа. Этот результат был особенно очевиден после курса введения бактериального экстракта OM в дозе 50 микрограммов интраназально. Удивительно то, что профилактическое введение бактериального экстракта OM интратрахеально приводило к еще большему снижению заболеваемости и смертности и даже с более высокой эффективностью при использовании дозы 5 микрограммов, что можно объяснить более глубоким воздействием на поверхность легких.
Эти результаты ясно продемонстрировали, что как интраназальное, так и интратрахеальное введение представляют собой высокоэффективные пути введения для терапевтического лечения респираторных заболеваний, таких, как астма, ХОБЛ и заболевания, вызываемые другими патогенами, с использованием бактериального экстракта ОМ.
ПРИМЕР 6: Новая схема лечения посредством интраназального введения бактериального экстракта согласно изобретению животному с моделью сублетальной инфекции гриппа
Это исследование (фигура 13) выявило эффективность интраназального введения бактериального экстракта OM для немедленного приема (бактериального экстракта лизатов от 21 штамма) с точки зрения снижения титра вируса в ткани легких после инфицирования вирусом гриппа. Это исследование также подтвердило зависимость ответа от дозы бактериального экстракта ОМ. В этом исследовании было также проведено сравнение двух различных схем приема нескольких доз (6 доз и 3 доз), а также сравнение схемы интраназального введения и перорального введения. Самки 7-недельных мышей BALB/с (не содержащих конкретного патогена; SPF) были закуплены у Charles River Laboratories и произвольно распределены по клеткам всего по 5 мышей на клетку. Мышей еженедельно наблюдали и оставляли для акклиматизации к условиям содержания за 7 дней до начала исследования (день исследования 0). В день исследования 0, возраст животных составлял 8 недель. Питьевая вода и корм были доступны ad libitum. Мышей разделили на 13 групп: группы с 1 по 11 получали активное вещество, бактериальный экстракт ОМ (ОМ), интраназально. Группе 12 вводили воду в качестве контроля (320 мкл воды в качестве контроля, перорально, ежедневно, со дня -10 до дня -1), а группе 13 вводили негативный контроль (только суб-летальную дозу вируса гриппа). В Таблицах 25 и 26 показаны различные группы и протоколы введения, схематически представленные на Фигуре 13.
Таблица 25 :
Таблица 26:
средство
(мкл)
(мкг)
-3
-3
-3
-3
-3
i.n.= интраназально; p.o. = перорально
На дни, указанные выше в протоколе исследования, мышей анестезировали с использованием прокалиброванной системы испарителей (VIP300, Provet, Vet. Med Center, Lyssach, CH), доставляющей анестетик, изофлуоран (Provet AG, номер по каталогу: 2222) в камеру из плексигласа, в которой содержатся мыши. Затем анестезированным животным вводили общий объем 50 микролитров тестируемого бактериального экстракта ОМ, который вводили через обе ноздри 100 мкл-микропипеткой.
Вирусный материал (штамм вируса гриппа PR8 (A/Пуэрто-Рико/8/34, H1N1), поставляемый от Virapur (San Diego)), хранили при -75°C±10°C и перед введением размораживали. После размораживания, материал разводили холодным PBS (4°C), что соответствует 100 БОЕ/50 мкл для A/PR/8/34. Разведенный вирус хранили на льду до введения мышам. Животных анестезировали путем внутрибрюшинной инъекции 9,75 мг ксилазола и 48,75 мг кетазола на кг массы тела, и каждому животному вводили 50 мкл раствора вируса путем интраназальной инокуляции.
На 5-й день, животных умерщвляли путем введения внутрибрюшинной инъекции летальной дозы пентабарбитала (Streuli Pharma AG, Uznach, Cat: 1170139A), после чего сразу выделяли ткань (легких). Выделенные доли легких были приготовлены для количественной оценки вирусной нагрузки в ткани легких с помощью количественной ПЦР. Доли легких выделяли и получали РНК с использованием реагента TRI (Molecular Research Center), а затем обрабатывали ДНКазой (Invitrogen) во избежание загрязнения геномной ДНК перед превращением РНК в кДНК посредством обратной транскрипции с использованием SuperScript III (Invitrogen). кДНК количественно определяли с помощью ПЦР в реальном времени (iCycler; Bio-Rad) с использованием SYBR Green (Stratagene), и образцы нормализовали по уровням экспрессии GAPDH. Все графики были построены с помощью программы Graphpad Prism Version 6, и был применен однофакторный ANOVA. Величины ошибок представляют собой стандартную ошибку среднего (SEM).
Результаты этого исследования ясно показали, что интраназальное введение бактериального экстракта OM эффективно защищало мышей от заражения вирусом гриппа в любых дозах, используемых в исследовании, и с более высокой эффективностью при интраназальном введении по сравнению с пероральным введением (фигура 14). По сравнению с необработанным контролем наблюдалось явное снижение уровня вируса как в водном, так и в бактериальном экстракте OM для групп перорального введения. Кроме того, этот защитный эффект значительно зависел от дозы, от 5 мкг до 100 микрограммов, самой последней и самой высокой дозы, оцененной в этом эксперименте. У групп, подвергаемых шести раундам интраназального введения бактериального экстракта OM, наблюдалась наилучшая эффективность с наименьшими отклонениями, хотя у мышей, которым вводили бактериальный экстракт OM только три раза, также наблюдалась значительная защита от вируса. Эти данные четко подтвердили результаты предыдущих экспериментов после интраназального введения, продемонстрировавшие, что бактериальный экстракт ОМ обеспечивает наиболее эффективный путь введения. Поскольку зависимость доза-ответ была подтверждена для обеих 3 и 6 обработок бактериальным экстрактом ОМ, то можно сделать вывод, что эта доза и схема введения оказывают очень эффективное профилактическое действие против гриппа у этой мышиной модели. Таким образом, следует ожидать, что общая более продолжительная обработка, более высокая частота периоральных введений, таких как интраназальное введение, и более высокие дозы будут более эффективными.
ПРИМЕР 7: Влияние бактериального экстракта согласно изобретению на экспрессию якорных белков риновируса и на ответы интерферона типа 1 и 2 на первичном человеческом эпителиальном слое, взятом у здоровых доноров.
Были опубликованы полученные ранее данные по противовирусной активности бактериального экстракта ОМ, приготовленного для немедленного периорального приема (бактериального экстракта из лизатов 21 штамма) в эпителиальных клетках легких человека, взятых у здоровых доноров, а также у пациентов с ХОБЛ и астмой (Roth М et al., PLoS ONE 2017, 12 (11), e0188010).
Для мониторинга противовирусной эффективности, продемонстрированной у животного после введения ему бактериального экстракта ОМ интратрахеально (прямого воздействия на легкие, Примеры 4, 5 и 6), заявителем была проведена оценка этого прямого воздействия на легкие с использованием первичных бронхиальных эпителиальных клеток, взятых из легких человека (hBEC). Для имитации результатов, полученных на мышах путем интратрахеального введения, эпителиальные бронхиальные клетки легких человека подвергали прямому воздействию новых стабильных композиций бактериального экстракта OM из лизатов 21 штамма (OM314 A (P1, P2, P3), OM314B (P4) и OM-314C (P5)) для оценки противовирусной эффективности ответных реакций клеток легких. Учитывая прямое противовирусное действие на первичные эпителиальные клетки легких, эти исследования подтвердили, что легкие являются основным органом-мишенью бактериального экстракта ОМ, как ранее предполагалось при интраназальном и интратрахеальном введении животным (примеры 4, 5 и 6).
В этом исследовании, заявитель продемонстрировал полученные на молекулярной основе результаты воздействия на клетки бактериального экстракта ОМ и его защитные эффекты в отношении риновирусных инфекций. С этой целью были проведены эксперименты по экспрессии белка и мРНК и по иммунофлуоресценции. Детектирование проводили с применением ELISA и методов иммунофлуоресценции (путем прямого подсчета клеток с окрашиванием и исключением трипанового синего), а также с помощью ОТ-ПЦР на культурах эпителиальных клеток легких человека, происходящих от легких нескольких здоровых доноров, пациентов с ХОБЛ и пациентов с астмой.
Выделение и характеризация БЭК: небольшие кусочки ткани бронхов (от 1 × 1 × 1 мм до 2 × 2 × 2 мм) помещали в сосуды для культивирования клеток, которые предварительно увлажняли БЭК-специфической средой Cnt-PR-A (CellnTech, Bern, Switzerland). Среду заменяли на каждый второй день, а клетки пассировали путем механического встряхивания делящихся клеток. Клетки были охарактеризованы по позитивному окрашиванию E-кадгерином и кератином различных видов и по негативному окрашиванию на фибронектин (Roth М et al., PLoS One 2017; 12:. E0188010).
В этом исследовании, заявитель продемонстрировал полученные на молекулярной основе превосходные результаты выбранного набора новых стабильных композиций бактериального экстракта OM и их профилактическое противовирусное действие в отношении риновирусной инфекции. Экспериментальные данные представляли собой количественные изменения вирусной нагрузки, а также противоинфекционных и противовоспалительных медиаторов, продуцируемых с помощью hBEC, включая, но не ограничиваясь ими, растворимые медиаторы, таких как интерферон типа 1 и типа 2. Эти биологические эффекты были оценены с применением следующих методов: детектирования мРНК с помощью ОТ-ПЦР на вирусную нагрузку и детектирования высвобождения растворимого медиатора с помощью ELISA на интерферон типа 1 (IFN-бета и интерферон-гамма типа II). Определение мРНК RV16 осуществляли для различных композиций, перечисленных в Таблице 27, где противовирусный эффект выражали в процентах мРНК по отношению к RV16 и уровню экспрессии мРНК RV16.
Пример 7.1: Результаты по антивирусному действию
Результаты, полученные с использованием различных протестированных новых стабильных композиций бактериального экстракта OM (OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5)), показали аналогичный или даже улучшенный противовирусный эффект по сравнению со стандартной HCl-композицией бактериального экстракта OM (Фигура 15А). В этой серии были протестированы противовирусные эффекты с новыми композициями, в которых несколько кислот были включены в технологичесий процесс очистки (фигура 15C). По сравнению с нестабильными жидкими композициями, помеченными как «HCl», новые стабильные композиции продемонстрировали эквивалентную или даже лучшую противовирусную эффективность. В зависимости от используемых бактериальных экстрактов OM314A (P1, P2, P3), OM314B (Р4) и ОМ-314C (P5), и за исключением одного случая, была продемонстрирована эквивалентная или даже лучшая эффективность, чем в случае «HCl»-композиции (ср. процент мРНК RV16 для HCL на фигуре 15A и I.B. на фигуре C с другими препаратами образцов).
Таблица 27: Процент мРНК RV16 и уровень экспрессии мРНК RV16, соответствующие фигуре 15A
Пример 7.2: Интерфероны типа 1 и типа 2
Индуцирование продуцирования интерферона-бета типа 1 бактериальным экстрактом OM первого поколения было ранее описано для мышей с экспериментальными моделями первичных дендритных клеток (ДК) костного мозга (Dang et al, Sci Rep., 2017, Mar 6; 7:43844). Вкратце, человеческие клетки БЭК, взятые у здоровых доноров, пациентов с астмой и ХОБЛ, высевали на день -2, удаляли сыворотку на день -1 и стимулировали в течение 0, 24 и 48 часов OM314A (P1, P2, P3), OM314B (P4)) и OM-314C (P5) (концентрация 10 микрограммов/мл), как показано на схеме (Фигура 16). Затем в указанное время собирали клеточные супернатанты для получения доз интерферона бета и гамма с помощью ELISA.
По сравнению с исходной секрецией INF-бета и гамма посредством БЭК с использованием предыдущего бактериального экстракта ОМ (фигуры 17A и 18A), новые стабилизированные продукты OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) были способны индуцировать интерферон-бета типа 1 и интерферон-гамма типа 2, аналогичным образом или в более высокой степени, как показано на фигурах 17С и 18С (ср. I.B. с другим продуктом). В зависимости от используемого процесса наблюдались некоторые заметные различия. В этом исследовании было оценено высвобождение интерферона всеми стабильными бактериальными экстрактами OM314, индуцированное определенным интервалом доз у 5 доноров. Средние значения интерферона для 5 доноров показаны на фигурах 17B и 18B. Следует отметить, что в отличие от фигур 17A и 18A, где IFN-зависимое высвобождение наблюдалось при определенных концентрациях бактериального экстракта ОМ, максимальный объем 20 микролитров был использован как показано на Фигурах 17C и 18C, то есть, объем, соответствующий меньшему количеству стандартного бактериального экстракта OM. Интерферон альфа не индуцировался бактериальными экстрактами OM и не индуцировался новыми стабильными экстрактами OM314A (Р1, Р2, Р3), OM314B (Р4) и ОМ-314C (Р5) на человеческих клетках БЭК in vitro (не показано).
ПРИМЕР 8: Защитное противовирусное действие бактериального экстракта согласно изобретению в отношении изменения экспрессии β-дефензина-1 и ICAM-1 на первичных эпителиальных клетках человека (БЭК), взятых путем биопсии из легких человека.
Пример 8.1: β-дефензин-1 и ICAM-1
Как показано в Примере 8 и в соответствии с последующей оценкой новых стабильных препаратов OM314А (Р1, Р2, Р3), OM314B (Р4) и ОМ-314C (Р5) после системного сравнения с предыдущими данными, полученными с использованием исходного бактериального экстракта ОМ, авторы поставили цель подтвердить ранее опубликованные данные по человеческим БЭК, но с использованием других антивирусных признаков, ранее индуцированных бактериальным экстрактом ОМ (Roth et al., 2017). На фигуре 19 показано, что новые стабильные препараты OM314А (Р1, Р2, Р3), OM314B (Р4) и ОМ-314C (Р5) индуцировали экспрессию антивирусного бета-дефензина-1 первичными эпителиальными клетками легких человека (БЭК) в такой же степени, как и в промышленной партии (I.B. № 1619057) или в большей степени. Аналогичным образом, такая противовирусная эффективность также была продемонстрирована снижением уровня ICAM-1 риновируса на поверхности этих клеток. На Фигуре 20B показана способность новых стабильных препаратов OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5) снижать экспрессию вирусного рецептора ICAM-1 человеческими БЭК в той же степени, как и для промышленной партии (I.B. #1619057). Таким образом, в обоих случаях была подтверждена способность этих только что полученных стабильных бактериальных экстрактов OM314 сохранять активность и эффективность уже полученных бактериальных стандартов ОМ в той же степени или с еще более превосходящими различиями в зависимости от процесса и содержания бактериального экстракта.
Пример 9: Способность бактериального экстракта согласно изобретению активировать адаптер и TLR-зависимый эффекторный белок MyD88, продемонстрированная и наблюдаемая по высвобождению TNFα из дендритных клеток мышиного костного мозга.
Пример 9.1: Получение BMDC
Для еще большего расширения исследования на способность только что полученных стабильных бактериальных экстрактов OM314A (P1, P2, P3), OM314B (Р4) и ОМ-314C (Р5) сохранить такую же или еще большую эффективность в отношении активации природного иммунитета, авторами были проведены идентичные исследования, первоначально продемонстрировавшие противовоспалительное и модулирующее действие бактериальных стандартов ОМ, широко представленных Dang et al. (Sci Rep. 2017 Mar 6; 7: 43844). С этой целью было проведено одно единственное, но обобщающее исследование, поскольку в этом исследовании были использованы все необходимые клеточные компоненты после активации. Поверхностный рецептор (TLR), эффекторный белок, обязательный для бактериального экстракта OM, индуцировали защиту (MyD88), а фактор транскрипции индуцировал высвобождение цитокинов после его расщепления и транслокации из цитоплазмы в ядро (NF kB), где был определен уровень транскрипция и высвобождение цитокинов (TNFα) в среду. Для этой цели использовали первичные дендритные клетки костного мозга, выделенные из костей мыши. Клетки костного мозга (BM) были извлечены из бедренных и большеберцовых костей 6-10-недельных мышей дикого типа C57/BL6 или различных мышей с нокаутом TLR (здесь показаны только мыши с нокаутом TLR4 (TLR4-/-) и мыши дикого типа) путем промывания кости охлажденным на льду PBS. Последующую обработку клеток BMDM и их созревание и дифференцировку в дендритные клетки (BMDC) проводили как описано Dang et al. 2017. Чистоту культуры определяли по окрашиванию клеток антителами против мышиных CD11c и мышиных MHCII, а процент клеток с высоким содержанием CD11c+-MHCII анализировали с помощью проточной цитометрии.
Пример 9.2: Стимуляция BMDC и оценка высвобождения цитокинов
BMDC высевали в 96-луночный планшет для культивирования тканей при плотности 2×105 клеток/лунку и стимулировали в течение 16 часов ЛПС (4 мкг/мл) от Enzo Life Sciences, или различными концентрациями только что приготовленных стабильных бактериальных экстрактов OM314A (P1, P2, P3), OM314B (P4) и OM-314C (P5). Как показано на фигуре 21, были использованы различные концентрации (50-1600 мкг/мл) промышленной партии (I.B. #1619056OM) бактериального экстракта (верхний левый угол). Концентрации цитокина TNFα оценивали в бесклеточных супернатантах с помощью наборов для ELISA в соответствии с инструкциями производителей и с использованием наборов для TNFα от eBioscience. Как это было проиллюстрировано на фигуре 21, все только что приготовленные стабильные бактериальные экстракты OM314A (P1, Р2), OM314B (Р4) и ОМ-314C (Р5), кроме одного (3-гидроксибутановой кислоты Р3), были способны индуцировать секрецию TNFα из BMDC к той же степени как у контроля (I.B.), взятого у нормальных мышей дикого типа. Интересно отметить, что в некоторых случаях, такая секреция была эквивалентной или даже лучшей (дозозависимой), что продемонстровало важное значение селективного ответа этих различных источников бактериального экстракта. Одновременно с этим, только что полученным стабильным бактериальным экстрактам OM314A Р3, Р4 и Р5 не требовался рецептор TLR для индуцирования высвобождения TNFα из BMDC, поскольку этот цитокин также секретировался в отсутствии этого TLR4 (TLR4-/-). LDA показал, что различные микроорганизмы доминируют в различных группах, и что i) BE (бактериальный экстракт из лизатов 21 штамма) предотвращает появление опасных бактериальных групп у мышей HFD и ii) увеличивает групповое разнообразие.
ПРИМЕР 10: Способность бактериального экстракта согласно настоящему изобретению при его периоральном введения устранять дисбактериоз кишечника у животных, которым давали корм с высоким содержанием жира
Пример 10.1: Важное значение баланса микробиоты и опасных последствий дисбактериоза и анализ микробиомы в соответствии с таксономией.
Конкретные паттерны микробиоты являются изменчивыми и зависят от многих внешних факторов, таких как режим питания, возраст, генетика и прием лекарственных средств (Dieterich et al. Med Sci (Basel). 2018; 6 (4):116. Published 2018, Dec 14, DOI: 10.3390/medsci6040116). Хотя исследования, проводимые в начале эры зарождения научных исследований, показали, что микробиома может способствовать гомеостазу, однако, выяснение точных механизмов, посредством которых дисбактериоз микробиомы приводит к определенным заболеваниям, и важность поддержания сбалансированной микробиомы имеет первостепенное значение, и требуются срочные меры для восстановления такого дисбаланса. Соответственно, восстановление неблагоприятной популяции кишечной флоры до благоприятной микробной экосистемы может предотвратить заболевания человека (Young VB et al. BMJ 2017; 356: j831). В исследовании, целью которого является оценка липотоксических эффектов потребления пищи с высоким содержанием жира (HFD) во время беременности, авторами было недавно показано, что потребление HFD в течение восьми недель приводит к дисбактериозу кишечника, к окислительному стрессу, к усилению воспаления и повышенному риску преждевременных родов, вызванных воспалением (РТВ). Соответственно, в настоящем Примере авторами было принято решение определить способность бактериального экстракта согласно изобретению устранять HFD-индуцированный дисбактериоз кишечника и связанные с ним нагативные воздействия на метаболизм и иммунный статус. Результаты таксономии позволили определить показатели линейного дискриминантного анализа (LDA), как показано на фигуре 22. На этой Фигуре проиллюстрирован специфический эффект бактериального лизата на определенные микроорганизмы. Нежелательные виды Clostridiales, Firmucutes, Clostridia и Blautia, присутствующие у контрольных мышей, которым давали HFD (HFD-контроль), были восстановлены у мышей, получавших бактериальный экстракт (HFD-BE), и в меньшей степени также у контрольных мышей, которым давали обычный корм (NCD-контроль). Кроме того, повышенные уровни желательных микроорганизмов, которые истощаются при потреблении HFD, также были идентифицированы в составе микробиоты мышей, получавших бактериальный лизат (HFD-BE и NCD-BE). В отличие от стандартного таксономического анализа, демонстрирующего увеличение и уменьшение выбранного набора видов, оценка LDA, показанная на фигуре 22, иллюстрирует отдельные виды каждой из 4 групп (NCD-контроль, NCD-BE, HFD-контроль, HFD-BE). LDA показал, что различные микроорганизмы доминируют в различных группах, и что i) BE (бактериальный экстракт из лизатов 21 штамма) предотвращает появление опасных бактериальных групп у HFD-мышей и ii) увеличивает групповое разнообразие, что тем самым подтверждает положительный эффект бактериального лизата согласно изобретению.
Пример 10.2: Методы, животные, потребление корма, толерантность к глюкозе, инсулинорезистентность и режим кормления.
В этом исследовании использовали мышей двух различных типов: C57BL/6 и CD1. Мыши C57BL/6 представляют собой инбредную линию, преимущество которой состоит в том, что они становятся тучными, имеют гипергликемию и инсулинорезистентность при кормлении кормом с высоким содержанием жира (HFD). С другой стороны, мыши CD1 имеют более легкую метаболическую дисфункцию после потребления HFD, но имеют то преимущество, что они являются аутбредными, а поэтому можно избежать любой идиосинкратической реакции на HFD. Мышей закупали в лаборатории Jackson Laboratories (Bar Harbor, ME, USA). Равное количество самцов и самок мышей каждого типа размещали в индивидуально вентилируемых клетках в Центре по уходу за животными при 24°С, с 12-часовой сменой дня и ночи, и обеспечивали свободный доступ к корму и воде. HFD-мышам давали корм с 60% жира и с высоким содержанием насыщенных жиров, то есть, жиров, полученных, в основном, из свиного сала и соевого масла, а NCD-мышам давали корм, содержащий 13,3% жира. Корм и воду давали без ограничений. Бактериальные экстракты OM вводили периорально путем интраназального пипетирования (0,05 мл) в течение 14 дней или перорально путем введения непосредственно в ротовую полость (≤0,15 мл) мышей ежедневно в течение четырех и восьми недель. Мышам, получающим «фиктивное лечение» (негативный контроль), вводили пипеткой 0,05 мл воды (интраназально) один раз в день в течение 14 дней или перорально непосредственно в ротовую полость (≤ 0,15 мл) ежедневно в течение четырех и восьми недель. Позитивный контроль: Lactobacillus plantarum, пробиотик, устраняющий дисбактериоз кишечника, вводили мышам в качестве позитивного контроля путем добавления 2 × 108 КОЕ/мл в питьевую воду в течение шести дней. Анализ на воздействие бактериальных экстрактов ОМ на микробиому кишечника: собирали образцы фекалий и анализировали рРНК 16S путем секвенирования. После секвенирования, функциональные гены в образцах охарактеризовывали, и различия между функциональными генами микробных сообществ анализировали с помощью анализа путей генов и геномов (KEGG) в соответствии с Киотской энциклопедией. Функциональную классификацию белков, кодируемых этими генами, предсказывали с использованием информации о семействах кластеров ортологичных групп (COG). Анализ на влияние бактериальных экстрактов ОМ на метаболический статус: анализы на толеранстность к глюкозе (GTT) и анализы на толеранстность к инсулину (ITT) проводили на всех мышах в начале и в конце 8-недельного периода. Мышей не кормили в течение 8 часов, а затем им вводили внутрибрюшинную инъекцию 2,0 г/кг глюкозы с инсулином или без него, и уровни глюкозы определяли через 0, 15, 30 и 60 минут.
Пример 10.3: Влияние бактериального экстракта из лизата 21 бактерии (ВЕ) на бактерии различных родов
В качестве дополнения и для дальнейшего пополнения данных, обобщенных на Фигуре 22, на Фигуре 26 показан пример нескольких изменений в роде, вызванных BE. В этом примере, BV продемонстрировал положительное влияние на бактерии нежелательных родов (снижение их роста) и одновременно продемонстрировал благоприятный рост на желательных бактериях. На этой фигуре показаны пять примеров. (A) ВЕ уменьшает число бактерий рода clostridiales lachnospiraceae blautia, вызываемых HFD; (B) ВЕ снижает число HFD-индуцированных бактерий рода Clostridia clostridiales ruminococcaceae GCA-900066225; (C) ВЕ снижает количество клостридий Ruminococcaceae ruminococcaceae UCG-0101 у NCD-мышей и у HFD-мышей; (D) ВЕ восстанавливал число некультивированных бактерий Bacteroidales Muribaculaceae, истощенных после HDF; (E) ВЕ снижал число бактерий группы Lachnospiraceaeae [Eubacterium] fissicantena.
ПРИМЕР 11: Способность бактериального экстракта при периоральном введении повышать толерантность к глюкозе.
Пример 11.1: Оценка концентрации глюкозы перед потреблением корма, содержащего бактериальный экстракт из лизатов 21 штамма (перед кормлением), у мышей после употребления нормального корма (после NCD) и после употребления корма с высоким содержанием жира (после HFD).
Помимо устранения дисбактериоза кишечника с помощью бактериального экстракта, этих мышей с диабетом также исследовали на толерантность к глюкозе. Этот параметр имеет первостепенное значение с клинической точки зрения. Как показано на Фигуре 23B, у мышей, которым давали нормальный контрольный корм с бактериальным экстрактом из лизатов 21 штамма (NCD-BE), но не L. Plantarum (который обычно используют в качестве позитивного контроля для устранения дисбактериоза кишечника), наблюдалось значительное повышение толерантности к глюкозе, что проявляется снижением концентрации глюкозы. Аналогичным образом, этот эффект был также продемонстрирован на мышах, которым давали корм с высоким содержанием жира, содержащий бактериальный экстракт из лизатов 21 штамма (HFD-BE), как показано на Фигуре 23C, хотя и в меньшей степени.
Пример 11.2: Оценка массы тела и потребления пищи
Как показано на Фигуре 24, оба параметра были протестированы как контрольные. Результаты показали, что у мышей, которым давали корм с высоким содержанием жира, содержащий бактериальный экстракт из лизатов 21 штамма (HFD-BE), наблюдалось значительное снижение прироста массы. Это было продемонстрировано на мышах, которым давали корм с высоким содержанием жира (фигура 24A). Одновременно, это отсутствие прироста массы наблюдалось без влияния на потребление корма, как было определено и выражено здесь в качестве контроля (фигура 24B). Интересно отметить, что этот эффект оказался даже более эффективным, чем в случае L. Plantarum, который обычно используется для такой цели.
Пример 11.3: Оценка толерантности к инсулину
Принимая во внимание приведенные выше результаты по защите в отношении толерантности к глюкозе, полученные при введении мышам с диабетом бактериального экстракта из лизатов 21 штамма (BE) по схеме потребления корма с высоким содержанием жиров (HDF), авторами было проведено дополнительное исследование для того, чтобы определить, был ли уровень инсулина также изменен до достижения его защитного действия. На фигуре 25 продемонстрирована толерантность к инсулину у всех мышей (42) до обработки (перед кормлением) в качестве эталона, и после последнего 8-недельного периода обработки (после кормления), у мышей, которым давали корм с высоким содержанием жира (HFD). Как и ожидалось, у мышей, которым давали нормальный корм (с NCD-L. Plantarum) наблюдалось снижение резистентности к инсулину (фигура 25В), при этом, у мышей, которым давали корм с высоким содержанием жира и с бактериальным экстрактом из 21 лизата (HFD-BE), наблюдалось значительное снижение резистентности к инсулину во все периоды времени. Этот защитный эффект бактериального экстракта из 21 лизата соответствует данным, полученным в отношении глюкозы и отсутствия увеличения массы, как показано на предыдущих фигурах, и все это еще раз подтверждает положительные результаты в восстановлении стандартных параметров, оцененных у пациентов с диабетом. Таким образом, было подтверждено, что бактериальный экстракт из лизатов 21 штамма (BE) не только обеспечивает защиту кишечника от дисбактериоза у мышей, которым постоянно давали HFD, но также устранял связанные с диабетом осложнения, проиллюстрированные здесь в отношении массы, глюкозы и инсулина, и все это положительно влияло на обеспечение защиты, индуцируемой бактериальным лизатом 21 штамма.
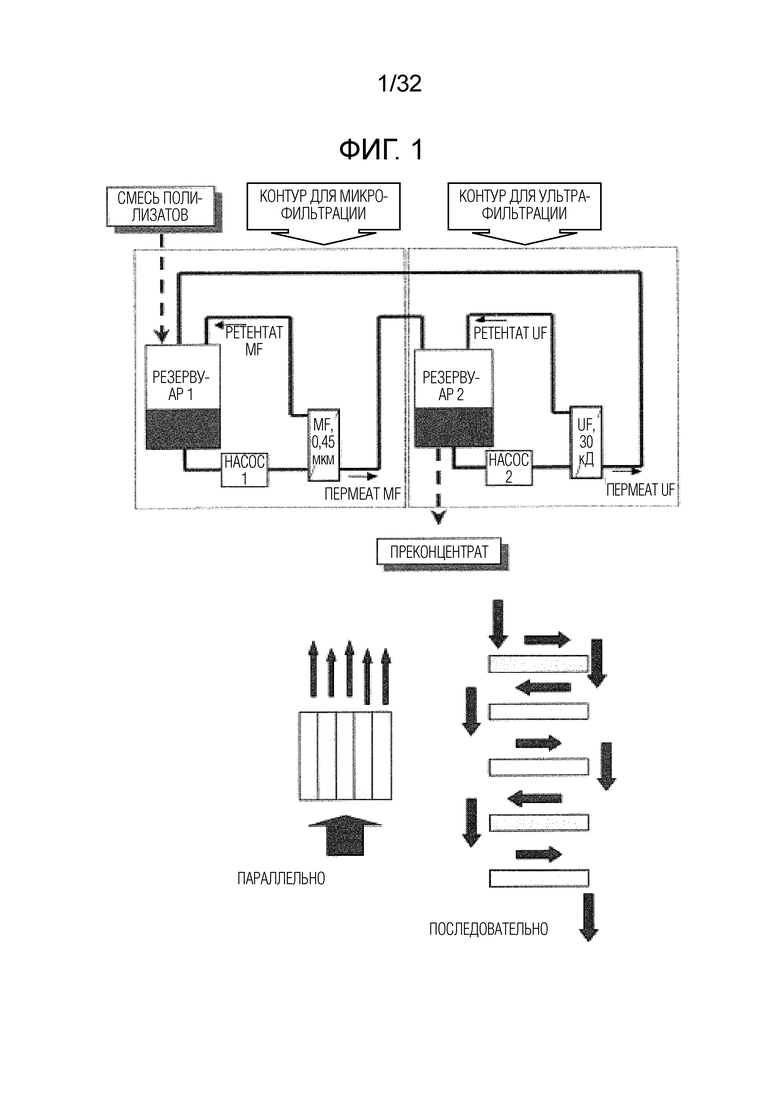
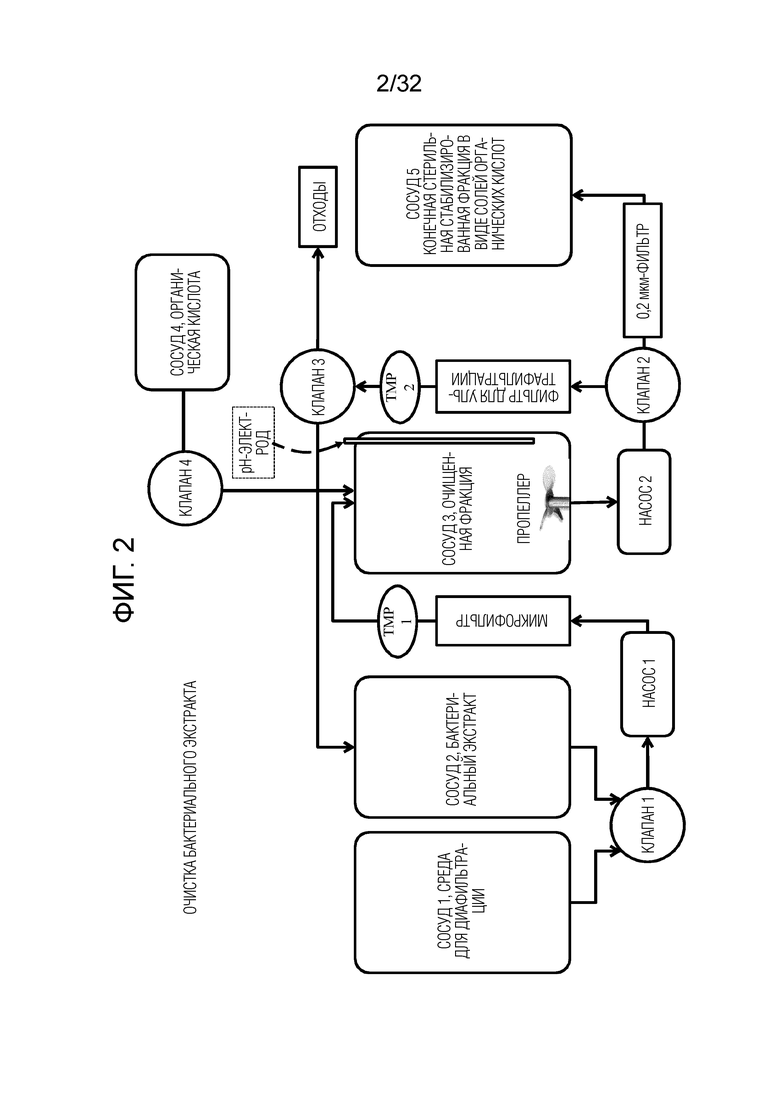
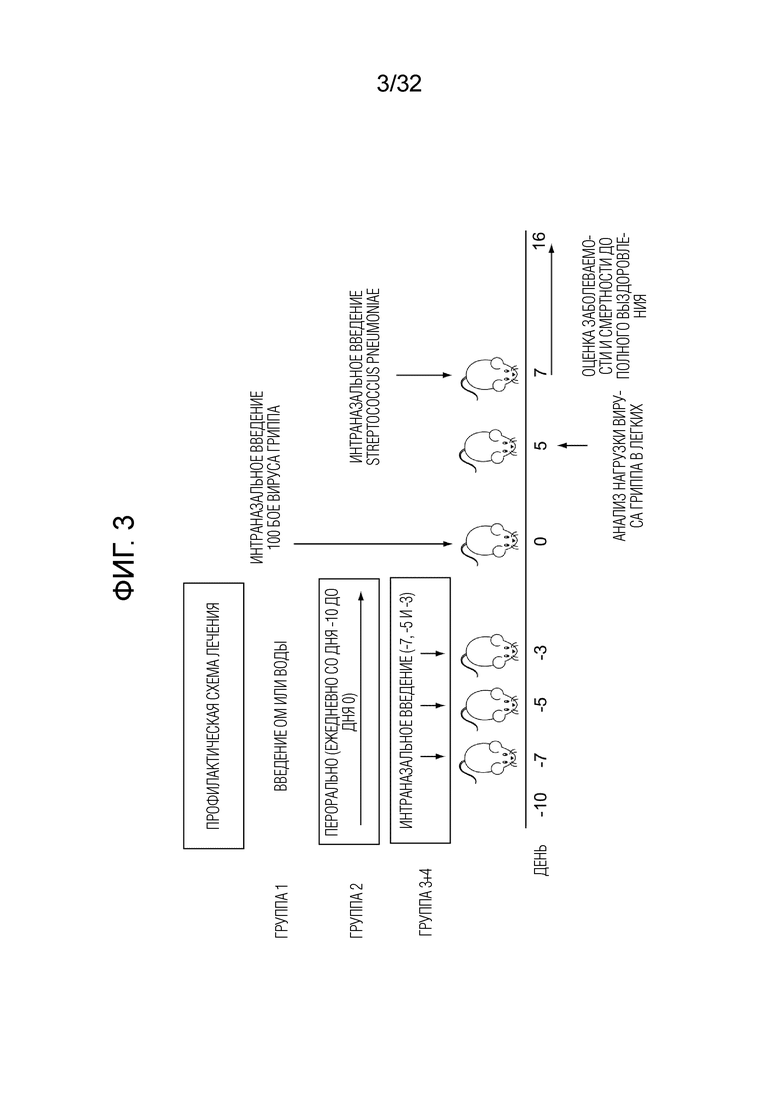
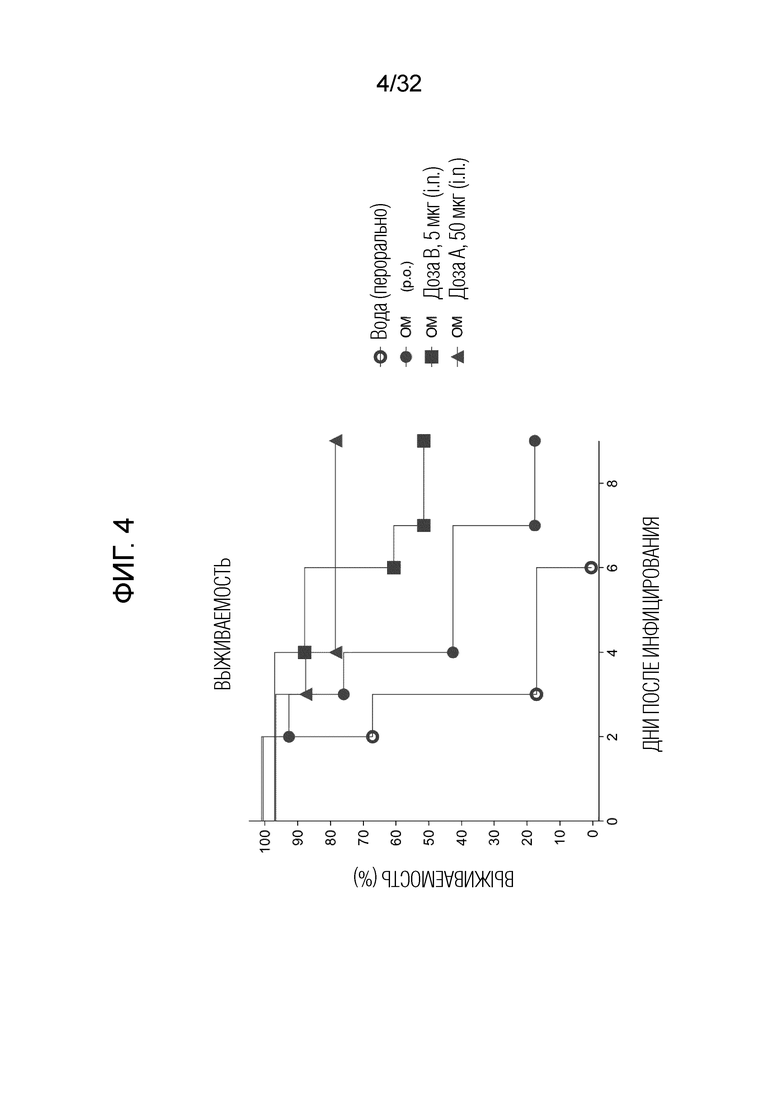
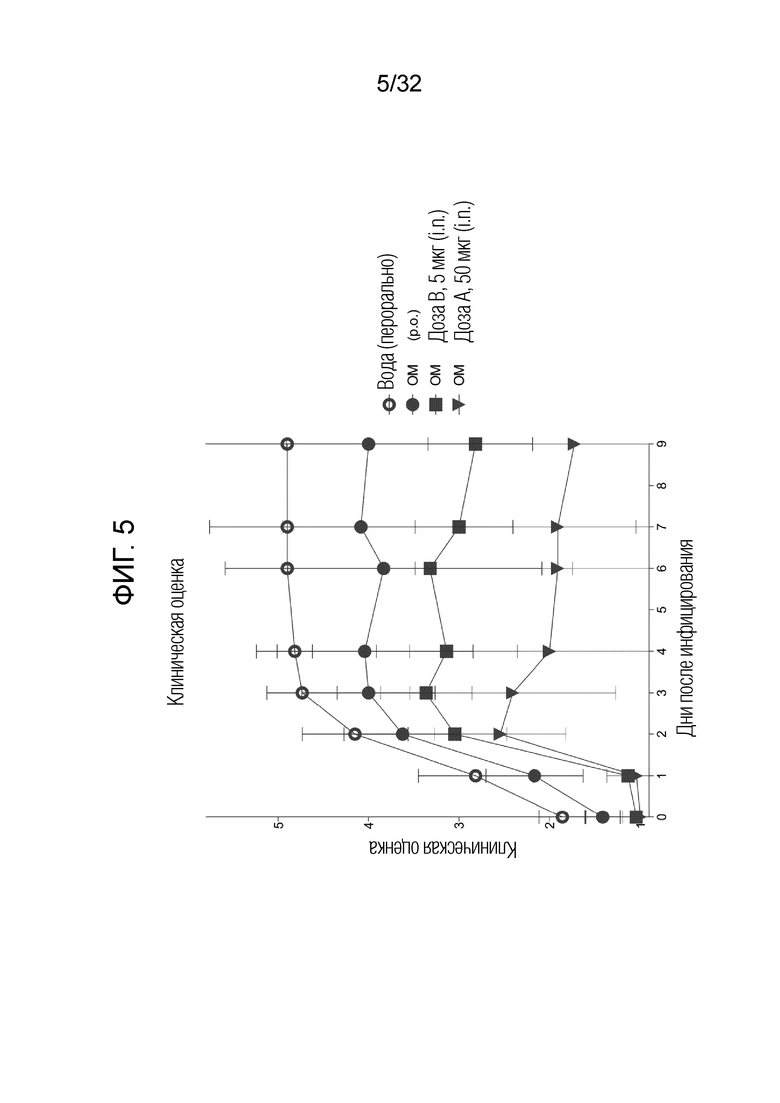
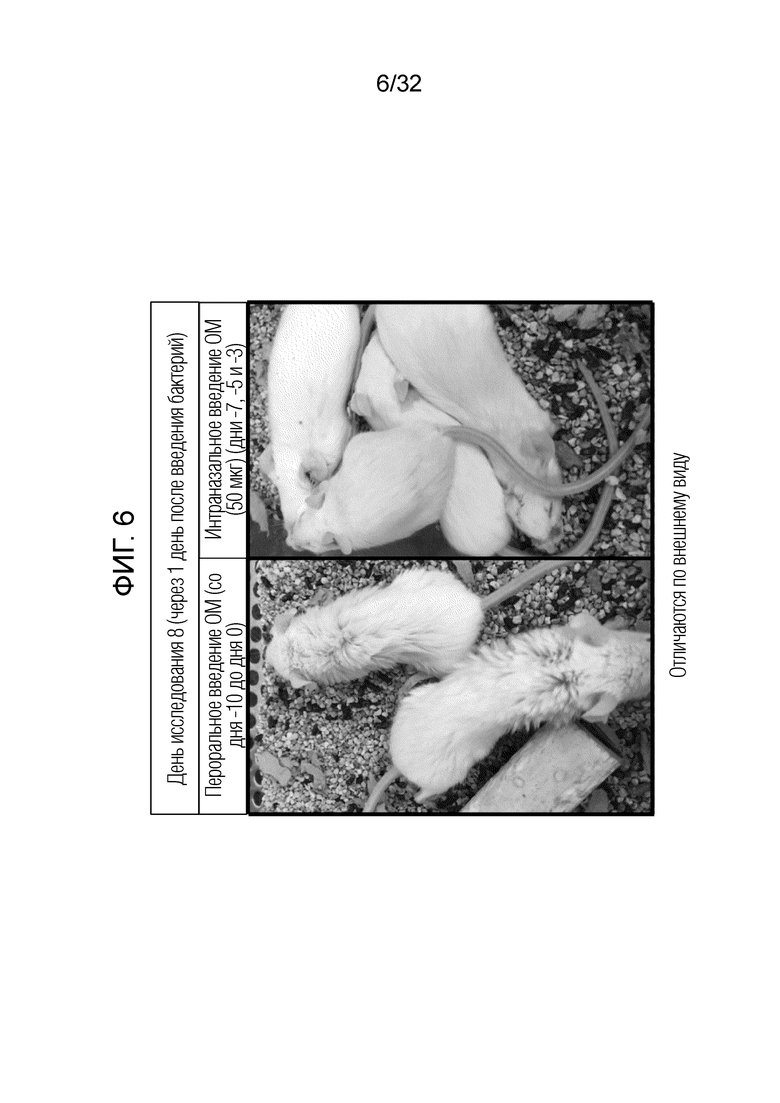
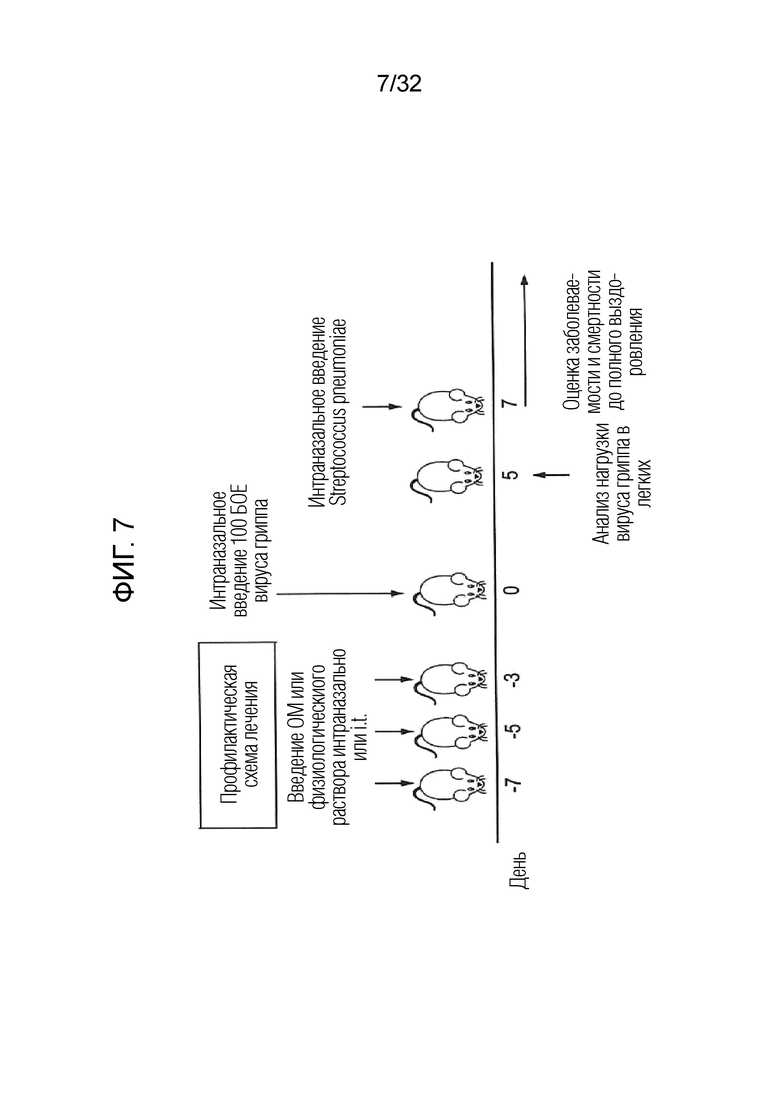
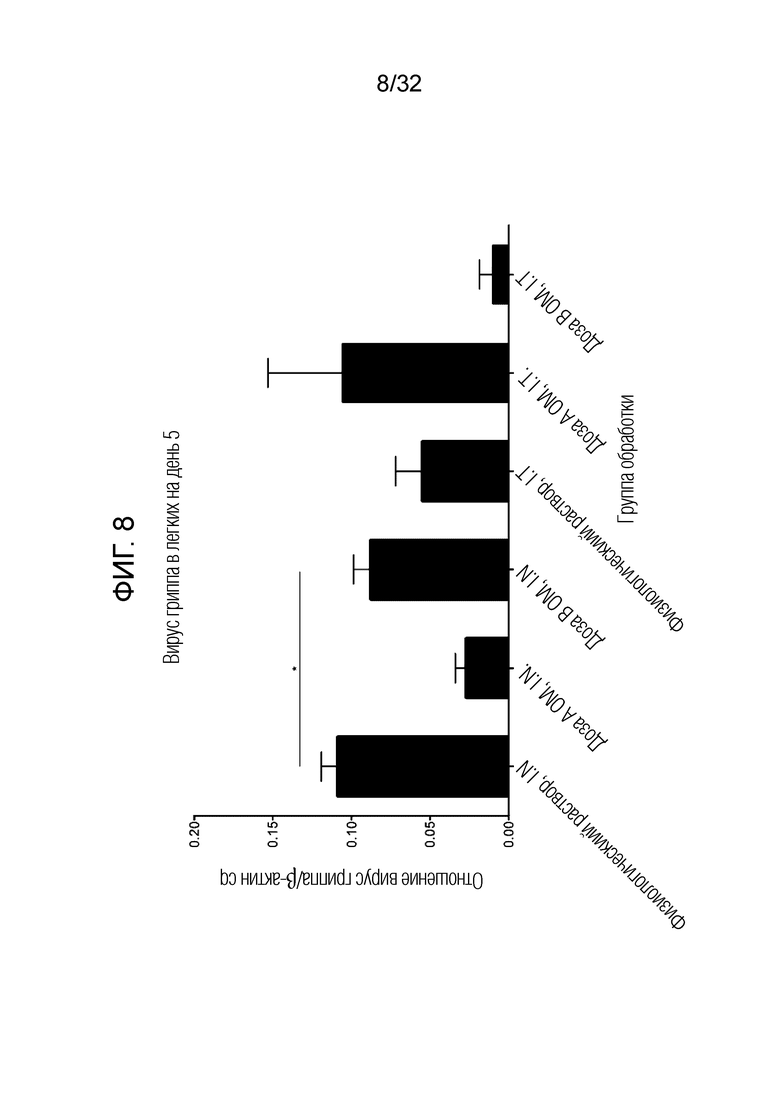
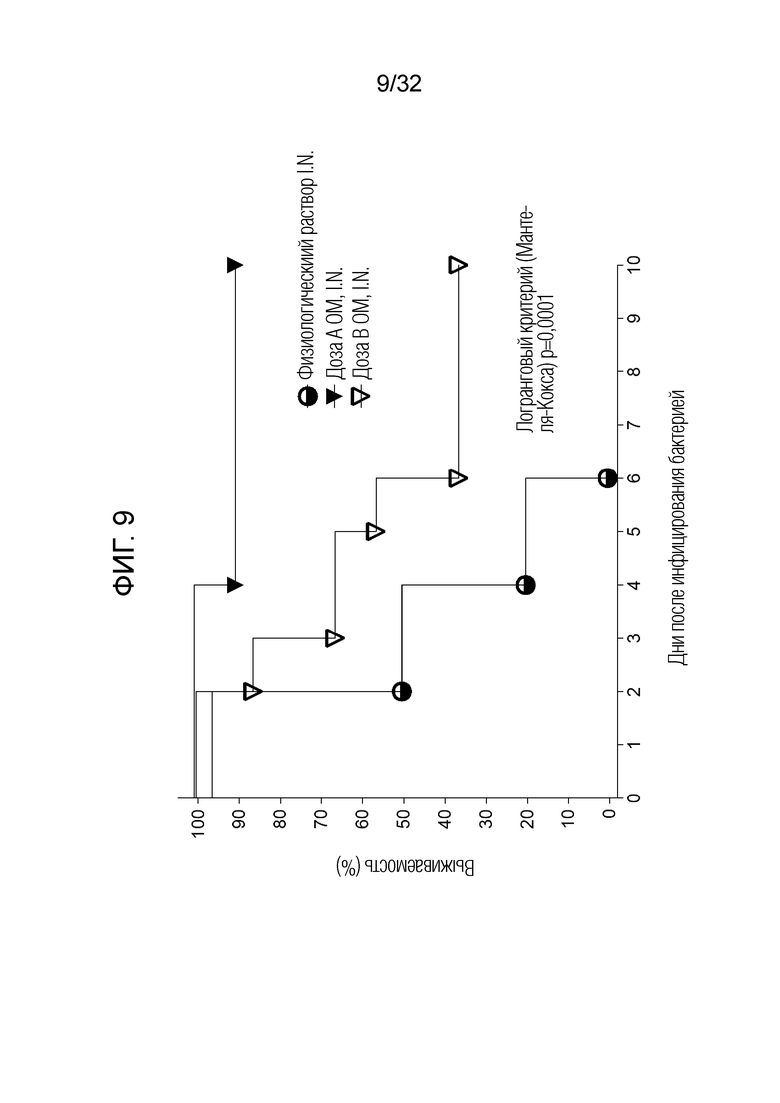
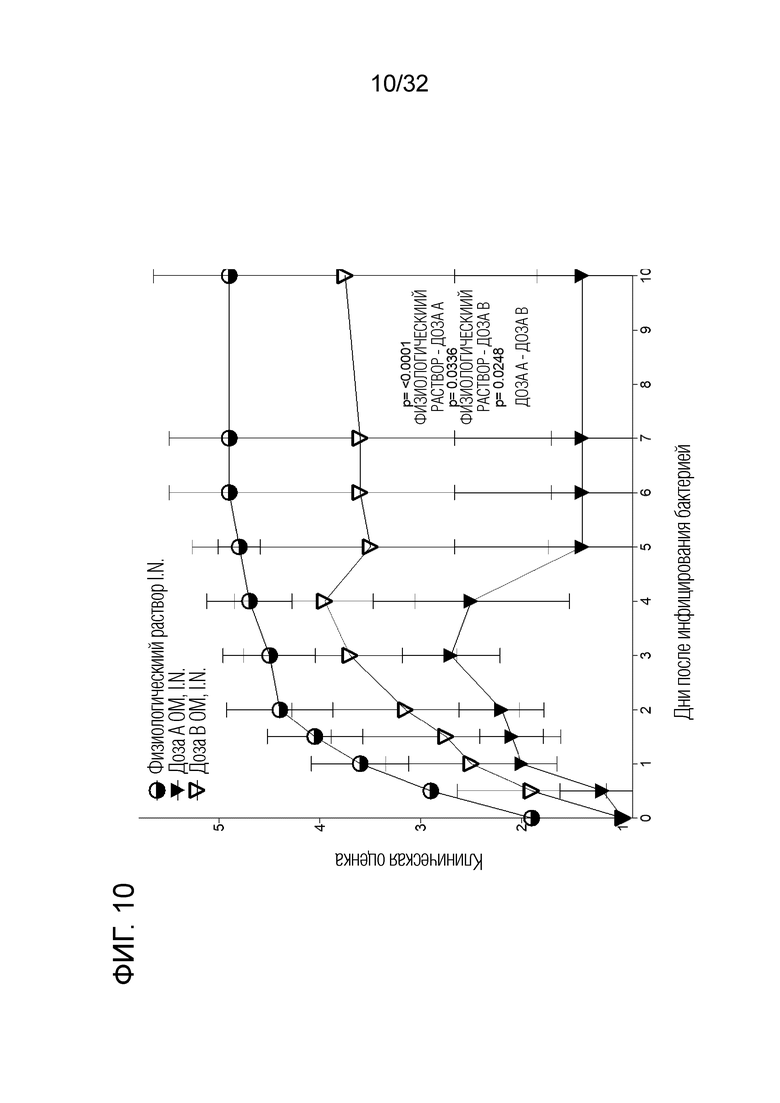
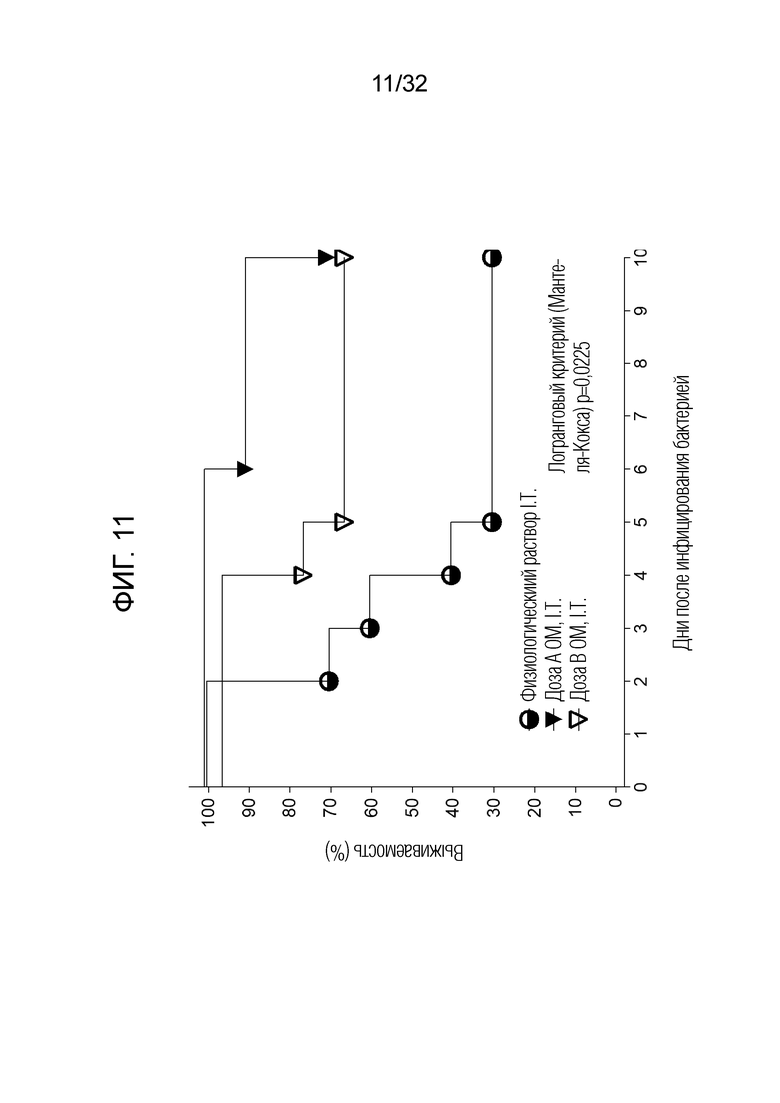
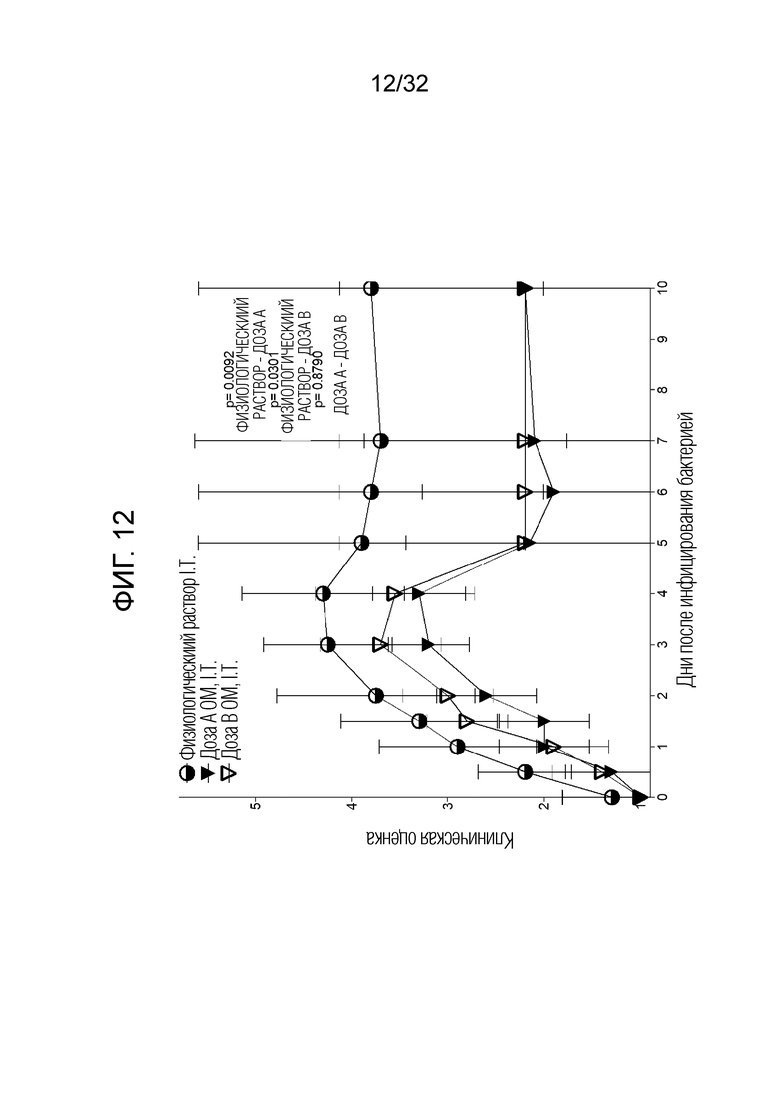
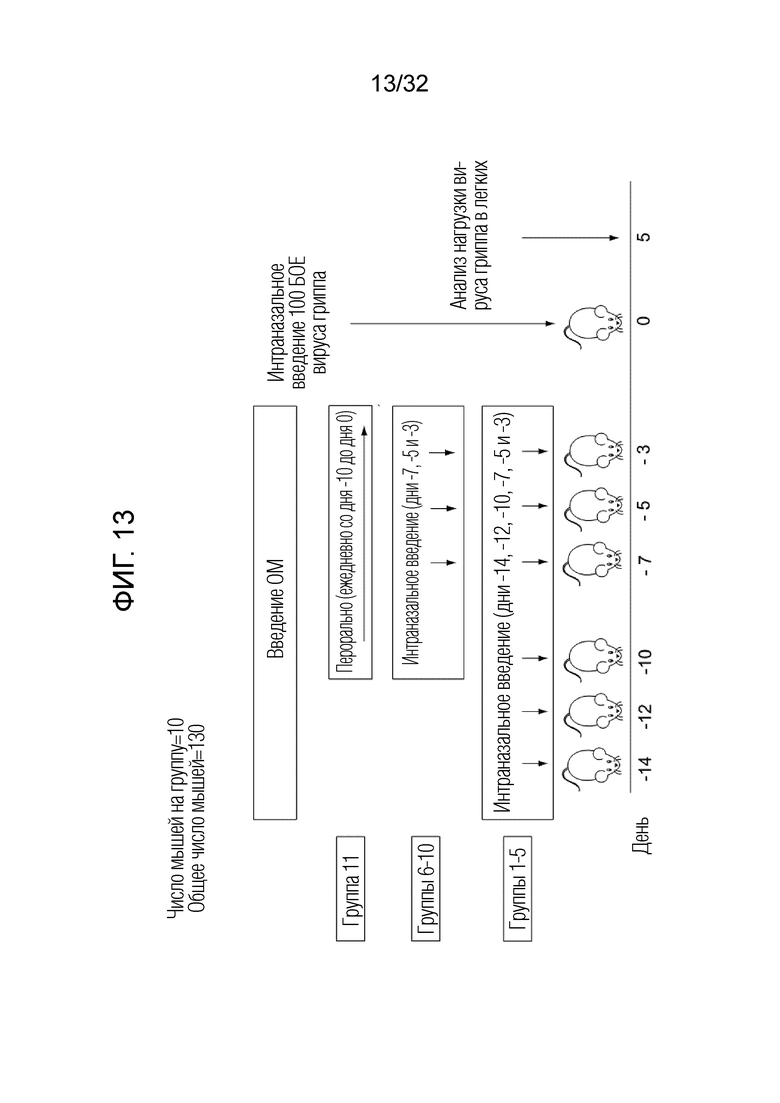
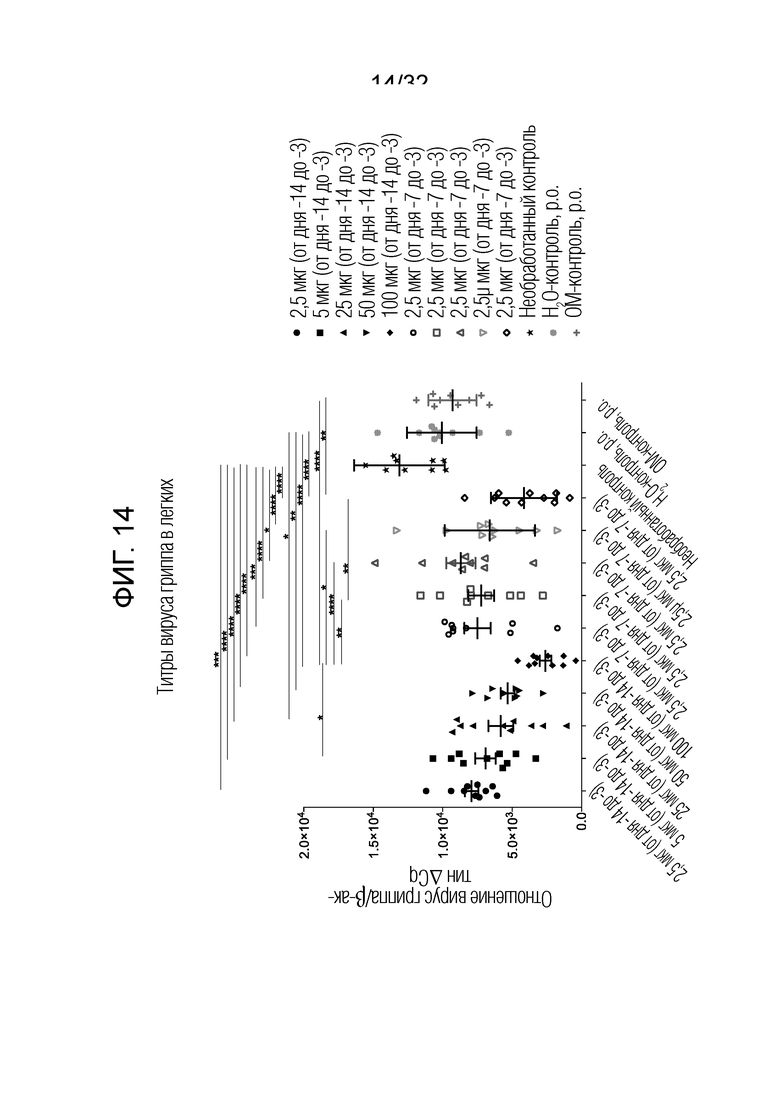
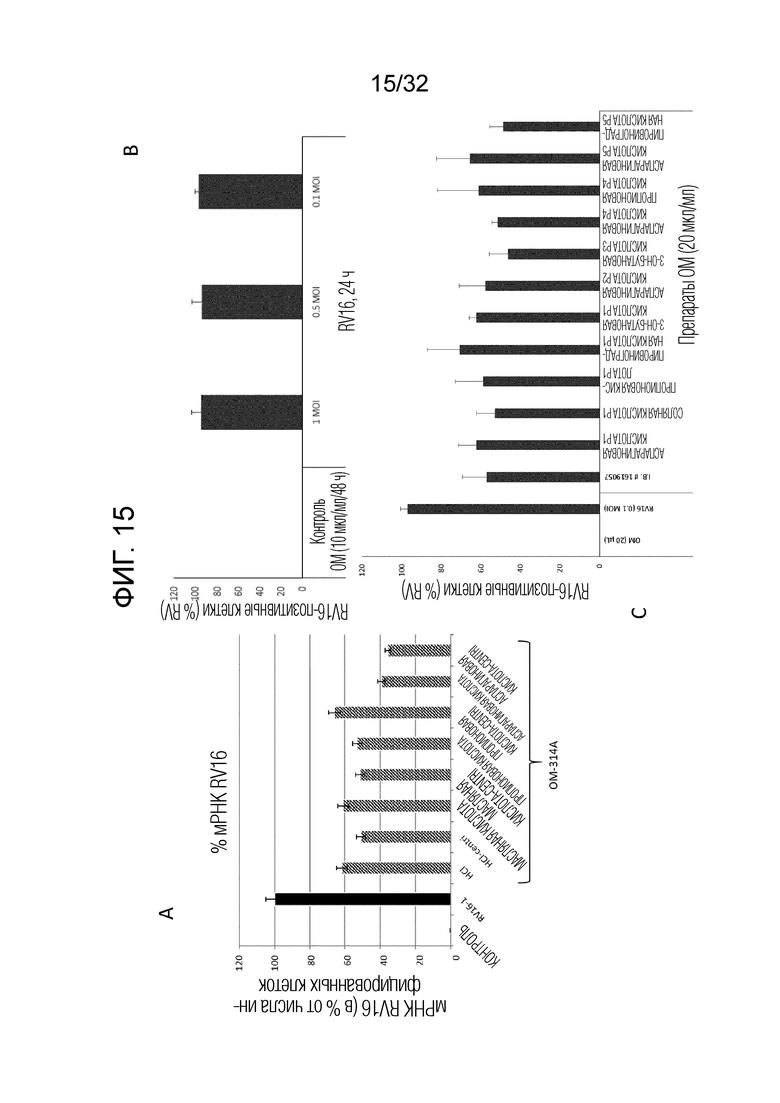
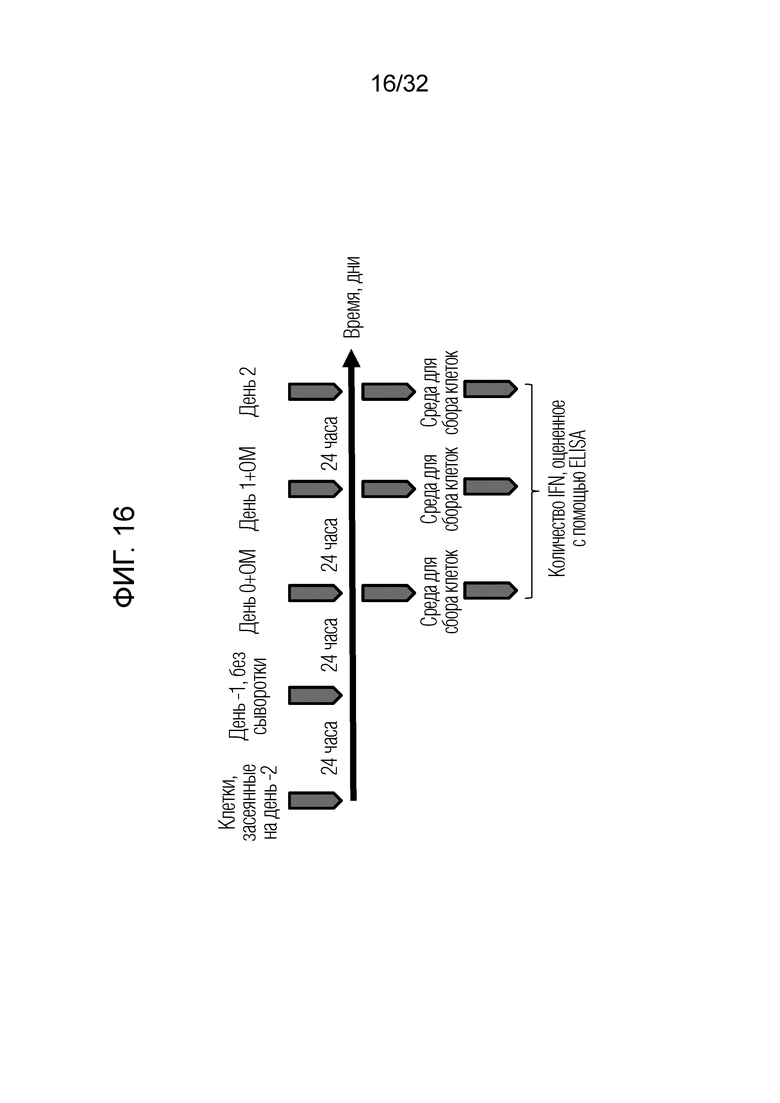

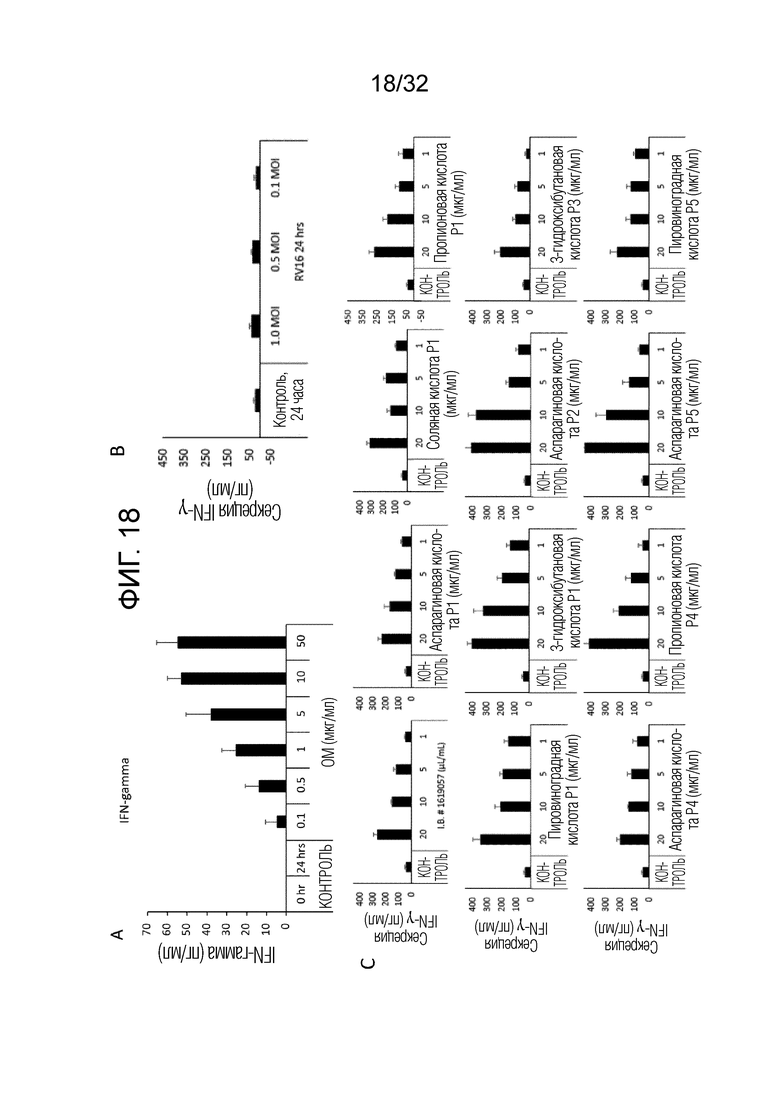
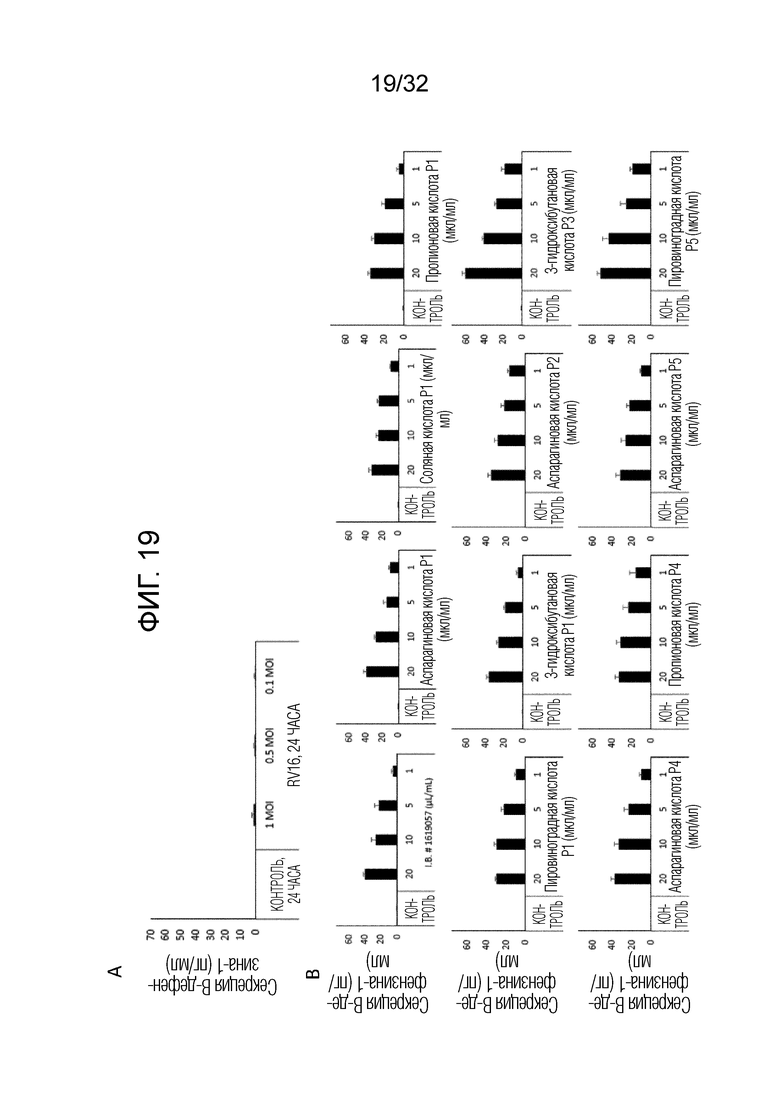
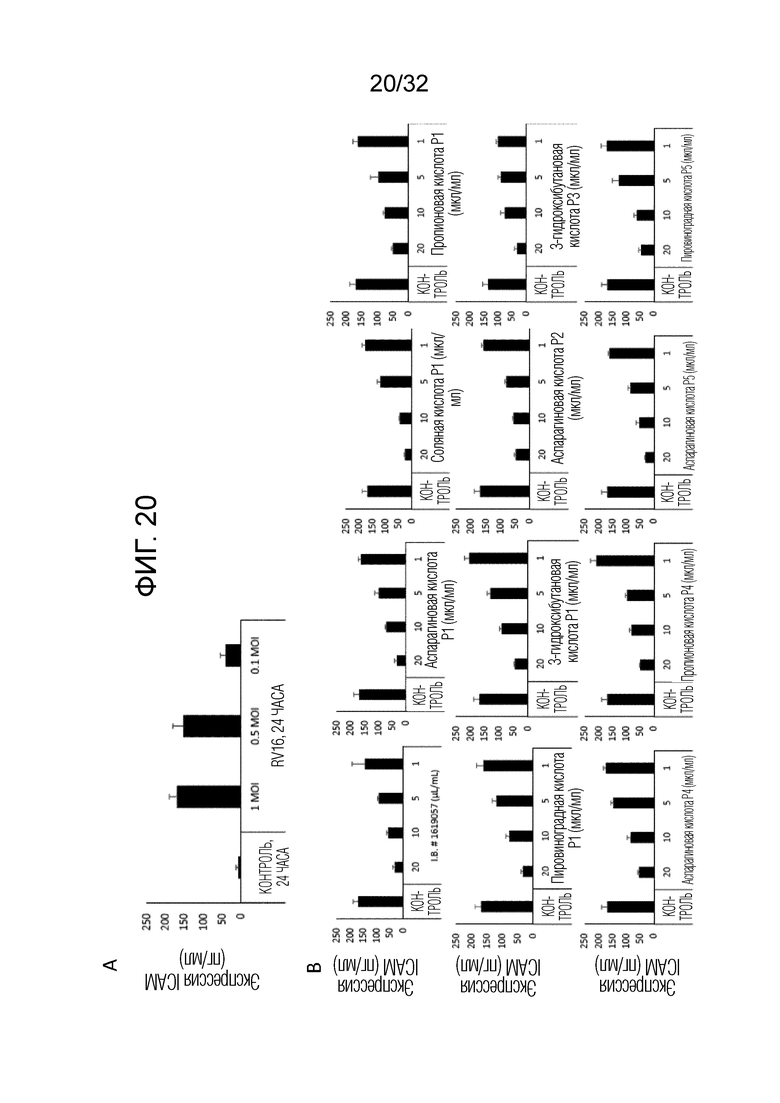
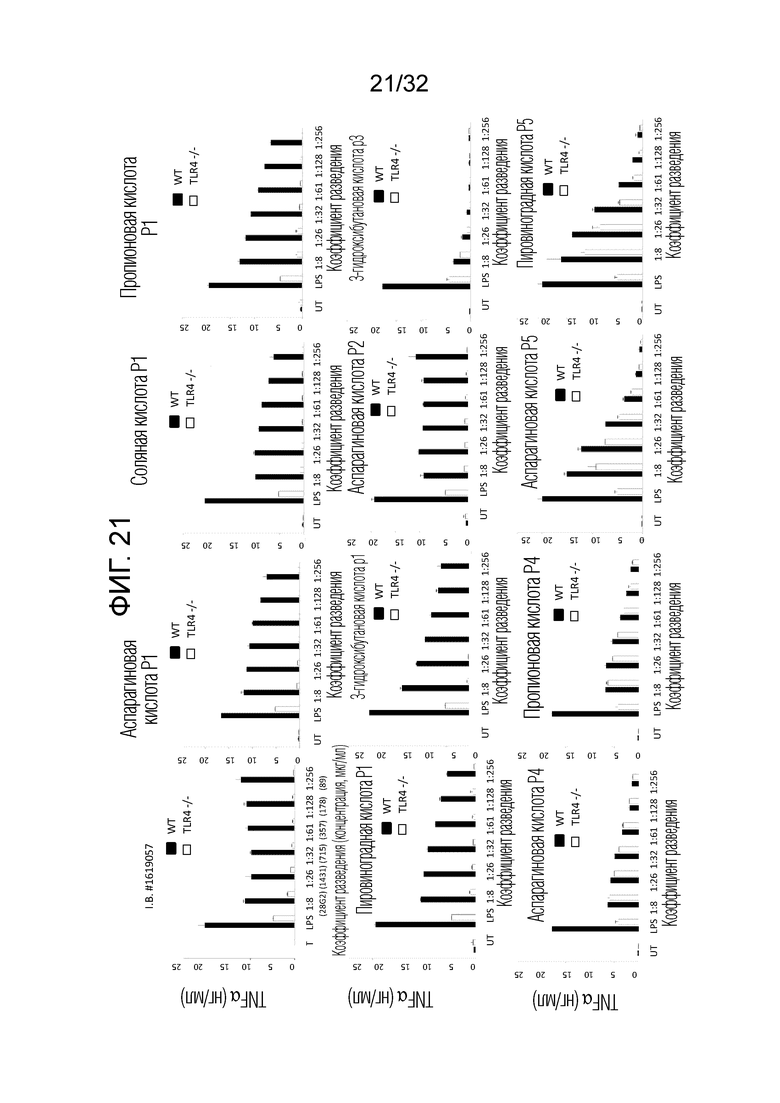
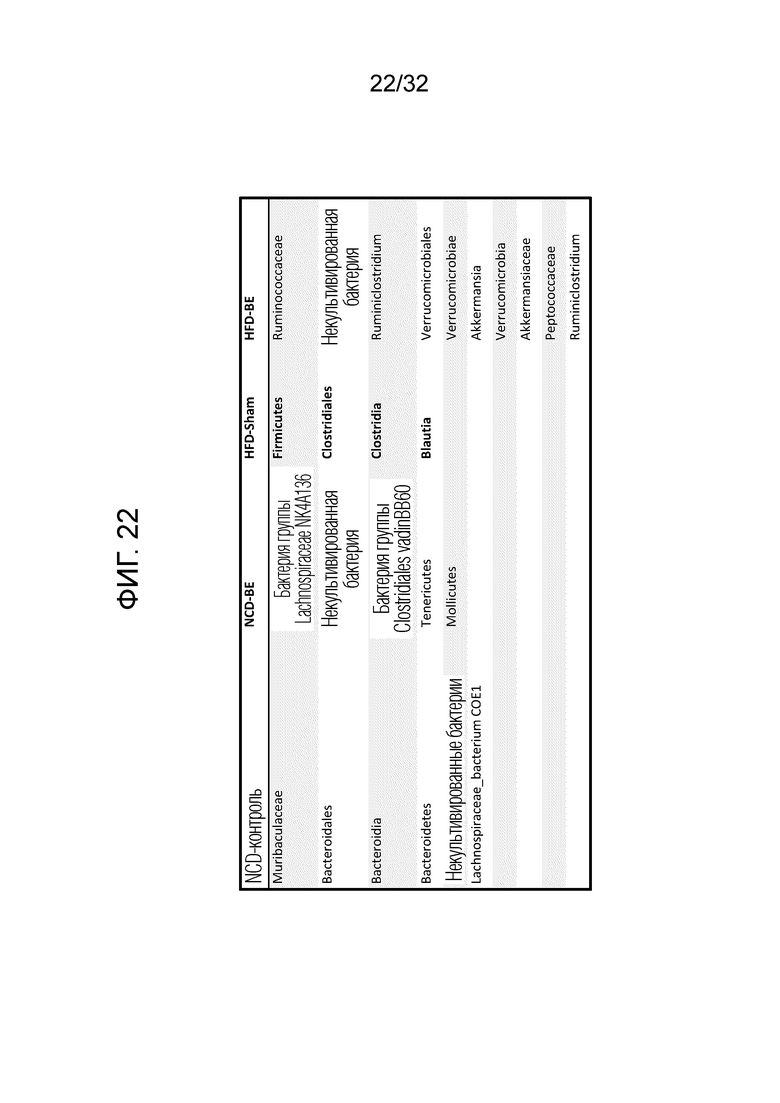
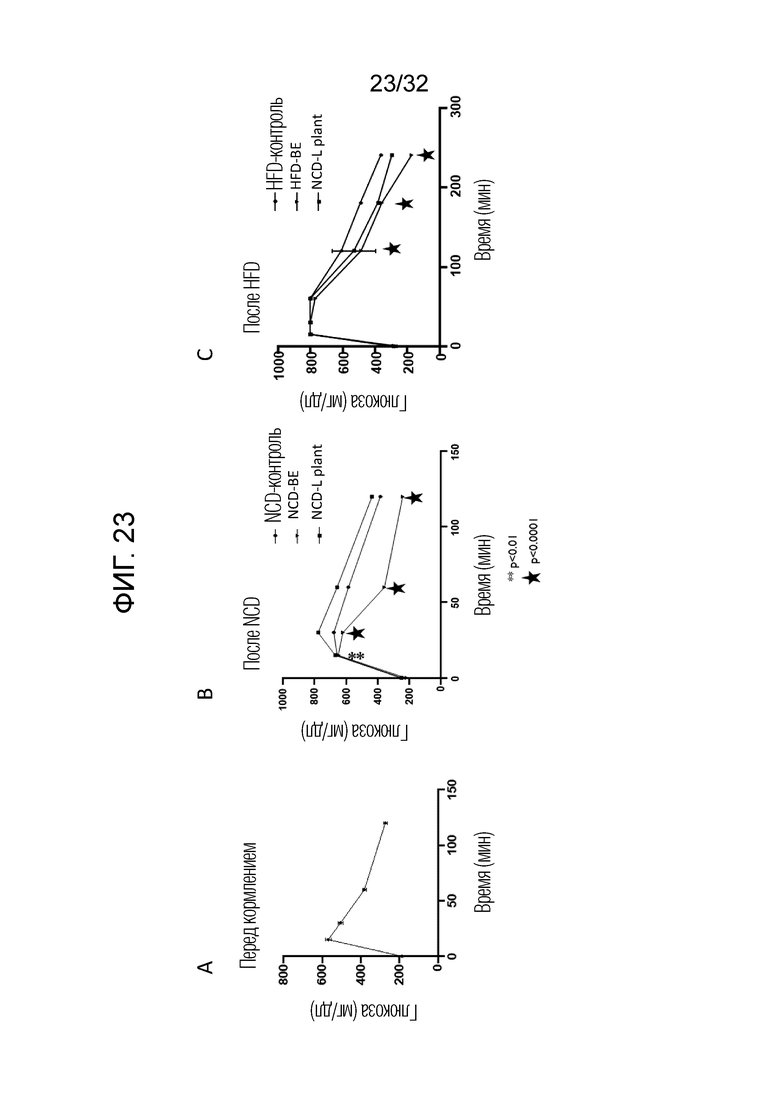
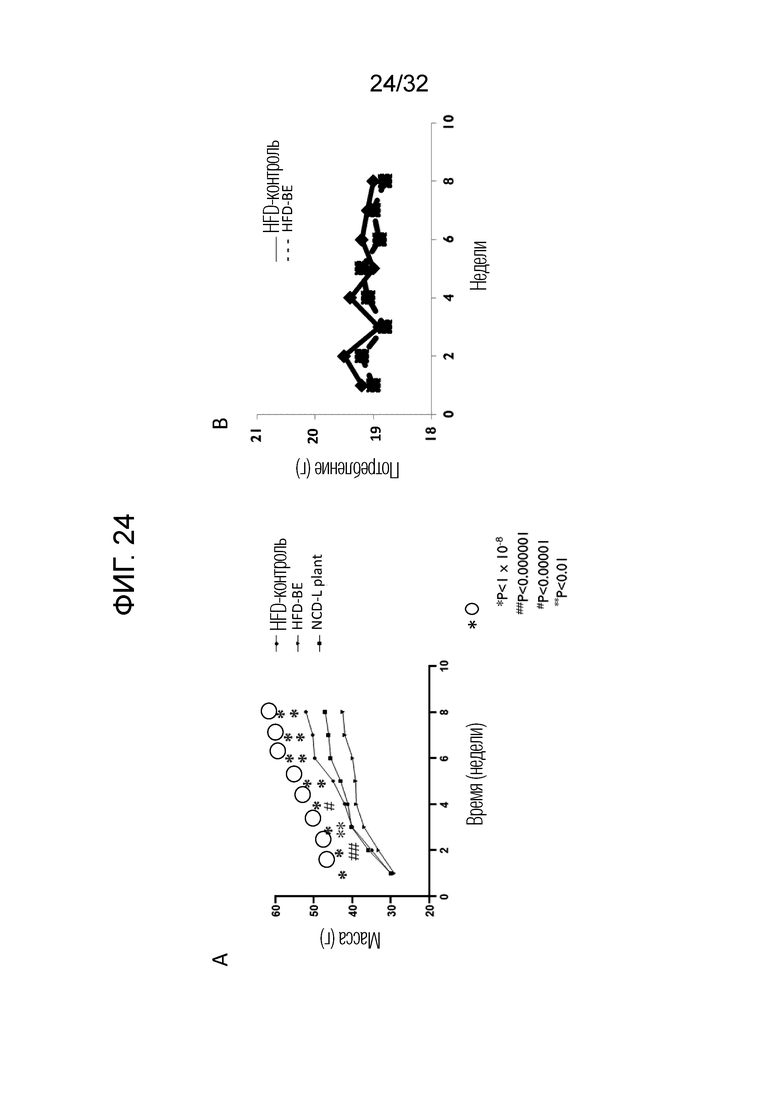
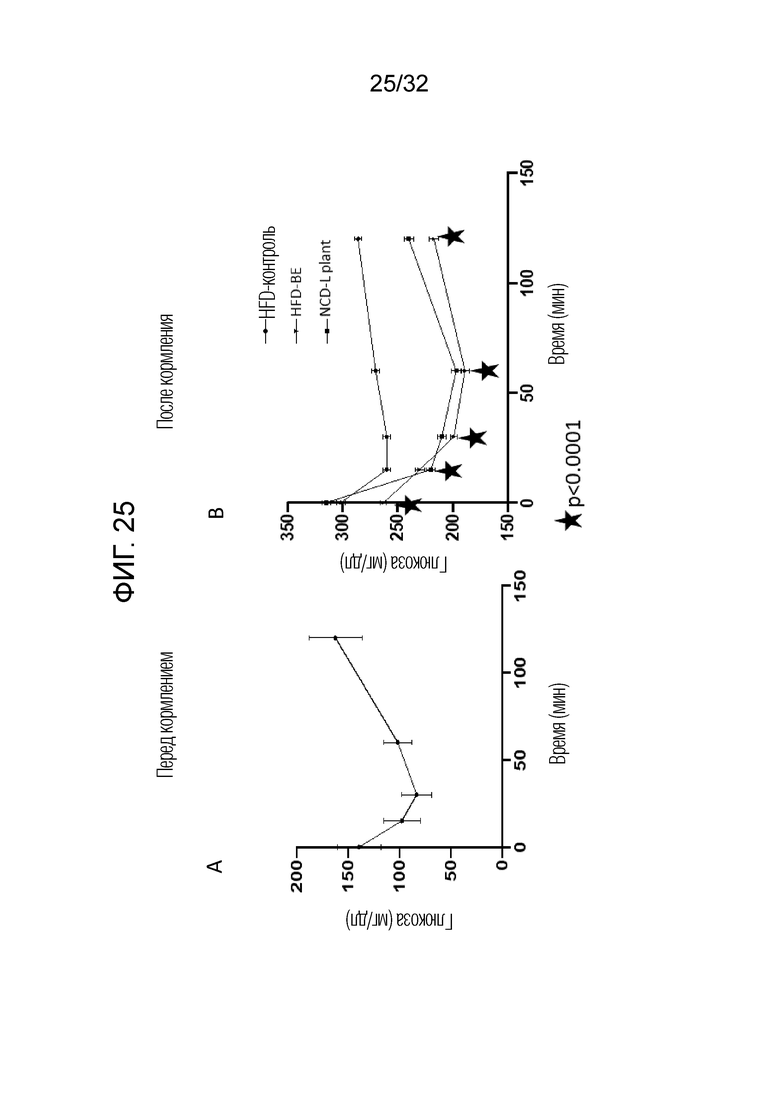
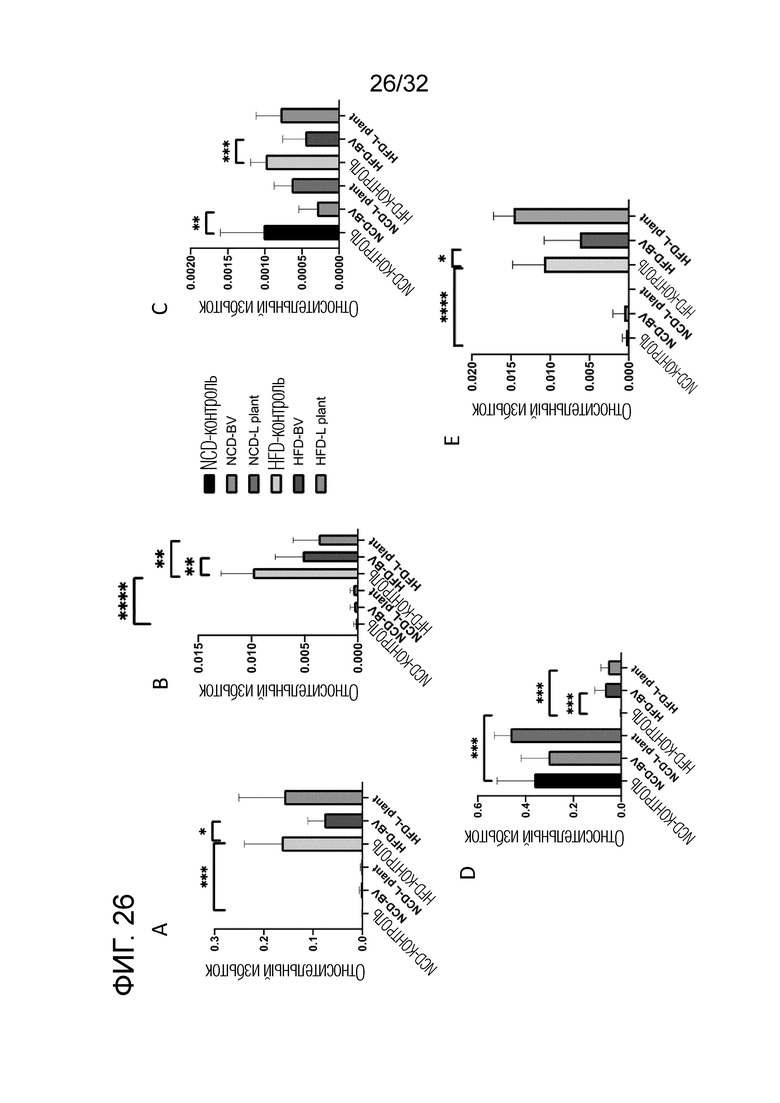
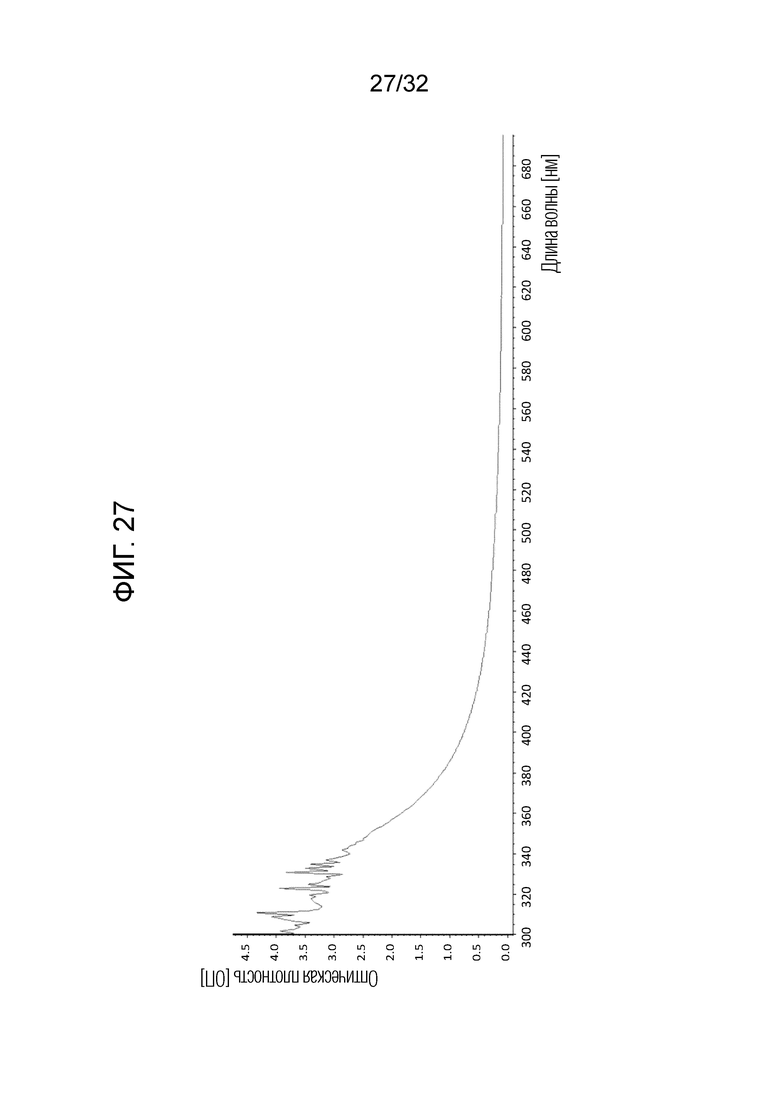
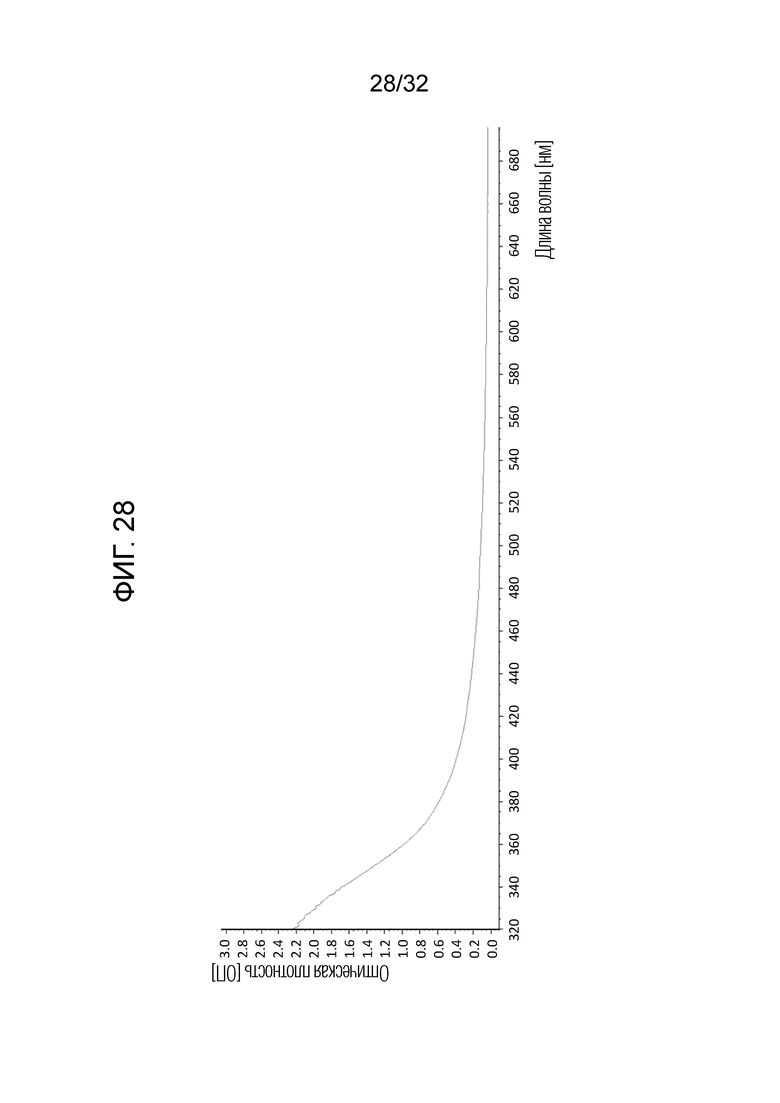
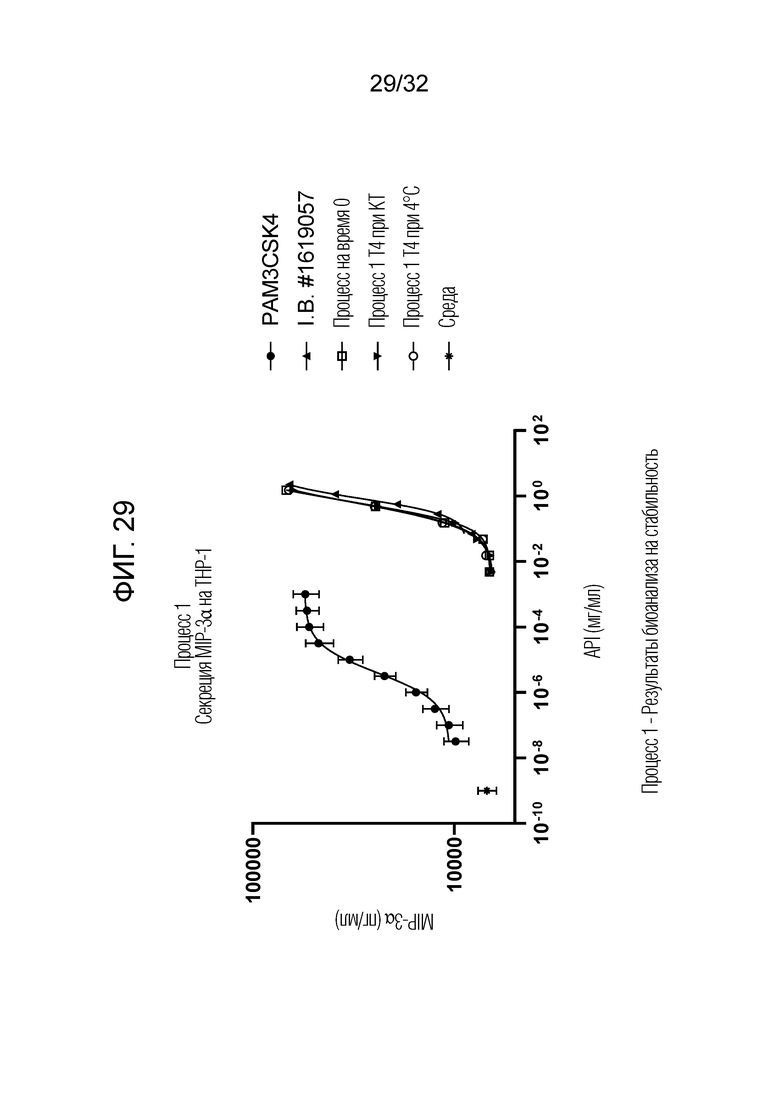
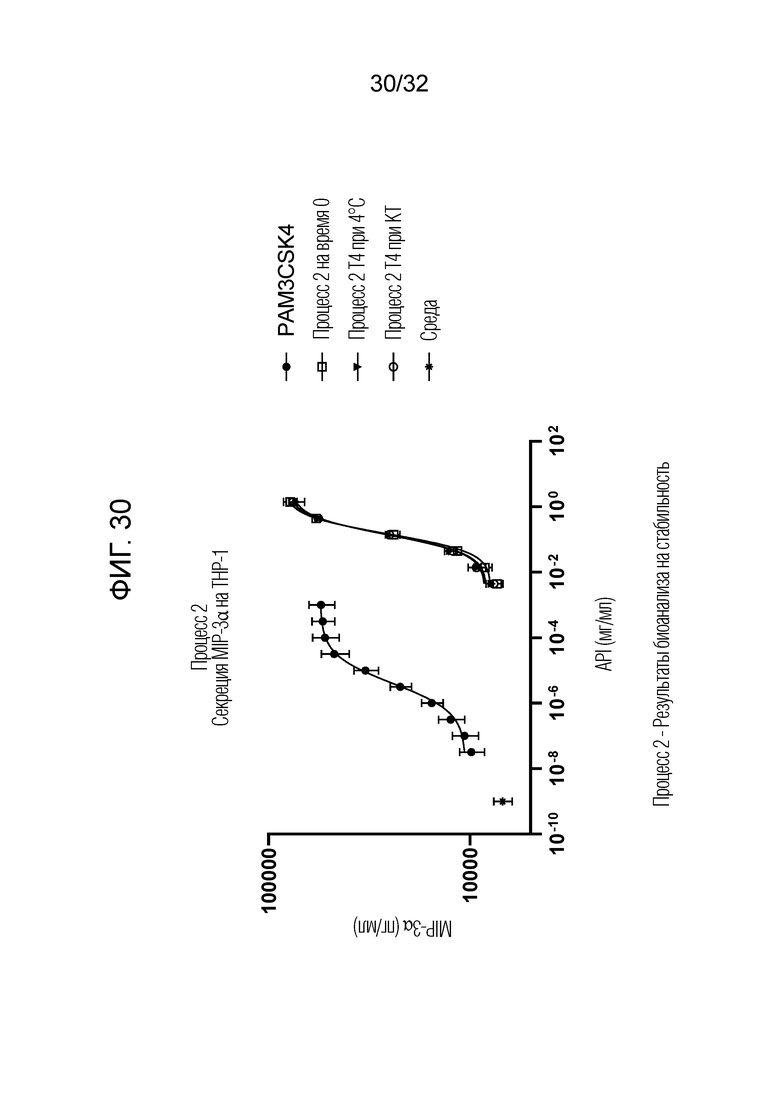
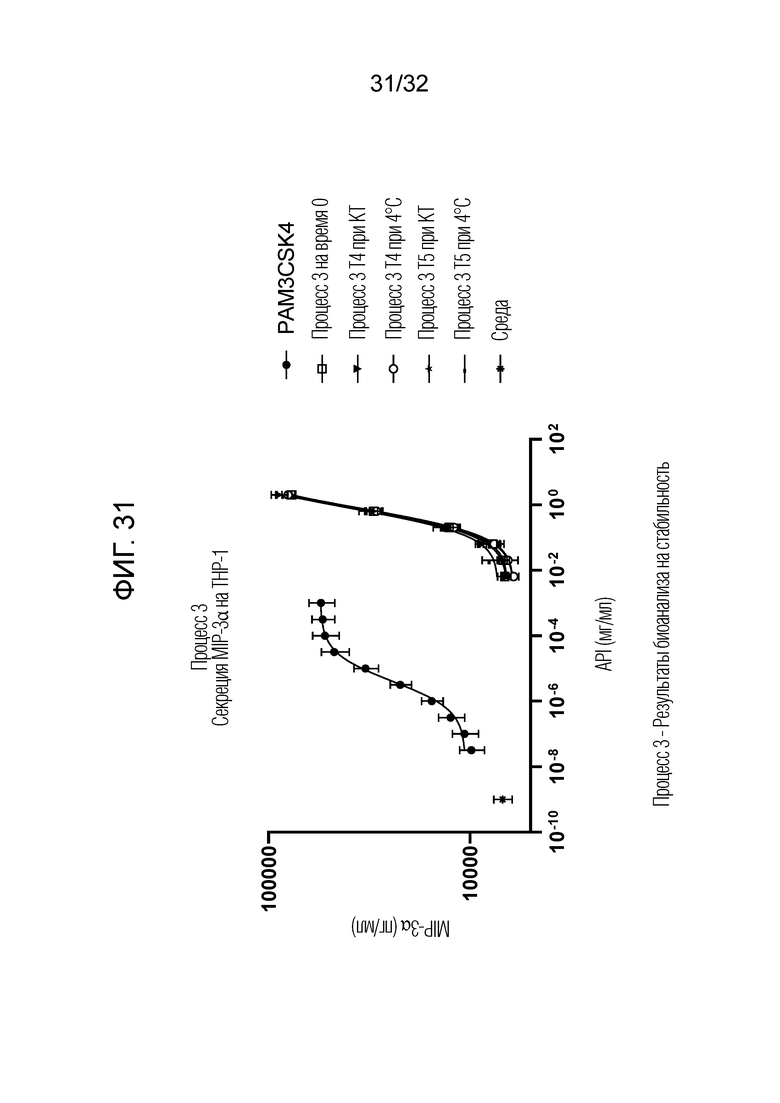
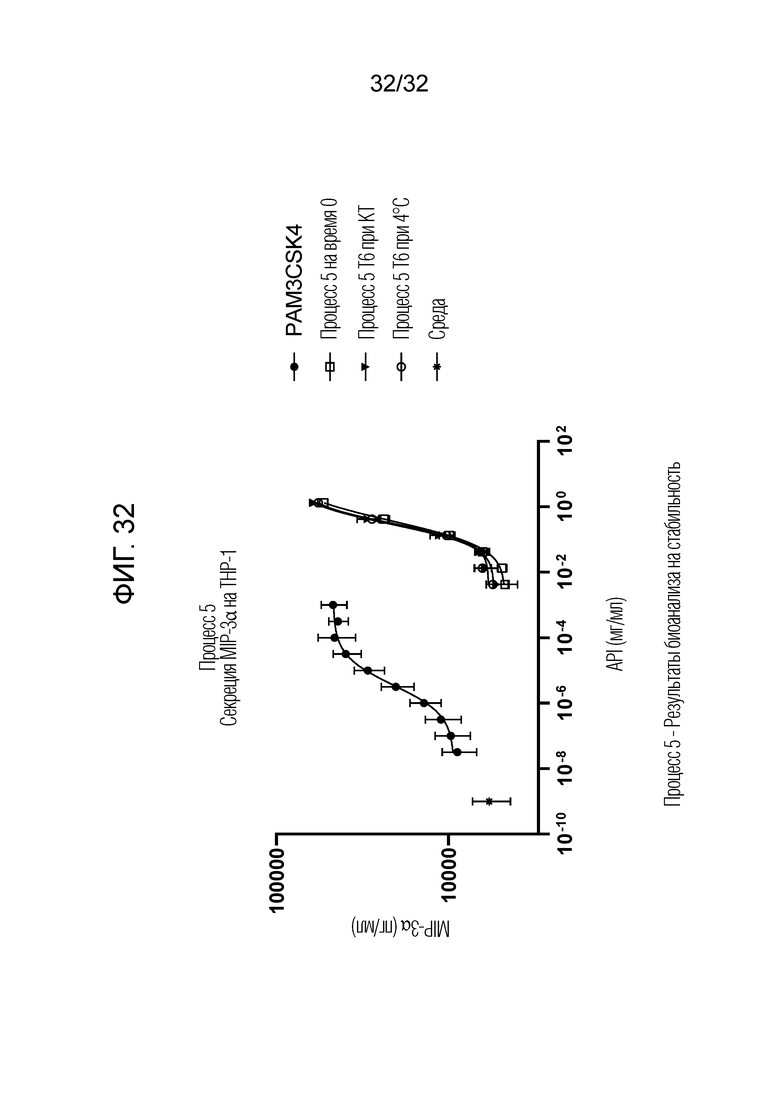
Группа изобретений относится к биотехнологии. Предложены бактериальный экстракт из грамположительных и/или грамотрицательных видов бактерий, выбранных из Moraxella cataralis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, штаммов бактерий Lactobacillus и/или штаммов бактерий Escherichia coli, для лечения инфекций и воспалений и способ его получения, включающий щелочной лизис указанных видов бактерий и нейтрализацию по меньшей мере одной органической кислотой, выбранной из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты и аспарагиновой кислоты; фармацевтическая композиция, содержащая указанный бактериальный экстракт, ее применение и устройство для ее доставки для лечения и/или профилактики острых и хронических иммунологических расстройств, возникающих в результате инфекций и/или воспалений. Изобретения направлены на расширение арсенала средств, обладающих терапевтическими иммуномодулирующими свойствами с повышенной стабильностью, обеспечивающей альтернативные пути введения. 5 н. и 13 з.п. ф-лы, 32 ил., 27 табл., 11 пр.
1. Бактериальный экстракт из грамположительных и/или грамотрицательных видов бактерий, выбранных из Moraxella cataralis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, штаммов бактерий Lactobacillus и/или штаммов бактей Escherichia coli, для лечения инфекций и воспалений, где указанный бактериальный экстракт может быть получен путем щелочного лизиса указанных видов бактерий и нейтрализации по меньшей мере одной органической кислотой, выбранной из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты и аспарагиновой кислоты, с последующей очисткой путем фильтрации нейтрализованного экстракта и доведением конечного физиологического pH путем добавления по меньшей мере одной органической кислоты, выбранной из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты и аспарагиновой кислоты, используемой для указанной нейтрализации.
2. Бактериальный экстракт по п.1, содержащий уменьшенную фракцию компонентов с молекулярной массой от 0 до 300 кДа, от 0 до 100 кДа или от 0 до 60 кДа.
3. Бактериальный экстракт по п.1, где указанная очистка включает фильтрацию с помощью фильтров от 1,2 до 0,1 мкм, или фильтров от 0,65 до 0,2 мкм, или фильтров 0,45 мкм.
4. Бактериальный экстракт по любому из пп. 1-3, где указанный щелочной лизис проводят при рН более чем 10 с отклонениями рН±0,1.
5. Бактериальный экстракт по любому из пп. 1-4, где конечный рН был скорректирован в пределах от 5 до 8, от 6 до 8, от 6,3 до 7,8 или от 6,5 до 7,8.
6. Бактериальный экстракт по любому из пп. 1-5, где указанные штаммы Lactobacillus содержат один или более из Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus Lactis и/или Lactobacillus delbrueckii.
7. Бактериальный экстракт по любому из пп. 1-6, где указанный стабильный очищенный бактериальный экстракт содержит менее 100 мкг/мл нуклеиновых кислот и/или по меньшей мере 0,1 мг/мл сахаридов.
8. Бактериальный экстракт по любому из пп. 1-7, являющийся стабильным в жидкой форме при комнатной температуре, 4°С, -20°С или при -80°С.
9. Фармацевтическая композиция для лечения или профилактики острых и хронических иммунологических расстройств, вызываемых инфекциями, или воспалениями, или новообразованиями, или дисбактериозом, содержащая бактериальный экстракт по любому из пп. 1-8 и фармацевтически приемлемый эксципиент или носитель, причем указанная фармацевтическая композиция может быть в форме твердого, полутвердого, жидкого или аэрозольного состава, и причем указанная композиция может быть составлена для интраназального введения, интратрахеального введения, введения в слизистую, введения через слизистую, нанесения на кожу, трансбуккального введения, подъязычного введения, перорального введения, введения в легкие, внутрибронхиального введения и/или внутрилегочного введения.
10. Фармацевтическая композиция по п. 9, где указанная фармацевтическая композиция представляет собой жидкость или аэрозоль и составлена в виде спрея, капель, коллоида, тумана, аэрозоля и/или распыленного пара, или где указанная композиция является жидкой или полутвердой и приготовлена в форме эмульсий, микроэмульсий, водных дисперсий, масел, молочка, бальзамов, пены, водных или масляных лосьонов, водных или масляных гелей, кремов, растворов, водно-спиртовых растворов, гидрогликолевых растворов, гидрогелей, сывороток, мазей, муссов, паст или трансдермальных пластырей, или где указанная композиция является твердой и составлена в виде порошка и/или измельчаемой таблетки.
11. Применение фармацевтической композиции по п.9 или 10 в способе лечения или профилактики острых и хронических иммунологических расстройств, вызываемых инфекциями, или воспалениями, или новообразованиями, или дисбактериозом.
12. Применение по п.11, где указанные инфекции выбраны из инфекций верхних и нижних дыхательных путей и/или ассоциированных с ними осложнений, таких как аллергический ринит, ринит, назофарингит, синусит, гиперчувствительный пневмонит, бронхопневмония, бронхит, бронхиолит, пневмония, обструктивная болезнь легких с острой инфекцией нижних дыхательных путей, обструктивная болезнь легких с острыми инфекциями верхних дыхательных путей или заболевания с нарушением движения эпителиальных ресничек и/или нарушением выведения слизи и где указанные инфекции могут дополнительно включать вторичные инфекции, бактериальные вторичные инфекции, вызываемые вирусными инфекциями, нереспираторными вирусными инфекциями, нереспираторными бактериальными инфекциями, системными инфекциями, такими как сепсис, септический шок или индуцированные вирусом осложнения.
13. Применение по п. 11, где указанные инфекции выбраны из вирусных инфекций, гриппа, респираторно-синцитиального вируса, риновируса, коронавируса, CoV, SARS-CoV и MERS-CoV.
14. Применение по п. 11, где указанной инфекцией является COVID-19.
15. Применение по п. 11, где указанные воспаления выбраны из аллергических/атопических респираторных и нереспираторных признаков атопического дерматита, острого и/или хронического ассоциированного дерматита, анафилаксии или пищевых аллергий, или где указанные воспаления включают кожные расстройства, воспаления кожи, экзему, розацея, атопический дерматит, псориаз, актинический кератоз, или где указанные воспаления выбраны из эозинофильных расстройств, таких как эозинофильная астма или эозинофильная пневмония, или где указанные воспаления выбраны из аутоиммунных заболеваний, ассоциированных с преобладанием Т-хелперов 2.
16. Применение по п. 11, где указанные расстройства, ассоциированные с дисбактериозом, выбраны из ожирения, астмы, диабета, аутоиммунных заболеваний, заболеваний, связанных с низким уровнем клетчатки, атопического дерматита, острого и/или хронического ассоциированного дерматита или где связанные с дисбактериозом расстройства выбраны из воспалительных заболеваний кишечника, включая язвенный колит, болезнь Крона, колит, диабета типа 2, аутоиммунных заболеваний или заболеваний, ассоциированных с низким содержанием клетчатки.
17. Устройство для доставки фармацевтической композиции по любому из пп. 9 или 10, где указанное устройство для доставки выбрано из группы, включающей устройство для назальной инсуффляции, интраназальный ингалятор, устройство для интраназального распыления, распылитель, флакон для назального спрея, контейнер для унифицированной дозы, насос, капельницу, флакон для выдавливания, аэрозольный распылитель, дозирующий ингалятор MDI, ингаляторы под давлением для введения дозы, инсуффляторы, двунаправленные устройства, ампулы с дозами, носовые подушечки, носовые губки и носовые капсулы.
18. Способ получения стабильного бактериального экстракта по любому из пп. 1-8, включающий следующие стадии:
а) культивирование бактериального штамма каждого указанного вида в подходящей культуральной среде,
b) инактивация бактерий путем обработки нагреванием, удаление культуральной среды и сбор концентрированной биомассы,
с) лизис каждого штамма при исходном рН предпочтительно более чем 10,
d) снижение pH экстракта(ов), полученного(ых) на стадии с) до 7,0±0,2 – 7,5±0,2 путем добавления по меньшей мере одной органической кислоты, выбранной из уксусной кислоты, пропионовой кислоты, молочной кислоты, 3-гидроксипропановой кислоты, пировиноградной кислоты, бутановой кислоты, 2-гидроксибутановой кислоты, 3-гидроксибутановой кислоты, глутаминовой кислоты, аспарагиновой кислоты,
е) пропускание продукта стадии d) по меньшей мере один раз через микрофильтр и удержание продукта на ультрафильтре для получения очищенного растворимого экстракта.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| БАКТЕРИАЛЬНЫЙ ЭКСТРАКТ ПРОТИВ РАССТРОЙСТВ ПИЩЕВАРИТЕЛЬНОГО ИЛИ МОЧЕВОГО ТРАКТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2457848C2 |
| ИММУНОМОДУЛИРУЮЩИЕ ЭКСТРАКТЫ ИЗ БАКТЕРИЙ Lactobacillus И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2008 |
|
RU2500412C2 |
| 2009 |
|
RU2515054C2 |
Авторы
Даты
2024-06-06—Публикация
2020-03-12—Подача