Изобретение относится к медицине, а именно к способу восстановления утраченной памяти в норме и патологии в результате неблагоприятных воздействий или времени, с использованием новых соединений не пептидной природы, фармацевтической композиции и лекарственному средству на их основе.
В настоящее время серьезной медицинской проблемой является деменция, особенно у людей пожилого возраста, которая проявляется у 4% населения в возрасте 65 лет и, по крайней мере, у 35% населения в возрасте 85 лет. В 2005 году в мире насчитывалось более 24 миллионов больных, страдающих от деменции, связанной с увеличением продолжительности жизни. Предполагается, что число больных, страдающих от деменции, достигнет 80 миллионов в 2040 году. Наиболее распространенной формой деменции является болезнь Альцгеймера (БА, около 60% всех случаев), представляющая собой прогрессирующее необратимое нейродегенеративное заболевание с недостаточно изученным патогенезом и практически не имеющая эффективных средств лечения. На протяжении многих лет ведется разработка средств для борьбы с заболеванием.
Формирование памяти представляет собой многостадийный процесс. Его первым этапом является процесс обучения, связанный с приобретением новой информации. Решающую роль на этом этапе играет активация АМРА рецепторов, и поэтому вещества, потенцирующие работу АМРА рецепторов, как правило, улучшают процесс запоминания (J.C.Quirk, E.S.Nisenbaum. A novel positive allosteric modulator of АМРА receptors. CNS Drug reviews. 2002, 8, 3:255-282). Однако, после того как процесс обучения закончился, данные вещества теряют свою эффективность. При этом сама память подвергается дальнейшей консолидации, при которой она переходит из кратковременной в долговременную форму. Этот процесс поддерживается за счет иных внутриклеточных механизмов, включающих в себя экспрессию генов и синтез новых белков и не вовлекающих активность АМРА рецепторов.
Обучение может быть сильным или слабым в зависимости от интенсивности и силы обучающего события. При слабом обучении необходимы дополнительные средства, чтобы сформировалась долговременная память. При слабом обучении формируется кратковременная память, которая проявляется при тестировании через 4-6, но не через 24 часа после обучения. Эта память может быть усилена введением некоторых соединений, например агонистов оксида азота, стероидных гормонов, определенных пептидов (Rickard N.S., Ng K.T., Gibbs M.E. A nitric oxide agonist stimulates consolidation of long-term memory in the 1-day-old chick. Behav Neurosci. 1994, 108:640-4; Sandi C., Rose S.P., Mileusnic R., Lancashire C. Corticosterone facilitates long-term memory formation via enhanced glycoprotein synthesis. Neuroscience 1995, 69:1087-93; Mileusnic R., Lancashire C.L., Rose S.P. The peptide sequence Arg-Glu-Arg, present in the amyloid precursor protein, protects against memory loss caused by A beta and acts as a cognitive enhancer. Eur J Neurosci. 2004, 19:1933-8).
Формирование долговременной памяти начинается с сильного обучения и обеспечивается синтезом новых белков в мозге, который начинается сразу после обучения (Davis H.P., Squire L.R. Protein synthesis and memory: a review. Psychol. Bull. 1984, 96:518-559). Введение в мозг блокаторов синтеза белка препятствует формированию долговременной памяти, в результате чего при тестировании через 24 часа после обучения доля животных, демонстрирующих выученное поведение, снижена (Goelet, P., Castelluci, V.F., Schacher, S., Kandel, E.R. The long and short of long-term memory - a molecular framework. Nature 1986, 322:419-423; Gibbs M.E., Ng, K.T. Psychobiology of memory: Towards a model of memory formation. Biobehav. Rev. 1977, 1:113-136; Mark, R.F., Watts, M.E. Drug inhibition of memory formation in chickens. II. Long-term memory. Proc. R. Soc. Lond. B. Biol. Sci. 1971, 178:439-454).
Забывание проявляется в невозможности или затруднении извлечения памяти. Природа забывания остается малоизученной, и рассматриваются сценарии как утраты следов памяти со временем, так и затруднений извлечения информации, продолжающей оставаться в памяти. Одним из способов извлечения памяти, в том числе и ослабленной, является напоминание. Напоминание представляет собой предъявление субъекту одного из компонентов ситуации обучения, приводящее к реактивации ранее сформированного следа памяти.
Способы и вещества, способные восстанавливать утраченную память, крайне немногочисленны и неудобны для применения с практической точки зрения. Они включают в себя сочетание напоминания с определенными воздействиями: электростимуляция ретикулярной формации мозга или голубого пятна, введение моносахаридов или стрихнина (DeVietti.T.L., Hopfer T.M.. Complete amnesia induced by ECS and complete recovery of memory following reinstatement treatment. Physiol. Behav. 1974, 12:599-603; Rodriguez, W.A., Horne C.A., Padilla J.L. Effects of glucose and fructose on recently reactivated and recently acquired memories. Prog. Neuropsychopharmacol. Biol. Psychiatry 1999, 23:1285-1317; Sara, S.J., Deweer В., Hars В. Reticular stimulation facilitates retrieval of a "forgotten" maze habit. 1980, Neurosci. Lett. 18:211-217; Gordon W.C. Susceptibility of a reactivated memory to the effects of strychnine: a time-dependent phenomenon. Physiol. Behav. 1977, 18:95-99).
Очевидно, что в реальной жизни невозможно восстанавливать память людей с использованием стимуляции ретикулярной формации или голубого пятна головного мозга при помощи вживленных в мозг электродов. Также практически неприменимо использование «крысиного яда» - стрихнина. Съедание кусочков сахара полезно для работы мозга, но вряд ли оно может рассматриваться как существенная помощь для извлечения памяти, особенно в случае патологических нарушений этого процесса. Таким образом, в фармакопее практически отсутствуют лекарства, способные восстанавливать утраченную память.
Известны соединения, которые можно отнести к производным амидов, арил(гетарил)глицинов например, описанные в RU 2270198, WO 03/082819, RU 2167866, US 6630451 могут быть использованы как средства, усиливающие секрецию гормона роста, как анальгетики либо в качестве антагонистов нейрокинина или как антагонисты рецептора тромбина, соответственно. При этом в двух последних случаях предполагается использование известных соединений для лечения нейродегенеративных заболеваний. Указанные соединения являются наиболее близкими по структуре к соединениям, используемым в настоящем изобретении.
Задачей, на решение которой направлено настоящее изобретение, является разработка способа восстановления утраченной памяти в норме и патологии, у пациентов всех возрастных групп, с использованием нового класса соединений с ранее неизвестными свойствами, обладающих направленным действием и не влияющих на другие функции организма, а также фармацевтических композиций и лекарственных средств на основе этих соединений.
Поставленная задача решается способом восстановления памяти, утраченной в результате патологии, неблагоприятных воздействий или времени, включающим введение эффективного количества производных амидов (гет)арилглицинов общей формулы I:
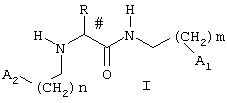
в которой n и m могут принимать значения 0, 1, 2 и 3;
знак (#) здесь и далее обозначает возможность наличия хирального центра;
R представляет необязательно замещенный C5-C10арил или 5-7-членный гетарил, содержащий 1-4 гетероатома, выбранных из азота, кислорода и серы, возможно, конденсированный с бензольным кольцом;
A1 и A2 независимо представляют необязательно замещенный 3-7-членный насыщенный, частично насыщеный или ароматический азагетероцикл, содержащий от 1 до 3 атомов азота в цикле и, возможно, конденсированный с бензольным кольцом;
или их фармацевтически приемлемых солей или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей.
Предпочтительными для использования являются соединения, представляющие собой (азагетероциклил)алкильные производные амидов арилглицинов общей формулы I.1
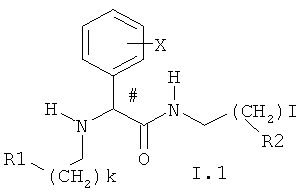
в которой k и I могут принимать значения 0 и 1;
X представляет H, необязательно замещенный алкил, необязательно замещенный C1-C8алкокси, галоген, OH, CF3, CN, CF3O, необязательно замещенную амино-группу, C1-C6ацильную группу, необязательно замещенный C6арил или 5-6-членный гетарил, содержащий 1-3 гетероатома, C2-C4алкенил, C2-C4алкинил, C6арC1-C6алкил, C1-C8алкоксикарбонил, 5-6-членный гетарил, содержащий 1-2 гетероатома выбранных из азота, кислорода и серы, C6арилсульфонил или C1-C8алкилсульфонил, необязательно N-замещенный аминосульфонил; либо группа Х означает бензольное кольцо, аннелированное с фенилом или 5-7-членным гетероциклилом, содержащим 1-3 гетероатома, выбранных из атомов азота, кислорода, серы;
R1 и R2 независимо представляют необязательно замещенный азагетероцикл, такой как пиридин, пиперидин, пиримидин, триазин, хинолин, изохинолин, хиназолин, хиноксалин.
При этом особенно предпочтительны соединения I.1 в виде отдельных изомеров или в виде смеси R-(-)- и S-(+)-изомеров, соответственно представленных общими формулами I.1.1 и I.1.2:
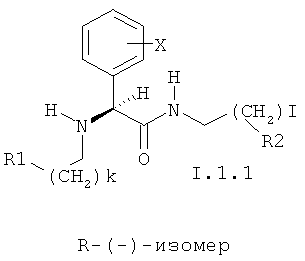

в которых k и I могут принимать значения 0 и 1;
X представляет H, необязательно замещенный C1-C8алкил, необязательно замещенный C1-C4алкокси, галоген, OH, CF3, CN, CF3O, необязательно замещенную амино-группу, C1-C6ацильную группу, необязательно замещенный C6арил или 5-6-членный гетарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода или серы, C2-C4алкенил, C2-C4алкинил, C6арC1-C6алкил, C1-C8алкоксикарбонил, карбоксигруппу, C6арилсульфонил или C1-C8алкилсульфонил, необязательно N-замещенный аминосульфонил; либо группа X означает бензольное кольцо, аннелированное с фенилом или 5-7-членным гетероциклилом, содержащим 1-3 гетероатома, выбранных из атомов азота, кислорода, серы;
R1 и R2 независимо представляют необязательно замещенный азагетероцикл, такой как пиридин, пиперидин, пиримидин, триазин, хинолин, изохинолин, хиназолин, хиноксалин.
В соединения настоящего изобретения общей формулы I в группах A1, A2, R C1-C8алкил представляет собой линейный или разветвленный алкил, возможно, циклический алкил, в котором одна или несколько CH2 групп могут быть заменены атомами кислорода, азота или серы. Примерами таких групп могут быть метил, этил, н.пропил, изопропил, н.бутил, трет бутил, пентил, гексил, н.гептил, изогептил, циклопропил, циклобутил, циклолпентил, циклогексил, циклогептил, циклооктил и др. Заместители алкила могут быть выбраны из атомов галогена, C1-C8, предпочтительно C1-C4алкокси, галогенированного C1-C4алкокси, гидрокси, арилокси, амино, моно- или C1-C4алкиламина, циано, нитро и др. Примерами таких групп являются прежде всего метокси, метоксиэтокси, этоксиметокси, пропоксиэтоксиэтил, изопропоксиэтокси, трифторметил, перфторэтил, дифторметил, фторметил, дифторметокси, трифторметокси, гидроксиметил, дигидроксиэтил, гидроксиэтил, фенилокси, дифенилокси, нафтилокси, аминометил, аминоэтил, диаминопропил и др.
Заместители амино-группы выбираются прежде всего из C1-C8алкила, преимущественно C1-C4алкила, который может быть разветвленным, или C1-C8алкила, замещенного гидрокси, C1-C4алкокси или амино, моно- или C1-C4алкиламингруппами. Примерами таких групп являются прежде всего моно- или диметиламино, моно- или диэтиламино, моно- или дигидроксиC1-C4алкиламино, гидроксиметиламино, этоксиметиламино, дигидроксиэтиламино, метоксиэтиламино, трифторметилэтиламино, фторметилэтиламино, дифторметоксиметиламино и др.
Заместители арила или гетарила, выбираются из H, необязательно замещенного алкила, где заместители указаны выше, необязательно замещенного C1-C4алкокси, например галогенированного алкокси, такого как CF3O, галогена, OH, CN, необязательно замещенной, как указано выше, амино-группы, C1-C6ацильной группы, необязательно замещенного C6арила или 5-6-членного гетарила, содержащего 1-3 гетероатома, где в каждом ариле и гетариле заместители могут быть выбраны из галогена, C1-C4алкила, C2-C4алкенила, C2-C4алкенила, C2-C4алкинила, C6арC1-C6алкила, C1-C8алкоксикарбонила, карбоксигруппы, 5-6-членного гетарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, C6арилсульфонила или C1-С8алкилсульфонила, необязательно N-замещенного, как указано выше, аминосульфонила. Аннелированные группы также могут быть замещены, например, атомами галогена, C1-C4алкилом, C1-C4алкокси.
Примерами таких заместителей могут быть метил, этил, изопропил, н-пропил, изобутил, s-бутил, трет бутил, гексил, нонил циклопропил, циклогексил, циклобутил, циклопентил, циклооктил и др.
Заместители алкила могут быть выбраны из атомов галогена, таких как атомы хлора, брома, йода, C1-C8, предпочтительно C1-C4алкокси, например метокси, этокси, изопропокси, пропокси, бутокси изобутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, галогенированного C1-C4алкокси, например трифторметилокси, дифторметилокси, фторметилокси, гидрокси, арилокси, например, фенилокси, нафтилокси, возможно, замещенного амино, циано, нитро, алкилтио, например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, трет.бутилтио, циклоалкилтио, например циклопропилтио, циклобутилтио или циклогексилтио и др.
Заместители амино-группы выбираются прежде всего из C1-C8алкила, преимущественно C1-C4алкила, который может быть разветвленным, или C1-C8алкила и могут представлять собой моно- или C1-С8алкиламин, например монометил- или моноэтиламин, диметил- или диэтиламин, который в свою очередь может быть замещен гидрокси, C1-C4алкокси или амино, моно- или C1-C4алкиламино, атомами галогена, например дихлорметил, дифторметил, трифторметил, бромметил, трифторметокси, аминометил, монометиламинометил, диметиламинометил, диметиламиноэтил и т.д.
Заместители арила или гетарила, выбираются из H, необязательно замещенного алкила, где заместители указаны выше, необязательно замещенного C1-C4алкокси, например галогенированного алкокси, такого как CF3O, галогена, OH, CN, необязательно замещенной, как указано выше, амино-группы, C1-C6ацильной группы, необязательно замещенного C6арила или 5-6-членного гетарила, содержащего 1-3 гетероатома, где в каждом ариле и гетариле заместители могут быть выбраны из галогена, C1-C4алкила, C2-C4алкенила, C2-C4алкенила, C2-C4алкинила, C6арC1-C6алкила, C1-C8алкоксикарбонила, карбоксигруппы, 5-6-членного гетарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, C6арилсульфонила или C1-C8алкилсульфонила, необязательно N-замещенного, как указано выше, аминосульфонила. Бензольное кольцо, аннелированное с фенилом или 5-7-членным гетероциклилом, содержащим 1-3 гетероатома, выбранных из атомов азота, кислорода, серы, как правило, представляет собой бициклическую или трициклическую группу, выбранную, например, из нафталина, хинолила, индолила,бензопиразолила, бензотиофенила, бензофуранила, бензоизофуранила, бензодиоксалила, бензодиоксина, бензазепина, бензодиазепина, бензимидазола, бензизоксазолила, бензоксазолила, бензтиазолила, бензоизотиазолила, пиридопиримидина, пиридоимидазолила, пиридотриазолила и др. Аннелированные группы также могут быть замещены, например, атомами галогена, C1-C4алкилом, C1-C4алкокси.
В качестве фармацевтически приемлемых солей могут быть использованы соли галоидводородных солей, особенно хлоргидраты, бромгидраты, соли серной и сульфоновой кислоты, такие как мезилат, тозилат, соли фосфорной, малеиновой, фумаровой, молочной, лимонной, винной, янтарной, малоновой, уксусной кислоты, карбоновой кислоты, например бикарбонаты, соли металлов, особенно соли щелочных или щелочноземельных металлов.
Предпочтительные соединения могут быть выбраны, в частности, из соединений, указанных в таблице, или их фармацевтически активных солей, если они не указаны специально.
Соединения формулы 1 потенцируют токи АМРА рецепторов и тем самым могут быть полезны для улучшения когнитивных функций, таких как обучение, формирование, консолидация и извлечение памяти.
При этом неожиданно было обнаружено, что соединения формулы 1, кроме того, обладают также способностью влиять и на другие звенья памяти, а именно улучшать процессы извлечения памяти, что делает их уникальными и особо ценными среди всех известных препаратов, которые влияют на память.
Способность восстанавливать память с помощью соединений формулы 1, благодаря обнаружению у них новых неожиданных свойств, не является очевидной и не вытекает из химической структуры этих соединений. Указанные свойства позволяют использовать соединения в качестве средства для восстановления утраченной памяти в норме и патологии у пациентов всех возрастных групп. Соединения могут быть использованы для восстановления памяти, утраченной, например, в результате нейродегенеративного заболевания или других заболеваний ЦНС. Такими заболеваниями могут быть болезнь Альцгеймера, болезнь Паркинсона; болезни (хореи) Хантингтона; рассеянный склероз; мозжечкововая дегенерация; амиотрофический латеральный склероз; деменция с тельцами Леви; спинальная мускульная атрофия; периферическая нейропатия; губчатый энцефалит; СПИД-ассоциированная деменция; мультиинфарктная деменция; лобно-височная деменция; лейкоэнцефалопатия; хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсия; церебральная ишемия; глаукома; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластома; шизофрения; депрессия и нейродегенеративные процессы.
Изобретение также относится к использованию соединений формулы I, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей, в том числе предпочтительных соединений, соответствующих соединениям формулы I, I.1, I.1.1 и I.1.2, в качестве активного ингредиента для фармацевтических композиций и лекарственных средств для восстановления утраченной памяти в норме или патологии у пациентов всех возрастных групп, а также к фармацевтическим композициям и лекарственным средствам с использованием указанных активных ингредиентов.
Фармацевтическая композиция, обладающая способностью восстанавливать утраченную память в результате патологий, неблагоприятных воздействий или времени, согласно настоящему изобретению содержит одно или несколько соединений активного ингредиента, соответствующего соединениям формулы I, I.1, I.1.1 и I.1.2, или их фармацевтически приемлемых солей или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей в эффективном количестве и, по крайней мере, один фармакологически совместимый наполнитель, и/или растворитель, и/или разбавитель. При необходимости фармацевтическая композиция может содержать вспомогательные, распределяющие и воспринимающие средства, средства доставки, такие как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки. Выбор и соотношение указанных компонентов зависит от природы и способа назначения и дозировки.
Понятие «эффективное количество», используемое в данной заявке, подразумевает использование того количества соединения формулы 1, которое вместе с его показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной фармацевтической композиции или лекарственной форме.
Содержание активного ингредиента составляет обычно от 1 до 20 вес.%, в сочетании с одной или более фармацевтически приемлемыми вспомогательными добавками, такими как разбавители, связующие, разрыхляющие агенты, адсорбенты, ароматизирующие вещества, вкусовые агенты.
Изобретение относится также к лекарственному средству для восстановления утраченной памяти в результате патологии, неблагоприятных воздействий или времени в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, включающему в свой состав один или более активных ингредиентов I, I.1, I.1.1 и I.1.2, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей или фармацевтическую композицию на их основе.
Указанные фармацевтическая композиция и лекарственное средство могут быть получены известными в фармацевтике способами.
Для получения фармацевтической композиции активный ингредиент (соединение формулы 1) смешивается с фармацевтически приемлемым носителем, разбавителем или растворителем и при необходимости соответствующими добавками.
При этом лекарственное средство может быть в виде жидкой или твердой формы.
Примерами твердых лекарственных форм являются, например, таблетки, пилюли, желатиновые капсулы и др. Примерами жидких лекарственных форм для инъекций и парентерального введения являются растворы, эмульсии, суспензии и др. Получение указанных лекарственных форм осуществляется традиционными для фармацевтики методами - смешением компонентов, таблетированием, капсулированием и т.д.
Изобретение также относится к способам восстановления памяти, утраченной в результате нейродегенеративных заболеваний или в результате злоупотребления веществами, вызывающими зависимость, при воздействии нейротоксинов или других амнестических агентов, в результате черепно-мозговой травмы или других физических воздействий на ЦНС или в результате старения организма. Указанные способы осуществляются путем введения активного ингредиента, представляющего собой соединения формул I, I.1, I.1.1 и I.1.2, или его фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей. При этом во всех указанных случаях лекарственная доза лекарственного средства для введения активного компонента (млекопитающему, такому как животное или человек) составляет 0,005-1,5 мг/кг массы по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
Еще одним аспектом изобретения является способ восстановления утраченной памяти в норме и патологии у пациентов всех возрастных групп, заключающийся во введении пациенту фармакологического средства, содержащего эффективное количество лекарственного средства в дозе 0,005-1,5 мг/кг, предпочтительно 0,005-1 мг/кг, массы тела, по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
Соединение формулы 1 может вводиться в виде общепринятых оральных композиций, таких как таблетки, таблетки с покрытием, желатиновые капсулы с твердым и мягким покрытием, эмульсии или суспензии.
Назначаемая для приема доза активного компонента (соединения формулы 1) варьируется в зависимости от многих факторов, таких как возраст, пол, вес пациента, симптомов и тяжести заболевания, конкретно назначаемого соединения, способа приема, формы препарата, в виде которой назначается активное соединение.
Обычно общая назначаемая доза составляет от 0.5 до 80 мг в день. Общая доза может быть разделена на несколько доз, например, для приема от 1 до 4 раз в день. При оральном назначении интервал общих доз активного вещества составляет от 1 до 80 мг в день. При парентеральном приеме интервал назначаемых доз составляет от 0.5 до 40 мг в день, предпочтительно, а при внутривенных инъекциях - от 0.1 до 5 мг в день, предпочтительно. Точная доза может быть выбрана лечащим врачом.
Техническим результатом, который может быть получен при осуществлении изобретения, является восстановление утраченной памяти в норме и патологии у пациентов всех возрастных групп.
Используемые в предлагаемом изобретении соединения являются новыми и могут быть получены мультикомпонентной реакцией альдегида, амина, изонитрила и карбоновой кислоты, с последующим удалением N-ацильной группы в соответствии со схемой 1:
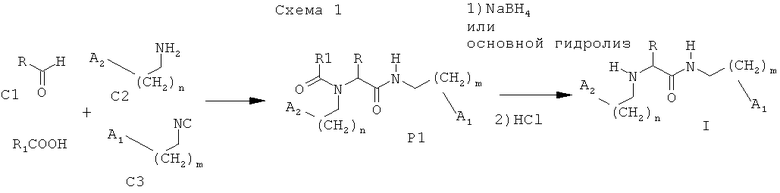
В мультикомпонентную реакцию в соответствии со схемой I вводят эквивалентные количества альдегида C1, амина С2, изонитрила С3 и карбоновой кислоты и процесс проводят при температуре 10-25°С в инертном протонном растворителе (метанол, этанол, трифторэтанол и подобных) или апротонном растворителе (гексан, циклогексан, этиленкарбонат, нитрометан и подобных) без катализатора или в его присутствии. При этом соединения формулы I получают, удаляя карбоксильную группу из полупродукта Р1 действием восстановительного агента, например, такого как борогидрид щелочного металла (NaBH4, LiBH4, KВН4), или действием основания, такого как гидроксиды или карбонаты щелочных металлов, или подобного.
Возможность осуществления изобретения с реализацией заявляемого назначения подтверждается, но не исчерпывается следующими сведениями. Приведенные ниже примеры иллюстрируют получение представителей предлагаемых соединений согласно изобретению, но не ограничивают последнее.
Все соединения, указанные ниже, как и соединения, перечисленные выше, но не упоминаемые в примерах, получены в соответствии со схемой 1.
Для синтеза были использованы следующие исходные реагенты и физико-химические методы доказательства строения синтезированных веществ и их чистоты.
Все растворители и реагенты были получены из коммерческих источников, таких как Sigma-Aldrich (США), Fluka (Германия), Acros (Бельгия) и Lancaster (Англия). Точки плавления (т.пл.) были получены на приборе фирмы Buchi модель В-520. 1Н и 13С ЯМР спектры были получены на спектрометрах фирмы Varian (300 MHz) в CDCl3, D2O и DMSO-d6, химические сдвиги приведены в шкале δ (м.д.). Внутренний стандарт тетраметилсилан.
Содержание основного вещества контролировали с помощью LC-MS на приборе Applied Biosystems (Shimadzu 10-AV LC, Gilson-215 автоматическая подача образца, масс-спектрометр API 150ЕХ, детекторы UV (215 и 254 нм) и ELS, колонка Luna-C18, Phenomenex, 5 см×2 мм). В соответствии с данными LC/MS все синтезированные соединения в спектрах MS имели молекулярный пик М+1, при этом содержание основного вещества во всех случаях было выше 95%.
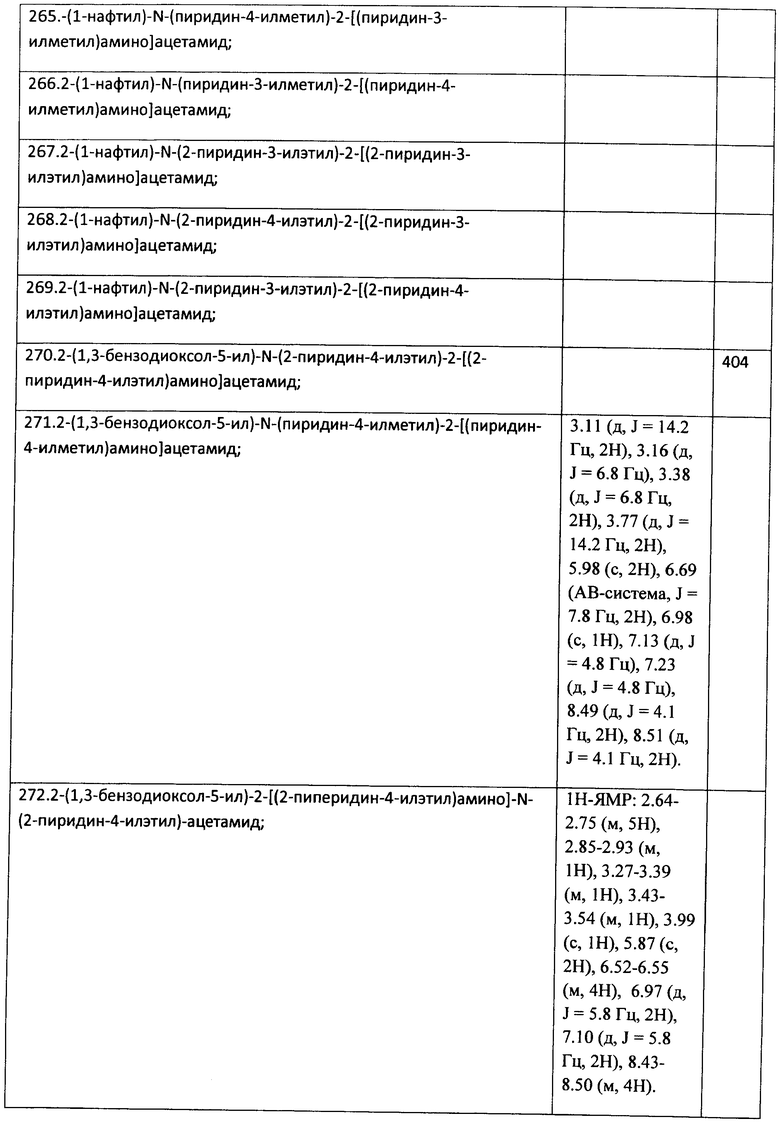
Пример 1. 2-(1,3-бензодиоксол-5-ил)-N-(2-пиридин-4-илэтил)-2-[(2-пиридин-4-илэтил)-амино]ацетамид (вещество 271)
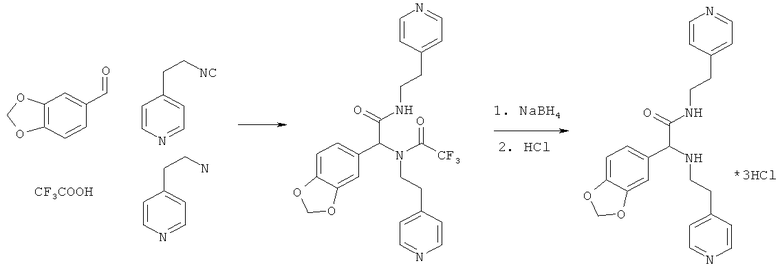
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 48%, 250 мг. Здесь и далее, если не указано иначе, приведены спектры оснований заявляемых соединений. Спектр 1Н-ЯМР: 2.64-2.75 (м, 5Н), 2.85-2.93 (м, 1H), 3.27-3.39 (м, 1H), 3.43-3.54 (м, 1H), 3.99 (с, 1H), 5.87 (с, 2Н), 6.52-6.55 (м, 4Н), 6.97 (д, J=5.8 Гц, 2Н), 7.10 (д, J=5.8 Гц, 2Н), 8.43-8.50 (м, 4Н).
Пример 2. Метил 4-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 661)
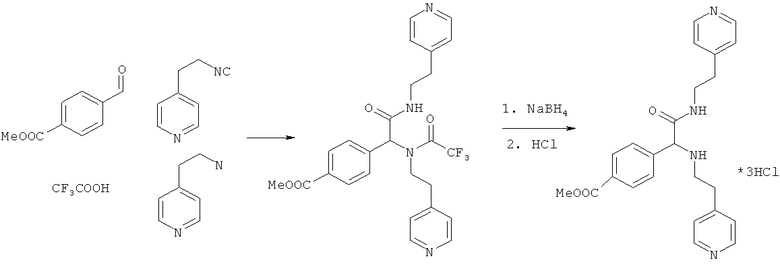
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НС1 (газ) и упаривают в вакууме. Выход 19% (100 мг). Спектр 1Н-ЯМР: 2.65-2.75 (м, 5Н), 2.85-2.93 (м, 1Н), 3.28-3.40 (м, 1H), 3.44-3.54 (м, 1Н), 3.88 (с, 3Н), 4.15 (с, 1Н), 6.85 (t, J=6.1 Гц, 1Н), 6.95 (д, J=5.8 Гц, 2Н), 7.06 (д, J=5.8 Гц, 2Н), 7.27 (д, J=8.1 Гц, 2Н), 7.95 (д, J=8.1 Гц, 2Н), 8.41 (д, J=6.41 Гц, 2Н), 8.46 (д, J=8.46 Гц, 2Н).
Пример 3. 2-(4-гидроксифенил)-N-(2-пиридин-4-илэтил)-2-[(2-пиридин-4-илэтил)амино]ацетамид(вещество 581)

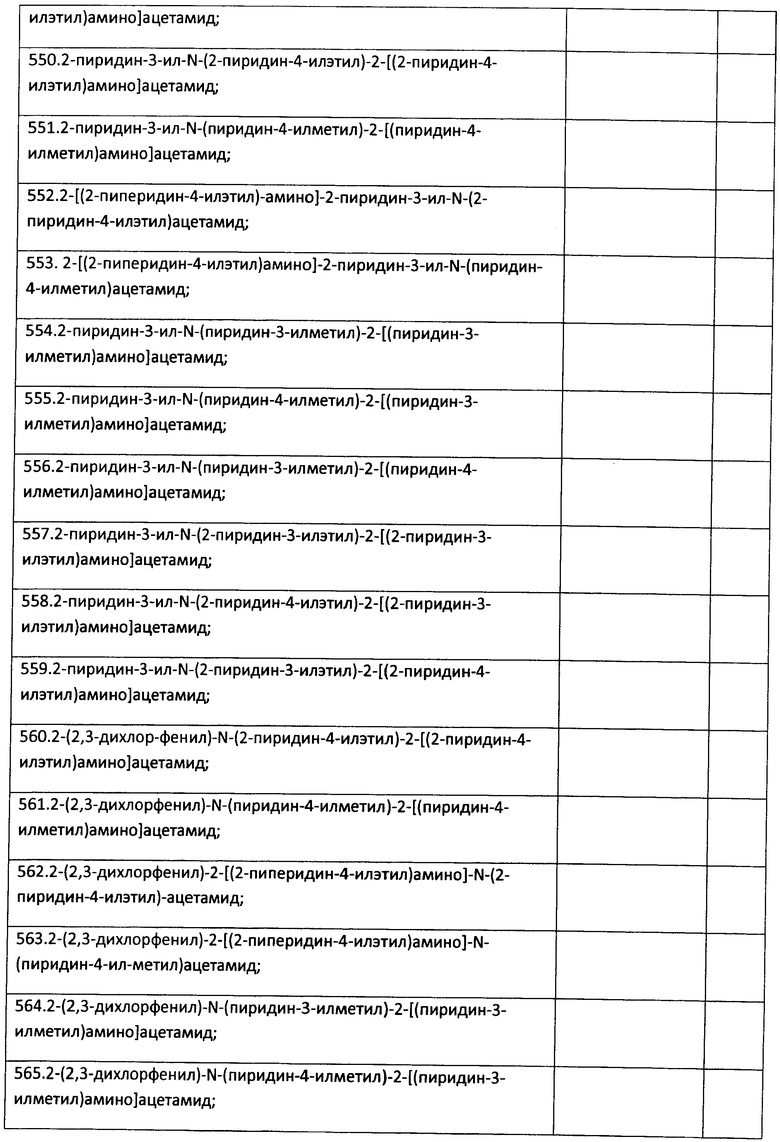
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Cl2МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 25% (120 мг). Спектр 1Н-ЯМР: 2.60-2.93 (м, 6Н), 3.27-3.37 (м, 1Н), 3.45-3.57 (м, 1Н), 4.01 (с, 1Н), 6.67 (д, J=8.6 Гц, 2Н), 6.92 (t, J=6.1 Гц, 1Н), 6.90-6.97 (м, 4Н), 7.07 (д, J=5.6 Гц, 2Н), 8.37 (д, J 5.8 Гц, 2Н), 9.45 (д, J=5.8 Гц, 2Н).
Пример 4. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)-амино]ацетамид (вещество 272)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 29% (140 мг). Спектр 1Н-ЯМР: 3.11 (д, J=14.2 Гц, 2Н), 3.16 (д, J=6.8 Гц), 3.38 (д, J=6.8 Гц, 2Н), 3.77 (д, J=14.2 Гц, 2Н), 5.98 (с, 2Н), 6.69 (АВ-система, J=7.8 Гц, 2Н), 6.98 (с, 1Н), 7.13 (д, J=4.8 Гц), 7.23 (д, J -4.8 Гц), 8.49 (д, J=4.1 Гц, 2Н), 8.51 (д, J=4.1 Гц, 2Н).
Пример 5. 2-(1,3-бензодиоксол-5-ил)-2-[(2-пиперидин-4-илэтил)амино]-Н-(2-пиридин-4-илэтил)ацетамид (вещество 273)
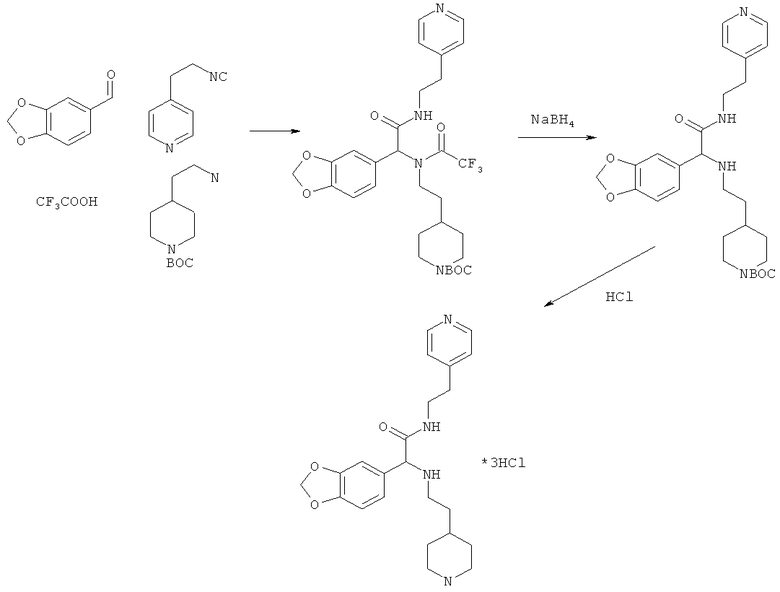
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 29% (150 мг). Спектр 1Н-ЯМР: 1.25-1.40 (м, 2Н), 1.55-1.70 (м, 1Н), 1.78-1.86 (м, 2Н), 2.75-2.95 (м, 4Н), 2.95-3.13 (м, 2Н), 3.25-3.33 (м, 2Н), 3.44-3.52 (м, 1H), 3.69-3.80 (м, 1Н), 5.98 (д, J=21.5 Гц, 2Н), 6.76-6.85 (м, 2Н), 6.91-6.97 (м, 1H), 7.78 (д, J=6.3 Гц, 2Н), 8.58 (д, J=6.3 Гц, 2Н).
Пример 6. 2-(1,3-бензодиоксол-5-ил)-2-[(2-пиперидин-4-илэтил)амино]-N-(пиридин-4-ил-метил)ацетамид (вещество 274)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 20% (100 мг). Спектр 1Н-ЯМР: 1.07-1.24 (м, 2Н), 1.50-1.70 (м, 5Н), 2.57-2.76 (м, 3Н), 2.80-2.90 (м, 1Н), 3.00-3.17 (м, 3Н), 5.14 (д, J=8.6 Гц, 1Н), 5.52 (д, J=8.6 Гц, 1Н), 5.68 (с, 2Н), 6.50 (д, J 7.6 Гц, 1Н), 6.75-6.79 (м, 1Н), 6.93 (с, 1Н), 8.04 (д, J=5.6 Гц, 2Н), 8.63 (д, J=5.6 Гц, 2Н).
Пример 7. 2-(4-гидроксифенил)-2-[(2-пиперидин-4-илэтил)амино]-N-(2-пиридин-4-ил-этил)ацетамид (вещество 583)

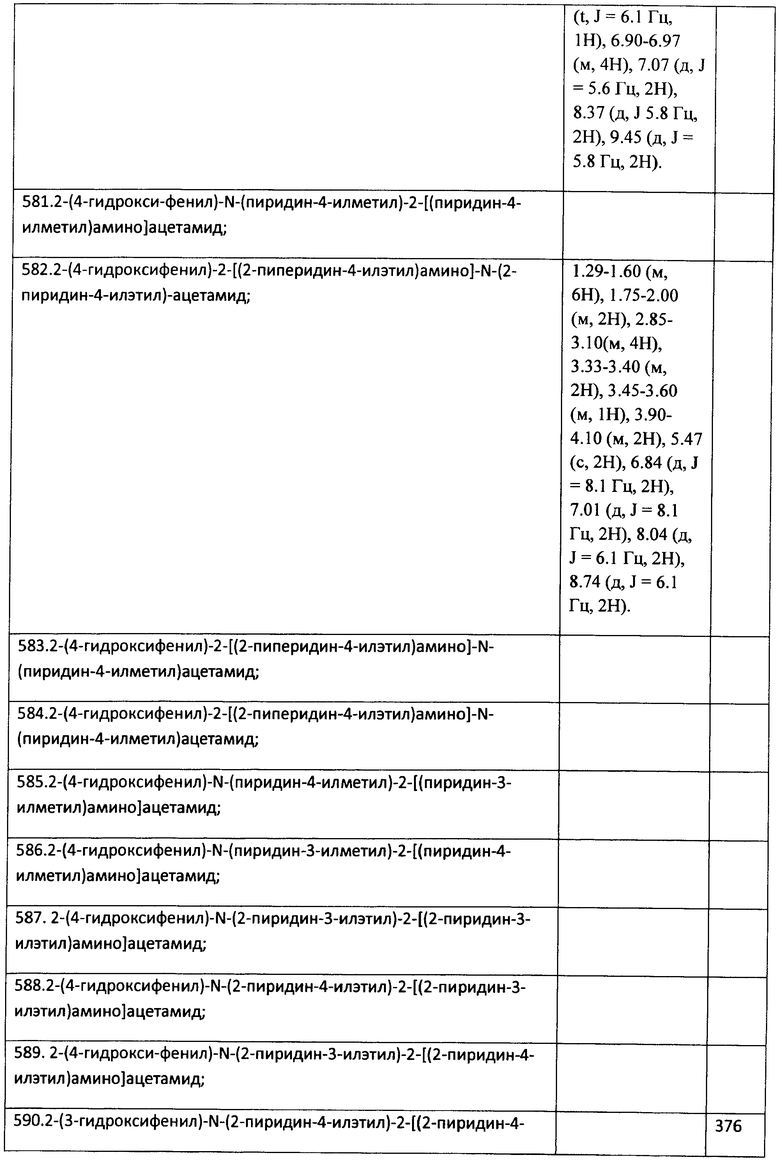
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 21% (100 мг). Спектр 1Н-ЯМР: 1.29-1.60 (м, 6Н), 1.75-2.00 (м, 2Н), 2.85-3.10 (м, 4Н), 3.33-3.40 (м, 2Н), 3.45-3.60 (м, 1Н), 3.90-4.10 (м, 2Н), 5.47 (с, 2Н), 6.84 (д, J=8.1 Гц, 2Н), 7.01 (д, J=8.1 Гц, 2Н), 8.04 (д, J=6.1 Гц, 2Н), 8.74 (д, J=6.1 Гц, 2Н).
Пример 8. Метил 4-{2-оксо-1-[(2-пиридин-3-илэтил)амино]-2-[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 669)
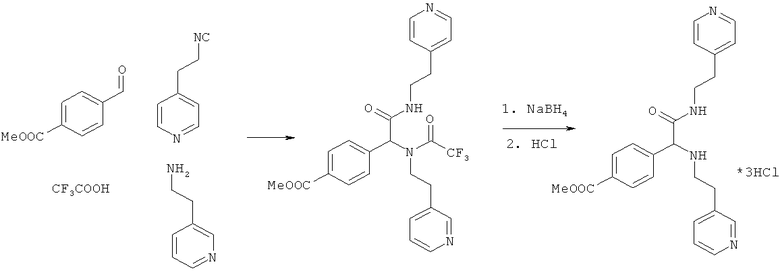
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 38% (200 мг). Спектр 1Н-ЯМР: 2.65-2.75 (м, 5Н), 2.81-2.90 (м, 1Н), 3.31-3.40 (м, 1Н), 3.44-3.55 (м, 1Н), 3.87 (с, 3Н), 4.15 (с, 1Н), 6.85-7.05 (м, 3Н), 7.2 (уш.с, 1Н), 7.26 (д, J=8.1 Гц, 2Н), 7.43 (д, J=7.6 Гц, 1Н), 7.93 (д, J=8.1 Гц, 2Н), 8.4 (уш.с, 4Н).
Пример 9. Метил 4-{2-оксо-1,2-бис[(2-пиридин-3-илэтил)амино]этил}бензоат (вещество 668)
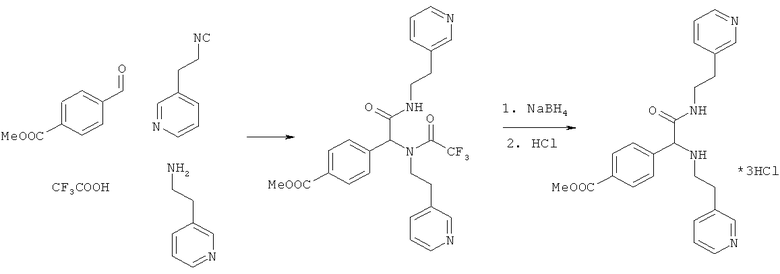
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 38% (200 мг). Спектр 1H-ЯМР: 2.65-2.75 (м, 5H), 2.80-2.90 (м, 1H), 3.30-3.40 (м, 1H), 3.44-3.50 (м, 1H), 3.87 (с, 3H), 4.15 (с, 1H), 6.03 (t, J=5.8 Гц), 7.13 (дд, J=4.8, 2.8 Гц, 1H), 7.18 (дд, J=4.8, 2.8 Гц, 1H), 7.27 (д, J=8.3 Гц, 2H), 7.35 (д, J=7.8 Гц, 1H), 7.44 (д, J=7.8 Гц, 1H), 7.93 (д, J=8.3 Гц, 2H), 8.34 (с, 1H), 8.39-8.47 (м, 3H).
Пример 10. Метил 4-{2-оксо-2-[(2-пиридин-3-илэтил)амино]-1-[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 670)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 38% (200 мг). Спектр 1H-ЯМР: 2.65-2.75 (м, 5H), 2.80-2.90 (м, 1H), 3.30-3.40 (м, 1H), 3.44-3.50 (м, 1H), 3.88 (с, 3H), 4.15 (с, 1H), 6.03 (t, J=5.8 Гц), 7.06 (д, J=5.6 Гц, 2H), 7.10-7.20 (м, 1H), 7.27 (д, J=8.3 Гц, 2H), 7.35 (д, J=7.8 Гц, 1H), 7.94 (д, J=8.3 Гц, 2H), 8.34 (с, 1H), 8.42 (д, J=3.8 Гц, 1H), 8.47 (д, J=5.6 Гц, 2H).
Пример 11. Метил 3-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 651)
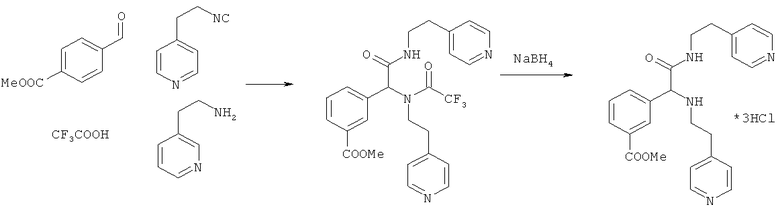
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 30% (160 мг). Спектр 1H-ЯМР: 2.60-2.77 (м, 5H), 2.81-2.93 (м, 1H), 3.32-3.55 (м, 2H), 3.88 (с, 3H), 4.15 (с, 1H), 7.00 (с, 1H), 7.10-7.20 (м, 2H), 7.30-7.55 (м, 4H), 7.86-8.00 (м, 2H), 8.30-8.57 (м, 4H).
Пример 12. Метил 3-{2-оксо-1-[(2-пиридин-3-илэтил)амино]-2-[(2-пиридин-4-илэтил)-амино]этил}бензоат (вещество 659)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 30% (160 мг). Спектр 1H-ЯМР: 2.64-2.77 (м, 5H), 2.81-2.93 (м, 1H), 3.32-3.40 (м, 1H), 3.44-3.53 (м, 1H), 3.88 (с, 3H), 4.15 (с, 1H), 6.91-7.00 (м, 3H), 7.17-7.20 (м, 1H), 7.32-7.44 (м, 3H), 7.90-7.95 (м, 2H), 8.35-8.50 (м, 4H).
Пример 13. Метил 3-{2-оксо-1,2-бис[(2-пиридин-3-илэтил)амино]этил}бензоат (вещество 658)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 23% (120 мг). Спектр 1H-ЯМР: 2.60-2.77 (м, 5H), 2.81-2.93 (м, 1H), 3.32-3.55 (м, 2H), 3.88 (с, 3H), 4.15 (с, 1H), 7.00 (с, 1H), 7.10-7.20 (м, 2H), 7.30-7.55 (м, 4H), 7.86-8.00 (м, 2H), 8.30-8.57 (м, 4H).
Пример 14. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-3-илметил)-2-[(пиридин-4-илметил)-амино]ацетамид (вещество 277)
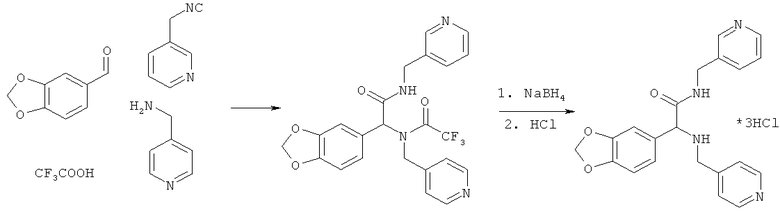
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 23% (110 мг). Спектр 1H-ЯМР: 3.66-3.75 (м, 2H), 4.13 (с, 1H), 4.35-4.45 (м, 2H), 5.92 (с, 2H), 6.72-6.78 (м, 2H), 6.92 (с, 1H), 7.15 (д, J=5.3 Гц, 2H), 7.15-7.20 (м, 1H), 7.25-7.30 (м, 1H), 7.48 (д, J=8.1 Гц, 1H), 8.41 (с, 1H), 8.45 (д, J=5.3 Гц).
Пример 15. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-3-илметил)-2-[(пиридин-3-илметил)-амино]ацетамид (вещество 275)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 23% (110 мг). Спектр 1H-ЯМР: 3.66 (AB-система, J=8.6 Гц, 2H), 4.16 (с, 1H), 4.41 (д, J=6.1 Гц, 2H), 5.93 (с, 2H), 6.73-6.79 (м, 2H), 6.83 (с, 1H), 7.18-7.23 (м, 2H), 7.51 (д, J=7.8 Гц, 1H), 7.56 (д, J=7.8 Гц, 1H), 8.41-8.49 (м, 4H).
Пример 16. 2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)амино]ацетамид (вещество 612)
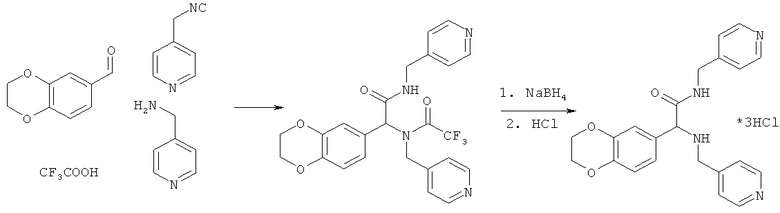
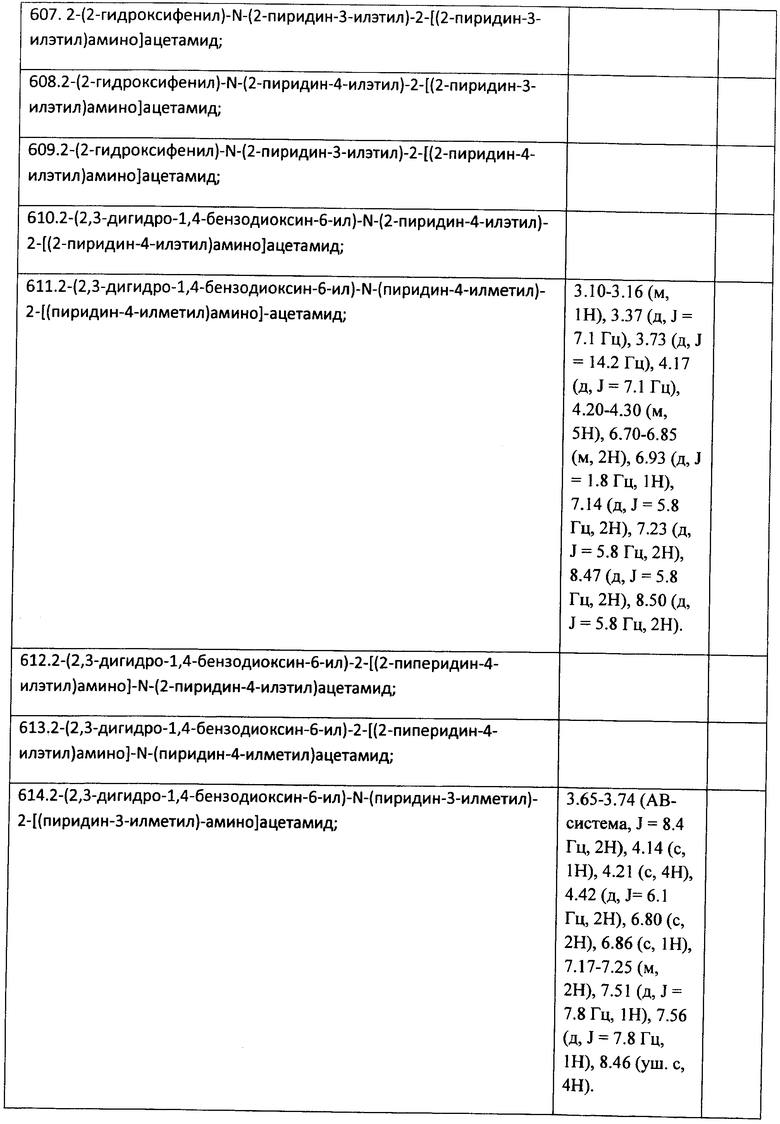
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 20% (100 мг). Спектр 1H-ЯМР: 3.10-3.16 (м, 1H), 3.37 (д, J=7.1 Гц), 3.73 (д, J=14.2 Гц), 4.17 (д, J=7.1 Гц), 4.20-4.30 (м, 5H), 6.70-6.85 (м, 2H), 6.93 (д, J=1.8 Гц, 1H), 7.14 (д, J=5.8 Гц, 2H), 7.23 (д, J=5.8 Гц, 2H), 8.47 (д, J=5.8 Гц, 2H), 8.50 (д, J=5.8 Гц, 2H).
Пример 17. 2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N-(пиридин-3-илметил)-2-[(пиридин-4-илметил)амино]ацетамид (вещество 617)
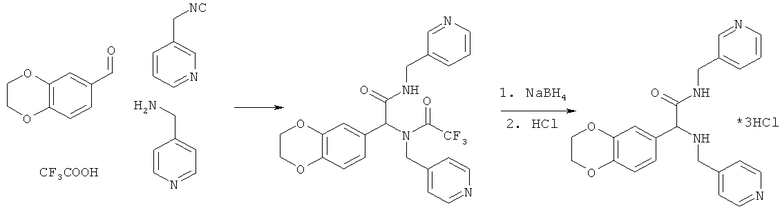
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 32% (160 мг). Спектр 1H-ЯМР: 3.65-3.74 (м, 2H), 4.10 (с, 1H), 4.19 (с, 4H), 4.33-4.43 (м, 2H), 6.78 (с, 2H), 6.84 (с, 1H), 7.10-7.20 (м, 3H), 7.33 (t, J=5.6 Гц, 1H), 7.47 (д, J=7.8 Гц), 8.39 (с, 1H), 8.43 (д, J=5.1 Гц, 3H).
Пример 18. 2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N-(пиридин-3-илметил)-2-[(пиридин-3-илметил)амино]ацетамид (вещество 615)
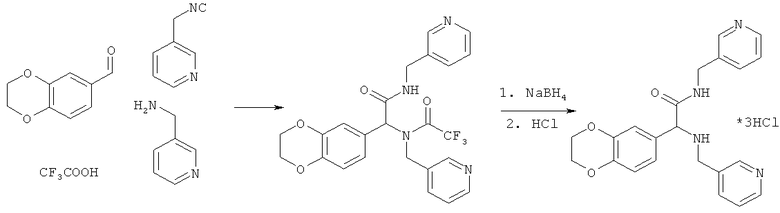
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 25% (100 мг). Спектр 1H-ЯМР: 3.65-3.74 (АВ-система, J=8.4 Гц, 2H), 4.14 (с, 1H), 4.21 (с, 4H), 4.42 (д, J=6.1 Гц, 2H), 6.80 (с, 2H), 6.86 (с, 1H), 7.17-7.25 (м, 2H), 7.51 (д, J=7.8 Гц, 1H), 7.56 (д, J=7.8 Гц, 1H), 8.46 (уш. с, 4H).
Пример 19. Метил 4-{2-оксо-1,2-бис[(пиридин-4-илметил)амино]этил}бензоат (вещество 662)

К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 25% (100 мг). Спектр 1H-ЯМР: 3.70-3.78 (м, 2H), 3.86 (с, 3H), 4.31 (с, 1H), 4.33-4.43 (м, 2H), 7.08 (д, J=5.6 Гц, 2H), 7.17 (д, J=5.6 Гц), 7.42 (д, J=8.3 Гц, 2H), 7.64 (t, J=6.1 Гц, 1H), 7.07 (д, J=8.3 Гц, 2H), 8.39 (д, J=5.8 Гц, 2H), 8.43 (J=5.8 Гц, 2H).
Пример 20. N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)амино]-2-(3,4,5-триметокси-фенил)ацетамид (вещество 622)
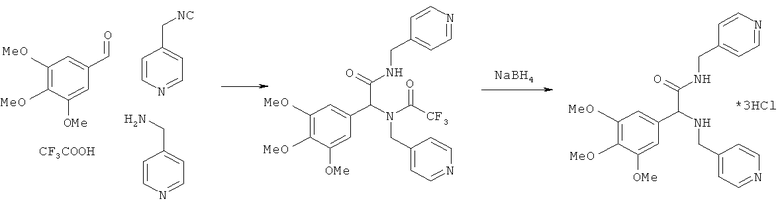
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 23% (120 мг). Спектр 1H-ЯМР: 3.10-3.20 (м, 2H), 3.43 (д, J=7.1 Гц), 3.80 (с, 6H), 3.84 (с, 3H), 4.21 (д, 6.8 Гц, 1H), 4.26 (д. 6.8 Гц, 1H), 6.54 (с, 1H), 7.14 (д, J=5.8 Гц, 1H), 7.23 (с, 1H), 8.49 (д, J=5.8 Гц, 2H), 8.52 (д, J=5.8 Гц).
Пример 21. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-4-илметил)-2-[(пиридин-3-илметил)-амино]ацетамид (вещество 276)
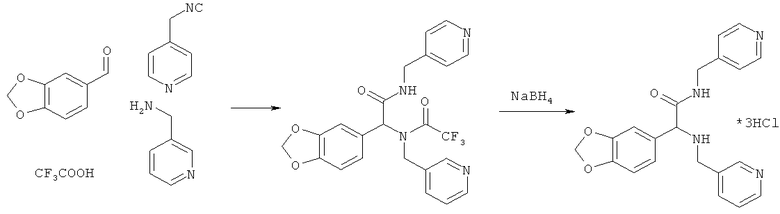
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 27% (130 мг). Спектр 1H-ЯМР: 3.11-3.20 (м, 2H), 3.40 (д, J=7.1 Гц, 1H), 3.76 (д, J=13.7 Гц, 1H), 4.13 (д, J=7.1 Гц, 1H), 4.24 (д, J=7.1 Гц, 1H), 5.96 (с, 2H), 6.66 (д, J=8.1 Гц, 1H), 6.73 (д, J=8.1 Гц), 6.97 (с, 1H), 7.11 (д, J=5.8 Гц, 2H), 7.18-7.23 (м, 1H), 7.58 (д, J=7.8 Гц, 1H), 8.47 (д, J=5.8 Гц, 3H), 8.50 (с, 1H).
Пример 22. Метил-4-[2-оксо-1,2-бис[[2-(4-пиридинил)этил]амино]этил]-бензоат

К перемешиваемому и охлаждаемому на ледяной бане раствору 10 г (0,08 моль) 4-(2-аминоэтил)пиридина в 200 мл сухого хлористого метилена, содержащего 25 г свежепрокаленных молекулярных сит 4А, порциями присыпали 13.4 г (0,08 моль, 1 экв) 4-карбоксиметилбензальдегида. По окончании прибавления смесь перемешивали 1 ч, раствор декантировали с молекулярных сит и упаривали в вакууме. Полученный остаток растворяли в 150 мл метанола, приливали 6 мл трифторуксусной кислоты и при охлаждении на ледяной бане прикапывали раствор 10.9 г пиридинэтил-изонитрила (0,08 моль, 1 экв) в 20 мл метанола. Полученный раствор перемешивали в течение 24 ч, упаривали, а остаток очищали методом колоночной хроматографии, используя в качестве элюента смесь дихлорметан/метанол 20/1. Полученный трифторацетамид растворяли в 150 мл метанола и порциями присыпали 15 г боргидрида натрия. После перемешивании в течение 24 ч реакционную смесь упаривали на роторном испарителе, обрабатывали небольшим количеством дихлорметана, фильтровали и очищали методом колоночной хроматографии, используя в качестве элюента смесь дихлорметан/метанол 20/1. Выделено 1,4 г целевого амида в виде желтоватого кристаллического вещества.
Приведенные выше примеры иллюстрируют, но не ограничивают предлагаемое изобретение. Все соединения изобретения получены или могут быть получены с использованием приведенной методики синтеза (см. таблицу).
В результате проведенного широкого скрининга нескольких тысяч молекул были отобраны около десяти предпочтительных структур для последующих испытаний на моделях консолидации памяти у животных.
Соединения-лидеры
Ниже приведены основные характеристики отобранных лекарственных кандидатов:
- вещества являются малыми молекулами с подтвержденной структурой и известным методом синтеза;
- растворимы в воде;
- соответствуют "правилу пяти" Липинского;
- проявляют активность в поведенческих тестах на животных;
- нетоксичны;
- патентно чисты.
Все методики синтеза были разработаны авторами данной патентной заявки и, в совокупности со структурами, являются предметом патента.
Данные о действии новых соединений на восстановление утраченной памяти
Возможность осуществления изобретения с реализацией заявляемого назначения подтверждается, но не исчерпывается следующими сведениями.
Метод оценки влияния новых соединений на память
Для исследования действия соединений на память животных была использована методика однократного обучения пассивному избеганию цыплят (Gallus gallus 6 domesticus) в возрасте 1-3 суток. Данная экспериментальная модель служит одной из базовых методик, используемых для исследования закономерностей и механизмов формирования памяти (Gibbs M.E., Ng, K.T. Psychobiology of memory: Towards a model of memory formation. Biobehav. Rev. 1977, 1:113-136; Rose S.P.R. Biochemical mechanisms involved in memory formation in the chick. Behavioral and Neural Plasticity: the Use of the Domestic Chick as a Model. // Ed.Andrew. R.J.Oxford: Oxford Univ. Press, 1991, 277-304; Rose S.P.R., Stewart M.G., 1999. Cellular correlates of memory formation in the chick following passive avoidance training. Behav. Brain Res., 98:237-243; Patterson, T.A., Alvarado, M.C., Warren, I.T., Bennett, E.L., Rosenzweig, M.R. Memory stages and brain asymmetry in chick learning. Behav. Neurosci. 1986, 100:856-865; Stewart, 1991, Rose, 1991, 1995). Преимуществом модели является очень быстрое (секунды) обучение, позволяющее точно фиксировать момент приобретения новой информации в нервной системе. Разворачивающаяся вслед за этим последовательность внутриклеточных и синаптических процессов, обеспечивающих формирование долговременной памяти в модели пассивного избегания, к настоящему времени подробно изучена. Дополнительным преимуществом данной модели является то, что неокостеневший череп новорожденных цыплят позволяет вводить фармакологические препараты микрошприцем непосредственно в заданные структуры мозга, без операции и анестезии; используется также системное введение препаратов, проникновение которых в мозг облегчается незрелым гематоэнцефалическим барьером. Животные. В экспериментах были использованы цыплята (самцы) кросса «Птичное». Животные доставлялись с птицефабрики в день вылупления и содержались парами в пеналах размером 20×25×20, с постоянным доступом к воде и корму, температуре 28°С и световом цикле 12:12 часов. Минимальное время адаптации к обстановке перед началом эксперимента составляло два часа.
Инъекции. Соединения растворяли в стерильном физиологическом растворе. Для системного введения растворов использовались внутрибрюшинные инъекции в объеме 0.1 мл. Внутричерепные инъекции выполнялись билатерально, микрошприцами («Hamilton») объемом 10 мкл с помощью пластикового головодержателя и направлялись в область боковых желудочков мозга. Объем инъекций составлял 5 мкл на полушарие. После окончания эксперимента и декапитации животных проводился мониторинг поверхности черепа и мозга для контроля локализации инъекций. Контрольные группы получали инъекции физиологического раствора в тех же объемах.
Модель «слабого» обучения пассивному избеганию. При слабом обучении формируется память, которая манифестируется при тестировании в течение нескольких часов после обучения, а позже угасает; память может быть усилена введением некоторых соединений, например агонистов оксида азота, стероидных гормонов, определенных пептидов (Rickard N.S., Ng K.T., Gibbs M.E. A nitric oxide agonist stimulates consolidation of long-term memory in the 1-day-old chick. Behav Neurosci. 1994, 108:640-4; Sandi C., Rose S.P., Mileusnic R., Lancashire C. Corticosterone facilitates long-term memory formation via enhanced glycoprotein synthesis. Neuroscience 1995, 69:1087-93; Gibbs M.E., Summers R.J. Effects of glucose and 2-deoxyglucose on memory formation in chicks: interaction with beta(3)-adrenoceptor agonist. Neurosci. 2002, 114:69-79; Mileusnic R., Lancashire C.L., Rose S.P. The peptide sequence Arg-Glu-Arg, present in the amyloid precursor protein, protects against memory loss caused by A beta and acts as a cognitive enhancer. Eur J Neurosci. 2004, 19:1933-8). Обучение цыплят в «слабой» модели пассивного избегания приводит к формированию избирательного избегания аверсивного объекта (бусинки), которое сохраняется на протяжении 6-12 часов после обучения; при тестировании через 24 часа у большинства обученных животных избегания не наблюдается. Эксперименты проводились по следующей схеме: за 20 мин до обучения проводили предобучение, состоящее из поочередного предъявления каждому животному двух нейтральных (смоченных водой) бусинок, закрепленных на стержне. Для последующего обучения использовали только тех цыплят, которые клевали каждую бусинку по крайней мере один раз в течение первых 10 сек. Для обучения цыплятам предъявляли «аверсивную» бусинку, смоченную жгучим веществом (10%-ный раствор метилантранилата в этаноле). Цыплята, клюнувшие бусинку, демонстрировали типичную видоспецифическую аверсивную реакцию. Тестирование проводилось через 24 часа после обучения и состояло из 10-секундного предъявления такой же «аверсивной» бусинки, как при обучении, но сухой, и затем нейтральной бусинки. Избирательная реакция избегания «аверсивной» бусинки оценивалась как наличие долговременной памяти. Для оценки уровня памяти сравнивали процент животных, демонстрировавших реакцию избегания, в разных экспериментальных группах; статистическую достоверность различий оценивали с помощью непараметрического критерия χ2.
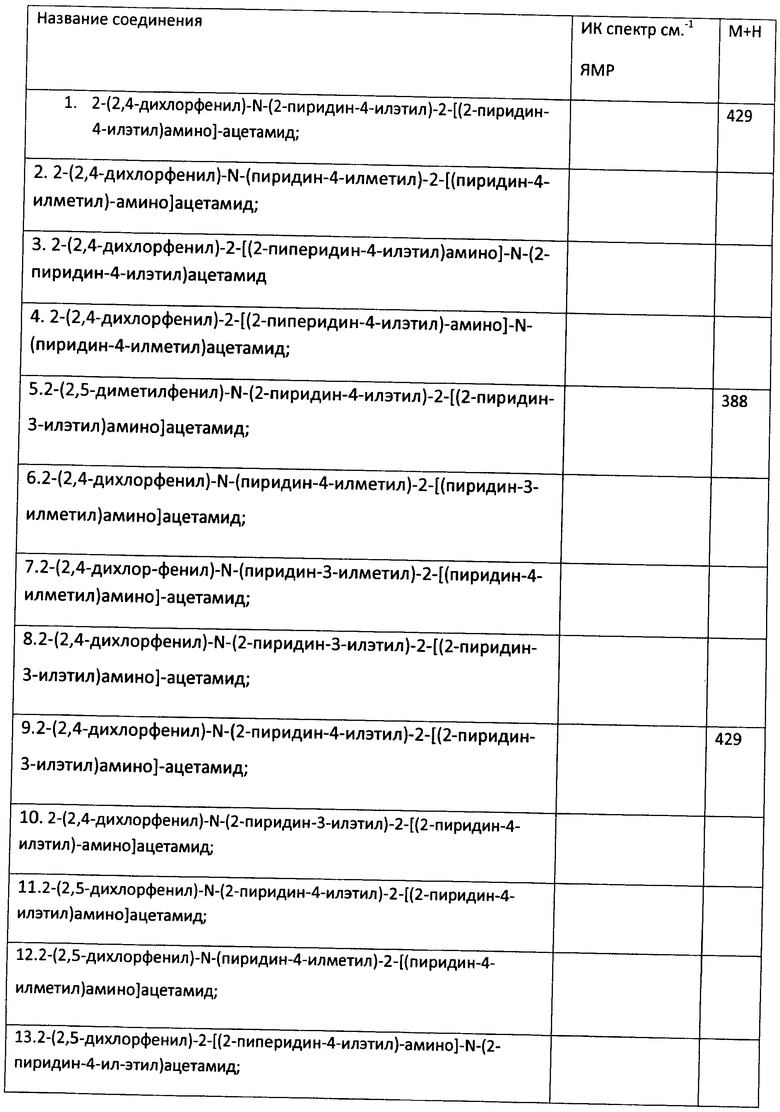
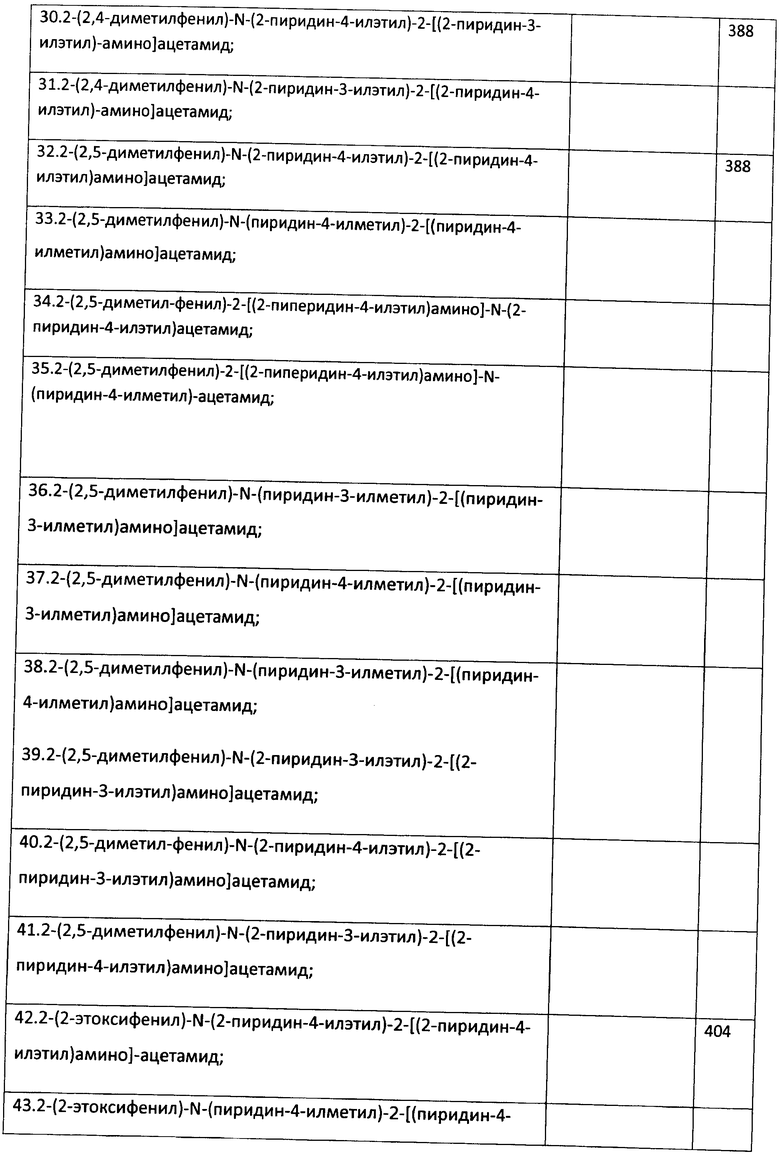
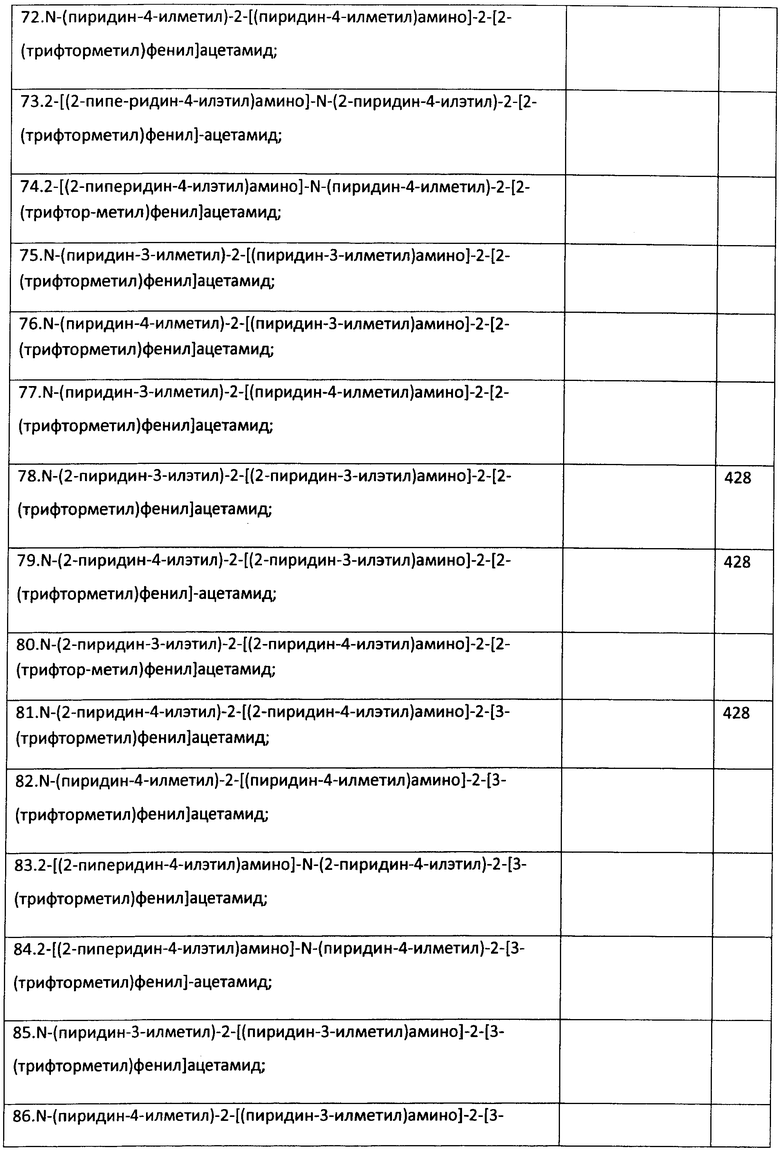
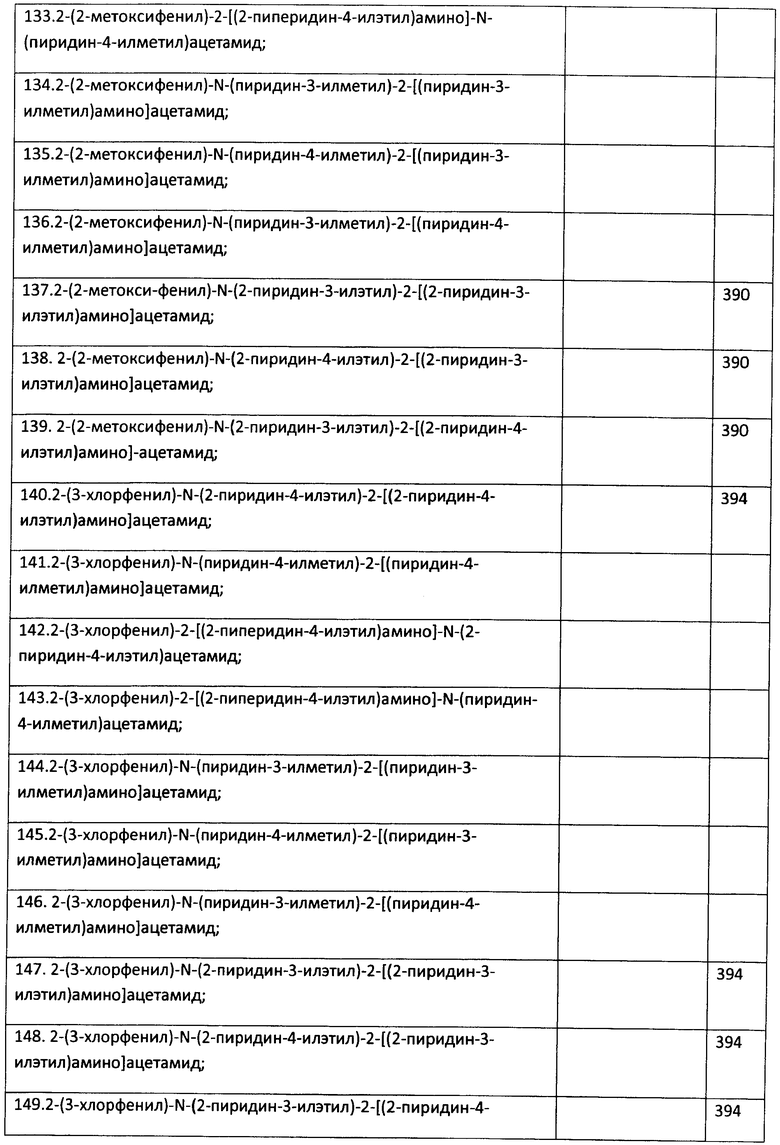
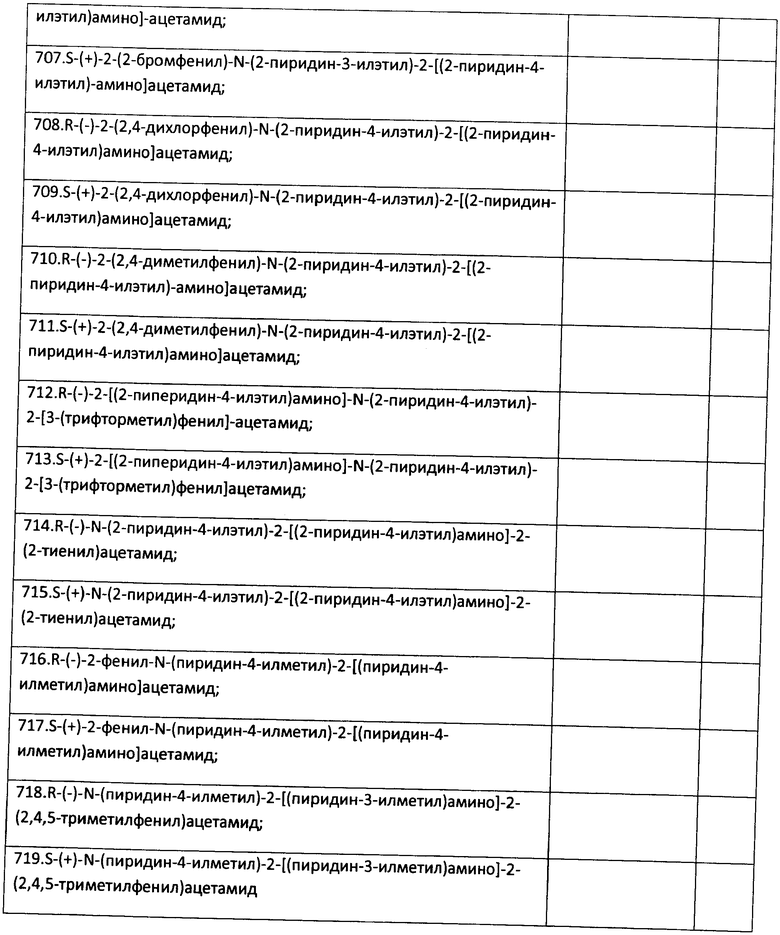
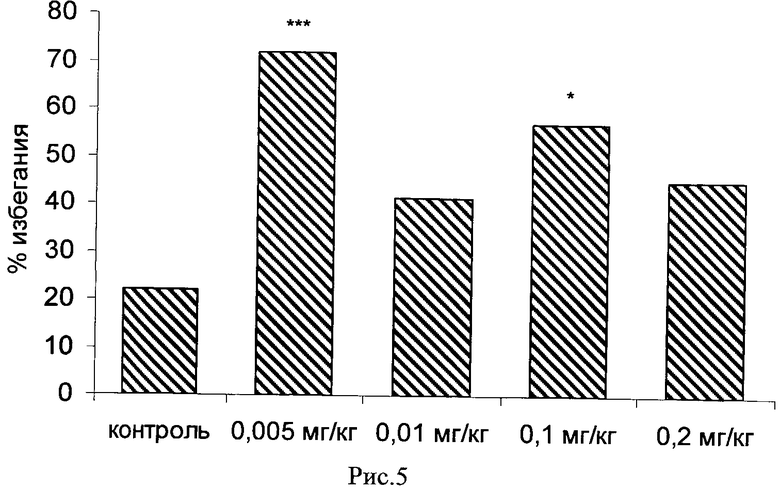
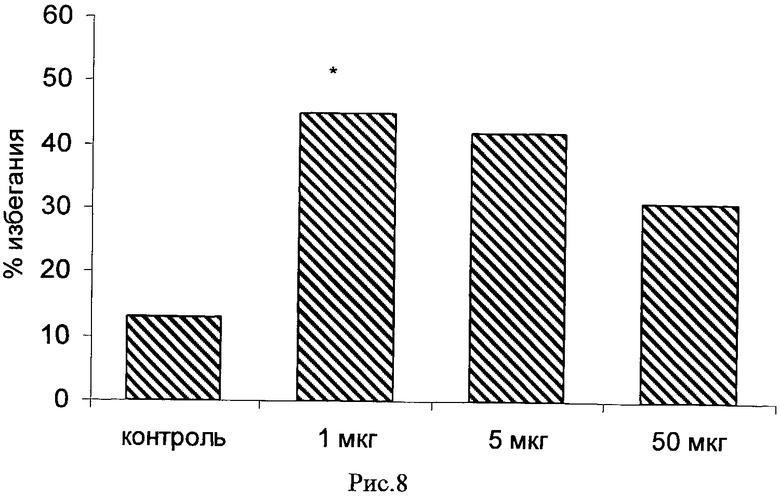
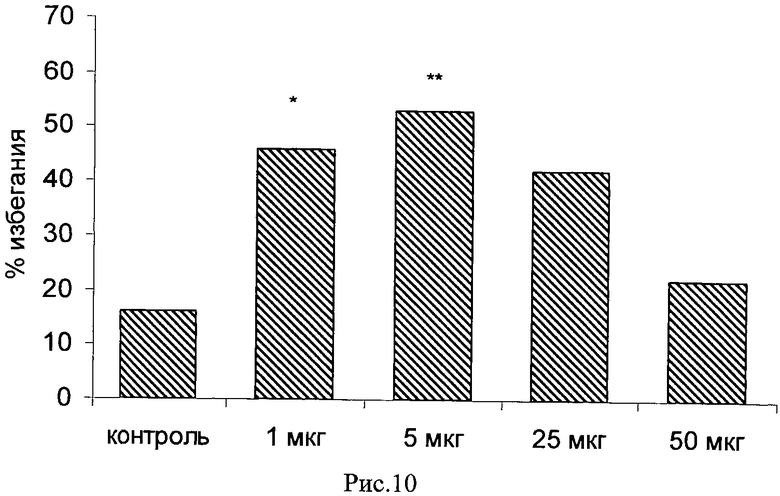
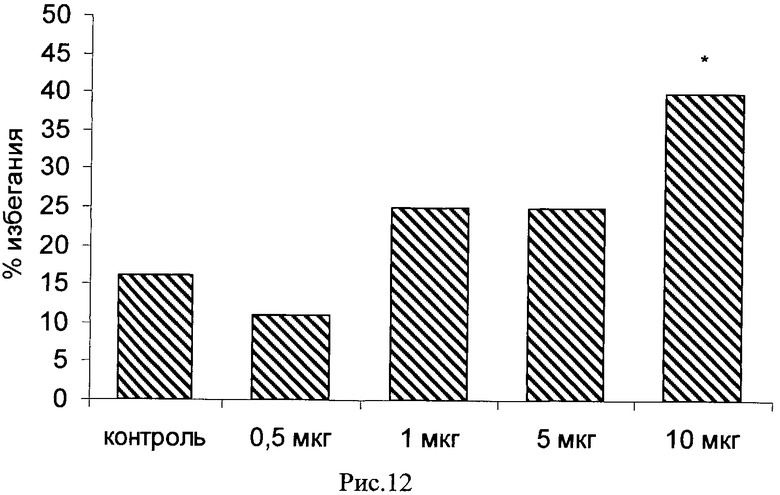
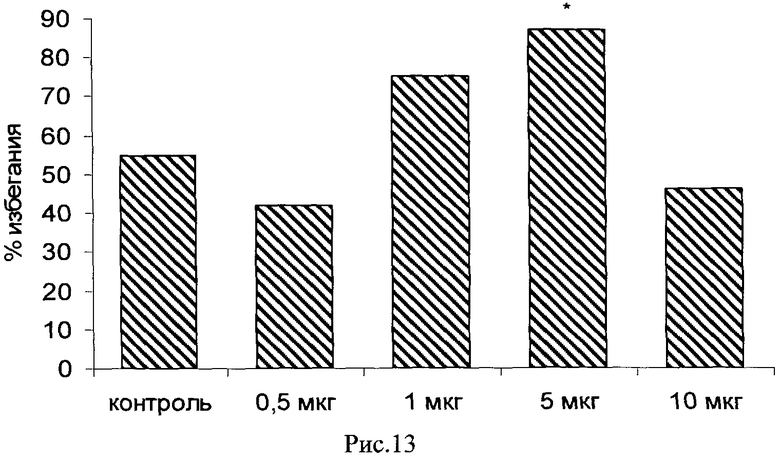
Пример 23. Возможность фармакологического усиления слабой памяти в момент обучения. Авторы использовали экспериментальную модель слабого обучения на фоне введения исследуемых соединений. Авторы показали, что введение цыплятам соединений 271, 661, 651, 272, 273, 583, 275, 615, 662, 622, 276 из серии I, I.1, I.1.1 и I.1.2 непосредственно перед «слабым» обучением пассивному избеганию приводит к увеличению доли животных, демонстрирующих через 24 часа реакцию избегания, т.е. к формированию более устойчивой памяти. Внутрижелудочковое введение соединений 271, 661, 651, 272, 273, 583, 275, 615, 662, 622, 276 за 10 мин до обучения приводило к дозозависимому повышению уровня избегания в экспериментальных группах по сравнению с контрольной группой, получавшей инъекцию физиологического раствора. Максимальный эффект наблюдался при следующих дозах: вещество 271 - 100 мкг (воспроизведение навыка повышено на 120% по сравнению с контролем, Рис.1), вещество 661 - 10 мкг (повышение на 50% по сравнению с контролем, Рис.2), вещество 651 - 0.5 мкг (повышение на 330% по сравнению с контролем, Рис.4), вещество 272 - 5 мкг (повышение на 170% по сравнению с контролем, Рис.6), вещество 273 - 1 мкг (повышение на 240% по сравнению с контролем, Рис.8), вещество 583 - 5 мкг (повышение на 230% по сравнению с контролем, Рис.10), вещество 275 - 0.5 мкг (повышение на 75% по сравнению с контролем, Рис.11), вещество 615 - 10 мкг (повышение на 150% по сравнению с контролем, Рис.12), вещество 662 - 5 мкг (повышение на 60% по сравнению с контролем, Рис.13), вещество 622 - 5 мкг (повышение на 300% по сравнению с контролем, Рис.15), вещество 276 - 1 мкг (повышение на 500% по сравнению с контролем, Рис.17).
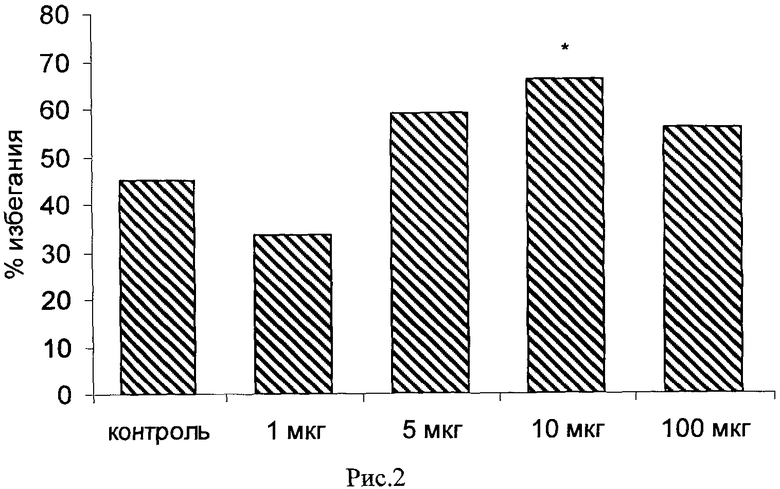
При системном введении исследуемых препаратов за 10 мин до обучения авторы также наблюдали дозозависимое усиление слабой памяти. Наиболее эффективными дозами при внутрибрюшинном введении были следующие: для вещества 661 1 мг/кг (40 мкг на животное, уровень воспроизведения при тестировании через 24 ч повышен по сравнению с контролем на 140%, Рис.3); для вещества 651 - 0.005 мг/кг (0.2 мкг на животное, повышение на 220% по сравнению с контролем, Рис.5); для вещества 272 - 0.1 мг/кг (4 мкг на животное, повышение на 160% по сравнению с контролем, Рис.7); для вещества 273 - 0.25 мг/кг (10 мкг на животное, повышение на 100% по сравнению с контролем, Рис.9); для вещества 662 - 0.01 мг/кг (0.4 мкг на животное, повышение на 400% по сравнению с контролем, Рис.14); для вещества 622 - 0.005 мг/кг (0.2 мкг на животное, повышение на 190% по сравнению с контролем, Рис.16); для вещества 276 - 0.01 мг/кг (0.4 мкг на животное, повышение более чем на 1000% по сравнению с контролем, Рис.18).
Представленные результаты показывают, что обучение на фоне введения соединений 271, 661, 651, 272, 273, 583, 275, 615, 662, 622, 276 приводит к формированию более устойчивой, длительно хранящейся памяти. Сопоставимые уровни усиления памяти как при внутрижелудочковом, так и при системном введении указывают на способность исследуемых соединений проникать через гематоэнцефалический барьер, что существенно облегчает возможность их использования в клинике.
Пример 24. Возможность фармакологического усиления слабой памяти после обучения. Была проверена возможность усиления памяти при введении соединений непосредственно после обучения (через 5 мин), а также через 4 часа после обучения.
Авторы использовали экспериментальную модель слабого обучения в сочетании с введением соединений 661 и 272 в разные сроки до и после обучения с целью выяснения временной динамики их действия на память. Отдельные группы животных обучали на фоне внутрижелудочкового введения соединений в дозе 10 мкг (661) или 5 мкг (272), за 30 или за 5 мин до обучения; другие группы обучали без предварительных инъекций и вводили соединение 661 в дозе 10 мкг или соединение 272 в дозе 5 мкг через разные интервалы времени после обучения (5 мин, 2 ч, 4 ч, 6 ч). Животных всех групп тестировали через 24 часа после обучения.
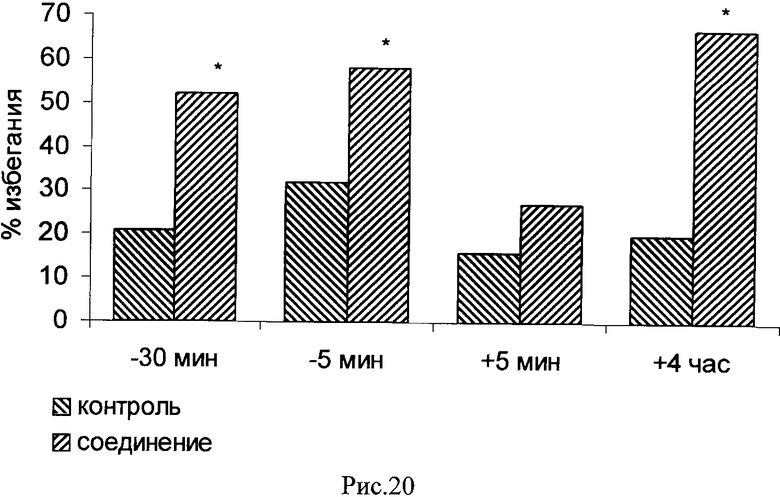
Представленные результаты показывают, что при тестировании памяти через 24 часа после слабого обучения животные контрольных групп демонстрируют низкий уровень избегания (Рис.19, 20, Контроль). Введение каждого из соединений за 5 мин до обучения приводило к усилению памяти примерно в два раза по сравнению с контрольной группой (Рис.19, 20, Соединение). При введении за 30 мин до обучения потенцирующий эффект обнаружен только для соединения 272 (Рис.20, Соединение), а при введении через 5 мин после обучения - только для соединения 661 (Рис.19, Соединение). Авторы также показали, что потенцирующий эффект обоих соединений проявляется при их введении через 4 часа после слабого обучения (усиление памяти более чем на 200% по сравнению с контрольными животными; Рис.19, 20, Соединение). Введение соединений через 2 или 6 часов после обучения эффекта на память не оказывало.
Таким образом, авторы обнаружили способность соединений 271, 661, 651, 272, 273, 583, 275, 615, 662, 622, 276 из серии I, I.1, I.1.1 и I.1.2 усиливать слабую память при введении непосредственно перед обучением или сразу после него, что указывает на участие этих соединений в процессах, поддерживающих ранние стадии формирования памяти. Потенциация этих ранних процессов приводит к формированию более устойчивой, длительно хранящейся памяти, уровень которой повышается в несколько раз. Кроме того, авторы выявили способность соединений 661 и 272 усиливать память при введении через 4 часа после окончания обучения, что указывает на возможность потенциации процессов, происходящих на поздних сроках формирования памяти (например, синтеза эффекторных белков, обеспечивающих модификацию нервных связей и закрепляющих таким образом приобретенный опыт). Следовательно, соединения 271, 661, 651, 272, 273, 583, 275, 615, 662, 622, 276 из серии I, I.1, I.1.1 и I.1.2 могут быть использованы как для формирования более прочной памяти при приобретении нового опыта, так и для усиления памяти о ранее приобретенном опыте (о событиях, произошедших в прошлом), что открывает совершенно новые возможности его применения в клинике.
При этом проведенные испытания показали, что наиболее перспективными соединениями являются соединения, выбранные из
метил 4-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоата (вещество 661) и 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)-амино]ацетамида (вещество 272).
Таким образом, заявляемая группа соединений общей формулы I, I.1, I.1.1 и I.1.2 может быть с большим эффектом применена в качестве средства для восстановления памяти в норме и патологии у пациентов всех возрастных групп.
Чертежи (к примерам 23 и 24)
Рис.1. Эффект внутрижелудочкового введения соединения 271 в дозе 1-100 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 1-100 мкг - доза 271. Число животных в группах: 18, 18, 16, 16, 15.
Рис.2. Эффект внутрижелудочкового введения соединения 661 в дозе 1-100 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 1-100 мкг - доза 661. Число животных в группах: 20, 18, 20, 19, 14.
Рис.3. Эффект системного введения соединения 661 в дозе 0.1-1.0 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.1-1 мг/кг - доза 661. Число животных в группах: 22, 18, 18, 19, 19.
Рис.4. Эффект внутрижелудочкового введения соединения 651 в дозе 0.5-10 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.5-10 мкг - доза 651. Число животных в группах: 21, 21, 20, 22, 18.
Рис.5. Эффект системного введения соединения 651 в дозе 0.005-0.2 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.005-0.2 мг/кг - доза 651. Число животных в группах: 18, 22, 19, 19, 20.
Рис.6. Эффект внутрижелудочкового введения соединения 272 в дозе 1-100 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 1-100 мкг - доза 272. Число животных в группах: 19, 18, 17, 17, 18.
Рис.7. Эффект системного введения соединения 272 в дозе 0.1-1.0 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.1-1 мг/кг - доза 272. Число животных в группах: 18, 19, 21, 19, 20.
Рис.8. Эффект внутрижелудочкового введения соединения 273 в дозе 1-50 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 1-50 мкг - доза 273. Число животных в группах: 16, 20, 19, 16.
Рис.9. Эффект системного введения соединения 273 в дозе 0.05-0.5 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 00.05-0.5 мг/кг - доза 273. Число животных в группах: 18, 18, 19, 13, 18.
Рис.10. Эффект внутрижелудочкового введения соединения 583 в дозе 1-50 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 1-50 мкг - доза 583. Число животных в группах: 19, 17, 17, 19, 13.
Рис.11. Эффект внутрижелудочкового введения соединения 275 в дозе 0.5-10 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.5-10 мкг - доза 275. Число животных в группах: 20, 19, 18, 19, 19.
Рис.12. Эффект внутрижелудочкового введения соединения 615 в дозе 0.5-10 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.5-10 мкг - доза 615. Число животных в группах: 19, 19, 19, 20, 20.
Рис.13. Эффект внутрижелудочкового введения соединения 662 в дозе 0.5-10 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.5-10 мкг - доза 662. Число животных в группах: 20, 19, 17, 17, 19.
Рис.14. Эффект системного введения соединения 662 в дозе 0.005-0.2 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.005-0.2 мг/кг - доза 662. Число животных в группах: 20, 19, 22, 21, 19.
Рис.15. Эффект внутрижелудочкового введения соединения 622 в дозе 0.5-10 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.5-10 мкг - доза 622. Число животных в группах: 20, 18, 20, 21, 23.
Рис.16. Эффект системного введения соединения 622 в дозе 0.005-0.2 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.005-0.2 мг/кг - доза 622. Число животных в группах: 18, 20, 20, 18, 17.
Рис.17. Эффект внутрижелудочкового введения соединения 276 в дозе 0.5-10 мкг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.5-10 мкг - доза 276. Число животных в группах: 22, 21, 20, 19, 20.
Рис.18. Эффект системного введения соединения 276 в дозе 0.005-0.2 мг/кг за 10 мин до обучения на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, 0.005-0.2 мг/кг - доза 276. Число животных в группах: 22, 22, 20, 20, 20.
Рис.19. Эффект внутрижелудочкового введения 10 мкг соединения 661 за 30 или 5 мин до обучения, а также через 5 мин или 4 часа после обучения, на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, соединение - соединение 661. Число животных в группах: 20, 19, 19, 20, 15, 19, 19, 16.
Рис.20. Эффект внутрижелудочкового введения 5 мкг соединения 272 за 30 или 5 мин до обучения, а также через 5 мин или 4 часа после обучения, на воспроизведение навыка пассивного избегания у цыплят через 24 часа после слабого обучения. Группы: контроль - физиологический раствор, соединение - соединение 272. Число животных в группах: 19, 19, 19, 20, 18, 18, 19, 19.





























| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ НИЗКОМОЛЕКУЛЯРНЫЕ sAPP-МИМЕТИКИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2465273C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ, ОПОСРЕДОВАННЫХ СХСR4 И CCR5 | 2001 |
|
RU2277092C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ТЕТРАЗОЛА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ТУБЕРКУЛЕЗА | 2018 |
|
RU2800930C2 |
| 2-ПРОПЕН-1-ОНЫ В КАЧЕСТВЕ ИНДУКТОРОВ HSP-70 | 2005 |
|
RU2341522C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОНА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2005 |
|
RU2577858C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ 637: ПИРИДОПИРИМИДИНДИОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2008 |
|
RU2479584C2 |
| АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2009 |
|
RU2552642C2 |
| 1-(2-ИЗОПРОПОКСИЭТИЛ)-2-ТИОКСО-1,2,3,5-ТЕТРАГИДРО-ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОН И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 2005 |
|
RU2409578C2 |
| АКТИВАТОРЫ ГЛЮКОКИНАЗЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2008 |
|
RU2450001C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ, СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРОМ ХЕМОКИНА | 2002 |
|
RU2325387C2 |












Изобретение относится к способу восстановления памяти, утраченной в результате патологии, неблагоприятных воздействий или времени, включающему введение эффективного количества (азагетероциклил)алкильных производных амидов (гет)арилглицинов общей формулы I: 
в которой: m и n могут принимать значения 0, 1, 2 и 3; знак (#) здесь и далее обозначает возможность наличия хирального центра; R представляет необязательно замещенный С5-С10арил или 5-6-членный гетарил, содержащий 1-2 гетероатома, выбранных из азота и серы, возможно, конденсированный с бензольным кольцом, причем заместители выбираются из С1-С8алкила, C1-С8алкокси, галогена, ОН, CF3, CN, NO2, CF3O, незамещенной амино-группы или моно-С1-C6алкил- или ди(С1-C6алкил)замещенной амино-группы, С1-C8алкилсульфанила, С1-C6алкоксикарбонил, C1-С6ацила; А1 и А2 независимо представляют необязательно замещенный 5-6-членный насыщенный или ароматический азагетероцикл, содержащий от 1 до 2 атомов азота в цикле и, возможно, конденсированный с бензольным кольцом; причем заместители в замещенных группах R, А1 и А2 независимо выбираются из С1-С8алкила, С1-С8алкокси, С1-С-алкилсульфанила, галогена, ОН, CF3, нитро, CN, CF3O, незамещенной аминогруппы, моно-С1-4алкил- или ди(С1-4алкил) амино-группы, С1-8алкоксикарбонила, C1-С6ацила, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей. Изобретение также относится к соединениям общей формулы I, фармацевтической композиции и лекарственному средству на их основе. 4 н. и 12 з.п. ф-лы, 24 пр., 1 табл., 20 ил.
1. Способ восстановления памяти, утраченной в результате патологии, неблагоприятных воздействий или времени, включающий введение эффективного количества (азагетероциклил)алкильных производных амидов (гет)арилглицинов общей формулы I:

в которой m и n могут принимать значения 0, 1, 2 и 3;
знак (#) здесь и далее обозначает возможность наличия хирального центра; R представляет необязательно замещенный С5-С10арил или 5-6-членный гетарил, содержащий 1-2 гетероатома, выбранных из азота и серы, возможно конденсированный с бензольным кольцом, причем заместители выбираются из С1-C8алкила, С1-C8алкокси, галогена, ОН, CF3, CN, NO2, CF3O, незамещенной амино-группы или моно-С1-6алкил- или ди(С1-6алкил)замещенной амино-группы, С1-8алкилсульфанила, С1-8алкоксикарбонил, C1-С6ацила;
А1 и А2 независимо представляют необязательно замещенный 5-6 членный насыщенный или ароматический азагетероцикл, содержащий от 1 до 2 атомов азота в цикле и возможно конденсированный с бензольным кольцом;
причем заместители в замещенных группах R, А1 и А2 независимо выбираются из С1-C8алкила, С1-C8алкокси, С1-C8алкилсульфанила, галогена, ОН, CF3, нитро, CN, CF3O, незамещенной аминогруппы, моно-С1-4алкил- или ди(С1-4алкил) аминогруппы, С1-C8алкоксикарбонила, C1-С6ацила, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров, или их смесей.
2. Способ по п.1, включающий введение соединения представляющего собой производные амидов арилглицинов общей формулы I.1,

в которой k и l могут принимать значения 0 и 1;
X независимо выбирается из Н, C1-C8алкила, C1-C8алкокси, галогена, ОН, CF3, нитро, CN, CF3O, незамещенной аминогруппы, моно-С1-4алкил- или ди(С1-4алкил) аминогруппы, C1-8алкоксикарбонила, С1-С6ацила,
либо группа X означает бензольное кольцо, аннелированное с фенилом или 5-6-членным гетероциклилом, содержащим 1-2 гетероатома, выбранных из атомов азота, кислорода,
R1 и R2 независимо представляют необязательно замещенный азагетероцикл, такой как пиридин, пиперидин, пиримидин, хинолин, изохинолин, или его фармацевтически приемлемой соли, или сложного эфира.
3. Способ по п.2, включающий введение соединения в виде отдельных изомеров или в виде смеси R-(-)- и S-(+)-изомеров, соответственно представленных общими формулами I.1.1 и I.1.2:

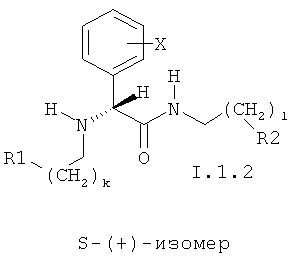
в которых
k и l могут принимать значения 0 и 1;
X, R1 и R2 имеют значения, указанные в п.2.
4. Способ по любому из пп.1, 2 или 3, включающий введение соединения, выбранного из
271. 2-(1,3-бензодиоксол-5-ил)-N-(2-пиридин-4-илэтил)-2-[(2-пиридин-4-илэтил)-амино]ацетамид;
272. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)-амино]ацетамид;
273. 2-(1,3-бензодиоксол-5-ил)-2-[(2-пиперидин-4-илэтил)амино]-N-(2-пиридин-4-илэтил)ацетамид;
275. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-3-илметил)-2-[(пиридин-3-илметил)-амино]ацетамид;
276. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-4-илметил)-2-[(пиридин-3-илметил)-амино]ацетамид;
583. 2-(4-гидроксифенил)-2-[(2-пиперидин-4-илэтил)амино]-N-(2-пиридин-4-ил-этил)ацетамид;
615. 2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N-(пиридин-3-илметил)-2-[(пиридин-3-илметил)амино]ацетамид;
622. N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)амино]-2-(3,4,5-триметокси-фенил)ацетамид;
651. метил 3-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоат;
661. метил4-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоат;
662. метил 4-{2-оксо-1,2-бис[(пиридин-4-илметил)амино]этил}бензоат.
5. Способ по любому из пп.1, или 2, или 3 для восстановления памяти, утраченной в результате нейродегенеративных заболеваний.
6. Способ по любому из пп.1, или 2, или 3 для восстановления памяти, утраченной в результате черепно-мозговой травмы или других физических воздействий на ЦНС.
7. Способ по любому из пп.1, или 2, или 3 для восстановления памяти, утраченной в результате злоупотребления веществами, вызывающими зависимость, при воздействии нейротоксинов или других амнестических агентов.
8. Способ по любому из пп.1, или 2, или 3 для восстановления памяти, утраченной в результате старения организма.
9. Способ восстановления утраченной памяти в норме и патологии по п.1, согласно которому вводят соединение формулы I, предпочтительно соединение, выбранное из соединения формулы I.1 или I.1.1 или I.1.2, указанные в любом из пп.2 или 3, соответственно, в виде лекарственного средства в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, в дозе 0,005-1,5 мг/кг массы, предпочтительно 0,005-1,0 мг/кг массы, по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
10. Соединение формулы I

где значения A1, А2, R указаны в п.1,
или их фармацевтически приемлемые соли, или сложные алкиловые эфиры, в виде отдельных оптических изомеров, или их смесей указанных в любом из пп.1, или 2, или 3 в качестве активного ингредиента для получения фармацевтической композиции или лекарственного средства для восстановления утраченной памяти в результате патологий, неблагоприятных воздействий или времени.
11. Соединение по п.10, соответствующее общей формуле I.1
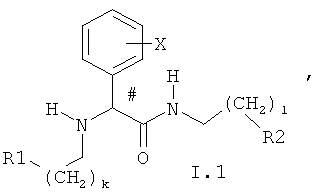
в которой k и l могут принимать значения 0 и 1;
X, R1 и R2 имеют значения, указанные в п.2.
12. Соединение по п.11, соответствующие общим формулам I.1.1 или I.1.2
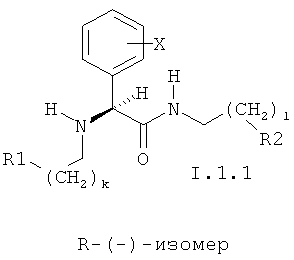
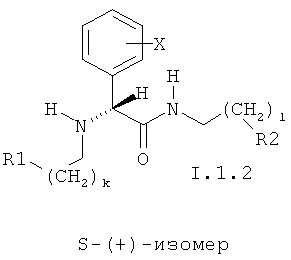
в которых k и l могут принимать значения 0 и 1;
X, R1 и R2 имеют значения, указанные в п.2.
13. Соединение по любому из пп.10-12 для получения фармацевтической композиции или лекарственного средства для восстановления утраченной памяти в результате заболевания, которое представляет собой болезнь Альцгеймера, болезнь Паркинсона; болезни (хореи) Хантингтона; рассеянный склероз; мозжечковую дегенерацию; амиотрофический латеральный склероз; деменцию с тельцами Леви; спинальную мускульную атрофию; периферическую нейропатию; губчатый энцефалит; СПИД-ассоциированную деменцию; мультиинфарктную деменцию; лобно-височную деменцию; лейкоэнцефалопатию; хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсию; церебральную ишемию; глаукому; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластому; шизофрению; депрессию; и нейродегенеративные процессы.
14. Фармацевтическая композиция обладающая способностью восстанавливать утраченную память в результате патологий, неблагоприятных воздействий или времени, отличающаяся тем, что содержит одно или несколько соединений активного ингредиента по любому из пп.10-12 и, по крайней мере один фармакологически совместимый наполнитель и/или растворитель и/или разбавитель.
15. Фармацевтическая композиция по п.14, отличающаяся тем, что дополнительно содержит, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых вспомогательных, распределяющих и воспринимающих средств, средств доставки; таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, лубриканты, регуляторы пролонгированной доставки.
16. Лекарственное средство для восстановления памяти, утраченной в результате патологии, неблагоприятных воздействий или времени, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку включающее в свой состав соединение по любому из пп.10-12 или фармацевтическую композицию по пункту 14.
| WO 2009095324 А1,06.08.2009 | |||
| ПРОИЗВОДНЫЕ АРИЛГЛИЦИНАМИДОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭТИ СОЕДИНЕНИЯ | 1996 |
|
RU2167866C2 |
Авторы
Даты
2012-07-27—Публикация
2010-09-07—Подача