Изобретение относится к области биотехнологии и экспериментальной онкологии, в частности к клеточным линиям, используемым для исследований in vitro в экпериментальной онкологии, а именно к клеточной линии mel Kor, полученной из опухолевого образца диссеминированной меланомы кожи человека [Патент РФ №2287578 с приоритетом от 22.04.2005].
Известны способы оценки потенциальной противоопухолевой активности и цитотоксичности новых противоопухолевых препаратов in vitro. Для этого на опухолевые клетки воздействуют растворами противоопухолевых препаратов в разной концентрации в течение различного времени, при этом получают зависимость доли выживших (погибших) клеток в результате такого воздействия. Оценка количества выживших клеток производится косвенными методами: колориметрическим методом с использованием МТТ [J.Carmichael, W.G.DeGraff, A.F.Gazdar, J.D.Minna, J.B.Mitchell. Evaluation of a tetrazolium-based semiautomated colorimetric assay: assessment of chemosensitivity testing. Cancer Res. 1987, Vol. 47, №4, p.936-942] или флуоресцентным методом с использованием флуоресцеиндиацетата (ФДА) [J.R.Sellers, S.Cook, V.C.Goldmacher. A cytotxicity assay utilizing a fluorescent dye that determines accurate surviving fractions of cells. J. Immunol. Meth. 1994. V. 172, p. 255-264] либо с использованием радиоактивных меток [M.Korbelik, G.Krosl. Enhanced macrophage cytotoxicity against tumor cells treated with photodynamic therapy. Photochem Photobiol. 1994, Vol. 60, №5, p.497-502]. Во всех этих методах клетки после воздействия дополнительно инкубируют с растворами, содержащими вещества, которые в зависимости от жизнедеятельности клеток изменяют уровень поглощения, флуоресценции или радиоактивный сигнал, что позволяет, измеряя количественно уровень поглощения, флуоресценции или радиоактивный сигнал, количественно оценить долю выживших либо погибших клеток.
Все вышеперечисленные способы оценки количества выживших клеток являются длительными и трудоемкими ввиду необходимости дополнительной инкубации клеток.
Известны опухолевые культуры, трансфицированные цветными флуоресцентными белками. Цветные флуоресцирующие белки являются уникальными генетическими маркерами для изучения молекулярных процессов в живых постоянно развивающихся клетках и организмах. Эти белки могут быть гетерологически экспрессированы в любых клетках, а для появления их флуоресцентного сигнала не требуются дополнительные ферменты или кофакторы [R.M.Hoffman. Advantages of multi-color fluorescent proteins for whole-body and in vivo cellular imaging. J. of Biomed. Optics. 2001. V.10. №4. p.1-10].
Известен вектор pTurboRFP-C [Международная заявка WO 2007085923, опубл. 02.08.2007], кодирующий экспрессию красного флуоресцирующего белка TurboRFP и предназначенный для клеток млекопитающих.
Задачей настоящего изобретения является расширение номенклатуры клеточных линий, используемых в экспериментальной онкологии для изучения in vitro потенциальных противоопухолевых препаратов, что дает возможность повысить эффективность, сократить длительность и трудоемкость исследований цитотоксичности противоопухолевых препаратов.
Поставленная задача решается тем, что получена новая клеточная линия mel Kor-TurboRFP из клеточной линии mel Kor путем введения гена, кодирующего экспрессию цветного флуоресцирующего белка TurboRFP.
Поставленная задача решается тем, что в способе оценки количества выживших опухолевых клеток после воздействия противоопухолевых препаратов, включающем измерение флуоресценции в лунках микропланшетов, измеряют собственную флуоресценцию клеток mel Kor-TurboRFP.
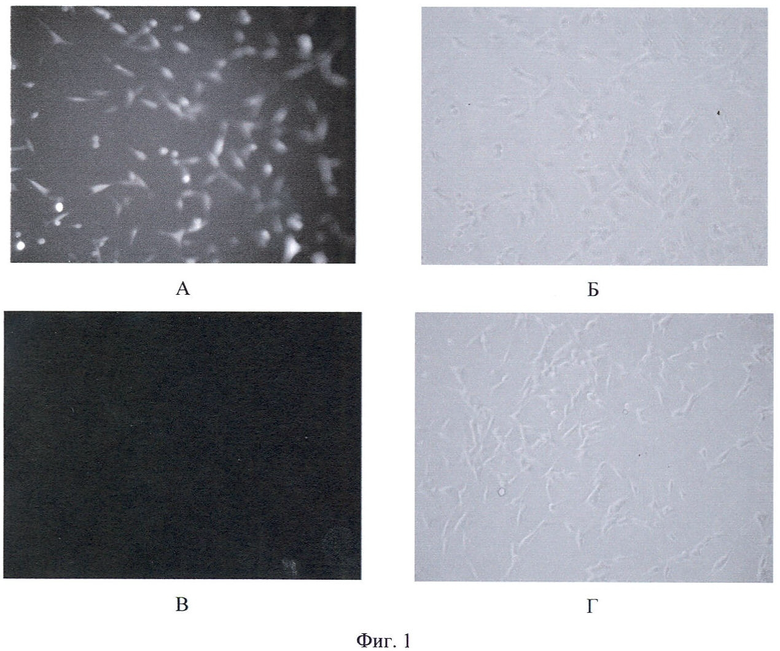
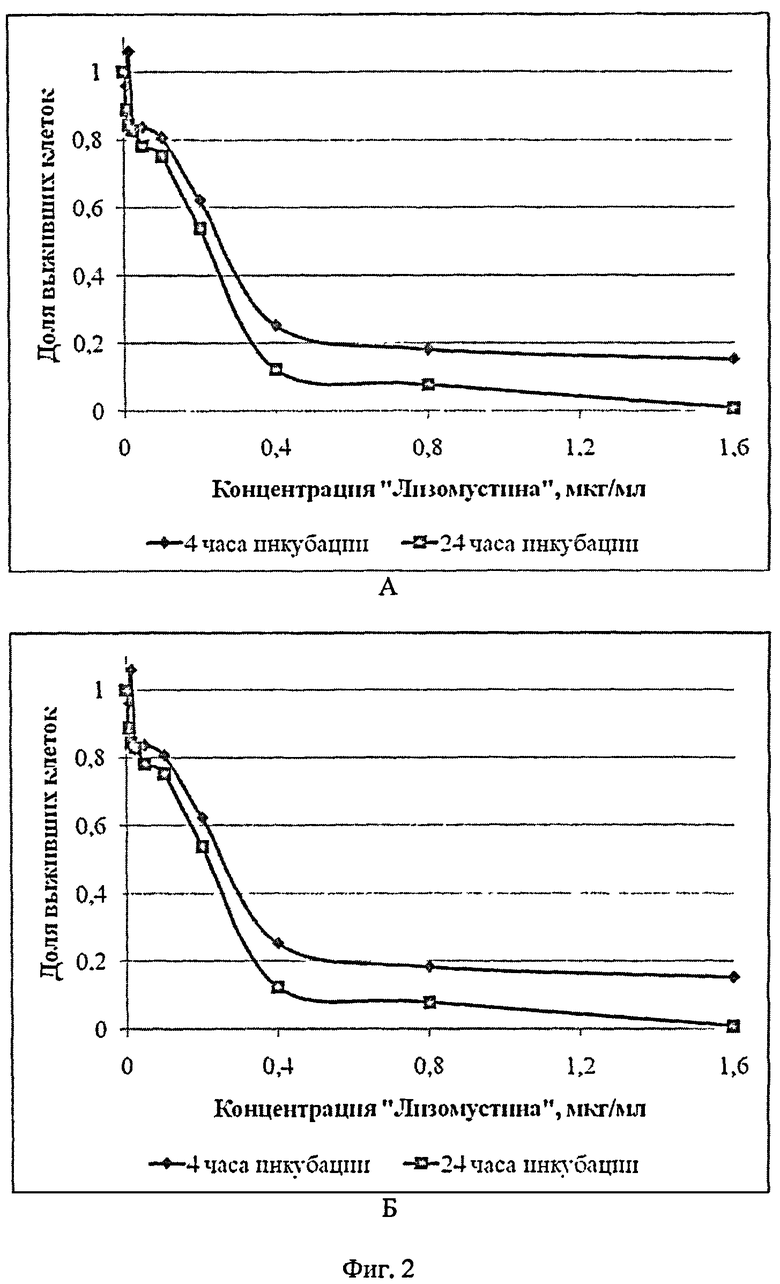
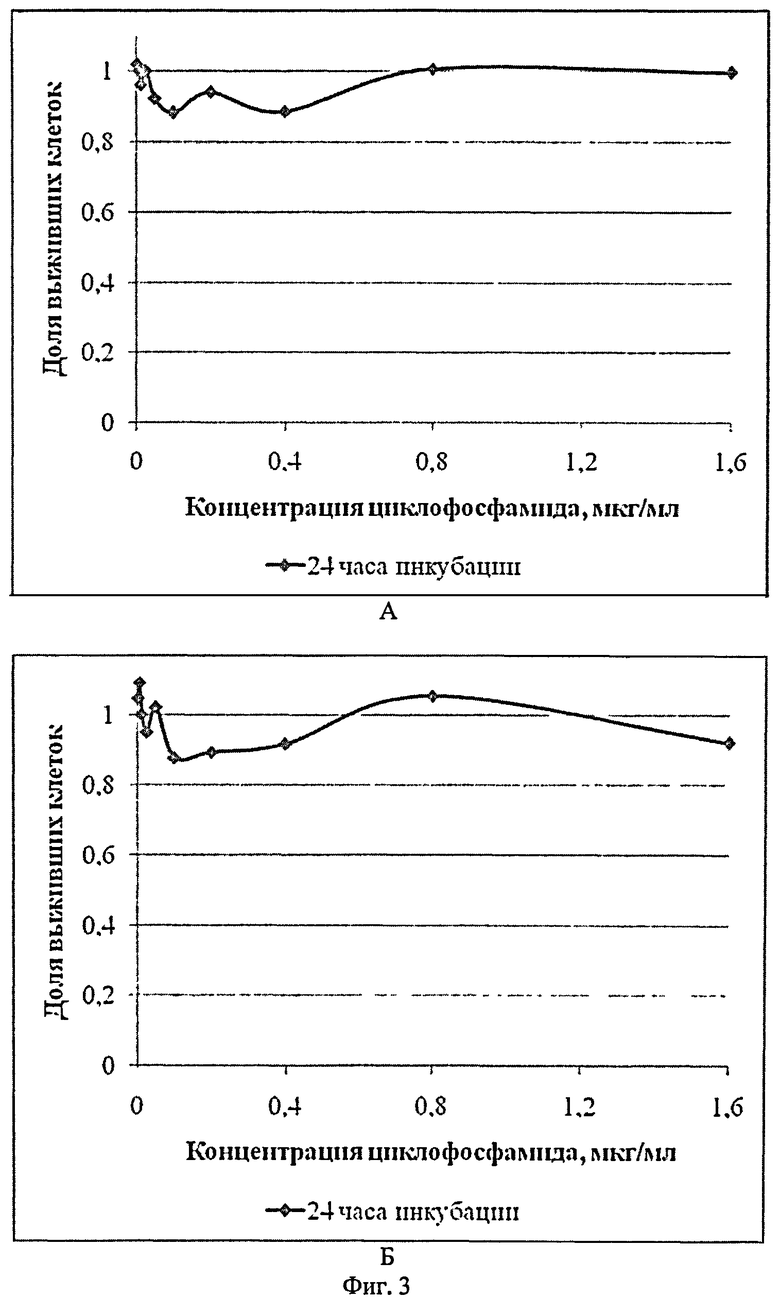
Сущность изобретения поясняется Фиг.1-4, где на Фиг.1 представлены микрофотографии опухолевых клеток флуоресцирующей меланомы, на Фиг.2 - кривые выживаемости клеток после использования противоопухолевого препарата "Лизомустин", на Фиг.3 - кривые выживаемости клеток после использования противоопухолевого препарата циклофосфамид, который действует только in vivo, а в случае in vitro был использован в качестве отрицательного контроля, на Фиг.4 - корреляция между данными по выживаемости клеток, полученными исходя из флуоресценции экспрессируемого клетками красного флуоресцирующего белка TurboRFP и по результатам ФДА-теста.
Полученная клеточная линия обладает стабильными культуральными и морфологическими характеристиками.
Родословная клеточной линии mel Kor-TurboRFP
Линия клеток получена из клеточной линии mel Kor следующим образом: клетки трансфицировали плазмидной ДНК pTurboRFP-C с использованием метода липосомальной трансфекции с последующей селекцией при помощи генетицина (антибиотик G418, аналог неомицина) и клонированием для получения индивидуальных клонов флуоресцирующих клеток; отбор среди клонов осуществляли по интенсивности флуоресценции и стабильности экспрессии флуоресцирующего белка в отсутствие селектирующей среды.
Морфологические признаки клеточной линии
Полученная клеточная линия характеризуется наличием множественных плотных центров роста опухолевых клеток, полиморфных меланомных клеток вытянутой, округлой и неправильной формы. В клетках обнаруживаются нормо- и гиперхромные ядра округлой и овальной формы, содержащие одиночные нуклеолы; базофильная негомогенная, иногда вакуолизированная цитоплазма. Имеются гигантские многоядерные клетки, фигуры митоза. Клеточная линия характеризуется наличием множественных плотных центров роста опухолевых клеток; полиморфных меланомных клеток вытянутой, округлой и неправильной формы.
Культуральные свойства клеточной линии
Культивируется в питательной среде DMEM, содержащей 10% фетальной телячьей сыворотки и антибиотики (пенициллин и стрептомицин в концентрации 100 ед./мл и 100 мкг/мл соответственно). В культуральные флаконы объемом 25 см2 в 5 мл среды засевают 1х10 клеток. Температура культивирования 37°С. Монослой клеток формируется через 3-4 дня.
Клетки снимаются с использованием стандартного раствора Трипсин-ЭДТА ("Панэко", Россия).
Условия криоконсервации
Для длительного хранения клетки консервируют путем замораживания в жидком азоте. Клетки ресуспендируют в среде для замораживания - фетальная телячья сыворотка 90%, ДМСО - 10%. Режим замораживания: жидкий азот, снижение температуры на 1°С в минуту до минус 25°С, затем быстрое замораживание до минус 70°С. Хранение в жидком азоте при температуре минус 196°С.
Размораживание быстрое при 37°С. Клетки разводят в 10 мл бессывороточной среды и осаждают центрифугированием, ресуспендируют в 5 мл той же среды, содержащей 10% фетальной телячьей сыворотки, и переносят в культуральный флакон объемом 25 см2. Жизнеспособность клеток оценивают по включению трипанового синего. Жизнеспособность клеток после размораживания составляет 80-90%.
Контаминация
При длительном наблюдении бактерии и грибы в культуре не обнаружены.
Стабильность экспрессии флуоресцирующего белка в отсутствие селектирующей среды наблюдается в течение более чем 10 циклов культивирования.
Клетки полученной клеточной линии экспрессируют цветной флуоресцирующий белок, что позволяет эффективно исследовать действие противоопухолевых агентов на монослои этих клеток in vitro, не применяя трудоемкий подсчет клеток при помощи камеры Горяева или функциональные тесты жизнеспособности клеток, требующие дополнительных манипуляций с соответствующими реагентами.
Клеточная линия депонирована в Российской коллекции клеточных культур (позвоночных) под номером РККК(П) 730 (Д).
Примеры
Пример 1. Культивирование клеточной линии mel Kor
Плазмидную ДНК pTurboRFP-C ("Евроген", Россия) нарабатывали с использованием штамма E.coli DH5α, затем выделяли и очищали при помощи набора "Endofree Plasmid Maxi Kit" (Qiagen) с целью очистки от эндотоксинов, что уменьшает токсичность процесса трансфекции для клеток
За 2 суток до трансфекции клетки рассаживали в лунки 24-луночного планшета в 0,5 мл ростовой среды (DMEM), содержащей 10% фетальной телячьей сыворотки, не содержащей антибиотиков, таким образом, чтобы во время трансфекции клетки составляли бы 90-95%-ный монослой. 6,0 мкл Lipofectamine 2000 (Invitrogen, США) разводили в 150 мкл среды Opti-MEM I (Invitrogen, США) без сыворотки и инкубировали 5 минут при комнатной температуре. 3,6 мкг плазмидной ДНК растворяли в 150 мкл среды Opti-MEM I без сыворотки и перемешивали пипетированием. Затем смешивали растворенную ДНК и разведенный Lipofectamine 2000 (общий объем 300 мкл), осторожно перемешивали и инкубировали в течение 20 минут при комнатной температуре. Затем добавляли по 100 мкл комплекса Lipofectamine 2000-ДНК в каждую из трех лунок 24-луночного планшета, содержавшую клетки и по 0,5 мл ростовой среды без антибиотиков. Осторожным покачиванием планшета распределяли добавленный комплекс по всей площади лунок. Клетки инкубировали при 37°С в СO2-инкубаторе в течение 24 часов перед исследованием экспрессии флуоресцирующего белка и манипуляциями, связанными с селекцией и клонированием.
После трансфекции смесь трансфицированных и нетрансфицированных клеток подвергали селекции при помощи генетицина (антибиотик G418, аналог неомицина) в концентрации в ростовой среде 800 мкг/мл. Смену селектирующей среды с антибиотиком производили каждый 4-й день, селекцию производили в течение 2 недель.
Из полученной популяции трансфицированных клеток выделяли индивидуальные клоны флуоресцирующих клеток меланомы с использованием клонирующих цилиндров.
Для повышения эффективности клонирования в полную среду добавляли кондиционную среду от гомологичных клеток, отобранную в log-фазе от клеток mel Kor меланомы и обогащенную среду Ham's F12 (DMEM, Ham's F12 и кондиционная среды взяты в соотношении 1:1:1).
Из полученных клонов производили отбор по следующим признакам:
а) интенсивность флуоресценции определялась визуально при помощи флуоресцентного инвертированного микроскопа и компьютеризированной спектрально-флуоресцентной установки «СПЕКТР-«Кластер» («Кластер», Россия) (в качестве базовой линии принималась автофлуоресценция нетрансфицированных клеток);
б) стабильность флуоресценции после многократных пассажей в среде без селектирующего антибиотика G-418.
Количество жизнеспособных клеток определяли по стандартной методике в камере Горяева, используя 0,5% раствор трипанового синего в PBS. В культуральные флаконы объемом 25 см2 в 5 мл среды засевали 1×106 клеток. Температура культивирования 37°С. Клетки культивировали в среде DMEM, содержащей 10% телячьей фетальной сыворотки, пенициллин (100 ед./мл), стрептомицин (100 мкг/мл) в культуральных флаконах (Costar).
Пример 2. Флуоресценция клеток клеточной линии mel Kor-Turbo-RFP in vitro Подтверждена при помощи флуоресцентной микроскопии (Фиг.1).
На Фиг.1 приведены микрофотографии опухолевых клеток флуоресцирующей меланомы mel Kor-TurboRFP (А, Б) и исходной меланомы mel Kor (В, Г). Микроскоп Nikon-TE2000U, x10, экспозиция 1/5 для флуоресценции (А, В), 1/50 для фазового контраста (Б, Г).
Пример 3. Способ оценки количества выживших опухолевых клеток после воздействия противоопухолевых препаратов
Клетки mel Kor-TurboRFP, находящиеся в log-фазе роста, рассаживали на 96-луночные культуральные планшеты за исключением крайних вертикальных и горизонтальных рядов в полной ростовой среде (DMEM, содержащей 10% телячьей фетальной сыворотки, пенициллин (100 ед./мл), стрептомицин (100 мкг/мл) в количестве, необходимом для получения 80% монослоя к моменту исследования противоопухолевого действия. При получении необходимой плотности монослоя ростовую среду заменяли на ростовую среду, содержащую противоопухолевый агент в различных концентрациях (каждая концентрация - в 6 повторах), и оставляли клетки в условиях СO2-инкубатора. После инкубации заменяли среду, содержащую противоопухолевый агент, на полную ростовую среду и оставляли на сутки. Затем параллельно проводили два теста для определения количества выживших клеток. В одном случае клетки отмывали от среды при помощи фосфатно-солевого буфера Дюльбекко (PBD) и добавляли по 100 мкл этого же буфера в каждую лунку планшета, а затем измеряли интенсивность флуоресценции при помощи флуориметра Labsystems Fluoroscan II (для возбуждения флуоресценции использовался интерференционный фильтр с длиной волны спектрального максимума 544 нм, для регистрации - фильтр с длиной волны максимума 607 нм). В другом случае использовали известный метаболитический тест, отражающий жизненную активность клеток, основанный на использовании производного флуоресцеиндиацетата [J.R-Sellers, S.Cook, V.C.Goldmacher. A cytotoxicity assay utilizing a fluorescent dye that determines accurate surviving fractions of cells. J. Immunol. Meth. 1994. V.172, p.255-264], проведенный по методике, описанной в [I.G.Meerovich, V.V.Jerdeva, V.M.Derkacheva, G.A.Meerovich, E.A.Lukyanets, E.A.Kogan, A.P.Savitsky. Photodynamic activity of dibiotinylated aluminium sulphphthalocyanine in vitro and in vivo. J. Photochem Photobiol. B: Biology. 2005. V.80, p.57-64]. В обоих случаях число выживших клеток определялось на основе калибровочной кривой. Калибровочная кривая строилась как зависимость флуоресцентного сигнала от количества посаженных клеток, для чего использовался культуральный микропланшет, в котором клетки были посажены одновременно с вышеуказанными планшетами, но следующим образом: во 2-м ряду - то же количество клеток, что и в планшетах для определения противоопухолевой активности, в 3-11 рядах - раститровка от этого количества в 2 раза. 12 ряд на всех планшетах использовался как контроль без клеток.
Произведенные эксперименты с противомеланомным препаратом "Лизомустин" продемонстрировали хорошую корреляцию между полученными кривыми выживаемости клеток, основанными на флуоресценции TurboRFP (Фиг.2А) и производного ФДА при использовании ФДА-теста (Фиг.2Б), пример приведен на Фиг.4, а также между концентрациями, необходимыми для достижения доли погибших клеток 50% и 90%, определенными при помощи этих методов (Фиг.2).
Эксперименты с циклофосфамидом, который не действует на опухолевые клетки в условиях in vitro, также показали корреляцию между кривыми выживаемости клеток, основанными на флуоресценции TurboRFP (Фиг.3А) и производного ФДА при использовании ФДА-теста (Фиг.3Б).
Использование флуоресцирующей клеточной mel Kor-TurboRFP позволяет быстро, эффективно и с минимальными затратами изучать цитотоксичность противомеланомных препаратов in vitro.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЛУОРЕСЦИРУЮЩАЯ КЛЕТОЧНАЯ ЛИНИЯ ГЛИОМЫ И СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2018 |
|
RU2699754C1 |
| СТАБИЛЬНАЯ КЛЕТОЧНАЯ ЛИНИЯ АДЕНОКАРЦИНОМЫ ЯИЧНИКА ЧЕЛОВЕКА SKOV-kat | 2008 |
|
RU2404244C2 |
| ПРИМЕНЕНИЕ КЛЕТОЧНОЙ ЛИНИИ МЕЛАНОМЫ КОЖИ ЧЕЛОВЕКА mel Cher В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНОЙ МОДЕЛИ ВАСКУЛОГЕННОЙ МИМИКРИИ | 2009 |
|
RU2404243C1 |
| ЛИНИЯ КЛЕТОК МЕЛАНОМЫ ЧЕЛОВЕКА KG, СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2008 |
|
RU2362805C1 |
| КЛЕТОЧНАЯ ЛИНИЯ МЕЛАНОМЫ ЧЕЛОВЕКА mel Kor, ИСПОЛЬЗУЕМАЯ ДЛЯ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ ВАКЦИН | 2005 |
|
RU2287578C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ ЦЕЛЬНОКЛЕТОЧНЫХ ПРОТИВООПУХОЛЕВЫХ ВАКЦИН | 2010 |
|
RU2458120C1 |
| КЛЕТОЧНЫЙ ПРОДУКТ ДЛЯ НАГРУЗКИ И АКТИВАЦИИ ДЕНДРИТНЫХ КЛЕТОК ЧЕЛОВЕКА | 2019 |
|
RU2714208C1 |
| КЛЕТОЧНАЯ ЛИНИЯ МЕЛАНОМЫ КОЖИ ЧЕЛОВЕКА mel-Alx-LP | 2022 |
|
RU2796357C1 |
| Применение белкового экстракта в качестве антипролиферативного и цитотоксического средства | 2017 |
|
RU2671632C1 |
| СТАБИЛЬНАЯ КЛЕТОЧНАЯ ЛИНИЯ КАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА SKBR-kat | 2018 |
|
RU2709675C1 |
Изобретение относится к области биотехнологии, конкретно к исследованиям противоопухолевого действия препаратов in vitro, и может быть использовано в экспериментальной онкологии. Клеточная линия меланомы человека mel Kor-TurboRFP обладает стабильными культуральными и морфологическими характеристиками. Клеточная линия характеризуется экспрессией меланомных (дифференцировочных) маркеров - CD63, НМВ45, MelanA, Tyrozinase, отсутствием антигенов гистосовместимости первого и второго классов. Клеточная линия характеризуется стабильной экспрессией красного флуоресцирующего белка TurboRFP. Оценить количество выживших опухолевых клеток после воздействия противоопухолевых препаратов возможно путем измерения интенсивности собственной флуоресценции клеток mel Kor-TurboRFP в лунках микропланшетов. Изобретение позволяет повысить эффективность и достоверность исследований противоопухолевых препаратов. 2 н.п. ф-лы, 4 ил., 3 пр.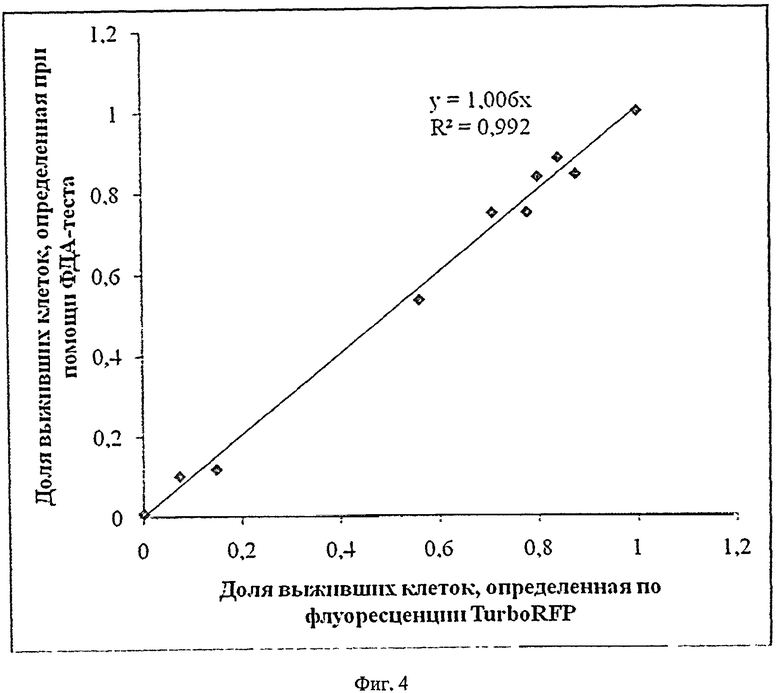
1. Клеточная линия меланомы человека mel Kor-TurboRFP, экспрессирующая красный флуоресцирующий белок и используемая для исследования противоопухолевого действия препаратов in vitro.
2. Способ оценки количества выживших опухолевых клеток после воздействия противоопухолевых препаратов, включающий измерение интенсивности флуоресценции в лунках микропланшетов, отличающийся тем, что измеряют интенсивность собственной флуоресценции клеток mel Kor-TurboRFP.
| Фундаментальные науки - медицине | |||
| Тезисы докладов на конференциях и семинарах по научным направлениям | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Угрюмов, А.А | |||
| Макоско, В.В | |||
| Круговых | |||
| - М.: Фирма "Слово", 2008, с.92, 93 | |||
| САВИЦКИЙ А.П | |||
| и др | |||
| Определение иммунофенотипа флуоресцирующих клеток MEL KOR-TURBO-RFP | |||
| КАМЕНСКИЙ В.А | |||
| и др | |||
| Разработка методов | |||
Авторы
Даты
2012-08-10—Публикация
2009-10-13—Подача