Предлагаемое изобретение относится к области биотехнологии и экспериментальной онкологии, касается стабильно трансфицированной клеточной линии аденокарциномы молочной железы человека, несущей онкомаркер HER2 и флуоресцирующей в дальне-красной области спектра, которая может быть использована для скрининга разрабатываемых противоопухолевых препаратов, в частности, HER2-специфичных таргетных агентов, а также может быть перевита лабораторному животному с получением экспериментальной флуоресцирующей модели рака молочной железа человека с высокой экспрессией онкомаркера HER2 in vivo, обеспечивающей прижизненную неинвазивную визуализацию развития опухоли в организме лабораторного животного методом оптического имиджинга.
В современных условиях высокой смертности от онкологических заболеваний поиск новых более эффективных противоопухолевых препаратов остается крайне актуальным направлением медико-биологических исследований. Стремительное развитие в настоящее время получил таргетная терапия, основанная на использовании препаратов, специфически взаимодействующих с молекулами-мишенями, экспрессирующимися в опухолевых клетках, но не представленными в нормальных тканях. Одним из наиболее значимых с клинической точки зрения опухолевых маркеров и успешно апробированной мишенью таргетной терапии является трансмембранный клеточный рецептор HER2, играющий важную роль в злокачественном перерождении клеток эпителиального происхождения. Известно, что в 15-20% клинических случаев рака молочной железы (РМЖ) наблюдается высокая экспрессия (гиперэкспрессия) онкомаркера HER2. Учитывая лидирующие позиции, занимаемые РМЖ в структуре смертности женского населения, разработка HER2-специфичных таргетных препаратов для лечения данного заболевания представляется актуальной задачей.
Неотъемлемым этапом работы в области разработки и скрининга противоопухолевых препаратов являются исследования эффективности потенциальных агентов на лабораторных животных in vivo. Важным критерием при оценке эффективности исследуемых препаратов является выбор метода мониторинга экспериментальных опухолей в организме животного. Технология использования флуоресцентных белков как генетически кодируемых маркеров опухолевых клеток обусловила развитие и широкое распространение оптического флуоресцентного имиджинга в экспериментальной онкологии. Признанными достоинствами этого метода являются высокая чувствительность и относительно низкая стоимость оборудования в сочетании с достаточным для терапевтического мониторинга разрешением. Для прижизненного флуоресцентного имиджинга экспериментальных опухолей наибольший интерес представляют красные и дальне-красные флуоресцентные белки, спектры излучения которых попадают в «терапевтическое окно прозрачности» биоткани.
Таким образом, актуальной задачей на сегодняшний день является создание линий опухолевых клеток с высокой экспрессией онкомаркера HER2 и флуоресцирующих в красной или дальне-красной области спектра с последующим получением на их основе экспериментальных опухолевых моделей in vivo для доклинического тестирования потенциальных таргетных НЕR2-специфичных агентов.
Известны клеточные линии меланомы мыши B16-F10-RFP (Ргос Natl Acad Sci U S А 100 (24): 14259-62 «Dual-color fluorescence imaging distinguishes tumor cells from induced host angiogenic vessels and stromal cells») и карциномы поджелудочной железы человека MIA-PaCa-2-RFP (J Surg Res. 113 (1): 151-60. 2003 «A novel red fluorescent protein orthotopic pancreatic cancer model for the preclinical evaluation of chemotherapeutics»), трансфицированные геном красного флуоресцентного белка DsRed2 (максимум флуоресценции при 588 нм), которые обеспечивают прижизненную визуализацию растущей опухоли в организме после перевивки лабораторным мышам. Недостатками указанных клеточных линий является отсутствие экспрессии онкомаркера HER2 и, соответственно, невозможность их использования для исследования эффективности HER2-cпeцифичныx таргетных агентов, а также невозможность их использования для создания модели рака молочной железы. Кроме этого, известно, что использование флуоресцентных белков с максимумом излучения менее 600 нм весьма ограничено в силу оптических свойств биологической ткани: сильного поглощения и рассеяния синего и зеленого света, а также ярко выраженной автофлуоресценции в данной области спектра. Данные особенности являются причиной низких значений интенсивности целевого сигнала флуоресценции, регистрируемого на интактном животном методом поверхностного имиджинга, и, в связи с этим, малого контраста получаемых изображений, а также размытия области флуоресцирующей опухоли на изображениях. Это значительно искажает результаты имиджинга, в частности, приводит к некорректному определению площади опухоли и интенсивности флуоресцентного сигнала [Chaudhuri et al., 2001, Puaux et al., 2011, Winnard et al., 2006].
Известны примеры использования флуоресцентных белков, излучающих в более длинноволновой области, для получения флуоресцирующих линий опухолевых клеток. Так, известны клеточные линии карциномы легкого Льюис LL-kat (Gene 517 (1): 72-81. 2013 «Development of a metastatic fluorescent Lewis Lung carcinoma mouse model: identification of mRNAs and microRNAs involved in tumor invasion) и эпидермоидной карциномы человека A431scM3-Kat2 (Cancer Immunol Immunother. 61 (10): 1617-26. 2012 «In vivo imaging of immunotoxin treatment using Katushka-transfected A-431 cells in a murine xenograft tumour model»), трансфицированные геном дальнекрасного флуоресцентного белка Katushka с максимумом флуоресценции при 635 нм. Также известна линия клеток карциномы молочной железы человека MDA-MB-231 E2-Crimson (PLoS One 10 (7): е0132725. 2015 «Non-Invasive In Vivo Imaging and Quantification of Tumor Growth and Metastasis in Rats Using Cells Expressing Far-Red Fluorescence Protein»), трансфицированная геном дальнекрасного флуоресцентного белка E2-Crimson с максимумом флуоресценции при 646 нм. Недостатками перечисленных линий клеток также является отсутствие экспрессии онкомаркера HER2 и, в связи с этим, невозможность их использования для исследования эффективности HER2 - специфичных таргетных агентов, а также невозможность получения на их основе модели HER2-пoлoжитeльнoгo рака молочной железы.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является линия клеток аденокарциномы яичника человека SKOV-kat, трансфицированная геном дальнекрасного флуоресцентного белка Katuskha, известная из патента RU 2404244 С2, кл. C12N 5/071, C12N 5/10, опубл. 20.11.2010 г., принятая за ближайший аналог (прототип).
Стабильная клеточная линия аденокарциномы яичника человека SKOV-kat, устойчивая к антибиотику G418, гиперэкспрессирующая онкомаркер HER2 и флуоресцирующая в дальней красной области спектра 600-700 нм, полученная способом, включающим следующие стадии: а. обеспечение плазмиды, содержащей ген флуоресцирующего белка Katushka; b. трансфекция клеток SKOV-3 плазмидой, содержащей ген флуоресцирующего белка Katushka; с. отбор флуоресцирующих колоний в среде в присутствии антибиотика G418; d. повторный отбор флуоресцирующих колоний в среде в отсутствие антибиотика G418.
Недостатком клеточной линии по прототипу является ее происхождение из эпителия яичника, в связи с чем она не может быть использована для получения модели НЕR2-положительного рака молочной железы in vivo с целью исследования данного заболевания и скрининга противоопухолевых агентов для его лечения.
В задачу изобретения положено создание клеточной линии аденокарциномы молочной железы человека, характеризующейся яркой флуоресценцией в дальнекрасной области спектра и экспрессией онкомаркера HER2.
Техническим результатом от использования изобретения является расширение коллекции клеточных линий для моделирования НЕR2-положительного рака молочной железы человека in vitro и in vivo.
Поставленная задача достигается тем, что стабильная клеточная линия карциномы молочной железы человека SKBR-kat, гиперэкспрессирующая онкомаркер HER2, получена путем трансфекции клеток исходной линии SKBR-3 плазмидой, содержащей ген флуоресцентного белка Katushka.
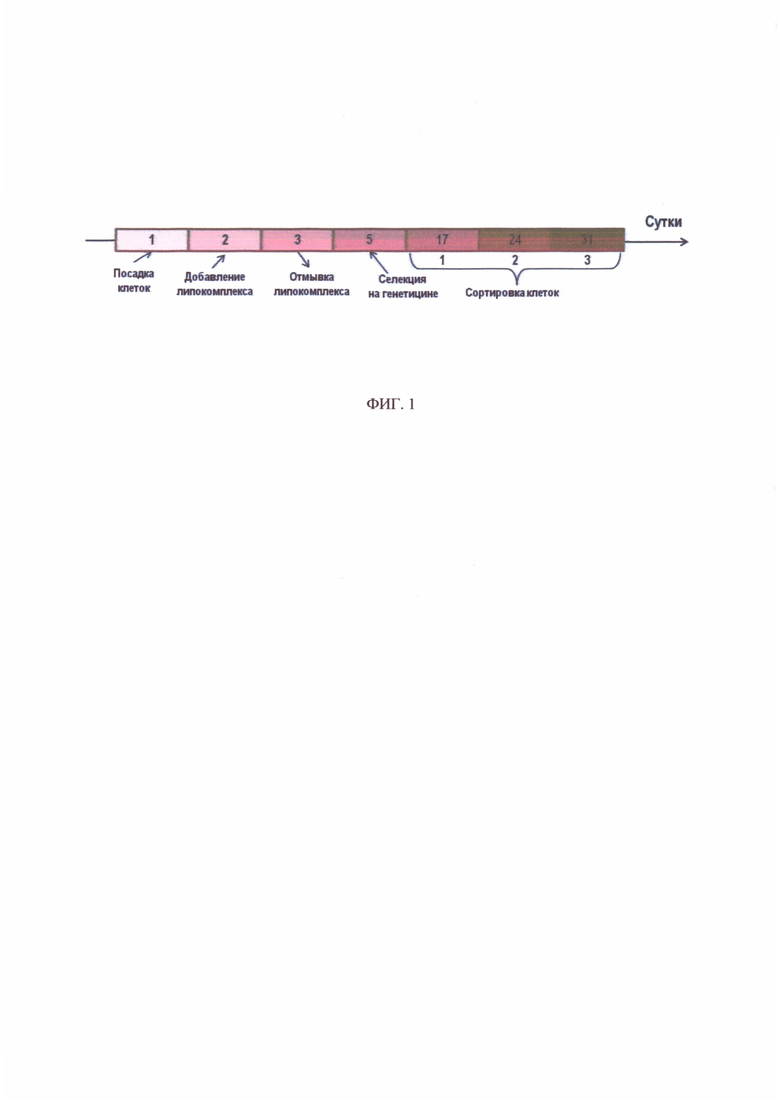
На фиг. 1 представлена схема процедуры трансфекции исходных клеток SKBR-3 геном флуоресцентного белка Katushka. Цифрами указаны сутки, за 1-й день принят день посадки клеток на планшет.
На фиг. 2 представлены результаты исследования флуоресценции клеток SKBR-kat, по сравнению с исходными клетками SKBR-3, в дальнекрасном диапазоне длин волн методами флуоресцентной микроскопии и проточной цитофлуориметрии: А -микроскопическое изображение клеток линии SKBR-kat в проходящем свете (слева) и при регистрации флуоресценции флуоресцентного белка Katushka (справа); Б - распределение по уровню сигнала флуоресценции в диапазоне 610/20 нм клеток исходной линии SKBR-3 (слева) и клеток линии SKBR-kat, полученных путем трансфекции клеток SKBR-3 геном флуоресцентного белка Katushka (справа).
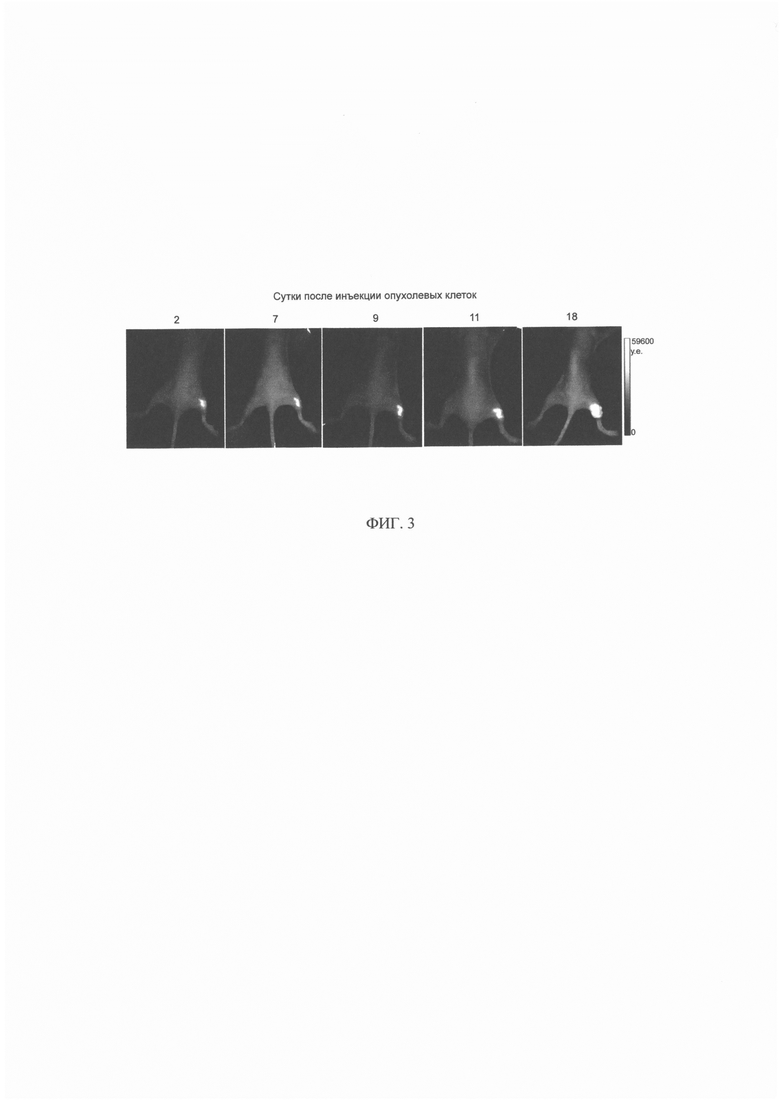
На фиг. 3 представлены последовательные прижизненные изображения иммунодефицичных мышей-опухоленосителей линии nude через различные сроки после подкожной перевивки клеток SKBR-kat в правую заднюю лапу. За нулевой день принят день подкожной инъекции клеток SKBR-kat (4 млн. клеток на мышь).
Создание предлагаемого изобретения осуществляли следующим образом.
Получение клеточной линии SKBR-kat.
Для получения заявленной клеточной линии ген флуоресцентного белка Katushka, содержащийся в векторной плазмиде pKatushka-N, вводили с помощью препарата Lipofectamin 3000 (Invitrogen, США) в линию раковых клеток SKBR-3, гиперэкспрессирующих онкомаркер HER2. С целью селекции трансфицированных клеток осуществлялась первичная селекция на среде с генетицином G418 (Gibco, USA) с дальнейшей сортировкой на оптическом проточном цитофлуориметре-сортере Aria III (BD, США).
Стабильность трансфекции подтверждена сохранением экспрессии флуоресценции белка Katushka клетками в течение не менее 20 пассажей, а также в ходе процедуры заморозки-разморозки клеток.
Для получения стабильно трансфицированной клеточной линии аденокарциномы молочной железы человека SKBR-kat использовали вектор для трансфекции pTurboFP635 (Евроген, Россия) содержащий ген флуоресцентного белка Katushka.
Трансфекция проводилась методом липофекции по схеме (фиг. 1). Клетки SKBR-3, гиперэкспрессирующие онкомаркер HER2, высаживались на 24-луночный планшет в количестве 50×103 клеток на лунку и инкубировались в СО2-инкубаторе в течение 24 часов. Затем к клеткам добавляли смешанный в питательной среде трансфицирующий реагент, содержащий липидные везикулы Lipofectamin 3000 (Invitrogen, USA) и плазмиду. Клетки с липокомплексом инкубировали в течение 24 часов, после чего заменяли среду с липокомплексом на обычную ростовую и инкубировали еще в течение 48 часов. Затем с целью предварительной селекции трансфицированных клеток их помещали на среду с генетицином G418 (Gibco, USA), т.к. использованная плазмида имеет ген устойчивости к данному антибиотику. Добавление антибиотика осуществляли на первом пассаже после липофекции в концентрации 0,3 мг/мл. При дальнейших пересаживаниях концентрацию генетицина G418 увеличивали до 2 мг/мл.
Отселектированные на среде с антибиотиком клетки были отсортированы на оптическом проточном цитофлуориметре-сортере Aria III (BD, США). Для дальнейшего культивирования отбирались популяции клеток с максимально яркой флуоресценцией в красном диапазоне спектра (610/20 нм при возбуждении лазером 561 нм), соответствующей спектру флуоресценции белка Katushka. Цикл сортировка-культивирование клеток был повторен трижды. На заключительном этапе путем сортировки единичных клеток были получены моноклоны клеток, последующий скрининг которых позволил отобрать моноклональную линию клеток SKBR-kat с наиболее яркой флуоресценцией белка Katushka.
Проверка полученной клеточной линии SKBR-kat на экспрессию флуоресцентного белка Katushka.
Методом конфокальной флуоресцентной микроскопии на системе Axio Obzerver Z1 LSM710 NLO Duo (Carl Zeiss, Германия) получены изображения стабильно трансфицированной клеточной линии SKBR-kat, подтверждающие соответствие результатов поставленной задаче (фиг. 2 А)
Для оценки уровня экспрессии белка Katushka клетками полученной линии SKBR-kat, по сравнению с клетками исходной линии SKBR-3 (АТСС®НТВ-30™), флуоресценция суспензий клеток была оценена методом проточной цитофлуориметрии (фиг. 2 Б). Показано, что клетки линии SKBR-kat обладают интенсивной флуоресценцией в дальнекрасной области спектра (610/20 нм), уровень которой превышает уровень флуоресценции исходной линии клеток SKBR-3 более чем в 1000 раз. При длительном культивировании клеточной линии SKBR-kat несветящихся клеток в культуре практически не наблюдалось, что свидетельствует о стабильности проведенной трансфекции клеток.
Предлагаемое изобретение работает следующим образом.
Получение флуоресцирующей ксенографтной модели аденокарциномы молочной железы SKBR-kat.
Для получения на основе созданной линии клеток SKBR-kat экспериментальной опухоли in vivo иммунодефицитным мышам линии BALB/c-Nude (самки, 17-23 г, 4-6 недель, питомник лабораторных животных ФИБХ РАН) были привиты клетки линии SKBR-kat в виде суспензии в фосфатно-солевом буфере (рН 7.4) в количестве 4 млн. клеток на животное, путем подкожной инъекции в правую заднюю лапу. Динамику роста опухоли оценивали методом поверхностного флуоресцентного биоимиджинга на основе интегральной интенсивности флуоресцентного сигнала по площади опухоли.
Было показано, что подкожная перевивка созданных клеток SKBR-kat приводит в формированию опухолевого узла у животного (фиг. 3). Развитие опухолевого узла характеризуется экспоненциальным ростом с коэффициентом скорости роста 0.2 сут-1 и периодом удвоения опухоли 3.4 сут.
Таким образом, клеточная линия HER2-пoлoжитeльнoй аденокарциномы молочной железы человека, флуоресцирующая в дальнекрасной области спектра (SKBR-kat), получена путем трансфекции клеток исходной HER2-гиперэкспрессирующей линии SKBR-3 геном флуоресцентного белка Katushka. Клеточная линия SKBR-kat сохраняет фенотипические свойства исходной линии SKBR-3, в частности, туморогенность после перевивки лабораторным иммунодефицитным мышам, выражающуюся в экспоненциальном росте формирующегося опухолевого узла. Клетки полученной линии SKBR-kat стабильно экспрессируют в цитоплазме флуоресцентный белок Katushka, что обусловливает интенсивную флуоресценцию данных клеток в дальнекрасном диапазоне длин волн.
Указанные свойства позволяют использовать созданную линию клеток SKBR-kat для моделирования HER2-пoлoжитeльнoгo рака молочной железы человека in vitro и in vivo с возможностью прижизненной и неинвазивной визуализации опухолей в организме животного методом флуоресцентного имиджинга, с целью мониторинга их роста и развития и оценки эффективности потенциальных агентов с противоопухолевой активностью, в частности, HER2-cпeцифичныx таргетных агентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНАЯ КЛЕТОЧНАЯ ЛИНИЯ АДЕНОКАРЦИНОМЫ ЯИЧНИКА ЧЕЛОВЕКА SKOV-kat | 2008 |
|
RU2404244C2 |
| РЕКОМБИНАНТНЫЙ ИММУНОТОКСИН, СПЕЦИФИЧНЫЙ К КЛЕТКАМ, ЭКСПРЕССИРУЮЩИМ РЕЦЕПТОР HER2 | 2014 |
|
RU2576232C1 |
| РЕКОМБИНАНТНЫЙ ТАРГЕТНЫЙ ТОКСИН, СПЕЦИФИЧНЫЙ К КЛЕТКАМ, ЭКСПРЕССИРУЮЩИМ РЕЦЕПТОР HER2 | 2016 |
|
RU2627215C1 |
| Клеточная линия рака молочной железы человека BrCCh4e | 2019 |
|
RU2717654C1 |
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА ЗЛОКАЧЕСТВЕННОСТИ КЛЕТОК | 2012 |
|
RU2508542C1 |
| Способ получения рекомбинантного противоопухолевого токсина на основе белков барназа-барстар и адресного полипептида дарпина с эффектом моментальной отмены цитотоксического действия | 2015 |
|
RU2610179C1 |
| ФЛУОРЕСЦИРУЮЩАЯ КЛЕТОЧНАЯ ЛИНИЯ ГЛИОМЫ И СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2018 |
|
RU2699754C1 |
| АЛЛОГЕННОЕ ПРОТИВООПУХОЛЕВОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО | 2004 |
|
RU2354694C2 |
| СПОСОБ СТИМУЛЯЦИИ ЦИТОТОКСИЧЕСКОГО ИММУННОГО ОТВЕТА ПРОТИВ КЛЕТОК ОПУХОЛЕВОЙ ЛИНИИ АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ, ЭКСПРЕССИРУЮЩИХ СПЕЦИФИЧЕСКИЕ АНТИГЕНЫ, С ПОМОЩЬЮ ДЕНДРИТНЫХ КЛЕТОК, ТРАНСФЕЦИРОВАННЫХ ПОЛИЭПИТОПНОЙ ДНК-КОНСТРУКЦИЕЙ | 2012 |
|
RU2520091C2 |
| РЕЦЕПТОР-НАПРАВЛЕННЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2682335C2 |

Изобретение относится к области биотехнологии, а именно к стабильной клеточной линии карциномы молочной железы человека SKBR-kat, гиперэкспрессирующей онкомаркер HER2. Линия получена путем трансфекции клеток исходной линии SKBR-3 плазмидой, содержащей ген флуоресцентного белка Katushka. Изобретение позволяет расширить коллекцию клеточных линий для моделирования HER2-пoлoжитeльнoгo рака молочной железы человека in vitro и in vivo с возможностью прижизненной и неинвазивной визуализации опухолей в организме методом флуоресцентного имиджинга. 3 ил.
Стабильная клеточная линия карциномы молочной железы человека SKBR-kat, гиперэкспрессирующая онкомаркер HER2, полученная путем трансфекции клеток исходной линии SKBR-3 плазмидой, содержащей ген флуоресцентного белка Katushka.
| СТАБИЛЬНАЯ КЛЕТОЧНАЯ ЛИНИЯ АДЕНОКАРЦИНОМЫ ЯИЧНИКА ЧЕЛОВЕКА SKOV-kat | 2008 |
|
RU2404244C2 |
| ФИЛОНЕНКО Д.В | |||
| и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Н.Н | |||
| Блохина РАМН", Российский биотерапевтический журнал, 2008; 3(7):20-23. | |||
Авторы
Даты
2019-12-19—Публикация
2018-11-15—Подача