Область техники, к которой относится изобретение
Данное изобретение относится к применению фармацевтических композиций, содержащих антисекреторные факторы, в лечении и/или предотвращении повышенного внутриглазного давления, которое предпочтительно характеризуется задержанным оттоком внутриглазной жидкости, приводящим к повышенному давлению в глазу. Это изобретение обеспечивает новый подход к лечению и/или предупреждению такого состояния, возвращающий внутриглазное давление к приемлемому уровню, необязательно, 21 мм ртутного столба или менее. Это изобретение относится также к способу лечения и/или предотвращения повышенного внутриглазного давления введением фармацевтических композиций, содержащих антисекреторные факторы.
Уровень техники
Повышенные уровни внутриглазного давления вызываются либо повышенным продуцированием жидкости, либо задержанным оттоком жидкости из глаза, или альтернативно их комбинациями. Внутриглазное давление (IOP) в глазу млекопитающего является сходным в широком диапазоне видов и имеет порядок 11-21 мм ртутного столба, например 10-20 мм ртутного столба, например 12-18 мм ртутного столба. Для людей нормальным диапазоном является диапазон приблизительно 11-21 мм ртутного столба. Он считается повышенным при превышении 20 мм ртутного столба, например 21 мм ртутного столба, например 21-24 мм ртутного столба или 22-30 мм ртутного столба, в течение продолжительного периода времени. Уровень IOP регулируется образованием жидкой водной внутриглазной жидкости (AH), происходящей из крови и переносимой посредством ресничных (цилиарных) отростков в заднюю камеру глаза. АН проходит через стекловидное тело и хрусталик в заднюю камеру и затем через зрачок в переднюю камеру глаза. Отсюда большая часть АН в конечном счете течет к радужно-роговичному углу (углу передней камеры глазного яблока) и выходит из глаза через трабекулярную сеть через канал Шлемма, водные вены и склеральные и эписклеральные вены. Существует обмен жидкости и метаболитов между АН и, например, хрусталиком в задней камере глазного яблока и роговицей в передней камере глазного яблока. Минорная часть АН входит в увеосклеральный путь, т.е. радужную оболочку, ресничную мышцу и склеру, и в конечном счете смешивается с локально продуцируемой тканевой жидкостью перед выходом из глаза (Jerndal, Hansson & Bill, 1990; Oyster, 1999). IOP в значительной степени контролируется этим оттоком, тогда как образование АН у взрослых людей считается менее вариабельным. Основными регуляторами IOP являются эндотелий трабекулярной сети, околоканальцевая эндотелиальная сеть и эндотелий внутренних стенок канала Шлемма (Lϋtjen-Drecoll 1998; Sacca et al 2005). Последний является особенно важным в очищении и мониторинге этого потока из передней камеры в сосудистую систему. В эндотелиальных клетках образуются инвагинации, называемые ямками, и заполняются АН и затем переносятся в основном в виде гигантских вакуолей через эти эндотелиальные клетки для опустошения в конечном счете их содержимого в канал Шлемма. Увеличенное IOP приводит к образованию большого числа таких гигантских вакуолей и к противоположному результату при уменьшении IOP (Jerndal, Hansson & Bill, 1990; Lϋtjen-Drecoll 1998). Кроме того, эти клетки могут, вероятно, иметь способность контроля их клеточного объема, дополнительно влияя посредством этого на парацеллюлярное истечение АН (Starner et al., 2001). Фигура 1а показывает схематическую картину глаза человека, а фигура 1b показывает микрофотографию, полученную с использованием сканирующего электронного микроскопа, радужно-роговичного угла в глазу взрослого человека.
Термин повышенное внутриглазное давление используется в медицинской практике в качестве диагноза для хронического заболевания с IOP, превышающим 20 мм ртутного столба, таким как 21-24 мм ртутного столба, например 22-30 мм ртутного столба. Пациенты с повышенным внутриглазным давлением могут страдать от этого состояния без развития каких-либо признаков последствий (осложнений), таких как снижение поля зрения или другие признаки отклонений от нормы сетчатки и зрительного нерва. Острое увеличение IOP может иметь место преходящим образом, например, при кашле, высокой рабочей нагрузке, после травмы глазного яблока и промывания среднего уха по методу Вальсальвы. В норме имеется циркадное (суточное) изменение IOP, являющееся наивысшим у людей в раннее дневное время. У взрослых людей приблизительно 2-3 мкл АН образуются в минуту, что приводит к тому, что АН в глазу обновляется при приблизительно 1½ ч. Это означает, что образование и отток должны контролироваться в узких пределах для поддержания IOP в пределах нормального диапазона. IOP не должно становиться ни слишком высоким, ни слишком низким. Основной функцией АН является обеспечение нутриентов, кислорода, ионов и жидкости, например, для хрусталика и роговицы, и дренирование метаболитов и остатков органических веществ. Кроме того, IOP и AH взаимодействуют для сохранения оптических свойств и формы глаза. Продуцирование АН может быть определено несколькими способами, такими как определение оборота АН и ее оттока. Внутриглазное давление определяют точно тонометрией.
Присутствие отклоняющегося от нормы IOP может быть продемонстрировано на некоторых имеющих глаукому пациентах. Несмотря на это не все пациенты с глаукомой действительно обнаруживают признаки повышенного внутриглазного давления. Таким образом, термин повышенное внутриглазное давление не должен приниматься за медицинский диагноз глаукомы. В отличие от повышенного внутриглазного давления глаукома определяется как заболевание, характеризуемое увеличивающимся со временем ухудшением и в конечном счете слепотой вследствие прогрессирующей потери ретинальных нервных клеток и дегенерации зрительного нерва. Широкий диапазон состояний включают в термин глаукома, все из которых имеют общий признак, заключающийся в том, что они в конечном счете приводят к ухудшению зрения (Ritch et al., 1996). Таким образом, диагноз глаукома относится к потере зрения, а не к отклоняющемуся от нормы внутриглазному давлению (IOP).
IOP регулируется в основном оттоком внутриглазной жидкости (AH) из передней камеры глазного яблока в глаз к венам через радужно-роговичный угол (угол передней камеры глазного яблока) в канал Шлемма. Если выход АН из глаза задерживается или даже блокируется, IOP становится повышенным. Сопротивление оттоку, обычно приводящее к IOP в диапазоне 10-20 мм ртутного столба, например 12-18 мм ртутного столба, в основном локализовано в трабекулярной сети и эндотелиальной выстилке канала Шлемма. Эти эндотелиальные клетки в трабекулярной сети и канале Шлемма взаимодействуют в регуляции оттока AH (Alvarado et al., 2005; Jerndal et al., 1991). Нет прямой коммуникации между передней камерой глазного яблока, с одной стороны, и каналом Шлемма, в том числе склеральной и эписклеральной венами, с другой стороны. В субъектах с повышенным внутриглазным давлением трабекулярная сеть характеризуется дегенерацией до варьируемой степени, накапливанием происходящего из влагалища глазного яблока бляшкообразующего материала и увеличенным сопротивлением оттоку АН (Rohen et al, 1993). Кроме того, накапливание пигментов и эксфолиативного материала, а также клеток крови и сгустка могут в некоторых случаях также способствовать задержке оттока и дополнительно затруднять отток, повышая IOP. Гиперсекреция, т.е. избыточное образование AH, является редкой единственной причиной повышенного внутриглазного давления. Таким образом, улучшенный, поддерживаемый контроль оборота АН, в частности контроль оттока АН через радужно-роговичный угол, имеет важное ключевое значение в снижении и нормализации IOP, для контроля повышенного глазного давления.
Доступные терапии для лечения повышенного внутриглазного давления в клинической практике нацелены предпочтительно на увеличение оттока АН, но некоторые лекарственные средства, такие как дорзоламид и бринзоламид, уменьшают продуцирование АН. Несколько из используемых в настоящее время лекарственных средств влияют как на образование, так и на пути оттока. Следует подчеркнуть, что эта композиция, как и оборот АН, являются важными в качестве снабжения АН, например, хрусталика и роговицы нутриентами, жидкостью и кислородом и способствует элиминации образованных продуктов-отходов. Распространенными являются побочные эффекты при использовании существующих в настоящее время лекарственных средств, и они часто препятствуют адекватному лечению. Кроме того, имеются субъекты с повышенным внутриглазным давлением, которые не могут лечиться адекватно доступными лекарственными средствами. Таким образом, существует потребность в терапевтических подходах для снижения IOP до нормальных уровней.
Антисекреторным белком является белок 41 кДа, первоначально описанный для обеспечения защиты против диарейных заболеваний и кишечного воспаления (в отношении обзора, см. Lange and Lоnnroth, 2001). Этот антисекреторный белок был секвенирован, и его кДНК была клонирована. Антисекреторная активность проявляется, по-видимому, в основном пептидом, локализованным между 1 и 163 или, более конкретно, между положениями 35 и 50 на аминокислотной последовательности этого антисекреторного белка. Иммунохимические и иммуногистологические исследования обнаружили, что этот антисекреторный белок присутствует и может быть также синтезирован большинством тканей и органов в теле. Синтетические пептиды, содержащие эту антидиарейную последовательность, были охарактеризованы (WO 97/08202; WO 05/030246). Ранее было описано, что антисекреторные факторы нормализуют патологический транспорт жидкости и/или воспалительные реакции, например, в кишечнике и сосудистом сплетении в центральной нервной системе после введения холерного токсина (WO 97/08202). Таким образом, было сделано предположение, что добавление антисекреторных факторов к пище и корму является полезным для лечения отека, диареи, дегидратации и воспаления, в WO 97/08202. WO 98/21978 описывает применение продуктов, имеющих ферментативную активность, для получения пищевого продукта, который индуцирует образование антисекреторных белков. Кроме того, WO 00/038535 описывает пищевые продукты, обогащенные антисекреторными белками, как таковые.
Было также показано, что антисекреторный белок и его фрагменты улучшают восстановление нервной ткани и пролиферацию, апоптоз, дифференцировку и/или миграцию стволовых клеток и клеток-предшественников и произведенных из них клеток в лечении состояний, ассоциированных с потерей и/или увеличением клеток (WO 05/030246).
Авторы данного изобретения неожиданно обнаружило, что антисекреторный белок-фактор, произведенные из него гомологи и пептидные фрагменты уменьшают сопротивление оттоку АН через радужно-роговичный угол глаза в венозную систему. Это является новым терапевтическим применением антисекреторных белков, их гомологов и фрагментов, т.е. применением таких белков и фрагментов в приготовлении лекарственных средств для лечения и/или предотвращения повышенного внутриглазного давления.
Сущность изобретения
Данное изобретение относится к применению фармацевтических композиций, содержащих антисекреторные факторы, в лечении и/или предотвращении повышенного внутриглазного давления. Это изобретение основывается на открытии, что антисекреторные факторы, т.е. антисекреторные белки и их пептиды, производные, гомологи и фрагменты, имеющие антисекреторную активность, увеличивают отток жидкости из глаз, уменьшая посредством этого внутриглазное давление.
В первом аспекте данное изобретение относится к применению антисекреторного белка или его гомолога, производного или фрагмента, имеющего антисекреторную активность, или его фармацевтически приемлемой соли, для приготовления фармацевтической композиции для предотвращения и/или лечения повышенного внутриглазного давления.
Во втором аспекте это изобретение относится к способу лечения и/или предотвращения повышенного внутриглазного давления у млекопитающего, где этот способ предусматривает введение эффективного количества фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное или фрагмент, имеющий антисекреторную активность, или их фармацевтически приемлемую соль, млекопитающему, нуждающемуся в этом.
Подписи к чертежам
Фиг.1а показывает схематическое изображение глаза человека (1-1). Канал Шванна (Sch) виден при более высоком увеличении, отделенный от передней камеры (АС) трабекулярной сетью (Т) (1-2). Также описано, что каждая трабекула (Tr) окружена эндотелиальными клетками (EC) (1-3). Внутриглазная жидкость образуется в ресничных (цилиарных) отростках, наблюдаемых справа от заключенной в рамку зоны на фиг.1-1. L = хрусталик; C = роговица; I = радужная оболочка (радужка); S = склера; модифицированная схема из: R.V. Krstic, 1991.
Фиг.1b является микрофотографией сканирующего электронного микроскопа радужно-роговичного угла глаза человека из 55-летнего мужчины, глаз которого был энуклеирован (удален) вследствие ретробульбарной опухоли. Трабекулярная сеть, помеченная как U, видна как отделенная от канала Шлемма довольно плотной тканью. C = роговица; Sp = след склеры; I = радужка; Cp = ресничные отростки; S = линия Швальбе. Наверху справа находится воздух. Из Jerndal et al., 1991.
Фиг.2 показывает внутриглазное давление при местной обработке глаз кроликов AF-16 (перевернутые треугольники), лекарственным средством Тимололом® (треугольники) и ЗФР-носителем (квадраты), соответственно, в соответствии с примером 7.
Фиг.3 показывает внутриглазное давление после 5 дней местной обработки глаз кроликов AF-16 (перевернутые треугольники), лекарственным средством Тимололом® (треугольники) и ЗФР-носителем (квадраты), соответственно, в соответствии с примером 7.
Фиг.4 показывает аминокислотную последовательность антисекреторного белка в соответствии с SEQ ID NO:6 данного изобретения. Эта последовательность соответствует SEQ ID NO:2 из US 6344440.
Определения
В данной заявке передняя (глазная) камера определена как пространство между передней поверхностью радужки и эндотелиальной поверхностью роговицы, соединенными в радужно-роговичном углу.
Задняя (глазная) камера определена как пространство между передней поверхностью стекловидного тела и хрусталика и задней поверхностью радужки. Задняя камера и передняя камера соединены через зрачок.
Антисекреторный белок в данном контексте обозначает белок с антисекреторными свойствами, как ранее определено в WO 97/08202 and WO 00/38535.
В данном контексте антисекреторным фактором (антисекреторными факторами) называют антисекреторный белок, или пептид, или их гомолог, или фрагмент, имеющий антисекреторную активность. В данном контексте такой пептид, гомолог, такое производное или такой фрагмент имеет аналогичную биологическую активность в лечении и/или предотвращении повышенного внутриглазного давления. В данном контексте термины антисекреторный белок, антисекреторный пептид, антисекреторное производное и антисекреторный фрагмент используются взаимозаменяемо. Под термином антисекреторный фактор имеют в виду также яичный желток, обогащенный антисекреторными факторами, описанный в SE 900028-2 и WO 00/38535, дополнительно описанный ниже.
Под водной (внутриглазной) жидкостью, АН, имеют в виду водянистую жидкость, образованную из крови в ресничных (цилиарных) отростках, текущую через заднюю камеру и затем оставляющую переднюю камеру в основном через трабекулярную сеть и канал Шлемма и в конечном счете венозные кровеносные сосуды.
ЦНС является центральной нервной системой, включающей в себя головной мозг и спинной мозг.
Под отеком имеют в виду накапливание избыточного количества водянистой (внутриглазной) жидкости в клетках, тканях или серозных полостях (см., например, Stedman's Medical Dictionary, 5th ed., Lippincott, Williams & Wilkins, Philadelphia, 2005).
Под глаукомой имеют в виду группу заболеваний, характеризуемых прогрессирующим повреждением сетчатки и зрительного нерва, приводящим к потере и сужению поля зрения и в конечном счете к потере зрения.
Внутриглазное давление (IOP) является давлением, оказываемым внутриглазной жидкостью в глазном яблоке.
Повышенное внутриглазное давление является состоянием, при котором давление в глазном яблоке превышает 20 мм ртутного столба, например 21 мм ртутного столба, например 22-30 мм ртутного столба, в бодрствующем субъекте. Таким образом, в данном контексте выражение повышенное внутриглазное давление используется взаимозаменяемо с отклоняющимся от нормы внутриглазным давлением.
Под пониженным внутриглазным давлением имеют в виду, что давление в глазном яблоке равно менее чем 11 мм ртутного столба, например 10 мм ртутного столба, у бодрствующего субъекта.
Радужно-роговичный угол является местом соединения в передней камере между радужной оболочкой и задней частью роговицы.
ЗФР является забуференным фосфатом солевым раствором.
В данном контексте термины «лечение» или «осуществление лечения» относится к терапевтической обработке для излечения или ослабления состояния повышенного внутриглазного давления. В данном изобретении термин «предотвращение» относится к профилактическому лечению во избежание появления повышенного внутриглазного давления.
Под трабекулярной сетью имеют в виду сеть из трабекул и слоев коллагеновой соединительной ткани, выстланной эндотелиальными клетками, вставленную в радужно-роговичном углу между передней камерой и каналом Шлемма.
Под каналом Шлемма имеют в виду кольцевой венозный канал в наружной части внутренней склеральной борозды в районе лимба глаза, соединенный через водные вены внутриглазной жидкости с венозной системой дренирования глаза. Канал Шлемма является основной системой оттока для внутриглазной жидкости из передней камеры глаза.
Белки являются биологическими макромолекулами, состоящими из аминокислотных остатков, связанных вместе пептидными связями. Белки, как линейные полимеры аминокислот, называют также полипептидами. Обычно белки имеют 50-800 аминокислотных остатков и, следовательно, имеют молекулярные массы в диапазоне от приблизительно 6000 до приблизительно нескольких сотен тысяч дальтон или более. Малые белки называют пептидами или олигонуклеотидами. Термин «белок» и «пептид» могут быть использованы взаимозаменяемо в данном контексте.
Фармацевтическая композиция в данном контексте обозначает композицию, содержащую терапевтически активное количество антисекреторного белка, необязательно в комбинации с фармацевтически активным эксципиентом, таким как носитель или наполнитель. Указанную фармацевтическую композицию готовят для подходящего способа введения, который может варьироваться в зависимости от состояния пациента, а также от других факторов, таких как возраст или предпочтительный выбор. Фармацевтическая композиция, содержащая антисекреторный белок, служит в качестве системы доставки лекарственного средства. Эта фармацевтическая композиция после введения предоставляет это активное вещество организму человека или животного. Фармацевтические композиции, подходящие для данного изобретения, описаны дополнительно ниже.
Подробное описание изобретения
Данное изобретение основано на неожиданном открытии, что антисекреторные факторы (AF), такие как антисекреторный белок и его гомологи, производные или фрагменты, вызывают уменьшение сопротивления оттоку внутриглазной жидкости через радужно-роговичный угол глаза в венозную систему, которое увеличивает отток ненормально накапливаемой жидкости в глазу. Посредством этого отток внутриглазной жидкости увеличивается, приводя к уменьшению внутриглазного давления в глазу. Это предоставляет новое терапевтическое применение антисекреторных белков и их фрагментов, т.е. применение таких белков и фрагментов в приготовлении фармацевтических композиций для лечения и/или предотвращения повышенного внутриглазного давления. Применение фармацевтических композиций в соответствии с данным изобретением является, по-видимому, наиболее полезным для пациентов, имеющих риск развития или страдающих от повышенного внутриглазного давления.
Как описано выше, отток внутриглазной жидкости происходит в основном через угол радужной оболочки и регулируется клетками, которые образуют трабекулярную сеть. Большая часть внутриглазной жидкости транспортируется из глаза через канал Шлемма. Внутриглазная жидкость транспортируется будучи заключенной в малых пузырьках, через клетки трабекулярной сети в канал Шлемма, а также в некоторой степени парацеллюлярно. Кроме того, в меньшей степени АН покидает глаз через угловые структуры радужной оболочки и склеры. Этот отток из глаза внутриглазной жидкости, в котором за один раз транспортируются «малые порции» жидкости, радикально отличается от транспорта ионов и воды, например, в кишечнике, где ионные и водные насосы эпителиальных клеток транспортируют одну молекулу за один раз. Таким образом, хотя антисекреторные факторы предлагались ранее для применения в лечении таких состояний, как отек, диарея, дегидратация, глаукома и воспаление (WO 97/08202), механизм действия антисекреторных факторов в лечении этих заболеваний отличается от их механизма действия в соответствии с данным изобретением, где сопротивление оттоку внутриглазной жидкости через радужно-роговичный угол глаза к венозной системе уменьшается этими антисекреторными факторами. Однако следует отметить, что повышенное внутриглазное давление в более поздней стадии может приводить или может не приводить к глаукоме.
Таким образом, в первом аспекте, данное изобретение относится к применению антисекреторного белка и/или его гомолога, производного или фрагмента, имеющего антисекреторную активность, т.е. антисекреторного фактора, и/или его фармацевтически приемлемой соли для приготовления фармацевтической композиции для предотвращения и/или лечения повышенного внутриглазного давления.
Антисекреторным фактором является белок, который природно встречается в организме. Антисекреторный фактор человека является белком 41 кДа, содержащим 382 аминокислоты, при выделении из гипофиза. Активный сайт в отношении уменьшающего внутриглазное давление действия согласно данному изобретению, по-видимому, расположен в области, близкой к N-концу этого белка, расположенной в аминокислотах 1-163 SEQ ID NO:6, или во фрагментах этой области.
Авторы данного изобретения показали, что антисекреторный фактор является в некоторой степени гомологичным с белком S5a, также называемым Rpn 10, который составляет субъединицу компонента, преобладающего во всех клетках позвоночных, протеасомы 26 S, более конкретно, в кэпе 19 S/PA 700. В данном изобретении антисекреторные белки определены как класс белков-гомологов, имеющих одни и те же функциональные свойства. Протеасомы имеют множество функций, связанных с деградацией избыточных белков, а также короткоживущих, нежелательных, денатурированных, неправильно уложенных и иным образом отклоняющихся от нормы белков. Кроме того, антисекреторный фактор/S5a/Rpn10 участвует в клеточном распределении и транспортировке клеточных компонентов, наиболее очевидно, белков, как описано дополнительно в обычных доступных руководствах.
Гомологи, производные и фрагменты антисекреторных белков и/или пептидов в соответствии с данным изобретением, все, имеют аналогичную биологическую активность, заключающуюся в способности уменьшать внутриглазное давление. Антисекреторные гомологи, производные и фрагменты, в данном контексте, содержат по меньшей мере 4 аминокислоты природно-встречающегося антисекреторного белка, который может быть дополнительно модифицирован изменением одной или нескольких аминокислот для оптимизации биологической активности антисекреторного фактора в лечении и/или предотвращении повышенного внутриглазного давления.
Фрагмент антисекреторного белка будет обычно содержать пептидную/аминокислотную последовательность или ее фрагмент в препарате, в котором более чем 90%, например 95%, 96%, 97%, 98% или 99%, белка в препарате является белком, пептидом и/или их фрагментами этого изобретения.
Кроме того, считается, что любая аминокислотная последовательность, являющаяся по меньшей мере на 70% идентичной, например, являющаяся по меньшей мере на 72%, 75%, 77%, 80%, 82%, 85%, 87%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, идентичной с аминокислотной последовательностью антисекреторного белка, пептида, гомолога, производного и/или фрагмента в соответствии с этим изобретением, находится также в объеме данного изобретения. В данном контексте термины гомологичный и идентичный используются взаимозаменяемо, т.е. аминокислотная последовательность, имеющая указанную степень идентичности с другой аминокислотной последовательностью, имеет ту же самую степень гомологии с указанной аминокислотной последовательностью.
Под производным в данном контексте имеют в виду белок, имеющий антисекреторную активность, определенную выше, произведенный из другого вещества либо непосредственно, либо посредством модификации или частичной замены, где одна или несколько аминокислот были заменены другой аминокислотой, причем аминокислота может быть модифицированной или неприродной аминокислотой. Такие модифицированные и/или неприродные аминокислоты хорошо известны квалифицированному в данной области специалисту. Например, производные антисекреторного фактора согласно этому изобретению могут содержать N-концевую и/или С-концевую защитную группу. Один пример N-концевой защитной группы включает в себя ацетил. Один пример С-концевой защитной группы включает в себя амид.
Под белками, гомологами, производными, пептидами и/или их фрагментом, имеющим аминокислотную последовательность, например, по меньшей мере на 95% идентичную ссылочной аминокислотной последовательности, имеют в виду, что эта аминокислотная последовательность, например, пептида, является идентичной ссылочной последовательности, за исключением того, что эта аминокислотная последовательность может включать в себя до 5 точечных мутаций на каждые 100 аминокислот ссылочной аминокислотной последовательности. Другими словами, для получения полипептида, имеющего аминокислотную последовательность, по меньшей мере на 95% идентичную ссылочной аминокислотной последовательности, до 5% аминокислот в ссылочной последовательности могут быть делетированы или заменены другой аминокислотой, или ряд аминокислот до 5% общего количества аминокислот в ссылочной последовательности могут быть инсертированы в эту ссылочную последовательность.
Эти мутации ссылочной последовательности могут встречаться в амино- или карбокси-концевых положениях ссылочной аминокислотной последовательности или в любом положении между этими концевыми положениями, разбросанные либо по отдельности среди аминокислот в ссылочной последовательности, либо в виде одной или нескольких смежных групп в ссылочной последовательности.
В данном изобретении для определения идентичности наилучшим образом подходит программа локальных алгоритмов. Программы локальных алгоритмов (например, Смита-Уотермана) сравнивают субпоследовательность в одной последовательности с субпоследовательностью во второй последовательности и находят комбинацию субпоследовательностей и сопоставление тех субпоследовательностей, которые дают наивысший общий балл сходства. Внутренние гэпы, если они допускаются, корректируются с использованием штрафа (пенальти). Локальные алгоритмы хорошо работают для сравнения двух мультидоменных белков, которые имеют единственный общий домен или просто единственный общий сайт связывания.
Способы определения идентичности и сходства кодифицированы (зашифрованы) в публично доступных программах. Предпочтительные способы компьютерных программ для определения идентичности и сходства между двумя последовательностями включают в себя, но не ограничиваются ими, пакет программ GCG (Devereux, J et al (1994)) BLASTP, BLAST и FASTA (Altschul, S.F. et al (1990)). Программа BLASTX публично доступна из NCBI и других источников (BLAST Manual, Altschul, S.F. et al, Altschul, S.F. et al (1990)). Каждая программа анализа последовательностей имеет матрицу (таблицу) оценивания по умолчанию и штрафы гэпов по умолчанию. Обычно предполагается, что молекулярный биолог будет использовать установки по умолчанию, установленные выбранной программой программного обеспечения.
Антисекреторный белок, или пептид, или его гомолог, производное или фрагмент, имеющие антисекреторную активность в соответствии с данным изобретением, могут быть 4 или более аминокислотами, например 5-16 аминокислотами, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 или более аминокислотами. В других предпочтительных вариантах осуществления антисекреторный фактор состоит из 42, 43, 45, 46, 51, 80, 128, 129 или 163 аминокислот. В предпочтительных вариантах осуществления антисекреторный фактор состоит из 5, 6, 7, 8 или 16 аминокислот.
В другом предпочтительном варианте осуществления антисекреторный белок, пептид и/или его гомолог, производное или фрагмент, имеющие антисекреторную активность в соответствии с данным изобретением, состоит из последовательности, соответствующей следующим формулам:
X1-V-C-X2-X3-K-X4-R-X5,
где X1 обозначает I, аминокислоты 1-35 SEQ ID NO:6 или отсутствует, X2 обозначает H, R или K, X3 обозначает S или L, X4 обозначает T или A, X5 обозначает аминокислоты 43-46, 43-51, 43-80 или 43-163 SEQ ID NO:6 или отсутствует.
Антисекреторный фактор по данному изобретению может быть получен in vivo или in vitro, например, рекомбинантно, химически синтезирован и/или выделен из природно-встречающегося источника антисекреторных факторов, таких как гипофизы свиней или яйца птиц. После получения антисекреторные факторы могут быть дополнительно обработаны, например, химическим или ферментативным расщеплением на меньшие антисекреторные активные фрагменты или модификацией аминокислот. В настоящее время невозможно получение антисекреторного фактора в чистом виде посредством очистки. Однако можно получить биологически активный антисекреторный фактор рекомбинантно, как описано ранее в WO 97/08202 и WO 05/030246. WO 05/030246 и WO 97/08202 описывают также получение биологически активных фрагментов этого белка.
Антисекреторный фактор согласно этому изобретению может дополнительно содержать N-концевую и/или C-концевую защитную группу. Один пример N-концевой защитной группы включает в себя ацетил. Один пример С-концевой защитной группы включает в себя амид.
Термин «фармацевтически активная соль» относится к соли антисекреторного белка, которая может быть любой солью, произведенной из него, на основании так называемого лиотропного ряда (ряда Хофмейзера). Поскольку белки и пептиды являются амфотерными, без ограничения объема изобретения, термин «фармацевтически приемлемая соль», следовательно, при хранении, например, трифторацетат или ацетат, относится также к более стабильной форме антисекреторного фактора согласно этому изобретению.
Фармацевтическая композиция или лекарственное средство этого изобретения может дополнительно содержать один или несколько фармакологически приемлемых носителей, эксципиентов или разбавителей, таких как носители, эксципиенты или разбавители, известные в данной области.
Эти композиции или лекарственные средства могут быть в форме, например, жидких, полужидких, полутвердых или твердах композиций, таких как, но не только, растворенные трансфузионные жидкости, такие как стерильный солевой раствор, растворы различных солей, растворы глюкозы, забуференный фосфатом солевой раствор, кровь, плазма или вода, порошки, микрокапсулы, микросферы, наночастицы, спреи, аэрозоли, ингаляционные устройства, растворы, дисперсии, суспензии, эмульсии и их смеси. В случае этих композиций могут учитываться стабильность и реактивность этих пептидов или этого белка.
Фармацевтические композиции этого изобретения могут быть приготовлены в соответствии с общепринятой фармацевтической практикой, например, в соответствии с “Remington: The science and practice of pharmacy", 21th edition, ISBN 0-7817-4673-6 или "Encyclopedia of pharmaceutical technology", 2nd edition, ed. Swarbrick J., ISBN: 0-8247-2152-7.
В одном предпочтительном варианте осуществления данного изобретения антисекреторным фактором является антисекреторный белок с аминокислотной последовательностью, показанной в SEQ ID NO:6, или его гомолог, производное и/или фрагмент, содержащий аминокислоты 38-42 SEQ ID NO:6.
В предпочтительном варианте осуществления данного изобретения антисекреторный фактор выбран из SEQ ID NO:1-6, т.е. VCHSKTRSNPENNVGL (SEQ ID NO:1, в данном контексте называемый также AF-16), IVCHSKTR (SEQ ID NO:2), VCHSKTR (SEQ ID NO:3), CHSKTR (SEQ ID NO:4), HSKTR (SEQ ID NO:5), или аминокислотной последовательности антисекреторного белка согласно SEQ ID NO:6 (также показанной на фигуре 4), использующей однобуквенные аббревиатуры для аминокислот. SEQ ID NO:1, 2 и 3 были описаны ранее, например, в WO 05/030246 и SEQ ID NO:6 в US 6344440. Как указано в сопутствующем списке последовательностей, некоторые из аминокислот в вышеуказанных последовательностях могут быть заменены другими аминокислотами. Далее в этом абзаце положение конкретной аминокислоты в конкретной аминокислотной последовательности рассчитывается с левого конца, с обозначением наиболее N-концевой аминокислоты как аминокислоты положения 1 в этой конкретной последовательности. Любая аминокислотная замена (любые аминокислотные замены), указанные ниже, могут выполняться независимо от любой другой аминокислотной замены (любых других аминокислотных замен) в этой последовательности. В SEQ ID NO:1, С в положении 2 может быть заменена S, H в положении 3 может быть заменена R или K, S в положении 4 может быть заменена L, и/или T в положении 6 может быть заменена A. В SEQ ID NO:2, C в положении 3 может быть заменена S, H в положении 4 может быть заменена R или K, S в положении 5 может быть заменена L и/или T в положении 7 может быть заменена A. В SEQ ID NO:3, C в положении 2 может быть заменена S, H в положении 3 может быть заменена R или K, S в положении 4 может быть заменена L и/или T в положении 6 может быть заменена A. В SEQ ID NO:4, C в положении 1 может быть заменена S, H в положении 2 может быть заменена R или K, S в положении 3 может быть заменена L и/или T в положении 5 может быть заменена A. В SEQ ID NO:5, H в положении 1 может быть заменена R или K, S в положении 2 может быть заменена L и/или T в положении 4 может быть заменена A.
В одном предпочтительном варианте осуществления данного изобретения указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:1.
В одном предпочтительном варианте осуществления данного изобретения указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:2.
В одном предпочтительном варианте осуществления данного изобретения указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:3.
В одном предпочтительном варианте осуществления данного изобретения указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:4.
В одном предпочтительном варианте осуществления данного изобретения указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:5.
Данное изобретение подразумевает также комбинацию двух или более антисекреторных факторов по данному изобретению, необязательно также в комбинации с яичным желтком, обогащенным антисекреторными факторами.
В одном предпочтительном варианте осуществления данного изобретения антисекреторный фактор используют для приготовления фармацевтической композиции для лечения и/или предотвращения или в способе лечения и/или предотвращения повышенного внутриглазного давления, где внутриглазное давление равно 21 мм или более ртутного столба, например 22 мм или более ртутного столба. В другом предпочтительном варианте осуществления данного изобретения внутриглазное давление является нормальным или даже более низким, т.е. ниже 21-24 мм ртутного столба, предпочтительно ниже 10-12 мм ртутного столба, например 11-21 мм ртутного столба. IOP, меньшее чем 11 мм ртутного столба, например меньшее чем 10 мм ртутного столба, например меньшее чем 10-12 мм ртутного столба, считается более низким, чем нормальное, т.е. являющимся низким. Полезные действия введения фармацевтических композиций в соответствии с данным изобретением также и млекопитающим, имеющим внутриглазное давление, которое является нормальным или даже более низким, чем нормальное, заключаются в том, что такие млекопитающие могут иметь максимумы во внутриглазном давлении на протяжении дня, которые могут затем вылечиваться и/или предупреждаться фармацевтическими композициями этого изобретения. В другом предпочтительном варианте осуществления внутриглазное давление превышает 21 мм ртутного столба, например равно 21-24 мм ртутного столба, например 22-30 мм ртутного столба.
Данное изобретение подразумевает также возможность лечения и/или предотвращения повышенного внутриглазного давления и/или приготовления фармацевтической композиции с использованием яичного желтка, обогащенного антисекреторными факторами. SE 9000028-2 описывает, как образование антисекреторных факторов может быть стимулировано у птиц, и антисекреторные факторы затем извлекают или концентрируют из продуктов расщепления яичного желтка. WO 00/38535 описывает дополнительно, как такие извлеченные или концентрированные антисекреторные факторы могут вводиться животным или людям с кормом или пищевым продуктом или, в виде более или менее выделенных продуктов, готовиться в виде фармацевтических продуктов. Таким образом, в данной заявке предполагается применение яичного желтка, обогащенного антисекреторными факторами, для приготовления продуктов, таких как фармацевтические композиции, для лечения и/или предотвращения повышенного внутриглазного давления или для применения в таком способе лечения. В предпочтительном варианте осуществления указанный антисекреторный белок обеспечен в концентрации по меньшей мере 1000 FIL единиц/мл в указанном яичном желтке. В данном контексте одна единица FIL соответствует 50% уменьшению потока жидкости в кишечнике в сравнении с контролем без предоставления антисекреторных факторов, как описано в WO 00/38535 и SE 9000028-2. Таким образом, антисекреторный фактор (антисекреторные факторы) согласно данному изобретению могут также вводиться в форме «лечебного питания». В данном контексте медицинским питанием называют пищевой продукт, который был приготовлен с композицией с антисекреторным белком. Такой пищевой продукт может быть подходящим пищевым продуктом в жидкой или твердой форме, такой как жидкость или порошок, или любым другим подходящим пищевым продуктом. Примеры такого материала могут быть найдены в WO 00/38535.
В одном предпочтительном варианте осуществления данного изобретения повышенное внутриглазное давление, которое подлежит лечению и/или предотвращению, вызвано сопротивлением оттоку внутриглазной жидкости из передней камеры глаза.
В другом предпочтительном варианте осуществления фармацевтическая композиция, используемая в соответствии с данным изобретением, уменьшает сопротивление оттоку внутриглазной жидкости из передней камеры через трабекулярную сеть и канал Шлемма.
В одном варианте осуществления данного изобретения фармацевтическая композиция согласно этому изобретению содержит фармацевтически приемлемый эксципиент. Выбор фармацевтически приемлемых эксципиентов и их оптимальной концентрации для применения в соответствии с данным изобретением могут быть легко определены квалифицированным в данной области специалистом посредством экспериментирования. Фармацевтически приемлемые эксципиенты для применения в соответствии с данным изобретением включают в себя растворители, буферные агенты, консерванты, хелатообразующие агенты, антиоксиданты, стабилизаторы, эмульгирующие агенты, суспендирующие агенты и/или разбавители.
Фармацевтически приемлемым эксципиентом является вещество, которое является по существу безвредным для индивидуума, которому будут вводить эту композицию. Такой эксципиент обычно удовлетворяет требованиям, выдвигаемым национальными агенствами, занимающимися лекарственными средствами. Официальные фармакопеи, такие как Фармакопея Соединенных Штатов Америки и Европейская фармакопея, установили стандарты для хорошо известных фармацевтически приемлемых эксципиентов.
Далее дается обзор соответствующих фармацевтических композиций для применения в соответствии с этим изобретением. Этот обзор основывается на конкретном способе введения. Однако понятно, что в тех случаях, когда фармацевтически приемлемый эксципиент может быть применен в различных лекарственных формах или композициях, применение конкретного фармацевтически приемлемого эксципиента не ограничивается конкретной лекарственной формой или конкретной функцией этого эксципиента.
Парентеральные композиции:
Для системного применения композиции согласно этому изобретению могут содержать общепринятые нетоксичные фармацевтически приемлемые носители и эксципиенты, в том числе микросферы и липосомы.
Композиции для применения согласно этому изобретению могут включать в себя все типы твердых, полутвердых и жидких композиций.
Фармацевтически приемлемые эксципиенты могут включать в себя растворители, буферные агенты, консерванты, хелатообразующие агенты, антиоксиданты, стабилизаторы, эмульгирующие агенты, суспендирующие агенты и/или разбавители. Примеры этих различных агентов приведены ниже.
Примеры различных агентов:
Примеры растворителей включают в себя, но не ограничиваются ими, воду, спирты, кровь, плазму, цереброспинальную жидкость, асцитическую жидкость и лимфатическую жидкость.
Примеры буферных агентов включают в себя, но не ограничиваются ими, лимонную кислоту, уксусную кислоту, винную кислоту, молочную кислоту, гидрофосфорную кислоту, бикарбонаты, фосфаты, диэтиламин и т.д.
Примеры хелатообразующих агентов включают в себя, но не ограничиваются ими, натрий-ЭДТА и лимонную кислоту.
Примеры антиоксидантов включают в себя, но не ограничиваются ими, бутилированный гидроксиланизол (ВНА), аскорбиновую кислоту и ее производные, токоферол и его производные, цистеин и их смеси.
Примеры разбавителей и дезинтегрирующих (разрыхляющих) агентов включают в себя, но не ограничиваются ими, лактозу, сахарозу, эмдекс, фосфаты кальция, карбонат кальция, сульфат кальция, маннит, крахмалы и микрокристаллическую целлюлозу.
Примеры связующих агентов включают в себя, но не ограничиваются ими, сахарозу, сорбит, аравийскую камедь, альгинат натрия, желатин, крахмалы, целлюлозу, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон и полиэтиленгликоль.
Фармацевтическую композицию или вещество, используемые в соответствии с этим изобретением, предпочтительно вводят через внутривенную периферическую инфузию или через внутримышечную или подкожную инъекцию в пациента или буккальным, легочным, назальным, кожным или пероральным способами. Кроме того, можно также вводить эту фармацевтическую композицию или фармацевтически активное вещество через хирургически вставленный шунт в желудочек головного мозга пациента.
В одном варианте осуществления фармацевтическую композицию по данному изобретению готовят для внутриглазного, интраназального, перорального, подкожного и/или системного введения. Фармацевтические композиции могут вводиться один или несколько раз а день. В предпочтительном варианте осуществления данного изобретения фармацевтическую композицию готовят для введения в виде спрея, аэрозоля, вводимых при помощи распылителя или ингалятора. В другом предпочтительном варианте осуществления композиция этого изобретения должна вводиться нанесением в виде суспензии или, даже более предпочтительно, порошка для ингаляции с использованием спрея, аэрозоля или распылителя назально и/или в дыхательные пути. Распылитель является медицинским устройством, которое доставляет жидкое лекарственное средство в форме тумана в дыхательные пути. Компрессоры распылителя гонят воздух через трубку в чашу для лекарственного средства, наполненную жидким лекарственным средством. Сила воздуха разбивает эту жидкость на тонкоизмельченные подобные туману частицы, которые могут быть ингалированы глубоко в дыхательные пути. Термин «аэрозоль» в данном контексте относится к газообразной суспензии тоноизмельченных частиц твердого вещества или жидкости. Фармацевтическая композиция в форме порошка, содержащая антисекреторные факторы, имеет дополнительные преимущества в отношении стабильности и дозы, и такой сухой порошок может вводиться ингалятором. Фармацевтическая композиция может также наноситься местно на глаз, внутриглазно, интраназально, перорально, подкожно и/или системно через кровеносные сосуды. В предпочтительном варианте осуществления эту фармацевтическую композицию готовят для местного введения в глаз. Обычно, при использовании для местного нанесения в глаз, применяемая концентрация в день в композиции этого изобретения равна 1 мкг-10 мг на введение, например 1 мкг-1 мг на введение, предпочтительно 50-1000 мкг в день, например 50-500 мкг в день, 50-250 мкг в день, 100-250 мкг в день, 500-250 мкг в день, 500-750 мкг в день или 50-100 мкг в день, либо в виде единственной дозы в день, либо в виде повторяемых несколько раз доз в день и на глаз. При системном введении в кровь эта доза обычно находится в диапазоне 0,1 мкг-120 мг на введение и кг массы тела и день, например 0,1 мкг-1 мг на введение и на кг массы тела и день, предпочтительно 1-1000 мкг/кг массы тела, предпочтительно опять 1-100 мкг/кг массы тела, либо в виде единственной дозы в день, либо повторяемых несколько раз доз в день. При использовании яичного желтка, обогащенного антисекреторными факторами, в соответствии с данным изобретением, его вводят предпочтительно перорально. Важным признаком белка AF, пептида, его фрагмента и/или производного является то, что не были обнаружены ни локальные, ни системные побочные действия даже при высоких дозах, что делает возможным интенсивное лечение без известных рисков.
Данное изобретение относится также к применению антисекреторного белка или его гомолога, производного и/или фрагмента, имеющего антисекреторнную активность, и/или его фармацевтически приемлемой соли для приготовления фармацевтической композиции для внутриглазного введения.
Данное изобретение относится также к пептиду, показанному в SEQ ID NO:4, его гомологу, производному и/или фрагменту per se. Это изобретение дополнительно относится к применению пептида в соответствии с SEQ ID NO:4 для лекарственного применения.
Данное изобретение относится также к пептиду, показанному в SEQ ID NO:5, его гомологу, производному и/или фрагменту per se. Это изобретение дополнительно относится к применению пептида в соответствии с SEQ ID NO:5 для лекарственного применения. Такой пептид описан также в ожидающей одновременного рассмотрения заявке от того же самого заявителя для применения для приготовления фармацевтической композиции для применения в лечении и/или предотвращении туннельного синдрома.
Данное изобретение относится также к способу лечения и/или предотвращения повышенного внутриглазного давления в млекопитающем, нуждающемся в этом, предусматривающему введение эффективного количества фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, имеющие антисекреторную активность, и/или его фармацевтически приемлемую соль. Фармацевтические композиции для применения в таком способе являются композициями, описанными выше.
Таким образом, данное изобретение относится к способу лечения и/или предотвращения повышенного внутриглазного давления в млекопитающем, нуждающемся в этом, предусматривающему введение эффективного количества фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, имеющие антисекреторную активность, и/или его фармацевтически приемлемую соль.
В предпочтительном варианте осуществления способ по данному изобретению предусматривает введение указанной фармацевтической композиции внутриглазным способом.
В предпочтительном варианте осуществления способа по данному изобретению указанная фармацевтическая композиция содержит один или несколько фрагментов, содержащих аминокислотную последовательность, показанную в SEQ ID NO:1-6.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанный антисекреторный белок состоит из последовательности, соответствующей следующим формулам:
X1-V-C-X2-X3-K-X4-R-X5,
где X1 обозначает I, аминокислоты 1-35 SEQ ID NO:6 или отсутствует, X2 обозначает H, R или K, X3 обозначает S или L, X4 обозначает T или A, X5 обозначает аминокислоты 43-46, 43-51, 43-80 или 43-163 SEQ ID NO:6 или отсутствует.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением этот антисекреторный белок является белком с аминокислотной последовательностью, показанной в SEQ ID NO:6, его гомологом, производным и/или фрагментом, содержащим аминокислоты 38-42 SEQ ID NO:6.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанный фрагмент антисекреторного белка содержит аминокислотную последовательность, показанную в SEQ ID NO:1.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанный фрагмент антисекреторного белка содержит аминокислотную последовательность, показанную в SEQ ID NO:2.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанный фрагмент антисекреторного белка содержит аминокислотную последовательность, показанную в SEQ ID NO:3.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанный фрагмент антисекреторного белка содержит аминокислотную последовательность, показанную в SEQ ID NO:4.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанный фрагмент антисекреторного белка содержит аминокислотную последовательность, показанную в SEQ ID NO:5.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением указанная фармацевтическая композиция содержит два или более любых из антисекреторных факторов данного изобретения, необязательно также в комбинации с яичным желтком, обогащенным антисекреторными факторами.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением внутриглазное давление в млекопитающем равно 21 мм ртутного столба или более.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением внутриглазное давление является нормальным или низким.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением антисекреторный белок обеспечен в яичном желтке, обогащенном таким антисекреторным белком, и указанный антисекреторный белок предпочтительно обеспечен в концентрации по меньшей мере 1000 единиц FIL/мл в указанном яичном желтке.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением повышенное внутриглазное давление вызвано сопротивлением оттоку внутриглазной жидкости из передней камеры глаза.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическая композиция уменьшает сопротивление оттоку внутриглазной жидкости из передней камеры через трабекулярную сеть и канал Шлемма.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическая композиция дополнительно содержит фармацевтически приемлемый эксципиент.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическую композицию готовят для внутриглазного, интраназального, перорального, подкожного и/или системного введения.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическую композицию готовят в виде спрея, аэрозоля или для введения при помощи распылителя или ингалятора.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическую композицию вводят системно в кровь в дозе 0,1 мкг-10 мг на введение и кг массы тела и день, предпочтительно 1-1000 мкг на введение и кг массы тела. Важным признаком белка AF, пептида, его фрагмента и/или производного является то, что не были обнаружены ни локальные, ни системные побочные действия даже при высоких дозах, что делает возможным интенсивное лечение без известных рисков.
В равным образом предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическую композицию вводят системно в кровь в дозе 0,1 мкг-10 мг на введение и кг массы тела и день, например в дозе 0,1 мкг-1 мг на введение и кг массы тела и день, предпочтительно 1-100 мкг на введение и кг массы тела.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением эту фармацевтическую композицию готовят для локального введения в глаз.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением эту фармацевтическую композицию вводят локально в дозе 1 мкг-10 мг на введение, предпочтительно 50-1000 мкг, в день.
В равным образом предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическую композицию вводят в дозе 0,1 мкг-10 мг на введение и кг массы тела и день, например в дозе 1 мкг-1 мг на введение, предпочтительно 50-250 мкг, в день.
В предпочтительном варианте осуществления способа в соответствии с данным изобретением фармацевтическую композицию вводят один или несколько раз в день.
Экспериментальный раздел
Пример 1
Молодые взрослые кролики (Ново-Зеландские белые, NZW) имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна динамика IOP, так как IOP у нормальных кроликов увеличивается при наступлении темноты. Одностороннее помещение 10-50 мкг AF-16 (SEQ ID NO:1) (растворенного в ЗФР с 10 или 50% добавленным этанолом) между глазным яблоком и теноновой капсулой приводило у анестезированных кроликов к временному падению IOP на 2,5 мм ртутного столба, как определено при помощи TonoPen® (Medtronic Inc., Minneapolis MN, USA). Краситель флуоресцеин (Sigma-Aldrich, Inc, St. Louis, MO, USA; натриевая соль, растворенная в ЗФР) инъецировали внутривенно и появление метки определяли при помощи рабочего микроскопа, оборудованного помещением щелевой лампы. Не было различия в отношении времени появления красителя флуоресцеина между глазом, обработанным AF-16, и контралатеральным глазом, обработанным только носителем. Описанную процедуру повторяли и документировали тот же самый результат. Сходный эффект снижения IOP получали с более высокой дозой, 100 мкг AF-16. Таким образом, был сделан вывод, что обработка AF-16 не влияла заметно на продуцирование АН, что отражалось в том, что удалось продемонстрировать, что используемая метка, флуоресцеин, как удалось показать, появляется приблизительно одновременно в обработанных AF-16 и обработанных носителем глазах, соответственно.
Пример 2
Молодые взрослые кролики (Ново-Зеландские белые, NZW) имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна динамика IOP. Одностороннее помещение посредством инъекции 10-50 мкг AF-16 (растворенного в 50 или 100 мкл ЗФР с 10 или 50% добавленным этанолом) между глазным яблоком и теноновой капсулой приводило через 2 часа в двух анестезированных кроликах к временному падению IOP на приблизительно 2,5 мм ртутного столба, как определено при помощи TonoPen®. Затем 20 или 50 мкл раствора в ЗФР, содержащего 3% краситель Эванса синий (Merck, Sigma) и 2% бычий сывороточный альбумин (Sigma), инъецировали в оба глаза через pars plana в границу между задней камерой глазного яблока и стекловидным телом. Глазные швы закрывали места инъекции для предотвращения рефлюкса и подтекания. Наблюдали, что синий краситель входил в переднюю камеру глазного яблока и покидал глаз через эписклеральные вены более быстро в глазу, предобработанном AF-16, чем в контралатеральном глазу, обработанном только носителем. Этот эксперимент повторяли один раз на следующий день с тем же самым результатом. Таким образом, отток АН, визуализированный комплексом альбумин-краситель, через радужно-роговичный угол в канал Шлемма и его соединительные вены, по-видимому, облегчался применением пептида AF-16.
Пример 3
Анестезированные взрослые животные будут иметь ток АН и сопротивление оттоку, определяемые в соответствии со способом перилимбической присоски (suction cup), установленным и периодически публикуемым подходом. Дополнительные подходы будут определять эти параметры. Посредством этого получают качественные и количественные фигуры в отношении действий AF-16 на динамику AH и IOP в здоровых животных и животных, с экспериментально повышенным внутриглазным давлением (IOP). То же самое относится к животным с врожденным повышенным внутриглазным давлением.
Пример 4
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Посредством этого IOP повышается на несколько мм ртутного столба во время первых нескольких часов темноты. Односторонняя инъекция (50-250 мкл) до 100 мкг AF-16, растворенного в ЗФР, с 10% добавленным этанолом, ниже теноновой капсулы в анестезированных животных вызывала через один час значимое снижение IOP, на 5 мм ртутного столба в сравнении с IOP в контралатеральном глазу, в который помещали только носитель (ЗФР с 10% этанолом). Это уменьшение IOP после обработки AF-16 сохранялось в течение по меньшей мере 4 ч и затем становилось опять равным IOP контралатерального глаза, как было определено на следующий день. Эти результаты могли быть повторены в течение 3 последовательных дней и на 3 кроликах. Сделан вывод, что AF-16 эффективно уменьшает IOP в здоровом глазу на несколько мм ртутного столба, что согласуется с тем, что, как сообщалось, достигается с использованием других лекарственных средств, предназначенных для снижения IOP.
Пример 5
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна суточная динамика IOP. Одностороннее помещение два раза с интервалом 2 минуты 25 мкг AF-16 (всего 50 мкг), в 25 мкл забуференного фосфатом солевого раствора (ЗФР), в нижнюю часть свода конъюнктивы (слепой мешок) анестезированных животных приводило после одного часа к снижению IOP на 1,5-2,5 мм ртутного столба в сравнении с IOP в контралатеральном глазу, в который помещали только носитель, ЗФР. Это снижение IOP после обработки AF-16 сохранялось в течение по меньшей мере 4 ч и затем становилось равным IOP контралатерального глаза на следующий день. Эти результаты могли быть повторены в течение 2 последовательных дней и на 2 кроликах. Таким образом, эти эксперименты демонстрируют, что локальное помещение AF-16 в этот слепой мешок здоровых кроликов приводит к временному понижению IOP.
Пример 6
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна суточная динамика IOP. Одностороннее помещение два раза с интервалом 2 минуты 50 мкг AF-16 (всего 100 мкг), в 50 мкл ЗФР, в нижний слепой мешок (нижнюю часть свода конъюнктивы) анестезированных животных приводило после одного часа к снижению IOP на 2-4 мм ртутного столба в сравнении с IOP в контралатеральном глазу, в который помещали только носитель. Это снижение IOP после обработки AF-16 сохранялось в течение по меньшей мере 4 ч и затем становилось равным IOP контралатерального глаза на следующий день. Эти результаты могли быть повторены в течение 3 последовательных дней и на 3 кроликах. Сделан вывод, что локальная обработка здорового глаза двойной дозой AF-16, установленной в примере 5, также временно снижала IOP, без наблюдаемых явных локальных или системных побочных эффектов.
Пример 7
Целью этого эксперимента, выполненного от имени заявителя Visionar AB, Uppsala, Sweden, было исследование динамики IOP в кроликах после локальной обработки AF-16 и сравнение полученных эффектов с эффектами лекарственного средства Тимолола® (2,5 мг/мл); Alcon Sweden AB, Stockholm, Sweden), о котором известно, что оно уменьшает внутриглазное давление, и носителя, ЗФР. Двадцать самок кроликов NZW (альбиносов) с массой 2,1-2,4 кг покупали и содержали со свободным доступом к корму (K1, Lactamin, Stockholm, Sweden) и водопроводной воде. Суточный цикл света регулировали включением света между 9 утра и 9 вечера. Во время 3-недельного периода акклиматизации животных приучали ежедневно к ситуации испытания измерения IOP после местной анестезии их роговиц.
Этих животных делили случайным образом на две группы: Группа 1, (n=10). Эти животные получали 2 капли AF-16 (всего 50 мкг, в 50 мкл ЗФР PBS) в один глаз и равный объем, 2×25 мкл, носителя, ЗФР, в контралатеральный глаз. Группа 2, (n=10). Эти животные получали 1 каплю (50 мкл Тимолола®; 125 мкг) в один глаз и равный объем ЗФР в другой глаз. Известно, что Тимолол® уменьшает внутриглазное давление в кроликах, и, следовательно, его использовали для валидизации этой модели, в качестве эталона. IOP измеряли при помощи TonoPen XL® (Medtronic) после нанесения 1 капли Tetrakain Chauvin® (Novartis Ophthalmics, Taby, Sweden) на каждую роговицу в качестве местного анестезирующего средства. В окончательном протоколе выполняли, следовательно, две серии измерений: одну серию после 5 дней локальной обработки AF-16 и другую серию после 5 дней локальной обработки Тимололом® или носителем.
При первом измерении ожидали, что снижающий IOP эффект Тимолола® будет обнаружен при 5-м и 6-м измерениях, так как ожидали, что IOP повышается вследствие используемого суточного цикла. В последний день измерения IOP выполняли во время пролонгированного периода (1, 2, 3,25, 4,25, 5,5, 6,5, 7,75, 9 и 10 ч после начала темноты в помещении животных) для гарантии того, что эти данные могли быть получены во время пролонгированного периода. Результаты представлены на прилагаемой фигуре 3. Величина IOP в начале 5-дневной обработки показана на фигуре 2. Ни локально, ни системно не наблюдали вредных действий или осложнений при обработке AF-16.
Из этих данных видно, что AF-16 оказывал снижающее действие на IOP, значимо отличающееся от IOP, измеренного после обработки только носителем, ЗФР. Эти высокозначимые действия, проявляемые AF-16, сравнивали с действиями Тимолола® (фигура 3). Был сделан вывод, что эти данные указывают на то, что AF-16 может быть таким же эффективным в снижении IOP в кроликах, что и обычно используемое лекарственное средство Тимолол®, которое, как известно, обладает такими действиями. Таким образом, AF-16 может быть применим в лечении повышенного внутриглазного давления в людях.
Пример 8
Два молодых здоровых кролика NZW (2,4-2,9 кг, самки) имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна суточная динамика IOP. Одностороннее помещение два раза с интервалом 2 минуты 50 или 100 мкг синтетического гексапептида CHSKTR (всего 100-200 мкг), каждый раз в 50 мкл ЗФР, в нижнюю часть свода конъюнктивы (слепой мешок) анестезированных животных приводило после одного часа к снижению IOP на 2-3 мм ртутного столба в сравнении с IOP в контралатеральном глазу, в который помещали только носитель. Это снижение IOP после обработки гексапептидом сохранялось в течение по меньшей мере 2 ч и затем становилось равным IOP контралатерального глаза на следующий день. Эти результаты могли быть повторены на 2 кроликах. Сделан вывод, что локальная обработка здорового глаза синтетическим пептидом, помещенным в нижний слезный мешок и имеющим части активной последовательности антисекреторного белка SEQ ID NO:6, CHSKTR (SEQ ID NO:4), снижает IOP.
Пример 9
Два молодых здоровых кролика NZW (2,4-2,9 кг, самки) имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна суточная динамика IOP. Анестезированные животные получали односторонне 50 или 100 мкг синтетического гексапептида, CHSKTR, растворенного в 100 мкл ЗФР с 10% этанолом, инъецированного в височной области ниже теноновой капсулы, что приводило спустя 30 минут к снижению IOP на 2-4 мм ртутного столба в сравнении с IOP контралатерального глаза, в который помещали носитель аналогичным образом. Уменьшение IOP после обработки гексапептидом сохранялось в течение по меньшей мере 2 ч. При определении на следующий день IOP в обоих животных был равен IOP контралатерального глаза. Эти результаты могли быть получены в два последующие дня. Сделан вывод, что локальная обработка здорового глаза инъекцией тест-вещества вне глазного яблока, синтетическим пептидом, имеющим части активной последовательности антисекреторного белка SEQ ID NO:6, CHSKTR (SEQ ID NO:4), уменьшала IOP, без индукции каких-либо локальных или системных побочных действий.
Пример 10
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого была известна суточная динамика IOP. Внутривенная инъекция AF-16, при каждом из двух уровней доз, 50 или 100 или 1000 мкг/кг массы тела, растворенного в ЗФР с добавленным 10% этанолом, анестезированным кроликам приводила после одного часа к понижению IOP на 2-3 мм ртутного столба в сравнении с IOP, измеренным непосредственно перед инъекцией AF-16. Это понижение IOP после обработки AF-16 сохранялось в течение по меньшей мере 2 ч. Не было видимого различия IOP между левым и правым глазами этих животных. IOP измеряли в каждом глазу еще один раз на следующий день, и оно возвращалось близко к величинам, полученным в день перед обработкой AF-16. Не наблюдали видимых побочных действий. Сделан вывод, что внутривенная инъекция AF-16 при 50, 100 или, наиболее эффективно, 1000 мкг/кг массы тела приводила к уменьшению IOP, демонстрируемому спустя один час и сохраняющемуся в течение нескольких часов, и что IOP возвращалось к исходному уровню спустя один день. Оба глаза обработанных кроликов обнаруживали одну и ту же картину динамики в отношении действий AF на IOP. Был сделан вывод, что пептид AF-16 при внутривенном введении, т.е. при введении системно, эффективно снижает IOP, но до приемлемого уровня, так что он не вызывает ненормально низкого внутриглазного давления (IOP).
Пример 11
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Вследствие этого, была известна суточная динамика IOP. Интраназальное помещение AF-16, 50, 100 или 1000 мкг/кг массы тела, растворенного в ЗФР, выполняли на 3 анестезированных кроликах, и оно приводило спустя один час к понижению IOP по меньшей мере на 2 мм ртутного столба в каждом из глаз в сравнении с IOP, измеренным непосредственно перед помещением AF-16 в ноздрю. Это снижение IOP после обработки высокой дозой AF-16 сохранялось в течение 2 и 3 часов исследованных периодов времени. Не было различия IOP между левым и правым глазами одного и того же животного. IOP измеряли в каждом из глаз еще раз на следующий день и показали, что величины IOP возвращались к величинам дня перед обработкой AF-16. Не наблюдали видимых побочных действий. Сделан вывод, что интраназальная инфузия до 1000 мкг/кг AF-16 будет приводить к понижению IOP, демонстрируемому в пределах 1 часа и сохраняющемуся по меньшей мере в течение 3 часов, и что величина IOP возвращалась к первоначальному уровню через день. Оба глаза в каждом кролике обнаруживают одни и те же картины давления. Не были отмечены местные или системные побочные действия.
Пример 12
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Посредством этого контролировали суточную динамику IOP. Под общей анестезией такой кролик имел 10 г лиофилизированного яичного желтка в AF-белке (Salovum™, растворенного в разбавленном коммерческом апельсиновом соке), находящегося в желудке. Такое внутрижелудочное депонирование происходило через один час к понижению IOP в каждом из глаз в сравнении с IOP, измеренным непосредственно перед помещением Salovum™. Не было различия IOP между левым и правым глазами этого животного. IOP измеряли в каждом глазу еще раз на следующий день, и величина IOP возвращалась приблизительно к величинам дня перед обработкой AF-16. Не были замечены видимые побочные действия. Был сделан вывод, что прием через рот яичного желтка, который был обогащен антисекреторными белками, например, Salovum™, приводил к понижению IOP, демонстрируемому приблизительно в пределах одного часа и сохраняющемуся в течение нескольких часов, и что IOP возвращался к первоначальному уровню через день. Оба глаза обнаруживали одну и ту же картину IOP.
Пример 13
Молодых взрослых кроликов NZW с односторонним легким буфтальмом («бычьим глазом», т.е. увеличенным левым глазным яблоком) анестезировали и измеряли их IOP при помощи тонометра TonoPen®. IOP в бутальмическом глазу было равно 30-32 мм ртутного столба, в то время как IOP в здоровом контралатеральном глазу было равно 11-12 мм ртутного столба при повторяемом исследовании. Односторонняя инъекция 50 мкг AF-16 в 100 мкл ЗФР с 10% этанолом в височной области ниже теноновой капсулы анестезированным животным приводила через один час к уменьшению IOP до 14-16 мм ртутного столба. Инъекция того же самого количества в контралатеральный глаз приводила к понижению всего лишь на приблизительно 2 мм ртутного столба, как определено с использованием TonoPen®. IOP в левом буфтальмическом глазу увеличивалось на следующий день до величины, слегка большей чем 30 мм ртутного столба, т.е. возвращалось к его исходному уровню. Инъекция еще раз AF-16 приводила через 2 часа опять к IOP 15-16 мм ртутного столба, хотя такая же доза AF-16 понижала IOP в правом глазу всего лишь на 1-2 мм ртутного столба. Не наблюдали вредных действий. Таким образом, был сделан вывод, что локальное помещение посредством инъекции в глазное яблоко снижает повышенное внутриглазное давление до нормальных уровней в буфтальмическом глазу.
Пример 14
Молодые взрослые кролики NZW имели их суточный ритм, корректированный подверганием этих животных темноте с 9 утра до 9 вечера, в то время как свет был включен с 9 вечера до 9 утра. Посредством этого динамика IOP была синхронизирована с суточными изменениями IOP. Было обнаружено, что подвергание таких кроликов импульсу сагиттального (действующего в переднезаднем направлении) ротационного ускорения, как описано в недавней публикации в научном медицинском международном журнале (Krave U, Hόjer S & Hansson H. -A., European J Neuroscience, 21, 2867-2882, 2005), приводило в этом исследовании к повреждению глаза, наряду с вызыванием диффузного повреждения головного мозга. Подвергание головы анестезированных кроликов импульсу переднезаднего (сагиттального) ротационного ускорения при силе до 200 кРад/с2 приводило к механической деформации глаза и силовой нагрузке на глаз. IOP увеличивалось во время следующих 30 минут до 35-40 мм ртутного столба, как определено тонометром TonoPen® на анестезированных животных, и оставалось повышенным в течение нескольких часов. Помещение 100 мкг на кг массы тела AF-16 инъекцией раствора AF-16 (100 мкл ЗФР с 10% этанолом) между теноновой капсулой и склерой височной области глаза спустя 10-30 минут после импульса сагиттального ротационного ускорения приводило к возвращению IOP к приблизительно нормальным уровням. IOP в контралатеральном глазу, который не получал AF-16, оставалось повышенным.
Подвергание кроликов такому импульсу сагиттального ротационного ускорения приводит к сильным цитоскелетным изменениям, например, в нервных клетках и сосудистых клетках (Hamberger et al., 2003). То же самое было показано ранее после подвергания головного мозга свиней высоким энергетическим нагрузкам (Suneson et al., 1990). Таким образом, сделан вывод, что изменения мембран, а также изменения цитоскелета в клетках в трабекулярной сети и канале Шлемма, индуцируемые травмой, вызываемой ротационным ускорением, приводили к временно нарушенному оттоку АН из передней камеры глазного яблока, генерирующему временно повышенное IOP. Местная обработка пептидом AF-16, по-видимому, уменьшает это повышенное внутриглазное давление (IOP).
Пример 15
Крысы должны иметь односторонне облитерированные 3 вены из их 4 эписклеральных вен. Вследствие этого венозная кровь из переднего сегмента оперированного глаза будет иметь только одну единственную вену для оттока крови из переднего сегмента глаза. Эта обработка приведет через несколько недель к повышенному внутриглазному давлению (IOP) в обработанном таким образом глазу. Глаза с повышенным IOP должны быть обработаны местно и/или системно AF-16 в ЗФР для определения, нормализует ли такая обработка IOP. Такие результаты позволят рассчитать скорость образования АН и характеристики оттока, делая возможным определение места действия AF-16 в пути потока AH через глаз.
Пример 16
Дополнительным крысам инъецируют гипертонический солевой раствор в височную эписклеральную вену, в то время как 3 другие эписклеральные вены имеют временно блокированный кровоток. Эта обработка через несколько недель приведет к повышенному IOP в обработанных глазах в соответствии с описанием, имеющимся в литературе (Morrison et al.). Глаза с повышенным IOP обрабатывают местно и/или системно AF-16 в ЗФР для определения, нормализует ли такая обработка IOP. Такие результаты позволят рассчитать скорость образования АН и характеристики оттока, делая возможным определение места действия AF-16 в пути потока AH через глаз.
Пример 17
Определенные линии грызунов, некоторые из которых являются трансгенными, были выведены для развития увеличенного внутриглазного давления с высокой частотой встречаемости. Будут оцениваться действия AF-16, введенного местно, локально и/или системно, на IOP. Подобные результаты позволят рассчитать скорость образования AH и характеристики оттока, делая возможным определение места действия AF-16 в пути потока AH через глаз. Применение подобных животных считается стандартным подходом к оценке лекарственных средств, предназначенных для лечения повышенного внутриглазного давления.
Резюме и выводы
Описанные эксперименты недвусмысленно раскрывают, что лечение антисекреторными факторами уменьшает и даже нормализует повышенное давление в глазах млекопитающих. Это показывает применимость лекарственных средств, содержащих антисекреторные факторы, белки, пептиды, гомологи и фрагменты, в клинической практике для контроля повышенного IOP у пациентов с повышенным внутриглазным давлением. Антисекреторный фактор AF-16 был экспериментально раскрыт для эффективной нормализации в глазах с повышенным IOP. Считается, что основное действие AF-16 осуществляется посредством его способности улучшать отток внутриглазной жидкости. Таким образом, сделан вывод, что было выявлено, что AF-16 понижает и нормализует повышенное внутриглазное давление облегчением выхода внутриглазной жидкости (АН) через клетки в трабекулярной сети и канал Шлемма.
ССЫЛКИ
1. Alvarado JA, Alvarado RG, Yeh RF, Franse-Carman L, Marcellino GR, & Brownstein MJ. A new insight into the cellular regulation of aqueous outflow: how trabecular meshwork endothelial cells drive a mechanism that regulates the permeability of Schlemm's canal endothelial cells. Brit. J Ophthalmol 89, 1500-1505, 2005.
2. Hamberger A, Huang Y-L, Zhu H, Bao F, Ding M, Blennow K, Olsson A, Hansson H.-A., Viano D & Haglid KG. Redistribution of neurofilaments and accumulation of β-amyloid protein after brain injury by rotational acceleration of a head. J Neurotrauma 20, 169-178, 2003.
3. Hogan MJ, Alvarado JA & Weddell JE. Histology of the human eye. W B Saunders Co., Philadelphia, PA, USA, 1971.
4. Jerndal T, Hansson H-A & Bill A. Goniodysgenesis; a new perspective on glaucoma. Scriptor, Copenhagen, Denmark, 1990 5. Krave U, Hόjer S & Hansson H.-A. Transient powerful pressures are generated in the brain by a rotational acceleration impulse to the head. Europ. J Neuroscience, 21, 2876-2882, 2005.
6. Krstic R V. Human microscopic anatomy. Springer Verlag, Berlin, 1991.
7. Lang GK: Ophthalmology. Thieme, Stuttgart, Germany, 2000.
8. Lange S, & Lόnnroth I. The antisecretory factor: synthesis, anatomical and cellular distribution, and biological action in experimental and clinical studies. Intern Rev. Cytology 210, 39-75, 2001.
9. Lϋtjen-Drecoll E. Functional morphology of the trabecular meshwork in primate eyes. Progress Retinal Eye Research 18, 91-119, 1998.
10. Morrison JC, Johnson EC, Cepurna W, & Jia L. Understanding mechanisms of pressure-induced optic nerve damage. Progress Retinal Eye Research 24, 217-240, 2005.
11. Oyster CW. The human eye; structure and function. Sinauer Associates Inc, Sunderland, Mass., USA, 1999.
12. Ritch R, Shields MB & Krupin T. The glaucomas, 2nd edition, Mosby, St. Louis.Miss. USA, 1996.
13. Rohen JW, Lϋtjen-Drecoll E, Flϋgel C, Meyer M & Grierson I. Ultrastructure of the trabecular meshwork in untreated cases of primary open-angle glaucoma (POAG). Exp Eye Res., 56, 683-692, 1993.
14. Sacca SC, Pascotto A, Camicione P, Capris P, & Izzotti A. Oxidative DNA damage in the human trabecular meshwork. Arch Ophthalmology 123, 458-463, 2005.
15. Salmon JF & Kanski JJ. Glaucoma, 3rd ed., Butterworth & Heinemann, Edinburgh, 2004.
16. Stamer WD, Peppel K, O'Donnell ME, Roberts BC, Wu F, & Epstein DL. Expression of aquaporin-1 in human trabecular meshwork cells: role in resting cell volume. Invest Ophthalmol. 42, 1803-1811, 2001.
17. Suneson A, Hansson H-A & Seeman T. Pressure wave injuries to the nervous system caused by high energy missile extremity impact. Part II. Distant effects on the central nervous system - a light and electron microscopic study on pigs. J Trauma 30, 295-306, 1990.
18. WO 05/030246.
19. WO 97/08202.
20. WO 98/21978.
21. US 6344440.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯЦИЯ ЛИПИДНЫХ РАФТОВ | 2007 |
|
RU2457853C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЯИЧНОГО ЖЕЛТКА С ВЫСОКИМ СОДЕРЖАНИЕМ AF-16 | 2016 |
|
RU2723097C1 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ КОМПАРТМЕНТ-СИНДРОМА | 2007 |
|
RU2465914C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОСТАВЛЕННАЯ ДЛЯ ЛОКАЛЬНОГО НАНЕСЕНИЯ НА ПОВЕРХНОСТЬ БАРЬЕРА ЭПИТЕЛИАЛЬНОЙ ТКАНИ, СОДЕРЖАЩАЯ АНТИТЕЛА, КОТОРЫЕ ПРОХОДЯТ ЧЕРЕЗ ЭТОТ БАРЬЕР | 2011 |
|
RU2565399C2 |
| НОВОЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2416426C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2542967C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |
| Лекарственное средство для лечения и профилактики высокого внутриглазного давления | 2018 |
|
RU2693899C1 |
| ПРИМЕНЕНИЕ ГЕНА СЫВОРОТОЧНОГО АМИЛОИДА А ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ГЛАУКОМЫ И ИДЕНТИФИКАЦИИ АНТИГЛАУКОМНЫХ АГЕНТОВ | 2007 |
|
RU2461378C2 |




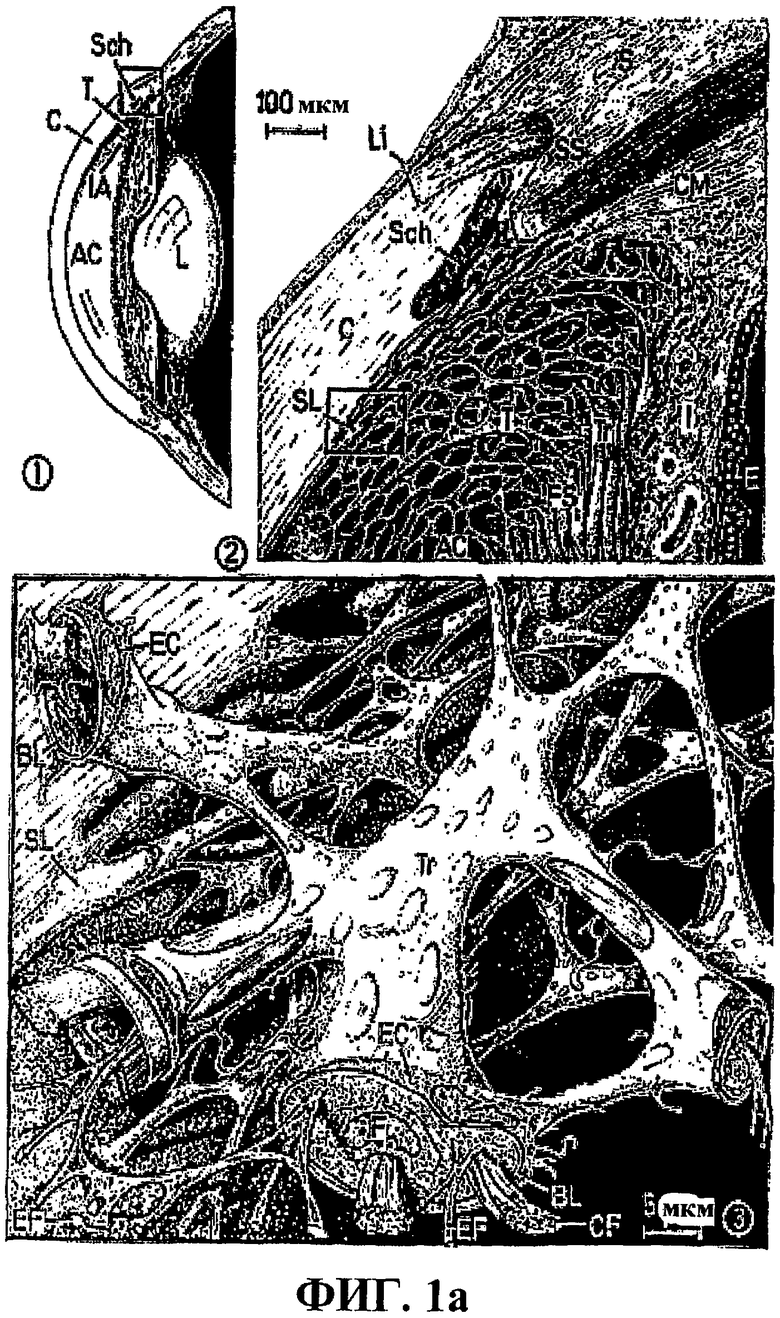
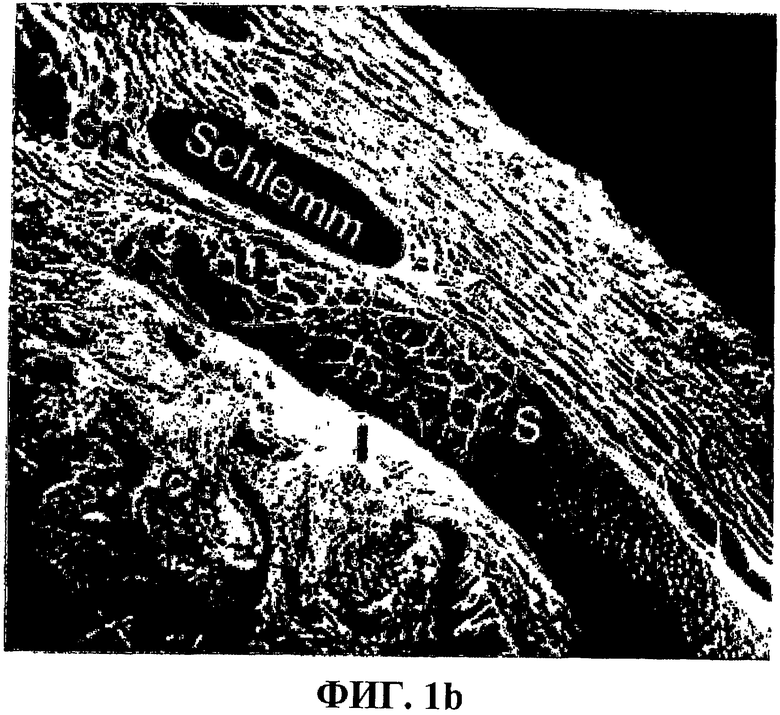
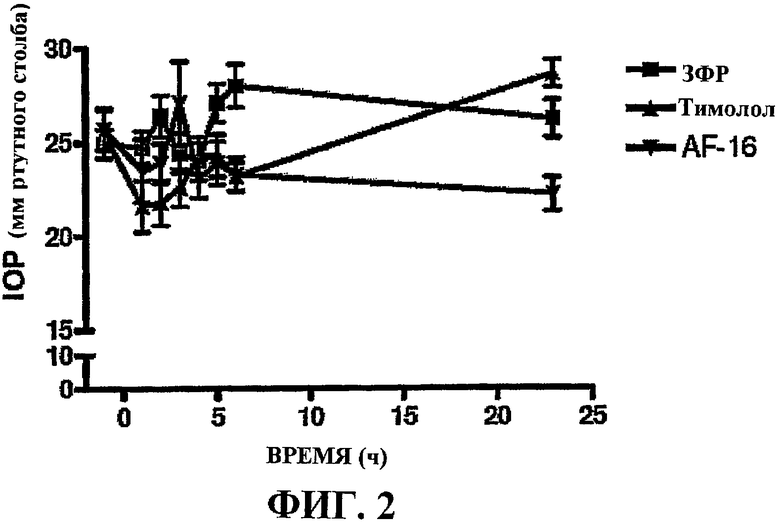
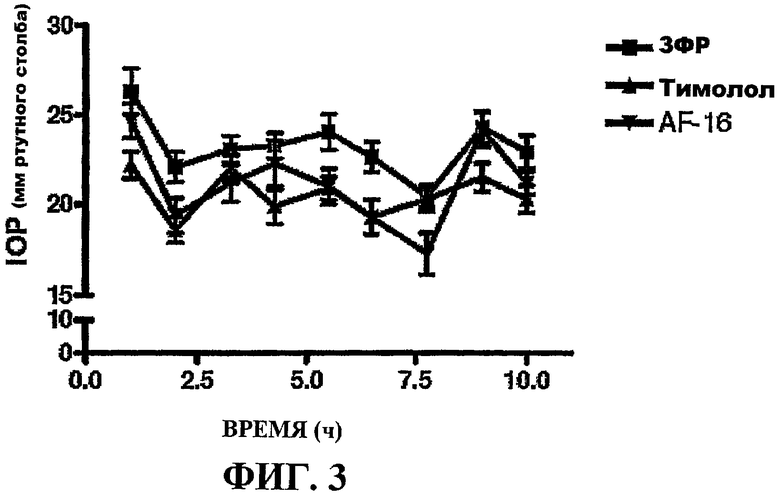

Группа изобретений относится к применению антисекреторного фактора, такого как антисекреторный белок (AF), его гомолога, и/или фрагмента, обладающего антисекреторной активностью, где указанный белок (АF) соответствует аминокислотной последовательности, представленной в SEQ ID NO:6, и/или где указанный фрагмент содержит аминокислотную последовательность, представленную в SEQ ID NO:4, для приготовления фармацевтической композиции для применения в лечении или предотвращении повышенного внутриглазного давления. Изобретение относится также к пептиду, показанному в SEQ ID NO:4, обладающему антисекреторной активностью, для предотвращения или лечения повышенного внутриглазного давления. Группа изобретений обеспечивает новый подход к лечению и/или предотвращению такого состояния, возвращающий внутриглазное давление к приемлемому уровню, необязательно, 21 мм ртутного столба или менее. 2 н. и 18 з.п. ф-лы, 17 пр., 4 ил.
1. Применение белка антисекреторного фактора (AF), его гомолога и/или фрагмента, обладающего антисекреторной активностью и/или его фармацевтически активной соли, где белок антисекреторного фактора (AF), соответствует аминокислотной последовательности, представленной в SEQ ID NO:6, и/или где указанный фрагмент содержит аминокислотную последовательность, представленную в SEQ ID NO:4, для приготовления фармацевтической композиции для предотвращения и/или лечения повышенного внутриглазного давления.
2. Применение по п.1, где указанный белок антисекреторного фактора состоит из последовательности, соответствующей следующим формулам:
X1-V-C-X2-X3-K-X4-R-X5,
где X1 обозначает I, аминокислоты 1-35 SEQ ID NO:6 или отсутствует, Х2 обозначает Н, R or K, Х3 обозначает S или L, Х4 обозначает Т или А, Х5 обозначает аминокислоты 43-46, 43-51, 43-80 или 43-163 SEQ ID NO:6 или отсутствует.
3. Применение по п.1, где указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:1.
4. Применение по п.1, где указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:2.
5. Применение по п.1, где указанный фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:3.
6. Применение по любому из предыдущих пунктов, где указанная фармацевтическая композиция содержит один или несколько из фрагментов по пп.1-5.
7. Применение по любому из пп.1-5, где внутриглазное давление равно 22 мм или более ртутного столба.
8. Применение по любому из пп.1-5, где внутриглазное давление равно 22- 30 мм ртутного столба.
9. Применение по любому из пп.1-5, где белок антисекреторного фактора находится в яичном желтке, обогащенном таким белком антисекреторного фактора, и где указанный белок антисекреторного фактора предпочтительно находится в концентрации по меньшей мере 1000 единиц FIL/мл в указанном яичном желтке.
10. Применение по любому из пп.1-5, где указанное повышенное внутриглазное давление вызвано сопротивлением в оттоке внутриглазной жидкости из передней камеры глаза.
11. Применение по п.10, где указанная фармацевтическая композиция уменьшает сопротивление в оттоке внутриглазной жидкости из передней камеры через трабекулярную сеть и канал Шлемма.
12. Применение по любому из пп.1-5, где фармацевтическая композиция дополнительно содержит фармацевтически приемлемый эксципиент.
13. Применение по любому из пп.1-5, где фармацевтическая композиция приготовлена для местного, внутриглазного, интраназального, перорального, подкожного, кожного введения, введения через слизистую оболочку и/или системного введения.
14. Применение по любому из пп.1-5, где фармацевтическая композиция приготовлена для введения в виде спрея, аэрозоля, посредством распылителя или посредством ингалятора.
15. Применение по любому из пп.1-5, где фармацевтическая композиция вводится системно в кровь в дозе 0,1 мкг - 10 мг на кг массы тела в день, предпочтительно 1-1000 мкг на кг массы тела.
16. Применение по любому из пп.1-5, где фармацевтическая композиция приготовлена для локального введения в глаз.
17. Применение по п.16, где фармацевтическая композиция вводится в дозе 1 мкг - 10 мг на введение, предпочтительно 50-1000 мкг в день.
18. Применение по любому из пп.1-5, где фармацевтическая композиция вводится один или более раз в день.
19. Пептид, показанный в SEQ ID NO:4, или его гомолог, обладающий антисекреторной активностью.
20. Пептид по п.19, обладающий антисекреторной активностью, для предотвращения и/или лечения повышенного внутриглазного давления.
| ПРИСПОСОБЛЕНИЕ К ВОЗДУШНЫМ ДВУХКАМЕРНЫМ ТОРМОЗАМ ДЛЯ ПОЛУЧЕНИЯ ПЕРЕМЕННОГО ТОРМОЖЕНИЯ | 1930 |
|
SU38535A1 |
| КОВАЛЕВСКИЙ Е.И | |||
| Глазные болезни, 3-е издание перераб | |||
| и дополн | |||
| - М.: Медицина, 1986 | |||
| СПОСОБ ЛЕЧЕНИЯ ГЕРПЕТИЧЕСКОГО КЕРАТИТА С ИЗЪЯЗВЛЕНИЕМ | 2001 |
|
RU2192898C1 |
Авторы
Даты
2012-08-20—Публикация
2007-04-27—Подача