Область техники, к которой относится изобретение
Данное изобретение относится к фармацевтической композиции, содержащей scFv-антитело с улучшенными свойствами в отношении проникновения в ткань и ее местному применению в диагностике и лечении заболевания, зависимого от сверхэкспрессии выбранного антигена.
Уровень техники
Локальное лечение многих заболеваний может проводиться местным нанесением лекарственного средства, которое должно быть способно проникать внутрь эпителиальной ткани. Смежные эпителиальные клетки герметизированы плотными контактами, предотвращающими прохождение большинства растворенных молекул с одной стороны эпителиального слоя к другому (Alberts et al., Molecular Biology of the Cell, 2nd ed.). Плотные контакты являются решающими для образования и поддержания парацеллюлярного барьера и для полярности клеток в простых эпителиях и эндотелиях. Они также играют большую роль в гематоэнцефалическом барьере, где они контролируют вещества, которые покидают головной мозг или входят в головной мозг. Лекарственные средства с большой молекулярной массой должны проходить через эти тканевые барьеры для попадания к местам их действия. Обычно, антитела являются слишком большими для пересекания плотных контактов слоев эпителиальных клеток.
В качестве части нормальной активности организма, плотные контакты селективно открываются и закрываются в ответ на различные сигналы внутри и снаружи клеток. Это делает возможным прохождение больших молекул или даже целых клеток через барьер плотных контактов.
Введение через слизистую оболочку терапевтических соединений может представлять определенные преимущества в сравнении с инъекцией и другими способами введения, например, в отношении удобства и скорости доставки, а также из-за уменьшения или элиминирования проблем соблюдения пациентом режима и схемы лечения и побочных действий, которые сопутствуют доставке посредством инъекции. Однако доставка через слизистую оболочку биологически активных агентов является ограниченной функциями мукозного барьера и другими факторами. По этим причинам, введение лекарственного средства через слизистую оболочку обычно требует больших количеств лекарственного средства, чем введение посредством инъекции. Другие терапевтические соединения, в том числе лекарственные средства с большой молекулой, пептиды и белки часто не поддаются доставке через слизистую оболочку.
Способность лекарственных средств проникать через поверхности слизистой оболочки, без помощи усиливающих доставку агентов, связана, по-видимому, с рядом факторов, включающих в себя размер молекулы, растворимость в липидах и ионизацию. Малые молекулы, меньшие чем приблизительно 300-1000 дальтон, часто способны проникать внутрь мукозных барьеров, однако, по мере увеличения размера молекул проницаемость быстро уменьшается. Липидрастворимые соединения обычно лучше проникают через поверхность слизистой оболочки, чем нерастворимые в липидах молекулы. Пептиды и белки слаборастворимы в липидах и, следовательно, обнаруживают плохие свойства абсорбции через поверхности слизистых оболочек.
US2006062758 обеспечивает композиции и способы, которые включают в себя биологически активный агент и повышающий проницаемость пептид, эффективный для усиления доставки через слизистую оболочку этого биологически активного агента в субъекте-млекопитающем. Повышающий проницаемость пептид обратимо увеличивает мукозный эпителиальный парацеллюлярный транспорт, обычно посредством модуляции структуры эпителиальных плотных контактов и/или физиологии в эпителиальной поверхности слизистой оболочки в этом субъекте.
Пептиды, способные модулировать функцию эпителиальных плотных контактов, были описаны ранее (Johnson, P. H. and Quay, S.C., 2000). CA2379661 обеспечивает систему парацеллюлярно доставки лекарственного средства, содержащей произведенный из Клаудина-6 пептид. Клаудины представляют суперсемейство интегральных мембранных белков, локализованных в плотных контактах и обеспечивающих барьерную функцию.
Антитела являются мощными инструментами для биохимических и молекулярно-биологических исследований и широко применяются в медицинской диагностике и терапии вследствие их способности специфического высокоаффинного связывания с их антигеном. Обычно, антитела состоят из двух тяжелых и двух легкой цепи, которые ковалентно связаны друг с другом через дисульфидные связи. На N-конце каждой цепи расположен высоко вариабельный домен, содержащий три комплементарных района (CDR). Вместе, вариабельные области тяжелой и легкой цепи определяют антигенную специфичность антитела. Одноцепочечные антитела (scFv) были сконструированы связыванием ДНК-последовательностей, кодирующих вариабельные тяжелые (VH) и вариабельные легкие (VL) домены со спейсерной последовательностью, кодирующей гибкий аминокислотный линкер (Bird et al., 1988).
Этот формат имеет преимущества в сравнении с общепринятыми полноразмерными антителами, заключающиеся в том, что scFv кодируется единственным геном, могут легко вводиться мутации и полученный scFv может экспрессироваться в дрожжах и прокариотических системах, которые позволяют быстрый отбор специфических высокоаффинных связывающих веществ фактически к любому эпитопу простой молекулярной биологией. Вследствие отсутствия у них эффекторной функции, scFv-антитела не проявляют токсических действий через антителозависимую или комплементзависимую клеточно-опосредованную цитотоксичность (ADCC или CDCC, соответственно) и, в отличие от полноразмерных антител, scFv-антитела обнаруживают хорошие способности проникновения внутрь тканей.
Многие одноцепочечные антитела (scFv) были генерированы против множества различных антигенов, в частности, потому, что они могут быть легко отобраны на высокую связывающую способность с использованием таких способов, как фаговый дисплей или рибосомный дисплей. Кроме того, scFv-антителв могут продуцироваться в микробных системах, которые связаны с меньшими расходами в сравнении с получением терапевтических полноразмерных антител.
Кроме общих внеклеточных и in vitro применений, scFv были также успешно использованы для внутриклеточных применений (Worn et al. 2000; Auf der Maur et al. 2002; Stocks MR, 2004); таким образом, были разработаны scFv против внутриклеточных антигенов. Обычно, внутриклеточная экспрессия функциональных scFv ограничивается их нестабильностью, нерастворимостью и тенденцией к образованию агрегатов. По этой причине, были успешно разработаны системы скрининга in vivo на scFv-антитела, которые являются особенно растворимыми и стабильными в восстанавливающих условиях, типичных для внутриклеточного окружения (например, ядра, цитоплазмы), с использованием так называемого скрининга «контроль качества» (WO0148017; Auf der Maur et al. (2001); Auf der Maur et al., 2004) и привели к идентификации особенно стабильных и растворимых каркасных последовательностей scFv для таких целей (WO03097697). Кроме того, эти каркасы обнаруживают исключительно высокие уровни экспрессии и повышенные свойства стабильности и растворимости также при природных окисляющих условиях во внеклеточном окружении (внеклеточной среде). Таким образом, эти благоприятные биофизические и биохимические свойства претворяются в подходящие продукционные выходы и позволяют применять эти фрагменты антител, после нацеливания против специфических антигенов, местно и/или системно в качестве белковых терапевтических веществ в конкретных терапевтических областях.
Для применения антител во многих терапевтических применениях, в частности, местных применениях, важным фактором является способность антитела проникать внутрь тканей, в частности, проникать через барьеры эпителиальной ткани.
Локальное применение является особенно желательным для лечения нарушений, которые проявляются в конкретном местоположении и не требуют системного лечения, например, глазных болезней.
Увеит передний
Увеит является острым или хроническим воспалением сосудистой оболочки глазного яблока с встречаемостью 30-40 на 100000 (Lightman and Kok 2002). Увеит подразделяют по местоположению на увеит передний, промежуточный или задний. Увеит передний развивается в увеит задний с последующими осложнениями, такими как катаракта, ретинит и даже слепота, если не применяется лечение (Kok and Lightman 2004). В <65-летних имеются много легально слепых индивидуумов, ослепших в результате увеита в виде диабетической ретинопатии (Kok and Lightman 2004). В 50 из этих случаев, увеит передний, как наиболее частая форма внутриглазных болезней, связан с локусом А гистосовместимости аллеля В27 (HLA-B27) (Power et al. 1998). Из этих пациентов, только приблизительно половина страдает от дополнительного системного заболевания, такого как анкилозирующий спондилит или хроническое воспалительное заболевание пищеварительного тракта (El-Shabrawi and Hermann 2002). Лечение увеита первично направлено на контроль воспалительного процесса (Kok and Lightman 2004). В настоящее время, кортикостероиды являются главной поддержкой для терапии увеита (Kok and Lightman 2004). Важно, что местное или системное лечение кортикостероидами значительно увеличивает риск глаукомы и катаракты, ограничивая таким образом их повторное применение (El-Shabrawi and Hermann 2002). Другие лечения, включающие в себя метотрексат, циклоспорин или азатиоприн, требуют минимально 6 недель лечения для получения эффекта, оставляя пациентов с огромной напряженностью качества жизни в течение длительного периода (El-Shabrawi and Hermann 2002, Dick et al. 1997).
Из описанного выше очевидной является ясно определенная медицинская потребность. Местные кортикостероиды в качестве наиболее обычной терапевтической возможности имеют существенные вредные побочные реакции, которые фактически обостряют долгосрочный риск слепоты.
Недавно, во внутриглазной жидкости пациентов с увеитом были обнаружены концентрации TNFα 15 пг/мл, в то время как соответствующие уровни в здоровых индивидуумах были равны 0,56 пг/мл (Perez-Guijo et а1. 2004). Несколько малых клинических исследований, выполненных с системно вводимыми ингибиторами TNFa сообщали о «промежуточном улучшении» (El-Shabrawi and Hermann 2002) или "заметном клиническом улучшении в пределах дней» (Murphy et al. 2004) или "в пределах 2 недель" (Joseph 2003) или "значительном улучшении после первой дозы инфликсимаба" (Benitez Del Castillo et al. 2004).
Таким образом, концепция нацеливания на TNFα хорошо валидизирована клинически. Однако соображения безопасности, связанные с системным применением ингибиторов TNFα, остаются и не могут оправдать их применения в значительной части пациентов с увеитом, которые не имеют дополнительных проявлений системного заболевания.
Таким образом, локальный ингибитор TNFα будет восполнять хорошо определенную медицинскую потребность, особенно у пациентов с передним увеитом. Вследствие их большой молекулярной массы, продаваемые ингибиторы TNFα не применимы для местного введения (см. Thiel et al. 2002).
Болезнь Бехчета
Болезнь Бехчета является идиопатическим, мультисистемным, хроническим и рецидивирующим заболеванием, классически характеризующимся эпизодическими агрессивными приступами глазного воспаления, орогенитальными язвами и кожными повреждениями. Кроме того, изредка могут наблюдаться тяжелые случаи болезни Бехчета, с вовлечением суставов, аудио-вестибулярного аппарата, с торакальным, желудочно-кишечным, сердечнососудистым, почечным или ЦНС-вовлечением. Глаз является наиболее часто вовлеченным внутренним органом в болезни Бехчета и является главной причиной хронической болезненности у пациентов. Глазная болезнь состоит из одностороннего (20%) или двустороннего (8%) иридоциклита, причем нагноение передней камеры глаза или панувеит имеют хроническое рецидивирующее течение. Обычно, первоначальные обострения имеют тенденцию быть более передними и/или односторонними, в то время как последующие приступы имеют тенденцию включать в себя полость стекловидного тела и заднего сегмента глаза, становясь двусторонними (Evereklioglu 2005). Тяжелый увеит более часто наблюдается среди пациентов из эндемических районов, таких как японские и турецкие пациенты, охватывающие 70-90% этой популяции (Ozen 1999; Tursen et al., 2003; Tugal-Tutkun et al., 2004; Yurdakul et al., 2004; Evereklioglu 2005). Риск потери зрения увеличивается прогрессирующимся образом, достигая одной четвертой случаев при 10 годах. Кроме того, практическая слепота является значительной и, в конечном счете, наступает в более, чем 50% случаях, в странах с высокой распространенностью и тяжестью этого заболевания, таких как Япония (Boyd et al., 2001; Evereklioglu 2005).
Болезнь Бехчета обнаруживает разную географическую вариацию и является эндемически более высокой, в частности, в Японии, Корее, Саудовской Аравии, Иране и Турции, а также в странах вдоль древнего «шелкового пути», в том числе Китае и Израиле (Bonfioli and Orefice 2005; Evereklioglu 2005). Например, болезнь Бехчета ответственна за 20% случаев увеита в Японии и Турции в сравнении только с 0,2% в США. В странах, в которых это заболевание является эндемическим, оно является более тяжелым, с более высокой частотой глазных проявлений и осложнений, и является более частым в мужчинах, особенно молодых взрослых мужчинах (Evereklioglu 2005). Эта своеобразная эпидемиология, по-видимому, опосредована комбинацией генетических факторов (например, ассоциацией с аллелем HLA-B51 (Sakane et al., 1999; Verity et al., 1999; Evereklioglu 2005), инфекционных агентов (Direskeneli 2001; Evereklioglu 2005) и факторов окружающей среды. Приближенно оцененная распространенность болезни Бехчета находится между 1:10000 и 1:1000 в Средиземноморских странах, Среднем Востоке и Дальнем Востоке. В Японии и Азиатских странах вдоль «шелкового пути», распространенность равна 13-30 на 1000000 и является наивысшей в северных частях Японии; наивысшая общая распространенность до 400 на 100000 наблюдается в некоторых частях Турции. В США имеются приблизительно 15000 людей с болезнью Бехчета (Zierhut et al., 2003; Evereklioglu 2005).
Последствия офтальмических воспалительных приступов являются главной причиной хронической заболеваемости у пациентов с болезнью Бехчета (Evereklioglu 2005). Лечение болезни Бехчета является симптоматическим и эмпирическим. Как и при других формах увеита, периокулярные и системные кортикостероиды представляют основную поддержку терапии в глазной болезни Бехчета. Однако применение способов лечения на основе кортикостероидов у пациентов ограничено их значительным профилем побочных эффектов. Кроме того, кортикостероиды редко индуцируют полные ремиссии при глазной болезни Бехчета, и значительная часть пациентов развивает устойчивое к стероидам заболевание со временем (Evereklioglu 2005). В ходе этого заболевания, схемы лечения часто используют иммуносупрессивные агенты, такие как азатиоприн, метотрексат и циклоспорин А. Однако, поскольку эти агенты также ассоциированы с критическими проблемами безопасности, существует хорошо выраженная потребность в лекарственных средствах для эффективного и безопасного нового способа лечения в случае этого показания.
Наряду с недавними эпидемиологическими открытиями, которые предполагают, что полиморфные вариации в TNFα являются ассоциированными с тяжестью болезни Бехчета (Verity et al., 1999b), существует большое разнообразие отчетов об отдельных случаях и малых клинических испытаниях, описывающих применение инфликсимаба в глазной болезни Бехчета (Ohno et al., 2004; Wechsler et al., 2004; Giansanti et al., 2004; Lanthier et al., 2005; Tugal-Tutkun et al., 2005; Lindstedt et al., 2005). Фактически, все эти исследования сообщают о быстрой и полной ремиссии глазной болезни Бехчета, даже у пациентов, не поддающихся общепринятой терапии. (Tugal-Tutkun et al., 2005). Однако, встречаемость и тяжесть вредных побочных действий у лечившихся инфликсимабом пациентов с увеитом является в некоторых исследованиях неожиданно высокой, ограничивая тем самым потенциал системно применимых антагонистов TNFα для лечения этого заболевания (Rosenbaum 2004; Suhler et al., 2005).
Клиническая валидизация TNFα в качестве в высокой степени привлекательного лекарства-мишени при глазной болезни Бехчета (Ohno et al., 2004; Wechsler et al., 2004; Giansanti et al., 2004; Lanthier et al., 2005; Tugal-Tutkun et al., 2005; Lindstedt et al., 2005) и очевидные проблемы безопасности с системной супрессией TNFα у пациентов с увеитом (Rosenbaum 2004; Suhler et al., 2005), показывают, что имеется потребность в разработке местно применимого антагониста TNFα для глазной болезни Бехчета, особенно для пациентов с преобладающими глазными симптомами.
Вследствие их хороших способностей проникновения в ткань и их быстрого почечного клиренса, scFv-антитела являются предпочтительными для местных применений. Кроме заряда, гидрофобности и молекулярной массы, такие свойства, как растворимость, тенденция к агрегации и термостабильность, влияют на способность молекулы проникать через тканевые барьеры. Например, высокорастворимый фрагмент антитела может быть неспособен проникать в эпителиальные барьеры, если он образует агрегаты при физиологической температуре около 37°С. Мутация единственного аминокислотного каркасного остатка scFv может, с одной стороны, улучшать его растворимость при температуре окружающей среды, и эта мутация может изменять термостабильность и, следовательно, приводить к частичному развертыванию и агрегации при 37°С. Такие агрегаты, вследствие их более высокой молекулярной массы будут уже неспособны проходить через тканевые барьеры.
Поскольку проникновение внутрь ткани является важным фактором для эффективной доставки лекарственного средства, в частности, в локальных применениях, имеется потребность в терапевтических антителах, в частности, в scFv-антителах с улучшенными способностями проникновения в ткань, наряду с другими желаемыми свойствами высокой стабильности и низкой антигенности. WO0040262 описывает фрагменты антител, например, scFv, в качестве фармацевтических средств или диагностических инструментов для лечения или диагностики, соответственно, глазных нарушений. Эксперименты по проникновению в глаз выполняли при концентрациях 0,2-0,25 мг/мл scFv. Было показано, что scFv мог проникать в эпителиальный барьер роговицы при очень низкой скорости в отсутствие и при более высоких скоростях в присутствии усилителей проникновения. Поскольку усилители проникновения могут иметь цитотоксические действия или вызывать эпителиальные изменения, существует потребность в альтернативных и/или улучшенных способах для лечения глазных заболеваний посредством scFv и его фрагментов. В частности, для контролируемой терапии локальным введением с низкой степенью побочных действий необходимы антитела, которые могут вводиться при относительно высокой концентрации.
Все публикации и ссылки, цитируемые здесь, включены в качестве ссылки в их полном виде.
Раскрытие изобретения
Таким образом, общей целью этого изобретения является обеспечение антитела, предпочтительно антитела scFv, которое специфически связывает выбранный антиген и имеет улучшенную способность проникновения в ткань.
Теперь, для осуществления этих и дополнительных объектов этого изобретения, которое станет более легко очевидным по мере продолжения описания, указанное антитело проявляется признаком, заключающимся в том, что оно может быть получено по способу, предусматривающему
(i) отбор из пула растворимых и стабильных каркасов каркаса, соответствующего наилучшим образом каркасу антитела не человека выбранной антигенсвязывающей специфичности,
(ii) либо обеспечение указанного каркаса CDR, которые связывают указанный антиген, либо мутирование этого каркаса указанного антитела не человека в направлении последовательности указанного растворимого и стабильного каркаса;
(iii) тестирование генерированного антитела на растворимость и стабильность, и
(iv) тестирование генерированного антитела на связывание антигена.
Необязательно, между стадиями (ii) и (iii) добавляют следующую стадию:
- мутирование указанного scFv-антитела сайт-направленным или случайным мутагенезом одного или нескольких CDR и/или каркаса.
Это изобретение обеспечивает также композицию, содержащую растворимый антигенсвязывающий полипептид, где этот антигенсвязывающий полипептид способен пересекать один или несколько эпителиальных слоев, например, эндотелиальный слой или мезотелиальный слой, за менее чем приблизительно 8 часов. Например, этот антигенсвязывающий полипептид способен пересекать один или несколько эпителиальных слоев за менее чем приблизительно 8, 7, 6, 5, 4, 3, 2, 1 или менее часов. В одном варианте осуществления, этот антигенсвязывающий полипептид способен пересекать эпителиальный слой или слои за менее чем приблизительно 4 часа. Должно быть понятно, что предполагается, что все величины и диапазоны включены в объем данного изобретения.
В других вариантах осуществления, этот эпителиальный слой является эпителиальным слоем глаза, роговицы, например, эпителием и/или эндотелием роговицы. В одном варианте осуществления, этот эпителиальный слой является эпителиальным слоем кишечника. Еще в одном варианте осуществления, этот эпителиальный слой является эпителиальным слоем гематоэнцефалического барьера.
В других вариантах осуществления, этот антигенсвязывающий полипептид способен пересекать интактную роговицу млекопитающего за менее чем приблизительно 8 часов. Например, этот антигенсвязывающий полипептид способен пересекать интактную роговицу млекопитающего за менее чем 8, 7, 6, 5, 4, 3, 2, 1 или менее часов. В одном варианте осуществления, этот антигенсвязывающий полипептид способен пересекать интактную роговицу человека. В одном варианте осуществления, антигенсвязывающий полипептид способен пересекать интактную роговицу свиньи или кролика.
В других вариантах осуществления, эта композиция дополнительно содержит усилитель проникновения. В некоторых вариантах осуществления, усилитель проникновения выбран из группы, состоящей из Азона (Azone®), хлорида бензалкония (BzCl), BL-7, BL-9, Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилен 1800, капрата натрия, каприловой кислоты, хлорида цетилпиридиния, хлоргексидина, холата, касторового масла, кукурузного масла, кремофора-EL, циклодекстринов, DMSO, бромида декаметония, дезоксихолата, декстрансульфата, ЭДТА, динатриевой соли ЭДТА, этанола, фузидата, гликохолата, лаурилсульфата, L-α-лизофосфатидилхолина, метазоламида, N-лауроилсаркозина, NMP, олеиновой кислоты, Pz-пептида, фосфолипидов, полиоксиэтилен-9-лаурилового эфира, сапонина, Твина 20, Твина 40, Твина 60, Твина 80, таурохолата и тауродезоксихолата. В другом варианте осуществления, усилителем проникновения является капрат натрия. Еще в одном варианте осуществления, усилитель проникновения включает в себя коллоидные системы, полиакрилаты и биоадгезивный полимер.
В некоторых вариантах осуществления, этот полипептид имеет аффинность связывания в отношении антигена-мишени с KD, по меньшей мере, 10-6 М или лучшую.
В некоторых аспектах, данное изобретение обеспечивает композицию, имеющую рН менее приблизительно 8, причем указанная композиция содержит антигенсвязывающий полипептид (например, одноцепочечное антитело), где этот полипептид является достаточно растворимым для прохождения через интактную роговицу. В некоторых вариантах осуществления, эта композиция имеет рН в диапазоне приблизительно 6 - приблизительно 8. В других вариантах осуществления, эта композиция имеет рН приблизительно 6, 6,5, 7,0, 7,5, 8,0 или эти величины с любыми их приращениями. Понятно, что любые величины и диапазоны между этими величинами включены в данное изобретение.
В некоторых аспектах, данное изобретение обеспечивает композицию, имеющую рН менее приблизительно 8, причем эта композиция содержит антигенсвязывающий полипептид (например, одноцепочечное антитело), причем этот полипептид является достаточно растворимым для прохождения через интактную роговицу. В некоторых аспектах, данное изобретение обеспечивает композицию, содержащую растворимый антигенсвязывающий полипептид, причем этот полипептид является достаточно растворимым для прохождения через интактную роговицу за менее чем приблизительно 8 часов, и приготовлен при приблизительно рН 8 или менее. В некоторых вариантах осуществления, этот полипептид является достаточно растворимым, чтобы проходить через интактную роговицу за менее чем приблизительно 4 часа. В других вариантах осуществления, эта композиция содержит дополнительно усиливающий проникновение агент. В некоторых вариантах осуществления, этот усиливающий проникновение агент выбран из группы, состоящей из Азона, хлорида бензалкония (BzCl), BL-7, BL-9, Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилен 1800, капрата натрия, каприловой кислоты, хлорида цетилпиридиния, хлоргексидина, холата, касторового масла, кукурузного масла, кремофора-EL, циклодекстринов, DMSO, бромида декаметония, дезоксихолата, декстрансульфата, ЭДТА, динатриевой соли ЭДТА, этанола, фузидата, гликохолата, лаурилсульфата, L-α-лизофосфатидилхолина, N-лауроилсаркозина, NMP, олеиновой кислоты, фосфолипидов, полиоксиэтилен-9-лаурилового эфира, сапонина, Твина 20, Твина 40, Твина 60, Твина 80, таурохолата и тауродезоксихолата. В другом варианте осуществления, усилителем проникновения является капрат натрия. В некоторых вариантах осуществления, усиливающим проникновение агентом является хлоргексидин.
В некоторых аспектах, данное изобретение обеспечивает композицию, содержащую растворимый антигенсвязывающий полипептид, где этот антигенсвязывающий полипептид способен пересекать один или несколько слоев интактной роговицы за менее чем приблизительно 8 часов. В других аспектах, данное изобретение обеспечивает композицию, содержащую антигенсвязывающий полипептид (например, одноцепочечное антитело) при концентрации, большей чем приблизительно 2,5 мг/мл, причем этот полипептид является достаточно растворимым для прохождения через интактную роговицу за менее чем приблизительно 8 часов. Эта композиция может содержать антигенсвязывающий полипептид при концентрации в диапазоне от более чем приблизительно 2,5 мг/мл до более чем приблизительно 10,0 мг/мл. Например, эта композиция может содержать антигенсвязывающий полипептид при концентрации приблизительно 2,5 мг/мл, 3,0 мг/мл, 3,5 мг/мл, 4,0 мг/мл, 4,5 мг/мл, 5,0 мг/мл, 5,5 мг/мл, 6,0 мг/мл, 6,5 мг/мл, 7,0 мг/мл, 7,5 мг/мл, 8,0 мг/мл, 8,5 мг/мл, 9,0 мг/мл, 9,5 мг/мл до более чем приблизительно 10,0 мг/мл, или эти величины с любыми их приращениями. Понятно, что любые величины и диапазоны между этими величинами включены в данное изобретение. В некоторых вариантах осуществления, антигенсвязывающий полипептид находится при концентрации, большей чем приблизительно 4,0 мг/мл. В других вариантах осуществления, этот антигенсвязывающий полипептид находится при концентрации, большей чем приблизительно 10,0 мг/мл.
В других вариантах осуществления, этот полипептид является достаточно растворимым, чтобы проходить через интактную роговицу за менее чем приблизительно 4 часа. В других вариантах осуществления, эта композиция содержит дополнительно усиливающий проникновение агент. В некоторых вариантах осуществления, этот усиливающий проникновение агент выбран из группы, состоящей из Азона, хлорида бензалкония (BzCl), BL-7, BL-9, Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилен 1800, капрата натрия, каприловой кислоты, хлорида цетилпиридиния, хлоргексидина, холата, касторового масла, кукурузного масла, кремофора-EL, DMSO, бромида декаметония, дезоксихолата, декстрансульфата, ЭДТА, динатриевой соли ЭДТА, этанола, фузидата, гликохолата, лаурилсульфата, L-α-лизофосфатидилхолина, N-лауроилсаркозина, NMP, олеиновой кислоты, фосфолипидов, полиоксиэтилен-9-лаурилового эфира, сапонина, Твина 20, Твина 40, Твина 60, Твина 80, таурохолата и тауродезоксихолата. В другом варианте осуществления, усилителем проникновения является капрат натрия. В некоторых вариантах осуществления, усиливающим проникновение агентом является хлоргексидин.
В некоторых аспектах, данное изобретение обеспечивает антигенсвязывающий полипептид (например, одноцепочечное антитела), имеющий аффинность связывания в отношении антигена-мишени с KD, по меньшей мере, 10-6 М, причем этот полипептид является достаточно растворимым, чтобы проходить через эпителиальный плотный контакт, и причем этот полипептид остается в мономерной форме при физиологических условиях.
В других аспектах, данное изобретение содержит композицию, содержащую антигенсвязывающий полипептид, причем этот антигенсвязывающий полипептид является стабильным при температуре приблизительно -80 градусов Цельсия -приблизительно 37 градусов Цельсия. Например, эта композиция может быть стабильной при температуре -80 градусов Цельсия, -70 градусов Цельсия, -60 градусов Цельсия, -50 градусов Цельсия, -40 градусов Цельсия, -30 градусов Цельсия, -20 градусов Цельсия, -10 градусов Цельсия, 0 градусов Цельсия, 10 градусов Цельсия, 20 градусов Цельсия или 30 градусов Цельсия или любой из этих величин с приращениями. Должно быть понятно, что предполагается, что все величины и диапазоны включены в данное изобретение. В некоторых вариантах осуществления, антигенсвязывающий полипептид остается стабильным в течение, по меньшей мере, приблизительно восьми часов. В других вариантах осуществления, этот антигенсвязывающий полипептид остается стабильным в течение, по меньшей мере, шести недель при 4 градусах Цельсия.
В некоторых аспектах, данное изобретение обеспечивает композицию, содержащую антигенсвязывающий полипептид, где этот антигенсвязывающий полипептид имеет фармакодинамические или фармакокинетические признаки, которые экспериментально показаны в любой из фигур, описанных здесь.
В других аспектах, данное изобретение обеспечивает антигенсвязывающий полипептид, имеющий аффинность связывания в отношении антигена-мишени с KD, по меньшей мере, 10-6 М, причем этот полипептид является достаточно растворимым, чтобы проходить через эпителиальный плотный контакт за менее чем приблизительно 8 часов. В некоторых вариантах осуществления этот полипептид является достаточно растворимым, чтобы проходить через эпителиальный плотный контакт за приблизительно 4 часа или менее.
В других аспектах, данное изобретение обеспечивает антигенсвязывающий полипептид, имеющий аффинность связывания в отношении антигена-мишени с Ко, по меньшей мере, 10-6 М или лучшую, причем этот полипептид имеет величину 1/2 Vmax, соответствующую кинетике прохождения антигенсвязывающего полипептида, который может проходить через эпителиальный плотный контакт за менее чем приблизительно 8 часов.
В других аспектах, данное изобретение включает в себя антигенсвязывающий полипептид, достаточно растворимый, чтобы проходить через эпителиальный плотный контакт, как измерено в стандартном анализе с монослоем эпителиальных клеток Сасо-2 (аденокарциномы ободочной кишки человека), что делает его подходящим для применения в терапии. В различных аспектах, данное изобретение включает в себя антигенсвязывающий полипептид, достаточно растворимый, чтобы проходить через эпителиальный плотный контакт, как измерено в стандартном анализе проницаемости с тощей кишкой мыши, что делает его подходящим для применения в терапии. В других аспектах, данное изобретение включает в себя антигенсвязывающий полипептид, достаточно растворимый, чтобы проходить через эпителиальный плотный контакт, как предсказано с использованием стандартных внутриклеточных анализов растворимости с одним гибридом или двумя гибридами, что делает его подходящим для применения в терапии. В других аспектах, данное изобретение включает в себя антигенсвязывающий полипептид, достаточно растворимый, чтобы проходить через эпителиальный плотный контакт, как предсказано с использованием стандартного анализа ПЭГ-преципитации или анализа хроматографии само-взаимодействия (SIC), что делает его подходящим для применения в терапии.
В других аспектах данное изобретение обеспечивает способ идентификации антигенсвязывающего полипептида, имеющего величину 1/2 Vmax, соответствующую прохождению этого антигенсвязывающего полипептида через эпителиальный плотный контакт за менее чем приблизительно 8 часов. Этот способ включает в себя: экспрессию внутриклеточно кандидатных антигенсвязывающих полипептидов в клетках-хозяевах, имеющих индуцируемую систему репортерного гена, где эта система репортерного гена дает регистрируемый сигнал в присутствии антигенсвязывающего полипептида, имеющего указанную кинетику прохождения; и скрининг указанных клеток на регистрируемый сигнал, где присутствие указанного сигнала идентифицирует кандидатный полипептид как антигенсвязывающий полипептид, имеющий указанную кинетику прохождения. Данное изобретение, в некоторых аспектах, обеспечивает также антигенсвязывающий полипептид, идентифицированный этим способом. В некоторых аспектах, данное изобретение обеспечивает также набор для проведения этого способа.
В других аспектах, данное изобретение обеспечивает способ лечения пациента с глазным нарушением местным введением терапевтически эффективного количества антигенсвязывающего полипептида по любому из указанных здесь пунктов, так что достигается лечение. В некоторых вариантах осуществления, этим глазным нарушением является увеит. В других вариантах осуществления, этим глазным нарушением является связанная с возрастом дегенерация желтого пятна.
В некоторых аспектах, данное изобретение обеспечивает антигенсвязывающий полипептид, содержащий полипептидный район, имеющий, по меньшей мере, один антигенсвязывающий мотив, фланкированный, по меньшей мере, одним каркасным районом, где этот полипептид имеет кинетику прохождения, достаточную для прохождения через эпителиальный плотный контакт за менее чем приблизительно 8 часов. В некоторых вариантах осуществления, этот полипептид содержит один антигенсвязывающий мотив, фланкированный двумя каркасными районами, два антигенсвязывающих мотива, фланкированных тремя каркасными районами, три антигенсвязывающих мотива, фланкированных четырьмя каркасными районами, или шесть антигенсвязывающих мотивов, фланкированных восемью каркасными районами, с промежуточным линкерным районом между четвертым и пятым каркасными районами. В других вариантах осуществления, этот антигенсвязывающий мотив является CDR, а каркасный район является каркасным районом иммуноглобулина. В других вариантах осуществления, этот полипептид содержит три CDR и четыре вставленных каркасных района или шесть CDR и восемь каркасных районов и промежуточный линкерный район.
В некоторых аспектах, данное изобретение обеспечивает также антигенсвязывающий полипептид, способный специфически связывать антиген-мишень и имеющий кинетику прохождения, достаточную для прохождения через эпителиальный плотный контакт за менее чем 8 часов, причем этот полипептид представлен формулой:
Y; или
Z; или
Y-L-Z; или
Z-L-Y;
где Y обозначает [F1-CDR1-F2-CDR2-F3-CDR3-F4] и Z обозначает [F5-CDR1-F6-CDR2-F7-CDR3-F8]; где каркасные районы (F1-F4) Y произведены из одного или нескольких каркасов легкой цепи человека; каркасные районы (F5-F6) Z произведены из одного или нескольких каркасов легкой цепи человека; CDR (CDR1-3) Y произведены из одного или нескольких донорных CDR, способных связывать антиген-мишень; CDR (CDR4-6) Z произведены из одного или нескольких донорных CDR, способных связывать антиген-мишень; и L является гибким полипептидным линкером. В некоторых вариантах осуществления, Y и Z представлены любой из последовательностей, описанных здесь, или их консенсусной последовательностью.
Альтернативно, в другом варианте осуществления, вдоль всей или части кодирующей последовательности антигенсвязывающего полипептида могут быть введены случайным образом мутации, например, насыщающим мутагенезом. «Консенсусная последовательность» является последовательностью, образованной из наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных последовательностей (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987). В семействе белков, каждое положение в этой консенсусной последовательности занято аминокислотой, наиболее часто встречающейся в этом положении в этом семействе. Если две аминокислоты встречаются с равной частотой, в консенсусную последовательность может быть включена любая из них.
В некоторых вариантах осуществления, данное изобретение обеспечивает антигенсвязывающий полипептид, приготовленный для достижения внутриглазной концентрации, по меньшей мере, приблизительно 100 нг/мл или более. В других аспектах, данное изобретение обеспечивает одноцепочечное антитело, приготовленное для местного введения, для получения внутриглазной концентрации 100 нг/мл или более, на основе системы клеток или модели животного, как описано здесь.
В других аспектах, данное изобретение обеспечивает антигенсвязывающий полипептид, приготовленный для локального введения в глаз и способный проходить через роговицу и во внутриглазное пространство в отсутствие усилителя проникновения. В других аспектах, данное изобретение обеспечивает способ лечения, предупреждения или диагностики глазной болезни или глазного нарушения с использованием полипептида по любому из приведенных здесь пунктов формулы изобретения.
Краткое описание фигур
Предыдущее описание и другие аспекты, варианты, объекты, признаки и преимущества этого изобретения могут быть более полно поняты из следующего описания вместе с сопутствующими фигурами. На фигурах одинаковые ссылочные буквы обычно относятся к одинаковым признакам и структурным элементам во всех различных фигурах. Эти рисунки не должны быть обязательно сопоставимыми, причем особое значение придается иллюстрации принципов этого изобретения.
Фигура 1 показывает профили элюции ESBA105 (фиг.1А), TB-WT (фиг.1В) и lucentis-scFv (фиг.1C) препаративной вытеснительной хроматографии (гель-фильтрации) после стадии рефолдинга. mAU: милли-единицы абсорбции.
Фигура 2 показывает профиль элюции аналитической гель-фильтрации собранных фракций пиков ESBA105 после препаративной гель-фильтрации.
Фигура 3 показывает растворимость ESBA105 в полиэтиленгликоле (ПЭГ).
Фигура 4 показывает стабильность ESBA105 и QC 15,2 scFv-антител при хранении в течение двух недель при различных температурах и концентрациях. Антитела разделяли электрофорезом в ДСН-ПААГ и окрашивали Кумасси бриллиантовым синим.
Фигура 5 показывает активность ESBA105, определенную L929-анализом после 8 недель хранения либо при 37°С, либо при -80°С, в каждом случае при рН 7,4. Треугольники указывают ESBA105, хранящийся при 37°С, а квадраты ESBA105, хранящегося при -80°С.
Фигура 6 показывает схематически шприцы, удаляющие жидкость из стекловидного тела и из передней камеры, соответственно. 1 - жидкость полости стекловидного тела, 2 - жидкость передней камеры глаза, 3 - радужная оболочка, 4 - роговица, 13 - шприц.
Фигура 7 показывает проникновение ESBA105 в переднюю камеру интактных глаз кролика после 4 часов.
Фигура 8 показывает проникновение ESBA105 в полость стекловидного тела интактных глаз кролика после 4 часов.
Фигура 9 показывает проникновение ESBA105 через слой клеток Сасо-2.
Фигура 10 показывает сравнение эффективностей проникновения антитела формата полноразмерного IgG (Инфликсимаба) и фрагмента антитела одноцепочечного формата (ESBA105) через тощую кишку крысы в модели невывернутого мешка для абсорбции кишечного лекарственного средства. Черные квадраты указывают концентрацию ESBA105 в нМ, белые кружки концентрацию инфликсимаба в нМ.
Фигура 11а является графическим изображением количества ESBA105 в нг/мл, обнаруживаемого во внутриглазной жидкости глаз кролика, собранной в виде проб, на протяжении хода исследования, описанного в примере 7.
Фигура 11b является графическим изображением количества ESBA105 в нг/мл, обнаруживаемого во внутриглазной жидкости стекловидного тела глаз кролика, собранной в виде проб, на протяжении хода исследования, описанного в примере 7.
Фигура 11с является графическим изображением количества ESBA105 в нг/мл, обнаруживаемого в нейросетчатке глаз кролика, собранной в виде проб, на протяжении хода исследования, описанного в примере 7.
Фигура 11d является графическим изображением количества ESBA105 в нг/мл, обнаруживаемого в сыворотке глаз кролика, собранной в виде проб, на протяжении хода исследования, описанного в примере 7.
Фигура 12 является графическим изображением локального in vitro pK ESBA105 в глазах кролика. Экстракт сетчатки ~500 нг/мл. 060721 ELISA (из #060718 цельного глаза кролика), Сетчатка.
Фигура 13 является графическим изображением локального времени полужизни ESBA105 после инъекции в стекловидное тело в глазах кролика.
Фигура 14 является графическим изображением моделирования локального накапливания лекарственного средства после введения ESBA105 (5 капель/день, 10 мг/мл ESBA105, Peff=2,9×10-5).
Фигура 15 является графическим изображением рК глаза. 4 - роговица, 5 - слезная пленка, 6 - передняя камера, 7 - хрусталик, 8 - стекловидное тело, 9 - сетчатка, 10 - склера.
Фигура 16 является графическим изображением путей абсорбции и элиминации для ESBA105. 11 - гидрофильные лекарственные средства, 12 - липофильные лекарственные средства.
Фигура 17 показывает данные доза-ответ в релевантной модели острого моноартрита in vivo (крыса). n=3, TNFα 10 мкг i.a.
Фигура 18А показывает графическое изображение результатов местного введения в глаз кролика in vivo. Каждая точка данных представляет среднее двух кроликов (четырех глаз), которые получали одну каплю (30 мкл) раствора 10 мг/мл ESBA105 в ЗФР рН 6,5 каждые 20 минут на протяжении максимального периода лечения 10 часов.
Капли наносили на верхнюю часть зрачка и затем веки сжимали для удаления избытка жидкости (с оставлением 7 мкл). Концентрации ESBA105 определяли во внутриглазной жидкости, стекловидном теле и сыворотке при помощи ELISA.
Фигура 19 показывает графическое изображение результатов местного введения в глаз кролика in vivo. Одну каплю раствора 10 мг/мл вводили в нижний глазной мешок обоих глаз каждого животного пять раз в день в течение до 6 дней.
Взятие проб: После введения второй капли в указанной временной точке (после 1, 3 или 6 дней) двух животных умерщвляли и оба глаза, а также сыворотку подвергали количественному анализу ELISA. Уровни ESBA105 определяли во внутриглазной жидкости (фиг.19А), в стекловидном теле (фиг.19В), в нейросетчатке (фиг.19С), в сосудистых оболочках глаз (фиг.19D) и в сыворотке (фиг.19Е), как указано.
"Carr" обозначает носитель, т.е. буферный раствор без ESBA105. Данные в виде столбцов представляют максимальные, минимальные и медианные концентрации ESBA105, измеренные в указанных компартментах и приведенные вместе с соответствующими стандартными отклонениями.
Осуществление изобретения
Для обеспечения ясного понимания описания и формулы изобретения, ниже приведены для удобства следующие определения.
Определения
Термин «антитело» относится к целым антителам и любому антигенсвязывающему фрагменту (т.е. «антигенсвязывающей части», «антигенсвязывающему полипептиду» или «иммуносвязывающему агенту») или их отдельной цепи. «Антителом» называют гликопротеин, содержащий, по меньшей мере, две тяжелые (Н) цепи и две легкие (L) цепи соединенные между собой дисульфидными связями, или их антигенсвязывающую часть. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращаемой как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращаемой как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть дополнительно подразделены на районы гипервариабельности, называемые определяющими комплементарность районами (CDR), перемежаемыми с районами, которые являются более консервативными, называемыми каркасными районами (FR). Каждая область VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классической системы комплемента.
Термин "антигенсвязывающий" относится к способности специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, включенных в термин «антигенсвязывающая часть» антитела, включают в себя (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и СН1; (iv) Fv-фрагмент, состоящий из доменов VL и VH единственного плеча антитела, (v) единственный домен или dAb-фрагмент (Ward et al, (1989) Nature 341: 544-546), который состоит из домена VH; и (vi) выделенный определяющий комплементарность домен (CDR) или (vii) комбинацию двух или более выделенных CDR, которые могут быть необязательно соединены синтетическим линкером. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются раздельными генами, они могут быть соединены, с использованием рекомбинантных способов, с использованием синтетического линкера, который позволяет приготовить их в виде единственной белковой цепи, в которой области VL и VH спариваются с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например. Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Эти фрагменты антител получают с использованием общепринятых способов, известных в данной области, и эти фрагменты подвергают скринингу на применимость таким же образом, как и интактные антитела.
В данном контексте, "иммуноглобулином" может называться любой класс или подкласс иммуноглобулинов, такой как IgG, IgA, IgM, IgD или IgE. Иммуноглобулин может быть получен из любого вида, такого как человек, мышь или кролик. Кроме того, иммуноглобулин может быть поликлональным, моноклональным или фрагментами. Такие фрагменты иммуноглобулинов могут включать в себя, например, фрагменты F(ab')2, Fv или Fab или другие узнающие иммуноглобулин фрагменты. Такие фрагменты иммуноглобулинов могут быть получены, например, расщеплением протеолитическими ферментами, например, расщеплением пепсином или папаином, восстановительным алкилированием или рекомбинантными способами. Материалы и способы для получения таких фрагментов иммуноглобулинов хорошо известны квалифицированным в данной области специалистам. (Parham, (1983) J. Immunology, 131:2895; Lamoyi et al., (1983) J. Immunological Methods, 56:235; Parham, (1982) J. Immunological Methods, 53:133; и Matthew et al., (1982) J. Immunological Methods, 50:239).
Кроме иммуноглобулина, может быть одноцепочечное антитело ("SCA"). Оно может состоять из одноцепочечных Fv-фрагментов ("scFv"), в которых вариабельные легкие ("VL") и вариабельные тяжелые ("VH") домены связаны пептидным мостиком или дисульфидными связями. Иммуноглобулин может также состоять из единственных доменов VH (dAb), которые обладают антигенсвязывающей активностью. См., например, G. Winter and С. Milstein, Nature, 349, 295 (1991); R. Glockshuber et al., Biochemistry 29, 1362 (1990); и Е. S. Ward et al., Nature 341, 544 (1989).
В данном контексте, термин "полипептид" относится к полимеру из двух или более природных аминокислот или неприродных аминокислот. Полипептиды этого изобретения содержат, по меньшей мере, одну аминокислотную последовательность, произведенную из молекулы иммуноглобулина (Ig). В одном варианте осуществления, полипептид этого изобретения содержит аминокислотную последовательность или одну или несколько частей молекулы, не произведенных из молекулы иммуноглобулина. Примерные модификации описаны более подробно ниже. Например, в одном варианте осуществления, полипептид может быть модифицирован добавлением функциональной части молекулы (например, ПЭГ, лекарственного средства или метки).
Предпочтительные полипептиды этого изобретения содержат аминокислотную последовательность, произведенную из последовательности иммуноглобулина человека. Однако полипептиды могут содержать одну или несколько аминокислот из другого вида млекопитающего. Например, в рассматриваемые полипептиды могут быть включены часть тяжелой цепи, шарнирная часть или сайт связывания примата. Альтернативно, одна или несколько мышиных аминокислот могут присутствовать в полипептиде. Предпочтительные полипептиды этого изобретения не являются иммуногенными.
Квалифицированному в данной области специалисту будет также понятно, что полипептиды этого изобретения могут быть изменены таким образом, что они отличаются в аминокислотной последовательности от природно-встречающегося или нативного полипептида, из которого они произведены, при сохранении желаемой активности нативного полипептида. Например, могут быть произведены нуклеотидные или аминокислотные изменения в «заменимых» аминокислотных остатках. Выделенная молекула нуклеиновой кислоты, кодирующая неприродный вариант полипептида, произведенного из иммуноглобулина (например, часть тяжелой цепи или часть легкой цепи иммуноглобулина) может быть создана введением одной или нескольких нуклеотидных замен, добавлений или делеций в нуклеотидную последовательность этого иммуноглобулина таким образом, что одна или несколько аминокислотных замен, одно или несколько добавлений или одна или несколько делеций вводятся в кодируемый белок. Мутации могут вводиться стандартными способами, такими как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез.
Полипептиды этого изобретения могут содержать консервативные аминокислотные замены в одном или нескольких несущественных аминокислотных остатках. "Консервативной аминокислотной заменой" является замена, в которой аминокислотный остаток заменяют аминокислотным остатком, имеющим сходную боковую цепь. В данной области были определены семейства аминокислотных остатков, имеющих сходные боковые цепи, в том числе основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, несущественный аминокислотный остаток в полипептиде предпочтительно заменяют другим аминокислотным остатком из того же самого семейства боковых цепей. В другом варианте осуществления, нить аминокислот может быть заменена структурно сходной нитью, которая отличается порядком и/или составом членов семейств боковых цепей. Альтернативно, в другом варианте осуществления, мутации могут водиться случайным образом вдоль всей или части кодирующей последовательности иммуноглобулина, например, насыщающим мутагенезом, и полученные мутанты могут быть включены в полипептиды этого изобретения и подвергнуты скринингу на их способность связываться с желаемой мишенью.
Термины «специфическое связывание», «селективное связывание», «селективно связывается» относятся к связыванию антитела с эпигоном на заданном антигене. Обычно, антитело связывается с аффинностью (KD) приблизительно меньшей 10-6 М, например, приблизительно меньшей 10-7 М, 10-8 М или 10-9 М или даже более низкой.
Термин «KD» относится к равновесной константе диссоциации конкретного взаимодействия антитело-антиген. Обычно, антитела этого изобретения связываются с их антигеном-мишенью с константой диссоциации равновесия (KD), меньшей, чем приблизительно 10-6 М, например, меньшей чем приблизительно 10-7 М, 10-8 М или 10-9 М или даже более низкой, например, как определено с использованием технологии резонанса поверхностных плазмонов (SPR) в приборе BIACORE.
Термин «кинетика прохождения» или «фармакокинетика» относится в данном контексте ко всем факторам, связанным с динамикой абсорбции лекарственного средства, распределением в тканях или жидкостях тела и метаболизмом и/или элиминацией. Это включает в себя физико-химические факторы, которые регулируют перенос полипептида через мембраны вследствие абсорбции, распределения, биопревращения и экскреции полипептида, все из которых включают в себя прохождение этого полипептида через клеточные мембраны.
Для клинициста большой интерес представляет биодоступность полипептида. Этот термин в данном контексте указывает степень, с которой полипептид достигает места его действия или биологической жидкости, из которой этот полипептид имеет доступ к его месту действия. Факторы, влияющие на биодоступность, включают в себя скорость абсорбции и метаболизацию или элиминацию этого полипептида из субъекта. Многие факторы влияют на абсорбцию, и они включают в себя многочисленные физико-химические факторы, которые влияют на транспорт через мембраны, такие как растворимость полипептида и механизмы поглощения, а также такие факторы, как место введения и приготовление (концентрация) и композиция (состав) этого полипептида. Различные способы введения полипептида имеют явно различные характеристики абсорбции. Эти способы включают в себя прием внутрь (проглатывание), легочную абсорбцию, парентеральную инъекцию, в том числе: внутримышечную, подкожную, внутривенную, внутриартериальную, внутриоболочечную или внутрибрюшинную инъекцию, и местное нанесение на слизистые мембраны, кожу или глаз. В предпочтительном варианте осуществления, полипептид этого изобретения для лечения глазной болезни вводят локально на поверхность глаза, например, в форме глазных капель. Кинетика прохождения полипептида этого изобретения может быть определена с использованием, например, любой из моделей на основе клеток или животного, описанных здесь, и их обычно выбирают для подходящего или клинически релевантного прохождения через плотные контакты гематоэнцефалического барьера, кишечника или глаза.
Термин «субъект» известен в данной области и, в данном контексте, относится к теплокровному животному, более предпочтительно млекопитающему, в том числе, например, животным, не являющимся человеком, таким как крысы, мыши, кролики, кошки, собаки, овцы, лошади, крупный рогатый скот, наряду с человеком. В предпочтительном варианте осуществления, этим субъектом является человек. Этими субъектами являются субъекты, чувствительные к лечению растворимым антигенсвязывающим полипептидом данного изобретения.
«Усиливающим проникновение агентом» или «усилителем проникновения», в данном контексте, называют молекулы или соединения, которые стимулируют прохождение через эпителиальный плотный контакт. Усиливающие проникновение агенты для применения с данным изобретением включают в себя, но не ограничиваются ими, Азон, хлорид бензалкония (BzCl), BL-7, BL-9, Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилен 1800, капрат натрия, каприловую кислоту, хлорид цетилпиридиния, хлоргексидин, холат, касторовое масло, кукурузное масло, кремофор-EL, DMSO, бромид декаметония, дезоксихолат, декстрансульфат, ЭДТА, динатриевая соль ЭДТА, этанол, фузидат, гликохолат, лаурилсульфат, L-α-лизофосфатидилхолин, N-лауроилсаркозин, NMP, олеиновую кислоту, фосфолипиды, полиоксиэтилен-9-лауриловый эфир, сапонин, Твин 20, Твин 40, Твин 60, Твин 80, таурохолат и тауродезоксихолат. Например, в некоторых вариантах осуществления, усилителем проникновения является капрат натрия. В других вариантах осуществления, усиливающим проникновение агентом является хлоргексидин.
В первом аспекте данного изобретения обеспечено антитело scFv, которое специфически связывает выбранный антиген и имеет улучшенную способность проникновения в ткань. Указанное антитело отличается тем, что оно может быть получено способом, предусматривающим
(i) отбор из пула растворимых и стабильных каркасов каркаса, соответствующего наилучшим образом каркасу антитела не человека выбранной антигенсвязывающей специфичности,
(ii) либо обеспечение указанного каркаса CDR, которые связывают указанный антиген, либо мутированием этого каркаса указанного антитела не человека в направлении последовательности указанного растворимого и стабильного каркаса,
(iii) тестирование генерированного антитела на растворимость и стабильность и
(iv) тестирование генерированного антитела на связывание антигена.
Термин «соответствующий наилучшим образом» обозначает являющийся таким близким, насколько возможно, в отношении первичной или третичной структуры.
Обычно, антитело данного изобретения содержит каркас с доменом VL и/или VH, причем указанный каркас отбирают, по меньшей мере, из части природного репертуара антител человека антиген-независимым способом на высокую стабильность и растворимость в клетке дрожжей. Указанный способ известен также как скрининг «контроля качества» каркасов антител, и он привел к отбору особенно стабильных и растворимых каркасов антител, которые характеризуются высокой внутриклеточной стабильностью и растворимостью. Эти каркасы могут быть использованы, например, во второй системе скрининга на основе дрожжей на специфичность к антигену. В этом случае, CDR особенно стабильного и растворимого антитела могут быть рандомизированы, и полученные антитела могут быть подвергнуты скринингу на лучшее возможное узнавание антигена. Альтернативно, CDR известного антитела из антител с сильной аффинностью связывания к выбранному антигену могут быть трансплантированы на указанные особенно стабильные и растворимые каркасы. Необязательно, указанное антитело может быть дополнительно улучшено мутагенезом выбранных CDR и/или каркаса, отбором улучшенных клонов в «системе контроля качества» (WO0148017, Auf der Maur et al. 2004), т.е. мутированием указанного антитела scFv сайт-направленным или случайным мутагенезом одного или нескольких отобранных CDR и/или каркаса и отбором на стабильные и растворимые антитела при тех же самых или при более строгих условиях. Отбор может быть выполнен in vivo в системе контроля качества дрожжей.
Термин «каркасные остатки» относится к аминокислотным остаткам антигенсвязывающих полипептидных звеньев, или соответствующим аминокислотным остаткам антигенсвязывающих полипептидных модулей, которые вносят вклад в топологию укладки, т.е. способствуют укладке указанного звена (или модуля) или которые способствуют взаимодействию с соседним звеном (или модулем). Таким вкладом может быть взаимодействие с другими остатками в этом звене (или модуле) или влияние на конформацию полипептидного скелета, как обнаружено в α-спиралях или β-складках или сегментах аминокислот, образующих линейные полипептиды или петли. Термин "остатки взаимодействия с мишенью" относится к аминокислотным остаткам этих звеньев или соответствующим аминокислотным остаткам модулей, которые вносят вклад во взаимодействие с последовательностями-мишенями. Такой вклад может быть прямым взаимодействием с последовательностями-мишенями или влиянием на другие непосредственно взаимодействующие остатки, например, посредством стабилизации конформации (поли)пептида указанного звена (или модуля), чтобы сделать возможным или усилить взаимодействие указанных непосредственно взаимодействующих остатков с указанной мишенью. Такие каркасные остатки и взаимодействия с мишенью могут быть идентифицированы анализом структурных данных, полученных физико-химическими способами, упомянутыми выше, или сравнением с известной и родственной структурной информацией, хорошо известной практикам в структурной биологии и/или биоинформатике. Такие каркасы могут также называться «остовами» (scaffold), так как они обеспечивают опору для представления более дивергентных остатков взаимодействия с мишенью или CDR.
CDR или остатки взаимодействия с мишенью могут быть трансплантированы в подходящие каркасы, такие как альтернативные «остовы», которые хорошо известны в данной области и включают в себя, но не ограничиваются ими, CTLA-4, тендамистат, фибронектин (FN3), неокарциностатин, СВМ4-2, липокалины, Т-клеточный рецептор, домен Белка А (белок Z), Im9, сконструированные белки с анкирин-повторами (DARP-ины), сконструированные TPR-белки, цинковый палец, pVIII, птичий панкреатический полипептид, GCN4, WW-домен, домен 3 Src-гомологии (SH3), домен 2 Src-гомологии (SH2), PDZ-домены, β-лактамаза ТЕМ-1, GFP, тиоредоксин, стафилококковая нуклеаза, PHD-палец, CI-2, BPT1 APPI, HPSTI, экотин, LACI-D1, LDTI, MTI-II, токсины скорпиона, пептид дефенсина А насекомых, EETI-II, Min-23, CBD, РВР, цитохром b562, домен A Ldl-рецептора, γ-кристаллин, убиквитин, трансферрин и пектин-подобный домен С-типа (см. Binz et al. (2005 Oct) Nat Biotech 23(10): 1257-68), или в подходящие каркасы произведенных из иммуноглобулина антигенсвязывающих полипептидов, которые хорошо известны в данной области и включают в себя, но не ограничиваются ими, VhH-домены, V-NAR-домены, Vh-домены, Fab, scFv, Bis-scFv, IG верблюда, IfNAR, IgG, Fab2, Fab3, минитело, диатела, триатела и тетратела (см. Holliger, P. and Hudson, P. (2005), Nat. Biotechnol. 23(9), pp.1126-1136).
Предпочтительно, антитело данного изобретения имеет один или несколько из следующих дополнительных признаков:
- оно является стабильным при восстанавливающих условиях согласно измерению в анализе взаимодействия с использованием дрожжей, где активность селектируемого маркерного белка, слитого с указанным Fv, коррелирует с высокой стабильностью и растворимостью указанного scFv во внутриклеточном окружении. Указанный способ анализа взаимодействия в дрожжах, так называемый «контроль качества», был описан подробно (Auf der Maur et al. (2001); Auf der Maur et al., 2004; причем ссылки включены здесь в их полном виде),
- оно является стабильным в течение, по меньшей мере, 1 месяца, предпочтительно, по меньшей мере, двух месяцев, наиболее предпочтительно, по меньшей мере, шести месяцев при 20°С - 40°С, предпочтительно при 37°С в ЗФР,
- оно остается мономерным при физиологических условиях,
- оно является растворимым при температуре окружающей среды в ЗФР при концентрациях > приблизительно 1 мг/мл, предпочтительно > приблизительно 4 мг/мл, более предпочтительно > приблизительно 10 мг/мл, даже более предпочтительно > приблизительно 25 мг/мл и наиболее предпочтительно > приблизительно 50 мг/мл,
- оно обнаруживает среднюю точку перехода в титровании гидрохлоридом гуанидиния, по меньшей мере, 1,5 М, предпочтительно, по меньшей мере, 1,75 М, более предпочтительно, по меньшей мере, 1,9 М, наиболее предпочтительно, по меньшей мере, 2 М, т.е. является устойчивым к денатурации.
Термин антитело в контексте данного изобретения относится к scFv-антителу или фрагменту антитела, который связывается с выбранным антигеном. Таким образом, scFv-антитело данного изобретения может быть либо полным scFv, содержащим домены VL и VH, которые связаны коротким линкерным пептидом, например, линкером, содержащим 1-4 повтора последовательности GGGGS, предпочтительно пептида (GGGGS)4 (SEQ ID No. 16), более предпочтительно линкером последовательности GGGGSGGGGSGGGGSSGGGS (SEQ ID No:17) или линкером, описанным в Alfthan et al. (1995) Protein Eng. 8:725-731, либо просто доменом VL или VH, который имеет достаточную связывающую способность в отношении выбранного антигена. Связь VL и VH может быть в любой ориентации, VL-линкер-VH или VH-линкер-VL.
В одном аспекте данное изобретение обеспечивает антитело, которое является стабильным в течение, по меньшей мере, 1 месяца, предпочтительно, по меньшей мере, двух месяцев, в забуференном фосфатом солевом растворе (ЗФР). Предпочтительно, указанное антитело тестируют на стабильность при физиологических условиях, т.е. при температуре 37°С. В другом предпочтительном варианте осуществления указанное антитело является стабильным в течение, по меньшей мере, 6 месяцев при хранении при 4°С в ЗФР или после лиофилизации при комнатной температуре. Стабильность может быть тестирована, например, анализом стандартных количеств указанных антител при помощи электрофореза в ДСН-полиакриламидных гелях (PAGE) с последующей стандартной процедурой окрашивания, такой как окрашивание Кумасси или содержащим серебро красителем и сравнением интенсивности окрашивания полноразмерной полосы с полосой стандартного белка. Кроме того, проверяют отсутствие продуктов деградации. Деградированный белок перемешается в виде размытой полосы или даже является невидимым вследствие коротких продуктов деградации, и в этом случае только потеря интенсивности полосы полноразмерного белка указывает на деградацию. Обычно, физическая стабильность антитела может быть предположена, если не наблюдаются признаки агрегации, осаждения и/или денатурации после визуального обследования цвета и/или прозрачности или при измерении по рассеянию УФ-света или при помощи гель-фильтрационной хроматографии.
Стабильность в отношении активности после определенного времени хранения является дополнительным важным признаком антитела данного изобретения. Она может быть определена сравнением активности этого антитела до и после хранения, например, в анализах связывания мишени in vitro с использованием ELISA или в анализах клеточной активности in vivo, где измеряют эффективность ингибирования этого антитела.
В другом аспекте данное изобретение обеспечивает антитело, которое является и остается мономерным при физиологических условиях, как может быть определено, например, гель-фильтрацией. Мономерное состояние является важным признаком антител, которые способны проникать через эпителиальные барьеры.
В следующем аспекте данное изобретение обеспечивает антитело, которое является растворимым при температуре окружающей среды в ЗФР при концентрациях, больших, чем приблизительно 1 мг/мл, предпочтительно больших, чем приблизительно 4 мг/мл, наиболее предпочтительно приблизительно 10 мг/мл. Растворимость очищенного антитела может быть определена ПЭГ-осаждением с использованием ПЭГ3000 или хроматографией само-взаимодействия (SIC).
Еще в одном аспекте данное изобретение обеспечивает антитело, которое обнаруживает среднюю точку перехода в титровании гидрохлоридом гуанидиния, по меньшей мере, приблизительно 1,5 М, предпочтительно, по меньшей мере, приблизительно 1,75 М, более предпочтительно, по меньшей мере, приблизительно 1,9 М, наиболее предпочтительно, по меньшей мере, приблизительно 2М. Эти величины являются мерой стабильности в смысле устойчивости к развертыванию, вследствие чего развертывание/денатурацию, индуцированные добавлением гидрохлорида гуанидиния, прослеживают с использованием флуоресцентной спектроскопии или спектроскопии кругового дихроизма.
В следующем аспекте данного изобретения, антитело, имеющее одну или несколько вышеуказанных биофизических характеристик, характеризуется структурно каркасом вариабельного домена (VL) легкой цепи, имеющим, по меньшей мере, 85% сходство, предпочтительно, по меньшей мере, приблизительно 95% сходство, наиболее предпочтительно, по меньшей мере, приблизительно 98% идентичность относительно VL-каркаса, выбранного из группы, состоящей из SEQ ID NO:1 (каппа 1-типа), SEQ ID NO:2 (каппа 1-типа), SEQ ID NO:3 (каппа 3-типа) или SEQ ID NO:4 (лямбда 1-типа), SEQ ID NO:5 (каппа 3-типа), SEQ ID NO:6 (лямбда 1-типа) или SEQ ID NO:7 (лямбда 3-типа) и/или каркасом вариабельного домена (VH) тяжелой цепи, имеющим, по меньшей мере, 85% сходство, предпочтительно, по меньшей мере, приблизительно 95% сходство, наиболее предпочтительно, по меньшей мере, приблизительно 98% идентичность относительно VH-каркаса, выбранного из группы, состоящей из SEQ ID NO:8 (Н3-типа), SEQ ID NO:9 (Н3-типа), SEQ ID NO:10 (HIb-типа) или SEQ ID NO:11 (Н3-типа). В предпочтительном варианте осуществления, используют комбинацию между VL-гомологами SEQ ID NO:2 и VH-гомологами SEQ ID NO:8, комбинацию между VL-гомологами SEQ ID NO:4 и VH-гомологами SEQ ID NO:10 или комбинации между гомологами любой из вышеуказанных VL-последовательностей и VH-гомологом SEQ ID NO:9. Более предпочтительными являются антитела с >90% сходством и даже более предпочтительными являются антитела с >95% сходством относительно SEQ ID NO:7. Наиболее предпочтительными являются антитела последовательности SEQ ID NO:7 и/или последовательности SEQ ID NO:8. Понятно также, что это изобретение включает в себя любую из описанных VL-последовательностей в комбинации с любой из описанных VH-последовательностей, пока сохраняется специфичность связывания мишени.
Процентное сходство между двумя последовательностями является мерой степени, до которой последовательности белков являются родственными. Степень сходства между двумя последовательностями может быть основана на сходстве между двумя последовательностями и/или на консервативности. Консервативностью называют изменения в конкретном положении аминокислотной последовательности, которые сохраняют физико-химические свойства исходного остатка. Сходство между последовательностями обычно определяют выравниванием последовательностей.
Сходства, которые описываются здесь, должны определяться с использованием программ BLAST (Basic Local Alignment Search Tools; cm. Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, DJ. (1990) "Basic local alignment search tool." J. Mol Biol. 215:403-410), доступных в Интернете. Поиски белков BLAST могут выполняться с программой XBLAST, оценка = 50, длина слова = 3 для получения аминокислотных последовательностей, сходных с белковыми молекулами этого изобретения. Для получения имеющих бреши выравниваний для целей сравнения, может быть использована программа Gapped BLAST, описанная в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При использовании программ BLAST и Gapped BLAST, могут быть использованы параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). Процентная идентичность между двумя последовательностями зависит от количества идентичных положений, общих между этими последовательностями, с учетом количества брешей и длины каждой бреши, которые должны быть введены для оптимального выравнивания этих двух последовательностей. Сравнение последовательностей и определение процентной идентичности между двумя последовательностями может выполняться с использованием математического алгоритма, который хорошо известен квалифицированным в данной области специалистам.
Процентная идентичность между двумя нуклеотидными последовательностями может быть определена с использованием программы GAP в пакете программного обеспечения GCG, с использованием матрицы NWSgapdna. CMP и веса бреши 40, 50, 60, 70 или 80 и веса длины 1, 2, 3, 4, 5 или 6. Процентная идентичность между двумя нуклеотидными или аминокислотными последовательностями может быть определена с использованием алгоритма Е. Meyers and W. Miller (CABIOS, 4:11-17 (1989)), которая была включена в программу ALIGN (версию 2.0), с использованием таблицы РАМ120 веса остатка, штрафа за длину бреши 12 и штрафа за брешь 4. Кроме того, процентная идентичность между двумя аминокислотными последовательностями может быть определена с использованием алгоритма Needleman and Wunsch (J. Mol. Biol. (48):444-453 (1970)), который был включен в программу в пакете программ GCG, использующую либо матрицу Blossum 62, либо матрицу РАМ250 и вес бреши 16, 14, 12, 10, 8, 6 или 4 и вес длины бреши 1, 2, 3, 4, 5 или 6.
В другом аспекте антитело этого изобретения является химически модифицированным. Химические модификации могут изменять свойства этого антитела, такие как стабильность, растворимость, антигенсвязывающая специфичность или аффинность, время полужизни in vivo, цитотоксичность и способность проникновения внутрь ткани. Химические модификации хорошо известны квалифицированному в данной области специалисту. Предпочтительной химической модификацией антитела данного изобретения является ПЭГилирование.
В другом предпочтительном аспекте, аффинность антитела этого изобретения характеризуется константой связывания Ко, меньшей, чем приблизительно 100 нМ, предпочтительно меньшей, чем приблизительно 10 нМ и наиболее предпочтительно меньшей, чем приблизительно 1 нМ. Параметры связывания, такие как аффинность этого антитела в отношении когнатного антигена, определяют резонансом поверхностных плазмонов (BiaCore) или ELISA. Эти способы хорошо известны в данной области.
Предпочтительно, антигеном, который связывается антителом данного изобретения, является TNFα (фактор некроза опухолей альфа). TNFα, также известный как кахектин, является природно-встречающимся цитокином млекопитающих, продуцируемым многочисленными типами клеток, в том числе моноцитами и макрофагами, в ответ на эндотоксин или другие стимулы. TNFα является основным медиатором воспалительных, иммунологических и патофизиологических реакций (Grell, М., et al. (1995) Cell, 83:793-802). Большое количество нарушений ассоциированы с повышенными уровнями TNFα, многие из которых являются нарушениями значительной медицинской важности. Было показано, что TNFα положительно регулируется в ряде заболеваний человека, в том числе хронических заболеваний, таких как ревматоидный артрит (RA), воспалительные нарушения кишечника, в том числе болезнь Крона и язвенный колит, сепсис, застойная сердечная недостаточность, бронхиальная астма и рассеянный склероз. TNFα называют также провоспалительным цитокином. Однако он также участвует в нарушениях с локальной манифестацией, такой как болезни глаз, например, дегенерация желтого пятна, увеит, глаукома, катаракта, ретинит, синдром сухих глаз, склерит, конъюнктивит и кератит. Антитело данного изобретения является особенно подходящим для лечения таких заболеваний, так как оно может наноситься локально и местно, например, для болезней глаз с использованием глазных капель.
Данное изобретение обеспечивает ДНК-последовательность, кодирующую антитело данного изобретения, а также клонирующий или экспрессирующий вектор, содержащий указанную ДНК-последовательность. Кроме того, обеспечена подходящая клетка-хозяин, трансформированная указанной ДНК-последовательностью. Она может быть прокариотической или эукариотической клеткой, в частности, Е.coli, клеткой дрожжей, растений, насекомых или млекопитающих.
Антитело данного изобретения может быть генерировано с использованием рутинных способов в области рекомбинантной генетики. Если последовательности полипептидов известны, кДНК, кодирующие их, могут быть генерированы синтезом генов.
Кроме того, обеспечен способ получения антитела данного изобретения, предусматривающий культивирование клетки-хозяина, трансформированной ДНК, кодирующей указанное антитело при условиях, который делают возможным синтез указанного антитела, и извлечение указанной молекулы из указанной культуры. Предпочтительно, указанный способ обеспечивает scFv-антитело, очищенное из тел включения Е.coli или из периплазмы Е.coli, если используемая scFv-конструкция содержит сигнальную последовательность, которая направляет этот полипептид в периплазму.
Другим аспектом данного изобретения является применение антитела, обеспеченного данным изобретением, в качестве инструмента для диагностики, предпочтительно диагностики in vitro, и/или в качестве фармацевтического средства. Это применение является особенно предпочтительным в контексте любого связанного с TNFα состояния. Заболевание, подлежащее лечению анти-TNFα-scPv или его фрагментом, является предпочтительно заболеванием, связанным со сверхэкспрессией TNFα. Если сверхэкспрессия TNFα приводит к патологической клеточной функции, антитело, которое может связывать и, следовательно, нейтрализовать избыточный TNFα, является идеальным фармацевтическим средством для лечения такого заболевания, если указанное антитело может достичь места избытка TNFα. Если это место находится внутри клетки, антитело должно быть способным к вхождению в эту клетку. Если это место является внеклеточным, это антитело должно быть способным достичь внеклеточного матрикса в ткани, т.е. оно должно пересечь, по меньшей мере, наружный слой клеток ткани, который является обычно слоем эпителиальных клеток. В другом варианте осуществления данного изобретения это антитело способно проникать внутрь эндотелия.
IV. Фармацевтические композиции и фармацевтическое введение
А. Композиции и введение
В большинстве случаев антитело данного изобретения будет применяться в фармацевтической композиции, причем указанная фармацевтическая композиция содержит, по меньшей мере, одно дополнительное соединение. Предпочтительно, антитело будет находиться в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом. Этот эксципиент может быть выбран из группы, состоящей из Азона, хлорида бензалкония (BzCl), BL-7, BL-9, Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилен 1800, капрата натрия, каприловой кислоты, хлорида цетилпиридиния, хлоргексидина, холата, касторового масла, кукурузного масла, кремофора-EL, DMSO, бромида декаметония, дезоксихолата, декстрансульфата, ЭДТА, динатриевой соли ЭДТА, этанола, фузидата, гликохолата, лаурилсульфата, L-α-лизофосфатидилхолина, N-лауроилсаркозина, NMP, олеиновой кислоты, фосфолипидов, полиоксиэтилен-9-лаурилового эфира, сапонина, Твина 20, Твина 40, Твина 60, Твина 80, таурохолата и тауродезоксихолата, открывающих плотный контакт пептидов и производных пептидов, открывающих плотный контакт белков и производных белков. Предпочтительно, эксципиент выбран из группы, состоящей из хлорида бензалкония, Твина 20, Твина 40, Твина 60, Твина 80 и хлоргексидина. Можно также использовать капрат. Такие вещества могут действовать в качестве усилителей проникновения.
В большинстве случаев фармацевтическая композиция, содержащая антитело данного изобретения, будет вводиться локально, а не системно. Антитело данного изобретения является особенно подходящим для локального применения, так как его scFv-формат является малым, а его каркас имеет физико-химические характеристики, позволяющие ему проникать через барьеры эпителиальной ткани. Локальное введение является применением в относительно ограниченной зоне, такой как зона глаза, полости носа, полости рта, кишечного тракта, кожи, слизистой оболочки рта и мочеполовых путей, суставов и суставных полостей, головного мозга, позвонка и т.д., где нанесение относительно малого объема достаточно концентрированного антитела является эффективным. С другой стороны, локальным нанесением является нанесение на поверхность части тела.
Предпочтительной формой введения фармацевтической композиции данного изобретения является введение местным нанесением; однако, другими формами являются формы, вводимые ингаляцией, например, если это антитело предназначено для проникновения в легочный эпителий. Легочная доставка может выполняться с использованием ингалятора или распылителя и готовой формы, содержащей аэрозолирующий агент.
Для местных введений, предпочтительным локусом является глаз. Антитело данного изобретения является особенно подходящим для проникновения в роговицу, которая в основном состоит из трех слоев ткани, а именно, эпителия, стромы и эндотелия. Таким образом, это антитело может быть использовано для лечения многих глазных болезней.
В. Системы доставки лекарственного средства
Неограничивающие примеры местных систем глазной доставки лекарственных средств для применения в этом изобретении включают в себя усилители проникновения, роговичные коллагеновые щитки, глазной ионтофорез, микрочастицы или наночастицы, глазные вкладыши, мукоадгезивные полимеры, система гелирования in situ, дендримеры, липидные эмульсии (см. Sultana, et al. (2007) Future Drugs, 2(2), 309-323 (2007).
i. Усилители проникновения
Фармацевтические композиции этого изобретения могут включать в себя усилитель проникновения. Примеры усилителей проникновения хорошо известны в данной области и включают в себя Азон (Azone®), хлорид бензалкония (BzCl), BL-7, BL-9, Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилен 1800, капрат натрия, каприловую кислоту, хлорид цетилпиридиния, хлоргексидин, холат, касторовое масло, кукурузное масло, кремофор-EL, циклодекстрины, DMSO, бромид декаметония, дезоксихолат, декстрансульфат, ЭДТА, динатриевую соль ЭДТА, этанол, фузидат, гликохолат, лаурилсульфат, L-α-лизофосфатидилхолин, метазоламид, N-лауроилсаркозин, NMP, олеиновую кислоту, Pz-пептид, фосфолипиды, полиоксиэтилен-9-лауриловый эфир, сапонин, Твин 20, Твин 40, Твин 60, Твин 80, таурохолат и тауродезоксихолат (см. Sultana, et al. (2007) Future Drugs, 2(2), 309-323 (2007). В другом варианте осуществления, усилителем проникновения является капрат натрия. Еще в одном варианте осуществления, усилитель проникновения включает в себя коллоидные системы, полиакрилаты и биоадгезивный полимер. См. также U.S.S.N. 60/, (Attorney Docket No. ES5-016-1, озаглавленный "Improved penetration Enhancers for the Delivery of Therapeutic Proteins", поданный 10 июля 2007 года filed on July 10, 2007).
ii. Роговичные коллагеновые щитки
Антитела этого изобретения могут быть также введены с корнеальным коллагеновым щитком. В некоторых вариантах осуществления, могут быть использованы коллагеновые щитки с периодами растворения 12, 24 и 72 ч, В других вариантах осуществления, коллагеновый щиток предварительно пропитывают в растворах гатифлоксапина и/или моксифлоксацина.
iii. Глазной ионтофорез
Антитела этого изобретения могут также доставляться глазным ионтофорезом. В одном варианте осуществления, антитела могут быть доставлены в передний сегмент глаза транскорнеальным ионтофорезом. В другом варианте осуществления, высокие и поддерживаемые концентрации антител этого изобретения могут быть доставлены в стекловидное тело и сетчатку транссклеральным ионтофорезом. Ионтофорез применяют в течение желаемой продолжительности времени. В некоторых вариантах осуществления, ионтофорез применяют в течение приблизительно 1 - приблизительно 4 минут. В других вариантах осуществления, ионтофорез выполняют менее 1 минуты. В другом варианте осуществления ионтофорез применяют в течение более 4 минут.
iv. Микрочастицы и наночастицы
Антитела этого изобретения могут быть также доставлены с использованием состоящих из микрочастиц или наночастиц систем доставки. В некоторых вариантах осуществления, микрочастицей является микрокапсула. В других вариантах осуществления, этой микрочастицей является микросфера. В дополнительных вариантах осуществления, микрочастица содержит полимеры, которые являются разрушаемыми, биодеградируемыми, неразрушаемыми частицами или ионообменными смолами. В другом варианте осуществления, этой состоящей из микрочастиц системой доставки является Betoptic S®, содержащий бетаксолол 0,25%.
Могут быть также использованы наночастицы, частицы, меньшие, чем 1 мкм. В одном варианте осуществления, наночастицей является наносфера. В одном варианте осуществления эта наночастица содержит полиакрилцианоакрилат (РАСА). В другом варианте осуществления, наночастица содержит поли-α-капролактон. В некоторых вариантах осуществления, наночастица содержит твердые липидные наночастицы, содержащие 2,5% тобрамицин с гексадецилфосфатом. В другом варианте осуществления, наночастица содержит Eudragit RS 100 или Eudragit RL 100 и необязательно содержит клорикромен. В дополнительных вариантах осуществления, наночастица включает в себя наносуспензии загруженного флубипрофеном (FB) акрилатного полимера.
v. Глазные вкладыши
Антитела этого изобретения могут быть введены с использованием глазных вкладышей. В некоторых вариантах осуществления, глазными вкладышами являются нерастворимые, растворимые или биодеградируемые вкладыши. Нерастворимые вкладыши включают в себя диффузионные системы, осмотические системы и гидрофильные контактные линзы. Растворимые вкладыши могут состоять из природных, синтетических или полу синтетических полимеров. Биодеградируемые вкладыши могут состоять из биодеградируемых полимеров.
vi. Мукоадгезивные полимеры
Фармацевтические композиции этого изобретения могут включать в себя мукоадгезивные полимеры. Примеры мукоадгезивных полимеров хорошо известны в данной области и включают в себя хитозан (CS), Ch-HCL и N-карбоксиметилхитозан (CMCh), полимеры N-триметилхитозана (ТМС), нагруженный пилокарпином CS/Карбопол®, полиакриловую кислоту (РАА), полисахариды, ксилоглюкан, полисахарид семени тамаринда (TSP) и тиолированные полимеры или тиомеры.
vii. Гелеобразующие системы in situ
Фармацевтические композиции этого изобретения могут включать в себя гелеобразующие системы in situ. Примеры гелеобразующих систем in situ хорошо известны в данной области и включают в себя рН-опосредуемые гелеобразующие системы in situ, опосредуемые температурой гелеобразующие системы in situ и опосредуемые ионами гелеобразующие системы in situ. рН-опосредуемые гелеобразующие системы in situ могут включать в себя, например, полимеры, такие как ацетат-фталат целлюлозы (CAP) Carbopol®. Опосредуемые температурой гелеобразующие системы in situ могут включать в себя, например, плуроники, тетраоники и этилгидроксиэтилцеллюлозу. Гелеобразующие системы in situ могут также включать в себя Gelrite® (деацетилированную геллановую камедь (DCG)), альгинаты, например, альгинат-поли(L-лизин), офтальмические растворы тимололмалеата, например, Тимоптол ХЕ и Лизмон TG®, и их комбинации.
viii. Дендримеры
Фармацевтические композиции этого изобретения могут включать в себя дендримеры. Примеры дендримеров хорошо известны в данной области и включают в себя ТМ-полиамидоамин (РАМАМ).
С. Готовые формы
В другом варианте осуществления, готовая форма может быть формой медленного, продленного или пролонгированного высвобождения, формой с носителем, такой как микросферы, микрокапсулы, липосомы и т.д., как известно квалифицированному в данной области специалисту. Любая из вышеупомянутых систем доставки может вводиться местно, внутриглазно, под конъюнктиву или посредством имплантата для получения поддерживаемого высвобождения агента на протяжении некоторого периода времени. Эта готовая форма может быть в форме носителя, например, микро- или макрокапсулы или матрикса биосовместимых полимеров, таких как поликапролактон, полигликолевая кислота, полимолочная кислота, полиангидриды, сополимеры полилактида и гликолида, полиаминокислоты, полиэтиленоксид, полиэтиленоксид с концевыми акриловыми остатками, полиамиды, полиэтилены, полиакрилонитрилы, полифосфазены, поли(ортоэфиры), ацетат-изобутират сахарозы (SAIB), и другие полимеры, такие как описанные в Патентах США с номерами 6,667,371; 6,613,355; 6,596,296; 6,413,536; 5,968,543; 4,079,038; 4,093,709; 4,131,648; 4,138,344; 4,180,646; 4,304,767; 4,946,931, каждый из которых специально включен здесь путем отсылки в его полном виде, или липиды, которые могут быть приготовлены в виде микросфер или липосом. Микроскопическая или макроскопическая готовая форма может вводиться местно или через шприц или может быть имплантирована. Свойства задержанного или продленного высвобождения могут быть обеспечены посредством различных готовых форм носителя (микросфер с покрытием или без покрытия, капсул с покрытием или без покрытия, липидных или полимерных компонентов, однослойных или многослойных структур и их комбинаций, и т.д.). Приготовление и загрузка микросфер, микрокапсул, липосом и т.д. и их глазная имплантация являются стандартными способами, известными квалифицированному в данной области специалисту, например, применением имплантата с поддерживаемым ганцикловиром высвобождением для лечения цитомегаловирусного ретинита, описанного в Vitreoretinal Surgical Techniques, Peyman et al., Eds. (Martin Dunitz, London 2001, chapter 45); Handbook of Pharmaceutical Controlled Release Technology, Wise, Ed. (Marcel Dekker, New York 2000), соответствующие разделы которых включены здесь в качестве ссылки в их полном виде. Например, внутриглазной имплантат поддерживаемого высвобождения может быть вставлен в ресничный кружок (pars plana) для имплантации в полость стекловидного тела. Внутриглазная инъекция может выполняться в стекловидное тело (интравитреально) или под конъюнктиву (субконъюнктивально) или позади глаза (ретробульбарно) или под тенонову капсулу и может находиться в депо-форме. Эти композиции могут вводиться через контактную линзу, вводимую на наружную поверхность глаза, причем эта композиция включена в материал линзы (например, при изготовлении или содержаться в растворе для линзы). Эта композиция может вводиться через внутриглазную линзу (IOL), которую имплантируют в глазе. Имплантируемые линзы включают в себя любые IOL, используемые для замены больного хрусталика пациента после хирургии катаракты, в том числе, но не только, линзы, изготовляемые Bausch and Lomb (Rochester N.Y.), Alcon (Fort Worth Тех.), Allergan (Irvine Calif) и Advanced Medical Optics (Santa Ana Calif). См. также Degim, LT and Celebi, N. (2007), Current Pharmaceutical Design, 13, 99-117]. При имплантации этой линзы в капсулу хрусталика эта композиция обеспечивает желаемый эффект для глаза. Концентрации, подходящие для имплантатов (линз и других типов) и для введения посредством контактных линз, могут варьироваться по решению квалифицированного в данной области специалиста. Например, имплантат может загружаться высоким количеством агента, но изготовляться или регулироваться таким образом, чтобы требуемая концентрация непрерывно высвобождалась в вышеописанных диапазонах (например, в форме медленного высвобождения).
Было обнаружено, что концентрации антитела, обычно достигаемые с scFv, в диапазоне до 1 мг/мл, не являются вполне эффективными в проникновении через эпителий, пока не добавляются усилители проникновения (WO0040262), Данное изобретение обеспечивает антитела, которые являются высокорастворимыми, так что фармацевтические композиции, содержащие указанное антитело при более высоких концентрациях, т.е. больших, чем приблизительно 2 мг/мл, предпочтительно более приблизительно 5 мг/мл, наиболее предпочтительно более приблизительно 10 мг/мл, могут быть приготовлены и использованы в эффективном лечении соответствующего, связанного с антигеном заболевания.
Таким образом, данное изобретение обеспечивает способ лечения антиген-связанного заболевания, в котором доставка антитела к месту взаимодействия антиген-антитело требует проникновения внутрь ткани, которая содержит плотные контакты, в частности, эпителий и/или эндотелий. Эпителий является тканью, состоящей из слоя клеток, и он выстилает как наружную (кожу), так и внутреннюю (например, кишечник) поверхность организмов. Эпителии включают в себя также слизистые оболочки, выстилающие внутреннюю поверхность полости рта и полости тела, и содержат мертвые клетки плоского эпителия и эпителиальные клетки, выстилающие внутреннюю поверхность легких, желудочно-кишечный тракт и половые пути, и мочевые пути. Эндотелий является слоем тонких, плоских клеток, которые выстилают внутреннюю поверхность кровеносных сосудов и органов. В сосудистой сети он образует границу раздела между циркулирующей кровью в просвете и остальной частью стенки сосуда. Эндотелиальные клетки выстилают всю систему кровообращения, от сердца до самого малого капилляра. В малых кровеносных сосудах и капиллярах эндотелиальные клетки часто являются единственным присутствующим типом клеток. Эндотелиальные клетки контролируют также прохождение веществ в кровоток и из кровотока. В некоторых органах, имеются высокодифференцированные эндотелиальные клетки для выполнения специализированных «фильтрующих» функций. Примеры таких уникальных эндотелиальных структур включают в себя почечный клубочек и гематоэнцефалический барьер. Эндотелиальная ткань является специализированным типом ткани эпителия.
В предпочтительном варианте осуществления данного изобретения, может достигаться проникновение в роговицу. Корнеальный эпителий покрывает переднюю часть роговицы и состоит из нескольких слоев клеток, которые делают проникновение антитела даже более трудным. Антитело данного изобретения предпочтительно способно проникать через всю роговицу.
Идеальное лекарственное средство для лечения увеита должно иметь следующие решающие характеристики: 1) обеспечивать быстрое возникновение действий на острые симптомы; 2) обнаруживать сравнимую эффективность в сравнении со стандартными местными кортикостероидами; 3) обнаруживать превосходящий профиль безопасности в сравнении со стандартными местными кортикостероидами; 4) иметь благоприятные фармакокинетические свойства, позволяющие местное нанесение на роговицу, а также интравитреальную инъекцию, в сравнении со стандартными кортикостероидами или стандартными моноклональными антителами.
Локально применяемый ингибитор TNFα, имеющий адекватные фармакокинетические свойства, может справиться со всеми этими аспектами. Хорошее проникновение анти-TNFα-scFv-антитела ESBA105 в переднюю часть глаза в комбинации с его высокой TNFα-нейтрализующей активностью приводит, в конечном счете, к внутриглазным концентрациям, которые очень хорошо подходят для терапевтической эффективности относительно переднего увеита (иридоциклита). С учетом того, что уровни TNFα, обнаруживаемые в больном глазе, были равны 15 пг/мл и что измеренные концентрации ESBA105 были до 40000 нг/мл в передней части (см. фигуру 7) и до 125 нг/мл для части стекловидного тела глаза (см. фигуру 8), авторы сделали вывод, что ESBA105 является подходящим не только для лечения переднего увеита, но также для лечения различных форм панувеита, таких как, например, болезнь Бехчета. Таким образом, данное изобретение обеспечивает антитело для лечения глазных нарушений местным введением в глаз, в частности, для лечения любой формы увеита, болезни Бехчета, ретинита, синдрома сухих глаз, глаукомы, синдрома Шегрена, сахарного диабета (в том числе диабетической невропатии) склерита, конъюнктивита и кератита. Введение предпочтительно выполняют с использованием глазных капель, глазной мази или из депо-устройств, таких как контактные линзы),
В другом предпочтительном варианте осуществления данного изобретения это антитело должно проникать через кишечный эпителий.
В случае лечения в легком, должна использоваться ингаляцию для введения этого антитела для подачи антитела данного изобретения в легочный эпителий.
Еще в одном аспекте данного изобретения, это антитело используют в качестве диагностического инструмента.
Последовательности данного изобретения являются следующими:




Примеры
Во всех примерах использовали следующие материалы и способы, если нет других указаний.
Материалы и способы
Обычно, практика данного изобретения использует, если нет других указаний, общепринятые способы химии, молекулярной биологии, технологии рекомбинантных ДНК, иммунологии (в частности, например, технологии иммуноглобулинов) и животноводства. См., например, Sambrook, Fritsch and Maniatis, Molecular Cloning: Cold Spring Harbor Laboratory Press (1989); Antibody Engineering Protocols (Methods in Molecular Biology), 510, Paul, S., Humana Pr (1996); Antibody Engineering: A Practical Approach (Practical Approach Series, 169), McCafferty, Ed., LrI Pr (1996); Antibodies: A Laboratory Manual, Harlow et al, C.S.H.L. Press, Pub. (1999); Current Protocols in Molecular Biology, eds. Ausubel et al, John Wiley & Sons (1992).
Пример 1. Получение scFv
ScFv-антитела получали посредством экспрессии в виде телец включения с последующей стадией рефолдинга и хроматографии. Получали три однопепочечных антитела. Они включают в себя два обычных scFv, которые предположительно не удовлетворяют критериям, требующим, чтобы они были хорошо растворимыми, очень стабильными и мономерными. Одним из них является TB-wt (SEQ ID No:14), которое было сконструировано связыванием природных последовательностей VL и VH мышиного моноклонального анти-TNFα-антитела Di62 (Doring et al., 1994). Другим является lucentis-scFv, которое было сконструировано связыванием последовательностей VL и VH VEGF-специфического Fab-фрагмента ранибицумаба (SEQ ID No:15). ESBA105 является антителом scFv, которое несет CDR D162 и которое обнаруживает величину Kd в наномолярном диапазоне в отношении TNFα. Растворимость, стабильность и мономерное поведение ESBA105 оптимизировали с использованием scFv-каркаса, который отбирали с использованием так называемой системы контроля качества (Auf der Maur et al., 2004). Аминокислотная последовательность ESBA105 описана в SEQ ID No.13.
Фигура 1 показывает профили элюции ESBA105 (А), TB-wt (В) и lucentis-scFv (С) препаративной гель-фильтрации, которая следует за стадией рефолдинга. В то время как профиль для ESBA105 состоит в основном из одного острого пика, идущего вверх до 300 mAU (относительные единицы абсорбции), несколько широких пиков с максимальной высотой 16 и 55 mAU, соответственно, можно видеть в профилях TB-wt и lucentis-scFv. Это указывает на то, что либо качество телец включения, либо процесс рефолдинга является гораздо менее эффективным для TB-wt и lucentis-scFv, в сравнении с ESBA105.
Ниже описана более подробно процедура получения для ESBA105.
Конструирование плазмиды pGMP002 для экспрессии ESBA 105:
Кодирующую последовательность ESBA105 лигировали в NcoI - HindIII-сайты pET-24d(+) (Novagen, номер по каталогу 69752-3). Затем, Bpu11021-NotI-фрагмент полученной конструкции удаляли лигированием тупых концов после заполнения липких концов, полученных расщеплением Bpu11021 и NotI, реакцией полимеразы Т4 с получением pGMP003. pGMP002 получали удалением Bpu1 1021 - NotI из pET-24d(+) непосредственно.
Экспрессия ESBA105 в Е.coli:
Для экспрессии ESBA105, Е.coli BL21 (DE3) (Novagen) трансформировали экспрессионной плазмидой pGMP002. Исходные культуры с глицерином готовили из отдельных колоний, культивировали в среде М9 (Sambrook et. al. Molecular Cloning, A laboratory Manual), содержащей 1% глюкозу, 1 мл/л раствор микроэлементов (Wang and Lee, Biotechnol Bioeng 58:325-328) и 50 мкг/мл канамицина. Клетки выращивали в течение ночи при 37°С, добавляли глицерин до 20% и аликвоты 1 мл хранили в качестве глицериновых исходных растворов при -80°С.
Для первой предварительной культуры 50 мл синтетической среды определенного состава (Korz et. al., J. Biotechnol. 1995, 39:59-65), содержащей 1% глюкозу, 1 мл/л раствора микроэлементов и 50 мкг/мл канамицина, инокулировали 1 мл глицеринового исходного раствора. Предварительную культуру выращивали в течение ночи при 37°С и 200 об/мин во встряхиваемой колбе с перегородкой. Вторую предварительную культуру с 250 мл той же самой среды инокулировали первой предварительной культурой и выращивали в течение дополнительных трех часов при 37°С.
Культивирования в биореакторе проводили в биореакторе на 5 л (BioFlo 110, New Brunswick Scientific), содержащем начальный объем 3 л той же синтетической среды, которую использовали для предварительных культур. Температуру культивирования устанавливали на 37°С. рН культуры доводили до 7,0 добавлением 25% аммиачной воды и 1 М фосфорной кислоты. Уровень растворенного кислорода поддерживали выше 20% уровня насыщенного воздуха варьированием процента чистого кислорода при общей скорости аэрации 4 л/мин. Биореактор инокулировали второй предварительной культурой, и он работал в периодическом режиме до OD600 10-12. Затем начинали экспоненциальную подачу глюкозы при скорости 0,15 ч-1 с 50% раствором глюкозы, содержащим 10 г/л MgSO4.H2O и 5 мл/л раствора микроэлементов. После 16 часов экспрессию белка индуцировали добавлением IPTG до 1 мМ и экспоненциальную подачу продолжали в течение 3 часов. Затем клетки собирали центрифугированием при 4600 от/мин в течение 1 часа.
Получение телец включения:
Для получения телец включения, 1 кг сырой клеточной массы ресуспендировали в 5 л TBS-буфера (10 мМ Трис, 150 мМ NaCl, pH 7,3). Добавляли 1 г твердого лизоцима и суспензию клеток инкубировали в течение 30-60 мин. Для разрушения клеток, эту суспензию пропускали два раза через гомогенизатор высокого давления (Niro Soavi, Panda 2K) при 1000 бар. Разрушенные клетки центрифугировали в течение 1 часа при 4600 об/мин, и полученные тельца включения ресуспендировали в 2 л ТВ S-буфера, содержащего 0,5% LDAO (N,N-диметилдодециламин-N-оксид, Fluka). Тельца включения промывали повторно, пока не переставал значительно детектироваться остаточный белок в супернатанте промывок. Наконец, тельца включения промывали дважды ТВ S-буфером без LDAO.
Рефолдинг ESBA105:
Тельца включения солюбилизировали в 10-кратном объеме буфера для солюбилизации, содержащего 6 М гуанидиний-HCl, 100 мМ Трис, 1 мМ ЭДТА и 20 мМ ДТТ при pH 8,0, и инкубировали в течение ночи при комнатной температуре. Затем солюбилизированный белок подвергали рефолдингу разведением 1:50 в буфер для рефолдинга, содержащий 3 М мочевину, 100 мМ Трис и 2 мМ каждого из цистеина или цистина при pH 8,5. Рефолдинг продолжали в течение 24 часов при комнатной температуре. После рефолдинга осадки удаляли глубинным фильтрованием и раствор для рефолдинга концентрировали до 50% первоначального объема. Затем концентрированный раствор для рефолдинга диализовали против 4-кратного объема буфера ЗФР (50 мМ Na-фосфат, 150 мМ NaCl, pH 6,5) и дополнительно концентрировали до концентрации белка приблизительно 1 мг/мл.
Очистка ESBA105 хроматографией:
ESBA105 очищали в две стадии хроматографии: гель-фильтрационной хроматографии и катионообменной хроматографии. Все стадии хроматографии выполняли с использованием систем очистки AKTA (GE Healthcare).
Для препаративной гель-фильтрационной хроматографии, использовали колонку Sephadex S75 26/60 (GE Healthcare) с буфером ЗФР (50 мМ Na-фосфат, 150 мМ NaCl, pH 6,5) в качестве рабочего буфера. Собранную фракцию ESBA105 элюировали при приблизительно 185 мл объема удерживания в виде единственного пика.
Фрактогель EMD SO3 - (М) (Merck) использовали в качестве колоночной смолы для второй стадии хроматографии. Смолу уравновешивали пятью колоночными объемами буфера для уравновешивания (50 мМ Na-ацетат, pH 5,5). Фракции пика ESBA105 из гель-фильтрации разбавляли в 10 раз 50 мМ Na-ацетатом pH 5,5 и затем наносили на эту колонку со скоростью тока 5 мл/мин. После нанесения, колонку промывали пятью колоночными объемами буфера для уравновешивания. Для элюции ESBA105 использовали линейный градиент 0-35% буфера для элюции (50 мМ Na-ацетат, 500 мМ NaCl, pH 5,5) в пределах 60 минут и при 5 мл/мин. Наиболее высокий пик после элюции собирали и идентифицировали как ESBA105. Наконец, эту собранную фракцию ESBA105 диализовали против ЗФР (50 мМ Na-фосфат, 150 мМ NaCl, pH 6,5) и хранили при -80°С.
Пример 2. Биофизическая характеристика scFv
Для исследования их «сходства с лекарственным средством», ESBA105 и некоторые из его производных характеризовали биофизически. Характеристика включала в себя определение (1) параметров растворимости (ПЭГ-осаждения и величины В22; величина В22 является мерой само-взаимодействия белка, которая важна в росте кристалла белка, солюбилизации и агрегации. См. Valente et al., Biophys J. 2005 Dec; 89(6):4211-8. Epub 2005 Sep 30), (2) величин pI, (3) измерение термической и хаотропной денатурации и (4) количественное определение мономерной фракции в сравнении с олигомерной фракцией. Результаты пунктов 1-3 суммированы в таблице 1, которая также включает в себя относительные величины эффективности, определенные анализами L929 и KYM-1, соответственно.
Пример 3. Стабильность scFv во время хранения
Стабильность scFv на протяжении времени является важным признаком в контексте фармацевтического вещества. Фиг.4 показывает анализ scFv ESBA105 (дорожки 1-6) scFv QC15.2 (дорожки 7-12), которые разделяли электрофорезом в ДСН-ПААГ и окрашивали Кумасси, после двух недель хранения при различной температуре (-80°С: дорожки 1, 3, 5, 7, 9 и 11) или 40°С: дорожки 2, 4, 6, 8, 10 и 12) и концентрациях (20 мг/мл: дорожки 1, 2, 7 и 8; 10 мг/мл; дорожки З, 4, 9 и 10; 1 мг/мл: дорожки 5, 6, 11 и 12). Эти антитела оставались стабильными на протяжении полных диапазонов температуры и при всех испытанных концентрациях и не обнаруживали признаков деградации или агрегации.
Антитело, которое является стабильным на протяжении определенного периода времени, должно сохранять его полную активность. Таким образом, авторы тестировали ESBA105 спустя восемь недель после хранения при 37°С или -80°С в L929-анализах на их активность. Этот результат представлен на фиг.5, и между этими двумя температурами не наблюдали никаких различий.
Пример 4. Проникновение ESBA105 ex vivo в целые глаза кроликов
Количество ESBA105, проникающее в различные компартменты целых глаз, тестировали при различных условиях в постановке эксперимента ех vivo. Для этой серии экспериментов глаза кроликов помещали на инкубационные тест-чашки, которые имеют углубления на их поверхности. Углубление содержало тест-раствор ESBA105, и глаза кроликов помещали на эти тест-чашки таким образом, что роговица находилась в контакте с этим тест-раствором. После времени инкубации 4 часов при 37°С разные компартменты глаз анализировали на их содержание ESBA105. Для этого анализа, использовали шприц для извлечения проб из представляющего интерес компартмента (см. фиг.6) и концентрацию ESBA105 пробы определяли при помощи ELISA.
Следующие условия оценивали с постановкой эксперимента, описанной выше; ESBA105 тестировали при концентрациях 1, 2, 5 и 10 мг/мл. Кроме того, концентрацию 1 мг/мл тестировали в присутствии 0,5% каприновой кислоты. Ранее было показано Thiel et al. (Clin. Exp. Immunol. 2002 Apr; 128 (1):67-74), что 0,5% каприновая кислота усиливает проникновение через роговицу. При введении 1 мг/мл в присутствии 0,5% каприновой кислоты, авторы измеряли концентрацию ESBA105 в передней части глаза приблизительно 40 мкг/мл, что было тем же самым результатом в сравнении с концентрациями, измеренными после введения 10 мг/мл в отсутствие каприновой кислоты (фиг.7). Интересно, что, когда результаты этих двух способов введения сравнивали с жидкостью стекловидного тела, были получены измерения 40 нг/мл для введения 1 мг/мл с каприновой кислотой и приблизительно 125 нг/мл для 10 мг/мл без каприновой кислоты (фиг.8). В отсутствие каприновой кислоты эти концентрации, измеренные в этих двух компартментах, выявили явную зависимость от применяемых концентраций 1, 2, 5 и 10 мг/мл (фиг.8).
Эти тест-чашки для инкубации глаз предынкубировали с блокирующим буфером (5% порошок молока с пониженным содержанием жира в ЗФР, рН 7,4) на протяжении ночи при 4°С. На следующий день эти чашки промывали ЗФР и после этого сушили инкубацией при 37°С в течение 30 минут. Лунки высушенных чашек заполняли 125 мкл тест-раствора, каждую, и выделенные глаза кроликов помещали в эти лунки таким образом, что только роговица находилась в контакте с тест-раствором. После инкубации при 37°С и влажности 100% в течение 4 часов глаза промывали в течение 3 часов ЗФР. Выполняли пункцию полости с использованием иглы 25G для передней камеры глаза и иглы 22G для стекловидного тела.
Концентрацию ESBA105 в этих пробах определяли при помощи ELISA следующим образом: Пробы центрифугировали в настольной микроцентрифуге при 13000 об/мин в течение 5 минут при комнатной температуре. Пробы из переднего компартмента разводили 1:10, 1:100 и 1:1000, пробы из компартмента стекловидного тела разводили 1:5 в TBST (TBS, дополненный 0,005% Твином), содержащем 0,5% порошком молока с пониженным содержанием жира (далее называемом раствором для разведения) для тестирования ELISA.
96-луночные планшеты ELISA (Nunc Maxisorb; номер по каталогу 442404) покрывали 0,5 мкг/мл TNFα человека на протяжении ночи при 4°С. На следующий день эти планшеты промывали 3 раза TBST при комнатной температуре и инкубировали с 300 мкл блокирующего буфера (5% порошок молока с пониженным содержанием жира в TBST) на лунку в течение 60 минут при комнатной температуре на шейкере (500-600 об/мин). После стадии блокирования эти планшеты промывали 3 раза TBST перед добавлением 50 мкл разведенных проб в каждую лунку и эти планшеты инкубировали на шейкере (500-600 об/мин) в течение 90 минут при комнатной температуре. После этой стадии инкубации планшеты промывали 3 раза TBST перед добавлением 50 мкл 1:10000-раствора (разведенного в растворе для разведения) вторичного антитела, AKA3A-биотинилированного, в каждую лунку. AKA3A-биотинилированное антитело является поликлональным кроличьим анти-ESBA105-антителом, которое было свежебиотинилированным (в соответствии со стандартными протоколами биотинилирования). После 90 минут инкубации на шейкере (500-600 об/мин) при комнатной температуре, эти планшеты промывали 3 раза TBST перед добавлением 50 мкл 1:2000-разведения (разведенного в растворе для разведения) связанной со стептавидином пероксидазы хрена (стрептавидин-полиHRP40, 1 мг/мл; SDT; #SP40C). После 60 минут инкубации на шейкере (500-600 об/мин) при комнатной температуре эти планшеты промывали 3 раза TBST и 2 раза ddH2O. Активность пероксидазы хрена (HRP) детектировали после добавления 50 мкл субстрата ВМ Blue POD (Roche Diagnostics, номер по каталогу 1484281) в каждую лунку. После 6-12 минут инкубации при комнатной температуре в темноте реакцию HRP останавливали добавлением 50 мкл 1 М HCl в каждую лунку. Реакцию HPR определяли количественно спектрометрическим измерением при 450 нм в ридере TECAN Genios.
Концентрацию ESBA105 этих проб, в конечном счете, определяли сравнением с калибровочной кривой, которую получали параллельно.
Пример 5. Проникновение ESBA105 через монослои клеток Сасо-2
Клетки аденокарциномы ободочной кишки человека (Сасо-2) высевали на проницаемые подложки 24-транслуночного планшета и культивировали в течение 21 дня при 37°С в атмосфере 5% СО2 для образования плотных монослоев. Перед выполнением анализа проницаемости измеряли трансэпителиальное электрическое сопротивление в каждой лунке для проверки целостности этих монослоев. Затем монослои Сасо-2 промывали три раза солевым раствором (HBSS) и смесь, содержащую либо 1 мкМ ESBA105 с капратом или без капрата, либо только среду для анализа, добавляли в верхний компартмент транслунок в качестве контроля. После определенных временных точек содержимое нижних компартментов собирали и заменяли свежей средой для анализа. Собранные пробы затем анализировали при помощи количественного ELISA для определения количества ESBA105, которое проникало через эпителиальный монослой Сасо-2 (фиг.9).
Пример 6. Проникновение через тощую кишку мыши
Приблизительно 5 см тощей кишки мыши вырезали сразу же после эвтаназии животного и инкубировали в насыщенном кислородом буфере Рингера-Кребса и промывали три раза буфером Рингера-Кребса. Отрезок 3,5 см перевязывали хирургическим шелком и наполняли 200 мкл смеси антител, содержащей 1 мг/мл каждого формата антитела (Инфликсимаба и ESBA105). Приблизительно на расстоянии 1 см от компартмента этого вывернутого мешка добавляли вторую лигатуру для надежного затягивания этого компартмента. Вывернутые мешки помещали в химический стакан, содержащий 10 мл насыщенного кислородом буфера Рингера-Кребса, так что только первые лигатуры соприкасались с этим буфером. В этот рецепторный компартмент добавляли ингибиторы протеаз для предотвращения деградации антител. Для определения количества каждого антитела, которое проникает через кишечную ткань, из этого рецепторного компартмента брали пробы по 200 мкл после определенных временных точек и затем анализировали количественным ELISA.
Пример 7. Местное применение растворимого антигенсвязывающего полипептида
Исследовали фармакодинамику и фармакокинетику местного применения растворимого антигенсвязывающего полипептида, ESBA105 в глазах кроликов in vivo. Готовили четыре разных препарата. Первый препарат (называемый здесь "В15") состоял из 9,6 мг/мл ESBA105 в 0,15 М фосфатном буфере при рН 6. Второй препарат (называемый здесь "В16") состоял из 10,3 мг/мл ESBA105 и 0,01% (масса/объем) хлоргексидина в 0,15 М натрий-фосфатном буфере при рН 6. Первый контроль (называемый здесь "В15-0") состоял из 0,15 М натрий-фосфатного буфера при 6. Второй контроль (называемый здесь "В16-0") состоял из 0,01% (масса/объем) хлоргексидина в 0,15 М натрий-фосфатном буфере при рН 6. Все препараты стерилизовали перед использованием и хранили при 4°С. В данном контексте «ОТТ» обозначает отсутствие обработки.
Для исследования фармакодинамики ESBA105 в глазе, для каждого препарата использовали 6 кроликов. Препарат тестировали на обоих глазах этих кроликов. Два кролика (4 глаза) использовали для каждого препарата без фрагментов антител, и два кролика (4 глаза) использовали в качестве необработанных контролей. В целом для этого исследования использовали 18 кроликов.
Препараты наносили локально в глаза на протяжении шести дней. Кроликов обрабатывали пять раз в день, при временных точках семь, десять, тринадцать, семнадцать и двадцать часов. В день умерщвления кроликов обрабатывали дважды при временных точках семь и десять часов и умерщвляли спустя один час после последнего нанесения.
Глаза оценивали в день 1, день 3 и день 6. Два кролика на препарат использовали для сбора фармакокинетических данных для каждой временной точки. Пробу внутриглазной жидкости и пробу сыворотки брали в день 1 и день 3. В день 6, брали пробу внутриглазной жидкости и пробу сыворотки и глаза кроликов иссекали из тканей для исследования распределения фрагмента антитела в различных тканях глаза. Результаты этого исследования графически изображены на фигурах 11а - 11d.
Выполняли дополнительные исследования для исследования растворимости, фармакодинамики и фармакокинетики ESBA105. Результаты представлены на фигурах 12-16. Как можно видеть из этих фигур, было показано, что ESBA105 проникает через слои ткани роговицы в кроликах и свиньях. ESBA105 накапливается в стекловидном теле и имеет локальное время полужизни приблизительно 25 часов. Локальное время полужизни ESBA105 в передней камере является значимо более низким, чем в стекловидном теле. Системное воздействие после локальной обработки является очень низким, например, приблизительно 2% наивысшей локальной концентрации. Кроме того, на основе локального эксперимента с кроликами терапевтические уровни лекарственного средства (приблизительно 16000-кратные в отношении TNF), могут достигаться всего лишь с пятью локальными каплями в день. Таким образом, местное (локальное) применение ингибирующих TNF фрагментов антител scFv могло бы быть эффективной терапией в болезнях, локализованных в более задних сегментах глаза, например, стекловидном теле и сетчатке.
Пример 8. Доза-ответ в крысиной модели острого моноартрита
Для исследования зависимости доза-ответ, ESBA105 вводили, как показано на фигуре 17. В качестве сравнения, Remicade® (инфликсимаб) вводили, как показано на фигуре 17. Для этого эксперимента TNFα вводили с тремя различными дозами (156 мкг, 45 мкг или 11 мкг) ESBA105 или инфликсимаба. В качестве контролей использовали ЗФР и только TNF (10 мкг La.) или только scPv. Результаты показаны на фигуре 17.
Пример 9. Локальное применение in vivo
Для определения максимального системного воздействия и локальных уровней лекарственного средства во время одного дня локального введения одну каплю вводили каждые 20 минут на протяжении периода 10 часов. Уровни лекарственного средства измеряли при помощи ELISA во внутриглазной жидкости, стекловидном теле и сыворотке. ESBA105 готовили при 10 мг/мл в ЗФР, рН 6,5. Для каждой капли, 30 мкл наносили на зрачок и затем веки глаз сжимали для удаления избыточной жидкости. Результаты показаны на фигуре 18 и в таблице 2.
Таблица 2 - показывает максимальные концентрации ESBA105 (Смакс); измеренные в указанных компартментах в ходе эксперимента, как описано в подписи фигуры 18А. Процентные величины указывают процент Смакс в сравнении с общей нанесенной дозой (кумулятивной дозой).
Пример 10. Локальное применение растворимого антигенсвязывающего полипептида
Для определения максимального системного воздействия и локальных уровней лекарственного средства во время продолжительной локальной обработки низкой частоты, одну каплю 5 раз в день применяли к двум кроликам (4 глаза) в течение до 6 дней. Для каждой капли 30 мкл ESBA105 вносили в нижний мешок глаза (презентация лекарственного средства в основном склере), с полным объемом 30 мкл, остающимся на глазной поверхности.
Глаза оценивали после второй капли в день 2, день 3 и день 6. Уровни лекарственного средства измеряли при помощи ELISA во внутриглазной жидкости, стекловидном теле, нейросетчатке, хороидах и сыворотке. Результаты этого исследования графически изображены на фигурах 19а - 19е.
Таблица 3 суммирует медианные концентрации scFv ESBA105, обнаруженные после 6-го дня введения в указанных компартментах в [нг/мл].
Многочисленные модификации и альтернативные варианты данного изобретения будут очевидны для квалифицированных в данной области специалистов в связи с предыдущим описанием. Таким образом, это описание должно рассматриваться только как иллюстративное и служит для объяснения квалифицированным в данной области специалистам наилучшего способа проведения данного изобретения. Детали этой структуры могут варьироваться по существу без отклонения от идеи этого изобретения, и резервируется приоритет эксклюзивного применения всех модификаций, которые находятся в объеме прилагаемой формулы изобретения. Предполагается, что данное изобретение ограничивается только до степени, требуемой прилагаемой формулой изобретения и применимыми правилами закона.
Весь литературный и подобный материал, цитируемый в этой заявке, включающий в себя патенты, заявки на патент, статьи, книги, диссертации и веб-страницы, независимо от формата таких литературных и подобных материалов, специально включен в качестве ссылки в полном виде. В случае, когда один или несколько из литературных и подобных материалов отличаются от этой заявки или противоречат этой заявке, в том числе определенным терминам, применению терминов, описанным способам или т.п., следует считать приоритетом эту заявку.
Заголовки разделов, используемые здесь, даются только для организационных целей и не должны рассматриваться как ограничивающие каким бы то ни было образом описанный предмет изобретения.
Хотя эти изобретения были описаны вместе с различными вариантами осуществления и примерами, не предполагается, что эти описания ограничиваются такими вариантами осуществления и примерами. Напротив, эти изобретения включают в себя различные альтернативы, модификации и эквиваленты, как будет понятно квалифицированным в данной области специалистам.
Формула изобретения не должна рассматриваться как ограниченная описанными порядком или элементами, если нет указаний о таком ограничении. Должно быть понятно, что могут быть произведены различные изменения в форме и деталях без отклонения от объема прилагаемой формулы изобретения. Таким образом, заявляются также все варианты осуществления, которые включены в объем и идею следующей формулы изобретения и ее эквивалентов.
Ссылки:
Alberts, В., Johnson, A., Lewis, J., Roberts, K., and Walter, P. (2002). Molecular Biology of the Cell, 4th ed.
Alfthan et al., (1995). Properties of a single-chain antibody containing different linker peptides. Protein Eng. 8:725-731.
Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, DJ. (1990) "Basic local alignment search tool." J. Mol. Biol. 215:403-410.
Auf der Maur, A., Escher, D., and Barberis, A. (2001). Antigen-independent selection of stable intracellular single-chain antibodies. FEBS Lett 508, 407-412.
Auf der Maur, A., Tissot, K., and Barberis, A. (2004). Antigen-independent selection of intracellular stable antibody frameworks. Methods 34, 215-224.
Auf der Maur, A., et al., Direct in vivo screening of intrabody libraries constructed on a highly stable single-chain framework. J Biol Chem, 277(47); p.45075-85, 2002.
Benitez Del Castillo, JM. et al. (2004) Long-term treatment of refractory posterior uveitis with anti-TNFα (infliximab). Eye, Sept 24, e-pub ahead of print.
Binz et al. (2005 Oct) Nat Biotech 23(10):1257-68.
Bird, RE, Hardman, K.D., Jacobson, J.W., Johnson, S., Kaufman, B.M., Lee, S.M., Lee, Т., Pope, S.H., Riordan, G.S., and Whitlow, M. (1988). Single-chain antigen-binding proteins. Science 242, 423-426.
Bonfioli and Orefice (2005). Behcet's disease. Semin Ophthalmol 20(3), 199-206.
Boyd et al. (2001). Immunopathology of the non-infectious posterior and intermediate uveitides. Surv Ophthalmol 46, 209-233.
Chothia, С, and Lesk, A. M. (1987). Canonical structures for the hypervariable regions of immunoglobulins. J Mol Biol 196, 901-917.
Chothia, С, Novotny, J., Bruccoleri, R., and Karplus, M. (1985). Domain association in immunoglobulin molecules. The packing of variable domains. J Mol Biol 186, 651-663.
Degim, LT and Celebi, N. (2007), Controlled delivery of peptides and proteins. Current Pharmaceutical Design, 13, 99-117.
Dick, AD. et al. (1997) Immunosuppressive therapy for chronic uveitis: optimising therapy with steroids and cylosporin A. Br. J. Ophtalmol. 81, 1107-1112.
Direskeneli (2001). Behcet's disease: infectious aetiology, new autoantigens, and HLA-B51. Ann Rheum Dis 60, 996-1002.
Doring, E. Stigler R, Grutz G, von Baehr R, and Schneider-Mergener J. (1994). Identification and characterization of a TNF alpha antagonist derived from a monoclonal antibody. Mol Immunol. 31:1059-67.
El-Shabrawi, Y. and Hermann J. (2002) Anti-tumor necrosis factor-alpha therapy with infliximab as an alternative to cortico steroids in the treatment of human leukocyte B27-associated acute anterior uveitis. Ophtalmology 109, 2342-2346.
El-Shabrawi, Y. et al. (2003) Anti-tumor necrosis factor alpha treatment in chronic recurrent inflammation of the anterior segment of the eye in patients resistant to standard immunomodulatory treatment. Ann Rheum Dis. 62, 1243-1244.
Evereklioglu (2005). Current concepts in the etiology and treatment of Behcet's disease. Surv Ophthalmol 50(4), 297-350.
Giansanti et al. (2004). Infliximab for the treatment of posterior uveitis with retinal neovascularization in Behcet's disease. Eur J Ophthalmol 14(5), 445-448.
Holliger, P. and Hudson, P. (2005), Nat. Biotechnol. 23(9), pp.1126-1136. Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883.
Johnson, P.H., and Quay, S. C. (2000). Advances in nasal drug delivery through tight junction technology. Expert Opin. Drug Deliv. 2:281-298.
Joseph, A. et al. (2003) Infliximab in the treatment of refractory posterior uveitis. Ophtalmology 110, 1449-1453.
Kotter et al. (2003). Human recombinant interferon alfa 2a for the treatment of Behcet's disease with sight threatening posterior or panuveitis. Br J Ophthalmol 87, 423-431.
Lanthier et al. (2005). Infliximab in the treatment of posterior uveitis Behcet's disease. PresseMed 34, 916-918.
Lightman, S., and Kok H. (2002) Developments in the treatment of uveitis. Expert Opin. Invetig. Drugs 11, 59-67.
Lindstedt et al. (2005). Anti-TNF-alpha therapy for sight threatening uveitis. Br J Ophthalmol 89(5), 533-536.
Murphy, CC. Et al. (2004) Neutralizing tumor necrosis factor activity leads to remission in patients with refractory noninfectious posterior uveitis. Arch. Ophtalmol. 122, 845 851.
Ozen (1999). Vasculopathy, Behcet's syndrome, and familial Mediterranean fever. Curr Opin Rheumatol 11, 393-398.
Ohno et al., (2004). Efficacy, safety, and pharmacokinetics of multiple administration of infliximab in Behcet's disease with refractory uveoretinitis. J Rheumatol 31, 1362-1368.
Perez-Guijo, V. et al. (2004) Tumour necrosis factor-alpha levels in aqueous humour and serum from patients with uveitis: the involvement of HLA-B27. Curr. Med. Res. Opin. 20, 155-157.
Powers С. et al. Pleiotrophin signalling through anaplastic lymphoma kinase is rate-limiting for glioblastoma growth. The Journal of biological chemistry 277(16), 14153-14158, 2002.
Power, WJ. et al. Outcomes in anterior uveitis associated with the HLA-B27 haplotype. Ophtalmology 105, 1646-1651 1998.
Reiff, A. et al. (2001) Etanercept therapy in children with treatment-resistant uveitis. Arthrit. Rheum. 44, 1411-1415.
Rosenbaum (2004). Blind insight: Eyeing anti-tumor necrosis factor treatment in uveitis associated with Behcet's disease. J Rheumatol 31(7), 1241-1243.
Sakane et al. (1999). Behcet's disease. N Engl J Med 341, 1284-1291.
Schaerer-Brodbeck, С. and A. Barberis, Coupling homologous recombination with growth selection in yeast: a tool for construction of random DNA sequence libraries. Biotechniques, 37(2): p.202-206, 2004.
Sfikakis, PP. et al. (2001) Effect of infliximab on sight-threatening pan-uveitis in Behcet's disease. Lancet 358, 295-296.
Suhler et al. (2005). A prospective trial of infliximab therapy for refractory uveitis: preliminary safety and efficacy outcomes. Arch Ophthalmol 123(7), 903-912.
Stocks, M.R. (2004). Intrabodies: production and promise. Drug Discov. Today 15:960-966.
Thiel, MA. et al. (2002). Penetration of engineered antibody fragments into the eye. Clin. Exp. Immunol. 128, 67-74.
Tugal-Tutkun et al. (2004). Uveitis in Beliefs disease: an analysis of 880 patients. Am J Ophthlmol 138, 373-380.
Tugal-Tutkun et al. (2005). Efficacy of infliximab in the treatment of uveitis that is resistant to treatment with the combination of azathioprine, cyclosporine, and corticosteroids in Behcet's disease. Arthritis Rheum 52(8), 2478-2484.
Tursen et al., (2003). Evaluation of clinical findings according to sex in 2313 Turkish patients with Behcet's disease. Int J Dermatol 42, 346-351.
Verity et al. (1999). Behcet's disease, the Silk Road and HLA-B51: historical and geographical perspectives. Tissue Antigens 54, 213-220.
Verity et al., (1999b). HLA and tumour necrosis necrosis factor (TNF) polymorphisms in ocular Behcet's disease. Tisue Antigens 54, 264-272.
Ward et al., (1989) Nature 341:544-546.
Wechsler et al. (2004). Infliximab in refractory uveitis due to Behcet's disease. Clin Exp Rheumatol 22 (4 Suppl 34), S14- S16.
Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987.
Worn, A., Auf der Maur, A., Escher, D., Honegger, A., Barberis, A., Pluckthun, A. (2000). Correlation between in vitro stability and in vivo performance of anti-GCN4 intrabodies as cytoplasmic inhibitors. J Biol. Chem. 275:2795-803.
Yurdakul et al. (2004). Behcet's syndrome. Curr Opin Rheumatol 16, 38-42.
Zierhut et al. (2003). Immunology and functional genomics of Behcet's disease. Cell MoI Life Sci 60, 1903-1922.
| название | год | авторы | номер документа |
|---|---|---|---|
| ScFv-АНТИТЕЛА, КОТОРЫЕ ПРОХОДЯТ ЧЕРЕЗ ЭПИТЕЛИАЛЬНЫЙ И/ИЛИ ЭНДОТЕЛИАЛЬНЫЙ СЛОИ | 2007 |
|
RU2438708C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ TNFα | 2018 |
|
RU2678120C1 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ TNFα | 2018 |
|
RU2704838C1 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ TNFα | 2009 |
|
RU2653753C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕННОЙ ДОСТАВКИ МАКРОМОЛЕКУЛ | 2009 |
|
RU2522245C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА | 2011 |
|
RU2558298C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ TNFα | 2009 |
|
RU2567100C2 |
| ОПТИМИЗАЦИЯ РАСТВОРИМОСТИ ИММУНОСВЯЗЫВАЮЩИХ СРЕДСТВ | 2009 |
|
RU2514658C2 |
| ОПТИМИЗАЦИЯ РАСТВОРИМОСТИ ИММУНОСВЯЗЫВАЮЩИХ СРЕДСТВ | 2014 |
|
RU2653441C2 |
| ФУНКЦИОНАЛИЗИРОВАННЫЕ ПОЛИПЕПТИДЫ | 2009 |
|
RU2582244C2 |
















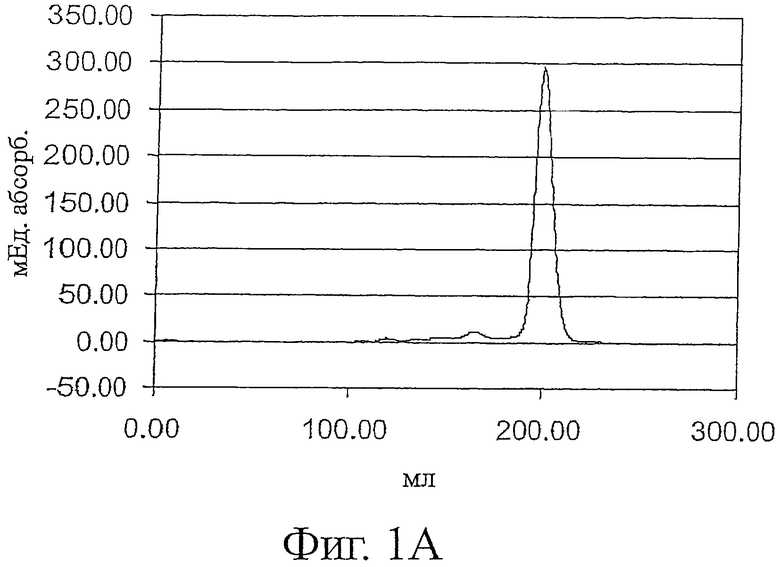
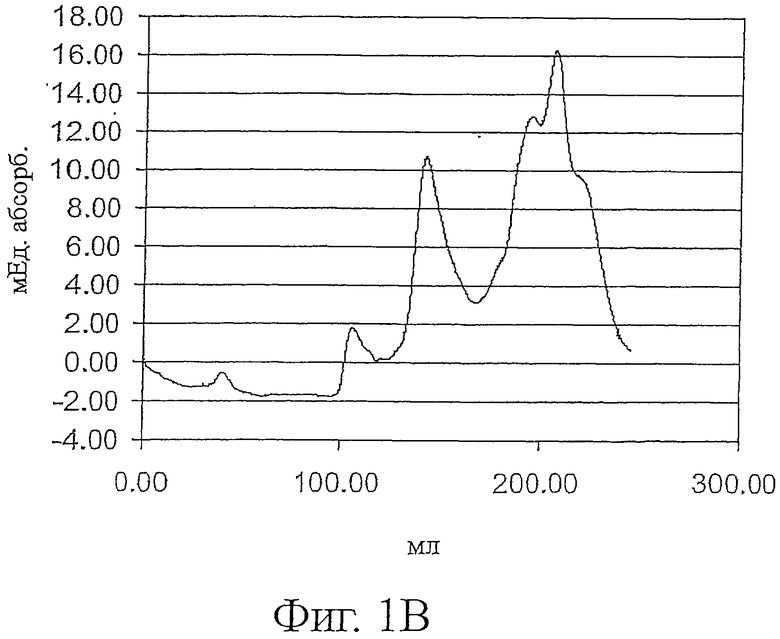
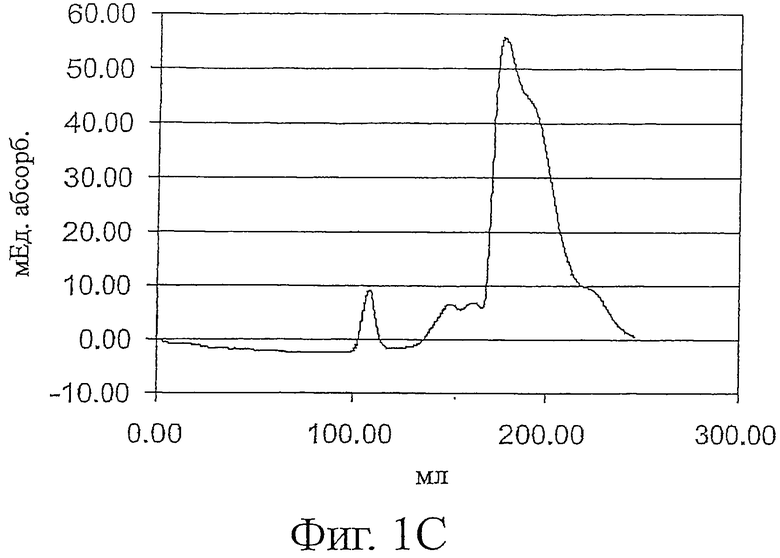

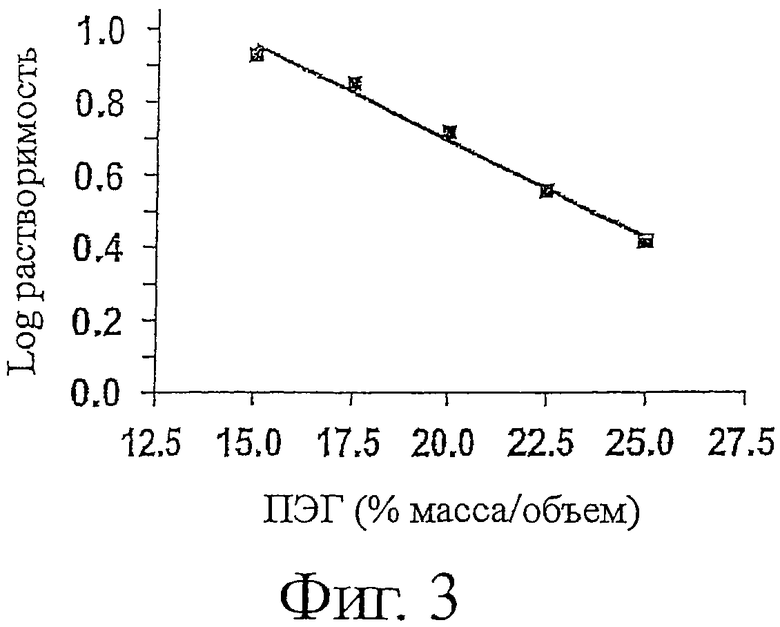
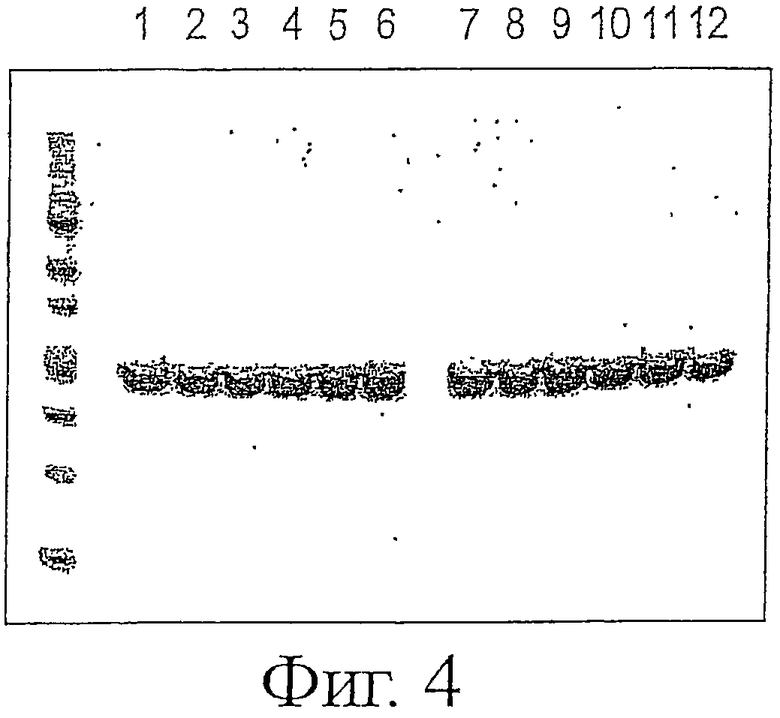


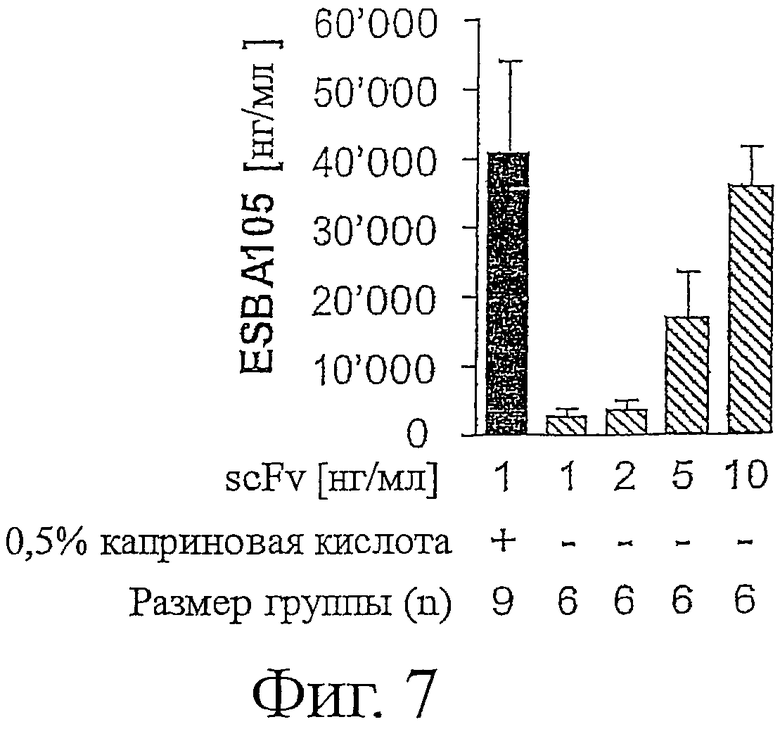

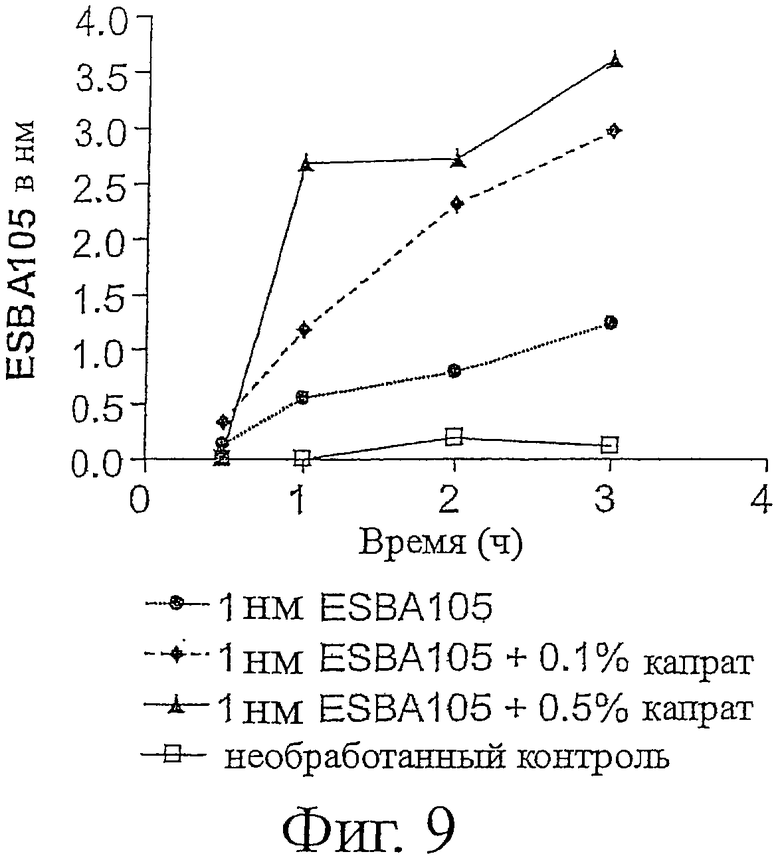
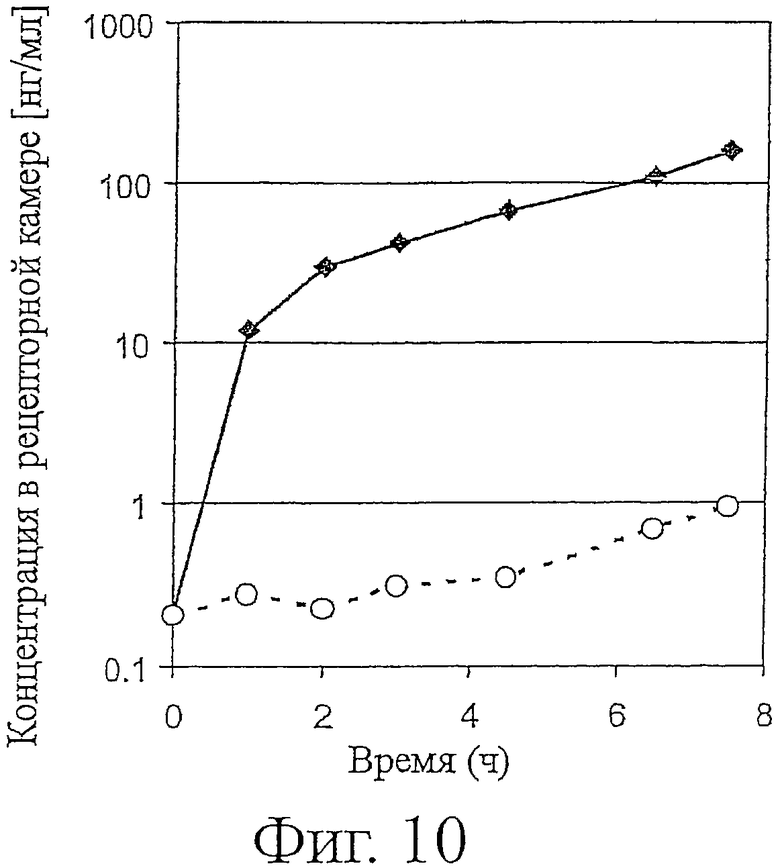
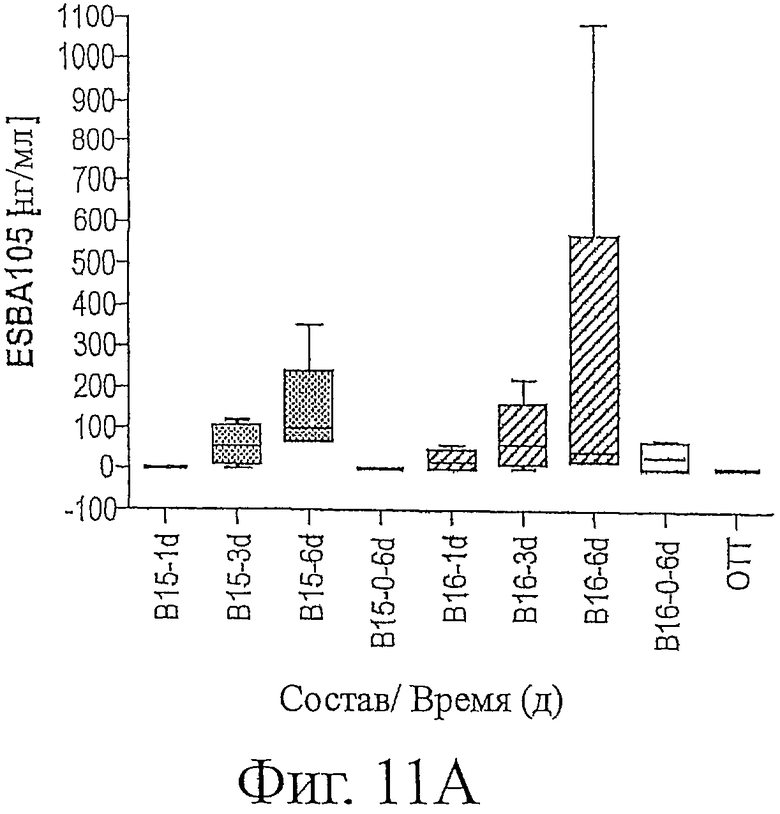
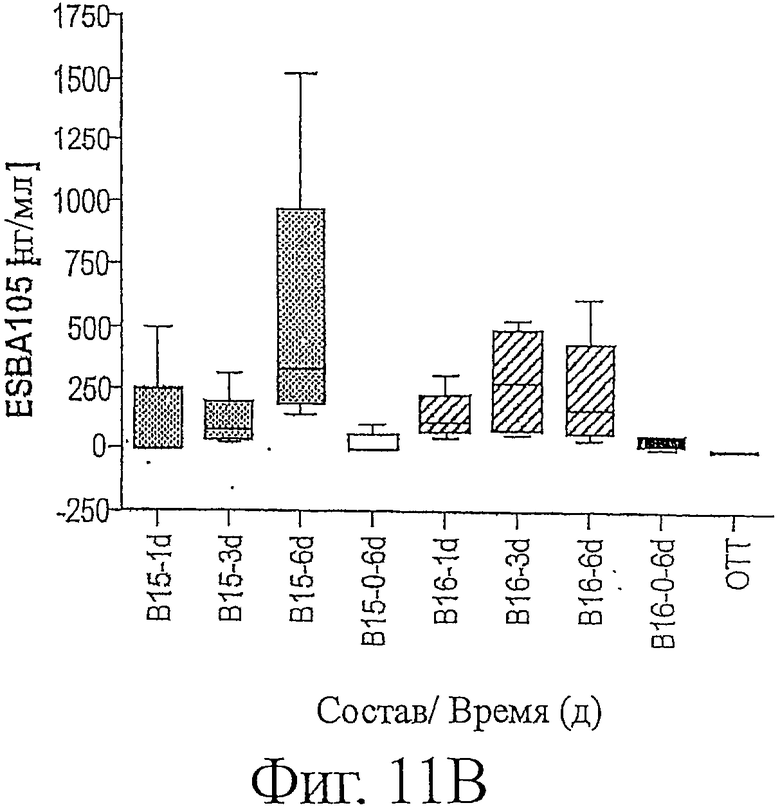
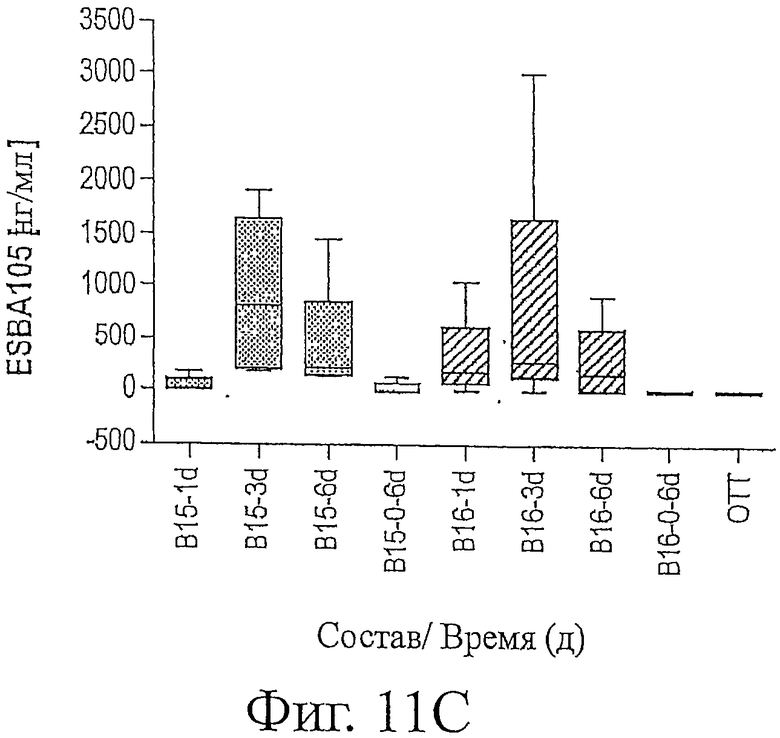




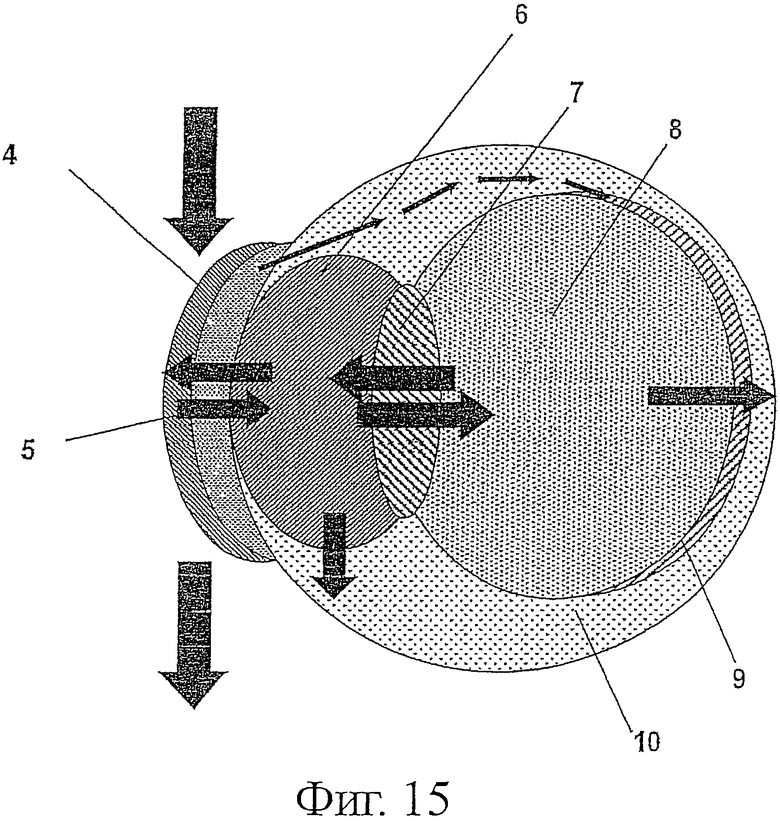
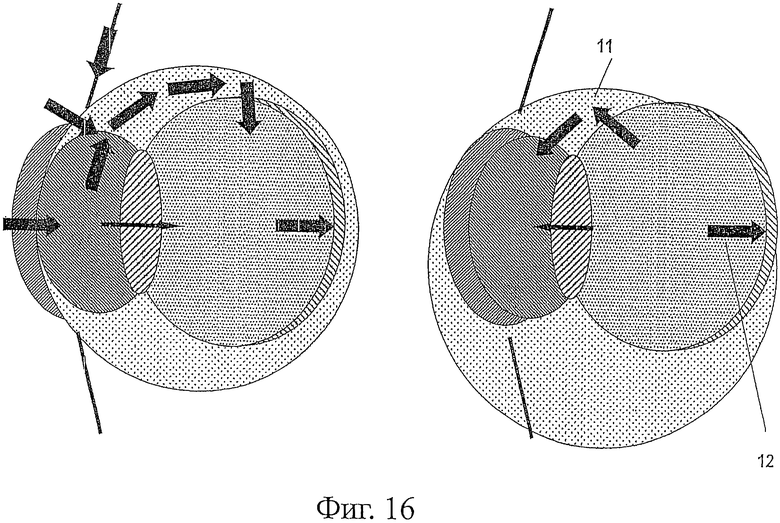







Изобретение касается фармацевтической композиции для локального нанесения на поверхность барьера эпителиальной ткани, содержащей растворимый, антигенсвязывающий полипептид, и фармацевтически приемлемый носитель, разбавитель или эксципиент. При этом указанный полипептид способен проходить, по меньшей мере, через один или несколько эпителиальных барьеров менее чем за 8 часов в отсутствие усилителя проникновения. Антигенсвязывающий полипептид в составе указанной фармацевтической композиции представляет собой одноцепочечное антитело, содержащее последовательность SEQ.ID: 12, SEQ.ID: 13, SEQ.ID: 18, SEQ.ID: 19, SEQ.ID: 20 или SEQ.ID: 21. Использование изобретения имеет ряд преимуществ в сравнении с инъекцией и другими способами введения: удобство доставки, а также уменьшение или элиминирование проблем соблюдения пациентом режима и схемы лечения и побочных действий, которые сопутствуют доставке посредством инъекции. 20 з.п. ф-лы, 28 ил., 3 табл., 10 пр.
1. Фармацевтическая композиция, составленная для локального нанесения на поверхность барьера эпителиальной ткани, содержащая растворимый, антигенсвязывающий полипептид, и фармацевтически приемлемый носитель, разбавитель или эксципиент, причем в которой указанный полипептид способен проходить, по меньшей мере, через один или несколько эпителиальных барьеров менее чем за 8 часов в отсутствие усилителя проникновения и в которой указанный антигенсвязывающий полипептид представляет собой одноцепочечное антитело, содержащее последовательность SEQ.ID: 12, SEQ.ID: 13, SEQ.ID: 18, SEQ.ID: 19, SEQ.ID: 20 или SEQ.ID: 21.
2. Фармацевтическая композиция по п.1, где указанным тканевым барьером является поверхность глаза, полости носа, полости рта, кишечного тракта, кожи, слизистой оболочки рта и мочеполовых путей, суставов и полостей суставов, головного мозга и позвоночника.
3. Фармацевтическая композиция по п.1, которая предназначена для местного нанесения в глаз.
4. Фармацевтическая композиция по п.3, составленная для достижения внутриглазной концентрации антигенсвязывающего полипептида, по меньшей мере, 100 нг/мл.
5. Фармацевтическая композиция по п.3, где антигенсвязывающий полипептид составлен для местного нанесения в глаз и способен проходить через роговицу и во внутриглазное пространство в отсутствие усилителя проникновения.
6. Фармацевтическая композиция по п.3, которая находится в форме глазных капель.
7. Фармацевтическая композиция по п.3, которая имеет рН менее 8.
8. Фармацевтическая композиция по п.1, где полипептид является достаточно растворимым для прохождения через один или несколько эпителиальных слоев менее чем приблизительно за 4 часа.
9. Фармацевтическая композиция по п.1, которая дополнительно содержит один или несколько усиливающих проникновение агентов.
10. Фармацевтическая композиция по п.9, где усиливающий проникновение агент выбран из группы, состоящей из Azone, хлорида бензалкония (BzCl), BL-7, BL-9, 15 Brij 35, Brij 78, Brij 98, Brij 99, Полиоксиэтилен-полиоксипропилена 1800, капрата натрия, каприловой кислоты, хлорида цетилпиридиния, хлоргексидина, холата, касторового масла, кукурузного масла, кремофора-EL, DMSO, бромида декаметония, дезоксихолата, декстрансульфата, ЭДТА, динатриевой соли ЭДТА, этанола, фузидата, гликохолата, лаурилсульфата, L-α-лизофосфатидилхолина, N-лауроилсаркозина, NMP, олеиновой кислоты, фосфолипидов, поли-20-оксиэтилен-9-лаурилового эфира, сапонина, Твина 20, Твина 40, Твина 60, Твина 80, таурохолата и тауродезоксихолата, в частности капрата натрия.
11. Фармацевтическая композиция по п.1, где этот полипептид имеет аффинность связывания в отношении антигена-мишени KD, по меньшей мере, 10-6 М или ниже.
12. Фармацевтическая композиция по п.1, содержащая антигенсвязывающий полипептид в концентрации, большей чем 2,0 мг/мл, или большей чем 2,5 мг/мл, предпочтительно большей чем 5 мг/мл, гораздо более предпочтительно большей чем 10 мг/мл.
13. Фармацевтическая композиция по п.1, где антигенсвязывающий полипептид достигает терапевтической концентрации, большей чем приблизительно 100 нг/мл.
14. Фармацевтическая композиция по п.1, где антигенсвязывающий полипептид является стабильным при температуре от -80°С до 37°С.
15. Фармацевтическая композиция по п.1, где антигенсвязывающий полипептид остается стабильным в течение, по меньшей мере, восьми недель.
16. Фармацевтическая композиция по п.1, где антигенсвязывающий полипептид остается стабильным в течение, по меньшей мере, шести недель при 4°С.
17. Фармацевтическая композиция п.1, где антигенсвязывающий полипептид остается стабильным в течение 1 месяца, предпочтительно, по меньшей мере, двух месяцев, наиболее предпочтительно, по меньшей мере, шести месяцев при 20°С-40°С, предпочтительно при 37°С в ЗФР.
18. Фармацевтическая композиция по п.1, где полипептид остается в мономерной форме при физиологических условиях.
19. Фармацевтическая композиция по п.1, где антигенсвязывающий полипептид является растворимым при температуре окружающей среды в ЗФР при концентрациях, больших чем 1 мг/мл, предпочтительно больших чем 4 мг/мл, более предпочтительно больших чем 10 мг/мл, даже более предпочтительно больших чем 25 мг/мл или наиболее предпочтительно больших чем 50 мг/мл.
20. Фармацевтическая композиция по п.1, где антигенсвязывающий полипептид обнаруживает среднюю точку перехода при титровании гидрохлоридом гуанидиния, по меньшей мере, 1,5 М, предпочтительно, по меньшей мере, 1,75 М, более предпочтительно, по меньшей мере, 1,9 М или наиболее предпочтительно, по меньшей мере, 2 М.
21. Фармацевтическая композиция по п.1, где эксципиент выбран из группы, включающей хлорид бензалкония, Твин 20, Твин 40, Твин 60, Твин 80 и хлоргексидин.
| WO03097697 A2, 27.11.2003 | |||
| Способ устройства вентиляционных каналов в кучах фрезерного торфа | 1933 |
|
SU40262A1 |
| Печь к аппаратам для выращивания монокристаллов тугоплавких веществ | 1961 |
|
SU148017A1 |
| THIEL M.A | |||
| et | |||
| al | |||
| Penetration of engineered antibody fragments into the eye, Clin Exp Immunol | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| BRERETON H.M | |||
| et | |||
| al | |||
| Influence of format on in vitro penetration of antibody fragments through porcine cornea, Br J Ophthalmol | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ПЛАНЕР - ОРНИТОПТЕР | 1920 |
|
SU1205A1 |
Авторы
Даты
2015-10-20—Публикация
2011-06-24—Подача