Область техники, к которой относится изобретение
Настоящее изобретение относится к применению антисекреторных белков, их производных, гомологов и/или фрагментов, обладающих эквивалентной функциональной активностью, и/или их фармацевтически активной соли, для получения фармацевтической композиции для лечения и/или профилактики структурной дезорганизации и дисфункции липидных рафтов и/или кавеол в клеточных мембранах, а также связывающих белков, рецепторов, нейротрансмиттеров, ионных каналов, водных каналов, цитоскелета и систем G-белков, связанных с липидными рафтами и кавеолами, включая поглощение и выделение соединений. Фармацевтическую композицию в настоящем изобретении используют для контроля и/или улучшения структуры, распределения и многочисленных функций липидных рафтов, рецепторов и/или кавеол в мембранах. Примерами такого положительного воздействия могут быть нейтрализация патологической функции, такой как гипо- или гиперфункция, восстановление и/или нормализация липидных рафтов, рецепторов и/или кавеол структурно и функционально, улучшение выживания и/или восстановления при заболеваниях, повреждениях, процессах восстановления и других дисфункциях. Кроме того, настоящее изобретение относится к применению указанной фармацевтической композиции для контролирования внутриклеточного транспорта и высвобождения клеточных продуктов, а также для нормализации распределения компонентов ткани.
Уровень техники настоящего изобретения
Липидные рафты представляют собой динамические гетерогенные микродомены, образующие специфические области в клеточных мембранах и богатые холестерином и гликолипидами, особенно сфинголипидами, такими как GM1 (Ross & Pawlina, 2006; Pollard & Earnshaw, 2002). Одним из вариантов их обнаружения in vitro является получение нерастворимого остатка после экстракции детергентом Triton X-100, используемого в разбавленном виде при низкой температуре. Такую мембранную фракцию, устойчивую к действию детергента, восстанавливают как полосу низкой плотности, выделяемую при помощи градиента флотации. Распространенность липидных рафтов уменьшают путем уменьшения количества или дезорганизации холестерина в клеточных мембранах. Липидные рафты тесно связаны и соединены с цитоскелетом и участвуют в клеточной поляризации. Они образуют специфические микродомены, преобладающие в мембранах клеток и тканях в любом возрасте, например, у эмбрионов, зародышей, а также у молодых, взрослых и пожилых индивидов.
Липидные рафты богаты белками, имеющими существенное значение для когезии и передачи сигнала, такими как рецепторы, белки связывания клеток, ионные переносчики и комплексы ионных каналов, включая, например, аквапорины, а также рецепторы хемокинов, рецепторы нейротрансмиттеров, рецепторы гормонов и рецепторы факторов роста. Указанные белки и белковые комплексы взаимодействуют с внутриклеточными системами G-белков, которые передают сигнал, полученный, например, рецепторами, в цитоплазму и ядро клетки (Dermine et al., 2001; Ross & Pawlina, 2006; Pollard & Earnshaw, 2002; Helms & Zurzolo, 2004; Chini & Parenti, 2004; Head et al., 2006; Mahmutefendic et al., 2007). Было показано, что распределение и концентрация ключевого для контролирования активности клеток иона, Ca2+, тесно связаны с липидными рафтами и кавеолами. Дополнительные белки, такие как коннексины, CD38, CD19, Thy-1 и CD59, залкорены в липидных рафтах, обычно посредством белков и рецепторов, связанных с гликозилфосфатидилинозитолом (GPI), которые позволяют им взаимодействовать с клеточными функциями. Сфинголипиды, примером которых является ганглиозид GM1, являются мишенью холерной интеротоксина и широко представлены в липидных рафтах, являясь их характерным признаком. Кроме того, рецепторы нейротрансмиттеров и другие компоненты синапсов и нейронных процессов, а также рецепторы факторов роста относятся к большому количеству белков, преобладающих в липидных рафтах, например, в таких высокоспециализированных клетках, как нейроны. Кальциевые каналы и переносчики, играющие важную роль в регуляции клеточных функций и взаимодействий, в значительной степени присутствуют в липидных рафтах (A Spät, 2007). В качестве примера можно привести тот факт, что разрушение липидных рафтов затрудняет или даже исключает способность клетки пропускать перемещение волн Ca2+ в клетках. Более того, всплески ионов кальция значительно влияют на ключевые функции нормальных клеток и в патологически измененных клетках, например, на клеточное деление, клеточное выживание и клеточную смерть.
Кроме того, было сделано предположение, что липидные рафты играют ключевую роль во внутриклеточном переносе белка, активности рецепторов и липидов. Сигналы и воздействия всех указанных принимающих и передающих белков передаются внутрь клеток посредством систем G-связанных белков, с помощью ферментных систем или участием цитоскелета (Triantafilou & Triantafilou, 2004). Например, известно, что физическое состояние липидных рафтов способствует локализации и ограничению подвижности множества белков, что облегчает функциональное образование соответствующих сигнальных комплексов.
Более того, было сделано предположение, что липидные рафты обладают способностью регулировать активацию, передачу сигнала и перестройку цитоскелета, что делает их чрезвычайно важными для механизмов, управляющих клеточной локолюцией, включая направленную миграцию, а также для поддержания формы и размера клеток и связанного с ними транспорта. Цитоскелет, кроме того, имеет важное значение для внутриклеточного переноса компонентов клетки и для восприятия динамической и статической нагрузки на клетку.
Липидные рафты, таким образом, представляют собой динамические структуры, как правило, диаметром порядка 5-50 нм, имеющим значительный диапазон изменений. Существует множество способов определения липидных рафтов, например, иммуногистохимическое или иммунохимическое выявление GM1, который обладает очень высокой аффинностью к холерному интеротоксину. Другим путем обнаружения и определения их местоположения является выделение клеточных мембран после разрушения клеток и последующее выделение устойчивой к детергенту фракции при определенной температуре, как описано в доступных руководствах по клеточной биологии. Для иммуногистохимической идентификации липидных рафтов можно использовать флотиллин, кавеолин и reggie. Из указанных белков флотиллин в дальнейшем может связываться с липидными каплями. Технологии визуализации липидных рафтов дополняют атомно-силовую микроскопию и аналогичные способы. Воздействие на клетки циклодекстрина и его вариантов, вызывающее удаление холестерина из мембран, представляет собой альтернативный способ обнаружения существования липидных рафтов.
Кавеолы образуют особый тип липидных рафтов, так как являются динамическими структурами, характеризующимися фокальным повышением содержания холестерина и сфинголипидов в мембранах, и передачей сигналов из окружающей среды во внутреннюю часть клеток, а также соединением с цитоскелетом. В отличие от других липидных рафтов, размер кавеол больше, и, как правило, они имеют вид ямок или впячиваний в форме колбы в клеточных мембранах и вид пузырьков (Kurzchalia & Parton, 1999). Их размер обычно имеет порядок 0,1 мкм, но значительно варьирует. Кавеолы распространены, например, в сердечных и гладкомышечных клетках, эндотелиальных клетках, макрофагах и адипоцитах, т.е. практически во всех клетках млекопитающих, хотя со значительными изменениями концентрации.
Было описано, что липидные рафты и кавеолы содержат систему генерации NO (оксид азота) и воздействуют на нее. Кроме передачи сигналов внутрь клетки и извне, кавеолы принимают участие в переносе жидкости и различных веществ внутрь и из клеток, в эндоцитозе и регуляции, транспорте, оттоке и сохранении жирных кислот и холестерина в клетках и их окружении (Pohl et al., 2004; Rajendran et al., 2007). Компоненты кавеол и липидные рафты, кроме того, участвуют в процессинге белка-предшественника β-амилоида (βAPP) и β-амилоида (Aβ), белков, связанных в первую очередь с болезнью Альцгеймера, но также и с другими нейродегенеративными заболеваниями и травмами нервной системы (Graham & Lantos, 2002).
Известно, что опухолевые клетки содержат липидные рафты, а также кавеолы. Поэтому возможно, например, ослабить рост и миграцию опухолевых клеток путем разрушения или дезинтегрирования в различной степени данных структур (Marquez, D. C. et al., 2006; Freeman et al., 2007).
Значение липидных рафтов и кавеол было дополнительно исследовано на генетически модифицированных животных. Нокаутированные мыши, дефицитные по кавеолину, страдают дилятационной кардиомиопатией и легочной гипертензией (Mathew et al., 2004). Более того, липидные рафты и кавеолы связаны с транспортными системами, стимулируемыми инсулином, такими как системы транспорта стероидных гормонов.
Был сделан вывод, что липидные рафты и кавеолы, образующие высокодинамические структуры, являются близкородственными, но в некоторых аспектах различаются, преимущественно по распространению в клетках млекопитающих, и выполняют множество важных функций. Способы, доступные к настоящему времени, позволяют разрушать или уменьшать липидные рафты и кавеолы, но способы восстановления и/или нормализации структуры, распределения, концентрации и/или функции липидных рафтов и сигнальных и переносящих массу белков, составляющих липидный рафт, не известны.
Антисекреторный белок представляет собой белок весом 41 кДа, который, как первоначально описано, обеспечивает защиту от диареи и воспаления кишечника (обзор представлен Lange и Lόnnroth, 2001). Антисекреторный белок был сиквенирован, а его кДНК клонирована. По-видимому, аналогичную активность проявляет главным образом пептид, расположенный между положениями 35 и 50 в последовательности антисекреторного белка. Иммунохимические и иммуногистохимические исследования показали, что антисекреторный белок присутствует и может также быть синтезирован большинством тканей и органов в организме. Были описаны синтетические пептиды, содержащие противодиарейную последовательность (WO 97/08202; WO 05/030246). До этого было описано, что антисекреторные факторы нормализуют патологический транспорт жидкости и/или воспалительные реакции, происходящие, например, в кишечнике и хороидном сплетении центральной нервной системы после введения холерного интеротоксина (WO 97/08202). Таким образом, в WO 97/08202 было сделано предположение, что использование натуральных антисекреторных факторов в питании и кормлении эффективно для лечения отечности, диареи, обезвоживания и воспаления. В WO 98/21978 описано применение продуктов, обладающих ферментативной активностью, для получения продуктов питания, которые вызывают образование антисекреторных белков. В WO 00/038535, кроме того, описаны продукты питания, обогащенные антисекреторными белками как таковыми.
Также было показано, что антисекреторный белок и его фрагменты улучшают восстановление нервной ткани и пролиферацию, апоптоз, дифференциацию и/или миграцию стволовых клеток и клеток-предшественников и клеток, происходящих от них, при лечении состояний, связанных с потерей и/или увеличением клеток (WO 05/030246).
Антисекреторные факторы (AF), особенно белки и пептиды, как подробно описано в WO 97/08202, эффективны для ликвидации гиперсекреторных состояний и заболеваний кишечника, таких как диарея. Другими примерами, связанными с воздействием AF в отношении гиперсекреторных состояний, являются, например, воспалительные заболевания кишечника, отек мозга, глаукома, повышенное внутричерепное давление, синдром Миньера и мастит. Также рассматривалось использование AF для лечения глаукомы (WO 97/08202).
Недавно было обнаружено, что структуру, преобладание, распределение и функцию липидных рафтов, которые были изменены в результате нарушения клеточной функции, избыточного или патологического воздействия, инфекции или токсичных соединений или лекарственных средств, можно контролировать и даже нормализовать благодаря определенным специфическим белкам и родственным соединениям.
Удивительно, что авторы изобретения смогли доказать, что белок-антисекреторный фактор (AF) и его производные пептиды, например, AF-16 и AF-8, могут влиять на структуру, преобладание, распределение и/или функцию липидных рафтов, рецепторов и/или кавеол, которые были изменены из-за патологической клеточной функции, избыточного или неправильного воздействия, инфекции или токсичных соединений или лекарственных средств, в клетках, тканях и/или органах, и, таким образом, впервые стало возможным контролировать и/или даже нормализовать функции липидных рафтов и кавеол или связанные с ними.
Сущность настоящего изобретения
Настоящее изобретение относится к применению фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий антисекреторной и/или эквивалентной по функциональности и/или аналогичной активностью, или его фармацевтически активную соль, для получения фармацевтической композиции для лечения и/или профилактики дисфункции липидных рафтов, рецепторов и/или кавеол в клеточных мембранах, такой как нарушенная, недостаточная, гипо- или гиперфункция.
Настоящее изобретение также относится к применению фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий эквивалентной и/или аналогичной активностью, или его фармацевтически активную соль, для получения фармацевтической композиции для лечения и/или профилактики различных состояний, связанных с дисфункцией липидных рафтов, рецепторов и/или кавеол, таких как любое состояние, выбранное из группы, состоящей из сосудистой дисфункции, сердечно-сосудистой дисфункции, легочной дисфункции, гиперплазии и/или гипертрофии клеток и ткани, сердечно-сосудистой дисфункции, кардиомиопатии и легочной гипертензии, образования рубцовой ткани, реактивного образования избыточной ткани и сахарного диабета, такого как диабет I и/или II типа.
Также настоящее изобретение относится к применению фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, или его фармацевтически активную соль, для получения фармацевтической композиции для лечения и/или профилактики различных состояний, связанных с дисфункцией липидных рафтов и/или кавеол, при которых указанная фармацевтическая композиция будет эффективно воздействовать, например, на перенос компонентов через клеточные барьеры, восстановление тканей и органов, реактивное образование избыточной ткани и/или восстановление и регенерацию эпителиального клеточного покрытия.
В другом аспекте настоящее изобретение относится к применению фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий эквивалентной функциональной активностью, или его фармацевтически активную соль для получения фармацевтической композиции для лечения и/или профилактики различных состояний, связанных с дисфункцией липидных рафтов и/или кавеол, выбиранных из группы, состоящей из болезней Альцгеймера, любых других нейродегенеративных нарушений и травмы нервной системы.
В предпочтительном варианте осуществления указанный антисекреторный белок состоит из последовательности следующей формулы:
X1-V-C-X2-X3-K-X4-R-X5,
где X1 представляет собой I, аминокислоты 1-35 последовательности SEQ ID NO:6 или отсутствует, X2 представляет собой H, R или K, X3 представляет собой S или L, X4 представляет собой T или A, X5 представляет собой аминокислоты 43-46, 43-51, 43-80 или 43-163 последовательности SEQ ID NO:6 или отсутствует.
Кроме того, настоящее изобретение относится к способу лечения и/или профилактики заболевания, связанного с дисфункцией липидных рафтов, рецепторов и/или кавеол, такой как указано выше, причем указанный способ включает в себя введение млекопитающему, при необходимости, терапевтически эффективного количества фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль.
Настоящее изобретение также относится к различным дозам и способам введения, подходящим для намеченной цели лечения, а также с учетом возраста, пола, состояния пациента и т.д.
Кроме того, указанная фармацевтическая композиция может, безусловно, содержать два или более антисекреторных белка, а также, кроме того, содержать фармацевтически приемлемый эксципиент. Фармацевтическая композиция по настоящему изобретению предназначена для внутриглазного, интраназального, перорального введения, местного применения, подкожного и/или системного введения и может, например, быть получена для использования в качестве спрея, аэрозоля и ингалятора или распылителя. При получении композиции для системного введения в кровь указанную композицию предпочтительно получают в дозировке от 0,1 мкг до 10 мг на прием на кг веса тела в день, например, в дозировке от 0,1 мкг до 1 мг на прием на кг веса тела в день, более предпочтительно, 1-500 мкг на прием на кг веса тела в день, например, 1-50 мкг на прием на кг веса тела в день. Такое введение можно осуществлять либо в виде единичной дозы, либо в виде многократных ежедневных введений.
Как правило, настоящее изобретение относится к применению антисекреторного белка, его гомолога, производного и/или фрагмента, обладающего эквивалентной активностью, или его фармацевтически активной соли для получения фармацевтической композиции для лечения и/или профилактики различных состояний, связанных с дисфункцией липидных рафтов и/или кавеол. В предпочтительном варианте осуществления указанная композиция может использоваться для контроля и нормализации структуры, распределения и функции кавеол и липидных рафтов, т.е. специализированных микродоменов, например, для восстановления их структурно и функционально, улучшения выживаемости и восстановления при заболеваниях, повреждениях, процессах восстановления и других нарушениях. Кроме того, настоящее изобретение позволяет контролировать внутриклеточный транспорт и высвобождение клеточных продуктов, а также нормализовать распределение компонентов ткани при различных заболеваниях и/или контролировать образование реактивных клеток и тканей, а также уменьшать образование рубцовой ткани, включая патологические соединения тканей и органов. Более того, указанная композиция также может использоваться для возможного лечения последствий воздействий токсических веществ и контроля их долговременных эффектов. В предпочтительном варианте осуществления такое состояние выбрано из группы, состоящей из травмы, интоксикации, инфекции, мальформации, дегенерации и других нарушений или заболеваний клеток, тканей и органов в организме млекопитающего.
Не имея цели ограничить объем настоящего изобретения конкретной теорией, можно предположить, что композиция по настоящему изобретению, содержащая антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль, может оказывать влияние посредством эффективного воздействия на нормализацию структуры, распределения и/или функции кавеол и/или липидных рафтов в клеточных мембранах.
Описание фигуры
На фиг.1 показана разность потенциалов клеточной мембраны в клетках с дефектным рецептором GABA. Добавляли гистамин или AF-16 и измеряли воздействие этих соединений на потенциал клеточной мембраны, измеренный в I/I0.
Определения и сокращения
Сокращения
КД: кровяное давление; СМЖ: спинномозговая жидкость; ЦНС: центральная нервная система, т.е. головной мозг и спинной мозг; ДИЖ: давление интерстициальной жидкости; ЛГ: легочная гипертензия; ФСБ: фосфатно-солевой буфер; AF: антисекреторный фактор, AF-16: пептид, состоящий из аминокислот VCHSKTRSNPENNVGL; октапептид IVCHSKTR; септапептид VCHSKTR; гексапептид CHSKTR; пентапептид HSKTR.
Определения
Белки представляют собой биологические макромолекулы, состоящие из аминокислотных остатков, соединенных вместе пептидными связями. Белки в виде линейных полимеров аминокислот также называют полипептидами. Обычно белки состоят из 50-800 аминокислотных остатков и, следовательно, имеют молекулярный вес в диапазоне от приблизительно 6000 до приблизительно нескольких сотен тысяч Дальтон или более. Небольшие белки называют пептидами или олигопептидами. В контексте настоящего изобретения термины "белок" и "пептид" можно использовать взаимозаменяемо.
"Фармацевтическая композиция" в контексте настоящего изобретения обозначает композицию, содержащую терапевтически активное количество антисекреторного белка, необязательно, в комбинации с фармацевтически активным эксципиентом, таким как носитель или наполнитель. Указанную фармацевтическую композицию получают для соответствующего способа введения, который может быть различным в зависимости от состояния пациента, а также от других факторов, таких как возраст или предпочитаемый выбор. Фармацевтическая композиция, содержащая антисекреторный белок, служит в качестве системы доставки препарата. Фармацевтическая композиция после введения обеспечивает поступление активного вещества в организм человека или животного. Указанная фармацевтическая композиция может быть в форме, например, таблеток, драже, пастилок, капсул, ректальных драже, гелей, растворов и т.д., но ими не ограничена.
Термин "фармацевтически активная соль" обозначает соль антисекреторного белка, которая может представлять собой любую его соль, на основании, так называемых, последовательностей Хофмейстера. Другие примеры фармацевтически активных солей включают трифторацетат, ацетат и лизинхлорид, но настоящее изобретение ими не ограничено.
Термин "антисекреторный" обозначает в настоящем контексте ингибирование или уменьшение секреции, особенно интестинальных секретов. Следовательно, термин "антисекреторный белок" обозначает белок, способный ингибировать или уменьшать секрецию в организме.
"Лечебное питание" в контексте настоящего изобретения обозначает питание, которое было получено вместе с композицией с антисекреторным белком. Указанное питание может представлять собой любое подходящее питание в жидкой или твердой форме, такое как жидкость или порошок, или любой другой подходящий пищевой продукт. Примеры таких продуктов можно найти в WO 0038535. Указанный компонент может также вызывать захват, образование и высвобождение антисекреторного белка.
В контексте настоящего изобретения "антисекреторный белок" или его гомолог, производное или фрагмент могут использоваться взаимозаменяемо с термином "антисекреторные факторы" или "белок-антисекреторный фактор", как определено в патенте WO 97/08202, и обозначают антисекреторный белок, или пептид, или его гомолог, производное и/или фрагмент, обладающий антисекреторной и/или эквивалентной функциональной и/или аналогичной активностью. Таким образом, следует понимать, что "антисекреторный фактор", "белок-антисекреторный фактор", "антисекреторный пептид", "антисекреторный фрагмент" или "антисекреторный белок" в контексте настоящего изобретения также могут обозначать их производное, гомолог или фрагмент. Все указанные термины в контексте настоящего изобретения могут применяться взаимозаменяемо. К тому же в контексте настоящего изобретения термин "антисекреторный фактор" может быть сокращен как "AF". Антисекреторный белок в контексте настоящего изобретения также обозначает белок с антисекреторными свойствами, как было определено ранее в WO97/08202 и WO 00/38535. Антисекреторные факторы были также описаны, например, в WO 05/030246. Также термином антисекреторный фактор обозначают яичный желток, обогащенный антисекреторными факторами, как описано в SE 900028-2 и WO 00/38535 и дополнительно описано ниже.
"Ингалятор" в контексте настоящего изобретения обозначает медицинское устройство, которое доставляет жидкий медикамент в форме аэрозоля в дыхательные пути. Компрессоры "ингалятора" прогоняют воздух через трубку в медицинскую чашку, заполненную жидким медикаментом. Сила воздуха разбивает жидкость на мельчайшие частицы в виде аэрозоля, которые можно глубоко вдохнуть в дыхательные пути.
Термин "аэрозоль" в контексте настоящего изобретения обозначает газообразную суспензию мелких твердых или жидких частиц.
Подробное описание изобретения
Существует необходимость в новых лекарственных средствах, предназначенных для фармакологического лечения заболеваний, связанных с дисфункцией липидных рафтов и/или кавеол, так как в настоящее время адекватная терапия отсутствует. Антисекреторные белки обладают эффективным воздействием, что подтверждается примерами далее.
Настоящее изобретение относится к контролю и регулированию структуры и функции липидных рафтов и кавеол родственной структуры, широко представленных в клеточных мембранах. Под липидными рафтами понимают мембранные микродомены, богатые холестерином, в которых заключены белки, например, сфинголипиды, такие как GM1, важные для транспорта ионов, связывания клеток, роста, передачи сигналов и связывания с цитоскелетом. Кавеолы представляют собой везикулярные или структуры в форме колбы, представленные в клетках, например, сердечно-легочной и сосудистой систем, включая эндотелиальные клетки, гладкомышечные клетки, эпителиальные клетки, фибробласты и кардиомиоциты (Chan and Ye, 2007; Petersen et al., 2007), образуемые одним или несколькими кластерами компонентов липидного рафта. Другими белками, связанными либо по отдельности, либо в комбинациях, являются флотиллин, кавеолин и реджи (reggie); существует несколько вариантов каждого из них.
Кавеолы превалируют, например, в сердечных и гладкомышечных клетках, эндотелиальных клетках, макрофагах и адипоцитах, и являются особым типом липидных рафтов, представляя собой динамические структуры, отличающиеся локальным повышением содержания в мембранах холестерина и сфинголипидов, передачей сигналов из окружающей среды во внутреннюю область клеток, а также связью с цитоскелетом. В отличие от других липидных рафтов, размер кавеол больше, и, как правило, они имеют вид ямок или впячиваний в форме колбы в клеточных мембранах и вид пузырьков. Их размер обычно находится в порядке 0,1 мкм, но имеет значительные вариации. Более того, связанные с гликозилфосфатидилинозитолом белки и их варианты образуют якорные белки, присоединенные к указанным структурам и взаимодействующие с ними. Также было обнаружено, что ферменты, опосредующие функции сосудов, локализованы в названных структурах. Указанные динамические составляющие мембран связаны с внутренней частью клетки посредством систем G-белков и ферментных систем, а также посредством цитоскелета, таким образом позволяя этим структурам влиять на клеточные функции и регулировать их. Таким образом, было обнаружено, что липидные рафты и кавеолы особенно важны для структуры и функции клеток. Не известно способов, делающих возможным контролирование, стабилизацию и нормализацию таких мембранных структур, включая сигнальные и переносящие массу белки.
Настоящее изобретение относится к применению фармацевтической композиции, содержащей антисекреторный белок, его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, или его фармацевтически активную соль, для производства фармацевтической композиции и/или лечебного питания для лечения и/или профилактики дисфункции липидных рафтов и кавеол в клеточных мембранах. Настоящее изобретение также относится к лечению и/или профилактики различных состояний, связанных с дисфункцией липидных рафтов и кавеол, таких как перенос компонентов сквозь клеточные барьеры, восстановление тканей и органов, гиперплазия и/или гипертрофия клеток и ткани, сердечно-сосудистая функция, образование рубцовой ткани, реактивное образование избыточной ткани и восстановление и регенерация эпителиального клеточного покрытия.
Также настоящее изобретение относится к способу лечения и/или нормализации дисфункций липидных рафтов и кавеол, как указано выше, причем указанный способ включает введение млекопитающему, при необходимости, терапевтически эффективного количества фармацевтической композиции и/или лечебного питания, содержащих антисекреторный белок или его производное, гомолог, или фрагмент, обладающий эквивалентной активностью, или его фармацевтически активную соль.
Настоящее изобретение также относится к различным дозам и способам использования, подходящим для намеченной цели, а также с учетом возраста, пола, состояния пациента и тому подобное.
Лечение в соответствии с настоящим изобретением, вероятно, является наиболее эффективным для пациентов с повышенным риском развития или страдающих от дисфункции липидных рафтов и кавеол, или от захвата или высвобождения патогенных веществ. Кроме того, такое лечение эффективно также при других состояниях, которые отличаются патологическим метаболизмом клеток и компонентов внеклеточного матрикса.
Обнаруженное доказательство того, что антисекреторные белки и пептиды, вероятно, оказывают воздействие на липидные рафты в клеточных мембранах, безусловно, является неожиданным для специалистов в данной области. Существует большое количество доменов со средним размером намного меньше мкм, названных липидными рафтами, характеризующихся высокой концентрацией холестерина и сфингомиелина. Липидные рафты содержат различные интегральные и периферические мембранные белки, участвующие в переносе массы и клеточной сигнализации. Такие сигнальные платформы плавают в мембране и несут необходимые элементы для соответствующих функций, как, например, рецепторы, факторы сопряжения, эффекторы ферментов и соединений и субстраты, посредством чего возможно получение и передача определенных ионов, молекул и сигналов. Эти домены также взаимодействуют, например, с цитоскелетом и, кроме того, влияют на состав и метаболизм интерстициальной жидкости, а также на ее давление. Более того, липидные рафты связаны с метаболизмом кавеол, а также с высвобождением и интернализацией, например, вирусов. В клеточных мембранах наблюдается образование кластеров рецепторов факторов роста, рецепторов воспалительного сигнала, ионных каналов и переносчиков в липидных рафтах, которые претерпевают динамические изменения, связанные с функцией, преобладающей в данный момент.
Применение антисекреторных белков и пептидов (AF) не ограничено тканями, органами и анатомическими структурами, описанными в примерах, но включает в себя дополнительные симптомы и заболевания, характеризуемые дисфункцией, патологической функцией, гипо- или гиперфункцией липидных рафтов и/или кавеол.
Антисекреторные белки, пептиды, производные и гомологи обладают способностью контролировать и даже нормализовывать функции липидных рафтов и белков, участвующих в переносе веществ и клеточной сигнализации. Очень широкий диапазон применяемых эффективных схем дозирования указывает на то, что риск побочных эффектов и неожиданных осложнений является минимальным. Таким образом, используемый способ осуществления наблюдения и контроля за структурами и функциями, связанными с липидными рафтами и кавеолами, делает возможным лечение избыточного воздействия на клетки и ткани, а также позволяет лечить пациента, применяя широкий диапазон доз, с учетом индивидуальной реакции и тяжести заболевания и/или недомогания.
Фармацевтическая композиция по настоящему изобретению может в соответствии с одним из аспектов вводиться местно, локально in situ, перорально, в нос, подкожно и/или системно через кровеносные сосуды или через дыхательные пути.
Антисекреторные факторы представляют собой природный класс белков организма. Белок-антисекреторный фактор человека представляет собой белок весом 41 кДа, содержащий 382 аминокислоты, при выделении его из гипофиза. Активный сайт в отношении благоприятного воздействия на нормализацию липидных рафтов и/или контролирование кавеол по настоящему изобретению можно обнаружить в сайте белка, прилегающем к N-концу белка, расположенного от 1 до 163 аминокислоты в последовательности SEQ ID NO:6 или в фрагменте этого участка.
Авторы настоящего изобретения показали, что антисекреторный фактор до некоторой степени гомологичен белку S5a, также называемому Rpn 10, который образует субъединицу компонента, широко распространенного во всех клетках, протеасомы 26 S, более конкретно в 19 S/PA 700 cap. В настоящем изобретении антисекреторные белки определяют как класс гомологичных белков, обладающих одинаковыми функциональными свойствами. Протеасомы осуществляют множество функций, связанных с деградацией излишков белка, а также короткоживущих ненужных, денатурированных, неправильно упакованных и с другими патологическими белками. Более того, антисекреторный фактор/S5a/Rpn10 участвует в распределении и транспорте клеточных компонентов, в первую очередь белков.
Все гомологи, производные и фрагменты антисекреторных белков и/или пептидов по настоящему изобретению обладают аналогичной биологической активностью, и могут быть эффективны для использования при получении лекарственного средства для лечения и/или профилактики дисфункций в липидных рафтах и/или кавеолах, а также в способе лечения состояний, связанных с дисфункциями в липидных рафтах и/или кавеолах. Гомологи, производные и фрагменты, в контексте настоящего изобретения, содержат по меньшей мере 4 аминокислоты природного антисекреторного белка, который дополнительно может быть модифицирован путем изменения одной или нескольких аминокислот, для оптимизации биологической активности антисекреторного фактора при лечении и/или профилактике состояний, относящихся к настоящему изобретению.
Фрагмент антисекреторного белка, как правило, содержит пептидную/аминокислотную последовательность или ее фрагмент в препарате, в котором содержание белка составляет более чем 90%, например 95%, 96%, 97%, 98% или 99% пептида и/или их фрагментов по настоящему изобретению.
Кроме того, любая аминокислотная последовательность по меньшей мере на 70% идентична, например, по меньшей мере на 72%, 75%, 77%, 80%, 82%, 85%, 87%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности антисекреторного белка, пептида, гомолога, производного и/или фрагмента по настоящему изобретению, рассматривается как входящая в объем настоящего изобретения. В контексте настоящего изобретения термины гомологичный и идентичный используются взаимозаменяемо, т.е. аминокислотная последовательность, имеющая определенный уровень идентичности с другой аминокислотной последовательностью, имеет тот же уровень гомологичности с указанной аминокислотной последовательностью.
Под производным в контексте настоящего изобретения подразумевается белок, обладающий эквивалентной активностью и/или функциональной эквивалентной активностью по отношению к антисекреторному фактору, как определено в настоящем описании, который получен из другого вещества либо непосредственно, либо путем модификации, либо частичного замещения, при котором одна или несколько аминокислот замещаются другой аминокислотой, при этом аминокислота может быть модифицирована или являться неприродной аминокислотой. Например, производные антисекреторного фактора по настоящему изобретению могут содержать N-концевую и/или C-концевую защитную группу. Один из примеров N-концевой защитной группы включает ацетил. Один из примеров C-концевой защитной группы включает амид.
Под белками, гомологами, производными, пептидами и/или их фрагментами с аминокислотной последовательностью, которая по меньшей мере, например, на 95% идентична ссылочной аминокислотной последовательности, подразумевается, аминокислотная последовательность, например, пептида, которая идентична ссылочной последовательности, за исключением того, что аминокислотная последовательность может включать до 5 точечных мутаций на каждые 100 аминокислот ссылочной аминокислотной последовательности. Другими словами, для получения полипептида с аминокислотной последовательностью, которая по меньшей мере на 95% идентична ссылочной аминокислотной последовательности, до 5% аминокислот ссылочной последовательности можно удалить или заменить другими аминокислотами, либо аминокислоты в количестве до 5% от всех аминокислот ссылочной последовательности можно встроить в ссылочную последовательность. Указанные мутации контрольной последовательности могут находиться в амино- или карбокси-концевых положениях ссылочной аминокислотной последовательности или в любом месте между указанными концевыми положениями, разбросанными либо по отдельности среди аминокислот ссылочной последовательности, либо в составе одной или нескольких сплошных групп в ссылочной последовательности.
В настоящем изобретении для определения идентичности наиболее подходит программа локального алгоритма. Программы локального алгоритма (такого как алгоритм Смита-Вотермана) сравнивают подпоследовательность одной последовательности с подпоследовательностью второй последовательности и находят комбинацию подпоследовательностей и сравнивают указанные подпоследовательности, что дает наивысший общий уровень сходности. На внутренние пропуски, если они присутствуют, накладывают штраф. Локальные алгоритмы хорошо работают при сравнении двух мультидоменных белков, имеющих один общий домен или хотя бы общий центр связывания.
Способы определения идентичности и сходности систематизированы в общедоступных программах. Предпочтительные способы определения идентичности и сходности двух последовательностей с помощью компьютерных программ включают, но ими не ограничиваются, пакет программ GCG (Devereux, J. et al. (1994)) BLASTP, BLASTN, и FASTA (Altschul, S. F. et al. (1990)). Программа BLASTX общедоступна из NCBI и других источников (BLAST Manual, Altschul, S. F. et al., Altschul, S. F. et al. (1990)). Каждая программа анализа последовательностей имеет таблицу подсчета баллов по умолчанию и штрафы за пропуски по умолчанию. Как правило, молекулярный биолог будет использовать параметры по умолчанию, установленные используемой компьютерной программой.
Антисекреторные белки или пептид или их гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, как определено в настоящем описании, могут содержать 4 аминокислоты или более, как, например, 5-16 аминокислот, как, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот или более. В других предпочтительных вариантах осуществления антисекреторный фактор состоит из 42, 43, 45, 46, 51, 80, 128, 129 или 163 аминокислот. В предпочтительных вариантах осуществления антисекреторный фактор состоит из 5, 6, 7, 8 или 16 аминокислот.
В другом предпочтительном варианте осуществления антисекреторные белки или пептид или их гомолог, производное или фрагмент, обладающий эквивалентной активностью в соответствии с настоящим изобретением, состоит из последовательности следующих формул:
X1-V-C-X2-X3-K-X4-R-X5
где X1 представляет собой I, аминокислоты 1-35 последовательности SEQ ID NO:6 или он отсутствует, X2 представляет собой H, R или K, X3 представляет собой S или L, X4 представляет собой T или A, X5 представляет собой аминокислоты 43-46, 43-51, 43-80 или 43-163 последовательности SEQ ID NO:6 или он отсутствует.
Антисекреторный фактор по настоящему изобретению может быть получен in vivo или in vitro, например, синтезирован рекомбинантным способом, синтетически и/или химически и/или получен из природного источника антисекреторных факторов, например, из гипофиза свиньи или птичьих яиц. После получения антисекреторные факторы могут быть подвергнуты дальнейшей обработке, такой как химическое или ферментативное расщепление на более мелкие фрагменты с антисекреторной активностью или путем аминокислотной модификации. В настоящее время при очистке невозможно получить антисекреторный фактор в чистой форме. Однако возможно получить биологически активный белок-антисекреторный фактор рекомбинантным способом или синтетически, как описано в WO 97/08202 и WO 05/030246. В WO 97/08202 также описано получение биологически активных фрагментов этого белка размером 7-80 аминокислот.
Антисекреторный фактор по настоящему изобретению может, кроме того, содержать N-концевую и/или C-концевую защитную группу. Один из примеров N-концевой защитной группы включает в себя ацетил. Один из примеров C-концевой защитной группы включает в себя амид.
В предпочтительном варианте осуществления настоящего изобретения антисекреторный фактор выбран из последовательнсти SEQ ID NO:6, т.е. VCHSKTRSNPENNVGL (SEQ ID NO:1, в контексте настоящего изобретения также называется AF-16), IVCHSKTR (SEQ ID NO:2), VCHSKTR (SEQ ID NO:3), CHSKTR (SEQ ID NO:4), HSKTR (SEQ ID NO:5) или аминокислотной последовательности антисекреторного белка в соответствии с SEQ ID NO:6, используя обычные однобуквенные обозначения аминокислот. Последовательности SEQ ID NO:1, 2 и 3 описаны, например, в WO 05/030246. Как определено в прилагаемом списке последовательностей, некоторые из аминокислот в определенных выше последовательностях могут быть заменены другими аминокислотами. Ниже в этом параграфе положение определенной аминокислоты в определенной аминокислотной последовательности вычисляется слева, ближайшую к N-концу аминокислоту обозначают как находящуюся в положении 1 в указанной определенной последовательности. Любая замена аминокислоты, как определено ниже, может быть осуществлена независимо от любой другой замены аминокислоты в этой последовательности. В последовательности SEQ ID NO:1 C в положении 2 можно заменить на S, H в положении 3 можно заменить на R или K, S в положении 4 можно заменить на L и/или T в положении 6 можно заменить на A. В последовательности SEQ ID NO:2 C в положении 3 можно заменить на S, H в положении 4 можно заменить на R или K, S в положении 5 можно заменить на L и/или T в положении 7 можно заменить на A. В последовательности SEQ ID NO:3 C в положении 2 можно заменить на S, H в положении 3 можно заменить на R или K, S в положении 4 можно заменить на L и/или T в положении 6 можно заменить на A. В последовательности SEQ ID NO:4, C в положении 1 можно заменить на S, H в положении 2 можно заменить на R или K, S в положении 3 можно заменить на L и/или T в положении 5 можно заменить на A. В последовательности SEQ ID NO:5 H в положении 1 можно заменить на R или K, S в положении 2 можно заменить на L и/или T в положении 4 можно заменить на A.
Настоящее изобретение также относится к комбинации двух или несколько любых фрагментов последовательности SEQ ID NO:1-6.
В одном варианте осуществления настоящего изобретения фармацевтическая композиция в соответствии с настоящим изобретением, кроме того, содержит фармацевтически приемлемый эксципиент. Выбор фармацевтически приемлемого эксципиента и его оптимальной концентрации для применения в соответствии с настоящим изобретением может быть легко осуществлен специалистом путем экспериментов. Фармацевтически приемлемые эксципиенты для использования в настоящем изобретении включают растворители, буферные вещества, консерванты, хелатирующие агенты, антиоксиданты и стабилизаторы, эмульгирующие вещества, суспендирующие вещества и/или разбавители. Фармацевтическая композиция по настоящему изобретению может быть получена в соответствии с общепринятой фармацевтической практикой, например в соответствии с "Remington: The science and practice of pharmacy", 21st edition, ISBN 0-7817-4673-6 или "Encyclopedia of pharmaceutical technology", 2nd edition, ed. Swarbrick J., ISBN: 0-8247-2152-7. Фармацевтически приемлемый эксципиент представляет собой вещество, которое по существу безвредно для индивидуума, которому должна быть введена композиция. Такой эксципиент, как правило, соответствует требованиям национальных органов здравоохранения. Официальные фармакопеи, такие как, например, Британская фармакопея, Фармакопея США и Фармакопея Европы, устанавливают стандарты для фармацевтически приемлемых эксципиентов.
Ниже следует обзор подходящих композиций для необязательного использования в фармацевтической композиции в соответствии с настоящим изобретением. Обзор основан на определенном способе введения. Однако следует понимать, что в тех случаях, когда фармацевтически приемлемый эксципиент может использоваться в различных лекарственных формах или композициях, применение определенного фармацевтически приемлемого эксципиента не ограничено определенной лекарственной формой или определенной функцией эксципиента. Следует подчеркнуть, что изобретение не ограничено применением указанной в дальнейшем композиции.
Парентеральные композиции. Для системного применения композиции по настоящему изобретению могут содержать обычные нетоксичные фармацевтически приемлемые носители и эксципиенты, включая микросферы и липосомы.
Композиции для использования по настоящему изобретению могут включать все виды твердых, полутвердых и жидких композиций.
Фармацевтически приемлемые эксципиенты могут включать растворители, буферные вещества, консерванты, хелатирующие агенты, антиоксиданты и стабилизаторы, эмульгирующие вещества, суспендирующие средства и/или разбавители. Примеры различных веществ приведены ниже.
Пример различных средств
Примеры растворителей включают, но ими не ограничиваются, воду, спирты, кровь, плазму, спинномозговую жидкость, асцитическую жидкость и лимфу.
Примеры буферных веществ включают, но ими не ограничиваются, лимонную кислоту, уксусную кислоту, винную кислоту, молочную кислоту, фосфорную кислоту, бикарбонаты, фосфаты, диэтиламид и т.д.
Примеры хелатирующих средств включают, но ими не ограничиваются, ЭДТА и лимонную кислоту.
Примеры антиоксидантов включают, но ими не ограничиваются, бутилированный гидроксианизол (BHA), аскорбиновую кислоту и ее производные, токоферол и его производные, цистеин и их смеси.
Примеры разбавителей и дезинтегрирующих средств включают, но ими не ограничиваются, лактозу, сахарозу, Еmdex™, фосфаты кальция, карбонаты кальция, сульфаты кальция, маннитол, крахмалы и микрокристаллическую целлюлозу.
Примеры связывающих средств включают, но ими не ограничиваются, сахарозу, сорбитол, гуммиарабик, альгинат натрия, желатин, хитозан, крахмалы, целлюлозу, карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон и полиэтиленгликоль.
Фармацевтическая композиция по настоящему изобретению может в одном из контекстов использоваться либо местно, либо путем внутривенной периферической инфузии, либо путем внутримышечной или подкожной инъекции пациенту, либо буккальным, пульмональным, назальным, кожным или пероральным путем. Кроме того, также фармацевтическую композицию можно вводить через хирургически вставленный шунт в желудочек головного мозга пациента.
В одном из вариантов осуществления фармацевтическую композицию, используемую в соответствии с настоящим изобретением, получают для внутриглазного, местного, интраназального, перорального, подкожного и/или системного введения. В предпочтительном варианте осуществления композицию по настоящему изобретению вводят в виде суспензии или, еще более предпочтительно, в виде порошка для ингаляции со спреем, аэрозолем, ингалятором или распылителем назально и/или в дыхательные пути.
Введение порошка, содержащего антисекреторные факторы, дает дополнительные преимущества с точки зрения стабильности и дозировки. Фармацевтическую композицию по настоящему изобретению можно также использовать местно, внутриглазным образом, интраназально, перорально, подкожно и/или вводить системно через кровеносные сосуды. В предпочтительном варианте осуществления фармацевтическую композицию получают для внутривенного, внутримышечного, местного, перорального или назального введения. Обычно, при местном использовании в глаза, используемая концентрация в композиции по настоящему изобретению составляет от 1 мкг до 1 мг на прием, предпочтительно 50-250 мкг, или в виде одной дозы в день, или повторяя несколько раз в день (многократный прием), но не ограничивается таким образом.
При системном введении в кровь дозировка находится в диапазоне от 0,1 мкг до 10 мг на прием на кг веса тела, как, например, от 0,1 мкг до 1 мг на прием на кг веса тела, предпочтительно, 1-500 мкг/ кг веса тела, более предпочтительно, 1-50 мкг/ кг веса тела, либо в виде одной дозы в день, или повторных введений несколько раз в день. При использовании в соответствии с настоящим изобретением обогащенного антисекреторными факторами яичного желтка такую композицию предпочтительно вводят перорально.
Соответственно, настоящее изобретение относится к применению антисекреторного белка или его гомолога, производного и/или фрагмента, обладающего эквивалентной активностью, и/или его фармацевтически активной соли, для получения фармацевтической композиции и/или лекарственного питания для лечения и/или профилактики дисфункции липидных рафтов и/или кавеол. В одном из вариантов осуществления указанный антисекреторный белок состоит из последовательности в соответствии со следующей формулой:
X1-V-C-X2-X3-K-X4-R-X5
где X1 представляет собой I, аминокислоты 1-35 последовательности SEQ ID NO:6 или он отсутствует, X2 представляет собой H, R или K, X3 представляет собой S или L, X4 представляет собой T или A, X5 представляет собой аминокислоты 43-46, 43-51, 43-80 или 43-163 последовательности SEQ ID NO:6 или он отсутствует. В другом варианте осуществления настоящее изобретение относится к применению антисекреторного белка, который содержит аминокислотную последовательность SEQ ID NO:1. В другом варианте осуществления настоящее изобретение относится к применению антисекреторного белка, который содержит аминокислотную последовательность SEQ ID NO:2. В еще одном варианте осуществления настоящее изобретение относится к применению антисекреторного белка, который содержит аминокислотную последовательность SEQ ID NO:3. В еще одном варианте осуществления настоящее изобретение относится к применению антисекреторного белка, который содержит аминокислотную последовательность SEQ ID NO:4. В другом варианте осуществления изобретение имеет отношение к применению антисекреторного белка, который содержит аминокислотную последовательность SEQ ID NO:5.
Кроме того, в еще одном варианте осуществления изобретение имеет отношение к применению антисекреторного белка, который представляет собой белок с аминокислотной последовательностью SEQ ID NO:6, или его гомолог, производное и/или фрагмент, содержащий аминокислоты 38-42 SEQ последовательности ID NO:6.
В еще одном варианте осуществления настоящее изобретение относится к применению фармацевтической композиции, как раскрыто в настоящем описании, которая содержит два или более антисекреторных белка, выбранных из белков SEQ ID NO:1-6, и SEQ ID NO:6 или его гомолог, производное и/или фрагмент, содержащий аминокислоты 38-42 последовательности SEQ ID NO:6, или последовательность, описываемую общими формулами, определенными в настоящем описании. Указанные последовательности все в равной мере предпочтительны для использования в настоящем изобретении.
В одном из вариантов осуществления настоящего изобретения указанная фармацевтическая композиция, кроме того, содержит фармацевтически приемлемый эксципиент. Такой эксципиент может представлять собой любой предпочтительный эксципиент, выбранный в качестве подходящего для определенной цели. Примеры эксципиентов раскрыты в настоящем описании.
В другом варианте осуществления настоящего изобретения указанную фармацевтическую композицию получают для внутриглазного, интраназального, перорального, местного, подкожного и/или системного введения. Выбранный способ введения будет различным в зависимости от состояния больного, возраста и пола пациента и т.д.
В другом варианте осуществления фармацевтическую композицию получают для введения в виде спрея, аэрозоля или посредством распылителя или ингалятора. В еще одном варианте осуществления настоящее изобретение относится к фармацевтической композиции и/или лечебному питанию, которые получают для введения системно в кровь в дозе от 0,1 мкг до 10 мг на прием на кг веса тела в сутки, как, например, от 0,1 мкг до 1 мг на прием на кг веса тела в сутки, предпочтительно, 1-500 мкг на прием на кг веса тела в сутки, более предпочтительно 1-50 мкг на прием на кг веса тела в сутки. В другом варианте осуществления указанная доза составляет 1-1000 мкг на прием на кг веса тела в сутки, как, например, 1-100 мкг на прием на кг веса тела в сутки. Количество фармацевтической композиции, которое назначают пациенту при возникновении необходимости, значительно зависит, безусловно, от конкретного пациента, подвергаемого лечению, и определяется специалистом в данной области, таким как практикующий врач, для каждого случая. Такое введение можно осуществлять или в виде отдельной дозы, или в виде многократных ежедневных применений.
За последние годы стало очевидно, что липидные рафты, кавеолы и кавеолины играют роль в нескольких патологических состояниях человека, таких как, но ими не ограничиваясь, мышечная дистрофия (например, поясноконечностная мышечная дистрофия), дисбаланс клеточного холестерина (например, болезнь Ниманна-Пика типа C) и/или дисфункция образования амилоидного пептида из белка-предшественника амилоида (APP) (например, болезнь Альцгеймера). Таким образом, настоящее изобретение в одном из вариантов осуществления также относится к применению фармацевтических композиций, как описано в настоящем описании, для профилактики и/или лечения мышечной дистрофии, дисбаланса клеточного холестерина и/или дисфункции образования амилоидного пептида из белка-предшественника амилоида.
Липидные рафты представляют тип клеточного домена, в котором липиды определенного химического строения могут динамически ассоциировать друг с другом, образуя платформы, существенные для упорядочивания мембранных белков и образования переносящих массу и сигнальных комплексов.
Известно, что некоторые клеточные рецепторы находятся в липидных рафтах и/или кавеолах клеточной мембраны, например, было показано, что рафты существенны для регуляции GPCR-рецепторов на всех стадиях их жизненного цикла, т.е. на экзоцитозном пути, в плазматической мембране и на эндоцитозном пути. Обнаружено, что липидные рафты и/или кавеолы участвуют в регуляции стабильности рецепторов, регулируя сигнализацию и транспорт любого определенного GPCR. Кроме того, можно контролировать быстрый метаболизм рецепторов, белков ионных каналов и водных каналов и других передатчиков сигналов. Таким образом, в одном из вариантов осуществления настоящее изобретение относится к применению фармацевтической композиции по настоящему изобретению для регуляции стабильности рецепторов, регуляции сигнализации и/или транспорта одного или нескольких рецепторов, расположенных в клеточной мембране.
Многие рецепторы существуют не более 3-5 часов. В результате для постоянного получения новых рецепторных белков необходимо, чтобы производимые рецепторные белки были безопасно и корректно направлены и закреплены в соответствующих местах в клеточной мембране. Настоящее изобретение раскрывает возможное применение фармацевтической композиции в соответствии с настоящим изобретением для улучшения и/или облегчения указанного позиционирования рецепторов в клеточной мембране.
Более того, недавние открытия указывают на то, что классические рецепторы стероидных гормонов находятся в липидных рафтах и/или кавеолах в клеточной мембране, а значит, могут функционировать в указанных структурах и с их помощью. Примерами таких рецепторов, но ими не ограничиваются, являются рецепторные тирозинкиназы, т.е. сигнальные пути EGFR и андрогенового рецептора, Akt1, IL-6, STAT3, эстрогеновый рецептор (ER). Таким образом, настоящее изобретение также относится к применению фармацевтической композиции по настоящему изобретению для лечения и/или профилактики состояний, связанных с дисфункциями рецепторов стероидных гормонов.
Полагают, что резистентность к инсулину, определяемая как уменьшенная способность клеток или тканей реагировать на физиологические количества инсулина, является первичным нарушением в патофизиологии диабета II типа. Известно, что в такой резистентности главную роль играет TNFα, как, вероято, и другие цитокины и лимфокины. В настоящее время ясно, что уникальное воздействие гормона тесно связано с компартментализацией сигнальной молекулы в липидных рафтах в клеточной мембране. Таким образом, было показано, что соответствующая функция липидных рафтов играет критическую роль для соответствующей компартментализации инсулиновой сигнализации, например, в адипоцитах. Разрушение строения и/или функции липидного рафта в свою очередь приводит к ингибированию и/или разрушению метаболической сигнализации инсулина, вероятно, по меньшей мере частично, из-за аберрантной экспрессии гликосфинголипидов. Предпочтительный в настоящее время вариант осуществления настоящего изобретения, таким образом, относится к применению фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль, для нормализации метаболической сигнализации инсулина. Настоящее изобретение, следовательно, в указанном варианте осуществления также относится к лечению и/или профилактике сахарного диабета, например диабета II типа.
Липидные рафты и кавеолы действуют как оборудованные центры передачи сигнала. Как инсулиновый рецептор, так и TC10 находятся в липидных рафтах. Ошибочное попадание TC10 в домен, не являющийся липидным рафтом, препятствует его активации инсулином и блокирует действие инсулина. Многочисленные исследования продемонстрировали, что липидные рафты действуют в качестве организационных центров для инсулиновой сигнализации в адипоцитах. Активированный инсулиновый рецептор, в частности, катализирует тирозиновое фосфорилирование определенных белков в липидных рафтах, включая кавеолин и CbI. Компоненты инсулиновой сигнализации, включая некоторые или все инсулиновые рецепторы, флотиллин и TC10, конститутивно расположены в липидных рафтах.
Инсулин стимулирует транспорт глюкозы в жировых и мышечных клетках посредством процесса регулируемого везикулярного рециклинга, в котором обеспечивающий транспорт глюкозы Glut4 перемещается из внутриклеточных участков на плазматическую мембрану. В нестимулированных клетках Glut4 подвергается эндоцитозу в эндосомы и затем распределяется по специализированным аккумулирующим везикулам, которые перемещаются к плазматической мембране после активации инсулинового рецептора. Затем везикулы стыкуются и сливаются в определенных участках мембраны, что приводит к внеклеточной экспозиции переносчика. Сигнальный каскад от инсулинового рецептора включает в себя тирозиновое фосфорилирование ряда внутриклеточных субстратов и активацию PI3-киназного пути и активацию G-белка, который в свою очередь связывается со множеством эффекторов, включая белок экзоциста Exo70.
Более того, комплекс экзоциста, соджержащий Exo70, Sec6 и Sec8, участвует в компартментализации содержащих Glut4 везикул в доменах липидных рафтов в клеточной мембране, например в адипоцитах. Части комплекса экзоциста рекрутируются G-белками после активации инсулином и являются существенными для инсулинстимулированного захвата глюкозы в клетках. Более того, недавно было показано, что их направленность на липидные рафты необходима для захвата глюкозы и стыковки Glut4 с плазматической мембраной. Любопытно, что данному комплексу также необходим белок с PDZ-доменом, который связывается с комплексом после его перемещения в липидный рафт. Скопления экзоцистов в липидных рафтах создают целевые сайты для везикул Glut4, которые временно связываются с данными микродоменами после стимуляции клеток инсулином.
Как показано в экспериментальной части данной заявки, авторы изобретения смогли продемонстрировать, что антисекреторные факторы оказывают эффективное воздействие на развитие симптомов при химически вызванном сахарном диабете. Подробно говоря, экспериментально индуцированный сахарный диабет, вызванный воздействием стрептозоцина, изучали на предмет того, будет ли лечение AF-16 эффективно воздействовать на него. В предпочтительном на данный момент варианте осуществления настоящее изобретение, следовательно, относится к применению фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль, для лечения и/или профилактики у пациента заболевания, связанного с сахарным диабетом и/или осложнениями, связанными с диабетом, как, например, выбранные из диабета I и II.
В другом предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция по настоящему изобретению используется для нормализации образования и/или функции липидных рафтов в мышечных клетках, эндотелиальных клетках, жировых клетках и/или эритроцитах для лечения и/или предупреждения дисфункции Glut4 и/или скопления экзоцистов в указанных клетках. Таким образом, указанная фармацевтическая композиция используется в настоящем изобретении для лечения и/или предупреждения сахарного диабета и/или осложнений, связанных с диабетом, как, например, выбранных из диабетов I и II.
Кавеолы представляют собой динамические структуры, которые могут развиваться из плазматической мембраны, образуя цитоплазматические переносчики, участвующие как в опосредуемом рецепторами захвате растворов в клетку, так и в трансцитозе через клетку. Хотя кавеолы обнаружены во многих типах клеток, они особенно распространены в адипоцитах, где они могут объединяться в кольцевидные структуры (розетки кавеол), часто связанные с нитями актина. Они принимают участие в захвате жирных кислот, а также в транспорте жирных кислот и/или связывании жирных кислот клетками. К тому же описано, что кавеолы и кавеолин-1 принимают участие в транспорте холестерина на клеточную поверхность и регулируются уровнем холестерина в клетке. Таким образом, настоящее изобретение в другом варианте осуществления также относится к применению фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль для лечения и/или предупреждения у пациента заболевания, связанного с дисфункциями захвата жирных кислот, транспорта жирных кислот, связывания жирных кислот и/или уровня холестерина.
Дисфункции кавеол связаны с некоторыми заболеваниями человека. Например, кавеолин-1 (CAV1) -нулевые клетки демонстрируют увеличенную пролиферацию, и недостаток CAV ускоряет развитие опухоли. При некоторых видах рака молочной железы происходит отрицательная регуляция CAV1, и был обнаружен ряд спорадических мутаций CAV1 в образцах рака молочной железы человека, что находится, в частности, во взаимосвязи с положительным статусом эстрогенового рецептора альфа. CAV3, изоформа кавеолина, характерная для мышц, также тесно связана с заболеванием. Многие мутации CAV3 связаны с рядом мышечных нарушений у человека.
В другом, в равной степени предпочтительном, варианте осуществления, фармацевтическая композиция в соответствии с настоящим изобретением используется для нормализации образования и/или функции кавеол противодействовать и/или стабилизировать высокое кровяное давление у пациента при возникновении необходимости. Как показано в экспериментальной части, применение к млекопитающим фармацевтической композиции в соответствии с настоящим изобретением может уменьшить осложнения, вызванные гипертонией, как в малом, так и в большом круге кровообращения организма млекопитающего. Таким образом, настоящее изобретение может применяться для лечения и/или предупреждения инфаркта миокарда, высокого кровяного давления, заболеваний легких, бляшкообразования и/или травматического повреждения сосудистой системы, такой как сердечной и легочной, а также гормональной дисфункции и дисрегуляции.
В другом аспекте настоящее изобретение относится к способу лечения и/или профилактики дисфункции липидных рафтов и/или кавеол у млекопитающих при возникновении необходимости, причем указанный способ включает в себя введение эффективного количества фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной функциональный активностью, и/или его фармацевтически активную соль. В одном варианте осуществления настоящее изобретение относится к способу, в котором указанный антисекреторный белок состоит из последовательности в соответствии со следующей формулой X1-V-C-X2-X3-K-X4-R-X5, где X1 представляет собой I, аминокислоты 1-35 последовательности SEQ ID NO:6 или отсутствует, X2 представляет собой H, R или K, X3 представляет собой S или L, X4 представляет собой T или A, X5 представляет собой аминокислоты 43-46, 43-51, 43-80 или 43-163 последовательности SEQ ID NO:6 или отсутствует. В другом варианте осуществления настоящее изобретение относится к способу, в котором указанный антисекреторный белок содержит аминокислотную последовательность SEQ ID NO:1. В еще одном варианте осуществления настоящее изобретение относится к способу, в котором указанный антисекреторный белок содержит аминокислотную последовательность SEQ ID NO:2. В еще одном варианте осуществления настоящее изобретение относится к способу, в котором указанный антисекреторный белок содержит аминокислотную последовательность SEQ ID NO:3. Кроме того, настоящее изобретение относится к способу, в котором указанный антисекреторный белок содержит аминокислотную последовательность SEQ ID NO:4. В еще одном варианте осуществления настоящее изобретение относится к способу, в котором указанный антисекреторный белок содержит аминокислотную последовательность SEQ ID NO:5. В еще одном варианте осуществления изобретение относится к способу, в котором указанный антисекреторный белок представляет собой белок с аминокислотной последовательностью SEQ ID NO:6 или его гомолог, производное и/или фрагмент, содержащий аминокислоты 38-42 из SEQ ID NO:6. В одном варианте осуществления настоящее изобретение относится к способу, в котором указанная фармацевтическая композиция содержит два или более антисекреторных белка, выбранных из белков SEQ ID NO:1-6, и SEQ ID NO:6 или его гомолог, производное и/или фрагмент, содержащий аминокислоты 38-42 из последовательности SEQ ID NO:6, или последовательности, описанные общей формулой в настоящем описании. В одном варианте осуществления указанную фармацевтическую композицию составляют для внутриглазного, интраназального, орального, местного, подкожного и/или системного введения. В еще одном варианте осуществления указанную фармацевтическую композицию и/или лечебное питание составляют для введения как спрей, аэрозоль или посредством распылителя или ингалятора. Также вариант осуществления настоящего изобретения охватывает способ, в котором фармацевтическую композицию составляют для введения системно в кровь в дозировке от 0,1 мкг до 10 мг на прием на кг веса тела в сутки, как, например, от 0,1 мкг до 1 мг на прием на кг веса тела в сутки, предпочтительно 1-500 мкг на прием на кг веса тела в сутки, более предпочтительно 1-50 мкг на прием на кг веса тела в сутки. В одном варианте осуществления указанного способа указанное введение осуществляют или в виде отдельной дозы, или в виде многократных ежедневных применений. Настоящее изобретение также относится к способу лечения и/или предупреждения дисфункции липидных рафтов и/или кавеол у млекопитающих при возникновении необходимости, причем указанный способ включает в себя введение эффективного количества фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной функциональной активностью, и/или его фармацевтически активную соль.
В одном предпочтительном варианте осуществления настоящее изобретение также относится к способу лечения и/или профилактики дисфункции липидных рафтов и/или кавеол у млекопитающих при возникновении необходимости, причем указанный способ включает в себя введение эффективного количества фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль.
При этом должно быть понятно и ясно, что способ, включающий введение эффективного количества фармацевтической композиции млекопитающему при возникновении необходимости и/или другое медицинское применение фармацевтической композиции, содержащей антисекреторный белок или его гомолог, производное и/или фрагмент, обладающий эквивалентной активностью, и/или его фармацевтически активную соль, в соответствии с настоящим изобретением, направлены на все состояния, описанные в настоящем описании, связанные с дисфункцией липидных рафтов и/или кавеол.
Экспериментальная часть
Пример 1
Незрелые и взрослые крысы, с весом тела 150-300 г и любого пола, обрабатывали экспериментально, чтобы вызвать легочную гипертензию и реактивные изменения в легких. Легочную гипертензию (ЛГ) определяют как наличие давления, превышающего нормальное легочное артериальное давление, ~20 мм рт. ст., как правило, в диапазоне 30-40 мм рт. ст. Это прогрессирующее заболевание с высокой распространенностью и летальностью у людей, а также у животных. Экспериментальные модели делают возможным изучение запускающих механизмов. Отдельное применение к крысам монокроталина является признанным способом индуцирования ЛГ (Cf. Mathew et al., 2004). Данный растительный алкалоид активируется в печени до пиррольных метаболитов с временем полужизни всего лишь несколько секунд, и поэтому главным образом воздействует на эндотелий легочных артерий, вызывая разрушение эндотелиальных клеток и проницаемость легочных сосудов. Затем в течение нескольких следующих дней следует значительная стимуляция синтеза ДНК и гипертрофии эндотелиальных клеток легочных артерий. Полагают, что данные эндотелиальные клетки секретируют факторы роста и стимулирующие миграцию, которые вносят вклад в миграцию и реактивные изменения прилегающих гладкомышечных клеток. В течение двух недель правый желудочек сердца становился гипертрофированным из-за повышенной нагрузки, вызванной индуцированными кроталином изменениями в легочной сосудистой системе.
Группе крыс Спрег-Доули сделали одну интраперитонеальную инъекцию кроталина (60 мг/кг веса тела; Sigma). Каждому второму животному имплантировали подкожно на спину осмотический мининасос Alzet (тип 2001; объем заполнения ~235 мкл; скорость качания ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола). Насос, таким образом, доставлял ~20 мкг AF-16 в час в течение по меньшей мере 10 дней. В одном эксперименте крысы с насосом Alzet 2001 получали при имплантации также одну внутримышечную инъекцию 2 мг AF-16. Для сравнения каждой второй крысе при инъекции кроталина имплантировали насос Alzet 2001, заполненный наполнителем, ФСБ с 15% этанола. Дополнительные группы крыс с подходящим весом несли только имплантированные насосы, заполненные или AF-16, или наполнителем, но не получили кроталина.
Через 18 дней крыс анестезировали и определяли их вес. Те из них, которые получили кроталин, были худыми и маленькими для своего возраста, были менее активны и имели жесткий мех и имели меньший вес, по сравнению с необработанными нормальными контрольными. Те из них, которые получили кроталин и которым вливали AF с помощью мининасосов, выглядели здоровыми и имели почти тот же самый вес и внешний вид, как и контрольные. Давление в правом желудочке сердца определяли с помощью оптоволоконной миниатюрной измерительной системы (Samba System 3200 & Samba Preclin 420 sensor; Samba Sensors AB, V. Frölunda, Sweden), вставленной через правую яремную вену. Среднее легочное артериальное кровяное давление составляло приблизительно 20 мм рт. ст. у крыс, которым вводили наполнитель или вводили AF-16. Напротив, крысы, которым вводили кроталин (одна интраперитонеальная инъекция; 60 мг/кг веса тела; кроталин растворен в ФСБ) и наполнитель, доставлявшийся насосом Alzet, имели в течение 18 дней легочное артериальное давление выше 30 мм рт. ст. и гипертрофию правого желудочка, как было определено путем сравнения его полного веса с полным весом левого желудочка и с весом соответствующих структур необработанных нормальных крыс. Введение AF-16 крысам, которым вводили кроталин, возвращало кровяное давление в правом желудочке и легочное артериальное кровяное давление близко к нормальному, и не наблюдалось значительной гипертрофии правого желудочка по сравнению с нормальными необработанными крысами. Данные результаты являются воспроизводимыми, что всякий раз выполнялось при повторении. Известно, что соединения, производные от кроталина, вызывают разрушение, например, белка кавеолина, что приводит к дезорганизации кавеол и липидных рафтов, каковые эффекты приводят к изменениям в сигнализации эндотелиальных клеток в данной модели ЛГ (Mathew R, et al., 2004).
Мы считаем, что применение AF-16 прекращало перестройку легочной сосудистой системы и, следовательно, развитие легочных нарушений и гипертрофии в правой половине сердца, которые в других случаях были зарегистрированы после применения кроталина. Индуцированное разрушение липидных рафтов и кавеол в эндотелии и гладкомышечных клетках сосудов и последующие реактивные изменения были, таким образом, уменьшены при помощи применения AF-16 и не привели ни ожидаемым сосудистым нарушениям, ни к желудочковой гипертрофии правой половины сердца.
Пример 2
Во втором эксперименте исследовали, влияет ли введение AF-16 в дозировке, которая, как показано выше, прекращает развитие легочной гипертензии, на процесс заживления поврежденных артерий.
Анестезированные взрослые крысы несли осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 10 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Кроме того, 1 мг AF-16 вводили с помощью внутримышечной инъекции сразу после имплантации. После этого кожу в правой части паха побрили, рассекли и выделили правую бедренную и общую подвздошную артерию. Около артерии установили зажим Пеана и закрывали его три раза, каждый раз на 15 секунд, а затем удалили. Особые усилия прилагали, чтобы не проколоть сосуд или какие-либо смежные структуры. Проверили проходимость бедренной и подвздошной артерий и вен, чтобы обеспечить соответствующую циркуляцию крови. Затем края раны выровняли и сшили. Параллельно у других крыс зажимали правую бедренную и подвздошную артерию, но им вводили наполнитель, ФСБ с 15% этанола, вместо активного материала.
Через 10 дней животные еще раз были подвержены анестезии, и им ввели 1 мл/кг веса тела смеси 2% голубого Эванса и 3% альбумина (бычий сывороточный альбумин: Sigma), растворенные в ФСБ. Через 15 минут животное фиксировали путем транскардиальной перфузии буферным раствором формалина после первоначального промывания ФСБ, к которому был добавлен гепарин. Правую и левую подвздошные и бедренные артерии тщательно отделяли и закрепляли их концы, погруженные в раствор формалина в ФСБ. Через 1 час сосуды продольно разрезали острыми ножницами и исследовали распространенность голубого окрашивания поверхности просвета артериальной стенки. Поверхности просвета нетронутых артерий демонстрировали отсутствие окрашивания. Напротив, те, у которых правая подвздошная и бедренная артерия были травмированы и обработаны наполнителем, демонстрировали непрерывное, отчетливое, интенсивное голубое окрашивание всей поврежденной поверхности сосуда, с довольно четкими краями. Травмированные подвздошные и бедренные артерии третьей группы животных, обработанные AF-16 после повреждения, несли пятна и прерывистые области неправильной формы, которые были окрашены в голубой цвет, разделенные областями, кажущимися неокрашенными, в поврежденной части сосуда. Насколько можно судить по внешнему виду, более половины области в поврежденной зоне осталось неокрашенной у обработанных AF-16 животных. Это означает, что AF-16 способствует восстановлению первоначально денудированной внутренней стенки сосуда, так что он становится покрытым изнутри клетками. Более того, наблюдаемый тромб был менее видимым по сравнению с сосудами, которые были повреждены у животных, обработанных наполнителем. Световая микроскопия поврежденных областей показала, что количество лейкоцитов, тромбоцитов, макрофагов и тучных клеток на и в поврежденной ткани было меньше после обработки с помощью AF-16 по сравнению с количеством после обработки наполнителем. Более того, одноядерных клеток, прикрепленных к поверхности, было меньше. Были обнаружены гладкомышечные клетки, проникшие в адлюминальный слой, но в меньшей степени после обработки AF-16 по сравнению с обработкой наполнителем. Эндотелиальные клетки, фибробласты и гладкомышечные клетки в нормальных условиях характеризуются большим количеством кавеол и везикул на и в их плазматической мембране. Функционирование данных поверхностных структур нарушается при и после механической травмы в кровеносном сосуде и остается до значительной степени в таком состоянии в течение по меньшей мере 10 дней, т.е. периода времени, исследованного в описываемых экспериментах. Однако у животных, которым вводили AF-16, наблюдается заметная тенденция к нормализации, по сравнению с состоянием, преобладающим у тех, которым вводили наполнитель. Известно, что передача сигнала для вышеупомянутых типов клеток в большой степени опосредуется липидными рафтами и кавеолами. Можно, таким образом, заключить, что обработка с помощью AF-16 уменьшает воспалительные и реактивные изменения поврежденных кровеносных сосудов и нормализует до значительной степени структуру и функцию клеток в таких областях. AF-16 оказывает свое благотворное воздействие, влияя на липидные рафты и кавеолы.
Пример 3
В эксперименте исследовали, влияет ли введение AF-16 на процесс заживления поврежденной кожи и хрящей, применяя повреждение уха крысы путем замораживания-оттаивания в качестве модельной системы.
Анестезированные взрослые крысы несли осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Кроме того, 1 мг AF-16 вводили с помощью внутримышечной инъекции сразу после имплантации насоса. После этого осуществили повреждение путем замораживания-оттаивания, сжав ухо стандартным образом с помощью зажима Пеана, охлажденного в жидком азоте. Для сравнения других крыс параллельно обрабатывали таким же образом, им вводили только наполнитель, ФСБ с 15% этанола, но не пептид. Кроме того, для контроля использовали нормальных крыс, которые не подвергались никакому повреждению путем замораживания-оттаивания, как и неповрежденных крыс с имплантированными насосами с AF-16.
Крысы, получавшие AF-16 в течение 2 недель после повреждения путем замораживания, демонстрировали меньший отек и воспаление по сравнению с получившими повреждение, но получавшими наполнитель. На обеих сторонах по краям поврежденного эластичного хряща в ухе образовывался новый гиалиновый хрящ. У крыс, которым вводили AF-16, за 2 недели осталось меньше некроза в оставшемся эластичном хряще, менее заметно образование окружающего гиалинового хряща, меньше отек и инфильтрация воспалительных клеток. Количество коллагена и плотность воспалительных клеток уменьшились у получавших AF-16 животных по сравнению с получавшими наполнитель. Применение к неповрежденным крысам как наполнителя, так и AF-16 не изменило структур в ухе.
Можно заключить, что исход процесса заживления по отношению к поврежденной коже и лежащему под ней хрящу был более удачным и приводил к образованию меньшего количества рубцовой ткани, если животные получали AF-16. Повреждение путем замораживания гораздо сильнее понижает количество кавеол в клетках в поврежденных областях в обработанных наполнителем ушах по сравнению с наблюдаемым в обработанных AF-16.
Пример 4
Взрослых кроликов изучали с точки зрения того, влияет ли введение AF-16 на процесс заживления поврежденной кожи и надкостницы.
Анестезированным взрослым новозеландским кроликам-альбиносам (самки, вес тела 2,5-2,8 кг) к хирургически открытой кости черепа приклеили шлем, сделанный из пластмассы, армированной стекловолокном. Кроликам внутривенно вводили инъекции или AF-16, или наполнителя в краевую ушную вену. Доза AF-16 составляла вплоть до 5 мг на кг веса тела дважды в день. Рану кожи свода черепа и участки инъекций в ухе изучили макроскопически через неделю. Затем образцы с обеих областей были вырезаны и подготовлены путем фиксации, заливки, изготовления срезов и окрашивания для исследования посредством световой микроскопии. Применение AF-16 привело к распространению меньшего отека в заживающей коже, которая к тому же была менее воспаленной и в ней было меньше выделяющейся, гипертрофированной рубцовой ткани, доступной наблюдению в соответствующих образцах животных, получавших наполнитель. Световая микроскопия подтвердила, что в образцах животных, которым вводили AF-16, меньше воспалительных клеток и меньше коллагена по сравнению с теми, которым вводили наполнитель. Более того, в образцах животных, которым вводили AF-16, кровеносные сосуды выглядели более зрелыми.
Можно заключить, что AF-16 улучшает заживление глубоких кожных ран, уменьшая значительное в ином случае воспаление и распространение отека и избыточной рубцовой ткани. Оказалось, что введение AF возвращает уменьшенную концентрацию кавеол к более нормальной, чем наблюдаемая у получавших наполнитель.
Пример 5
Взрослых крыс изучали по отношению к тому, влияет ли на заживление экспериментально индуцированных желудочных ран введение AF-16.
Анестезированные крысы несли осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Кроме того, 2 мг AF-16 вводили с помощью внутримышечной инъекции сразу после имплантации насоса. После этого брили живот и хирургически открывали брюшную стенку. Был найден желудок и открыта его брюшная сторона, причем большое внимание уделялось тому, чтобы не дать различным соседним органам и структурам высохнуть или получить механические повреждения. Брюшную сторону гландулярной (дистальной) части желудка затем обработали 80% уксусной кислотой, содержащейся в стеклянной трубке, в течение 60 секунд. После этого стеклянную трубку быстро убрали и открытую серозную оболочку промыли большим объемом ФСБ. Затем живот зашили. Параллельно другие крысы были обработаны таким же образом, но в насосе у них был наполнитель, и они получили инъекцию с равным объемом наполнителя. Через неделю крыс еще раз анестезировали, и им открыли и хирургически вскрыли живот. Исследовали распространение спаек и асцитной жидкости, как и заживление язвы желудка. Меньше жидкости в брюшной полости оказалось у тех крыс, которые получали AF-16, по сравнению с теми, которые получали наполнитель. Количество спаек между большим сальником и желудком, кишечником, селезенкой и печенью, а также у раны брюшной стенки, было менее значительным и с меньшими концентрацией и размером у тех, которые получали AF-16. Световая микроскопия подтвердила макроскопическое впечатление, что стенка желудка была менее отечной. Эпителиальное покрытие на внутренней поверхности желудка было более полным и обширным и казалось лучше упорядоченным после применения AF-16. Кроме того, после применения AF-16 была меньше инфильтрация воспалительных клеток в стенке желудка. Можно заключить, что AF-16 улучшает заживление ран стенки желудка. К тому же уменьшилось распространение асцитной жидкости, как и количество и опасность спаек брюшной полости.
Пример 6
В другом эксперименте исследовали, влияет ли введение AF-16 на биоинтеграцию в организм имплантированных чужеродных материалов.
Анестезированные взрослые крысы несли каждая осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 10 или 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Кроме того, 2 мг AF-16 вводили с помощью внутримышечной инъекции сразу после имплантации. Имплантаты состояли из тонких мембран (1×2 см), шовного материала и губки (0,2×0,5×1 см; предназначена для аугментации), изготовленных из разлагаемой полиуретанмочевины (Artelon®, получена в виде подарка от Artimplant, V. Frölunda, Sweden). Параллельно другим крысам имплантировали те же материалы в те же участки непосредственно под мышечной фасцией на их спине. Процедуру имплантации осуществляли настолько осторожно, насколько возможно, чтобы избежать кровотечения и избыточного повреждения ткани. Более того, губки из хитозана и хитозановые мембраны (Medicarb AB, Bromma, Sweden) имплантировали, как описано выше, крысам, которым вводили или AF-16, или наполнитель.
При проверке через 10 дней было обнаружено, что биоинтеграция имплантатов была превосходной у тех животных, которые получали AF-16, как при макроскопической оценке, так и при оценке посредством световой микроскопии тонких окрашенных срезов. Вдоль краев имплантатов было меньше воспалительных клеток и макрофагов, и было обнаружено, что фибробласты проникли в имплантированную губку, извлеченную из животных, получавших AF-16. Кроме того, заживление ран кожи у крыс, которым вводили AF-16, оказалось более законченным с меньшими реактивными изменениями по сравнению с теми, которым вводили наполнитель. Известно, что передача сигнала, приводящая к реактивным изменениям ткани, включает в себя передачу сигнала через липидные рафты и кавеолы клеток в поврежденной ткани.
Пример 7
Были проведены эксперименты, чтобы исследовать, влияет ли введение AF-16 на ишемические реакции во внутреннем органе тела.
Анестезированные взрослые крысы несли осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Кроме того, 2 мг AF-16 вводили с помощью внутримышечной инъекции сразу после имплантации насосов. Ишемию индуцировали односторонне в левой почке путем затруднения кровотока через почечную артерию в течение 40 минут и последующей рециркуляции. Правую почку хирургически удалили во время фиксации. После этого раны закрывали, и животные получали болеутоляющие лекарства, но не получали никакого дополнительного лечения. Параллельно другие крысы, получившие наполнитель, но не пептид, подверглись ишемии в левой почке, и их правые почки были удалены. Животные были анестезированы еще раз или через 4, или через 7 дней. Почку отделяли, осматривали, измеряли и взвешивали и фиксировали в буферном растворе формалина для дальнейшего исследования с помощью световой микроскопии.
Эксперименты показали, что ишемические и реактивные изменения в почке были наиболее значительными в проксимальных канальцах. В тех, которые были обработаны AF-16, наблюдалось меньшее кровотечение и некроз.
Пример 8
Были проведены эксперименты с неопластическими опухолями, чтобы исследовать, влияет ли на их рост применение AF-16.
Анестезированные взрослые крысы несли осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Кроме того, 2 мг AF-16 вводили с помощью внутримышечной инъекции сразу после имплантации насосов. Насосы заменяли на новые один раз в неделю. Различные опухоли, вызванные химически или трансплантированные, изучали по отношению к эффекту от введения AF-16, по сравнению с применением наполнителя.
У тех крыс, которые получили канцерогенный химикат, развились меньшие опухоли молочной железы в более низкой концентрации после применения AF-16, по сравнению с применением наполнителя. Реактивные и воспалительные изменения также были менее заметными. Также были изучены дополнительные экспериментальные опухоли, при применении AF-16 достигалось благотворное воздействие по сравнению с наполнителем.
Пример 9
Были проведены эксперименты с крысами с экспериментально индуцированным сахарным диабетом, вызванным воздействием стрептозоцина, изучаемыми по отношению к тому, влияет ли на них применение AF-16.
Анестезированные взрослые крысы несли осмотический мининасос (Alzet тип 2001; объем заполнения ~235 мкл; ~1 мкл/ч; заранее запущенный; заполняющий раствор содержит 20 мг/мл AF-16, растворенного в ФСБ, с добавлением 15% этанола), имплантированный подкожно на спину. Для сравнения другим крысам вводили наполнитель, но не пептид. Одну дозу стрептозоцина (Sigma) инъецировали крысам и наблюдали за появлением глюкозы в моче, контролируемом при помощи коммерческих индикаторных полосок, и появлением повышенных объемов мочи.
Применение AF-16 уменьшило, в соответствии с нашими предварительными результатами, потерю глюкозы с мочой и также уменьшило объем мочи. Уровень глюкозы в крови оказался ниже после AF-16.
Таким образом, AF-16 проявляет благотворное воздействие на развитие симптомов при химически вызванном сахарном диабете.
Пример 10
Были проведены эксперименты с AF, вводимым людям, страдающим сахарным диабетом II типа. Исследование было слепым по отношению к врачу и к пациентам. У всех пациентов был сахарный диабет II типа, и частота заболевания болезнями, отличными от сахарного диабета, для них всех была тщательно исследована в госпитале Университета в Lund в Швеции. Этические разрешения были получены от регионального комитета. Одной группе, x субъектов, давали AF, тогда как x субъектам во второй группе для сравнения вводили то же самое количество контрольного материала. Через 12 недель были забраны и проанализированы образцы крови.
Наблюдаемый результат состоял в том, что уровень HbA1c значительно упал (p≥0,05), на 0,2 единицы, для тех, кому вводили AF, по сравнению с теми, кому вводили неактивный раствор. Это означает, что уровень глюкозы в крови субъектов, получавших AF, остался на более низком уровне и лучше контролируется по сравнению с параметрами у тех, кто оказался в группе сравнения (плацебо). Таким образом, благотворное воздействие по отношению к исходу заболевания сахарным диабетом типа II достигнуто для тех субъектов, которые получали AF.
Пример 11
Осциллирующие изменения концентрации иона кальция составляют крайне важную часть сигнального аппарата во многих типах клеток, например нейронах и астроцитах, доминирующих в мозге, спинном мозге и ретине. Более того, было описано, что эндокринные клетки, как, например, панкреатические β-клетки, проявляют пульсирующую секрецию инсулина. Также показано, что эндокринные панкреатические клетки проявляют связанные ионные изменения при, например, захвате глюкозы. Полагают, что слабые нарушения осцилляций ионов кальция в астроглиальных клетках нарушают регуляцию, например, внеклеточного глутамата, что само по себе может привести к местной микроглиальной активации с производством провоспалительных цитокинов, набуханием астроцитов и, вследствие указанного набухания, уменьшенному внеклеточному пространству и в конце концов к разрушению мозга. В таком состоянии наблюдается уменьшение как высвобождения глутамата, так и нейрональной трансмиссии. Предположительно, такая пониженная трансмиссия и нарушенная активность в мозге соотносится, вероятно, с дисфункцией нервной системы и патологической психоневрологической активностью и деятельностью.
Были проведены эксперименты, чтобы проиллюстрировать осцилляции ионов кальция в астроцитах в нервной ткани. Осцилляции вызывают с помощью стимулятора, например гистамина и/или моноаминергического трансмиттера, и определяют возможность контроля активности с помощью определенных белков, таких как AF. Локальную концентрацию ионов кальция определяют с помощью соединений, связывающих кальций, флуоресценция которых изменяется количественно и качественно с концентрацией внутриклеточных ионов кальция. Использовали флуоресцентную микроскопию и конфокальную сканирующую микроскопию астроцитов и нейронов, главным образом выращенных in vitro. Затем применяли электрофизиологические методы. К клеткам добавляли определенные концентрации AF, для того чтобы посредством этого определить воздействие на системы ионных переносчиков, расположенных в липидных рафтах в клетках.
Кроме того, различные типы мышечных клеток и клеток соединительной ткани аналогичным образом анализировали на распространение, частоту и амплитуду осцилляций ионов кальция в их цитоплазме непосредственно перед и после добавления AF и родственных соединений.
Как можно видеть на типичной фиг.1, наблюдение осцилляций кальция в клетке, ткани и/или органе действительно позволяет наблюдать за дисфункциями таких сигнальных процессов и помочь в нормализации. Посредством этого становится возможным лечение дисфункций и заболеваний.
Пример 12
Аквапорины представляют собой семейство белков, интегрированных в мембраны и экспрессируемых во всех живых клетках и организмах. Главной функцией аквапоринов является контролирование потока воды внутрь и наружу клеток, т.е. между цитоплазмой клеток и внеклеточной средой. Каждый тип клеток, тканей и органов имеет свой специфический набор аквапоринов с особенностями распределения характеристик. Функциональные аквапорины в основном скапливаются в липидных рафтах и кавеолах, тогда как субъединицы и диссоциированные аквапориновые комплексы можно наблюдать вне указанных мембранных компонентов.
Проведенные эксперименты на мозге и спинном мозге показали, что экспрессия и распределение аквапоринов, главным образом аквапорина-1 и аквапорина-4, изменяется под воздействием ишемии или деформации и механической нагрузки. Более того, при инфекции мозга и спинного мозга, например энцефалите, схема распределения и интенсивности двух указанных аквапоринов изменяется, как показано с помощью иммуногистохимии и иммунохимии. Взаимодействие между, например, нейронами и поддерживающими глиальными клетками и сосудистыми структурами, по-видимому, является запутанным и сложным, но важным.
Провели эксперименты, более подробно отображающие результаты травмы, инфекций и других патологических состояний. Курсы лечения с AF белками, пептидами, производными и гомологами вводили местно и системно, принимали в виде отдельной дозы, или в виде многократных применений, или постоянно, т.е. до конца жизни субъекта, которого лечат. Результаты характеризуют количественно и качественно значение воздействия на структуру и функции различных типов аквапоринов в организме. Эксперименты демонстрируют, что AF оказывает большое воздействие на контролирование и даже нормализацию распространения, распределения и активности аквапоринов и комплексов ионных каналов, из которых вторые взаимодействуют с первыми. Таким образом, на основании достигнутых результатов могут быть разработаны новые и важные способы лечения.
СПИСОК ЛИТЕРАТУРЫ

| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ КОМПАРТМЕНТ-СИНДРОМА | 2007 |
|
RU2465914C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЯИЧНОГО ЖЕЛТКА С ВЫСОКИМ СОДЕРЖАНИЕМ AF-16 | 2016 |
|
RU2723097C1 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ ПОВЫШЕННОГО ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ | 2007 |
|
RU2458703C2 |
| НОВОЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2416426C2 |
| НЕЙРОЭНДОКРИННЫЕ ФАКТОРЫ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2496790C2 |
| УРОКОРТИН III, ЕГО АНАЛОГ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2002 |
|
RU2305109C2 |
| ИНГИБИТОРЫ АПОПТОЗА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2582247C2 |
| СПОСОБНЫЕ К ТРАНСДУКЦИИ ПОЛИПЕПТИДЫ ДЛЯ МОДИФИКАЦИИ МИТОХОНДРИАЛЬНОГО МЕТАБОЛИЗМА | 2009 |
|
RU2529950C2 |
| МУТАНТНЫЕ ПОЛИПЕПТИДЫ СУАА И ПРОИЗВОДНЫЕ ПОЛИПЕПТИДОВ, ПОДХОДЯЩИЕ ДЛЯ ДОСТАВКИ ИММУНОГЕННЫХ МОЛЕКУЛ В КЛЕТКУ | 2010 |
|
RU2585216C2 |
| ОЧИЩЕННЫЙ ИММУНОГЕННЫЙ БЕЛОК, ЕГО ФРАГМЕНТЫ И ПРОИЗВОДНЫЕ | 1999 |
|
RU2304585C2 |




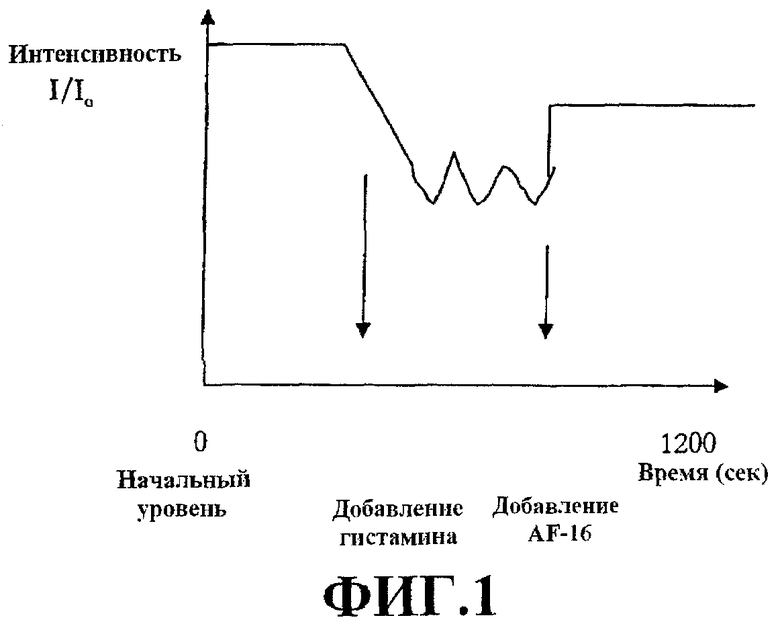
Группа изобретений относится к вариантам применения антисекреторного белка, который соответствует аминокислотной последовательности SEQ ID NO:6, его гомолога, и/или фрагмента, содержащего аминокислотную последовательность SEQ ID NO:4, обладающего эквивалентной активностью, и/или его фармацевтически активной соли для получения фармацевтической композиции и/или лечебного питания для лечения и/или профилактики дисфункции, например патологической функции, гипо- или гиперфункции липидных рафтов, рецепторов и/или кавеол. Дисфункция липидных рафтов, рецепторов и/или кавеол может быть вызвана или служить причиной ряда других состояний, таких как сосудистые и легочные дисфункции и/или эндокринные нарушения, например диабет и родственные нарушения. Группа изобретений позволяет контролировать внутриклеточный транспорт и высвобождение клеточных продуктов, а также нормализовать распределение компонентов ткани при различных заболеваниях. 2 н. и 10 з.п. ф-лы, 12 пр., 1 ил.
1. Применение антисекреторного белка, который соответствует аминокислотной последовательности SEQ ID NO:6, его гомолога или фрагмента, содержащего аминокислотную последовательность SEQ ID NO:4, которые имеют эквивалентную активность, и/или фармацевтически активной соли, для получения фармацевтической композиции
a. для лечения и/или профилактики дисфункции липидных рафтов, рецепторов и/или кавеол в клеточных мембранах, где указанная дисфункция выбрана из группы, состоящей из сосудистой дисфункции, сердечно-сосудистой дисфункции, легочной дисфункции, сахарного диабета, осложнений, связанных с сахарным диабетом, образования рубцовой ткани, восстановления тканей и/или органов, реактивного образования избыточной ткани, восстановления и/или регенерации эпителиального клеточного покрытия, гиперплазии и/или гипертрофии клеток и/или ткани, кардиомиопатии, легочных нарушений и опухолей и их осложнений, или
b. для улучшения биоинтеграции имплантированного чужеродного материала млекопитающему.
2. Применение по п.1, где указанный антисекреторный белок выбран из одного или нескольких белков, содержащих аминокислотные последовательности SEQ ID NO:1-6.
3. Применение по п.1, где указанная фармацевтическая композиция содержит два или более антисекреторных белка.
4. Применение по п.1, где дисфункция выбрана из группы, состоящей из патологической, недостаточной, гипо- или гиперфункции.
5. Применение по п.1, где указанная фармацевтическая композиция дополнительно содержит фармацевтически приемлемый эксципиент.
6. Применение по любому из пп.1-5, где указанную фармацевтическую композицию получают для внутриглазного, интраназального, перорального введения, местного нанесения, подкожного и/или системного введения.
7. Применение по любому из пп.1-5, где указанную фармацевтическую композицию получают для введения в виде спрея, аэрозоля, ингалятора или посредством распылителя.
8. Применение по любому из пп.1-5, где фармацевтическую композицию и/или лечебное питание получают для системного введения в кровь в дозировке от 0,1 мкг до 10 мг на прием на кг веса тела в сутки, предпочтительно, 1-1000 мкг на прием на кг веса тела в сутки.
9. Применение по п.8, где указанное введение осуществляют или в виде единичной дозы, или в виде многократных ежедневных приемов.
10. Применение по п.6, где указанную фармацевтическую композицию получают для введения в виде спрея, аэрозоля, ингалятора или посредством распылителя.
11. Применение по п.7, где указанное введение осуществляют или в виде единичной дозы, или в виде многократных ежедневных приемов.
12. Применение антисекреторного белка, его гомолога, и/или фрагмента, обладающего эквивалентной активностью, и/или его фармацевтически активной соли, для лечения и/или профилактики дисфункции липидных рафтов, рецепторов и/или кавеол в клеточных мембранах, где указанная дисфункция выбрана из группы, состоящей из сосудистой дисфункции, сердечно-сосудистой дисфункции, легочной дисфункции, сахарного диабета, осложнений, связанных с сахарным диабетом, образования рубцовой ткани, восстановления тканей и органов, реактивного образования избыточной ткани, восстановления и/или регенерации эпителиального клеточного покрытия, гиперплазии и/или гипертрофии клеток и/или ткани, кардиомиопатии, легочных нарушений и опухолей и их осложнений, или для улучшения биоинтеграции имплантированного чужеродного материала млекопитающему,
где указанный антисекреторный белок состоит из последовательности следующей формулы
X1-V-C-X2-X3-K-X4-R-X5,
где X1 представляет собой I, аминокислоты 1-35 последовательности SEQ ID NO:6 или отсутствует, Х2 представляет собой Н, R или K, Х3 представляет собой S или L, Х4 представляет собой Т или А, Х5 представляет собой аминокислоты 43-46, 43-51, 43-80 или 43-163 последовательности SEQ ID NO:6 или отсутствует.
| WO 2005030246 А, 07.04.2005 | |||
| ПРИСПОСОБЛЕНИЕ К ВОЗДУШНЫМ ДВУХКАМЕРНЫМ ТОРМОЗАМ ДЛЯ ПОЛУЧЕНИЯ ПЕРЕМЕННОГО ТОРМОЖЕНИЯ | 1930 |
|
SU38535A1 |
| US 6344440, 05.02.2002 | |||
| US 20050048100 A1, 03.03.2005. | |||
Авторы
Даты
2012-08-10—Публикация
2007-04-27—Подача