ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению пептидов, полипептидов и белков, содержащих определенные элементы группы белков, называемых антисекреторными факторами, в производстве лекарственного средства для лечения и/или профилактики состояния, характеризующегося или связанного с патологической гибелью и/или ростом клеток, или повышенной продукцией, или отклоняющейся от нормы скоростью разрушения белков, экспрессирующихся в клетке, например, при патологическом разрушении или потере контроля над восстановлением, возвращением к норме и/или регенерацией дифференцированных клеток и/или тканей, включая в себя стволовые клетки или клетки-предшественники, или медицинских состояний, характеризующихся или связанных с такими состояниями, включая повреждение головного мозга и других частей нервной системы в результате травмы, асфиксии, под действием токсинов, гипоксии, ишемии, инфекций или дегенеративных или метаболических повреждений, приводящих в результате к нарушению, задерживающему воздействию или другому отклонению от нормы в структуре и функции. Особенно оно относится к новому применению антисекреторного белка или олиго- или полипептида, или их производных, к новому применению индуцирующей антисекреторный белок пищи (ссылка 15) и к новому применению яичного желтка с высоким уровнем антисекреторного белка.
Кроме того, настоящее изобретение относится к способу размножения, индукции, снижения и/или поддержания воспроизводства выделенной стволовой клетки, и к способу лечения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Травматические, асфиксические, гипоксические, ишемические, токсические, инфекционные, дегенеративные или метаболические повреждения центральной нервной системы (CNS), периферической нервной системы (PNS) или автономной нервной системы (ANS) часто приводят в результате к повреждению нескольких различных типов клеток. Примерами дегенеративного состояния в CNS являются болезни Паркинсона и Альцгеймера, каждая из которых часто вызывает гибель специфических популяций клеток. В частности, первая связана со специфической гибелью допаминергических нейронов в черной субстанции. Подобным образом, рассеянный склероз связан со структурным и функциональным повреждением аксонов, а также с потерей миелина и олигодендроцитов. Болезнь Альцгеймера представляет собой другую иллюстрацию дегенеративного заболевания, обусловленного гибелью нейронов. Кроме того, существует много примеров, в которых повреждения или заболевания CNS, PNS и ANS связаны с повреждением олигодендроглии, астроглии, клеток-сателлитов, шванновских клеток, микроглии, клеток сосудов и нейронов.
В целом, для головного мозга взрослого млекопитающего после разрушения или повреждения не характерно замещение нейронов и дифференцированных клеток глии. Поэтому гибель нейронов, как правило, считают необратимой. Однако необходимо подчеркнуть, что восстановление при заболеваниях, опухолях головного мозга и травмах нервной системы в основном зависит от восстановления и перестройки выживших клеток. Тем не менее, в субвентрикулярной зоне (SVZ) боковых желудочков головного мозга, а также в субгранулярной зоне зубчатой извилины в гиппокампе (ссылки 2, 3, 4) постнатальный нейрогенез в значительной степени сохраняется во взрослом состоянии во всех видах млекопитающих, включая человека. Кроме того, незначительно распространенная совокупность нейрональных клеток-предшественников существует в спинном мозге и в ANS. Необходимо подчеркнуть, что при повреждениях и заболеваниях тканей нервной системы могут восстанавливаться и образовываться клетки сосудов, клетки микроглии и макрофаги, а также клетки соединительной ткани. Как и в других тканях организма взрослых млекопитающих, включая человека, в головном мозге существует популяция омнипотентных клеток, называемых клетками-предшественниками. Нейрональные клетки-предшественники представляют собой стволовые клетки и располагаются в субвентрикулярной зоне (SVZ) боковых желудочков головного мозга, а также в субгранулярной зоне зубчатой извилины гиппокампа, где такие клетки постоянно пролиферируют и мигрируют в прилежащие структуры головного мозга, и в итоге разрушаются или выживают и дифференцируются. "Новорожденные" нейроны, предпочтительно, например, в SGZ, мигрируют в слой зернистых клеток гиппокампа и в итоге экспрессируют маркеры дифференцированных нейронов, и обладают морфологическими характеристиками, соответствующими дифференцированным зернистым клеткам, встраиваясь отростками аксонов в путь мшистых волокон и образуя синаптические контакты с их мишенями в гиппокампе (ссылка 5). Следует подчеркнуть, что без адекватной стимуляции значительная часть таких вновь образованных клеток может разрушаться, тогда как другие приобретают характеристики глиальной клетки (ссылки 3, 4, 5).
Нейрогенез в зубчатой извилине чрезвычайно интересен сам по себе, поскольку гиппокамп тесно связан с пространственными обучением и памятью (ссылка 6). Нейрогенез в SVZ происходит через ростральный миграционный тракт, обеспечивая обонятельную долю новыми нейронами, но, например, при инсульте и травме нервной системы направление миграции первичных нейрональных клеток-предшественников может отклоняться к поврежденным или пораженным заболеванием участкам, если они расположены в достаточной близости к мигрирующим клеткам-предшественникам.
На пролиферацию клеток-предшественников в SVZ и SGZ влияет, например, введение факторов роста, интерлейкинов, антагониста рецептора N-метил-d-аспартата (NMDA) или удаление надпочечников, приводящее в дальнейшем к пониженному уровню или отсутствию кортикостероидных гормонов (ссылки 7, 8). Кроме того, воздействие "обогащенной внешней среды" сопровождается повышенным числом выживших, вновь образованных зернистых клеток, а также повышенным общим числом выживших нейронов, например, в зубчатой извилине (ссылка 9). С возрастом образование новых нейронов снижается (ссылка 3).
Ослабление воспалительной реакции в нервной ткани после повреждения или заболевания является полезным и приводит в результате к повышенному числу выживших нейронов, повышенному и распространенному формированию синапсов и пониженному астроцитозу, с сопутствующими меньшими задерживающими воздействиями на кровеносные сосуды и связанные структуры, и, тем самым, на кровоток. Воспаление, от слабого до умеренного, благоприятствует процессам возвращения к норме и восстановления, а также нейрогенезу, тогда как сильное воспаление причиняет вред и может приводить к усиленной гибели клеток и ткани, которые в противном случае могли быть восстановлены.
Антисекреторные факторы (AF) представляют собой класс белков, естественным образом образующихся в организме. Общеизвестные сведения об антисекреторных факторах суммированы Lange & Lönnroth (ссылка 1). Их структура и некоторые эффекты, проявляемые AF в организме животных, включая человека, описаны в заявке на патент WO97/08202 (ссылка 10). Выделенный из гипофиза белок AF человека представляет собой белок размером 41 кДа, включающий в себя 382 аминокислоты.
Связанный с противовоспалительным и антисекреторным эффектами AF активный участок, по-видимому, расположен в белке в области, близкой N-концевым частям AF, расположен в №1-163 или, более предпочтительно, в 36-52 или 36-44, или их вариантах.
В недавних исследованиях, выполненных авторами настоящего изобретения, было обнаружено, что AF в некоторой степени гомологичен белку S5a, также называемому Rpn 10, который образует субъединицу преобладающего во всех клетках компонента, протеасомы 26 S, более конкретно - регуляторного комплекса 19 S/PA 700. В настоящем изобретении белки AF определяют как класс гомологичных белков, обладающих одними и теми же функциональными свойствами. Протеасомы обладают множеством функций, относящихся к разрушению избыточных белков, а также короткоживущих, нежелательных, денатурированных, с неправильной укладкой и других отклоняющихся от нормы белков. Кроме того, AF/S5a/Rpn10 вовлечен в распределение и транспорт компонентов клетки, большей частью, очевидно, белков.
В двух статьях, опубликованных в международных научных журналах в 2004, Davidson и Hickey (ссылки 11, 12), подтверждая положения предыдущих патентной заявки и патента (ссылки 10, 14), сообщают, что они получили антитело к AF, регулирующее воспалительные реакции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В ходе этой работы авторы настоящего изобретения неожиданно обнаружили, что AF и их фрагменты способны улучшать восстановление нервных тканей, а также опосредовать и/или снижать воздействие травмы, воспалений и прогрессирующих дегенераций, что определяли по сниженной гибели нервной ткани и по ингибированию образования или повышению распада накапливающихся в противном случае β-амилоида и других компонентов ткани, спасая таким образом ткань. Также зарегистрированы благоприятные воздействия, например, на компоненты сосудов. Кроме того, AF и их фрагменты способны приводить к спасению компонентов нервной ткани и поддерживать пролиферацию клеток-предшественников, преобладающих в CNS во взрослом состоянии. Это позволяет предположить новый и интересный способ действия, которым AF и их фрагменты могут опосредовать спасение и выживание пораженных клеток, а также способствовать пролиферации и миграции стволовых клеток и клеток-предшественников в SVZ и SGZ.
В частности, авторы изобретения установили, что AF и их определенные фрагменты могут регулировать разрушение, восстановление, регенерацию компонентов нервной ткани, миграцию и дифференцировку клеток-предшественников и формирование синапсов между существующими клетками и новыми клетками, способствуя формированию синапса и функциональному восстановлению, а также снижению скорости и степени дегенерации и разрушения ткани.
Таким образом, настоящее изобретение относится к новым и улучшенным способам лечения повреждений, дисфункций, заболеваний или нарушений в CNS, PNS и/или ANS, в числе прочих, и тем самым предоставляет возможности благоприятного воздействия на функцию ткани.
Головной и спинной мозг у взрослых млекопитающих, включая человека, на протяжении жизни сохраняет способность к образованию нейронов, хотя это в значительной степени ограничено только определенными областями. Новые нейроны, клетки глии, а также, предположительно, клетки сосудов образуются посредством пролиферации стволовых клеток или клеток-предшественников. В ходе исследования, приведшего к настоящему изобретению, стало очевидно, что определенные фрагменты AF приводят к спасению нервную ткань и вызывают повышенное образование новых клеток, включая в себя отростки и синапсы между клетками.
В ходе этой работы было неожиданно обнаружено, что гибель нервной ткани после повреждения CNS или в ходе развития заболевания или расстройства нервной системы возможно лечить введением эффективного количества AF или определенных фрагментов AF. Таким образом, существует возможность спасать нервную ткань и воздействовать на образование, миграцию и дифференцировку клетки, и на формирование синапса после гибели как нейрона, так и клетки глии в CNS, PNS или ANS, или предотвращать связанное с возрастом разрушение указанных клеток в CNS, PNS и ANS.
В последующем тексте аминокислоты названы в соответствии с общепринятыми в биохимии сокращениями, основанными на применении однобуквенного обозначения каждой аминокислоты.
В одном из аспектов настоящее изобретение относится к применению
антисекреторного белка;
или олиго- или полипептида, или их производных, содержащих аминокислотную последовательность из формулы I:
X1-V-C-X2-X3-K-X4-R-X5 (формула I)
где
X1 представляет собой I, аминокислоты №№1-35 из SEQ ID №:2, или отсутствует;
X2 представляет собой H, R или K
X3 представляет собой S или L
X4 представляет собой T или A
X5 представляет собой аминокислоты №№43-46, 43-51, 43-80 или 43-163 из SEQ ID №:2, или отсутствует;
или их фармацевтически приемлемой соли;
в производстве лекарственного средства для лечения и/или профилактики состояния, связанного с или характеризующегося спасением или патологической гибелью и/или ростом нервной ткани.
В одном из вариантов осуществления изобретения формула I имеет последовательность, выбранную из одной из:
a) аминокислот под номерами 35-42 SEQ ID №:2,
b) аминокислот под номерами 35-46 SEQ ID №:2,
c) аминокислот под номерами 36-51 SEQ ID №:2,
d) аминокислот под номерами 36-80 SEQ ID №:2,
e) аминокислот под номерами 1-80 SEQ ID №:2, или
f) аминокислот под номерами 1-163 SEQ ID №:2
или их фармацевтически приемлемой соли.
SEQ ID №:1 представляет собой аминокислотную последовательность полипептида или белка антисекреторного фактора, как указано в Johansson, E. et al. (ссылка 13) или Lange, S et al. (ссылки 10, 14).
Во втором аспекте настоящее изобретение относится к применению индуцирующей антисекреторный белок пищи в производстве пищи или лечебных продуктов питания для лечения и/или профилактики состояния, связанного с или характеризующегося спасением или патологической гибелью и/или ростом нервной ткани.
В третьем аспекте настоящее изобретение относится к применению яичного желтка с высоким уровнем антисекреторного белка, предпочтительно, по крайней мере 1000 FIL единиц/мл, в производстве пищи или лечебных продуктов питания для лечения и/или профилактики состояния, связанного с или характеризующегося спасением или патологической гибелью и/или ростом нервной ткани.
В одном из вариантов осуществления изобретения состояние характеризуется проявлением патологической дегенерации, потери способности к и/или потери контроля над регенерацией дифференцированной клетки и/или ткани, эмбриональной стволовой клетки, взрослой стволовой клетки, клетки-предшественника и/или клетки, происходящей из стволовой клетки или клетки-предшественника. В другом же варианте осуществления состояние связано с или характеризуется патологической гибелью и/или ростом клеток периферической нервной системы, автономной нервной системы и/или центральной нервной системы, а в еще одном варианте осуществления состояние связано с или характеризуется спасением или патологической гибелью и/или ростом нейрональных стволовых клеток или нейрональных клеток-предшественников.
В одном из вариантов осуществления изобретения состояние связано с или характеризуется патологической гибелью и/или ростом олигодендроглии, астроглии, шванновских клеток и/или нейрональных клеток, и/или популяций клеток, а в другом - состояние связано с или характеризуется патологической гибелью и/или ростом нехолинергических нейрональных клеток, холинергических нейрональных клеток и/или клеток глии, и/или популяций клеток.
В другом же варианте осуществления изобретения состояние обусловлено повреждением центральной нервной системы или нарушением в центральной нервной системе, а в еще одном варианте осуществления состояние обусловлено травматическим, злокачественным, воспалительным, аутоиммунным или дегенеративным заболеванием.
В другом варианте осуществления состояние обусловлено повреждением аксонов, вызываемым сотрясением, ушибом, повреждением аксонов, вызываемым черепно-мозговой травмой, повреждением аксонов, вызываемым болезнью малых сосудов в CNS и/или повреждением спинного мозга после заболевания и/или травмы, в другом варианте осуществления указанное состояние характеризуется потерей памяти, и, наконец, в последнем варианте осуществления новых применений состояние представляет собой рассеянный склероз, асфиксию, гипоксическое повреждение, ишемическое повреждение, травматическое повреждение, болезнь Паркинсона, болезнь Альцгеймера, инсульт или демиелинизирующее заболевание.
В четвертом аспекте настоящее изобретение относится к применению яичного желтка с высоким уровнем антисекреторных белков в соответствии с любым из новых применений, как описано выше.
В пятом аспекте настоящее изобретение относится к применению пищи и/или питьевого раствора, индуцирующих образование антисекреторных белков, в соответствии с любым из новых применений, как описано выше.
В одном из вариантов осуществления лекарственное средство составляют для внутривенной инфузии, внутримышечной инъекции и/или подкожной инъекции, в другом варианте осуществления лекарственное средство составляют таким образом, что при введении пациенту активное вещество проникает в желудочки и/или другие полости на или в головном мозге указанного пациента, а в еще одном варианте осуществления лекарственное средство составляют таким образом, что при введении пациенту активное вещество проникает в спинномозговую жидкость указанного пациента.
В шестом аспекте настоящее изобретение относится к способу размножения, индукции, снижения и/или поддержания воспроизводства in vitro стволовой клетки и/или потомка стволовой клетки, выделенных из любого зародышевого ростка, характеризующемуся обработкой выделенной клетки антисекреторным белком или олиго- или полипептидом, или их производными, содержащими аминокислотную последовательность из формулы I:
X1-V-C-X2-X3-K-X4-R-X5 (формула I)
где
X1 представляет собой I, аминокислоты №№1-35 из SEQ ID №:2, или отсутствует;
X2 представляет собой H, R или K
X3 представляет собой S или L
X4 представляет собой T или A
X5 представляет собой аминокислоты №№43-46, 43-51, 43-80 или 43-163 из SEQ ID №:2, или отсутствует,
или их фармацевтически приемлемой солью.
В одном из вариантов осуществления описанного выше способа формула I имеет последовательность, выбранную из одной из:
a) аминокислот под номерами 35-42 SEQ ID №:2,
b) аминокислот под номерами 35-46 SEQ ID №:2,
c) аминокислот под номерами 36-51 SEQ ID №:2,
d) аминокислот под номерами 36-80 SEQ ID №:2,
e) аминокислот под номерами 1-80 SEQ ID №:2, или
f) аминокислот под номерами 1-163 SEQ ID №:2
или их фармацевтически приемлемой соли.
В другом варианте осуществления способа указанную выделенную клетку выбирают из группы, содержащей эпителиальные клетки, фибробласты, остеогенные клетки, макрофаги и клетки микроглии, клетки сосудов, костные клетки, хондроциты, клетки миокарда, клетки крови, нейроны, олигодендроциты, клетки астроглии, клетки-предшественники, стволовые клетки и/или клетки, происходящие из клеток-предшественников или стволовых клеток.
В седьмом аспекте настоящее изобретение относится к способу лечения и/или профилактики состояния, связанного с или характеризующегося патологической гибелью и/или ростом, и/или спасением нервной ткани, где способ включает введение пациенту эффективного количества антисекреторного белка или олиго- или полипептида, или их производных, содержащих аминокислотную последовательность из формулы I:
X1-V-C-X2-X3-K-X4-R-X5 (формула I)
где
X1 представляет собой I, аминокислоты №№1-35 из SEQ ID №:2, или отсутствует;
X2 представляет собой H, R или K
X3 представляет собой S или L
X4 представляет собой T или A
X5 представляет собой аминокислоты №№43-46, 43-51, 43-80 или 43-163 из SEQ ID №:2, или отсутствует,
или их фармацевтически приемлемой соли.
В одном из вариантов осуществления способа лечения и/или профилактики формула I имеет последовательность, выбранную из одной из:
a) аминокислот под номерами 35-42 SEQ ID №:2,
b) аминокислот под номерами 35-46 SEQ ID №:2,
c) аминокислот под номерами 36-51 SEQ ID №:2,
d) аминокислот под номерами 36-80 SEQ ID №:2,
e) аминокислот под номерами 1-80 SEQ ID №:2, или
f) аминокислот под номерами 1-163 SEQ ID №:2
или их фармацевтически приемлемой соли.
В другом варианте осуществления способа состояние характеризуется проявлением патологической дегенерации, потери способности к и/или потери контроля над регенерацией дифференцированной клетки и/или ткани, эмбриональной стволовой клетки, взрослой стволовой клетки, клетки-предшественника и/или клетки, происходящей из стволовой клетки или клетки-предшественника, а в еще одном варианте осуществления состояние связано с или характеризуется патологической гибелью и/или ростом клеток периферической, автономной или центральной нервной системы.
В еще одном варианте осуществления способа состояние связано с или характеризуется патологической гибелью и/или ростом нейрональных стволовых клеток или нейрональных клеток-предшественников, а в другом же варианте осуществления состояние связано с или характеризуется патологической гибелью и/или ростом олигодендроглиальных, астроглиальных, шванновских клеток и/или нейрональных клеток, и/или популяций клеток.
В другом варианте осуществления состояние связано с или характеризуется патологической гибелью и/или ростом нехолинергических нейрональных клеток, холинергических нейрональных клеток и/или клеток глии, и/или популяций клеток, а в еще одном варианте осуществления состояние обусловлено повреждением центральной нервной системы или нарушением в центральной нервной системе.
В одном из вариантов осуществления состояние обусловлено травматическим, аутоиммунным или дегенеративным заболеванием, в другом варианте осуществления состояние обусловлено повреждением аксонов, вызываемым сотрясением, ушибом, повреждением аксонов, вызываемым черепно-мозговой травмой, повреждением аксонов, вызываемым болезнью малых сосудов в CNS и/или повреждением спинного мозга после заболевания и/или травмы, в еще одном варианте осуществления указанное состояние характеризуется потерей памяти.
В одном из вариантов осуществления способа лечения и/или профилактики состояние представляет собой рассеянный склероз, асфиксию, гипоксическое повреждение, ишемическое повреждение, травматическое повреждение, болезнь Паркинсона, болезнь Альцгеймера, инсульт или демиелинизирующее заболевание.
В другом варианте осуществления описанного выше способа антисекреторный белок или олиго- или полипептид, или их производные включают в состав лекарственного средства для внутривенной инфузии, внутримышечной инъекции и/или подкожной инъекции, в еще одном варианте осуществления антисекреторный белок или олиго- или полипептид, или их производные включают в состав лекарственного средства таким образом, что при введении пациенту активное вещество проникает в желудочки и/или другие полости в и/или на головном мозге указанного пациента, и в последнем варианте осуществления антисекреторный белок или олиго- или полипептид, или их производные включают в состав лекарственного средства таким образом, что при введении пациенту активное вещество проникает в спинномозговую жидкость указанного пациента.
В восьмом аспекте настоящее изобретение относится к способу размножения, индукции, снижения и/или поддержания воспроизводства стволовой клетки и/или потомка стволовой клетки, выделенных у пациента из любого зародышевого ростка, характеризующемуся:
a) введением указанному пациенту эффективного количества антисекреторного белка или олиго- или полипептида, или их производных, содержащих аминокислотную последовательность из формулы I, как указано выше, перед выделением указанной клетки;
b) размножением in vitro указанной выделенной клетки;
с последующей
с) пересадкой указанных размноженных клеток тому же или другому пациенту.
В девятом аспекте настоящее изобретение относится к способу размножения, индукции, снижения и/или поддержания воспроизводства стволовой клетки и/или потомка стволовой клетки, выделенных у пациента из любого зародышевого ростка, характеризующемуся:
a) выделением у пациента указанных клетки и/или потомка стволовой клетки;
b) введением in vitro эффективного количества антисекреторного белка или олиго- или полипептида, или их производных, содержащих аминокислотную последовательность из формулы I, как определено выше, в указанную выделенную клетку и размножением указанных клеток;
с последующей
c) пересадкой указанных размноженных клеток обратно тому же или другому пациенту.
В одном из вариантов осуществления этих двух только что описанных способов указанную выделенную клетку выбирают из группы, состоящей из фибробластов, макрофагов, клеток сосудов, костных клеток, хондроцитов, клеток миокарда, клеток крови, нейронов, олигодендроцитов, клеток астроглии, шванновских клеток, клеток-предшественников, стволовых клеток и/или клеток, происходящих из клеток-предшественников или стволовых клеток.
В некоторых вариантах осуществления изобретения полипептиды из формулы I могут дополнительно содержать защищающие группы. Примеры N-концевых защищающих групп включают в себя ацетильную группу. Примеры C-концевых защищающих групп включают в себя амидную группу.
Другой вариант осуществления изобретения относится к лечению состояний, связанных с недостаточным образованием AF и родственных соединений или недостаточностью функции рецептора AF, посредством обеспечения индивидуума необходимым AF соответствующим способом, как описано выше.
Для специалиста в этой области очевидно, что другой вариант осуществления изобретения включает в себя использование эндогенно вырабатываемых AF. Их можно получать согласно патенту, в котором описан способ индукции AF введением индуцирующих AF продуктов питания (ссылка 15).
В другом варианте осуществления изобретения используют введение содержащих высокий уровень AF яичных желтков, также описанное ранее в патенте (ссылка 16).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем контексте термин патологическая гибель и/или рост клеток применяют для описания общепринятой технической характеристики множества медицинских состояний и заболеваний. Состояния и заболевания характеризуются проявлением патологической дегенерации, потери способности к регенерации и/или потери контроля над регенерацией дифференцированной клетки и/или ткани, эмбриональной клетки, взрослой стволовой клетки, клетки-предшественника и/или клетки, происходящей из стволовой клетки или клетки-предшественника. Кроме того, термин дополнительно включает в себя повышенные выживание и спасение клеток нервной ткани и сниженные или устраненные вторичные дегенеративные эффекты.
Состояние, которое следует лечить, может быть обусловлено, в числе прочих, одним или более из травматической асфиксии, невропатической боли, гипоксических, ишемических, токсических, инфекционных, дегенеративных или метаболических повреждений нервной системы. Они часто приводят в результате к повреждению нескольких различных типов клеток. Таким образом, повреждение головного мозга вследствие любой из указанных причин часто вызывает неврологические, когнитивные нарушения и дополнительные психиатрические симптомы. В других случаях состояния могут быть обусловлены травматическим, аутоиммунным или дегенеративным заболеванием или лечением лекарственными средствами или рентгеновским излучением. Кроме того, в других случаях состояние может быть обусловлено генетическими факторами, или причина может быть неизвестна. Более того, в других случаях состояние может быть обусловлено повреждением аксонов, вызываемым сотрясением, повреждением аксонов, вызываемым черепно-мозговой травмой или травмой туловища, повреждением аксонов, вызываемым болезнью малых сосудов в CNS и/или повреждением спинного мозга после заболевания и/или травмы.
В одном из вариантов осуществления изобретения состояние, которое следует лечить, представляет собой состояние, связанное с или характеризующееся патологической гибелью и/или ростом клеток в CNS, а также PNS и/или ANS.
Клетки, на которые можно воздействовать полипептидом, содержащим фрагмент аминокислотной последовательности по SEQ ID №:2, представляют собой, например, стволовые клетки, клетки-предшественники и/или даже дифференцированные клетки, приобретающие повышенную выживаемость и восстанавливающие временно потерянную функцию. Они могут принадлежать к любому из трех зародышевых листков. После стимуляции клетки дифференцируются, приобретают функцию и формируют синапсы, замещая неправильно функционирующие, гибнущие или погибшие клетки или популяции клеток, такие как при патологических состояниях CNS, PNS и/или ANS, которые характеризуются отклоняющейся от нормы гибелью клеток, таких как глиальные и/или нейрональная клетка или популяции клеток, таких как нейрональные клетки, и/или популяция клеток, а также клетки сосудов.
В частности, изобретение относится к лечению состояний, связанных с или характеризующихся гибелью стволовых клеток, предпочтительно - нейрональных стволовых клеток, или состояний, характеризующихся или связанных с гибелью и/или ростом клеток-предшественников. Кроме того, изобретение относится к повышенной выживаемости стволовых клеток или клеток-предшественников, пересаженных в нервную ткань.
Также, в частности, изобретение относится к лечению состояний, связанных с гибелью и/или ростом дифференцированных клеток. В одном предпочтительном варианте осуществления дифференцированные клетки представляют собой костные клетки, клетки хряща, кардиомиоциты, клетки олигодендроглии, астроглии, нейрональные клетки, эпителиальные клетки эндотелия, кожи, крови, печени, почки, кости, соединительной ткани, ткани легких, ткани железы внешней секреции и/или ткани железы внутренней секреции, или мышечные клетки. Предпочтительно, дифференцированные клетки представляют собой нейрональные клетки, нейроны, астроциты, олигодендроциты, шванновские клетки или другие клетки глии.
Также изобретение относится к применению полипептида, содержащего аминокислотную последовательность из формулы I, в производстве лекарственного средства для спасения и приведения в норму клеток нервной ткани, а также для регулирования развития стволовых клеток/клеток-предшественников и/или синапсов между клетками в CNS, PNS и/или ANS.
Следующий вариант осуществления изобретения относится к способу регулирования развития стволовых клеток и синапсов между клетками в CNS, включающему в себя взаимодействие ex vivo или in vivo стволовых клеток с дозой полипептида, содержащего аминокислотную последовательность из формулы I.
Применения и способы по изобретению предпочтительно приспособлены для лечения отклоняющихся от нормы и/или медицинских состояний, отражающихся в патологической гибели или росте клеток-предшественников и синапсов между нейрональными клетками, и/или клеток, происходящих из нейрональных стволовых клеток. Таким образом, способы можно применять для профилактики, лечения или улучшения состояния при повреждениях, заболеваниях или нарушениях CNS, PNS и/или ANS. Используемое по изобретению фармацевтически активное вещество особенно приемлемо для лечения состояний, при которых поражаются шванновские клетки, клетки-сателлиты, олигодендроглия, астроглия и/или нейрональные клетки. Такие состояния могут быть обусловлены повреждением или нарушениями CNS, гибелью нейрональных клеток или потерей памяти. Такие состояния могут быть обусловлены, например, множеством таких различных факторов или заболеваний, как травматические, аутоиммунные или дегенеративные заболевания, такие как рассеянный склероз, гипоксическое повреждение, ишемическое повреждение, травматическое повреждение, болезни Альцгеймера и Паркинсона, и демиелинизирующее заболевание. Эффект фармацевтически активного вещества, применяемого по этому предпочтительному варианту осуществления изобретения, связан с его способностью повышать выживаемость клетки, индуцировать образование клетки, формирование синапсов или устранение нейрональных очагов повреждения и/или β-APP, β-амилоида и других соединений, накапливающихся в указанных клетках.
Тем не менее, и как подчеркнуто выше, настоящее изобретение не ограничивают применениями и способами лечения заболеваний и состояний нервной системы, но указанные применения и способы также можно использовать для лечения значительного разнообразия таких характеризующихся патологической гибелью и/или ростом клеток состояний млекопитающих, как болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, инсульт, асфиксия или гипоксия вследствие сердечной недостаточности.
Фармацевтическая композиция или лекарственное средство по изобретению могут дополнительно содержать один или более фармакологически приемлемых носителей, реципиентов или разбавителей, таких как известные в этой области.
Композиции или лекарственные средства могут быть, например, в виде жидких, полужидких, полутвердых или твердых композиций, таких как, но без ограничения, растворенные жидкости для трансфузии, как, например, стерильный физиологический раствор, различные солевые растворы, растворы глюкозы, забуференный фосфатом солевой раствор, кровь, плазма или вода, порошки, микрокапсулы, микросферы, наночастицы, спреи, аэрозоли, устройства для ингаляции, растворы, дисперсии, суспензии, эмульсии и их смеси.
Композиции можно составлять в соответствии с общепринятой фармацевтической практикой, принимая во внимание стабильность и реакционную способность олиго- или полипептидов или белка.
Очевидно, что композиции могут включать в себя индуцирующую AF пищу (ссылка 15) или яичные желтки, которые содержат высокий уровень AF. Предпочтительно, индуцирующие AF продукты питания (ссылка 15) вводят орально или перорально в композициях, приспособленных к такому назначению. Предпочтительно, яичные желтки с уровнем AF вводят орально или перорально. Также, AF и их производные можно вводить инъекциями и посредством аэрозоли, или поверхностным нанесением.
Композиции или лекарственные средства можно составлять в соответствии с общепринятой фармацевтической практикой, см., например, "Remington: The science and practice of pharmacy" 20th ed. Mack Publishing, Easton PA, 2000 ISBN 0-912734-04-3 и "Encyclopedia of Pharmaceutical Technology", под редакцией Swarbrick, J. & J. C. Boylan, Marcel Dekker, Inc., New York, 1988 ISBN 0-8247-2800-9.
Выбор фармацевтически приемлемых эксципиентов в композиции или лекарственном средстве для применения по изобретению и их оптимальную концентрацию можно легко определять в эксперименте. Также, пригодность фармацевтически приемлемого эксципиента для использования в фармацевтической композиции, как правило, зависит от выбираемого вида лекарственной формы. Однако специалист в области технологии производства лекарственных средств может найти рекомендации, например, в "Remington: The science and practice of pharmacy" 20th ed. Mack Publishing, Easton PA, 2000 ISBN 0-912734-04-3.
Фармацевтически приемлемый эксципиент представляет собой вещество, по существу, безвредное для индивидуума, которому будут вводить композицию. Обычно такой эксципиент соответствует требованиям, предоставленным национальными агентствами по контролю за лекарственными средствами. Стандарты для общеизвестных фармацевтически приемлемых эксципиентов устанавливают в официальных фармакопеях, таких как фармакопея Соединенных Штатов Америки и Европейская фармакопея.
Последующее представляет собой обзор пригодных для применения по изобретению фармацевтических композиций. Обзор основан на конкретном способе введения. Однако следует принимать во внимание, что в тех случаях, когда фармацевтически приемлемый эксципиент можно использовать в различных лекарственных формах или композициях, применение конкретного фармацевтически приемлемого эксципиента не ограничено конкретной лекарственной формой или конкретной функцией эксципиента.
Композиции для парентерального введения
Композиции по изобретению для системного применения могут содержать общепринятые нетоксичные фармацевтически приемлемые носители и эксципиенты, включая микросферы и липосомы.
Композиции для применения по изобретению могут включать в себя все виды твердых, полутвердых и жидких композиций. Особенно пригодные композиции представляют собой, например, растворы, суспензии и эмульсии.
Фармацевтически приемлемые эксципиенты могут включать в себя растворители, буферные вещества, консерванты, хелатобразующие вещества, антиоксиданты, стабилизаторы, эмульгаторы, суспендирующие вещества и/или разбавители. Примеры различных веществ приведены ниже.
Примеры различных веществ
Примеры растворителей включают в себя, но не ограничиваются ими, воду, спирты, кровь, плазму, спинномозговую жидкость, асцитическую жидкость и лимфатическую жидкость.
Примеры буферных веществ включают в себя, но не ограничиваются ими, лимонную кислоту, уксусную кислоту, винную кислоту, молочную кислоту, фосфорную кислоту, бикарбонаты, фосфаты, диэтиламин и т.д.
Примеры хелатообразующих веществ включают в себя, но не ограничиваются ими, ЭДТХ натриевую соль и лимонную кислоту.
Примеры антиоксидантов включают в себя, но не ограничиваются ими, бутилированный гидроксианизол (BHA), аскорбиновую кислоту и ее производные, токоферол и его производные, цистеин и их смеси.
Примеры разбавителей и дезинтегрирующих веществ включают в себя, но не ограничиваются ими, лактозу, сахарозу, "Emdex", фосфаты кальция, карбонат кальция, сульфат кальция, маннит, крахмалы и микрокристаллическую целлюлозу.
Примеры связывающих веществ включают в себя, но не ограничиваются ими, сахарозу, сорбит, гуммиарабик, альгинат натрия, желатин, крахмалы, целлюлозу, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон и полиэтиленгликоль.
Предпочтительно, используемую по изобретению фармацевтическую композицию или вещество пациенту вводят посредством внутривенной периферической инфузии или посредством внутримышечной или подкожной инъекции, или посредством буккального, легочного, назального или перорального введения. Кроме того, фармацевтическую композицию или фармацевтически активное вещество также возможно вводить в желудочек мозга пациента через введенный хирургическим путем шунт.
В одном из вариантов осуществления настоящего изобретения указанную фармацевтическую композицию составляют таким образом, что активное вещество проникает в желудочки головного мозга пациента.
В одном из вариантов осуществления настоящего изобретения указанную фармацевтическую композицию составляют таким образом, что при введении пациенту активное вещество проникает в желудочки головного мозга указанного пациента или в спинномозговую жидкость указанного пациента. Этого можно достигать, например, посредством механических устройств, переносчиков, липосом, липосфер или биологических, или синтетических носителей.
Предпочтительно, диапазон вводимых доз составляет приблизительно 0,001-100 мг полипептида, содержащего аминокислотную последовательность из формулы I, на 100 г массы тела, включая в себя диапазоны 0,001-100 мг/1 г, 0,001-100 мг/10 г и 0,001-100 мг/50 г массы тела. Предпочтительно, диапазон вводимых доз составляет приблизительно 0,001-100 мг полипептида, содержащего аминокислотную последовательность из формулы I, на 1 кг массы тела.
Когда используют индуцирующую AF пищу (ссылка 15), вводимая доза соответствует 0,2-5 г осоложенного зерна на кг массы тела. При введении яичных желтков с высоким уровнем AF, т.е. по крайней мере 1000 FIL единиц/мл, используют дозу 0,05-0,5 г на кг массы тела. Следует контролировать ответную реакцию индивидуума.
Изобретение можно использовать для лечения человека или не являющихся человеком млекопитающих.
В рамках настоящей заявки термин "лечение" относится и к терапевтическому лечению для излечения или смягчения симптомов заболевания или медицинского состояния, характеризующихся отклоняющейся от нормы гибелью и/или ростом клеток, и к профилактическому лечению для предотвращения развития заболевания или медицинского состояния, характеризующихся патологической гибелью и/или ростом клеток и клеточных компонентов, например синапсов. Таким образом, объем изобретения включает в себя как профилактическое, так и терапевтическое лечение. Также, термин "лечение" относится к обеспечению образования клеток из стволовых клеток или клеток-предшественников посредством индукции образования дифференцированных клеток, таких как, например, нейроны и/или клетки глии, после гибели как нейрональных, так и олигодендроглиальных или глиальных клеток в CNS, PNS или ANS, или к профилактике обычных, связанных с возрастом нарушений в CNS, PNS или ANS, или в других структурах организма. Лечение можно проводить как на срочной, так и на длительной основе.
AF-расширенные стволовые клетки и/или клетки-предшественники можно размножать и предифференцировать перед пересадкой или позволять дифференцироваться в результате взаимодействий между пересаженными клетками и клетками хозяина. AF-расширенные стволовые клетки и/или клетки-предшественники можно вводить и/или пересаживать один раз или доставлять многократно через продолжительный период. Это особенно пригодно, если для достижения органа-мишени стволовые клетки и/или клетки-предшественники вводят через кровоток.
По другому предпочтительному варианту осуществления изобретения существует возможность использовать полипептид, содержащий аминокислотную последовательность из формулы I, для размножения клеток-предшественников или стволовых клеток, или других клеток в культуре ткани или культуре клеток. В дальнейшем, такие клетки можно применять для пересадки клеток пациенту, страдающему, например, гибелью нейрональных клеток или состоянием, обусловленным недостатком эндогенных клеток другого типа. Клетки, используемые для начала выращивания культуры, могут быть взяты или у пациента, или у другого человеческого или животного донора, и их можно использовать для лечения широкого разнообразия заболеваний и нарушений, включающих в себя сердечные заболевания, такие как инфаркт, диабет, или ряда таких неврологических заболеваний и нарушений, как те, что указаны выше.
Таким образом, изобретение также относится к способу размножения, индукции, снижения и/или поддержания воспроизводства in vitro выделенных стволовой клетки и/или потомка стволовой клетки, характеризующемуся обработкой выделенной клетки полипептидом, содержащим аминокислотную последовательность из формулы I. Предпочтительно, выделенную клетку выбирают из группы, содержащей эпителиальные клетки, фибробласты, остеогенные клетки, макрофаги и клетки микроглии, хондроциты, клетки миокарда, клетки крови, нейроны, олигодендроциты, клетки астроглии, клетки-предшественники, стволовые клетки и/или клетки, происходящие из указанных клеток. В целом, выделенную клетку обрабатывают в соответствующих условиях и в течение времени, достаточного для достижения желаемых размножения, индукции, снижения и/или поддержания.
Когда для размножения in vitro у пациента следует забрать клетки, сначала может быть полезно увеличить у пациента число клеток-предшественников. Это значительно облегчит последующее выделение у пациентов указанных клеток. Число клеток-предшественников увеличивают, используя способ или фармацевтическую композицию по изобретению.
Полипептид, содержащий аминокислотную последовательность из формулы I, можно использовать индивидуально или в сочетании с другими лекарственными средствами, интерлейкинами или, например, такими факторами роста, как эпидермальный фактор роста (EGF), трансформирующий фактор роста (TGF), тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF) или инсулиноподобный фактор роста (IGF), разработанных для индукции образования или пролиферации клеток, например, в CNS, PNS или ANS. Для способствования образованию клеток или формированию специфических типов клеток in vivo или in vitro можно использовать полипептид, содержащий аминокислотную последовательность из формулы I, индивидуально или в сочетании с другими лекарственными средствами, пептидами, факторами роста, стероидами, липидами, гликозилированными белками или пептидами, применяемыми или одновременно, или последовательно. Также его можно использовать для индукции активации в незрелых или мультипотентных клетках специфических программ развития, а также специфических генов в указанных выше клетках.
Под указанным выше термином “образование клеток” подразумевают образование таких новых клеток, как нейроны, олигодендроциты, шванновские клетки, клетки-сателлиты и клетки астроглии, из мультипотентных клеток, клеток-предшественников или стволовых клеток во взрослой CNS или PNS, или других органах организма, in situ или в выделенном состоянии.
Кроме того, изобретение также относится к терапевтическому применению веществ, снижающих у пациента количество активного AF или встречающихся в природе аналогов AF и, таким образом, снижающих образование новых клеток, например, олигодендроцитов, у пациентов с таким повреждением аксонов или спинного мозга, как повреждение аксонов, вызываемое сотрясением, повреждение аксонов, вызываемое черепно-мозговой травмой, повреждение аксонов, вызываемое болезнью малых сосудов в CNS, и/или повреждение спинного мозга после заболевания и/или травмы. Примерами таких веществ являются лекарственные средства, антитела, соединения, пептиды и/или ингибитор высвобождения эндогенного AF.
Поскольку AF поддерживает образование новых клеток и, особенно, нейронов в гиппокампе, структуре, непосредственно связанной с обучением и памятью, полипептид, содержащий аминокислотную последовательность из формулы I, можно использовать для способствования обучению и памяти посредством образования указанных клеток.
Хотя настоящее изобретение главным образом относится к способу лечения отклоняющихся от нормы состояний в CNS или PNS, которые характеризуются патологической гибелью и/или ростом клеток, посредством воздействия на нейрональные стволовые клетки или клетки-предшественники, в равной степени применения и способы по изобретению могут быть пригодны для лечения и/или предотвращения медицинских состояний других органов организма, при условии, что указанные медицинские состояния характеризуются патологической гибелью и/или ростом клеток.
Хотя, прежде всего, здесь дана ссылка на применение полипептидов, содержащих аминокислотную последовательность формулы I, изобретение, с соответствующими изменениями, также относится к полипептидам, преимущественно состоящим из последовательности аминокислот из формулы I, и к полипептидам, состоящим из последовательности аминокислот из формулы I.
Полипептиды, содержащие аминокислотную последовательность из формулы I, можно получать обычными способами, включающими в себя способы рекомбинации и синтеза.
Более полно изобретение может быть понятно при чтении следующих примеров, предназначенных только для иллюстрации, но не ограничения, объема изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Полученные при конфокальной флуоресцентной микроскопии, описывающие распределение групп пролиферирующих клеток микрофотографии зубчатой извилины контрольного головного мозга, обработанного плацебо (A), и после судорожных припадков, вызванных внутрибрюшинной инъекцией каиновой кислоты (10 мг/мл) в забуференном физиологическом растворе (B - 7 суток; C - 28 суток). Вновь образованные клетки окрашены темным. Число рибонуклеотидредуктазо-(RNR)положительных клеток, т.е. митотических, значительно повышалось в SGZ на 7 сутки (B) и на 28 сутки (C) после судорожных припадков. Вставка в B из еще одного среза того же головного мозга, окрашенного способом с тем же принципом, иллюстрирует две группы положительных = митотических клеток. GCL = слой зернистых клеток, Hil = ворота. Линейка для измерения = 200 мкм (A, B, C), 20 мкм (вставка в B).
Фигура 2. Фотография головного мозга крыс через 2 суток после того, как на наружную сторону кости их черепа помещали на 40 секунд замораживающий зонд. В верхнем ряду представлены два головных мозга крыс, имевших свободный доступ к общепринятым гранулам и водопроводной воде перед и после повреждения головного мозга. Отмечают кровоизлияния и изменение цвета ткани головного мозга. В нижнем ряду представлены два головных мозга крыс, имевших неограниченный доступ к пище SPC и питьевому раствору в течение 12 суток перед воздействием замораживающего зонда на наружную сторону кости черепа, а затем в течение следующих двух суток перед умерщвлением. Отмечают отсутствие макроскопического кровоизлияния и менее распространенное повреждение головного мозга. Высокий уровень AF у крыс, питавшихся SPC, приводил к снижению повреждения головного мозга, что в дальнейшем подтвердили световой микроскопией окрашенных срезов.
Фигура 3. Фотография головного мозга крыс через 6 суток после того, как на наружную сторону кости их черепа помещали на 40 секунд замораживающий зонд. В верхнем ряду представлены три головных мозга взрослых крыс, которые имели свободный доступ к общепринятым гранулам и водопроводной воде перед и после повреждения головного мозга. Отмечают незначительные кровоизлияния и поверхностный дефект в ткани головного мозга. В нижнем ряду представлены три головных мозга крыс, имевших неограниченный доступ к пище SPC и питьевому раствору в течение 5 суток перед воздействием замораживающего зонда на наружную сторону кости черепа, а затем в течение следующих шести суток перед умерщвлением. По сравнению с головным мозгом крыс в верхнем ряду, отмечают менее распространенное повреждение головного мозга. Уровень AF у крыс, питавшихся SPC в течение 5 суток перед повреждением замораживанием, приводил к снижению повреждения головного мозга, что в дальнейшем подтвердили световой микроскопией окрашенных срезов.
ПРИМЕРЫ
Пример 1: Индукция повышенного образования AF усиливает нейрогенез
Для оценки влияния введения AF на нейрогенез в головном мозге обычного взрослого млекопитающего, крысы, проводили следующий эксперимент.
Крыс (масса тела на начало экспериментов - 180-350 г), самцов и самок, приобретали в B & K AB, Stockholm, Sweden. Животных содержали в клетках утвержденного типа и размера, при наличии освещения с 06 до 18. На эксперименты получали разрешение регионального этического комитета по контролю над экспериментами над животными. Принимали меры по снижению неприятных ощущений и боли.
В течение по крайней мере 10 суток перед умерщвлением тестируемых крыс кормили гранулированной пищей SPC и поили экстрактом SPC. Животных не подвергали какому-либо хирургическому или другому воздействию. Крыс обезболивали или внутрибрюшинной инъекцией избыточной дозы пентобарбитала натрия в физиологическом растворе, или ингаляцией изофлурана. Вскрывали полость грудной клетки, вводили канюлю в левый желудочек сердца и для промывания сосудистой системы от крови вливали доведенный до нужного состояния уравновешенный забуференный раствор соли с добавленным гепарином. Затем для фиксирования ткани вливали забуференный раствор формальдегида в физиологическом растворе. В конечном итоге, препарировали головной мозг, спинной мозг, сетчатку и дополнительные части нервных тканей и дополнительно фиксировали в забуференном формалине в течение ночи на холоде. На следующий день препарировали передний мозг и гиппокамп, промывали и погружали в забуференный физиологический раствор с 20% сахарозой, добавляемой перед получением срезов на микротоме-криостате. Затем тонкие срезы, толщиной 5-25 мкм, обрабатывали для демонстрации посредством иммуногистохимии распределения и преобладания субъединицы R1 рибонуклеотидредуктазы (RNR) (фигура 1 a), фермента ключевой значимости в любом синтезе ДНК, выявляя образование клеток посредством митоза (Zhu, H., et al., ссылка 4). Параллельно, дополнительные образцы ткани переднего мозга и гиппокампа заливали парафином и обрабатывали, как описано выше.
Посредством световой микроскопии срезов, обработанных для RNR иммуногистохимии, выявили, что по сравнению с животными, обеспечивавшимися общепринятыми гранулами для грызунов, лечение обычных взрослых крыс пищей SPC
в течение по крайней мере 10 суток повышает распространенность в SGZ, в гиппокампе, пролиферирующих стволовых клеток и клеток-предшественников. Также, повышенную частоту делящихся клеток можно было выявлять в SVZ, в переднем мозге. Идентификацию вновь образованных клеток выполняли иммуногистохимически, посредством антител к даблкортину (экспрессирующемуся мигрирующими незрелыми нейронами), NeuN (экспрессирующемуся зрелыми нейронами) и GFAP (экспрессирующемуся астроцитами).
Делают вывод, что обеспечение взрослых млекопитающих пищей SPC в течение по крайней мере 10 суток, по-видимому, заметно стимулирует пролиферацию стволовых клеток и клеток-предшественников во взрослом головном мозге.
Пример 2: Модель повреждения головного мозга посредством наложения замораживающего зонда
Для оценки повреждения головного мозга грызунов, вызываемого наложением очень холодного зонда на наружную сторону кости черепа, проводили следующий эксперимент.
Крыс (масса тела на начало экспериментов - 180-350 г), самцов и самок, приобретали в B & K AB, Stockholm, Sweden. Животных содержали в клетках утвержденного типа и размера, при наличии освещения с 06 до 18. На эксперименты получали разрешение регионального этического комитета по контролю над экспериментами над животными. Принимали меры по снижению неприятных ощущений и боли.
Крыс обезболивали ингаляцией изофлурана и брили их головы. Кожу на черепе рассекали в срединной сагиттальной плоскости. Обнажали свод черепа между брегмой и ламбдой с левой стороны. Отделяли периост от кости, которую затем промывали. В дальнейшем, с повышенной осторожностью из свода черепа удаляли кровь и любую жидкость, поскольку они могут причинить вред последующей процедуре. Сделанный из меди зонд, имеющий цилиндрическую конечную часть длиной 4 мм, с диаметром 3 мм, охлаждали погружением в жидкий азот общепринятым способом. Затем охлажденный зонд на 40 сек помещали на свод черепа между ламбдой и брегмой, 4 мм вбок от срединной сагиттальной линии. Затем зонд удаляли и зашивали рану на коже. Наложение замораживающего зонда временно приводило к тому, что ткань головного мозга, расположенная под участком воздействия, замораживалась. Следует подчеркнуть, что череп не вскрывали и не вызывали никаких трещин или других признаков значительного повреждения. Впоследствии, после восстановления от обезболивания животные передвигались без каких-либо видимых затруднений, вели себя обычно и принимали пищу и питьевую жидкость сходно с теми, которые не подвергались обработке.
Через 2 суток после повреждения замораживанием наблюдали изменение цвета коры левого полушария головного мозга и кровоизлияние в области диаметром 3-5 мм, расположенной непосредственно под участком кости черепа, подвергавшимся охлаждению (фигура 2). Незначительное углубление указывало на произошедшую гибель нервной ткани. В зоне пенумбры, т.е. вещества головного мозга, ограничивающего центральную зону тяжело поврежденной нервной ткани, присутствует отек. При внимательном рассмотрении можно выявить распространение отека на белое вещество, более очевидного на той же стороне, что и повреждение. Исследование световой микроскопией окрашенных тонких срезов выявило в центре поврежденной коры головного мозга некротизированную ткань, с отеком, по-видимому, распространяющимся на вторичную ткань, и повреждением клеток в зоне пенумбры. Первичное повреждение представляет собой повреждение, происходящее в течение первых нескольких секунд после наложения замораживающего зонда. Вторичное повреждение головного мозга включает в себя изменения, происходящие через минуту и более, точное время определяется в зависимости от вида повреждения. Вторичные изменения могут со временем становиться более тяжелыми, особенно при наличии отека головного мозга, который способствует повреждению. Присутствовала начинавшаяся в течение минут воспалительная реакция, более очевидная в зоне пенумбры и характеризовавшаяся наличием повышенного числа активированных астроцитов и клеток микроглии. Кровеносные сосуды также повреждались, но быстро восстанавливались. Однако реваскуляризация некротизированной центральной части поврежденной ткани происходила не раньше, чем через сутки или даже недели.
Любое повреждение головного мозга вызывает воспаление, обуславливающее временное повышение пролиферации стволовых клеток и клеток-предшественников в SGZ и в SVZ, если эти области не сильно повреждены. Кроме того, для выживания, миграции и дифференцировки новые нейрональные стволовые клетки и клетки-предшественники необходимо стимулировать; в противном случае пролиферация клеток может приводить в суммарном итоге к гибели нейрональных клеток.
Происходит сопутствующее накопление белков-предшественников бета-амилоида (β-APP) и бета-амилоида (Aβ), образующихся в результате повреждения головного мозга и накапливающихся в телах и отростках нейронов. Как β-APP, так и Aβ токсичны для нейронов и начинают накапливаться в течение нескольких часов после травмы нервной системы. Однако, если эти два белка растворяются и, таким образом, исчезают, возможность выживания, восстановления и повторного составления структурно и функционально единого целого необходимо рассматривать как высоко благоприятную. Кроме того, при травме нервной системы подвергаются воздействию и накапливаются компоненты цитоскелета, такие как нейрофиламенты и микротрубочки, формируя скопления и сплетения, которые делают первичное повреждение более тяжелым и даже разрушительным. Вследствие очагового накопления компонентов цитоскелета, клеточных органелл и амилоида аксоны и дендриты выглядят имеющими неравномерную четкообразную структуру, утолщенными и деформированными. Вследствие такой дезорганизации нейронов после травмы, как, например, вследствие замораживания, обычная, очень точная и равномерная организация механизмов клетки частично утрачивается, и обычные компоненты клетки, как, например, убиквитин, могут накапливаться или появляться в отклоняющихся от нормы концентрациях. За исключением нейронов в SGZ и SVZ, нейроны в нормальных условиях не делятся, но после травмы нервной системы могут начать образовывать в отклоняющихся от нормы высоких количествах белки и другие соединения, такие как, например, циклины и родственные им компоненты, распространенные обычно только в делящихся клетках.
Клетки глии, астроциты и клетки микроглии, пролиферировали и становились гипертрофированными. Кроме того, в поврежденной ткани происходили восстановление оставшихся кровеносных сосудов и ангиогенез.
Появляющийся после любой травмы нервной системы отек усиливает повреждение ткани (вторичное повреждение).
На шестые сутки после повреждения замораживанием (фигура 2) в центре поврежденной коры головного мозга присутствует мелкая полость, обусловленная гибелью ткани головного мозга. Можно выявить незначительные остатки кровоизлияния, но большая часть внесосудистой крови устранена. Зона некроза в центре повреждения была частично очищена от продуктов разрушения и поэтому выглядела, как совершенно отчетливое ограниченное углубление. Зона пенумбры, окружающая центральную зону некроза, богата клетками микроглии и гипертрофированными пролиферирующими астроцитами. В зоне пенумбры видны поврежденные и погибающие нейроны, а также выжившие нейроны. Для большинства нейронов показывают накопление нейрофиламентов, β-APP и Aβ. Делают вывод, что замораживание головного мозга через неповрежденную кость черепа воспроизводимым способом приводит к повреждению головного мозга.
Пример 3: Как исследовали через 2 суток, AF приводит к спасению поврежденной замораживанием ткани головного мозга
Для оценки, воздействует ли, оказывая нейропротективный эффект, повышенное возникновение AF в организме на распространенность и тяжесть повреждения головного мозга, вызываемого в головном мозге грызунов наложением замораживающего зонда на наружную сторону кости черепа, проводили следующий эксперимент.
Крыс (масса тела на начало экспериментов - 180-350 г), самцов и самок, обеспечивали пищей SPC и питьевой жидкостью в течение по крайней мере 10 суток перед повреждением головного мозга. В сутки повреждения крыс обезболивали и обрабатывали, как описано в эксперименте 2. Замораживающий зонд накладывали один раз в течение 40 секунд. После наложения швов на рану на коже черепа и восстановления после обезболивания крысам позволяли свободно передвигаться и предоставляли доступ к пище SPC и питьевой жидкости.
Через двое суток после повреждения замораживанием крыс умерщвляли и фиксировали перфузией, как описано. При вскрытии кости черепа стала очевидной меньшая распространенность повреждения головного мозга по сравнению с таковой у животных, получавших общепринятые коммерческие гранулы и водопроводную воду (фигура 2). Выявляли только незначительные кровоизлияния. В дальнейшем, мелкое углубление центральных участков поврежденной области не было заметно. Зона пенумбры выглядела подверженной меньшему отеку, чем наблюдаемый отек у животных, получавших общепринятую гранулированную пищу и водопроводную воду. Исследование световой микроскопией тонких окрашенных срезов поврежденной ткани головного мозга выявило меньшую распространенность появления поврежденных клеток и только незначительное выхождение элементов крови из сосудов. Неравномерно распределенные утолщения и четкообразные структуры были редки. Отмечали меньшее накопление, например, амилоида и нейрофиламентов, заметное в противоположном случае. Глиоз был менее заметен, чем у животных для сравнения, обеспечивавшихся общепринятой пищей и водопроводной водой. Однако существовало определенное различие в распространенности нейропротективного эффекта, оказываемого через двое суток пищей SPC и питьевой жидкостью.
Делают вывод, что экспериментальная индукция повышенного образования AF в организме приводит к нейропротективному эффекту, что устанавливали по сниженному повреждению ткани головного мозга при исследовании через 2 суток после очагового повреждения.
Пример 4: Как исследовали через 6 суток, AF приводит к спасению поврежденной замораживанием ткани головного мозга
Для оценки, воздействует ли, оказывая нейропротективный эффект, повышенное возникновение AF в организме на распространенность и тяжесть повреждения головного мозга, вызываемого в головном мозге грызунов наложением замораживающего зонда на наружную сторону кости черепа, проводили следующий эксперимент.
Крыс (масса тела на начало экспериментов - 180-350 г), самцов и самок, обеспечивали пищей SPC и питьевой жидкостью в течение по крайней мере 10 суток перед повреждением головного мозга. В сутки повреждения крыс обезболивали и обрабатывали, как описано в эксперименте 2. Замораживающий зонд накладывали один раз в течение 40 секунд. После наложения швов на рану на коже черепа и восстановления после обезболивания крысам позволяли свободно передвигаться и предоставляли доступ к пище SPC и питьевой жидкости.
Через шесть суток после повреждения замораживанием крыс умерщвляли и фиксировали перфузией, как описано. При вскрытии кости черепа стала очевидной меньшая распространенность повреждения головного мозга по сравнению с таковой у животных, получавших общепринятые коммерческие гранулы и водопроводную воду (фигура 3). Кровоизлияний не выявляли. В дальнейшем, мелкое углубление центральных участков поврежденной области не было заметно и в некоторых случаях с трудом поддавалось точному выявлению. Зона пенумбры выглядела подверженной меньшему отеку, чем наблюдаемый отек у животных, получавших общепринятую гранулированную пищу и водопроводную воду. Исследование световой микроскопией тонких окрашенных срезов поврежденной ткани головного мозга выявило меньшую распространенность появления поврежденных клеток и более редко где-либо присутствующее выхождение крови из сосудов. Неравномерно распределенные утолщения и четкообразные структуры аксонов и дендритов были редки. В области зоны пенумбры был четко выражен астроглиоз, но не столь обширный и распространенный, как в соответствующих головных мозгах крыс, получавших общепринятые гранулы и водопроводную воду. Однако существовало различие в распространенности нейропротективного эффекта, оказываемого пищей SPC и питьевой жидкостью.
При исследовании гиппокампа наблюдали заметное повышение пролиферации в SGZ нейрональных стволовых клеток и клеток-предшественников. То же было справедливо, но менее заметно, для SVZ.
Делают вывод, что экспериментальная индукция повышенного образования AF в организме приводит к нейропротективному эффекту, что устанавливали по сниженному повреждению ткани головного мозга, менее выраженному глиозу и повышенному образованию новых нейронов из стволовых клеток и клеток-предшественников, наиболее очевидному в SGZ, при исследовании через 6 суток после очагового повреждения.
Пример 5: Как исследовали через 6 суток, ежесуточные внутривенные инъекции производного AF (пептид из 16 аминокислот) приводят к спасению поврежденной замораживанием ткани головного мозга
Для оценки, воздействует ли, оказывая нейропротективный эффект, повышенное возникновение AF в организме на распространенность и тяжесть повреждения головного мозга, вызываемого в головном мозге грызунов наложением замораживающего зонда на наружную сторону кости черепа, проводили следующий эксперимент.
Крыс (масса тела на начало экспериментов - 180-350 г), самцов и самок, обеспечивали общепринятой гранулированной пищей и водопроводной водой перед и после повреждения головного мозга. В сутки повреждения крыс обезболивали и обрабатывали, как описано в эксперименте 2. Замораживающий зонд накладывали один раз в течение 40 секунд. После наложения швов на рану на коже черепа и восстановления после обезболивания крысам позволяли свободно передвигаться.
В течение 5 суток, начиная с суток хирургического вмешательства, всем крысам дважды в сутки проводили внутривенную инъекцию, 1-10 мкг на кг массы тела, синтетического пептида, представляющего собой фрагмент AF, содержащий аминокислоты 36-51, т.е. состоящий из 16 аминокислот. Его растворяли в физиологическом растворе и получали заново перед каждой инъекцией. В сутки умерщвления, 6 сутки, внутривенную инъекцию не проводили. Ни у одного из животных не наблюдали побочных эффектов в отношении двигательной активности, исследовательского поведения, приема пищи или особенностей питья.
Через шесть суток после повреждения замораживанием крыс умерщвляли и фиксировали перфузией, как описано. При вскрытии кости черепа стала очевидной меньшая распространенность повреждения головного мозга по сравнению с таковой у животных, получавших общепринятые коммерческие гранулы и водопроводную воду. Кровоизлияний в или на головном мозге не выявляли. В дальнейшем, мелкое углубление центральных участков поврежденной области не было заметно и в некоторых случаях с трудом поддавалось точному выявлению. Зона пенумбры выглядела подверженной незначительному отеку. Исследование световой микроскопией тонких окрашенных срезов поврежденной ткани головного мозга выявило меньшую распространенность появления поврежденных клеток и более редко где-либо присутствующее выхождение крови из сосудов, чем наблюдавшиеся в головном мозге крыс, обрабатываемых и исследуемых, как в эксперименте 2. Неравномерно распределенные утолщения и четкообразные структуры аксонов и дендритов были редки. В области зоны пенумбры был четко выражен астроглиоз, но не столь обширный и распространенный, как в соответствующих головных мозгах крыс, получавших общепринятые гранулы и водопроводную воду. Однако существовало различие в распространенности нейропротективного эффекта, оказываемого инъецированным пептидом.
При исследовании гиппокампа наблюдали повышенную пролиферацию в SGZ нейрональных стволовых клеток и клеток-предшественников. То же было справедливо для SVZ.
Делают вывод, что ежесуточные внутривенные инъекции фрагмента AF в течение первых 5 суток после повреждения замораживанием приводят к нейропротективному эффекту, что устанавливали по сниженному повреждению ткани головного мозга, менее выраженному глиозу и повышенному образованию новых нейронов из стволовых клеток и клеток-предшественников, наиболее очевидному в SGZ, при исследовании через 6 суток после очагового повреждения.
Пример 6: Как исследовали через 6 суток, AF приводит к спасению ткани головного мозга, поврежденной каиновой кислотой, эксайтотоксическим лекарственным средством
Для оценки, воздействует ли, оказывая нейропротективный эффект, повышенное возникновение AF в организме на распространенность и тяжесть повреждения головного мозга, вызываемого в головном мозге грызунов внутрибрюшинной инъекцией эксайтотоксического соединения каиновой кислоты, проводили следующий эксперимент.
Крыс (масса тела на начало экспериментов - 180-350 г), самцов и самок, обеспечивали пищей SPC и питьевой жидкостью в течение по крайней мере 10 суток перед повреждением мозга. Такое же число крыс в параллели для сравнения получали общепринятую гранулированную пищу и водопроводную воду.
В сутки повреждения каиновую кислоту (Sigma Chemical Co, St. Louis, Mo, USA) растворяли в забуференном физиологическом растворе и вводили внутрибрюшинной инъекцией один раз в количестве 10 мг/кг массы тела. Затем крысам позволяли свободно передвигаться и предоставляли доступ к пище SPC и питьевой жидкости. Через 45-60 минут крысы начинали вести себя стереотипно, многократно выполняя одно или два движения. Затем у них проявлялись односторонние и генерализованные судорожные припадки. За крысами тщательно наблюдали и регистрировали распространение повреждения. Для прекращения судорожных припадков вводили инъекцией диазепам через 3 часа после обработки каинатом. В настоящее исследование включали только крыс с проявлением судорожных припадков стандартного типа и степени выраженности.
Через шесть суток после судорожных припадков крыс умерщвляли и фиксировали перфузией, как описано. При вскрытии кости черепа не выявляли признаков повреждения головного мозга. Различий между крысами, получавшими пищу SPC, и крысами, получавшими общепринятые гранулы и водопроводную воду, не наблюдали. В каждом из случаев не наблюдали макроскопически заметного отека.
Исследование световой микроскопией тонких окрашенных срезов гиппокампа головных мозгов выявило различия в распространенности повреждения между двумя группами животных. По сравнению с крысами с более тяжелым повреждением, получавшими общепринятые гранулы и водопроводную воду, у крыс, которым проводили лечение пищей SPC, наблюдали менее распространенную дегенерацию нейронов в областях CA1 и CA3/4. Такое же различие наблюдали в росте мшистых волокон. Выявляли неравномерно распределенные утолщения и четкообразные структуры аксонов и дендритов. Кроме того, по сравнению с получавшими общепринятые гранулы крысами, у крыс, получавших пищу SPC, наблюдали менее выраженный астроглиоз в области ворот и в лакунарном слое, и в молекулярном слое, а также в воротах. Существовало значительное различие в распространенности нейропротективного эффекта, оказываемого пищей SPC и питьевой жидкостью.
При исследовании гиппокампа ясно наблюдали в SGZ повышенную пролиферацию нейрональных стволовых клеток и клеток-предшественников (фигура 1). То же было справедливо, хотя и менее заметно, для SVZ. После кормления пищей SPC и питьевым раствором наблюдали повышенный уровень выживания вновь образованных RNR-положительных клеток в SGZ.
Делают вывод, что экспериментальная индукция повышенного образования AF в организме приводит к нейропротективному эффекту, что устанавливали по сниженной распространенности повреждения ткани головного мозга в гиппокампе через 6 суток после судорожных припадков и по сопутствующим менее выраженному глиозу и повышенному образованию новых нейронов из стволовых клеток и клеток-предшественников, наиболее заметному в SGZ.
Пример 7: Воздействие AF и фрагментов AF на спасение ткани головного мозга после диффузного повреждения головного мозга, наиболее очевидное при диффузном повреждении аксонов
Для оценки, воздействует ли повышенное возникновение AF или фрагментов AF в организме на распространенность и тяжесть диффузного повреждения головного мозга, обусловленного травмой головы кроликов при вращательном ускорении, проводили следующий эксперимент.
Наиболее распространенная черепно-мозговая травма представляет собой травму, называемую сотрясением головного мозга. Ежегодно ее воздействию подвергается 80000-90000 шведов, и из них приблизительно каждый четвертый вынужден для клинического исследования и наблюдения по крайней мере сутки оставаться в больнице. Соответствующие показатели для США составляют приблизительно 2 миллиона индивидуумов, страдающих сотрясением головного мозга, и из них ориентировочно половина миллиона остается в больнице в течение суток или более. Для значительного числа этих больных проводят исследование рентгеновским излучением и/или MRI.
После сотрясения головного мозга для таких индивидуумов существует повышенный риск подверженности в течение длительных периодов времени психоневрологическим последствиям и боли. Кроме того, существует повышенный риск последующего развития деменции, наиболее вероятно, болезни Альцгеймера.
Используют молодых и взрослых кроликов. У обезболенных кроликов отделяют кость их черепа от мягкой ткани. К кости черепа приклеивают сформированный из пластмассы и укрепленный стекловолокном шлем. Шлем подключают к воздействующему устройству, воспроизводящему нанесение травмы головы при вращательном ускорении, или в передне-заднем, или в обратном направлении. Кроликам проводят лечение введением AF или синтетических пептидов, соответствующих выбранным последовательностям AF. Дополнительных кроликов кормят пищей SPC и питьевым раствором или альтернативными композициями на основе яичного желтка. Характеристики воздействия тщательно контролируют посредством компьютеризированной регистрирующей системы.
У умерщвленных кроликов, через заранее определенные периоды времени после травмы при вращательном ускорении, удаляют головной мозг и тщательно исследуют на предмет предполагаемых нейропротективных эффектов AF и его производных, а также яичного желтка. Преимущество планируемых экспериментов состоит в том, что черепно-мозговая травма стандартизирована и соответствует наиболее частой травме у человека, сотрясению головного мозга. Формирование отека головного мозга тщательно контролируют посредством внутримозговой имплантации волоконно-оптических сенсоров, подключенных к компьютеру. Таким образом, можно тщательно отслеживать и регистрировать воздействие AF и его производных на формирование отека и гистопатологические отклонения от нормы. Также, проводят долгосрочные исследования.
Делают вывод, что экспериментальная индукция диффузного повреждения головного мозга, которое лечат AF или его производными, имеет ключевую значимость для оценки отдаленных нейропротективных эффектов на смоделированное состояние, в клинической медицинской практике представляющее собой основную причину черепно-мозговой травмы у человека.
ССЫЛКИ
1. Lange, S. & Lönnroth, I. Int. Review of Cytology 210 39-75 (2001)
2. Eriksson, P.S. et al.: Nature Med. 11: 1313-1317 (1998)
3. Kuhn, H. et al.: J Neurosci. 16: 2027-2033 (1996)
4. Zhu, H., Wang, Z.-Y. & Hansson, H.-A.: Brain Res. 977:180-189 (2003)
5. Gage, F. H.: Science 287: 1433-1438 (2000)
6. McNamara, R.K. et al.: Brain Res. Rev. 18: 33-49 (1993)
7. Cameron, H. A. et al.: Neuroscience 61: 203-209 (1994)
8. Cameron, H. A. et al.: Neuroscience 82: 349-354 (1998)
9. Kempermann, G. et al.: Nature 386: 493-495 (1997)
10. Lange, S et al: W097/08202
11. Davidson, J., & Rickey, W.F.: Lab. Investigation 84:. 307-319 (2004)
12. Davidson, J., & Нickey, W.F.: J. Leukocyt Biol 74: 907-919 (2004)
13. Johansson, E et al.: J Biol. Chem. 270: 20615-20620 (1995)
14. Lange, S et al.: патент США 6344440
15. Lange, S et al: PCT/SE97/01918
16. Lange, S et al.: PCT/SE 99/02340
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯЦИЯ ЛИПИДНЫХ РАФТОВ | 2007 |
|
RU2457853C2 |
| СПОСОБ ТКАНЕВОЙ ИНЖЕНЕРИИ СПИННОГО МОЗГА ПОСЛЕ ЕГО АНАТОМИЧЕСКОГО РАЗРЫВА | 2012 |
|
RU2489176C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЯИЧНОГО ЖЕЛТКА С ВЫСОКИМ СОДЕРЖАНИЕМ AF-16 | 2016 |
|
RU2723097C1 |
| СПОСОБЫ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ СОСТОЯНИЙ С ПРИМЕНЕНИЕМ ГЕМАТОПОЭТИЧЕСКИХ ФАКТОРОВ РОСТА | 2003 |
|
RU2353385C2 |
| ПОЛУЧЕНИЕ ГАМКергических НЕЙРОНОВ in vitro ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2380410C2 |
| Препарат для стимулирования регенерации и нейропротекции нервной ткани и способ его использования | 2023 |
|
RU2828544C1 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ КОМПАРТМЕНТ-СИНДРОМА | 2007 |
|
RU2465914C2 |
| ТРАНСПЛАНТАЦИЯ НЕРВНЫХ КЛЕТОК ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ СОСТОЯНИЙ | 2005 |
|
RU2434636C2 |
| Генно-клеточный везикулярный терапевтический препарат и способ терапии рассеянного склероза посредством трансплантации генно-клеточного везикулярного терапевтического препарата | 2021 |
|
RU2762855C1 |
| ИНГИБИТОРЫ ПЕРЕДАЧИ СИГНАЛА ТРАНСФОРМИРУЮЩИХ ФАКТОРОВ РОСТА (TGF-R) ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2005 |
|
RU2385933C2 |







Изобретение относится к области медицины и касается применения белка антисекреторного фактора (AF), или полипептида, или производного заявленной (формулы I), или фармацевтически приемлемой соли в производстве лекарственного средства для лечения, и/или профилактики состояния, связанного с патологической гибелью и/или ростом нервной ткани, или для протекции. Изобретение также включает способ лечения и/или профилактики состояния, связанного с патологической гибелью, и/или ростом нервной ткани, или для протекции. Преимущество изобретения заключается в разработке лекарственного средства, по своим свойствам близкого к классу белков, естественным образом образующихся в организме. 2 н. и 30 з.п. ф-лы, 3 ил.
1. Применение
a) белка антисекреторного фактора (AF) или
b) олигопептида, полипептида или производного а), где олиго- или полипептид или производное AF состоит из аминокислотной последовательности формулы I
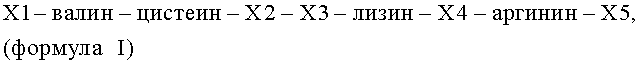
где X1 представляет собой I, аминокислоты №№1-35 SEQ ID №:2 или отсутствует, Х2 представляет собой гистидин, аргинин или лизин, Х3 представляет собой серин или лейцин, Х4 представляет собой треонин или аланин, Х5 представляет собой аминокислоты №№43-46, 43-51, 43-80 или 43-163 SEQ ID NO:2, или отсутствует; или
c) их фармацевтически приемлемой соли
в производстве лекарственного средства для лечения и/или профилактики состояния, связанного с или характеризующегося патологической гибелью и/или ростом нервной ткани, или для нейропротекции.
2. Применение по п.1, где формула I имеет последовательность, выбранную из одной из:
a) аминокислот под номерами 35-42 SEQ ID NO:2,
b) аминокислот под номерами 35-46 SEQ ID NO:2,
c) аминокислот под номерами 36-51 SEQ ID NO:2,
d) аминокислот под номерами 36-80 SEQ ID NO:2,
e) аминокислот под номерами 1-80 SEQ ID NO:2 или
f) аминокислот под номерами 1-163 SEQ ID NO:2 или их фармацевтически приемлемой соли.
3. Применение по любому из пп.1 и 2, где состояние характеризуется проявлением патологической дегенерации, потери способности к и/или потери контроля над регенерацией дифференцированной клетки и/или ткани, эмбриональной стволовой клетки, взрослой стволовой клетки, клетки-предшественника и/или клетки, происходящей из стволовой клетки или клетки-предшественника.
4. Применение по любому из пп.1 и 2, где состояние связано с или характеризуется патологической гибелью и/или ростом клеток в периферической нервной системе, автономной нервной системе и/или центральной нервной системе.
5. Применение по любому из пп.1 и 2, где состояние связано с или характеризуется патологической гибелью и/или ростом нейрональных стволовых клеток или нейрональных клеток-предшественников.
6. Применение по любому из пп.1 и 2, где состояние связано с или характеризуется патологической гибелью и/или ростом олигодендроглии, астроглии, шванновских клеток, и/или нейрональных клеток, и/или популяций клеток.
7. Применение по п.6, где состояние связано с или характеризуется патологической гибелью и/или ростом нехолинергических нейрональных клеток, холинергических нейрональных клеток, и/или клеток глии, и/или популяций клеток.
8. Применение по любому из пп.1 и 2, где состояние обусловлено повреждением центральной нервной системы или нарушением в центральной нервной системе.
9. Применение по любому из пп.1 и 2, где состояние обусловлено травматическим, аутоиммунным или дегенеративным заболеванием.
10. Применение по любому из пп.1 и 2, где состояние обусловлено повреждением аксонов, вызываемым сотрясением, ушибом, повреждением аксонов, вызываемым черепно-мозговой травмой, повреждением аксонов, вызываемым болезнью малых сосудов в CNS и/или повреждением спинного мозга после заболевания и/или травмы.
11. Применение по любому из пп.1 и 2, где указанное состояние характеризуется потерей памяти.
12. Применение по любому из пп.1 и 2, где состояние представляет собой рассеянный склероз, асфиксию, гипоксическое повреждение, ишемическое повреждение, травматическое повреждение, болезнь Паркинсона, болезнь Альцгеймера, инсульт или демиелинизирующее заболевание.
13. Применение по любому из пп.1 и 2, где лекарственное средство составляют для внутривенной инфузии, внутримышечной инъекции и/или подкожной инъекции.
14. Применение по любому из пп.1 и 2, где лекарственное средство составляют таким образом, что при введении пациенту активное вещество проникает в желудочки и/или другие полости на или в головном мозге указанного пациента.
15. Применение по любому из пп.1 и 2, где лекарственное средство составляют таким образом, что при введении пациенту активное вещество проникает в спинномозговую жидкость указанного пациента.
16. Способ лечения и/или профилактики состояния, связанного с или характеризующегося патологической гибелью и/или ростом нервной ткани, или нейропротекции, включающий введение пациенту эффективного количества антисекреторного белка, или олиго- или полипептида, или их производных, содержащих аминокислотную последовательность формулы I
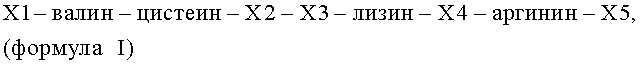
где X1 представляет собой I, аминокислоты №№1-35 SEQ ID №:2 или отсутствует,
Х2 представляет собой гистидин, аргинин или лизин,
Х3 представляет собой серин или лейцин,
Х4 представляет собой треонин или аланин,
Х5 представляет собой аминокислоты №№43-46, 43-51, 43-80 или 43-163 SEQ ID №:2, или отсутствует;
или их фармацевтически приемлемой соли.
17. Способ по п.16, где формула I имеет последовательность, выбранную из одной из:
a) аминокислот под номерами 35-42 SEQ ID №:2,
b) аминокислот под номерами 35-46 SEQ ID №:2,
c) аминокислот под номерами 36-51 SEQ ID №:2,
d) аминокислот под номерами 36-80 SEQ ID №:2,
e) аминокислот под номерами 1-80 SEQ ID №:2 или
f) аминокислот под номерами 1-163 SEQ ID №:2 или их фармацевтически приемлемой соли.
18. Способ по п.16 или 17, где состояние характеризуется проявлением патологической дегенерации, потери способности к и/или потери контроля над регенерацией дифференцированной клетки и/или ткани, эмбриональной стволовой клетки, взрослой стволовой клетки, клетки-предшественника и/или клетки, происходящей из стволовой клетки или клетки-предшественника.
19. Способ по п.16 или 17, где состояние связано с или характеризуется патологической гибелью и/или ростом клеток в периферической, автономной или центральной нервной системе.
20. Способ по п.16 или 17, где состояние связано с или характеризуется патологической гибелью и/или ростом нейрональных стволовых клеток или нейрональных клеток-предшественников.
21. Способ по п.16 или 17, где состояние связано с или характеризуется патологической гибелью и/или ростом олигодендроглиальных, астроглиальных, шванновских клеток и/или нейрональных клеток, и/или популяций клеток.
22. Способ по п.21, где состояние связано с или характеризуется патологической гибелью и/или ростом нехолинергических нейрональных клеток, холинергических нейрональных клеток, и/или клеток глии, и/или популяций клеток.
23. Способ по п.16 или 17, где состояние обусловлено повреждением центральной нервной системы или нарушением в центральной нервной системе.
24. Способ по п.16 или 17, где состояние обусловлено травматическим, аутоиммунным или дегенеративным заболеванием.
25. Способ по любому из п.16 или 17, где состояние обусловлено повреждением аксонов, вызываемым сотрясением, ушибом, повреждением аксонов, вызываемым черепно-мозговой травмой, повреждением аксонов, вызываемым болезнью малых сосудов в CNS и/или повреждением спинного мозга после заболевания и/или травмы.
26. Способ по п.16 или 17, где указанное состояние характеризуется потерей памяти.
27. Способ по п.16 или 17, где состояние представляет собой рассеянный склероз, асфиксию, гипоксическое повреждение, ишемическое повреждение, травматическое повреждение, болезнь Паркинсона, болезнь Альцгеймера, инсульт или демиелинизирующее заболевание.
28. Способ по п.16 или 17, где антисекреторный белок или олиго- или полипептид, или их производные включают в состав лекарственного средства для внутривенной инфузии, внутримышечной инъекции и/или подкожной инъекции.
29. Способ по п.16 или 17, где антисекреторный белок или олиго- или полипептид, или их производные включают в состав лекарственного средства таким образом, что при введении пациенту активное вещество проникает в желудочки и/или другие полости в и/или на головном мозге указанного пациента.
30. Способ по любому из пп.16 и 17, где антисекреторный белок или олиго- или полипептид, или их производные включают в состав лекарственного средства таким образом, что при введении пациенту активное вещество проникает в спинномозговую жидкость указанного пациента.
31. Применение по любому пп.1 и 2, для лечения состояний, связанных с недостаточным образованием антисекреторных факторов.
32. Применение по любому из пп.1 и 2, для лечения состояний, связанных с недостаточностью функции рецепторов AF и связывающих антисекреторный фактор компонентов ткани.
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| WO 00/38535A, 06.07.2000 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| LANGE S | |||
| et al | |||
| Antisecretory factor synthesis and clinical studies | |||
| Int | |||
| Rev | |||
| Cytol., 2001, v.210, pp.39-75. | |||
Авторы
Даты
2011-04-20—Публикация
2004-09-24—Подача