Настоящее изобретение относится к ксинафоатной соли N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина и к фармацевтическим композициям, содержащим ее, и к способам получения данного соединения. Изобретение дополнительно относится к применению соли и ее композиций для лечения различных состояний, особенно для лечения воспалительных состояний, таких как, например, астма.
Соединение N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамин, имеющее структурную формулу (I):
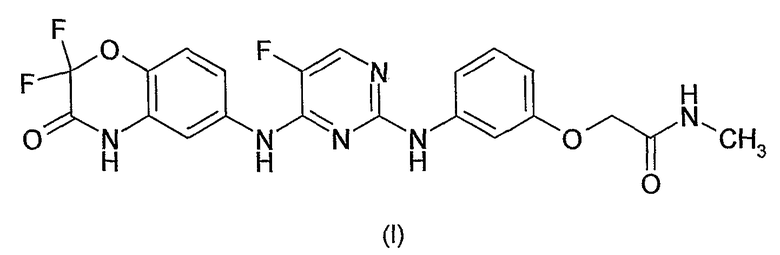
раскрыто в WO-A-03/063794 как пример 7.3.907 на странице 440. Соединение, которое также известно как 2-{3-[4-(2,2-дифтор-3-оксо-3,4-дигидро-2H-бензо[1,4]оксазин-6-иламино)5-фторпиримидин-2-иламино]фенокси}N-метилацетамид, является одним из класса соединений, которые, как указано, являются ингибиторами Syk-киназы и, вследствие этого, пригодны для лечения воспалительных состояний, таких как, например, хроническое обструктивное заболевание легких (COPD). Отмечают, что соединения в фармацевтической композиции могут быть включены в свободной форме или в форме гидрата, сольвата, N-оксида или фармацевтически приемлемой соли (стр. 70-71). Особенно упомянута (стр. 72) фармацевтическая композиция, подходящая для ингаляции, содержащая одно из соединений и подходящую порошковую основу, такую как, например, лактоза или крахмал.
Если соединение должно быть разработано в качестве лекарственного препарата, важно обеспечить форму этого соединения (обычно известного как лекарственное вещество), которую можно надежно получать и очищать в больших масштабах, которая является стабильной и которая не разрушается при хранении. Такие характеристики, как правило, обнаруживаются в лекарственном веществе, которое является кристаллическим и с высокой точкой плавления; твердая кристаллическая фаза с высокой точкой плавления имеет тенденцию к легкой очистке посредством перекристаллизации и стабильности при хранении. Кроме того, лекарственное вещество должно быть подходящим для получения готовой формы в виде лекарственной формы, выбираемой в соответствии с предполагаемым способом введения. Для получения готовой формы в виде сухого порошка, подходящего для ингаляции, для того чтобы получать хорошие характеристики текучести, особенно важна негигроскопичность. Совместимость с общепринятыми наполнителями, такими как, например, лактоза и крахмал, является дополнительным обязательным требованием. Дополнительно, лекарственному веществу обычно будет требоваться обработка для того, чтобы добиться размера частиц, подходящего для ингаляции, и любая кристаллическая форма должна быть стабильна в процессе такой обработки так, чтобы свойства итогового продукта являлись предсказуемыми и надежными. Коротко, подходит или нет соединение для промышленного внедрения в качестве лекарственного препарата зависит от обнаружения формы соединения с уникальным сочетанием свойств, определяемых в соответствии с предполагаемым способом введения.
Свободная форма N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина, раскрытая в WO-A-03/063794, не подходит для промышленного внедрения в качестве лекарственного препарата, поскольку она преимущественно аморфна или существует в неупорядоченной кристаллической форме и склонна к гидратации и сольватации. Вследствие этого, имеется необходимость обеспечить новую форму N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина, которая имеет необходимые характеристики. Образование соли является одним из возможных путей исследования, но свойства солей тяжело прогнозировать, и, хуже того, соединение не будет образовывать соли со многими обычными фармацевтически приемлемыми кислотами. Многие солевые формы, которые образуются, такие как, например, мезилатные, фумаратные, гемифумаратные, гидробромидные, гидрохлоридные, D-тартатные, гемисульфатные и изетионатные соли, обладают одним или более неудовлетворительными свойствами, такими как, например, слабая кристалличность и предрасположенность к образованию гидратов и/или сольватов.
В результате обширного исследования, однако, теперь возможно разработать форму N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина, которая имеет уникальный набор характеристик, делающих ее идеальной для введения в сухой порошковой готовой форме. Ксинафоатная соль является высококристаллической, имеет точку плавления, равную приблизительно 233°C, является, по существу, негигроскопичной и может быть микронизирована посредством размола на струйной мельнице, не вызывая какого-либо изменения в кристаллической форме. Кроме того, она демонстрирует хорошую стабильность при смешивании с моногидратом лактозы и хранении в агрессивных условиях температуры и влажности, а смешанные с лактозой аэрозоли хороши при применении в сочетании со стандартными ингаляторами сухого порошка.
Настоящее изобретение, вследствие этого, предоставляет, в первом аспекте, ксинафоатную соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина, имеющую структуру, показанную в формуле (II) ниже. Ксинафоат является обычным названием для 1-гидрокси-2-нафтоата. Необходимо отметить, что данная молекула может быть изображена в нескольких различных таутомерных формах, в зависимости от расположения протона, каждая из которых является равноценной.
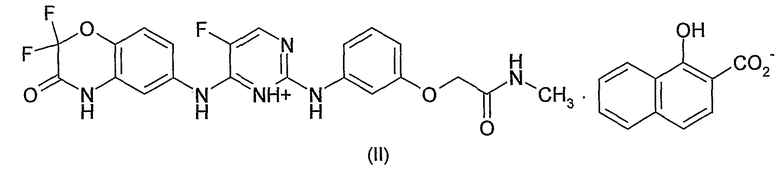
Изобретение дополнительно предоставляет ксинафоатную соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина для применения в качестве лекарственного средства; ксинафоатную соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина для применения при состоянии, при котором показано лечение ингибитором Syk-киназы; применение ксинафоатной соли N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина для производства лекарственного средства, чтобы лечить заболевание, при котором показан ингибитор Syk-киназы; фармацевтическую композицию, содержащую ксинафоатную соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина и фармацевтически приемлемый наполнитель; фармацевтическую композицию для лечения заболевания, при котором показан ингибитор Syk-киназы, содержащую ксинафоатную соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина; и способ лечения заболевания, при котором показан ингибитор Syk-киназы у млекопитающего, включающий введение млекопитающему, при его необходимости, терапевтически эффективного количества ксинафоатной соли N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина. Предпочтительными заболеваниями, для которых показан ингибитор Syk, являются воспалительные респираторные заболевания, такие как, например, астма, риниты и COPD, особенно астма.
Ксинафоатная соль может быть получена посредством растворения N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина и 1-1,1 молярного эквивалента 1-гидрокси-2-нафтоевой кислоты в минимальном количестве подходящего органического растворителя и медленного охлаждения раствора, необязательно с перемешиванием, до осаждения соли из раствора. Подходящими растворителями являются ацетон, ацетонитрил и метилэтилкетон (MEK), необязательно содержащие каждый в своем составе небольшое количество воды (например, менее чем 10%). Особенно предпочтителен метилэтилкетон, и используется, предпочтительно, с приблизительно 5% объема воды. Реагенты, как правило, растворяют в растворителе при температуре выше, чем комнатная температура, но ниже точки кипения растворителя.
N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамин может быть получен посредством общего и специфического способов, раскрытых в WO-A-03/063794. Он может, например, быть получен путем взаимодействия соединения формулы
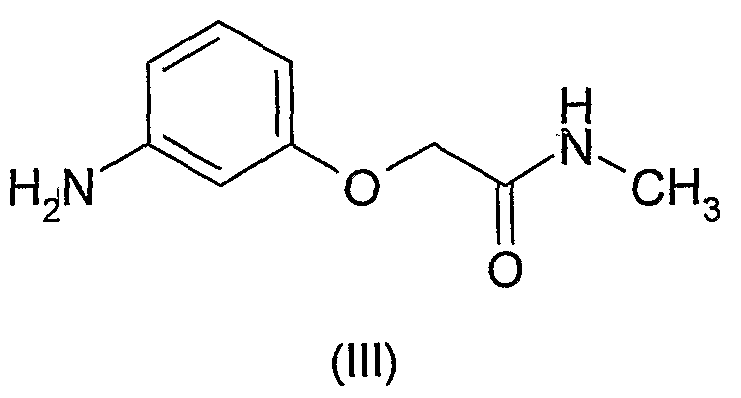
с соединением формулы
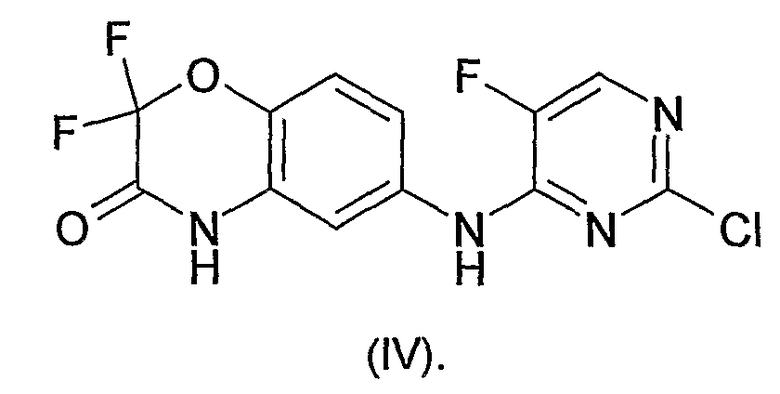
Реакцию, как правило, проводят в подходящем растворителе, предпочтительно, спирте, таком как, например, изоамиловый спирт или изопропиловый спирт, и в присутствии кислотного катализатора, такого как, например, трифторуксусная кислота. Реакцию предпочтительно проводят при повышенной температуре. Если в качестве растворителя выбирают, например, амиловый спирт, предпочтительной является температура, равная приблизительно 100°C.
Соединение формулы (III) может быть получено, как показано на схеме 1 ниже.
Схема 1
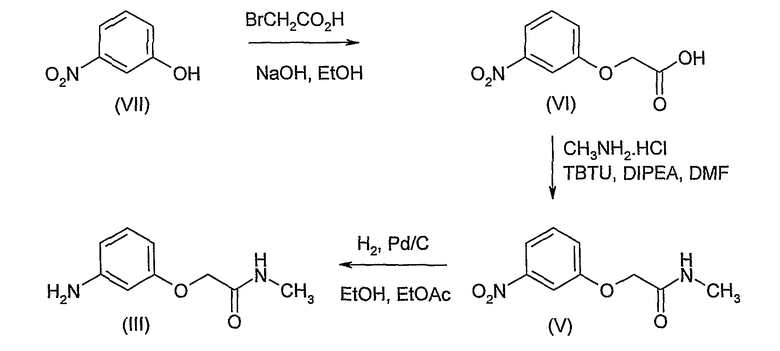
Соединение формулы (III) может быть получено путем восстановления нитрогруппы в соединении формулы (V). В предпочтительной методике использована гидрогенизация. Как правило, раствор соединения формулы (V) в подходящем органическом растворителе, таком как, например, смесь этанола (EtOH) и этилацетата (EtOAc), обрабатывают катализатором гидрирования, таким как, например, палладий-на-углероде, и подвергают воздействию газообразного водорода. Водород обычно применяют при давлении выше атмосферного, предпочтительно, при 30 фунтах на квадратный дюйм (psi).
Соединение формулы (V) может быть получено посредством конденсации кислоты формулы (VI) с метиламином или его солью (такой как, например, гидрохлоридная соль). В принципе, может быть использовано любое конденсирующее средство, подходящее для образования амидных связей, но применение 2-(1H-бензатриазол-1-ил)-1,1,3,3-тетраметилуроний тетрафторбората (TBTU) является предпочтительным. Конденсацию, катализированную TBTU, проводят в подходящем органическом растворителе, таком как, например, N,N-диметилформамид (DMF), и в присутствии основания, такого как, например, N,N-диизопропилэтиламин (DIPEA).
Соединение формулы (VI) может быть получено посредством алкилирования 3-нитрофенола (VII) с бромуксусной кислотой. Реакцию, как правило, проводят в подходящем растворителе, таком как, например, вода или водный раствор этанола (EtOH), в присутствии основания, такого как, например, гидроксид натрия (NaOH), и при повышенной температуре, например, при температуре флегмы выбираемого растворителя.
Соединение формулы (IV) может быть получено, как показано на схеме 2 ниже.
Схема 2
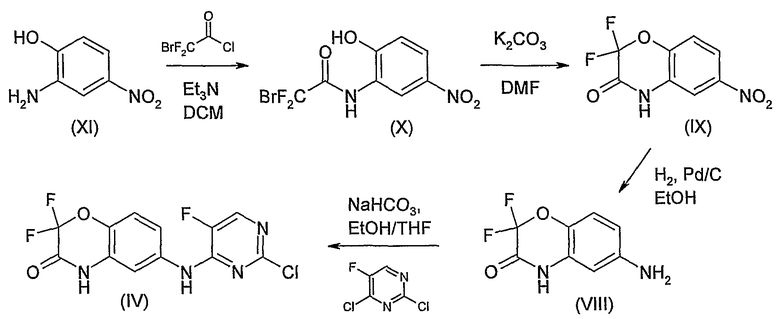
Соединение формулы (IV) может быть получено путем взаимодействия соединения формулы (VIII) с 5-фтор-2,4-дихлорпиримидином. В обычной методике раствор реагентов в подходящем органическом растворителе, таком как, например, этанол (EtOH) или смесь этанола и тетрагидрофурана (THF), обрабатывают основанием, таким как, например, кислый карбонат натрия.
Соединение формулы (VIII) может быть получено посредством восстановления нитрогруппы в соединении формулы (IX). В предпочтительной методике используют гидрогенизацию. Как правило, раствор соединения формулы (IX) в подходящем органическом растворителе, таком как, например, этанол (EtOH), обрабатывают катализатором гидрирования, таким как, например, палладий-на-углероде, и подвергают воздействию газообразного водорода. Водород обычно применяют при давлении выше атмосферного, предпочтительно, при 30 фунтах на квадратный дюйм (psi).
Соединение формулы (IX) может быть получено посредством циклизации соединения формулы (X). В обычной методике раствор соединения формулы (X) в подходящем органическом растворителе, таком как, например, N,N-диметилформамид (DMF) или изопропилацетат, обрабатывают основанием, таким как, например, карбонат калия, и нагревают, например, при температуре флегмы растворителя. Когда в качестве растворителя выбирают DMF, предпочтительной является температура, равная приблизительно 120°C. Когда в качестве растворителя выбирают изопропилацетат, предпочтительной является температура, равная приблизительно 85°C.
Соединение формулы (X) может быть получено посредством ацилирования анилина формулы (XI) 2-бром-2,2-дифторацетил хлоридом. Реакцию предпочтительно проводят в подходящем органическом растворителе, таком как, например, дихлорметан (DCM) или ацетонитрил, в присутствии основания, такого как, например, триэтиламин. Реакция является экзотермической, и, вследствие этого, может быть необходимо охлаждение, например, до 0°C.
Настоящее изобретение включает все кристаллические и фармацевтически приемлемые изотопно-меченные формы ксинафоатной соли N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина. В изотопно-меченной форме один или более атомов замещают атомом или атомами, имеющими такое же атомное число, но атомную массу или массовое число, отличающееся от атомной массы или массового числа, которое преобладает в природе.
Подходящие изотопы включают изотопы водорода, такие как, например, 2H и 3H; углерода, такие как, например, 11C, 13C и 14C; азота, такие как, например, 13N и 15N; кислорода, такие как, например, 15O, 17O и 18O; и серы, такие как, например, 35S. Определенные изотопно-меченные соединения, такие как, например, соединения, содержащие радиоактивный изотоп, пригодны для лекарственного препарата и/или исследований распределения в ткани субстрата. Радиоактивные изотопы тритий, т.е. 3H, и углерод-14, т.е. 14C, особенно пригодны для данной цели ввиду их легкости включения и представляют собой готовое средство обнаружения. Замена более тяжелыми изотопами, как например дейтерий, т.е. 2H, может предоставлять определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличенный in vivo период полувыведения или уменьшенные потребности в дозировках, и, следовательно, может быть предпочтительной в некоторых обстоятельствах. Замена позитроном, излучающим изотопы, такие как, например, 11C, 18F, 15O и 13N, может быть пригодна в исследованиях позитронно-эмиссионной томографии (PET) для исследования оккупации субстратом рецептора. Изотопно-меченные соединения могут в большинстве случаев быть получены посредством общепринятых методик, известных квалифицированным специалистам в данной области, или посредством технологических процессов, аналогичных процессам, описанным в прилагаемых примерах и способах получения, с использованием соответствующего изотопно-меченного реагента вместо немеченного реагента, использованного ранее.
N4-[(2,2-Дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамин представляет собой ингибитор Syk-киназы и способен ингибировать дегрануляцию иммунных клеток, таких как, например, тучные, базофильные, нейтрофильные и/или эозинофильные клетки. Он может быть использован в форме ксинафоатной соли, раскрытой настоящим изобретением и иным образом, для лечения следующих состояний:
- поддающихся лечению обструктивных, рестриктивных или воспалительных заболеваний дыхательных путей любого типа, этиологии или патогенеза, в частности, обструктивных, рестриктивных или воспалительных заболеваний дыхательных путей, таких, например, как выбранные из
астмы, в частности атопической астмы, аллергической астмы, атопической бронхиальной IgE-опосредованной астмы, неатопической астмы, бронхиальной астмы, неаллергической астмы, эссенциальной астмы, истинной астмы, эндогенной астмы, обусловленной патофизиологическими нарушениями, эссенциальной астмы, вызванной неизвестной или скрытой причиной, эмфизематозной астмы, астмы физического усилия, психогенной астмы, экзогенной бронхиальной астмы, вызванной факторами окружающей среды, астмы, индуцированной холодным воздухом, профессиональной астмы, инфекционной астмы, вызванной или ассоциированной с бактериальной, грибковой, протозойной или вирусной инфекцией, начинающейся астмы, синдрома стридора детей, бронхиолита, кашлевой астмы или лекарственной астмы;
гиперреактивности бронхов на агенты окружающей среды;
ринитов или синуситов любого типа, этиологии или патогенеза, в частности сезонного аллергического ринита, круглогодичного аллергического ринита, круглогодичного ринита, вазомоторного ринита, стекания слизи из носоглотки, гнойного или негнойного синуситов, острого или хронического синуситов и этмоидальных, фронтальных, верхнечелюстных или сфеноидальных синуситов;
хронической обструктивной болезни легких (COPD), хронической обструктивной болезни легких (COLD), хронической непроходимости дыхательных путей (COAD) или незначительной обструкции дыхательных путей любого типа, этиологии или патогенеза, в частности хронического бронхита, эмфиземы легких, бронхоэктазии, муковисцидоза, облитерирующего бронхиолита, облитерирующего бронхиолита с организующейся пневмонией (BOOP), хронической организующейся пневмонии (COP), фиброзирующего бронхиолита, фолликулярного бронхиолита или связанной с ним одышкой;
бронхита любого типа, этиологии или патогенеза, в частности острого бронхита, острого ларинготрахеобронхита, арахинового бронхита, катарального бронхита, крупозного бронхита, хронического бронхита, сухого бронхита, инфекционно-астматического бронхита, продуктивного бронхита, стафилококкового или стрептококкового бронхита и везикулярного бронхита;
бронхоэктазии любого типа, этиологии или патогенеза, в частности цилиндрической бронхоэктазии, мешотчатой бронхоэктазии, веретеновидной бронхоэктазии, капиллярной бронхоэктазии, кистовидной бронхоэктазии, муковисцидоза, синдрома Картагенера, сухой бронхоэктазии или фолликулярной бронхоэктазии;
легочных эозинофильных синдромов любого типа, этиологии или патогенеза, в частности острой эозинофильной пневмонии (идиопатической или обусловленной лекарственными препаратами или паразитами), простой легочной эозинофилии, синдрома Леффлера, тропической легочной эозинофилии, хронической эозинофильной пневмонии, аллергического бронхолегочного микоза, аллергического бронхолегочного аспергиллеза (ABPA), синдрома Чарджа-Стросса или идиопатического гиперэозинофильного синдрома;
интерстициальных легочных заболеваний (ILD) или пневмосклероза любого типа, этиологии или патогенеза, в частности идиопатического пневмосклероза, криптогенного фиброзирующего альвеолита, фиброзирующего альвеолита, ILD или пневмосклероза, связанного с заболеванием соединительной ткани (системной красной волчанкой, смешанным заболеванием соединительной ткани, полимиозитом, дерматомиозитом, синдромом Шегрена, системным склерозом, склеродермией, ревматоидным артритом), обычной интерстициальной пневмонии (UIP), десквамативной интерстициальной пневмонии (DIP), гранулематозной болезни легких, саркоидоза, гранулематоза Вегенера, гистиоцитоза X, гранулематоза, обусловленного клетками Лангерганса, пневмонита гиперчувствительности, экзогенно-аллергического альвеолита, силикоза, хронической эозинофильной пневмонии, лимфангиомиоматоза, ILD или пневмосклероза, индуцированных приемом лекарственных препаратов, ILD или пневмосклероза, вызванных радиационным излучением, альвеолярного протеиноза, реакции "трансплантат-против-хозяина" (GVHD), отторжения легочного трансплантата, ILD или пневмосклероза, обусловленных воздействием окружающей среды/профессиональных факторов, BOOP, COP, фиброзирующего облитерирующего бронхиолита, фолликулярного бронхиолита, острого идиопатического интерстициального пневмонита (синдрома Хаммана-Рича) или альвеолярных геморрагических синдромов;
пневмокониоза любого типа, этиологии или патогенеза, в частности алюминиевого пневмокониоза или бокситного силикоза легких, антракоза или астмы шахтеров, прогрессирующего массивного фиброза (PMF), асбестоза или астмы монтажников парового оборудования, халикоза или силикоза, птилоза, вызванного вдыханием пыли от страусовых перьев, сидероза, вызванного вдыханием частиц железа, силикоза или болезни шлифовщиков, биссиноза или астмы, вызванной хлопковой пылью, и талькового пневмокониоза;
острого респираторного дистресс-синдрома (ARDS), респираторного дистресс-синдрома взрослых или острого повреждения легких любого типа, этиологии или патогенеза;
аспирационных нарушений любого типа, этиологии или патогенеза, приводящих к развитию аспирационного пневмонита или аспирационной пневмонии;
альвеолярного кровотечения любого типа, этиологии или патогенеза, в частности члена группы, состоящей из идиопатического гемосидероза легких, альвеолярного кровотечения, обусловленного приемом лекарственных препаратов или других экзогенных агентов, альвеолярного кровотечения, ассоциированного с ВИЧ или трансплантатом костного мозга или аутоиммунного альвеолярного кровотечения (например, связанного с системной красной волчанкой, синдромом Гудпасчера, гранулематозом Вегенера, микроангиопатией, синдромом Чарджа-Стросса, пауцииммунным гломерулонефритом);
острого или хронического ларингита или фарингита;
кашля любого типа, этиологии или патогенеза, в частности идиопатического кашля или кашля, связанного с желудочно-пищеводной рефлюксной болезнью (GERD), лекарственными препаратами, гиперчувствительностью бронхов, астмой, COPD, COLD, COAD, бронхитом, бронхоэктазией, легочными эозинофильными синдромами, пневмокониозом, интерстициальным легочным заболеванием, пневмосклерозом, аспирационными нарушениями, ринитом, ларингитом или фарингитом;
- анафилактической реакции и реакции гиперчувствительности 1 типа любой этиологии;
- атопическими, аллергическими, аутоиммунными или воспалительными поражениями кожи любого типа, этиологии или патогенеза, в частности атопического дерматита, аллергического дерматита, контактного дерматита, аллергической или атопической экземы, красного плоского лишая, мастоцитоза, узловой эритемы, мультиформной эритемы, доброкачественного семейного пемфигуса, эритематозного пемфигуса, листовидного пемфигуса и обыкновенного пемфигуса, буллезного пемфигоида, буллезного эпидермолиза, герпетиформного дерматита, псориаза, иммуноопосредованной крапивницы, крапивницы, опосредованной комплементом, крапивницы, индуцированной веществом, вызывающим крапивницу, крапивницы, индуцированной физическим агентом, крапивницы, индуцированной стрессом, идиопатической крапивницы, острой крапивницы, хронической крапивницы, ангионевротического отека, холинергической крапивницы, холодовой крапивницы в аутосомно-доминантной форме или в приобретенной форме, контактной крапивницы, гигантской крапивницы и папулезной детской крапивницы;
- конъюнктивита любого типа, этиологии или патогенеза, в частности актинического конъюнктивита, острого катарального конъюнктивита, острой трахомы, аллергического конъюнктивита, атопического конъюнктивита, хронического катарального конъюнктивита, гнойного конъюнктивита и весеннего конъюнктивита;
- рассеянного склероза любого типа, этиологии или патогенеза, в частности первичного прогрессирующего рассеянного склероза или возвратно-ремиттирующего рассеянного склероза;
- аутоиммунных/воспалительных заболеваний любого типа, этиологии или патогенеза, в частности аутоиммунных гематологических расстройств, гемолитической анемии, апластической анемии, истинной эритроцитарной анемии, идиопатической тромбоцитопенической пурпуры, ревматоидного артрита, системной красной волчанки, склеродермии, системного склероза, ревматической полимиалгии, дерматомиозита, полимиозита, полихондрита, гранулематоза Вегенера, хронического активного гепатита, миастении gravis, синдрома Стевена-Джонсона, идиопатической спру, аутоиммунных воспалительных кишечных заболеваний, болезни Крона, язвенного колита, эндокринной офтальмопатии, болезни Грейвса, саркоидоза, альвеолита, хронического аллергического пневмонита, первичного билиарного цирроза печени, ювенильного диабета или сахарного диабета I типа, сухого кератоконъюнктивита, эпидемического кератоконъюнктивита, гломерулонефрита с нефротическим синдромом и без нефротического синдрома, острого гломерулонефрита, идиопатического нефротического синдрома, нефропатии минимального изменения, аутоиммунных нарушений, связанных с интерстициальными легочными заболеваниями и/или пневмосклерозом или аутоиммунных или воспалительных поражений кожи;
- воспалительного кишечного заболевания (IBD) любого типа, этиологии или патогенеза, в частности коллагенозного колита, полипозного колита, трансмурального колита, неспецифического язвенного колита и болезни Крона (CD);
- легочной гипертензии любого типа, этиологии или патогенеза, включая легочную артериальную гипертензию, легочную венозную гипертензию, легочную гипертензию, индуцированную нарушениями дыхательной системы и/или гипоксией, легочную гипертензию, обусловленную хроническим тромботическим и/или эмболическим заболеванием, и легочную гипертензию, обусловленную нарушениями, вызванными непосредственно сосудистой системой легких;
- артрита любого типа, этиологии или патогенеза, в частности ревматоидного артрита, остеоартрита, подагрического артрита, пирофосфатной артропатии, острого кальцифицирующего периартрита, хронического воспалительного артрита, артрита, обусловленного поражением соединительной ткани (например, системной красной волчанкой, полимиозитом, дерматомиозитом, системным склерозом, склеродермией), саркоидоза, ревматической полимиалгии, дегенеративного артрита, инфекционного артрита, артрита Лайма, пролиферативного артрита, псориатического артрита, анкилозирующего спондилита, шейного спондилеза, артрита позвонковых суставов, юванильного артрита (болезни Стилла), амилоидоза, анкилозирующего гиперостоза позвоночника (болезни Форрестера), синдрома Бехчета, артрита, обусловленного приемом лекарственных препаратов, семейной средиземноморской лихорадки, синдрома гипермобильности суставов, рассекающего остеохондрита, остеохондроматоза, мигрирующего артрита, пигментного виллезонодулярного синовита, рецидивирующего полихондрита, дисфункционально-болевого синдрома височно-нижнечелюстного сустава или артрита, обусловленного гиперлипидемией;
- эозинофильного поражения любого типа, этиологии или патогенеза, в частности эозинофильных синдромов, аспергилломы, эозинофильной гранулемы, аллергического гранулематозного ангиита или синдрома Чарджа-Стросса, узелкового полиартериита (PAN) или системного некротического васкулита;
- увеита любого типа, этиологии или патогенеза, в частности воспаления всей сосудистой оболочки глазного яблока или ее участка, переднего увеита, ирита, циклита, иридоциклита, гранулематозного увеита, негранулематозного увеита, факоантигенного увеита, заднего увеита, хориоидита и хориоретинита;
- септического шока любого типа, этиологии или патогенеза;
- заболеваний потери/резорбции кости, включая остеопороз и остеопению;
- лимфопролиферативных заболеваний (например, лимфомы, миеломы);
- заболеваний, относящихся к ВИЧ или СПИД;
- инфекции, особенно инфекции вирусами, где такие вирусы повышают продуцирование TNF-α у их хозяина, либо где такие вирусы чувствительны к положительной регуляции TNF-α у их хозяина, так что на их репликацию или другие жизненные активности оказано вредное воздействие, включая вирус, который является членом, выбранным из группы, состоящей из ВИЧ-1, ВИЧ-2 и ВИЧ-3, цитомегаловируса (CMV), вируса гриппа, аденовирусов и вирусов герпеса, включая Herpes zoster и Herpes simplex;
- дрожжевых и грибковых инфекций, где указанные дрожжи и грибки чувствительны к положительной регуляции TNF-α или повышают продуцирование TNF-α у их хозяина, например грибкового менингита, особенно при введении в сочетании с другими препаратами выбора для лечения системных дрожжевых и грибковых инфекций, включая, но не ограничиваясь ими, полимиксины (например, полимицин В), имидазолы (например, клотримазол, эконазол, миконазол и кетоконазол), триазолы (например, флуконазол и итраназол), и амфотерицины (например, амфотерицин В и липосомальный амфотерицин В); и
- микобактериальных инфекций, например, обусловленных mycobacterium tuberculosis.
Ксинафоатная соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина (называемая в дальнейшем соединение изобретения) может быть введена отдельно, но в большинстве случаев будет вводиться в виде готовой формы совместно с одним или более фармацевтически приемлемыми наполнителями. Термин 'наполнитель' использован в данной заявке для описания любого ингредиента, иного, чем соединение изобретения. Выбор наполнителя будет в значительной степени зависеть от таких факторов, как особенный способ введения, влияние наполнителя на растворимость и стабильность, и природа лекарственной формы.
Фармацевтические композиции, подходящие для доставки соединения изобретения, и способы их получения будут легко понятны средним специалистам в данной области. Такие композиции и способы их получения могут быть найдены, например, в Remington's Pharmaceutical Sciences, 19ое Издание (Mack Publishing Company, 1995).
Соединение изобретения может быть введено перорально. Пероральное введение может включать проглатывание, так чтобы соединение входило в желудочно-кишечный тракт, или может быть использовано защечное или подъязычное введение, посредством которого соединение входит в кровоток непосредственно изо рта.
Готовые формы, подходящие для перорального введения, включают твердые готовые формы, такие как, например, таблетки, капсулы, имеющие в своем составе твердые частицы, жидкости или порошки, пастилки (включающие жидкие заполнители), жевательные резинки, мульти- и наночастицы, гели, твердый раствор, липосомы, пленки, овулы, спреи и жидкие готовые формы.
Жидкие готовые формы включают суспензии, растворы, сиропы и эликсиры. Такие готовые формы могут быть использованы в качестве наполнителей в мягких или твердых капсулах и, как правило, содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие готовые формы могут также быть получены посредством растворения твердых, например, из пакетика.
Соединение изобретения может также быть использовано в быстрорастворимых, быстроразлагающихся лекарственных формах, таких как, например, формы, описанные в Экспертном Мнении в Терапевтических Патентах, 11 (6), 981-986, Liang и Chen (2001).
Для таблетированных лекарственных форм, в зависимости от дозы, соединение изобретения может составлять от 1% мас. до 80% мас. лекарственной формы, более часто от 5% мас. до 60% мас. лекарственной формы.
Кроме того, таблетки в большинстве случаев имеют в своем составе разрыхлитель. Примеры разрыхлителей включают натрий крахмалгликолят, натрийкарбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, кроскармелозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, низшую алкил-замещенную гидроксипропилцеллюлозу, крахмал, прежелатинизированный крахмал и натрия альгинат. В большинстве случаев, разрыхлитель будет содержать от 1% мас. до 25% мас., предпочтительно от 5% мас. до 20% мас. лекарственной формы.
Связующие вещества также в большинстве случаев используют, чтобы придать таблетированной готовой форме когезионные качества. Подходящие связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, натуральные и синтетические смолы, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропиловую целлюлозу и гидроксипропиловую метилцеллюлозу. Таблетки могут также иметь в своем составе разбавители, такие как, например, лактозу (моногидрат, распылительно-высушенный моногидрат, безводную и т.п.), маннит, ксилит, декстрозу, сукрозу, сорбит, микрокристаллическую целлюлозу, крахмал и двухосновный кальций фосфат дигидрат.
Таблетки могут также необязательно содержать поверхностно-активные агенты, такие как, например, лаурилсульфат натрия и полисорбат 80, и глиданты, такие как, например, диоксид кремния и тальк. Когда присутствуют, поверхностно-активные агенты могут содержать от 0,2% мас. до 5% мас. таблетки, а глиданты могут содержать от 0,2% мас. до 1% мас. таблетки.
Таблетки также в большинстве случаев имеют в своем составе смазывающие вещества, такие как, например, магния стеарат, кальция стеарат, цинка стеарат, натрия стеарил фумарат, и смеси магния стеарата с лаурилсульфатом натрия. Смазывающие вещества в большинстве случаев содержат от 0,25% мас. до 10% мас., предпочтительно от 0,5% мас. до 3% мас. таблетки.
Другие возможные ингредиенты таблеток включают антиоксиданты, окрашивающие агенты, ароматизирующие агенты, консерванты и маскирующие вкус агенты.
Иллюстративные таблетки имеют в своем составе до приблизительно 80% мас. лекарственного вещества, от приблизительно 10% мас. до приблизительно 90% мас. связующего вещества, от приблизительно 0% мас. до приблизительно 85% мас. разбавителя, от приблизительно 2% мас. до приблизительно 10% мас. разрыхлителя и от приблизительно 0,25% мас. до приблизительно 10% мас. смазывающего вещества.
Для придания формы таблеток смеси для таблеток могут быть подвергнуты прямому прессованию или роликовому прессованию. Смеси для таблеток или части смесей, альтернативно, могут быть гранулированы мокрым путем, сухим путем или из расплава, заморожены в расплавленном состоянии или экструдированы перед таблетированием. Конечная готовая форма может содержать один или более слоев и может быть с покрытием или без него; она может даже быть заключена в капсулу.
Готовая форма таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, Vol. 1, by H. Lieberman и L. Lachman (Marcel Dekker, New York, 1980).
Соединение изобретения может также вводиться перорально в форме готовой к употреблению пероральной пленки для людей или применения в ветеринарии. Такая пленка представляет собой, как правило, гибкую растворимую в воде или набухаемую в воде тонкопленочную лекарственную форму, которая может быстро растворяться или прилипать к слизистым оболочкам и, как правило, содержит соединение изобретения, пленкообразующий полимер, связующее вещество, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, модификатор вязкости и растворитель. Некоторые компоненты готовой формы могут выполнять более чем одну функцию.
Пленкообразующий полимер может быть выбран из натуральных полисахаридов, белков или синтетических гидроколлоидов и, как правило, присутствует в диапазоне от 0,01 до 99% мас., более точно в диапазоне от 30 до 80% мас.
Другие возможные пленочные ингредиенты включают антиоксиданты, окрашивающие агенты, ароматизаторы и усилители аромата, консерванты, стимулирующие саливацию агенты, охлаждающие агенты, совместные растворители (включая масла), смягчающие вещества, объемообразующие агенты, противовспенивающие агенты, поверхностно-активные вещества и маскирующие вкус агенты.
Пленки в соответствии с изобретением, как правило, получают посредством сушки выпариванием тонких водных пленок, наносимых на отслаивающуюся поддерживающую подложку или бумагу. Это может быть выполнено в сушильной печи или туннеле, как правило, комбинированной установке для нанесения покрытий и сушки, или посредством лиофилизации или вакуумной сушки.
Твердые готовые формы для перорального введения могут быть составлены для немедленного и/или модифицированного высвобождения. Модифицированное высвобождение включает отсроченное, замедленное, прерывистое, регулируемое, нацеленное и запрограммированное высвобождение.
Подходящие готовые формы с модифицированным высвобождением для целей изобретения описаны в патенте США № 6106864. Подробности других подходящих методик высвобождения, таких как, например, высокоэнергетические дисперсии и осмотические и покрытые частицы можно найти в Pharmaceutical Technology On-line, 25(2), 1-14, by Verma et al. (2001). Применение жевательной резинки для достижения регулируемого высвобождения описано в WO-A-00/35298.
Соединение изобретения может также быть введено непосредственно в кровоток, внутримышечно или во внутренний орган. Такое парентеральное введение может происходить посредством внутривенного, внутриартериального, внутрибрюшинного, интратекального, внутрижелудочкового, интрауретрального, интрастернального, внутричерепного, внутримышечного или подкожного способа. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и инфузионные методики.
Парентеральные готовые формы, как правило, представляют собой водные растворы, которые могут иметь в своем составе наполнители, такие как, например, соли, углеводы и буферные агенты (предпочтительно для pH, равного от 3 до 9), но, для некоторых способов применения, они могут быть составлены более подходящим образом, в виде стерильного неводного раствора или в виде высушенной формы, подлежащей использованию в сочетании с подходящей средой, такой как, например, стерильная, апирогенная вода.
Получение парентеральных готовых форм в стерильных условиях, например, посредством лиофилизации, может быть легко выполнено с применением стандартных фармацевтических методик, хорошо известных квалифицированным специалистам в данной области.
Готовые формы для парентерального введения могут быть составлены для немедленного и/или модифицированного высвобождения. Модифицированное высвобождение включает отсроченное, замедленное, прерывистое, регулируемое, нацеленное и запрограммированное высвобождение. Таким образом, соединение изобретения может быть составлено в виде плотной, полутвердой или тиксотропной жидкости для введения в качестве имплантируемого депо, обеспечивающего модифицированное высвобождение соединения изобретения. Примеры таких готовых форм включают стенты, покрытые лекарственным веществом, и микросферы поли(dl-молочной-когликолевой)кислоты (PGLA).
Соединение изобретения может также быть введено местно на кожу или слизистую, т.е. дермально или трансдермально. Обычные готовые формы для данной цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, накожные пластыри, прокладки, импланты, губки, волокна, перевязочные материалы и микроэмульсии. Также могут быть использованы липосомы. Обычные носители включают спирт, воду, минеральное масло, жидкий вазелин, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены вещества, способствующие проникновению, см., например, J. Pharm. Sci., 88 (10), 955-958, Finnin and Morgan (October 1999).
Другое средство местного введения включает доставку посредством электрофореза, ионтофореза, фонофореза, сонофореза и микроигольной или безыгольной инъекции (например, Powderject™, Bioject™).
Готовые формы для местного введения могут быть составлены для немедленного и/или модифицированного высвобождения. Модифицированное высвобождение включает отсроченное, замедленное, прерывистое, регулируемое, нацеленное и запрограммированное высвобождение.
Соединение изобретения можно также вводить интраназально или посредством ингаляции, как правило, в форме сухого порошка (либо отдельно, в качестве смеси, например, в сухой смеси с лактозой, или в качестве смешанной составной частицы, например, смешанной с фосфолипидами, такой как, например, фосфатидилхолин) через ингалятор сухого порошка или в качестве аэрозольного спрея через баллон с повышенным давлением, помпу, распылитель, аэрозольный аппарат (предпочтительно, аэрозольный аппарат с использованием электрогидродинамики для получения мелкодисперсного тумана), или небулайзер, с применением подходящего пропеллента, такого как, например, 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или без него. Для интраназального использования порошок может содержать биоадгезивный агент, например, хитозан или циклодекстрин. Введение в форме сухого порошка через ингалятор сухого порошка является особенно предпочтительной формой доставки.
Баллон с повышенным давлением, помпа, пульверизатор, аэрозольный аппарат или небулайзер содержат раствор или суспензию соединения изобретения, содержащие, например, этанол, водный раствор этанола или подходящий альтернативный агент для диспергирования, солюбилизации или пролонгированного высвобождения активного вещества, пропеллента (пропеллентов) в качестве растворителя и необязательного поверхностно-активного вещества, такого как, например, сорбитан триолеат, олеиновая кислота или олигомолочная кислота.
Перед применением готовой формы в виде сухого порошка или суспензии лекарственный продукт микронизируют до размера, пригодного для доставки посредством ингаляции (как правило, менее чем 5 микрон). Это может быть достигнуто посредством любого соответствующего способа измельчения, такого как, например, размол на спиральной струйной мельнице, размол на струйной мельнице кипящего слоя, переработка надкритической жидкости для формирования наночастиц, гомогенизация под высоким давлением или сушка распылением.
Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе могут иметь готовые формы, в состав которых входит порошковая смесь соединения изобретения, подходящая порошковая основа, такая как, например, лактоза или крахмал, и модификатор действия, такой как, например, l-лейцин, маннит или магния стеарат. Лактоза может быть безводной или в форме моногидрата, предпочтительно последнее. Другие подходящие наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящий раствор готовой формы для применения в аэрозольном аппарате с использованием электрогидродинамики для получения мелкодисперсного тумана может иметь в своем составе от 1 мкг до 20 мг соединения изобретения на разовую дозу, и объем разовой дозы может варьировать от 1 мкл до 100 мкл. Обычная готовая форма может содержать соединение формулы I, пропиленгликоль, стерильную воду, этанол и натрия хлорид. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
Подходящие ароматизирующие агенты, такие как, например, ментол и левоментол, или подсластители, такие как, например, сахарин или сахарин натрия, можно добавлять к тем готовым формам изобретения, которые предназначены для ингаляционного/интраназального введения.
Готовые формы для ингаляционного/интраназального введения могут быть составлены для немедленного и/или модифицированного высвобождения с использованием, например, PGLA. Модифицированное высвобождение включает отсроченное, замедленное, прерывистое, регулируемое, нацеленное и запрограммированное высвобождение.
В случае ингаляторов сухого порошка и аэрозолей, единица дозирования может определяться посредством клапана, который доставляет отмеренное количество. Суммарную суточную дозу можно вводить в виде одноразовой дозы или, более обычно, в виде раздельных доз в течение дня.
Соединение изобретения можно вводить ректально или вагинально, в форме, например, суппозитория, пессария или клизмы. Масло какао является традиционной основой для суппозитория, но в случае необходимости могут быть использованы различные альтернативы. Соединение изобретения можно использовать посредством глазного или ушного введения.
Соединение изобретения может быть объединено с растворимым макромолекулярным объектом, таким как, например, циклодекстрин или его подходящее производное или полимер, имеющий в своем составе полиэтиленгликоль, для того чтобы улучшить его растворимость, скорость растворения, исправление вкуса, биодоступность и/или стабильность для применения в любом из упомянутых выше вариантов введения.
Обнаружено, что комплексы лекарственный препарат-циклодекстрин, например, являются в большинстве случаев пригодными для большинства лекарственных форм и способов введения. Могут быть использованы комплексы, как включения, так и невключения. Как альтернатива прямому комплексообразованию с лекарственным веществом, в качестве вспомогательной добавки может быть использован циклодекстрин, т.е. в качестве носителя, разбавителя или солюбилизатора. Наиболее часто для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в WO-A-91/11172, WO-A-94/02518 и WO-A- 98/55148.
Для введения людям суммарная суточная доза соединения изобретения будет, как правило, находиться в диапазоне от 0,002 мг/кг до 100 мг/кг в зависимости, конечно, от пути введения. Суммарная суточная доза может вводиться в виде одноразовой или раздельных доз и, по усмотрению врача, может выходить за пределы обычного диапазона, приводимого в данной заявке.
С целью исключить неправильное толкование, ссылки в данной заявке на "лечение" включают ссылки на терапевтическое, паллиативное и профилактическое лечение.
Ингибиторы Syk-киназы, такие как, например, соединение изобретения, можно преимущественно вводить в комбинации с одним или более другими терапевтическими агентами, особенно для лечения респираторных заболеваний, таких как астма. Примеры таких дополнительных терапевтических агентов включают (i) ингибиторы 5-липоксигеназы (5-LO) или антагонистов 5-липоксигеназаактивирующего белка (FLAP); (ii) антагонисты лейкотриена (LTRA), включая антагонисты LTB4, LTC4, LTD4, и LTE4; (iii) антагонисты гистаминового рецептора, включая антагонисты H1, H3 и H4; (iv) агонистические по отношению к α1- и α2-адренорецепторам сосудосуживающие симпатомиметические агенты против заложенности носа; (v) антагонисты мускаринового M3 рецептора или антихолинергические агенты; (vi) ингибиторы PDE (фосфодиэстераза), например ингибиторы PDE3, PDE4 и PDE5; (vii) теофиллин; (viii) кромогликат натрия; (ix) ингибиторы СОХ (циклооксигеназа) как неселективные, так и селективные ингибиторы СОХ-1 или COX-2 (NSAID (нестероидные противовоспалительные лекарственные средства)); (x) пероральные и ингалируемые глюкокортикостероиды, такие как DAGR (диссоциированные агонисты кортикоидного рецептора); (xi) моноклональные антитела, активные против эндогенных воспалительных объектов; (xii) агенты против фактора некроза опухоли (анти-TNF-α); (xiii) ингибиторы молекул адгезии, включая антагонисты VLA-4 (очень поздний антиген-4); (xiv) антагонисты кинин-B1- и -В2-рецепторов; (xv) иммуносупрессивные агенты; (xvi) ингибиторы матриксных металлопротеиназ (ММР); (xvii) антагонисты тахикининовых NK1-, NK2- и NK3-рецепторов; (xviii) ингибиторы эластазы; (xix) агонисты аденозинового А2а-рецептора; (xx) ингибиторы урокиназы; (xxi) соединения, воздействующие на допаминовые рецепторы, например, D2-агонисты; (xxii) модуляторы NFκβ-пути, например, ингибиторы IKK; (xxiii) модуляторы цитокиновых сигнальных путей, такие как р38 МАР-киназа (митогенактивируемая протеинкиназа) или ингибитор JAK-киназы (Янус-киназы); (xxiv) агенты, которые можно классифицировать как муколитические или противокашлевые средства; (xxv) антибиотики; (xxvi) ингибиторы HDAC (гистондиэтилазы); (xxvii) ингибиторы PI3-киназы; (xxviii) β2-агонисты; и (xxix) двойные соединения, активные в качестве β2-агонистов и антагонистов мускаринового M3 рецептора. Предпочтительные примеры таких терапевтических агентов включают (a) глюкокортикостероиды, в частности ингалируемые глюкокортикостероиды с пониженными системными побочными эффектами, флунисолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флютиказона пропионат, циклесонид и мометазона фуроат; (b) антагонисты мускаринового M3 рецептора или антихолинергические агенты, включая соли ипротропиума, такие как, например, бромид, соли тиотропиума, такие как, например, бромид, соли окситропиума, такие как, например, бромид, перензепин и телензепин; и (c) β2 агонисты, включая сальбутамол, тербуталин, бамбутерол, фенотерол, сальметерол, формотерол, тулобутерол. Любой из отдельно упомянутых агентов необязательно можно использовать в форме фармацевтически приемлемой соли.
Когда необходимо вводить комбинацию активных соединений, две или более фармацевтические композиции, по меньшей мере одна из которых имеет в своем составе соединение изобретения, можно легко объединить в виде набора, подходящего для совместного введения.
Такой набор содержит две или более отдельные фармацевтические композиции, по меньшей мере, одна из которых имеет в своем составе соединение изобретения, и средство для хранения раздельно указанных композиций, такое как, например, контейнер, бутылка с отделениями или пакет из фольги с отделениями. Примером такого набора является хорошо известная блистерная упаковка, используемая для упаковки таблеток, капсул и т.п.
Такой набор особенно подходит для введения различных лекарственных форм, например пероральных и парентеральных лекарственных форм, для введения отдельных композиций с различными интервалами между введениями лекарственного средства, или для титрования отдельных композиций друг другом. Чтобы следовать правилам, набор обычно содержит инструкции по введению и может быть предоставлен с так называемой памяткой.
Пример получения
Получение ксинафоатной соли N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина иллюстрирует следующий пример.
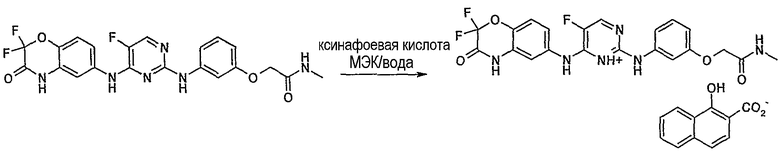
Суспензию 2-{3-[4-(2,2-дифтор-3-оксо-3,4-дигидро-2H-бензо[1,4]оксазин-6-иламино)5-фторпиримидин-2-иламино]фенокси}N-метилацетамида (1,18 кг, 2,49 ммоль, 1 эквивалент) в метилэтилкетоне (МЭК) (23,6 л, 20 мл/г) нагревали до 55°C, после чего добавляли воду (1,18 л, 1 мл/г), с получением раствора. Раствор пропускали через фильтр для очищения, затем выдерживали при 55°C в течение 1 часа. Последующее добавление предварительно полученного произвольным образом раствора 1-гидрокси-2-нафоевой кислоты (515 г, 2,74 моль, 1,1 эквивалент) в МЭК (4,72 л, 4 мл/г) приводило к осаждению белого твердого вещества после ~10 мин. Реакцию охлаждали до температуры внешней среды, перемешивали в течение ночи (18 часов), а затем охлаждали до 5°C в течение 2 часов перед фильтрованием. Отфильтрованное твердое вещество отмывали с МЭК (2×2,36 л, 2×2 мл/г) и высушивали при пониженном давлении при 50°C в течение 16 часов. Продукт, соль 2-{3-[4-(2,2-дифтор-3-оксо-3,4-дигидро-2H-бензо[1,4]оксазин-6-иламино)5-фторпиримидин-2-иламино]фенокси}N-метилацетамид 1-гидрокси-2-нафоевой кислоты, выделяли в виде белого твердого вещества (1,32 кг, 80%).
При анализе посредством общепринятого протонного ЯМР (300 МГц, d6-ДМСО), ксинафоатная соль дает следующий спектр: δ 2,65 (д, J=4,5 Гц, 3H), 4,34, (с, 2H), 6,46-6,52 (м, 1H), 7,10 (т, J=8,0 Гц, 1H), 7,23-7,28 (м, 2H), 7,36-7,41 (м, 2H), 7,45-7,48 (м, 1H), 7,55-7,62 (м, 2H), 7,64-7,71 (м, 1H), 7,73-7,77 (м, 1H), 7,86-7,95 (м, 2H), 8,14 (д, J=4,0 Гц, 1H), 8,26-8,32 (м, 1H), 9,14 (с, 1H), 9,56 (с, 1H), 11,90-11,96 (м, 1H).
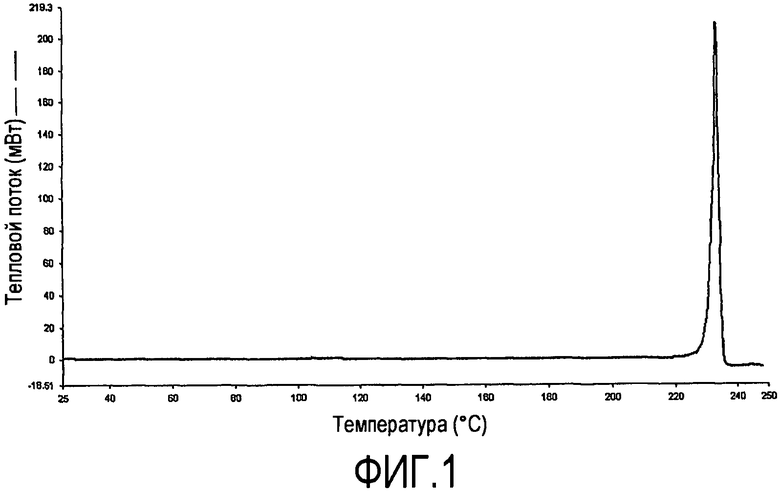
При анализе посредством дифференциальной сканирующей калориметрии (DSC) (8,588 мг образца нагревали от 25 до 250°C на 20°C в минуту с использованием Perkin Elmer Diamond DSC с автоматическим пробоотборником и алюминиевой кюветой и крышкой с вентилируемой боковой стенкой с 4 отверстиями с током газообразного азота), ксинафоатная соль демонстрирует острый эндотермический пик плавления при 233°Cλ2°C. Запись DSC показана на фиг.1.
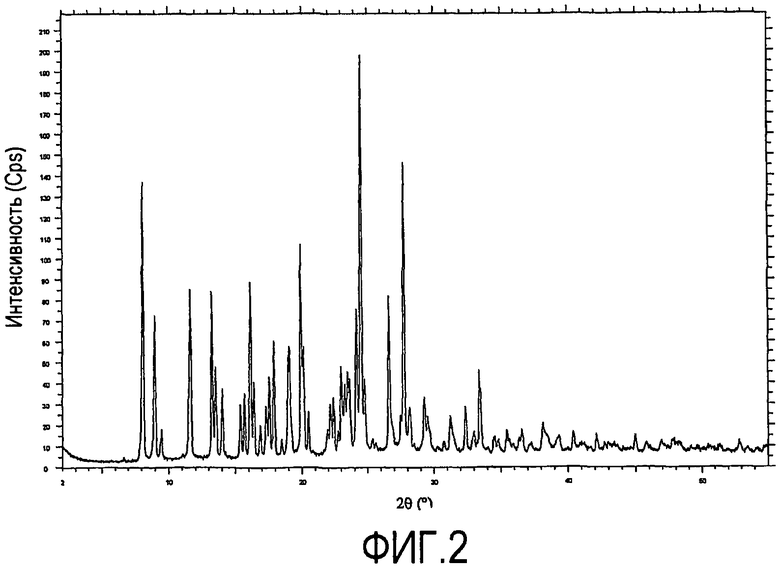
При характеризации посредством порошковой рентгеновской дифрактометрии (PXRD), ксинафоатная соль дает диаграмму, показанную на фиг.2. Характеристические пики предоставлены ниже в таблице 1. Главные характеристические пики находятся на 8,0, 8,9, 11,6, 24,5 и 27,7 градусах два тета (λ0,1 градуса).
Характеристические пики PXRD
Диаграмма порошковой рентгеновской дифрактометрии была определена с использованием порошкового рентгеновского дифрактометра Bruker-AXS Ltd D4, снабженного устройством автоматической смены образцов, тета-тета гониометром, автоматической щелью расходимости пучка и детектором PSD Vantec-1. Образец готовили для анализа посредством установки на низкофоновый держатель образцов кремниевых пластин. Образец вращали во время облучения рентгеновскими лучами K-альфа1 меди (длина волны = 1,5406 Ангстрем) с рентгеновской трубкой, задействованной при 40 кВ/30 мА. Анализ выполняли с гониометром, работающим с установкой непрерывного режима для 0,2-секундного счета на шаг 0,018° в два тета диапазоне от 2° до 55°. Пики выбирали вручную с использованием программного обеспечения для оценки Bruker-AXS Ltd. Данные получали при 21°C.
Как будет понятно специалистам, относительные интенсивности различных пиков в таблице 1, приводимые ниже, могут варьировать вследствие ряда факторов, таких как, например, эффекты ориентации кристаллов в рентгеновском пучке или чистота материала, подлежащего анализу, или степень кристалличности образца. Положения пиков могут также сдвигаться для вариантов образцов по высоте, но положения пиков будут оставаться по существу, как определено в приводимой таблице 1. Квалифицированные специалисты также поймут, что измерения с использованием различных длин волн будет приводить к различным сдвигам в соответствии с уравнением Брэгга - nλ = 2d sin θ. Такие альтернативные диаграммы PXRD, созданные с помощью применения альтернативных длин волн, являются, тем не менее, представлением того же самого материала.
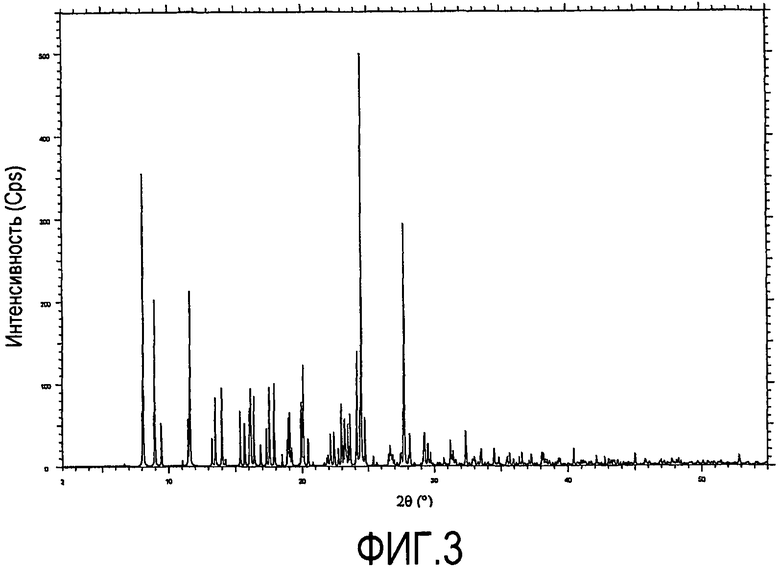
Главные пики PXRD, которые были смоделированы из рентгеноструктурного анализа, перечислены в таблице 2 ниже, а соответствующая смоделированная диаграмма показана на фиг.3.
Характеристические смоделированные PXRD пики
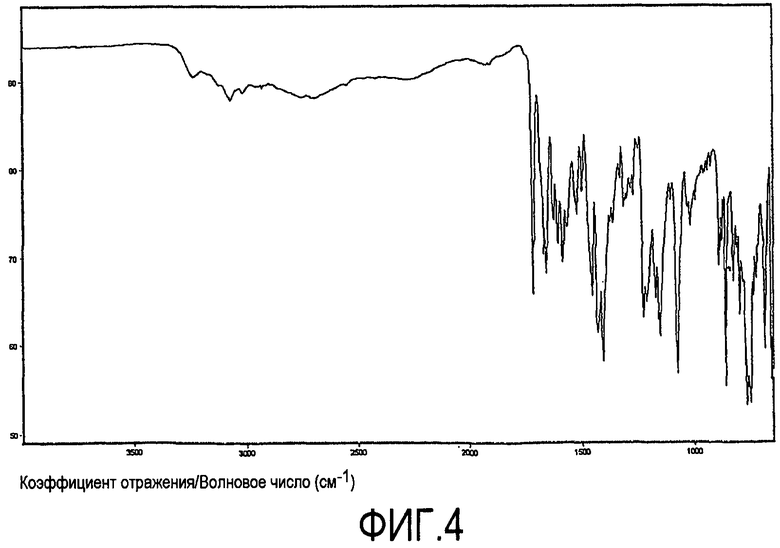
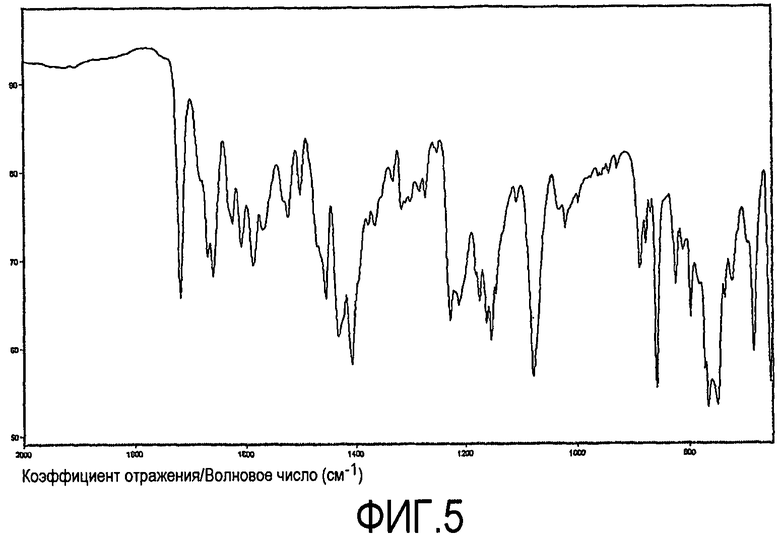
При характеризации посредством инфракрасной спектроскопии с Фурье-преобразованием (FT-IR), ксинафоатная соль дает диаграмму, показанную на фиг.4. На фиг.5 характеристическая область показана в развернутом виде. Характеристические пики приведены в таблице 3 ниже (w = слабый, s = сильный, m = средний). Главные характеристические пики представляют собой 1228 (m), 1152 (m), 1078 (s) и 858 (s).
Характеристические FT-IR пики
Спектр FT-IR получили с использованием спектометра FTIR ThermoNicolet Nexus, оборудованного приспособлением ATR однократного отражения 'DurasampllR' (алмазная поверхность на основе селенида цинка) и детектором d-TGS KBr. Спектр получали при разрешении 2 см-1 и совместном добавлении 256 сканов для всех соединений. Использовали аподизацию Happ-Genzel. По причине того, что спектр FT-IR записывали с использованием ATR однократного отражения, не требовалось никакой подготовки образцов. Использование ATR FT-IR будет служить причиной относительных интенсивностей инфракрасных полос, отличающихся от полос, видимых в спектре пропускания FT-IR, с использованием препаратов образцов диска KBr или nujol mull. Благодаря природе ATR FT-IR, полосы при более низком волновом числе более интенсивные, чем полосы при более высоком волновом числе. Погрешность эксперимента до тех пор, пока не отмечено иное, составляла λ2 см-1. Пики выделяли с использованием программного обеспечения ThermoNicolet Omnic 6,0a.
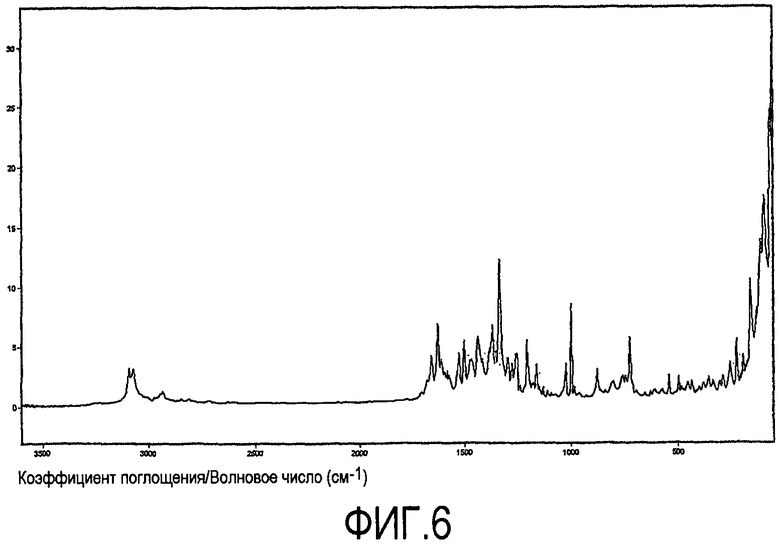
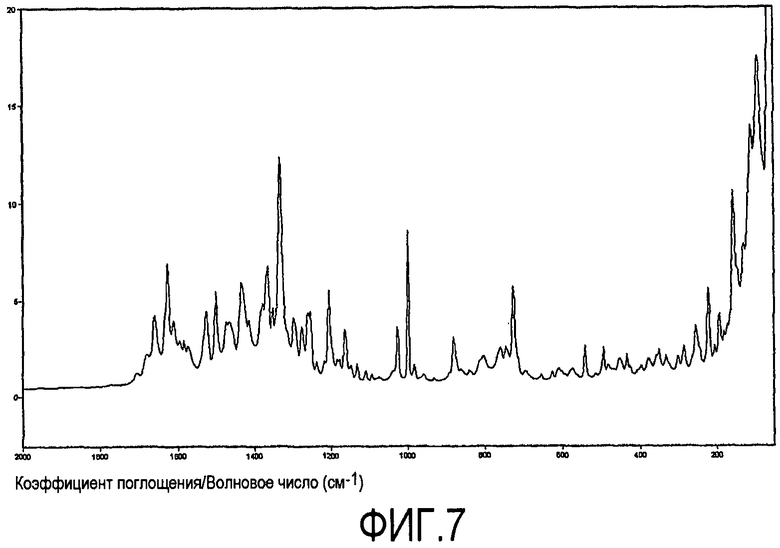
При характеризации посредством Фурье-спектроскопии комбинационного рассеивания (спектроскопия Рамана), ксинафоатная соль дает диаграмму, показанную на фиг.6. Характеристическая область показана более подробно на фиг.7. Характеристические пики приведены в таблице 4 ниже (w = слабый, s = сильный, m = средний). Главные характеристические пики составляют 1626 (m), 1205 (m), 998 (s), 156 (s) и 91 (s).
Характеристические пики FT-Рамана
Спектр Рамана получали с использованием спектометра Bruker Vertex70 с Ramll модулем FT-Raman, оборудованным 1064 нм лазером и LN-Germanium детектором. Спектр записывали с использованием разрешения 2 см-1 и аподизации Blackman-Harris с 4 слагаемыми. Мощность лазера составляла 300 мВт, и было получено 2048 совместно добавленных сканов. Каждый образец помещали в стеклянную пробирку и подвергали воздействию лазерного излучения. Данные представлены как интенсивность в виде функции комбинационного сдвига и скорректированы по сигналу прибора и рассеиванию, зависящему от частоты, с использованием спектра белого света от стандартной лампы. Для проведения коррекции использовали функцию Коррекции Брукера Рамана (программное обеспечение Bruker - OPUS 6.0). Погрешность эксперимента до тех пор, пока не отмечено иное, составляла λ2 см-1. Пики выделяли с использованием программного обеспечения ThermoNicolet Omnic 6.0a.
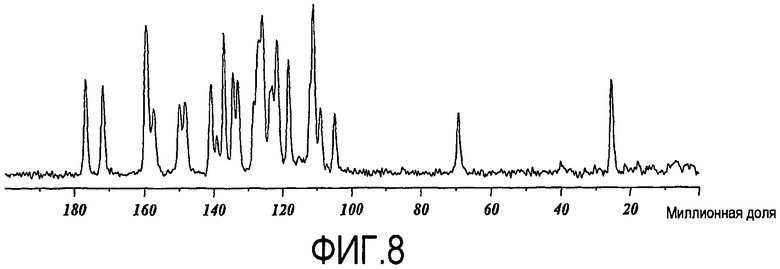
При характеризации посредством 13C твердофазного ЯМР с расщеплением протонов, ксинафоатная соль дает спектр, показанный на фиг.8. Характеристические сдвиги приведены в таблице 5 ниже. Главные характеристические сдвиги составляют 176,8, 159,4, 137,1, 118,2, 104,9 и 25,4 миллионных долей. Интенсивности могут варьировать в зависимости от фактической установки параметров экспериментального исследования и изменения температуры образца во времени и, вследствие этого, не всегда могут поддаваться количественному анализу.
Характеристические сдвиги
13
C твердофазного ЯМР
Приблизительно 80 мг образца плотно упаковали на 4 мм вращающейся платформе с ZrO2. Спектр получали в условиях окружающей среды на Bruker-Biospin 4 мм BL HFX CPMAS зонде, расположенном в широкопросветном Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре. Образец помещали под магическим углом и вращали при 15,0 кГц. Быстрая скорость вращения минимизировала интенсивности боковых полос частот вращения. Чтобы получать достаточное отношение сигнал/шум, регулировали количество сканов. 13C твердофазный спектр получали с использованием кросс-поляризационного экспериментального исследования с расщеплением протонов с вращением под магическим углом (CPMAS). Применяли поле расщепления протонов, равное приблизительно 85 кГц. 656 сканов получали с задержкой повторного цикла, отрегулированной до 80 секунд. Спектр относили с использованием внешнего стандарта кристаллического адамантана, с установкой резонанса сильного поля до 29,5 миллионных долей.
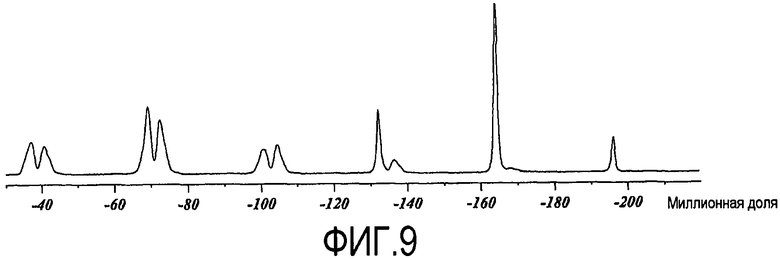
При характеризации посредством фторного твердофазного ЯМР, ксинафоатная соль дает спектр, показанный на фиг.9. Характеристические сдвиги составляют -69,2, -72,4 и -164,0 миллионных долей. Интенсивности могут варьировать в зависимости от фактической установки параметров экспериментального исследования и изменения температуры образца во времени и, вследствие этого, не всегда могут поддаваться количественному анализу.
Для получения спектра ЯМР фтора использовали тот же самый прибор, который использовали для получения 13C спектра. 19F твердофазный спектр получали с использованием экспериментального исследования вращения под магическим углом (MAS) с расщеплением протонов. Применяли поле расщепления протонов, равное приблизительно 85 кГц, и получали 8 сканов. Задержку повторного цикла установили на 750 с, чтобы обеспечить получение поддающегося количественному определению спектра. Времена продольной релаксации протонов (1H T1) вычисляли на основании экспериментального исследования с обнаружением фтора релаксации протонов по методу инверсия-восстановление. Времена продольной релаксации фтора (19F T1) вычисляли на основании экспериментального исследования с обнаружением фтора релаксации фтора по методу инверсия-восстановление. Спектр относили с использованием внешнего образца трифторуксусной кислоты (50% по объему в H2O), с установкой его резонанса до -76,54 миллионных долей.
Данные по стабильности
В отличие от свободного основания, ксинафоатная соль N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина по существу негигроскопична. Гигроскопичность оценивали с использованием оборудования определения динамической сорбции паров (Surface Measurement Systems Ltd, model DVS-1). Анализ проводили при 30°C с потоком газообразного азота, равным 200 см3/мин. Сорбцию и десорбцию воды определяли в диапазоне от 0 до 90% относительной влажности (RH) с использованием 15% интервалов RH. Воздействие проводили в течение минимум 2 часов для каждого уровня влажности или до тех пор, пока скорость изменения массы составляла менее чем 0,0003%/мин (усредняли за 10 минут). Масса образцов составляла 12,6 мг. Образец взвешивали с использованием CAHN D-200, весов с семизначной цифровой записью, встроенных в оборудование. Соединение показывало только 0,6% водопоглощения при 90% RH. Кроме того, последующая микронизация с использованием размола на струйной мельнице не привела к изменению твердой формы, при ничтожном понижении степени кристалличности и незначительном изменении гигроскопичности (0,9% водопоглощения при 90% относительной влажности).
Кроме того, ксинафоатная соль не показывает какой-либо гидратации или сольватации. Сольватацию/гидратацию оценивали посредством термогравиметрического анализа (TGA) с использованием инструмента TA Instruments Hi-Res TGA 2950, измеряя потерю массы образца в 8,8 мг в открытой платиновой кювете. Образец нагревали при 20°C/мин от условий окружающей среды до 300°C с использованием печного продувочного газообразного азота. Несмотря на то что до сих пор была идентифицирована единственная форма ксинафоатной соли, свободное основание гидратируется с образованием полугидрата и образует другую сольватированную форму в каждом из девяти испытанных растворителей.
Для того чтобы протестировать стабильность твердой фазы и совместимость наполнителей, образец ксинафоатной соли микронизировали посредством размола на струйной мельнице (размер частиц: D10 = 0,24 мкм; D50 = 1,15 мкм, D90 = 4,29 мкм) и полученный в результате порошок смешивали в массовом соотношении 1:100 с моногидратом лактозы (Respitose grade SV008). Образцы сохраняли в течение 12 недель при 25°C/60% относительной влажности и 40°C/75% относительной влажности и оценивали на содержание удержанного лекарственного препарата и примесей через 4, 8 и 12 недель. Результаты показаны в таблице 6. Контрольный образец сохраняли при 5°C/0% влажности.
Данные по стабильности
Результаты показывают, что смеси лактозы ксинафоатной соли обладают хорошей стабильностью. В процессе эксперимента не было обнаружено никакого изменения в физической форме и не наблюдалось значительного разрушения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ПОМОЩЬЮ СОЕДИНЕНИЙ 2,4-ПИРИМИДИНДИАМИНА | 2003 |
|
RU2376992C2 |
| СОЕДИНЕНИЯ 2, 4-ПИРИМИДИНДИАМИНА, ОБЛАДАЮЩИЕ ВОЗДЕЙСТВИЕМ ПРИ АУТОИММУННЫХ РАССТРОЙСТВАХ | 2004 |
|
RU2356901C2 |
| ПРОЛЕКАРСТВА СОЕДИНЕНИЙ 2,4-ПИРИМИДИНДИАМИНА И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2416616C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ПОМОЩЬЮ СОЕДИНЕНИЙ 2,4-ПИРИМИДИНДИАМИНА | 2013 |
|
RU2659777C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ПУТИ JAK | 2011 |
|
RU2672100C2 |
| ПРИМЕНЕНИЕ 2,4-ПИРИМИДИНДИАМИНОВ ДЛЯ ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА | 2009 |
|
RU2490015C2 |
| НОВЫЕ ХИМИЧЕСКИЕ СОЕДИНЕНИЯ ПРОИЗВОДНЫЕ 2,4-ДИАМИНО-1,3,5-ТРИАЗИНА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2012 |
|
RU2509770C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ, СОДЕРЖАЩАЯ ИНГИБИТОР ALK И ИНГИБИТОР SHP2 | 2018 |
|
RU2769132C2 |
| СОЕДИНЕНИЯ, ПРОЯВЛЯЮЩИЕ АКТИВНОСТЬ В ОТНОШЕНИИ JAK-КИНАЗЫ (ВАРИАНТЫ), СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ JAK-КИНАЗОЙ, СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ JAK-КИНАЗЫ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ УКАЗАННЫХ СОЕДИНЕНИЙ | 2006 |
|
RU2485106C2 |
| 3,4-ДИГИДРОБЕНЗОКСАЗИНОВЫЕ СОЕДИНЕНИЯ И ИНГИБИТОРЫ АКТИВНОСТИ ВАНИЛЛОИДНЫХ РЕЦЕПТОРОВ ПОДТИПА 1 (VR1) | 2006 |
|
RU2427579C2 |
Изобретение относится к новой ксинафоатной соли N4-[(2,2-дифтор-4H-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина, указанной ниже структурной формулы. Указанная соль обладает свойствами ингибитора Syk-киназы и может быть использована при лечении воспалительного состояния, например такого, как астма.
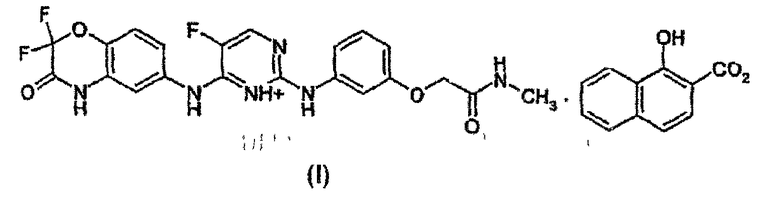
Изобретение также относится к способу получения соли, применению последней, фармацевтической композиции и способу лечения. Способ получения ксинафоатной соли включает растворение N4-[(2,2-дифтор-4Н-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина и 1-1,1 молярных эквивалентов 1-гидрокси-2-нафтоевой кислоты в минимальном количестве подходящего органического растворителя, такого как ацетон, ацетонитрил или метилэтилкетон (МЭК), причем каждый необязательно содержит небольшое количество воды, и последующее медленное охлаждение раствора при необязательном перемешивании до осаждения соли из раствора. 5 н. и 7 з.п. ф-лы, 6 табл., 9 ил., 1 пр.
1. Ксинафоатная соль N4-[(2,2-дифтор-4Н-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина.
2. Ксинафоатная соль по п.1, имеющая сдвиги при приблизительно -69,2, -72,4 и -164,0 миллионных долей, охарактеризованная посредством твердофазного ЯМР на атомах фтора, относительно внешнего образца трифторуксусной кислоты (50 об.% в H2O), имеющего резонанс при -76,54 миллионных долей.
3. Фармацевтическая композиция, обладающая свойствами ингибитора Syk-киназы, содержащая терапевтически эффективное количество ксинафоатной соли по п.1 или п.2 и фармацевтически приемлемый наполнитель.
4. Способ лечения заболевания у млекопитающего, для которого показан ингибитор Syk, включающий введение млекопитающему при его необходимости, терапевтически эффективного количества ксинафоатной соли по п.1 или 2.
5. Ксинафоатная соль по п.1 или 2 для применения в качестве лекарственного средства, для лечения воспалительного состояния для которого показан ингибитор Syk.
6. Применение ксинафоатной соли по п.1 или 2 для производства лекарственного средства для лечения заболевания, для которого показан ингибитор Syk-киназы.
7. Способ по п.4, или применение по п.6, где заболевание, для которого показан ингибитор Syk, представляет собой астму.
8. Способ получения ксинафоатной соли по п.1, включающий растворение N4-[(2,2-дифтор-4Н-бензо[1,4]оксазин-3-он)-6-ил]-5-фтор-N2-[3-(метиламинокарбонилметиленокси)фенил]-2,4-пиримидиндиамина и 1-1,1 молярных эквивалентов 1-гидрокси-2-нафтоевой кислоты в минимальном количестве подходящего органического растворителя и медленное охлаждение раствора при необязательном перемешивании до осаждения соли из раствора.
9. Способ по п.8, где растворителем является ацетон, ацетонитрил или метилэтилкетон (МЭК), причем каждый необязательно содержащий небольшое количество воды.
10. Способ по п.9, где растворителем является метилэтилкетон, содержащий приблизительно 5 об.% воды.
11. Ксинафоатная соль по п.1 или 2 для применения в качестве лекарственного средства для ингибирования Syk киназы.
12. Ксинафоатная соль по п.1 или 2 для применения в качестве лекарственного средства для ингаляционной терапии астмы, опосредованной активностью Syk-киназы.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| САЛЬМЕТЕРОЛ КСИНАФОАТ С РЕГУЛИРУЕМЫМ РАЗМЕРОМ ЧАСТИЦ И ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 1994 |
|
RU2136655C1 |
| RU 2004130438 A, 10.06.2005 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2012-08-20—Публикация
2008-08-27—Подача