Изобретение относится к биядерным сера-нитрозильным комплексам железа катионного типа - новым донорам NO c вазодилятаторными свойствами и может быть использовано в качестве гипотензивных препаратов для терапии сердечно-сосудистых заболеваний.
NO, как известно уже более 20 лет, вовлечен в различные физиологические и патофизиологические процессы в организмах млекопитающих [1) J.A. McCleverty, Chem.Rev., 2004, 104, 403; 2) P.C. Ford, L.E. Laverman, Coord.Chem.Rev., 2005, 249, 391; 3) N.M. Crawford, J. of Experimental Botany, 2006, 57, 471; 4) R. Butler and I. L.Megson, Chem. Rev., 2002, 102, 1155; 5) L.J. Ignarro (Ed.), Nitric Oxide: Biology and Pathobiology, Academic Press, San Diego, 2000; 6) D.A. Wink, Y. Vodovotz, J. Laval, F. Laval, M.W. Dewhirst, J.B. Mitchell, Carcinogenesis, 1998, 19, 711; 7) A. Butler, R. Nicholoson (Eds.), Life, Death and Nitric Oxide, The Royal Society of Chemistry, Cambridge, 2003; 8) P.C. Ford, J. Bourassa, S. Kudo and K. Miranda, Coord. Chem. Rev., 1998, 171, 185]. Полученные данные о многоликой биологической активности этого радикала-медиатора и его реакциях с биологическими субстратами в клетках используются при разработке эффективных лекарственных препаратов - доноров NO. Для изменения внутритканевого уровня NO применяют соединения, либо генерирующие этот радикал, либо эффективно его связывающие.
Исследованиями последних лет в области молекулярной кардиологии установлена центральная роль оксида азота (NO) в регуляции сосудистого тонуса и метаболизма миокарда [Jones S.P., Bolli R. The ubiquitous role of nitric oxide in cardioprotection. J Mol Cell Cardiol 2006; 40 (1): 16-23]. Выяснено, что недостаток образования NO приводит к развитию эндотелиальной дисфункции, что в свою очередь вызывает повышение тонуса коронарных сосудов, а также увеличивает агрегационную и адгезивную способность тромбоцитов. При ишемическом и реперфузионном повреждении сердца это способствует развитию синдрома «no reflow», приводящему к прогрессивному ухудшению кровотока и в конечном итоге гибели кардиомиоцитов [Jugdutt B.I. Nitric oxide and cardioprotection during ischemia-reperfusion. Heart Fail Rev 2002; 7(4): 391-405]. Наиболее распространенными лекарственными средствами при нарушениях сердечно-сосудистой системы являются органические нитраты и нитропруссид [В.Г. Граник, Н.Б. Григорьев. Экзогенные доноры оксида азота (химический аспект) / Известия Академии наук. Серия химическая, 2002, №8, стр. 1268-1313]. Однако эти препараты обладают рядом недостатков и побочных действий: i) нитратная толерантность и цианидное отравление, ii) необходимость дополнительной активации (термо-, фото- или ферментативной), что ограничивает возможность их использования в клинике. В связи с этим актуальной задачей является разработка новых перспективных доноров NO, к числу которых относятся катионные биядерные нитрозильные комплексы железа c cеросодержащими алифатическими лигандами, которые были впервые выделены в кристаллической форме в ИПХФ РАН в 2007 г. [Н.А. Санина, Т.Н. Руднева, К.А. Лысенко, О.С. Жукова, Н.С. Емельянова, С.М. Алдошин «Водорастворимые биядерные катионные нитрозильные комплексы железа с природными алифатическими тиолилами, обладающие цитотоксической, апоптотической и NO-донороной активностью» заявка № PCT/RU2008/000338 от 02.06.2008; Т.N. Rudneva, N.А. Sanina, К.А. Lysenko, S.М. Aldoshin, М.Y. Antipin, N.S. Оvanesyan., Synthesis and structure of water-soluble nitrosyl iron complex with cysteinamine ligand [Fe2(S(CH)2NH3)2(NO)4]SO4·2.5H2O // Mend.Comm. (2009) 19, 253-255]. Синтезированные в ИПХФ РАН нитрозильные [2Fe-2S] комплексы являются аналогами активных центров негемовых нитрозильных [2Fe-2S] белков и представляют собой гибридные молекулы, содержащие в своем составе одновременно два фармакозначимых фрагмента: серосодержащие лиганды природного происхождения (пеницилламин, структурные аналогии природных сульфонатов и др.) и NO группы. Так установлено, что вазодилатация коронарных сосудов под действием растворов моноядерных динитрозильных комплексов железа c цистеином и восстановленным глутатионом (ДНКЖ) сопровождается снижением длительности нарушений ритма во время окклюзии коронарной артерии и достоверным уменьшением повреждения клеточных мембран в зоне риска при последующей реперфузии. Эти эффекты обусловлены антиоксидантным свойствами ДНКЖ и сочетаются с лучшим восстановлением аэробного обмена в ишемизированных кардиомиоцитах. Как правило, ДНКЖ получают в виде малостабильных водных растворов или в форме лиофильно высушенных композитов этих растворов с водорастворимыми полимерами [Ванин А.Ф., Лозинский В.И., Капелько В.И. Полимерная композиция для получения стабилизированной формы динитрозильного комплекса железа и способ получения указанной формы комплекса. Патент RU 2291880 C1], что ограничивает их широкое использование в прикладных целях, связанное с неконтролируемостью исходного состава.
В ИПХФ РАН биядерные сера-нитрозильные комплексы железа выделены в кристаллической форме и надежно установлено, что в протонных средах (вода, физиологические растворы) генерируют NO самопроизвольно без дополнительной активации и образуют в растворах динитрозильные моноядерные интермедиаты (ДНКЖ). Определены количественные показатели NO-донирования синтезированных соединений в зависимости от концентрации используемого донора, температуры, pH среды в аэробных и анаэробных условиях электрохимическим методом с помощью сенсорных электродов amiNO-700. Взятые вместе эти результаты указывают на возможность создания новых оригинальных антигипертензивных и противоишемических лекарственных средств на основе биядерных нитрозильных комплексов железа.
Задачей настоящего изобретения является расширение арсенала вазодилататорных лекарственных средств и создание вазодилататорного лекарственного средства на основе комплекса [Fe2(SC5H11NO2)2(NO)4]·5H2O с улучшенной кардиотропной активностью.
Поставленная задача решается применением биядерного сера-нитрозильного комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O в качестве вазодилататорного лекарственного средства, оригинального антигипертензивного и противоишемического лекарственного средства.
Сущность изобретения заключается в следующем.
Авторы настоящего изобретения обнаружили, что комплекс железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O оказывает действие на аортальное давление.
В опытах на изолированных сердцах крыс Wistar (средний вес тела и сердца соответственно 340 г и 1.7 г) исследовали действие комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O на аортальное давление (АД) в условиях ретроградной перфузии стандартным, насыщенным карбогеном раствором Кребса (РК) при t=37оC и постоянном коронарном потоке.
После наркоза уретаном (1.25 мг/г веса тела, в/б) и торакотомии изолированные сердца помещали в охлаждённый раствор Кребса на 30-40 сек до полной остановки сокращений. В течение 10-20 мин сердца перфузировали антеградно (при постоянном давлении наполнения левого предсердия 15 мм рт.ст. и АД 60 мм рт.ст.) и определяли величину спонтанного коронарного потока (КП). После этого переходили на перфузию с постоянной объёмной скоростью, равной спонтанному КП (в среднем 17 мл/мин). Регистрировали АД, стабилизация которого на 60-65 мм рт.ст. происходила через 5-10 мин, что служило исходным фоном для введения исследуемых доноров NO.
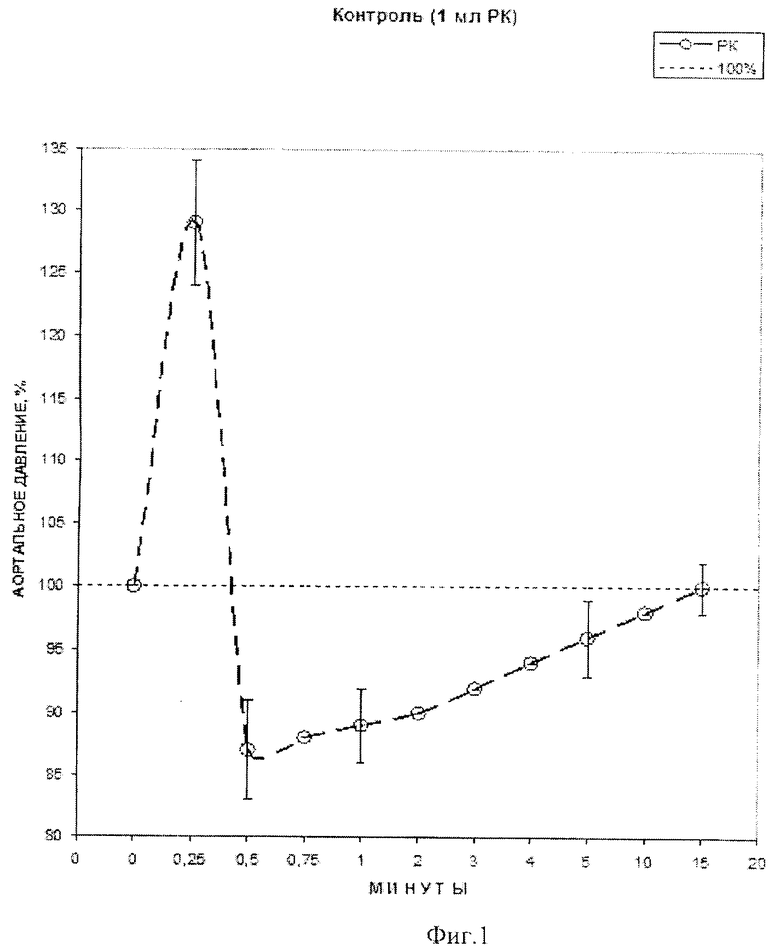
1 мл донора NO - комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O, вводили в аортальную канюлю в течение 2 сек. При этом использовали исходные концентрации комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O 6.25 (n=4), 12.5 (n=8), 25.0 (n=4) и 50.0 (n=4) мкМ. Соответствующие действующие концентрации комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O составляли 3.9, 7.8, 16.0 и 30.5 мкМ. В качестве препарата сравнения использовали нитропруссид натрия (НП). 1 мл раствора НП вводили в аортальную канюлю в течение 2 с. Исходные концентрации НП были: 0.5 (n=11), 1.0 (n=8), 2.5 (n=10) и 5.0 (n=10) мкМ. Соответствующие действующие концентрации с учетом КП составляли 0.31, 0.61, 1.50 и 3.03 мкМ. В 12 контрольных опытах в аорту вводили РК без НП. Действие РК и НП на АД наблюдали в течение 15 мин, комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O - 30 мин после введения веществ. Таким образом, контрольное введение в аорту 1 мл РК в течение 2″ сопровождалось характерными изменениями АД, представленными на фиг. 1 - влияние введения 1 мл раствора Кребса (РК) на изменения аортального давления. В начале периода наблюдения (через 15″ после введения РК) АД возрастало в среднем на 29%, а в течение последующих 15″ падало в среднем на 13% от исходного. В дальнейшем АД сравнительно быстро восстанавливалось, и через 5-10 мин различия с исходным значением были недостоверны. Очевидно, что причиной изменений АД в контрольных опытах являлась кратковременная гиперволюмическая нагрузка коронарных сосудов, т.н. «гидродинамический удар», имевший место во всех группах опытов.
Действие нитропруссида.
Результаты, представленные в табл. 1 и фиг. 1, 2 (изменения АД под действием введения 1 мл 0.5, 1.0, 2.5 и 5.0 мкМ нитропруссида), показали, что введение растворов НП с действующими концентрациями 0.31, 0.61 и 1.5 мкМ вызывает изменения АД, подобные контрольным: как и в контрольных опытах, наибольшему падению АД (наблюдавшемуся через 30″ после введения НП) предшествовало кратковременное увеличение и затем постепенное восстановление АД. В целом, динамика АД мало отличалась от контрольной, за исключением выраженности «гидродинамического удара», который был достоверно меньше, по сравнению с контрольным. При увеличении действующей концентрации НП до 3.03 мкМ начальный подъём АД был ещё меньше, а восстановление АД замедлялось, так что к 15′ было всё ещё ниже исходного значения. Именно поэтому действующая концентрация НП 3.03 мкМ использовалась в качестве контрольной для сравнения с другими веществами.
Действие комплекса железа катионного типа [Fe 2 (SC 5 H 11 NO 2 ) 2 (NO) 4 ]·5H 2 O.
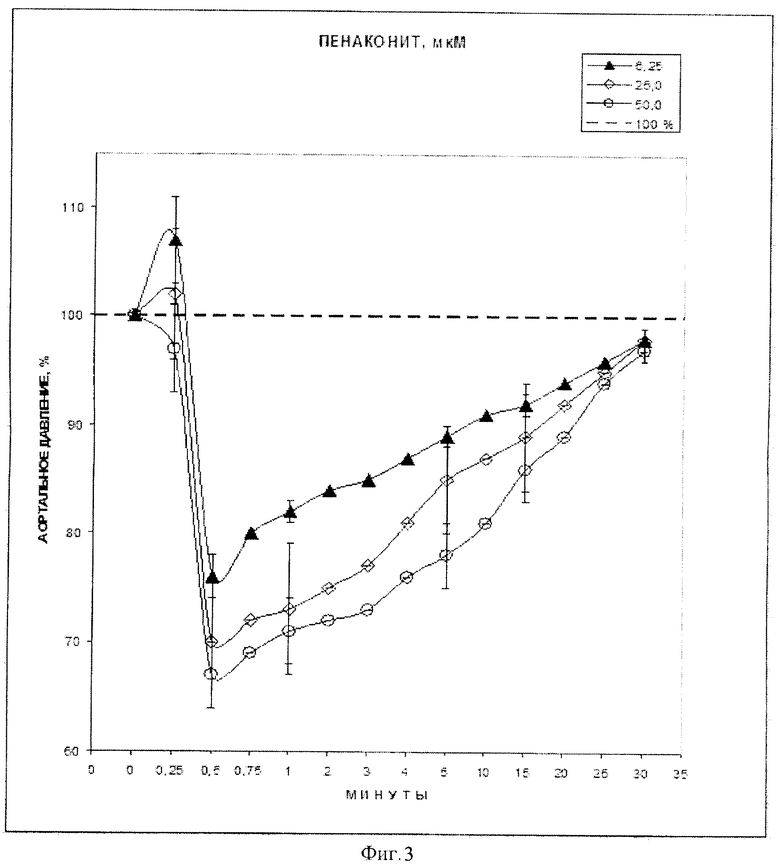
Увеличение исходной концентрации препарата комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O от 6.25 до 50 мкМ сопровождалось соответствующими изменениями АД (табл. 2). По мере нарастания концентрации степень падения АД через 30″ после введения препарата возрастала в среднем от 24% до 33% от исходного. В большинстве опытов с препаратом восстановление АД к 30′ было полным, независимо от концентрации вещества. На фиг. 3 (изменения АД под действием введения 1 мл 6.25, 25.0 и 50.0 мкМ комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O) показана динамика АД в течение 30′ после введения раствора препарата с исходной концентрацией 6.25, 25 и 50 мкМ (действующие концентрации 3.9, 16.0 и 30.5 мкМ соответственно).
Сопоставление эффективности НП и комплекса железа катионного типа [Fe 2 (SC 5 H 11 NO 2 ) 2 (NO) 4 ]·5H 2 O.
В табл. 3 представлены результаты, полученные при действии на АД одинаковых (или приблизительно равных) действующих концентраций веществ: НП (3.03 мкМ) и комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O (3.94 мкМ). Показано, что при использовании равных действующих концентраций более эффективным дилататором является комплекс железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O: максимальная степень падения АД через 30″ после введения составляла 19% у НП и 24% - у комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O от исходного, а дефицит восстановления АД к 15′ составлял у комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O 8%, а у НП - 6%.
Табл.1.
Действие нитропруссида на АД(%)
Табл.2.
Действие комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O на АД (%)
Табл.3.
Действие ~3 мкМ НП и комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O на АД (%)
Таким образом, результаты свидетельствуют о том, что биядерный сера-нитрозильный комплекс железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O снижает АД при болюсном введении в аорту изолированного сердца крысы, перфузируемого при постоянном коронарном потоке. Вазодилататорная эффективность биядерного сера-нитрозильного комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O выше, чем Нитропруссида при близких действующих концентрациях (около 3 мкМ).
Авторы настоящего изобретения обнаружили также влияние биядерного сера-нитрозильного комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O на артериальное давление у крыс IN VIVO.
Эксперименты проводили на крысах-самцах линии Wistar с массой тела 280-400 г, наркотизированных кетамином (100 мг/кг массы тела, внутрибрюшинно). Искусственную вентиляцию легких осуществляли комнатным воздухом с помощью дыхательного аппарата KTR-5 (Hugo Suchs Elektronik Harvard). Катетеризировали правую сонную артерию и левую яремную вену для регистрации артериального давления (Мингограф-804 Siemens Elema) и введения испытываемого комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O соответственно.
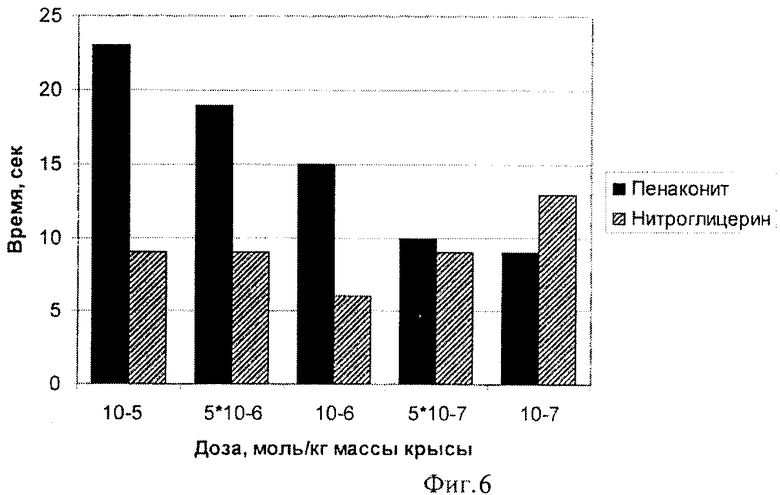
После завершения препаровки животных в течение 20-30 мин интервала происходила стабилизация гемодинамических параметров. Комплекс железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O вводили растворенным в физиологическом растворе (0,9% NaCl) однократно внутривенно болюсно в дозах 10-5; 5×10-6; 10-6; 5×10-7 и 10-7 моль/кг массы животного. После регистрации реакции на введение препарата и полного восстановления гемодинамических показателей до стабильных величин артериального давления в качестве препарата сравнения вводили нитроглицерин в эквимолярной дозе.
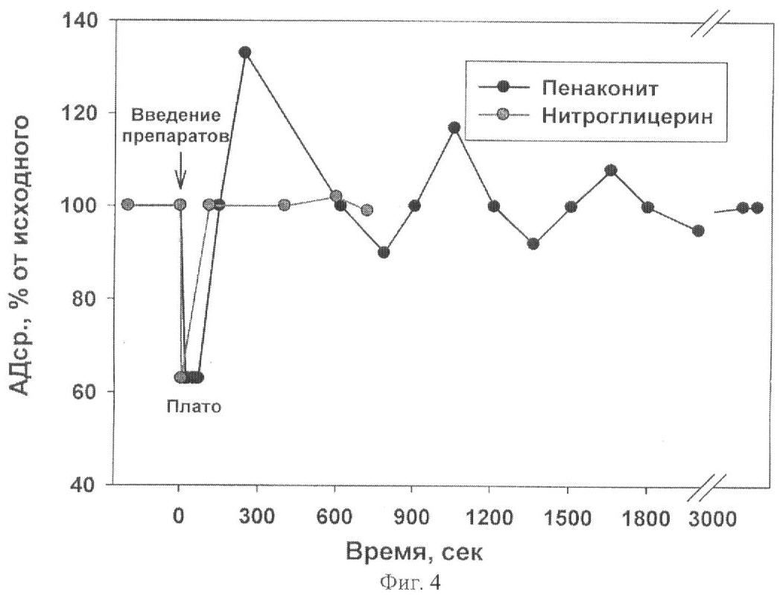
В исходном состоянии АДср составляло118±4 мм рт. ст. При введении комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O происходило снижении АД, зависящее от дозы введения (Табл. 4). Время снижения АД составляло 9-23 сек с момента введения (время реакции). Далее АД сохранялось сниженным до 18-71 сек от начала введения (время окончания плато). В дальнейшем АД восстанавливалось, как правило, выше исходного (до 130% при введении дозы 1·10-5 моль/кг массы крысы, рис.4). В некоторых случаях (дозы 1·10-6 и 5·10-7 моль/кг массы крысы) превышения исходного АД не наблюдалось. Дальнейшее восстановление АД имело волнообразный характер, сопровождаясь колебаниями АД ниже и выше относительно исходного значения. Длительность восстановления АД составляла 30 - 50 мин в зависимости от введенной дозы.
Введение нитроглицерина носило иной характер (Табл. 4): сопровождалось быстрым падением (6 -13 сек) и окончательным восстановлением (1- 1.5 мин).
Таблица 4.
Сравнительный анализ влияния внутривенного болюсного введения комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O и Нитроглицерина на АД у крыс in vivo по фазам.
сек
нитроглицерина, моль/кг массы крысы
АДmin - снижение АД сразу после болюсного введения препаратов (в % от исходного).
Время реакции - время достижения АДmin.
Время окончания плато - время окончания состояния со сниженным давлением (плато).
I Время восст. - время достижения исходного АД.
АДmax - повышение АД после его восстановления.
II Время восст. - время достижения исходного АД после подъема.
Падение АД - второе снижение АД.
~ - непрерывное колебание АД.
На фиг. 4. показано влияние введения комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O и Нитроглицерина в дозе 10-5 моль/кг массы крысы на артериальное давление.
При анализе отдельных фаз процесса изменения АД было отмечено дозо-зависимое действие пенаконита на снижение АД сразу после его введения (фиг. 5). Введение нитроглицерина приводило к сходному снижению АД.
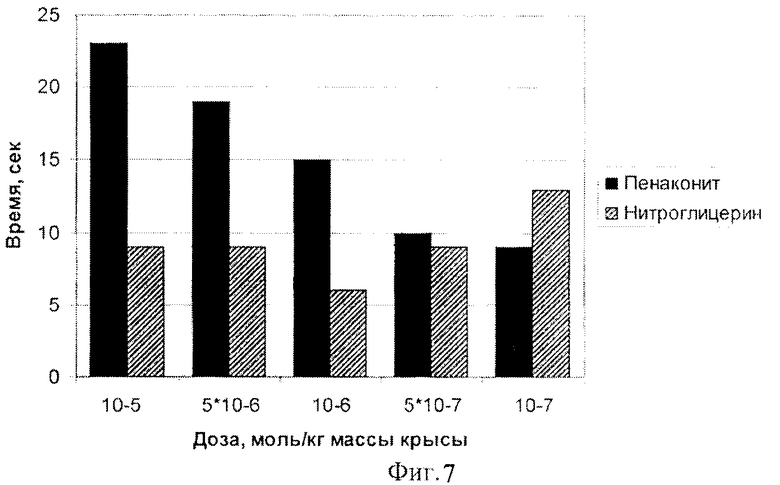
Время достижения АДmin и время окончания состояния со сниженным давлением снижалось с уменьшением вводимой дозы комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O (фиг. 6, 7). Такие эффекты не наблюдались в случае использования эквимолярных доз нитроглицерина.
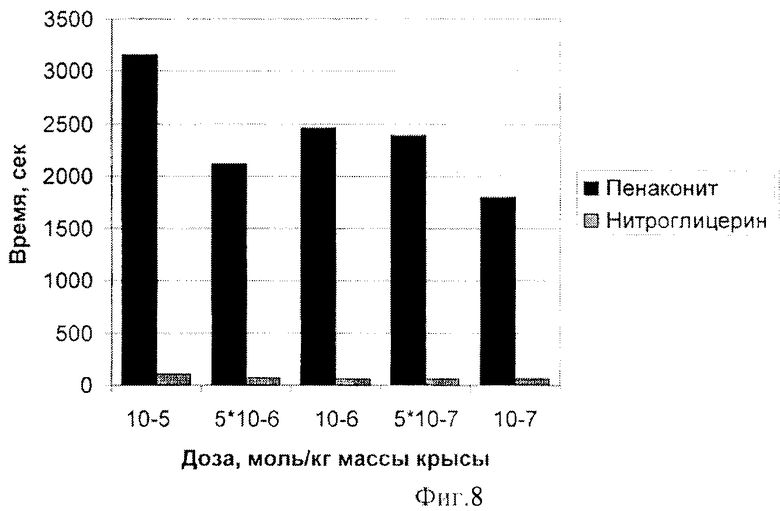
Время окончательного восстановления исходного АД при использовании комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O значительно превышало этот показатель для нитроглицерина (фиг.8).
Таким образом, комплекс железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O у наркотизированных крыс in vivo вызывает дозо-зависимое снижение АД. Эквимолярные дозы комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O и Нитроглицерина эквимолярных доз уменьшают АД в одинаковой степени. Восстановление АД имеет сложный характер, может сопровождаться возрастанием и последующим снижением АД относительно исходного в течение длительного времени (до 30-50 мин).
Результаты испытаний указывают на способность комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O эффективно влиять на тонус сосудов. Вазодилатационное действие донора NO катионного типа отчетливо проявлялось на модели изолированного перфузируемого сердца крысы дозо-зависимым снижением аортального давления. У наркотизированных крыс in vivo также обнаружен дозо-зависимый характер снижения артериального давления при внутривенном введении комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O. При этом восстановление АД имеет длительный и сложный характер, сопровождаясь колебаниями выше и ниже исходного уровня.
Таким образом, заявляемое изобретение расширяет арсенал вазодилататорных лекарственных средств с улучшенной кардиотропной активностью. Биядерный сера-нитрозильного комплекс железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O может быть применен в качестве вазодилататорного лекарственного средства, оригинального антигипертензивного и противоишемического лекарственного средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ БИЯДЕРНОГО СЕРА-НИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА АНИОННОГО ТИПА В КАЧЕСТВЕ ВАЗОДИЛАТАТОРНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2010 |
|
RU2437667C1 |
| ВОДОРАСТВОРИМЫЕ БИЯДЕРНЫЕ КАТИОННЫЕ НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА С ПРИРОДНЫМИ АЛИФАТИЧЕСКИМИ ТИОЛИЛАМИ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ, АПОПТОТИЧЕСКОЙ И NO-ДОНОРНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2441873C2 |
| БИЯДЕРНЫЕ НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА С БЕНЗАЗАГЕТЕРОЦИКЛИЧЕСКИМИ ПРОИЗВОДНЫМИ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2441872C2 |
| ПРИМЕНЕНИЕ ТЕТРАНИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА С ТИОФЕНОЛОМ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2007 |
|
RU2429242C2 |
| МОНОЯДЕРНЫЕ ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА, СПОСОБ ПОЛУЧЕНИЯ МОНОЯДЕРНЫХ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА, ДОНОР МОНООКСИДА АЗОТА, ПРИМЕНЕНИЕ МОНОЯДЕРНОГО ДИНИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2011 |
|
RU2494104C2 |
| МОНОЯДЕРНЫЕ КАТИОННЫЕ ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДОНОР МОНОКСИДА АЗОТА | 2014 |
|
RU2567245C1 |
| Супрамолекулярные ансамбли динитрозильных комплексов железа, способ их получения, доноры монооксида азота, ингибиторы фосфодиэстераз, применение супрамолекулярных ансамблей динитрозильных комплексов железа в качестве противовоспалительных лекарственных средств | 2023 |
|
RU2814108C1 |
| Применение динитрозильного комплекса железа с глутатионом-GS { (GS) Fe(NO)} для лечения больных с легочной артериальной гипертензией | 2022 |
|
RU2804734C1 |
| Применение нитрозильного комплекса железа с N,N-диэтилтиомочевиной в качестве нового NO-донорного противоопухолевого средства | 2016 |
|
RU2687269C2 |
| Средство, обладающее противовирусной активностью в отношении SARS-CoV-2, и способ его применения | 2022 |
|
RU2797619C1 |


Изобретение относится к применению биядерного сера-нитрозильного комплекса железа катионного типа формулы [Fe2(SC5H11NO2)2(NO)4]·5H2O в качестве вазодилататорного средства и для получения лекарственного средства для лечения ишемических заболеваний. Изобретение обеспечивает расширение арсенала вазодилататорных лекарственных средств с улучшенной кардиотропной активностью. 2 н.п. ф-лы, 4 табл., 8 ил.
1. Применение биядерного сера-нитрозильного комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O в качестве вазодилататорного лекарственного средства.
2. Применение биядерного сера-нитрозильного комплекса железа катионного типа [Fe2(SC5H11NO2)2(NO)4]·5H2O для получения лекарственного средства для лечения ишемического заболевания.
| RU 2291880 C1, 20.01.2007 | |||
| WO 2008147242 A1, 04.12.2008 | |||
| АЛДОШИН С.М | |||
| Новый класс нейтральных парамагнитных биядерных нитрозильных серосодержащих комплексов железа | |||
| - Известия Академии наук | |||
| Серия химическая, №8, 2003, с.1614-1620 | |||
| РУДНЕВА Т.Н | |||
| Синтез, исследование строения и NO-донорной активности нитрозильных комплексов железа с |
Авторы
Даты
2012-09-10—Публикация
2010-04-05—Подача