Изобретение относится к лекарственным препаратам на основе координационных соединений железа, а именно к противовирусному средству на основе динитрозильного комплекса железа, являющегося донором катионов нитрозония, и может быть использовано в медицине и химико-фармацевтической промышленности.
К настоящему времени показано, что для вирусной инфекции характерно резкое повышение в тканях и клетках хозяина уровня одного из универсальных регуляторов метаболических процессов - оксида азота (NO) [1-15], по-видимому, как защита организма животных и человека от этой инфекции. Поскольку это повышение сопровождается S-нитрозированием разнообразных вирусных белков - протеаз, S-белков, обратных транскриптаз, факторов транскрипции, а также протеаз хозяина [2-16], есть основание предполагать, что именно этот процесс обеспечивает снижение вирусной продукции, являясь эффективным средством защиты организма животных и человека от вирусной инфекции.
Учитывая тот факт, что S-нитрозирование различных внутриклеточных компонентов не осуществляется непосредственно молекулами NO, а обеспечивается одноэлектронно-окисленной формой этих молекул - катионами нитрозония (NO+), связывающимися вместо протонов с тиоловыми группами тиол-содержащих белков и низкомолекулярных соединений, необходимо понимание механизма превращения NO в NO+ в клетках животных и человека.
В настоящее время большинство исследователей полагает, что это превращение обеспечивается окислением NO до диоксида азота (NO2) с последующим связыванием NO2 с NO с образованием донора NO+- триоксида азота (N2O3), способного S-нитрозировать тиолы [17-19]. Однако, показано, что процесс S-нитрозирования может происходить в клеточных культурах и в отсутствие кислорода, то есть без окисления NO до NO2 [20-22]. Ряд авторов предполагает, что появление катионов NO+ в клетках и тканях животных и человека обеспечивается образованием в них при участии молекул NO динитрозильных комплексов железа (ДНКЖ) с тиолсодержащими лигандами, способных выступать в качестве доноров как молекул NO, так и катионов NO+ [20-26].
ДНКЖ с тиолсодержащими лигандами были открыты и идентифицированы сначала в дрожжевых клетках, а затем в тканях животных методом ЭПР в 60-е годы прошлого столетия одним из авторов настоящей работы А.Ф. Ваниным по характерному для моноядерной формы ДНКЖ (М-ДНКЖ) сигналу ЭПР со средним значением g-фактора (gcp.), равным 2,03, - сигналу 2.03 (с g⊥=2.04, g||=2.014) [27, 28]. В последние годы им же был предложен механизм образования этих комплексов, в основе которого лежит реакция диспропорционирования двух молекул NO, связывающихся с ионом Fe2+ в присутствии тиолсодержащих лигандов (I) [25,26]:
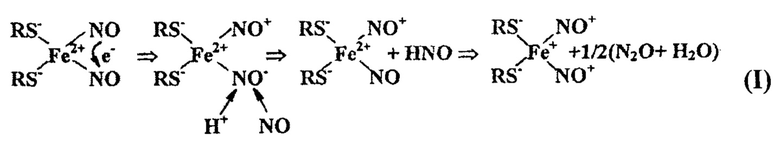
Механизм образования М-ДНКЖ с тиолсодержащими лигандами в реакции Fe2+, NO и тиолов, предполагающий диспропорционирование - взаимное одноэлектронное окисление-восстановление молекул NO в лигандной сфере железа.
В результате этой реакции молекулы NO превращаются в катион нитрозония (NO+) и анион нитроксила (NO-) [25, 26]. Образующийся анион нитроксила в результате гидролиза (связывания с протоном) превращается в молекулу нитроксила (HNO) и выходит из комплекса, его место занимает нейтральная молекула NO. Что касается сохраняющегося в комплексе катиона нитрозония, его гидролиз (связывание с анионом гидроксила) предотвращается перемещением на этот катион части электронной плотности с тиоловой серы, характеризующейся высокой π-донорной активностью. В результате положительный заряд на этом нитрозильном лиганде нейтрализуется, и он перестает связываться с ОН- анионами.
Таким образом, в соответствии с механизмом образования М-ДНКЖ с тиолсодержащими лигандами одна из его резонансных структур может быть представлена как: [(RS-)2Fe2+(NO)(NO+)]+. Такая же структура может быть характерной для биядерной формы ДНКЖ (Б-ДНКЖ) - [(RS-)2Fe2+2(NO)2(NO+)2]2+ [25, 26].
Реализация этой структуры обеспечивает появление в клетках организма-хозяина доноров катионов нитрозония - ДНКЖ с тиолсодержащими лигандами, способных инициировать S-нитрозирование различных тиолсодержащих соединений в клетках животных и человека и тем самым снижать и/или исключать вирусную продукцию в чувствительной клетке.
В работах группы А.Ф. Ванина [29, 30] был предложен подход, позволяющий селективно высвобождать из М- и Б-ДНКЖ катионы нитрозония с одновременным включением ионов железа и молекул NO в устойчивые комплексы - мононитрозильные комплексы железа (МНКЖ) с производными дитиокарбамата (ДТК), устраняя тем самым какое-либо влияние ионов железа и молекул NO на внутриклеточные процессы. Такое влияние могли оказывать только высвобождающиеся под действием ДТК катионы NO+ (II):
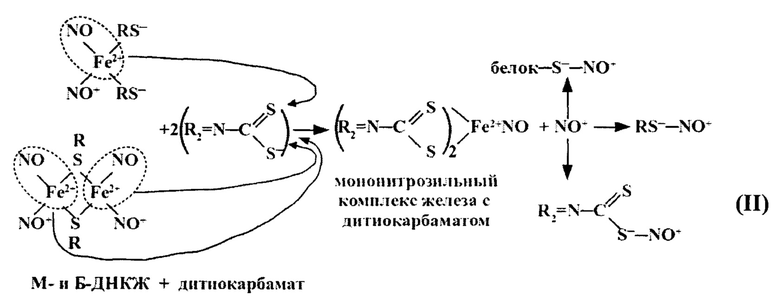
Механизм превращения М- и Б-ДНКЖ с тиолсодержащими лигандами в МНКЖ с производными ДТК. Высвобождающиеся при этом катионы NO+ могут S-нитрозировать низкомолекулярные и белковые тиолы, а также тиоловую группу в структуре ДТК.
Для МНКЖ с ДТК характерен сигнал ЭПР со значениями g- фактора 2,04 и 2,02 и триплетной сверхтонкой структурой [29,30].
Изучение регулирующего влияния ДНКЖ на метаболические процессы в живых организмах позволило выявить их мощное сосудорасширяющее и гипотензивное действие [31], противогипоксическое действие на миокард [32] и кардиопротекторные свойства [33], способность подавлять агрегацию тромбоцитов [34], способность ингибировать рост опухолей на ранней стадии развития [35, 36].
Противовирусная активность ДНКЖ до настоящего времени не исследовалась. В 2020 году А.Ф. Ваниным была высказана гипотеза, что ДНКЖ с тиолсодержащими лигандами могут как доноры катионов нитрозония подавлять вирусные инфекции [16, 37].
В предлагаемом изобретении на сирийских хомячках, инфицированных вирусом SARS-CoV-2 (животная модель COVID-19), исследовано противовирусное действие системы соединений: биядерная форма ДНКЖ с глутатионом (Б-ДНКЖ-GSH) + диэтилдитиокарбамат натрия (ДЭТК), способной путем аэрозольного введения этих соединений поставлять катионы нитрозония в организм этих животных.
Задачей изобретения является создание эффективного средства, обладающего противовирусной активностью в тканях легких как органа-мишени.
Задачей изобретения является также разработка способа применения средства для лечения инфекции, вызванной SARS-CoV-2, который будет отличаться простотой и сможет обеспечить доступ лекарства в зону репликации вируса.
Решение поставленной задачи достигается предлагаемым средством, обладающим противовирусной активностью, а также способностью продуцировать катионы нитрозония, представляющим собой систему соединений, включающую координационное соединение железа, содержащее биядерную форму динитрозильного комплекса железа с глутатионовыми лигандами (Б-ДНКЖ-GSH) формулы [(GS-)2Fe2+2(NO)2(NO+)2]2+, и диэтилдитиокарбамат натрия (ДЭТК) при молярном соотношении Б-ДНКЖ-GSH : ДЭТК=1:1-5.
Предлагаемое средство содержит Б-ДНКЖ-GSH и ДЭТК в виде водных растворов для ингаляции.
Концентрация водного раствора Б-ДНКЖ-GSH для ингаляции в предлагаемом средстве составляет 5-20 мМ.
Водный раствор Б-ДНКЖ-GSH для ингаляции хранится до применения при температуре не выше -18°С.
Концентрация водного раствора ДЭТК для ингаляции в предлагаемом средстве составляет 10-50 мМ.
Водный раствор ДЭТК для ингаляции хранится до применения в темноте при комнатной температуре.
Решение поставленной задачи достигается также предлагаемым способом применения заявляемого средства, характеризующимся тем, что водный раствор Б-ДНКЖ-GSH размораживают и распыляют небулайзером в течение 30 мин, затем в течение 30 мин распыляют небулайзером водный раствор ДЭТК.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
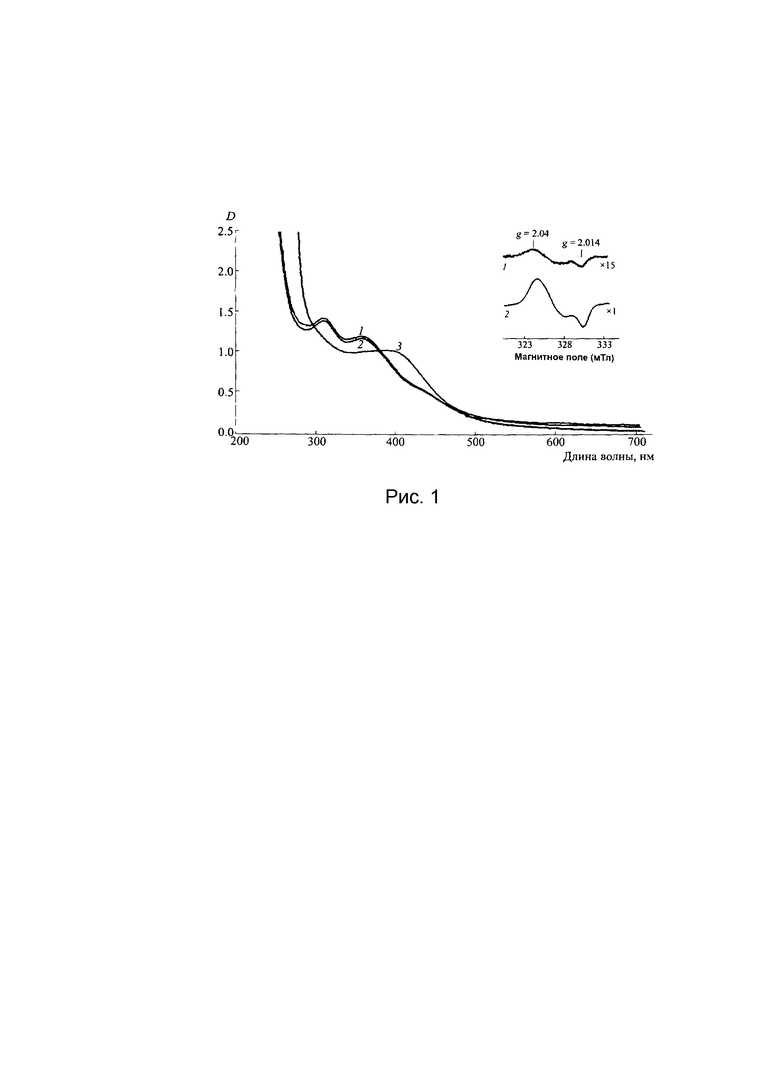
Рис. 1. Спектры оптического поглощения Б- и М-ДНКЖ-GSH при концентрации 0,46 мМ (соответственно кривые 1, 2 и 3) и сигнал ЭПР М-ДНКЖ-GSH (сигнал 2,03 со значениями тензора g-фактора, равными g⊥=2.04, g||=2.014).
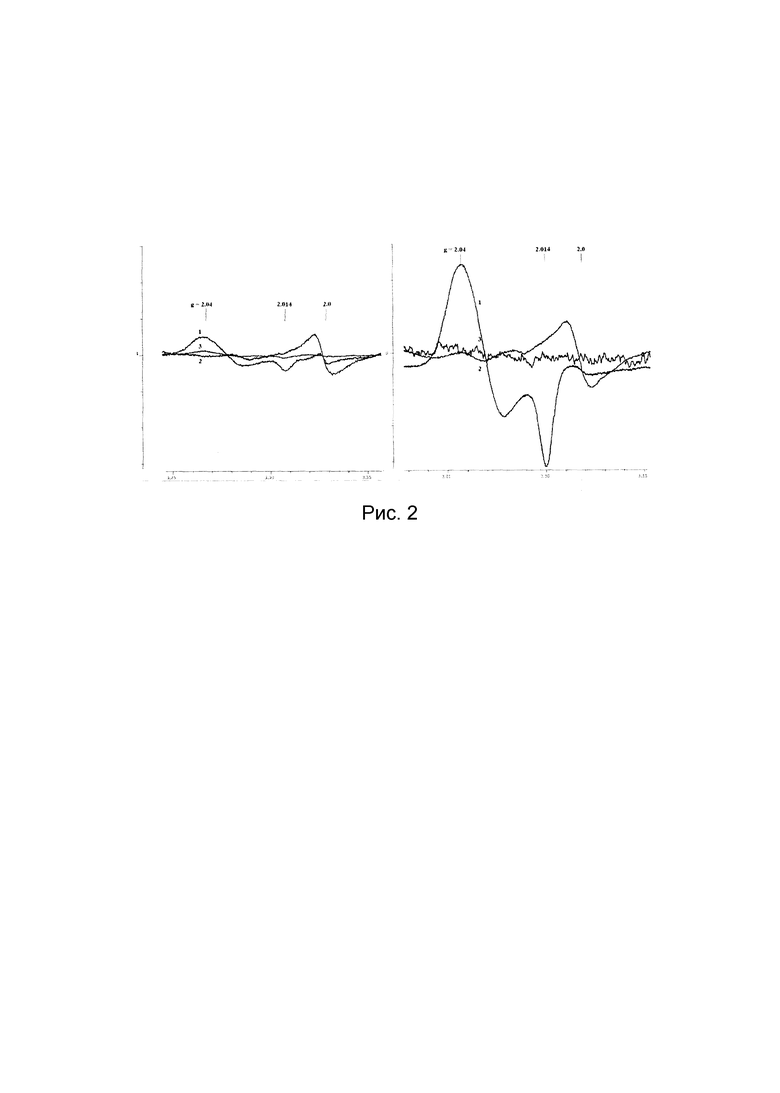
Рис. 2. Спектры ЭПР тканей легких (1), печени (2) и крови (3) хомячков, подвергнутых ингаляции распыленным 10 мМ раствором ДНКЖ (слева) и 10 мМ растворами сначала ДНКЖ, а затем ДЭТК (справа). Сигнал при g=2,0 обусловлен эндогенными свободными радикалами. Спектры зарегистрированы на радиоспектрометре «Bruker» при 77 K, 5 мвт СВЧ мощности, 0,5 мТ амплитуде ВЧ модуляции магнитного поля и одинаковом усилении радиоспектрометра.
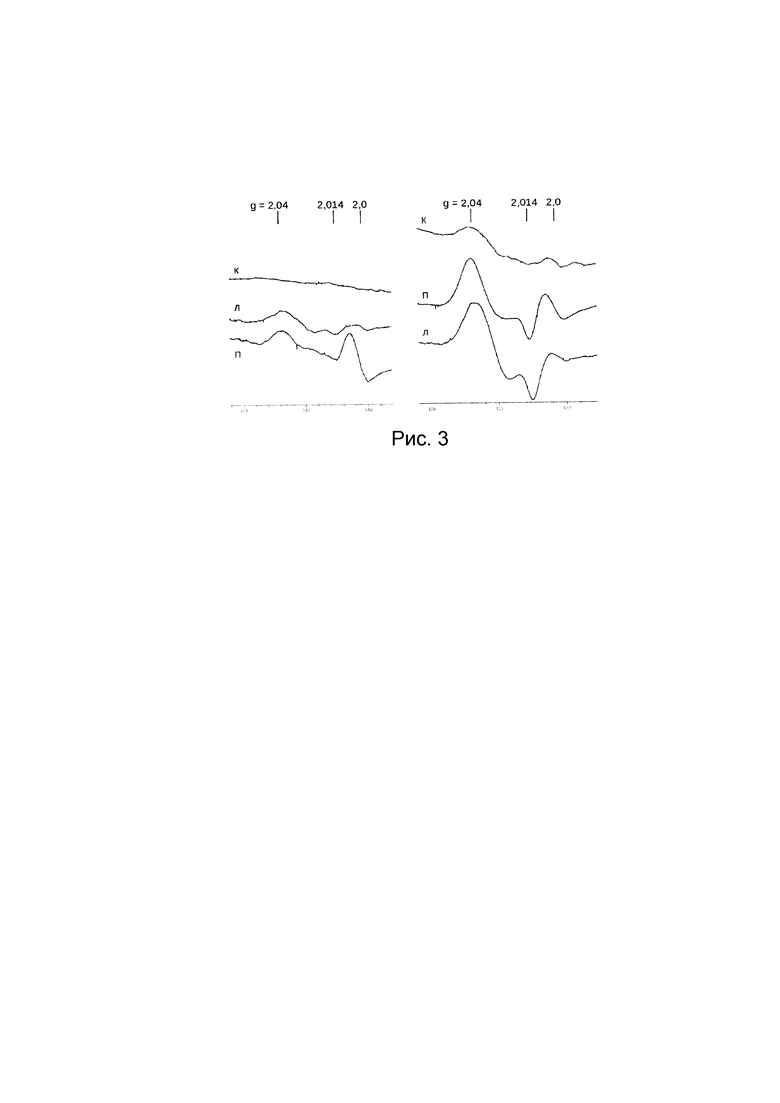
Рис. 3. Сигнал 2,03 в крови (к), легких (л) и печени (п) мышей CD1, подвергнутых ингаляции: левая панель - 10 мМ раствором Б-ДНКЖ-GSH; правая панель - сначала 10 мМ раствором ДНКЖ, а затем 50 мМ раствором ДЭТК. Сигнал при g=2,0 обусловлен эндогенными свободными радикалами. Спектры зарегистрированы на радиоспектрометре «РадиоПан» при 77 К, 5 мвт СВЧ мощности, 0,5 мТ амплитуде ВЧ модуляции магнитного поля и одинаковом усилении радиоспектрометра.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
МАТЕРИАЛЫ И МЕТОДЫ
СОЕДИНЕНИЯ/ПРЕПАРАТЫ
В экспериментах использовали ферросульфат (FeSO4⋅7H2O) (Fluka, Швейцария); восстановленный глутатион (GSH), нитрит натрия (NaNO2) и диэтилдитиокарбамат натрия (C5H10NS2Na⋅3H2O) (ДЭТК) - фирма Sigma, США.
ВИРУСЫ
В работе использовали штамм SARS-CoV-2 hCoV-19/Russia/Vologda-171613-1208/2020, полученный из Государственной коллекции микроорганизмов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Инфекционный вирус выделяли в культуре клеток Vero Е6, аликвоты вируса были заморожены и хранились при температуре минус 80°С. Титр стока составлял не менее 106 ЦПД50/мл. Для исследований использовался вирус пассажа 4. Титр вирусной суспензии определяли методом конечных разведения на клетках Vero Е6 по методу Рида и Менча [38]. Работа, связанная с живым вирусом, проводилась в условиях максимально изолированной лаборатории, соответствующей международным требованиям BSL3+ в ГНЦ ВБ «Вектор» Роспотребнадзора, имеющего разрешение на проведение таких исследований.
КУЛЬТУРЫ КЛЕТОК
В работе использовали линию клеток Vero Е6, полученную из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Выращивание монослоя клеток Vero Е6 осуществляли в среде DMEM («Gibco», США) с добавлением 10% эмбриональной сыворотки крупного рогатого скота («HyClone», США) и комплексного антибиотика («Gibco», США). В качестве поддерживающей среды при культивировании вируса использовали ту же среду, но с 2% эмбриональной сыворотки.
ЖИВОТНЫЕ
В эксперименте использовали самцов и самок аутбредных сирийских хомячков (Mesocricetus auratus) с массой тела 80-100 г. Животные были получены из Питомника лабораторных животных ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Хомячкам подкожно имплантировали транспондеры (чипы) IPTT-300 («BMDS», США) для бесконтактного измерения температуры и идентификации ID и помещали по два в индивидуально вентилируемые клетки. Животные имели неограниченный доступ к пище и воде. Акклиматизация к условиям эксперимента была проведена в течение 7 дней до заражения. Во время экспериментов температура в клетках поддерживалась 22-24°С, а относительная влажность 40-55%. Хомячков взвешивали, измеряли температуру и оценивали на клинические признаки болезни ежедневно.
Для определения оптимальных концентраций аэрозольно вводимых растворов предлагаемого средства использовали самцов аутбредных мышей CD1 массой тела 18-20 г. Животные были получены из вивария Института биохимической физики им. Н.М. Эмануэля РАН.
Все эксперименты на животных проводились в соответствии с соответствующими национальными и международными руководящими принципами по уходу и гуманному использованию животных.
МОДЕЛЬ ИНФЕКЦИИ SARS-COV-2 В СИРИЙСКИХ ХОМЯКАХ
Модель заражения хомяков вирусом SARS-CoV-2 была описана ранее [39].
В работе использовали 6 групп животных (4 опытных и 2 контрольных) по 8 хомяков (4 самца и 4 самки) в каждой.
Перед заражением сирийских хомячков анестезировали внутримышечным наркозом Zoletil 100 («Virbac», Франция). Заражение анестезированных животных производили интраназально инокуляцией вируса пипеткой в объеме 50 мкл, в дозе 50 ИД50. Через 120 часов после заражения все животные подвергались эвтаназии методом трансцервикальной дислокации. Производили вскрытие, забор тканей носовых ходов и легких. Полученные с помощью механического гомогенизатора (FastPrep-24, «МР Biomedicals», США) 10% гомогенаты тканей осветляли путем центрифугирования при 10000 об/мин (ротор SW28, «Beckman Coulter», «High Mycombe», Великобритания). Аликвоты осветленных образцов использовали для определения количества РНК вируса в образцах методом ОТ-ПЦР в режиме реального времени с помощью полимеразной цепной реакции через суррогатный показатель Ct (число циклов) и для определения концентрации в ЦПД50/мл (TCID50/ml) инфекционного вируса методом титрования на культуре клеток Vero Е6.
ОПРЕДЕЛЕНИЕ РНК ВИРУСА SARS-COV-2 В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ МЕТОДОМ ОТ-ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
Для выделения РНК использовали набор «РИБО-преп» («АмплиСенс», Россия). Синтез кДНК из выделенной РНК проводили реагентами для реакции обратной транскрипции «Реверта-L» (ЦНИИЭ Роспотребнадзора, Россия). Набор реагентов «Вектор-ПЦРРВ-COVID19-RG» (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) использовали для амплификации фрагментов кДНК вируса SARS-CoV-2. Результаты исследования интерпретировали в соответствии с инструкцией производителя.
ОПРЕДЕЛЕНИЕ ИНФЕКЦИОННОГО ТИТРА ВИРУСА SARS-COV-2 В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ НА ПЕРЕВИВАЕМОЙ КУЛЬТУРЕ КЛЕТОК VERO Е6
Клетки Vero Е6 высевали за 24 часа до заражения в 96-луночные планшеты с посевной дозой 1,5×104 клетки/лунка. В день эксперимента были сделаны последовательные 10-кратные разведения вируса в среде DMEM («Gibco», США) с добавлением 2% эмбриональной сыворотки крупного рогатого скота («HyClone», США) и комплексного антибиотика («Gibco», США), и в общей сложности от шести до восьми лунок были заражены каждым разведением вируса. После 72-часовой инкубации клетки фиксировали 4% раствором забуференного формалина с последующим окрашиванием 0,1% кристаллическим фиолетовым. Специфическое поражение монослоя культуры клеток в лунке учитывали как ЦПД. Расчет титра вируса проводили по формуле Рида-Менча [38] и выражали в lg ЦПД50/мл (lg TCID50/ml).
ВВЕДЕНИЕ ТЕСТИРУЕМЫХ СОЕДИНЕНИЙ/ПРЕПАРАТОВ
Аэрозольное введение тестируемых препаратов проводили в вертикальной динамической камере в течение 30 минут. Рабочий расход воздуха через камеру составлял 10 л/мин. Во внутренний объем камеры одновременно помещали 8 хомяков. Диспергирование проводили небулайзером (распылителем) «Омрон» с расходом воздуха 6 л/мин. В распылитель заливали 10 мл водного раствора препарата. Отбираемый аэрозоль улавливали с помощью пробоотборника (МЦ-2), соединяемого с выходным штуцером камеры. Объемная скорость отбора проб аэрозоля в пробоотборнике составляла 10±0,5 л/мин, объем сорбирующей жидкости (диет, вода) - 10 мл.
Аналогичным образом вводили ингаляционным путем тестируемые препараты аутбредным мышам CD 1.
Введение препарата - в течение 4 суток 2 раза в сутки, первое введение через 1 час после заражения.
ИЗМЕРЕНИЕ ЭПР СПЕКТРОВ ОБРАЗЦОВ ИЗОЛИРОВАННЫХ ТКАНЕЙ НАТИВНЫХ (НЕ ЗАРАЖЕННЫХ) ЖИВОТНЫХ
После проведения эксперимента (введения тестируемых препаратов) у животных (сирийские хомячки, мыши) проводили забор крови и подвергали их эвтаназии (методом трансцервикальной дислокации). Производили вскрытие и забор тканей легких и печени в асептических условиях. Образцы помещали в пластмассовые трубки диаметром 4 мм и замораживали в жидком азоте. Для последующего измерения спектров ЭПР трубки с замороженными в них образцами крови или тканей извлекали из жидкого азота и постепенно, нагревая в руках, поршнем выдавливали цилиндрики образцов в жидкий азот и помещали в жидком азоте в палец Дьюара соответствующей формы, после чего регистрировали в этих образцах спектры ЭПР при соответствующих параметрах радиоспектрометра ЭПР («Bruker», Германия) или модифицированного радиоспектрометра ЭПР («РадиоПан», Польша).
СИНТЕЗ Б-ДНКЖ С ГЛУТАТИОНОВЫМИ ЛИГАНДАМИ (Б-ДНКЖ-GSH)
При синтезе Б-ДНКЖ-GSH использовали способность S-нитрозотиолов (RS-NO) образовывать в реакции с ионами Fe2+ и тиолами соответствующие М-ДНКЖ (III):
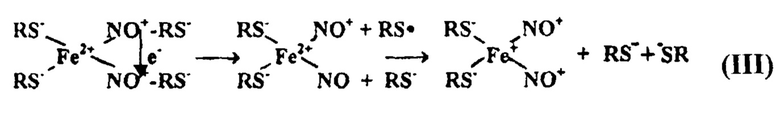
Механизм образования М-ДНКЖ в реакции RS-NO, Fe2+ и тиолов [40].
Ионы Fe2+ связывают по две молекулы RS-NO на ион с последующим диспропорционированием этих молекул, что сразу же приводит к образованию М-ДНКЖ, характеризующихся, как уже указывалось выше, сигналом ЭПР с gcp=2.03 (сигналом 2,03). При низкой концентрации тиолов в растворе М-ДНКЖ конденсируются в Б-ДНКЖ - диамагнитные комплексы, не дающие сигнала 2,03 (IV):
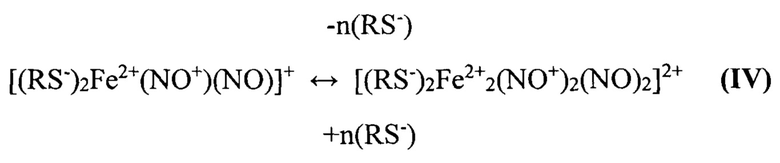
Равновесное взаимопревращение М- и Б-ДНКЖ с тиолсодержащими лигандами - равновесие сдвигается влево при повышении в растворе уровня тиолов (RS-), ионизованных по тиоловой группе [41].
Концентрацию Б-ДНКЖ можно было оценить по интенсивности двух полос их оптического поглощения на 310 и 360 нм (приведенными на Рис. 1) с коэффициентами экстинкции в пересчете на один атом железа в Б-ДНКЖ, равными соответственно 4600 и 3700 М-1см-1.
Пример 1. Получение 10 мМ водного раствора биядерной формы динитрозильного комплекса железа с глутатионовыми лигандами (Б-ДНКЖ-GSH) формулы:
[(GS-)2Fe2+2(NO)2(NO+)2]2+
Синтез 10 мМ раствора Б-ДНКЖ-GSH проводили в соответствии с методом, разработанным в [42]. Глютатион, ферросульфат и нитрит натрия в концентрации соответственно 40, 20 и 20 мМ последовательно вводили, тщательно размешивая, в 15 мМ раствор ГЕПЕС-буфера при рН 7,2-7,4. Введение глутатиона приводило к подкислению раствора этого буфера до рН 3,6-3,8; для надежного предотвращения образования нерастворимых гидроокисных комплексов железа при последующем добавлении в раствор глутатиона ферросульфата до введения ферросульфата рН раствора понижали добавлением серной кислоты до рН 1-2. Последнее гарантировало также более эффективное образование в растворе S-нитрозоглютатиона (GS-NO) после добавления в реакционный раствор нитрита натрия. За этим процессом следили по интенсивности полосы поглощения на 334 нм, характерной для GS-NO с ε=0.94 М-1см-1 [43]. Обычно образование GS-NO в концентрации 20 мМ завершалось при комнатной температуре в течение 1.5 часов. После этого рН реакционного раствора, окрашенного из-за наличия в нем GS-NO в розовый цвет, повышали капельным добавлением крепкого (100 мМ) раствора NaOH до рН 7.3-7.5 - при этом раствор приобретал коричневую окраску, обусловленную начавшимся в соответствии со схемой 3 образованием М-ДНКЖ-GSH. Раствор оставляли на ночь на воздухе при комнатной температуре. За это время в соответствии со схемами 3 и 4 половина железа (10 мМ) включалась в М-ДНКЖ-GSH, а затем в Б-ДНКЖ-GSH, тогда как другая половина железа включалась в водонерастворимые гидроокисные комплексы, выпадавшие в осадок. На следующий день этот осадок удаляли фильтрацией раствора на бумажном фильтре. В результате получали прозрачный раствор Б-ДНКЖ-GSH в концентрации 10 мМ который замораживали в жидком азоте и хранили в замороженном состоянии при температуре не выше -18°С до использования в экспериментах на животных.
На Рис. 1 приведен спектр оптического поглощения полученного описанным выше методом препарата Б-ДНКЖ-GSH (кривая 1) с полосами поглощения на 310 и 360 нм (ε=4600 и 3700 М-1см-1 соответственно) (раствор разбавлен до концентрации 0,46 мМ). Спектр не изменялся в течение часа при подкислении раствора до рН=1.0 (кривая 2). На вставке приведен сигнал ЭПР 10 мМ раствора Б-ДНКЖ-GSH (сигнал 2,03, кривая 1), обусловленный 5%-ной примесью М-ДНКЖ-GSH. При добавлении к этому раствору 10 мМ GSH и повышении рН с 7,5 до 10,5 Б-ДНКЖ полностью переходил в М-ДНКЖ. Спектр поглощения последнего с полосой на 400 нм и сигнал ЭПР 2,03 представлены на Рис. 1 соответственно кривой 3 и ЭПР сигналом 2.
Пример 2. Получение 20 мМ водного раствора биядерной формы динитрозильного комплекса железа с глутатионовыми лигандами (Б-ДНКЖ-GSH)
20 мМ раствор Б-ДНКЖ-GSH получали аналогично примеру 1. Глютатион, ферросульфат и нитрит натрия использовали в концентрации соответственно 80, 40 и 40 мМ. Полученный 20 мМ раствор Б-ДНКЖ-GSH замораживали в жидком азоте и хранили при температуре не выше -18°С до использования в экспериментах на животных.
Пример 3. Приготовление 10 и 50 мМ водных растворов диэтилдитиокарбамата натрия (ДЭТК)
Кристаллический порошок диэтилдитиокарбамата натрия (C5H10NS2Na⋅3H2O, молекулярная масса 225,31) растворяли в нужном количестве дистиллированной воды и растворы хранили в темноте при комнатной температуре.
Пример 4. Лечебное действие ингаляции инфицированных хомяков предлагаемым средством (распыленными растворами Б-ДНКЖ-GSH и ДЭТК)
3 группы животных (2 опытных и 1 контрольная) по 8 хомяков (4 самца и 4 самки) в каждой заражали вирусом SARS-CoV-2 по методике, описанной выше. Через 1 час после заражения опытные группы хомяков поочередно помещали в вертикальную динамическую камеру для аэрозольного введения лечебных препаратов небулайзером «Омрон», как описано выше:
а) в небулайзер заливали 10 мл 10 мМ водного раствора Б-ДНКЖ-GSH и распыляли в течение 30 мин.
б) в небулайзер сначала заливали 10 мл 10 мМ водного раствора Б-ДНКЖ-GSH и распыляли в течение 30 мин. Затем распылитель небулайзера отмывали от Б-ДНКЖ-GSH в течение 5 мин 1 л дистиллированной воды, после чего в небулайзер заливали 10 мл 10 мМ водного раствора ДЭТК и проводили распыление в течение 30 мин.
в) аэрозольную ингаляцию контрольной группы хомяков проводили дистиллированной водой.
Лечение проводили 4 суток с двукратным в течение суток введением препарата по методике, описанной выше.
Через 120 часов после заражения все животные подвергались эвтаназии (методом трансцервикальной дислокации). Производили вскрытие и забор тканей носовой полости и легких (в асептических условиях) для определения количества РНК вируса в гомогенатах тканей методом ОТ-ПЦР в режиме реального времени с помощью полимеразной цепной реакции через показатель Ct (число циклов) и методом титрования на культуре клеток Vero Е6 (lg TCID50/ml). Полученные результаты приведены в таблице 1.

Анализ результатов, приведенных в таблице 1, по данным метода ОТ-ПЦР (Ct) показывает, что при проведении лечения животных только раствором Б-ДНКЖ-GSH (ДНКЖ в таблице) достоверно снижается вирусная нагрузка в тканях носовой полости - в 16 раз (р=0,0006, Манн-Уитни) по сравнению с контрольными (плацебо). При этом по инфекционному титру (lg TCID50/ml) достоверного снижения (р>0,005, Манн-Уитни) вирусной нагрузки ни в тканях носовой полости, ни в тканях легких зафиксировано не было.
Для системы соединений Б-ДНКЖ-GSH + ДЭТК при их последовательном введении определена достоверная противовирусная активность. По данным метода ОТ-ПЦР (Ct) отмечено снижение уровня накопления РНК в тканях легких в 21 раз (р=0,0007, Манн-Уитни), в тканях носовой полости - в 16 раз (р=0,0025, Манн-Уитни). Методом титрования в тканях носовой полости определено еще большее снижение вирусной нагрузки - в 200 раз (р=0,0002, Манн-Уитни). При исследовании тканей легких наблюдалось снижение вирусной нагрузки в 20 раз (р=0,0002, Манн-Уитни).
В соответствии со схемой 2 такая последовательность введения в дыхательные пути хомяков Б-ДНКЖ-GSH и ДЭТК должна приводить к накоплению в тканях дыхательных путей высвобождающихся из Б-ДНКЖ катионов нитрозония, что, по-видимому, и обеспечило подавление инфекции SARS-CoV-2.
Уменьшение концентрации Б-ДНКЖ-GSH в растворе для ингаляции до 5 мМ (концентрация ДЭТК в последующей ингаляции составляла 10 мМ) не привело к снижению показателей вирусной нагрузки в тканях носовой полости и в тканях легких хомяков. Дальнейшее уменьшение концентрации динитрозильного комплекса в заявляемом средстве без потери эффективности лечения потребовало бы увеличения продолжительности ингаляции, что нецелесообразно. Постепенное увеличение концентрации Б-ДНКЖ-GSH в растворе для ингаляции вплоть до 20 мМ позволило лишь незначительно повысить показатели, достигнутые для концентрации 10 мМ. Следует отметить, что дальнейшее увеличение концентрации Б-ДНКЖ-GSH невозможно из-за снижения его растворимости в воде.
При увеличении концентрации раствора ДЭТК в системе Б-ДНКЖ-GSH + ДЭТК до 50 мМ для лечения хомяков наблюдалось незначительное улучшение показателей вирусной нагрузки в тканях носовой полости и в тканях легких хомяков.
Пример 5. (Сравнительный). Ингаляция инфицированных хомяков распыленными растворами: а) ДЭТК; б) сначала ДЭТК, а потом Б-ДНКЖ-GSH
3 группы животных (2 опытных и 1 контрольная) по 8 хомяков (4 самца и 4 самки) в каждой заражали вирусом SARS-CoV-2 по методике, описанной выше. Через 1 час после заражения опытные группы хомяков поочередно помещали в вертикальную динамическую камеру для аэрозольного введения лечебных препаратов небулайзером «Омрон», как описано выше:
а) 1-я группа хомяков: в небулайзер заливали 10 мл 10 мМ водного раствора ДЭТК и распыляли в течение 30 мин.
б) 2-я группа хомяков: в небулайзер сначала заливали 10 мл 10 мМ водного раствора ДЭТК и распыляли в течение 30 мин. После этого распылитель небулайзера в течение 5 мин отмывали от ДЭТК 1 л дистиллированной воды. Затем в небулайзер заливали 10 мл 10 мМ водного раствора Б-ДНКЖ-GSH и проводили распыление в течение 30 мин.
в) аэрозольную ингаляцию контрольной группы хомяков проводили дистиллированной водой.
Лечение проводили 4 суток, с двукратным в течение суток введением препарата по методике, описанной выше.
Через 120 часов после заражения все животные подвергались эвтаназии.
Производили вскрытие и забор тканей носовой полости и тканей легких для определения количества РНК вируса в гомогенатах тканей методом ОТ-ПЦР в режиме реального времени с помощью полимеразной цепной реакции через показатель Ct (число циклов) и методом титрования на культуре клеток Vero Е6 ((lg TCID50/ml). Полученные результаты приведены в таблице 2.
Результаты, полученные после аэрозольного введения зараженным хомячкам соединений ДЭТК или ДЭТК с последующим аэрозольным введением Б-ДНКЖ-GSH, показали (таблица 2), что при такой последовательности введения указанных соединений достоверного снижения вирусной нагрузки в чувствительных тканях органов-мишеней по двум исследуемым параметрам по сравнению с контрольными (плацебо) животными зафиксировано не было.
Пример 6. Измерение ЭПР спектров образцов изолированных тканей нативных (не зараженных) сирийских хомячков для определения в них концентрации М-ДНКЖ-GSH
Сирийским хомячкам аэрозольно вводили:
а) в течение 30 мин 10 мл 10 мМ раствора Б-ДНКЖ-GSH;
б) в течение 30 мин 10 мл 10 мМ раствора Б-ДНКЖ-GSH с последующим 30-минутным введением 10 мл 10 мМ раствора ДЭТК.
Забор образцов крови и тканей легких и печени у животных и измерение спектров ЭПР описаны выше.
В качестве эталонного образца (стандарта) при определении концентрации комплекса М-ДНКЖ-GSH, возникавшего в тканях животных, использовался 10 мМ раствор М-ДНКЖ-GSH, сигнал ЭПР которого приводится на Рис. 1 - ЭПР сигнал 2. Поскольку плотность ткани легкого примерно в 2 раза меньше плотности воды, после оценки содержания М-ДНКЖ-GSH в этом органе в соответствии со стандартом полученную величину умножали на 2.
На Рис. 2 приведен типичный спектр ЭПР, зарегистрированный при 77 К в образцах легких (1), печени (2) и крови (3) хомяков:
- левая панель - введение только Б-ДНКЖ-GSH;
- правая панель - последовательное введение сначала Б-ДНКЖ-GSH и затем ДЭТК (система ДНКЖ+ДЭТК).
В обоих случаях наибольший сигнал 2,03 (сигнал ЭПР появляющихся в тканях М-ДНКЖ) наблюдался в легких. При ингаляции животных только раствором Б-ДНКЖ-GSH концентрация М-ДНКЖ в этом органе варьировала в пределах 30-40 μмолей/кг влажной ткани. В крови эта величина варьировала в пределах 3-5 μмолей/л, в печени - сигнал 2,03 практически не обнаруживался.
При ингаляции животных сначала раствором Б-ДНКЖ-GSH, а затем раствором ДЭТК (ДНКЖ+ДЭТК, правая панель), судя по интенсивности сигнала 2,03, уровень М-ДНКЖ в легких достигал 140-160 μмолей/кг, то есть в среднем повышался в 4-5 раз по сравнению с величиной, наблюдавшейся при ингаляции животных только Б-ДНКЖ-GSH. В печени содержание М-ДНКЖ достигало 3 μмолей/кг, в крови сигнал 2,03 не обнаруживался.
Пример 7. Измерение ЭПР спектров образцов изолированных тканей нативных (не зараженных) мышей CD1 для определения в них концентрации М-ДНКЖ-GSH
Введение препаратов, забор образцов крови и тканей легких и печени животных и измерение спектров ЭПР проводили аналогично примеру 6.
На Рис. 3 приведен типичный спектр ЭПР, зарегистрированный при 77 К в образцах легких (л), печени (п) и крови (к) мышей CD1.
Аэрозольное введение мышам 10 мМ раствора Б-ДНКЖ-GSH объемом 10 мл в течение 30 мин приводило, судя по интенсивности сигнала 2,03, к появлению М-ДНКЖ в легких и печени в концентрации, соответственно 0.5-1.2 и 1.5-2.0 μмолей/кг (Рис. 3, левая панель), то есть, в отличие от сирийских хомячков, аэрозольно вводимый комплекс Б-ДНКЖ-GSH достаточно эффективно переходил из легких в кровь, а оттуда в печень. Тем не менее, в крови регистрировался лишь очень слабый сигнал 2,03.
При последовательном введении мышам сначала 10 мл распыленного 10 мМ раствора Б-ДНКЖ-GSH и затем 10 мл распыленного 10 мМ раствора ДЭТК уровень появлявшихся в тканях мышей М-ДНКЖ практически не повышался. При увеличении концентрации ДЭТК до 50 мМ, существенно, в 3-4-раза увеличивалась концентрация М-ДНКЖ во всех исследовавшихся тканях животных (Рис. 3, правая панель). При этом в легких уровень М-ДНКЖ варьировал в пределах 1,5-3,0 μмолей/кг, в печени -0,8-1,4 μмолей/кг, в крови - 0,3-0,5 μмолей/л.
Как видно из результатов, полученных в примерах 6 и 7, для животных разного размера - хомяков и мышей - наблюдается различная преимущественная локализация М-ДНКЖ в изолированных тканях животных. При введении хомякам 10 мМ раствора Б-ДНКЖ-GSH с последующим введением 10 мМ раствора ДЭТК накопление М-ДНКЖ в тканях легких хомяков (140-160 μмолей/кг) в 50 раз превосходит содержание М-ДНКЖ в печени, тогда как у мышей заметный уровень М-ДНКЖ в тканях легких (1,5-3,0 μмолей/кг) и печени (0,8-1,4 μмолей/кг) появился только при увеличении концентрации ДЭТК до 50 мМ. Такую разницу можно объяснить более высокой проницаемостью сосудов у мышей как у животных меньшего размера, что приводит к быстрому переходу введенного ДНКЖ-GSH из дыхательных путей мышей в кровь, а оттуда в печень.
Наблюдаемая преимущественная локализация М-ДНКЖ в тканях легких хомяков позволяет предположить, что при возможном использовании системы Б-ДНКЖ-GSH + ДЭТК для лечения COVID-19 у человека высвобождающиеся из Б-ДНКЖ-GSH катионы нитрозония будут также локализоваться в тканях дыхательных путей (зоне репликации вируса), обеспечивая подавление инфекции.
Таким образом, совокупность результатов проведенных исследований свидетельствует, что предлагаемое средство, представляющее собой систему соединений Б-ДНКЖ-GSH + ДЭТК в виде водных растворов для ингаляции, обладает выраженной противовирусной активностью в отношении вируса SARS-CoV-2 в тканях дыхательных путей и может использоваться для лечения тяжелых форм вирусной пневмонии при COVID-19. Предлагаемый способ применения заявляемого средства отличается простотой и обеспечивает доступ лекарства в зону репликации вируса.
Список литературы
1. Н.О. Быкова, Н.В. Горбунов, А.П. Волгарев и др. Бюлл. Эксп. Биол. Мед. 112, 617 (1991)
2. G. Karapian and N. Harris, J. Exp. Med. 181, 2171 (1995)
3. C.J. Lowenstein, S.L. Hill., A. Lafond-Walker et al. Clin. Invest. 92, 1837 (1996)
4. E. Peterhans, Biol. Trace Element Res. 56,107 (1997)
5. C.S. Reiss and T. Kamatsu, J. Virol. 72, 4547 (1998)
6. T. Akaike and H. Maeda, Immunology 101, 300 (2000)
7. S. Akerstrom, M. Mousavi-Jazi, J. Klingstrom et al., J. Virol. 78, 1966 (2005)
8. J. Martel, Y.-F. Ko, J.D. Young et al., Microbes and Infection 22, 168 (2020)
9. J. Wu, Nitric Oxide Biol. Chem 102, 39 (2020)
10. F. Sodano, E. Gazzano, R. Frattero at al., Molecules 27, 2337 (2022)
11. E. Keaerts, L. Vijgen, L. Chen, et al., Int. J. Infect. Dis. 8, 223 (2004)
12. W. Xu, S. Zheng, R.A. Dweik, et al., Free Rad. Biol. Med. 41, 19 (2006)
13.G. Regev-Shoshani, S. Vimalnathan, B. McMullin et al., Nitric Oxide Biol. Chem. 31, 48 (2015)
14. E.U. Uehara, B. de Stefano Shida, and C.A. de Brito, Inflamm. Res. 64, 845 (2015)
15. M. Colosanti, Т. Persichini, G. Venturinio, et al., IUBMB Life, 48, 25 (1999)
16. А.Ф. Ванин, Биофизика 65, 818 (2020)
17. J.S. Stamler, Cell 78, 931 (1994)
18. K.M. Miranda, M.G. Espey, D.A. Wink, J. Inorg. Biochem. 79, 237 (2000)
19. T.A. Heinrich, R.S. da Silva, K.M. Miranda, et al., Br. J. Pharmacol. 169, 1417 (2013)
20. M. Boese, P.I. Mordvintcev, A.F. Vanin et.al., J. Biol. Chem. 270, 2924 (1995)
21. C.A. Bosworth, J.C. Toledo, J.W. Zmiewski, et al., Proc. Ntl. Acad. Sci. USA 106, 4671 (2009)
22. M.F. Foster, L. Liu, M. Zhang et. al. Biochemistry 48, 792 (2009)
23. A.F. Vanin, Austin J. Analyt. Pharmaceut. Chem. 5, 1109 (2018)
24. A.F. Vanin, Cell Biochem Biophys. 77, 279 (2019)
25. А.Ф. Ванин, Биофизика 65, 421 (2020)
26. A.F. Vanin, Appl. Magn. Res. 51, 851 (2020)
27. A.F. Vanin, Dinitrosyl Iron Copmplexes as a "Working Form" of Nitric Oxide in Living Organisms (Cambridge Scholars Publishing Cambridge, UK, 2019)
28. N. Lehnert, E. Kim, H.N. Dong, et al. Chem Rev. 121, 14682 (2021)
29. R.R. Borodulin, L.N. Kubrina, V.D. Mikoyan, et al., Nitric Oxide Biol. Chem. 29, 4 (2013)
30. A.F. Vanin, V.A. Tronov and R.R. Borodulin, Cell Biochem. Biophys.79, 93 (2021)
31. Родненков O.B., Зорин A.B. и др. Эффективность и безопасность нового гипотензивного препарата "Оксаком". Евразийский кардиологический журнал, 2016/3. Тезисы IV Евразийского конгресса кардиологов, 10-11 октября 2016 г. Ереван, Армения.
32. RU 2522953, МПК A61K 38/06, A61K 31/295, A61K 33/26. Опубл. 20.07.2014.
33. RU 2438698, МПК A61K 38/28, A61K 33/14, A61K 31/194. Опубл. 10.01.2012.
34. RU 2291880, МПК C08J 3/03, C01G 49/00. Опубл. 20.01.2007.
35. RU 2441873, МПК C07F 15/02, A61K 31/295, А61Р 35/00. Опубл. 10.02.12.
36. RU 2494104, МПК C07F 15/02, A61K 31/295, А61Р 35/00. Опубл. 27.09.2013.
37. Ванин А.Ф., Тронов В.А., Микоян В.Д. и Ткачев Н.А. Российская академия наук, Отделение химии и наук о материалах. Важнейшие научные результаты в сфере медицинской химии в 2021 году. Сборник тезисов, 2022, с. 22-23.
38. L.J. Reed and Н.А. Muench, Am. J. Hyg. 27, 493 (1938)
39. J.F. W. Chan, A.J. Zhang, S. Yuan et al. Clin. Infect. Dis. 71, 2428 (2020)
40. A.F. Vanin, I.V. Malenkova and V.A. Serezhenkov. Nitric Oxide Biol. Chem. 1, 191 (1997)
41. A.F. Vanin, A.P. Poltorakov, V.D. Mikoyan et al. Nitric Oxide Biol. Chem. 23, 136 (2011)
42. R.R. Borodulin, L.N. Kubrina, V.O. Shvydkiy et al. Nitric Oxide Biol. Chem. 35, 110 (2013)
43. D.L.H. Williams, Nitrosation Reactions and the Chemistry of Nitric Oxide (Elsevier, Amsterdam, 2004).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ НИТРОЗОСОЕДИНЕНИЙ И НИТРИТА В БИООБЪЕКТАХ | 2008 |
|
RU2395096C2 |
| Комбинированное лекарственное средство, обладающее противовирусным эффектом в отношении нового коронавируса SARS-CoV-2 | 2021 |
|
RU2746362C1 |
| МОНОЯДЕРНЫЕ КАТИОННЫЕ ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДОНОР МОНОКСИДА АЗОТА | 2014 |
|
RU2567245C1 |
| ПРИМЕНЕНИЕ ДАЛАРГИНА ДЛЯ ПРОИЗВОДСТВА СРЕДСТВ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19 | 2020 |
|
RU2728939C1 |
| Производные ди(диазониадиспиро[5.2.5.2]гексадекан)-5-нитропиримидина и их применение для лечения коронавирусных инфекций, в частности вызванных вирусом SARS-Cov-2 | 2020 |
|
RU2761950C1 |
| Средство для снижения риска и облегчения симптомов заражения бета-коронавирусной инфекцией | 2021 |
|
RU2747890C1 |
| Рекомбинантный штамм Sen-Sdelta(M) вируса Сендай, продуцирующий S белок SARS-CoV-2 и используемый для получения интраназальной вакцины против COVID-19 | 2024 |
|
RU2837536C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2743593C1 |
| МОНОЯДЕРНЫЕ ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА, СПОСОБ ПОЛУЧЕНИЯ МОНОЯДЕРНЫХ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА, ДОНОР МОНООКСИДА АЗОТА, ПРИМЕНЕНИЕ МОНОЯДЕРНОГО ДИНИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2011 |
|
RU2494104C2 |
| Вакцинная композиция против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743595C1 |
Изобретение относится к лекарственным препаратам на основе координационных соединений железа, а именно к противовирусному средству, представляющему собой систему соединений, включающую координационное соединение железа, содержащее биядерную форму динитрозильного комплекса железа с глутатионовыми лигандами (Б-ДНКЖ-GSH) формулы [(GS-)2Fe2+2(NO)2(NO+)2]2+, и диэтилдитиокарбамат натрия (ДЭТК) при молярном соотношении Б-ДНКЖ-GSH : ДЭТК=1:1-5. Также предложен способ применения указанного средства. Предложенное средство обладает противовирусной активностью в отношении SARS-CoV-2, а также способностью продуцировать катионы нитрозония и может использоваться для лечения тяжелых форм вирусной пневмонии при COVID-19. 2 н. и 5 з.п. ф-лы, 3 ил., 2 табл., 7 пр.
1. Средство, обладающее противовирусной активностью в отношении SARS-CoV-2, а также способностью продуцировать катионы нитрозония, представляющее собой систему соединений, включающую координационное соединение железа, содержащее биядерную форму динитрозильного комплекса железа с глутатионовыми лигандами (Б-ДНКЖ-GSH) формулы [(GS-)2Fe2+2(NO)2(NO+)2]2+, и диэтилдитиокарбамат натрия (ДЭТК) при молярном соотношении Б-ДНКЖ-GSH : ДЭТК=1:1-5.
2. Средство по п. 1, отличающееся тем, что оно содержит Б-ДНКЖ-GSH и ДЭТК в виде водных растворов для ингаляции.
3. Средство по п. 2, отличающееся тем, что концентрация водного раствора Б-ДНКЖ-GSH для ингаляции составляет 5-20 мМ.
4. Средство по п. 3, отличающееся тем, что водный раствор Б-ДНКЖ-GSH для ингаляции хранится до применения при температуре не выше -18°С.
5. Средство по п. 2, отличающееся тем, что концентрация водного раствора ДЭТК для ингаляции составляет 10-50 мМ.
6. Средство по п. 5, отличающееся тем, что водный раствор ДЭТК для ингаляции хранится до применения в темноте при комнатной температуре.
7. Способ применения средства по любому из пп. 1-6, характеризующийся тем, что водный раствор Б-ДНКЖ-GSH размораживают и распыляют небулайзером в течение 30 мин, затем в течение 30 мин распыляют небулайзером водный раствор ДЭТК.
| US 20220193181 А1, 23.06.2022 | |||
| Средство для снижения риска и облегчения симптомов заражения бета-коронавирусной инфекцией | 2021 |
|
RU2747890C1 |
| VANIN A.F | |||
| et al., Gaseous Nitric Oxide and Dinirtosyl Iron Complexes with Thiol-Containing Ligands as Potential Medicines that Can Covid-19, Biophysics, 2021, v | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Канатное устройство для подъема и перемещения сыпучих и раздробленных тел | 1923 |
|
SU155A1 |
| ВАНИН А.Ф., Динитрозильные комплексы железа с тиолсодержащими лигандами могут как доноры катионов нитрозония | |||
Авторы
Даты
2023-06-07—Публикация
2022-06-27—Подача