Область техники
Изобретение относится к водорастворимым биядерным нитрозильным комплексам железа и может быть использовано в медицинской практике для создания лекарственных средств нового поколения для лечения онкологических заболеваний.
Предшествующий уровень техники
В последние годы с целью создания лекарственных препаратов нового поколения, применяемых в терапии онкологических заболеваний, ведется интенсивный поиск противоопухолевых средств на основе комплексов переходных металлов с улучшенным спектром активности и уменьшенными побочными эффектами по сравнению с уже используемыми клиническими препаратами, например цисплатином, нитропруссидом натрия и т.п.
Применение NO доноров как нового класса противоопухолевых агентов связано с важной ролью NO в процессе роста злокачественных образований [Wink D., Vodovoz J., Cook J., Biochemistry, 1998, 63, 7, pp. 948-957]. Показано, что монооксид азота изменяет уровень апоптоза опухолевых клеток, активность гена р53 и неоангиогенез [Brune B., Scheneiderhan N., Nitric oxide evoked p53-accumulation and apoptosis, Toxicol Letters, 2003, 193, 2, рр.19-23], подавляет активность ключевого белка репарации О6-метил-гуанин-ДНК-метил-трансферазы млекопитающих [L.Liu, M.Xu-Welliver, S.Kanagula, H.E.Pegg, Inactivation and degradation of O6-alkylguanine-DNA alkyltransferase after reaction with nitric oxide., Canser. Res., 2002, 62, рр.3037-3043]. Однако известные к настоящему времени синтетические NO-доноры различных классов (органические нитраты, диазониумдиолаты, нитрозотиолы и др.) не используются в качестве клинических терапевтических средств для лечения онкологических заболеваний, а применяются только для усиления (в различной мере, в зависимости от химической природы) действия существующих химиотерапевтических средств или радиотерапии [Wink D., Vodovoz J., Cook J., Biochemistry, 1998, 63, 7, pp. 948-957; N.P. Konovalova, S.A. Goncharova, L.M. Volkova, T.A. Raevskaya, L.T. Eremenko, A.M. Korolev, Nitric Oxide: Biology and Chemistry, 2003, 8, pp. 59-64; Yang, W., Rogers P.A., Ding H., J. Biol. Chem., 2002, 277, pp. 12868-12873; O. Siri, A. Tabard, P. Pullumbi, R. Guilard, Inorg. Chim. Acta 2003, 350, p. 633; J.L. Burgaud, E. Jngini, Del Soldato P. Ann, N.Y. Acad. Sci. 2002, 962, p.360; T. I. Karu, L. V. Pyatibrat, G. S. Kalendo, Toxicology Letters, 2001, 121, p.57].
С другой стороны, в последние 15 лет надежно установлено, что одной из форм природных резервуаров NO являются нитрозильные комплексы железа с серосодержащими лигандами. Такие соединения образуются в клетках в результате действия эндогенного NO на активные центры не гемовых железо-серных белков [Butler A.R., Megson I.I., Chem. Rev., 2002, 102, pp.1155-1165] и являются клеточным “депо” NO. Связывание NO с активными центрами металлоферментов, в частности, с негемовыми железосодержащими белками интенсивно изучается [Ford P.C., Lorkovic I.M., Chem.Rev., 2002, 102, 993; Hoshino M., Laverman L.E., Ford P.C., Coord. Chem. Rev., 1999, 187, р.75]. Их синтетические модели - эфиры “красной соли” Руссена - имеют состав [Fe2(SR)2(NO)4], где R=Et, t-Bu, (CH2)4-CH3, C6H5F, Ph [T. Thomas, J.H. Robertson, E.G. Cox, Acta. Crystalogr., 1958, 11, p.599; C. Glidewell, M.E. Harman, M.B. Hursthouse, I.L. Johnson, M. Motevalli, J. Chem.Res., 1998, 212, p.1676; R.E. Marsh, A.L. Spek, Acta. Crystalogr.,Sect.B.Struct.Sci., 2001, 57, p.800; C. Jinhua, M. Shaoping, H. Jinling, L. Jiaxi, Chinese J. Struct. Chem., 1983, 2, p. 263; T. B. Rauchfuss, T.D. Weatherill, Inorg. Chem., 1982, 21,pp. 827-830.]. Эти биядерные диамагнитные сера-нитрозильные комплексы µ-S типа с R=Alk генерируют NO при термо- или фотоактивации [J.L. Bourassa, P.C. Ford, Coord. Chem.Rev., 2000, 200-202, p.p. 887-900] и могут служить новыми перспективными противоопухолевыми NO-донирующими агентами. В работе A. Janczyk, et.all. Nitric Oxide, 2004, 10, 1, pp. 42-50 впервые изучено непосредственное цитотоксическое действие нитрозильного комплекса железа Na[Fe4S3(NO)7] на клетки меланомы человека и мыши. Однако этот нитрозильный комплекс железа генерирует NO только при фотоактивации, а также не может быть использован в качестве противоопухолевого лекарственного средства из-за высокой токсичности в отношении нормальных клеток.
Известны также биядерные парамагнитные сера-нитрозильные комплексы железа с ароматическими лигандами µ-N-C-S типа [Н.А. Санина, С.М. Алдошин ”Функциональные модели нитрозильных [Fe-S] протеинов”// Изв.АН.Сер.хим. (2004) 11 2326-2345; Н.А. Санина, С.М. Алдошин, Т.Н. Руднева, Н.И. Головина, Г.В. Шилов, Ю.М. Шульга, В.М. Мартыненко, Н.С. Ованесян. ”Синтез, структура и твердофазные превращения нитрозильного комплекса железа Na2[Fe2(S2O3)2(NO)4]∙4H2O”, Координационная Химия, 2005, 31, 301-306; N.A. Sanina, TN Rudneva, S.M. Aldoshin, G.V. Shilov, DV Korchagin, Yu.M. Shul'ga, V.M. Martinenko, N.S. Ovanesyan, “Influence of CH3 group in 1-methyl-imidazole-2-yl on the properties of binuclear sulfure-nitrosyl iron complex with the ligand of µ-N-C-S type”//Inorganica Chimica Acta (2006), 359, 2, 570-576; Н.А. Санина, Т.Н. Руднева, С. М. Алдошин, А. Н. Чехлов, Р. Б. Моргунов, Е. В. Курганова, Н. С. Ованесян, “Синтез, строение и NO-донорная активность парамагнитного комплекса [Fe2(SC3H5N2)2(NO)4] как модели нитрозильных [2Fe-2S] белков”//Известия Академии наук. Серия химическая, 1(2007) 28-34; А. F.Vanin, N.A. Sanina, V. A. Serezhenkov, D. Sh.Burbaev, V. I. Lozinsky and S. M. Aldoshin, Nitric oxide: biology & chemistry 2007, 16, 82-93], которые самопроизвольно генерируют NO в протонных средах и, как показали недавние исследования, могут использоваться как высокоэффертивные доноры NO в химиотерапии [Н.А. Санина, О.С. Жукова, З.С. Смирнова, Т.Н. Руднева, Г.В. Шилов, С.М. Алдошин “Биядерные нитрозильные комплексы железа с бензазагетероциклическими производными, способ их получения, донор монооксида азота, фармацевтическая композиция, содержащая их и их применение в качестве противоопухолевых лекарственных средств - заявка № PCT/RU2007/000286 от 30 мая 2007 г.; Н.А. Санина, О.С. Жукова, С.М. Алдошин, Н.С. Емельянова, Г.К. Герасимова, “Применение тетранитрозильного комплекса железа с тиофенолом в качестве противоопухолевого лекарственного средства и фармацевтические композиции и наборы, содержащие этот комплекс - заявка № РСТ/RU2007000285 от 30 мая 2007г.]. Однако их широкое применение в клинике ограничено их низкой растворимостью в воде и физиологических растворах. Таким образом, существует потребность в водорастворимых (а значит - и более биодоступных) противоопухолевых средствах с повышенной эффективностью и пониженной токсичностью. В работе [S.A.T. Dillinger, H.W.Schmalle, T.Fox, H.Berke, “Developing iron nitrosyl complexes as NO donor prodrugs”//Dalton Trans., (2007)3562-3571] описаны синтезы биядерных катионных нитрозильных комплексов железа с цистеамином состава [Fe(NO)2S(CH2)2NH3]2X2 (X=Cl, I): для получения основных продуктов требуется вести реакции в токсичном тетрагидрофуране с использованием многостадийно получаемых динитрозилов железа - Fe(CO)2(NO)2 или [Fe(NO)2I]2.
Задачей настоящего изобретения является расширение арсенала противоопухолевых средств и создание противоопухолевых препаратов на основе нитрозильных комплексов железа с улучшенным спектром активности и уменьшенными побочными эффектами, в частности водорастворимых биядерных нитрозильных комплексов железа с серосодержащими алифатическими лигандами природного происхождения (предпочтительно - цистеамин, пеницилламин), действующими как NO-доноры и обладающими повышенной активностью и пониженной токсичностью.
Краткое описание существа изобретения
В одном аспекте изобретение относится к новым водорастворимым биядерным катионным нитрозильным комплексам железа формулы [Fe2(SR)2(NO)4]SO4,
где R представляет собой серосодержащие алифатические лиганды природного происхождения, такие как цистеамин, пеницилламин, цистеин, S-сульфанилцистеин, различные цистеинсульфокислоты, N-ацетил-DL-пеницилламин, N-ацетилцистеин, тиогликолевая кислота, меркаптосукцииновая кислота, метионин, метионинсульфоксид, метионинсульфон, S-аденозилметионин, глютатион и др. Предпочтительно R представляет собой цистеамин или пеницилламин.
В другом аспекте изобретение относится к способу получения водорастворимых биядерных катионных нитрозильных комплексов железа с серосодержащими алифатическими лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4 обработкой водного раствора сульфата железа (II) соответствующим водорастворимым тиоамином в стехиометрическом соотношении в присутствии газообразного NO в кислой среде. Этот способ позволяет впервые получить заявляемые комплексы в кристаллической форме.
В дополнительном аспекте настоящее изобретение относится к донору моноокиси азота, представляющему собой биядерный нитрозильный комплекс железа с водорастворимыми серосодержащими алифатическими лигандами, охарактеризованный выше.
В следующем аспекте изобретение относится к индуктору апоптоза опухолевых клеток, представляющему собой биядерный нитрозильный комплекс железа с водорастворимыми серосодержащими алифатическими лигандами, охарактеризованный выше.
В следующем аспекте настоящее изобретение касается применения биядерных нитрозильных комплексов железа с серосодержащими алифатическими лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4 в качестве противоопухолевого лекарственного средства.
В дополнительном аспекте настоящее изобретение касается применения биядерных нитрозильных комплексов железа с серосодержащими алифатическими лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4 для получения противоопухолевых лекарственных средств.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество биядерного нитрозильного комплекса железа с серосодержащими алифатическими лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4 и фармацевтически приемлемый носитель.
В следующем аспекте настоящее изобретение относится к набору, применяемому для лечения онкологических заболеваний, содержащему (1) фармацевтическую композицию, включающую биядерный нитрозильный комплекс железа с серосодержащими алифатическими лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4, где R имеет вышеуказанные значения, в герметичной упаковке и (2) вспомогательные средства.
Описание фигур
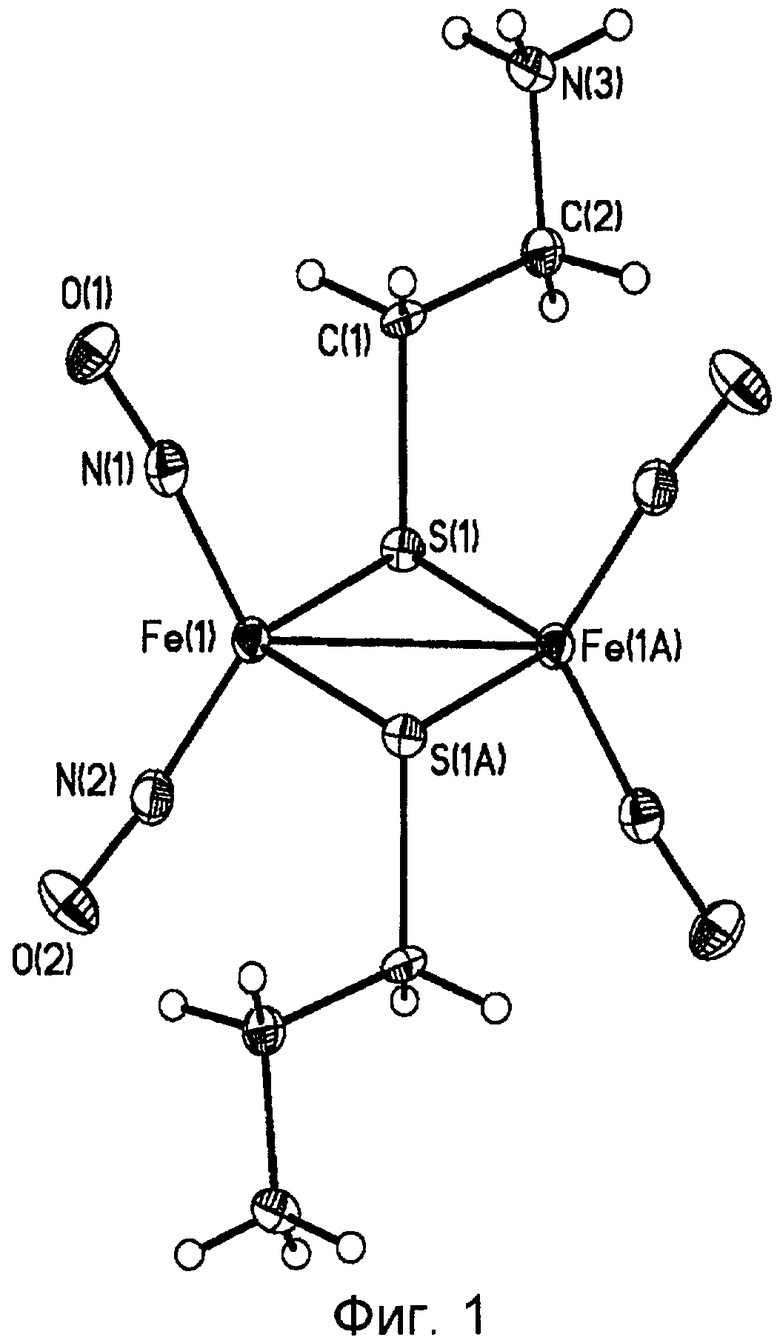
На фиг.1 представлена молекулярная структура комплекса [Fe2(S(CH2)2NH3)2(NO)4]SO4·2,5H2O (комплекса I ).
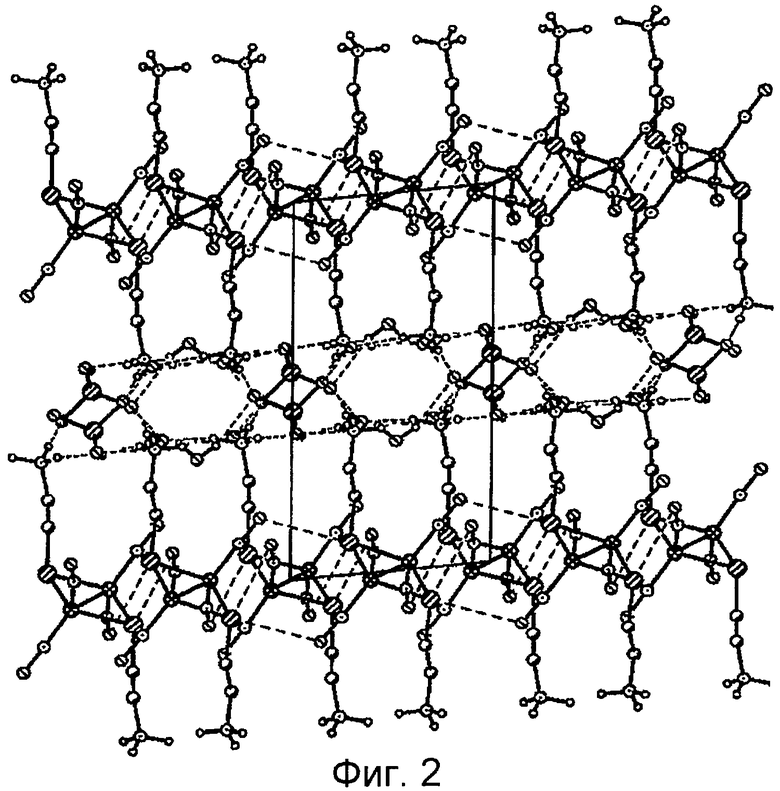
На фиг.2 представлена кристаллическая структура комплекса I .
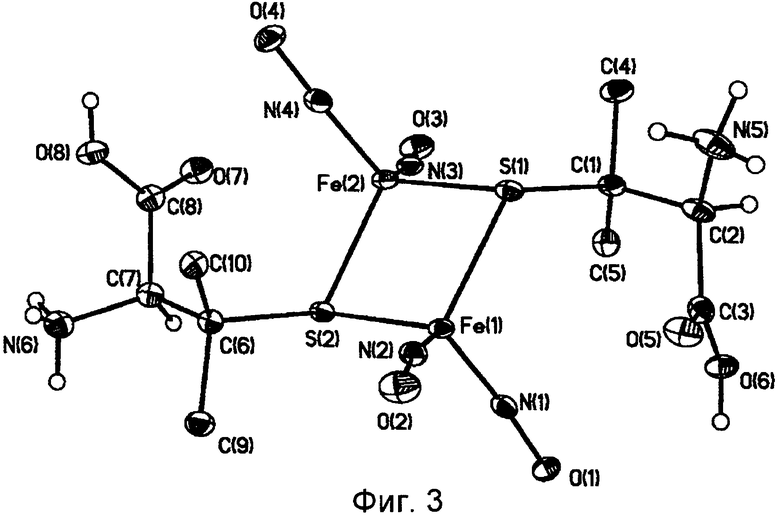
На фиг.3 представлена молекулярная структура комплекса [Fe2(S(C(CH3)2CH(NH3)COOH))2(NO)4]SO4·5H2O (комплекса II ).
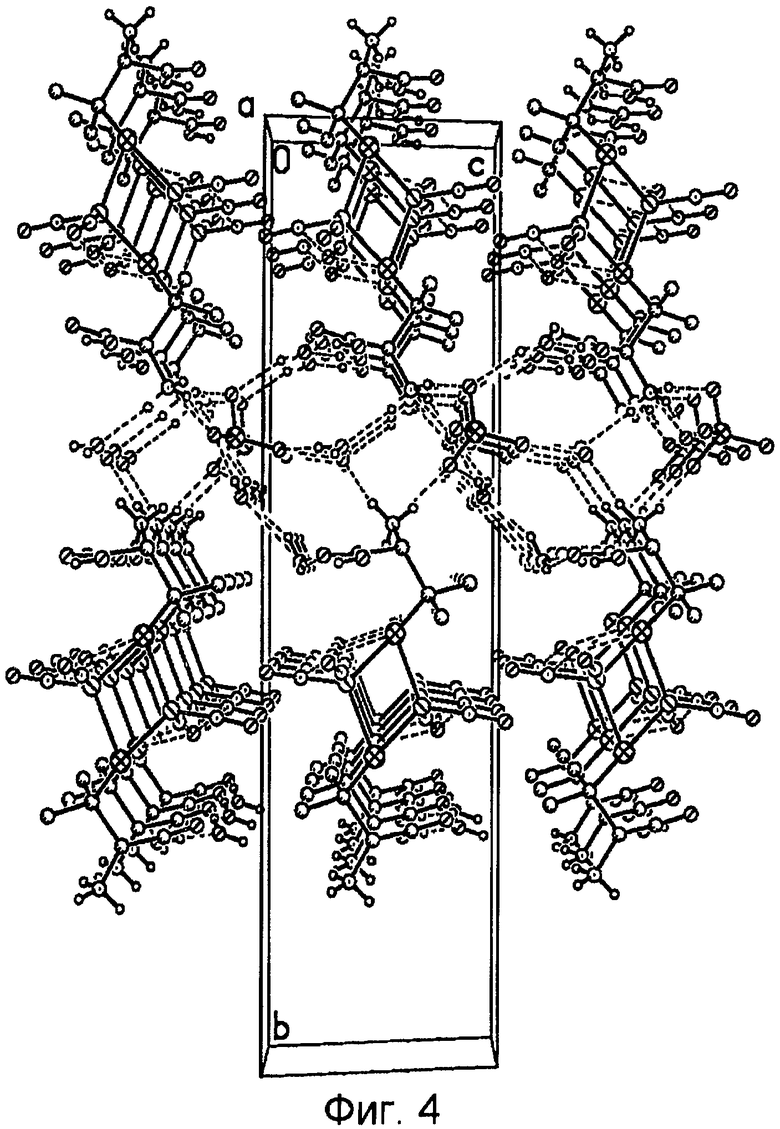
На фиг.4 представлена кристаллическая структура комплекса II .
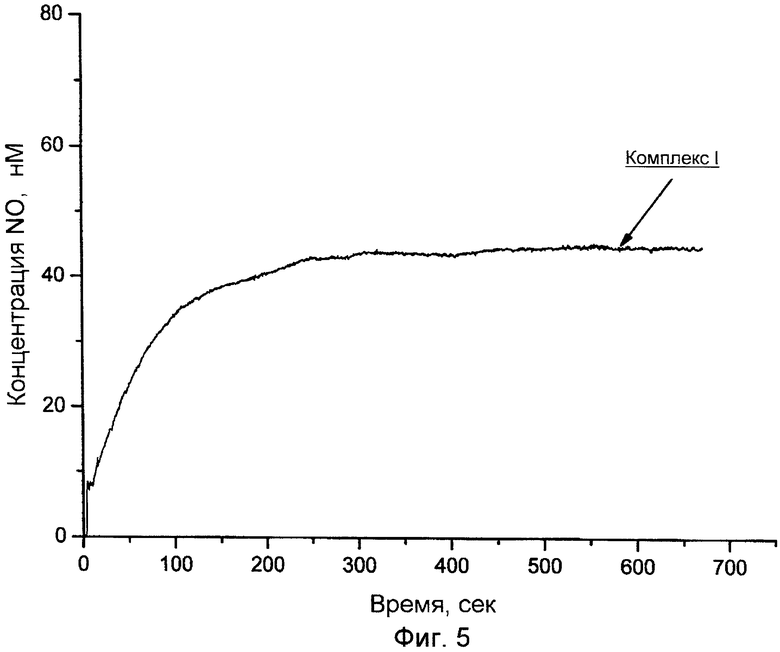
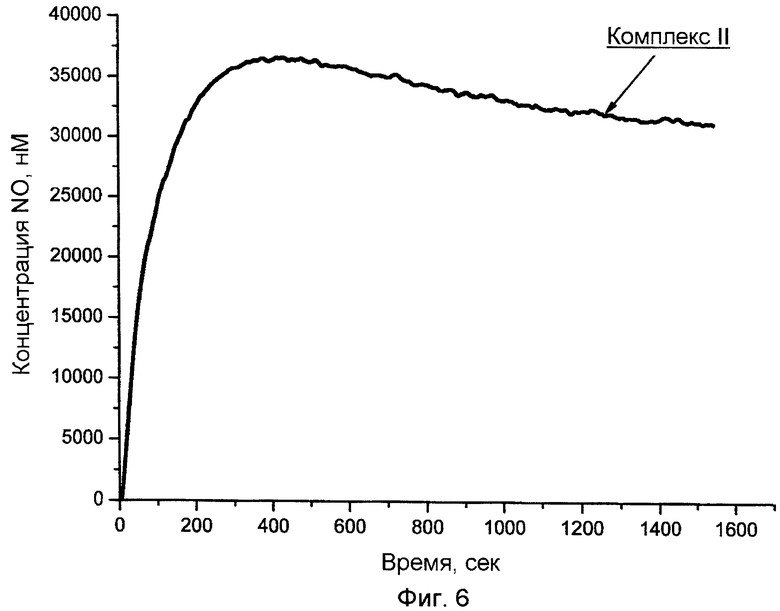
На фиг.5, 6 показаны зависимости концентрации NO от времени при разложении комплексов I и II (4·10-6М) в воде в анаэробных условиях при pH 6,25 и температуре 25°С.
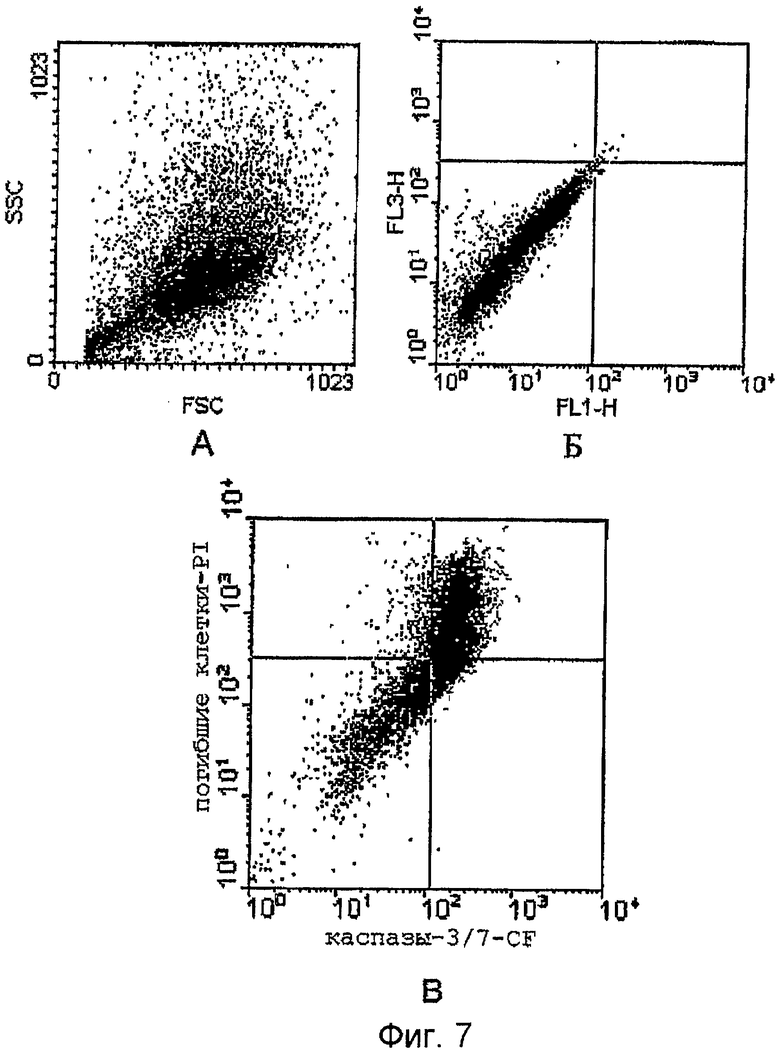
На фиг.7 представлен анализ флуоресцентного сигнала в I -50 индуцированных клетках: А - графическое изображение в координатах прямого (FSC) и поперечного (SSC) светорассеяния индуцированных неокрашенных клеток линии К-562 (контроль); Б - аутофлуоресценция индуцированных неокрашенных клеток; В - флуоресценция индуцированных окрашенных клеток.
Подробное описание изобретения
Новые биядерные катионные нитрозильные комплексы железа с водорастворимыми тиолилами, согласно настоящему изобретению, имеют общую формулу [Fe2(SR)2(NO)4]SO4, где R представляет собой серосодержащие алифатические лиганды природного происхождения, такие как цистеамин, пеницилламин, цистеин, S-сульфанилцистеин, различные цистеинсульфокислоты, N-ацетил-DL-пеницилламин, N-ацетилцистеин, тиогликолевая кислота, меркаптосукцииновая кислота, метионин, метионинсульфоксид, метионинсульфон, S-аденозилметионин, глютатион и др.
Предпочтительно R представляет собой цистеамин или пеницилламин.
В уровне техники отсутствуют сведения о заявляемых соединениях и способе их получения.
Способ получения новых биядерных нитрозильных комплексов железа с серосодержащими алифатическими лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4, где R имеет вышеуказанные значения, заключается в том, что водный раствор сульфата железа (II) обрабатывают соответствующим водорастворимым тиоамином в стехиометрическом соотношении в присутствии газообразного NO и процесс ведут в кислой среде с последующим выделением целевого продукта известными приемами.
Предпочтительно, процесс осуществляют при комнатной температуре, преимущественно при 18-25°С.
Предпочтительно, процесс ведут в бескислородной атмосфере.
В качестве водорастворимого тиоамина предпочтительно используют алифатические амины природного происхождения - цистеамин, пеницилламин.
Авторы изобретения установили, что биядерные нитрозильные комплексы железа с серосодержащими лигандами природного происхождения настоящего изобретения являются эффективными донорами NO, генерируя монооксид азота самопроизвольно при разложении в протонных средах (таких как вода, кровь и ее компоненты, физиологические растворы и т.п.), в отсутствие хемо-, фото- или ферментативной активации. Таким образом, комплексы по настоящему изобретению представляют собой новый перспективный класс доноров монооксида азота - синтетических аналогов активных участков нитрозильных негемовых железо-серных белков - природных “депо” NO. Поэтому настоящее изобретение в дополнительном аспекте относится к донорам монооксида азота, представляющим собой биядерные нитрозильные комплексы железа с водорастворимыми лигандами природного происхождения, представленные выше. Биядерные нитрозильные комплексы железа с лигандами природного происхождения настоящего изобретения обладают противоопухолевой активностью в отношении опухолевых клеток человека.
Авторы изобретения установили также, что биядерные нитрозильные комплексы железа с лигандами природного происхождения настоящего изобретения обладают апоптотической активностью в отношении опухолевых клеток. Поэтому настоящее изобретение в дополнительном аспекте относится к индукторам апоптоза опухолевых клеток, представляющим собой биядерные нитрозильные комплексы железа с водорастворимыми лигандами природного происхождения, представленные выше.
Настоящее изобретение далее направлено на применение биядерных нитрозильных комплексов железа формулы [Fe2(SR)2(NO)4]SO4, где R имеет вышеуказанные значения, в качестве противоопухолевого лекарственного средства. В частности, соединения настоящего изобретения могут быть использованы для лечения эритробластного лейкоза человека линии К562, рака яичников, аденокарциномы молочной железы Са -755, лимфолейкоза Р-388, меланомы B-16, эпидермоидной карциномы Льюиса. Комплексы железа согласно настоящему изобретению пригодны для ингибирования роста опухолей у млекопитающих, и их предпочтительно вводят в виде фармацевтической композиции, включающей эффективное противоопухолевое количество соединения согласно настоящему изобретению в комбинации с, по меньшей мере, одним фармацевтически или фармакологически приемлемым носителем и/или эксципиентом. Носитель, также известный из уровня техники как эксципиент, наполнитель, вспомогательное вещество, добавка или разбавитель, представляет собой любое вещество, которое фармацевтически инертно, придает соответствующую консистенцию или форму композиции и не ослабляет терапевтической эффективности противоопухолевых соединений. Носитель является ″фармацевтически или фармакологически приемлемым″, если он не вызывает побочной, аллергической или другой неблагоприятной реакции при введении млекопитающему или человеку соответственно.
Настоящее изобретение дополнительно предлагает фармацевтические композиции, содержащие эффективное количество биядерного нитрозильного комплекса железа с водорастворимыми лигандами природного происхождения формулы [Fe2(SR)2(NO)4]SO4, где R имеет вышеуказанные значения, и фармацевтически приемлемый носитель.
Предпочтительно, в качестве фармацевтически приемлемого носителя в композиции по изобретению используют протонсодержащую среду.
Предпочтительно, в качестве протонсодержащей среды используют воду, физиологический раствор, водорастворимые биополимеры.
Предпочтительно, биядерный нитрозильный комплекс железа с водорастворимыми лигандами природного происхождения присутствует в композиции в количестве 50-100 мкМ.
Фармацевтические композиции, содержащие противоопухлевые соединения согласно настоящему изобретению, могут быть получены любым обычным способом. Необходимая препаративная форма выбирается в зависимости от выбранного способа введения. Композиции согласно изобретению могут быть приготовлены для любого способа введения так, чтобы ткань-мишень была доступна при таком пути введения. Пригодные пути введения включают, но не ограничены ими, пероральное, парентеральное (например, внутривенное, внутриартериальное, подкожное, ректальное, внутримышечное, интраорбитальное, интракапсулярное, интраспинальное, интраперитонеальное или интрастернальное), локальное (назальное, чрескожное, внутриглазное), внутривезикулярное, внутриоболочечное, в тонкую кишку, легочное, интралимфатическое, внутриполостное, вагинальное, трасуретральное, интрадермальное, ушное, интрамаммарное, трансбуккальное, ортотопическое, внутритрахеальное, внутриочаговое, чрескожное, эндоскопическое, чресслизистое, подъязычное и кишечное введение.
Фармацевтически приемлемые носители для использования в композициях согласно настоящему изобретению хорошо известны специалисту, и их выбирают в зависимости от ряда факторов: используемое конкретное противоопухолевое соединение и его концентрация, стабильность и ожидаемая биологическая доступность; заболевание, нарушение или состояние человека, которого лечат композицией; субъект, его возраст, вес и общее состояние; и способ введения. Пригодные носители легко определяются специалистом [J.G. Nairn в: Remington′s Pharmaceutical Science (изд. A. Gennaro), Mack Publishing Co., Easton, Pa, 1985, р.р. 1492-1517].
Композиции предпочтительно получают в виде таблеток, диспергирующихся порошков, пилюль, капсул, желатиновых капсул, каплет с покрытием, гелей, липосом, гранул, растворов, суспензий, эмульсий, сиропов, эликсиров, пастилок, драже, лепешек или любой другой лекарственной формы, которая может быть введена перорально. Композиции согласно настоящему изобретению для перорального введения включают эффективное противоопухолевое количество соединения согласно изобретению в фармацевтически приемлемом носителе. Пригодные носители для твердых дозированных форм включают сахара, крахмалы и другие обычные вещества, включающие лактозу, тальк, сахарозу, желатин, карбоксиметилцеллюлозу, агар, манит, сорбит, фосфат кальция, карбонат кальция, карбонат натрия, каолин, альгиновую кислоту, гуммиарабик, кукурузный крахмал, картофельный крахмал, сахаринат натрия, карбонат магния, трагакант, микрокристаллическую целлюлозу, коллоидный диоксид кремния, натрийкроскармеллозу, тальк, стеарат магния и стеариновую кислоту. Далее, такие твердые лекарственные формы могут быть без покрытия или могут быть с нанесенным известными способами покрытием, например, для задержки разрушения и абсорбции. Противоопухолевые соединения, согласно настоящему изобретению, также предпочтительно используют для приготовления дозированной формы для парентерального введения, например, в виде дозированной формы для инъекции внутривенным, внутриартериальным, подкожным, ректальным, внутримышечным, интраорбитальным, интракапсулярным, интраспинальным, интраперитонеальным или интрастериальным путями. Композиции согласно изобретению для парентерального введения включают эффективное противоопухолевое количество противоопухолевого соединения в фармацевтически приемлемом носителе. Пригодные для парентерального введения лекарственные формы включают растворы, суспензии, дисперсии, эмульсии или любую другую лекарственную форму, которая может быть введена парентерально. Методики и композиции для получения парентеральных лекарственных форм известны из уровня техники.
В композиции согласно изобретению может быть включено для различных целей незначительное количество дополнительных компонентов, хорошо известных в фармацевтической промышленности. Эти компоненты большей частью придают свойства, которые увеличивают время удерживания противоопухолевого соединения в месте введения, способствуют стабильности композиции, обеспечивают регулирование значения рН, облегчают введение противоопухолевого соединения в фармацевтические композиции, и т. п. Каждый из этих компонентов индивидуально присутствует в количестве предпочтительно меньше чем примерно 15 масс.%, более предпочтительно меньше чем примерно 5 масс.%, и наиболее предпочтительно меньше чем примерно 0,5 масс.%, в расчете на общую массу композиции. Некоторые компоненты, такие как наполнители или разбавители, могут составлять вплоть до 90 масс.%, в расчете на общую массу композиции, как хорошо известно в технологии приготовления лекарственных средств. Такие добавки включают криозащитные компоненты для предотвращения осаждения комплекса железа, поверхностно-активные вещества, смачивающие или эмульгирующие агенты (как, например, лецитин, полисорбат-80, Твин® 80, плюроник-60, полиоксиэтиленстеарат), консерванты (как, например, этил-п-гидроксибензоат), предохраняющие от воздействия микробов средства (как, например, бензиловый спирт, фенол, м-крезол, хлорбутанол, сорбиновая кислота, тимеросал и парабен), агенты для регулирования значения рН или буферирующие агенты (как, например, кислоты, основания, ацетет натрия, сорбитан-монолаурат), компоненты для регулирования осмомолярности (как, например, глицерин), загустители (как, например, моностеарат алюминия, стеариновая кислота, цетиловый спирт, стеариловый спирт, гуаровая смола, метилцеллюлоза, гидроксипропилцеллюлоза, тристеарин, сложные цетиловые эфиры воска, полиэтиленгликоль), пигменты, красители, добавки, придающие текучесть, нелетучие силиконы (как, например, циклометикон), глины (как, например, бентониты), адгезивы, увеличивающие объем агенты, ароматизаторы, подслащивающие вещества, адсорбенты, наполнители (как, например, вода, солевой раствор, растворы электролитов), связующие (как, например, вода, солевой раствор, растворы электролитов), связующие (как, например, крахмалы, такие, как кукурузный крахмал, пшеничный крахмал, рисовый крахмал или картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза, поливинилпирролидон, сахара, полимеры, гуммиарабик), разрыхляющие агенты (как, например, крахмалы, такие, как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал или карбоксиметилкрахмал, структурированный поливинилпирролидон, агар, альгиновая кислота или ее соль, такая, как альгинат натрия, натрийкроскармеллоза или кросповидон), смазывающие агенты (как, например, диоксид кремния, тальк, стеариновая кислота или ее соли, такие, как стеарат магния, или полиэтиленгликоль), агенты для покрытий (как, например, концентрированные растворы сахара, включающие гуммиарабик, тальк, поливинилпирролидон, карбополгель, полиэтиленгликоль или диоксид титана) и антиоксиданты (как, например, метабисульфит натрия, бисульфит натрия, сульфит натрия, декстроза, фенолы и тиофенолы).
Также предпочтительным является, чтобы противоопухолевое соединение имело значение ID100 (то есть концентрация лекарственного средств, вызывающая 100%-ное ингибирование образования колонии), по меньшей мере, в 4 раза меньше, чем цисплатин, при проведении измерения в соответствии с методикой, описанной в [«Экспериментальная оценка противоопухолевых препаратов в СССР и США». /Под ред. З.П. Софьиной, А.Б. Сыркина (СССР), А. Голдина, А. Кляйна (США). М.: «Медицина», 1979 с.71-105].
Введение дозированной формы указанными путями может быть непрерывным или периодическим, зависящим, например, от физиологического состояния пациентов, от того, является ли цель введения терапевтической или профилактической, и других факторов, известных или оцениваемых практикующим врачом.
Доза и схемы введения фармацевтических композиций согласно изобретению могут быть легко определены онкологом. Понятно, что доза противоопухолевых соединений зависит от возраста, пола, состояния здоровья и веса реципиента, типа проводимого одновременно лечения, если оно имеется, частоты обработки и природы желаемого эффекта. Для любого способа введения точное количество используемого противоопухолевого соединения, а также назначаемая доза, необходимая для достижения описанных здесь полезных воздействий, также зависит, в частности, от таких факторов, как биодоступность противоопухолевого соединения, заболевание человека, которое лечат, желаемая терапевтическая доза, и других факторов, которые очевидны специалисту.
Концентрация противоопухолевого соединения в жидкой фармацевтической композиции составляет наиболее предпочтительно 50-100 мкМ. Как правило, предпочтительны относительно низкие концентрации, так как противоопухолевое соединение наиболее растворимо при низких концентрациях.
Растворы для перантерального введения могут быть приготовлены растворением противоопухолевого соединения в воде и других протонсодержащих средах (солевые растворы, растворы сахаров, водорастворимые полимеры, белки, растворы электролитов) для парентерального введения пациенту.
Так, например, для жидких препаративных форм в качестве носителя обычно используют воду, солевые растворы, растворы декстрозы (например, DW5), растворы электролитов или любую другую протонную, фармацевтически приемлемую среду.
Предпочтительно, в качестве фармацевтически приемлемого носителя в настоящем изобретении можно использовать протонсодержащие среды, такие как вода, солевые растворы, водорастворимые полимеры, белки, растворы декстрозы (например, DW5), растворы электролитов или спиртов из каталога “PAA Laboratory's” (2006) р.26.
В следующем аспекте настоящего изобретения предлагается набор для лечения онкологических заболеваний, который включает (1) фармацевтическую композицию, содержащую биядерный нитрозильный комплекса железа с серосодержащими лигандами природного происхождения настоящего изобретения, в герметичной упаковке и (2) вспомогательные средства.
Набор может содержать композицию в виде единичной дозированной формы или в виде множественных доз. Набор может включать формы для перорального или парентерального введения.
Фармацевтическая композиция в наборе может быть помещена в стеклянные или полимерные пузырьки, ампулы, флаконы, дозированные картриджи для инъекторов, блистеры, капсулы, пакетики с композицией, применяемые соответственно для пероральной или парентеральной формы.
Вспомогательные средства включают жидкости для восстановления композиции, вводимой парентерально, если она в наборе представлена в концентрированной форме, например, в виде сухого вещества, высушенного препарата и т.п.; средства для получения пероральных жидких форм и форм для инъекций ex tempore. В качестве жидкости для восстановления может быть использована вода для инъекций, физиологический раствор, раствор лидокаина и т.п. Для восстановления композиции, применяемой в жидком виде перорально, может быть использован раствор глюкозы, сахаров, сиропы и т.п. Необязательные вспомогательные средства набора включают средства для вскрытия укупорок, средства для герметизации вскрытых многоразовых укупорок, вкладыши-инструкции.
Фармацевтическая композиция, представляющая собой твердую дозированную форму для перорального введения, может быть представлена в наборе в виде таблеток, капсул в блистерах, ампулах, флаконах, пузырьках, пакетиках и т.п. Фармацевтическая композиция, представляющая собой жидкую дозированную форму для парентерального или перорального введения, может быть представлена в наборе во флаконах, капсулах, ампулах, картриджах и т.п.
Пример набора для парентерального введения включает упаковку, в которой размещены инструкции по применению, ампулы или флаконы с сухой композицией и ампулы с физиологическим раствором для инъекций. В упаковку вкладывается приспособление для вскрытия ампул. Ампулы упакованы в блистеры по 10 ампул.
Другие варианты набора очевидны для специалиста в данной области из представленного выше описания.
Следующие примеры приводятся только как дополнительная иллюстрация изобретения и их не следует рассматривать в качестве ограничения изобретения.
Примеры синтеза комплексов
Пример 1
Сульфат ди-μ-цистеаминтетранитрозилдижелеза (Fe 2 S 3 N 6 C 4 H 19 O 10,5 ) (I) получен реакцией растворенного в воде сульфата железа (II) c раствором цистеамин гидрохлорида. Дистиллированная вода, используемая в синтезе, требует предварительной подготовки для удаления растворенного в ней кислорода. Для этого через склянку с дистиллированной водой пропускают ток инертного газа (аргона либо азота) в течение 30 минут. 0,84 г (3 ммоль) семиводного сульфата железа растворили в 12 мл подготовленной дистиллированной воды. К этому раствору добавили 0,40 г (3,5 ммоль) цистеамин гидрохлорида, растворенного в 8 мл воды. Через получившийся раствор пропускали ток монооксида азота, полученного по методике [Ю.В. Карякин и И.И. Ангелов. Чистые химические вещества. М.: Химия, 1974, 23] в течение 1-1,5 часов при ~40оС до образования в растворе кристаллов. Реакционную смесь затем выдерживали при 6-8°С в течение 15-20 ч, образовавшийся мелкий кристаллический осадок коричнево-красного цвета отфильтровывали и сушили на воздухе в течение суток. Выход составил 0,143 мг (16,5%). Комплекс хорошо растворим в воде и ДМСО, хуже в метаноле, в других органических растворителях (этанол, ТГФ, гептан, ацетонитрил, эфир и т.д.) не растворяется. Поликристаллы этого комплекса довольно устойчивы и сохраняются на воздухе при комнатной температуре довольно длительное время.
Найдено, %: Fe, 21,57; S, 18,39; N, 16,34; C, 9,40; H, 2,38.
Вычислено, %: Fe=21,58; S=18,50; N=16,18; C=9,25, О=32,37; H=2,12.
ИК-спектр (в таблетках KBr), (см-1): 3454 (ср.), 3003 (слаб.), 2927 (слаб.), 1769 (силн.), 1727 (силн.), 1461 (слаб.), 1385 (ср.), 1340 (ср.), 1266 (ср.), 1120 (силн.), 770 (слаб.), 620 (силн.). ν NO: 1769 и 1727 см-1.
Пример 2
Сульфат ди-μ-пеницилламинтетранитрозилдижелеза (Fe 2 S 3 N 6 C 10 H 32 O 17 ) (II) получен реакцией сульфата железа (II) c D-пеницилламином в соотношении 1:3. Реакция проводилась с использованием стандартной вакуумной линии и технологии Шленка в атмосфере аргона при комнатной температуре. Из воды предварительно удалялся кислород методом трехкратной заморозки и откачки в вакууме. К сухой смеси, содержащей 0,42 г (1,5 ммоль) семиводного сульфата железа и 0,68 г (4,5 ммоль) D-пеницилламина, приливали 10 мл подготовленной воды. Через образовавшийся раствор темно-фиолетового цвета пропускали оксид азота, полученный по известной методике [Ю.В. Карякин и И.И. Ангелов. Чистые химические вещества. М.: Химия, 1974, 23]. В ходе реакции раствор приобретал темно-красную окраску. Через 10-12 минут на стенках реакционного сосуда появлялись мелкие игольчатые кристаллы красного цвета, постепенно заполняющие весь объем раствора. Их фильтровали в вакууме и сушили под аргоном. Выход составил: 98 мг (11,3%). Полученный продукт стабилен в отсутствие инертной атмосферы в течение длительного времени. Оставшийся маточный раствор выдерживали еще трое суток при температуре 6-8°С. Полученные таким образом красно-оранжевые игольчатые кристаллы были пригодны для рентгено-структурного анализа (РСА).
Найдено, %: Fe,15,62; S,13,34; N,11,89; C,16,80, H,4,62.
Вычислено, %: Fe=15,64; S=13,42; N=11,72; C=16,76, О=37,99; H=4,47.
ИК-спектр (в таблетках KBr), (см-1): 1771 (силн.), 1723 (силн.), 1626 (ср.), 1375 (ср.), 1337 (ср.), 1269 (ср.), 1189 (ср.), 1114 (ср.), 1089 (ср.), 746 (ср.). νNO: 1771 и 1723 см-1.
Рентгенодифракционный анализ комплексов I и II выполнен на диффрактометре SMART APEX2 CCD (Bruker) [λ(MoKα)=0,71072Å, ω-scans, 2θ<56°] при 100.
Кристаллографические данные и основные параметры уточнения представлены в таблицах 1, 2. Межатомные расстояния и углы представлены в таблицах 3, 4. Кристаллохимические параметры депозитированы в Кембриджском кристаллографическом банке даны (CCDC для I -663194, для II -680286).
Кристаллографические данные и характеристики анализа для комплекса
I
Кристаллографические данные и характеристики анализа для комплекса
II
Межатомные расстояния и валентные углы в структуре комплекса
I
Межатомные расстояния и валентные углы в структуре комплекса
II
Молекулярные структуры комплексов I и II представлены на фиг.1 и 3 соответственно. Согласно данным РСА I одна молекула сульфатной соли дикатиона [Fe2(S(CH)2NH3)2(NO)4]2+ кристаллизуется с 2,5 молекулами воды. В кристаллической структуре I два независимых дикатиона (оба центросимметричны), в которых атомы железа связаны с двумя атомами азота нитрозильных лигандов и двумя атомами μ-S протонированных цистеаминовых лигандов. Последние характеризуются антиперипланарной конформацией с торсионными углами SCCN, равными 169,1° и 179,8°. Атомы железа кроме связи Fe(1)-Fe(1A) находятся в немного искаженной тетраэдрической конфигурации с максимальным отклонением угла NO-Fe-NO до 121,3(2)°. Хотя геометрия двух независимых дикатионов почти идентична, расстояния Fe…Fe в них немного отличаются и равняются 2,672 (1) и 2,682 (1) Å. Отклонение от линейности связей Fe-NO в среднем около 10°. С одной стороны это может быть результатом только геометрии четырехчленного кольца Fe2S2. Надо заметить, что расстояние Fe…Fe в таких комплексах довольно чувствительно к эффектам кристаллической упаковки и, например, в вышеупомянутом йодиде равна 2,715 (1) Å.
На одну молекулу дикатиона комплекса II приходится сульфатный анион и 5 молекул воды. Дикатион имеет центросимметричную димерную биядерную структуру, где два тетраэдрически координированных атома железа связаны с двумя NO группами и двумя пеницилламиновыми тиолилами. Между собой атомы железа связаны через фрагмент μ-S пеницилламиновых лигандов. Расстояние Fe(1)-Fe(2) составляет 2,7088(6).
Суммируя данные анализа геометрии дикатиона, можно сделать вывод о том, что структура комплексов I и II относится к структурному типу эфиров красной соли Руссена [Н.А. Санина, С.М. Алдошин, Изв. АН. Сер. Хим., 2004, 11, 2326]. Принимая во внимание факт, что комплексы I и II являются диамагнитными, довольно малое расстояние Fe…Fe может указывать на наличие связи между атомами железа.
Кристаллические структуры комплексов I и II представлены на фиг.2 и 4 соответственно.
Исследование NO-донорной активности комплексов I и II
Для определения NO, генерируемого комплексами I и II в воде, использовали сенсорный электрод “amiNO-700” системы “inNO Nitric Oxide Measuring System” (Innovative Insruments, Inc., Tampa, FL, USA). Концентрацию NO фиксировали в течение ~1600 секунд (с шагом 0,2 сек) c концентрацией донора NO (0.1 мкмоль). Для калибровки электрохимического сенсора использовали стандартный водный раствор NaNO2 (100 мкмоль), который добавляли в смесь 0,12М KI и 2 мл 1M H2SO4 в 18 мл воды. Все эксперименты проводили в аэробных растворах при температуре 25°С. pH растворов измеряли с помощью мембранного pH-метра “HI 8314” (HANNA instruments, Germany).
Установлено, что комплексы I и II генерируют NO в аэробных водных растворах самопроизвольно, т.е. в отсутствие хемо-, фото- или ферментативной активации (фиг.5, 6). В отличие от биядерных нитрозильных комплексов железа с ароматическими тиолилами, комплексы I и II выделяют NO пролонгированно.
Исследование цитотоксичности водорастворимых комплексов железа I и II на опухолевых клетках человека in vitro
В качестве объекта исследования использовали клетки эритробластного лейкоза человека линии К562 и немелкоклеточного рака легкого А549. Клетки выращивали на среде RPMI1640, содержащей 10% эмбриональную сыворотку теленка при 37°С, 5% СО2 и 100% влажности.
Тестирование цитотоксической активности проводили стандартным МТТ-тестом с использованием 96-луночных планшет. Плотность посадки клеток составила 5000 клеток в лунке. Клетки К562 и А549 инкубировали с комплексами I и II в концентрациях 1 мкМ, 10 мкМ или 100 мкМ в течение 72 часов.
МТТ-тест основан на способности дегидрогеназ живых клеток восстанавливать неокрашенный МТТ-реагент в виде синих кристаллов формазана, растворимых в ДМСО. Оптическое поглощение окрашенных растворов ДМСО измеряли на автоматическом счетчике. Цитотоксическую активность оценивали в % по выживаемости клеток и вычисляли по формуле: (среднее значение оптического поглощения в опытных пробах/среднее поглощение в контроле) х 100. ИК50 определяли по кривой «доза-эффект».
Исследование цитотоксической активности нитрозильного комплексов железа I и II на клетках линии К562 и А549 выявило прямую зависимость выживаемости клеток от концентрации I и II . Значения ИК50 для I составило 50 мкМ, для II 100 мкМ.
Исследование апоптотической активности водорастворимых комплексов железа на опухолевых клетках
Метод определения активности каспаз основан на использовании флуорохромных ингибиторов каспаз (FLICA). Эти ингибиторы способны проникать в клетку и при этом не являются цитотоксичными. Внутри клетки FLICA-ингибитор ковалентно связывается с активной каспазой. Для реактивов (китов), флуоресцирующих в зеленой области спектра, используют меченный ингибитор каспаз - карбоксифлуоресцеин флуорометил кетон пептид.
Для тестирования апоптотических клеток в экспериментах был использован леофилизированный реактив FAM-DEVD-FMK для определения каспазы-3 и каспазы-7. При добавлении к популяции клеток FAM-DEVD-FMK проникает в каждую клетку, ковалентно связывается с большой субъединицей активного каспазного гетеродимера и таким образом ингибирует ферментативную активность. Реагент, ковалентно связанный с ферментом, остается внутри клетки. Часть несвязанного реагента диффундирует из клетки и может быть удалена промыванием. Оставшийся зеленый флуоресцентный сигнал прямо зависит от количества активных каспазных ферментов, которые присутствовали в клетке в момент добавления реагента.
Рабочий раствор реагента получали добавлением к леофилизированному реактиву FAM-DEVD-FMK 50 мкл ДМСО (150х тест), а затем 200 мкл раствора фосфатного буфера до получения 30х теста.
Для удаления несвязанного реагента FAM-DEVD-FMK использовали предоставленный фирмой ICT 10х Буфер для промывания клеток. Для экспериментов использовали разведенный дистиллированной водой 1х буфер.
Для экспериментов клетки рассевали во флаконы с плотностью 500 тыс. клеток в мл. Индуцированные клетки получали инкубацией в течение 72 часов с нитрозильными комплексами I и II в эквимолярной концентрации 50 мкМ, близкой к ИК50 для всех комплексов.
В качестве отрицательного контроля использовали неиндуцированные неокрашенные клетки и FLICA-клетки, а также индуцированные неокрашенные клетки.
По окончании срока инкубации клетки центрифугировали в течение 5 минут при 1200 об/минуту при комнатной температуре (КТ). Осадок клеток ресуспендировали в 300 мкл среды, добавляли 10 мкл 30× FLICA и инкубировали в течение 1 часа при 37°С и 5% СО2. По окончании инкубации пробы центрифугировали, удаляли супернатант. Затем дважды промывали осадок клеток 1× Буфером (2 мл и 1 мл). Осадок клеток ресуспендировали в 900 мкл 1× Буфера. Отбирали аликвоты образцов индуцированных и неиндуцированных клеток, добавляли 2 мкл готового для использования фирменного реагента пропидий йодида (PI) и инкубировали при КТ в течение 10 минут для окрашивания погибших клеток.
Флуоресценцию всех образцов клеток анализировали на жидкостном цитометре BACKTON Dikenson Fascalibur с использованием лазера с длиной волны 488 нм. Результаты получали в виде распределения флуоресцентного сигнала окрашенных клеток в канале FL1 (зеленая область FLICA) и FL3 (красная область PI). В левом нижнем квадранте определяются живые клетки; в правом нижнем - позитивные FLICA клетки (FLICA+); в левом верхнем - окрашенные PI клетки; в правом верхнем - окрашенные PI и FLICA+ клетки. Графическое изображение клеток в каналах получали с помощью программы Дот-Плот. Количественную оценку результатов осуществляли с использованием программы WinMDA версия 2/8 и выражали в виде содержания окрашенных и неокрашенных клеток по отношению к общему числу клеток в %.
Исследованный нитрозильный комплекс I проявил способность инициировать активность каспазы 3 и 7 и, таким образом, индуцировать апоптоз в клетках эритробластного лейкоза человека линии К562. При этом в присутствии комплекса I зарегистрировано 77% клеток в апоптозе (фиг.7).
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЯДЕРНЫЕ НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА С БЕНЗАЗАГЕТЕРОЦИКЛИЧЕСКИМИ ПРОИЗВОДНЫМИ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2441872C2 |
| ПРИМЕНЕНИЕ ТЕТРАНИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА С ТИОФЕНОЛОМ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2007 |
|
RU2429242C2 |
| МОНОЯДЕРНЫЕ ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА, СПОСОБ ПОЛУЧЕНИЯ МОНОЯДЕРНЫХ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА, ДОНОР МОНООКСИДА АЗОТА, ПРИМЕНЕНИЕ МОНОЯДЕРНОГО ДИНИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2011 |
|
RU2494104C2 |
| ПРИМЕНЕНИЕ БИЯДЕРНОГО СЕРА-НИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА КАТИОННОГО ТИПА В КАЧЕСТВЕ ВАЗОДИЛАТАТОРНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2010 |
|
RU2460531C2 |
| Супрамолекулярные ансамбли динитрозильных комплексов железа, способ их получения, доноры монооксида азота, ингибиторы фосфодиэстераз, применение супрамолекулярных ансамблей динитрозильных комплексов железа в качестве противовоспалительных лекарственных средств | 2023 |
|
RU2814108C1 |
| МОНОЯДЕРНЫЕ КАТИОННЫЕ ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДОНОР МОНОКСИДА АЗОТА | 2014 |
|
RU2567245C1 |
| ПРИМЕНЕНИЕ БИЯДЕРНОГО СЕРА-НИТРОЗИЛЬНОГО КОМПЛЕКСА ЖЕЛЕЗА АНИОННОГО ТИПА В КАЧЕСТВЕ ВАЗОДИЛАТАТОРНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2010 |
|
RU2437667C1 |
| Применение нитрозильного комплекса железа с N,N-диэтилтиомочевиной в качестве нового NO-донорного противоопухолевого средства | 2016 |
|
RU2687269C2 |
| АПОПТОЗИНДУЦИРУЮЩИЕ СРЕДСТВА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2709498C1 |
| Средство, обладающее противовирусной активностью в отношении SARS-CoV-2, и способ его применения | 2022 |
|
RU2797619C1 |
Изобретение относится к биядерному катионному нитрозильному комплексу железа с природными алифатическими тиолилами общей формулы [Fe2(SR)2(NO)4]SO4, где R представляет собой алифатические лиганды природного происхождения. Также предложены способ получения биядерного катионного нитрозильного комплекса железа, донор монооксида азота, индуктор апоптоза опухолевых клеток, применение биядерного катионного нитрозильного комплекса железа, фармацевтическая композиция и набор, применяемый для лечения онкологических заболеваний. Технический результат заключается в получении биядерного катионного нитрозильного комплекса железа, обладающего цитотоксической, апоптотической и NO-донорной активностью. 8 н. и 7 з.п. ф-лы, 4 табл., 7 ил.
1. Биядерный катионный нитрозильный комплекс железа с природными алифатическими тиолилами общей формулы [Fe2(SR)2(NO)4]SO4, где R представляет собой алифатические лиганды природного происхождения.
2. Биядерный катионный нитрозильный комплекс железа по п.1, где R представляет собой цистеамин или пеницилламин.
3. Способ получения биядерных катионных нитрозильных комплексов железа по п.1, заключающийся в том, что водный раствор сульфата железа (II) обрабатывают соответствующим водорастворимым тиоамином в присутствии газообразного NO в кислой среде.
4. Способ п.3, отличающийся тем, что процесс ведут при комнатной температуре, преимущественно при 18-25°С.
5. Способ п.3, отличающийся тем, что процесс ведут в бескислородной атмосфере.
6. Способ п.3, отличающийся тем, что в качестве тиоамина используют цистеамин или пеницилламин.
7. Донор монооксида азота, представляющий собой биядерный катионный нитрозильный комплекс железа по п.1.
8. Индуктор апоптоза опухолевых клеток, представляющий собой биядерный катионный нитрозильный комплекс железа по п.1.
9. Применение биядерного катионного нитрозильного комплекса железа по п.1 в качестве противоопухолевого лекарственного средства.
10. Применение биядерного катионного нитрозильного комплекса железа по п.1 для получения противоопухолевого лекарственного средства.
11. Фармацевтическая композиция, содержащая эффективное количество биядерного катионного нитрозильного комплекса железа по п.1 и фармацевтически приемлемый носитель, в качестве противоопухолевого агента.
12. Фармацевтическая композиция по п.11, где в качестве фармацевтически приемлемого носителя используют протонсодержащую среду.
13. Фармацевтическая композиция по п.12, где в качестве протонсодержащей среды используют воду, физиологический раствор, водорастворимые биополимеры.
14. Фармацевтическая композиция по п.11, где биядерный катионный нитрозильный комплекс железа присутствует в количестве 50-100 мкМ.
15. Набор, применяемый для лечения онкологических заболеваний, включающий (1) фармацевтическую композицию, содержащую биядерный катионный нитрозильный комплекс железа по п.1, в герметичной упаковке и (2) вспомогательные компоненты.
| SIMONA COSTANZO et al, RE-EXAMINATION OF THE FORMATION OF DINITROSYL-IRON COMPLEXES DURING REACTION OF S-NITROSOTHIOLS WITH Fe(II), INORGANICA СHIМIСА ACTA, 2001, v.318, p.1-7 | |||
| ВАНИН А.Ф | |||
| Динитрозильные комплексы железа и S-нитрозотиолы - две возможные формы стабилизации и транспорта оксида азота в биосистемах | |||
| Биохимия, 1998, т.63, вып.7, с.924-938 | |||
| RU 2291880 С1, 20.01.2007 | |||
| СПОСОБ ЛЕЧЕНИЯ ТРОМБОЗОВ ВЕН СЕТЧАТКИ С ПОМОЩЬЮ ДОНОРОВ И ИНГИБИТОРОВ ОКСИДА АЗОТА | 2002 |
|
RU2223072C2 |
Авторы
Даты
2012-02-10—Публикация
2008-06-02—Подача