Предпосылки создания изобретения
Область, к которой относится изобретение
Настоящее изобретение относится к новым гидрогеназам, выделенным из новых штаммов, принадлежащих к роду Thermococcus; к генам, кодирующим указанные гидрогеназы; и к способам получения водорода с использованием штаммов, имеющих указанные гены.
Предшествующий уровень техники
Энергетическая ценность водорода привлекает внимание специалистов как источник энергии нового поколения, который может заменить ископаемое топливо, поскольку его теплотворная способность на единицу массы по меньшей мере в три раза превышает теплотворную способность нефтяного топлива, но при этом это топливо не выделяет веществ, которые могут оказывать негативное воздействие на окружающую среду, например таких, как двуокись углерода, NOx и SOx.
Традиционные способы получения водорода включают электролиз воды и термокрекинг или конверсию природного газа или сырой нефти (лигроина) с водяным паром. Однако осуществление этих способов сталкивается с определенными проблемами, заключающимися в том, что обработка ископаемого топлива должна проводиться при высоких температурах и высоком давлении. Кроме того, при осуществлении этих методов образуются смешанные газы, содержащие монооксид углерода, что требует применения сложных технологий по удалению монооксида углерода из смешанных газов.
С другой стороны, биологические способы получения водорода с использованием микроорганизмов имеют преимущества, заключающиеся в том, что они могут быть осуществлены в условиях, не требующих высоких температур и высокого давления, путем подведения отдельной энергии, а также в том, что вырабатываемые при этом газы не содержат монооксида углерода. Такие биологические способы получения водорода могут быть грубо разделены на способы на основе фотосинтезирующих микроорганизмов и способы на основе не-фотосинтезирующих микроорганизмов (главным образом, анаэробных микроорганизмов). Примером первого из вышеупомянутых способов является способ, описанный в Корейском патенте рег. No. 10-0680624, озаглавленном «Способ получения водорода с использованием фотосинтезирующих бактерий штамма Rhodobacter sphaeroides, обладающего высокой продуктивностью водорода при высокой концентрации соли».
Однако технология культивирования фотосинтезирующих бактерий при высокой концентрации соли с использованием света в качестве источника энергии пока еще недостаточно разработана, и используемые ранее фотосинтезирующие бактерии имеют тот недостаток, что в них ингибирование субстрата затрудняется при высоком парциальном давлении субстрата. Кроме того, указанные бактерии имеют тот недостаток, что их способность продуцировать водород может поддерживаться только под действием света.
Поэтому до сих пор продолжают предприниматься попытки разработать способ получения водорода с использованием микроорганизмов, которые могут продуцировать водород, используя органический углерод, и примеры таких способов описаны в Корейском патенте рег. No. 10-0315663, озаглавленном «Citrobacter sp. Y19 и получение водорода с использованием этого микроорганизма», и в Корейском патенте рег. No. 10-0315662, озаглавленном «Rhodopseduomonas palustris P4 и получение водорода с использованием этого микроорганизма».
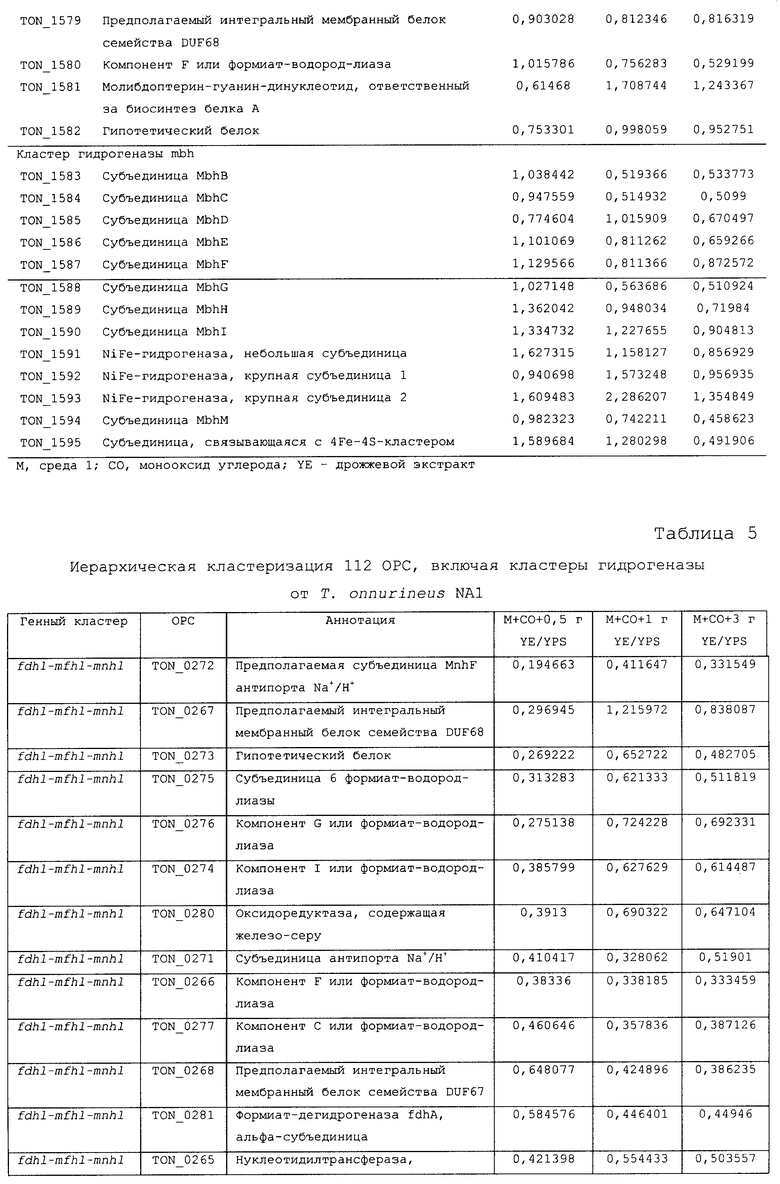
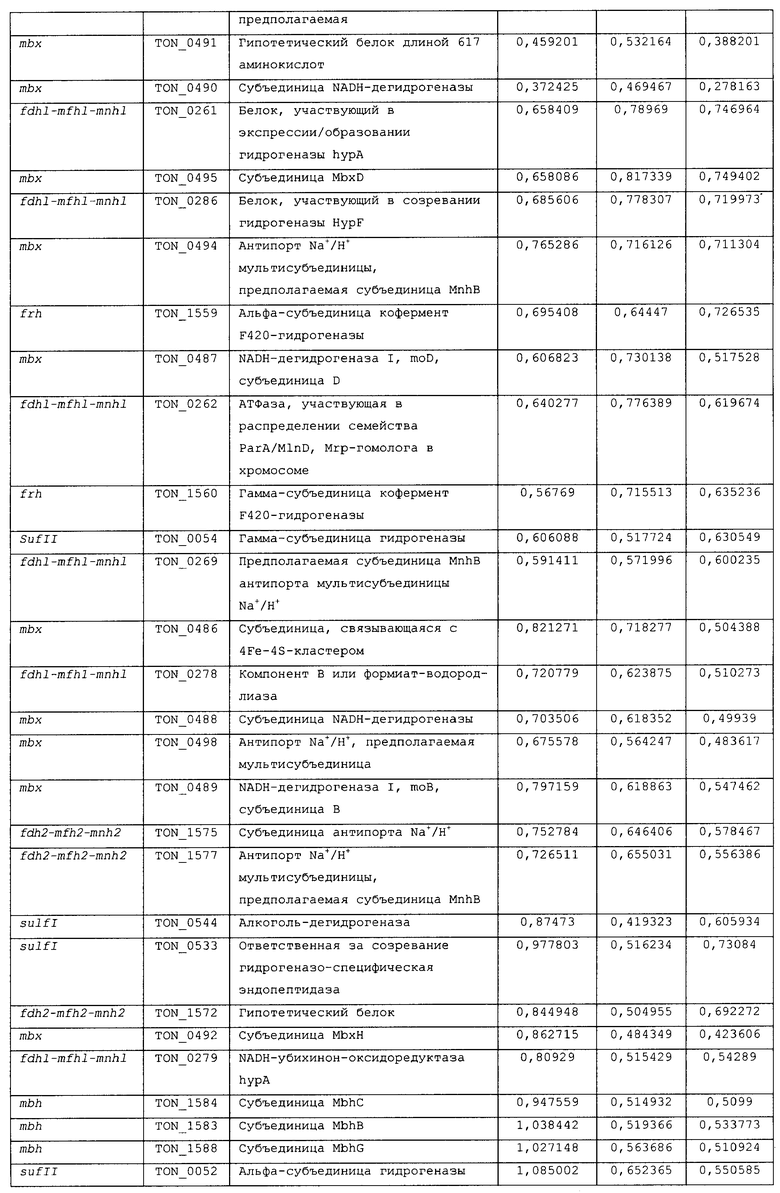
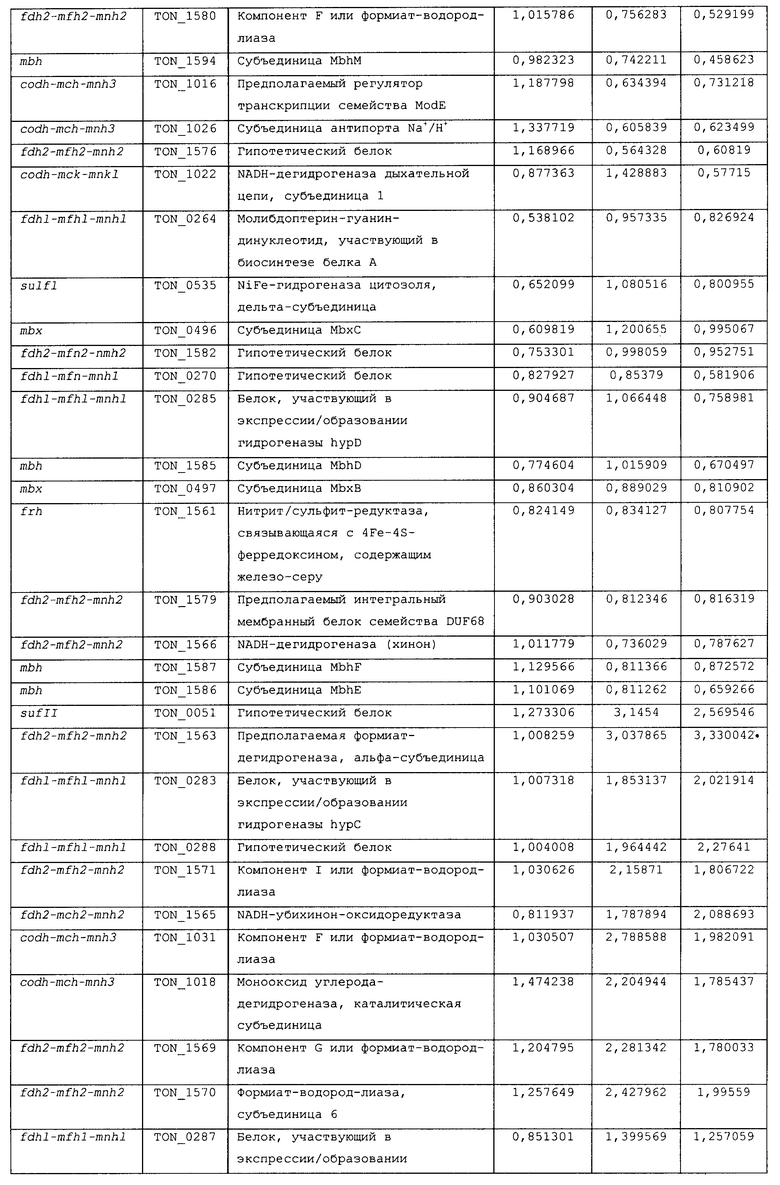
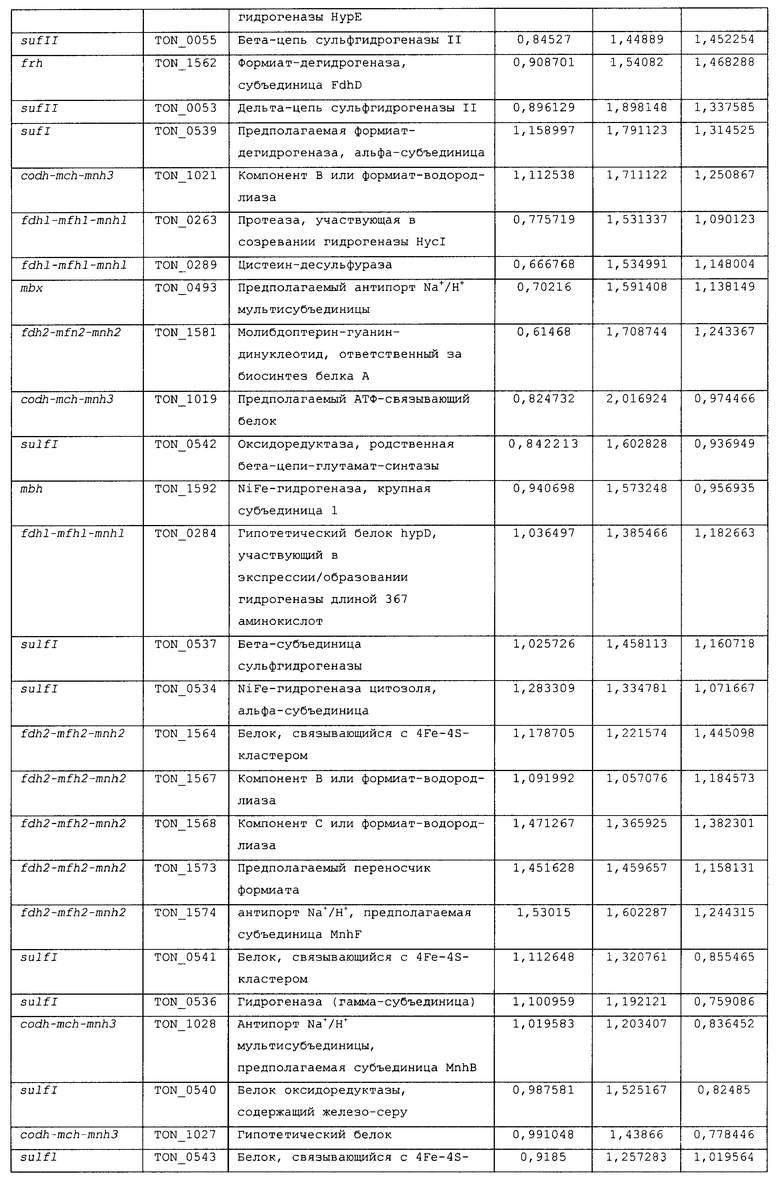
Ранее, то есть, 5 сентября 2008 года, авторами настоящего изобретения была подана патентная заявка (заявка на патент Кореи рег. No. 10-2008-0087794), относящаяся к новым белкам, выделенным из новых гипертермофильных Thermococcus onnurineus NA1 (рег. №: КСТС 10859ВР), и к генам, кодирующим такие белки, и настоящее изобретение, в частности, относится к тем генам и белкам из числа уже описанных в настоящей заявке, которые связаны с продуцированием водорода. Авторами настоящего изобретения были проведены эксперименты по оценке способности вышеописанного штамма продуцировать водород, и в результате этих экспериментов было обнаружено, что вышеуказанный штамм продуцирует большое количество водорода даже в условиях высоких температур, и кроме того, были обнаружены новые гидрогеназы, которые в высокой степени экспрессируются, в частности, в условиях культивирования с добавлением монооксида углерода (СО) или формиата, что послужило основой для создания настоящего изобретения.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение гидрогеназ, выделеных из гипертермофильных микроорганизмов Thermococcus spp., которые могут продуцировать водород даже в условиях высоких температур; и генов, кодирующих указанные гидрогеназы; а также разработка эффективных способов получения водорода с использованием штаммов, имеющих указанные гены.
Для достижения этих целей было разработано настоящее изобретение, которое относится к гидрогеназам, выделенным из штамма Thermococcus spp., способного продуцировать водород в аэробных условиях культивирования, и к генам, кодирующим указанные гидрогеназы. Кроме того, настоящее изобретение относится к способу получения водорода путем культивирования указанного штамма и к способу получения водорода с использованием указанных генов.
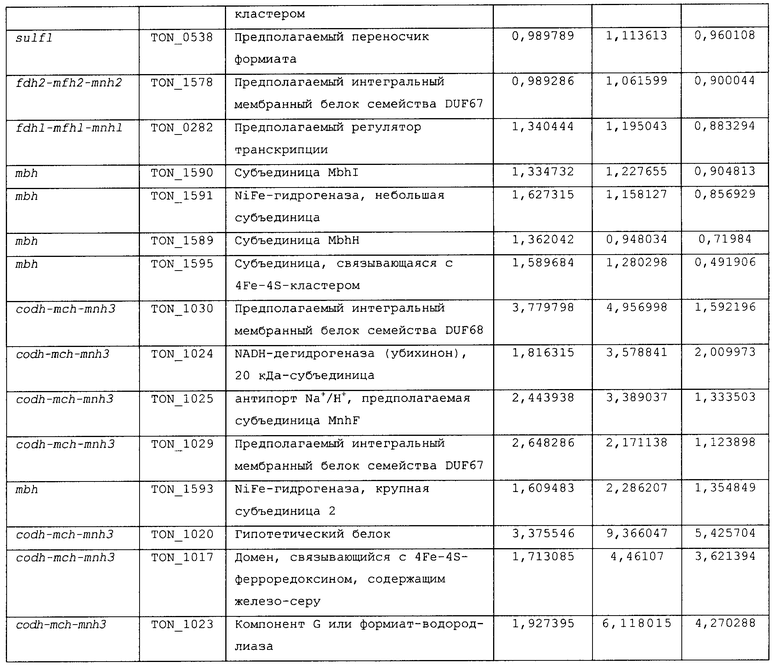
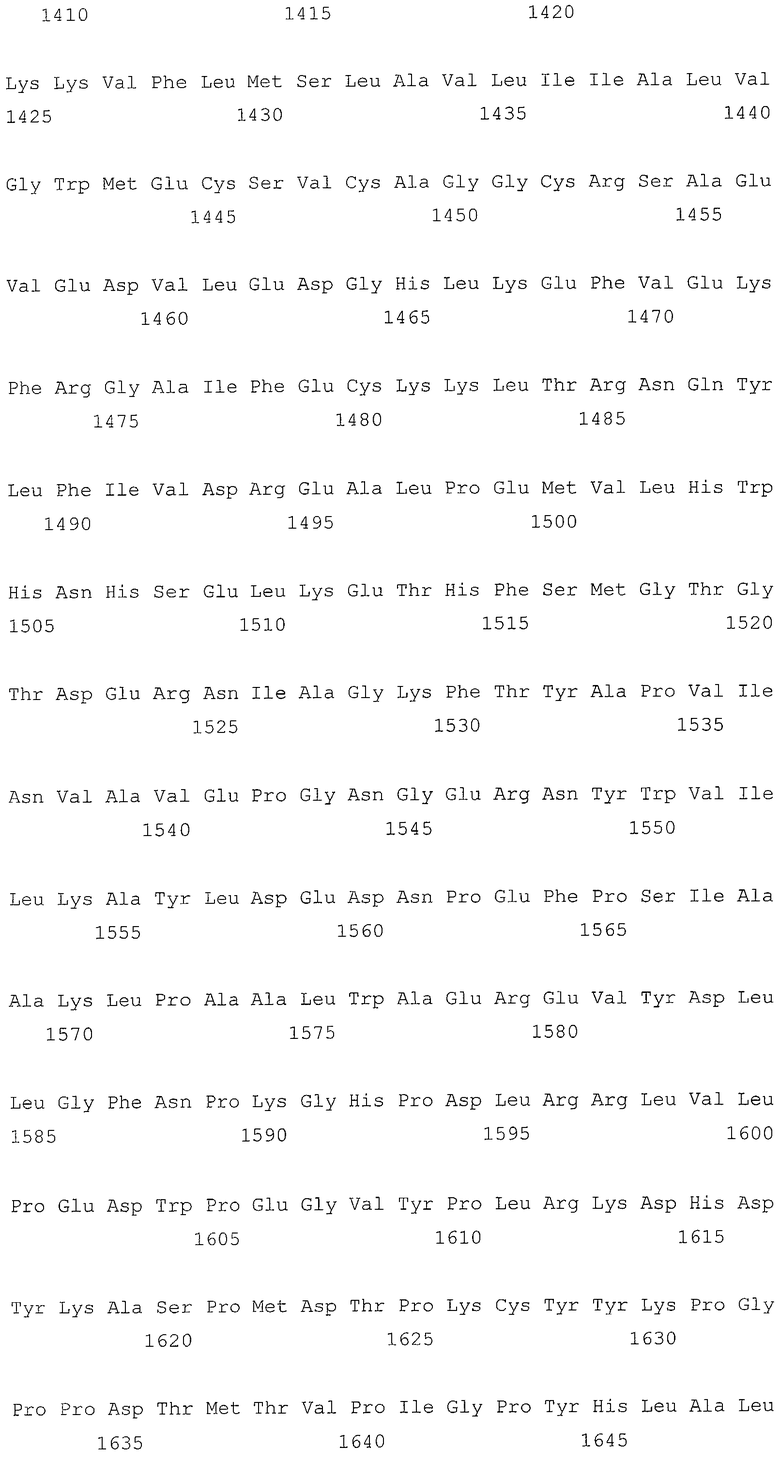
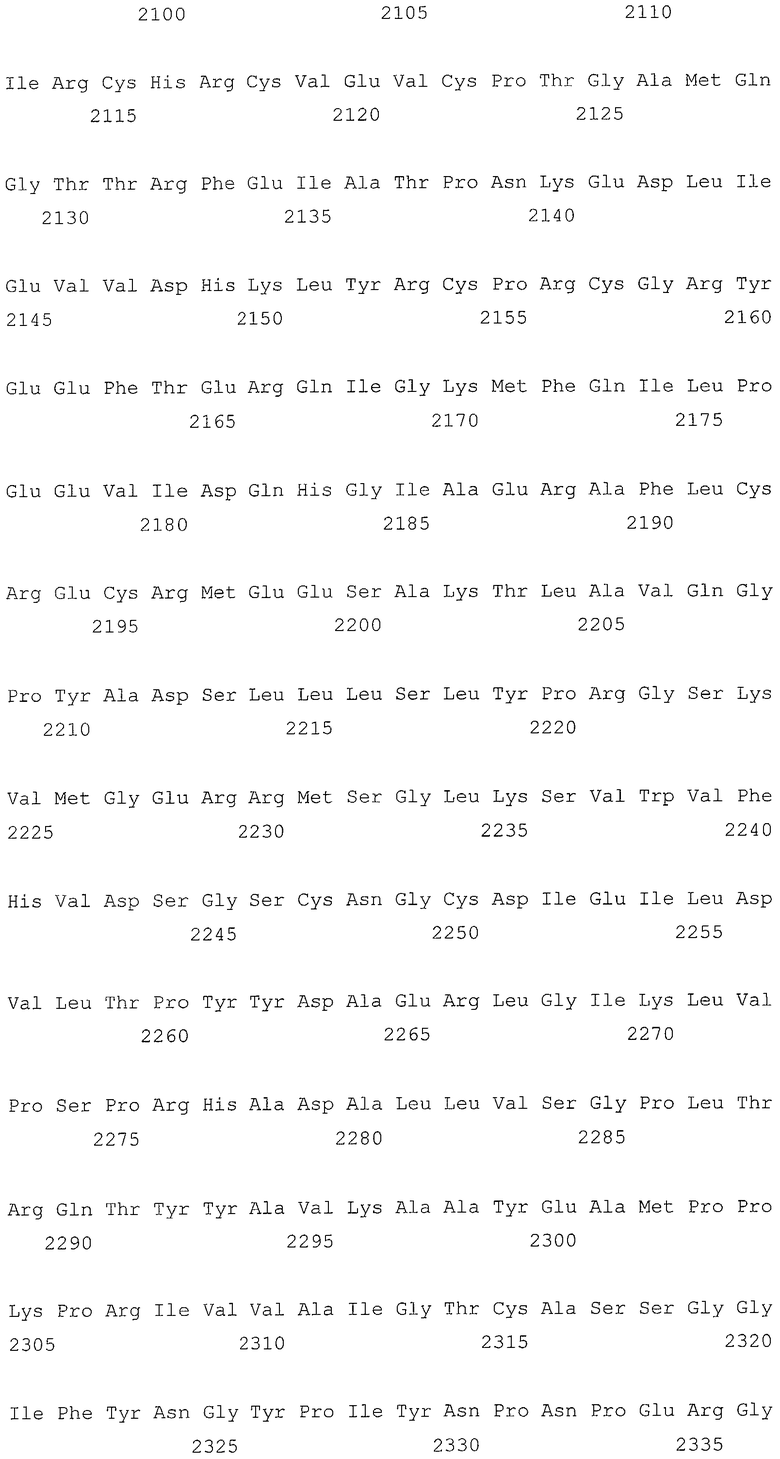
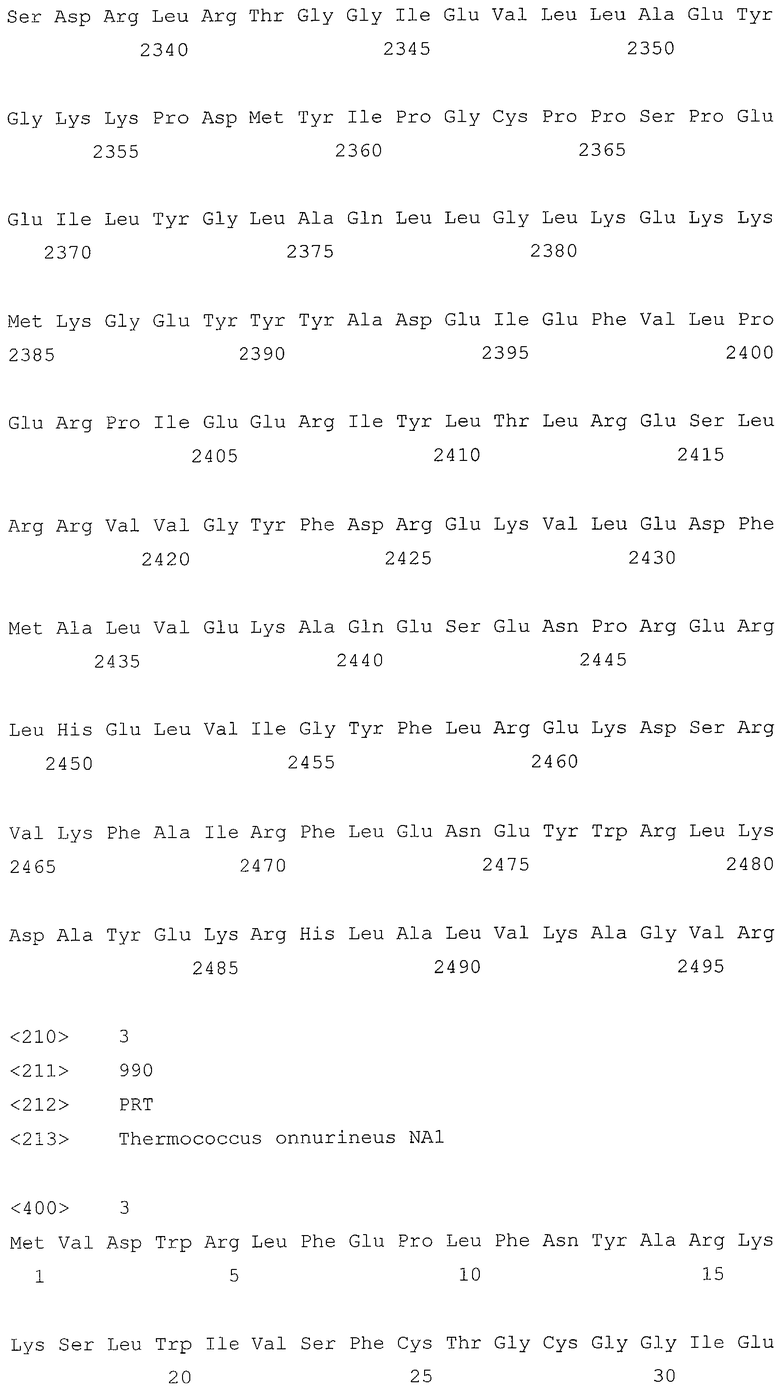
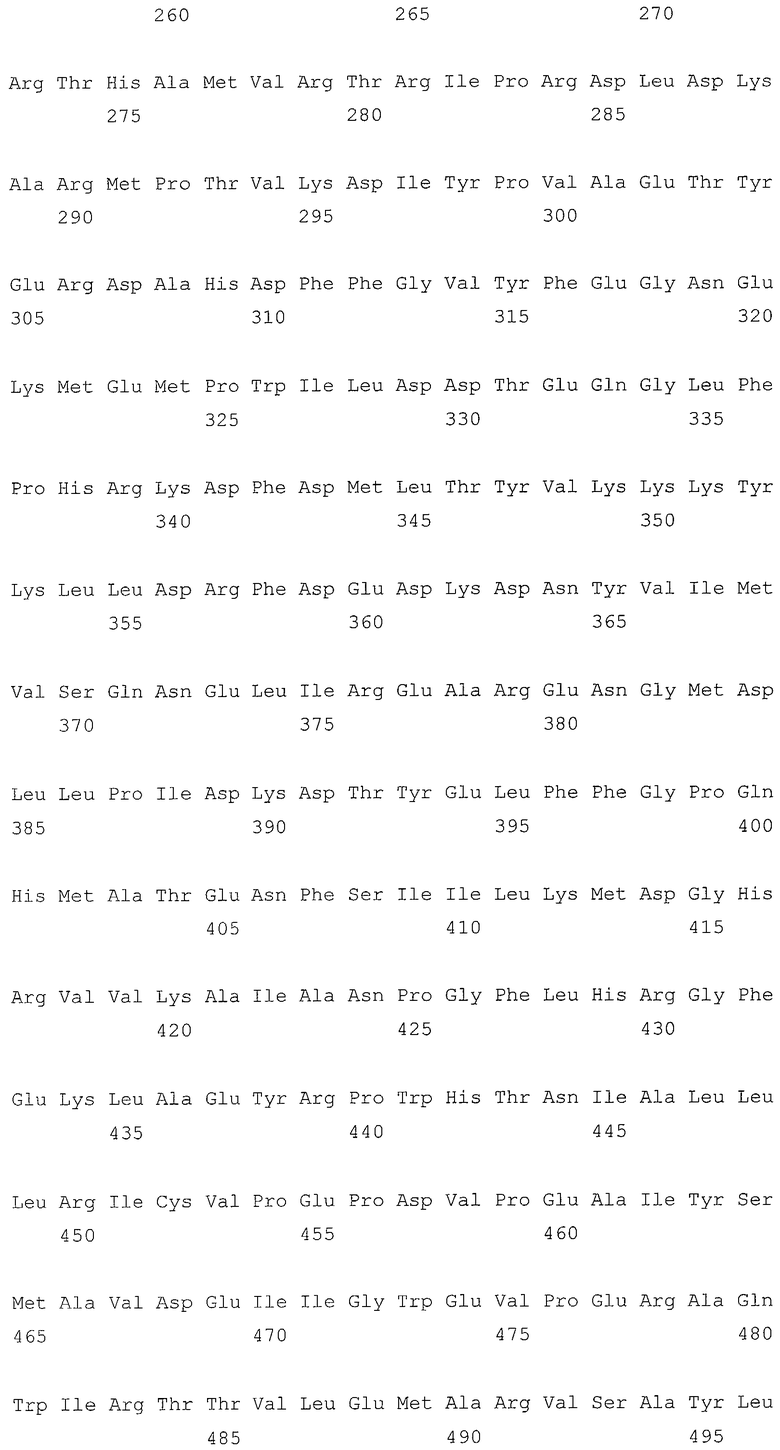
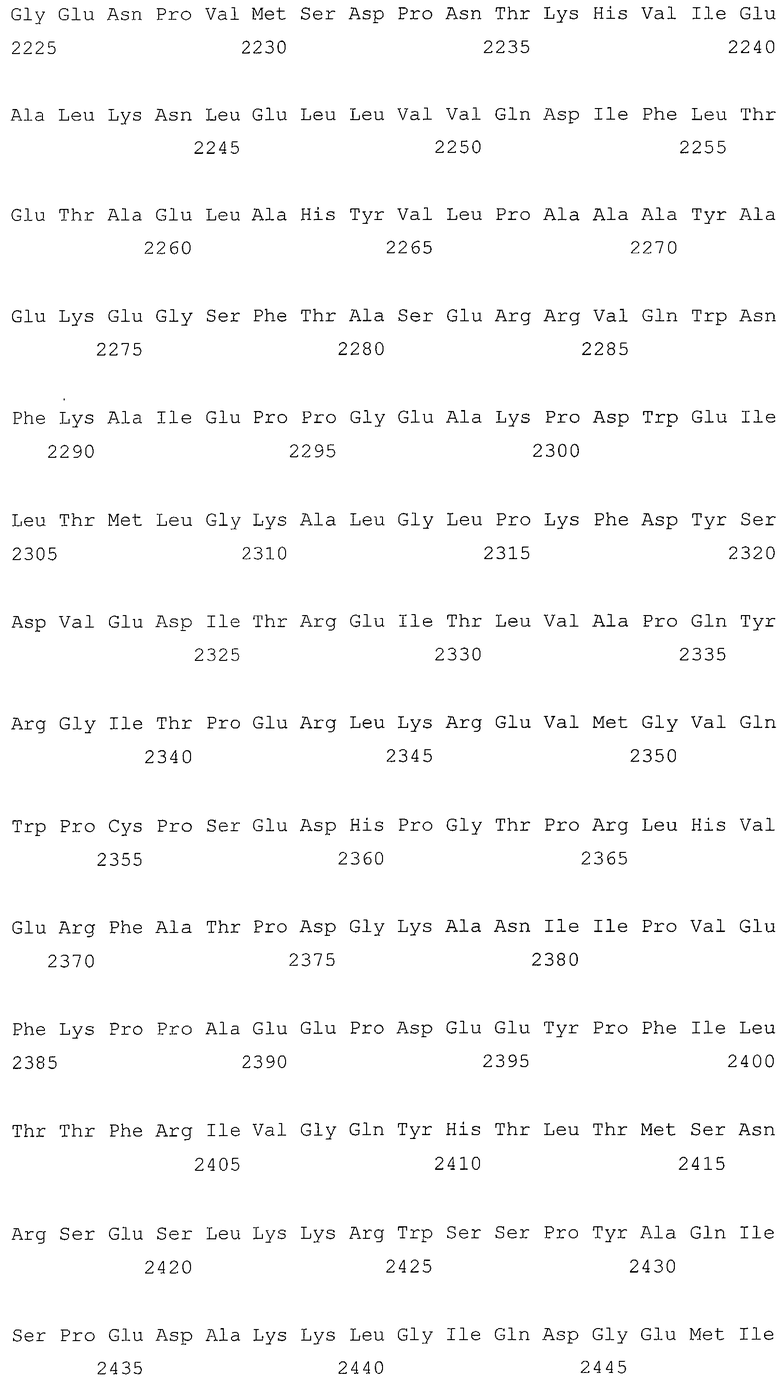
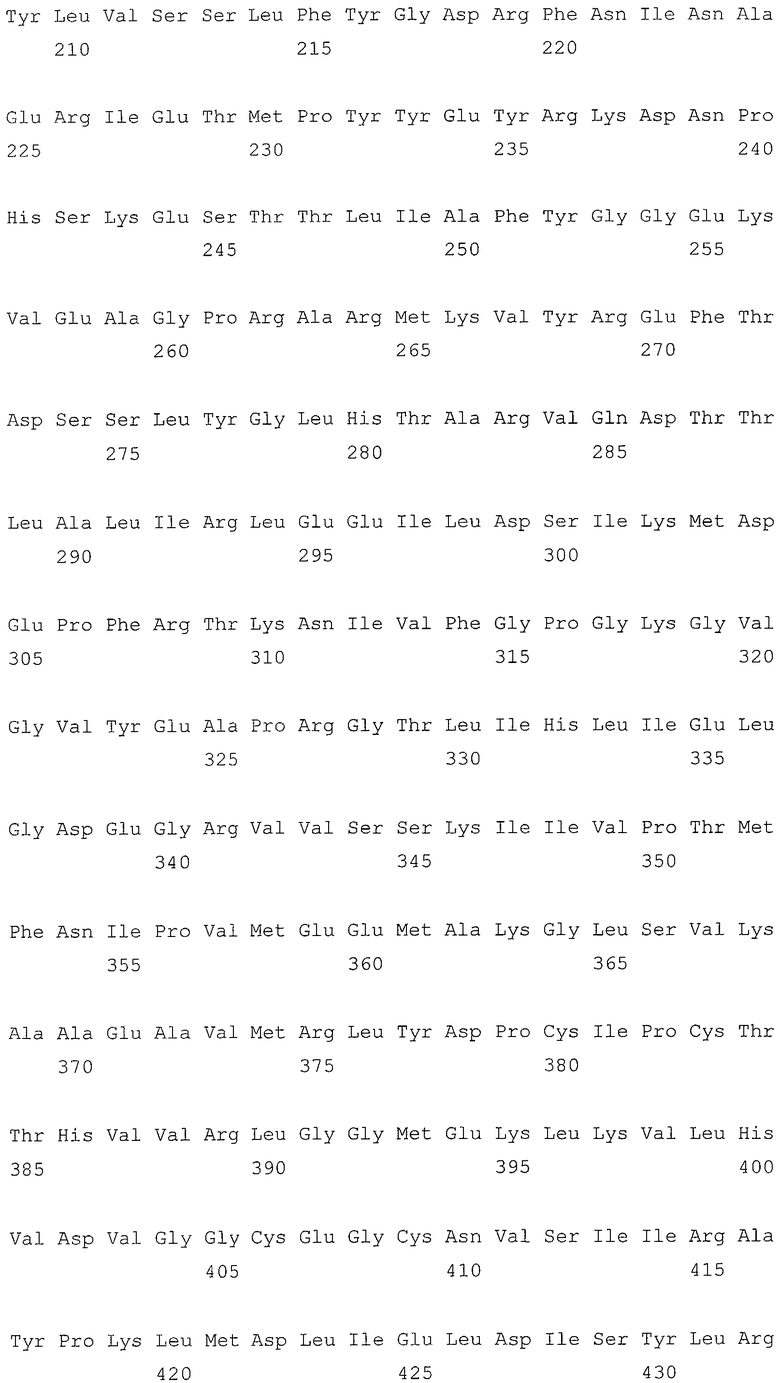
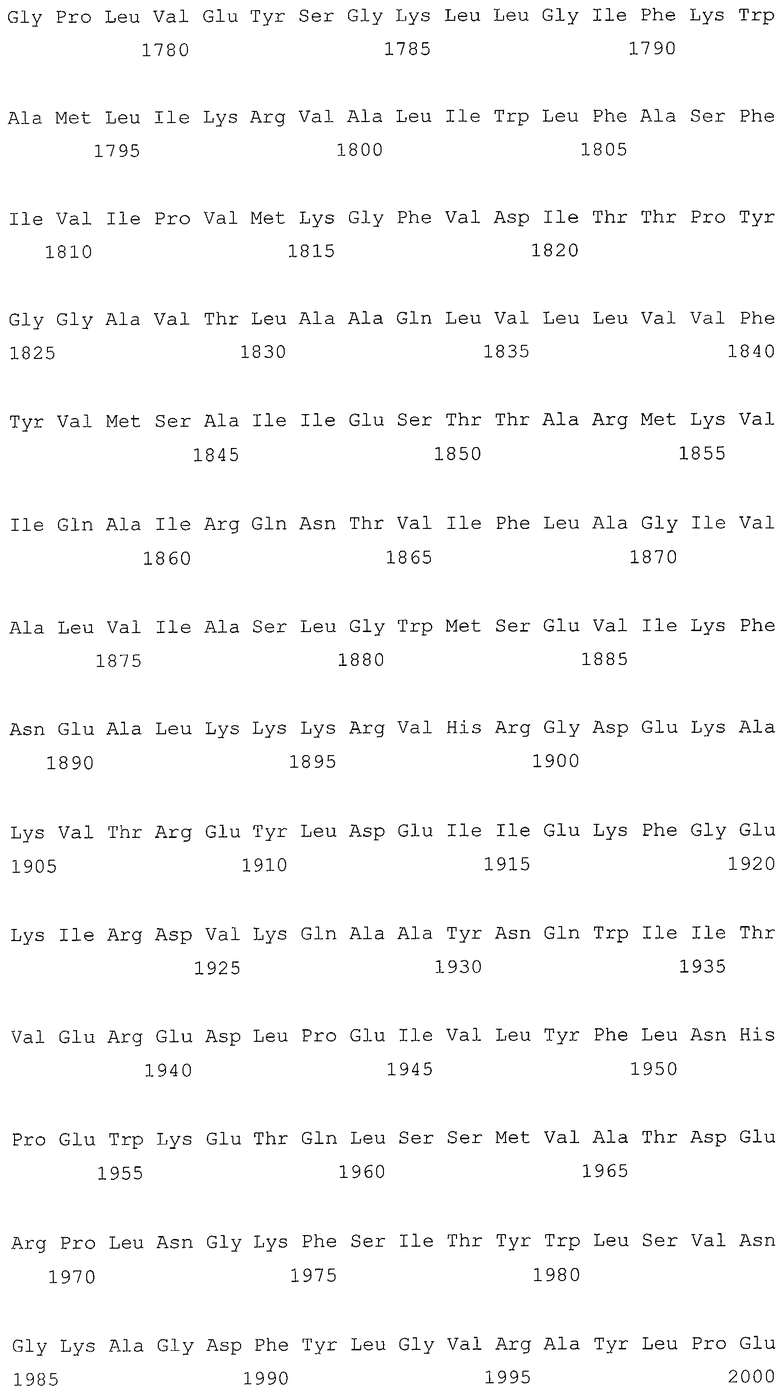
В первом аспекте, настоящее изобретение относится к гидрогеназам, продуцируемым новым гипертермофильным штаммом Thermococcus onnurineus NA1 (рег. №: KCTC 10859BP). T. onnurineus NA1 имеет восемь новых кластеров генов гидрогеназы, и аминокислотные последовательности гидрогеназ, принадлежащих этим кластерам, представлены в SEQ ID NO:1 - SEQ ID NO:8.
Во втором аспекте, настоящее изобретение относится к генам, кодирующим указанные аминокислотные последовательности. Такими генами, предпочтительно, являются, но не ограничиваются ими, гены, представленные в SEQ ID NO. 12 - SEQ ID NO: 19 (аминокислотные последовательности SEQ ID NO. 1 - SEQ ID NO: 8 соответствуют генам, представленным в SEQ ID NO. 12 - SEQ ID NO: 19, соответственно).
В третьем аспекте, настоящее изобретение относится к способу получения водорода путем культивирования Thermococcus spp. Этот способ включает стадии: 1) приготовления среды в сосуде для культивирования; 2) культивирования Thermococcus spp. в сосуде для культивирования; 3) извлечения водорода из сосуда для культивирования. Микроорганизмом Thermococcus spp., предпочтительно, является Thermococcus onnurineus NA1 (рег. №: КСТС 10859ВР).
Кроме того, указанной средой может быть среда, в которую были добавлены один или несколько компонентов, выбранных из группы, состоящей из монооксида углерода, формиата и крахмала. Культивирование может быть осуществлено при высокой температуре 80°С в анаэробных условиях.
В четвертом аспекте, настоящее изобретение относится к дегидрогеназе, содержащей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 9 - SEQ ID NO: 11.
В пятом аспекте, настоящее изобретение относится к гену, кодирующему дегидрогеназу. Предпочтительно, указанный ген имеет последовательность оснований, выбранную из последовательностей SEQ ID NO: 20 - SEQ ID NO: 22 (аминокислоты SEQ ID NO: 9-11 соответствуют SEQ ID NO: 20-22, соответственно).
В шестом аспекте, настоящее изобретение относится к рекомбинантному вектору, содержащему гены, организованные в гидрогеназные кластеры CODH-MCH-MNH3 в T. onnurineus NA1, где все указанные гены являются функционально связанными. Предпочтительно гены включают, но не ограничиваются ими, гены SEQ ID NO: 21 (CODH-дегидрогеназы) и SEQ ID NO: 16 (MCH-гидрогеназы). Кроме того, настоящее изобретение относится к клетке-хозяину, трансформированной рекомбинантным вектором.
Кроме того, настоящее изобретение относится к способу получения водорода с использованием указанного трансформанта, включающему стадии: приготовления среды в сосуде для культивирования; подачи монооксида углерода в газовую фазу, присутствующую в сосуде для культивирования; культивирования указанного трансформанта в сосуде для культивирования; и извлечения водорода из сосуда для культивирования.
В седьмом аспекте, настоящее изобретение относится к рекомбинантному вектору, содержащему гены, организованные в гидрогеназный кластер FDH2-MFH2-MNH2 в T. onnurineus NA1, где все указанные гены являются функционально связанными. Предпочтительно гены включают, но не ограничиваются ими, гены SEQ ID NO:22 (FDH2-дегидрогеназы) и SEQ ID NO:18 (MFH2-гидрогеназы). Кроме того, настоящее изобретение относится к клетке-хозяину, трансформированной рекомбинантным вектором.
Кроме того, настоящее изобретение относится к способу получения водорода с использованием указанного трансформанта, включающему стадии: приготовления содержащей формиат среды в сосуде для культивирования; культивирования указанного трансформанта в сосуде для культивирования; и извлечения водорода из сосуда для культивирования.
В восьмом аспекте, настоящее изобретение относится к рекомбинантному вектору, содержащему гены, организованные в гидрогеназный кластер FDH1-MFH1-MNH1 в T. onnurineus NA1, где все указанные гены являются функционально связанными. Предпочтительно гены включают, но не ограничиваются ими, гены SEQ ID NO:20 (FDH1-дегидрогеназы) и SEQ ID NO:13 (MFH1-гидрогеназы). Кроме того, настоящее изобретение относится к клетке-хозяину, трансформированной рекомбинантным вектором.
Кроме того, настоящее изобретение относится к способу получения водорода с использованием указанного трансформанта, включающему стадии: приготовления содержащей крахмал среды в сосуде для культивирования; культивирования указанного трансформанта в сосуде для культивирования; и извлечения водорода из сосуда для культивирования.
Способы получения водорода, в отличие от применяемых ранее химических способов получения водорода, имеют те преимущества, что они не требуют создания специальных условий, а именно высоких температур и высокого давления, и позволяют получать водород при температуре окружающей среды и при атмосферном давлении, а также не приводят к образованию вредных побочных продуктов. Кроме того, способы согласно изобретению имеют то преимущество, что, в отличие от известных способов получения водорода с использованием микроорганизмов, они являются гораздо более эффективными и позволяют получать водород высокой чистоты даже при высокой температуре.
Поэтому настоящее изобретение является экономически выгодным, поскольку оно позволяет исключить монооксид углерода при высокой температуре в процессе очистки нефти и т.п. и может быть непосредственно использовано для получения водорода без проведения отдельной стадии охлаждения после поглощения монооксида углерода. Кроме того, настоящее изобретение может быть использовано для кондиционирования воздуха.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
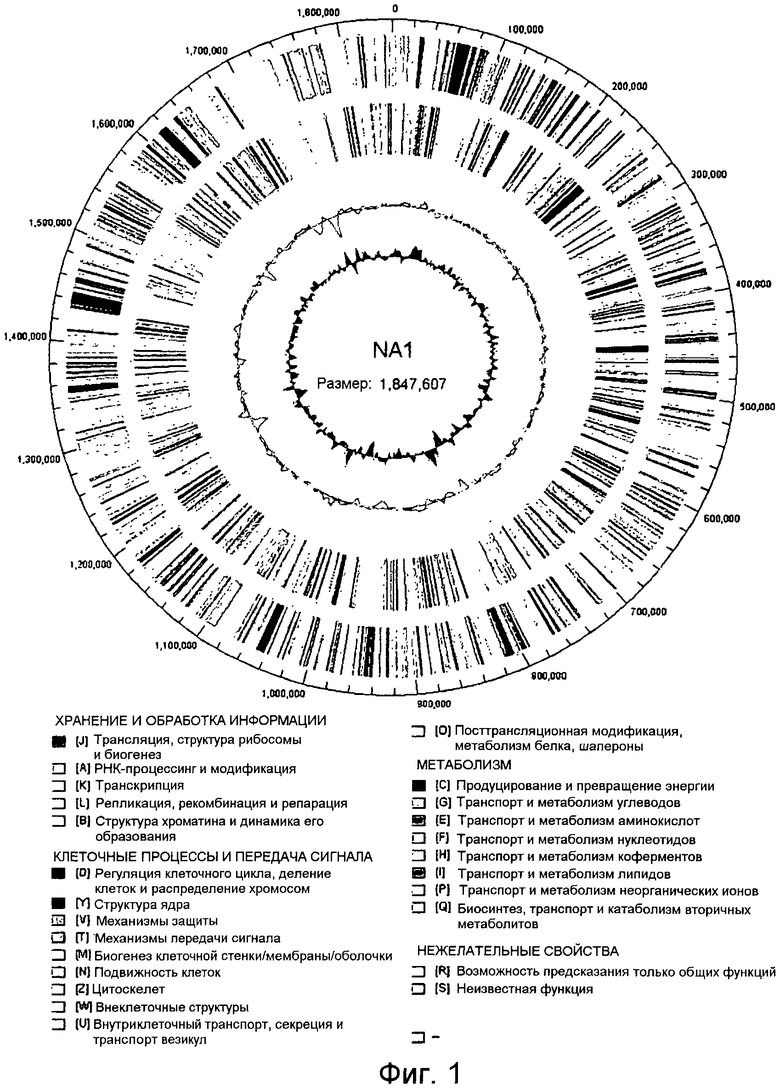
На фиг.1 представлена диаграмма Венна, иллюстрирующая общие и уникальные части протеома (совокупоности белков) четырех штаммов Thermococcales, T. onnurineus
NA1 (NA1), T. kodakaraensis, P. furiosus, и P. abyssi. Набор белков для этих штаммов был взят из коллекции RefSeq в NCBI.
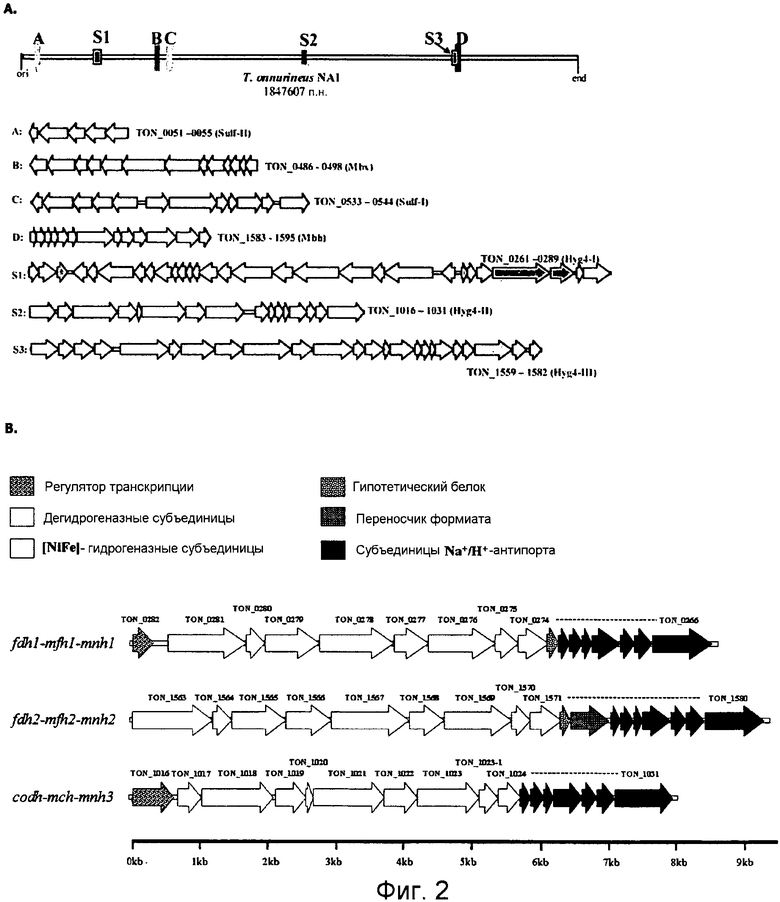
На фиг.2A представлена репрезентативная карта восьми кластеров генов гидрогеназы в T. onnurineus NA1. А, В, С и D: мембраносвязанные гидрогеназы и цитоплазматические NiFe-гидрогеназы. S1, S2 и S3: T. onnurineus NA1. Гены были окрашены в соответствии с функциональными категориями COG. TON_0051-0055 представляют собой SEQ ID NO: 1-5; TON_0486-0498 представляют собой SEQ ID NO: 35-47; TON_0533-0544 представляют собой SEQ ID NO: 48-59; TON_1583-1595 представляют собой SEQ ID NO: 100-112; TON_0261-0289 представляют собой SEQ ID NO: 6-34; TON_1016-1031 представляют собой SEQ ID NO: 60-75; а TON_1559-1582 представляют собой SEQ ID NO: 76-99.
На фиг.2B представлена организация генов из трех кластеров генов гидрогеназ (fdhl-mfhl-mnhl, fdh2-mfh2-mnh2 и codh-mch-mnh), имеющих 3-модульный генный кластер в геноме T. onnurineus NA1. Гены, принадлежащие к тем же самым субкластерам, показаны одним и тем же цветом.
На фиг.3 показаны паттерны распределения и консервативности кластеров генов гидрогеназы в 31 архегеноме. В синие скобки (первая скобка, третья скобка, пятая скобка снизу) заключены CDS, обнаруживающие низкое сходство (<25%) с любыми CDS из 31 архегенома. В черных скобках показаны CDS, аналогичные гидрогеназе 4 от P. abyssi. 31 археген представлен ниже:
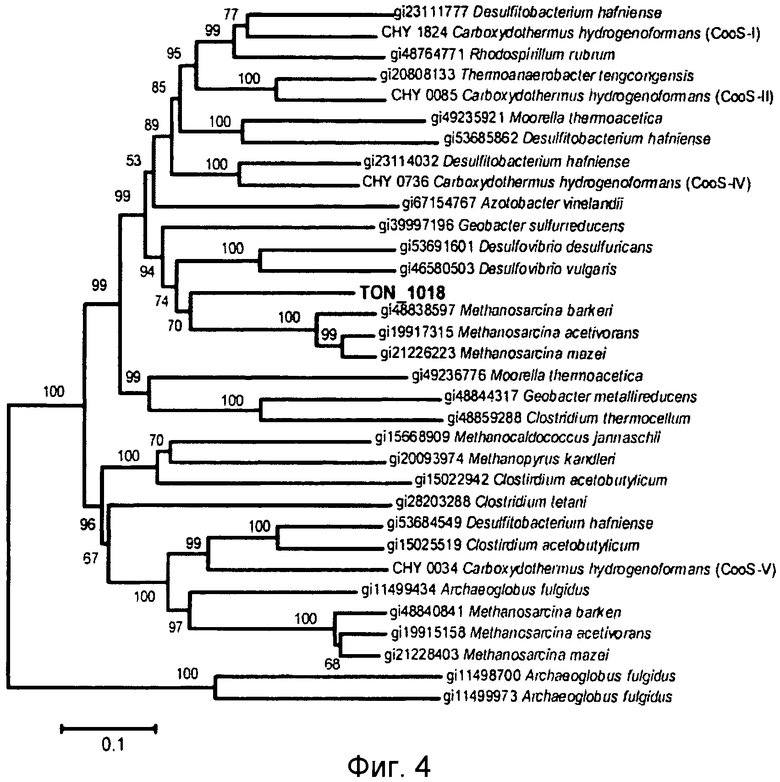
На фиг.4 и 5 проиллюстрировано сравнение α-субъединиц CODH- и F420-гидрогеназных белков. На фиг.4 представлено филогенетическое дерево CODH, а на фиг.5 представлено филогенетическое дерево α-субъединицы F420-гидрогеназы. Гомологи белков на филогенетическом дереве были взяты из базы данных NCBI.
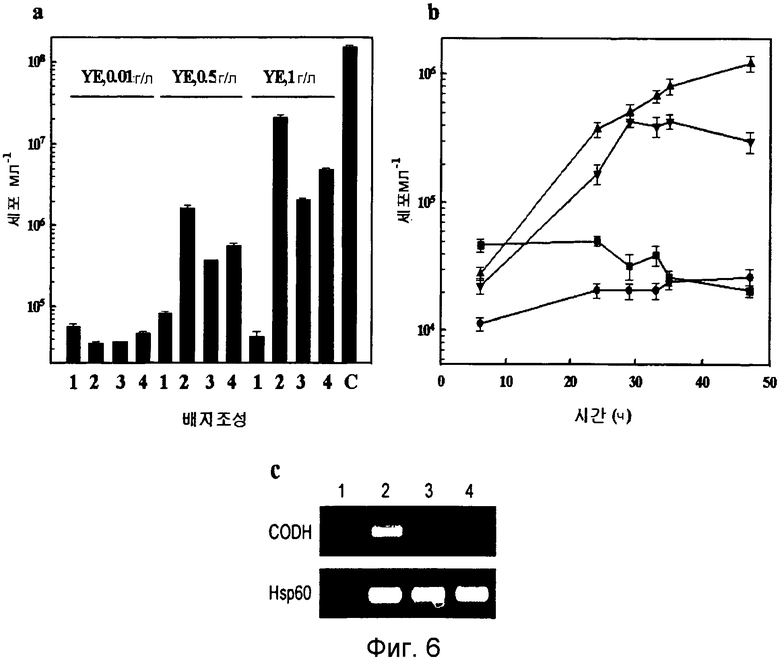
На фиг.6 показан график роста T. onnurineus NA1 в зависимости от CO. T. onnurineus NA1 культивировали в среде 1, в которую были добавлены CO (дорожка 2; треугольники), сера (3; квадраты) или то и другое (дорожка 4; перевернутые треугольники). Были включены контроль без добавок (дорожка 1; кружки), и культура в среде YPS (C). DAPI-окрашенные клетки были непосредственно подсчитаны на фильтрах под флуоресцентным микроскопом. a: Влияние состава среды при различных концентрациях дрожжевого экстракта (YE). b: Кривые роста Т. onnurineus NA1 в среде 1 с другими добавками. c: Анализ транскрипции гена CODH.
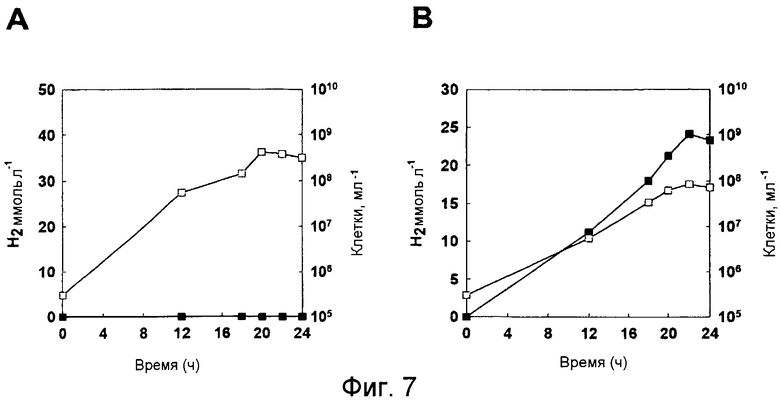
На фиг.7 проиллюстрирован рост микроорганизма T. onnurineus NA1 и продуцирование водорода указанным микроорганизмом в YPS (A) или в CO-содержащей среде. Незаштрихованные кружки: рост; и заштрихованные кружки: продуцирование водорода.
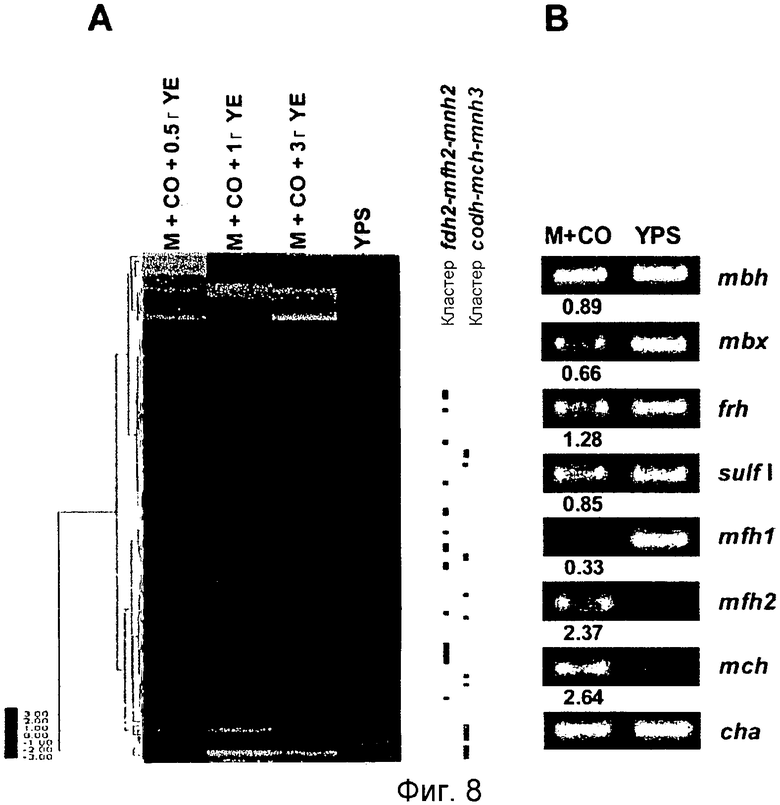
На фиг.8 проиллюстрирован анализ, проводимый с использованием микромассивов (microarray) (A), и ОТ-ПЦР-анализ (B) экспрессии кластеров генов гидрогеназы T. onnurineus NA1 в YPS (A) или в CO-содержащей среде (B). На фиг.8 (A) проиллюстрирован анализ восьми кластеров генов гидрогеназы в T. onnurineus NA1, проводимый с использованием микромассивов. Изменения в иерархической кластеризации мРНК в присутствии CO сравнивали с кластеризацией в культуральной среде YPS, используемой в качестве контроля. Стимуляция и ингибирование показаны красным и зеленым цветом соответственно. Условия роста показаны в верхней части картины кластеризации. На правой стороне картины кластеризации ОРС для каждого из codh-mch-mnh3, fdhl-mfhl-mnhl или fdh2-mfh2-mnh2 показаны в виде горизонтальных полос. YE: дрожжевой экстракт. На фиг.8 (B) представлены результаты количественного ОТ-ПЦР-анализа в присутствии CO или YPS, проводимого для каждой из крупных субъединиц гидрогеназ mbh (TON_1593), mbx (TON 0489), frh (TON_1560), sulf I (TON_0534), mch (TON_1023), mfh2 (TON_1569) и mfhl (TON_0276). Ген, кодирующий шаперонин (cha), использовали в качестве контроля для нормализации уровней экспрессии.
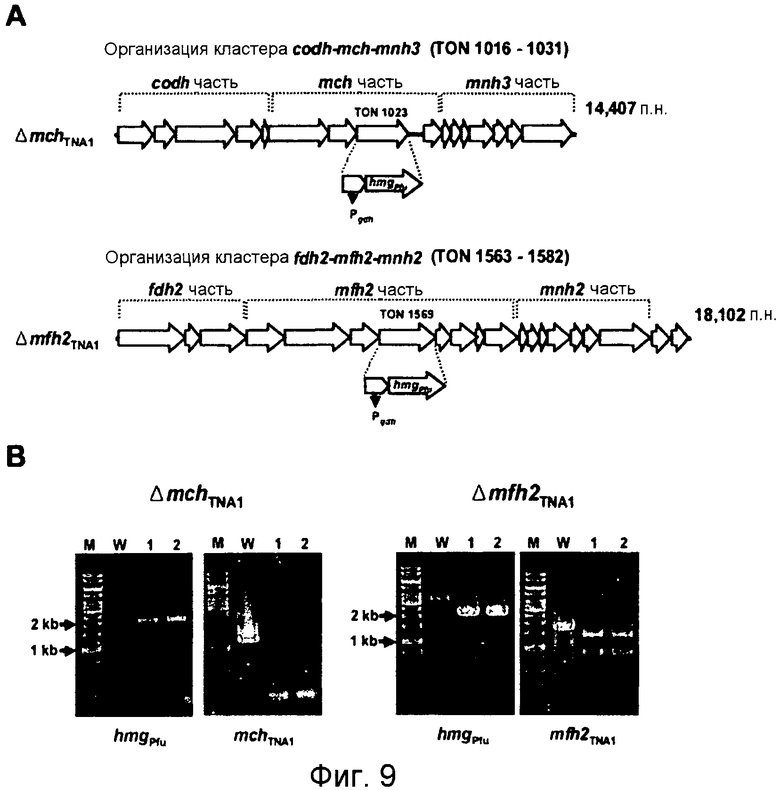
На фиг.9 представлено разрушение гена-мишени крупной субъединицы каждой из гидрогеназ mch (TON_1023) и mfh2 (TON 1569). На фиг.9 (А) представлена организация гена каждого из кластеров codh-mch-mnh3 и fdh2-mfh2-mnh2 в Т. onnurineus NA1. Pqdh: промоторная область, расположенная слева (выше) от 5'-конца гена глутамат-дегидрогеназы Т. kodakaraensis KOD1; и hmgpfu: ген 3-гидрокси-метилглутарил-кофермент А-редуктазы Pyrococcus furiosus. На фиг.8(В) проиллюстрирована идентификация разрушения гена с помощью ПЦР. На левой панели проиллюстрирована ПЦР-амплификация с использованием праймеров для области кассеты сверхэкспрессии (Pgdh-hmgpfu). На правой панели проиллюстрирована ПЦР-амплификация с использованием праймеров для крупной субъединицы каждой из гидрогеназ mchTNA1 и mfh2TNA1. М: маркер размера (1 т.п.н.-лэддер); W: дикого типа; дорожки 1 и 2: мутантные штаммы.
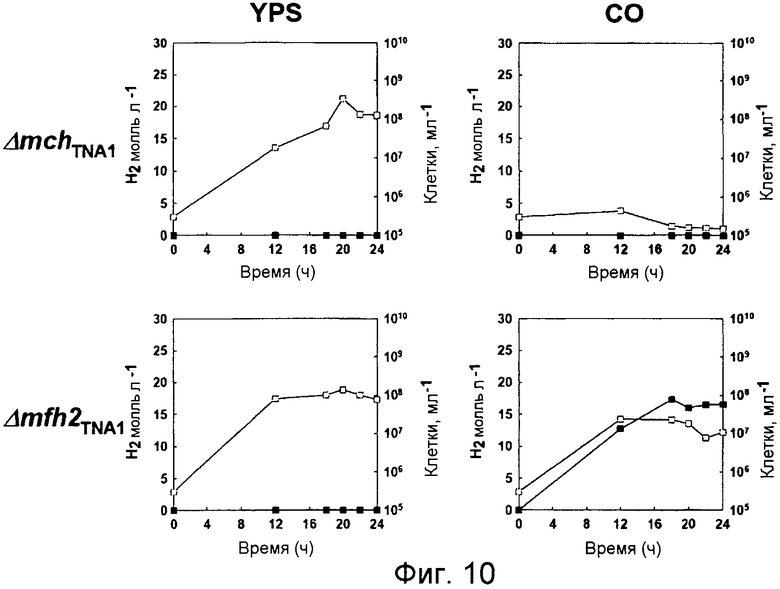
На фиг.10 проиллюстрирован рост мутантных штаммов ΔmсhTNA1 и Δmfh2TNA1 и продуцирование ими водорода в среде, содержащей YPS или СО. Незаштрихованные кружки: рост; заштрихованные кружки: продуцирование водорода.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте, настоящее изобретение относится к гидрогеназам, продуцируемым новым гипертермофильным штаммом Thermococcus onnurineus NA1 (per. №: КСТС 10859 ВР), который продуцирует водород в анаэробных условиях. Этот штамм был выделен из гидротермальной глубоководной дренажной зоны в регионе островов Манус в Тихом океане, а именно в бассейне восточных островов Манус. Выделенный штамм был депонирован в Корейской коллекции типовых культур (КСТС) при Корейском научно-исследовательском институте биологии и биотехнологии (KRIBB) 7 октября, 2005, а 20 октября 2005 ему был присвоен peг. №: КСТС 10859 ВР. Свойства этого штамма и методы его культивирования описаны в заявке на патент Кореи No. 10-2007-0127255, на основе которой было разработано настоящее изобретение.
Т. onnurineus NA1 имеет восемь новых кластеров генов гидрогеназы. Гидрогеназы являются ключевыми ферментами, которые имеют отношение к метаболизму молекулярного водорода (Н2) и действуют как катализаторы в следующей обратимой реакции: 2Н++2е- ⇔ Н2. Предпочтительно, гидрогеназы, принадлежащие к вышеописанным кластерам, продуцируют белки и их функциональные эквиваленты, содержащие одну или несколько аминокислотных последовательностей, выбранных из группы, состоящей из последовательностей SEQ ID NO: 1 - SEQ ID NO: 8. Используемый в настоящем документе термин «функциональный эквивалент» включает варианты аминокислотной последовательности, имеющие аминокислотные замены в некоторых или во всех белках, или аминокислотные добавления или делеции в некоторых из этих белков. Аминокислотными заменами, предпочтительно, являются консервативные замены. Примерами консервативных замен являются замены следующих природных аминокислот, таких как: алифатические аминокислоты (Gly, Ala и Pro), гидрофобные аминокислоты (Ilе, Leu и Val), ароматические аминокислоты (Phe, Тyt и Тrр), кислотные аминокислоты (Asp и Glu), основные аминокислоты (His, Lys, Arg, Gln и Asn), и серусодержащие аминокислоты (Cys и Met). Делеции аминокислот предпочтительно присутствуют в области, которая не оказывает непосредственного влияния на активность гидрогеназ.
Во втором аспекте, настоящее изобретение относится к генам, кодирующим вышеописанные аминокислотные последовательности. Такими генами, предпочтительно, являются, но не ограничиваются ими, гены, представленные в SEQ ID NO. 12 - SEQ ID NO: 19 (аминокислотные последовательности SEQ ID NO. 1 - SEQ ID NO: 8 соответствуют генам, представленным в SEQ ID NO. 12 - SEQ ID NO: 19, соответственно).
В третьем аспекте, настоящее изобретение относится к способу получения водорода путем культивирования Thermococcus spp. Этот способ включает стадии: 1) приготовления среды в сосуде для культивирования; 2) культивирования Thermococcus spp. в сосуде для культивирования; и 3) извлечения водорода из сосуда для культивирования. Микроорганизмом Thermococcus spp., предпочтительно, является Thermococcus onnurineus NA1 (peг. №: КСТС 10859 ВР).
Кроме того, указанной средой может быть среда, в которую были добавлены один или несколько компонентов, выбранных из группы, состоящей из монооксида углерода, формиата и крахмала. Культивирование может быть также осуществлено при высокой температуре 80°С в анаэробных условиях.
В четвертом аспекте, настоящее изобретение относится к дегидрогеназе, содержащей по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в SEQ ID NO: 9 - SEQ ID NO: 11. Дегидрогеназы Fdhl (SEQ ID NO: 20), Fdh2 (SEQ ID NO: 22) и CODH (SEQ ID NO: 21) соответственно могут образовывать кластеры с гидрогеназами MFH1, MFH2 и МСН.
В пятом аспекте, настоящее изобретение относится к гену, кодирующему указанную дегидрогеназу. Предпочтительно, указанный ген выбран из генов, представленных в SEQ ID NO: 20 - SEQ ID NO: 22 (аминокислотные последовательности SEQ ID NO: 9-11 соответствуют SEQ ID NO: 20-22, соответственно).
В шестом аспекте, настоящее изобретение относится к рекомбинантному вектору, содержащему гены, организованные в гидрогеназные кластеры CODH-MCH-MNH3 в Т. onnurineus NA1, где все указанные гены являются функционально связанными. Предпочтительными генами являются, но не ограничиваются ими, гены SEQ ID NO:21 (CODH-дегидрогеназы) и SEQ ID NO:16 (МСН-гидрогеназы). Используемый в настоящем документе термин «вектор» означает молекулу нуклеиновой кислоты, которая может иметь другую присоединенную к ней молекулу нуклеиновой кислоты.
В качестве экспрессионного вектора, который может синтезировать белок, кодируемый рекомбинантным геном, присутствующим в указанном векторе, могут быть использованы плазмида, космида или фаг. Предпочтительным вектором является вектор, который может самореплицироваться и экспрессировать нуклеиновую кислоту, связанную с этим вектором.
Кроме того, настоящее изобретение относится к клеткам-хозяевам, трансформированным рекомбинантным вектором. Рекомбинантный вектор может быть использован для трансформации клеток, таких как прокариотические клетки, клетки грибов, клетки растений и клетки животных, в целях получения трансформированных клеток, которые могут продуцировать водород с высокой эффективностью. Используемый в настоящем документе термин «трансформация» означает абсорбцию чужеродной ДНК или РНК в клетки для изменения их генотипа. Для получения такой клетки-хозяина может быть использован общеизвестный метод трансформации каждой из указанных клеток.
Настоящее изобретение также относится к способу получения водорода с использованием указанных трансформантов, включающему стадии: приготовления среды в сосуде для культивирования; подачи моноокида углерода в газовую фазу, присутствующую в среде для культивирования; культивирования указанного трансформанта в сосуде для культивирования; и извлечения водорода из сосуда для культивирования.
В седьмом аспекте, настоящее изобретение относится к рекомбинантному вектору, содержащему гены, организованные в гидрогеназные кластеры FDH2-MFH2-MNH2 в Т. onnurineus NA1, где все указанные гены являются функционально связанными. Предпочтительными генами являются, но не ограничиваются ими, гены SEQ ID NO:22 (FDН2-дегидрогеназы) и SEQ ID NO:18 (MFH2-гидрогеназы). Кроме того, настоящее изобретение относится к клетке-хозяину, трансформированной рекомбинантным вектором.
Подробное описание вектора, трансформации и клеток-хозяев приводится выше в шестом аспекте.
Настоящее изобретение также относится к способу получения водорода с использованием указанного трансформанта, включающему стадии: приготовления формиат-содержащей среды в сосуде для культивирования; культивирования указанного трансформанта в сосуде для культивирования; и извлечения водорода из сосуда для культивирования.
В восьмом аспекте, настоящее изобретение относится к рекомбинантному вектору, содержащему гены, организованные в FDH1-MFH1-MNH1-гидрогеназные кластеры в Т. onnurineus NA1, где все указанные гены являются функционально связанными. Предпочтительными генами являются, но не ограничиваются ими, гены SEQ ID NO:20 (FDH1-дегидрогеназы) и SEQ ID NO:13 (MFH1-гидрогеназы). Кроме того, настоящее изобретение относится к клетке-хозяину, трансформированной рекомбинантным вектором.
Подробное описание вектора, трансформации и клеток-хозяев приводится выше в шестом аспекте.
Настоящее изобретение также относится к способу получения водорода с использованием указанного трансформанта, включающему стадии: приготовления крахмал-содержащей среды в сосуде для культивирования; культивирования указанного трансформанта в сосуде для культивирования; и извлечения водорода из сосуда для культивирования.
Ниже приводится более подробное описание настоящего изобретения со ссылкой на примеры. В этой связи следует отметить, что эти примеры приводятся лишь в иллюстративных целях и не ограничивают объема настоящего изобретения.
Пример 1: Анализ генов гидрогеназы штамма Thezmococcus onnurineus NA1
(1) Тест-методы
1) Условия культивирования
Для осуществления рутинного культивирования клетки выращивали в анаэробных условиях при 80°С в среде, содержащей дрожжевой экстракт-пептон-серу (YPS) (Holden et al. 2001). Физиологические тесты осуществляли с использованием модифицированной среды 1 (Sokolova, Т.G., С.Jeanthon, N.А Kostrikina, N.A. Chernyh, A.V. Lebedinsky, E. Stackebrandt and Е.A. Bonch-Osmolovskaya. 2004. «The first evidence of anaerobic CO oxidation coupled with H2 production by a hyperthermophilic archaeon isolated from a deep-sea hydrothermal vent». Extremophiles 8:317-323), в которую было добавлено 1 мл смеси микроэлементов, 1 мл раствора витамина (Balch, W.E., G.E. Fox, L.J. Magrum, С.R. Woese, and R.S. Wolfe. 1979. Methanogens: reevaluation of a unique biological group.Microbio 1. Rev. 43:260-296), NaCl (30 г/л), и дрожжевой экстракт (0,5 г/л). рН доводили до 8,0 с использованием NaOH. Среду, полученную в анаэробных условиях, распределяли по 25-миллилитровым бутылям с сывороткой, и газовую фазу (15 мл) заменяли на N2/CO3 (80:20; 1 бар) или 100% СО. Если клетки культивировали в присутствии формиата или крахмала, то в среду добавляли 10 г/л формиата натрия (Sigma) или 5 г/л растворимого крахмала (Sigma), а затем автоклавировали. Все культуры для проведения физиологических тестов выращивали при 80°С в течение 2 дней.
2) Секвенирование генов
Последовательность генома Т. onnurineus NA1 определяли путем секвенирования всего генома методом «дробового ружья» (shotgun) и пиросеквенирования. Для капиллярного секвенирования конструировали библиотеку со вставками размером 2 т.п.н.-3 т.п.н. (11028 клонов), библиотеку со вставкой размером 40 т.п.н. (1870 клонов) и библиотеку со вставкой размером 35 т.п.н. (288 клонов), и эти библиотеки секвенировали на секвенаторе ABI 3730XL (Applied Biosystems, CA). Для осуществления пиросеквенирования 581990 фрагментов ДНК секвенировали на секвенаторе GS-20 (454 Life Sciences). Контиги, полученные на обоих секвенаторах, объединяли, и «закрытие» пропусков секвенирования осуществляли методом «прогулки по клонам» и методом ПЦР-секвенирования. Гены ОРС и РНК определяли с использованием комбинации программ Glimmer 3.0 (Универистет в шт.Мэриленд), GSFinder и RBSFinder, с последующей подгонкой ОРС вручную. После определения всех ОРС проводили дополнительный анализ последовательности белка с помощью поисковой программы BLASTP на последовательности белка в не-избыточных базах данных Национального центра биотехнологической информации (NCBI), в энциклопедии генов и геномов Киото (KEGG) и COG (базе данных кластеров ортологичных групп белков) (Tatusova, R.L., D.А.Natale, I.V.Garkavtsev, Т.A.Tatusova, U.Т.Shankavaram, В.S.Rao, В.Kiryutin, M.Y.Galperin, N.D.Fedorova and E.V.Koonin. 2001. The COG database: new developments in phylogenetic classification of proteins from complete genomes. Nucleic Acids Res. 29:22-28). Для определения тРНК использовали программу tRNAScan-SE (Lowe, Т.M., and S.R.Eddy. 1997. tRNAscan-SE: a program for improved detection of transfer RNA genes in genomic sequence. Nucleic Acids Res. 25:955-964).
3) Анализ белков
Клетки Т. onnurineus NA1 суспендировали в 100 мМ трис-HCl-буфере (рН 6,8), содержащем 4% додецилсульфат натрия (ДСН) и 4 мМ EDTA, и кипятили в течение 10 минут, после чего центрифугировали при 22000×g в течение 20 минут. Клеточный лизат отделяли с помощью электрофореза в 12% полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ), и получали 30 фракций исходя из размера их молекул. Затем эти фракции гидролизовали в геле с использованием трипсина (Promega, USA) (Kim, Y.H., К.Cho, S.H.Yun, J.Y.Kim, K.H.Kwon, J.S.Yoo, and S.I.Kim. 2006. Analysis of aromatic catabolic pathways in Pseudomonas putida KT 2440 by combined proteomic approach: 2-DE/MS and cleavable ICAT analysis. Proteomics 6:1301-1318), и трипсиновые гидролизаты растворяли в 0,5% растворе трифторуксусной кислоты для проведения масс-спектрометрического анализа (Thermo Finnigan LTQ IT). Идентичность пептидов определяли с помощью программы Sequest (Thermo Finnigan, San Jose, CA).
4) Выделение всей РНК и ОТ-ПЦР-анализ
50-миллилитровую культуру Т. onnurineus NA1 выращивали до средней экспоненциальной фазы роста в модифицированной среде 1, в которую были добавлены различные концентрации дрожжевого экстракта в газовой фазе, состоящей из N2/CO2 (80:20, 1 бар) или 100% СО. Клетки собирали путем центрифугирования при 6000×g в течение 30 минут. Осадок ресуспендировали в 50 мкл 50 мМ трис-HCl-буфера (рН 7,5), в который было добавлено 500 мкл реагента тризола (Invitrogen, Carlsbad, CA). Клетки подвергали лизису путем замораживания и оттаивания, а затем образцы экстрагировали 200 мкл хлороформа. Водную фазу, содержащую всю РНК, дополнительно обрабатывали путем преципитации этанолом, а затем ресуспендировали в дистиллированной воде. Концентрацию и целостность РНК определяли путем измерения оптической плотности на 260 и 280 нм, а также с помощью анализа в 0,8% агарозном геле. Обратную транскрипцию и ПЦР-амплификацию осуществляли с использованием обратной транскриптазы Superscript™ II (Invitrogen) в соответствии с инструкциями производителей. Для амплификации CODH (окись углерода-дегидрогеназы) и Нsр60 (шаперонина), используемого в качестве контроля, применяли два набора нижеследующих праймеров:
Ген CODH (прямой праймер: 5'-GGACCATGTAGAATCGAYCCGTTY-3' (SEQ ID NO: 23) и обратный праймер 5'-TTCRTTTCCGGTACAGCA-3' (SEQ ID NO: 24)); и ген Нsр60 (прямой праймер: 5'-ATGGCACAGCTTAGTGGACAG-3' (SEQ ID NO: 25) и обратный праймер, 5'-CAAGGATTTCCTGGGCTTTCTC-3' (SEQ ID NO: 26)).
5) Компьютерный анализ
Поиск гомологии аминокислотных последовательностей осуществляли с использованием программы BLAST в не-избыточной базе данных белков NCBI. Поиск мотива белков, имеющих сигнал L1 (С[GS][ILV]С[AGNS]ххН, где х означает любую аминокислоту) в гидрогеназах группы 4, осуществляли с использованием программы ProteinFinder (Ensoltek, Korea) в не-избыточной базе данных белков NCBI. Выравнивание множества последовательностей белков осуществляли с использованием программы ClustalW (Thompson, J.D., Higgins, D.G. and Gibson, T.J. (1994) CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 22, 4673-4680), и конструировали филогенетическое дерево с использованием компьютерной программы для молекулярно-эволюционного генетического анализа (Molecular Evolutionary Genetics Analysis) (Меgа 4.1) (Tamura, К., Dudley, J., Nei, M. and Kumar, S. (2007) MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0. Mol. Biol. Evol. 24, 1596-1599). Филогенетическое дерево для последовательностей рРНК 16S строили на основе последовательностей, подвергнутых предварительному выравниванию и взятых из базы данных для рибосом на сайте (http://rdp.cme.msu.edu/index.j sp).
6) Создание сигнатур logo-данных
Logo-представления данных использовали для визуализации объема информации, ассоциированного с каждым положением данного мотива, который является общим для родственных последовательностей. В графическом представлении общая высота для каждого положения коррелирует с консервативностью в данном положении (выражено в битах), где относительные размеры символов в данном положении указывают на их относительную частоту. Logo-анализы осуществляли в Центре структурной геномики Беркли (http://weblogo.berkeley.edu/).
(2) Результат анализов
1) Общие признаки генов Т. onnurineus NA1
Для получения какого-либо представления относительно факторов, которые вносят свой вклад в явно успешную конкуренцию Thermococcus spp. с другими микроорганизмами, обитающими в гидротремальной дренажной зоне, геномную последовательность Т. onnurineus NA1 определяли комбинированным методом рандомизированного секвенирования всего генома, проводимым методом «дробовика» и пиросеквенирования. В результате было обнаружено, что Т. onnurineus NA1 имеет одну кольцевую хромосому (1847607 п.н.), не содержащую каких-либо внехромосомных элементов, и было идентифицировано всего 1976 кодирующих последовательностей ДНК (CDS) (Таблица 1 и фиг.1). Из них, 1104 CDS (55,8%) было выявлено путем поиска гомологии и доменов, но функция остальных 872 CDS не могла быть предсказана исходя из их первичной структуры. При поиске сходства белков в масштабе всего генома 82,7% белков Т. onnurineus NA1 обнаруживали сходство с другими членами Thermococcales.
2) Кластеры гидрогеназ
В геноме Т. onnurineus NA1 было обнаружено очень высокое содержание гидрогеназ и родственных белков (5,5%), что указывает на повышенную консервативность или рециклизацию восстановительного потенциала в отношении оксидоредуктаз, включая СО-дегидрогеназу и формиат-дегидрогеназу.
Гидрогеназы могут быть разделены на следующие три основных группы исходя из их каталитического металлического центра: [NiFe]-гидрогеназы, [FeFe]- гидрогеназы и [Fe]-гидрогеназы. На основании уникального функционального центра, который является консервативным для каждой из групп гидрогеназ, был сделан вывод, что все гидрогеназы в Т. onnurineus NA1, за исключением одной гидрогеназы, принадлежат к [NiFe]-гидрогеназам. В соответствии с системой классификации гидрогеназ Vignais et al., [NiFe]-гидрогеназы в Т. onnurineus NAl принадлежат к группе 3 (одна F420-восстанавливающая гидрогеназа и две NADP-восстанавливающие гидрогеназы) или к группе 4 (четыре мембраносвязанных гидрогеназы) (Silva, P.J., van den Ban, E.C., Wassink, H., Haaker, H., de Castro, В., Robb, F.T. and Hagen, W.R. (2000) Enzymes of hydrogen metabolism in Pyrococcus furiosus. Eur. J. Biochem. 267, 6541-6551). Гидрогеназы, принадлежащие к группе 4, называются преобразующими энергию гидрогеназами (Ech), и такие гидрогеназы широко распространены в бактериях и архебактериях.
Для выявления молекулярной основы метаболизма гидрогеназ генные кластеры гидрогеназ подвергали сравнительному анализу. Указанные гидрогеназы подвергали филогенетическому анализу и на основе полученных данных гидрогеназы группы 4 могут быть подразделены на две подгруппы, 4а и 4b, и во всех последовательностях подгруппы 4b можно обнаружить общие паттерны пар мотивов.
Как показано на фиг.2, в геноме Т. onnurineus NAl были обнаружены три дополнительных кластера гидрогеназ (FDH1-MFH1-MNH1 (Hyg4-I, S1:TON_0279-0274, MFH1: SBQ ID NO: 2), CODH-MCH-MNH3 (Hyg4-II, S2:TON_1021-1024, MCH: SEQ ID NO: 5) и FDH2-MFH2-MNH2 (Hyg4-III, S3:TON_1565-1571, MFH2: SEQ ID NO: 7)) и Frh (TON 1559-1562, SEQ ID NO: 6) вместе с двумя мембраносвязанными гидрогеназами (Mbh (TON_1590-1595, SEQ ID NO: 8) и Mbx (TON 0489-0486, SEQ ID NO: 3)), и двумя цитоплазматическими NiFe-гидрогеназами (Sulf-I (TON_0533-0544, SEQ ID NO: 4) и Sulf-II (TON_0051-0055, SEQ ID NO:1), которые, как сообщалось, присутствуют в Pyrococcus spp. и Т. kodakaraensis KOD1. Анализ генного кластера гидрогеназ с CDS от 31 архегенома явно показал, что FDH1-MFH1-MNH1 (Hyg4-I), CODH-MCH-MNH3 (Hyg4-II) и FDH2-MFH2-MNH2 (Hyg4-III) являются уникальными по своей первичной последовательности, что указывает на невысокое сходство с 4 компонентами гидрогеназ от Р. abyssi и R. rubrum (фиг.3). Аналогично дополнительным гидрогеназам, кластер FDH2-MFH2-MNH2 (Hyg4-III) (TON_1559-1582, SEQ ID NO: 76-99) включает субъединицы α/β/γ F420-гидрогеназы (TON 1559-1561, SEQ ID NO: 76-78) в геноме. Субъединицы F420-гидрогеназы имеют уникальные первичные последовательности, что указывает на сходство с кофермент F420-восстанавливающей гидрогеназой (YP_001097176) от Methanococcus maripaludis (33%) и кофермент F420-восстанавливающей гидрогеназой (NP_987940) от М. maripaludis S2 (33%) (фиг.3 и фиг.5). При этом, в литературе отсуствуют какие-либо сообщения о гомологах F420-гидрогеназы Thermococcales.
3) Конструирование 3-модульных генных кластеров
Было обнаружено, что каждая из трех гидрогеназ Ech (MFH1, MFH2 и МСН), принадлежащих к группе 4 [NiFe]-гидрогеназ, представляет собой часть крупных 17- или 18-генных кластеров (fdh1-mfh1-mnh1, fdh2-mfh2-mnh2 и codh-mch-mnh3), состоящих из ОРС (открытых рамок считывания) TON_266-TON_282, TON_1563-TON_1580 и TON_1016-TON_1031 (фиг.2В). ОРС в кластерах могут быть подразделены на три подкластера. Первая часть кодирует оксидоредуктазу, такую как формиат-дегидрогеназы (Fdh1 (SEQ ID NO: 9) или Fdh2 (SEQ ID NO: 11)), или монооксид углерода-дегидрогеназа (Codh (SEQ ID NO: 10)). Вторая часть кодирует мультимерные мембраносвязанные гидрогеназы (MFH1, MFH2 или МСН), имеющие 5-7 субъединиц. Последняя часть кодирует катионные/протонные антипорты, такие как Na+/H+-aнтипорт. При этом в литературе отсуствуют какие-либо сообщения о 3-модульных генных кластерах.
Пример 2: Анализ состава газа
(1) Метод проведения анализа
Состав газа водорода определяли на газовом хроматографе HP 5890 серии II (Hewlett Packard), снабженном колонкой с молекулярными ситами HP-PLOT (Agilent) и детектором TCD. В качестве газа-носителя использовали аргон. Для количественной оценки состава газа водорода использовали газовый калибровочный эталон (Supleco), содержащий 1% (масс./масс.) каждого из компонентов (СО, СО2/ H2, CH4 и О2) в азоте.
(2) Получение водорода с использованием различных веществ
Для того чтобы определить, могут ли различные гидрогеназы в Т. onnurineus NA1 осуществлять эффективное продуцирование водорода в различных средах, скорость продуцирования водорода анализировали с использованием различных источников энергии (таблица 2). В результате было обнаружено, что штамм NA1 может продуцировать водород с использованием крахмала, СО и формиата даже в отсутствие серы. В частности, СО и формиат являются наиболее подходящими источниками энергии для эффективного продуцирования водорода.
Уровень продуцирования водорода штаммом NA1 в периодической культуре был аналогичен уровню продуцирования, наблюдаемому в непрерывной культуре Т. kodakaraensis KOD1 и Pyrococcus furiosus. Гипертермофильные архебактерии, несмотря на их низкую волюметрическую продуктивность, имеют ряд преимуществ, заключающихся в том, что они обнаруживают определенную скорость продуцирования водорода, превышающую скорость продуцирования водорода при сбраживании мезофильных бактерий, или скорость продуцирования водорода в фотобактериях, и продуцируют водород высокой чистоты. Описанная здесь высокая скорость продуцирования водорода может быть еще больше увеличена путем оптимизации условий культивирования, способов обработки и технологии получения продуктов метаболизма.
Пример 3: СО-зависимое продуцирование Н2 штаммом Thermoсоссus onnurineus NA1: идентификация СО-чувствительных гидрогеназ
(1) Генный кластер CODH и рост в карбоксидотропных условиях
Как описано выше, было обнаружено, что Т. onnurineus NA1 имеет уникальный генный кластер (CODH-MCH-MNH3), который состоит из предполагаемого регулятора транскрипции (TON_1016), вспомогательного белка CODH (CooC, TON_1019), каталитической субъединицы CODH (CooS, TON_1018) и белка-переносчика электронов (CooF, TON_1017), а также гидрогеназы (mch, TON_1021-1024, SEQ ID NO: 5) (фиг.2В). CooS (TON_1018), фермент, играющий центральную роль в метаболизме монооксида углерода (СО) в микробах обнаруживает значительное сходство с ферментами CODH, происходящими от СО-окисляющих метаногенных архебактерий, такими как CODH (AAM06652) от Methanosarcina acetivorans C2A (60%) и CODH (AAM29817) от Methanosarcina mazei Gol (59%) (фиг.3 и 4). Предполагается, что монофункциональный CODH (Bonam, D., L.Lehman, G.P.Roberts and P.W.Ludden., 1989, Regulation of carbon monoxide dehydrogenase and hydrogenase in Rhodospirillum rubrum: effects of CO and oxygen on synthesis and activity. J. Bacteriol. 171:3102-3107; и Wu, M.Q.Ren, A.S.Durkin, S.C.Daugherty, L.M.Brinkac, R.J.Dodson, R.Madupu, S.A.Sullivan, J.F.Kolonay, W.С Nelson, L.J.Tallon, K.M.Jones, L.E.Ulrich, J.M.Gonzalez, I.B.Zhulin, F.T.Robb, and J.A.Eisen. 2005, Life in hot carbon monoxide: the complete genome sequence of Carboxydothermus hydroqenoformans Z-2901. PLoS Genet. l:e65) не обладает активностью бифункциональной CODH/ацетил-кофермент А-синтетазы, заключающейся в синтезе/ расщеплении ацетил-кофермента А. Как описано в публикации Fox et al. (Fox, J. D., R.L.Kerby, G.P.Roberts, and P.W.Ludden, 1996, Characterization of the CO-induced, CO-tolerant hydrogenase from Rhodo spirillum rubrum and the gene encoding the large subunit of the enzyme. J. Bacteriol. 178:1515-1524), монофункциональный комплекс CODH/гидрогеназы, происходящий от Rhodospirillum rubrum, участвует в СО-индуцируемом поглощении протонов, что приводит к сохранению энергии в форме протонного градиента, создаваемого по всей клеточной мембране. В этой связи, чтобы убедиться в том, что CODH-кластер может играть аналогичную роль в сохранении энергии посредством окисления СО, авторами настоящего изобретения был проведен тест на утилизацию СО штаммом Т. onnurineus NA1. В результате было обнаружено, что этот штамм действительно способен лучше расти в среде 1 в атмосфере СО в отсутствие и в присутствии серы, чем в базовой среде (фиг.6а и b), даже в том случае, когда выход культивирования был меньше, чем в среде с YPS (фиг.6а). Рост в атмосфере СО ассоциируется с транскрипцией гена СооS, что указывает на то, что это ген может быть индуцирован в присутствии СО (фиг.6с). Заслуживает внимания тот факт, что добавление серы приводит к снижению уровня транскрипции гена СооS. Полученные результаты подтвердили гипотезу, что штамм Т. onnurineus NA1 генерирует энергию из СО. Ниже описаны конкретные методы тестирования и результаты, подтверждающие данную гипотезу.
(2) Методы тестирования
1) Условия культивирования
Т. onnurineus NA1 культивировали в анаэробных условиях при 80°С в среде, содержащей дрожжевой экстракт-пептон-серу (YPS). Для оценки параметров роста мутантного штамма в качестве базовой среды использовали модифицированную среду 1, в которую было добавлено 30,0 г/л NaCl (Uffen, R. L., 1976, Anaerobic growth of a Rhodopseudomonas species in the dark with carbon monoxide as sole carbon and energy substrate. Proc. Natl. Acad. Sci. USA 73:3298-3302). Среду автоклавировали, а затем в модифицированную среду 1 в аэробной камере добавляли 1,0 мл/л раствора витамина (Balch, W.E., G.Е.Fox, L.J.Magrum, С.R.Woese, and R.S.Wolfe. 1979. Methanogens: reevaluation of a unique biological group.Microbiol. Rev. 43:260-296) и 0,5 г/л дрожжевого экстракта. рН доводили до 8,0 путем добавления 1 н NaOH в базовую среду. 30 мл полученной среды распределяли по 150-миллилитровым бутылям с сывороткой и газовую фазу (120 мл) заменяли на 100% СО (105 Па). Все культуры для проведения физиологических тестов выращивали при 80°С в анаэробных условиях в течение 24 часов и эти тесты проводили в дубликате.
2) Экстракция РНК и конструирование микромассивов
Культуры центрифугировали при 4°С при 3500×g в течение 10 минут и всю РНК экстрагировали из культур с использованием реагента Тризола в соответствии с протоколом, рекомендованным производителями (Invitrogen, Carlsbad, California). Все РНК-образцы количественно и качественно анализировали на спектрофотометре NanoDrop (ND-1000, Thermo Scientific) и с помощью электрофореза. Микромассив, используемый в этом эксперименте, представляет собой микромассив Roche NimbleGen. Вкратце, было сконструировано всего 31994 уникальных 60-мерных олигонуклеотидов, и эти олигонуклеотиды были синтезированы in situ химическим методом снятия защиты под действием света. Каждый уникальный олигонуклеотид получали на массиве в дубликате (всего ~72000 олигонуклеотидов).
3) Синтез кДНК и условия гибридизации
Тест на микромассивах осуществляли в соответствии с протоколом, рекомендованным производителем. Каждый образец полноразмерной РНК (5 мкг) метили Cy5-dCTP (Amersharm, Piscataway, NJ) путем проведения реакции обратной транскрипции с использованием обратной транскриптазы Superscript II (Invitrogen, Carlsbad, California). Затем, смесь меченной кДНК концентрировали путем преципитации этанолом. 30 мкл концентрированных Сy5-меченных кДНК суспендировали в растворе для гибридизации (GenoCheck, Korea). Меченные кДНК локализовали на микромассиве, а затем помещали в камеру для гибридизации MAUI Mixer X4 (BioMicro Systems, Salt Lake 32 City, UT). Гибридизацию на предметных стеклах осуществляли с использованием 12-секционных систем MAUI (BioMicro Systems, Salt Lake City, UT) при 42°С в течение 12 часов. Гибридизованные предметные стекла промывали при комнатной температуре в 2 Х SSC, 0,1% ДСН в течение 2 минут, 1 X SSC в течение 3 минут, а затем 0,2 Х SSC в течение 2 минут. Предметные стекла центрифугировали при 1000×g в течение 20 секунд, а затем сушили.
4) Сканирование предметных стекол, нормализация и анализ данных
Массивы сканировали с использованием сканера GenePix 4000B (Molecular Devices Corporation, Union City, CA), и данные получали с помощью компьютерной программы NimbleScan 2.4. Нормализацию массивов осуществляли методом уточнения среднего и нормализации квантилей (Amaratunga, D., and J.Cabrera. 2001. Statistical analysis of viral microchip data. J. Am. Stat. Assoc. 96:1161-1170). Нормализованные величины экспрессии для отдельных зондов использовали в целях получения величин экспрессии для данной ОРС методом RMA (надежным методом вычисления средних с использованием множества массивов), ранее описанным Irizarry et al. (Karl, D. M. 1995. The microbiology of deep-sea hydrothermal vents. CRC Press, Boca Raton, FL). И наконец, n-кратные изменения отношений (R) определяли с использованием RMA-обработанных величин экспрессии (RMA-запрос), полученных для конкретного гена в образце. Анализ данных осуществляли с использованием программы GeneSpring GX 7.3.1 (Agilent Technologies, CA). Программы-фильтры для кратных изменений требуют, чтобы стимулируемые гены составляли по меньшей мере 200% от контроля, а ингибируемые гены составляли менее чем 50% от контроля. Данные были объединены в группы генов с аналогичным поведением в экспериментах, проводимых с использованием GeneSpring GX 7.3.1 (Agilent technologies, CA). Для разделения генов с аналогичными паттернами был использован алгоритм, разработанный на основе евклидова расстояния и усреднения связей.
5) Количественная ОТ-ПЦР
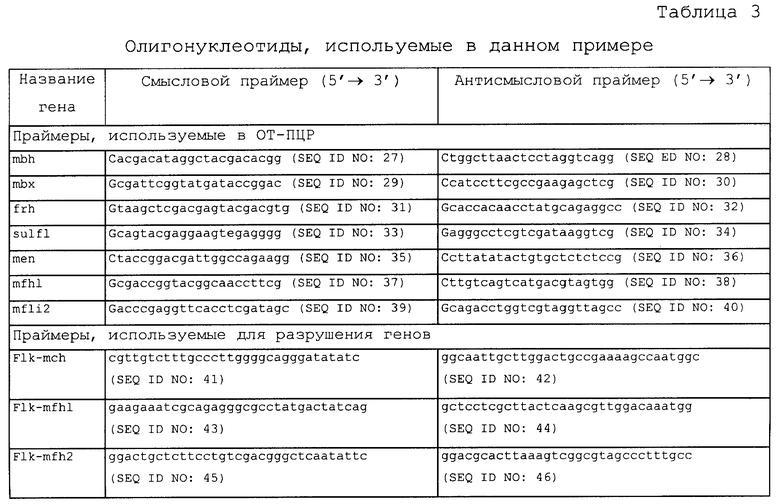
Геноспецифические праймеры были сконструированы на основе геномной последовательности T.onnurineus NA1 (Genbank peг. №: СР000855). Праймерные последовательности представлены ниже в таблице 3.
кДНК синтезировали из 350 нг всей РНК с использованием обратной транскриптазы, SuperScrip II (Invitrogen, Carlsbad, California), в соответствии с протоколом, рекомендованным производителем. ПЦР-реакции осуществляли с использованием ДНК-полимеразы rTaq (Takara) в термоячейке Tl (Biometra). Реакции проводили в 50 мкл смеси, содержащей кДНК для реакции первой цепи, 10 пмоль праймеров, 250 мкМ dNTP и буфер от производителя. Кроме того, реакции ПЦР-амплификации проводили в следующих условиях: денатурация в течение 2 минут при 94°С, а затем 25 циклов денатурации (30 секунд при 94°С), отжига (30 секунд при 56°С) и удлинения (1 минута при 72°С). ПЦР-продукты анализировали с помощью электрофореза в 0,8% агарозном геле. Уровень экспрессии измеряли с использованием GelPro32.EXE v4.6 (Media Cybernetics, Inc.). Шаперонин-кодирующий ген, обозначенный cha", использовали в качестве контроля для нормализации уровней экспрессии.

6) Разрушение гена-мишени
Для анализа функции гидрогеназ in vivo T. onnurineus, мутанты инсерционной инактивации крупной субъединицы гидрогеназы mch или mfh2 конструировали с использованием системы разрушения генов для гипертермофильных архебактерий T. kodakaraensis KOD1 (Sapra, R., К.Bagramyan, and M.W.W.Adams, 2003, A simple energy-conserving system: Proton reduction coupled to proton translocation. Proc. Natl. Acad. Sci. USA 100:7545-7550). В частности, ДНК-фрагменты, содержащие фланкирующую область крупных субъединиц ((TON_023 и TON_1569) каждой из гидрогеназ mch и mfh2, амплифицировали из геномной ДНК Т. onnurineus NA1 с использованием наборов праймеров (таблица 3) для Flk-mch или Flk-mfh2. Каждый из амплифицированных фрагментов лигировали в pUC118, гидролизованный ферментом HincII. Затем матрицу (рекомбинантную плазмиду Flk-mch_pUC118 или Flk-mfh2 pUC118) подвергали обратной ПЦР с использованием наборов праймеров (Ivs-mch или Ivs-mfh2) (таблица 3), а затем лигировали в кластер Рgdh-hmgpfu (Sapra, R., K.Bagramyan, and M.W.W.Adams. 2003. A simple energy-conserving system: Proton reduction coupled to proton translocation. Proc. Natl. Acad. Sci. USA 100:7545-7550). Лигированный продукт переносили в клетки Escherichia coli DH5α. Рекомбинантные плазмиды (mch:: Pgdh-hmgPfu и mfh2:: Pgdh-hmgPfu) получали с использованием мининабора для плазмид (Qiagen, Hilden, Germany). И наконец, плазмиды переносили в Т. onnurineus NA1 с применением слегка модифицированного метода Sato et al. (Sato, Т., Т.Fukui, H.Atomi, and T.Imanaka. 2003. Targeted gene disruption by homologous recombination in the hyperthermophilic archaeon Thermococcus kodakaraensis KOD1. J. Bacteriol. 185:210-220., Sato, Т., T.Fukui., H.Atomi, and T.Imanaka. 2005. Improved and versatile transformation system allowing multiple genetic manipulations of the hyperthermophilic archaeon Thermococcus kodakaraensis. Appi. Environ. Microbiol. 71:3889-3899). Трансформанты скринировали в среде ASW-YT-S в присутствии 10 мкМ симвастатина (Matsumi, R., К.Manabe, Т.Fukui, H.Atomi, and T.Imanaka. 2007. Disruption of a sugar transporter gene cluster in a hyperthermophilic archaeon using a host-marker system based on antibiotic resistance. J. Bacteriol. 189:2683-2691), и группы-кандидаты, в которых, как предполагается, были делегированы гены-мишени, подтверждали путем оценки присутствия кластера Pgdh-hmgPfu в области-мишени.
7) Влияние кинетики на рост микроорганизмов и продуцирование водорода
Рост микроорганизмов наблюдали визуально. Образцы разводили в стерильной воде, содержащей морскую соль (30,0 г/л), формалин (2,5%) и 4,6-диамидино-2-фенилиндол (0,01%) (Sato, Т., Т.Fukui, H.Atomi, and T.Imanaka. 2005. Improved and versatile transformation system allowing multiple genetic manipulations of the hyperthermophilic archaeon Thermococcus kodakaraensis. Appl. Environ. Microbiol. 71:3889-3899). Разведенные образцы фильтровали через черный поликарбонатный фильтр (размер пор: 0,2 мкм; Whatman), а затем анализировали на оптическом фазово-контрастном микроскопе (Zeiss Axioplan). Состав газа водорода определяли на газовом хроматографе HP 5890 серии II (Hewlett Packard), снабженном колонкой с молекулярными ситами HP-PLOT (Agilent) и детектором TCD. В качестве газа-носителя использовали аргон. Температура печи составляла 40°С. 10 мкл газового образца для анализа брали с помощью газонепроницаемого шприца через бутилкаучуковую пробку. Состав детектируемого газа водорода определяли путем сравнения площади пика с площадью пика калибровочной кривой, построенной с помощью регрессионного анализа с использованием стандартного газа, содержащего 40% водорода в азоте.
(3) Результаты теста
1) In silico анализ гидрогеназы Т. onnurineus NA1
Предварительный геномный анализ Т. onnurineus NA1 указывал на присутствие восьми кластеров генов гидрогеназы (Porter, К.G. and Y.S.Feig. 1980. The use of DAPI for identifying and counting microflora. Limnol. Oceanogr. 25:943-948), которые включают пять мембраносвязанных [NiFe]-гидрогеназ (Mbh, TON_1583-1595; Mbx, TON_0486-0498; Mfh1, TON_0273-0278; Mfh2, TON_1566- 1573; и Mch, TON_1021-1024), и три цитоплазматические [NiFe]-гидрогеназы (Fru, TON_1559-1562; Sulf I, TON_0533-0544; и Sulf II, TON 0051-0055). В результате проведения сравнительного анализа кластеров генов гидрогеназы и штаммов Thermococcales, секвенирование генома которых было завершено, было обнаружено, что кластеры, гомологичные кластерам Mfhl, Mfh2 и Mch, встречаются очень редко, и такие кластеры были обнаружены в штаммах Thermococcales, у которых были недавно определены последовательности геномов, а именно такие, как Т. barophilus МР (гомологи Mfhl и Mch), Thermococcus sp. AM4 (гомологи Mfhl и Mch) (неопределенная последовательность, GenBank peг. №ABXN00000000), и Т. gammatolerans (гомологи Mfhl и Mfh2) (GenBank peг. №СР001398). Секвенирование кластера fdh1-mfh1-mnh1 (обозначенного Нуg4-I в работах Lee, H. S., S.G.Каng, S.S.Bae, J.К.Lim, Y.Cho, Y.J.Kirn, J.H.Jeon, S.-S.Cha, K.K.Kwon, H.-T.Kirn, C.-J.Park, H.-W.Lee, S.I.Kirn, J.Chun, R.R.Colwell, S.-J.Kirn, and J.-H.Lee. 2008. The complete genome sequence of Thermococcus onnunneus NAl reveals a mixed heterotrophic and carboxydotrophic metabolism. J. Bacteriol. 190:7491-7499), кластера fdh2-mfh2-mnh2 (обозначенного Hyg4-III) и кластера codh-mch-mch3 (обозначенного Hyg4-II) в Т. onnurineus NAl показало, что каждый из этих кластеров включал оксидоредуктазы, такие как формиат-дегидрогеназа (FDH) и СО-дегидрогеназа (Codh). В частности, карбоксидотропный метаболизм, наблюдаемый при культивировании в СО-содержащей среде, позволяет предположить, что кластер Codh-Mch-Mnh3 играет функциональную роль в вырабатывании энергии в реакциях продуцирования водорода путем окисления СО.
2) Экспрессия генов гидрогеназы в условиях СО-индуцированного роста
Был проведен тест для того, чтобы определить, может ли T. onnurineus NA1 продуцировать водород при культивировании в СО-содержащей среде. Как показано на фиг.7, в среде YPS, продуцирование водорода не может быть детектировано, однако в среде 1, в которую был добавлен СО, общее количество газа водорода и число клеток увеличивалось по мере увеличения времени культивирования.
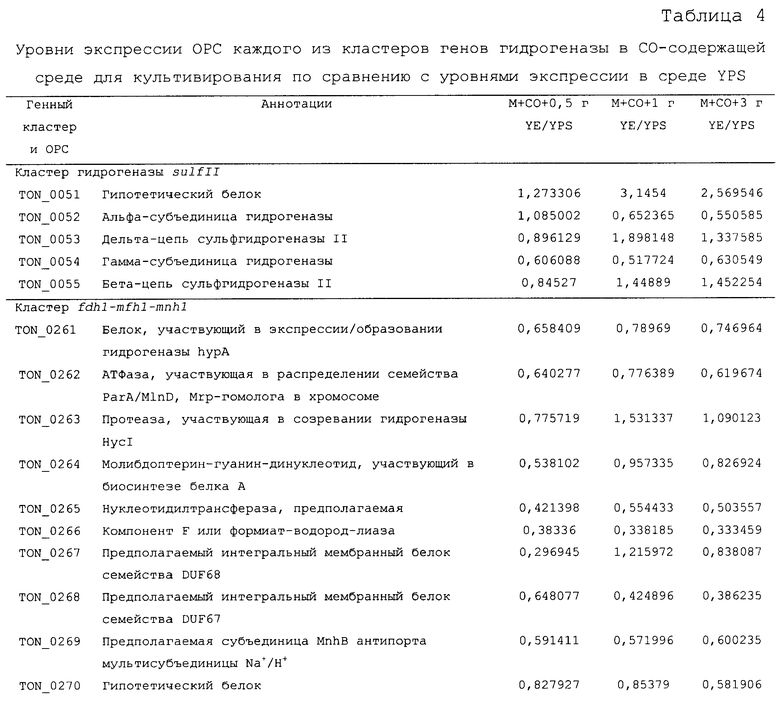
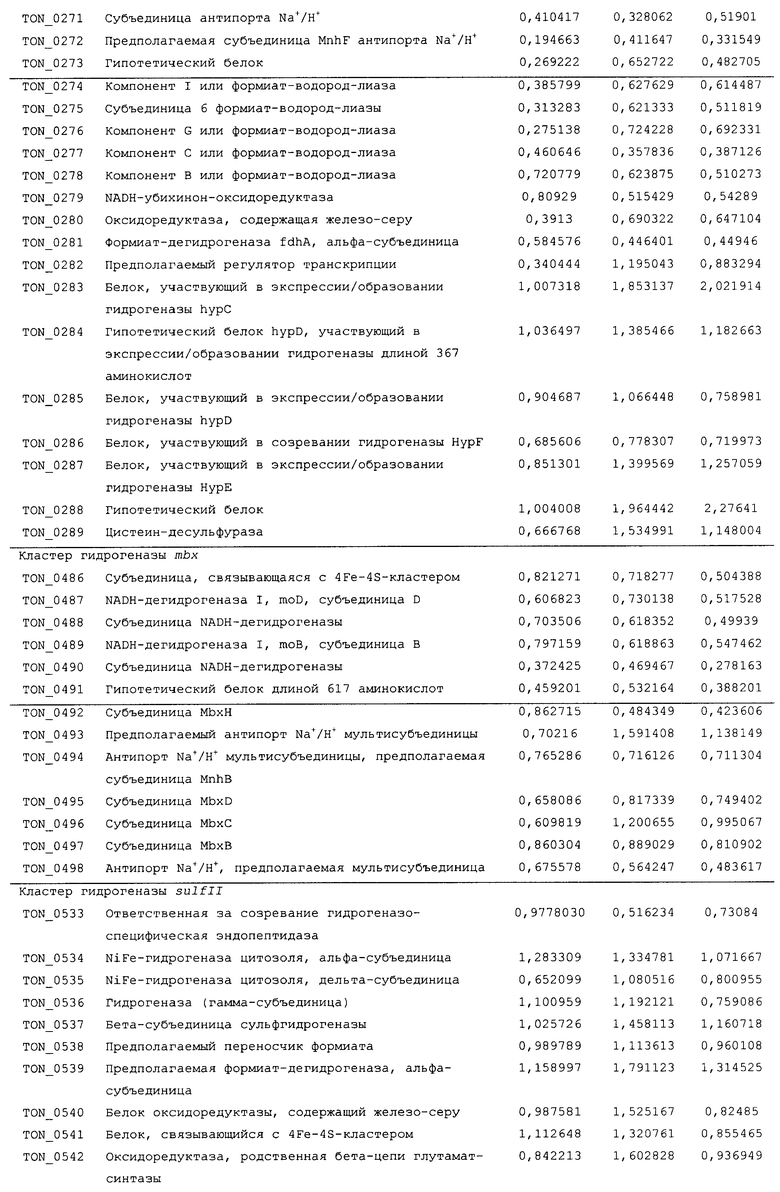
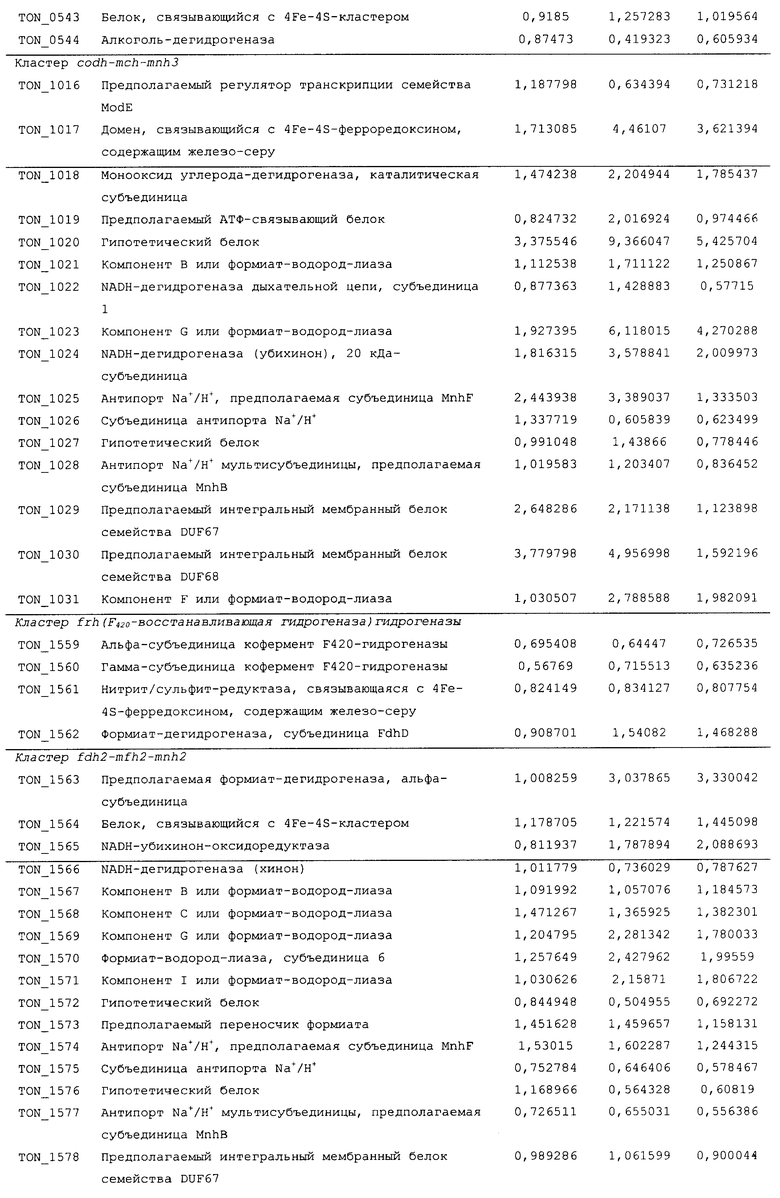
Для того чтобы определить, какие из гидрогеназ участвуют в продуцировании водорода в процессе карбоксидотропного роста, были проанализированы уровни экспрессии генов гидрогеназы в СО-содержащей среде для культивирования или в комплексной среде (YPS). Как показано в таблице 4 и 5 и на фиг.8А, уровни экспрессии некоторых ОРС (10 из 16 ОРС) в кластере codh-mch-mnh3 в СО-содержащей среде для культивирования были по меньше мере в два раза выше уровней экспрессии в среде с YPS. Кроме того, уровни экспрессии нескольких ОРС (TON_1563 и TON_1569-1571) в кластере fdh2-mfh2-mnh2 были также выше в СО-содержащей среде для культивирования, включающей 1 г дрожжевого экстракта. Уровни экспрессии ОРС в кластере codh-mch-mnh3 варьировались в зависимости от количества дрожжевого экстракта, что дает основание предположить, что дрожжевой экстракт ассоциируется с ингибированием или активацией катаболизма при СО-индуцированном метаболизме (таблицы 4 и 5). С другой стороны, уровень экспрессии других кластеров генов гидрогеназы значительно не изменялся, а экспрессия генов (20 генов из 29 ОРС) в кластере fdh1-mfh1-mnh1 снижалась. Данные количественного ОТ-ПЦР-анализа для крупной субъединицы каждой из гидрогеназ также совпадают с данными, полученными с использованием микромассивов. Экспрессия крупных субъединиц (TON_1023 и TON_1569) гидрогеназ mch и mfh2 возрастала по меньшей мере в два раза (фиг.8В), а экспрессия крупной субъединицы (TON_0276) гидрогеназы mfhl ингибировалась; а что касается экспрессии других крупных субъединиц (mbh, mbx, frh и sulfl), то она поддерживалась на постоянном уровне в обоих состояниях. Полученные результаты позволяют предположить, что кластеры codh-mch-mnh3 или fdh2-mfh2-mnh2 могут быть индуцированы СО и могут участвовать в процессах продуцирования водорода, ассоциированных с карбоксидотропным метаболизмом.
3) Разрушение гена и анализ фенотипов мутантов по разрушению
Транскриптомный анализ дает основание предположить, что гидрогеназный кластер mch, который является близкородственным кластеру codh (фиг.9А), может играть важную роль в карбоксидотропном гидрогенезе в T. onnurineus NA1. Однако в связи с активацией кластера fdh2-mfh2-mnh2 и образованием большого числа копий мРНК других кластеров возникает вопрос, может ли сам кластер codh-mch-mnh3 участвовать в карбоксидотропном гидрогенезе и могут ли другие гидрогеназы действовать по альтернативному пути для mch посредством образования комплексов в комбинации с дегидрогеназами или рециклинга электронных носителей, таких как FADH2 или NADH. Таким образом, авторами настоящего изобретения были сконструированы мутанты по разрушению крупной субъединицы каждой из гидрогеназ mch и mfh2 (Matsumi, R., К.Manabe, Т.Fukui, H.Atomi, and T.Imanaka. 2007. Disruption of a sugar transporter gene cluster in a hyperthermophilic archaeon using a host-marker system based on antibiotic resistance. J. Bacteriol. 189:2683-2691). Метод конструирования мутантов по разрушению проиллюстрирован на фиг.9А. Крупную субъединицу кластера гена гидрогеназы Mch или Mfh2 подвергали дизрупции путем инсерционной инактивации кластера Pgdh-hmgPfu посредством гомологичной рекомбинации в области мишени, что приводило к сверхэкспрессии гена hmg-CoA. Дизрупцию гена-мишени подтверждали путем анализа на присутствие кластера Pgdh-hmgPfu с помощью ПЦР-амплификации после скрининга групп-кандидатов в среде YPS, в которую было добавлено 10 мкМ симвастатина (фиг.9В). Pgdh-hmgPfu может быть амплифицирован в группах-кандидатах с дизрупцией (ΔmchTNA1 и Δmfh2TNA1), тогда как амплификация крупных субъединиц mch или mfh2 не происходила. Полученные результаты показали, что система дизрупции генов, сообщаемая для Т. kodakaraensis KOD1 (Sapra, R., K.Bagramyan и М.W.W.Adams. 2003. A simple energy-conserving system: Proton reduction coupled to proton translocation. Proc. Natl. Acad. Sci. USA 100:7545-7550), может быть также применена к Т. onnurinues NA1.
Поскольку мутанты с разрушением (ΔmchTNA1 и Δmfh2TNA1) могут быть получены в среде YPS, то очевидно, что Mch или Mfh2 не играют важной роли в метаболическом поглощении среды YPS. Как видно на фиг.10, изменения в росте и морфологии мутантных штаммов ΔmchTNA1 и Δmfh2TNA1 подтвердили, что эти гены необязательно должны присутствовать в среде YPS. Кроме того, штамм Δmfh2TNА1 обладает способностью расти и продуцировать водород в СО-содержащей среде для культивирования на уровне, аналогичном уровню, наблюдаемому для штамма дикого типа (фиг.7 и 10). С другой стороны, мутант ΔmсhTNA1 не обладает способностью расти в СО-содержащей среде для культивирования и не способен продуцировать водород в данной среде (фиг.10). Полученные данные показали, что отсуствие крупной субъединицы Mch приводит к полному подавлению способности штамма Т. onnurineus NA1 выживать в карбоксидотропных условиях в присутствии СО. Полученные результаты в целом показали, что при подаче СО в качестве субстрата в росте и продуцировании водорода участвует только гидрогеназа Mch.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
Как описано выше, новые гидрогеназы согласно изобретению могут продуцировать большое количество водорода благодаря их специфической восприимчивости к различным субстратам, таким как монооксид углерода, формиат или крахмал. В соответствии со способами получения водорода согласно изобретению большое количество водорода может быть получено просто путем культивирования вышеописанного штамма в специфических условиях культивирования. Таким образом, способы согласно изобретению имеют преимущества, заключающиеся в том, что они являются экономически более выгодными и более эффективными, чем известные способы получения водорода, и могут быть применены для получения водорода даже при высоких температурах.
































































































































Изобретение относится к биотехнологии. Представлены ферменты: гидрогеназа и дегидрогеназа, выделенные из Thermococcus onnurineus NA1 и имеющие последовательности, приведенные в описании, а также кодирующие их гены. Описан вектор, содержащий указанные гены, объединенные в кластер CODH-MCH-MNH3. Создана клетка-хозяин, содержащая указанный вектор. Предложены способы получения водорода, включающие следующие стадии: приготовления среды в сосуде для культивирования, культивирования рекомбинантной клетки-хозяина или штамма Thermococcus onnurineus NA1 в присутствии монооксида углерода, извлечения водорода из сосуда для культивирования. Изобретение позволяет наиболее эффективно получать водород микробиологическим способом. 8 н. и 4 з.п. ф-лы, 10 ил., 5 табл., 4 пр.
1. Выделенная гидрогеназа, содержащая аминокислотную последовательность SEQ ID NO: 5.
2. Выделенный ген, кодирующий гидрогеназу по п.1.
3. Ген по п.2, содержащий последовательность оснований SEQ ID NO: 16.
4. Способ получения водорода из Thermococcus spp., включающий стадии:
приготовления среды в сосуде для культивирования;
культивирования Thermococcus onnurineus NA1, имеющего гены, кодирующие гидрогеназу, содержащую аминокислотную последовательность SEQ ID NO: 5, и дегидрогеназу, содержащую аминокислотную последовательность SEQ ID NO: 10, в сосуде для культивирования с монооксидом углерода в качестве добавки к среде; и извлечения водорода из сосуда для культивирования.
5. Способ по п.4, где культивирование осуществляют при высокой температуре 80°С.
6. Способ по п.4, где культивирование осуществляют в анаэробных условиях.
7. Дегидрогеназа, содержащая аминокислотную последовательность SEQ ID NO: 10.
8. Ген, кодирующий дегидрогеназу по п.7.
9. Ген по п.8, содержащий последовательность оснований SEQ ID NO: 21.
10. Рекомбинантный вектор для получения водорода, содержащий гены SEQ ID NO:21 и SEQ ID NO:16 (гены, организованные в кластер CODH-MCH-MNH3), где указанные гены являются функционально связанными.
11. Прокариотическая клетка-хозяин для получения водорода, трансформированная рекомбинантным вектором по п.10.
12. Способ получения водорода с использованием трансформанта по п.11, включающий стадии:
приготовления среды в сосуде для культивирования;
подачи монооксида углерода в газовую фазу, присутствующую в сосуде для культивирования;
культивирования указанного трансформанта в сосуде для культивирования; и
извлечения водорода из сосуда для культивирования.
| TATYANA G | |||
| SOKOLOVA et al, "The first evidence of anaerobic CO oxidation coupled with Н production by a hyperthermophilic archaeon isolated from a deep-sea hydrothermal vent", Extremophiles (2004) 8:317-323 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| TAMOTSU KANAI et al., "Continuous hydrogen production by the hyperthermophilic archaeon, | |||
Авторы
Даты
2012-09-10—Публикация
2009-09-07—Подача