Область техники, к которой относится изобретение
Настоящее изобретение относится к реакциям амплификации нуклеиновых кислот, включая такие амплификации, при которых используется полимеразная цепная реакция, а также к анализу, использующему такие реакции в сочетании с методами детекции, включающими секвенирование и гибридизацию зонда.
Уровень техники
Методы и анализы, в которых используется амплификация нуклеиновых кислот хорошо известны. В некоторых случаях реакции амплификации изотермичны, например, в случае амплификации, основанной на последовательности нуклеиновой кислоты (NASBA). В других используется термический циклинг, как, например, в случае полимеразной цепной реакции (ПЦР). Предпочтительные амплификационные анализы, использующие флуоресцентную детекцию амплифицированного продукта, гомогенны, то есть, они не требуют физического разделения реагентов для детекции (например, отделения связанных зондов от несвязанных) и могут осуществляться в одном закрытом сосуде. Такие анализы могут быть проведены по конечной концентрации, то есть, продукт может определяться после завершения амплификации, а могут работать в режиме реального времени, при котором определение продукта происходит в процессе амплификации.
Амплификация нуклеиновых кислот и использующие ПЦР анализы описаны, например, в патентах U.S. Patents 4,683,202, 4,683,195 и 4,965,188, а, в общем случае, в руководстве ПЦР (PCR PROTOCOLS, a guide to Methods and Applications, Innis et al. eds., Academic Press (San Diego, CA (USA) 1990)). Гомогенные ПЦР-анализы, включая анализ в режиме реального времени, когда амплифицированный продукт определяется во время некоторых или всех циклов ПЦР в ходе реакции, описаны, например, в работах U.S. Patents 5,994,056, 5,487,972, 5,925,517 и 6,150,097.
Обычно, реакции ПЦР-амплификации планируют как симметричные, чтобы экспоненциально наращивать количество двухцепочечных ампликонов, используя прямой и обратный праймер в эквимолярных концентрациях и равные температуры плавления (Тm). Ограниченное использование нашел способ приготовления одноцепочечных ДНК непосредственно в ПЦР-реакции, он получил название "ЛПЭ-ПЦР". Gyllensten and Erlich, "Generation of Single-Stranded ДНК by the Polymerase Chain Reaction and lts Application to Direct Sequencing of the HLA-DQA Locus," Proc. Natl. Acad. Sci. (USA) 85: 7652-7656 (1988); а также U.S. Patent 5,066,584. Асимметричная ПЦР отличается от симметричной ПЦР-амплификации тем, что один праймер разбавляют в пять-сто раз, так чтобы его концентрация составляла от 1 до 20% от концентрации другого праймера. В результате амплификация состоит из экспоненциальной фазы, когда удлиняются оба праймера с получением двухцепочечного продукта, или ампликона, и следующей за ней линейной амплификации, когда остается только один праймер, что приводит к образованию одноцепочечного ампликона.
Авторы изобретения разработали несимметричный способ ПЦР-амплификации, получивший название "Линейная после экспоненциальной" или сокращенно "ЛПЭ-ПЦР". ЛПЭ-ПЦР представляет собой несимметричную амплификацию ПЦР, состоящую из экспоненциальной фазы, когда отжигаются и удлиняются оба праймера, и следующей за ней линейной фазой, наступающей после исчерпания запасов ограниченного праймера, когда отжигается и удлиняется только избыточный праймер. См. Sanchez et al. (2004) Proc. Natl. Acad. Sci. (USA) 101: 1933-1938, опубликованную международную патентную заявку WO 03/054233 (3 July 2003), и Pierce et al. (2005) Proc. Natl. Acad. Sci (USA) 102: 8609-8614, все эти работы включены по ссылке по всей своей полноте.
Удобный и недорогой способ наблюдения за процессом накопления двухцепочечных ампликонов при ПЦР-амплификации заключается в использовании красителя, флуоресцирующего при интеркаляции или каком-либо другом взаимодействии с двухцепочечной ДНК, например, это красители SYBR Green I или SYBR Gold. См., например, U.S. Patent 5,994,056. Для идентификации продукта проводят анализ температур плавления ампликонов, делая это либо в режиме реального времени в ходе амплификации, либо после завершения процесса. Проблема такого анализа температуры плавления заключается в том, что флуоресценция красителя зависит от размера ампликона. Еще одна проблема связана с перераспределением в ходе анализа красителя из продуктов амплификации, или ампликонов, с низкой температурой плавления в ампликоны с более высокой температурой плавления, что искажает результаты. Для решения проблем было разработано два подхода. Один подход называется G-гашением, при этом на конструкцию праймера накладываются серьезные ограничения и наблюдается большая фоновая флуоресценция. (Crockett АО, Wittwer СТ. "Fluorescein-Labeled Oligonucleotides for Real-Time PCR: Using the Inherent Quenching of Deoxyguanosine Nucleotides" Anal. Biochem. 290:89-97 (2001)). Согласно другому способу красители SYBR заменяют на LC Green, что приводит к очень низкому проценту сигнала для сиквенсов, не представленных в избытке, и требует высоко специализированного программного обеспечения и оборудования (Wittwer et al. High- Resolution Genotyping by Amplicon Melting Analysis Using LCGreen," Clin. Chem. 49:853-860(2003).
Флуоресцентные меченые зонды используются в гомогенном анализе амплификации нуклеиновых кислот, включая ПЦР, для измерения накопления требуемого ампликона как в реальном времени, так и по конечной концентрации. Несколько доступных типов зондов эффективно позволяют различать аллели, по сравнению с линейными одноцепочечными зондами. Зонды реального времени включают двукратно меченые линейные зонды, расщепляемые в результате 5'-3'-экзонуклеазной активности ДНК-полимеразы на этапе удлинения цикла ПЦР (см. американские патенты U.S. 5,210,015, 5,487,972 и 5,538,848); молекулярные сигнальные зонды (см. американские патенты 5,925,517, 6,103,476 и 6,365,729); минорные зонды, связывающиеся с бороздками (minor groove binding probes) (см. Afonina et al. "Minor Groove Binder-Conjugated ДНК Probes for Quantitative ДНК Detection by Hybridization-Triggered Fluorescence," Biotechniques 32: 946-949 (2002)); линейные пары зондов, дающие ответ FRET при гибридизации рядом друг с другом на целевой цепочке; гасимые двухцепочечные линейные зонды, конкурирующие с мишенью по гибридизации с меченой цепочкой зонда (см Li, Q. et al. (2002), Nucl. Acid. Res. 30: e5); а также так называемые зонды, "зажигающие свет", представляющие собой олигомеры пептидов и нуклеиновых кислот (PNA), связанные с асимметричным цианиновым красителем, который начинает флуоресцировать, если зонд связывается с мишенью с образованием двухцепочечного участка. Для способа ЛПЭ-ПЦР использовали низкотемпературные аллель-дифференцирующие зонды, такие как низкотемпературные молекулярные сигнальные зонды (см. WO 03/045233). Меченые олигонуклеотидные зонды можно связать с праймерами с помощью линкеров, так что при амплификации зонды не будут копироваться, а могут гибридизоваться с последовательностью мишени, что приводит к удлинению праймера. Примерами являются праймеры Scorpions® с присоединенными к ним молекулярными сигнальными зондами или Anglers® с присоединенными к ним флуорофор-мечеными линейными зондами. Lee, М.А. et al. (2002), Analytica Clinica Acta 457: 61:70; Whitcombe, D. et al. (1999), Nature Biotechnology 17: 804-807. Входящий в состав такой сложной структуры зонд, несущий на себе флуоресцентную метку, гибридизуется отдельно от праймера. Таким образом, в соответствии с используемыми здесь терминами, они представляют собой меченые зонды и немеченые праймеры. Однако, специфичные к мишени зонды не позволяют осуществлять мониторинг общего накопления двухцепочечного продукта.
Существуют зонды, устойчивые к несоответствиям. Такие зонды гибридизуются (с генерацией детектируемого сигнала) с более чем одной последовательностью-мишенью при температуре детекции анализа, и различные формирующиеся при этом гибриды будут обладать различными температурами плавления. В общем случае, к таким зондам относятся линейные одноцепочечные зонды, или зонды в виде статистического клубка. Примерами таких зондов являются линейные зонды с внутренней флуоресцирующей группой, уровень флуоресценции которых возрастает с той или иной целевой цепью; флуоресцентно меченые линейные зонды, используемые совместно с красителями SYBR Gold и SYBR Green I, так что флуоресценция метки возникает по методу FRET из красителя при гибридизации зонда с той или иной мишенью (см. американский патент US 2002/0119450, 28 August 2002), так называемые "водяные маяки" и разновидности пар линейных зондов, участвующих в резонансном гашении флуоресценции (FRET, см. U.S. patent 6,472,156).
Использование нескольких зондов, каждый из которых связывается только с одним возможным целевым ампликоном, полученным в ходе реакции амплификации, создает проблемы при анализе сложных реакционных смесей или при детекции одной или нескольких мишеней среди большого количества возможных. Доступные методы детекции флуоресценции позволяют различить только ограниченное число флуорофоров, обычно не больше восьми. Возможно также ограниченное мультиплексирование, например, заключающееся в конструировании отдельного аллель-дискриминирующего молекулярного сигнального зонда (маяка) для каждой мишени и дифференцированное введение в них метки (см., например, Tyagi et al. (2000) Nature Biotechnology 18:1191-1196). Смеси аллель-дискриминирующих зондов, каждый из которых содержит аликвоты нескольких различных цветов, дают при удлинении большое количество характеристик. Этот способ эффективен, только если в смеси фактически присутствует только одна из нескольких (по меньшей мере до 56) мишеней; если присутствует более одной мишени, то возникают неоднозначные результаты.
Часто приходится работать с комплексными мишенями или с одной мишенью из нескольких возможных. Для таких случаев было разработано и предлагалось несколько схем, но все они связаны с серьезными недостатками и ограничениями. В международной патентной заявке WO 01/31062 авторы Tyagi et al. описали способ, иногда называемый "водяными маяками". Последние представляют собой молекулярные зонды, аминокислотные последовательности которых собраны в большие петли, что делает их толерантными к несоответствиям и способными до некоторой степени связываться с несколькими мишенями при температуре отжига реакции ПЦР-амплификации. Такие зонды характеризуются плохой кинетикой реакции с несоответствующими мишенями, при температуре циклов ПЦР-амплификации они остаются гибридизованными с мишенями, обладающими "правильной" последовательностью, кроме того, они расщепляются ДНК-полимеразой Taq. Более того, удается получить только косвенные данные о температурах плавления гибридов зонд-мишень в условиях анализа, и это позволяет предположить, что равновесие было достигнуто. Было описано мультиплексирование в режиме реального времени для симметричной ПЦР-амплификации с зондами FRET, описанными выше. Чтобы не мешать амплификации, температуры плавления всех гибридов зонд-мишень ограничиваются в узком температурном интервале между температурой отжига праймера и температурой его удлинения. Кроме того, подобная схема не является количественной. В работе Wittwer et al., "Real-Time Multiplex PCR Assays, Methods" 25:430-442 (2001) рассматривается пост-амплификационный мультипробный анализ с использованием зондов FRET различных цветов. После симметричной ПЦР-амплификации реакционную смесь быстро охлаждают, а затем медленно нагревают, чтобы определить кривые плавления различных флуорофоров. Данный подход не является количественным. Кроме того, из-за большого разброса данных, получаемых при повторе симметричных ПЦР-амплификации, анализы по конечной концентрации также, как правило, бывают только качественными.
Альтернативой зондам служат продукты реакций секвенирования. При традиционной расшифровке последовательности ДНК продукты реакции амплификации, такой как симметричная ПЦР или ЛПЭ-ПЦР, могут использоваться как исходный материал для цикла секвенирования. Амплифицированный продукт очищают осаждением в этаноле или на колонке для проведения хроматографии по сродству, чтобы удалить оставшиеся дНТФ и праймеры, после чего подвергают циклической реакции секвенирования с использованием одного секвенированного праймера и флуоресцентно меченых нуклеотидов, а затем проводят капиллярный гель-электрофорез. В соответствующей области известен также способ "пиросеквенирования", представляющий собой изотермический метод синтеза последовательности нуклеотидов в режиме реального времени. Если для наработки исходного материала для пиросеквенирования используются способы экспоненциальной амплификации, такие как ПЦР, то амплифицированный продукт необходимо очистить, выделив одноцепочечный продукт и удалив из реакции дНТФ, пирофосфат и неиспользованные праймеры. Метод ЛПЭ-ПЦР упрощает приготовление образцов, поскольку позволяет получить первично одноцепочечные продукты, но не избавляет от необходимости проведения очистки.
Аспектом настоящего изобретения являются способы гомогенной детекции продуктов реакций амплификации, изотермической или в режиме температурного циклинга. При этом детектируется флуоресценция меченных флуорофором линейных олигонуклеотидных праймеров, причем возбуждается непосредственно флуоресцентный краситель ДНК, такой как SYBR Green I или, предпочтительно, SYBR Gold. Такие красители начинают флуоресцировать, если связываются с двухцепочечной ДНК, в которую они должны интеркалировать. Описанные далее способы могут осуществляться в режиме реального времени или после окончания реакции амплификации, причем либо при температуре детекции считывается значение флуоресценции (детекция по конечной концентрации), либо флуоресценция определяется как функция от температуры с помощью пост-амплификационного анализа плавления. При нагреве реакционной смеси температура последовательно проходит температуры плавления различных продуктов реакции, при этом содержащие праймеры с флуорофором ампликоны последовательно становятся одноцепочечными, и флуоресценция быстро снижается. Предпочтительные способы включают вычисление отношения сигнала от праймера к сигналу от красителя.
Еще одним аспектом настоящего изобретения является набор реагентов, содержащий как флуоресцентный краситель ДНК, так и по меньшей мере один такой меченый праймер, предпочтительно в составе пары праймеров, а также необязательно реагенты для амплификации.
Другими аспектами настоящего изобретения являются гомогенные способы определения продуктов реакции ЛПЭ-ПЦР, использующие этап низкотемпературной детекции. Согласно некоторым аспектам в реакционную смесь включают по меньшей мере один аллель-дискриминирующий зонд, соответствующий настоящему изобретению, а именно, погашенный двухцепочечный зонд, тип которого, в целом, был описан в работе Li, Q. et al. (2002) Nucl. Acids Res. 30: e5, за исключением того, что он представляет собой низкотемпературный (Low-Tm или Super-Low Tm) мишень-специфический зонд, и что для его косвенного возбуждения необходимо возбудить флуоресцентный ДНК-краситель, интеркалированный в гибрид зонд-мишень, такой как, предпочтительно, SYBR Gold. К числу других аспектов относится включение в реакционную смесь по меньшей мере одного косвенно возбуждаемого толерантного к несоответствиям зонда в соответствии с настоящим изобретением, а именно, погашенного одноцепочечного зонда, в целом, относящегося к типу, описанному в работе Lee и в опубликованной в США патентной заявке Pub. No. US 2002/0119450, за исключением того, что он представляет собой погашенный низкотемпературный зонд. Эти разнообразные способы включают возбуждение красителя на этапе низкотемпературной детекции во время ЛПЭ-ПЦР-амплификации и детекции флуоресценции зондов в этих условиях, что позволяет определить количество целевой одноцепочечной последовательности. Конкретные аспекты могут далее включать определение общего количества двухцепочечного продукта (продуктов) в реакционной смеси с помощью измерения флуоресценции красителя, предпочтительно во время или в конце этапа протекания циклов ПЦР, причем температура реакционной смеси остается выше температуры (температур) плавления зондов. В соответствии с некоторыми предпочтительными способами определяется отношение сигнала зонда к сигналу красителя. При наличии повторных образцов такое соотношение корректирует величину различий между амплификации, которые, как известно, имеют место при ПЦР-амплификации.
Другими аспектами настоящего изобретения являются такие низкотемпературные аллель-дискриминирующие и погашенные толерантные к несоответствиям зонды, наборы ЛПЭ-ПЦР, которые включают по меньшей мере один такой низкотемпературный мишень-специфический зонд совместно с реагентами для амплификации и, предпочтительно, с флуоресцентным красителем ДНК; а также наборы олигонуклеотидов, содержащие праймеры ЛПЭ-ПЦР и по меньшей мере один такой зонд.
Другими аспектами изобретения являются гомогенные способы детекции, применяемые при наличии нескольких ампликонов. Такие способы предполагают включение в реакционную смесь ЛПЭ-ПЦР-амплификации одного или нескольких низкотемпературных толерантных к несоответствиям детекционных зондов, которые из-за своей низкой Тm не мешают амплификации и не гидролизуются (не режутся) ДНК-полимеразами с 5'-3'-экзонуклеазной активностью и которые при гибридизации и возбуждении испускают флуоресцентный сигнал либо непосредственно, благодаря наличию подходящего источника возбуждения, либо косвенно, благодаря флуоресцентному красителю, возбуждаемому подходящим источником возбуждения. Такие способы включают анализы с использованием одного или нескольких зондов и применяются, например, при генотипировании. Одним флуорофором можно пометить несколько зондов, и в этом случае дискриминация будет основана на изменении флуоресценции с температурой, как в случае одного зонда. Зонды можно пометить различными флуорофорами, и в этом случае для дискриминации также используются и различия в цвете. Дискриминация между мишенями с целью идентификации и количественного анализа может включать определение соотношения флуоресценции между флуорофорами при одной и той же или различных температурах, а также соотношения флуоресценции флуорофора/красителя. Детекция предпочтительно осуществляется при амплификации (в режиме реального времени), еще более предпочтительно, на этапе низкотемпературной детекции, включенной в протокол ЛПЭ-ПЦР-амплификации, этап детекции может предполагать детекцию при нескольких температурах. Еще один аспект настоящего изобретения представляет собой одноцепочечный линейный зонд, подходящий для этих способов детекции (такие зонды описаны в американской патентной заявке U.S. 2002/0119450 (29 августа 2002)), то есть, зонд, возбуждаемый эмиссией флуоресценции из флуоресцентного красителя ДНК, если не считать того, что он представляет собой низкотемпературный зонд (Low-Tm или Super-Low-Tm), толерантен к несоответствиям, а также содержит группу, гасящую флуоресценцию, которая в противном случае при низкой температуре была бы обусловлена вторичной структурой.
Еще одним аспектом настоящего изобретения является амплификация при секвенировании, которая позволяет подготовить продукт ЛПЭ-ПЦР-амплификации для пиросеквенирования, причем происходит это в реакционной камере для амплификации, сосуде, ячейке, слайде или контейнере. Это означает выполнение всех операций "в одной пробирке" и позволяет проводить ЛПЭ-ПЦР-амплификацию в маленьких объемах, предпочтительно, 17 мкл или меньше.
Еще одним аспектом настоящего изобретения является способ приготовления продуктов ЛПЭ-ПЦР для определения последовательности нуклеиновых кислот, при котором проводится только пост-амплификационное разбавление водой реакционных смесей для амплификации и который может быть представлен как операция "в одной пробирке".
Раскрытие изобретения
В настоящей заявке упоминается температура плавления, Тm, праймеров нуклеиновых кислот, зондов и ампликонов. Тm означает температуру, при которой половина исследуемого вещества существует в двухцепочечной, а половина в одноцепочечной форме. В общем случае, если не считать ЛПЭ-ПЦР, Тm праймера рассчитывается либо по методу "%GC" (Wetmar, J.G. (1991) "ДНК Probes: Applications of the Principles of Nucleic Acid Hybridization," Crit. Rev. Biochem. MoL Biol. 26: 227-259), либо по методу "2(А+Т) плюс 4(G+C)", оба они хорошо известны. Рассчет производится для стандартных условий концентраций праймера и солей. В то же время, способ ЛПЭ-ПЦР учитывает фактические температуры плавления праймеров в конкретной реакции, а для этого учитывается также концентрация праймера в начале амплификации. См. Sanchez et al. (2004) PNAS (USA) 101: 1933-1938, and Pierce et al. (2005) Proc. Natl. Acad. Sci (USA) 102: 8609-8614.
В настоящей заявке такие связанные с концентрацией температуры плавления в начале процесса амплификации обозначают символом Тm[0]. Его значение можно определить эмпирически, что бывает необходимо при использовании ненатуральных нуклеотидов, или его можно рассчитать по методу "ближайшего соседа" (Santa Lucia, J. (1998), PNAS (USA) 95: 1460-1465; and Allawi, H.T. and Santa Lucia, J. (1997), Biochem. 36: 10581-10594), настроив нужным образом концентрацию соли; в приводимом далее примере она составляет 0,7 М одновалентного катиона. В способе ЛПЭ-ПЦР может быть учтена также температура плавления ампликона, вычисляемая по формуле Тm=81,5+0,41(%G+%C)-500/L+16,6 log [M]/(l+0,7 [М]), где L означает длину в нуклеотидах, а [М] соответствует молярной концентрации одновалентного катиона. Температуры плавления линейных или свернутых в статистический клубок зондов рассчитываются как для праймеров. Температуры плавления структурированных зондов, например, молекулярных маяков, можно определить эмпирически.
В настоящей заявке термин "ЛПЭ-ПЦР" соответствует несимметричной амплификации ДНК, основанной на полимеразной цепной реакции (ПЦР), один из олигонуклеотидных праймеров которой (избыточный праймер) представлен в пятикратном избытке по сравнению с другим праймером (ограниченный праймер), причем его концентрация невелика (до 200 нМ), так чтобы его хватило приблизительно на столько циклов ПЦР, чтобы получить флуоресцентно детектируемый ампликон в виде двойной спирали, где зависящая от концентрации температура плавления ограниченного праймера в начале амплификации, Тm[0] L, не более чем на пять градусов меньше зависящей от концентрации температуры плавления избыточного праймера в начале амплификации, Tm[0] x, предпочтительно, если она будет по меньшей мере столь же высока, еще более предпочтительно, если она будет на 3-10°С выше; и где после израсходования ограниченного праймера термическая обработка продолжается достаточное количество циклов, чтобы получить одноцепочечный продукт, а именно продукт удлинения избыточного праймера, иногда называемый "цепочкой избыточного праймера".
Праймеры и зонды настоящего изобретения или используемые в способах и наборах настоящего изобретения представляют собой олигонуклеотиды в широком смысле слова, то есть, они могут представлять собой ДНК, РНК, смеси ДНК и РНК, могут содержать неприродные нуклеотиды (например, 2'-орто-метилрибонуклеотиды) и неприродные межнуклеотидные связи (например, фосфортиоатные связи). Частично функция праймеров и зондов заключается в гибридизации с интересующей последовательностью в реакционной смеси. Праймер представляет собой одноцепочечный олигонуклеотид, который может гибридизоваться с комплементарной последовательностью при температуре отжига в реакции амплификации, а также может удлиняться в сторону 3'-конца под действием ДНК-полимеразы. Праймер настоящего изобретения сигнализирует о своей гибридизации с помощью косвенно возбуждаемого флуорофора. Зонд настоящего изобретения или используемый в способах и наборах настоящего изобретения представляет собой или содержит одноцепочечный олигонуклеотид, который может гибридизоваться с целевой последовательностью (или последовательностями) при температуре (или температурах) детекции во время или после реакции амплификации и подавать флуоресцентный сигнал о прошедшей гибридизации с помощью косвенно возбуждаемого флуорофора. В контексте настоящего изобретения "зонд" не удлиняется в реакции амплификации под действием ДНК-полимеразы. Зонды, которые высоко специфичны к комплементарной целевой последовательности и не гибридизующиеся в очень похожими мишенями, отличающимися от целевой на одно или два основания, называются "аллель-дискриминирующими" (allele discriminating). Зонды, которые гибридизуются в приемлемых условиях детекции не только с идеально комплементарными последовательностями, но также и с частично комплементарными последовательностями, содержащими одно или два отличия, называются зондами "толерантными к несоответствиям" (mismatch tolerant).
Флуоресцентный ДНК-краситель в настоящем изобретении означает состав, например, SYBR Green I или SYBR Gold, который флуоресцентно возбуждается при связывании с двухцепочечной ДНК. Сообщалось, что флуоресцентные ДНК-красители интеркалируют в двухцепочечную ДНК, но это не ограничивается никакими теориями, объясняющими их действие.
Праймеры настоящего изобретения используются совместно с флуоресцентным красителем ДНК и представляют собой одноцепочечные олигонуклеотиды, меченные косвенно возбуждаемым флуорофором, который при гибридизации праймера с цепочкой-темплатом реакционной смеси формирует область двухцепочечной ДНК и излучает свет (обычно, но не всегда видимый) с длиной волны, которая возбуждает или поглощается флуоресцентным красителем ДНК, флуорофор испускает свет. Сообщалось, что энергия передается от флуоресцентного красителя ДНК к соседнему флуорофору с помощью флуоресцентной резонансной передачи энергии (fluorescence resonance energy transfer (FRET)), но не ограничиваясь какими-либо теориями, объясняющими их действие. Флуорофор, испускающий свет при таких условиях, будет называться "косвенно возбуждаемым". Зонды настоящего изобретения также используются совместно с флуоресцентным красителем, который связывается с двухцепочечной ДНК ("флуоресцентные красители ДНК"); этот краситель помечен таким косвенно возбуждаемым флуорофором, так что, когда зонд гибридизуется с целевой цепочкой в реакционной смеси и краситель возбуждается, флуорофор испускает свет.
В контексте настоящего изобретения "набор" означает группу реагентов для выполнения амплификации или анализа. Набор может быть "полным", то есть, содержать все реагенты, необходимые на всех этапах амплификации или детекции. Он может быть также "частичным", то есть, некоторые необходимые для этого реагенты могут отсутствовать. Полные и частичные наборы настоящего изобретения могут дополнительно содержать реагенты для приготовления образцов, например, для выделения нуклеиновых кислот или обратной транскрипции. Секвенирование может требовать двух наборов, например, полного набора для ЛПЭ-ПЦР-амплификации и полного набора для циклического секвенирования, или эти наборы можно объединить в общий набор.
В контексте настоящего изобретения термин "группа олигонуклеотидов" означает группу праймеров или праймеров и зондов для выполнения амплификации или анализа. Набор олигонуклеотидов для секвенирования может включать, например, ограниченный и избыточный праймер для ЛПЭ-ПЦР и один или несколько дополнительных праймеров для циклического секвенирования. Набор олигонуклеотидов для анализа с гибридизационными зондами может включать, например, ограниченный и избыточный праймер для ЛПТ-ПЦР и по меньшей мере один меченный флуорофором гибридизационный зонд.
В контексте настоящего изобретения термин "метод одной пробирки" означает по меньшей мере две операции, например, приготовление образца, амплификацию или секвенирование, для выполнения которых не требуется переноса образца из одного контейнера, будь то пробирка, реакционная ячейка, камера в микрофлуидальном устройстве, стеклянный слайд или любой другой аппарат, в котором может находиться реакционная смесь, в другой контейнер.
Зонды с низкими температурами плавления (то есть, зонды, формирующие гибриды зонд-мишень с низкой температурой плавления) можно вводить в реакционную смесь для амплификации до начала амплификации и использовать только при необходимости. Поддержание температуры выше температуры плавления зонда во всех или части реакций амплификации позволяет удержать зонд от гибридизации с мишенями, что может снизить эффективность реакции. В некоторых аспектах ЛПЭ-ПЦР-анализов используются низкотемпературные зонды. В контексте настоящего изобретения термин "низкотемпературный (Low-Tm) зонд" означает гибридизационный зонд, температура плавления которого (определенная с учетом концентрации) в начале амплификации, Тm[0], по меньшей мере на 5°С ниже Tm[0] ограниченного праймера в ЛПЭ-ПЦР-анализе; а термин "супернизкотемпературный зонд" означает гибридизационный зонд, Tm[0] которого по меньшей мере на 5°С меньше средней температуры отжига праймера экспоненциальной фазы ЛПЭ-ПЦР-реакции. Часто зонды вводятся в ЛПЭ-ПЦР-реакции в концентрации 1 мкМ. Таким образом, при проектировании зондов иногда используют номинальную Tm[0], рассчитанную, как описано ранее, но использующую номинальную концентрацию 1 мкМ. Tm[0] большинства низко- и супернизкотемпературных зондов, рассчитанная для 1 мкМ концентрации, находится в интервале 30-55°С.
Детекция низкотемпературных зондов также требует низких температур, то есть, температуру смеси зонд-мишень понижают настолько, чтобы флуоресцентно меченные зонды могли гибридизоваться и сформировать сигнал. Это может быть выполнено во время завершения амплификации (метод конечной точки) или на этапе постамплификационного анализа плавления. Альтернативно, этап низкотемпературной детекции можно включить в некоторые или во все циклы линейной фазы ЛПЭ-ПЦР-амплификации для анализа в режиме реального времени. Предпочтительно, чтобы такой этап осуществлялся после удлинения праймера и до расплавления (или денатурации) высокотемпературной цепочки, хотя его можно включить и на этапе отжига праймера. Этап низкотемпературной детекции ЛПЭ-ПЦР-анализа означает понижение температуры по меньшей мере на 5°С ниже температуры отжига праймера.
В некоторых способах, соответствующих настоящему изобретению, используются меченые флуорофором праймеры и гибридизационные зонды совместно с флуоресцентными красителями, которые связываются с двухцепочечной ДНК. Эти способы предполагают стимуляцию красителя при длине волны, возбуждающей краситель, но не флуорофор, и детекцию флуоресценции, испущенной флуорофором, который косвенности мулируется указанной процедурой. Некоторые аспекты способов, соответствующих настоящему изобретению, предполагают также и детекцию флуоресцентной эмиссии красителя. В соответствии с некоторыми предпочтительными способами рассчитывается отношение эмиссии флуорофора и эмиссии красителя.
В соответствии с одним аспектом настоящего изобретения к смеси для амплификации нуклеиновых кислот добавляют флуоресцентный краситель ДНК, такой как SYBR Green I или, предпочтительно, SYBR Gold и по меньшей мере один праймер амплификации в соответствии с настоящим изобретением, то есть, линейный одноцепочечный олигонуклеотид, способный удлиняться под действием ДНК-полимеразы и меченный флуорофором, который косвенно возбуждается в ответ на сигнал праймера, как описано выше; осуществляют реакцию амплификации, предпочтительно, ПЦР-реакцию (включая ЛПЭ-ПЦР), включающую в себя отжиг и удлинение этого меченого праймера; а затем во время амплификации (детекция в режиме реального времени) или после ее завершения (детекция по конечным результатам в конце реакции амплификации или во время последующего термического анализа (кривая плавления)) возбуждение красителя и детекция эмиссии флуоресценции из флуорофора, возможно, совместно с детекцией эмиссии красителя. Протокол амплификации можно спроектировать таким образом, чтобы в желаемых точках реакции амплификации осуществлять анализ плавления двухцепочечных продуктов. В данном аспекте флуоресцировать будут только праймеры, встроенные в двухцепочечную ДНК. Невстроенные праймеры флуоресцировать не будут, что избавляет от необходимости отделять несвязанные праймеры физически. Этот способ - гомогенный. Кроме того, эмиссия флуорофора возникает только из двухцепочечных участков продукта, содержащих меченый праймер, а не из всех двухцепочечных продуктов. Данные усовершенствования продемонстрированы в приводимом далее Примере 1. В нем показано, что в цикле одиночного удлинения, спроектированном для получения смешанных продуктов удлинения различной длины, кривая плавления, основанная на детекции эмиссии флуорофора праймера, показывает все продукты, а кривая плавления, основанная на детекции эмиссии красителя, не все. Пример 1 демонстрирует также использование способа данного аспекта в изотермической реакции.
Компетентные специалисты в данной области понимают, что, в общем случае, важно учесть наложение флуоресценции, если флуоресцентный краситель ДНК, например, SYBR Green I, применяется совместно с флуоресцентно меченным праймером или зондом, возбуждаемым по методу FRET из интеркалированного красителя. Это связано с тем, что флуоресцентный краситель ДНК, как правило, испускает свет в очень широком спектральном диапазоне, который может включать длины волн, на которых определяют флуоресценцию праймера или зонда. Требуемую коррекцию можно осуществить следующим образом: 1) заданием спектра эмиссии одного красителя; 2) измерением эмиссии красителя в каждом образце при длине волны, более короткой, чем длина волны эмиссии праймера или зонда; 3) рассчетом интенсивности эмиссии красителя на длине волны эмиссии праймера или зонда, основываясь на информации, полученной на этапах 1) и 2); и 4) вычитанием этой рассчитанной интенсивности эмиссии красителя из общей интенсивности, измеренной на длине волны эмиссии праймера или зонда. Программное обеспечение, требуемое для такой коррекции, поставляется совместно с большинством коммерчески доступных приборов, таких как АВI 7700 и Cepheid Smart Cycler. Кроме того, можно измерить спектр красителя, эмиссию одного красителя и общую эмиссию красителя/зонда, после чего вручную применить подходящую формулу для коррекции. Например, такая формула описана в работе Lee and Fuerst, United States Published Patent Application Pub. No. US 2002/0119450, она позволяет измерять и вручную исправлять наложение флуоресценции красителя SYBR Green I в приборе Light Cycler.
Все примеры этой заявки были выполнены на приборе ABI 7700, коррекция наложения флуоресценции во всех случаях, когда флуоресцентный краситель ДНК использовался совместно с косвенно возбуждаемым флуоресцентным праймером или зондом, проводилась на программном обеспечении прибора, независимо оттого, была ли записана флуоресценция одного красителя.
В случае ПЦР-амплификации с использованием одиночной пары праймеров, где по меньшей мере один праймер помечен косвенно возбуждаемым флуорофором, как описано выше, для различения интересующего и неспецифических продуктов можно использовать анализ кривых плавления. В случае мультиплексной ПЦР-амплификации с использованием нескольких пар праймеров, по меньшей мере один член каждой из которых помечен косвенно возбуждаемым флуорофором, как описано выше, интересующие продукты можно различить по цвету и по температуре плавления, ассоциированной с различными флуорофорами. В случае ПЦР-амплификации в целом, осуществляя мониторинг эмиссии флуорофора и эмиссии красителя на протяжении реакции, можно отслеживать процесс создания специфических продуктов и всех двухцепочечных продуктов, соответственно.
Для анализа реакций амплификации можно использовать отношение эмиссии флуорофора, специфичной для гибридизованных праймеров или зондов, к неспецифичной эмиссии красителя. Такое отношение, например, можно исправить с учетом колебаний при повторе реакции. Кроме того, при анализе можно использовать пик плавления праймер-темплат, величина которого снижается по мере включения меченого праймера в продукт или продукты удлинения.
Настоящее изобретение включает наборы и частичные наборы для амплификации, содержащие флуоресцентный краситель ДНК, по меньшей мере одну пару праймеров, содержащую праймер, меченный флуорофором, возбуждаемым косвенно при возбуждении красителя, а также реагенты для амплификации участка, определяемого праймером, предпочтительно, ЛПЭ-ПЦР-амплификации.
Еще один аспект способа, соответствующего настоящему изобретению, включает в себя добавление к смеси для амплификации нуклеиновых кислот флуоресцентного красителя ДНК, такого как SYBR Green I или, предпочтительно, SYBR Gold, и по меньшей мере одного косвенно возбуждаемого, гасимого, аллель-дискриминирующего гибридизационного зонда Low-Tm или Super-Low-Tm, который может быть зондом настоящего изобретения. Аллель-дискриминирующие зонды настоящего изобретения относятся к типу двухцепочечных зондов, описанных в работе Li, Q. et al. (2002), "A New Class of Homogeneous Nucleic Acid Probes Based on Specific Displacement Hybridization," Nucl. Acid Res. 30: (2)e5 (меченная флуорофором линейная цепочка олигонуклеотидного зонда, комплементарного мишени, а также меченная гасителем комплементарная цепочка, которая короче цепочки зонда, в общем случае, на 2-10 олигонуклеотидов), за исключением того, что они помечены флуорофором, косвенно возбуждаемым при возбуждении красителя, и того, что их температура плавления приемлема для использования в качестве зондов Low-Tm и Super-Low-Tm при ЛПЭ-ПЦР-амплификации. Способность двухцепочечных зондов дискриминировать аллели можно отрегулировать, как описано в работе Li et al., то же относится и к уровню фоновой флуоресценции. Кроме того, фоновую флуоресценцию можно снизить, включив рядом с флуоресцирующей группой остатки гуанидина, это называется G-гашением.
Методы данного аспекта включают амплификацию с использованием такой смеси и детекцию при температуре, когда зонд гибридизуется аллель-дискриминирующим образом. Предпочтительный аспект включает использование этапа низкотемпературной детекции в фазе линейной реакции ЛПЭ-ПЦР-амплификации, когда вышеупомянутый зонд гибридизуется с синтезируемым одноцепочечным ампликоном, возбуждая флуоресцирующий ДНК-краситель при длине волны, которая не возбуждает флуорофор или флуорофоры непосредственно, а также чтение флуоресценции флуорофора или флуорофоров зонда, который или которые возбуждаются косвенно описанным выше образом. Другие аспекты включают амплификацию, сопровождаемую низкотемпературной детекцией в качестве определения по конечным результатам. Согласно некоторым аспектам производится детекция эмиссии красителя, ряд предпочтительных аспектов включает подсчет отношения эмиссии зонда к эмиссии красителя. Наиболее предпочтительно, если детекция эмиссии красителя осуществляется на самой начальной стадии этапа детекции, пока температура реакционной смеси выше температур плавления всех присутствующих в ней зондов. Описанные выше соотношения можно получить на основании данных, полученных от накапливающихся (или накопленных) двухцепочечных молекул (сигнал красителя) и от накапливающихся или накопленных одноцепочечных молекул (сигнал каждого зонда). Методы, соответствующие настоящему изобретению включают также использование низкотемпературных молекулярных сигнальных зондов, как описано в опубликованной заявке WO 03/054233, если флуорофорная метка стимулируется эмиссией красителя при длине волны, не совпадающей с той, что используется для возбуждения красителя.
Настоящее изобретение включает также наборы и частичные наборы для ЛПЭ-ПЦР-анализа, которые содержат реагенты для осуществления несимметричной амплификации, предпочтительно, ЛПЭ-ПЦР-амплификации, с этапом низкотемпературной детекции (конечная точка или режим реального времени), а также флуоресцентный ДНК-краситель, по меньшей мере одну пару праймеров, предпочтительно, пару ЛПЭ-ПЦР-праймеров, включающую избыточный и ограниченный праймер, и по меньшей мере один меченный флуорофором гибридизационный зонд Low-Tm, или Super-Low-Tm для одноцепочечного продукта реакции амплификации (продукт удлинения праймера, присутствующего в избытке), причем этот зонд является не толерантным к несоответствиям, а при указанной температуре детекции проявляет аллель-дискриминирующие свойства, и при этом флуорофор зонда косвенно возбуждается при возбуждении красителя. В предпочтительных и частичных наборах по меньшей мере один зонд является аллель-дискриминирующим зондом настоящего изобретения. Настоящее изобретение включает также набор олигонуклеотидов, содержащий по меньшей мере одну пару праймеров для несимметричной амплификации, предпочтительно, ЛПЭ-ПЦР-амплификации и по меньшей мере один гасимый аллель-дискриминирующий двухцепочечный зонд Low-Tm, или Super-Low-Tm, помеченный косвенно возбуждаемым (как описано выше) флуорофором, предпочтительно, красителем SYBR, а также сами такие двухцепочечные зонды.
Еще один аспект способа, соответствующего настоящему изобретению, включает добавление к смеси для несимметричной амплификации, предпочтительно, к ЛПЭ-ПЦР-реакционной смеси, реагентов для детекции, включающих флуоресцентный краситель ДНК, такой как SYBR Gold, и по меньшей мере один толерантный к несоответствиям одноцепочечный линейный гибридизационный зонд, полностью комплементарный к одной, возможно, одноцепочечной последовательности мишени ампликона, которая может присутствовать или отсутствовать в реакции, и не полностью комплементарный к еще одной, возможно, одноцепочечной последовательности мишени ампликона, которая также может присутствовать. Подходящие для данного аспекта зонды представляют собой одиночные цепи, меченые флуорофором, косвенно возбуждаемым путем эмиссии флуоресценции красителя. Они представляют собой Low-Tm или, предпочтительно, Super-Low-Tm зонды по отношению к своей наиболее комплементарной мишени, которая может присутствовать, в общем случае, это означает полностью комплементарную мишень. Предпочтительно, чтобы их Тm[0] по отношению к полностью комплементарной мишени была не более, чем на несколько градусов выше, предпочтительно, ниже, еще предпочтительнее, по меньшей мере на 5°С ниже температуры отжига праймера в фазе экспоненциальной амплификации реакции амплификации. Зонды могут быть линейными (или свернутыми в статистический клубок) или такими свернутыми в статистический клубок зондами, которые соответствуют настоящему изобретению, то есть, их флуоресценция гасится при образовании вторичной структуры при низких температурах. Соответствующие настоящему изобретению гасимые флуоресцентные зонды, предпочтительно, содержат флуорофор на одном своем конце и нефлуоресцирующую гасящую группу на другом конце, причем та группа, которая находится на 3'-конце, заменяет фосфатный "хвост" вводимый туда для предотвращения удлинения зонда, то есть, чтобы он не начал функционировать как праймер.
Этот аспект изобретения предполагает осуществление в описанной смеси несимметричной амплификации, предпочтительно, ЛПЭ-ПЦР-амплификации для генерации одноцепочечных молекул ампликонов и проведение в этой смеси термического анализа с использованием по меньшей мере одного толерантного к несоответствиям зонда, сигнализирующего о процессе гибридизации. Термический анализ можно выполнить не только после завершения реакции амплификации, но также и на этапе низкотемпературной ЛПЭ-ПЦР-детекции при термических циклах, в которых получается одноцепочечный продукт, то есть, после исчерпания ограниченного праймера. Термический анализ позволяет обнаружить мишени каждого зонда по температурам плавления гибридов зонд-мишень, которые формируются или дестабилизируются при повышении или понижении температуры, соответственно. При понижении температуры зонд сначала гибридизуется со своей полностью соответствующей мишенью (если она присутствует) и дает флуоресцентный сигнал. При дальнейшем понижении температуры зонд будет гибридизоваться с все более и более "несоответствующими" мишенями, каждый раз давая повышенный флуоресцентный сигнал. Как было показано при описании предыдущих аспектов, можно измерять также и эмиссию флуоресцентного красителя, предпочтительно, когда зонды негибридизованы, то есть, при температуре выше Тm зонда (зондов), что позволяет проводить мониторинг накопления двухцепочечных молекул в ходе реакции, а также рассчитать соотношение, что позволяет снизить разброс при повторе измерения одного образца.
Настоящее изобретение включает наборы, содержащие реагенты для несимметричной амплификации, предпочтительно, ЛПЭ-ПЦР-амплификации, которые включают флуоресцентный краситель ДНК, по меньшей мере одну пару праймеров, предпочтительно, пару ЛПЭ-ПЦР-праймеров, содержащую избыточный и ограниченный праймеры, и по меньшей мере один толерантный к несоответствиям свернутый в статистический клубок зонд Low-Tm или Super-Low-Tm, гасимый при необходимости, для одноцепочечных продуктов амплификации, а также частичные наборы и наборы олигонуклеотидов, содержащие такие праймеры и зонды, и сами эти зонды.
Методы настоящего изобретения, использующие этап низкотемпературной детекции ЛПЭ-ПЦР-анализов, предпочтительно, этап низкотемпературной детекции после удлинения праймера но до плавления цепочки, включают анализы мультиплексных зондов, содержащих более одной пары праймеров и генерирующих один или больше одноцепочечных ампликонов (один зонд на каждую мишень), а также мультипробные анализы, включающие по меньшей мере один зонд на несколько мишеней. Некоторые предпочтительные способы с этапом низкотемпературной детекции включают осуществление низкотемпературной детекции после удлинения праймера и до плавления цепочки. На этапе детекции в таких анализах температура может опускаться на 30°С, а иногда и на 40°С ниже температуры отжига праймера, что оставляет большое температурное окно для детекции. Аллель-дифференцирующие зонды, помимо дифференцировки по цвету (длине волны эмиссии флуорофора), можно дифференцировать и по различию температур плавления. Например, четыре различных меченых FAM аллель-дифференцирующих зонда с Тm 30, 35, 40 и 45°С по отношению к своим мишеням, соответственно, можно различить в режиме реального времени или по завершении амплификации по конечным результатам, так как температура реакции повышается или понижается, а не только с помощью постамплификационного анализа плавления. Эта дополнительная степень свободы существенно повышает число различных зондов, которые могут использоваться в одной и той же реакции. Толерантные к несоответствиям зонды характеризуются более низкими значениями Тm по отношению к несоответствующим им мишеням, по сравнению с идеально соответствующими. Комбинации по-разному окрашенных низкотемпературных толерантных к несоответствиям зондов, подающих сигнал при гибридизации, позволяют получить в процессе низкотемпературной детекции паттерны кривых зависящей от температуры эмиссии флуоресценции. Методы настоящего изобретения включают использование таких кривых эмиссии, производных кривых и их соотношений при одной и той же или при разных температурах для идентификации компонентов смешанных мишеней с постамплификационным анализом плавления и в режиме реального времени с помощью мониторинга флуоресценции при различных температурах в окне низкотемпературной ЛПЭ-ПЦР-детекции. Отношения могут включать зонд/тот же зонд, зонд/другой зонд, зонд/краситель и их комбинации.
Наборы ЛПЭ-ПЦР, частичные наборы и наборы олигонуклеотидов могут включать по меньшей мере два аллель-дискриминирующих зонда одного цвета, различаемых по Тm, или по меньшей мере два толерантных к несоответствиям зонда, гибридизацию которых к различным мишеням можно различить по Тm, предпочтительно, гасимые зонды в виде статистического клубка, косвенно возбуждаемые при возбуждении флуоресцентного ДНК-красителя.
Настоящее изобретение включает улучшенные способы приготовления продуктов ЛПЭ-ПЦР-амплификации для реакций секвенирования, будь то обычная расшифровка последовательности ДНК или такие способы секвенирования при синтезе, как пиросеквенирование. В частности, продемонстрирована генерация и приготовление таких стартовых веществ в одном реакционном контейнере, например, в пробирке для микроцентрифугирования. Согласно предпочтительным аспектам в реакционную смесь для ЛПЭ-ПЦР включают реагент, ингибирующий неправильный старт, наиболее предпочтительно, если этот реагент описан в предварительной патентной заявке United States Provisional patent application no. 60/619,620, озаглавленной "Реагенты и методы для повышения воспроизводимости и снижения неверного старта в ПЦР-амплификации" и включенной сюда по ссылке во всей своей полноте. В случае обычной расшифровки последовательности ДНК продемонстрировано получение продуктов ЛПЭ-ПЦР-амплификации для секвенирования в одну стадию при разбавлении образца; метод назван "разбавь и вперед". В случае пиросеквенирования продемонстрированы методы, требующие до отжига праймера добавить к смеси продуктов ЛПЭ-ПЦР только фермент/субстратные реагенты пиросеквенирования.
Методы, соответствующие настоящему изобретению включают также ЛПЭ-ПЦР-амплификацию и приготовление образцов для пиросеквенирования в одном контейнере, таком как реакционная пробирка или камера для микрообработки жидкостей; все эти методы сокращенно названы "методы одной пробирки". В традиционном пиросеквенировании молекулу ДНК амплифицируют симметричной ПЦР, причем один праймер с 5'-конца помечен молекулой биотина. По завершении амплификации для отмывки остаточных компонентов ПЦР-реакции, мешающих пиросеквенированию (и включающих пирофосфат (PPi), дНТФ и праймеры ПЦР) и выделения одноцепочечной ДНК(оцДНК) используют шарики, покрытые стрептовидином, и вакуумное или магнитное оборудование. Благодаря способности генерировать оцДНК, способ ЛПЭ-ПЦР избавляет от необходимости непосредственно осуществлять разделение и упрощает процесс приготовления образцов, если применить его совместно с методом одного контейнера для устранения четырех мешающих компонентов, остающихся после ПЦР. Согласно одному такому методу удается минимизировать количество остающейся в конце реакции дНТФ, включая ограниченное количество этого реагента в реакционную смесь для ЛПЭ-ПЦР-амплификации, правда, при этом необходимо включить, все-таки, достаточное его количество, чтобы получить достаточное количество оцДНК для пиросеквенирования. Чтобы удалить пирофосфат, к продуктам амплификации добавляют фермент с пирофосфатазной активностью, такой как пирофосфатазу (например, пирофосфатазу из дрожжей); чтобы денатурировать фермент до перехода к этапу пиросеквенирования, смесь нагревают. Так как по завершении ЛПЭ-ПЦР-амплификации ограниченного праймера в смеси не остается, а оставшийся избыточный праймер не может в процессе амплификации запустить удлинение цепи из избыточного праймера (цепи избыточного праймера), в большинстве случаев остающиеся праймеры удалять не требуется. Однако, во избежание возможного неверного старта в реакционную смесь для ЛПЭ-ПЦР можно включить олигонуклеотид, гибридизующийся с избыточным праймером при температуре ниже Тm избыточного праймера, включая температуру, используемую для пиросеквенирования. Кроме того, по завершении ЛПЭ-ПЦР-амплификации, но до начала пиросеквенирования к смеси можно добавить олигонуклеотид, блокирующий удлинение по 3'-концу и полностью комплементарный избыточному праймеру. Это позволяет избежать потенциального неверного старта избыточного праймера при используемых для пиросеквенирования температурах. Третья стратегия избежания неверного старта избыточного праймера по 3'-концу цепи, удлиняемой при амплификации из ограниченного праймера (цепи ограниченного праймера) предполагает использование достаточной концентрации 3'-блокированного олигонуклеотида, содержащего ту же последовательность, что и избыточный праймер, с целью создания конкуренции избыточному праймеру за сайты связывания.
Разработанный авторами более предпочтительный метод приготовления образца "в одной пробирке" позволяет избежать необходимости определения соответствующих ограничивающих концентраций дНТФ для конкретных амплификации. В соответствии с этим методом сначала к продукту ЛПЭ-ПЦР добавляют фермент/субстратные реагенты для пиросеквенирования. Эти реагенты позволяют удалить дНТФ и пирофосфат. После этого осуществляется отжиг праймера с использованием добавленного праймера секвенирования, и затем уже вводят индивидуальные дНТФ для пиросеквенирования. Кроме того, для удаления дНТФ можно добавить очищенный фермент с дНТФ-азной активностью, такой как апираза картофеля, а затем нагреть смесь, инактивировав фермент. Для удаления пирофосфата можно добавить очищенный фермент с пирофосфатазной активностью, такой как пирофосфатаза дрожжей, после чего также нагреть смесь для его инактивации. Оба эти фермента можно добавлять одновременно.
Соответствующие настоящему изобретению анализы, в особенности, ЛПЭ-ПЦР-анализы, предпочтительно, включают средства, позволяющие избежать неверного старта, который может уменьшить сигнал зонда на поздних стадиях реакции. Избежать этого эффекта удалось, включив в реакционную смесь подавляющие неверный старт реагенты, которые были описаны в американской предварительной патентной заявке, процитированной выше. Кроме того, этого удается избежать, правильно подобрав концентрацию полимеразы, добавляемой в реакционную смесь. Уменьшение неверного старта при подборе концентрации полимеразы можно наблюдать на кривых кинетики ЛПЭ-ПЦР-реакции с использованием зонда оцДНК, а также при анализе состава заключительного продукта, выполняемого различными методами, известными в соответствующей области.
Подробное описание одного или нескольких аспектов настоящего изобретения приводится в следующем далее описании и проиллюстрировано на сопровождающих заявку диаграммах. Остальные свойства, цели и преимущества настоящего изобретения станут очевидны из описания, диаграмм, а также из формулы изобретения.
Краткое описание чертежей
На Фиг.1 показано использование флуоресцентно меченных праймеров, соответствующих способам настоящего изобретения, для анализа кривых плавления.
На Фиг.2 показано снижение разброса сигнала при использовании отношений флуоресценции одноцепочечных продуктов к двухцепочечным продуктам в соответствии с способами настоящего изобретения.
На Фиг.3 показано сравнение способов идентификации пяти образцов культуры Mycobacteria с помощью анализа кривых плавления, полученных при помощи либо обычных толерантных к несоответствиям зондов к гену 16S рибосомальной РНК, либо двух различных версий гасимых толерантных к несоответствиям зондов к той же мишени, сконструированных в соответствии со способами настоящего изобретения.
На Фиг.4 показана идентификация пяти образцов культуры Mycobacteria с помощью только двух толерантных к несоответствиям зондов к гену 16S рибосомальной РНК в соответствии с способами настоящего изобретения.
На Фиг.5 показана идентификация пяти образцов культуры Mycobacteria с помощью анализа первых производных кривых плавления, представленных на Фиг.3 и полученных с помощью двух толерантных к несоответствиям зондов к гену 16S рибосомальной РНК, сконструированных в соответствии со способами настоящего изобретения.
На Фиг.6 показана идентификация пяти образцов культуры Mycobacteria с помощью отношения флуоресцентных сигналов, полученных при различных температурах из двух толерантных к несоответствиям зондов к гену 16S рибосомальной РНК в соответствии со способами настоящего изобретения.
На Фиг.7 показано генотипирование по конечным результатам гомозиготных и гетерозиготных образцов мутации G269 человеческого гена НехА с использованием способа ЛПЭ-ПЦР и одного толерантного к несоответствиям зонда Low-Tm по отношению к аллели дикого типа в соответствии со способами настоящего изобретения.
На Фиг.8 показана раздельная идентификация трех различных аллелей человеческого гена cystic fibrosis transmembrane regulator (CFTR) с использованием ЛПЭ-ПЦР, аллель-дискриминирующих зондов Low-Tm, помеченных одним цветом, и анализа первых производных кривых плавления.
На Фиг.9 показана одновременная идентификация различных комбинаций разнообразных аллелей человеческого гена cystic fibrosis transmembrane regulator (CFTR) с использованием аллель-дискриминирующих зондов Low-Tm, меченных одинаковым цветом, а также анализ первых производных кривых плавления.
На Фиг.10 показана идентификация комбинаций различных аллелей человеческого гена cystic fibrosis transmembrane regulator (CFTR) путем нанесения на график изменений флуоресценции при двух температурах, полученных в соответствии со способами настоящего изобретения.
На Фиг.11 показаны анализы с нормализацией по двум температурам и фоновой коррекцией.
На Фиг.12 показаны анализы с нормализацией по двум температурам без фоновой коррекции.
На Фиг.13 показаны анализы с нормализацией по двум температурам.
На Фиг.14 представлено сравнение метода "разбавь и вперед" приготовления образцов ЛПЭ-ПЦР для пиросеквенирования в соответствии с способами настоящего изобретения и традиционных методов получения образцов ЛПЭ-ПЦР для такого же анализа.
Фиг.15 представляет собой пирограммы, полученные для отдельных клеток, приготовленных однопробирочным способом ЛПЭ-ПЦР. Стрелки показывают β-глобиновый сайт IVS 110: а) гомозиготного дикого типа; b) гетерозиготного и с) гомозиготных мутантных клеток.
Фиг.16 представляет собой пирограммы, полученные в ходе реакции пиросеквенирования для более чем 50 пар оснований. Под каждым пиком перечислен порядок высвобождения нуклеотидов, а над ним предполагаемая последовательность генов.
Фиг.17 представляет собой хроматограмму процесса определения последовательности ДНК, полученные методом "разбавь и вперед" приготовления образцов ЛПЭ-ПЦР для секвенирования ДНК в соответствии со способами настоящего изобретения, а также традиционного метода приготовления образцов ЛПЭ-ПЦР для такого же анализа.
Фиг.18 представляет собой гель для электрофореза, полученный в результате ЛПЭ-ПЦР-амплификации более чем одного продукта из одного и того же темплата ДНК в одной и той же реакции.
Фиг.19 представляет собой хроматограмму секвенирования ДНК "разбавь и вперед" для продуктов ЛПЭ-ПЦР-амплификации фигуры 18.
На Фиг.20 показано, что количество оцДНК (одноцепочечная ДНК) и дцДНК (двухцепочечная ДНК), генерированной ЛПЭ-ПЦР-амплификацией, можно измерить независимо друг от друга, с помощью полученных в результате этого данных можно вычислить отношение оцДНК/дцДНК, которое, в свою очередь, позволяет определить, достаточно ли наработанного на данный момент количества оцДНК для последующего секвенирования по методу "разбавь и вперед".
Фиг.21 представляет собой хроматограмму секвенирования ДНК, полученную в результате применения метода "разбавь и вперед" к смеси ЛПЭ-ПЦР-ампликонов состава 50:50, характеризующихся двумя близкородственными, но различными последовательностями.
На Фиг.22 показан диапазон чувствительности смеси ЛПЭ-ПЦР-ампликонов, характеризующихся близкородственными, но различными последовательностями, которые можно различить по методу "разбавь и вперед".
На Фиг.23 представлен способ ЛПЭ-ПЦР совместно по меньшей мере с одним одиночным толерантным к несоответствиям зондом, который позволяет генерировать кривые плавления по конечным результатам, а последние, в свою очередь, могут использоваться для качественного определения относительных количеств двух или более смешанных ЛПЭ-ПЦР-ампликонов, характеризующихся близкородственными, но различными последовательностями.
На Фиг.24 представлена кинетика нескольких ЛПЭ-ПЦР-анализов, выполненных с использованием двух различных концентраций Taq-полимеразы совместно с тремя различными количествами геномной ДНК.
Одинаковые символы на различных фигурах обозначают одинаковые элементы.
Осуществление изобретения
Настоящее изобретение включает анализы амплификации нуклеиновых кислот, например, анализы ПЦР, включающие детекцию эмиссии флуоресценции по меньшей мере одного меченного флуорофором праймера, возбуждаемого не непосредственно с помощью видимого или невидимого света такой длины волны, которая сильно поглощается флуорофором, а косвенно, с помощью света такой длины волны, которая возбуждает расположенный по соседству флуоресцентный краситель ДНК, например, SYBR Green или, предпочтительно, SYBR Gold; а также полные или частичные наборы, содержащие все или некоторые реагенты для амплификации и наборы олигонуклеотидов, содержащие такие меченые праймеры; а также и сами эти праймеры.
Праймеры для амплификации хорошо известны. Соответствующие настоящему изобретению праймеры представляют собой короткие олигонуклеотиды, обычно длиной менее пятидесяти оснований, которые гибридизуются с цепочкой-мишенью и удлиняются под действием соответствующей полимеразы. Праймер может состоять из природных нуклеотидов, а может включать и не встречающиеся в природе нуклеотиды и неприродные межнуклеотидные связки. Хотя праймеры, обычно, представляют собой линейные олигонуклеотиды, у них может быть и вторичная структура. (См., например, Nazarenko IA, Bhatnagar SK, Hohman RJ (1997), "A Closed Tube Format for Amplification and Detection of ДНК Based on Energy Transfer," Формат закрытой пробирки для амплификации и детекции ДНК на основе передачи энергии. Nucleic Acids Res. 25:2516-2521). Часто амплификация включает использование одной или нескольких пар праймеров, состоящих из прямого и обратного праймера. В соответствии с способами, наборами и олигонуклеотидами настоящего изобретения, либо один праймер из пары, либо оба праймера могут быть помечены ковалентно связанным флуорофором, флуоресцирующим при стимуляции расположенного рядом флуоресцирующего красителя. Когда меченый праймер гибридизуется (или отжигается) со своей комплементарной последовательностью в цепочке темплата, образуется двухцепочечная область. Флуоресцирующий краситель ДНК связывается с этой областью (интеркалируясь в нее или иначе) и начинает флуоресцировать. Указанная область находится поблизости от флуорофора праймера, так что, когда краситель стимулируется на длине волны, не возбуждающей флуорофор непосредственно, последний начинает излучать на характерной для него длине волны. Такие праймеры позволяют осуществлять мониторинг синтеза продуктов, получающихся при удлинении под действием ДНК-полимеразы, например, в результате ПЦР или анализа процесса удлинения праймера по конечным результатам или в режиме реального времени, а также определять специфичность продукта путем анализа кривой плавления.
Соответствующие настоящему изобретению праймеры, используемые ДНК-полимеразой в качестве субстратов для удлинения и включающие праймеры для ПЦР-амплификации (симметричной и несимметричной, в том числе, в особенности, ЛПЭ-ПЦР), можно пометить по любому нуклеотиду ковалентно связываемым флуорофором, так чтобы 3'-конец олигонуклеотидного праймера оставался доступным для удлинения. Праймеры могут представлять собой двухцепочечные зонды, описанные в работе Li, Q. et al. (2002) ("A New Class of Homogeneous Nucleic Acid Probes Based on Specific Displacement Hybridization," Новый класс гомогенных зондов нуклеиновых кислот, основанный на гибридизации со специфическим замещением. Nucl. Acid Res. 30: (2)е5). Единственное накладываемое на последовательность олигонуклеотидного праймера ограничение заключается в том, что у него не должно быть вторичной структуры, которая сама по себе может вести к косвенному возбуждению флуорофора. Это означает, что, в общем случае, вторичная структура не должна быть длиннее двух пар оснований. Флуорофорная группа не должна непосредственно возбуждаться в заметной степени, однако, краситель должен непосредственно возбуждаться при действии света соответствующей длины волны. Флуорофор должен испускать свет при возбуждении расположенного в непосредственной близости от него флуоресцентного красителя ДНК; обычно, это расстояние не превосходит расстояния, на котором возможен флуоресцентный резонансный перенос энергии; и спектр эмиссии выбранного флуорофора должен быть отличим от спектра эмиссии флуоресцентного красителя ДНК, при этом возможно либо использование фильтров, либо спектральное обращение. При этих условиях флуорофор флуоресцирует при включении в двухцепочечный продукт после отжига праймера, в том числе, при удлинении под действием ДНК-полимеразы. Прекращение флуоресценции происходит при нагревании при достижении температуры плавления (Тm) конкретного фрагмента содержащей флуорофор двухцепочечной ДНК.
Условия, при которых возможно использование праймеров настоящего изобретения совместно с флуоресцирующими красителями ДНК (концентрация праймера и красителя ДНК, длина волны возбуждения красителя ДНК), соответствуют тем, которые используются при мониторинге синтеза продуктов реакций удлинения праймера (включая ПЦР) во время этих реакций и при анализе специфичности продуктов удлинения по кривым плавления с использованием только флуоресцирующих красителей ДНК, за исключением того, что флуоресценцию считывают при длине волны эмиссии флуорофора праймера, а не (или в добавление к) эмиссии красителя. При таких условиях сигнал флуоресценции возникает из содержащей праймер двухцепочечной последовательности, а не из всех двухцепочечных последовательностей реакции.
Сравнение производительности красителя ДНК с способами и системами настоящего изобретения было выполнено в эксперименте, описанном ниже как пример 1, и проиллюстрировано на Фиг.1. Меченный флуорофором праймер был удлинен ДНК-полимеразой в присутствии красителя SYBR Green и относительно длинного неудлиняемого олигонуклеотида, гибридизованного с цепочкой темплата рядом с областью удлинения праймера. Это привело к получению смеси продуктов, содержащей гибриды цепочки темплата и неудлиняемого праймера, короткие продукты удлинения праймера и неудлиняемый олигонуклеотид, так что Тm гибридов с темплатом колебалось от 60°С (праймер, меченный флуорофором Сy5) до 79°С (неудлиняемый олигонуклеотид), причем продукты удлинения праймера оказались между этими двумя значениями.
Стандартный анализ кривой плавления выполнили в заключительной реакционной смеси (по два повтора), определяя как флуоресценцию красителя, так и флуоресценцию флуорофора. Кривые плавления представлены на Фиг.1. Панель А соответствует кривым плавления 1, полученным на основании эмиссии красителя. Одиночный пик при 79°С соответствует температуре плавления неудлиняемого олигонуклеотида. Других пиков нет, нет даже пика для неудлиненного праймера. Панель А демонстрирует миграцию красителя SYBR Green к гибриду с более высокой Тm при генерации кривой плавления, что маскирует наличие гибридов с низкой Тm. Панель В соответствует кривым плавления 2, полученным с использованием эмиссии флуорофора. На ней виден пик при 60°С, соответствующий Тm неудлиненного гибрида праймер-темплат, а также дополнительный пик при температуре между 69 и 79°С, то есть, пик, соответствующий продукту удлинения праймера. Более низкие Тm заметны, несмотря на тенденцию красителя к миграции, как показано на кривых плавления 1. Мониторинг эмиссии флуорофора в соответствии с способами настоящего изобретения позволяет обнаружить в смеси все помеченные флуорофором гибриды в правильных концентрациях.
В случае ПЦР-амплификации, когда используется одна пара праймеров, по меньшей мере один участник которой является праймером настоящего изобретения, анализ кривых плавления позволяет различить специфические и неспецифические продукты с помощью одного флуоресцирующего агента, так как специфический продукт характеризуется ожидаемой, предсказуемой температурой плавления, чего нельзя сказать о неспецифическом продукте. В случае мультиплексных ПЦР-амплификации, когда используется более одной пары праймеров, причем по меньшей мере один праймер каждой пары является праймером настоящего изобретения, удается отличить друг от друга два различных специфических продукта, потому что они характеризуются различными, но ожидаемыми значениями Тm, и/или потому что два различных используемых праймера помечены различными флуорофорами. Более того, анализ кривых плавления с использованием праймеров настоящего изобретения может быть выполнен как в процессе реакции амплификации, так и после ее завершения.
Включение в реакцию одного или более праймеров настоящего изобретения позволяет также количественно измерить степень амплификации одной или более мишеней в ходе ПЦР или синтеза одного или более фрагментов двухцепочечной ДНК в ходе изотермической реакции удлинения. В любом случае, для определения зависимости количества двухцепочечных молекул полной длины от времени необходимо проводить детекцию возрастающей флуоресценции; это же количество можно измерить в конце реакции. Кроме того, включение одного или более праймеров настоящего изобретения в изотермическую реакцию или реакцию термического циклинга позволяет определить наличие или следить за накоплением частичных продуктов, то есть, таких продуктов, удлинение вдоль цепи темплата которых началось, но еще не достигло максимальной степени. В таких случаях температуры плавления частичных продуктов ниже температуры плавления продукта полной длины, но выше температуры плавления меченого праймера, из которого они получились. Кроме того, при включении меченого праймера в цепочку продукта частичной или полной длины снижается величина пика температуры плавления, генерируемого системой праймер/темплат ДНК-ДНК-гибрид, что может использоваться в качестве дополнительного способа измерить синтез ДНК.
Как уже упоминалось ранее, каждый фрагмент двухцепочечной ДНК или ампликона, синтезированный путем включения праймера настоящего изобретения, генерирует флуоресцентный сигнал на длине волны эмиссии ковалентно связанного флуорофора праймера при косвенном возбуждении от связанного красителя SYBR по методу FRET или другому механизму, так называемый "праймер-специфичный сигнал". Кроме того, та же самая двухцепочечная молекула ДНК генерирует флуоресцентный сигнал на длине волны эмиссии красителя SYBR, так называемый "общий сигнал SYBR", отражающий сумму всех сигналов от двухцепочечных последовательностей, присутствующих в реакционной смеси, так как все двухцепочечные последовательности флуоресцируют, независимо от того, содержат ли они встроенный меченый праймер. Таким образом, праймеры настоящего изобретения позволяют проанализировать сигнал с точки зрения отношения "праймер-специфичный сигнал"/"общий сигнал SYBR", далее это отношение будет называться значением PSS/TSS (primer-specific-signal/total-SYBR-signal). Анализ данных в терминах значений PSS/TSS дает возможность провести коррекцию с учетом отклонений значений сигнала флуоресцентного красителя ДНК (TSS) при повторе реакции. Это особенно полезно для ЛПЭ-ПЦР-амплификаций, поскольку скорость синтеза одноцепочечного ампликона пропорциональна количеству двухцепочечного ампликона, накопленного в конце экспоненциальной фазы реакции. Таким образом, небольшие отличия в количестве двухцепочечной ДНК при повторе реакции позволяют изменить скорость накопления одноцепочечного ампликона.
Можно также использовать несколько праймеров, меченных одним и тем же флуорофором; главное, чтобы ампликоны можно было различить постамплификационным анализом кривых плавления. Пример этого подхода представлен на панели В Фиг.1. Сигнал общего флуорофора в конце этапа удлинения, который может быть заключительным (конечная точка) или промежуточным этапом, позволяет определить общее количество ампликонов, содержащих флуорофор. Анализ кривых плавления дает возможность различить продукты и получить количественную характеристику их концентраций.
ЛПЭ-ПЦР представляет собой несимметричную ПЦР-амплификацию, которая, помимо прочих преимуществ, предоставляет большое "температурное пространство" для выполнения различных действий. См. цитировавшиеся выше работы WO 03/054233 и Sanche zet al. (2004). ЛПЭ-ПЦР позволяет использовать гибридизационные зонды "Low-Tm" и "Super-Low-Tm", определяя с их помощью одноцепочечные продукты амплификации (ампликоны). Совместно со способом ЛПЭ-ПЦР и зондами Low-Tm, и Super-Low-Tm можно использовать разнообразные типы зондов, специфичных по отношению к мишеням данного конкретного анализа, включая аллель-дискриминирующие зонды, позволяющие различить одиночные несоответствия в паре оснований, например, это могут быть аллель-дискриминирующие молекулярные сигнальные зонды. Можно использовать также толерантные к несоответствиям зонды, такие как толерантные к несоответствиям молекулярные сигнальные зонды или линейные (свернутые в статистический клубок) зонды, содержащие флуорофор, косвенно возбуждаемый эмиссией красителя SYBR. Разработан новый класс аллель-дискриминирующих зондов, полезных в качестве зондов Low-Tm и Super-Low-Tm, в ЛПЭ-ПЦР-анализе, которые позволяют определить отношение одноцепочечных ДНК к двухцепочечным ДНК в реакции, также как аллель-дискриминирующие молекулярные сигнальные зонды, меченные таким флуорофором.
Аллель-дискриминирующие зонды настоящего изобретения представляют собой модифицированные двухцепочечные, аллель-дискриминирующие, гасимые зонды, описанные в работе Li, Q. et al. (2002), Nucl. Acid Res. 30: (2)e5). В них внесены следующие изменения: они помечены флуорофором, косвенно возбуждаемым при возбуждении двухцепочечного флуоресцирующего красителя ДНК, такого как SYBR Green или SYBR Gold, но не могут непосредственно возбуждаться светом с длиной волны, используемой для стимуляции красителя (в этом отношении они напоминают описанные выше праймеры), и их конструируют так, чтобы они были зондами Low-Tm или Super-Low-Tm. Когда зонд не связан со своей целевой мишенью, он связан с более коротким комплементарным олигонуклеотидом. Чтобы уменьшить фоновую флуоресценцию зонда, предпочитают включать в комплементарный олигонуклеотид гаситель, такой как DabcyI или Black Hole™. Альтернативно или в дополнение, фоновую флуоресценцию можно снизить, включив рядом с флуорофором остатки гуанидина (G-гашение). В присутствии полностью комплементарной цепочки мишени более короткая комплементарная цепь отделяется, а более длинная меченная флуорофором цепь гибридизуется с мишенью, после чего гашение флуорофора прекращается, и он приобретает способность получать энергию от красителя, флуоресцируя на характерной для него длине волны. В мультиплексных анализах может использоваться несколько таких зондов для различных мишеней и помеченных различными флуорофорами.
Описанные аллель-дискриминирующие зонды конструируют так, чтобы их температура плавления Тm[0] зависела от концентрации; в анализах это позволяет сделать из них зонды Low-Tm или Super-Low-Tm. Обычно, Тm[0] гибрида зонд-мишень определяют и настраивают эмпирически, однако, рассчитанное значение можно использовать по крайней мере как хорошую отправную точку, чтобы минимизировать настройки. Длину и концентрацию комплементарной цепи зонда относительно цепи, меченной флуорофором, настраивают эмпирически, чтобы добиться максимальной дискриминации аллелей. Начинают с длины на 1-3 нуклеотида короче меченной флуорофором цепочки и концентрации в 1-1.2 раза выше концентрации этой цепочки.
В ЛПЭ-ПЦР-анализе такие аллель-дискриминирующие зонды используются на этапе низкотемпературной детекции, предпочтительно, следующей после этапа удлинения праймера в циклах, осуществляемых после исчерпания запаса ограниченного праймера. Для чтения флуоресценции в течение большого количества циклов в режиме реального времени необходимо возбудить краситель SYBR, после чего можно читать флуоресценцию как красителя, так и флуорофора (или флуорофоров). Предпочитают определять сигнал красителя во время или по завершении этапа ПЦР-удлинения, когда температура выше Тm зонда или зондов, а эмиссию флуорофора определять на этапе низкотемпературной детекции, когда зонды (либо аллель-дискриминирующие зонды настоящего изобретения, либо меченные соответствующим образом молекулярные сигнальные зонды) гибридизованы. После этого определяют отношение флуоресценции каждого зонда к общему сигналу SYBR. Это отношение сводит к минимуму различия между повторяющимися анализами, вызванные различием в концентрации накопленного продукта. Из-за того, что различия сведены к минимуму, подобные отношения могут применяться и для анализа по конечным результатам.
Как было описано выше, применение отношений концентрации одноцепочечного продукта к концентрации двухцепочечного продукта, допускаемое при использовании праймеров и зондов настоящего изобретения, представляет собой технологию снижения разброса между повторяющимися анализами. Особенно это важно для анализа по конечным результатам, не позволяющего определить кинетику реакции. Примером здесь может служить использование ЛПЭ-ПЦР-анализа для того, чтобы отличить гомозиготные образцы от гетерозиготных, причем для обеих аллелей используется одна пара праймеров и аллель-дискриминирующий зонд настоящего изобретения. На Фиг.2 показано снижение разброса, достигаемое при выполнении ПЦР-амплификации с этапом низкотемпературной детекции и с использованием красителя SYBR (в данном случае SYBR Gold), аллель-дискриминирующего зонда для одной аллели, меченного Сy5, с возбуждением красителя и чтением его сигналов (при 72°С, температура удлинения), а также с возбуждением флуорофора и чтением его сигналов (при 55°С, низкотемпературная детекция после возбуждения праймера). На панели А представлены данные, полученные у флуорофора в режиме реального времени для повторяющихся гомозиготных образцов (кружки 21) и повторяющихся гетерозиготных образцов (кружки 22). Очевидно, что разброс при повторах не позволяет определить различие. Однако, на панели В показано отношение сигналов Сy5 к сигналам SYBR для гомозиготных образцов (кружки 23) и гетерозиготных образцов (кружки 24). Снижение разброса оказывается достаточным, чтобы выполнить анализ по конечным результатам.
Настоящее изобретение направлено также на толерантные к несоответствиям Low-Tm или Super-Low-Tm линейные одноцепочечные зонды, меченные, предпочтительно, терминально меченные флуорофором, возбуждаемым эмиссией флуоресцентного красителя ДНК (например, SYBR Green I или SYBR Gold) и погашенные для снижения фоновой флуоресценции. Такие зонды содержат гасящую группу, подавляющую флуоресценцию в отсутствие мишени. При понижении температуры толерантные к несоответствиям линейные зонды характеризуются тенденцией свертываться и формировать короткие двухцепочечные участки. Этап низкотемпературной ЛПЭ-ПЦР-детекции усиливает эту тенденцию. Такого не происходит, когда последовательность зонда гибридизуется с последовательностью мишени. Если зонд включает флуорофор, возбуждающийся при эмиссии из присутствующего в реакционной смеси красителя SYBR, то краситель интеркалирует или иначе связывается со случайными двухцепочечными областями несвязанных молекул зонда, что возбуждает флуорофор зонда по методу FRET. В результате фоновая флуоресценция при низкой температуре повышается.
Гашение толерантных к несоответствиям зондов в соответствии с настоящим изобретением достигается путем включения в зонд группы-гасителя (гасящей группы), например, DABCYL или гасителя Black HoleTM (BHQ) в таком месте, где она гасит флуоресценцию флуорофора, обусловленную случайными вторичными структурами несвязанного зонда. Когда это возможно, предпочитают прикреплять гаситель с конца, противоположного тому, где находится флуорофор. В приводимом далее примере 2 продемонстрировано два различных способа достижения этой цели: простое добавление гасителя и конструирование гасящей шпильки (петли ДНК), то есть, специально созданной вторичной структуры, которая приводит гаситель в непосредственную близость с флуорофором, во вторичную структуру или то и другое одновременно. Предпочтительно, чтобы Тm сконструированной вторичной структуры была по меньшей мере на 5°С выше Тm любой альтернативной вторичной структуры, так что в отсутствие мишени большая часть молекул зонда оказывается в конфигурации шпильки, и фоновая флуоресценция невелика. Тm сконструированной структуры будет ниже Тm зонда, гибридизованного с правильно соответствующей мишенью, и соответствовать Тm зондов, гибридизованных с несоответствующими мишенями, так что образование "ствола" не мешает гибридизации ее последовательности с мишенями.
Детекцию и идентификацию мишеней нуклеиновых кислот можно осуществить с помощью одного или нескольких толерантных к несоответствиям низкотемпературных зондов, которые дают сигнал при гибридизации, включая толерантные к несоответствиям молекулярные сигнальные зонды, линейные одноцепочечные зонды, косвенно возбуждаемые при возбуждении флуоресцентного красителя ДНК, а также погашенные линейные зонды в соответствии с настоящим изобретением. В некоторых аспектах изобретения смесь зондов может содержать также по меньшей мере один соответствующий изобретению аллель-специфический зонд. Полезным способом различения мишеней с одинаковой Тm по меньшей мере к одному из зондов является определение отношения флуоресценции двух зондов как функции температуры. Иногда кривые такого отношения называют "флуоресцентной сигнатурой" мишени.
Метод ЛПЭ-ПЦР, включающий этап низкотемпературной детекции, позволяет объединить эффекты температуры детекции и эффекты флуоресцентной сигнатуры. Низкотемпературные зонды, включающие, но не ограничивающиеся, гасимые, одноцепочечные, косвенно возбуждаемые зонды, соответствующие настоящему изобретению, используют в ЛПЭ-ПЦР-амплификации, включающей в себя высокотемпературный этап для денатурации двухцепочечной ДНК (95 градусов в течение 2 минут), за которым следует экспоненциальная фаза амплификации с использованием ограниченного и избыточного праймера (30 циклов при 95°С по 10 секунд, при 60°С по 15 секунд и при 78°С по 40 секунд) с последующим завершением экспоненциальной фазы и линейной фазой, в которую входят этапы детекции зонда (40 циклов при 95°С по 10 секунд, при 60°С по 15 секунд, при 78°С по 40 секунд, при 55°С по 20 секунд, при 50°С по 20 секунд, при 45°С по 20 секунд и при 40°С также по 20 секунд). Здесь предусмотрено четыре температуры детекции ниже температуры отжига праймера, 60°С. За накоплением двухцепочечной продукции можно следить по эмиссии красителя SYBR при температуре удлинения праймера, 78°С, что выше Тm любого зонда. Эмиссия флуорофора регистрируется при каждой низкой температуре от 55°С до 40°С. По завершении последнего цикла температуру можно опустить до какого-либо низкого значения, например, 30°С, и медленно повышать, выполняя анализ плавления. Кроме регистрации уровней флуоресценции можно определять также отношения флуоресценции флуорофора к флуоресценции красителя и отношения флуоресценции различных флуорофоров, получая дополнительную информацию, позволяющую дифференцировать ампликоны.
На некоторых фигурах проиллюстрированы способы, реализующие описанные возможности. На Фиг.4 показано поведение плавления двух толерантных к несоответствиям зондов по отношению к гену 16S рибосомальной РНК нескольких штаммов Mycobacteria. Были использованы два зонда: формирующий шпильку гасимый зонд из примера 2 с последовательностью 5'-Сy5-СТG GAT AGG АСС ACG AGG ССА G-BHQ II-3' (SEQ. ID No. 2) и меченный TAMRA зонд с последовательностью 5'-G CAT GTC TTG TGG TGG-TAMRA-3' (SEQ. ID No. 3). Обнаружено, что последний зонд в непогашенном состоянии дает заметные сигналы фона для нескольких штаммов. Панель А фигуры 4 демонстрирует кривые плавления зонда-шпильки при отсутствии мишени (строка 41), в присутствии М. asiaticum (строка 42), М. gordonae (строка 43), М. heidelburgense (строка 44), М. mahnoense (строка 45) и М. marinum (строка 46). Панель В демонстрирует кривые плавления меченного TAMRA зонда при отсутствии мишени (строка 47), М. asiaticum (строка 48), М. gordonae (строка 49), М. heidelburgense (строка 50) М. malmoense (строка 51), и М. marinum (строка 52). На панели С этой фиугры представлено отношение флуоресценции TAMRA к флуоресценции Сy5 для М. asiaticum (строка 53), М. gordonae (строка 54), М. heidelburgense (строка 55), М. malmoense (строка 56) и М. marinum (строка 57).
Еще один аналитический способ заключается в нанесении на график зависимости скорости флуоресценции флуорофора от температуры. На Фиг.5 такой график представлен для описанного выше меченного Сy5 погашенного зонда-шпильки (соответствующего настоящему изобретению) и для меченного TAMRA непогашенного зонда, оба они были описаны ранее. На панели А изображены данные для погашенного зонда-шпильки, на панели В - для меченного TAMRA зонда. На графике показаны пики плавления для М. asiaticum (строки 61, 71), М. gordonae (строки 62, 72), М. heidelburgense (строки 63, 73), М. malmoense (строки 64, 74) и М. marinum (строки 65, 75). С использованием обоих зондов удается различить пять мишеней по пикам плавления. Сy5-меченный зонд сам по себе дает возможность отделить М. gordonae (строка 62) от остальных. Меченный TAMRA зонд позволяет отличить от остальных М. asiaticum (строка 71), М. gordonae (строка 72) и М. marinum (строка 75). Вместе эти зонды позволяют отличить М. heidelburgense от М. asiaticum, поскольку М. heidelburgense дает высокий пик при использовании зонда Сy5 и низкий пик для зонда TAMRA, а М. asiaticum - наоборот. Если используется один зонд на ампликон, то относительные высоты пиков характеризуют различия в концентрации продуктов. Здесь, однако, оба зонда детектируют один и тот же ампликон, так что относительные высоты пиков отражают различия в характеристиках плавления зонд-мишень.
Еще один описываемый здесь аналитический инструмент связан с определением одного или нескольких отношений флуоресценции, таких как (в рассматриваемом здесь конкретном аспекте) отношение флуоресценции TAMRA к флуоресценции Сy5 в процессе ПЦР при одной или при разных температурах. Полезная стратегия конструирования зондов включает создание одного зонда для связывания с консервативным участком, общим для нескольких штаммов, который будет использоваться для сравнения, или, при необходимости, использование в качестве консервативного участка фрагмента ограниченного праймера. Эта возможность приемлема для ЛПЭ-ПЦР, так как Тm зондов значительно ниже Тm, ограниченного праймера и температуры отжига, так что зонд с общей последовательностью не будет мешать амплификации. На Фиг.6 представлены результаты использования комбинаций отношений флуоресценции. В этом аспекте одним отношением флуоресценции является отношение значений флуоресценции TAMRA/Cy5, полученных при температуре детекции 40°С, а другим отношением является отношение сигналов флуоресценции TAMRA/Cy5, полученных при температуре детекции 45°С и 55°С, соответственно. На Фиг.6 оба отношения изображены в виде эллипса, в данном случае, круга 50. Шесть повторов дают неперекрывающиеся данные для различных штаммов М. asiaticum (эллипс 81), М. gordonae (эллипс 82), М. heidelburgense (эллипс 83), М. malmoense (эллипс 84), и М. marinum (эллипс 85).
Измерение флуоресценции зонда при различных температурах в процессе выполнения ПЦР обладает рядом преимуществ по сравнению с анализом, ограниченным расплавами, полученными после окончания реакции. Одно из таких преимуществ - это возможность сравнивать значения флуоресценции по выполнении указанного количества циклов после достижения порогового цикла, Ст. Это позволяет использовать отношения флуоресценции с участием красителей SYBR (или других интеркалирующих красителей), как описано выше. Еще одно преимущество - это то, что каждый образец характеризуется фоновой флуоресценцией, измеряемой при каждой температуре циклов до детекции ампликона. Так, по фоновой флуоресценции можно выполнить точный учет разброса значений между образцами. Можно измерить флуоресценцию при большом количестве температур в ПЦР-реакции, что позволяет получить почти полный анализ плавления в температурном диапазоне, в котором имеются различия в гибридизации зондов с различными мишенями. Число и продолжительность этих этапов частично зависит от возможностей оборудования по детекции. Некоторые термальные циклеры позволяют непрерывно регистрировать флуоресценцию при повышении или понижении температуры. Детекцию при нескольких температурах имеет смысл начинать не с самого начала, а незадолго перед предполагаемым началом роста флуоресценции. Детекцию при нескольких температурах можно выполнять каждый цикл, через некоторый промежуток времени или, например, каждый пятый цикл. Отказ от многократной детекции в самых первых циклах и снижение частоты этапов такой детекции уменьшает общее время, требуемое для завершения реакции амплификации. При работе с отношением флуоресценции зонда к флуоресценции красителя предпочтительно измерять флуоресценцию зонда при таких температурах, когда он гибридизуется со своими мишенями, а флуоресценцию SYBR начинать при температурах, когда зонды не связаны. Наиболее предпочтительно измерять флуоресценцию SYBR при температуре удлинения. Так как флуоресценция зонда возрастает в каждом цикле после порогового цикла (значение Ст), на котором флуоресценция SYBR выходит на плато, эти отношения будут изменяться в процессе реакции амплификации. Таким образом, значения индивидуальных образцов важно сравнивать при достижении указанного количества циклов после значения Ст для каждого образца.
Анализ одноцепочечных продуктов ДНК можно выполнить также с помощью одиночных толерантным к несоответствиям зондов, сигнал от которых измеряется при более чем одной, например, при двух или трех различных температурах. Полученные данные можно затем представить в виде отношений значений флуоресценции при двух или более температурах. Отношения значительно снижают разбор сигналов при повторном измерении образцов и дают количественную характеристику изучаемой аллели. На Фиг.11 показаны уровни флуоресценции зонда при двух температурах. Как видно из фигуры, сигналы, возникающие при гибридизации зонда с цепочкой избыточного праймера, регистрируются как при высокой температуре, когда зонд является аллель-дискриминирующим и связывается только с полностью комплементарной аллелью, так и при более низких температурах, когда зонд полностью толерантен к несоответствиям и связывается со всеми возможными вариантами аллелей последовательности мишени. Измерение флуоресценции при высокой и при низкой температуре с последующим определением отношения можно выполнить также как анализ по конечным результатам. Такие анализы называют двухтемпературными нормализованными анализами (без фоновой коррекции). Как показано на Фиг.11, с помощью таких анализов легко удается различить гомозиготные и гетерозиготные генотипы. Анализ данного типа можно назвать гомогенным ЛПЭ-ПЦР-анализом по конечным результатам (end-point homogenous LATE-PCR, QE-LATE-PCR).
На Фиг.11 представлены сигналы флуоресценции, скорректированные по базовой линии. Как рассматривается в примере 5, предпочитают использовать "сырые", а не скорректированные по базовой линии сигналы флуоресценции от ABI 7700, они показаны на Фиг.12. Потенциально, коррекция по базовой линии вносит артефакты в нормализованные отношения флуоресценции индивидуальных образцов, поскольку фактор коррекции чувствителен к беспорядочным флуктуациям сигналов фоновой флуоресценции, используемых для определения базовой линии. "Сырые" значения флуоресценции нечувствительны к этому артефакту. Использование "сырых" сигналов флуоресценции позволяет применять анализ на любом термоциклере ПЦР с возможностями флуориметра или на обычных термоциклерах совместное регулируемым по температуре флуориметром для анализа флуоресценции по конечным результатам.
Для дополнительного уточнения генотипирования QE-ЛПЭ-ПЦР можно определить соотношения сигналов, зарегистрированных при различных температурах. Трехтемпературный метод нормализации данных по конечным результатам описывается следующей формулой: Нормализованное значение флуоресценции=(Fs-Ft)/(Fb-Ft), где (Ft=флуоресценция при верхней температуре), (Fb=флуоресценция при нижней температуре), (Fs=флуоресценция при любой третьей температуре). Применение трехтемпературного метода к гомозиготным и гетерозиготным генотипам сайта SNP человеческого гена р53 описан на примере 6 и проиллюстрирован на Фиг.13.
Пиросеквенирование представляет собой изотермический метод секвенирования при синтезе в реальном времени, известный в соответствующей области. Он катализируется четырьмя кинетически сбалансированными ферментами - ДНК-полимеразой, АТФ-сульфурилазой, люциферазой и апиразой. Метод включает праймер секвенирования, отжигаемый к одноцепочечной ДНК. Каждый нуклеотид впрыскивается по очереди, и проверяется его присоединение к 3'-концу праймера, удлиняемого в соответствии с последовательностью ДНК темплата. В случае успешного включения образуется молекула пирофосфата (PPi) в количестве, эквимолярном количеству включенного нуклеотида. АТФ-сульфурилаза количественно преобразует образовавшийся пирофосфат в АТФ в присутствии аденозин-5'-фосфосульфата. Благодаря АТФ происходит опосредуемое люциферазой превращение люциферина в оксилюциферин, сопровождаемое генерацией видимого света, количество которого пропорционально количеству АТФ. Свет регистрируется специальной камерой (charge coupled device (CCD)) и выводится на пирограмму в виде пика. Не вошедший дНТФ и избыток АТФ непрерывно разлагаются апиразой. Нуклеотидная последовательность определяется из информации о порядке впрыскивания нуклеотидов и высотах пиков на пирограмме, которые пропорциональны количеству включенного нуклеотида.
ЛПЭ-ПЦР интенсивно генерирует одноцепочечные молекулы ДНК, что избавляет от необходимости использовать традиционные методы приготовления образцов для пиросеквенирования, требующиеся для получения одноцепочечных темплатов из двухцепочечных продуктов ПЦР. Однако, использование продуктов ЛПЭ-ПЦР для пиросеквенирования требует эффективного удаления реагентов, остающихся после реакции амплификации (дНТФ, пирофосфат и избыточный праймер), которые влияют на химию пиросеквенирования. Удаление оставшихся реагентов можно выполнить очисткой на колонке, осаждением из этанола или любым другим методом, используемым для очистки продукта ПЦР и удаления дНТФ, пирофосфата и избыточного праймера из реакции амплификации. После очистки одноцепочечную ДНК на выходе способа ЛПЭ-ПЦР непосредственно отжигают к праймеру для секвенирования и обрабатывают далее для пиросеквенирования в соответствии с инструкциями производителя. Очень важно не нагревать ЛПЭ-ПЦР-образцы до температур, при которых происходит денатурация образующихся в реакции двухцепочечных продуктов. Это гарантирует, что единственными доступными для секвенирования темплатами останутся одноцепочечные ДНК-продукты. Фактически, может даже, вообще, не потребуется нагревать ЛПЭ-ПЦР-образцы для отжига праймера, поскольку ДНК-темплат уже является одноцепочечным.
Чтобы получить образцы для секвенирования, были объединены ЛПЭ-ПЦР-амплификация с упрощенными методами очистки. Этот подход изложен в примере 7 и на Фиг.14. Авторами спроектированы два метода приготовления ЛПЭ-ПЦР-образцов для пиросеквенирования, которые не включают физическую очистку ПЦР-продукта и могут быть выполнены в одной пробирке. В соответствии с первым методом, проблема удаления из процесса ЛПЭ-ПЦР оставшегося дНТФ решается использованием ограниченного количества дНТФ в процессе амплификации, так что этот дНТФ удаляется в ходе реакции (но не преждевременно, чтобы не вызвать недостаточное накопление одноцепочечной ДНК, а именно, цепочки избыточного праймера), что можно определить рутинным экспериментом. Проблема удаления пирофосфата из смеси для ЛПЭ-ПЦР решается обработкой ЛПЭ-ПЦР-образца ферментом с пирофосфатазной активностью, например, пирофосфатазой, такой как пирофосфатаза дрожжей, с последующей тепловой инактивацией. Остающийся после ЛПЭ-ПЦР-ампрификации избыточный праймер не должен мешать пиросеквенированию, так как соответствующая этому праймеру целевая последовательность на 3'-конце продукта удлинения ограниченного праймера (цепи ограниченного праймера): А) связана в двухцепочечную форму и поэтому недоступна; и В) ее в 5-20 раз меньше, чем цепочки избыточного праймера, в зависимости от отношений праймера ЛПЭ-ПЦР. Однако, чтобы устранить любую возможность неверного старта избыточным праймером на продуктах ЛПЭ-ПЦР при температурах пиросеквенирования, в начале процесса можно добавить комплементарный избыточному праймеру олигонуклеотид. Тm этого олигонуклеотида должна быть по крайней мере на 5-10°С ниже Тm избыточного праймера, например, для этого он может быть на несколько нуклеотидов короче избыточного праймера по 3'-концу и должен быть блокирован на этом конце любым методом, известным специалистам в данной области и позволяющим не допустить удлинение олигонуклеотида ДНК-полимеразами (например, можно включить фосфатную группу). При таком конструировании комплементарный олигонуклеотид не влияет на ЛПЭ-ПЦР-амплификацию, но формирует при температуре пиросеквенирования стабильный двухцепочечный гибрид с избыточным праймером, не допуская его неверный старт с другими комплементарными сайтами амплифицируемого материала. Кроме того, комплементарный олигонуклеотид может быть той же длины, или его Тm может быть меньше чем на 5-10°С ниже Тm избыточного праймера, или и то и другое, если он добавляется после реакции ЛПЭ-ПЦР. Кроме того, заблокированный олигонуклеотид с той же последовательностью, что и избыточный праймер, с или без других модификаций для повышения Тm (например, дополнительных оснований на 3'-конце, использования аналогов LNA и т.д.) можно добавить после реакции ЛПЭ-ПЦР в концентрации, достаточной, чтобы вытеснить избыточный праймер с 3'-конца комплементарного сайта цепочки ограниченного праймера.
Второй метод включает предварительную обработку ЛПЭ-ПЦР-образцов той же фермент-субстратной смесью, что используется и для пиросеквенирования, после чего следует отжиг праймера и добавление индивидуальных дНТФ для пиросеквенирования. Согласно этому методу обращается порядок введения, рекомендованный протоколом производителя (то есть, согласно нормальному протоколу рекомендуется провести сначала отжиг праймера и лишь потом добавлять смесь для реакции пиросеквенирования). Согласно этому подходу, присутствующая в смеси для пиросеквенирования апираза разрушает дНТФ, а АТФ-сульфурилаза и люцифераза превращают пирофосфат в АТФ и свет. Содержащиеся в этих растворах люцифераза и люциферин создают полезную систему мониторинга распада пирофосфат и дНТФ. Субстратами для люциферазы являются АТФ и дНТФ, так что прекращение потока видимого света, регистрируемого камерой CCD в установке для пиросеквенирования, является хорошим признаком окончания очистки. В некоторых случаях, особенно если ампликоны длиннее, приблизительно, 100 пар оснований, или если необходимо провести секвенирование более чем, приблизительно, 20 пар оснований, субстраты, расходуемые в этой реакции (аденозин-5'-фосфосульфат и люциферин) добавляют еще раз перед началом секвенирования ДНК. Иногда первоначальная обработка может потребовать больше субстратов, чем предлагается протоколом производителя. Если для последующего отжига праймера необходимо провести нагрев и охлаждение, то эти реагенты разрушатся, и их придется заменить перед началом пиросеквенирования.
Разновидностью второго метода является введение очищенного фермента с дНТФ-азной активностью, например, апиразы, такой как апираза картофеля, и очищенного фермента с пирофосфатазной активностью, такого как пирофосфатаза, например, пирофосфатаза дрожжей, с последующей тепловой инактивацией этих ферментов, отжигом праймера и традиционным пиросеквенированием. Как и раньше, оставшиеся после ЛПЭ-ПЦР избыточные праймеры, обычно, не мешают пиросеквенированию, но, если все-таки помешали, необходимо воспользоваться описанной выше стратегией введения комплементарного олигонуклеотида. Этот второй метод не требует определения концентраций дНТФ для различных ЛПЭ-ПЦР-амплификаций и, тем самым, экономит драгоценное время.
Прямое пиросеквенирование продуктов ЛПЭ-ПЦР требует 0,5-4 пикомолей, иногда 2-4 пмолей, приготовленного одноцепочечного продукта, отожженного к 3-15 пмолей, иногда 10-15 пмолей, праймера секвенирования, в зависимости от используемого для пиросеквенирования инструмента. Во втором и третьем методах приготовления образцов важно, чтобы объем добавляемого ЛПЭ-ПЦР-образца составлял меньше, чем половину, иногда меньше чем треть от общего объема реакции пиросеквенирования, чтобы сохранить оптимальный рН смеси пиросеквенирования (рН 7,5, по сравнению с принятым в ПЦР рН 8,0 или выше, иногда рН 8,3). Альтернативно, продукты ЛПЭ-ПЦР могут составлять более половины реакционного объема, если соответственно настроить концентрацию буфера и рН. Реагенты, используемые для мониторинга различных фаз ЛПЭ-ПЦР-амплификаций, такие как флуоресцентные красители ДНК или гибридизационные зонды, совместимы с пиросеквенированием, и их не требуется удалять, если только гибридизационный зонд не связывается с участком, где будет проходить секвенирование, или где связывается праймер для пиросеквенирования. В таких случаях, чтобы блокировать гибридизационный зонд, необходимо применить одну из описанных выше стратегий блокирования избыточного праймера. Авторы выяснили, что реагенты, используемые для ингибирования неверного старта при амплификации и описанные в поданной американской патентной заявке "Реагенты и методы для повышения воспроизводимости и снижения неверного старта в ПЦР-амплификациях", совместимы с пиросеквенированием, если финальные концентрации этих соединений в реакции пиросеквенирования составляют 300 нМ или меньше, предпочтительно, 200 нМ или меньше, и используется стандартная ДНК-полимераза для пиросеквенирования (экзонуклеаза-дефицитный фрагмент ДНК полимеразы Klenow). Если использовать методы приготовления ПЦР-образцов, допускающих приготовление и амплификацию в одной камере или контейнере (см., например, американский патент US-2003-022231-А1), совместно с ЛПЭ-ПЦР-амплификацией, выполняемой в маленьких объемах, предпочтительно, не больше 10 мкл, например, 2-10 мкл, то удается получить данные пиросеквенирования от небольших количеств клеток (от одной до 10 000 клеток) в формате одной пробирки. В соответствии с таким методом "Клетка-сиквенс" маленькие группы клеток (от одной до 10 000 клеток) готовят для амплификации такими методами приготовления образцов для ПЦР, которые описаны в работе, например, Pierce et al (2002) Biotechniques 32(5): 1106-1111 (см. американскую патентную публикацию US-2003-022231-А1), подвергают ЛПЭ-ПЦР-амплификации, и затем приступают к пиросеквенированию в одном контейнере, ячейке, пробирке или реакционной камере, как описано выше. Как показано в примере 8 и на Фиг.15, метод одной пробирки позволяет осуществить точное и аккуратное генотипирование, даже на уровне одной клетки, одной молекулы.
Общей проблемой методов ферментативной очистки ПЦР для пиросеквенирования является перепроизводство сопутствующих продуктов распада, которые могут привести к ингибированию ферментов по методу обратной связи при последующем секвенировании и сократить читаемую длину. Такие продукты включают SO4 2-, оксилюциферин, неорганический фосфат (Pi), дНТФ и АМФ. Одним из способов сокращения количества Pi и дНТФ является уменьшение концентрации дНТФ в процессе ПЦР (хотя это не обязательно делать до состояния, когда реагент полностью поглощается в процессе реакции, как было описано в методе 1). Проводя количественные ПЦР наблюдения на дЛПЭ-ПЦР-ампликонами длиной до 600 пар оснований, авторы обнаружили, что концентрацию дНТФ можно снизить до 100 нМ, не влияя на эффективность амплификации. В таких условиях пиросеквенирование ферментативно приготовленных реакций ЛПЭ-ПЦР можно выполнить более чем для 50 последовательных оснований, как показано в примере 9 и на Фиг.16.
В случае обыкновенного секвенирования авторы разработали протокол, включающий разбавление как единственную необходимую обработку ЛПЭ-ПЦР-амплифицированного продукта. Обычное циклическое секвенирование одноцепочечного ампликона, полученного в результате ЛПЭ-ПЦР-амплификации, требует 50 фмолей этого продукта и известное определенное количество остальных продуктов, поскольку метод капиллярного электрофореза чувствителен к количеству продукта. Используя ДНК-связывающий флуоресцентный краситель SYBR Green I для мониторинга синтеза двухцепочечной ДНК и меченый Сy5 линейный зонд для мониторинга синтеза одноцепочечного ампликона, можно следить за ходом реакции ЛПЭ-ПЦР, в которую предпочтительно включают ингибирующий неверный синтез реагент, открытый в нашей американской патентной заявке "Реагенты и методы для повышения воспроизводимости и снижения неверного старта в амплификациях ПЦР". Ни одна из этих добавок не мешает последующей реакции секвенирования. В реакции ЛПЭ-ПЦР степень экспоненциальной амплификации и синтеза двухцепочечного продукта определяется количеством ограниченного праймера и не зависит от количества исходного темплата. Чтобы, если это требуется, ограничить производство одноцепочечного продукта, надо ограничить количество по меньшей мере одного дНТФ или количество циклов амплификации.
Авторы определили, что в случае синтеза цепи избыточного праймера (то есть, цепи, состоящей из избыточного праймера в ЛПЭ-ПЦР) двадцати и более кратное разбавление ЛПЭ-ПЦР-амплификации водой делает цепочку избыточного праймера пригодной в качестве исходного материала для обычного секвенирования. Чтобы убедиться, что в капиллярный секвенатор попало после разбавления требуемое минимальное количество 50 фмолей вещества для секвенирования, на выходе линейной фазы реакции ЛПЭ-ПЦР должно получаться по меньшей мере 200 фемтомолей (фмолей) одноцепочечной ДНК на микролитр (мкл) при концентрации ограниченного праймера 25 нМ (25 фмолей/мкл), требуется также, приблизительно, 8-кратный избыток одноцепочечной ДНК. Чтобы оценить концентрацию одноцепочечной ДНК, генерируемой при ЛПЭ-ПЦР-амплификации, авторы сложили концентрацию цепей, присутствующих в двухцепочечной ДНК в конце реакции (тех, которые участвуют в циклическом секвенировании и концентрация которых определяется концентрацией ограниченного праймера), плюс концентрацию одноцепочечной ДНК, получаемой за цикл (по оценкам авторов изобретения, в целом, каждый цикл линейного синтеза дает на выходе, приблизительно, 50% теоретического продукта, причем количество теоретического продукта равно количеству двухцепочечной ДНК в реакции), умноженную на количество циклов, пока реакция остается линейной. Если в ходе реакции накопление продукта перестает подчиняться линейному закону (что видно по уплощению флуоресцентной кривой для флуорофора, получаемой в режиме реального времени), то количество одноцепочечной ДНК в нелинейной фазе вычисляется на основании кратности увеличения флуоресцентного сигнала между последним циклом, когда реакция оставалась линейной, и заключительным циклом реакции амплификации. Обычно, если концентрация одноцепочечного продукта, полученного в ЛПЭ-ПЦР-амплификации, составляет около 200 фмолей/мкл, разбавляют цепочку избыточного праймера в отношении 1:8 до 25 фмолей/мкл и вводят 2 мкл разбавленного продукта (50 фмолей) непосредственно в 20 мкл реакционной смеси для секвенирования. При этих условиях общий фактор разбавления продуктов ЛПЭ-ПЦР в реакции секвенирования составляет 80. Если ввести в реакцию секвенирования 8 мкл разбавленного продукта ЛПЭ-ПЦР (200 фмолей), то общее разведение будет 20-кратным, и, по-прежнему, удастся получить интерпретируемые хроматограммы секвенирования.
Очистку образцов выполнять необходимо, потому что остающиеся после ПЦР амплификации реагенты, такие как праймеры и дНТФ, мешают обычному секвенированию. Метод ЛПЭ-ПЦР заменяет очистку осаждением из этанола или на колонках сродства простым этапом разбавления водой. Полученные для секвенирования ЛПЭ-ПЦР-образцы требуется только разбавить водой, чтобы разбавить избыточные одноцепочечные продукты ДНК водой по меньшей мере в 8-10 раз до концентрации 25 фмоль/мкл, а затем добавить 50-200 фмоль одноцепочечного продукта ДНК к реакционной смеси для секвенирования, содержащей 10 пмоль праймера секвенирования. Общий фактор разбавления в готовой смеси составляет по меньшей мере 20. При этих условиях остающиеся после ЛПЭ-ПЦР дНТФ будут слишком разбавлены, чтобы мешать секвенированию. Остаток избыточного праймера после ЛПЭ-ПЦР также не представляет собой проблемы, поскольку темплат, с которым эти праймеры связываются, ограниченный праймер, остается после разбавления в очень малой концентрации и полностью гибридизуется с цепочкой избыточного праймера. По этим двум причинам избыточный праймер не функционирует как праймер секвенирования. Пример 10 и фигура 17 демонстрируют эффективность метода "разбавь и вперед". На Фиг.17 показаны хроматограммы секвенирования, полученные с использованием симметричного ПЦР и традиционного метода приготовления образцов (очистка продуктов ДНК на колонке Qiagen с последующим количественным анализом гель-электрофорезом; общее время подготовки 1 час), и хроматограммы секвенирования, полученные способом ЛПЭ-ПЦР и разбавлением водой (общее время подготовки 30 секунд). Хроматограммы практически идентичны.
В примере 11 и на фигурах 18-19 показаны стратегии ЛПЭ-ПЦР-амплификации более чем одного продукта, полученного из одного и того же темплата ДНК в одной и той же реакции. Такие реакции содержат две пары праймеров (каждая пара состоит из избыточного и ограниченного праймера), которые амплифицируют две смежные последовательности непрерывного темплата. Две пары праймеров можно составить так, чтобы и избыточный, и ограниченный праймеры гибридизовались к одной и той же или к противоположным цепям темплата. Компетентный специалист в данной области понимает, что, когда одинаковые праймеры гибридизуются на противоположных цепочках темплата, два избыточных праймера могут удлиняться "внутрь" или "наружу" относительно своих соответствующих цепей темплата. Как видно из фигуры 19, последовательности обеих цепей избыточных праймеров можно получить в одной и той же реакционной смеси по методу "разбавь и вперед".
В примере 12 и на Фиг.20 показано, что количество оцДНК и дцДНК, генерируемых в процесса ЛПЭ-ПЦР-амплификации, можно измерить независимо, и с помощью этих данных можно вычислить отношение оцДНК/дцДНК, которое, в свою очередь, позволяет определить, достаточно ли накопленного на данный момент оцДНКдля последующего секвенирования по методу "разбавь и вперед".
В примере 13 и на Фиг.21 показано использование метода "разбавь и вперед" в смеси ЛПЭ-ПЦР-ампликонов состава 50:50, причем ампликоны характеризуются двумя близкородственными, но различными последовательностями. На Фиг.22 показано, что по методу "разбавь и вперед" можно отличить смеси, состоящие из двух ЛПЭ-ПЦР-ампликонов с близкородственными, но различными последовательностями в отношении 90:10 и 10:90 от чистых смесей состава 100:0 и 0:100, так же как и 30:70 и 70:30. Чтобы выполнить анализ такого типа, необходимо скорректировать наблюдаемые амплитуды пика каждого нуклеотида в каждом гетероплазмическом положении на ожидаемую амплитуду эквивалентного чистого нуклеотида в этом положении. Затем можно рассчитать относительные количества каждой последовательности как отношение амплитуд (скорректированный нуклеотид 1) / (скорректированный нуклеотид 1+скорректированный нуклеотид 2). Таким образом, как и в случае различающихся последовательностей митохондриальной ДНК, описанный здесь способ ЛПЭ-ПЦР и "разбавь и вперед" могут использоваться для обнаружения гетероплазмии. Сиквенс особенно удобно использовать для измерения гетероплазмии, поскольку с его помощью можно исследовать несколько сотен нуклеотидов за один анализ. Не связывая себя никакой теорией, можно предположить, что описанные здесь способы работают, в отличие от предыдущих попыток, основанных на симметричной ПЦР и секвенировании, поскольку способ ЛПЭ-ПЦР позволяет получить высокогомогенные популяции одноцепочечных ампликонов. Симметричный ПЦР, напротив, характеризуется тенденцией генерировать популяции молекул полной длины совместно с частичными ампликонами и ампликонами, полученными в результате неправильного старта.
Пример 14 и фигура 23 показывает, что способ ЛПЭ-ПЦР совместно по меньшей мере с одним простым толерантным к несоответствиям зондом позволяет получить кривые плавления по конечным результатам, которые, в свою очередь, дают возможность получить количественную оценку относительного содержания в смеси двух или более ЛПЭ-ПЦР-ампликонов с близкородственными, но различными последовательностями. Количественный анализ плавления по конечным результатам (QE) ЛПЭ-ПЦР смесей родственных ампликонов можно выполнить, поскольку способ ЛПЭ-ПЦР генерирует одноцепочечные продукты. Так, если в реакционной смеси присутствует один или более меченых толерантных к несоответствиям зондов, то зонды гибридизуются сначала с мишенью с наиболее комплементарной последовательностью, и затем, если температура понизилась в достаточной степени, к мишеням с остальными родственными последовательностями. Это, в свою очередь, означает, что каждый гибрид зонд/мишень характеризуется своей собственной температурой плавления и что величина пика плавления, полученного для каждого гибрида зонд/мишень, точно соответствует количеству образовавшейся соответствующей последовательности мишени. На основании количественных измерений либо амплитуды, либо двумерной площади под кривой плавления можно вычислить относительное наличие каждой мишени. Как показано на Фиг.23, этот способ позволяет с достоверностью 99.7% различить смеси, содержащие две последовательности, которые различаются на один нуклеотид и присутствуют в отношении 0:100-10:90-50:50-90:10-100:0.
Соответствующие настоящему изобретению анализы, выполняемые в присутствии или отсутствии реагента, описанного в нашей американской предварительной патентной заявке 60/619,620, можно независимо оптимизировать, чтобы избежать или минимизировать неверный старт, изменяя концентрацию добавляемой ДНК-полимеразы, например, Taq-полимеразы. Уменьшение неверного старта при изменении концентрации полимеразы можно наблюдать по кинетике реакции ЛПЭ-ПЦР с использованием зонда оцДНК или по изменению состава финального продукта, который можно определить различными известными методами. Авторы выяснили, что экспериментально удобно начинать с типичной избыточной концентрации Taq-полимеразы и затем поэтапно снижать эту концентрацию. Хотя слишком малое количество полимеразы может сделать реакцию неэффективной (это выражается в виде значимого снижения скорости или степени амплификации продукта), оптимальное ее содержание позволяет получить анализ ЛПЭ-ПЦР-амплификации с эффективной амплификацией дцДНК, и синтез оцДНК будет поддерживаться в течение большого количества циклов. На Фиг.15 показано, что оптимальный уровень полимеразы можно оценить по сигналу дцДНК, наблюдаемому при использовании такого двухцепочечного красителя, как SYBR Green, и по кривым плавления продукта дцДНК, также определяемым с использованием SYBR Green. Согласно примеру 16 и фигуре 24, если указанные анализы проводят на конкретный продукт оцДНК, генерируемый из различных количеств исходного материала, получаются линейные графики, параллельные на протяжении большого количества циклов получения оцДНК.
ПРИМЕРЫ
Пример 1. Сравнение связывания обычного красителя и такого красителя, в состав которого входят меченые праймеры
Чтобы сравнить производительность интеркалированного красителя с производительностью красителя, включающего взаимодействующий флуорофор, выполнили анализ удлинения. В качестве красителя использовали SYBR Green I с разведением 1:40000.
Были проанализированы три цепочки нуклеотидов. Темплат ДНК, удлиняемый праймер ДНК (меченный по 5' Сy5, комплементарный темплату и Тm которого составляла 60°С) и неудлиняемый олигонуклеотид ДНК (блокированный по 3'-концу фосфатной группой), также комплементарный мишени, в локализации 3' праймера, также меченный флуорофором Сy5 и характеризующийся более высоким значением Тm=79°С. Расстояние между праймером и неудлиняемым олигонуклеотидом было выбрано так, чтобы значения Тm продуктов удлинения праймера вплоть до неудлиняемого олигонуклеотида были ниже 79°С.
Реакционная смесь для анализа удлинения праймера включала 0.5 мкМ темплата ДНК, 1.5 мкМ праймера и 1.5 мкМ неудлиняемого олигонуклеотида. Смесь содержала также 1Х буфер ПЦР, 3 мМ MgCl2 и 250 нМ дНТФ, 1:40,000Х SYBR Green I и ДНКТаq-полимеразы. Реакционную смесь 2 минуты выдерживали при 50°С, так чтобы связать праймер и неудлиняемый олигонуклеотид и генерировать продукты удлинения праймера, почти достигающие олигонуклеотида. Образцы были получены в двух повторах.
По завершении реакции удлинения праймера продукт подвергли анализу плавления, в котором краситель SYBR Green возбуждался при изменении температуры. Температуру повышали, и по мере ее прохождения через диапазон температур плавления, охватывающий неудлиненный праймер и неудлиняемый олигонуклеотид, проводили регистрацию флуоресценции на длине волны эмиссии красителя и длине волны эмиссии флуорофора. Зависимость кривых плавления, первых производных флуоресценции как функции от температуры, представлена на Фиг.1. Панель А соответствует кривым 1 для двух образцов, данные получены для эмиссии красителя; панель В соответствует кривым 2 для двух образцов, данные получены для эмиссии Сy5.
Пример 2. Погашенные толерантные к несоответствиям зонды
Меченный зонд был сконструирован так, чтобы его консенсусная последовательность была комплементарна гену 16S рибосомальной ДНК штамма Mycobacterium. Вторичную структуру предсказали с помощью программы Mfold ((Zucker, M (2003), "Mfold web server for nucleic acid folding and hybridization prediction," Nucleic Acids Res 31:3406-3415), концентрация натрия была задана равной 70 мМ, а магния - 3 мМ. Последовательность зонда была Cy5-AATACTGGATAGGACC ACG AGG (SEQ. ID No. 1), предсказанная вторичная структура формировалась гибридизацией подчеркнутых участков. Предсказанное значение Тm для вторичной структуры зонда составляло 37°С. Зонд был протестирован на образцах, не содержащих мишень или содержащих M. Gordonae или M. Asiaticum в смеси с красителем SYBR Green I, где краситель возбуждался непосредственно, а флуорофор - косвенно. Результаты зависимости флуоресценции Сy5 от температуры представлены на Фиг.3, панель А. В строке 31 (нет мишени) показано высокое значение фоновой флуоресценции, но строки 32 (M. gordonae) и 33 (M. asiaticum) демонстрируют заметное превышение сигнала над фоном. Чтобы погасить фоновую флуоресценцию, к 3'-терминальному нуклеотиду зонда добавили нефлуоресцирующий гаситель (Black Hole(tm) II). Модифицированный зонд протестировали аналогично, результаты показаны на панели В фигуры 3. Как видно, фоновая флуоресценция (строка 34, нет мишени) заметно снизилась, а сигналы от M. gordonae (строка 35) и M. asiaticum (строка 36) стали существенно выше фона.
Другая технология гашения зонда заключается в конструировании зонда со структурой шпильки, терминально меченной соответствующим флуорофором с одного конца и гасителем с другого конца. Авторами сконструирован зонд с последовательностью Сy5-CTGGATAGGACCACGAGGCCAG-BHOII (SEQ. ID. NO. 2), где подчеркнутые последовательности комплементарны и формируют ножку шпильки. Чтобы достичь ножки, добавляют три 3'-терминальных нуклеотида. Предсказанная температура плавления зонда с полностью соответствующей мишенью составляет 60°С. Предсказанная Тm, ножки составляет, приблизительно, 48°С (данные получены на основе предсказанного значения Тm=40°С для немодифицированной нуклеотидной ножки, не объясняющего возросшую аффинность взаимодействия флуорофор-гаситель). Этот зонд также был протестирован, как описано выше, данные представлены на панели С фигуры 3. Фоновая флуоресценция (строка 37, нет мишени) была достаточно низка, а сигналы М. gordonae (строка 38) и М. asiaticum (строка 39) были значительно выше фона.
Пример 3. Генотипирование в реальном времени и по конечным результатам с использованием зондов, толерантных к несоответствиям
Этот пример иллюстрирует идентификацию гомозиготных и гетерозиготных образцов аллели G269 гена человеческой гексозаминидазы (Hex А), ответственного за болезнь Тея-Сакса. Эта идентификация осуществляется с помощью ЛПЭ-ПЦР-амплификации в режиме реального времени и меченных Сy5 толерантных к несоответствиям линейных зондов low-Тm, косвенно возбуждаемых при эмиссии красителя SYBR. Гибридизацию зонда регистрировали дважды за каждый цикл амплификации в температурном пространстве ЛПЭ-ПЦР-детекции, сначала при температуре 55°С, когда зонд является аллель-дискриминирующим в этом анализе и связывается исключительно с полностью соответствующей мишенью, и затем при 40°С, когда зонд толерантен к несоответствиям и связывается со всеми аллелями мишени в реакции амплификации. Детекция специфических аллелей и общего содержания аллелей с помощью зонда, толерантного к несоответствиям, позволяет провести коррекцию стохастических отклонений между ампликонами разных пробирок, которые наблюдаются при повторах. Отношение содержания специфических аллелей к общему содержанию аллелей в реакции (Сy5 при 55°С/Су5 при 40°С) позволяет провести нормализацию повторяющихся образцов при генотипировании по конечным результатам. Информацию о генотипировании получают из значений отношения. Для гомозиготных образцов сигналы зонда, регистрируемые в аллель-дискриминирующих условиях совпадают с сигналами, регистрируемыми в условиях толерантности зонда к несоответствиям, так как в обоих случаях зонд связывается со 100% аллелей мишени. Напротив, для гетерозиготных образцов сигналы зонда, регистрируемые в аллель-дискриминирующих условиях, в два раза слабее сигналов, регистрируемых в условиях толерантности к несоответствиям, так как в аллель-дискриминирующих условиях зонд связывается только с 50% аллелей мишени, а в условиях толерантности к несоответствиям - со 100%. Таким образом, гомозиготные образцы характеризуются более высоким отношением (Сy5 при 55°С/Сy5 при 40°С), по сравнению с гетерозиготными образцами. Этот метод генотипирования основан на детекции только одной аллели.
Праймеры и зонды ЛПЭ-ПЦР характеризуются следующими последовательностями и концентрационно-зависимыми температурами плавления. Последовательность ограниченного праймера 5' CGAGGTC ATTGAATACGC ACGGCTCC 3' (SEQ. ID No. 3). Его Tm[0] составляет 63.2°С при 25 нМ. Последовательность избыточного праймера 5' TAACAAGCAGAGTCCCTCTGGT 3' (SEQ. ID No. 4). Его Tm[0] составляет 61.8°С при 1 мкМ. Последовательность зонда 5' Сy5-GGGACCAGGTAAGAA 3' (SEQ. ID No. 5). Его Тm составляет 56.3°С. Он представляет собой зонд Low-Tm, a при использовании при температуре отжига 65°С также и Super-Low-Tm.
Для каждого генотипа (гомозиготный G269 и гетерозиготный G269) была поставлена серия повторяющихся ЛПЭ-ПЦР-анализов (n=15) в буфере 1 XPCR, 3 mM MgCl2, 250 мкМ дНТФ, 25 нМ ограниченного праймера, 1000 нМ избыточного праймера, 1.25 единицы Taq ДНК полимеразы, 0.6 мкМ меченного Сy5 зонда и SYBR Gold I с разведением 1:40000. Параметры циклов ПЦР следующие: 3 минуты при 95°С, затем 25 циклов при 95°С в течение 10 секунд, при 65°С в течение 20 секунд, при 72°С в течение 20 секунд, затем 30 циклов при 95°С в течение 10 секунд, при 65°С в течение 20 секунд, при 72°С в течение 20 секунд, при 55°С в течение 20 секунд и при 40°С в течение 20 секунд, значение флуоресценции в канале Сy5 регистрировали при 55°С и при 40°С. На Фиг.7 показан анализ отношения сигналов Сy5 при 55°С к сигналам Сy5 при 40°С и продемонстрировано, что эти сигналы подходят для генотипирования по конечным результатам на любом цикле амплификации после преодоления порога детекции зонда. На данной Фиг. отношения для гомозиготных образцов (круг 91) приблизительно в два раза превосходят отношения для гетерозиготных образцов (круг 92).
Пример 4. Анализ нескольких мишеней с использованием мишень-специфических зондов с различными температурами плавления
С помощью нескольких зондов, меченных одним и тем же флуорофором, можно определить и количественно оценить различные последовательности вдоль одного более длинного олигонуклеотида (например, продукта асимметричной ПЦР, ЛПЭ-ПЦР или амплификации типа rolling circle) или нескольких олигонуклеотидов. Использование зондов Low-Tm повышает специфичность по отношению к таким мишеням, сильно снижая или устраняя сигналы, генерируемые несоответствующими мишенями. Одним возможным применением такой технологии является генотипирование ДНК человека с целью поиска аллелей, вызывающих наследственные болезни. В этом примере описан температурный анализ для конструирования зондов и для детекции продуктов.
Для начала выбирают следующие мишени, которые потенциально могут присутствовать в продукте амплификации: нормальная последовательность гена трансмембранного регулятора муковисцидоза (cystic fibrosis transmembrane regulator (CFTR)) в области, кодирующей аминокислоту 542 протеина; последовательность мутации Delta F508, наиболее распространенной мутации CFTR; и нормальная последовательность, соответствующая мутации Delta F508.
Для каждой из трех мишеней конструируют аллель-дискриминирующие зонды Low-Tm. Эти зонды представляют собой низкотемпературные молекулярные сигнальные зонды, каждый из которых помечен флуорофором FAM и гасителем. Три зонда сконструировали так, чтобы их Тm по отношению к своим мишеням отличались в смесях, содержащих 70 mM Tris-HCl и 3 мМ MgCl2. Значение Тm "зонда 542" составляет 40°С (по методу ближайшего соседа было предсказано значение 41°С); значение Тm для "нормального зонда 508" составляет 47°С (по методу ближайшего соседа было предсказано значение 46°С); и значение Тm для "зонда Delta F508" составляет 54°С (по методу ближайшего соседа было предсказано значение 53°С). Кривые плавления, из которых получены эти значения, представлены на Фиг.8. На нем показана отрицательная первая производная функции зависимости значений флуоресценции от температуры для зонда 542 (строка 96), зонда DF508 (строка 97) и нормального зонда 508 (строка 98) для образцов в двух повторах. Приблизительно равные значения пиков были получены для концентраций мишени 1 мкМ и концентрации зонда 542 - 2 мкМ. Чтобы проверить дискриминацию аллелей, каждый зонд был протестирован по отношению к несоответствующим мишеням. Обнаружено при этом, что значение флуоресценции по отношению к правильной мишени в 5-10 раз превосходит флуоресценцию по отношению к несоответствующей мишени.
Как видно на Фиг.8, хорошо разрешимы даже маленькие различия в Тm. На таком графике, как фигура 8, можно разрешить различия в 4-5°С. Деконволюция с помощью программного обеспечения, поставляемого совместно с термоциклерами ПЦР в режиме реального времени, позволяют разрешить значения Тm, интервал между которыми в два раза меньше.
Одним из методов определения того, какая олигонуклеотидная мишень присутствует в анализируемом образце, является изучение отрицательной первой производной флуоресценции. Такой анализ представлен на Фиг.9, там использована флуоресценция, значения которой выше фона. Образцы, содержащие нормальную мишень 508, но где отсутствует мишень Delta F508 (круг 101), характеризуются пиком плавления при 54°С, указывающего на этот гибрид мишени и молекулярного маяка. Образцы, содержащие мишень Delta F508, но не содержащие нормальной мишени (круг 102), характеризуются пиком плавления при 47°С, что говорит о гибридизации с маяком мутантной последовательности. Образцы, содержащие обе мишени (круг 103), характеризуются широким пиком, охватывающим весь указанный диапазон температур, что говорит о флуоресценции от обоих гибридов мишени и молекулярного маяка. Наличие и относительная концентрация нормальной последовательности по аминокислоте 542 определяется наличием и относительной высотой пика плавления при температуре приблизительно 40°С. Образцы с нормальной мишенью по 542 (сплошная линия в каждой пронумерованной группе) характеризуются большим пиком при этой температуре. Образцы с мутантной мишенью 542, у которых изменен один нуклеотид в этой области, что совпадает со второй наиболее распространенной мутацией CFTR (пунктирная линия для каждой пронумерованной группы), не имеют пика при этой температуре, а образцы, содержащие обе мишени (штриховая линия для каждой пронумерованной группы), характеризуются пиком промежуточной высоты. Высота пика в образцах с обеими мишенями 542 определяется наличием соседнего пика плавления Delta F508.
Получить полный профиль плавления всей реакции амплификации не всегда возможно или желательно. Дополнительный анализ описанных выше образцов показывает, что на основании небольшого количества этапов детекции можно получить информацию, требуемую для идентификации специфических олигомеров в смеси.
Можно понижать, а не повышать температуру. Образцы сначала нагрели до температуры 70°С, а затем понижали температуру скачками по 5°С до достижения 30°С с 30-секундной детекцией на каждом этапе. Образцы, содержащие нормальную мишень 508, но не Delta F508, или содержащие мишень Delta F508, но не нормальную мишень, можно различить, основываясь на изменении флуоресценции от 60 до 50°С. Каждая комбинация олигонуклеотидов мишени давала уникальный паттерн изменения флуоресценции. На Фиг.10 представлена диаграмма рассеяния процентного изменения в росте флуоресценции при 55°С по сравнению с процентным изменением в росте флуоресценции при 45°С. Этот анализ позволяет различить комбинации мишеней, присутствующих в каждом образце. На основании изменений флуоресценции, а не интенсивности самой флуоресценции можно сделать точную оценку, даже когда образцы значительно различаются по общей концентрации мишеней, что может иметь место при повторном получении образцов для амплификации. На Фиг.10 представлены образцы в двух повторах для комбинации нормальной мишени 508+нормальной мишени 542 (круг 111), нормальной мишени 508+обеих мишеней 542 (круг 112), нормальной мишени 508+мутантной мишени 542 (круг 113), обеих мишеней 508+нормальной мишени 542 (круг 114), обеих мишеней 508+обеих мишеней 542 (круг 115), обеих мишеней 508+мутантной мишени 542 (круг 116), мишени Delta 508+нормальной мишени 542 (круг 117), мишени Delta 508+обеих мишеней 542 (круг 118) и мишени Delta 508+мутантной мишени 542 (круг 119). Можно выполнить сходный анализ с использованием этого температурного профиля для каждого цикла или избранных циклов реакции амплификации. Можно амплифицировать несколько образцов с ДНК известных генотипов и использовать полученные данные для определения ожидаемого диапазона значений. Это позволяет разработать метод быстрого определения генотипов неизвестных образцов. Хотя в этом примере было использовано только три зонда, возможно комбинированное использование значительно большего их количества. Основные ограничения на максимальное количество зондов накладывает температурный диапазон детекции и минимальные различия Тm между гибридами зонд-мишень. В свою очередь, эти ограничения зависят от природы реакции амплификации и возможностей оборудования и программного обеспечения для деконволюции. Например, 10 различных комбинаций зонд-мишень можно различить в 30-градусном температурном интервале, если минимальное различие в Тm для деконволюции составляет 3°С. Применение нескольких флуорофоров позволяет увеличить это число в несколько раз (имеется в виду число различимых комбинаций зонд-мишень).
Пример 5. Температурные нормализации с и без фоновой коррекции
QE ЛПЭ-ПЦР генотипирование rs858521 SNP было выполнено с неизвестными образцами ДНК. Для этого использовался гомозиготный контроль rs858521 (СС аллели) и гетерозиготный контроль (CG аллели) с одним Сy5-меченым зондом, толерантным к несоответствиям. Амплификацию и детекцию выполнили на детекторе ABI Prism Sequence Detector 7700 (Applied Biosystems, Foster City, California, U.S.A.), который, обычно, генерирует сигналы флуоресценции, скорректированные на базовую линию. Однако, в этом анализе используются отношения, и эти отношения были получены как из скорректированных на базовую линию сигналов флуоресценции (Фиг.11), так и из сырых сигналов (Фиг.12). На Фиг.11 представлено отношение флуоресценции зондов при 50°С к флуоресценции при 25°С как функция номера цикла реакции амплификации, флуоресцентные сигналы были аппаратно скорректированы на базовую линию. На этой Фиг. круг 113 представляет собой повторы гомозиготного контроля, круг 114 соответствует повторам гетерозиготного контроля, круги 111 и 112 соответствуют неизвестным данным. На Фиг.112 показаны те же данные, но полученные для сырых сигналов. Круг 116 здесь представляет собой повторы гомозиготного контроля, круг 117 - повторы гетерозиготного контроля, круг 115 неизвестен. Использование для нормализации сигналов, скорректированных на базовую линию, привело к неоднозначному генотипированию для одного образца на Фиг.11, кругу 112. Напротив, использование сырых сигналов для нормализации позволило сделать корректное генотипирование для всех образцов. Результат показывает, что реализованная в программном обеспечении прибора ABI Prism 7700 Sequence Detector коррекция на базовую линию может создавать артефакты, влияющие на нормализацию сигнала, и потому, предпочтительно, ее следует избегать.
Пример 6. Нормализация по трем температурам
Повторяющиеся реакции ЛПЭ-ПЦР-амплификации, содержащие праймеры rs858521 SNP и один толерантный к несоответствиям резонсенсный зонд, были выполнены с очищенной геномной ДНК для каждого генотипа rs858521 gene SNP (эквивалент 1800 геномов, 18 повторов реакции для гомозиготного СС, гетерозиготного CG и гомозиготного GG генотипов). Амплифицированные продукты проанализировали по кривым плавления, показанным на Фиг.13, панель А, и по нормализации данных, показанных на панелях В и С. На Фиг.13А представлен график "сырых" флуоресцентных сигналов, полученных при анализе кривой плавления после ЛПЭ-ПЦР-амплификации. При высоких температурах использовавшийся зонд был аллель-дискриминирующим, но при понижении температуры становился значительно более толерантным к несоответствиям. Внутренняя вариабельность выхода продукта при повторах мешает дискриминации их генотипов по "сырому" флуоресцентному сигналу (круг 131) в температурном окне аллельной дискриминации для этого зонда (40-60°С, ранее было определено с помощью синтетических олигонуклеотидных мишеней, данные не показаны). На Фиг.13В представлены сигналы от каждого образца, нормализованные при каждой температуре по сигналу, собранному при температуре полной толерантности к несоответствиям (25°С) для этого образца. На Фиг.13В нормализованные сигналы для гомозиготных аллелей СС соответствуют кругу 132, нормализованные сигналы для гетерозиготных аллелей CG соответствуют кругу 133, и нормализованные сигналы для гомозиготных аллелей GG соответствуют кругу 134. Как видно из фигуры, нормализация уменьшает разброс сигнала и дает возможность осуществить идентификацию каждого генотипа в окне аллельной дискриминации. Максимальное разделение наблюдалось при 52°С, что соответствует Тm использованного резонансного зонда. Хотя разброс сигнала на Фиг.13В значительно снижен по сравнению с 13А, в интенсивности сигналов от повторяющихся образцов все еще наблюдается некоторая вариабельность, очевидная из рассеяния на кинетических кривых. Фиг.13С показывает, что наилучшим методом устранения этого остаточного разброса сигнала является нормализация флуоресцентного сигнала при каждой температуре на флуоресцентные сигналы, зарегистрированные при верхней и нижней температурах окна аллельной дискриминации, определяемого на Фиг.13В по точкам, где кривые плавления начинают расходиться (то есть, 40 и 60°С, соответственно). На Фиг.13С нормализованные сигналы для гомозиготных аллелей СС соответствуют кругу 135, нормализованные сигналы для гетерозиготных аллелей CG соответствуют кругу 136, и нормализованные сигналы для гомозиготных аллелей GG соответствуют кругу 137. Если Fb и Ft представляют собой значения флуоресценции, полученные для нижней и верхней границ температурного окна дискриминации аллелей, соответственно, a Fs соответствует флуоресценции при любой данной температуре в ходе анализа плавления, то нормализованные отношения флуоресценции вычисляются следующим образом:
Нормализованное по трем температурам отношение флуоресценции=(Fs-Ft)/(Fb-Ft).
Одновременная нормализация флуоресцентного сигнала при каждой температуре на сигналы при 40 и при 60°С для любого данного образца еще больше снизила разброс значений флуоресценции и привела к тому, что повторяющиеся кривые плавления для каждого генотипа стали чрезвычайно компактными (см. фигуру 13С). Отношения флуоресценции, вычисленные при одной температуре, а именно, Тm зонда (52°С, и нормализованные на значения флуоресценции, определенные для верхней и нижней температур окна дискриминации аллелей (то есть, при 60 и 40°С), уникально определяют каждый генотип с вероятностью больше 99.7% (то есть, области графика, содержащие три стандартных отклонения для 99.7% всех возможных отношений флуоресценции для каждого генотипа, не перекрываются друг с другом, данные не показаны). Подобным образом улучшенные сигналы были получены для сайта rs2270517 SNP, когда флуоресцентный сигнал был вычислен для Тm зонда (57°С) и нормализован на соответствующие верхнюю и нижнюю температуры окна дискриминации аллелей (то есть, на 71 и 45°С).
Пример 7. Прямое пиросеквенирование продукта ЛПЭ-ПЦР
Повторяющиеся ЛПЭ-ПЦР-амплификации были выполнены в объеме 25 мкл в буфере 1Х PCR, 3 мМ MgCl2, 20 нМ дНТФ, 25 нМ ограниченного праймера, 1000 нМ избыточного праймера, 1.25 единицы Platinum Taq ДНК полимеразы и 100 геномов человеческой ДНК. Последовательность ограниченного праймера была 5' CCGCCCTTCTCTCTGCCCCCTGGT 3' (SEQ. ID No. 6), а последовательность избыточного праймера - 5' GCCAGGGGTTCCACTACGTAGA 3' (SEQ. ID No. 7). Эти последовательности амплифицируют сегмент длиной 94 пары оснований из экзона 11 гена человеческой гексозаминидизы А. Профиль термического циклинга для ЛПЭ-ПЦР-амплификации заключался в следующем: сначала 3 минуты при 95°С, затем 10 циклов при 95°С по 10 секунд и при 72°С по 20 секунд, а затем 55 циклов при 95°С по 10 секунд, при 67°С по 20 секунд и при 72°С по 20 секунд. По завершении реакции 16.6 мкл (эквивалент 3 пмолей одноцепочечной ДНК (оцДНК), в соответствии с эмпирическими оценками, сделанными на основании предыдущих экспериментов по пиросеквенированию) смешали с 20 мкл 10 mM Tris-Cl pH 8.5 и перенесли в ячейку используемой для пиросеквенирования платы для микротитрования. Для удаления избыточных дНТФ и пирофосфата из продуктов, амплифицированных по способу ЛПЭ-ПЦР, в систему ввели стандартную ферментативную смесь для пиросеквенирования, содержащую экзонуклеаза-дефицитную ДНК полимеразу Klenow, апиразу, люциферазу, АТФ-сульфурилазу, а также стандартную смесь субстратов для пиросеквенирования, содержащую люциферин и аденозин-5'-фосфосульфат.Все смеси входят в набор PSQ 96 SNP Reagent Kit (Pyrosequencing, Inc, Westboro, MA), их впрыснули в ячейки с ЛПЭ-ПЦР-образцами с помощью прибора PSQ 96 (Pyrosequencing, Inc., Westboro, MA), в соответствии с инструкциями производителя, и инкубировали 60 секунд при температуре 37°С. Дальнейшие включения дНТФ, обычно, выполняются автоматически прибором PSQ 96. Вместо этого в смесь вручную добавили требуемый в соответствии с программой объем 10 mM Tris-Cl pH 7.5. После этого в ячейки с ЛПЭ-ПЦР-образцом ввели 2.5 мкл 10 мкМ праймера секвенирования (5' CTGGTACCTGAACCGTAT 3') (SEQ. ID No. 8). Учитывая объемы ферментных и субстратных смесей, добавляемых к ЛПЭ-ПЦР-образцу, конечная концентрация праймера секвенирования была оценена как 0.5 мкМ, а конечный объем как 50 мкл. Образец с праймером снова поместили в аппарат PSQ 96 и продолжали обработку в соответствии с инструкциями производителя, за исключением того, что вместо обычно вводимых прибором ферментов и субстратов для пиросеквенирования в данном случае вводили аналогичные объемы 10 mM Tris-Cl pH 7.5 и затем дНТФ. Полученная пирограмма представлена на Фиг.14, панель А. На нем заметен световой сигнал, возникающий после включения конкретных нуклеотидов. Высота пика соответствует количеству нуклеотида, включенного при его введении. На панели С той же фигуры видно, что в темплат были встроены по одному нуклеотиду А и Т, затем два следующих нуклеотида С и т.д. На основании высот пиков и порядка введения нуклеотидов была определена следующая последовательность: 5'ATCCTATGGCCC3' (SEQ. ID No. 9). Эта последовательность подтверждена по данным GenBank для гена гексаминидазы А человека (GenBank accession number: S62068). Эти результаты показывают, что предварительная обработка ЛПЭ-ПЦР-образцов используемыми для пиросеквенирования ферментными и субстратными смесями позволяет осуществить прямое пиросеквенирование ЛПЭ-ПЦР-амплифицированного продукта после отжига праймера и итерактивного присоединения дНТФ. Приведение описанного выше протокола в соответствие с инструкциями производителя (то есть, выполнение отжига праймера после добавления ферментных и субстратных смесей для пиросеквенирования) приводит к появлению 80% ложнопозитивных пиков после добавления тех нуклеотидов дНТФ, которые не включались в темплат.Эти ложнопозитивные пики обусловлены частичным удлинением праймера секвенирования в результате ЛПЭ-ПЦР-амплификации с оставшимися дНТФ до начала пиросеквенирования.
В отдельном эксперименте описанный выше ЛПЭ-ПЦР-образец подвергли очистке с помощью набора для очистки PCR purification kit (Qiagen, Valencia, CA) в соответствии с инструкциями производителя и восстановили при 0.375 пмоль/мкл в 10 мМ Tris-Cl pH 7.5. Восемь микролитров этого раствора (всего 3 пмоль) смешали с описанным выше праймером секвенирования, так чтобы конечная концентрация праймера составляла 0.5 мкМ, а конечный объем - 50 мкл в 10 мМ Tris-Cl pH 7.5. Образец подвергли пиросеквенированию на приборе PSQ 96 в соответствии с инструкциями производителя. Полученная пирограмма показана на Фиг.14, панель В. Традиционное приготовление, требующее больше времени и более дорогое, не позволило получить результаты, которые превосходили бы способ согласно изобретению, проиллюстрированный на панели А.
Пример 8. Прямое пиросеквенирование продуктов ЛПЭ-ПЦР.
Чтобы генотипировать одиночные клетки, выполнили повторяющиеся ЛПЭ-ПЦР-амплификации в объеме 25 мкл, содержащем буфер 1Х PCR, 3 mM MgCl2, 100 мкМ дНТФ, 100 пМ ограниченного праймера, 1000 нМ избыточного праймера, 1.25 единиц AmpliTaq Gold ДНК полимеразы (Applied Biosystems, USA). Каждую реакцию инициировали одним человеческим лимфобластом, приготовленным, как описано в работе Pierce et al. (2002) Biotechniques 32(5):1106-1111 (см. американский патент US-2003-022231-А1), и обладающего одним из трех возможных генотипов для мутации IVS-110. Последовательность ограниченного праймера 5' GGCCATCACTAAAGGCACCGAGCACT 3' (SEQ. ID No. 10), последовательность избыточного праймера 5' GGGTTTCTGATACGCACTGACTCTCTC 3' (SEQ. ID No. 11). Эти последовательности амплифицируют состоящий из 191 пары оснований сегмент гена β-глобина человеческой хромосомы 11р. Профиль термического циклинга ЛПЭ-ПЦР-амплификации следующий: 10 минут при 95°С, затем 65 циклов при 95°С по 10 секунд, при 66°С по 15 секунд и при 72°С по 20 секунд. После амплификации 5 мкл смешали с 6.64 мкл 20 mM Tris-Acetate pH 7.6 и перенесли в ячейку оптической платы для пиросеквенирования. Чтобы удалить оставшиеся дНТФ и пирофосфат из продукта ЛПЭ-ПЦР-амплификации, добавили стандартный объем ферментативной смеси для пиросеквенирования (содержащую экзонуклеаза-дефицитную ДНК полимеразу Klenow, апиразу, люциферазу, АТФ-сульфурилазу) и приблизительно двукратный стандартный объем субстратной смеси (содержащей люциферин и аденозин-5'-фосфосульфат), входящих в состав набора Pyro Gold Reagent Kit (Biotage AB, Uppsala, Sweden). Смеси последовательно диспергировали в ячейках, содержащих ЛПЭ-ПЦР-образцы с помощью прибора PSQ HS 96A (Biotage AB, Uppsala, Sweden). Прибор был настроен следующим образом: время впрыскивания ферментативной смеси 23.5 мс, субстратной смеси - 44.0 мс; давление диспергирования реагентов - 400 мбар. В течение 60 секунд образцы инкубировали при 28°С, за это время выход света падал ниже фоновых значений. После этого к каждому образцу добавили 0.36 мкл 10 мкМ раствора праймера секвенирования состава 5' GACCACCAGCAGCCTAAG 3' (SEQ. ID No. 12). Реакционный объем был тем самым увеличен до 12 мкл, после чего осуществили отжиг праймера при 80°С в течение 2 минут с последующим охлаждением до комнатной температуры на 10 минут. Кроме того, добавили 900 мкМ 3'-фосфорилированного варианта ограниченного праймера ЛПЭ-ПЦР (SEQ. ID No. 7). Это было сделано, чтобы не допустить самосвертывания и удлинения 3'-конца темплата. Образцы с праймером секвенирования снова поместили в прибор PSQ HS 96A и продолжали обработку в соответствии с инструкциями производителя, включая обычное добавление ферментативных и субстратных смесей. Полученные пирограммы клеток с гомозиготным диким типом, гетерозиготным и гомозиготным мутантными генотипами показаны на Фиг.15, панели А-С, соответственно. Световые единицы и высоты пиков описаны в примере 7. Относительные высоты пиков соответствуют количеству нуклеотидов, включенных по каждому положению. Взглянув на панель А, можно видеть, что второй пик (Т) в два раза ниже первого (G), в три раза ниже третьего (G), в четыре раза ниже четвертого (А) и такой же высоты, как пики 5-8 (TAGA). Для первых восьми пиков получается следующая последовательность: GGTGGGAAAATAGA(SEQ. ID No. 13). На основании высот пиков и порядка введения нуклеотидов, была определена последовательность β-глобина дикого типа (фиг.15, панель А); в дальнейшем она была подтверждена по данным GenBank для гена β-глобина человека. Гетерозиготная (панель В) или гомозиготная (панель С) мутации были подтверждены для сайта IVS-110, что отмечено стрелками. Следует отметить, что на панели В пик "С" высотой 1.5 единицы сопровождается 0.5 единичным пиком "Т". Это означает, что за основанием "С" в обоих аллелях следует основание "С" в одной аллели и "Т" в другой аллели. Данные результаты демонстрируют, что предварительная обработка ЛПЭ-ПЦР-образцов ферментными и субстратными смесями, используемыми для пиросеквенирования, позволяет осуществить прямое пиросеквенирование ЛПЭ-ПЦР после отжига праймера и итеративного добавления дНТФ. Приведение описанного выше протокола в соответствие с инструкциями производителя (то есть, выполнение отжига праймера после добавления ферментных и субстратных смесей для пиросеквенирования) приводит к появлению 80% ложнопозитивных пиков после добавления тех нуклеотидов дНТФ, которые не должны включаться в темплат. Эти ложнопозитивные пики обусловлены частичным удлинением праймера секвенирования с помощью оставшихся дНТФ.
Пример 9. Пиросеквенирование продуктов ЛПЭ-ПЦР для длинных последовательностей
ЛПЭ-ПЦР-амплификацию выполнили в объеме 25 мкл, содержащем буфер "1X PCR, 3 mM МgCl2, 100 нкМ дНТФ, 100 нМ ограниченного праймера, 1000 нМ избыточного праймера, 1.25 единиц AmpliTaq Gold ДНК полимеразы (Applied Biosystems, USA) и 50 нМ реагента, снижающего неверный старт (реагент 9-22DD) и описанного в предварительной американской патентной заявке, озаглавленной "Реагенты и методы для повышения воспроизводимости и снижения неверного старта в ПЦР-амплификациях". Реагент 9-22DD представляет собой олигонуклеотид типа шпильки с ножкой из 9 нуклеотидов и одноцепочечной петлей длиной 22 нуклеотида. Этот олигонуклеотид модифицировали, введя группы Dabcyl по 5' и по 3'-концам. Последовательность олигонуклеотида 5' CGCGGCGTCAGGCATATAGGATACCGGGACAGACGCCGCG3' (SEQ. ID. No 14). Реакцию инициировали 20 геномными эквивалентами человеческой ДНК. Последовательность ограниченного праймера соответствует 5' GGTCAGCGCCGGGCTGCAAGTGTAGA3' (SEQ. ID No. 15), а последовательность избыточного праймера - 5' GATGGGTGGAGCTTGTCTTGAGG 3' (SEQ. ID No. 16). Эти последовательности амплифицируют сегмент длиной 78 пар оснований, расположенный около гена р53 человеческой хромосомы 17р. Профиль термического циклинга ЛПЭ-ПЦР-амплификации следующий: 10 минут при 95°С, затем 60 циклов при 95°С по 10 секунд, при 66°С по 10 секунд и при 72°С по 20 секунд. По завершении амплификации 7.5 мкл продукта смешали с 9.96 мкл 20 мМ Tris-Acetate pH 7.6 и перенесли в ячейки оптической платы для пиросеквенирования. Чтобы удалить оставшиеся дНТФ и пирофосфат из продукта ЛПЭ-ПЦР-амплификации, добавили стандартный объем ферментативной смеси для пиросеквенирования (содержащую экзонуклеаза-дефицитную ДНК полимеразу Klenow, апиразу, люциферазу, АТФ-сульфурилазу) и приблизительно двукратный стандартный объем субстратной смеси (содержащей люциферин и аденозин-5'-фосфосульфат), входящих в состав набора Pyro Gold Reagent Kit (Biotage AB, Uppsala, Sweden). Смеси последовательно диспергировали в ячейках, содержащих ЛПЭ-ПЦР-образцы с помощью прибора PSQ HS 96A (Biotage AB, Uppsala, Sweden). Прибор был настроен следующим образом: время впрыскивания ферментативной смеси 23.5 мс, субстратной смеси - 44.0 мс; давление диспергирования реагентов - 400 мбар. В течение 60 секунд образцы инкубировали при 28°С, за это время выход света падал ниже фоновых значений. В этом ампликоне в качестве праймера для пиросеквенирования использовали ограниченный праймер ЛПЭ-ПЦР (SEQ. ID No. 10), и по 0.54 мкл 10 мкМ раствора этого праймера добавили к каждому образцу, доведя общий объем реакционной смеси до 18 мкл, после чего осуществили отжиг праймера при 80°С в течение 2 минут с последующим охлаждением до комнатной температуры на 10 минут. Образцы с праймером секвенирования снова поместили в прибор PSQ HS 96A и продолжали обработку в соответствии с инструкциями производителя, включая обычное добавление ферментативных и субстратных смесей. Полученная пирограмма показана на Фиг.16. Как разъясняется в примере 8, относительные высоты пиков соответствуют числу нуклеотидов, встроившихся по каждому положению. Правильная предполагаемая последовательность в соответствии с данными из базы GenBank изображена над пиками, причем подстрочные символы обозначают количество данного основания в строке (то есть, G1C1A1G2=GCAGG). Данные результаты демонстрируют, что предварительная обработка ЛПЭ-ПЦР-образцов ферментными и субстратными смесями, используемыми для пиросеквенирования, позволяет прочитать больше 50 пар оснований.
Пример 10. Прямое обыкновенное секвенирование продукта ЛПЭ-ПЦР
ПЦР-амплификацию выполнили на детекторе ABI Prism Sequence Detector 7700 (Applied Biosystems, Foster City, CA, U.S.A.) для сегмента экзона 7 гена человеческой гексозаминидизы А с мутацией G269, отвечающей за болезнь Тея-Сакса. Последовательность соответствует номеру М 16417 из базы GenBank. Одна амплификация представляет собой ЛПЭ-ПЦР-амплификацию, продукт которой непосредственно был подвержен секвенированию. В качестве контроля концентрацию праймера изменили на эквимолярную и выполнили обычную симметричную ПЦР-амплификацию, после чего продукт амплификации подвергли традиционной очистке и затем обычному секвенированию.
Реакционные смеси для амплификации (финальные концентрации):
Объем: 25 мкл
1× PCR буфер (Invitrogen, Carlsbad, CA, U.S.A.)
3 мМ MgCl2
10 мкМ дНТФ
0.6 мкМ зонда (только для ЛПЭ-ПЦР)
Краситель SYBR Gold (Molecular Probes, Eugene, OR, U.S. А), разбавленный в отношении 1:41,666
1.25 Units Platinum Taq ДНК полимеразы (Invitrogen)
6 нг человеческой геномной ДНК (эквиваленты 1000 геномов)
Праймеры: для ЛПЭ-ПЦР - 25 нМ ограниченного праймера и 1000 нМ избыточного праймера (для контроля. по 300 нМ каждого из этих праймеров).
Последовательности олигонуклеотидов
Ограниченный праймер: 5' CGAGGTCATTGAATACGCACGGCTCC 3' (SEQ. ID. No. 17)
Избыточный праймер: 5' TAACAAGCAGAGTCCCTCTGGT 3' (SEQ. ID. No. 18)
Зонд: 5' Cy5 GGGACCAGGTAAGAA-фосфат 3' (SEQ. ID No. 19)
Реакционная смесь для циклов секвенирования:
Объем 20 мкл
100 фемтомолей (фмолей) секвенируемого продукта
5 пикомолей (пмолей) праймера для секвенирования (ограниченного или избыточного праймера)
Смесь 1× DTC5 Quick Start Master Mix (Beckman Coulter, Inc., Fullerton, CA, U.S.A.) [включает дНТФ, ддНТФ, буфер, MgCl2].
Обычные секвенирование
Смеси для реакции секвенирования подвергли циклическому секвенированию и капиллярному электрофорезу на установке CEQ 2000XL ДНК Sequence (Beckman Coulter, Inc., Fullerton, CA, U.S.A.) с использованием набора CEQ 2000 Due Termination Cycle Sequencing Kit (Beckman Coulter) и следуя инструкциям производителя.
ЛПЭ-ПЦР-амплификация и осуществление секвенирования
Реакционную смесь для ЛПЭ-ПЦР-амплификации подвергли термическому циклингу следующим образом: 3 минуты при 95°С; 20 циклов при 95°С по 10 секунд, при 65°С по 20 секунд и при 72°С по 20 сек, и 70 циклов при 95°С по 10 секунд, при 65°С по 20 секунд, при 72°С по 20 секунд, при 55°С по 20 секунд и при 40°С по 20 секунд. За синтезом двухцепочечного ампликона следили по возбуждению красителя SYBR, флуоресценцию регистрировали при 72-градусном этапе удлинения праймера. За синтезом одноцепочечного продукта после израсходования ограниченного праймера следили по возбуждению красителя SYBR, читая флуоресценцию флуорофора Сy5 зонда low-Тm на 40-градусном низкотемпературном этапе детекции.
Чтобы получить 100 фмолей продукта удлинения избыточного праймера, было необходимо разбавить продукт амплификации. Количество продукта в 25 мкл продукта реакции оценивают следующим образом. Во-первых, количество этого продукта в двухцепочечном продукте, полученном во время первоначальных циклов амплификации, определяется количеством ограниченного праймера. В данном примере это 25 нМ, что соответствует 25 фмоль/мкл. Для оценки концентрации одноцепочечного продукта удлинения на линейной фазе ЛПЭ-ПЦР-амплификации, то есть, после исчерпания ограниченного праймера, эту фазу разделили на две части по результатам изучения кривой флуоресценции Сy5: в первой части амплификация усиливается в арифметической прогрессии, а во второй части накопление продукта замедляется. Для первой части, которая в этом примере составляет 6 циклов предположили, что эффективность амплификации составляет 50% (предположение сделано на основании работы Gyllensten, U.B.H. and Eriich, А. (1988), "Generation of Single-Stranded ДНК by the Polymerase Chain Reaction and its Application to Direct Sequencing of the HLA-DQA LOCUS," Генерация одноцепочечной ДНК в полимеразной цепной реакции и его использование в прямом секвенировании локуса HLA-DQA. Proc. Natl. Acad. Sci. USA 85:7652-7656.). Генерация одноцепочечного продукта в этих шести циклах была оценена как исходная концентрация (25 фмоль/л)*число циклов (6)*эффективность (0.5). Дальнейшее накопление продукта было оценено как процентное усиление сигнала Сy5 в оставшейся части реакции (в данном случае это 233.3%). Общее накопление продукта на линейной фазе, таким образом, составляло 175 фмоль/мкл (25×6×0.5×2.333), а общая концентрация продукта, включая 25 фмоль/мкл двухцепочечного ампликона, оценивается в 200 фмоль/мкл. Чтобы получить 100 фмоль реакционной смеси для циклического секвенирования, разбавили продукт реакции водой в отношении 1:8 и ввели 4 мкл разбавленного продукта в 20 мкл реакционной смеси. Это означает, что продукт амплификации окончательно был разбавлен в отношении 1:40.
Получая 100 фмоль продукта удлинения ограниченного праймера, оценили, что продукт реакции амплификации содержал 25 нМ этого продукта, или 25 фмоль/мкл. Добавили 4 мкл продукта амплификации к 20 мкл смеси реакции для циклического секвенирования, получив желаемое исходное количество 100 фмоль.
Контроль амплификации и подготовка к секвенированию
Реакционную смесь для амплификации подвергли такому же профилю термического циклинга, за исключением того, что выполнили только 18 (а не 70) пятитемпературных циклов, поскольку построенный в реальном времени график сигнала интеркалированного красителя показал, что в этой точке амплификация выходила на плато и образовывался только требуемый продукт. Продукты амплификации в смеси амплификации в конце реакции очистили традиционным способом с использованием набора для быстрой очистки ПЦР QUIA (Qiagen, Valencia, CA, U.S.A.) и следуя инструкциям производителя. Очищенные ампликоны подвергли количественному анализу методом гель-электрофореза в 3% агарозном геле в 0.5×ТВЕ против различных количеств ДНК маркеров ФХ174 Hind III, который поставили вслед за визуализацией методом окраски этидиум бромидом (0.5 мкг/мл). В реакцию циклического секвенирования включили 100 фмоль продукта для каждого праймера секвенирования.
Результаты
И способом ЛПЭ-ПЦР, и контрольным способом получили последовательности, соответствующие информации из базы GenBank (номер доступа М 16417). На Фиг.17 приведены четыре хроматограммы секвенирования. Панель А иллюстрирует способ ЛПЭ-ПЦР, ограниченный праймер используется в циклическом секвенировании как праймер секвенирования. Панель В иллюстрирует способ ЛПЭ-ПЦР, избыточный праймер используется в циклическом секвенировании как праймер секвенирования. Панель С соответствует контрольному способу, когда в качестве праймера секвенирования используется избыточный праймер. Панель D соответствует контрольному способу, когда в качестве праймера секвенирования используется ограниченный праймер. На каждой хроматограмме приведены кривые флуоресценции, полученные для меченых нуклеотидов, а также установленные последовательности нуклеотидов.
Пример 11. Стратегии ЛПЭ-ПЦР-амплификации более чем одного продукта из одного и того же темплата ДНК в одной и той же реакции
ПЦР-амплификации были выполнены с помощью детектора ABI Prism Sequence Detector 7700 (Applied Biosystems, Foster City, CA, U.S.A.). При этом было амплифицировано два ампликона длиной 549 и 464 основания, спроектированные как Н и L цепи HV1 и HV2. Все было сделано в одной дуплексной реакции в d-кольцевой области человеческой митохондриальной ДНК, основываясь на которой последовательности амплифицировали с использованием избыточного праймера.
Реакционные смеси для амплификации (финальные концентрации)
Объем: 25 мкл
1× PCR буфер (Invitrogen, Carlsbad, CA, U.S.A.)
3 мМ MgCl2 (Invitrogen)
250 мкМ дНТФs (Promega)
1.0 мкМ зонда (только для ЛПЭ-ПЦР)
Краситель SYBR Green (FMC Bioproducts, Rockland ME, U.S.А), разведенный в 10 раз
1.25 единицы Platinum Taq ДНК полимеразы (Invitrogen)
Геномная ДНК человеческих лимфоцитов крови (эквивалентно 100 mtДНК геномам)
Праймеры: для ЛПЭ-ПЦР, 50 нМ ограниченного праймера и 1000 нМ избыточного праймера.
22 Последовательности олигонуклеотидов
Зонд: 5 ' Сy5 - TGCTAATGGTGGAG -Phosphate 3 ' (SEQ. ID No. 20)
HV1-H
Ограниченный праймер: 5' GCCCGGAGCGAGGAGAGTAGCACTCTTG3'(SEQ. ID. No. 21)
Избыточный праймер: 5' CACCAGTCTTGTAAACCGGAGATGAA 3' (SEQ. ID. No. 22) HV2-H
Ограниченный праймер: 5' GTATGGGAGTGGGAGGGGAAAATAATGTGTTAG 3' (SEQ. ID. No.23)
Избыточный праймер: 5' AGGTCT АТСАСССТАТТААСС АСТСА 3' (SEQ. ID. No. 24)
HV1-L
Ограниченный праймер: 5' CACCAGTCTTGTAAACCGGAGATGAAAACC 3' (SEQ. ID. No.25)
Избыточный праймер: 5' CGAGGAGAGTAGCACTCTT3' (SEQ. ID. No. 26)
HV2-L
Ограниченный праймер: 5' AGGTCTATCACCCTATT AACCACTC ACGGG 3' (SEQ. ID. No.27)
Избыточный праймер: 5' GGAGGGGAAAATAATGTGTTAGT 3' (SEQ. ID. No. 28)
Реакционная смесь для циклов секвенирования
Объем 25 мкл
100 фмолей секвенируемого продукта
5 пмолей праймера для секвенирования (ограниченного или избыточного праймера)
Смесь 1× DTC5 Quick Start Master Mix (Beckman Coulter, Inc., Fullerton, CA, U.S.A.) [включает дНТФ, ддНТФ, буфер, MgCl2].
Обычное секвенирование
Смеси для реакции секвенирования подвергли циклическому секвенированию и капиллярному электрофорезу на установке CEQ 2000XL ДНК Sequence (Beckman Coulter, Inc., Fullerton, CA, U.S.A.) с использованием набора CEQ 2000 Due Termination Cycle Sequencing Kit (Beckman Coulter) и следуя инструкциям производителя.
ЛПЭ-ПЦР-амплификация и осуществление секвенирования
Реакционную смесь для ЛПЭ-ПЦР-амплификации подвергли термическому циклингу следующим образом: 3 минуты при 95°С; 15 циклов при 95°С по 15 секунд, при 64°С по 10 секунд и при 72°С по 45 сек, и 50 циклов при 95°С по 15 секунд, при 64°С по 10 секунд, при 72°С по 45 секунд, и только для HV1-H при 50°С по 20 секунд. За синтезом двухцепочечного ампликона следили по возбуждению красителя SYBR, флуоресценцию регистрировали при 72-градусном этапе удлинения праймера. За синтезом одноцепочечного продукта после израсходования ограниченного праймера следили по возбуждению красителя SYBR, читая флуоресценцию флуорофора Сy5 зонда low-Тm на 50-градусном низкотемпературном этапе детекции только для участка HV1-H.
Чтобы получить 100 фмолей продукта удлинения избыточного праймера, было необходимо разбавить продукт амплификации. Количество продукта в 25 мкл продукта реакции оценили следующим образом. Во-первых, количество этого продукта в двухцепочечном продукте, полученном во время первоначальных циклов амплификации, определяется количеством ограниченного праймера. В данном примере это 50 нМ, что соответствует 50 фмоль/мкл. Для оценки концентрации одноцепочечного продукта удлинения на линейной фазе ЛПЭ-ПЦР-амплификации, то есть, после исчерпания ограниченного праймера, эту фазу разделили на две части по результатам изучения кривой флуоресценции Сy5: в первой части амплификация усиливается в арифметической прогрессии, а во второй части накопление продукта замедляется. Для первой части, которая в этом примере составляла 11 циклов, предположили, что эффективность амплификации составляла 50% (предположение сделано на основании работы Gyllensten, U.B.H. and Eriich, А. (1988), "Generation of Single-Stranded ДНК by the Polymerase Chain Reaction and its Application to Direct Sequencing of the HLA-DQA LOCUS," Генерация одноцепочечной ДНК в полимеразной цепной реакции и его использование в прямом секвенировании локуса HLA-DQA. Proc. Natl. Acad. Sci. USA 85: 7652-7656.). Генерация одноцепочечного продукта в этих одиннадцати циклах была оценена как исходная концентрация (50 фмоль/л)*число циклов (11)*эффективность (0.5). Дальнейшее накопление продукта было оценено как процентное усиление сигнала Сy5 в оставшейся части реакции (в данном случае это 100%). Общее накопление продукта на линейной фазе, таким образом, составляло 275 фмоль/мкл (50×11×0.5×1.0), а общая концентрация продукта, включая 50 фмоль/мкл двухцепочечного ампликона, оценивается в 325 фмоль/мкл. Чтобы получить 100 фмоль реакционной смеси для циклического секвенирования, разбавили продукт реакции водой в отношении 1:13 и ввели 4 мкл разбавленного продукта в 25 мкл реакционной смеси.
Результаты
Существуют четыре возможные комбинации: 1) HV1-H с HV2-H, 2) HV1-L с HV2-L, 3) HV1-H с HV2-L, 4) HV1-L с HV2-H. На Фиг.18 показан 4% агарозный гель из электрофореза с контролями без темплата (NTC), три левые дорожки; ампликоны реакций, начавшихся со 100 копий геномной ДНК, следующие три дорожки; и самая правая дорожка соответствует иерархии из 100 пар оснований. На Фиг.18 показано образование ампликонов дцДНК HV1-H и HV2-H для 549 и 464 пар оснований с использованием 100 копий геномной ДНК в начале реакции. Контроль без темплата, NTC, не амплифицировался.
Компетентному в данной области специалисту понятно, что при амплификации двух одноцепочечных ампликонов в одной реакции из одного темплата, могут быть получены две цепочки избыточного праймера - из той же цепочки ДНК или из комплементарной цепочки. Оба подхода успешно реализованы. В комбинации HV1-H с HV2-H и HV1-Lc HV2-L оба ампликона генерируются из одной цепи темплата ДНК. В комбинации HV1-H с HV2-L и HV1-L c HV2-H два ампликона генерируются из комплементарных цепей ДНК. На Фиг.19А изображена информация о последовательности для ампликона HV1-H в дуплексе HV1-H с HV2-H в области оснований 16209-16169. На Фиг.19В приведена информация о последовательности для ампликона HV2-H в дуплексе HV1-H с HV2-H в области оснований 289-326. На Фиг.19С приведена информация о последовательности для ампликона HV1-H в дуплексе HV1-H с HV2-L в области оснований 16209-16169. На Фиг.19D приведена информация о последовательности для ампликона HV2-L в дуплексе HV1 -Н с HV2-L в области оснований 289-326. Полученные по способу ЛПЭ-ПЦР последовательности соответствуют данным о последовательности из базы GenBank.
Пример 12. Определение потребности в оцДНК
Чтобы определить количество оцДНК, требующееся для секвенирования "разбавь и вперед", можно использовать информацию о количестве генерируемых в ЛПЭ-ПЦР-амплификациях одноцепочечных и двухцепочечных ДНК. Амплификации ПЦР были выполнены на детекторе ABI Prism Sequence Detector 7700 (Applied Biosystems, Foster City, CA, U.S.A.). При этом был амплифицирован ампликон длиной 549 оснований, спроектированный как HV1-H в d-кольцевой области человеческой митохондриальной ДНК. Митохондриальную ДНК экстрагировали в условиях лизиса (как описано в работе Peirce et al. (2002) Biotechniques 32(5); 1106-1111, с добавлением 4 мкл DTT к 100 мкл лизирующей реакционной смеси) из человеческого волосяного стержня. Все амплификации представляют собой ЛПЭ-ПЦР-амплификации, с продуктом непосредственно провели обычное секвенирование.
Реакционные смеси для амплификации (Финальные концентрации)
Объем: 25 мкл
1× PCR буфер (Invitrogen, Carlsbad, CA, U.S.A.)
3 мМ MgCl2 (Invitrogen)
250 мкМ дНТФs (Promega)
1.0 мкМ зонда (только для ЛПЭ-ПЦР)
Краситель SYBR Green (FMC Bioproducts, Rockland ME, U.S.A), разведенный в 10 раз
1.25 единицы Platinum Taq ДНК полимеразы (Invitrogen)
1 мкл лизирующего раствора ДНК (эквивалентно ~10 геномам митохондриальной ДНК)
Праймеры: для ЛПЭ-ПЦР, 50 нМ ограниченного праймера и 1000 нМ избыточного праймера.
Последовательности олигонуклеотидов:
HV1H: Ограниченный праймер, избыточный праймер и зонд, как в примере 11.
Реакционная смесь для циклов секвенирования
Как в примере 11
Обычное секвенирование
Как в примере 11
ЛПЭ-ПЦР-амплификация и осуществление секвенирования
Как в примере 11. Чтобы определить количество продукта, доступного для секвенирования, использовали "сырые" данные флуоресценции как Сy5, так и SYBR Green. Отношение Cy5/SYBR Green позволило нормализовать все флуктуации "сырых" данных.
Результаты
Данные флуоресценции ЛПЭ-ПЦР-амплификаций представлены на Фиг.20, панели А и В. Например, на Фиг.20А все полученные для волосяного стержня данные изображены в зависимости от номера цикла амплификации в виде отношения оц-ДНК/дц-ДН К (сигнала зонда к сигналу красителя). Этот способ анализа минимизирует отклонения, вызванные началом экспоненциальной фазы амплификации или ее выходом на плато, а также демонстрирует, что эффективность амплификации оцДНК практически одинакова для всех образцов кроме того, для которого она началась слишком поздно.
На Фиг.20В приведен метод мониторинга хода ЛПЭ-ПЦР-анализа, чтобы выяснить его готовность к секвенированию "разбавь и вперед". График содержит вычисленные отношения оцДНК/дцДНК (сигнал зонда к сигналу красителя по сравнению с сигналом красителя) для всех амплифицированных образцов и цикла 45 (квадратики) и 65 (ромбики). Для секвенирования готовы только образцы со значением отношения между 0.06 и 0.10 и значением SYBR между 300 и 600 (значения "в коробке"). На Фиг.20В количественный анализ по конечным результатам (QE ЛПЭ-ПЦР) используется, чтобы показать, что через 65 циклов все образцы, кроме одного, накопили достаточно оцДНКдля использования в секвенировании "разбавь и вперед".
Пример 13. Ампликоны с несколькими SNP
Чувствительность способов ЛПЭ-ПЦР и "разбавь и вперед" позволяет различить смеси ампликонов с несколькими SNP до уровня разрешения 10%. Амплификации ПЦР выполнены для 2 мм волосяного стержня или отпечатка большого пальца человека на стеклянной пластине. Все амплификации представляли собой ЛПЭ-ПЦР-амплификации, и их продукт был непосредственно подвержен обычному секвенированию. Финальные амплификационные реакционные смеси, последовательности олигонуклеотидов (HV1-H), реакционная смесь для циклов секвенирования, обычное секвенирование, а также ЛПЭ-ПЦР-амплификация и приготовления для секвенирования все совпадали с изложенными в примере 11.
Смеси одноцепочечных продуктов ЛПЭ-ПЦР каждой из трех реакций в соотношении от 10:90 до 90:10 были секвенированы по описанному ранее протоколу "разбавь и вперед". Результаты приведены на фигурах 21 и 22.
На Фиг.21 показан сегмент длиной 10 оснований, окружающий основания 16320 и 16311 смеси 50:50 лимфоцитов человеческой крови и отпечатка большого пальца человека. Максимальные высоты отражают фактические 100% высоты реакции обычного секвенирования, а не ожидаемые равные высоты в смеси 50:50. Строка 211 отражает пик для основания G в этой последовательности, а строка 202 соответствует пику основания А в том же положении последовательности. Пик 212 выше пика 211 в 50:50 смеси ДНК из лимфоцитов человеческой крови и человеческого волосяного стержня с различными генетическими последовательностями из-за флуорометрических характеристик секвенирования, как показано в анализе чистых последовательностей для того же участка.
На Фиг.22 показаны обоюдные проценты (90:10, 70:30, 50:50, 30:70 и 10:90) для двух образцов в каждой из пяти локализаций SNP. Образец 1 получен из волосяного стержня человека, а образец 2 - из отпечатка большого пальца другого человека. Высоты каждого пика в каждом положении были измерены на распечатках секвенирования и затем масштабированы по одному основанию (100% образец 1 или 100% образец 2 контроль). Строка 222 на Фиг.22 соответствует заданному (intended) проценту образца 1 в смеси, нанесенному на график относительно заданного процента образца 2 в смеси. Строка 221 - это линия, соответствующая фактическому сигналу, то есть, это наблюдаемый процент образца 1 в смеси, нанесенный на график относительно заданного процента образца 2 в смеси. Наблюдаемый процент для каждого заданного процента образца 2 представляет собой пять точек, по одной для каждого основания. Данные показывают, что для каждого процента наблюдается очень маленький разброс между различных оснований, но, кроме того, данные показывают, что строка 221 наблюдаемых значений не ложится на вершину строки предсказанных значений (строка 222), вероятно, потому что содержание в смеси образца 1 и образца 2 не строго одинаково.
Пример 14. Различение смесей
Чтобы различить образцы, содержащие 100% гетерозиготной геномной ДНК от образцов, содержащих 90% гетерозиготной ДНК и 10% гомозиготной геномной ДНК, причем изменения происходят только в одном нуклеотиде, для начала приготовили смесь ДНК, содержащую 90% гетерозиготной ДНК по SNP-сайту rs858521, локализованному в человеческой хромосоме 17 (аллели C/G), плюс 10% гомозиготной ДНК для того же SNP-сайта (аллели С/С). SNP-сайт представлен в базе данных NCBI dbSNP, доступной по адресу http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?DB=SNP. Эту смесь приготовили, смешивая необходимые концентрации соответствующих гомозиготных и гетерозиготных ДНК, предоставленных лабораторией Райда Университета Вашингтона в Сиэтле. Для целей смешивания концентрации каждой геномной ДНК были оценены на основании значений Ct флуоресценции SYBR, полученной в результате проведенного в реальном времени анализа ЛПЭ-ПЦР-образцов, подобного тому, который будет описан ниже. После приготовления смесей ДНК "запустили" повторяющиеся реакции ЛПЭ-ПЦР, содержащие либо 100% гетерозиготную ДНК, либо 90% гетерозиготную+10% гомозиготнуюДНК. Каждый ЛПЭ-ПЦР-образец содержал 1Х Platinum Taq Buffer (Invitrogen, Carlsbad, CA), 3 мМ MgCl2, 250 мкМ смеси дНТФ, 0.24Х SyberGold I (Invitrogen, Carlsbad, CA), 200 нМ реагента, предотвращающего неверный старт, который называют соединение Elixir 9-3iDD, 1.25 единиц Platinum Taq полимеразы (Invitrogen, Carlsbad, CA), 1 мкМ rs858521 избыточного праймера, 50 nM rs858521 ограниченного праймера, и 2.4 мкМ резонсенсного зонда по отношению к аллели rs858521 SNP G, а также 1800 геномных эквивалентов соответствующей геномной ДНК в окончательном объеме 25 мкл. Последовательность избыточного праймера rs858521 следующая:
5' CAATCCCTTGACCTGTTGTGGAGAGAA 3' (SEQ. ID. No. 29)
Последовательность ограниченного праймера rs858521 следующая:
5 ' TCCCCAGAGCCCAGCCGGTGTCATTTTC 3 '(SEQ. ID. No. 30)
Последовательность резонсенсного зонда по отношению к аллели rs858521 SNP G следующая:
5' [Cy5] CTTCAGCTCAAACAATA [Phos] (SEQ. ID. No. 31)
Последовательность реагента, не допускающего неверный старт, следующая:
5' Dabcyl-CGCTATAATGAAATTATAGCG-Dabcyl (SEQ. ID. No. 32).
Эти образцы подвергли амплификации в устройстве ABI 7700, профиль термического циклинга представлял собой один цикл в течение 3 минут при 95°С, а затем 45 циклов при 95°С по 10 секунд, при 66°С по 10 секунд и при 72°С по 20 секунд. В конце реакции смесь была расплавлена. Анализ осуществлялся в интервале от 95 до 25°С через 1 градус, при каждой температуре смесь инкубировали 1 минуту, регистрируя флуоресценцию на канале Cy5. Монотонные сигналы флуоресценции Cy5 без коррекции на базовую линию были экспортированы в компьютерную программу Excel. Первую производную флуоресцентных сигналов подсчитали, вычитая сигналы при одной температуре из сигналов при следующих температурах в ходе плавления. Результаты показаны на Фиг.23, панели А и В. Фиг.23А представляет собой график первой производной флуоресцентных сигналов от температуры, то есть, кривые плавления. Эти кривые сгладили с помощью функции скользящего среднего, доступной в Excel, устранив тем самым шум, связанный с термическими флуктуациями ABI 7700. На Фиг.23А показаны пики плавления, соответствующие связыванию зонда с соответствующей мишенью G-аллель при более высокой температуре и с несоответствующей мишенью С-аллель при более низкой температуре. Как видно из фигуры, 90% гетерозиготных+10% гомозиготных образцов, кружок 231, демонстрирует более низкий пик G-аллели и более высокий пик плавления С-аллели, относительно высот пиков плавления G- и С-аллелей в 100% гетерозиготных образцах, кружок 232. Эти различия соответствуют ожидаемой более высокой пропорции С-аллели в 90% гетерозиготном+10% гомозиготном образце (55% С аллели: 45% G аллели) по сравнению со 100% гетерозиготном образце (50% С аллели: 50% G аллели). Отношение высоты пика С аллели к высоте пика G-аллели показано на гистограмме фигуры 23В. Столбики справа соответствуют 90% гетерозиготным+10% гомозиготным образцам, соответствующим кружку 231. Более темные столбики слева - это 100% гетерозиготные образцы. Ошибки 233 и 234 показаны и для столбиков, соответственно. Это отношение позволяет отличить 100% гетерозиготные образцы от смеси 90% гетерозиготных+10% гомозиготных образцов с вероятностью 99.7%, основываясь на неперекрывании областей с ошибками, отражающих три стандартных отклонения от среднего.
Пример 15. Чувствительность реакций ЛПЭ-ПЦР к начальной концентрации полимеразы
На приборе АВ17700 амплифицировали ампликон длиной 549 оснований, сконструированный как HV1-H, в d-кольцевом участке человеческой митохондриальной ДНК. Реакционные смеси для человеческой геномной ДНК, последовательности олигонуклеотидов (HV1-H) и ЛПЭ-ПЦР-амплификации приготовили в соответствии с описанием примера 11, за исключением того, что активность Platinum Taq ДНК полимеразы колебалась в зависимости от образца следующим образом: 0.125, 0.250, 0.375, 0.50, 0.625 и 1.25 единиц.
Был выполнен анализ кривых плавления (флуоресценция SYBR green от температуры). Кривые плавления показывали, как концентрация Taq влияла на специфичность продукта дцДНК для этой реакции ЛПЭ-ПЦР. В случае Platinum Taq при снижении концентрации с 1.25 до 0.375 единиц специфичность реакции возрастала, что отразилось на пиках плавления повторов. Дальнейшее понижение концентрации до 0.250 единиц, уменьшало специфичность. При 0.125 единиц реакция не протекала. Максимальная специфичность наблюдалась при концентрации Taq 0.375 единиц.
Пример 16. Вариация наклона как функция концентрации Taq для ЛПЭ-ПЦР-анализа и Duplex ЛПЭ-ПЦР в режиме реального времени
Мы спроектировали дуплексный ЛПЭ-ПЦР-анализ в режиме реального времени для одновременного анализа последовательностей из экзонов мышиных генов Oct4 и Xist (номера доступа GenBank NM 013633 и L04961, соответственно). Каждая реакция протекала в финальном объеме 50 мкл и содержала следующие реагенты: 1 Х PCR буфер (Invitrogen, Carlsbad, CA), включающий 20 мМ Tris-HCl, pH 8.4, и 50 мМ KCl, 3 мМ MgCl2, 0.4 мМ каждого дНТФ, 50 нМ ограниченного праймера для Oct4 с последовательностью 5 ' TGGCTGGACACCTGGCTTCAGACT 3 ' (SEQ ID No: 33), 2 мкМ избыточного праймера для Oct4 с последовательностью 5' CAACTTGGGGGACTAGGC 3' (SEQ ID No: 34), 100 нМ ограниченного праймера для Xist с последовательностью 5' GGTCGTACAGGAAAAGATGGCGGCTCAA3' (SEQ ID No: 35), 2 мкМ избыточного праймера для Xist с последовательностью 5' TGAAAGAAACCACTAGAGGGCA 3' (SEQ ID No:36), 1 мкмкМ молекулярного сигнального зонда для Oct4 с низкой температурой плавления и с последовательностью 5' TET-CCG CCT GGG ATG GCA TAC TGT GGA AGG CGG-Dabcyl 3' (SEQ ID No: 37) и 300 нМ реагента для предотвращения неверного старта (мы называем его соединением 9-3bDD) с последовательностью 5'Dabcyl-CGTTATAATGAAATTATAACG-Dabcyl 3' (SEQ. ID. No. 38). В смесь для ПЦР включили также связанную в комплекс с антителом Platinum® Taq ДНК полимеразу (Invitrogen, Carlsbad, CA) в концентрации 1, 2 или 3 единицы на анализ). В этом примере не использовался молекулярный сигнальный зонд для детекции ампликонов Xist.
Параллельно с этими дуплексными ЛПЭ-ПЦР-анализами запустили также серию анализов ЛПЭ-ПЦР-амплификации для одного только ампликона Oct4. Состав этих анализов совпадает с описанными выше дуплексами, за исключением того, что в них отсутствует ограниченный и избыточный праймеры Xist.
ДНК из мышиного генома (Sigma, St Louis, МО) добавлялась во все анализы и служила темплатом для амплификации ПЦР. Число добавляемых в каждую пробирку геномов было рассчитано как 1000 на основании размера 6 пг/геном (см. Vendrely and Vendrely (1949) Experientia 5: 327-329).
Все анализы повторялись дважды. Амплификация выполнялась на детекторе ABI Prism 7700 Sequence Detector (Applied Biosystems, CA) со следующим профилем термического циклинга: 1 цикл при 95 градусов в течение 5 минут, 6 циклов при 95°С по 10 секунд, при 63°С по 10 секунд и при 72°С по 30 секунд; и затем 54 цикла при 95°С по 15 секунд, при 55°С по 25 секунд, при 72°С по 35 секунд и при 45°С по 30 секунд; флуоресценция регистрировалась при 45°С в канале ТЕТ.
Результаты эксперимента представлены на Фиг.24, на котором представлены флуоресцентные сигналы, генерируемые ампликонами Oct4, накапливающимися при гибридизации с молекулярным сигнальным зондом TET-Oct4. Если присутствует только одна пара праймеров, то повышение концентрации Taq-полимеразы с 1 (круг 241) до 2 (круг 242) или до 3 (круг 243) единиц на анализ делает наклон сигналов более крутым, что связано с возрастанием эффективности амплификации. Сигналы, описываемые кругами 242 и 243 (2 и 3 единицы на анализ, соответственно), были рассеяны, что может означать достижение максимальной эффективности, приблизительно, на этом уровне. Как и ожидалось, наклоны линий, генерируемых дуплексными реакциями (круги 244, 245 и 246), были во всех случаях меньше тех, что генерируются амплификацией одиночных ампликонов, поскольку Taq-полимераза используется здесь с в два раза большей скоростью. Как и в случае ЛПЭ-ПЦР с одним ампликоном, увеличение концентрации Taq в дуплексной реакции от 1 единицы на анализ (круг 244) до 2 (круг 245) или 3 (круг 246) единиц приводит к увеличению наклона. Начиная с 3 единиц на анализ (круг 246), дальнейшего увеличения первоначального наклона не наблюдалось, если сравнивать с начальным наклоном при 2 единицах на анализ (круг 245), что также наводит на мысль о достижении максимальной эффективности. Однако, образцы с 3 единицами на анализ (круг 246) быстро достигали плато, но наклон затем начинал уменьшаться, в отличие от использования 2 единиц на анализ (круг 245), что может говорить о неверном старте в присутствии максимальных исследованных концентраций Taq. Это не относится к образцу 243, также содержащему 3 единицы Taq на анализ, но только одну пару праймеров. Несмотря на большее количество доступной Taq полимеразы в анализах с одним ампликоном при сравнении с дуплексами (3 единицы используются для генерации только одного ампликона, а не двух ампликонов одновременно), неправильный старт возникает в дуплексах в большей степени из-за добавления праймеров Xist. Таким образом, чтобы добиться максимальной эффективности, но избежать неверного старта, концентрацию Taq-полимеразы необходимо оптимизировать с учетом количества и последовательностей праймеров, добавляемых в реакцию.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕАГЕНТ И СПОСОБ ПРЕДОТВРАЩЕНИЯ ПО МЕНЬШЕЙ МЕРЕ ОДНОГО ОШИБОЧНОГО СТАРТА В АМПЛИФИКАЦИИ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ, НАБОРЫ РЕАГЕНТОВ И ОЛИГОНУКЛЕОТИДОВ ДЛЯ ОСУЩЕСТВЛЕНИЯ АМПЛИФИКАЦИИ ПОСРЕДСТВОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2495046C2 |
| СПОСОБ ДЕТЕКЦИИ СПЕЦИФИЧЕСКИХ НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И НУКЛЕОТИДНЫХ ЗАМЕН С ПОМОЩЬЮ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ С ЭФФЕКТОМ ГАШЕНИЯ ФЛУОРЕСЦЕНЦИИ ЗОНДА ПРАЙМЕРОМ | 2010 |
|
RU2451086C1 |
| СПОСОБ АМПЛИФИКАЦИИ И ДЕТЕКЦИИ НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В РЕАКЦИОННОЙ СМЕСИ И ИСПОЛЬЗУЕМЫЙ В НЕМ НАБОР | 2009 |
|
RU2523589C2 |
| ПРАЙМЕРЫ ДЛЯ ВЫЯВЛЕНИЯ ВИДОВ MONILINIA LAXA, MONILINIA FRUTICOLA, MONILINIA FRUCTIGENA | 2019 |
|
RU2751248C2 |
| Способ анализа соматических мутаций в генах GNAQ и GNA11 с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2017 |
|
RU2674687C1 |
| Способ генотипирования гена TLR2 по полиморфизму rs5743708 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805861C1 |
| Способ выявления мутации p.L265P в гене MYD88 | 2020 |
|
RU2756909C1 |
| НУКЛЕИНОВО-КИСЛОТНЫЙ ЗОНД | 2014 |
|
RU2668154C2 |
| СПОСОБ ДИАГНОСТИКИ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ТРОМБОФИЛИИ | 2007 |
|
RU2352641C1 |
| Способ диагностики точечных мутаций в нативной ДНК с применением оксида графена | 2015 |
|
RU2614111C1 |










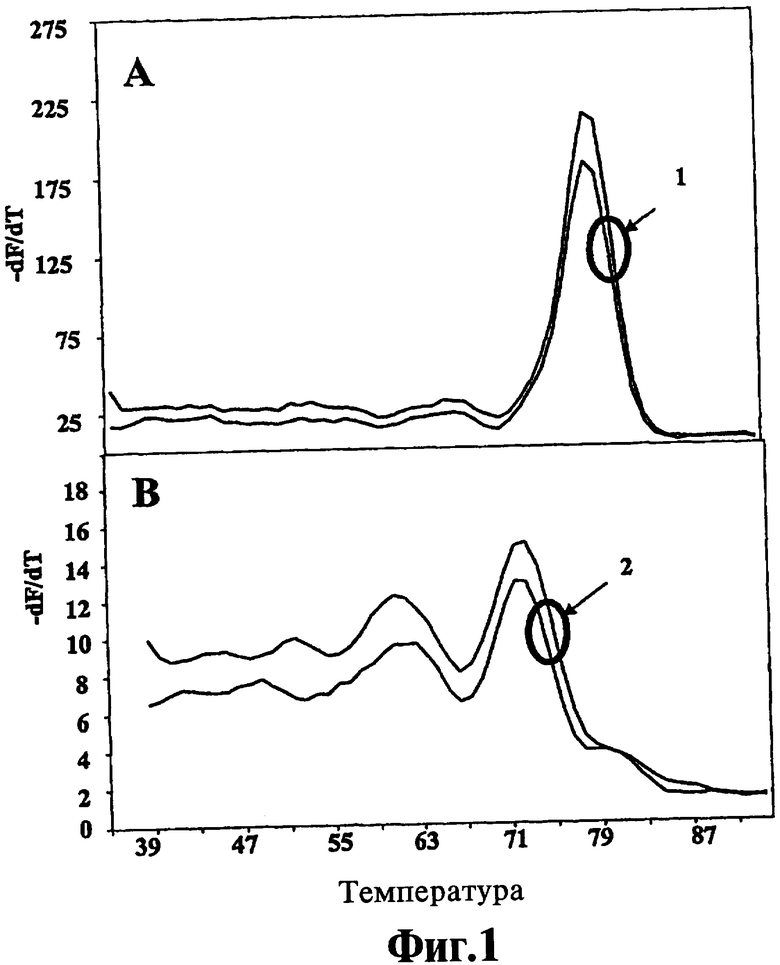

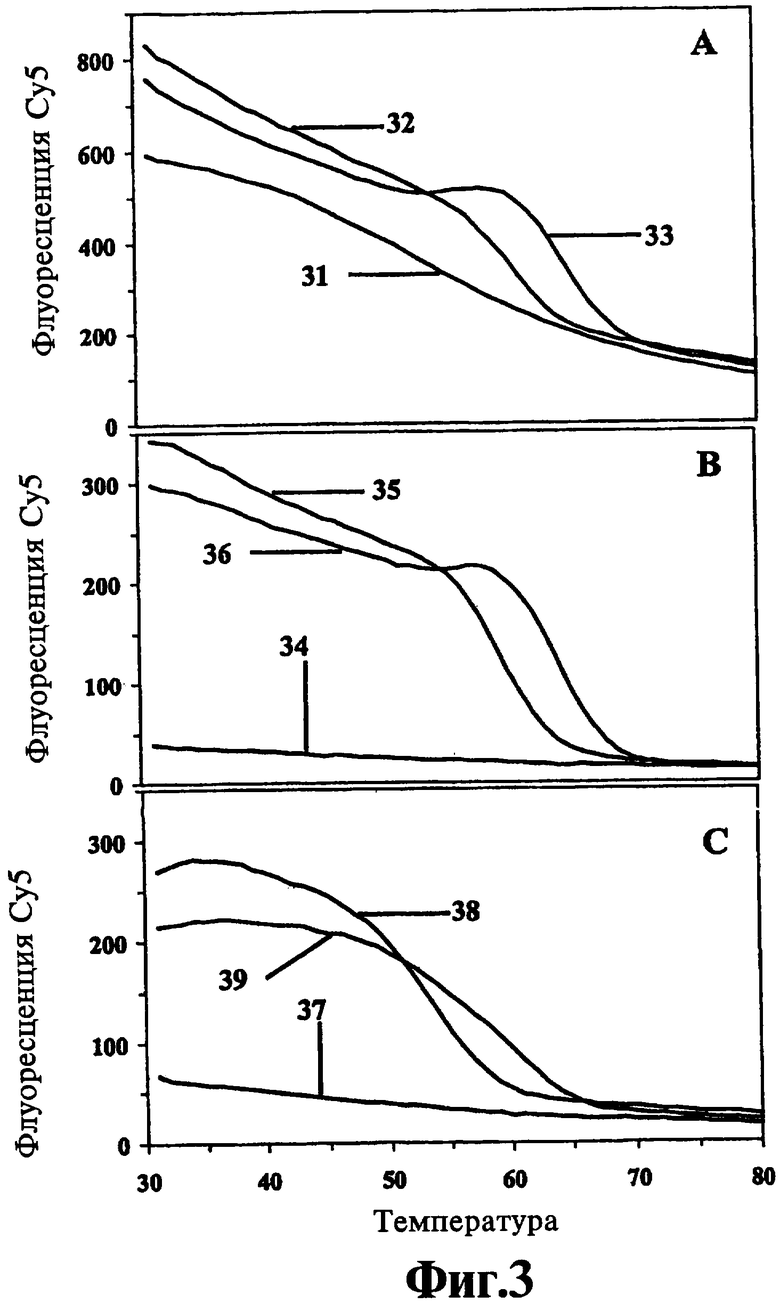
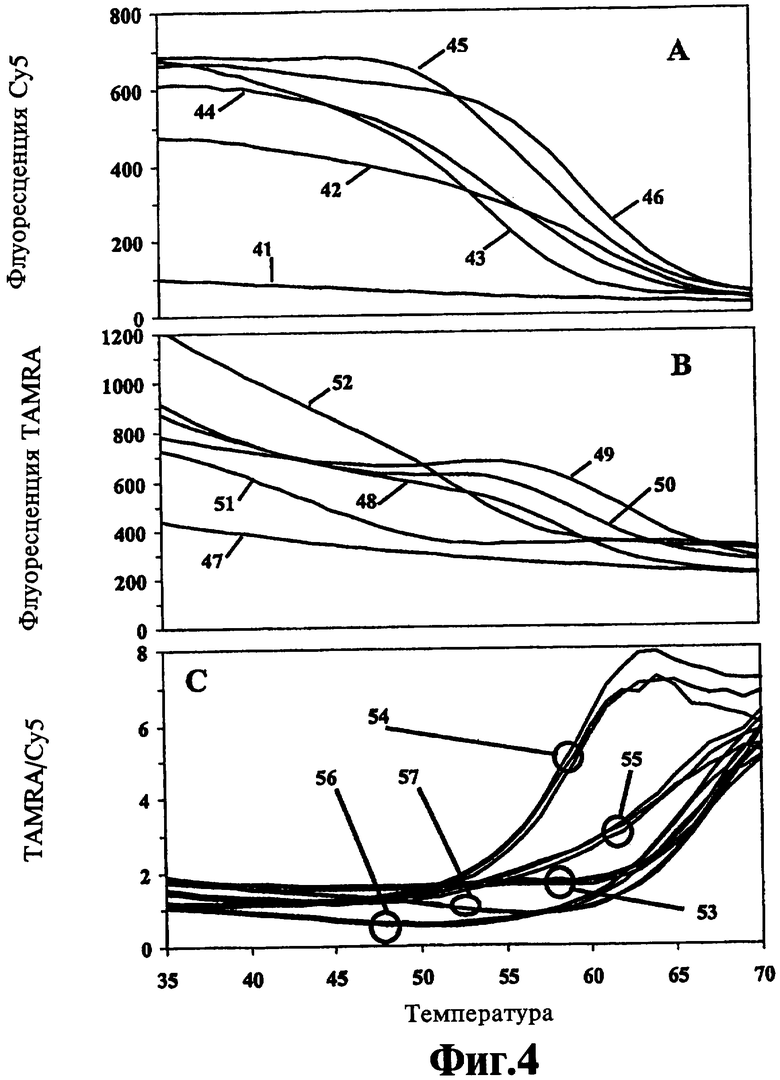
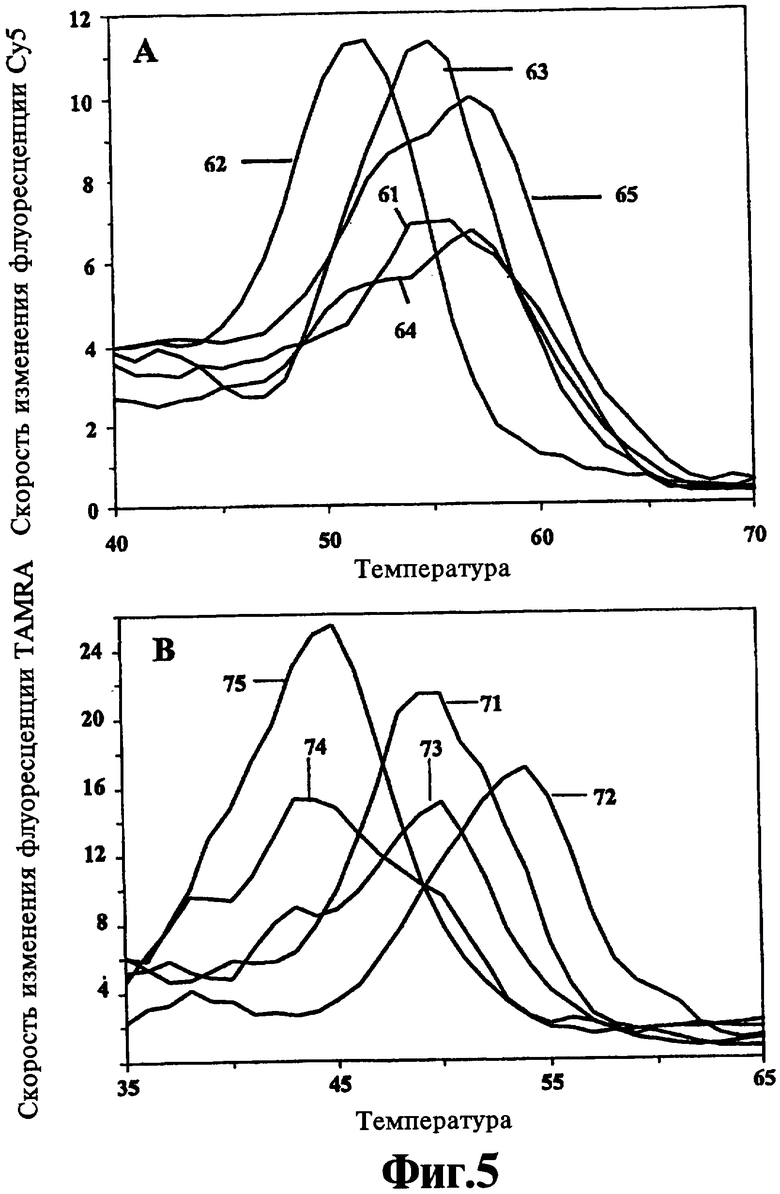
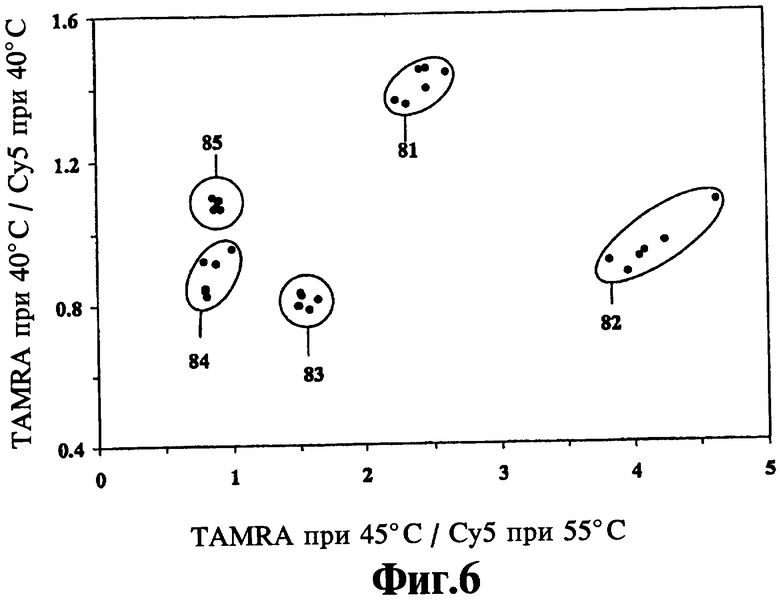
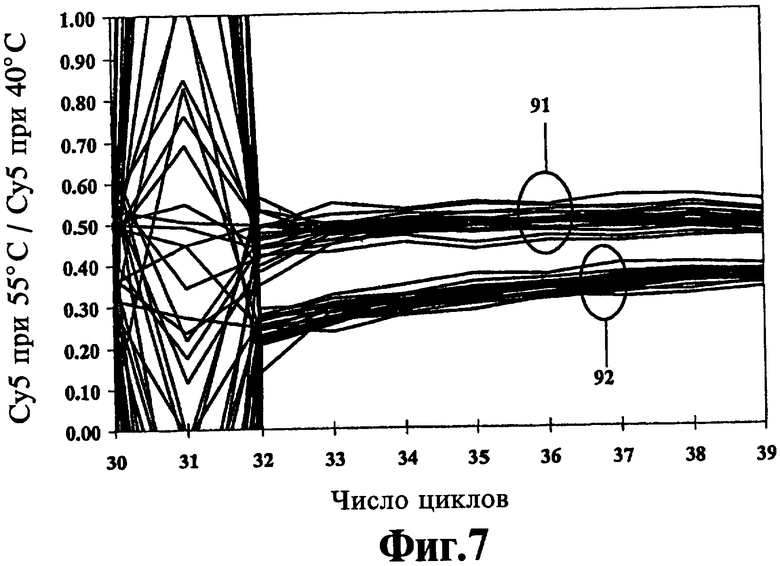
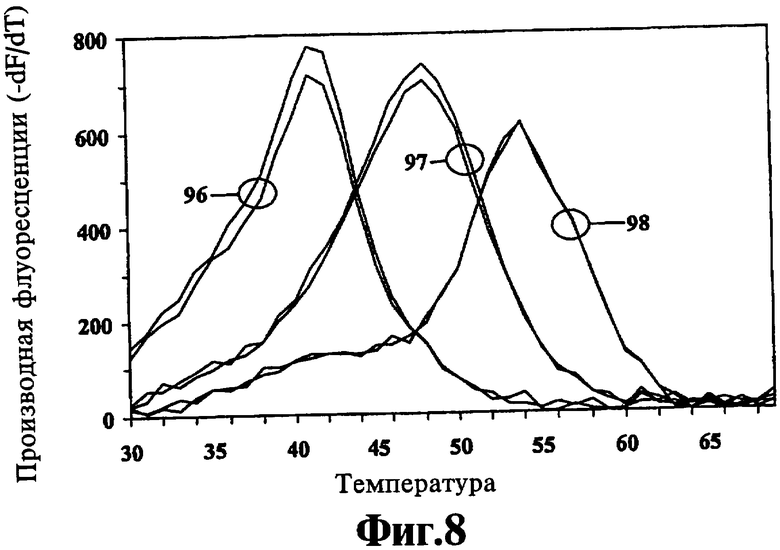

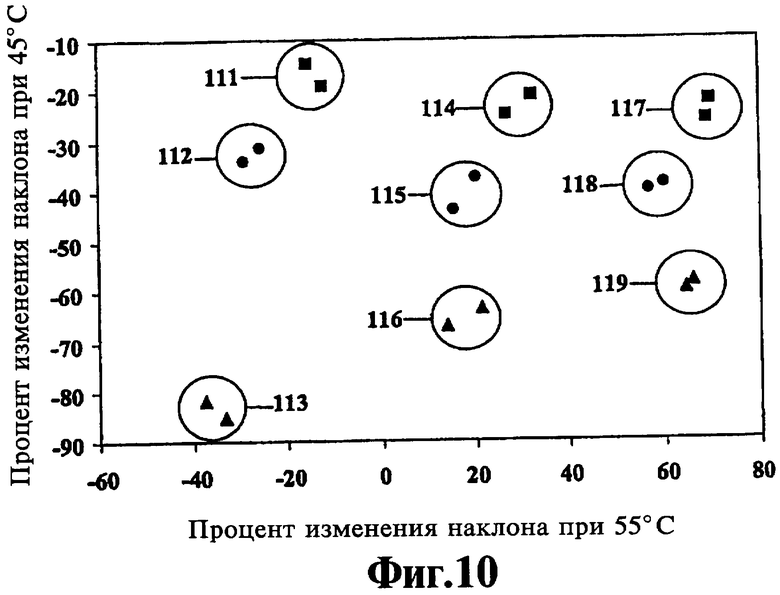
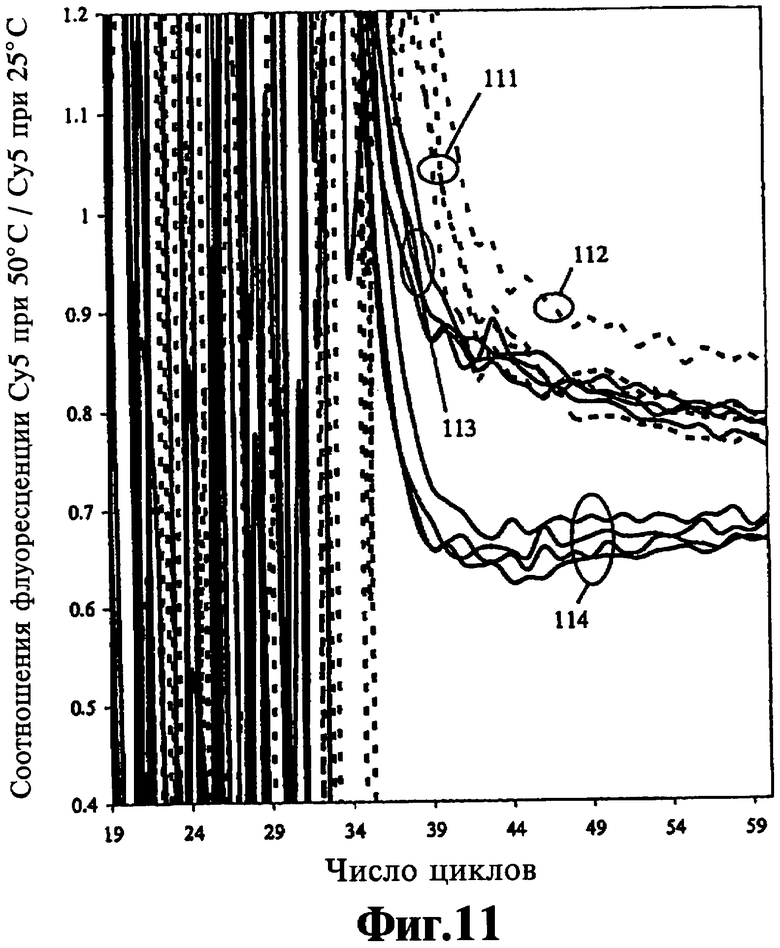

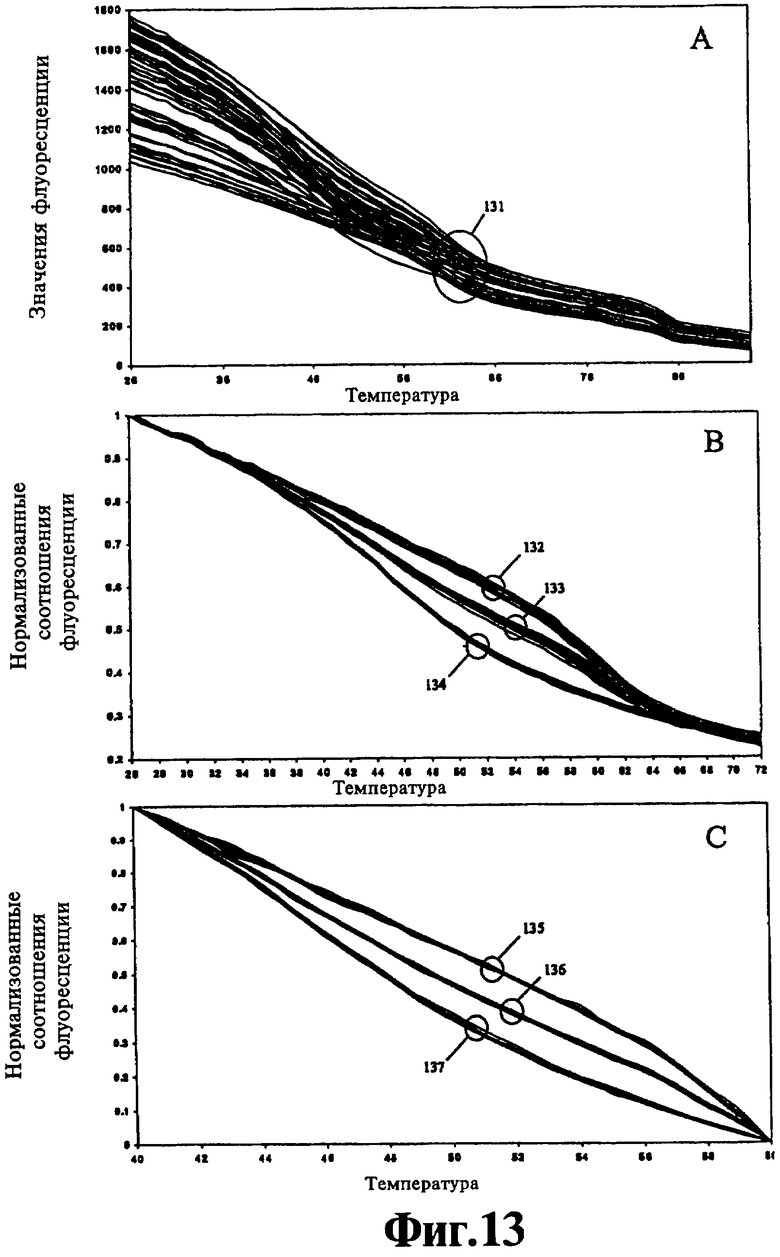
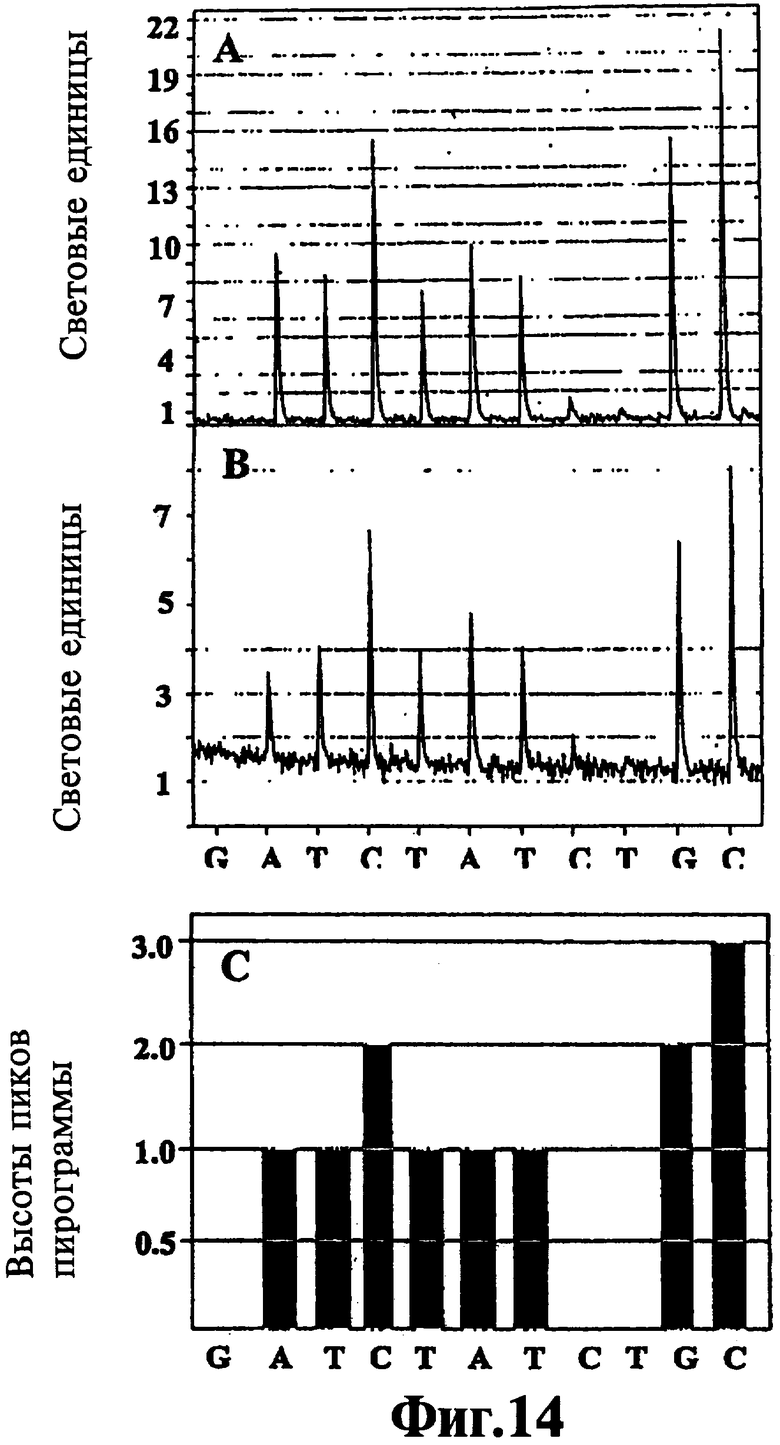
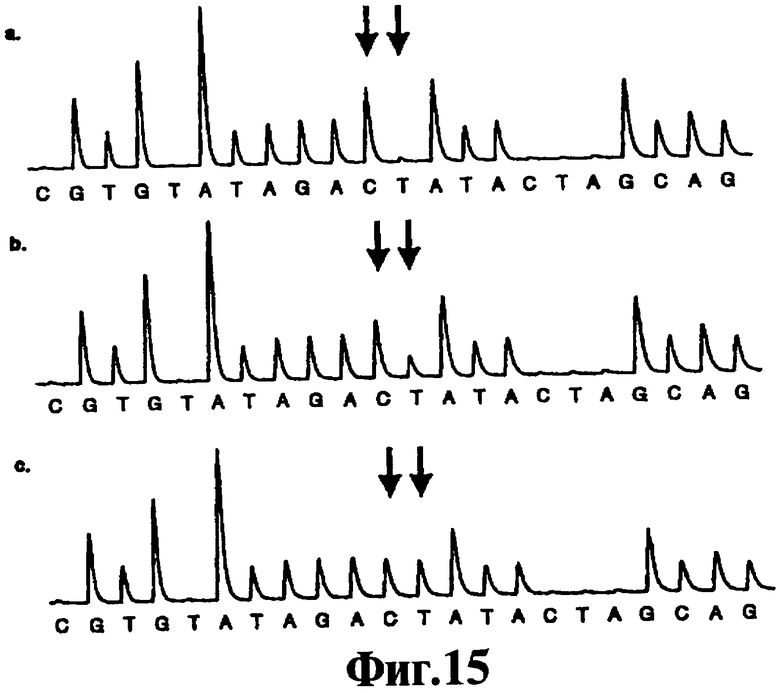

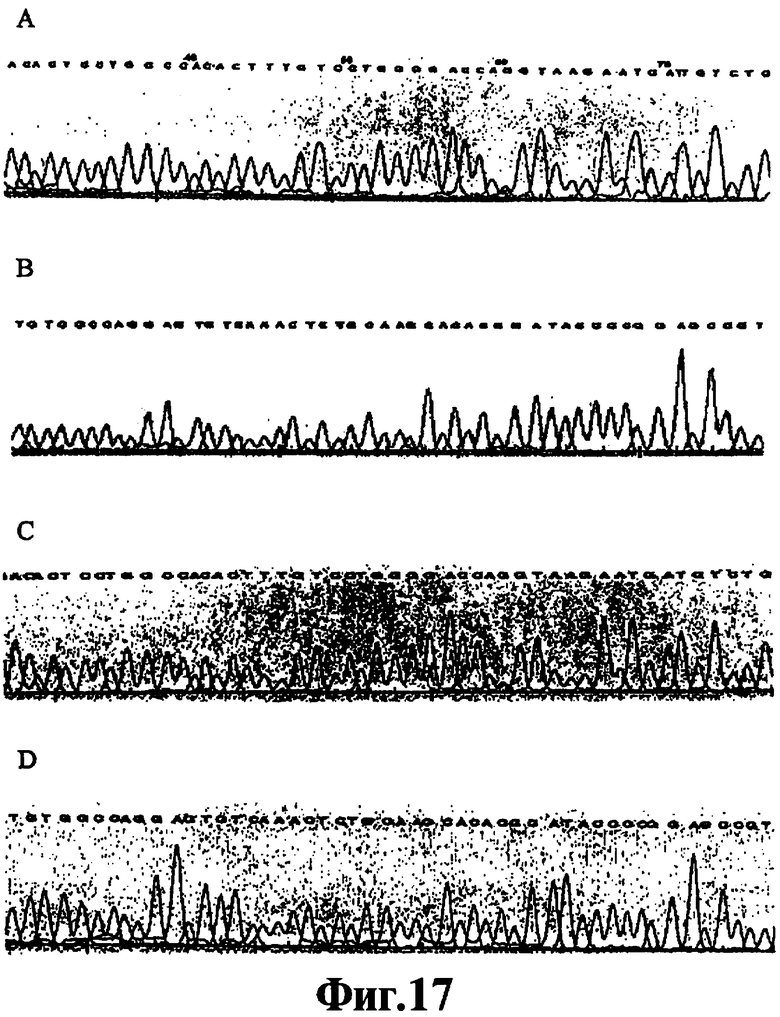
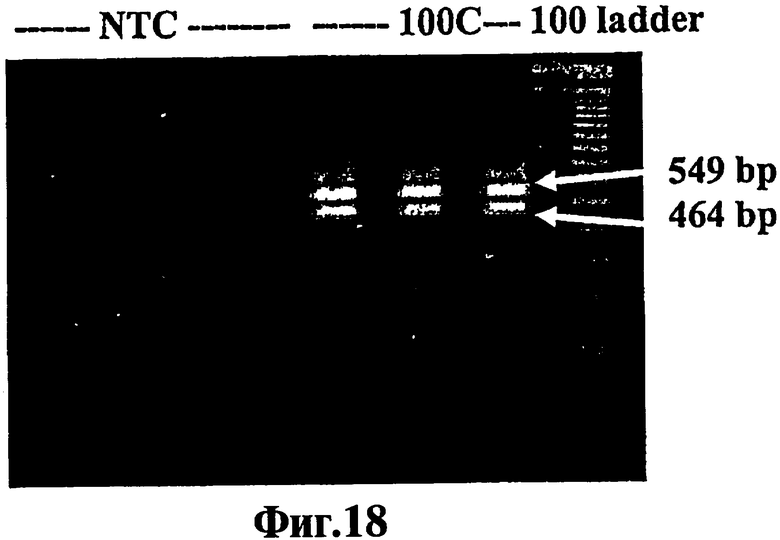
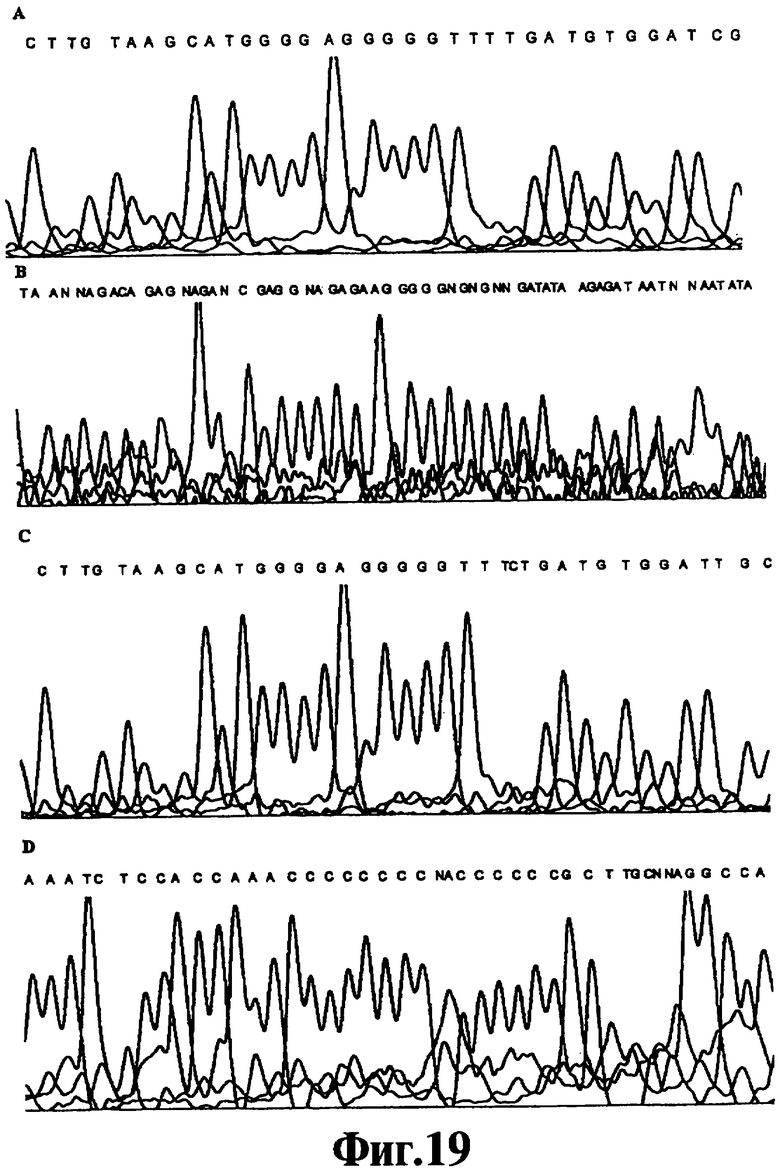
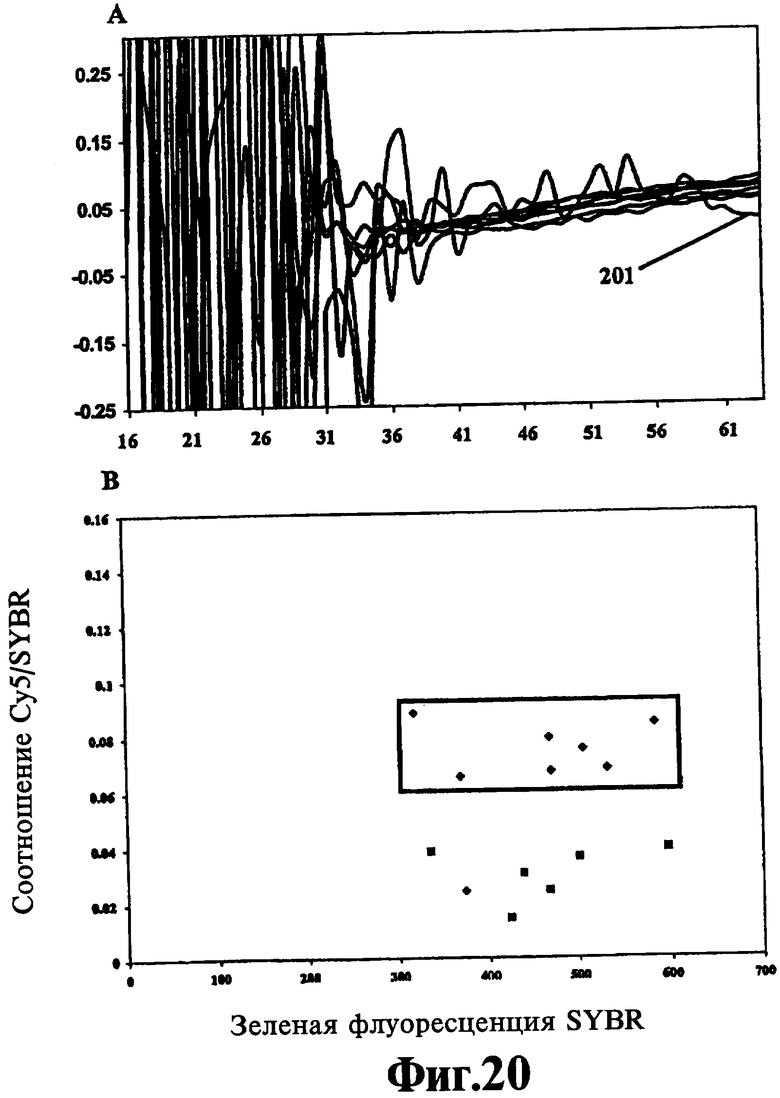
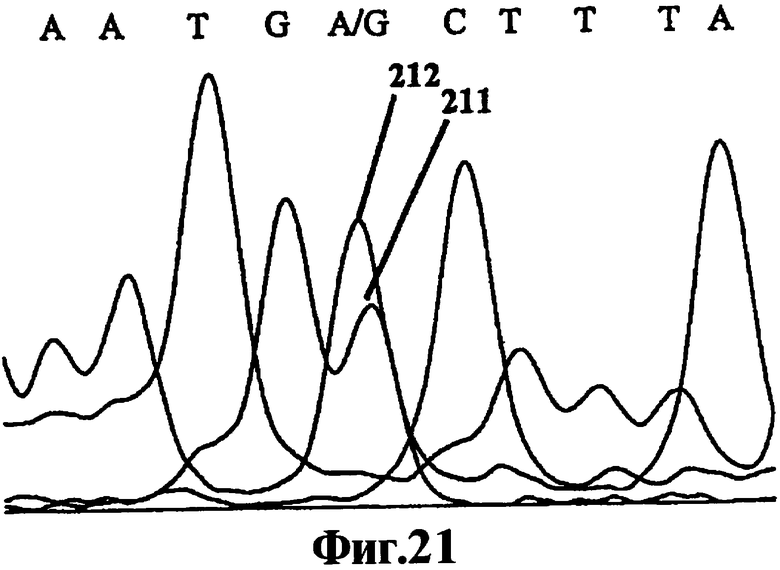

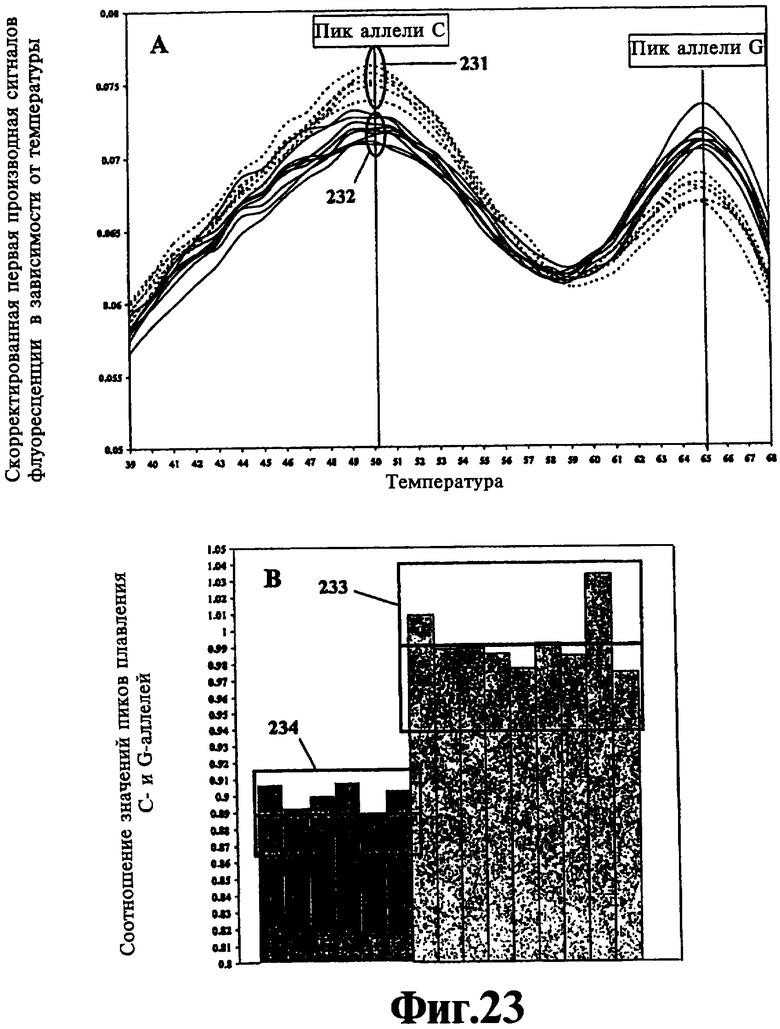
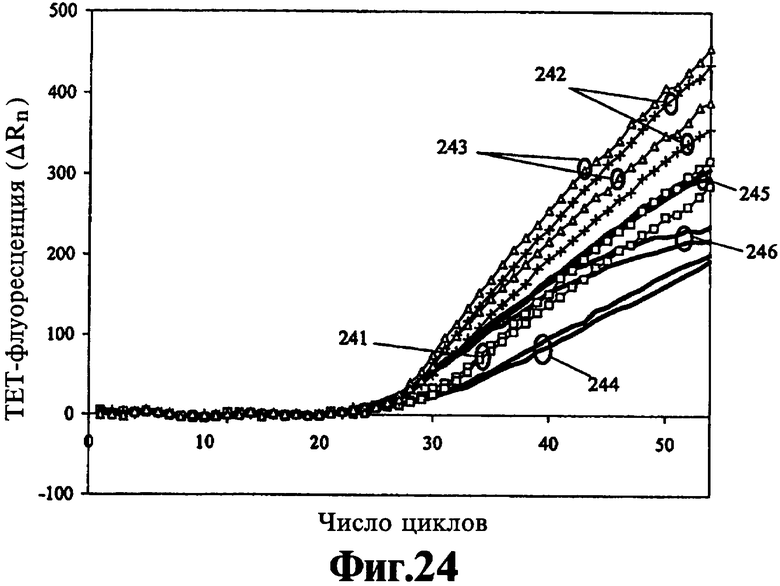
Изобретение относится к области биотехнологии, а именно к способу гомогенной детекции со сниженным разбросом данных по меньшей мере одного продукта одноцепочечной амплификации. Способ включает получение реакционной смеси амплификации, содержащей по меньшей мере одну последовательность-мишень из нуклеиновой кислоты, праймер указанной последовательности, гибридизационный зонд указанной последовательности, флуоресцентный краситель ДНК и реагенты, необходимые для амплификации. Проводят амплификацию указанной последовательности-мишени из нуклеиновой кислоты с помощью указанного процесса несимметричной амплификации нуклеиновых кислот с образованием одноцепочечных и двухцепочечных ампликонов. Затем двухцепочечные ампликоны детектируют посредством флуоресцентного красителя ДНК, а по меньшей мере один указанный одноцепочечный ампликон детектируют посредством меченного флуорофором гибридизационного зонда при температуре ниже температуры отжига праймера последовательности-мишени. После чего нормализуют специфичный для последовательности флуоресцентный сигнал в виде рассчитанного отношения флуоресценции указанного одноцепочечного продукта к флуоресценции указанных двухцепочечных ампликонов. Предложенное изобретение позволяет осуществить гомогенную детекцию со сниженным разбросом данных продукта одноцепочечной амплификации процесса несимметричной амплификации нуклеиновых кислот. 8 з.п. ф-лы, 24 ил., 16 пр.
1. Способ гомогенной детекции со сниженным разбросом данных по меньшей мере одного продукта одноцепочечной амплификации процесса несимметричной амплификации нуклеиновых кислот, характеризующийся тем, что получают реакционную смесь амплификации, содержащую по меньшей мере одну последовательность-мишень из нуклеиновой кислоты, праймер указанной последовательности, гибридизационный зонд указанной последовательности, флуоресцентный краситель ДНК и реагенты, необходимые для амплификации, проводят амплификацию указанной последовательности-мишени из нуклеиновой кислоты с помощью указанного процесса несимметричной амплификации нуклеиновых кислот с образованием одноцепочечных и двухцепочечных ампликонов, затем двухцепочечные ампликоны детектируют посредством флуоресцентного красителя ДНК, а по меньшей мере один указанный одноцепочечный ампликон детектируют посредством меченного флуорофором гибридизационного зонда при температуре ниже температуры отжига праймера последовательности-мишени, после чего нормализуют специфичный для последовательности флуоресцентный сигнал в виде рассчитанного отношения флуоресценции указанного одноцепочечного продукта к флуоресценции указанных двухцепочечных ампликонов.
2. Способ по п.1, в котором гибридизационный зонд для по меньшей мере одного указанного одноцепочечного ампликона представляет собой аллель-дискриминирующий погашенный двухцепочечный зонд.
3. Способ по п.1, в котором используют по меньшей мере два аллель-дискриминирующих зонда для различных одноцепочечных ампликонов, помеченных одним и тем же флуорофором, но характеризующихся различными температурами плавления по отношению к своим мишеням, при этом указанный этап детекции, который проводится при температуре ниже по меньшей мере одной температуры отжига праймера, включает в себя детекцию эмиссии указанного флуорофора при температуре, при которой только один зонд связывается со своей мишенью и при температуре, когда по меньшей мере два зонда связываются со своими соответствующими мишенями.
4. Способ по п.1, в котором используют по меньшей мере один толерантный к несоответствиям гибридизационный зонд, который связывают с, по меньшей мере, двумя возможными одноцепочечными ампликонами с формированием гибридов, характеризующихся различными температурами плавления ниже температуры, используемой для отжига праймеров в указанном процессе несимметричной амплификации, и который помечают флуорофором, который косвенно стимулируют при эмиссии флуоресценции из указанного флуоресцентного красителя ДНК, при этом детекцию одноцепочечного ампликона осуществляют в виде низкотемпературной детекции при нескольких температурах, определяемых указанными различными температурами плавления.
5. Способ по п.4, в котором указанный толерантный к несоответствиям гибридизационный зонд представляет собой линейный гибридизационный зонд, формирующий вторичную структуру, которая включает двухцепочечный участок длиной 1-4 нуклеотида, во время указанного этапа низкотемпературной детекции, где флуоресценция указанной вторичной структуры внутренне гасится.
6. Способ по п.4, в котором указанный толерантный к несоответствиям гибридизационный зонд представляет собой молекулярный сигнальный зонд.
7. Способ по п.4, в котором используют группу по-разному флуоресцентно меченых толерантных к несоответствиям гибридизационных зондов, температура плавления каждого из которых по отношению к любому ампликону ниже температуры отжига праймера, и которые совместно гибридизуют с большим количеством возможных ампликонов при различных температурах, и содержат флуорофоры, возбуждающиеся при эмиссии флуоресценции из указанного флуоресцентного красителя ДНК, при этом детекцию одноцепочечных ампликонов осуществляют при стимуляции указанной реакционной смеси амплификации при по меньшей мере трех температурах ниже указанной температуры отжига праймера светом, который возбуждает флуоресцентный краситель ДНК, но не флуорофоры указанных толерантных к несоответствиям зондов, и при детекции эмиссии из указанных зондов.
8. Способ по п.1, в котором процесс амплификации является линейной после экспоненциальной амплификацией полимеразной цепной реакции (ЛПЭ-ПЦР).
9. Способ по п.8, в котором указанная детекция представляет собой детекцию по методу конечной точки, осуществляемую после завершения процесса амплификации.
| SANCHEZ J.A | |||
| ЕТ AL, Linear-after-the-exponential (LATE)-PCR: an advanced method of asymmetric PCR and its uses in quantitative real-time analysis, Proc Natl Acad Sci USA, 2004, v.101, T.7, p.1933-1938, см.стp.1933-1934, 1936, 1938 | |||
| PIERCE K.E | |||
| ЕТ AL, Detection of cystic fibrosis alleles from single cells using molecular beacons and a novel method |
Авторы
Даты
2012-09-10—Публикация
2005-10-17—Подача