Изобретение относится к области молекулярной биологии, биотехнологии, генной инженерии и медицинской молекулярной диагностики, генодиагностики, а именно к выявлению специфических нуклеотидных последовательностей и нуклеотидных замен в известных последовательностях нуклеиновых кислот с использованием метода полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) с эффектом гашения флуоресценции зонда праймером. Изобретение может быть использовано для детекции специфических нуклеотидных последовательностей, нуклеотидных замен (полиморфизмов) в известных нуклеотидных последовательностях и других природных или инженерных генных мутаций в сложном генетическом окружении.
Известны различные способы детекции специфических нуклеотидных последовательностей и нуклеотидных замен в исследуемых последовательностях нуклеиновых кислот с использованием полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) с флуоресцентно-мечеными олигонуклеотидными зондами. Наиболее широко используется 5'-экзонуклеазный метод, основанный на эффекте пространственного разделения флуорофора и гасителя флуоресценции вследствие расщепления Taq ДНК-полимеразой зонда, связанного с амплифицируемой последовательностью ДНК (Heid, С.A., J.Stevens, К.J.Livak, and Р.М.Williams. 1996. Real time quantitative PCR. Genome Res. 6:986-994).
Основные недостатки этого способа:
1) Необходимость использования отдельных зондов для каждой детектируемой нуклеотидной последовательности (или нуклеотидной замены) и вытекающее из этого ограничение возможности одновременного обнаружения множества последовательностей (или вариантов одной последовательности) в одной реакции. При этом максимальное число одновременно определяемых последовательностей соответствует числу используемых флуоресцентно-меченых зондов, сигнал которых может быть разделен детектирующим устройством.
2) Невозможность выявления новых (неизвестных) нуклеотидных полиморфизмов в заданном участке последовательности.
Существуют альтернативные способы ПЦР-РВ, позволяющие частично преодолеть вышеуказанные ограничения благодаря использованию анализа кривых плавления зондов (Lyon, E. 2001. Mutation detection using fluorescent hybridization probes and melting curve analysis. Expert. Rev. Mol. Diagn. 1:92-101) после завершения амплификации. К их числу относятся: ПЦР-РВ с парными зондами с резонансным переносом энергии (FRET) (Cardullo, R.A., S.Agrawal, С.Flores, P.С.Zamecnik and D.E.Wolf. 1988. Detection of nucleic acid hybridization by nonradiative fluorescence resonance energy transfer. Proc. Natl. Acad. Sci. U.S.A 85:8790-8794. Didenko, V.V. 2001. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. Biotechniques 31:1106-1), ПЦР-РВ с резонансным переносом энергии между неспецифическим ДНК-связывающим флуорофором SYBR Green I и флуоресцентно-меченым зондом (iFRET) (Howell, W.M., M.Jobs, and A.J.Brookes. 2002. iFRET: an improved fluorescence system for DNA-melting analysis. Genome Res. 12:1401-1407), ПЦР-РВ с зондами, содержащими комплементарные концевые последовательности (Molecular Beacons) (Tyagi, S. and F.R.Kramer. 1996. Molecular beacons: probes that fluoresce upon hybridization. Nat. Biotechnol. 14:303-308), ПЦР-РВ с зондами, содержащими ДНК-лиганд и гаситель флуоресценции на 5'-конце и флуорофор на 3'-конце (MGB Eclipse) (Afonina, I.A., M.W.Reed, E.Lusby, I.G.Shishkina, and Y.S.Belousov. 2002. Minor groove binder-conjugated DNA probes for quantitative DNA detection by hybridization-triggered fluorescence. Biotechniques 32:940-949) и ПЦР-РВ с переносом энергии флуоресценции между донорным и акцепторным флуорофорами, расположенными на зонде и праймере (Lay, M.J. and С.Т.Wittwer. 1997. Real-time fluorescence genotyping of factor V Leiden during rapid-cycle PCR. Clin. Chem. 43:2262-2267. Wittwer, С.Т., Rasmussen, R.P., and Lay, M. Monitoring amplification with FRET probes. University of Utah Research Foundation, US. (US Patent 7160998). 09-01-2007). Во всех перечисленных случаях анализ кривых плавления предполагает использование зондов, флуоресценция которых отличается в свободном и связанном (с ДНК-мишенью) состоянии. Анализ осуществляется путем регистрации флуоресценции (F) при постепенном повышении температуры (Т) смеси, в которой находятся зонд и комплементарная ДНК. При связывании зонда с полностью комплементарной последовательностью образуется дуплекс с максимально высокой температурой плавления (Тm), тогда как связывание зонда с частично несовпадающей (мутантной) последовательностью приводит к образованию менее стабильного комплекса с более низкой Тm. Таким образом, анализ кривой флуоресценции зонда в зависимости от температуры реакционной смеси (dF/dT) позволяет определять значения Тm дуплексов и идентифицировать последовательности ДНК, как полностью комплементарные зонду, так и отличающиеся единичными нуклеотидными заменами. Возможно одновременное определение полностью комплементарной и мутантной последовательности (например, анализ гетерозиготности) с помощью одного зонда. Основным недостатком перечисленных выше подходов является сложность детекции определенных нуклеотидных замен в вариабельных последовательностях ДНК, где интересующие мутации находятся в окружении других (сателлитных) полиморфизмов. Использование всех перечисленных вариантов ПЦР-РВ является принципиально невозможным во всех случаях, когда минимальная длина зонда или его фрагмента, участвующего в связывании с ДНК мишенью, превышает расстояние между сателлитными полиморфизмами.
Наиболее близким аналогом изобретения можно считать вышеупомянутый способ ПЦР-РВ с переносом энергии флуоресценции между донорным и акцепторным флуорофорами, расположенными на зонде и праймере (Lay, M.J. and С.Т.Wittwer. 1997. Real-time fluorescence genotyping of factor V Leiden during rapid-cycle PCR. Clin. Chem. 43:2262-2267). В этом случае, так же как и в случае использования классических зондов FRET-типа (Didenko, V.V. 2001. DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. Biotechniques 31:1106-1), применяются пары флуоресцентных красителей (донорный и акцепторный), между которыми возможен резонансный перенос энергии флуоресценции (Forster. 1948. Zwischenmolekulare Energiewanderung und Fluoreszenz. Ann. Physik. 437:55). Принципиальными недостатками обоих способов являются следующие:
1) Возможность частичного расщепления зондов в ходе ПНР за счет 5'-экзонуклеазной активности ДНК-полимеразы.
2) Невозможность проведения мультиплексного анализа для одновременной детекции нескольких ДНК-последовательностей в одной реакции из-за ограниченного набора пар донорных и акцепторных красителей, отличающихся по спектрам флуоресценции.
Недостатки описанных подходов устраняются в настоящем изобретении. Исходя из сказанного выше задача настоящего изобретения состоит в повышении эффективности и расширении возможностей анализа специфических нуклеотидных последовательностей и нуклеотидных полиморфизмов с помощью метода ПЦР-РВ за счет применения нового подхода, основанного на эффекте гашения флуоресценции зонда праймером, несущим нефлуоресцирующий гаситель флуоресценции.
Сущность изобретения состоит в том, что способ детекции специфических нуклеотидных последовательностей и нуклеотидных замен с помощью ПЦР в режиме реального времени с эффектом гашения флуоресценции зонда праймером включает выделение нуклеиновых кислот из исследуемых образцов, подбор соответствующих олигонуклеотидных зондов и праймеров, ПЦР-амплификацию одного или более необходимых (целевых) участков нуклеотидной последовательности, анализ кривых плавления зондов после проведения ПЦР, при этом для амплификации каждого из целевых участков нуклеотидной последовательности используют соответствующую пару праймеров, один из которых, а именно реверсный праймер, служит для образования цепи ДНК, комплементарной зонду, и содержит нефлуоресцирующий гаситель флуоресценции внутри нуклеотидной последовательности, ближе к 3' концу, а для детекции целевой нуклеотидной последовательности, находящейся между участками связывания праймеров, используют соответствующий 3'-флуоресцентно-меченый олигонуклеотидный зонд, участок связывания которого с одной стороны частично перекрывается с областью связывания немеченого (форвардного) праймера, а с другой стороны находится на расстоянии нескольких нуклеотидов от 3'-конца праймера, несущего гаситель флуоресценции, таким образом, что связывание зонда с цепью ДНК, образованной в результате элонгации реверсного праймера, приводит к сближению флуорофора и гасителя на расстояние, достаточное для эффективного гашения флуоресценции за счет флуоресцентно-резонансного переноса энергии (FRET) или образования стабильных комплексов между флуорофором и гасителем (статическое или контактное гашение).
При этом имеется ряд вариантов осуществления предлагаемого способа.
Второй из них состоит в том, что детектируемые специфические нуклеотидные последовательности являются инвариантными, то есть не содержат нуклеотидных замен, делеций, инсерций и других генных мутаций.
Третий вариант состоит в том, что, в отличие от второго варианта, он является способом детекции нуклеотидных замен, делеций, инсерций и других точечных генетических полиморфизмов (в первой нуклеиновой кислоте по сравнению со второй нуклеиновой кислотой).
В четвертом варианте осуществления способа накопление продуктов ПЦР регистрируется по уменьшению исходного уровня флуоресценции зонда непосредственно в ходе амплификации.
В пятом варианте осуществления способа последовательности зонда и праймеров выбирают таким образом, чтобы Тm зонда была на 3-5°С выше Тm праймеров, а перекрывание последовательности зонда и немеченого праймера было минимальным, 1-3 нуклеотида.
В шестом варианте осуществления способа размер амплифицируемого участка нуклеотидной последовательности составляет 45-100 пн.
В седьмом варианте осуществления способа длина участка перекрывания последовательностей зонда и немеченого праймера составляет один или несколько нуклеотидов.
В восьмом варианте осуществления способа последовательности зонда и реверсного праймера, несущего гаситель, выбирают таким образом, что связывание зонда с ДНК-мишенью осуществляется на расстоянии 0-20 нуклеотидов между 3' концами зонда и праймера.
В девятом варианте осуществления способа участок целевой нуклеотидной последовательности, комплементарный участку зонда, не перекрывающемуся с немеченым форвардным праймером, содержит одну или несколько анализируемых нуклеотидных позиций.
Десятый вариант осуществления способа предполагает возможность связывания немеченого форвардного праймера с ДНК-мишенью непосредственно перед анализируемой нуклеотидной позицией, где могут присутствовать сателлитные полиморфизмы - несовпадающие нуклеотиды.
Одиннадцатый вариант осуществления способа предполагает возможность наличия сателлетных полиморфизмов: нуклеотидных замен, коротких делеций, инсерций в участке нуклеотидной последовательности между 3' концом зонда и 3' концом реверсного праймера.
Двенадцатый вариант осуществления способа состоит в том, что ПЦР в режиме реального времени является мультиплексной ПЦР в режиме реального времени.
Описанный выше дизайн ПЦР-РВ позволяет осуществлять идентификацию различных мутаций в области связывания зонда с помощью анализа кривых плавления после завершения амплификации. При полном соответствии последовательностей зонда и ДНК мишени Тm дуплекса является максимальной, а при наличии несовпадающих нуклеотидов - снижается в различной степени в зависимости от положения и характера мутации.
Описанный способ отличается от наиболее близкого аналога (Lay, M.J. and С.Т.Wittwer. 1997. Real-time fluorescence genotyping of factor V Leiden during rapid-cycle PCR. Clin. Chem. 43:2262-2267) по следующим ключевым признакам:
1) Для мечения праймера используются не акцепторные флуорофоры, а неизлучающие гасители флуоресценции, такие как: BHQ1 (Black Hole Quencher-1, λmaxabs=534 нм, рабочий диапазон гашения 480-580 нм), BHQ2 (Black Hole Quencher-2, λmaxabs=579 нм, рабочий диапазон гашения 560-670 нм), BHQ3 (Black Hole Quencher-3, λmaxabs=672 нм, рабочий диапазон гашения 620-730 нм), RTQ1 (Real Time Quencher-1, λmaxabs=520 нм, рабочий диапазон гашения 470-570 нм), RTQ2 (Real Time Quencher-2, λmaxabs=625 нм, рабочий диапазон гашения 580-670 нм) и другие «темновые» гасители (Dark quenchers). Преимущество гасителей серий BHQ и RTQ состоит в том, что, обладая сходными физическими свойствами, они имеют разные спектральные характеристики и, следовательно, могут быть использованы в сочетании с различными флуорофорами, в том числе и для мультиплексной детекции. Предпочтительными флуорофорами, которые могут комбинироваться с гасителями серий BHQ и RTQ, являются, например, ксантиновые красители, включая флуоресцеины, цианины, родамины (Cook, R.M., Lyttle, M., and Dick, D. Dark quenchers for donor-acceptor energy transfer. Biosearch Technologies, Inc. (US Patent 7109312). 19-9-2006. Haugland, R.P., M. T.Z.Spence, and I.D.Johnson. 1996. Handbook of Fluorescent Probes and Research Chemicals. Molecular Probes, Eugene, OR). Таким образом, предлагаемый нами способ обеспечивает широкие возможности выбора донорно-акцепторных пар (флуорофор-гаситель) и мультиплексного анализа (одновременной детекции нескольких ДНК-мишеней в одной реакции). Детекция продуктов амплификации осуществляется путем мониторинга флуоресценции красителя, связанного с зондом. О накоплении продуктов ПНР в ходе реакции амплификации можно судить по снижению уровня флуоресценции (если регистрация сигнала осуществляется при температуре ниже Тm дуплекса зонд-ДНК мишень). При проведении постамплификационного анализа кривых плавления диссоциация комплекса зонд-ДНК мишень сопровождается резким увеличением флуоресценции.
2) Используется частичное перекрывание областей связывания зонда и немеченого праймера, благодаря чему исключается возможность расщепления зонда полимеразой в процессе элонгации праймера, облегчается дизайн зондов для детекции мутаций в сложном генетическом окружении. Близкое расположение праймеров обеспечивает также высокую эффективность ПЦР.
Сущность изобретения поясняется чертежами.
На фиг.1. представлена общая схема взаимного расположения праймеров и зонда, где 1 - зонд, 2 - праймер, 3 - участок прерывания последовательностей, 4 - флуорофор, 5 - гаситель флуоресценции.
На фиг.2. представлено связывание зонда с комплементарной цепью ДНК.
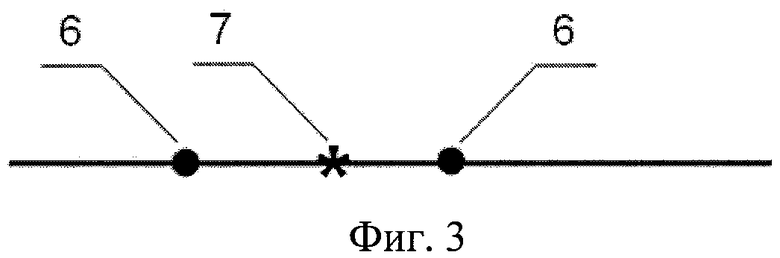
На фиг.3 представлена исходная последовательность, содержащая фланкирующие сателлитные полиморфизмы, где 6 - сателлитные полиморфизмы, 7 - анализируемая нуклеотидная позиция.
На фиг.4 изображено связывание праймера с исходной последовательностью.
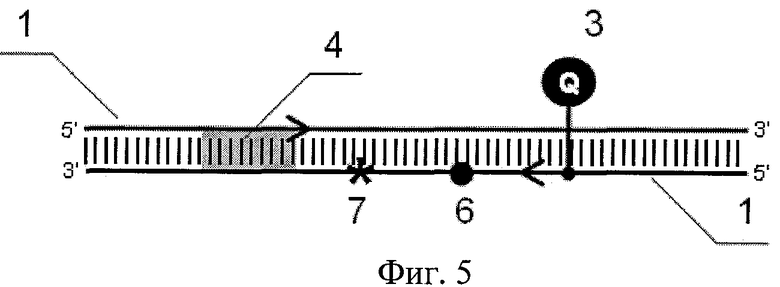
На фиг.5 представлен ПНР-продукт.
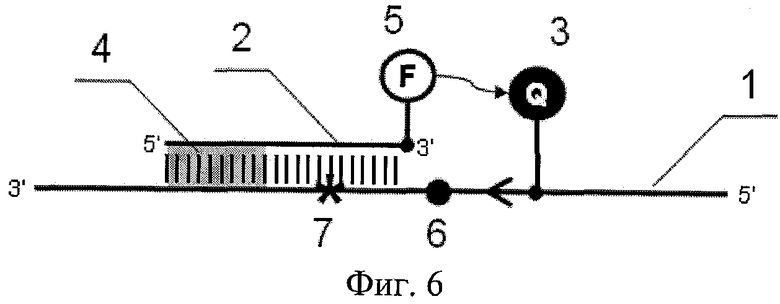
На фиг.6 показано связывание зонда.
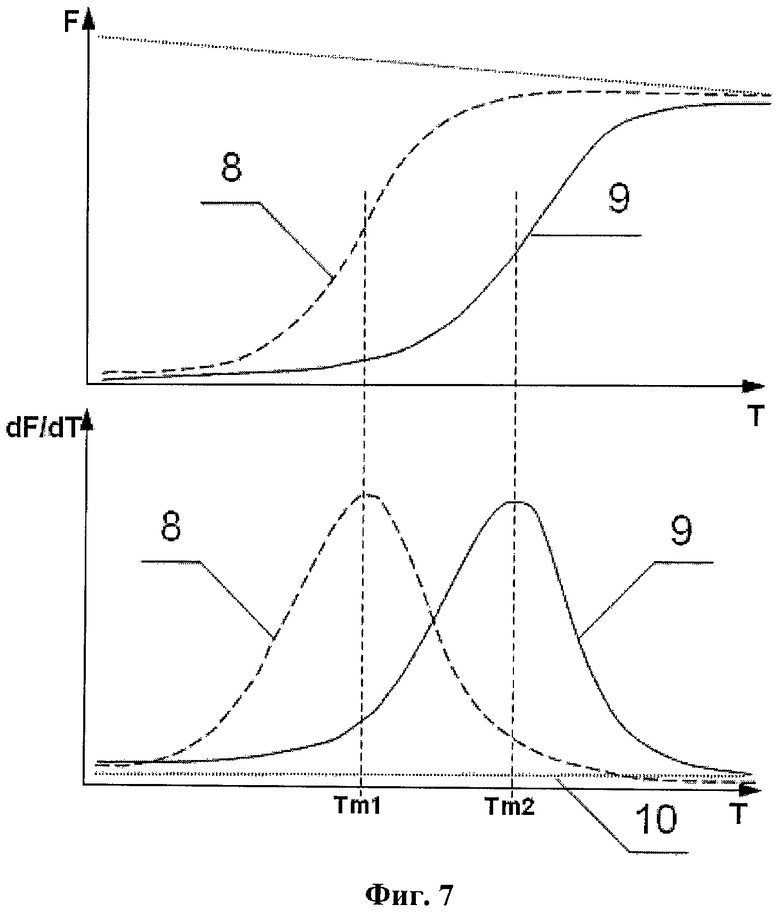
На фиг.7 представлен анализ кривых плавления в случае гашения флуоресценции зонда при связывании с комплементарной цепью ДНК, для ПНР-продукта, содержащего нуклеотидную замену, - 8, ПНР-продукта, полностью комплементарного зонду, - 9, и для орицательного образца при отсутствии ПЦР-продукта - 10, где F - флуоресценция, Т - температура, dF/dT - производная флуоресценции по температуре, Tm1 - температура плавления зонда при связывании с полностью комплементарной последовательностью, Tm2 - температура плавления зонда при связывании с мутантной последовательностью.
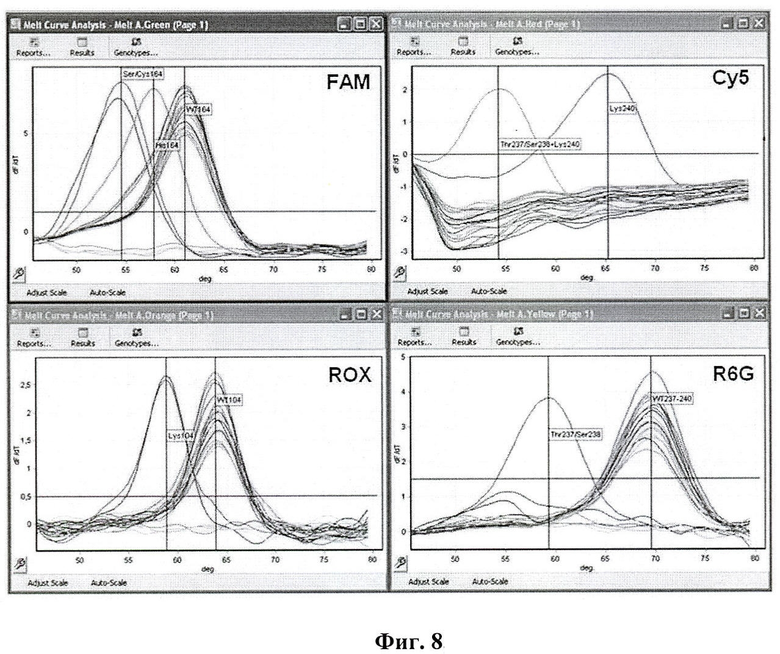
На фиг.8. представлен пример детекции мутаций: Glu104Lys, Arg164Cys/His/Ser, Ala237Thr, Gly238Ser и Glu240Lys, определяющих расширенный спектр активности ТЕМ β-лактамаз с помощью мультиплексной ПЦР-РВ с эффектом гашения флуоресценции зонда праймером и анализа кривых плавления, где FAM, ROX, Cy5, R6G - красители.
На фиг.9. представлен пример детекции мутаций: Ser83Phe, Asp87Gly/Tyr/Asn в QRDR GyrA, определяющих резистентность к хинолонам у Salmonella enterica с помощью ПЦР-РВ с эффектом гашения флуоресценции зонда праймером и анализа кривых плавления.
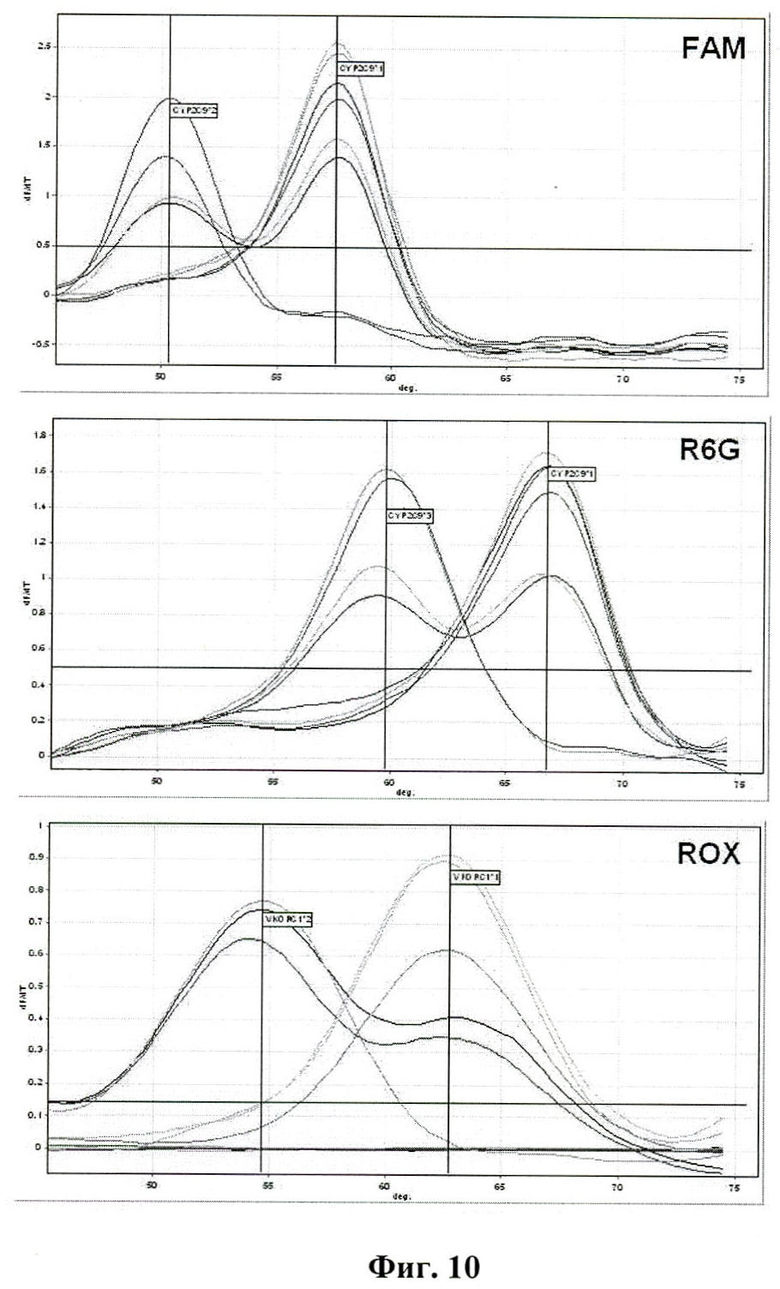
На фиг.10. представлен пример детекции аллельных вариантов VKORC1 и CYP2C9, ассоциированных с гиперчувствительностью к варфарину с помощью мультиплексной ПЦР-РВ с эффектом гашения флуоресценции зонда праймером и анализа кривых плавления.
Осуществление изобретения
Способ осуществляется следующим образом:
1) Осуществляют выбор последовательностей праймеров 1 (фиг.1, 2, 4, 5, 6) и зондов 2 (фиг.1, 2, 6) в соответствии со стандартными правилами, описанными в литературе (Peters, I.R., С.R.Helps, E.J.Hall, and M.J.Day. 2004. Real-time RT-PCR: considerations for efficient and sensitive assay design. J.Immunol.Methods 286:203-217) и с учетом следующих специфических требований:
а) вначале осуществляют выбор зонда 2, комплементарного анализируемой последовательности ДНК. Затем подбирают амплификационные праймеры 1 таким образом, чтобы 3' конец праймера 1, несущего гаситель флуоресценции 3 (фиг.1, 2, 5, 6), находился на расстоянии 0-10 нуклеотидов от участка связывания зонда, а 3' и 5' концы немеченого праймера и зонда частично перекрывались;
б) при необходимости регистрации процесса накопления ПЦР-продуктов непосредственно в ходе амплификации (например, для проведения количественного анализа ДНК-мишени в исследуемых образцах) рекомендуется выбирать последовательности зонда и праймеров таким образом, чтобы Тm зонда была на 3-5°С выше Тm праймеров, а перекрывание последовательности зонда и немеченого праймера 4 (фиг.1, 2, 4, 5, 6) было минимальным и составляло 1-3 нуклеотида;
в) при отсутствии необходимости регистрации накопления ПЦР-продуктов в ходе амплификации Тm зонда и праймеров могут быть приблизительно одинаковы и могут варьировать в широком диапазоне;
г) для выявления специфических нуклеотидных замен выбор цепи ДНК, комплементарной зонду, рекомендуется проводить таким образом, чтобы значения Тm зонда при связывании с полностью комплементарной и мутантной последовательностью отличались максимально.
2) Меченые олигонуклеотидные праймеры и зонды синтезируют путем химического присоединения флуорофора 5 (фиг.1, 2, 6) или гасителя к выбранной в соответствии с требованиями метода олигонуклеотидной последовательности. При создании зонда по данному изобретению флуоресцентная метка преимущественно присоединяется к 3'-концу олигонуклеотидной последовательности, хотя присоединение к внутренним сайтам также может быть использовано в некоторых конкретных случаях. При создании меченого праймера 4, в соответствии с данным изобретением, гаситель флуоресценции 3 присоединяется к внутренней позиции олигонуклеотидной цепи. Флуорофоры 5 (или гасители 3) вводятся в состав олигонуклеотидного зонда 2 (или праймера 1) преимущественно в виде производных амидитов. Альтернативно, флуорофоры 5 (или другие низкомолекулярные метки), содержащие реакционно-способные группировки (например, изотиоцианаты или активированные эфиры), могут вводиться с помощью реакции с реакционно-способной группировкой линкера, присоединенного к нуклеиновой кислоте (например, гексиламин). Кроме того, флуорофор 5 может быть прикреплен к 3'-концу олигонуклеотидной последовательности с использованием синтеза на модифицированном необходимыми реакционно-способными группировками (дериватизированном) твердом носителе (Cook, R.M., Lyttle, M., and Dick, D. Dark quenchers for donor-acceptor energy transfer. Biosearch Technologies, Inc. (US Patent 7109312). 19-9-2006).
3) Проводят выделение нуклеиновых кислот с использованием любых стандартных методов для последующего ПНР-анализа. Наличие в образцах потенциальных ингибиторов ПЦР оказывает минимальное влияние на результаты амплификации с помощью описанного подхода по сравнению с другими вариантами ПЦР-РВ вследствие небольшой длины ПНР-продуктов. При наличии в исследуемых образцах высокой исходной концентрации ДНК/РНК-мишени (>103-104 копий на реакцию) возможно использование методов быстрого лизиса клеток (с помощью повышенной температуры, щелочных и хаотропных реагентов и т.д.) без последующего удаления ингибиторов.
4) Проводят реакцию амплификации ДНК с помощью приборов для ПЦР в режиме реального времени. В реакции может использоваться эквимолярное соотношение праймеров 1, однако рекомендуется проведение ассиметричной ПЦР с соотношением немеченого и меченого праймеров 1: 1:2-1:10. Избыток праймера 1, несущего гаситель флуоресценции 3, способствует преимущественному накоплению в ходе ПЦР цепи ДНК, комплементарной зонду 2, что обеспечивает максимальную эффективность детекции. Рекомендуемые концентрации праймеров 1 в ПЦР смеси: 40-800 нМ; концентрация зонда 2: 80-400 нМ. В случае ассиметричной ПЦР количество циклов амплификации может быть увеличено по сравнению с обычной ПЦР. При проведении количественного ПЦР-анализа измерение уровня флуоресценции проводится на этапе отжига праймеров 1. Вследствие малой длины ПЦР-продуктов продолжительность этапов отжига и элонгации праймеров 1 может быть сокращена до нескольких секунд.
5) После завершения амплификации проводят анализ кривых плавления (фиг.3). Пространственное разделение флуорофора 5 и гасителя 3 в результате плавления комплекса зонд-ДНК-мишень приводит к увеличению флуоресценции. Идентификацию продуктов амплификации или выявление нуклеотидных замен в области связывания зонда осуществляют по значениям Тm, соответствующим пикам кривых плавления на графике dF/dT vs T.
Пример 1. Мультиплексная детекция мутаций в генах ТЕМ β-лактамаз, определяющих расширенный спектр устойчивости к β-лактамным антибиотикам у клинических штаммов семейства Enterobacteriaceae
β-Лактамазы ТЕМ-типа являются одними из наиболее распространенных ферментов, расщепляющих β-лактамные антибиотики и обуславливающих резистентность к ним грамотрицательных бактерий. Точечные мутации в генах blaTEM, соответствующие аминокислотным заменам Glul04→Lys, Arg164→Cys/His/Ser, Ala237→Thr, Gly238→Ser и Glu240→Lys, определяют расширенный спектр активности ТЕМ ферментов - способность гидролизовать все современные антибиотики группы цефалоспоринов.
Для детекции 7 нуклеотидных замен в формате мультиплексной ПЦР-РВ использованы три пары праймеров, фланкирующих участки мутаций в кодонах 104, 164, 237-240, три зонда, комплементарных исходной (немутантной) последовательности blaTEM-1 меченных, соответственно, FAM, R6G, ROX, и один зонд, комплементарный мутантному варианту Lys240, меченный Су5 (табл.1, на которой представлены олигонуклеотидные праймеры и зонды, использованные для детекции мутаций в генах ТЕМ β-лактамаз).
Состав ПЦР смеси общим объемом 25 мкл: праймеры и зонды в концентрации, указанной в таблице 1; 0,2 мМ дНТФ; 2 мМ MgCl2; 2,5 ед. Диа Так ДНК-полимеразы (ООО «ИнтерЛабСервис», Россия); 67 мМ Трис-НС1 (рН=8.3); 17 мМ (NH4)2SO4; 0,1% Твин-20; 0,12 мг/мл бычьего сывороточного альбумина (БСА); 8% глицерина и 5 мкл образца ДНК. Для обеспечения «горячего старта» ПЦР смесь праймеров, зондов и дНТФ вносили в реакционные пробирки отдельно, покрывали слоем легкоплавкого воска и после его застывания добавляли смеси остальных компонентов.
Выделение бактериальной ДНК: 2-3 колонии каждой культуры ресуспендировали в 100 мкл ТЕ буфера; инкубировали 20 мин при 99°С; центрифугировали 2 мин при 10000 g; 5 мкл надосадочной жидкости использовали в ПЦР.
Амплификацию и анализ кривых плавления проводили с помощью системы Rotor-Gene 2000 согласно следующему протоколу: начальная инкубация 15 мин при 80°С; денатурация 1 мин при 95°С; затем 40 циклов 15-сек денатурации при 95°С и 15-сек отжига-элонгации при 61°С c детекцией флуоресценции на каналах JOE и Су5; анализ кривых плавления с начальной инкубацией 2 мин при 45°С и последующим повышением температуры на 1°С каждые 10 сек до 80°С с постоянной детекцией флуоресценции на каналах FAM, JOE, ROX и Су5.
Идентификацию последовательностей blaTEM «дикого типа» и мутаций в кодонах 104, 164 и 237-240 проводили в соответствии с температурой плавления зондов (фиг.4). В качестве контролей использовали штаммы энтеробактерий с известной нуклеотидной последовательностью генов blaTEM, включая 5 культур с генами «дикого типа», отличающимися только спектром молчащих мутаций, и 14 культур с мутациями, соответствующими амнокислотным заменам Glu104→Lys, Arg164→Cys/His/Ser, Ala237→Thr, Gly238→Ser, Glu240→Lys. Метод использован также для скрининга перечисленных мутаций у 718 клинических штаммов энтеробактерий-возбудителей нозокомиальных инфекций.
Для контрольных образцов показана возможность детекции и дифференциации всех перечисленных выше мутаций в любых комбинациях с помощью мультиплексной ПЦР-РВ и анализа кривых плавления зондов. Различия в значениях Тm зондов при связывании с полностью комплементарными и мутантными последовательностями ДНК-мишени составили от 4 до 10°С (фиг.4). Продемонстрирована возможность выявления ключевых мутаций (например, мутаций в кодоне 164) независимо от наличия расположенных в непосредственной близости сателлитных полиморфизмов 6 (фиг.3) (фланкирующих мутаций в кодонах 160 и 165). При анализе клинических штаммов у 533 (74,2%) культур обнаружены последовательности blaTEM «дикого типа», у 1 (0,1%) штамма - замена G/A (Arg164His), наличие которой подтверждено секвенированием гена.
Пример 2. Анализ мутаций резистентности к хинолонам у Salmonella enterica
Фторированные хинолоны являются основными антимикробным препаратами для лечения инвазивных сальмонеллезов. Устойчивость сальмонелл к хинолонам связна с мутациями мишени, А субъединицы ДНК-гиразы (GyrA), в области аминокислотных остатков 83-87, которые участвуют в связывании хинолонов и формируют так называемый QRDR участок (Quinolone Resistance Determining Region).
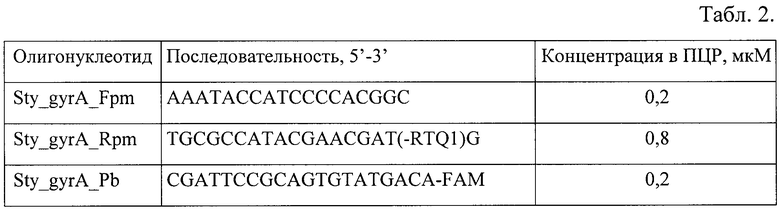
Метод ПЦР-РВ с эффектом гашения флуоресценции зонда праймером использован для одновременной детекции нуклеотидных замен, соответствующих наиболее частым мутациям: Ser83→Phe, Asp87→Gly/Tyr/Asn, вызывающим хинолон-резистентность. В реакции использована одна пара праймеров, фланкирующих QRDR участок gyrA, и один зонд, последовательность которого совпадает с немутантным вариантом QRDR (табл.2, на которой представлены олигонуклеотидные праймеры и зонд, использованные для детекции мутаций в QRDR gyrA).
Состав ПЦР смеси общим объемом 25 мкл: праймеры и зонды в концентрации, указанной в таблице 2; 0,2 мМ дНТФ; 2 мМ MgCl2; 2,5 ед. TaqF ДНК-полимеразы (ООО «ИнтерЛабСервис», Россия); 67 мМ Трис-НСl (рН=8.3); 17 мМ (NH4)2SO4; 0,1% Твин-20; 0,12 мг/мл бычьего сывороточного альбумина (БСА); 8% глицерина и 3 мкл образца ДНК.
Выделение бактериальной ДНК: 2-3 колонии каждой культуры ресуспендировали в 100 мкл ТЕ буфера; инкубировали 20 мин при 99°С; центрифугировали 2 мин при 10000 g; 3 мкл надосадочной жидкости использовали в ПЦР.
Амплификацию и анализ кривых плавления проводили с помощью системы Rotor-Gene 2000 согласно следующему протоколу: начальная денатурация 15 мин при 95°С; затем 45 циклов 15-сек денатурации при 95°С и 20-сек отжига-элонгации при 55°С c детекцией флуоресценции на канале FAM; анализ кривых плавления с начальной инкубацией 3 мин при 35°С и последующим повышением температуры на 1°С каждые 10 сек до 75°С c постоянной детекцией флуоресценции на канале FАМ.
Идентификацию мутаций проводили в соответствии с температурой плавления зонда: 59,2±0,05°С - для последовательности QRDR дикого типа, 53,8±0,14°С - для вариантов Gly83/Tyr83/Asn83 и 50,7±0,16°С - для Phe83 (фиг.5). В качестве контролей использовали штаммы S. enterica серотип Typhimurium с известными мутациями в QRDR gyrA. Метод применен для анализа структуры QRDR у 48 клинических штаммов сальмонелл, проявляющих чувствительность к хинолонам, и 32 изолятов, устойчивых к налидиксовой кислоте (минимальная подавляющая концентрация [МПК]≥128 мг/л). У чувствительных штаммов мутации в QRDR не выявлены; у 25 резистентных изолятов обнаружены мутации в позиции 87, у семи - замена Ser83→Phe. Результаты анализа подтверждены секвенированием участка gyrA в 100% случаев.
Пример 3. Выявление генетических маркеров гиперчувствительности к пероральным антикоагулянтам у людей
Пероральные антикоагулятные препараты группы кумаринов (варфарин) широко используются в клинической практике для профилактики артериальных и венозных тромбозов. Фармакокинетика и фармакодинамика варфарина крайне вариабельны и зависят от множества факторов, включая генетически детерминированные различия в скорости метаболизма под действием цитохрома Р450, кодируемого геном CYP2C9, и различия в уровне экспрессии гена VKORC1, кодирующего мишень варфарина - витамин К-эпоксидредуктазу. Аллельные варианты CYP2C9*2 (-485Т→А; -484С→А), CYP2C9*3 (42614A→C) и VKORC1*2 (6484С→T), ассоциированы с гиперчувствительностью к варфарину. Выявление данных генетических маркеров рекомендуется с целью снижения риска передозировки и развития кровотечений при терапии варфарином у всех пациентов.
Для детекции перечисленных полиморфизмов 6 в формате мультиплексной ПЦР-РВ использованы три пары праймеров, фланкирующих участки мутаций в нуклеотидных позициях -485/-484, 42614 CYP2C9 и 6484 VKORC1, и три зонда, комплементарных немутантным последовательностям CYP2C9*1 и VKORC1*1, меченных, соответственно, FAM, R6G и ROX (таблица 3, на которой представлены олигонуклеотидные праймеры и зонды, использованные для детекции аллельных вариантов VKORC1 и CYP2C9, ассоциированных с гиперчувствительностью к варфарину).
Состав ПЦР смеси общим объемом 25 мкл: праймеры и зонды в концентрации, указанной в таблице 3; 0,2 мМ дНТФ; 2 мМ MgCl2; 2,5 ед. TaqF ДНК-полимеразы (ООО «ИнтерЛабСервис», Россия); 67 мМ Трис-НСl (рН=8.3); 17 мМ (NH4)2SO4; 0,1% Твин-20; 0,12 мг/мл бычьего сывороточного альбумина (БСА); 8% глицерина и 5 мкл образца ДНК.
Выделение ДНК проводили из 100 мкл цельной крови с помощью коммерческих наборов ДНК-сорб-Б (OOO «ИнтерЛабСервис», Россия).
Амплификацию и анализ кривых плавления проводили с помощью системы Rotor-Gene 2000 согласно следующему протоколу: начальная денатурация 15 мин при 95°С; затем 55 циклов 15-сек денатурации при 95°С, 10-сек отжига при 58°С с детекцией флуоресценции на каналах FAM, JOE и ROX и 10-сек элонгации при 72°С; анализ кривых плавления с начальной инкубацией 3 мин при 45°С и последующим повышением температуры на 1°C каждые 10 сек до 80°С с постоянной детекцией флуоресценции на каналах FAM, JOE и ROX.
Идентификацию аллельных вариантов CYP2C9 и VKORC1 проводили в соответствии с температурой плавления зондов: CYP2C9*3-Pb3: 57,6±0,10°C для CYP2C9*1 и 50,3±0,11°С для CYP2C9*2; CYP2C9*2-Pb-485: 66,8±0,15°C для CYP2C9*1 и 59,7±0,21°С для CYP2C9*3; VKORC1*2-Pb: 62,6±0,23°C для VKORC1*1 и 54,4±0,29°С для VKORC1*2 (фиг.6). В качестве контролей использовали образцы ДНК лиц обоего пола с известными генотипами: CYP2C9*1*1, CYP2C9*2*2, CYP2C9*3*3, CYP2C9*1*2 и CYP2C9*1*3, VKORC1*1*1, VKORC1*2*2 и VKORC1*1*2. Метод также применен для выявления маркеров гиперчувствительности к варфарину у 42 пациентов, нуждающихся в приеме непрямых антикоагулянтов. Полиморфизмы 6 в генах CYP2C9 и VKORC1 обнаружены у 26 (62%) пациентов. У 6 (14%) пациентов выявлены генотипы, предполагающие гиперчувствительность к варфарину и необходимость снижения стартовой дозы препарата: CYP2C9*1*1/VKORC1*2*2 (n=2), CYP2C9*1*2/VKORC1*2*2 (n=2) и CYP2C9*1*3/VKORC1*2*2 (n=2).
Основным преимуществом разработанного способа является возможность выявления специфических нуклеотидных последовательностей или анализа определенных нуклеотидных позиций в сложном генетическом окружении. Дизайн олигонуклеотидного зонда для связывания с участком последовательности ДНК, содержащим сателлитные полиморфизмы 6 по обе стороны от интересующей нуклеотидной позиции, обычно является затруднительным. В предлагаемом способе связывание праймера непосредственно перед интересующей нуклеотидной позицией (в участке одного из сателлитных полиморфизмов 6) позволяет получить ПЦР-продукт с константной последовательностью на 5' конце. Это обеспечивает возможность выбора зонда необходимой длины, последовательность которого на 5'-конце перекрывается с последовательностью праймера, а на 3' конце - включает анализируемые нуклеотидные позиции 7 (фиг.6). Нуклеотидные замены, находящиеся вне области связывания зонда, не влияют существенно на Тm дуплекса зонд-ДНК мишень.




Изобретение относится к области биотехнологии, а именно к способу детекции специфических нуклеотидных последовательностей и нуклеотидных замен с помощью ПЦР в режиме реального времени. Способ включает выделение нуклеиновых кислот из исследуемых образцов, подбор соответствующих олигонуклеотидных зондов и праймеров и проведение ПЦР-амплификации целевой нуклеиновой кислоты. Выполняют анализ кривых плавления зондов. При этом для амплификации целевой нуклеиновой кислоты используют соответствующую пару праймеров, один из которых, а именно реверсный, служит для образования цепи ДНК, комплементарной зонду, и содержит нефлуоресцирующий гаситель флуоресценции внутри нуклеотидной последовательности, ближе к 3' концу. А для детекции участка целевой нуклеиновой кислоты, находящегося между участками связывания праймеров, используют соответствующий 3'-флуоресцентно-меченый олигонуклеотидный зонд, участок связывания которого с одной стороны частично перекрывается с областью связывания немеченого форвардного праймера, а с другой стороны находится на расстоянии нескольких нуклеотидов от 3'-конца праймера, несущего гаситель флуоресценции. Предложенное изобретение позволяет повысить эффективность анализа специфических нуклеотидных последовательностей и нуклеотидных замен с помощью ПЦР в режиме реального времени. 11 з.п. ф-лы, 10 ил., 3 табл., 3 пр.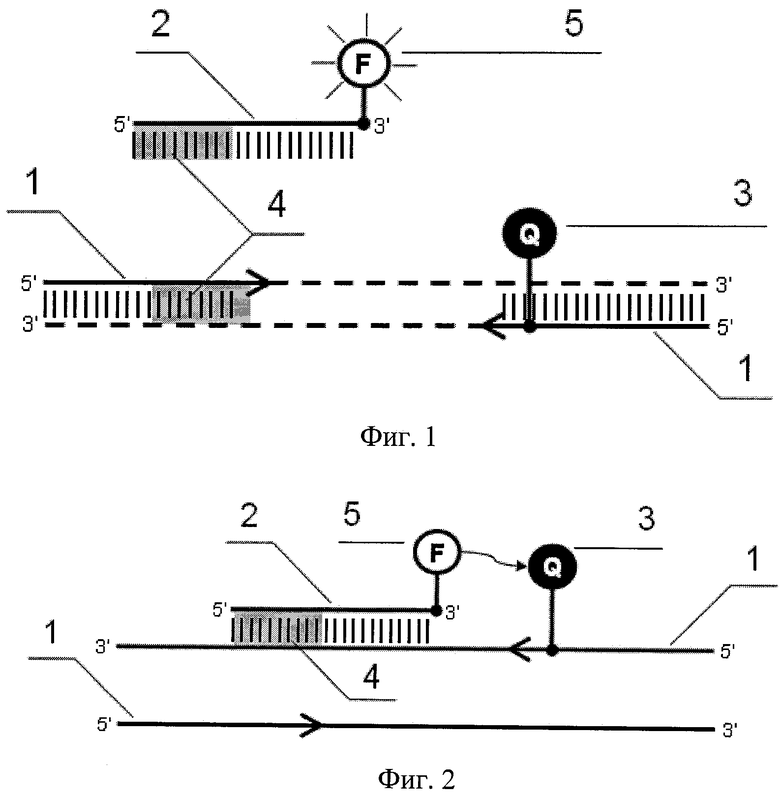
1. Способ детекции специфических нуклеотидных последовательностей и нуклеотидных замен с помощью ПЦР в режиме реального времени с эффектом гашения флуоресценции зонда праймером, включающий: выделение нуклеиновых кислот из исследуемых образцов, подбор соответствующих олигонуклеотидных зондов и праймеров, ПЦР-амплификацию одного или более необходимых целевых участков нуклеотидной последовательности, анализ кривых плавления зондов после проведения ПЦР, отличающийся тем, что для амплификации каждого из целевых участков нуклеотидной последовательности используют соответствующую пару праймеров, один из которых, а именно реверсный праймер, служит для образования цепи ДНК, комплементарной зонду, и содержит нефлуоресцирующий гаситель флуоресценции внутри нуклеотидной последовательности, ближе к 3' концу, а для детекции целевой нуклеотидной последовательности, находящейся между участками связывания праймеров, используют соответствующий 3'-флуоресцентно-меченый олигонуклеотидный зонд, участок связывания которого с одной стороны частично перекрывается с областью связывания немеченого (форвардного) праймера, а с другой стороны находится на расстоянии нескольких нуклеотидов от 3'-конца праймера, несущего гаситель флуоресценции, таким образом, что связывание зонда с цепью ДНК, образованной в результате элонгации реверсного праймера, приводит к сближению флуорофора и гасителя на расстояние, достаточное для эффективного гашения флуоресценции за счет флуоресцентно-резонансного переноса энергии (FRET) или образования стабильных комплексов между флуорофором и гасителем (статическое или контактное гашение).
2. Способ по п.1, отличающийся тем, что детектируемые специфические нуклеотидные последовательности являются инвариантными, то есть не содержат нуклеотидных замен, делеций, инсерций и других генных мутаций.
3. Способ по п.1, отличающийся тем, что является способом детекции нуклеотидных замен, делеций, инсерций и других точечных генетических полиморфизмов в первой нуклеиновой кислоте по сравнению со второй нуклеиновой кислотой.
4. Способ по п.1, отличающийся тем, что накопление продуктов ПЦР регистрируется по уменьшению исходного уровня флуоресценции зонда непосредственно в ходе амплификации.
5. Способ по п.4, отличающийся тем, что последовательности зонда и праймеров выбирают таким образом, чтобы Тm зонда была на 3-5°С выше Тm праймеров, а перекрывание последовательности зонда и немеченого праймера было минимальным, 1-3 нуклеотида.
6. Способ по п.1, отличающийся тем, что размер амплифицируемого участка нуклеотидной последовательности составляет 45-100 пн.
7. Способ по п.6, отличающийся тем, что длина участка перекрывания последовательностей зонда и немеченого праймера составляет один или несколько нуклеотидов.
8. Способ по п.7, отличающийся тем, что последовательности зонда и реверсного праймера, несущего гаситель, выбирают таким образом, что связывание зонда с ДНК-мишенью осуществляется на расстоянии 0-20 нуклеотидов между 3' концами зонда и праймера.
9. Способ по п.3, отличающийся тем, что участок целевой нуклеотидной последовательности, комплементарный участку зонда, не перекрывающемуся с немеченым форвардным праймером, содержит одну или несколько анализируемых нуклеотидных позиций.
10. Способ по п.9, отличающийся тем, что связывание немеченого форвардного праймера с ДНК-мишенью происходит непосредственно перед анализируемой нуклеотидной позицией, причем в участке связывания могут содержаться сателлитные полиморфизмы несовпадающие нуклеотиды.
11. Способ по п.3, отличающийся тем, что участок нуклеотидной последовательности между 3' концом зонда и 3' концом реверсного праймера содержит сателлитные полиморфизмы: нуклеотидные замены, короткие делеции, инсерции.
12. Способ по п.1, отличающийся тем, что ПЦР в режиме реального времени является мультиплексной ПЦР в режиме реального времени.
| LAY M.J | |||
| ЕТ AL., Real-time fluorescence genotyping of factor V Leiden during rapid-cycle PCR, Clin Chem., 1997, v.43, №12, p.2262-2267 | |||
| US 7160998 B2, 09.01.2007 | |||
| DIDENKO V.V | |||
| ET AL., DNA probes using fluorescence resonance energy transfer (FRET): designs and applications, Biotechniques | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2012-05-20—Публикация
2010-12-03—Подача