Область техники, к которой относится изобретение
Данное изобретение относится к способу модификации полифенолсодержащего растительного материала(ов) и к новым применениям в медицине различного полифенолсодержащего растительного материала(ов).
Уровень техники
Всемирная Организация Здравоохранения (WHO) предсказывает, что 300 миллионов людей (~5% населения) будут иметь диабет типа 2 в 2025 году. Это означает, что значительное количество населения будет страдать от различных метаболических нарушений, таких как метаболический синдром. Термин «метаболический синдром» обсуждался как в клинической диагностике, так и в качестве определения. До сих пор он обозначает вызывающую обеспокоенность группу метаболических факторов риска, которая идентифицирует субъектов, имеющих высокий риск развития диабета типа 2 и сердечно-сосудистого заболевания.
В настоящее время имеются три главных критерия, которые являются общепризнанными Международной Федерацией по Диабету (IDF) и Всемирной Организацией Здравоохранения (WHO), которыми являются ожирение, дислипидемия и инсулинорезистентность. Каждый из этих факторов риска является хорошим прогностическим фактором (показателем) сердечно-сосудистого заболевания. Однако инсулинорезистентность считается ключевым компонентом этого метаболического синдрома, так как она прогнозирует как диабет типа 2, так и сердечно-сосудистое заболевание. Секреция инсулина необходима не только для поддержания метаболизма глюкозы, но также для регуляции липидного метаболизма и сосудистого тонуса. Инсулинорезистентность приводит к неточной регуляции бета-клеток для поддержания эугликемии (нормогликемии), приводящей к гиперинсулинемии, которая, в свою очередь, усугубляет инсулинорезистентность в основных метаболических тканях и органах, таких как мышечная ткань, жировая ткань и печень, и развивается патологический круг между инсулинорезистентностью и гиперинсулинемией. Причина инсулинорезистентности не выяснена полностью, и имеются несколько генетических предрасположений (генетическое наследование, полиморфизмы), молекулярные факторы, такие как окислительный стресс и различные маркеры воспаления, которые могут препятствовать передаче сигнала инсулина.
Последним, но не менее важным, является большое влияние интенсивных модификаций стиля жизни, которые, как было обнаружено в исследованиях с корректировкой ситуации, задерживает или предотвращает диабет типа 2 на 40-58%. Диета в этих исследованиях с корректировкой ситуации, нацеленная на уменьшение массы посредством уменьшения поглощения энергии из жира, прежде всего из насыщенного жира (частично заменяемого мононенасыщенным жиром), была, кроме того, богата клетчаткой, цельным зерном, овощами и фруктами. Эти ограничения диеты сопровождались 30-минутной физической активностью в день. Физиологической пользой, получаемой с использованием интенсивных изменений стиля жизни, являются уменьшенная масса тела и уменьшенное кровяное давление и улучшение чувствительности к инсулину и содержание липидов крови. Это будет влиять на весь спектр компонентов риска и, как было обнаружено, задерживать или предотвращать развитие заболеваний, связанных с метаболическим синдромом.
Ввиду описанного выше, неудивительно, что громадное количество усилий было вовлечено в исследование механизма, лежащего в основе вышеупомянутых заболеваний, а также в нахождение новых путей для предотвращения, ослабления или лечения этих заболеваний.
Пищевые продукты, вызывающие снижение инсулинового ответа считаются благоприятными, так как высокие уровни инсулина (гиперинсулинемия) после еды являются факторами риска для развития заболеваний, находящихся в объеме метаболического синдрома (сердечно-сосудистых заболеваний, диабета типа 2 и ожирения). Таким образом, пищевые продукты, вызывающие более низкие уровни инсулина в теле человека, могут быть предпочтительными для людей в индустриализованной части мира, где увеличиваются проблемы сердечно-сосудистых заболеваний, таких как диабет типа 2, ожирение и метаболический синдром.
В соответствии с данным изобретением были найдены новые пути лечения и предотвращения таких заболеваний.
Сущность изобретения
В одном аспекте данное изобретение обеспечивает способ модификации полифенолсодержащего растительного материала(ов), где указанный способ предусматривает:
a) смешивание по меньшей мере одного полифенолсодержащего материала и по меньшей мере одного растворителя для обеспечения смеси;
b) нагревание этой смеси для элиминации присутствующих бактериальных видов для обеспечения нагретой смеси;
c) добавление по меньшей мере одного модифицирующего полифенол штамма молочнокислых бактерий и необязательно по меньшей мере одного источника белка, в произвольном порядке или одновременно, к этой нагретой смеси для обеспечения ферментационной смеси; и
d) подвергание этой ферментационной смеси условиям, подходящим для ферментации этой ферментационной смеси для обеспечения смеси модифицированного полифенолсодержащего растительного материала(ов) и
е) необязательное удаление модифицирующего полифенол штамма молочнокислых бактерий для обеспечения смеси модифицированного полифенолсодержащего растительного материала(ов), не содержащей живых молочнокислых бактерий.
В дополнительном аспекте данное изобретение обеспечивает применение смеси модифицированного полифенолсодержащего растительного материала(ов), содержащей живые молочнокислые бактерии, или смеси модифицированного полифенолсодержащего растительного материала(ов), не содержащей живых молочнокислых бактерий, для изготовления композиции для предотвращения или лечения диабета, метаболического синдрома, сердечно-сосудистых заболеваний.
Краткое описание фигур
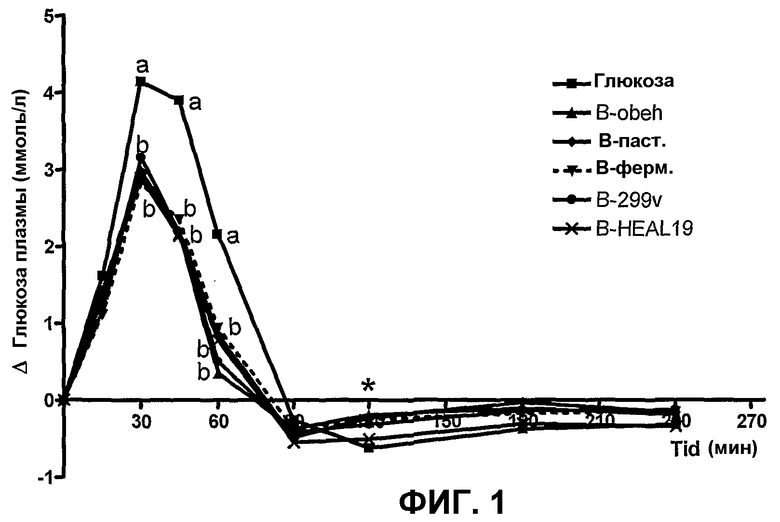
Фиг.1 показывает кривые глюкозы в плазме после приема пищи, полученные после приема внутрь различных напитков из черники тестируемыми индивидуумами, относительно сравнительного напитка, содержащего глюкозу.
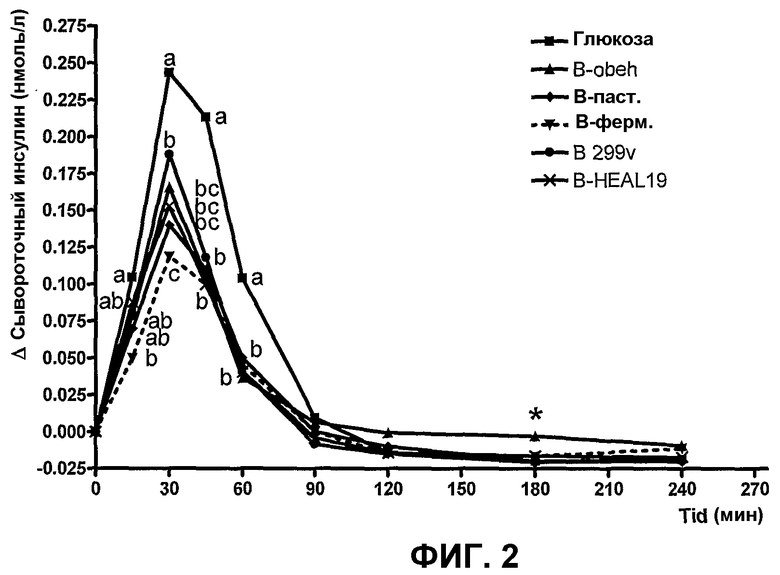
Фиг.2 показывает инсулиновый ответ сыворотки после приема внутрь различных продуктов из черники, подвергнутых действию различных процессов/добавок, в сравнении со сравнительным напитком, содержащим глюкозу.
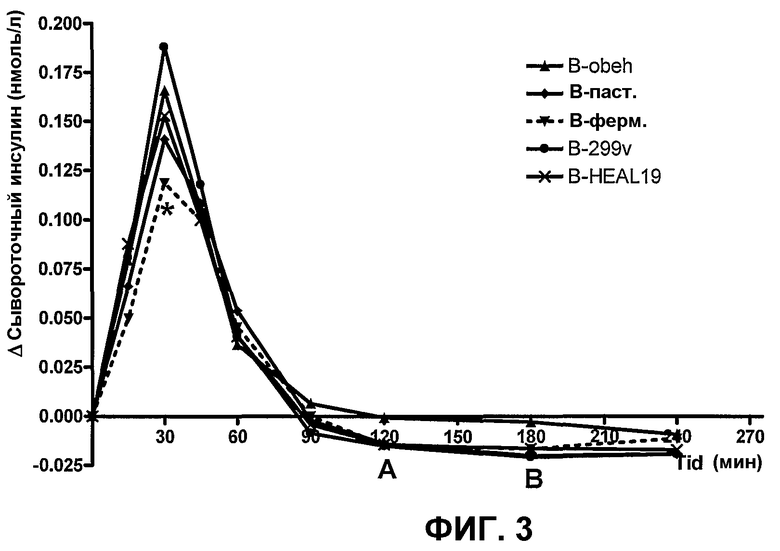
Фиг.3 показывает инсулиновый ответ после приема внутрь различных продуктов из черники, подвергнутых действию различных процессов/добавок, в сравнении с необработанным контролем (В-необработанным). После 30 минут этот В-ферментированный вариант дает значимо более низкий инсулиновый ответ в сравнении с контролем (В-необработанным) (P<0,05, критерий Дуннета с B-необработанным вариантом в качестве контроля).
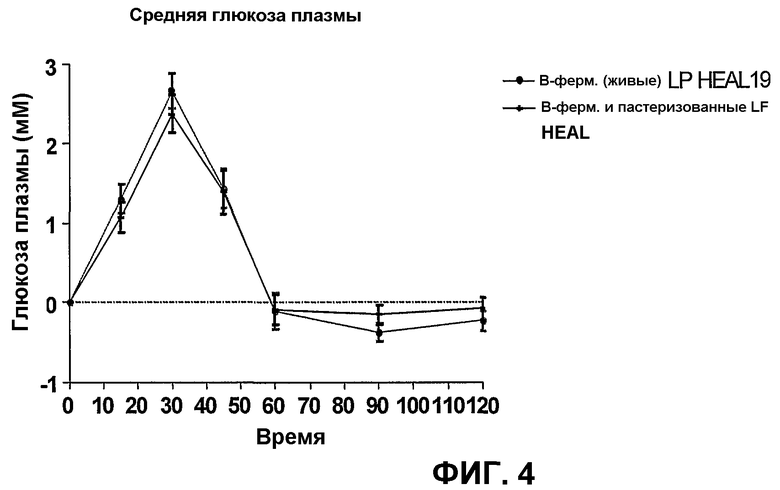
Фиг.4 показывает кривые глюкозы плазмы после приема пищи, полученные после приема внутрь ферментированного напитка из черники с живыми бактериями и ферментированного напитка, в котором эти бактерии после этого уничтожены пастеризацией.
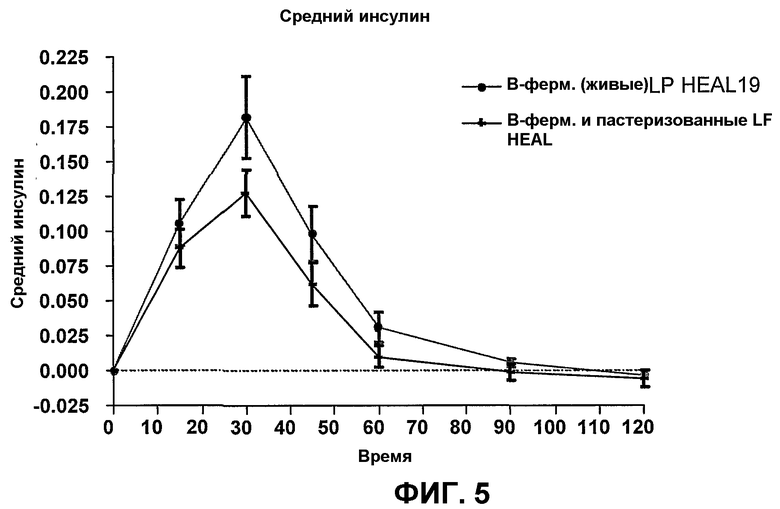
Фиг.5 показывает инсулиновый ответ после приема внутрь ферментированного напитка из черники с живыми бактериями, где эти бактерии после этого уничтожены пастеризацией.
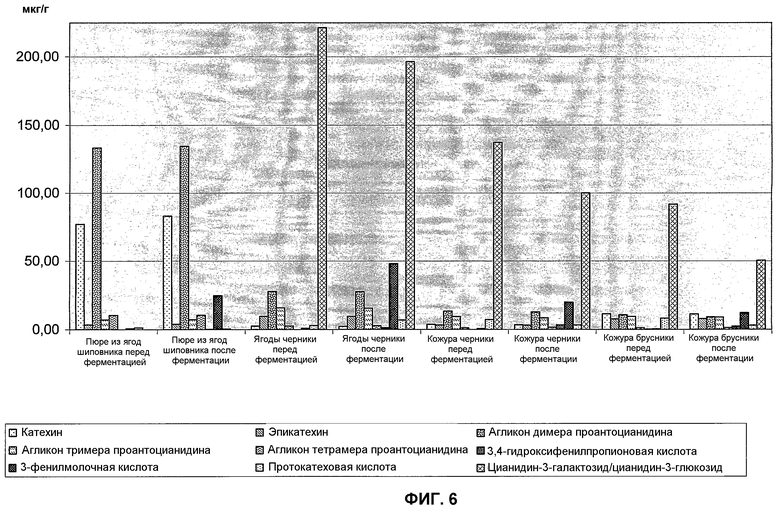
Фиг.6 показывает содержание катехина, эпикатехина, агликона димера проантоцианидина, агликона тримера проантоцианидина агликона тетрамера проантоцианидина, 3,4-дигидроксифенилпропионовой кислоты, 3-фенилмолочной кислоты, протокатеховой кислоты и цианидин-3-галактозида/цианидин-3-глюкозида в пюре из ягод шиповника, черники, кожуры черники и кожуры брусники, до и после ферментации.
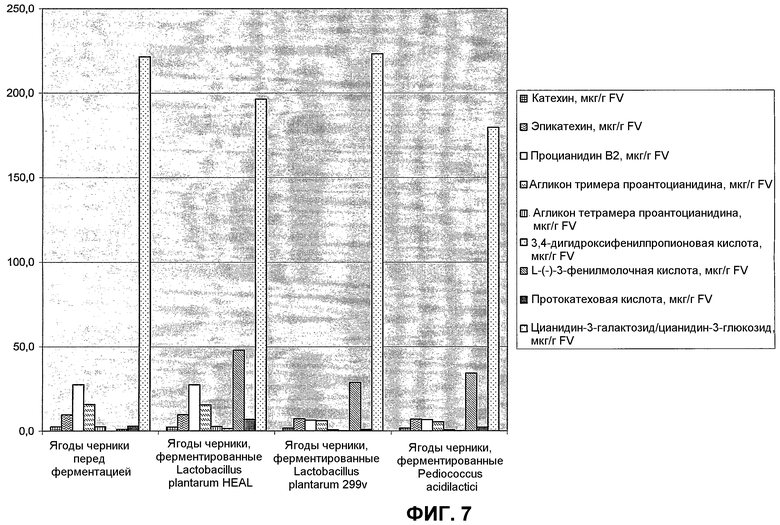
Фиг.7 показывает содержания катехина, эпикатехина, процианидина В2, агликона тримера проантоцианидина, агликона тетрамера проантоцианидина, 3,4-дигидроксифенилпропионовой кислоты, L-(-)-3-фенилмолочной кислоты, протокатеховой кислоты и цианидин-3-галактозида/цианидин-3-глюкозида в чернике до ферментации и после ферментации с Lactobacillus plantarum HEAL 19, Lactobacillus plantarum 299v или Pediococcus acidilactici.
Подробное описание вариантов осуществления изобретения
В одном варианте осуществления способа изобретения смесь по меньшей мере одного полифенолсодержащего растительного материала и по меньшей мере одного растворителя получают гомогенизацией. Этим растворителем является предпочтительно вода, водопроводная вода или дистиллированная вода, но может быть другой водный, годный в пищу растворитель, такой как минеральная вода, соки, такие как фруктовые и овощные соки, молоко и другие напитки.
Для элиминации любых бактериальных видов, таких как бактерии и/или микроорганизмы, присутствующие в приготовленной смеси по меньшей мере одного полифенолсодержащего материала и по меньшей мере одного растворителя, для предотвращения их любого роста, нагревание в стадии b) имеет место при температуре 60°C-100°C, предпочтительно 80°C-100°C, более предпочтительно 90°C-100°C, т.е. при температуре, достаточной чтобы уничтожить бактерии и микроорганизмы, например пастеризации при 94°C в течение 2 сек или с использованием общепринятого автоклава для уничтожения присутствующих бактерий. Ферментация, обеспечиваемая в стадии d), должна иметь место только для конкретного штамма молочнокислых бактерий, добавляемых к этой смеси. Таким образом, необходимо элиминировать любые другие виды бактерий, которые могут присутствовать в стадии нагревания b), перед ферментацией. Решение о температуре нагревания и продолжительности нагревания принимаются в соответствии с желаемым результатом, т.е. для уничтожения любых присутствующих бактерий и микроорганизмов.
После стадии нагревания b) рН нагреваемой смеси может быть доведен до рН в диапазоне приблизительно 4,5-9, предпочтительно 5-7, например, добавлением КОН, так как полифенолсодержащий материал может быть кислым. Это объясняется тем, что добавляемый штамм молочнокислых бактерий будет расти хорошо в этом интервале рН. Этот по меньшей мере один модифицирующий полифенол штамм добавляют в количестве приблизительно 105-109 кое/мл смеси. Предпочтительно ферментация имеет место в присутствии по меньшей мере одного источника белка, например источника аминокислот, причем указанный источник белка выбран, но не ограничивается этим, из группы, состоящей из пептонов, триптонов (молочного бульона), экстрактов дрожжей и их комбинаций. Другим примером является мясной бульон или бульон из овсяной муки, которые также содержат необходимые компоненты для этих бактерий. Ферментация может также иметь место без добавления источника белка, т.е. в присутствии только компонентов добавленного полифенолсодержащего растительного материала (добавленных полифенолсодержащих растительных материалов), т.е. присутствующих белков и углеводов в этих растительных материалах. Этот по меньшей мере один белок добавляется или присутствует в количестве 0,0001-0,1 мас.% общей смеси.
В одном варианте осуществления этого изобретения указанный по меньшей мере один модифицирующий полифенол штамм молочнокислых бактерий выбран из группы, состоящей из Lactobacillus, Pediococcus, Streptococcus, Weissella, Leuconostoc, Oenococcus, Lactococcus и филогенетически родственных родов. В другом варианте осуществления этого изобретения указанный по меньшей мере один модифицирующий полифенол штамм Lactobacillus выбран из группы, состоящей из Lactobacillus plantarum, Lactobacillus paraplantarum, Lactobacillus pentosus и Lactobacillus argentoratensis.
Предпочтительно Lactobacillus plantarum выбран из группы штаммов, состоящей из Lactoabacillus plantarum 299, DSM 6595, который был депонирован 2 июля 1991 года в Немецкой Коллекции микроорганизмов и клеточных культур GmbH, Lactobacillus plantarum 299v, DSM 9843, который был депонирован 16 марта 1995 года в Немецкой Коллекции микроорганизмов и клеточных культур GmbH, Lactobacillus plantarum HEAL 9, DSM 15312, Lactobacillus plantarum HEAL 19, DSM 15313 и Lactobacillus plantarum HEAL 99, DSM 15316, которые были депонированы 27 ноября 2002 года в Немецкой Коллекции микроорганизмов и клеточных культур GmbH, и затем получили номера доступа, указанные выше.
После добавления конкретного штамма молочнокислых бактерий условия ферментации являются следующими: температура приблизительно 30°C-50°C, предпочтительно приблизительно 35°C-45°C, особенно предпочтительно приблизительно 37°C-40°C, в жидкой среде при атмосферном давлении. Ферментация обычно протекает, пока не достигается величина рН<5, предпочтительно <4. Если ферментируется йогурт, ферментация продолжается до рН<4,6-4,7. Ферментация имеет место в течение приблизительно 10-30 часов, предпочтительно приблизительно 15-25 часов, например приблизительно 20-24 часов. Продолжительность ферментации должна быть достаточной для обеспечения полезного модифицированного полифенолсодержащего растительного материала (полезных модифицированных полифенолсодержащих растительных материалов).
После завершения ферментации имеет место необязательная стадия f) удаление модифицирующего полифенол штамма молочнокислых бактерий посредством нагревания, ультрафиолетового излучения, гамма-излучения, давления, электрического тока, электрического разряда, импульсных электрических полей, электрического шока или стерильного фильтрования. Посредством элиминирования этого штамма молочнокислых бактерий можно будет использовать полученную смесь модифицированной полифенолсодержащей растительной смеси, не содержащую молочнокислых бактерий, в любой композиции, которая может приниматься внутрь индивидуумом.
Полифенолсодержащий растительный материал(ы), которые модифицированы ферментацией штамма молочнокислых бактерий, выбраны, например, из группы, состоящей из фруктов, овощей, ягод, чая, зерна, зеленого чая, кофе, какао, шоколада и коры. Фрукты и ягоды выбраны, например, из группы, состоящей из черники, брусники, клюквы, яблок, бананов, черной смородины, земляники, малины, шиповника, винограда, цитруса, черной рябины, японской айвы, терна, шиповника и бузины, маслин, ягод каперсов и других плодов, богатых полифенолами. Кора обычно является корой коричного дерева. Овощи, например, выбраны из разновидностей фасоли. Это изобретение не ограничивается вышеупомянутыми конкретными примерами. Важным аспектом в отношении выбранного полифенолсодержащего растительного материала(ов) является то, что используемые полифенолсодержащие растительные материалы должны быть способны ферментироваться штаммом молочнокислых бактерий и обеспечивать модифицированный полифенолсодержащий растительный материал.
В данном контексте фраза "модификация полифенолсодержащих растительных материалов» обозначает, что ферментация добавленного штамма молочнокислых бактерий имела место в присутствии полифенолсодержащего растительного материала. Эта ферментация имеет место и влияет на присутствующие полифенольные группы с образованием модифицированного полифенолсодержащего растительного материала(ов). В данном контексте термин "модифицированный полифенолсодержащий растительный материал(ы)" относится к продукту (продуктам), полученным после ферментации полифенолсодержащего растительного материала в присутствии штамма молочнокислых бактерий в указанных условиях. В экспериментальной части тестируемым полифенолсодержащим растительным материалом является черника, брусника и шиповник, и было показано, что только тест-продукт, содержащийся в ферментированных чернике, бруснике и шиповнике, вызывает значимое действие на более низкий инсулиновый ответ, что означает наибольшую вероятность того, что именно ферментация полифенолсодержащих материалов вызывает более низкий инсулиновый ответ. Таким образом, согласно данному изобретению, термин "модифицированный полифенолсодержащий растительный материал(ы)" обозначает такие вещества, которые получают после ферментации полифенолсодержащих растительных материалов. Такие "модифицированные полифенолсодержащие растительные материалы" должны обеспечивать желаемый эффект снижения инсулинового ответа в людях после приема их внутрь в сравнении с приемом внутрь полифенолсодержащего растительного материала, который не был ферментирован штаммом молочнокислых бактерий. Снижение уровня инсулина приемом внутрь модифицированных полифенолсодержащих растительных материалов в любой подходящей форме должно происходить в диапазоне приблизительно 1-50%, предпочтительно приблизительно 5-40%, более предпочтительно приблизительно 10-30%, даже более предпочтительно приблизительно 15-25%, например приблизительно 25%.
Это изобретение относится также к применению смеси модифицированного полифенолсодержащего растительного материала(ов), содержащей живые молочнокислые бактерии, или смеси модифицированного полифенолсодержащего растительного материала(ов), не содержащей живых молочнокислых бактерий, для приготовления композиции для предотвращения или лечения диабета, метаболического синдрома, ожирения и сердечно-сосудистых заболеваний.
Эта композиция является предпочтительно фармацевтической композицией или пищевой композицией. Этой пищевой композицией является, например, пищевой продукт или пищевая добавка.
Этот пищевой продукт может быть выбран из группы, содержащей разновидности хлеба, сыры, йогурты, соки, диетические напитки, диетические брикеты, пасты, бисквиты (печенья) и зерновые завтраки. Удобным является включение смеси модифицированного полифенолсодержащего растительного материала(ов) или смеси модифицированного полифенолсодержащего растительного материала(ов), не содержащей живых молочнокислых бактерий, в пищевую композицию, так как такая композиция легко используется индивидуумом для поддержания здоровья и для предупреждения вышеуказанных сердечно-сосудистых заболеваний.
Способ и материал
Тест-продукты
Для демонстрации эффектов данного изобретения его испытывали для оценивания потенциальных различий в глюкозе и инсулиновом ответе после приема пищи, после приема внутрь различных композиций на основе полифенолсодержащего растительного материала(ов), такого как черника и сахароза, в зависимости от 1) типа и степени обработки нагреванием композиции черники, 2) присутствия продуцирующих молочную кислоту бактерий (Lactobacillus plantarum 299v и Lactobacillus plantarum HEAL 19 соответственно) в этой композиции и 3) ферментации композиции черники с L. plantarum HEAL 19.
В это исследование включали пять различных тест-напитков и ссылочный напиток (Ref.). Эти тест-напитки состояли из одного необработанного неферментированного напитка из черники (B-необ.), одного напитка на основе неферментированных ягод черники, которые пастеризовали (B-паст.), двух напитков, которые пастеризовали и не ферментировали с добавлением Lactobacillus plantarum 299v и HEAL 19 соответственно (B-299v и B-HEAL), и одного напитка, который пастеризовали и ферментировали (B-ферм.) L. plantarum HEAL 19. Ссылочный напиток состоял из глюкозы, растворенной в воде. Ягоды черники (Vaccinium myrtillus) смешивали до пюре перед хранением при -20°C. После оттаивания чернику разбавляли водой (1:1) и гомогенизировали в течение 5 минут с использованием домашнего миксера. После этого чернику разбавляли второй раз (1:1) с получением 25% раствора черники. Затем этот раствор черники гомогенизировали при 25000 об/мин диспергатором высокой производительности (Ultra Turrax T25, Janke & Kunkel IKA, Werke GmbH & Co.KG, Staufen, Germany). Брали пробы неферментированного напитка из черники (B-необработанного) и замораживали при -20°C до использования в исследовании с приемом пищи. Остальной раствор черники пастеризовали (94°C, 2 с) и хранили при -20°C (B-пастеризованный).
Два напитка с отдельным добавлением Lactobacillus plantarum 299v (B-299v) и Lactobacillus plantarum HEAL 19 (B-HEAL 19) готовили оттаиванием B-пастеризованного напитка за один день перед этим исследованием и добавляли соответствующий штамм Lactobacillus и после этого этому напитку давали стоять в течение ночи в холодильнике (+4°C) до подачи.
Приблизительно за одну неделю перед подачей 600 мл пастеризованного раствора черники ферментировали в сосуде, добавляли КОН до получения рН 5. После этого этот раствор черники инокулировали с использованием Lactobacillus plantarum HEAL 19 (1×107 колониеобразующих единиц (кое)/мл). Один грамм автоклавированных цветков кормовых (конских) бобов добавляли в качестве источника азота. Раствору черники давали ферментироваться в течение 20 часов, пока не получали конечные кое 1×109/мл (pH 3,8) (B-ферментированный). После ферментации раствор черники хранили при 4°С. Ферментацию выполняли с использованием Probi AB (Lund, Sweden). Глюкозный напиток использовали в качестве ссылочного напитка, содержащего 30 г D+-глюкозы (VWR international Ltd. Poole, England) и до 300 мл воды. Все напитки содержали 30 г углеводов. Батон пшеничного белого хлеба (WWB, Dollar Storfranska, Lockarp, Sweden) давали каждому из тестируемых субъектов в начале этого исследования. Индивидуально выбранное количество ломтей должно было быть съеденным вечером перед каждым случаем.
Таблица 1 показывает разный состав тест-напитков и ссылочного напитка.
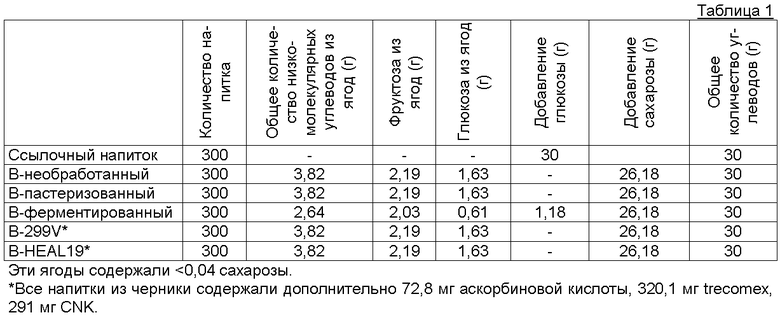
Перед подачей в каждый напиток из черники добавляли 72,8 аскорбиновой кислоты, 320,1 мг trecomex (модифицированного картофельного крахмала), 291 мг CNK (каррагенана E407) и 26,18 г сахарозы. Кроме того, к В-ферментированному напитку добавляли 1,18 г глюкозы для компенсации потерь углеводов во время ферментации. Наконец, все напитки из черники дополняли 32,0 г воды, так что получали 300 г напитков из черники, содержащих 20% черники и 30 г углеводов.
Исследования тест-напитков
Все напитки подавали в качестве завтраков и предоставляли случайным образом, с интервалом по меньшей мере пять дней. От всех субъектов получали письменное информированное согласие. Субъектам было известно, что они могут выйти из этого исследования в любой момент без дополнительного объяснения. Это исследование было одобрено комитетом по этике факультета медицины Lund University.
Тест-субъекты
Пятнадцать здоровых, некурящих добровольцев, 7 женщин и 8 мужчин, участвовали в этом исследовании экстренного приема напитка. Средний возраст был 25±2,4 (среднее ± SD) лет и средний индекс массы тела находился в нормальном диапазоне (22,4±2,0 кг/м2; среднее±SD). Эти субъекты не получали никакого лекарственного лечения. Их просили избегать приема алкоголя, физической активности и обеда, богатого клетчаткой, в день перед проведением этого теста. Субъекты съедали индивидуально выбранное количество WWB (пшеничного белого хлеба) между 9 и 10 часами вечером перед каждым случаем. Это индивидуально выбранное количество ломтей должно было быть одинаковым на протяжении этого исследования. Субъектов просили не есть ничего больше после съедания WWB до прибытия в лабораторию. Но позволялось, если требуется, выпивать небольшое количество воды после 10 часов пополудни. Каждый субъект участвовал в четырех случаях с интервалами, равными по меньшей мере одной неделе.
Схема исследования и взятие крови
Эти субъекты прибывали в лабораторию утром в 07,45, и им вставляли катетер в вену, находящуюся впереди от локтевого сустава. В каждом случае все участники заполняли опросник, касающийся их физического состояния в течение этого дня, в том числе ощущений стресса или тревожности. Напиток выпивали постоянно в течение 10 минут. Капиллярную кровь собирали для анализа на сывороточный инсулин и для анализа глюкозы плазмы крови натощак и при 15, 30, 60, 90, 120, 180, 240 минутах после выпивания напитка.
Анализ глюкозы
Глюкозу крови определяли в B-Glucose Analyser (Hemocue 201 +, Hemocue AB, Angelholm, Sweden).
Анализ инсулина
Пробы сывороточного инсулина хранили при -20°C. Этот анализ выполняли на интегрированном анализаторе для иммуноанализа (CODA Open Microplate System; Bio-Rad Laboratories, Hercules CA) с использованием набора для ферментного иммуноанализа (Mercodia Insulin Elisa; Mercodia AB, Uppsala, Sweden).
Расчеты и статистический анализ
Для каждого участника и каждого тест-напитка инкрементные площади под кривой (AUC) при 0-45 минутах и 0-120 минутах для глюкозы крови и сывороточного инсулина рассчитывали с использованием программы GraphPad PRISM (version 3.02; GraphPad Software Inc, San Diego). Все площади ниже линии фона исключали из этих расчетов. В каждой временной точке глюкозу крови и сывороточный инсулин статистически анализировали. Эти статистические вычисления выполняли при помощи статистической программы MINITAB Statistical Software (release 13.1 for windows). Значимость определяли при помощи общей линейной модели (ANOVA), с последующим критерием множественных сравнений Тьюки или критерием Дуннета. Различия, приводящие к P<0,05, считали значимыми.
Глюкоза плазмы
Как очень ранние (0-45 мин), так и поздние (0-90 мин) площади под кривыми глюкозы были значимо более низкими после приема напитков из черники в сравнении с глюкозным ссылочным напитком. Величины GI для напитков из черники хорошо собирались в интервале 58-64 и были значимо более низкими, чем для ссылочной глюкозы (GI=100). Эта реакция глюкозы плазмы показана на фиг.1.
Сывороточный инсулин
Инсулиновый ответ после приема внутрь различных напитков из черники и ссылочных напитков показаны на фиг.2. В интервале 30-60 мин все напитки из черники вызывали значимо более низкий инсулиновый ответ в сравнении с глюкозным ссылочным напитком. После 15 минут уровень инсулина после приема В-ферментированного напитка был значимо более низким в сравнении с глюкозным ссылочным напитком. В ранней фазе после приема (выраженной как 0-45 мин AUC) В-ферментированный напиток вызывал более низкий инсулиновый ответ, чем B-HEAL 19.
Для исследования важности пастеризации и ферментации (с L. plantarum HEAL 19) или добавления Lactobacillus plantarum к необработанному материалу брусники инсулиновый ответ B-паст., B-ферм., B-299v и B-HEAL 19 сравнивали с необработанным контрольным напитком (B-необр.). При 30 мин после приема внутрь B-ферм. был значимо более низким в сравнении с В-необработанным. При 120 мин B-299v и B-HEAL 19 обнаруживали более низкий инсулиновый ответ в сравнении с В-необработанным вариантом. Сравнение раннего инсулинового ответа (0-45 мин AUC) показало, что В-ферм. давал значимо более низкий инсулиновый ответ (25%) в сравнении с необработанным напитком из черники (P<0,05, таблица 4). Ни пастеризация, ни добавление Lactobacillus plantarum 299v или Lactobacillus plantarum HEAL 19 соответственно не влияли значимо на площадь инсулина после приема относительно необработанного напитка из черники.
Ферментация ягод черники с использованием Lactobacillus plantarum HEAL19 является, по-видимому, ключевым фактором для уменьшенного инсулинового ответа. Эти результаты предполагают, что процесс ферментации улучшает экономию инсулина.
Этот на 25% более низкий инсулиновый ответ после приема внутрь ферментированного напитка черники с Lactobacillus plantarum HEAL 19 не сопутствовал сходному уменьшению глюкозы плазмы, так как реакции глюкозы плазмы после приема напитка находились на том же самом уровне. Однако ферментация ягод черники с использованием Lactobacillus plantarum HEAL19 является, по-видимому, ключевым фактором уменьшенного инсулинового ответа, наблюдаемого с напитками, содержащими ферментированные ягоды черники. Этот эффект не наблюдали при добавлении тех же самых бактерий Lactobacillus plantarum HEAL 19 к напитку из черники непосредственно перед приемом. Таким образом, не присутствие бактерий per se приводит к уменьшенному инсулиновому ответу, а скорее важной является сама ферментация. Активный механизм, вызывающий этот представляющий интерес эффект, мог быть обусловлен компонентами, продуцируемыми или модифицируемыми ферментацией, т.е. модифицированными полифенольными компонентами, доступными в ягодах черники после ферментации.
В целом, можно сделать вывод, что ферментированный напиток черники уменьшал инсулиновый ответ на 25% в сравнении с неферментированным напитком черники. В будущем продукты, предназначенные для людей с метаболическими расстройствами, представляют дополнительный путь предупреждения и, возможно, также уменьшения развития диабета типа 2 и эндотелиальных нарушений. Рассматривая "эпидемическое заболевание с метаболическими нарушениями" в большей перспективе, предпочтительно посредством интеграции всех аспектов этой проблемы, т.е. не только связанных с питанием и клинических, но также социальных, культурных и экономических, можно получить возможность введения общего здорового стиля жизни в западных и в развивающихся странах. Можно надеяться, что расширенное знание этих аспектов у всех потребителей заставит промышленность подчиниться желаниям рынка.
Тест, сравнивающий эффекты для напитков с живыми бактериями с эффектами для напитков с элиминированными бактериями
В это исследование включали два различных тест-напитка для оценивания, дает ли напиток, в котором культуру L. plantarum HEAL 19 пастеризуют после ферментации, тот же самый низкий инсулиновый ответ, что и напиток, в котором культуру L. plantarum HEAL 19 оставляют живой после ферментации.
Тест-напитки состояли из одного напитка, пастеризованного и ферментированного L. plantarum HEAL 19, и одного напитка, который пастеризовали и ферментировали L. plantarum HEAL 19 и затем пастеризовали после этой ферментации. Ягоды черники (Vaccinium myrtillus) смешивали до пюре перед хранением при -20°C. После оттаивания чернику разбавляли водой (1:1) и гомогенизировали в течение 5 минут с использованием домашнего миксера. После этого чернику разбавляли второй раз (1:1) с получением 25% раствора черники. Затем этот раствор черники гомогенизировали при 25000 об/мин диспергатором высокой производительности (Ultra Turrax T25, Janke & Kunkel IKA, Werke GmbH & Co.KG, Staufen, Germany). Брали пробы неферментированного напитка из черники (B-необработанного) и замораживали при -20°C до использования в исследовании с приемом внутрь. Остальной раствор черники пастеризовали (94°C, 2 с) и хранили при -20°C (B-пастеризованный).
Приблизительно за одну неделю перед подачей 600 мл пастеризованного раствора черники ферментировали в сосуде, добавляли КОН до получения рН 5. После этого этот раствор черники инокулировали с использованием Lactobacillus plantarum HEAL 19 (1×107 колониеобразующих единиц (кое)/мл). Один грамм автоклавированных цветков кормовых (конских) бобов добавляли в качестве источника азота. Раствору черники давали ферментироваться в течение 20 часов, пока не получали конечные кое 1×109/мл (pH 3,8) (B-ферментированный). После ферментации раствор черники хранили при 4°С или опять пастеризовали. Ферментацию выполняли с использованием Probi AB (Lund, Sweden).
Таблица 5 показывает разный состав этих тест-напитков.
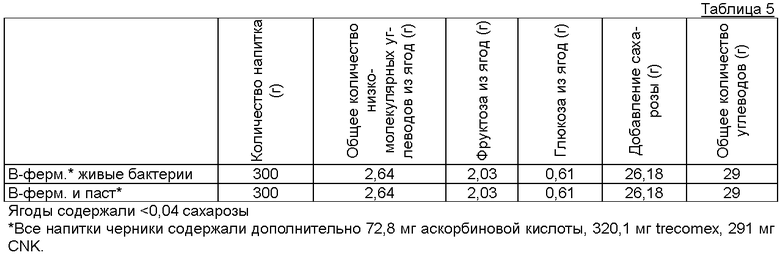
Перед подачей в каждый напиток из черники добавляли 72,8 аскорбиновой кислоты, 320,1 мг trecomex (модифицированного картофельного крахмала), 291 мг CNK (каррагенана E407) и 26,18 г сахарозы. Кроме того, к В-ферментированному напитку добавляли 1,18 г глюкозы для компенсации потерь углеводов во время ферментации. Наконец, все напитки из черники дополняли 32,0 г воды, так что получали 300 г напитков из черники, содержащих 20% черники и 30 г углеводов.
Исследования тест-напитков
Все напитки подавали в качестве завтраков и предоставляли случайным образом, с интервалом по меньшей мере пять дней. От всех субъектов получали письменное информированное согласие. Субъектам было известно, что они могут выйти из этого исследования в любой момент без дополнительного объяснения. Это исследование было одобрено комитетом по этике факультета медицины Lund University.
Тест-субъекты
Пятнадцать здоровых, некурящих добровольцев, 7 женщин и 8 мужчин, участвовали в этом исследовании экстренного приема напитка. Средний возраст был 25,5±1,34 (среднее±SD) лет и средний индекс массы тела находился в нормальном диапазоне (20,8±0,24 кг/м2; среднее ± SD). Один из этих субъектов страдал от желудочного гриппа в дни перед одним случаем тестирования и, следовательно, был исключен из этого исследования. Эти субъекты не получали никакого лекарственного лечения. Их просили избегать приема алкоголя, физической активности и обеда, богатого клетчаткой, в день перед проведением этого теста. Субъекты съедали индивидуально выбранное количество WWB (пшеничного белого хлеба) между 9 и 10 часами вечером перед каждым случаем. Это индивидуально выбранное количество ломтей должно было быть одинаковым на протяжении этого исследования. Субъектов просили не есть ничего больше после съедания WWB до прибытия в лабораторию. Но позволялось, если требуется, выпивать небольшое количество воды после 10 часов пополудни. Каждый субъект участвовал в четырех случаях с интервалами, равными по меньшей мере одной неделе.
Схема исследования и взятие крови
Эти субъекты прибывали в лабораторию утром в 07,45, и им вставляли катетер в вену, находящуюся впереди от локтевого сустава. В каждом случае все участники заполняли опросник, касающийся их физического состояния в течение этого дня, в том числе ощущений стресса или тревожности. Напиток выпивали постоянно в течение 10 минут. Капиллярную кровь собирали для анализа на сывороточный инсулин и для анализа глюкозы плазмы крови натощак и при 15, 30, 60, 90, 120, 180, 240 минутах после выпивания напитка.
Анализ глюкозы
Глюкозу крови определяли в B-Glucose Analyser (model no. 120401, Hemocue AB, Angelholm, Sweden).
Анализ инсулина
Пробы сывороточного инсулина хранили при -20°C. Этот анализ выполняли на интегрированном анализаторе для иммуноанализа (CODA Open Microplate System; Bio-Rad Laboratories, Hercules CA) с использованием набора для ферментого иммуноанализа (Mercodia Insulin Elisa; Mercodia AB, Uppsala, Sweden).
Расчеты и статистический анализ
Для каждого участника и каждого тест-напитка инкрементные площади под кривой (AUC) при 0-45 минутах и 0-120 минутах для глюкозы крови и сывороточного инсулина рассчитывали с использованием программы GraphPad PRISM (version 3.02; GraphPad Software Inc, San Diego). Все площади ниже линии фона исключали из этих расчетов. В каждой временной точке глюкозу крови и сывороточный инсулин статистически анализировали. Эти статистические вычисления выполняли при помощи статистической программы MINITAB Statistical Software (release 13.1 for windows). Значимость определяли при помощи общей линейной модели (ANOVA), с последующим критерием множественных сравнений Тьюки или критерием Дуннета. Различия, приводящие к P<0,05, считали значимыми.
Глюкоза плазмы
Как очень ранние (0-45 мин), так и поздние (0-120 мин) площади под кривыми глюкозы были слегка более низкими после приема тест-напитка, который был пастеризован после ферментации, в сравнении с тест-напитком с живыми бактериями, как можно видеть на фиг.4. Профиль кривой глюкозы анализировали делением периода, в течение которого глюкоза крови остается выше величины, измеренной натощак, на максимальное увеличение глюкозы крови от величины, измеренной натощак. Это частное называют квотой (долей) продолжительность/пик (мин/Δ мМ). Высокая величина квоты продолжительность/пик глюкозы обозначает, что кривая глюкозы является длинной и низкой, а низкая величина указывает на неблагоприятный профиль кривой с короткой и высокой формой кривой. Величина GI не могла быть определена, так как в этом тесте не был включен ссылочный напиток.
Сывороточный инсулин
Инсулиновый ответ после приема внутрь двух напитков из черники показан на фиг.5. AUC был более низкий после приема тест-напитка, который был пастеризован после ферментации, в сравнении с тест-напитком с живыми бактериями. Величина GI не могла быть определена, так как в этом тесте не был включен ссылочный напиток.
Обсуждение
Оба напитка давали приблизительно одну и ту же реакцию на глюкозу. Напиток, который пастеризовали, т.е. бактерии уничтожали, показал лучшие результаты на инсулиновый ответ, чем напиток с живыми бактериями. В более раннем исследовании не наблюдали эффекта из одной пастеризации на инсулиновый ответ, т.е. пастеризованные ягоды черники давали тот же самый результат, что и непастеризованные ягоды черники. Однако данное изобретение указывает на то, что степень обработки нагреванием после ферментации до значительной степени может влиять на инсулиновый ответ.
Механизм этого эффекта требует дополнительного оценивания. Одной теорией является то, что более мощная обработка нагреванием, через действия на полифенолы и другие биоактивные компоненты в ягодах черники, дает эффект снижения инсулина, который иллюстрируется напитком с уничтоженными нагреванием бактериями вследствие дополнительной стадии обработки нагреванием.
Анализ фенольных соединений
Для обеспечения доказательства, что модификация полифенолсодержащих растительных материалов имеет место, проводили сравнение содержаний катехина, эпикатехина, агликона димера проантоцианидина, агликона тримера проантоцианидина агликона тетрамера проантоцианидина, 3,4-дигидроксифенилпропионовой кислоты, L-(-)-3-фенилмолочной кислоты, протокатеховой кислоты и цианидин-3-галактозида/цианидин-3-глюкозида в пюре из ягод (и семян) шиповника, черники, кожуры черники и кожуры брусники до и после ферментации.
Все фракции плодов пастеризовали перед ферментацией во избежание того, что другие микроорганизмы будут влиять на ферментацию.
Для анализа фенольных соединений пробы взвешивали и добавляли раствор для экстракции (концентрация в этой пробе: 50% этанол, 0,05М фосфорная кислота, альтернативно 50% метанол, 0,5%). После этого эти пробы экстрагировали в течение 10 минут в ультразвуковой бане и затем центрифугировали, после чего супернатант переносили во флаконы и анализировали при помощи ВЖХ-МС-анализа. ВЖХ-МС-анализ выполняли, как описано Salminen et al. Characterisation of proanthocyanidin aglycones and glycosides from rose hips by high-performancce liquid chromatography-mass spectrometry, and their rapid quantification together with Vitamin C. J Chrom A 2005; 1077:170-180, и Salminen et al. Characterisation of hydrolysable tannins from leaves of Betula pubescens by high-performance liquid chromatography-mass spectrometry. J Chrom A 1999; 864: 283-291 с использованием ионного распылителя API 150 EX Turbo.
Этот прибор устанавливали в отрицательном режиме, т.е. анализировали отрицательно заряженные ионы. Система ВЖХ состояла из насоса ВЖХ типа PerkinElmer LC-200 Micro Pump, а также пробоотборника PerkinEImer 200 Auto sampler. Инжекционный объем этих проб был равен 8 мкл.
Сканирование проводили на протяжении массовых чисел 90-1000 m/z. Конкретные массовые числа, использованные для детектирования:
Катехин, m/z 289 (M-H)
Эпикатехин, m/z 289 (M-H)
Процианидин B2, m/z 577 (M-H)
Агликон димера проантоцианидина, m/z 577 (M-H)
Агликон тримера проантоцианидина aglycone, m/z 865 (M-H)
Агликон тетрамера проантоцианидина, m/z 1153 (M-H)
3,4-дигидроксифенилпропионовая кислота, m/z 181 (M-H)
L-(-)-3-фенилмолочная кислота, m/z 165 (M-H)
Протокатеховая кислота, m/z 153 (M-H)
Цианидин-3-галактозид, цианидин-3-глюкозид, m/z 447 (M-H)
На фиг.6 можно видеть результаты этого исследования, показывающие, что модификация полифенолсодержащих растительных материалов имеет место как в ягодах черники, так и в ягодах брусники и в ягодах шиповника.
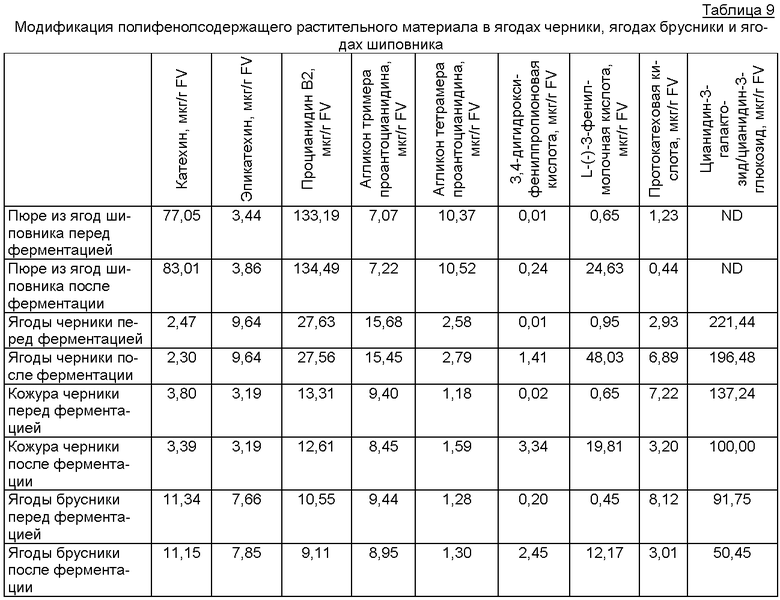
В исследовании на крысах было показано, что концентрации выбранных фенольных соединений в слепой кишке были различными при потреблении в пищу ягод шиповника плюс Lactobacillus plantarum 299v или Lactobacillus plantarum HEAL 19 в сравнении с потреблением только ягод шиповника (таблица 10). Это указывает на то, что эти полифенольные компоненты были модифицированы во время ферментации в слепой кишке.
Тест, сравнивающий ферментацию с Lactobacillus plantarum HEAL 19, Lactobacillus plantarum 299v или Pediococcus acidilactici
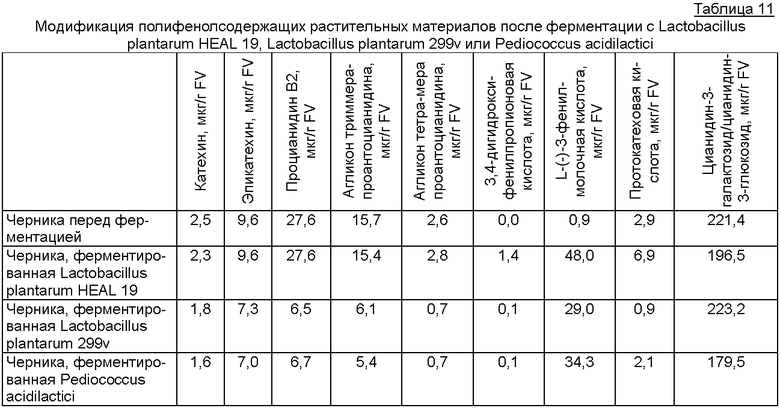
Для обеспечения доказательства, что модификация полифенолсодержащих растительных материалов имеет место при ферментации с другими бактериями, проводили сравнение содержаний катехина, эпикатехина, агликона димера проантоцианидина, агликона тримера проантоцианидина агликона тетрамера проантоцианидина, 3,4-дигидроксифенилпропионовой кислоты, L-(-)-3-фенилмолочной кислоты, протокатеховой кислоты и цианидин-3-галактозида/цианидин-3-глюкозида в ягодах черники до и после ферментации Lactobacillus plantarum HEAL 19, Lactobacillus plantarum 299v или Pediococcus acidilactici.
Результаты этого исследования можно видеть на фиг.7, показывающей, что модификация полифенолсодержащих растительных материалов имеет место после ферментации со всеми тестируемыми бактериями, т.е. Lactobacillus plantarum HEAL 19, Lactobacillus plantarum 299v или Pediococcus acidilactici.
Изобретение относится к фармацевтической промышленности, в частности к продукту, снижающему инсулиновый ответ. Способ получения продукта, снижающего инсулиновый ответ, включает смешивание по меньшей мере одного полифенолсодержащего растительного материала, выбранного из группы, состоящей из фруктов, овощей, ягод, чая, зеленого чая, кофе, какао, шоколада и коры и по меньшей мере одного водного, годного для пищи растворителя для обеспечения смеси; нагревание этой смеси; добавление по меньшей мере одного штамма молочнокислых бактерий, выбранного из Lactobacillus plantarum, и необязательно по меньшей мере одного источника белка, выбранного из группы, содержащей пептоны, триптоны, экстракты дрожжей и их комбинации, к этой нагретой смеси для обеспечения ферментационной смеси; и подвержение этой ферментационной смеси условиям, подходящим для ферментации для обеспечения продукта, снижающего инсулиновый ответ; и необязательную элиминацию штамма Lactobacillus plantarum. Применение снижающего инсулиновый ответ продукта для изготовления композиции для предупреждения или лечения диабета, метаболического синдрома, ожирения и сердечно-сосудистых заболеваний. Продукт, полученный вышеописанным способом, эффективно снижает инсулиновый ответ. 2 н. и 11 з.п. ф-лы, 7 ил., 11 табл.
1. Способ получения продукта, снижающего инсулиновый ответ, включающий:
a) смешивание по меньшей мере одного полифенолсодержащего растительного материала, выбранного из группы, состоящей из фруктов, овощей, ягод, чая, зеленого чая, кофе, какао, шоколада и коры и по меньшей мере одного водного годного для пищи растворителя для обеспечения смеси;
b) нагревание этой смеси для элиминации присутствующих бактериальных видов для получения нагретой смеси;
c) добавление по меньшей мере одного штамма молочнокислых бактерий, выбранного из Lactobacillus plantarum, и необязательно по меньшей мере одного источника белка, выбранного из группы, содержащей пептоны, триптоны, экстракты дрожжей и их комбинации, в произвольном порядке или одновременно, к этой нагретой смеси для обеспечения ферментационной смеси; и
d) подвержение этой ферментационной смеси условиям, подходящим для ферментации этой ферментационной смеси для обеспечения продукта, снижающего инсулиновый ответ; и
е) необязательную элиминацию штамма Lactobacillus plantarum для обеспечения продукта, снижающего инсулиновый ответ, не содержащего живых молочнокислых бактерий.
2. Способ по п.1, где этот по меньшей мере один штамм Lactobacillus plantarum добавляют в количестве приблизительно 105-109 кое/мл смеси.
3. Способ по любому из пп.1 или 2, в котором этот по меньшей мере один белок добавляют в количестве 0,0001-0,1 мас.% от массы смеси.
4. Способ по любому из пп.1 или 2, в котором Lactobacillus plantarum выбран из группы, содержащей Lactobacillus plantarum 299, DSM 6595, Lactobacillus plantarum 299v, DSM 9843, Lactobacillus plantarum HEAL 9, DSM 15312, Lactobacillus plantarum HEAL 19, DSM 15313 и Lactobacillus plantarum HEAL 99, DSM 15316.
5. Способ по любому из пп.1 или 2, где условиями ферментации являются ферментация при температуре 30-50°С, в жидкой среде при атмосферном давлении.
6. Способ по любому из пп.1 или 2, где ферментация протекает, пока не достигается величина рН<5, предпочтительно <4.
7. Способ по любому из пп.1 или 2, где элиминация штамма Lactobacillus plantarum происходит при нагревании, ультрафиолетовом излучении, гамма-излучении, давлении, электрическом токе, электрическом разряде, импульсных электрических полях, стерильном фильтровании или электрическом шоке.
8. Способ по п.1, где фрукты и ягоды выбраны из группы, состоящей из черники, брусники, клюквы, яблок, бананов, черной смородины, земляники, малины, шиповника, винограда, цитруса, черноплодной рябины, японской айвы, терна, шиповника и бузины, ягод каперсов, маслин или других плодов, богатых полифенолами.
9. Способ по п.1, где кора является корой коричного дерева.
10. Применение снижающего инсулиновый ответ продукта по любому из пп.1-9, для изготовления композиции для предупреждения или лечения диабета, метаболического синдрома, ожирения и сердечно-сосудистых заболеваний.
11. Применение по п.10, где указанная композиция является фармацевтической композицией или пищевой композицией.
12. Применение по п.11, где пищевая композиция является пищевым продуктом или пищевой добавкой.
13. Применение по п.12, где указанный пищевой продукт выбран из группы, состоящей из разных видов хлеба, сыров, йогуртов, соков, диетических напитков, диетических брикетов, паст, печенья и зерновых продуктов.
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИКАРБИНОЛА | 0 |
|
SU238165A1 |
| JP 2005278517, 13.10.2005 | |||
| WO 2004101770 А1, 25.11.2004 | |||
| Naruszewicz M | |||
| et all | |||
| АВТОМАТ ДЛЯ ПУСКА В ХОД ПОРШНЕВОЙ МАШИНЫ | 1920 |
|
SU299A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2012-10-10—Публикация
2008-06-05—Подача