ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение направлено на разработку способов лечения рака, резистентного к лекарственным препаратам. В частности, настоящее изобретение направлено на разработку способов лечения BcrAbl-положительной лейкемии, резистентной к иматинибу.
УРОВЕНЬ ТЕХНИКИ
[0002] Иматиниб, коммерчески доступный под торговыми марками Gleevac и Glivec, возможно, изменил лечение хронического миелолейкоза, помог многим пациентам практически на 90% достичь пятилетнюю ремиссию заболевания. У группы пациентов, принимающих иматиниб, коммерчески доступный под торговыми марками Gleevac и Glivec, вырабатывается резистентность к препарату, зачастую в связи с наличием мутаций гена bcrabl в тирозинкиназе. Лечение иматинибом позволило пациентам с хроническим миелоцитарным лейкозом (ХМЛ) ощутить 90% пятилетнюю ремиссию заболевания в связи с тем, что препарат блокирует тирозинкиназную активность белка Bcr-Abl-аномального белка, приводящего к перепроизводству аномальных белых кровяных телец, характерных для лейкемии. Однако многие пациенты постепенно выработали резистентность к данной терапии, потому что раковые клетки способны мутировать и адаптироваться, что вызывает рецидив болезни.
[0003] Аберрантно активированная тирозинкиназа BcrAbl (продукт bcrabl гена и хромосомы Филадельфия) считается причиной хронической миелобластной лейкемии и острой лимфобластной лейкемии. Значительная активность тирозинкиназы BcrAbl ускоряет распространение и выживаемость клеток хронической миелобластной лейкемии (ХМЛ). Ингибирование активности тирозинкиназы BcrAbl или сигнальных белков, активированных геном BcrAbl в клетках ХМЛ, блокирует распространение и провоцирует естественную смерть клетки. Селективный ингибитор Abl-киназной активности STI-571 (коммерчески доступный как Gleevec) токсичен для клеток ХМЛ, что приводит к регрессии опухолей, вызванных ХМЛ, у белых мышей, и в данное время используется для лечения пациентов с ХМЛ. Экспрессия BcrAbl в кроветворных стволовых клетках ускоряет трансформацию и начинает участвовать в кроветворении на ранних стадиях. Ингибирование данной киназы с помощью STI-571 эффективно контролирует развитие ХМЛ в хронической фазе заболевания, но и в острой фазе пациенты зачастую чувствуют улучшение при лечении STI-571. Модели STI-571 резистентности in vitro и клинические образцы, полученные от резистентных пациентов показали, что гиперэкспрессия других киназ или активация отдельных сигнальных путей связана с независимостью BcrAbl. Ингибированпе тирозинкиназной активности BcrAbl является эффективной стратегией, нацеленной на уничтожение ХМЛ, как показала клиническая эффективность STI-571. Другие молекулы, включающие семейство киназ Src, участвуют в передаче сигнала от BcrAbl, и, таким образом, являются потенциальными терапевтическими мишенями для лечения болезни, устойчивой к действию STI-571. Показано, что киназы семейства Src, которые включают Lyn и Hck, участвуют в передаче сигнала от BcrAbl.
[0004] Несмотря на то что селективный ингибитор Abl-киназной активности STI-571 является действенным и хорошо переносится большинством пациентов в хронической стадии ХМЛ, пациенты, находящиеся на стадии фазы акселерации или фазы бластного криза, обычно в меньшей степени подвергаются его воздействию. Следовательно, возникает потребность в альтернативных препаратах, эффективных на поздних стадиях заболевания. Частота точечных мутаций bcrabl в раковых клетках у ХМЛ пациентов возросла от 42 до 90% (Hochhaus et al. Leukemia 2004 Vol 2. (2), August 2002, pp.117-125). Иматиниб одобрен в качестве первостепенной терапии для пациентов со впервые выявленным диагнозом ХМЛ. Однако устойчивость к иматинибу в связи с точечными мутациями в гене bcr/abl признана препятствием в лечении пациентов с ХМЛ (Gore, Science 2001; 293(5531):876-880 and Lecoutre, Blood 2000; 95(5): 1758-66).
[0005] Исследования, проведенные Kantarijian et al., см. Engl J Med. 2006 Jun 15; 354(24):2594-6, показали, что нилотиноб не эффективен в борьбе с ХМЛ, если у пациентов присутствует мутация аминокислоты гена BcrAbl T315I N.
[0006] Исследования, проведенные Talpaz et al., см. New England J Med. 2006:354:2531-2541, показали, что дазатиниб в лечении положительной по филадельфийской хромосоме лейкемии, резистентной к иматинибу, также не имел эффективного воздействия против мутации T315I. Эта ссылка также показала, что дазатиниб может вызывать гематологическую токсичность и отек.
[0007] Branford et al. сообщают, что мутации гена BcrAbl у пациентов с ХМЛ практически всегда сопровождаются клинической сопротивляемостью, и мутации в АТП фосфатном мостике связаны с плохим прогнозом (Blood, 1 July 2003, Vol.102, No.1, pp.276-283).
[0008] В патенте США №6297258 показано, что замещенные 3-цианохинолины могут использоваться как антинеопластические агенты, а также в лечении поликистоза почек. В заявке на патент США №20050101780 раскрыты способы предотвращения или ингибирования ХМЛ путем введения пациенту терапевтически активного количества препарата SKI-606.
[0009] В публикации заявки на патент США №20050101780, в частности, описано применение соединения, имеющего следующую структурную формулу
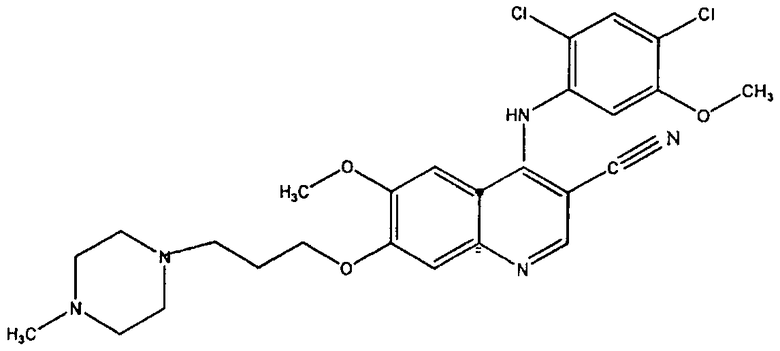
для лечения ХМЛ. Это соединение также известно как босутиниб или SKI-606 и согласно химической номенклатуре называется 4-[(2,4-дихлоро-5-метокси-фенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил.
[0010] Исследования, проведенные Soverini et al., см. J Clin Oncol. 2006 Nov 20; 24(33): e51-2, демонстрируют резистентность пациентов с наличием мутации F317V к действию препарата дазатиниб.
[0011] Исследования, проведенные Puttini et al., см. Cancer Res. 2006; 66(23): Dec 1, 2006, показывают, что SKI-606, новейший ингибитор активности Src-Abl, является эффективным в уменьшении размножения резистентных к иматинибу линий клеток ХМЛ, имеющих определенные мутации, связанные с сопротивляемостью к иматинибу.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
[0012] Было обнаружено, что значительное число пациентов с устойчивостью к иматинибу хорошо отвечают на лечение препаратом SKI-606 (4-[(2,4-дихлоро-5-метокси-фенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил).
[0013] Было также обнаружено, что значительное число пациентов, имеющих известные точечные мутации, связанные с устойчивостью к иматинибу, также обнаруживают положительный отклик на лечение препаратом SKI-606. Таким образом, в одном примере реализации настоящего изобретения, представлен способ лечения субъектов, страдающих BcrAbl-положительной лейкемией, в случае лейкемии, резистентной к препарату иматиниб; при этом указанный способ, включает введение субъекту терапевтически эффективного количества соединения, имеющего следующую формулу:
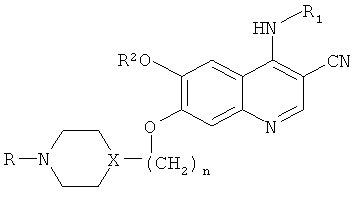
где:
n равно 1, 2 или 3;
X представляет собой N или СН, при условии, что если Х представляет собой N, тогда n равно 2 или 3;
R представляет собой алкил, включающий от 1 до 3 атомов углерода;
R1 выбран из группы, состоящей из 2,4-дихлор-5-метоксифенила; 2,4-дихлорфенила; 3,4,5-триметоксифенила; 2-хлор-5-метоксифенила; 2-метил-5-метоксифенила; 2,4-диметилфенила; 2,4-диметил-5-метоксифенила; и 2,4-дихлор-5-этоксифенила; и
R2 представляет собой алкил, состоящий из 1 или 2 атомов углерода;
или его фармацевтически приемлемую соль.
[0014] Согласно одному примеру реализации настоящего изобретения способ включает лечение субъекта, больного лейкемией; при этом в некоторых примерах реализации настоящего изобретения лейкемия может представлять собой хроническую миелобластную лейкемию (ХМЛ) и острую лимфобластную лейкемию (ОЛЛ).
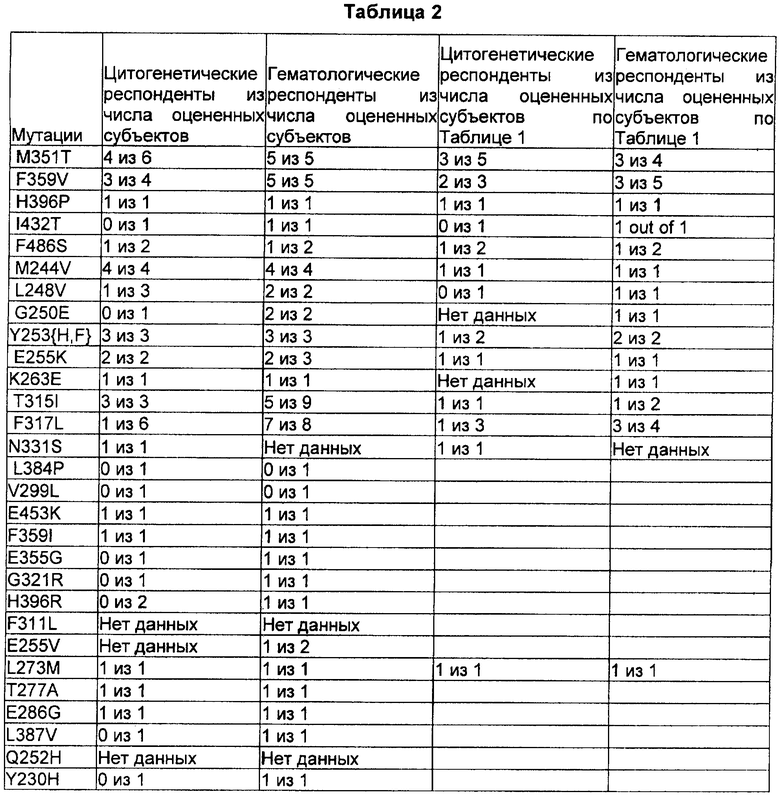
[0015] Согласно некоторым примерам реализации настоящего изобретения настоящее изобретение обеспечивает способ лечения лейкемии в случаях, когда субъекты, резистентные к иматинибу, имеют одну или несколько мутаций нуклеиновой кислоты гена bcrabl gene, выбранных из группы, состоящей из: 1052T>C; 1075T>G; 1187A>C; 1295T>C; 1457T>C; 730A>G; 742C>S; 749G>A; 757T>C; 758A>T; 763G>A; 787A>G; 817T>A; 944C>T; 944C>T; 949T>C; и 992A>G.
[0016] В некоторых вариантах реализации, настоящее изобретение обеспечивает способ лечения лейкемии в случаях, когда субъекты, резистентные к иматинибу, характеризуются одной или несколькими мутациями аминокислоты bcrabl, выбранными из группы, состоящей из: M351T; F359V; H396P; I432T; F486S; M244V; L248V; G250E; Y253H; Y253F; E255K; K263E; L273M; T315I; F317L; и N331S.
[0017] В одном из примеров реализации настоящего изобретения соединения согласно настоящему изобретению назначаются в интервале концентраций от 100 до примерно 1000 мг, в интервале от 200 до около 800 мг, от 300 до 700 мг, от 400 до 600 мг и других интервалах или пропорциях, заключающихся в рамках этих диапазонов. В одном из примеров реализации настоящего изобретения соединения вводили в концентрациях, лежащих в интервале от 400 до 600 мг в день. В еще одном примере реализации настоящее изобретения, соединения вводили в концентрации около 500 мг в день.
[0018] В другом примере реализации настоящего изобретения изобретение обеспечивает способ лечения субъекта больного BcrAbl-положительной лейкемией, в случае, если лейкемия резистентна к лечению иматинибом; способ, включающий введение пациенту терапевтически эффективного количества соединения, имеющего следующую формулу:
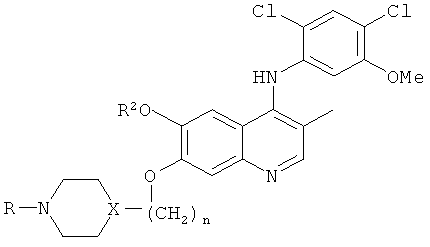
где:
X представляет собой N или CH;
n равно 3;
R2 и R представляют собой метил;
или фармацевтически приемлемой соли вышеуказанного соединения.
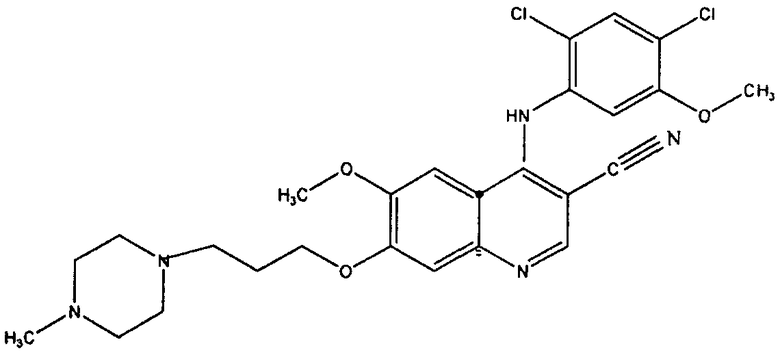
[0019] Согласно одному примеру реализации изобретение обеспечивает способ лечения субъекта больного BcrAbl-положительной лейкемией, в случае, если лейкемия резистентна к лечению иматинибом; способ включающий введение пациенту терапевтически эффективного количества соединения, имеющего следующую формулу:
[0020] Согласно другому примеру реализации настоящего изобретения предложено использовать соединение, имеющее следующую формулу:
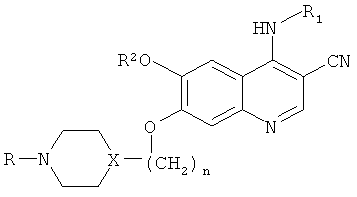
где:
n равно 1, 2 или 3;
X представляет собой N или CH, при условии, что если X представляет собой N, то n равно 2 или 3;
R представляет собой алкил, включающий от 1 до 3 атомов углерода;
R1 выбран из группы, включающей 2,4-дихлор-5-метоксифенил; 2,4-дихлорфенил; 3,4,5-триметоксифенил; 2-хлор-5-метоксифенил; 2-метил-5-метоксифенил; 2,4-диметилфенил; 2,4-диметил-5-метоксифенил; и 2,4-дихлор-5-этоксифенил;
R2 представляет собой алкил, включающий от 1 до 2 атомов углерода;
или его фармацевтически приемлемую соль;
в производстве медикамента для лечения рака, резистентного к иматинибу.
[0021] Согласно другому примеру реализации настоящего изобретения предложено использование соединения, характеризующегося формулой:
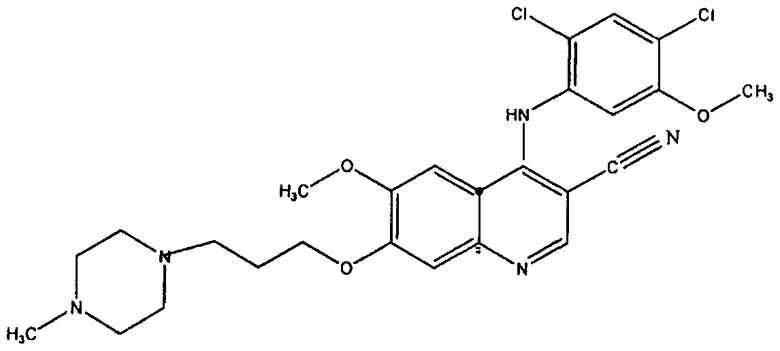
или его фармацевтически приемлемой соли;
для производства медикамента для лечения резистентной к иматинибу лейкемии. Соединение также известно как SKI-606 или босутиниб и согласно химической номенклатуре называется 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0022] На фигуре 1 показаны обобщенные отклики гематологических и цитологических реакций на терапию препаратом SKI-606.
[0023] На фигуре 2 показаны уровни экспрессии гена bcrabl.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Основные методики
[0024] Автоматизированный клинический анализ крови, анализ определения лейкоцитарной формулы (с ручным подтверждением отклонений), морфологический анализ костного мозга и цитогенетические эксперименты используются для определения отклика на терапию.
[0025] Морфологический анализ костного мозга используется для установления количества бластных и незрелых клеток миелоцитов с целью определения стадии развития заболевания.
[0026] Стандартные цитогенетические эксперименты используются для определения присутствия филадельфийской хромосомы и ее процентного содержания в костном мозге. Двадцать или более метафаз необходимо подсчитать для данного определения. Анализ методом флуоресцентной гибридизации на хромосомах in situ (FISH) может использоваться для подтверждения присутствия продукта слияния гена BcrAbl.
[0027] Обратная транскрипция цепной полимеразной реакции (RT-PCR) для числа копий BcrAbl выполняется с использованием периферической крови.
[0028] Термин «BcrAbl-положительная лейкемия», используемый в данной заявке, относится к разновидности лейкемии, которая связана с экспрессией гена bcrabl.
[0029] Цитогенетический ответ на терапию. Используемый в данном описании термин «цитогенетический ответ на терапию» означает относительное исчезновение филадельфийской хромосомы у субъектов, что определяется оценкой процентного содержания в клетках присутствующей положительной филадельфийской хромосомы. Ответ может быть минимальным, малым, частичным или полным. «Отрицательный» цитогенетический ответ составляет примерно 95,5% клеток, положительных по филадельфийской хромосоме после терапии. «Минимальный» ответ указывает на примерно 66-95% клеток, положительных по филадельфийской хромосоме. «Малый» цитогенетический ответ указывает на 36-65% клеток, положительных по филадельфийской хромосоме. «Частичный» ответ указывает на 1-35%, клеток положительных по филадельфийской хромосоме. «Полный» ответ указывает на 0% клеток, положительных по филадельфийской хромосоме. Приведенные значения процентных соотношений основываются на анализе 20 метафаз (на один субъект). Анализ флуоресцентной гибридизации in situ (FISH) может использоваться для квалификации откликов даже в случае присутствия незначительного количества метафаз.
[0030] Гематологический ответ на терапию. Используемый в данном описании термин «Гематологический ответ на терапию» указывает на элиминирование наблюдаемых под микроскопом клеток лейкемии в крови.
[0031] Соединения согласно настоящему изобретению могут использоваться для лечения, предотвращения или ингибирования лейкемии, резистентной к иматинибу. В предпочтительном примере реализации настоящего изобретения соединения используются в качестве фармацевтического препарата.
[0032] Фармацевтически приемлемыми солями считаются соли, которые являются производными следующих органических и неорганических кислот: уксусная, молочная, карбоксильная, лимонная, коричная, винная, янтарная, фумаровая, малеиновая, малоновая, миндальная, яблочная, щавелевая, пропионовая, хлористоводородная, бромистоводородная, фосфорная, азотная, серная, гликолевая, пировиноградная, метансульфоновая, этансульфоновая, толуолсульфоновая, салициловая, бензойная, а также подобные допустимые кислоты.
[0033] Термин «алкил» относится к радикалу насыщенных алифатических углеводородов, включающих разветвленные и неразветвленные цепи алкильных групп, циклоалкильные (ациклические) группы, алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. Согласно предпочтительному примеру реализации настоящего изобретения разветвленные и неразветвленные цепи алкила должны иметь 3 или менее атомов углерода в скелете.
[0034] Соединения могут доставляться перорально, с помощью подкожной, интраперитониальной, внутримышечной, внутривенной инъекций; инфузии; липосомной иммобилизации; местно, назально, анально, вагинально, сублингвально, уретрально, трансдермально, интратекально, введением через глаз или ухо. С целью получения постоянной концентрации при обеспечении соединения согласно настоящему изобретению предпочтительно нахождение указанного соединения в форме индивидуальной дозы.
[0035] Подходящие единичные дозированные формы включают таблетки, капсулы, порошки в индивидуальных пакетах или пузырьках. Такие единичные дозированные формы могут содержать от 0,1 до 1000 мг, предпочтительно от 400 до 600 мг вышеописанного соединения для лечения лейкемии резистентной к иматинибу.
Согласно другому примеру реализации настоящего изобретения единичные дозированные формы содержат 500 мг соединения согласно настоящему изобретению.
[0036] Согласно одному примеру реализации настоящего изобретения ежедневная доза составлет от 400 до 600 мг. Согласно еще одному примеру реализации настоящего изобретения соединения могут быть введены в виде единичных дозированных форм, содержащих 500 мг соединения.
[0037] Соединения настоящего изобретения могут быть введены перорально. Препараты могут быть введены от 1 до 6 раз в день, обычно от 1 до 4 раз в день. Специалистам в данной области техники известно эффективное количество соединения; оно также зависит от конкретного соединения. Для специалистов в данной области техники не составит труда провести эмпирические испытания активности, чтобы определить биологическую активность препарата и его биодоступность и, таким образом, определить величину дозы для введения.
[0038] Составы настоящего изобретения могут быть изготовлены с применением таких традиционных эксципиентов, как наполнители, распадающиеся вещества, связующие вещества, лубриканты, вкусовые добавки, красители или носители, выполняющие транспортную функцию. Транспортную функцию может выполнять разбавитель, аэрозоль, местный носитель, водный раствор, неводный раствор или твердый носитель. Носителем может быть полимер или зубная паста. Носитель в настоящем изобретении включает любой из стандартных фармацевтически приемлемых носителей, таких как: забуференный фосфатом физиологический раствор, забуференный ацетатом физиологический раствор, вода, такие эмульсии, как водно-масляная эмульсия или эмульсия триглицерида, различные виды смачивающих реагентов, таблетки, таблетки, покрытые оболочкой, и капсулы.
[0039] При пероральном или местном способе доставки данные препараты доставляются в организм с помощью различных носителей. Обычно такие носители содержат добавки: крахмал, молоко, сахар, определенные виды глины, желатин, стеариновую кислоту, тальк, растительные жиры или масла, камедь или гликоли. Необходимо, чтобы специфичный носитель был выбран на основе желательного способа доставки, например физиологический раствор в фосфатном буферном растворе может использоваться для внутривенного или системного введения, тогда как растительные жиры, кремы, бальзамы, мази или гели могут использоваться для местного применения.
[0040] Соединения настоящего изобретения могут вводиться совместно с подходящими разбавителями, консервантами, эмульгаторами, вспомогательными веществами и/или носителями, использующимися в лечении или профилактике неоплазмы. Такими веществами являются жидкости или лиофилизированные или другим способом осушенные системы, которые включают растворители с различными буферными добавками (например, Tris-HCl, ацетат, фосфат), рН и ионной силы; такие добавки, как альбумин или желатин для предотвращения поверхностной адсорбции, детергенты (например, TWEEN 20, TWEEN 80, PLURONIC F68, соли желчной кислоты), растворители (например, глицерин, полиэтиленгликоль), антиоксиданты (например, аскорбиновая кислота, метабисульфат натрия), консерванты (например, тимерозал, бензиловый спирт, парабены), объемдобавляющие вещества или тонусные модификаторы (например, лактоза, маннитол), ковалентные фрагменты таких полимеров, как полиэтиленгликоль, комплексы с ионами металлов или включение соединения внутрь или на поверхность определенных препаратов гидрогелей или липосом, микроэмульсий, мицелл, однослойных или многослойных везикул, эритроцитов или сферобластов. Такие соединения влияют на физическое состояние, растворимость, стабильность, скорость in vivo высвобождения и скорость in vivo клиренса соединения или состава. Выбор состава зависит от физических и химических свойств соединения, предназначенного для лечения и профилактики новообразований.
[0041] Соединение настоящего изобретения может доставляться локально с помощью капсулы, что обеспечивает продолжительное высвобождение вещества через определенный промежуток времени. Композиции для контролируемого или продолжительного высвобождения включают составы в липофильных депо (например, жирные кислоты, воски, масла).
[0042] Настоящее изобретение дополнительно обеспечивает использование соединения согласно настоящему изобретению в качестве терапевтического вещества для лечения, профилактики или ингибирования ХМЛ.
[0043] Настоящее изобретение дополнительно обеспечивает способ лечения ХМЛ у человека, который включает введение инфицированному индивиду эффективного количества соединения или фармацевтической композиции настоящего изобретения. Доза, которая предусматривается для пациента, варьируется в зависимости от конкретного вводимого соединения, от цели введения, способа введения и подобных условий. «Терапевтически эффективное количество» означает достаточное количество для лечения или улучшения симптомов ХМЛ.
[0044] Соединения настоящего изобретения можно вводить индивидуально или в комбинации с другими препаратами для лечения ХМЛ. Такие препараты включают, но не ограничены указанными, GLEEVEC, гидроксимочевину, IFN-alpha, цитотоксические вещества, 17-(аллиламино)-17-деметоксигелдамицин или его производные, вортманнин.
[0045] Соединения настоящего изобретения были получены из (а) коммерчески доступных исходных реагентов, (б) известных доступных реагентов, которые могут быть получены способами, описанными в литературе, или (в) новых промежуточных соединений, описанных в схемах и экспериментальных методиках настоящей заявки. Соединения, которые включает настоящее изобретение, могут быть получены способами, раскрытыми в патентах США №6,002,008 и №6,780,996, включенными в данную заявку посредством ссылки.
[0046] Реакции были выполнены в подходящем для реагентов растворителе, с использованием материалов, пригодных для проведения необходимых преобразований. Специалисту в области органического синтеза понятно, что различные функциональные группы, которые присутствуют в молекуле, должны быть устойчивыми к предполагаемым химическим превращениям. При отсутствии точных указаний, последовательность операции синтеза, выбор защитных групп и условий снятия защиты будут очевидными для специалистов в данной области. Кроме того, в некоторых случаях, заместители на исходных реагентах могут быть несовместимыми с определенными условиями реакции. Ограничения, относящиеся к данным заместителям, очевидны для специалистов в данной области. По мере необходимости реакции проводили в инертной среде.
[0047] Приготовление соединений формулы 1 проводили согласно литературным источникам [Boschelli, D.H., et. al., J. Med. Chem., 44, 3965 (2001)], Boschelli, D.H., et al., J Med. Chem., 44, 822 (2001), Boschelli, D.H., et al., Bioorg. Med. Chem. Lett., 13, 3797 (2003), Boschelli, D.H., et. al., J. Med. Chem., 47, 1599 (2004), and Ye, F. et. al., 221th National Meeting of the American Chemical Society, San Diego, Calif. (April, 2001)].
[0048] Настоящее изобретение дополнительно обеспечивает соединение настоящего изобретения для использования в качестве активного терапевтического вещества для лечения, профилактики или ингибирования ХМЛ у пациентов, у которых не было положительного ответа на терапию иматинибом.
[0049]Настоящее изобретение дополнительно обеспечивает способ лечения ХМЛ у пациентов, которые не показали отклика на лечение иматинибом, который включает введение инфицированному индивиду эффективного количества соединения или фармацевтической композиции, которая представляет собой замещенный 3-цианохинолин. В одном примере реализации настоящего изобретения замещенный 3-цианохинолин известен как SK606 (также известный как SKI-606 или босутиниб). Химическое название этого соединения:
4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил. Вводимая пациенту доза варьируется в зависимости от того, какой конкретно препарат вводят, от цели введения, способа введения и подобных условий. «Терапевтически эффективное количество» - это количество, достаточное для лечения или улучшения симптомов ХМЛ. В одном примере настоящего изобретения способ лечения BcrAbl-положительной лейкемии у субъектов, резистентных к иматинибу, включает введение субъекту терапевтически эффективного количества 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрила в случае, если субъект имеет хотя бы одну из перечисленных мутации гена BcrAbl: M351T; F359V; H396P; I432T; F486S; M244V; L248V; G250E; Y253H; Y253F; E255K; K263E; L273M; T315I; F317L; и N331S.
[0050] Соединения настоящего изобретения можно вводить индивидуально или в комбинации с другими препаратами для лечения ХМЛ. Такие препараты включают, но не ограничиваются указанными, GLEEVEC, гидроксимочевину, IFN-alpha, цитотоксические вещества, 17-(аллиламино)-17-деметоксигелдамицин или его производные, вортманнин.
[0051] Соединения настоящего изобретения, в частности, как описанные ниже в Примерах 2-23, были получены с помощью: (а) коммерчески доступных исходных реагентов, (б) известных доступных реагентов, которые могут быть получены способами, описанными в литературе, или (в) новых промежуточных соединений, описанных в схемах и экспериментальных методиках настоящей заявки. Соединения, которые включает настоящее изобретение, могут быть получены способами, раскрытыми в патентах США №6,002,008 и №6,780,996, включенными в данную заявку посредством ссылку.
Пример 1
[0052] Известные мутации, которые связаны с резистентностью к иматинибу, расположены в гене bcr/abl, показаны ниже с учетом нуклеотидной позиции и нуклеотидных замен, следующими по убыванию соответственно аминокислотному изменению, показанному по убыванию:
: 1052T>C (M351T); 1075T>K (F359V); 1187A>M (H396P); 1295T>Y (I432T); 1457T>C (F486S); 730A>G (M244V); 742C>S (L248V); 749G>R (G250E); 757T>C (Y253H); 758A>T (Y253F); 763G>R (E255K); 787A>R (K263E); 817T>А (L273M); 944C>T (T315I); 949T>C (F317L); и 992A>G (N331S).
[0053] Пробы аспиратов костного мозга отбирали у субъектов, не показавших положительного ответа на лечение хронической миелобластной лейкемии иматинибом до момента введения им препарата SKI-606. Последовательно изучали исходные данные гена bcr/abl и фиксировали точечные мутации. Затем пациентам вводили препарат SKI 606, что привело к лучшим цитогенетическим и подтвержденным гематологическим откликам. Вводимые дозы, в среднем, варьировались от 400 до 600 мг в день одному пациенту. Было подтверждено, что лечение препаратом SKI-606 дало положительные цитогенетические или гематологические результаты у пациентов, имевших хотя бы одну из девятнадцати уникальных точечных мутации гена bcr/abl. Эти точечные мутации связаны с резистентностью к лечению препаратом иматиниб. Время лечения варьировалось от недели до более чем одного года.
[0054] Результаты лечения пациентов, резистентных к иматинибу, у которых были известные связанные с резистентностью мутации, представлены в Таблице 1. Все 66 пациентов, резистентных к иматинибу, получали лечение препаратом SKI-606 в течение промежутка времени от недели до более чем одного года для каждого пациента. Из 66 пациентов 42 пациента имели одну или более известных мутаций, связанных с резистентностью к иматинибу. Более того, пациенты, не имеющие мутаций, связанных с резистентностью, также показывали положительный ответ на терапию.
[0055] Последующие дополнительные примеры от 2 до 23 го описывают соединения, используемые в способах изобретения, которые получают с помощью: (а) коммерчески доступных исходных реагентов, (б) известных доступных реагентов, которые могут быть получены способами, описанными в литературе, или (в) новых промежуточных соединений, описанных в схемах и экспериментальных методиках настоящей заявки. Соединения, которые включает настоящее изобретение, могут быть получены способами, раскрытыми в патентах США №6,002,008 и №6,780,996, включенными в данную заявку посредством ссылки.
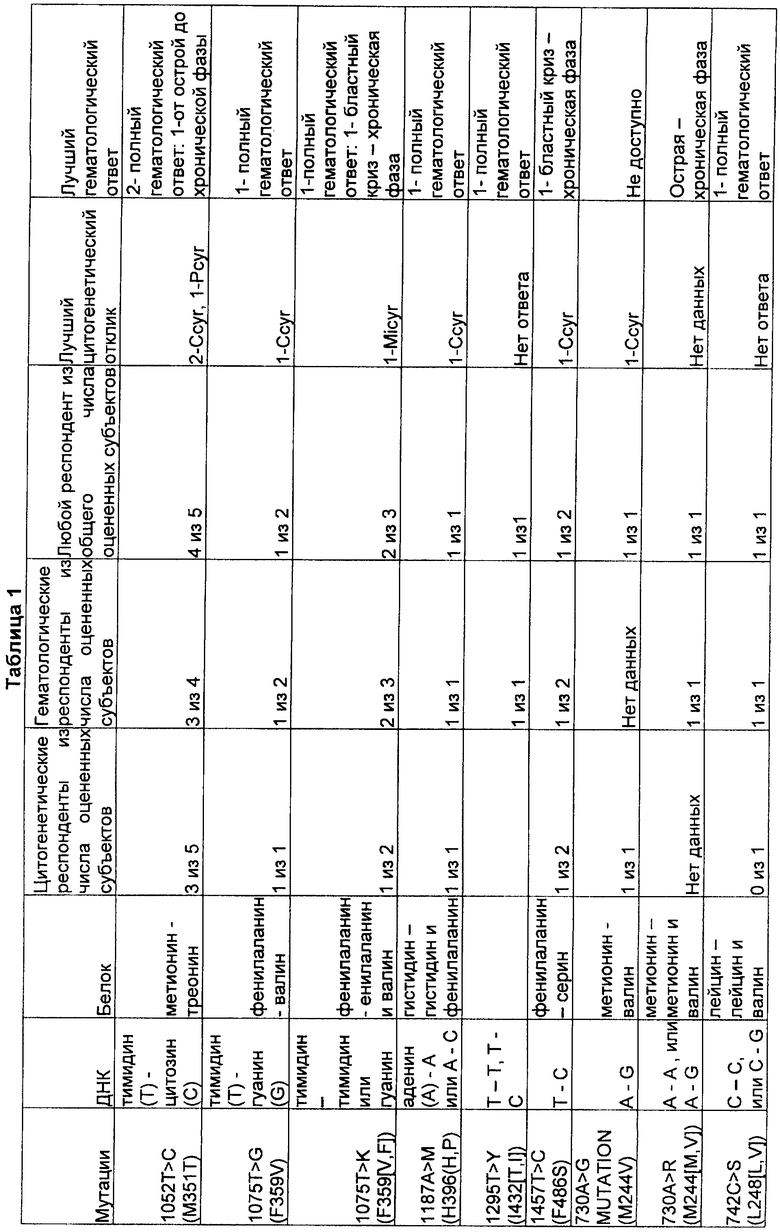
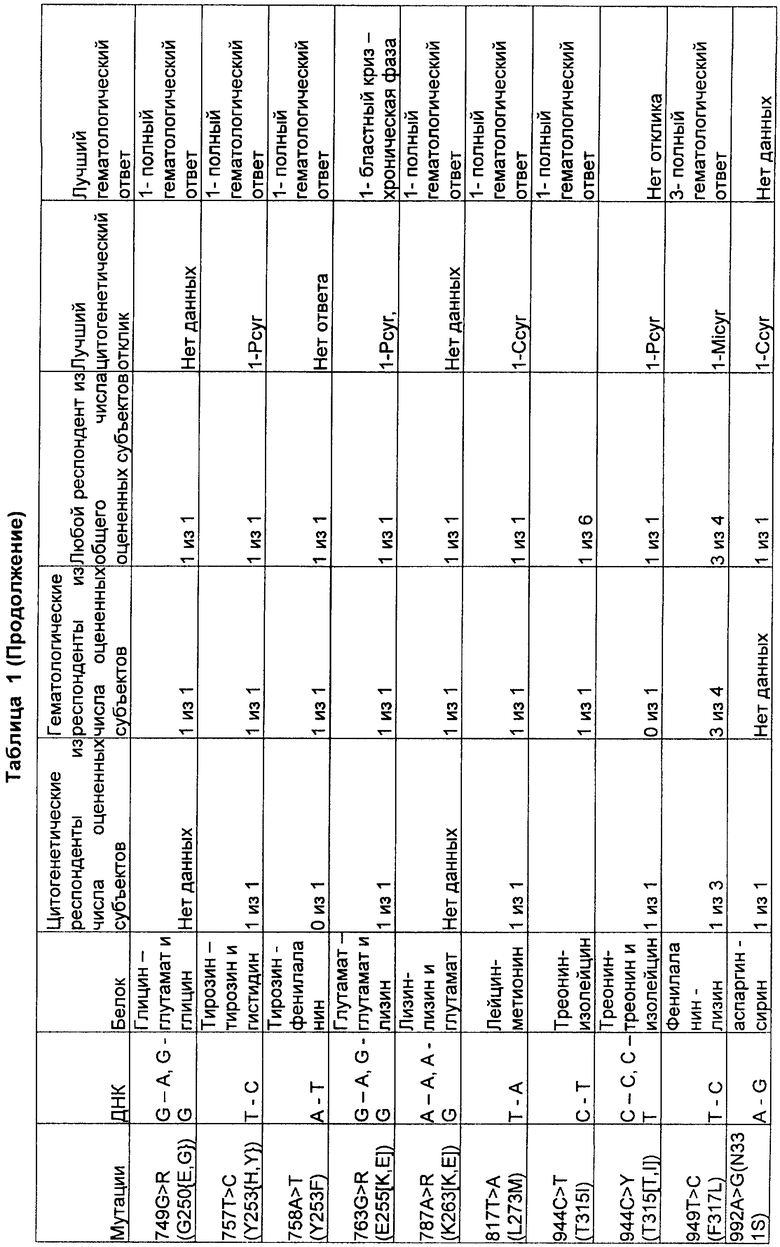
Ccyr = полный цитогенетический ответ
Pcyr = частичный цитогенетический ответ
MiCyr = минимальный цитогенетический ответ
Пример 2
[0056] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил. Тпл 116-120°С; MS (ES) m/z 530.2, 532.2 (М+1);
Пример 3
[0057] 4-[(2,4-дихлор-5-метоксифенил)амино]-7-[3-(4-этил-1-пиперазинил)пропокси]-6-метокси-3-хинолинкарбонитрил; Тпл 102-104°С; MS (ES) m/z 544.3, 546.4 (М+1);
Пример 4
[0058] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[2-(4-метил-1-пиперазинил)этокси]-3-хинолинкарбонитрил, Тпл 165-167°С; MS (ES) m/z 516.0, 518.2 (М+1);
Пример 5
[0059] 4-[(2,4-дихлор-5-метоксифенил)амино]-7-[2-(4-этил-1-пиперазинил)этокси-]-6-метокси-3-хинолинкарбонитрил, Тпл 101-105°С; MS (ES) m/z 530.4, 532.4 (М+1);
Пример 6
[0060] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]-3-хинолинкарбонитрил, Тпл 200-202°С, MS 501.3 (М+Н)+, анализ для C25H26Cl2N4O3-0.8H2O, рассчитано: С, 58.21; Н, 5.39; N, 10.86, найдено: C, 58.19; Н, 5.23; N, 10.67;
Пример 7
[0061] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[2-(1-метилпиперидин-4-ил)этокси]-3-хинолинкарбонитрил, Тпл 190-191°С, MS 515.19 (М+Н)+, анализ для C26H28Cl2N4O3-1.0 H2O, рассчитано: C, 58.53; H, 5.67; N, 10.50, найдено: C, 58.65; H, 5.57; N, 10.34
Пример 8
[0062] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(1-метилпиперидин-4-ил)пропокси]хинолин-3-карбонитрил, Тпл 144-145°С; Mass spec. 529.2 (ES+);
Пример 9
[0063] 4-[(2,4-дихлор-5-метоксифенил)амино]-7-[(1-этилпиперидин-4-ил)метокси]-6-метоксихинолин-3-карбонитрил, Тпл 192-195°С; Mass spec. 515.2 (ES+);
Пример 10
[0064] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-[3-(4-метилпиперазин-1-ил)пропокси]хинолин-3-карбонитрил, Тпл 137-138°С, MS 542.0 (M-H)-, анализ для C27H31Cl2N5O3-0.6 H2O, рассчитано: C, 58.40; H, 5.84; M, 12.61, найдено: C, 58.31; H, 5.71; N, 12.43;
Пример 11
[0065] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил, Тпл 182-186°С, MS 513.0 (M-H)-, анализ для C26H28Cl2N4O3-1.4 H2O, рассчитано: C, 57.76; H, 5.74; N, 10.36, найдено: C, 57.65; H, 5.43; N, 10.15;
Пример 12
[0066] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-[3-(4-этилпиперазин-1-ил)пропокси]хинолин-3-карбонитрил, Тпл 127-130°С, MS 558.3 (М+Н)+, анализ для C28H33Cl2N5O3-1.5 H2O, рассчитано: C, 57.44; H, 6.20; N, 11.96, найдено: C, 57.44; H, 6.24; N, 11.79;
Пример 13
[0067] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-[3-(1 -метилпиперидин-4-ил)пропокси]хинолин-3-карбонитрил, Тпл 148-151°С, 543.2 (M+H)+, анализ для C28H32Cl2N4O3-1.8 H2O, рассчитано: C, 58.39; H, 6.23; N, 9.73, найдено: C, 58.40; H, 6.16; N, 9.64;
Пример 14
[0068] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-[2-(4-метил-1-пиперазинил)этокси]хинолин-3-карбонитрил, Tпл 141-143°С, MS 530.2 (М+Н)+, анализ для C26H29Cl2N5O3, рассчитано: C, 58.87; H, 5.51; N, 13.20, найдено: C, 58.48; H, 5.45; N, 12.95;
Пример 15
[0069] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-этокси-7-[2-(1-метилпиперидин-4-ил)этокси]хинолин-3-карбонитрил, Тпл 174-176°С, MS 529.1 (М+Н)+, анализ для C27H30Cl2N4O3, рассчитано: C, 61.25; H, 5.71; N, 10.58, найдено: C, 61.40; H, 5.84; N, 10.35;
Пример 16
[0070] 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-пропил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил, Тпл 1°С; MS (ES) m/z 558.2, 560.2 (M+1);
Пример 17
[0071] 4-[(2,4-дихлорфенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси-]-3-хинолинкарбонитрил, Тпл 224-225°С, MS 469.0 (ES-);
Пример 18
[0072] 6-метокси-7-[(1-метилпиперидин-4-ил)метокси]-4-[(3,4,5-триметоксифенил)амино]хинолин-3-карбонитрил, Тпл>245°С; HRMS (М+Н)+ рассчитано 493.24455, найдено 493.24311;
Пример 19
[0073] 4-[(2-хлор-5-метоксифенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил, Тпл 106-108°С, MS 467.2 (ES+);
Пример 20
[0074] 6-метокси-4-[(5-метокси-2-метилфенил)амино]-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил, Тпл>250°С, MS 445.2 (ES-);
Пример 21
[0075] 4-[(2,4-диметилфенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси-]хинолин-3-карбонитрил, Тпл 190-191°С, MS 429.2 (ES-);
Пример 22
[0076] 6-метокси-4-[(5-метокси-2,4-диметилфенил)амино]-7-[(1 -метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил, Тпл 160-162°С, MS 461.3 (ES+);
Пример 23
[0077] 4-[(2,4-дихлор-5-этоксифенил)амино]-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хинолин-3-карбонитрил.
Пример 24
[0078] Группа пациентов, страдающих BcrAbl-положительной лейкемией, резистентной к лечению иматинибом, принимали препарат SKI-606 в течение периода времени от одной недели до более одного года.
[0079] На Фигуре1 показаны гематологический и цитогенетический ответы пациентов в численном (N) и процентном (%) соотношениях и дифференцированы по хронической и острой формами лейкемии.
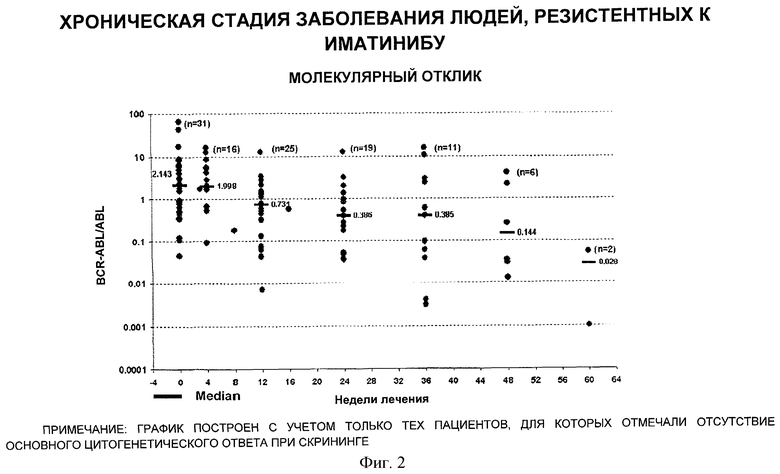
[0080] На Фигуре 2 показана медиана соотношения bcrabl к экспрессии гена abl в хронической фазе иматиниб резистентных пациентов, которые принимали препарат SKI-606.
Пример 25
[0081] Таблица 2 представляет данные исследований, собранные для дополнительных респондентов на мутации, описанные выше в Таблице 1, а также для респондентов и нереспондентов к дополнительным мутациям bcrabl.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 7-ЗАМЕЩЕННОГО-3-ХИНОЛИН И 3-ХИНОЛ-4-ОН КАРБОНИТРИЛОВ | 2003 |
|
RU2309149C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788174C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788163C2 |
| СПОСОБ ОПТИМИЗАЦИИ ЛЕЧЕНИЯ ЛЕЙКОЗА, ПОЛОЖИТЕЛЬНОГО ПО ФИЛАДЕЛЬФИЙСКОЙ ХРОМОСОМЕ, ИНГИБИТОРАМИ Ab1-ТИРОЗИНКИНАЗЫ | 2007 |
|
RU2483732C2 |
| УСТРОЙСТВО И СПОСОБ ВЫДЕЛЕНИЯ ЛЕЙКОЦИТОВ И РАКОВЫХ КЛЕТОК ПУТЕМ ФИЛЬТРОВАНИЯ | 2012 |
|
RU2578848C2 |
| ПРОИЗВОДНОЕ АКРИЛАНИЛИДА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЯ В ФАРМАКОЛОГИИ | 2016 |
|
RU2742372C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ДОЗИРОВКА И СПОСОБ ЛЕЧЕНИЯ Ph+ ЛЕЙКЕМИЙ | 2017 |
|
RU2664420C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-3-ХИНОЛИНКАРБОНИТРИЛОВ | 2004 |
|
RU2345069C2 |
| ПРИМЕНЕНИЕ МИДОСТАУРИНА ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ СТРОМАЛЬНЫХ ОПУХОЛЕЙ | 2005 |
|
RU2410098C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО МИЕЛОЛЕЙКОЗА | 2012 |
|
RU2481583C1 |

Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения BcrAbl-положительной лейкемии у субъекта, резистентного к иматинибу. Для этого пациенту вводят терапевтически эффективное количество 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрила или его фармацевтически приемлемую соль. Использование данных изобретений позволяет обеспечить положительные цитогенетические или гематологические результаты как при лечении BcrAbl-положительной лейкемии, резистентной к иматинибу, так и при отсутствии мутаций, связанных с этой резистентностью. 4 н. и 18 з.п. ф-лы, 2 табл., 2 ил., 25 пр.
1. Способ лечения BcrAbI-положительной лейкемии у субъекта, резистентного к иматинибу, включающий введение пациенту терапевтически эффективного количества соединения, которое представляет собой: 4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил или фармацевтически приемлемой соли, причем лейкемия характеризуется связанной с резистентностью мутацией аминокислоты в белке BcrAbl, выбранной из группы, состоящей из: M351T; F359V; H396P; I432T; F486S; M244V; L248V; G250E; Y253H; К263Е; L273M; F317L; и N331S.
2. Способ по п.1, отличающийся тем, что лейкемия представляет собой хроническую миелобластную лейкемию.
3. Способ по п.1, отличающийся тем, что лейкемия представляет собой острую лимфобластную лейкемию.
4. Способ по п.1, отличающийся тем, что лейкемия характеризуется связанной с резистентностью мутацией нуклеиновой кислоты в гене BcrAbl, выбранной из группы, состоящей из: 1052Т>С; 1075T>G; 1187А>С; 1295Т>С; 1457Т>С; 730A>G; 742C>G; 749G>A; 757Т>С; 787A>G; 817Т>А; 949Т>С; и 992A>G.
5. Способ по любому из пп.1-3, отличающийся тем, что вводимое субъекту соединение является ингибитором Src или ингибитором Abl киназы.
6. Способ по п.1, отличающийся тем, что указанные соединения вводят пациенту в комбинации с одним или несколькими другими соединениями, пригодными для лечения BcrAbl-положительной лейкемии.
7. Способ по п.6, отличающийся тем, что одно или несколько других соединений включают GLEEVEC.
8. Применение соединения по п.1 для приготовления лекарственного препарата для лечения пациента, у которого выявлена BcrAbl-положительная лейкемия, резистентная к действию иматиниба, причем указанная лейкемия характеризуется связанной с резистентностью мутацией аминокислоты в белке BcrAbl, выбранной из группы, состоящей из: М351Т; F359V; Н396Р; I432T; F486S; M244V; L248V; G250E; Y253H; К263Е; L273M; F317L; и N331S.
9. Применение соединения по п.8, отличающееся тем, что лейкемия представляет собой хроническую миелоцитарную лейкемию.
10. Применение по п.8, отличающееся тем, что лейкемия представляет собой острую лимфобластную лейкемию.
11. Применение по любому из пп.9-10, отличающееся тем, что лейкемия характеризуется связанной с резистентностью мутацией нуклеиновой кислоты в гене BcrAbl, выбранной из группы, состоящей из: 1052Т>С; 1075T>G; 1187А>С; 1295Т>С; 1457Т>С; 730A>G); 742C>G; 749G>A; 757Т>С; 787A>G; 817Т>А; 949Т>С; и 992A>G.
12. Применение по любому из пп.9-10, отличающееся тем, что соединение, вводимое пациенту, является ингибитором Src или ингибитором киназной активности Abl.
13. Применение по любому из пп.9-10, отличающееся тем, что указанное соединение используется в комбинации с одним или несколькими другими соединениями в производстве лекарства для лечения BcrAbl-положительной лейкемии.
14. Применение по п.13, отличающееся тем, что одно или более других соединений включают GLEEVEC.
15. Способ лечения BcrAbl-положительной лейкемии у пациентов, имеющих резистентность к иматинибу, включающий введение субъекту терапевтически эффективного количества 4-[(2,4-дихлор-5-метокси-фенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрила, при этом субъект имеет хотя бы одну мутацию белка BcrAbl, выбранную из группы: М351Т; F359V; Н396Р; I432T; F486S; M244V; L248V; G250E; Y253H; К263Е; L273M; F317L; и N331S.
16. Композиция для лечения пациента, у которого выявлена BcrAbI положительная лейкемия, резистентная к действию иматиниба, причем указанная лейкемия характеризуется связанной с резистентностью мутацией аминокислоты в белке BcrAbl, выбранной из группы, состоящей из: М351Т; F359V; Н396Р; I432T; F486S; M244V; L248V; G250E; Y253H; К263Е; L273M; F317L; и N331S, которая содержит терапевтически эффективное количество соединения, которое представляет собой 4-[(2,4-дихлор-5-метокси-фенил)амино]-6-метокси-7-[3-(4-метил-1-пиперазинил)пропокси]-3-хинолинкарбонитрил или фармацевтически приемлемую соль указанного соединения и эксципиент.
17. Композиция по п.16, отличающаяся тем, что лейкемия представляет собой хроническую миелобластную лейкемию.
18. Композиция по п.16, отличающаяся тем, что лейкемия представляет собой острую лимфобластную лейкемию.
19. Композиция по любому из пп.17 и 18, отличающаяся тем, что лейкемия характеризуется связанной с резистентностью мутацией нуклеиновой кислоты в гене BcrAbl, выбранной из группы, состоящей из: 1052Т>С; 1075T>G; 1187А>С; 1295Т>С; 1457Т>С; 730A>G); 742C>G; 749G>A; 757Т>С; 787A>G; 817Т>А; 949Т>С; и 992A>G.
20. Композиция по любому из пп.17 и 18, отличающаяся тем, что соединение, вводимое пациенту, является ингибитором Src или ингибитором киназной активности Abl.
21. Композиция по любому из пп.17 и 18, отличающаяся тем, что указанное соединение используется в комбинации с одним или несколькими другими соединениями в производстве лекарства для лечения BcrAbl-положительной лейкемии.
22. Композиция по п.21, отличающаяся тем, что одно или более других соединений включают GLEEVEC.
| PUTTINI М | |||
| et al | |||
| РАСПРЕДЕЛИТЕЛЬНЫЙ МЕХАНИЗМ ДЛЯ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО ГОРЕНИЯ | 1922 |
|
SU606A1 |
| JABBOUR E | |||
| et al | |||
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| СПОСОБЫ ВВЕДЕНИЯ АНАЛОГОВ ЭПОТИЛОНА ПРИ ЛЕЧЕНИИ РАКА | 2002 |
|
RU2292202C2 |
Авторы
Даты
2012-10-20—Публикация
2008-05-30—Подача