Введение
[001] Настоящее изобретение обеспечивает новые способы лечения и медицинские применения, связанные с лечением эндокринно–резистентного эстроген–рецептор–положительного рака молочной железы. Кроме того, настоящее изобретение обеспечивает комбинации, подходящие для лечения эстроген–рецептор–положительного рака молочной железы.
Предпосылки создания изобретения
[002] Давно было признано, что многие типы рака молочной железы являются гормонозависимыми. Эстроген(oestrogen) (может быть взаимозаменяемо указан как эстроген(estrogen)), в частности, действует как эндокринный фактор роста в значительной части раков молочной железы. Таким образом, лишение таких опухолей эстрогена является основным методом лечения при раке молочной железы.
[003] Наиболее часто диагностируемый рак молочной железы (BC) в клинике является эстрогеновый рецептор(ER)–положительным, и на долю ER–положительного BC приходится более 80% случаев.
[004] Эстроген опосредует свои эффекты, связываясь с ER. ER, связанный с эстрогеном, классически ассоциируется с эстрогеновыми ответными элементами (ERE) на генах–мишенях, контролирующих пролиферацию и выживание клеток. ER имеет два разных домена активации, AF–1 и AF–2. AF–2 является неотъемлемой частью лиганд–связывающего домена и регулируется связыванием эстрогена. Активность AF–1 регулируется фосфорилированием, тогда как AF–2 связывается с коактиваторами семейства p160, контролируя транскрипционный комплекс ER.
[005] Классически, пациентов с ER–позитивной BC лечат эндокринными препаратами, такими как тамоксифен или ингибиторы ароматазы (AI), которые препятствуют передаче сигналов эстрогена.
[006] Хотя более 50% пациентов демонстрируют ответ на эндокринную терапию, у значительной части пациентов возникают рецидивы с de novo или приобретенным резистентным заболеванием, делая это одной из самых серьезных проблем для исследования рака молочной железы (см. обзор Ma et al. 2015). Одной из специфических особенностей эндокринно–резистентного BC является тот факт, что большинство пациентов продолжают экспрессировать ER. На сегодняшний день множественные молекулярные механизмы вовлечены в резистентный фенотип, и все они сходятся на уровне циклина D, стимулируя прогрессию клеточного цикла. Эта высокая степень гетерогенности в адаптивных механизмах в процессе прогрессирования ER–положительного BC подчеркивает важность выявления общих точек пересечения, связанных с неэффективностью терапии.
[007] Поскольку неконтролируемая пролиферация является отличительной чертой рака (см. обзор Hanahan & Weinberg 2011), направленное действие на клеточный цикл с использованием ингибиторов CDK было привлекательным предложением, но до недавнего времени лишь немногие из них показали специфичность, а связанная с ними клиническая токсичность была неприемлемой (Asghar et al. 2015). Ось CDK4/6–RB является критической для входа в клеточный цикл, и неудивительно, что большинство раковых образований разрушают эту ось, промотируя пролиферацию, например, 19% случаев рака молочной железы показывают амплификацию CDK4, тогда как амплификация CCND1 связана с эндокринной резистентностью (см. обзор Musgrove et al. 2011).
[008] Недавно было показано, что комбинация ингибиторов CDK4/6 с эндокринной терапией улучшает клинический результат у пациентов с ER+ раком молочной железы. Однако не все пациенты получат пользу от такой комбинированной терапии, и у многих в конечном итоге будут рецидивы с приобретенной резистентностью.
[009] В данной области существует потребность в новых вариантах лечения, что касается ER+ рака молочной железы. В частности, в данной области существует потребность в новых эффективных терапиях для лечения эндокринно–резистентного ER+ рака молочной железы.
Сущность изобретения
[0010] В настоящей заявке впервые показано, что MPS1, к удивлению, связан с резистентностью к эндокринной терапии, а также, что MPS1 обеспечивает рациональную мишень для лечения рака молочной железы, который является резистентным к эндокринной терапии.
[0011] В одном аспекте настоящее изобретение относится к способу для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, включающему введение указанному субъекту терапевтически эффективного количества ингибитора MPS1, где:
(i) указанный субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии.
[0012] В одном аспекте настоящее изобретение относится к ингибитору MPS1 для применения в лечении эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, где:
(i) субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии.
[0013] В одном аспекте настоящее изобретение относится к применению ингибитора MPS1 для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, где:
(i) субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии.
[0014] В одном аспекте настоящее изобретение относится к комбинации, включающей ингибитор MPS1 и эндокринное средство.
[0015] В одном аспекте настоящее изобретение относится к фармацевтическому продукту, включающему ингибитор MPS1 и эндокринное средство.
[0016] В одном аспекте настоящее изобретение относится к способу лечения эстроген–рецептор положительного рака молочной железы у субъекта, нуждающегося в этом, включающему введение указанному субъекту, раздельно, последовательно или в комбинации, терапевтически эффективного количества ингибитора MPS1 и терапевтически эффективного количества эндокринного средства.
[0017] В одном аспекте настоящее изобретение относится к фармацевтическому продукту, включающему ингибитор MPS1 и эндокринное средство для применения в лечении эстроген–рецептор–положительного рака молочной железы, где соединение, способное ингибировать MPS1, и эндокринное средство предназначены для отдельного, последовательного или совместного введения.
[0018] В одном аспекте настоящее изобретение относится к применению фармацевтического продукта, включающего ингибитор MPS1 и эндокринное средство, для получения лекарственного средства для лечения эстроген–рецептор положительного рака молочной железы, где соединение, способное ингибировать MPS1, и эндокринное средство предназначены для отдельного, последовательного или совместного введения.
[0019] В одном аспекте настоящее изобретение относится к ингибитору MPS1 и эндокринному средству для применения в лечении эстроген–рецептор–положительного рака молочной железы.
[0020] В одном аспекте настоящее изобретение относится к ингибитору MPS1 для применения в лечении эстроген–рецептор–положительного рака молочной железы, где указанный ингибитор MPS1 предназначен для отдельного, последовательного или совместного введения с эндокринным средством.
[0021] В одном аспекте настоящее изобретение относится к эндокринному средству для применения в лечении эстроген–рецептор–положительного рака молочной железы, где указанное эндокринное средство предназначено для отдельного, последовательного или совместного введения с ингибитором MPS1.
[0022] В одном аспекте настоящее изобретение относится к применению ингибитора MPS1 и эндокринного средства для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы.
[0023] В одном аспекте настоящее изобретение относится к применению ингибитора MPS1 для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы, где указанный ингибитор MPS1 предназначен для отдельного, последовательного или совместного введения с эндокринным средством.
[0024] В одном аспекте настоящее изобретение относится к применению эндокринного средства для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы, где указанное эндокринное средство предназначено для отдельного, последовательного или совместного введения с ингибитором MPS1.
[0025] Предпочтительные, подходящие и необязательные отличительные признаки любого конкретного аспекта настоящего изобретения также являются предпочтительными, подходящими и необязательными отличительными признаками любого другого аспекта.
Краткое описание чертежей
[0026] Фиг. 1A показывает: A. Схематическое представление методики исследования.
[0027] Фиг. 1B показывает: B. Пересечение изображений кинома из некоторых LTED клеточных линий, либо ER+, либо ER–, идентифицирует белки контрольных точек G2/M в качестве общих детерминант резистентности; и C. Подтверждение роли MPS1 в LTED резистентном фенотипе осуществляли путем целевого нокдауна с миРНК против MPS1. PLK1 использовали в качестве положительного контроля.
[0028] Фиг. 1C показывает: D. Анализ данных РНК–секвенирования из MCF7 против MCF7–LTED показывает повышенную экспрессию в эндокринно–резистентной модели; и E. Глобальный анализ количества белка показывает повышенный уровень MPS1 в клетках MCF7–LTED.
[0029] Фиг. 1D показывает: F. Иммуноблот–анализ, показывающий повышенную экспрессию MPS1 в клеточных линиях MCF7–LTED и SUM44–LTED.
[0030] На Фиг. 2 A показывает экспрессию гена MPS1 в процессе лечения у пациентов, принимавших анастразол, и B показывает связь между экспрессией гена MPS1 в процессе лечения и Ki67 значением на неделе 2. Показаны коэффициенты ранговой корреляции Спирмена(rho) и P–значения.
[0031] Фиг. 3: C. Показывает исходный уровень экспрессии MPS1, а D показывает экспрессию гена MPS1 в процессе лечения у пациентов, принимавших летрозол.
[0032] Фиг. 4 показывает график Каплана–Мейера, выявляющий связь высокой или низкой экспрессии гена MPS1 до лечения у ER+ BC пациентов, которых лечили тамоксифеном, из общедоступных данных, собранных за 10 лет.
[0033] Фиг. 5 показывает результаты обработки различных клеток рака молочной железы в присутствии или в отсутствие E2 увеличивающимися концентрациями CCT289346.
[0034] Фиг. 6 показывает культуры сфероидальных wt–MCF7 и MCF7–LTED клеток, содержащих дикого типа или мутантный ESR1, которые обрабатывали ингибитором MPS1 CCT289346. Столбиковая диаграмма представляет жизнеспособность клеток, определенную с использованием TitreGlo.
[0035] Фиг. 7 показывает ответ клеточных линий рака молочной железы на увелививающуюся концентрацию ингибитора MPS1 NMS–P175.
[0036] Фиг. 8 показывает ответ клеточных линий рака молочной железы на увеличивающуюся концентрацию ингибитора MPS1 BAY 1161909.
[0037] Фиг. 9A и B показывает ответ клеточных линий рака молочной железы на увеличивающуюся концентрацию ингибитора MPS1 BAY 1217389 в 2D (Фиг. 9A) и сфероидальной культуре (Фиг. 9B). Столбиковая диаграмма представляет жизнеспособность сфероидальных клеток, определенную с использованием TiterGlo.
[0038] Фиг. 10 показывает результаты для четырех клеточных линий: Wt–SUM44, SUM44 LTED, HCC1428 и HCC1428 LTED, которые культивировали в присутствии или в отсутствие эстрадиола (E2) и увеличивающейся концентрации ингибитора MPS1 CCT289346 в течение 6 дней с заменой среды в день 3. Жизнеспособность клеток оценивали с использованием TitreGlo. Данные нормализовали к носителю, используемому в качестве контроля, для каждого состояния.
[0039] Фиг. 11 показывает результаты обработки wt–MCF7 клеток, которые обрабатывали увеличивающимися концентрациями CCT289346 в присутствии E2 или в отсутствие E2.
[0040] Фиг. 12 показывает результаты обработки клеток увеличивающимися концентрациями A. только фулвестранта или в комбинации с 50нМ CCT289346. B. только 4–OHT или в комбинации с 50нМ CCT289346 в течение 6 дней с заменой среды в день 3. Жизнеспособность клеток измеряли с использованием TitreGlo.
[0041] Фиг. 13A и 13B показывают результаты анализов пролиферации в палбоциклиб–резистентной и чувствительной клеточных линиях.
[0042] Фиг. 14 показывает результаты скрининга библиотеки кинома миРНК в палбоциклиб–резистентных моделях. A. Диаграмма Венна идентифицировала MPS1 как одну из общих мишеней во всех резистентных моделях. B. Столбиковая диаграмма, показывающая изменение жизнеспособности клеток (среднее значение ± стандартная ошибка среднего), нормализованное к нецелевому si Контролю, определенному в анализах скрининга библиотеки.
[0043] Фиг. 15 показывает wt–MCF7 и wt–T47D палбоциклиб–резистентные клеточные линии, которые обрабатывали увеличивающимися концентрациями CCT289346 или NMS–P715 в присутствии или в отсутствие палбоциклиба в течение 6 дней с заменой среды в день 3. Жизнеспособность клеток определяли с использованием TiterGlo и данные выражали как кратное изменение жизнеспособности клеток.
[0044] Фиг. 16 показывает MCF7–LTED и T47D–LTED палбоциклиб–резистентные клеточные линии, которые обрабатывали увеличивающимися концентрациями CCT289346 или NMS–P715 в присутствии или отсутствие палбоциклиба в течение 6 дней с заменой среды в день 3. Жизнеспособность клеток определяли с использованием TiterGlo и данные выражали как кратное изменение жизнеспособности клеток.
[0045] Фиг. 17 показывает эффект CCT289346 (также указан как BOS172722) в MCF7–LTED опухолевом росте.
[0046] Фиг. 18 показывает эффект CCT289346, отдельно или в комбинации с фулвестрантом, в PDX моделе HBCx–34.
[0047] Фиг. 19 показывает эффект CCT289346, отдельно или в комбинации с фулвестрантом, в PDX модели hbcx–34.
Подробное описание изобретения
Определения
[0047] В контексте настоящей заявки “эстроген–рецептор–положительный (ER+) рак молочной железы” относится к раку молочной железы, который естественным образом экспрессирует эстрогеновые рецепторы (соответственно, ядерные эстрогеновые рецепторы; подходяще ER–альфа). Любой подходящий метод, известный в данной области, можно использовать для определения, экспрессирует или нет рак молочной железы эстрогеновые рецепторы, включая анализы связывания лиганда и иммуногистохимические методы.
[0049] В контексте настоящей заявки “эндокринная терапия” относится к любому лечению, способному удалять эстроген, блокировать выработку эстрогена, снижать уровни эстрогена, блокировать действие эстрогена, уменьшать эффект эстрогена и/или которое может привести к нестабильности, деградации и/или даун–регуляции эстрогеновых рецепторов. Соответственно, эндокринная терапия включает/по существу состоит из/состоит из введения эндокринного средства.
[0050] В контексте настоящей заявки термин “эндокринное средство” относится к любому химическому соединению или биологическому средству, способному удалять эстроген, блокировать выработку эстрогена и/или снижать уровни эстрогена. Подходящим эндокринным средством является химическое соединение, например лекарственное средство или лекарственно–подобная молекула.
[0051] В контексте настоящей заявки “неудачное предшествующее лечение” может означать, что указанный субъект был определен соответствующим квалифицированным специалистом как имеющий неэффективное лечение с применением эндокринной терапии. Соответствующий специалист мог бы легко определить, когда применение эндокринной терапии является неэффективным у субъекта. Например, неэффективность эндокринной терапии может проявляться как одно или несколько из следующих во время или после терапии: прогрессирование заболевания (например, рост рака, возврат болезни, рецидив, распространение рака, повышение степени опухоли, увеличение пролиферации), отсутствие ответа (т.е. отсутствие патологических изменений в раке, отсутствие изменений в размере опухоли) и недостаточный ответ (недостаточное уменьшение размера опухоли, недостаточный патологический ответ).
[0052] В контексте настоящей заявки термин “совместное введение” относится к терапии, при которой оба средства (например, ингибитор MPS1 и эндокринное средство) вводят одновременно.
[0053] В контексте настоящей заявки термин “последовательное введение” означает, что одно средство вводят после другого, однако период времени между введением каждого из средств таков, что оба средства способны действовать терапевтически одновременно. Таким образом, введение “последовательно” может позволить введение одного средства в течение 5 минут, 10 минут или нескольких часов после другого, при условии, что период полужизни в кровотоке первого введенного средства является таким, что они оба одновременно присутствуют в терапевтически эффективных количествах. Временная задержка между введением средств может варьироваться в зависимости от конкретной природы средств, взаимодействия между ними и их соответствующих периодов полувыведения.
[0054] В контексте настоящей заявки термин “раздельное введение” означает, что одно средство вводят после другого, однако период времени между введениями таков, что первое вводимое средство больше не присутствует в терапевтически эффективном количестве, когда вводится второе средство. Соответственно, два средства проявляют свои терапевтические эффекты отдельно. Тем не менее, общий терапевтический эффект, наблюдаемый, когда два средства по отдельности действуют терапевтически, может быть больше, чем у любого средства, используемого отдельно.
[0055] В контексте настоящей заявки “субъект(субъекты)” и/или “пациент(пациенты)”, соответственно, относятся к млекопитающим (например, людям и отличным от человека млекопитающим, таким как домашний скот (коровы, овцы, козы) или домашние животные (кошки, собаки, лошади, кролики). Соответственно, субъект(субъекты) и/или пациент(пациенты) представляют собой человека(людей).
[0056] В контексте настоящей заявки “резистентный к эндокринной терапии” или “эндокринно–резистентный” рак может означать, что указанный рак определен специалистом в данной области как резистентный к эндокринной терапии. Специалист в данной области легко сможет определить, когда рак резистентен к эндокринной терапии. Например, клинически, резистентность может проявляться как рецидив или повторное появление рака в процессе лечения или после эндокринной терапии. Альтернативно, резистентность можно наблюдать как клиническое прогрессирование первичного заболевания, обычно заключающееся в увеличении первичного размера опухоли или распространении заболевания на регионарные узлы или за их пределы в более отдаленные участки метастазирования. Патологические изменения, такие как повышенная степень злокачественности опухоли или повышенная пролиферация, указывают на потенциальную резистентность к терапии. При неоадъювантном лечении резистентность возникает либо как первоначальное отсутствие ответа (отсутствие изменения или увеличение размера опухоли и отсутствие признаков патологического ответа) в начале лечения, что предполагает врожденную или de novo резистентность, либо позднее после периода ответа, что предполагает приобретенную резистентность. Альтернативно, резистентность к эндокринной терапии можно определить у не принимавших ранее эндокринную терапию пациентов на основании генотипических и/или фенотипических маркеров резистентности.
[0057] В контексте настоящей заявки термин ингибитор CDK4/6 относится к химическим или биологическим средствам, способным ингибировать CDK4 и CDK6. Подходящим образом, ингибиторы CDK4/6 являются селективными к CDK4/6 по сравнению с другими киназами, в частности, по сравнению с другими CDK. Подходящим образом, ингибиторы CDK4/6 в настоящей заявке имеют наномолярные значения IC50 для CDK4 и CDK6. Подходящим образом, ингибиторы CDK4/6 представляют собой химические соединения, например, лекарственные средства или подобные лекарствам молекулы.
[0058] В контексте настоящей заявки термин ингибитор MPS1 относится к химическому или биологическому средству, способному ингибировать MPS1 (монополярное веретено) киназу. Подходящим образом, ингибиторы MPS1 являются селективными к MPS1 по сравнению с другими киназами. Подходящим образом, ингибиторы MPS1 в настоящей заявке имеют наномолярные значения IC50 для MPS1. Подходящим образом, ингибиторы MPS1 представляют собой химические соединения, например, лекарственные средства или подобные лекарствам молекулы.
[0059] В контексте настоящей заявки термин “BAY 1161909” относится к следующему соединению:
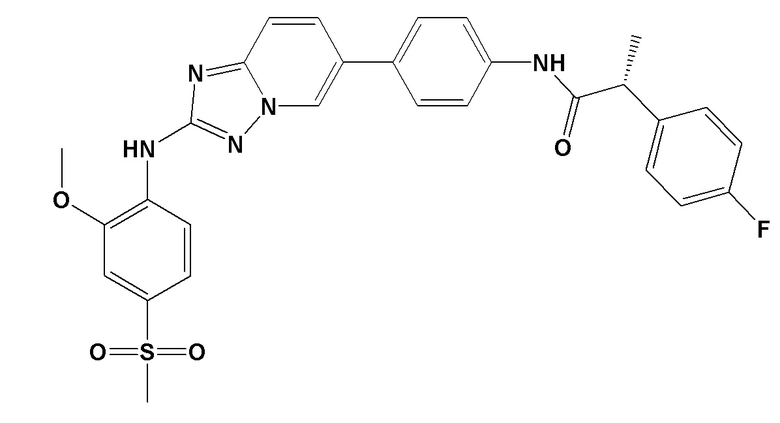 .
.
[0060] В контексте настоящей заявки термин “BAY 1217389” относится к следующему соединению:
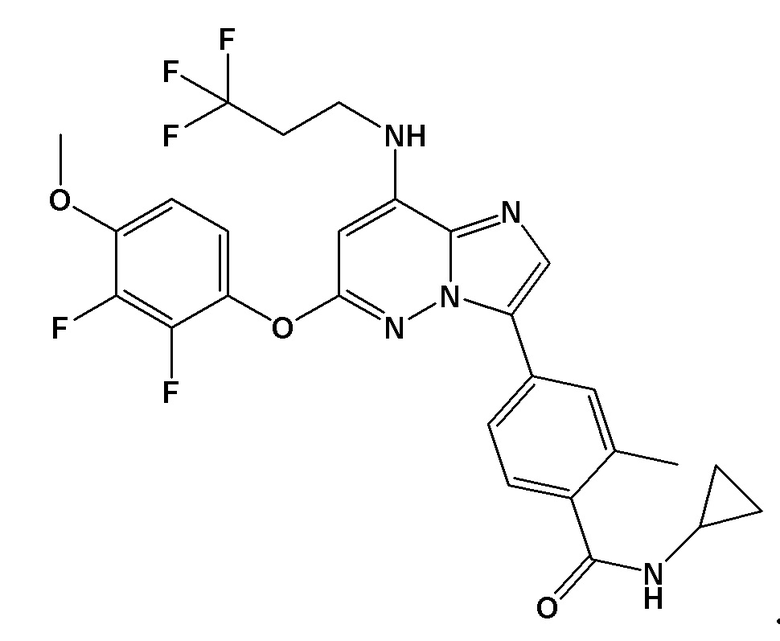 .
.
[0061] В контексте настоящей заявки термин “NMS–P715” относится к следующему соединению:
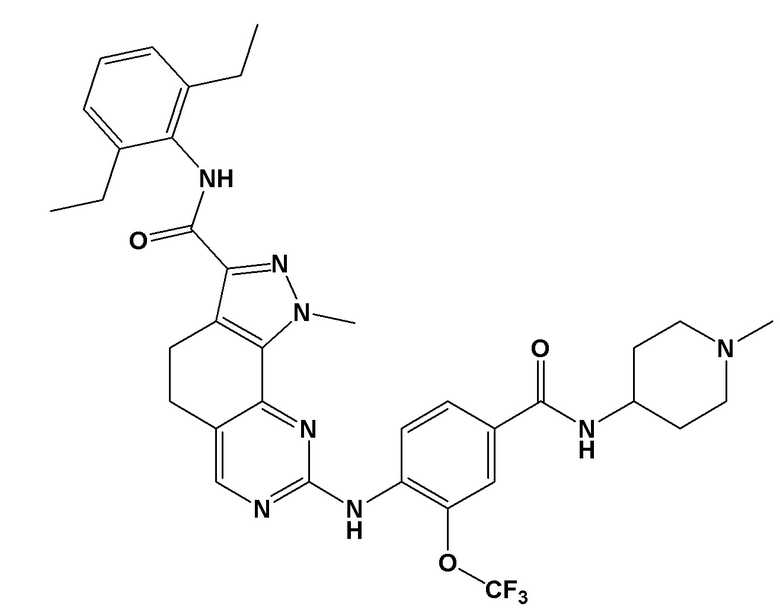 .
.
[0062] В контексте настоящей заявки термин “AZ3146” относится к следующему соединению:
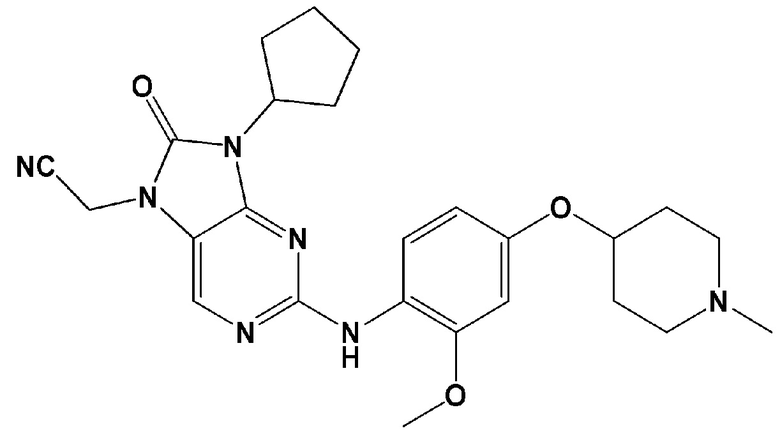 .
.
[0063] В контексте настоящей заявки термин “MPS1–IN–3” относится к следующему соединению:
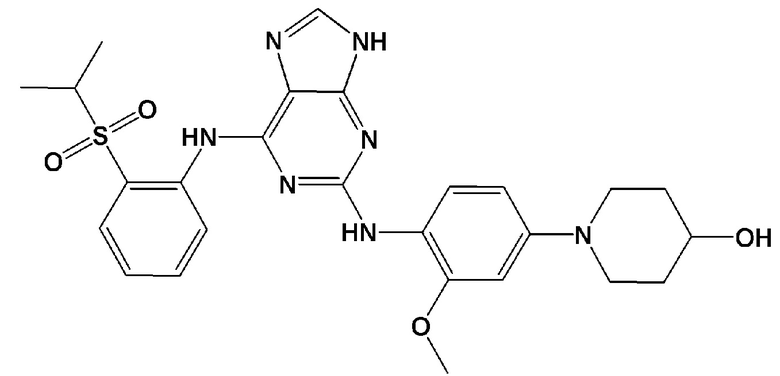 .
.
[0064] В контексте настоящей заявки термин “MPS1–IN–2” относится к следующему соединению:
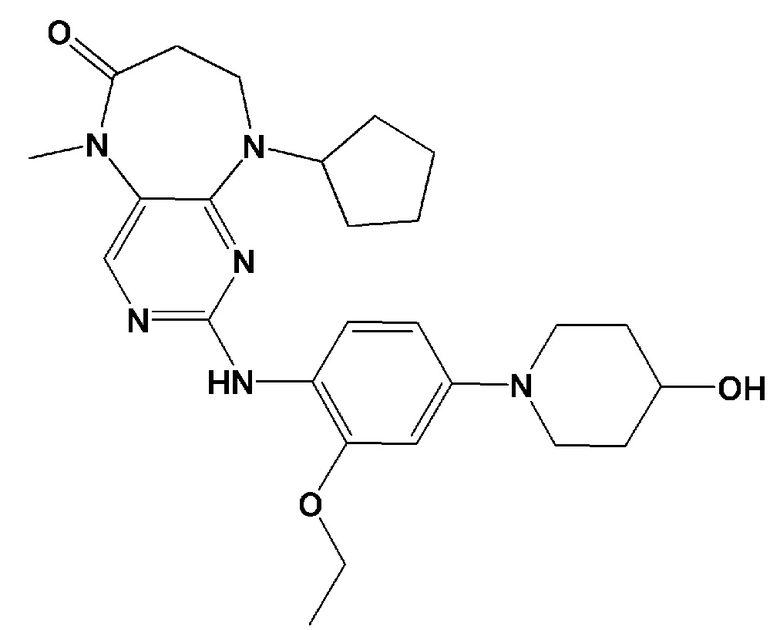 .
.
[0065] В контексте настоящей заявки термин “CFI–402257” относится к следующему соединению:
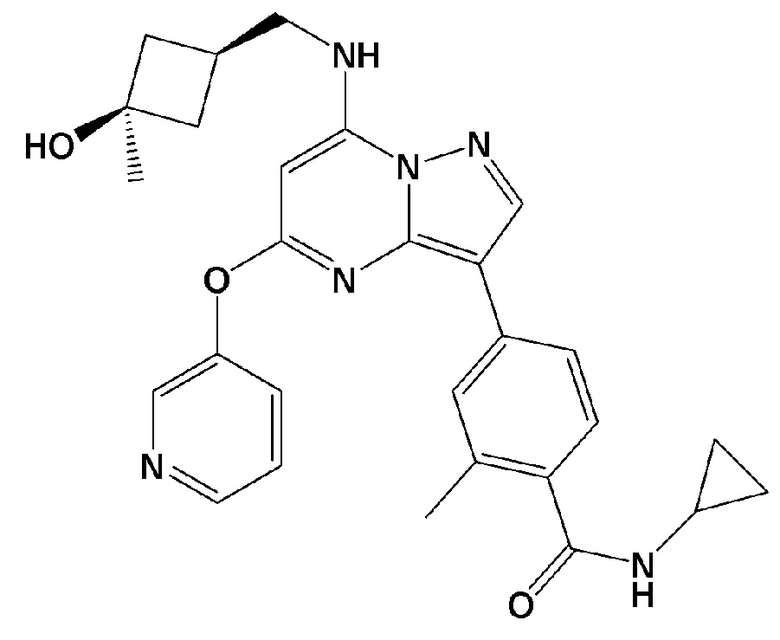 .
.
[0066] В контексте настоящей заявки термин “CCT289346” относится к N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамину.
[0067] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “терапевтические” и “терапевтически эффективное количество” относятся к количеству соединения, композиции или лекарственного средства, которое (a) ингибирует или вызывает улучшение конкретного заболевания, состояния или расстройства; (b) ослабляет, облегчает или устраняет один или несколько симптомов конкретного заболевания, состояния или расстройства; (c) или замедляет появление одного или нескольких симптомов конкретного заболевания, состояния или расстройства, описанного в настоящей заявке. Должно быть понятно, что термины “терапевтический” и “терапевтически эффективный” охватывают любой из вышеуказанных эффектов (a)–(c), либо отдельно, либо в комбинации с любым из других (a)–(c). Должно быть понятно, что, например, для человека или другого млекопитающего терапевтически эффективное количество можно определить экспериментально в лаборатории или клинических условиях, или терапевтически эффективное количество может представлять собой количество, требуемое, в соответствии с руководящими указаниями United States Food and Drug Administration (FDA) или соответствующего иностранного регуляторного органа, для конкретного заболевания и субъекта, подлежащего лечению. Должно быть понятно, что определение подходящих лекарственных форм, дозируемых количеств и путей введения находится в пределах обычных навыков в области фармацевтики и медицины.
[0068] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “лечащий”, “леченный” и “лечение” могут относиться к медицинским действиям и результатам и включают профилактические, благоприятные, паллиативные и лечебные действия и результаты. В некоторых вариантах осуществления термины “лечащий”, “леченный” и “лечение” относятся к лечебным действиям и результатам, а также действиям и результатам, которые облегчают или уменьшают тяжесть конкретного описанного состояния, характеристики, симптома, расстройства или заболевания, описанного в нестоящей заявке. Например, лечение может включать уменьшение нескольких симптомов состояния или расстройства или полное устранение указанного состояния или расстройства. Следует понимать, что термин “профилактический”, используемый в настоящей заявке, не является абсолютным, а скорее относится к действиям и результатам, когда введение соединения или композиции уменьшает вероятность или серьезность состояния, симптома или болезненного заболевания и/или задерживает возникновение состояния, симптома или заболевания на определенный период времени.
[0069] Соединения и промежуточные соединения, описанные в настоящей заявке, могут быть названы в соответствии с номенклатурными системами IUPAC (International Union for Pure and Applied Chemistry) или CAS (Chemical Abstracts Service). Должно быть понятно, что, если специально не указано иное, термины “соединения формулы I” и более общий термин “соединения” относятся к, и включают их, любым и всем соединениям, описанным формулой I и/или со ссылкой на формулу I. С учетом необходимых изменений это также применимо к терминам “соединения формулы II”, “соединения формулы III”, “соединения формулы IV” и “соединения формулы V”. Следует также понимать, что эти термины охватывают все стереоизомеры, то есть цис– и транс–изомеры, а также оптические изомеры, то есть R и S–энантиомеры таких соединений и всех их солей, в по существу чистой форме и/или любые смеси вышеуказанных в любом соотношении. То же распространяется на фармацевтические композиции и способы лечения, которые используют или включают одно или несколько соединений формул I, II, III, IV и V как таковые или в комбинации с дополнительными средствами.
[0070] Различные углеводород–содержащие группы, представленные в настоящей заявке, могут быть описаны с использованием префикса, указывающего минимальное и максимальное количество атомов углерода в группе, например, “(Ca–b)” или “Ca–Cb” или “(a–b)C”. Например, (Ca–b)алкил означает алкильную группу с количеством атомов углерода от целого числа “a” до целого числа “b” включительно. Некоторые группы также могут быть описаны в соответствии с минимальным и максимальным количеством членов с или без конкретного указания конкретного атома или общей структуры. Например, термины “a –b–членное кольцо” или “содержащий a–b членов” относятся к группе, имеющей количество атомов от целого числа “a” до целого числа “b” включительно.
[0071] "Около", в контексте настоящей заявки, вместе с измеримым значением, таким как, например, количество или период времени и т.п., предполагает включение приемлемых отклонений этого значения, например, для допуска экспериментальной ошибки в измерении указанного значения.
[0072] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, "алкил" и “алкильная группа” относятся к разветвленной или неразветвленной насыщенной углеводородной цепи. Если не указано иное, алкильные группы типично содержат 1–10 атомов углерода, например, 1–6 атомов углерода, или 1–4 атомов углерода, или 1–3 атомов углерода и могут быть замещенными или незамещенными. Репрезентативные примеры включают, но не ограничиваются этим, метил, этил, н–пропил, изопропил, н–бутил, изобутил, втор–бутил, трет–бутил, н–пентил, н–гексил, н–гептил, н–октил, н–нонил, н–децил, изопропил, трет–бутил, изобутил и т.д.
[0073] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкилен” и “алкиленовая группа” относятся к разветвленной или неразветвленной насыщенной углеводородной цепи. Если не указано иное, алкиленовые группы типично содержат 1–10 атомов углерода, например 1–6 атомов углерода или 1–3 атомов углерода, и могут быть замещенными или незамещенными. Репрезентативные примеры включают, но не ограничиваются этим, метилен ( –CH2 –), этиленовые изомеры ( –CH(CH3) – и –CH2CH2 –), пропиленовые изомеры ( –CH(CH3)CH2 –, –CH(CH2CH3) –, –C(CH3)3 – и –CH2CH2CH2 –) и т.д.
[0074] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкенил” и “алкенильная группа” относятся к разветвленной или неразветвленной углеводородной цепи, содержащей по меньшей мере одну двойную связь. Если не указано иное, алкенильные группы типично содержат 2–10 атомов углерода, например 2–6 атомов углерода или 2–4 атомов углерода, и могут быть замещенными или незамещенными. Репрезентативные примеры включают, но не ограничиваются этим, этенил, 3–бутен–1–ил, 2–этенилбутил и 3–гексен–1–ил.
[0075] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкинил” и “алкинильная группа” относятся к разветвленной или неразветвленной углеводородной цепи, содержащей по меньшей мере одну тройную связь. Если не указано иное, алкинильные группы типично содержат 2–10 атомов углерода, например 2–6 атомов углерода или 2–4 атомов углерода, и могут быть замещенными или незамещенными. Репрезентативные примеры включают, но не ограничиваются этим, этинил, 3–бутин–1–ил, пропинил, 2–бутин–1–ил и 3–пентин–1–ил.
[0076] В контексте настоящей заявки, как таковой или вместе с другим термином или терминами, “ароматический” относится к моноциклическим и полициклическим кольцевым системам, содержащим 4n+2 π–электронов, где n представляет собой целое число. Ароматический следует понимать как относящийся к, и включающий, кольцевым системам, которые содержат только атомы углерода (т.е. “арил”), а также кольцевым системам, которые содержат по меньшей мере один гетероатом, выбранный из N, O или S (т.е. “гетероароматический” или “гетероарил”). Ароматическая кольцевая система может быть замещенной или незамещенной.
[0077] В контексте настоящей заявки, как таковой или вместе с другим термином или терминами, “неароматический” относится к моноциклической или полициклической кольцевой системе, содержащей по меньшей мере одну двойную связь, которая не является частью расширенной конъюгированной π–системы. В контексте настоящей заявки неароматический относится к, и включает их, кольцевым системам, которые содержат только атомы углерода, а также к кольцевым системам, которые содержат по меньшей мере один гетероатом, выбранный из N, O или S. Неароматическая кольцевая система может быть замещенной или незамещенной.
[0078] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “арил” и “арильная группа” относятся к фенилу и 7–15–членным бициклическим или трициклическим углеводородным кольцевым системам, включая связанные мостиковой связью, спиро и/или конденсированные кольцевые системы, в которых по меньшей мере одно из колец является ароматическим. Арильные группы могут быть замещенными или незамещенными. Если не указано иное, арильная группа может содержать 6 кольцевых атомов (т.е. фенил), или кольцевая система содержит 9–15 атомов, например 9–11 кольцевых атомов или 9 или 10 кольцевых атомов. Репрезентативные примеры включают, но не ограничиваются этим, нафтил, инданил, 1,2,3,4–тетрагидронафталенил, 6,7,8,9–тетрагидро–5H–бензоциклогептенил и 6,7,8,9–тетрагидро–5H–бензоциклогептенил. Подходящим образом арильная группа представляет собой фенил и нафтил, подходящим образом фенил.
[0079] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “арилен” и “ариленовая группа” относятся к фенилену ( –C6H4 –) или к 7–15–членным бициклическим или трициклическим углеводородным кольцевым системам, включая связанные мостиковой связью, спиро и/или конденсированные кольцевые системы, в которых по меньшей мере одно из колец является ароматическим. Ариленовые группы могут быть замещенными или незамещенными. В некоторых вариантах осуществления ариленовая группа может содержать 6 (т.е. фенилен) кольцевых атомов или может представлять собой кольцевую систему, содержащую 9–15 атомов; например 9–11 кольцевых атомов; или 9 или 10 кольцевых атомов. Ариленовые группы могут быть замещенными или незамещенными.
[0080] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкиларил” и “алкиларильная группа” относятся к алкильной группе, в которой атом водорода замещен арильной группой, где алкильная группа и арильная группа имеют значения, определенные выше, такие как, например, бензил (C6H5CH2 –). Алкиларильные группы могут быть замещенными или незамещенными.
[0081] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “карбоциклическая группа” и “карбоцикл” относятся к моноциклическим и полициклическим кольцевым системам, которые содержат только атомы углерода в кольце(кольцах), т.е. углеводородным кольцевым системам, безотносительно или без указания ароматичности или степени ненасыщенности. Таким образом, карбоциклическую группу следует понимать как относящуюся к, и включающую их, кольцевым системам, которые являются полностью насыщенными (таким как, например, циклогексильная группа), кольцевым системам, которые являются ароматическими (таким как, например, фенильная группа), а также кольцевым системам, содержащим полностью насыщенные, ароматические и/или ненасыщенные части (таким как, например, циклогексенил, 2,3–дигидро–инденил и 1,2,3,4–тетрагидро–нафталенил). Термины карбоциклический и карбоцикл также включают связанные мостиковой связью, конденсированные и спироциклические кольцевые системы.
[0082] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “циклоалкил” и “циклоалкильная группа” относятся к неароматической карбоциклической кольцевой системе, которая может быть моноциклической, бициклической или трициклической, насыщенной или ненасыщенной, и может быть связанной мостиковой связью, спиро и/или конденсированной. Циклоалкильная группа может быть замещенной или незамещенной. Если не указано иное, циклоалкильная группа типично содержит от 3 до 12 кольцевых атомов. В некоторых случаях циклоалкильная группа может содержать 4–10 кольцевых атомов (например, 4 кольцевых атома, 5 кольцевых атомов, 6 кольцевых атомов, 7 кольцевых атомов и т.д.). Репрезентативные примеры включают, но не ограничиваются этим, циклопропил, циклопропенил, циклобутил, циклобутенил, циклопентил, циклопентенил, циклогексил, циклогексенил, норборнил, норборненил, бицикло[2.2.1]гексан, бицикло[2.2.1]гептан, бицикло[2.2.1]гептен, бицикло[3.1.1]гептан, бицикло[3.2.1]octane, бицикло[2.2.2]октан, бицикло[3.2.2]нонан, бицикло[3.3.1]нонан и бицикло[3.3.2]декан. Подходящим образом, циклоалкильные группы выбраны из циклопропильной, циклобутильной, циклопентильной и циклогексильной групп.
[0083] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкилциклоалкил” и “алкилциклоалкильная группа” относятся к алкильной группе, в которой атом водорода замещен циклоалкильной группой, где алкильная группа и циклоалкильная группа имеют значения, определенные выше, так как, например, циклогексилметил (C6H11CH2 –). Алкилциклоалкильные группы могут быть замещенными или незамещенными.
[0084] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “галогеналкил” и “галогеналкильная группа” относятся к алкильным группам, в которых один или несколько атомов водорода замещены атомами галогена. Галогеналкил включает как насыщенные алкильные группы, так и ненасыщенные алкенильные и алкинильные группы. Репрезентативные примеры включают, но не ограничиваются этим, –CF3, –CHF2, –CH2F, –CF2CF3, –CHFCF3, –CH2CF3, –CF2CH3, –CHFCH3, –CF2CF2CF3, –CF2CH2CH3, –CF=CF2, –CCl=CH2, –CBr=CH2, –CI=CH2, –C≡C–CF3, –CHFCH2CH3 и –CHFCH2CF3. Галогеналкильные группы могут быть замещенными или незамещенными. Подходящим образом, галогеналкильная группа выбрана из CHF2 и CF3, подходящим образом CF3.
[0085] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “галогеналкокси” и “галогеналкокси группа” относятся к алкокси группам (т.е. O–алкильным группам), в которых один или несколько атомов водорода замещены атомами галогена. Галогеналкокси включает как насыщенные алкокси группы, так и ненасыщенные алкенильные и алкинильные группы. Репрезентативные примеры включают, но не ограничиваются этим, –OCF3, –OCHF2, –OCH2F, –OCF2CF3, –OCHFCF3, –OCH2CF3, –OCF2CH3, –OCHFCH3, –OCF2CF2CF3, –OCF2CH2CH3, –OCF=CF2, –OCCl=CH2, –OCBr=CH2, –OCHFCH2CH3 и –OCHFCH2CF3. Галогеналкокси группы могут быть замещенными или незамещенными. Подходящим образом, галогеналкилоки группа выбрана из –OCHF2 и –OCF3, подходящим образом –OCF3.
[0086] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “гало” и “галоген” включают фтор, хлор, бром и иод, как атомы, так и заместители.
[0087] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “гетероарил” и “гетероарильная группа” относятся к (a) 5 и 6–членным моноциклическим ароматическим кольцам, которые содержат, в дополнение к атому(атомам) углерода, по меньшей мере один гетероатом, такой как азот, кислород или сера, и (b) 7–15–членным бициклическим и трициклическим кольцам, которые содержат, в дополнение к атому(атомам) углерода, по меньшей мере один гетероатом, такой как азот, кислород или сера, и в которых по меньшей мере одно из колец является ароматическим. В некоторых случаях гетероарильная группа может содержать два или более гетероатомов, которые могут быть одинаковыми или отличными друг от друга. Гетероарильные группы могут быть замещенными или незамещенными и могут быть связанными мостиковой связью, спиро и/или конденсированными. В некоторых случаях гетероарильная группа может содержать 5, 6 или 8–15 кольцевых атомов. В других случаях гетероарильная группа может содержать 5–10 кольцевых атомов, например 5, 6, 9 или 10 кольцевых атомов. Репрезентативные примеры включают, но не ограничиваются этим, 2,3–дигидробензофуранил, 1,2–дигидрохинолинил, 3,4–дигидроизохинолинил, 1,2,3,4–тетрагидроизохинолинил, 1,2,3,4–тетрагидрохинолинил, бензоксазинил, бензтиазинил, хроманил, фуранил, 2–фуранил, 3–фуранил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиридинил, 2–, 3–, или 4–пиридинил, пиримидинил, 2–, 4– или 5–пиримидинил, пиразолил, пирролил, 2– или 3–пирролил, пиразинил, пиридазинил, 3– или 4–пиридазинил, 2–пиразинил, тиенил, 2–тиенил, 3– тиенил, тетразолил, тиазолил, тиадиазолил, триазинил, триазолил, пиридин–2–ил, пиридин–4–ил, пиримидин–2–ил, пиридазин–4–ил, пиразин–2–ил, нафтиридинил, птеридинил, фталазинил, пуринил, аллоксазинил, бензимидазолил, бензофуранил, бензофуразанил, 2H–1–бензопиранил, бензотиадиазин, бензотиазинил, бензотиазолил, бензотиофенил, бензоксазолил, циннолинил, фуропиридинил, индолинил, индолизинил, индолил или 2–, 3–, 4–, 5–, 6– или 7–индолил, 3H–индолил, хиназолинил, хиноксалинил, изоиндолил, изохинолинил, 10–аза–трицикло[6.3.1.02,7]додека–2(7),3,5–триенил, 12–окса–10–аза–трицикло[6.3.1.02,7]додека–2(7),3,5–триенил, 12–аза–трицикло[7.2.1.02,7]додека–2(7),3,5–триенил, 10–аза–трицикло[6.3.2.02,7]тридека–2(7),3,5–триенил, 2,3,4,5–тетрагидро–1H–бензо[d]азепинил, 1,3,4,5–тетрагидро–бензо[d]азепин–2–онил, 1,3,4,5–тетрагидро–бензо[b]азепин–2–онил, 2,3,4,5–тетрагидро–бензо[c]азепин–1–онил, 1,2,3,4–тетрагидро–бензо[e][1,4]диазепин–5–онил, 2,3,4,5–тетрагидро–1H–бензо[e][1,4]диазепинил, 5,6,8,9–тетрагидро–7–окса–бензоциклогептенил, 2,3,4,5–тетрагидро–1H–бензо[b]азепинил, 1,2,4,5–тетрагидро–бензо[e][1,3]диазепин–3–онил, 3,4–дигидро–2H–бензо[b][1,4]диоксепинил, 3,4–дигидро–2H–бензо[f][1,4]оксазепин–5–онил, 6,7,8,9–тетрагидро–5–тиа–8–аза–бензоциклогептенил, 5,5–диоксо–6,7,8,9–тетрагидро–5–тиа–8–аза–бензоциклогептенил и 2,3,4,5–тетрагидро–бензо[f][1,4]оксазепинил. Подходящим образом, гетероарил представляет собой 5– или 6–членное гетероарильное кольцо, включающее один, два или три гетероатома, выбранных из N, O или S.
[0088] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкилгетероарил” и “алкилгетероарильная группа” относятся к алкильной группе, в которой атом водорода замещен гетероарильной группой, где алкильная группа и гетероарильная группа имеют значения, определенные выше. Алкилгетероарильные группы могут быть замещенными или незамещенными. Если указано количество атомов углерода, например, (Cn–m)алкилгетероарил, указанный диапазон относится к группе в целом. Подходящим образом, алкильная группа, являющаяся составляющей частью, содержит 1–6 атомов углерода, подходяще 1–3 атома углерода.
[0089] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “гетероциклическая группа” и “гетероцикл” относятся к моноциклическим и полициклическим кольцевым системам, которые содержат атомы углерода и по меньшей мере один гетероатом, выбранный из азота, кислорода, серы или фосфора в кольце(кольцах), безотносительно или без указания ароматичности или степени ненасыщенности. Таким образом, гетероциклическую группу следует понимать как относящуюся к, и включающую их, кольцевым системам, которые являются полностью насыщенными (таким как, например, пиперидинильная группа), кольцевым системам, которые являются ароматическими (таким как, например, пириндинильная группа), а также кольцевым системам, содержащим полностью насыщенные, ароматические и/или ненасыщенные части (таким как, например, 1,2,3,6–тетрагидропиридинил и 6,8–дигидро–5H–[1,2,4]триазолo[4,3–a]пиризинил). Термины гетероциклический и гетероцикл также включают связанные мостиковой связью, конденсированные и спироциклические кольцевые системы.
[0090] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “гетероциклоалкил” и “гетероциклоалкильная группа” относятся к 3–15–членным моноциклическим, бициклическим и трициклическим неароматическим кольцевым системам, которые содержат, в дополнение к атому(атомам) углерода, по меньшей мере один гетероатом, такой как азот, кислород, сера или фосфор. Гетероциклоалкильные группы могут быть полностью насыщенными или содержать ненасыщенные части и могут представлять собой связанные мостиковой связью, спиро и/или конденсированные кольцевые системы. В некоторых случаях гетероциклоалкильная группа может содержать по меньшей мере два гетероатома, которые могут быть одинаковыми или отличными друг от друга. Гетероциклоалкильные группы могут быть замещенными или незамещенными. В некоторых случаях гетероциклоалкильная группа может содержать от 3 до 10 кольцевых атомов, или от 3 до 7 кольцевых атомов, или от 5 до 7 кольцевых атомов, например 5 кольцевых атомов, 6 кольцевых атомов или 7 кольцевых атомов. Репрезентативные примеры включают, но не ограничиваются этим, тетрагидрофуранил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, индолинил, изоиндолинил, морфолинил, тиоморфолинил, гомоморфолинил, гомопиперидил, гомопиперазинил, тиоморфолинил–5–оксид, тиоморфолинил–S, S–диоксид, пирролидинил, тетрагидропиранил, пиперидинил, тетрагидротиенил, гомопиперидинил, гомотиоморфолинил–S, S–диоксид, оксазолидинонил, дигидропиразолил, дигидропирролил, дигидропиразинил, дигидропиридинил, дигидропиримидинил, дигидрофурил, дигидропиранил, тетрагидротиенил–5–оксид, тетрагидротиенил–S, S–диоксид, гомотиоморфолинил–5–оксид, хинуклидинил, 2–окса–5–азабицикло[2.2.1]гептанил, 8–окса–3–аза–бицикло[3.2.1]октанил, 3,8–диаза–бицикло[3.2.1]октанил, 2,5–диаза–бицикло[2.2.1]гептанил, 3,8–диаза–бицикло[3.2.1]октанил, 3,9–диаза–бицикло[4.2.1]нонанил, 2,6–диаза–бицикло[3.2.2]нонанил, [1,4]оксафосфинанил– 4–оксид, [1,4]азафосфинанил– 4–оксид, [1,2]оксафосфоланил– 2–оксид, фосфинанил–1–оксид, [1,3]азафосфолидинил– 3–оксид, [1,3]оксафосфоланил– 3–оксид, 7–оксабицикло[2.2.1]гептанил, 6,8–дигидро–5H–[1,2,4]триазолo[4,3–a]пиразин–7–ил, 6,8–дигидро–5H–имидазо[1,5–a]пиразин–7–ил, 6,8–дигидро–5H–имидазо[1,2–a]пиразин–7–ил, 5,6,8,9–тетрагидро–[1,2,4]триазолo[4,3–d][1,4]диазепин–7–ил и 6,8–дигидро–5H–[1,2,4]триазолo[4,3–a]пиразин–7–ил. Подходящим образом, гетероциклилалкильная группа, как определено в настоящей заявке, представляет собой моноциклическую, бициклическую или спиро гетероциклильную группу, содержащую один, два или три гетероатома, выбранных из N, O или S.
[0091] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “гетероциклоалкилен” и “гетероциклоалкиленовая группа” относятся к 3–15–членным моноциклическим, бициклическим или трициклическим неароматическим кольцевыем системам, которые содержат, в дополнение к атому(атомам) углерода, по меньшей мере один гетероатом, такой как азот, кислород, сера или фосфор. Гетероциклоалкиленовые группы могут быть полностью насыщенными или содержать ненасыщенные части и могут быть связанными мостиковой связью, спиро и/или конденсированными. Гетероциклоалкиленовые группы могут быть замещенными или незамещенными. В некоторых случаях гетероциклоалкиленовая группа может содержать от 3 до 10 кольцевых атомов; например от 3 до 7 кольцевых атомов. В других случаях гетероциклоалкиленовая группа может содержать от 5 до 7 кольцевых атомов, например 5 кольцевых атомов, 6 кольцевых атомов или 7 кольцевых атомов.
[0092] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “алкилгетероциклоалкил” и “алкилгетероциклоалкильная группа” относятся к алкильной группе, в которой атом водорода замещен гетероциклоалкильной группой, где алкильная группа и гетероциклоалкильная группа имеют значения, определенные выше, например, пирролидинилметил (C4H8NCH2–). Алкилгетероциклоалкильные группы могут быть замещенными или незамещенными. Если указано количество атомов углерода, например, (Cn–m)алкилгетероциклоалкил, указанный диапазон относится к группе в целом. Подходящим образом, алкильная группа, являющаяся составляющей частью, содержит 1–6 атомов углерода, подходяще 1–3 атомов углерода.
[0093] В контексте настоящей заявки, как таковой или вместе с другим термином или терминами, “фармацевтически приемлемый” относится к веществам, которые, как правило, химически и/или физически совместимы с другими ингредиентами (например, в контексте композиции) и/или, как правило, физиологически совместимы их реципиентом (таким как, например, субъект).
[0094] В контексте настоящей заявки, как таковой или вместе с другим термином или терминами, термин “фармацевтическая композиция” относится к композиции, которую можно использовать для лечения заболевания, состояния или расстройства у субъекта, включая человека.
[0095] В контексте настоящей заявки, как таковые или вместе с другим термином или терминами, “стабильный” и “химически стабильный” относится к соединению, которое является достаточно устойчивым для выделения из реакционной смеси с полезной степенью чистоты. Настоящая заявка направлена исключительно на получение стабильных соединений. Когда перечни альтернативных заместителей включают членов, которые из–за требований к валентности, химической стабильности или других причин не могут быть использованы для замещения конкретной группы, такой перечень следует рассматривать в контексте как включающий тех членов перечня, которые подходят для замещения конкретной группы. Например, при рассмотрении степени необязательного замещения конкретного фрагмента следует понимать, что число заместителей не превышает валентность, подходящую для этого фрагмента. Например, если R1 представляет собой метильную группу (–CH3), она может быть необязательно замещена 1–3 заместителями R5.
[0096] В контексте настоящей заявки, как таковой или вместе с другим термином или терминами, “замещенный” означает, что атом водорода в молекуле замещен другим атомом или группой атомов, а такой атом или группа атомов, замещающие атом водорода, является “заместителем”. Следует понимать, что термины “заместитель”, “заместители”, “фрагмент”, “фрагменты”, “группа” или “группы” относятся к заместителю(заместителям).
[0097] В контексте настоящей заявки “фармацевтический продукт” относится к продукту, включающему фармацевтический препарат. Например, примеры фармацевтического продукта включают медицинское устройство, фармацевтическую композицию и набор, включающий одно или несколько медицинских устройств и/или фармацевтическую композицию. Соответственно, фармацевтический продукт представляет собой фармацевтическую композицию.
Способы лечения и медицинские применения
[0098] В одном аспекте настоящее изобретение обеспечивает способ для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества ингибитора MPS1, где:
(i) указанный субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии.
[0099] В другом аспекте настоящее изобретение обеспечивает ингибитор MPS1 для применения в лечении эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, где:
(i) субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии.
[00100] В другом аспекте настоящее изобретение обеспечивает применение ингибитора MPS1 для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, где:
(i) субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии.
[00101] В одном варианте осуществления каждого из описанных выше аспектов, субъект ранее лечился препаратом эндокринной терапии. Типично, необходимость в дальнейшем лечении предполагает, что предшествующая эндокринная терапия оказалась неэффективной.
[00102] Специалист в данной области легко сможет определить неэффективность лечения. В одном варианте осуществления неэффективность эндокринной терапии у субъекта проявляется как рецидив и/или повторное появление рака в процессе или после эндокринной терапии.
[00103] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность эндокринной терапии у субъекта наблюдается как прогрессирование заболевания в процессе или после эндокринной терапии, например, увеличение размера первичной опухоли и/или распространение заболевания; например, в регионарные узлы или за их пределы в более отдаленные участки метастазирования.
[00104] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность эндокринной терапии у субъекта определяется по патологическим изменениям, таким как повышенная степень злокачественности опухоли.
[00105] в одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность эндокринной терапии у субъекта определяется по повышенной пролиферации рака.
[00106] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность эндокринной терапии у субъекта наблюдается как отсутствие ответа рака; например, никакого существенного изменения/недостаточное изменение размера опухоли и/или отсутствие существенного уровня/недостаточный уровень патологического ответа.
[00107] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения у субъекта развился резистентный к эндокринной терапии рак молочной железы в процессе или после эндокринной терапии. Этот феномен можно назвать приобретенной резистентностью.
[00108] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения рак молочной железы является резистентным к эндокринной терапии. В одном варианте осуществления резистентность к эндокринной терапии наблюдается в процессе или после эндокринной терапии, которая может изначально приводить к положительному ответу (т.е. приобретенная резистентность). В другом варианте осуществления резистентность к эндокринной терапии наблюдается на раннем этапе эндокринной терапии без периода положительного ответа, что предполагает врожденную или de novo резистентность. В другом варианте осуществления субъект не принимал ранее эндокринную терапию, и резистентность рака молочной железы к эндокринной терапии определена на основании фенотипических или генотипических маркеров.
[00109] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является резистентным к эндокринной терапии, и субъект не принимал ранее эндокринную терапию.
[00110] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является de novo резистентным к эндокринной терапии.
[00111] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является резистентным к эндокринной терапии и продолжает экспрессировать эстрогеновые рецепторы, в частности ER–альфа.
[00112] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы имеет ESR1–активирующую мутацию. Подходящим образом, ESR1–активирующая мутация выбрана из Y537S, Y537N, Y537C, D538G, E380Q, S463P, L536R. Подходящим образом, ESR1–активирующая мутация выбрана из Y537S, Y537N и Y537C. Подходящим образом, ESR1–активирующая мутация представляет собой Y537C.
[00113] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является резистентным к эндокринной терапии и имеет ESR1–активирующую мутацию. Подходящим образом, ESR1–активирующая мутация выбрана из Y537S, Y537N, Y537C, D538G, E380Q, S463P, L536R. Подходящим образом, ESR1–активирующая мутация выбрана из Y537S, Y537N и Y537C. Подходящим образом, ESR1–активирующая мутация представляет собой Y537C.
[00114] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы чрезмерно экспрессирует фосфо–KNL1 белок.
[00115] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является резистентным к эндокринной терапии, и рак молочной железы чрезмерно экспрессирует фосфо–KNL1 белок.
[00116] В одном варианте осуществления каждого из аспектов настоящего изобретения субъекта дополнительно ранее лечили ингибитором CDK4/6. Типично, необходимость в дальнейшем лечении предполагает, что предшествующее лечение ингибитором CDK4/6 было неудачным.
[00117] Специалист в данной области легко сможет определить неэффективность лечения. В одном варианте осуществления неэффективность лечения ингибитором CDK4/6 у субъекта проявляется как рецидив и/или повторное появление рака в процессе или после лечения ингибитором CDK4/6.
[00118] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность лечения ингибитором CDK4/6 у субъекта наблюдается как прогрессирование заболевания в процессе или после лечения ингибитором CDK4/6, например, увеличение размера первичной опухоли и/или распространение заболевания; например, в регионарные узлы или за их пределы в более отдаленные участки метастазирования.
[00119] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность лечения ингибитором CDK4/6 у субъекта определяется по патологическим изменениям, таким как повышенная степень злокачественности опухоли.
[00120] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность лечения ингибитором CDK4/6 у субъекта определяется по повышенной пролиферации рака.
[00121] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения неэффективность лечения ингибитором CDK4/6 у субъекта наблюдается как отсутствие ответа рака; например, отсутствие изменения размера опухоли и/или отсутствие признаков патологического ответа.
[00122] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения у субъекта развился резистентный к ингибитору CDK4/6 рак молочной железы в процессе или после лечения ингибитором CDK4/6. Этот феномен можно назвать приобретенной резистентностью.
[00123] В одном варианте осуществления каждого из аспектов или вариантов осуществления настоящего изобретения рак молочной железы является резистентным к лечению ингибитором CDK4/6. В одном варианте осуществления резистентность к ингибитору CDK4/6 наблюдается в процессе или после лечения ингибитором CDK4/6, которое может изначально приводить к положительному ответу (т.е. приобретенная резистентность). В другом варианте осуществления резистентность к ингибитору CDK4/6 наблюдается в начале лечения ингибитором CDK4/6, без периода положительного ответа, что предполагает врожденную или de novo резистентность. В другом варианте осуществления субъект ранее не получал лечение ингибитором CDK4/6, и резистентность рака молочной железы ингибитор CDK4/6 определена на основании фенотипических или генотипических маркеров.
[00124] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является резистентным к ингибиторам CDK4/6, и субъект ранее не получал лечение ингибитором CDK4/6.
[00125] В одном варианте осуществления каждого из аспектов настоящего изобретения рак молочной железы является de novo резистентным к ингибиторам CDK4/6.
[00126] В одном варианте каждого из аспектов или вариантов осуществления настоящего изобретения ингибитор MPS1 вводят/предназначен для введения отдельно, последовательно и/или комбинации с эндокринной терапией. Подходящим образом, эндокринная терапия включает/состоит по существу из/состоит из лечения эндокринным средством.
[00127] В одном аспекте настоящее изобретение обеспечивает применение ингибитора MPS1 в качестве терапии второй или третьей линии для лечения эстрогеновый рецептор–положительного рака молочной железы, в частности, резистентного к эндокринной терапии ER+ рака молочной железы.
[00128] В одном варианте осуществления ингибитор MPS1 используют в качестве терапии третьей линии, а терапия первой линии включала лечение эндокринным средством, и терапия второй линии включала лечение ингибитором CDK4/6.
[00129] В одном варианте осуществления ингибитор MPS1 используют в качестве терапии второй линии, а терапия первой линии включала лечение эндокринным средством. В другом варианте осуществления ингибитор MPS1 используют в качестве терапии третьей линии, а каждая из терапий первой и второй линии включала лечение эндокринным средством.
[00130] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения субъектом является человек. Подходящим образом, субъектом является субъект женского пола.
[00131] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения субъект находится в постменопаузальном периоде. В другом варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения субъект находится в пременопаузальном периоде.
[00132] В способах и медицинских применениях по изобретению ингибиторы MPS1 и/или эндокринные средства можно вводить/предназначены для введения субъекту любым удобным путем введения.
[00133] Пути введения включают, но не ограничиваются этим, пероральный (например, прием внутрь); буккальный; сублингвальный; трансдермальный (включая, например, нанесением пятна, с использованием пластыря и т.д.); трансмукозальный (включая, например, нанесением пятна, с использованием пластыря и т.д.); интраназальный (например, с использованием назального спрея); глазной (например, с использованием глазных капель); пульмональный (например, путем ингаляции или инсуффляции с использованием, например, аэрозоля, например, через рот или нос); ректальный (например, с использованием суппозитория или клизмы); вагинальный (например, с использованием пессария); парентеральный, например, путем инъекции, включая подкожную, внутрикожную, внутримышечную, внутривенную, внутриартериальную, внутрисердечную, интратекальную, интраспинальную, интракапсулярную, субкапсулярную, интраорбитальную, интраперитонеальную, интратрахеальную, подкожную, интраартикулярную, субарахноидальную и интрастернальную; путем имплантации депо или резервуара, например, подкожно или внутримышечно. Подходящий путь введения выбран из перорального и парентерального введения.
[00134] Терапевтические средства (т.е. ингибиторы MPS1, эндокринные средства, ингибиторы CDK4/6) для применения в описанных в настоящей заявке способах могут быть в форме, подходящей для введения субъекту. Например, для перорального введения используют таблетки, пастилки, твердые или мягкие капсулы, водные или масляные суспензии, эмульсии, диспергируемые порошки или гранулы, сиропы или эликсиры; для местного применения используют кремы, мази, гели или водные или масляные растворы или суспензии); для введения путем ингаляции используют тонкоизмельченный порошок или жидкий аэрозоль; для введения путем инсуффляции используют мелкодисперсный порошок); или для парентерального введения используют стерильный водный или масляный раствор для внутривенного, подкожного, внутримышечного, внутрибрюшинного или внутримышечного введения; или суппозиторий для ректального введения.
[00135] Подходящие фармацевтические композиции можно получить, используя обычные процедуры, необязательно, с использованием обычных фармацевтических наполнителей, хорошо известных в данной области. Таким образом, композиции, предназначенные для перорального применения, могут содержать, например, один или несколько красителей, подсластителей, ароматизаторов и/или консервантов.
[00136] Эффективное количество средств (т.е. ингибиторов MPS1, эндокринных средств, ингибиторов CDK4/6) в способах, описанных в настоящей заявке, представляет собой количество, достаточное для лечения или профилактики указанного рака молочной железы, описанного в настоящей заявке, для замедления прогрессирования заболевания и/или уменьшения симптомов, связанных с состоянием.
[00137] Количество активного ингредиента, которое комбинируют с одним или несколькими эксципиентами для получения одной лекарственной формы, обязательно будет варьироваться в зависимости от индивидуума, которого лечат, и конкретного пути введения. Например, композиция, предназначенная для перорального введения людям, обычно будет содержать, например, от 0,5 мг до 0,5 г активного вещества (более предпочтительно от 0,5 до 100 мг, например от 1 до 30 мг), смешанного с подходящим и удобным количеством эксципиентов, которое может варьироваться от около 5 до около 98 процентов в расчете на общую массу композиции.
[00138] Размер дозы средства для терапевтических или профилактических целей, естественно, будет варьироваться в зависимости от природы и тяжести состояния, возраста и пола животного или пациента и пути введения в соответствии с хорошо известными правилами медицины.
[00139] Следует отметить, что дозировки и режимы дозирования могут варьироваться в зависимости от типа и тяжести состояния, подлежащего облегчению, и могут включать введение однократной или многократных доз, т.е. QD (один раз в день), BID (два раза в день) и т.д., в течение определенного периода времени (дни или часы). Кроме того, следует понимать, что для любого конкретного субъекта или пациента возможно будет необходимо скорректировать конкретные режимы дозировки с течением времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, осуществляющего введение или контролирующего введение фармацевтических композиций. Например, дозы могут быть скорректированы на основании фармакокинетических или фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты, и/или лабораторные показатели. Таким образом, настоящая заявка охватывает повышение дозы для индивидуального пациента, определяемое специалистом в данной области. Процедуры и способы для определения подходящей дозировки и схем введения хорошо известны в соответствующей области, и специалист в данной области легко может установить их. Таким образом, специалисту в данной области будет очевидно и понятно, что диапазоны доз, описанные в настоящей заявке, приведены только в качестве примера и не предназначены для ограничения объема или осуществления на практике фармацевтических композиций, описанных в настоящей заявке.
Эндокринная терапия
[00140] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринная терапия включает/состоит по существу из/состоит из лечения эндокринным средством.
[00141] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринное средство выбрано из одного или нескольких из ингибитора ароматазы, селективного модулятора эстрогеновых рецепторов (SERM) и селективного деструктора/даун–регулятора эстрогеновых рецепторов (SERD).
[00142] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения ингибитором ароматазы и SERD.
[00143] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения ингибитором ароматазы и SERM.
[00144] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения с использованием SERM и SERD.
[00145] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения SERM выбран из группы, состоящей из тамоксифена, афимоксифена, ралоксифена, торемифена, базедоксифена и лазофоксифена или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERM выбирают из группы, состоящей из тамоксифена, ралоксифена, торемифена, базедоксифена и лазофоксифена или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERM выбирают из группы, состоящей из тамоксифена, ралоксифена и торемифена или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERM выбирают из группы, состоящей из тамоксифена и торемифена или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERM выбирают из группы, состоящей из тамоксифена и ралоксифена или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERM представляет собой тамоксифен или его фармацевтически приемлемые соли или сольваты.
[00146] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор ароматазы выбран из группы, состоящей из анастрозола, экземестана, летрозола, фадрозола и форместана или их фармацевтически приемлемых солей или сольватов. Подходящим образом, ингибитор ароматазы выбирают из группы, состоящей из анастрозола, экземестана, летрозола и фадрозола или их фармацевтически приемлемых солей или сольватов. Подходящим образом, ингибитор ароматазы выбирают из группы, состоящей из анастрозола, экземестана и летрозола или их фармацевтически приемлемых солей или сольватов. Подходящим образом, ингибитор ароматазы выбирают из группы, состоящей из анастрозола и летрозола или их фармацевтически приемлемых солей или сольватов. Подходящим образом, ингибитор ароматазы выбирают из группы, состоящей из анастрозола и экземестана или их фармацевтически приемлемых солей или сольватов. Подходящим образом, ингибитор ароматазы выбирают из группы, состоящей из экземестана и летрозола или их фармацевтически приемлемых солей или сольватов.
[00147] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения SERD выбран из группы, состоящей из фулвестранта, бриланестранта и элацестранта или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERD выбирают из группы, состоящей из фулвестранта и элевестранта или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERD выбирают из группы, состоящей из фулвестранта и бриланестранта или их фармацевтически приемлемых солей или сольватов. Подходящим образом, SERD представляет собой фулвестрант или его фармацевтически приемлемые соли или сольваты.
[00148] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринная терапия включает/по существу состоит из/состоит из отдельного, последовательного или комбинированного лечения анастрозолом и фулвестрантом.
[00149] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения эндокринная терапия включает/по существу состоит из/состоит из отдельного, последовательного или комбинированного лечения тамоксифеном и фулвестрантом
Ингибиторы MPS1
[00150] В одном варианте осуществления аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 представляет собой соединение, способное ингибировать MPS1 киназу. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 100нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 75нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 50нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 25нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 10нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 8нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 5нМ или меньше. Подходящим образом, соединение имеет значение IC50 для ингибирования MPS1 киназы 3нМ или меньше.
[00151] IC50 для ингибирования MPS1 киназы можно определить любым подходящим способом. Например, IC50 можно определить путем осуществления анализа ингибирования фермента in vitro, включающего полноразмерный MPS1, подходящий флуорофор, испытываемое соединение и аналитический буфер.
[00152] Подходящим образом, IC50 определяют путем испытания соединений в диапазоне концентраций.
[00153] Подходящим образом, флуорофор может представлять собой флуоресцентно–меченный пептид, например H236, который имеет последовательность: 5FAM–DHTGFLTEYVATR–CONH2.
[00154] Подходящим образом, анализ ингибирования фермента осуществляют при комнатной температуре (21°C±3°C) примерно в течение одного часа.
[00155] В одном варианте осуществления анализ ингибирования фермента (общий объем 10мкл) осуществляли в черных 384–луночных планшетах малого объема, содержащих полноразмерный MPS1 (12,5нМ или 3нМ), флуоресцентный меченный пептид [известный как H236, который имеет последовательность: 5FAM–DHTGFLTEYVATR–CONH2] (5мкМ), АТФ(10мкМ), либо DMSO (1% об/об), либо испытываемое соединение (в диапазоне 0,25нМ–100мкМ в 1% DMSO) и аналитический буфер (50мМ HEPES (pH 7,0), 0,02% NaN3, 0,01% BSA, 0,1мМ Ортованадата, 10мкМ MgCl2, 1мкМ DTT, ингибитор протеазы Roche). Реакцию осуществляли в течение 60 мин при комнатной температуре и останавливали путем добавления буфера (10мкл), содержащего 20мМ EDTA, 0,05% (об/об) Brij–35, в 0,1M HEPES–забуференном физиологическом растворе (Free acid, Sigma, UK). Планшет считывали на считывающем устройстве Caliper EZ reader II (Caliper Life Sciences).
[00156] Считывающее устройство обеспечивает пакет программ (‘Reviewer’), которое преобразовывает высоту пиков в % конверсии путем измерения как пика продукта, так и субстрата, а также позволяет выбрать контрольную лунку, которая представляет 0% и 100% ингибирование, соответственно. % ингибирования для соединений рассчитывают относительно средних значений выбранных контрольных лунок. Значения IC50 определяют путем испытания соединений в диапазоне концентраций 0,25 нМ – 100 мкМ. % ингибирования при каждой концентрации затем используют для 4–параметрического логистического уравнения:
y = (a+((b–a)/(1+((c/x^d))))
где a= asym мин., b= asym макс., c= IC50 и d=коэффициент Хилла
[00157] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, S 81694 (NMS–P153), AZ3146, BAY 1217389, BAY 1161909, MPS1–IN–3, MPS1–IN–2, CFI–402257, CCT289346, соединения формулы I, соединения формулы II, соединения формулы III и соединения формулы IV или фармацевтически приемлемой соли или сольвата такого соединения;
где формула I представляет собой:
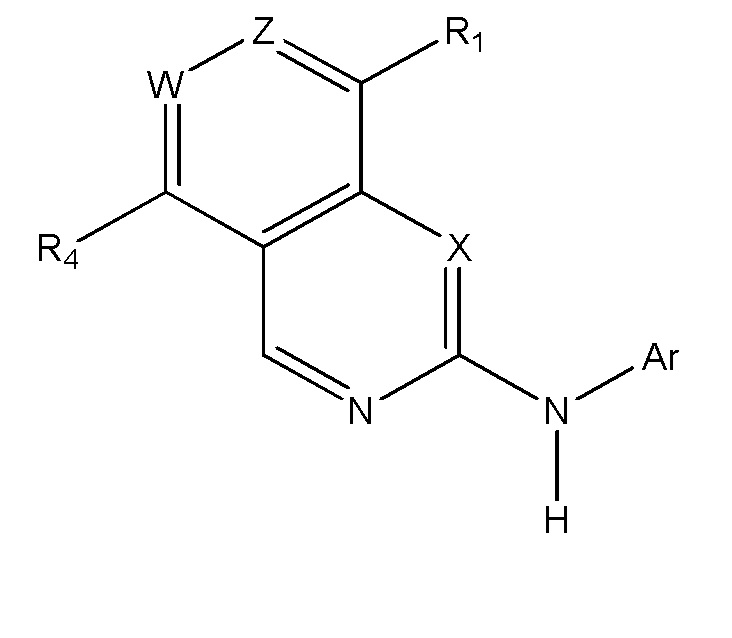
I
где:
W представляет собой N или C–R3;
X представляет собой CH или N;
Z представляет собой N или C–H;
R1 выбран из хлора, (1–6C)алкила, (1–8C)гетероалкила, арила, арил(1–2C)алкила, гетероарила, гетероарил(1–2C)алкила, гетероциклила, гетероциклил(1–2C)алкила, (3–8C)циклоалкила, (3–8C)циклоалкил(1–2C)алкила, NR7R8, OR9, C(O)R9, C(O)OR9, OC(O)R9, N(R10)OR9, N(R10)C(O)OR9, C(O)N(R10)R9, N(R10)C(O)R9, S(O)pR9 (где p имеет значение 0, 1 или 2), SO2N(R10)R9, N(R10)SO2R9, N(R10)SOR9 или SON(R10)R9;
и где R1 необязательно замещен одной или несколькими замещающими группами, выбранными из фтора, хлора, трифторметила, трифторметокси, циано, нитро, гидрокси, амино, карбокси, карбамоила, сульфамоила, (1–4C)алкила, (1–4C)алкокси, S(O)qCH3 (где q имеет значение 0, 1 или 2), метиламино или диметиламино, арила, арил(1–2C)алкила, гетероарила, гетероарил(1–2C)алкила, гетероциклила, гетероциклил(1–2C)алкила, (3–8C)циклоалкила или (3–8C)циклоалкил(1–2C)алкила,
и где любая (1–4C)алкильная, (1–4C)алкокси, арильная, гетероарильная, гетероциклильная или (3–8C)циклоалкильная группа, присутствующая в группе заместителя на R1, необязательно дополнительно замещена фтором, хлором, трифторметилом, трифторметокси, циано, нитро, гидрокси, амино, карбокси, карбамоилом, сульфамоилом, (1–4C)алкилом, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p имеет значение 0, 1 или 2), SO2N(Rb)Ra, или N(Rb)SO2Ra, где Ra и Rb каждый независимо выбран из H или (1–4C)алкила;
R3 представляет собой водород, (1–4C)алкил, (3–6C)циклоалкил, галоген, CF3, CN и (1–4C)алкокси;
R4 представляет собой водород, (1–3C)алкил, (1–3C)алкокси, фтор, хлор или CF3;
Ar имеет формулу:
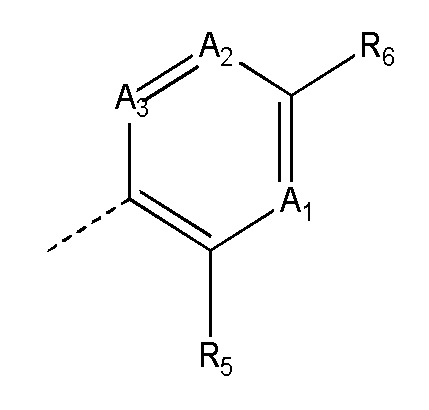
где:
(i) все из A1, A2 и A3 представляют собой CH;
(ii) один из A1, A2 и A3 представляет собой N, а другие представляют собой CH; или
(iii) два из A1, A2 и A3 представляют собой N, а один представляет собой CH;
R5 выбран из водорода, циано, (1–3C)алкила, (1–3C)фторалкила, (1–3C)алкокси, (1–3C)фторалкокси, галогена, (1–3C)алканоила, C(O)NR15R16 или S(O)2NR15R16, и где R15 и R16 каждый независимо выбран из H или (1–3C)алкила,
и где любые алкильные или алкокси группы, присутствующие в группе заместителя R5, необязательно дополнительно замещены гидрокси или метокси;
R6 выбран из галогена, трифторметила, трифторметокси, циано, нитро, гидрокси, амино, карбокси, карбамоила, сульфамоила, уреидо, (1–6C)алкила, (2–6C)алкенила, (2–6C)алкинила,
или R6 представляет собой группу формулы:
–L1–L2–R17
где
L1 отсутствует или представляет собой линкерную группу формулы –[CR18R19]n–, в которой n представляет собой целое число, выбранное из 1, 2, 3 или 4, и R18 и R19 каждый независимо выбран из водорода или (1–2C)алкила;
L2 отсутствует или выбран из O, S, SO, SO2, N(R20), C(O), C(O)O, OC(O), CH(OR20), C(O)N(R20), N(R20)C(O), N(R20)C(O)N(R21), S(O)2N(R20) или N(R21)SO2, где R20 и R21 каждый независимо выбран из водорода или (1–2C)алкила; и
R17 представляет собой (1–6C)алкил, арил, арил–(1–6C)алкил, (3–6C)циклоалкил, (3–6C)циклоалкил–(1–4C)алкил, гетероарил, гетероарил–(1–4C)алкил, гетероциклил, гетероциклил–(1–4C)алкил,
и где R17 необязательно дополнительно замещен одной или несколькими замещающими группами, независимо выбранными из оксо, галогена, циано, нитро, гидрокси, NR22R23, (1–4C)алкокси, (1–4C)алкила, (3–8C)циклоалкила, (3–8C)циклоалкил–(1–3C)алкила, (1–5C)алканоила, (1–5C)алкилсульфонила, гетероциклила, гетероциклил–(1–2C)алкила, гетероарила, гетероарил–(1–2C)алкила, CONR22R23 и SO2NR22R23; где R22 и R23 каждый независимо выбран из водорода, (1–4C)алкила или (3–6C)циклоалкила или (3–6C)циклоалкил(1–2C)алкила;
и при этом, когда указанная группа заместителя включает алкильную, циклоалкильную, гетероциклильную или гетероарильную группу, тогда указанная группа необязательно дополнительно замещена гидрокси, фтором, хлором, циано, CF3, OCF3, (1–2C)алкилом, (1–2C)алкокси, SO2(1–2C)алкилом или NReRf (где Re и Rf каждый независимо выбран из водорода, (1–3C)алкила, (3–6C)циклоалкила или (3–6C)циклоалкил(1–2C)алкила);
или R17 представляет собой группу, имеющую формулу:
–L3–L4–R24
L3 отсутствует или представляет собой линкерную группу формулы –[CR25R26]n–, в которой n представляет собой целое число, выбранное из 1, 2, 3 или 4, и R25 и R26 каждый независимо выбран из водорода или (1–2C)алкила;
L4 отсутствует или выбран из O, S, SO, SO2, N(R27), C(O), C(O)O, OC(O), CH(OR27), C(O)N(R27), N(R27)C(O), N(R27)C(O)N(R28), S(O)2N(R27) или N(R28)SO2, где R27 и R28 каждый независимо выбран из водорода или (1–2C)алкила; и
R24 представляет собой (1–6C)алкил, арил, арил–(1–6C)алкил, (3–6C)циклоалкил, (3–6C)циклоалкил–(1–4C)алкил, гетероарил, гетероарил–(1–4C)алкил, гетероциклил, гетероциклил–(1–4C)алкил;
R8 и R9 каждый независимо выбран из водорода, (1–6C)алкила, (1–6C)алкокси, (3–9C)циклоалкила, (3–9C)циклоалкил–(1–2C)алкила, арила, арил–(1–2C)алкила, гетероциклила, гетероциклил–(1–2C)алкила, гетероарила, гетероарил–(1–2C)алкила, и при этом R8 и R9 необязательно дополнительно замещены одним или нескольким заместителями, выбранными из гидрокси, фтора, хлора, циано, CF3, OCF3 (1–2C)алкила или (1–2C)алкокси;
R7 и R10 независимо выбраны из водорода, (1–6C)алкила, (3–6C)циклоалкила, (3–6C)циклоалкил–(1–2C)алкила, и при этом R7 и R10 необязательно дополнительно замещены одним или нескольким заместителями, выбранными из гидрокси, фтора, хлора, циано, CF3, OCF3, (1–2C)алкила или (1–2C)алкокси;
необязательно с соблюдением условия, что:
X означает только N, когда Z представляет собой N;
W означает только N, когда X и Z оба представляют собой N; и
R6 не является метокси, когда R1 представляет собой S(O)2R9 и R9 представляет собой гетероциклил;
где формула II представляет собой:
II
где:
R1 выбран из:
(i) 5– или 6–членного гетероарила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из галогена, трифторметила, дифторметила, трифторметокси, дифторметокси, циано, нитро, (1–4C)алкила, NRaRb, ORa, C(O)Ra, C(O)ORa, OC(O)Ra, N(Rb)ORa, C(O)N(Rb)Ra, N(Rb)C(O)Ra, S(O)pRa (где p имеет значение 0, 1 или 2), SO2N(Rb)Ra или N(Rb)SO2Ra,
где Ra и Rb каждый независимо выбран из H или (1–4C)алкила, и при этом любая алкильная группа, присутствующая в группе заместителя, необязательно дополнительно замещена одним или несколькими заместителями, выбранными из галогена, трифторметила, дифторметила, трифторметокси, дифторметокси, циано, нитро, (1–4C)алкила, 4–7–членного гетероциклила, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)qRc (где q имеет значение 0, 1 или 2), SO2N(Rd)Rc, или N(Rd)SO2Rc, где Rc и Rd каждый независимо выбран из H или (1–4C)алкила; или
где 5– или 6–членный гетероарил необязательно конденсирован с 4–, 5–, 6– или 7–членным гетероциклическим кольцом, где конденсированная кольцевая система необязательно замещена одним или несколькими заместителями, независимо выбранными из галогена, трифторметила, дифторметила, трифторметокси, дифторметокси, циано, нитро, (1–4C)алкила, NRkRl, ORk, C(O)Rk, C(O)ORk, OC(O)Rk, N(Rl)ORk, C(O)N(Rl)Rk, N(Rl)C(O)Rk, S(O)pRk (где p имеет значение 0, 1 или 2), SO2N(Rk)Rl или N(Rk)SO2Rl, где Rk и Rl каждый независимо выбран из H или (1–4C)алкила,
и где любая алкильная группа, присутствующая в группе заместителя, необязательно дополнительно замещена одним или несколькими заместителями, выбранными из галогена, трифторметила, дифторметила, трифторметокси, дифторметокси, циано, нитро, (1–4C)алкила, 4–7–членного гетероциклила, NRmRn, ORm, C(O)Rm, C(O)ORm, OC(O)Rm, N(Rn)ORm, C(O)N(Rn)Rm, N(Rn)C(O)Rm, S(O)qRm (где q имеет значение 0, 1 или 2), SO2N(Rn)Rm или N(Rn)SO2Rm, где Rm и Rn каждый независимо выбран из H или (1–4C)алкила; или
(ii) группы –C(O)N(Rf)Re– или –S(O)2N(Rf)Re–;
где Re и Rf каждый независимо выбран из H или (1–4C)алкила, который необязательно замещен галогеном или (1–2C)алкокси;
или Re и Rf связаны так, что вместе с атомом азота, к которому они присоединены, они образуют 4–, 5– или 6–членное гетероциклическое кольцо, где указанное кольцо необязательно замещено одним или несколькими заместителями, независимо выбранными из галогена, трифторметила, дифторметила, трифторметокси, дифторметокси, циано, нитро, (1–4C)алкила, NRgRh, ORg, C(O)Rg, C(O)ORg, OC(O)Rg, N(Rh)ORg, C(O)N(Rh)Rg, N(Rh)C(O)Rg, S(O)pRh (где p имеет значение 0, 1 или 2), SO2N(Rh)Rg или N(Rh)SO2Rg, где Rg и Rh каждый независимо выбран из H или (1–4C)алкила;
R2 выбран из водорода, фтора, хлора, (1–3C)алкокси или (1–3C)фторалкокси;
и либо:
(i) R3 выбран из водорода или (1–3C)алкила, и R4 выбран из (1–6C)алкила, (3–9C)циклоалкила, (3–9C)циклоалкил–(1–4C)алкила, арила, арил–(1–4C)алкила, гетероциклила, гетероциклил–(1–4C)алкила, гетероарила, гетероарил–(1–4C)алкила, и при этом R4 необязательно дополнительно замещен одним или нескольким заместителями, выбранными из гидрокси, фтора, хлора, циано, CF3, CHF2, OCF3, OCHF2, (1–4C)алкил, NRoRp, ORo, C(O)Ro, C(O)ORp, OC(O)Ro, N(Rp)ORo, C(O)N(Rp)Ro, N(Rp)C(O)Ro, S(O)pRo (где p имеет значение 0, 1 или 2), SO2N(Rp)Ro или N(Rp)SO2Ro, или (3–6C)циклоалкила, (3–6C)циклоалкил–(1–2C)алкила, 4, 5 или 6–членного гетероциклила, 4–, 5– или 6–членного гетероциклил–(1–2C)алкила, где Ro и Rp каждый независимо выбран из H или (1–4C)алкила, (3–6C)циклоалкила или (3–6C)циклоалкил–(1–4C)алкила; либо
(ii) R3 и R4 связаны так, что вместе с атомом азота, к которому они присоединены, они образуют азот–связанное 4–, 5– 6– или 7–членного гетероциклическое кольцо,
где указанное кольцо необязательно конденсировано с дополнительным 3–, 4–, 5– или 6–членным кольцом карбоциклическим или гетероциклическим кольцом, 5– или 6–членным гетероарильным кольцом или фенильным кольцом с образованием бициклической гетероциклической системы, или
связано через спиро атом углерода с дополнительным 4–, 5– или 6–членным кольцом карбоциклическим или гетероциклическим кольцом с образованием спиро бициклической кольцевой системы;
и при этом гетероциклическое кольцо, бициклическая кольцевая система или спиро бициклическая кольцевая система необязательно замещены одним или несколькими заместителями, независимо выбранными из галогена, трифторметила, дифторметила, трифторметокси, дифторметокси, циано, нитро, (1–4C)алкила, NRiRj, ORi, C(O)Ri, C(O)ORi, OC(O)Ri, N(Rj)ORi, C(O)N(Rj)Ri, N(Rj)C(O)Ri, S(O)qRi (где q имеет значение 0, 1 или 2), SO2N(Rj)Ri или N(Rj)SO2Ri, где Ri и Rj каждый независимо выбран из H или (1–4C)алкила;
необязательно при условии, что указанное соединение не является одним из следующих:
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(2–метокси–4–(1–(2–метоксиэтил)–2–метил–1H–имидазол–5–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(2–метокси–4–(4–(метилсульфонил)пиперазин–1–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(4–(1,3–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(6–окса–2–азаспиро[3.4]октан–2–ил)пиридо[3,4–d]пиримидин–2–амин;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(1–метил–1H–1,2,4–триазол–5–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
N2–(2–(дифторметокси)–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(2–метокси–2–метилпропил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
(4–(3–метокси–4–((8–((2–метокси–2–метилпропил)амино)–6–метилпиридо[3,4–d]пиримидин–2–ил)амино)фенил)–1–метил–1H–пиразол–5–ил)метанол;
где формула III представляет собой
III
где:
X представляет собой CH или N;
Y представляет собой N или C–H;
R2 выбран из (1–6C)алкила, (1–8C)гетероалкила, арила, арил(1–2C)алкила, 5 или 6–членного гетероарила, 5 или 6–членного гетероарил(1–2C)алкила, 3–6–членного гетероциклила, 3– 6–членного гетероциклил(1–2C)алкила, (3–8C)циклоалкила, (3–8C)циклоалкил(1–2C)алкила, NR11R12, OR13, C(O)R13, C(O)OR13, OC(O)R13, N(R14)OR13, N(R14)C(O)OR13, C(O)N(R14)R13, N(R14)C(O)R13, S(O)xR13 (где x имеет значение 0, 1 или 2), SO2N(R14)R13 или N(R14)SO2R13;
и где R2 необязательно замещен одной или несколькими замещающими группами, выбранными из фтора, хлора, трифторметила, трифторметокси, циано, нитро, гидрокси, амино, карбокси, карбамоила, сульфамоила, (1–4C)алкила, (1–4C)алкокси, S(O)xCH3 (где x имеет значение 0, 1 или 2), метиламино или диметиламино, арила, арил(1–2C)алкила, гетероарила, гетероарил(1–2C)алкила, гетероциклила, гетероциклил(1–2C)алкила, (3–8C)циклоалкила или (3–8C)циклоалкил(1–2C)алкила,
и где любая (1–4C)алкильная, (1–4C)алкокси, арильная, гетероарильная, гетероциклильная или (3–8C)циклоалкильная группа, присутствующая в группе заместителя на R2, необязательно дополнительно замещена фтором, хлором, трифторметилом, трифторметокси, циано, нитро, гидрокси, амино, карбокси, карбамоилом, сульфамоилом, (1–4C)алкилом, NRcRd, ORc, C(O)Rc, C(O)ORc, OC(O)Rc, N(Rd)ORc, C(O)N(Rd)Rc, N(Rd)C(O)Rc, S(O)yRc (где y имеет значение 0, 1 или 2), SO2N(Rd)Rc или N(Rd)SO2Rc, где Rc и Rd каждый независимо выбран из H или (1–4C)алкила;
R3 представляет собой водород, (1–4C)алкил, (3–6C)циклоалкил, галоген, CF3, CN и (1–4C)алкокси;
R4 представляет собой водород, (1–3C)алкил, фтор, хлор или CF3;
Ar имеет формулу:
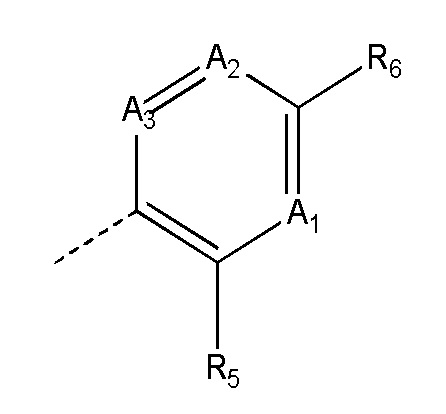
где:
(i) все из A1, A2 и A3 представляют собой CH; или
(ii) A3 представляет собой CH, и A1 или A2 выбраны из N или CH;
R5 представляет собой водород, циано, (1–3C)алкил, (1–3C)фторалкил, (1–3C)алкокси, (1–3C)фторалкокси, галоген, (1–3C)алканоил, C(O)NR15R16 или S(O)2NR15R16, и где R15 и R16 каждый независимо выбран из H или (1–3C)алкила, и при этом любые алкильные или алкокси группы, присутствующие в R5 группе заместителя, необязательно дополнительно замещены гидрокси или метокси;
R6 представляет собой галоген, трифторметил, трифторметокси, циано, нитро, гидрокси, амино, карбокси, карбамоил, сульфамоил, уреидо, (1–6C)алкил, (2–6C)алкенил, (2–6C)алкинил,
или R6 представляет собой группу формулы:
–L1–L2–R17
где
L1 отсутствует или представляет собой линкерную группу формулы –[CR18R19]n–, в которой n представляет собой целое число, выбранное из 1, 2, 3 или 4, и R18 и R19 каждый независимо выбран из водорода или (1–2C)алкила;
L2 отсутствует или выбран из O, S, SO, SO2, N(R20), C(O), C(O)O, OC(O), CH(OR20), C(O)N(R20), N(R20)C(O), N(R20)C(O)N(R21), S(O)2N(R20) или N(R21)SO2, где R20 и R21 каждый независимо выбран из водорода или (1–2C)алкила; и
R17 представляет собой (1–6C)алкил, арил, арил–(1–6C)алкил, (3–6C)циклоалкил, (3–6C)циклоалкил–(1–4C)алкил, гетероарил, гетероарил–(1–4C)алкил, гетероциклил, гетероциклил–(1–4C)алкил,
и где R17 необязательно дополнительно замещен одной или несколькими замещающими группами, независимо выбранными из оксо, галогена, циано, нитро, гидрокси, NR22R23, (1–4C)алкокси, (1–4C)алкила, (3–8C)циклоалкила, (3–8C)циклоалкил–(1–3C)алкила, (1–5C)алканоила, (1–5C)алкилсульфонила, гетероциклила, гетероциклил–(1–2C)алкила, гетероарила, гетероарил–(1–2C)алкила, CONR22R23 и SO2NR22R23; где R22 и R23 каждый независимо выбран из водорода, (1–4C)алкила или (3–6C)циклоалкила или (3–6C)циклоалкил(1–2C)алкила; или R22 и R23 могут быть связаны так, что вместе с атомом азота, к которому они присоединены, они образуют 4–6–членное гетероциклическое кольцо;
и при этом, когда указанная группа заместителя включает алкильную, циклоалкильную, гетероциклильную или гетероарильную группу, тогда указанная группа необязательно дополнительно замещена гидрокси, фтором, хлором, циано, CF3, OCF3, (1–2C)алкилом, (1–2C)алкокси, SO2(1–2C)алкилом или NReRf (где Re и Rf каждый независимо выбран из водорода, (1–3C)алкила, (3–6C)циклоалкила или (3–6C)циклоалкил(1–2C)алкила);
или R17 представляет собой группу, имеющую формулу:
–L3–L4–R24
где
L3 отсутствует или представляет собой линкерную группу формулы –[CR25R26]n–, в которой n представляет собой целое число, выбранное из 1, 2, 3 или 4, и R25 и R26 каждый независимо выбран из водорода или (1–2C)алкила;
L4 отсутствует или выбран из O, S, SO, SO2, N(R27), C(O), C(O)O, OC(O), CH(OR27), C(O)N(R27), N(R27)C(O), N(R27)C(O)N(R28), S(O)2N(R27) или N(R28)SO2, где R27 и R28 каждый независимо выбран из водорода или (1–2C)алкила; и
R24 представляет собой (1–6C)алкил, арил, арил–(1–6C)алкил, (3–6C)циклоалкил, (3–6C)циклоалкил–(1–4C)алкил, гетероарил, гетероарил–(1–4C)алкил, гетероциклил, гетероциклил–(1–4C)алкил;
R12 выбран из водорода, (1–6C)алкила, (1–6C)алкокси, (3–6C)циклоалкила, (3–6C)циклоалкил–(1–2C)алкила, арила, арил–(1–2C)алкила, гетероциклила, гетероциклил–(1–2C)алкила, гетероарила, гетероарил–(1–2C)алкила, и при этом R12 необязательно дополнительно замещен одним или нескольким заместителями, выбранными из гидрокси, фтора, хлора, циано, CF3, OCF3 (1–2C)алкила или (1–2C)алкокси;
R13 выбран из водорода, (1–6C)алкила, (1–6C)алкокси, (3–6C)циклоалкила, (3–6C)циклоалкил–(1–2C)алкила, арила, арил–(1–2C)алкила, гетероарила, гетероарил–(1–2C)алкила, и при этом R13 необязательно дополнительно замещен одним или нескольким заместителями, выбранными из гидрокси, фтора, хлора, циано, CF3, OCF3 (1–2C)алкила или (1–2C)алкокси;
R11 и R14 независимо выбраны из водорода, (1–6C)алкила, (3–6C)циклоалкила, (3–6C)циклоалкил–(1–2C)алкила, и при этом R11 и R14 необязательно дополнительно замещены одним или нескольким заместителями, выбранными из гидрокси, фтора, хлора, циано, CF3, OCF3, (1–2C)алкила или (1–2C)алкокси;
необязательно с соблюдением условия, что:
X может означать только N, когда Y представляет собой N; и
когда X и Y оба представляют собой N, R3 выбран из H или фтора, и R2 не является NR11R12 группой;
где формула IV представляет собой:
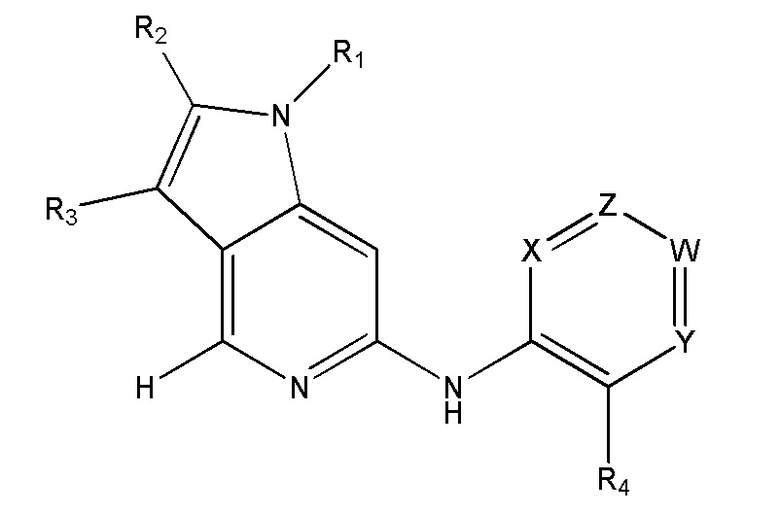
Формула I
где:
R1 представляет собой водород, (1–5C)алкил, (1–5C)фторалкил, (3–8C)циклоалкил, (3–8C)циклоалкил–(1–4C)алкил, арил, арил–(1–4C)алкил, гетероарил, гетероарил–(1–4C)алкил, –S(O)2–Ra, –C(O)–Ra или –C(O)–O–Ra, где Ra представляет собой (1–5C)алкил, (3–8C)циклоалкил, (3–8C)циклоалкил–(1–4C)алкил, арил, арил–(1–4C)алкил, гетероарил или гетероарил–(1–4C)алкил, и при этом любая (1–5C)алкильная, (3–8C)циклоалкильная, (3–8C)циклоалкил–(1–4C)алкильная, арильная, арил–(1–4C)алкильная, гетероарильная, гетероарил–(1–4C)алкильная группа, присутствующая в группе заместителя R1, необязательно замещена метилом, трифторметилом, метокси, трифторметокси, галогеном, циано, нитро, гидрокси, мекапто, амино, карбокси, карбамоилом или сульфамоилом;
R2 представляет собой арил, арил(1–2C)алкил, 5– или 6–членный гетероарил или 5– или 6–членный гетероарил(1–2C)алкил,
где R2 необязательно замещен одним или нескольким заместителями, выбранными из галоген, трифторметила, трифторметокси, циано, нитро, гидрокси, мекапто, амино, карбокси, карбамоила, сульфамоила,
или группы формулы:
L–L0–Rb
где
L отсутствует или представляет собой линкерную группу формулы –[CRgRh]n–, в которой n представляет собой целое число, выбранное из 1, 2, 3 или 4, и Rg и Rh каждый независимо выбран из водорода или (1–2C)алкила;
L0 отсутствует или выбран из O, S, SO, SO2, N(Rc), C(O), C(O)O, OC(O), CH(ORc), C(O)N(Rc), N(Rc)C(O), N(Rc)C(O)N(Rd), SO2N(Rc) или N(Rc)SO2, где Rc и Rd каждый независимо выбран из водорода или (1–2C)алкила; и
Rb представляет собой (1–4C)алкил, арил, арил–(1–4C)алкил, (3–6C)циклоалкил, (3–6C)циклоалкил–(1–4C)алкил, гетероарил, гетероарил–(1–4C)алкил, гетероциклил или гетероциклил–(1–4C)алкил;
и где Rb необязательно дополнительно замещен одним или несколькими заместителями, независимо выбранными из оксо, галоген, циано, нитро, гидрокси, NReRf, (1–5C)алкила, (1–5C)алкокси, (1–5C)алканоила, (1–5C)сульфонила или арила; и где Re и Rf каждый независимо выбран из водорода или (1–4C)алкила или (3–6C)циклоалкил–(1–4C)алкила; или Re и Rf могут быть связаны так, что вместе с атомом азота, к которому они присоединены, они образуют 4–7–членное гетероциклическое, гетероарильное или карбоциклическое кольцо;
R3 представляет собой H, (1–3C)алкил, галоген или CF3;
R4 представляет собой циано, (1–3C)алкил, (1–3C)фторалкил, (1–3C)алкокси, (1–3C)перфторалкокси, галоген, (1–3C)алканоил, C(O)NRiRj или S(O)2NRiRj; где Ri и Rj каждый независимо выбран из H или (1–3C)алкила;
X представляет собой CH или CR5;
W, Y и Z каждый независимо выбран из N, CH или CR5;
R5 представляет собой галоген, трифторметил, трифторметокси, циано, нитро, гидрокси, мекапто, амино, карбокси, карбамоил, сульфамоил, уреидо, (1–6C)алкил, (2–6C)алкенил, (2–6C)алкинил,
или R5 представляет собой группу формулы:
–L1–L2–R7
где
L1 отсутствует или представляет собой линкерную группу формулы –[CR8R9]n–, в которой n представляет собой целое число, выбранное из 1, 2, 3 или 4, и R8 и R9 каждый независимо выбран из водорода или (1–2C)алкила;
L2 отсутствует или выбран из O, S, SO, SO2, N(R10), C(O), C(O)O, OC(O), CH(OR10), C(O)N(R10), N(R10)C(O), N(R10)C(O)N(R11), S(O)2N(R10) или N(R13)SO2, где R10 и R11 каждый независимо выбран из водорода или (1–2C)алкила; и
R7 представляет собой (1–6C)алкил, арил, арил–(1–6C)алкил, (3–6C)циклоалкил, (3–6C)циклоалкил–(1–6C)алкил, гетероарил, гетероарил–(1–6C)алкил, гетероциклил, гетероциклил–(1–6C)алкил,
и где R7 необязательно дополнительно замещен одним или несколькими заместителями, независимо выбранными из водорода, оксо, галоген, циано, нитро, гидрокси, NR12R13, (1–4C)алкокси, (1–5C)алкила, (3–8C)циклоалкила, (3–8C)циклоалкил–(1–5C)алкила, арила, арил–(1–5C)алкила, (1–5C)алканоила, (1–5C)алкилсульфонила, гетероциклила, гетероциклил–(1–5C)алкила, гетероарила, гетероарил–(1–5C)алкила, CONR12R13 и SO2NR12R13;
R12 и R13 каждый независимо выбран из водорода или (1–2C)алкила; или R12 и R13 могут быть связаны так, что вместе с атомом азота, к которому они присоединены, они образуют 4–7–членное гетероциклическое или гетероарильное кольцо;
или любые W и Z, W и Y или Z и X оба представляют собой CR5, и R5 группы на смежных атомах углерода связаны так, что вместе с атомами углерода, к которым они присоединены, они образуют конденсированное 4–7–членное гетероциклическое, гетероарильное или карбоциклическое кольцо.
[00158] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, S 81694 (NMS–P153), AZ3146, BAY 1217389, BAY 1161909, MPS1–IN–3, MPS1–IN–2 и CFI–402257.
[00159] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, BAY 1217389 и BAY 1161909.
[00160] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, S 81694 (NMS–P153), AZ3146, BAY 1217389, BAY 1161909, CFI–402257, CCT289346, соединения формулы I, соединения формулы II, соединения формулы III и соединения формулы IV или фармацевтически приемлемой соли или сольвата вышеуказанного соединения.
[00161] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, AZ3146, BAY 1217389, BAY 1161909, CFI–402257, CCT289346, соединения формулы I, соединения формулы II, соединения формулы III и соединения формулы IV или фармацевтически приемлемой соли или сольвата вышеуказанного соединения.
[00162] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, BAY 1217389, BAY 1161909, CCT289346, соединения формулы I, соединения формулы II, соединения формулы III и соединения формулы IV или их фармацевтически приемлемых солей или сольватов.
[00163] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 не выбран из группы, состоящей из соединения формулы I, соединения формулы II, соединения формулы III и соединения формулы IV или их фармацевтически приемлемых солей или сольватов.
[00164] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из соединения формулы I, соединения формулы II, соединения формулы III и соединения формулы IV или их фармацевтически приемлемых солей или сольватов.
[00165] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, BAY 1217389, BAY 1161909 и CCT289346.
[00166] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из соединения формулы I или соединения формулы II, или их фармацевтически приемлемых солей или сольватов.
[00167] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из соединения формулы V:
(V)
где
Ra представляет собой водород;
Rb представляет собой C1–6 алкил, необязательно замещенный галогеном; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют 4–10–членное гетероциклическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из водорода, C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила;
Rc представляет собой C1–3 алкил; и
Ar1 представляет собой 5– или 6–членное гетероарильное кольцо, необязательно замещенное одним или несколькими заместителями, независимо выбранными из C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила.
[00168] В одном варианте осуществления формулы V Rb представляет собой C1–6 алкил, подходяще C5 и C6 алкил.
[00169] В другом варианте осуществления формулы V Ra и Rb вместе с атомом азота, к которому они присоединены, образуют азетидинильную группу, которая необязательно может быть замещена одной или несколькими группами, выбранными из C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила, или связана через спиро атом углерода с дополнительным 4–, 5– или 6–членным карбоциклическим или гетероциклическим кольцом с образованием спиро бициклической кольцевой системы, которая необязательно может быть замещена одной или несколькими группами, выбранными из водорода, C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила.
[00170] В одном варианте осуществления формулы V Rc выбран из метила и этила, предпочтительно этила.
[00171] В одном варианте осуществления формулы V Ar1 представляет собой 5–членную гетероарильную группу, предпочтительно 1,2,4–триазол, необязательно замещенную одним или несколькими заместителями, независимо выбранными из C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила.
[00172] В одном варианте осуществления формулы V Ar1 представляет собой 1,2,4–триазол, замещенный одним или несколькими C1–3 алкильными заместителями, предпочтительно метилом.
[00173] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из NMS–P715, BAY 1217389, BAY 1161909 и соединения формулы V или их фармацевтически приемлемых солей.
[00174] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из NMS–P715, BAY 1217389, BAY 1161909 и
5–(фуран–2–ил)–N–(4–метоксифенил)изохинолин–3–амина;
N–(4–метоксифенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
N–(2–метокси–4–((1–метилпиперидин–4–ил)окси)фенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
N–(2,4–диметоксифенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
3–хлор–N, N–диметил–4–((5–(1–метил–1H–пиразол–4–ил)изохинолин–3–ил)амино)бензамида;
3–метокси–N, N–диметил–4–((5–(1–метил–1H–пиразол–4–ил)изохинолин–3–ил)амино)бензамида;
(3–метокси–4–((5–(1–метил–1H–пиразол–4–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N–(2–хлор–4–(1–метил–1H–пиразол–4–ил)фенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
(3–хлор–4–((5–(1–метил–1H–пиразол–4–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
(3–метокси–4–((5–(пиридин–3–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N–(4–(3,5–диметилизоксазол–4–ил)–2–метоксифенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
(3–метокси–4–((8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–хлор–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–хлор–4–(1–метил–1H–имидазол–5–ил)фенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
(3–метокси–4–((5–(пиримидин–5–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N–(2–метокси–4–(1–метил–1H–имидазол–5–ил)фенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
(4–((5–(1,5–диметил–1H–пиразол–4–ил)изохинолин–3–ил)амино)–3–метоксифенил)(3–метоксиазетидин–1–ил)метанона;
(3–метокси–4–((5–(1–метил–1H–пиразол–3–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N–(2–хлор–4–(1,2–диметил–1H–имидазол–5–ил)фенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–5–(1–метил–1H–пиразол–4–ил)изохинолин–3–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–фенилпиридо[3,4–d]пиримидин–2–амина;
8–циклопропил–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–5–метил–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
(3–метокси–4–((5–(1–метил–1H–пиразол–5–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
(4–((5–(1,3–диметил–1H–пиразол–4–ил)изохинолин–3–ил)амино)–3–метоксифенил)(3–метоксиазетидин–1–ил)метанона;
(4–((5–(1–изопропил–1H–пиразол–4–ил)изохинолин–3–ил)амино)–3–метоксифенил)(3–метоксиазетидин–1–ил)метанона;
4–((5–(1–метил–1H–пиразол–4–ил)изохинолин–3–ил)амино)–N–(1–метилпиперидин–4–ил)–3–(трифторметокси)бензамида;
(4–((5–(3,5–диметилизоксазол–4–ил)изохинолин–3–ил)амино)–3–метоксифенил)(3–метоксиазетидин–1–ил)метанона;
(3–метокси–4–((5–(1–метил–1H–имидазол–5–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(пирролидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
трет–бутил 4–(4–(3–((2–метокси–4–(3–метоксиазетидин–1–карбонил)фенил)амино)изохинолин–5–ил)–1H–пиразол–1–ил)пиперидин–1–карбоксилат;
(3–метокси–4–((5–(1–(пиперидин–4–ил)–1H–пиразол–4–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
(3–метокси–4–((5–(1–(1–метилпиперидин–4–ил)–1H–пиразол–4–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
(3–метокси–4–((5–(1–(2–метоксиэтил)–1H–пиразол–4–ил)изохинолин–3–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N8,N8–диэтил–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–циклопентил–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
(4–((5–(1–(2–(диметиламино)этил)–1H–пиразол–4–ил)изохинолин–3–ил)амино)–3–метоксифенил)(3–метоксиазетидин–1–ил)метанона;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–5–(1–метил–1H–пиразол–4–ил)–2,6–нафтиридин–3–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(пиперидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–циклогексил–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(3–метилпирролидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
8–(3,3–дифторпирролидин–1–ил)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–5–(1–метил–1H–пиразол–4–ил)–2,6–нафтиридин–3–амина;
N8–(циклопропилметил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(1–метил–1H–пиразол–4–ил)–N–(2–метил–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N8–циклопентил–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–изопропокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–(2–метоксиэтокси)–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(1–метил–1H–пиразол–4–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–изопентил–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–морфолинoпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(4–метилпиперазин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
8–(3,3–дифторазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–метилпирролидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–изобутил–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(циклогексилтио)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–циклогексил–N2–(2–метокси–4–(1–(2–(4–метилпиперазин–1–ил)этил)–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(1–этил–1H–пиразол–4–ил)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
8–(1–изопропил–1H–пиразол–4–ил)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(3–метоксиазетидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N1–(циклопропилметил)–N7–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–2,6–нафтиридин–1,7–диамина;
N1–циклогексил–N7–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–2,6–нафтиридин–1,7–диамина;
N8–циклогексил–N2–(4–(1–(2–(диметиламино)этил)–1H–пиразол–4–ил)–2–метоксифенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(циклопропилметил)–N2–(2–метил–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–циклогексил–N2–(2–метил–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(циклопропилметил)–N2–(2–этокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(циклогексилметил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
2–(4–(4–((8–(циклогексиламино)пиридо[3,4–d]пиримидин–2–ил)амино)–3–метоксифенил)–1H–пиразол–1–ил)этанола;
8–(циклопропилметокси)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
1–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)–2–метилпропан–2–ола;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(оксетан–3–илметил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(3,3–диметилбутан–2–ил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
3–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)–2,2–диметилпропан–1–ола;
N2–(2–этокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–6–морфолинoпиридин–3–ил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–6–(метилсульфонил)пиридин–3–ил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–имидазол–5–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1,3–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N8–(1–циклопропилэтил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
2–(4–(3–метокси–4–((8–((тетрагидро–2H–пиран–4–ил)амино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)–1H–пиразол–1–ил)этанола;
N2–(4–(1,5–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
(R)–N8–(3,3–диметилбутан–2–ил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(тетрагидрофуран–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–((тетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
1–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)пирролидин–3–ола;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(трет–бутил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(1–метилциклогексил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(1–(2,2–дифторэтил)–1H–пиразол–4–ил)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–морфолинoфенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N8–(2,2–дифторпропил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(3–метокси–2,2–диметилпропил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(2,2,2–трифторэтил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)метил)циклобутанола;
8–хлор–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–этил–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1–метил–1H–пиразол–4–ил)–2–(трифторметокси)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8,N8–диметилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)–2–метилпропан–2–сульфинамида;
N2–(2–метокси–4–(4–морфолинoпиперидин–1–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–((3–метилоксетан–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(пиперидин–1–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)–2–метилпропан–2–сульфонамида;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(оксетан–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
(1–(3–метокси–4–((8–(неопентиламино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)пиперидин–4–ил)(морфолинo)метанона;
N2–(2–метокси–4–(4–метилпиперазин–1–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
1–(((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)метил)циклопропанола;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(1–метилпиперидин–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
2–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)–2–метилпропан–1–ола;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(оксетан–2–илметил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–хлор–4–морфолинoфенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–(метилсульфонил)пиперазин–1–ил)фенил)–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(1,5–диметил–1H–пиразол–4–ил)–2–метоксифенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(1,5–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–((3–метилоксетан–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1,5–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
2–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)этанола;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(2–метоксиэтил)пиридо[3,4–d]пиримидин–2,8–диамина;
1–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)пропан–2–ола;
2–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)пропан–1–ола;
N2–(4–(1,5–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
4–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)тиоморфолин 1,1–диоксида;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–5–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(6–окса–2–азаспиро[3.4]октан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)азетидин–3–карбонитрила;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–окса–6–азаспиро[3.5]нонан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–((3–фтороксетан–3–ил)метил)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–хлор–2–метоксифенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2,4–дихлорфенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
4–((8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–ил)амино)–3–метоксибензонитрила;
N–(2–хлор–4–(метилсульфонил)фенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–хлор–4–(пиримидин–5–ил)фенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–хлор–4–(5–метил–1,3,4–оксадиазол–2–ил)фенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
6–циклопропил–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
2–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)пропан–1,3–диола;
3–метокси–2–((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)пропан–1–ола;
(3–(((2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)амино)метил)оксетан–3–ил)метанола;
(S)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
(R)–N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–хлор–2–фторфенил)–8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
4–((8–(2–окса–6–азаспиро[3.4]октан–6–ил)пиридо[3,4–d]пиримидин–2–ил)амино)–3–хлорбензонитрила;
N2–(2–метокси–4–(1–(2–метоксиэтил)–2–метил–1H–имидазол–5–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–(метилсульфонил)пиперазин–1–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(пиридин–4–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–5–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–5–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(2–метилморфолинo)пиридо[3,4–d]пиримидин–2–амина;
(4–(3–метокси–4–((8–((2–метокси–2–метилпропил)амино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)–1–метил–1H–пиразол–5–ил)метанола;
(4–(3–метокси–4–((8–(((3–метилтетрагидрофуран–3–ил)метил)амино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)–1–метил–1H–пиразол–5–ил)метанола;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(1–(2–метоксиэтил)–2–метил–1H–имидазол–5–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–(2–метоксиэтил)–2–метил–1H–имидазол–5–ил)фенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,6–дигидро–2H–пиран–4–ил)–N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)пиридо[3,4–d]пиримидин–2–амина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–6–(1–метил–1H–тетразол–5–ил)пиридин–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(6–(1,2–диметил–1H–имидазол–5–ил)–2–метоксипиридин–3–ил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(пиримидин–5–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(1–(тетрагидрофуран–3–ил)этил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1,3–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1,3–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(4–метоксипиперидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)пиперидин–4–карбонитрила;
N–(2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)–8–(4–(метилсульфонил)пиперазин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(1,3–диметил–1H–пиразол–4–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(6–окса–2–азаспиро[3.4]октан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(6–(1,3–диметил–1H–пиразол–4–ил)–2–метоксипиридин–3–ил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(6–(1,5–диметил–1H–пиразол–4–ил)–2–метоксипиридин–3–ил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–6–(1–метил–1H–1,2,3–триазол–5–ил)пиридин–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–6–(2–метил–2H–1,2,3–триазол–4–ил)пиридин–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
(3–метокси–4–((8–((2–метокси–2–метилпропил)амино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
3–метокси–4–((8–((2–метокси–2–метилпропил)амино)пиридо[3,4–d]пиримидин–2–ил)амино)–N, N–диметилбензамида;
(3–метокси–4–((8–((2–метокси–2–метилпропил)амино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)(4–метилпиперазин–1–ил)метанона;
(1–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)пирролидин–3–ил)метанола;
(1–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)пиперидин–3–ил)метанола;
(4–(2–((2–метокси–4–(1–метил–1H–пиразол–4–ил)фенил)амино)пиридо[3,4–d]пиримидин–8–ил)морфолин–2–ил)метанола;
N2–(2–(дифторметокси)–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–(дифторметокси)–4–фторфенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–(1–этил–1H–пиразол–4–ил)–2–метоксифенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
(3–метокси–4–((8–(неопентиламино)пиридо[3,4–d]пиримидин–2–ил)амино)фенил)(3–метоксиазетидин–1–ил)метанона;
N2–(2–метокси–4–(тетрагидро–2H–пиран–4–ил)фенил)–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(4–хлор–2–(дифторметокси)фенил)–N8–(2–метокси–2–метилпропил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–5–метил–N8–((3–метилоксетан–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–5–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–5–метил–8–(6–окса–2–азаспиро[3.4]октан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N8–(2–метокси–2–метилпропил)–N2–(2–метокси–4–(1–метил–1H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–(дифторметокси)–4–(1–метил–1H–пиразол–4–ил)фенил)–N8–(2–метокси–2–метилпропил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
(4–(3–метокси–4–((8–((2–метокси–2–метилпропил)амино)–6–метилпиридо[3,4–d]пиримидин–2–ил)амино)фенил)–1–метил–1H–пиразол–5–ил)метанола;
N2–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
1–(((2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)амино)метил)циклобутанола;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)пиперидин–4–карбонитрила;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–ола;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((3–метилоксетан–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(((2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)амино)метил)циклопропанола;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)пиперидин–4–карбонитрила;
1–(2–((4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–пиразол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–дифторазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(2–метилморфолинo)пиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–азабицикло[3.1.0]гексан–3–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–(диметиламино)азетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)пиперидин–4–ола;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилпирролидин–3–ола;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)пирролидин–3–карбонитрила;
N2–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(1–метил–1H–пиразол–5–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(оксазол–2–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метоксипирролидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилпирролидин–3–карбонитрила;
8–(2,2–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(3–(трифторметил)азетидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(2–азаспиро[3.3]гептан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
(R)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–N8–((1–метоксициклобутил)метил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(1–метилазетидин–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(оксетан–3–илметил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(пирролидин–1–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(2–азаспиро[3.4]октан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–этилазетидин–3–ола;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(1–метилпиперидин–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(4–(диметиламино)пиперидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((тетрагидро–2H–пиран–4–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((4–метилтетрагидро–2H–пиран–4–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–этилпиперидин–4–карбонитрила;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(2–(3–метилтетрагидрофуран–3–ил)этил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(1–(тетрагидро–2H–пиран–4–ил)этил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(пентан–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(тетрагидрофуран–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(3–этокси–3–метилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–этил–3–метоксиазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–этокси–3–этилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–изопропил–3–метоксиазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–этокси–3–изопропилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–этилазетидин–3–карбонитрила;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–изопропилазетидин–3–карбонитрила;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–2,2,3–триметилазетидин–3–карбонитрила;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–2,2–диметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–2,2,3–триметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–2,2–диметилазетидин–3–карбонитрила;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(1–метилпиперидин–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(4–(диметиламино)пиперидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((тетрагидро–2H–пиран–4–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((4–метилтетрагидро–2H–пиран–4–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
4–этил–1–(2–((2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)пиперидин–4–карбонитрила;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(2–(3–метилтетрагидрофуран–3–ил)этил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(1–(тетрагидро–2H–пиран–4–ил)этил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(пентан–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N2–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(тетрагидрофуран–3–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
8–(3–этокси–3–метилазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–этил–3–метоксиазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–этокси–3–этилазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–изопропил–3–метоксиазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–этокси–3–изопропилазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
3–этил–1–(2–((2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)азетидин–3–карбонитрила;
3–изопропил–1–(2–((2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)азетидин–3–карбонитрила;
1–(2–((2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–2,2,3–триметилазетидин–3–карбонитрила;
8–(3–метокси–2,2–диметилазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
8–(3–метокси–2,2,3–триметилазетидин–1–ил)–N–(2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–2,2–диметилазетидин–3–карбонитрила;
8–(3,3–диметилазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
8–(3–метокси–3–метилазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–тетразол–5–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3,3–диметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–(дифторметокси)–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(4–этил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–этокси–4–(4–этил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(3,3–диметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–8–(3,3–диметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
8–(3–метокси–3–метилазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–1,2,3–триазол–5–ил)фенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–8–(3,3–диметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(1,2–диметил–1H–имидазол–5–ил)–2–метоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–8–(3,3–диметилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(1,5–диметил–1H–имидазол–2–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
8–(3–метокси–3–метилазетидин–1–ил)–N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(2–метокси–4–(1–метил–1H–имидазол–2–ил)фенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
8–(3,3–диметилазетидин–1–ил)–N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,4–диметилоксазол–5–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,4–диметилоксазол–5–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,5–диметилоксазол–4–ил)–2–метоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–4–метилпиперидин–4–карбонитрила;
N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–8–(4–метоксипиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–8–(4–метокси–4–метилпиперидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метил–8–(1–окса–6–азаспиро[3.3]гептан–6–ил)пиридо[3,4–d]пиримидин–2–амина;
1–(2–((4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метил–N8–((3–метилтетрагидрофуран–3–ил)метил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метил–8–(2–окса–7–азаспиро[4.4]нонан–7–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метил–N8–(тетрагидро–2H–пиран–4–ил)пиридо[3,4–d]пиримидин–2,8–диамина;
N–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метил–8–(7–окса–2–азаспиро[3.5]нонан–2–ил)пиридо[3,4–d]пиримидин–2–амина;
N2–(4–(2,5–диметилоксазол–4–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина
или их фармацевтически приемлемых солей.
[00175] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715 и
N–циклопропил–4–(6–(2,3–дифтор–4–метоксифенокси)–8–((3,3,3–трифторпропил)амино)имидазо[1,2–b]пиридазин–3–ил)–2–метилбензамида;
(R)–2–(4–фторфенил)–N–(4–(2–((2–метокси–4–(метилсульфонил)фенил)амино)–[1,2,4]триазолo[1,5–a]пиридин–6–ил)фенил)пропанамида;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
или фармацевтически приемлемой соли или сольвата такого соединения.
[00176] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из NMS–P715, BAY 1217389, BAY 1161909 и N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина, или их фармацевтически приемлемых солей.
[00177] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из:
N–циклопропил–4–(6–(2,3–дифтор–4–метоксифенокси)–8–((3,3,3–трифторпропил)амино)имидазо[1,2–b]пиридазин–3–ил)–2–метилбензамида;
(R)–2–(4–фторфенил)–N–(4–(2–((2–метокси–4–(метилсульфонил)фенил)амино)–[1,2,4]триазолo[1,5–a]пиридин–6–ил)фенил)пропанамида;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
или фармацевтически приемлемой соли или сольвата такого соединения.
[00178] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из:
N–циклопропил–4–(6–(2,3–дифтор–4–метоксифенокси)–8–((3,3,3–трифторпропил)амино)имидазо[1,2–b]пиридазин–3–ил)–2–метилбензамида; и
(R)–2–(4–фторфенил)–N–(4–(2–((2–метокси–4–(метилсульфонил)фенил)амино)–[1,2,4]триазолo[1,5–a]пиридин–6–ил)фенил)пропанамида;
или фармацевтически приемлемой соли или сольвата такого соединения.
[00179] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 выбран из группы, состоящей из:
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
или их фармацевтически приемлемых солей.
[00180] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор MPS1 представляет собой N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин, или его фармацевтически приемлемые соли.
Ингибитор CDK4/6
[00181] В одном варианте осуществления каждого из аспектов и вариантов осуществления настоящего изобретения ингибитор CDK4/6 выбран из одного или нескольких из палбоциклиба, абемациклиба и рибоциклиба или их фармацевтически приемлемых солей или сольватов.
[00182] Подходящим образом, ингибитор CDK4/6 выбран из одного или нескольких из палбоциклиба и рибоциклиба или их фармацевтически приемлемых солей или сольватов.
[00183] Подходящим образом, ингибитор CDK4/6 выбран из одного или нескольких из палбоциклиба и абемациклиба или их фармацевтически приемлемых солей или сольватов.
[00184] Подходящим образом, ингибитор CDK4/6 выбран из одного или нескольких из рибоциклиба и абемациклиба или их фармацевтически приемлемых солей или сольватов.
[00185] Подходящим образом, ингибитор CDK4/6 представляет собой палбоциклиб или его фармацевтически приемлемые соли или сольваты.
Комбинации
[00186] В одном аспекте настоящее изобретение относится к комбинации, включающей ингибитор MPS1 и эндокринное средство.
[00187] В одном аспекте настоящее изобретение относится к фармацевтическому продукту, включающему ингибитор MPS1 и эндокринное средство.
[00188] В одном аспекте настоящее изобретение относится к способу для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, включающему введение указанному субъекту, раздельно, последовательно или в комбинации, терапевтически эффективного количества ингибитора MPS1 и терапевтически эффективного количества эндокринного средства.
[00189] В одном аспекте настоящее изобретение относится к фармацевтическому продукту, включающему ингибитор MPS1 и эндокринное средство для применения в лечении эстроген–рецептор–положительного рака молочной железы, где ингибитор MPS1 и эндокринное средство предназначены для отдельного, последовательного или совместного введения.
[00190] В одном аспекте настоящее изобретение относится к применению фармацевтического продукта, включающего ингибитор MPS1 и эндокринное средство, для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы, где ингибитор MPS1 и эндокринное средство предназначены для отдельного, последовательного или совместного введения.
[00191] В одном аспекте настоящее изобретение относится к ингибитору MPS1 и эндокринному средству для применения в лечении эстроген–рецептор–положительного рака молочной железы.
[00192] В одном аспекте настоящее изобретение относится к ингибитору MPS1 для применения в лечении эстроген–рецептор–положительного рака молочной железы, где указанный ингибитор MPS1 предназначен для отдельного, последовательного или совместного введения с эндокринным средством.
[00193] В одном аспекте настоящее изобретение относится к эндокринному средству для применения в лечении эстроген–рецептор–положительного рака молочной железы, где указанное эндокринное средство предназначено для отдельного, последовательного или совместного введения с ингибитором MPS1.
[00194] В одном аспекте настоящее изобретение относится к применению ингибитора MPS1 и эндокринного средства для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы.
[00195] В одном аспекте настоящее изобретение относится к применению ингибитора MPS1 для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы, где указанный ингибитор MPS1 предназначен для отдельного, последовательного или совместного введения с эндокринным средством.
[00196] В одном аспекте настоящее изобретение относится к применению эндокринного средства для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы, где указанное эндокринное средство предназначено для отдельного, последовательного или совместного введения с ингибитором MPS1.
[00197] Подходящим образом, ингибитор MPS1 является таким, как он определен в любом из описанных выше вариантов осуществления. Подходящим образом, эндокринное средство является таким, как оно определено в любом из описанных выше вариантов осуществления.
[00198] В одном варианте осуществления ингибитор MPS1 выбран из:
N–циклопропил–4–(6–(2,3–дифтор–4–метоксифенокси)–8–((3,3,3–трифторпропил)амино)имидазо[1,2–b]пиридазин–3–ил)–2–метилбензамида;
(R)–2–(4–фторфенил)–N–(4–(2–((2–метокси–4–(метилсульфонил)фенил)амино)–[1,2,4]триазолo[1,5–a]пиридин–6–ил)фенил)пропанамида;
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
или фармацевтически приемлемой соли или сольвата такого соединения, а эндокринное средство выбрано из анастразола, летрозола, экземестана, тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
[00199] В одном варианте осуществления ингибитор MPS1 выбран из:
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамина;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амина;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрила;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
или фармацевтически приемлемой соли или сольвата такого соединения, а эндокринное средство выбрано из анастразола, летрозола, экземестана, тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
[00200] В одном варианте осуществления ингибитор MPS1 выбран из:
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
или его фармацевтически приемлемой соли или сольвата, а эндокринное средство выбрано из анастразола, летрозола, экземестана, тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
[00201] В одном варианте осуществления ингибитор MPS1 выбран из:
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина;
или его фармацевтически приемлемой соли или сольвата, а эндокринное средство выбрано из тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
ПРИМЕРЫ
Материалы и методы
[00202] 17–β–эстрадиол (E2) и 4–гидрокситамоксифен (4–OHT) закупали у Sigma–Aldrich, (Dorset, UK); фулвестрант (ICI182780) у Tocris Bioscience (Bristol, UK); паклитаксол у Selleckchem (Suffolk, UK); палбоциклиб (PD–0332991) был синтезирован и поставлялся компанией Pfizer (Tadworth, UK). Ингибиторы MPS1: CCT289346, BAY 1161909 и BAY 1217389 были синтезированы и поставлялись компанией ICR Cancer Therapeutics (Sutton, UK); ингибитор MPS1 NMS–P715 закупали у Calbiochem (Hertfordshire, UK).
Тканевая культура
[00203] ER+ BC линии, MCF7 дикого типа (wt), wt–HCC1428, wt–SUM44, wt–T47D и wt–ZR75.1 клетки получали от ATCC и культивировали в не содержащей фенолового красного среде RPMI 1640 (Gibco, Thermo Fisher Scientific, Loughborough, UK), дополненной 10% фетальной бычьей сыворотки (Gibco, Thermo Fisher Scientific) и 1нМ E2, при 37°C в 5% CO2. Идентичность клеточных линий подтверждали профилированием короткого тандемного повтора (Promega, Madison, WI, USA). Лишенные эстрогена в течение длительного времени клетки (MCF7–LTEDwt ESR1 и MCF7–LTEDY537C мутанты, HCC1428–LTED, SUM44–LTED и ZR75.1–LTED), моделирующие резистентность к эндокринной терапии, культивировали в не содержащей фенолового красного RPMI 1640, дополненной 10% очищенной на покрытом декстраном активированном угле фетальной бычьей сыворотки (DCC–FBS).
Анализы жизнеспособности клеток (2D и 3D)
[00204] Для оценки эффекта ингибирования MPS1 в BC клетках, выращенных в 2D–культуре, клетки высевали в белые 96–луночные планшеты (Greiner Bio–One, Gloucestershire, UK) в среду RPMI 1640, дополненную 10% DCC–FBS. Wt клетки очищали от E2 в течение 72 часов перед экспериментом. Через 24 часа клетки обрабатывали увеличивающимися дозами ингибиторов MPS1 ± 4–OHT или фулвестранта в присутствии или в отсутствие E2. Среду заменяли через 3 дня и жизнеспособность клеток оценивали через 6 дней с использованием люминесцентного анализа жизнеспособности клеток CellTitre–Glo® (Promega) в соответствии с инструкциями изготовителя.
[00205] Для оценки эффектов ингибиторов MPS1 на жизнеспособность ER+ BC в 3D сфероидальной культуре wt–MCF7 и MCF7–LTEDwt ESR1 и MCF7–LTEDY537C клетки высевали в базовую среду в 96–луночные планшеты со сверхнизким связыванием (Corning) при плотности 2500 клеток/лунка и центрифугировали в течение 10 мин при 900 об/мин. После 3 дней инкубации новообразованные сферы обрабатывали увеличивающимися дозами CCT289346 или BAY 1217389 и снова обрабатывали через каждые 3–4 дня. Эффект обработки на жизнеспособность клеток оценивали через 10 дней. Изображения сфер получали с использованием CeligoS (Nexcelome Bioscience, Lawrence, MA, US) и для определения количественных показателей осуществляли люминесцентный 3D анализ жизнеспособности клеток CellTitre–Glo® (Promega) в соответствии с протоколом изготовителя. Каждый эксперимент осуществляли по меньшей мере два раза с восемью техническими повторами на обработку. Люминесцентный сигнал считывали на спектрофотометре Victor (Perkin Elmer, Wokingham, UK) и значения выражали как кратное изменение по сравнению с контролем, обработанным носителем.
Киномная библиотека миРНК
[00206] Панель LTED клеточных линий, включая MCF7–LTED, SUM44–LTED, HCC1428–LTED, ZR75–LTED и T47D–LTED, а также MCF7–991R, MCF7–LTED 991R, T47D–991R, T47D–LTED 991R и MCF7–LTED ICIR 991R, трансфицировали ON–TARGETplus библиотека миРНК–человеческой протеинкиназой (G–103505, GE Dharmacon, Buckinghamshire, UK). Библиотеку миРНК, состоящую из девяти 96–луночных планшетов, содержащих SMART пул миРНК, нацеленных на 709 протеинкиназ, переносили на три 384–луночных планшета с белыми стенками и прозрачным дном (Greiner Bio–One) с использованием автоматизированного устройства для манипуляций с жидкостями Hamilton Microlab Star (Hamilton, Bonaduz, Switzerland). Библиотеку дополняли не–таргетирующей миРНК и миРНК PLK1 (оба SMART пула от GE Dharmacon) в качестве положительного и отрицательного контролей, соответственно, и планшеты замораживали.
[00207] Для обратной трансфекции, планшеты, содержащие 200нМ миРНК, размораживали, добавляли 10мкл RNAiMax (Invitrogen, Paisley, UK) на лунку с использованием Multidrop Combi (Thermo Fisher Scientific) и инкубировали в течение 30 мин при комнатной температуре. Затем клетки высевали в 35мкл базовой питательной среды на лунку с использованием Multidrop Combi. Через 6 дней жизнеспособность клеток оценивали с использованием люминесцентного анализа жизнеспособности клеток CellTitre–Glo® (Promega) в соответствии с протоколом изготовителя и измеряли люминесценцию с использованием спектрофотометра Victor (Perkin Elmer, Wokingam. UK). Показатель люминесценци для каждой лунки планшетов логарифмически преобразовывали, усредняли до среднего значения для планшетов и затем рассчитывали среднее значение повторов. Это в конечном счете использовали для расчета Z–оценки с использованием абсолютного отклонения среднего для клеточной линии. Динамику кажого скрининга библиотеки оценивали путем расчета основных Z–значений. Порог приемлемости устанавливали как Z’>0,3 (Brough et al., 2011). Каждый скрининг состоял из по меньшей мере двух биологических экспериментов, которые включали технический повтор библиотеки. Затем строили диаграмму Венна, объединяющую мишени из разных BC моделей с использованием Venny 2.1.0 (Computational Genomics, CNB–CSIC, Spain).
Иммуноблоттинг
[00208] Для сравнения уровней экспрессии MPS1 в BC линиях клеточные экстракты получали из wt–MCF7, wt–HCC1428, wt–SUM44, wt–T47D, wt–ZR75.1, MCF7–LTEDwt ESR1 и MCF7–LTEDY537C, HCC1428–LTED, SUM44–LTED и ZR75.1–LTED и SKBR3, выращенных в базовой среде при 70% конфлюентности.
[00209] Белковые экстракты получали, как описано ранее (Martin et al., 2003). Равные количества белка (25мкг) разделяли методом SDS–PAGE и осуществляли иммуноблот–анализ. Детекцию белков осуществляли с использованием антител против MPS1 (NT клон 3–472–1 IgG1, 05–682, 1:1000, Millipore, Walford, UK) и α–тубулина (T9026, мышиное IgG1, 1:4000, Sigma–Aldrich). Вторичные антитела (Dako/Agilent, Santa Clara, CA, UK) использовали при 1:2000 разведении и взаимодействия антиген–антитело определяли с использованием реагента ECL (Amersham).
[00210] Для детекции расщепления PARP клетки высевали в 10–см чашки и давали им акклиматизироваться в течение ночи перед 72–часовой обработкой CCT289346 или носителем, используемым в качестве контроля. Белки разделяли методом SDS–PAGE и осуществляли иммуноблот–анализ и мембраны инкубировали с антителами против расщепленной поли(АДФ–рибоза)полимеразы (PARP) (Santa Cruz Biotechnology, Santa Cruz, CA, UK) и α–тубулина (T9026, мышиное IgG1, 1:4000, Sigma–Aldrich).
Нокдаун 709 киназ идентифицировал MPS1 в качестве общей детерминанты резистентности к E–депривации
[00211] Для идентификации мишеней, которые управляют гормон–независимым ростом в клетках, лишенных эстрогена (LTED), осуществляли скрининг с использованием библиотеки с пулами миРНК, нацеленными на 709 киназ (Фиг. 1A). Жизнеспособность клеток измеряли с использованием titerGlo. В этом скрининге MPS1/TTK был определен и подтвержден как наиболее часто встречающееся совпадение в панели клеточных линий LTED независимо от статуса экспрессии ER (Фиг. 1B). Оценка данных глобальной экспрессии генов и присутствия белка с использованием диметил–мечения MCF7 против MCF7–LTED клеток показала увеличение MPS1 как на уровне мРНК, так и на уровне белка (Фиг. 1C), что было подтверждено иммуноблот–анализом (Фиг. 1D). Следует отметить, что SUM44–LTED показал аналогичное содержание MPS1 по сравнению с родительским контролем, в то время как T47D и T47D–LTED оказались схожими, а HCC1428–LTED, по–видимому, имеют более низкие уровни MPS1 по сравнению с их родительской клеточной линией.
Экспрессия MPS1 ассоциируется с плохим ответом на эндокринную терапиию
[00212] Для оценки клинической значимости MPS1 оценивали наборы данных глобальной экспрессии генов для ER+ BC пациентов, которые получали неоадъювантное лечение анастрозолом или летрозолом. Имелись данные клинических ответов для 72 пациентов, которых лечили анастрозолом, из которых 55 были классифицированы как отвечающие на лечение на основании оценки через 2 недели остаточной Ki67 <10%, и 17 были классифицированы как не отвечающие на лечение.
[00213] В этой ситуации экспрессия гена MPS1 при лечении (р <0,0001) была достоверно связана с плохим ответом на анастрозол (Фиг. 2А). Было также обнаружено, что повышенная экспрессия гена MPS1 при лечении (р <0,0001) коррелировала с более высокой экспрессией Ki67 после 2 недель терапии, при выражении в виде непрерывной переменной (Фиг. 2B).
[00214] Во второй когорте были доступны данные для 52 опухолей, из которых 37 были классифицированы как отвечающие на лечение на основании сокращения опухоли ≥50%. Хотя базовая экспрессия MPS1 показала тенденцию к плохому ответу (p=0,13) (Фиг. 3C), повышенная экспрессия MPS1 при лечении (p=0,018) в значительной степени ассоциировалась с плохим ответом на летрозол (Фиг. 3D).
[00215] Затем оценивали, связана ли также экспрессия MPS1 с отдаленным результатом при адъювантном лечении тамоксифеном. После 10 лет наблюдения за 747 ER+ пациентами, получавшими тамоксифен, было показано, что MPS1 (p=3.14e–02) сильно ассоциируется с низкой безрецидивной выживаемостью (RFS) (Фиг. 4)
Ингибирование MPS1 подавляет пролиферацию эндокринно–резистентных клеточных линий в 2D и сфероидальной культуре
[00216] Чувствительность wt–MCF7 и MCF7–LTED клеток к увеличивающимся концентрациям ингибитора MPS1, CCT289346, в присутствии или в отсутствие эстрадиола (E2). В присутствии E2, CCT289346 вызывал зависимое от концентрации уменьшение пролиферации wt–MCF7 клеток (IC50 100 нМ) (Фиг. 5). Более того, CCT289346 вызывал существенное уменьшение пролиферации двух MCF7–LTED моделей, одна из которых содержала wt–ESR1, а другая мутационную горячую точку (Y537C) (IC50 значения 60нМ и 40нМ, соответственно).
[00217] Затем оценивали эффективность CCT289346 в культуре сфероидальных клеток (Фиг. 6). Согласно предыдущему наблюдению, CCT289346 уменьшал размер сфер, что было подтверждено с использованием TiterGlo для оценки жизнеспособности.
[00218] Затем wt–MCF7 и MCF7–LTED модели обрабатывали тремя альтернативными ингибиторами MPS1: NMS–P715, BAY 1161909 и BAY 1217389. Все три средства вызывали одинаковое зависимое от концентрации уменьшение пролиферации wt–MCF7 клеток в присутствии E2, а обе MCF7–LTED модели в присутствии и в отсутствие E2 (Фиг. 7–9).
[00219] Примечательно, что IC50 значения в ответ на BAY 1217389 были намного ниже, чем у других испытываемых средств примерно в 20 раз. Кроме того, BAY 1217389 был особенно эффективен в сфероидальных культурах (Фиг. 9). Для рассмотрения возможности, что эти наблюдения были специфическими для определенной клеточной линии, были обработаны еще две LTED модели, SUM44 LTED и HCC1428 LTED, и они показали аналогичный паттерн чувствительности (Фиг. 10). В присутствии E2 обе wt–SUM44 и wt–HCC1428 показали зависимое от концентрации уменьшение пролиферации. Оказалось, что концентрации выше 250нМ индуцируют цикл обратной связи и ассоциированное повышение пролиферации. В отсутствие E2, при моделировании добавления эндокринной терапии (следует отметить, что данные нормализовали к носителю и поэтому выражали как 100%) CCT289346 вызывал 30% снижение пролиферации, снова подтверждая способность CCT289346 направленно действовать на de novo резистентность. Оба HCC1428 LTED и SUM44 LTED показали зависимое от концентрации уменьшение пролифераци в отсутствие или в присутствии E2.
[00220] Взятые вместе, эти данные показывают класс– специфический эффект ингибирования MPS1, подтверждая его как клинически релевантную мишень при резистентном к эндокринной терапии раке молочной железы.
[00221] Затем исследовали потенциальную роль MPS1 в качестве мишени в de–novo резистентности. Ранее было показано, используя оценку сигнатуры E2F “в процессе лечения” у пациентов, получавших анастрозол, что можно было идентифицировать пациентов, у которых рак молочной железы обладал лиганд–независимой активностью ER (Miller et al. 2011). Для рассмотрения этого клетки wt–MCF7 культивировали в присутствии или в отсутствие E2, моделируя добавление эндокринной терапии. CCT289346 в присутствии E2 вызывал зависимое от концентрации уменьшение пролиферации. Добавление CCT289346 к DCC (моделирование комбинации с эндокринной терапией) показало дальнейшее снижение пролиферации на 20%, предполагая, что ингибирование MPS1 нацелено на de–novo резистентность (Фиг. 11).
Эффект CCT289346 в комбинации с эндокринной терапией
[00222] Была исследована возможность комбинирования CCT289346 с фулвестрантом или 4–гидрокситамоксифеном (4–OHT) для повышения эффективности. Клетки MCF7–LTED обрабатывали возрастающими концентрациями эндокринных средств отдельно или в комбинации с CCT289346 (установленная IC50 концентрация). Как и ожидалось, оба эндокринных средства в комбинации с CCT289346 вызывали зависимое от концентрации уменьшение пролиферации клеток, подтверждая зависимость от ER для пролиферации (Фиг. 12). Взятые вместе, эти данные предполагают, что CCT289346 в комбинации с любым эндокринным средством может обеспечить клиническую пользу для пациентов с резистентным к эндокринной терапии раком молочной железы.
Геномное профилирование выявляет, что потеря RB связана с необратимой резистентностью к ингибированию CDK4/6
[00223] Панель клеточных линий рака молочной железы (wt–MCF7, MCF7 LTED, wt–T47D и T47D LTED) с различным фенотипическим фоном длительно обрабатывали в присутствии ингибитора CDK4/6 (палбоциклиб, 1 мкМ). Резистентность подтверждали путем культивирования резистентных клеточных линий с возрастающими концентрациями палбоциклиба по сравнению с их предшественником дикого типа (Фиг. 13).
[00224] Затем клеточные линии, резистентные к палбоциклибу, культивировали в течение короткого и длительного периода времени в отсутствие лекарственного средства для оценки стабильности резистентного фенотипа. Следует отметить, что “вымывание” wt–MCF7991R и MCF7 LTED991R производных повторно сенсибилизировало их к антипролиферативному эффекту палбоциклиба, предполагая, что фенотип был пластичным. Напротив, клеточные линии wt–T47D991R и T47D LTED991R оставались резистентными (Фиг. 13).
Таргетирование резистентности к палбоциклибу
[00225] Для исследования, какие киназы обычно ассоциировались с CDK4/6 резистентным фенотипом, использовали скрининг кинома с нокдауном (миРНК), нацеленный на 709 киназ в палбоциклиб–резистентных клеточных линиях (Фиг. 14). Все клеточные линии демонстрировали зависимость от регуляторов контрольных точек G2/M в различной степени, однако MPS1 был общей детерминантой во всех моделях клеточных линий, независимо от RB или ESR1 статуса. Затем это наблюдение было подтверждено путем сравнения эффекта миРНК, нацеленной на MPS1, против PLK в клеточных линиях. Ингибирование варьировало между клеточными линиями с уменьшением пролиферации в пределах 20–40%.
Палбоциклиб–резистентные клеточные линии чувствительны к антипролиферативным эффектам CCT289346
[00226] Для рассмотрения обоснованности MPS1 в качестве общей детерминанты резистентности к ингибированию CDK4/6 осуществляли анализ пролиферации с использованием ингибиторов MPS1 CCT289346 и NMS–P715 в присутствии или в отсутствие палбоциклиба в различных клеточных линиях рака молочной железы, включая клеточные линии дикого типа (Фиг. 15) и LTED (Фиг. 16).
[00227] Все клеточные линии показали зависимое от концентрации уменьшение пролиферации в ответ на оба ингибитора MPS1 (Фиг. 15 и 16) в различной степени. Добавление CCT289346 к палбоциклибу показало повышенный эффект, отражаемый более низкими IC50 значениями (около 50нМ для wt–MCF7991R, MCF7 LTED991R и wt–T47D991R). Оказалось, что T47D–LTED991R является наиболее чувствительной к ингибированию MPS1, с IC50 значением 25нМ.
[00228] До настоящего времени ингибиторы MPS1 изучали только на моделях тройного негативного рака молочной железы в сочетании с химиотерапией. Как показано в настоящей заявке, MPS1 также является подходящей мишенью в моделях ER+ рака молочной железы с резистентностью к эндокринной терапии и/или палбоциклибу. Приведенные данные показывают, что ингибиторы MPS1 снижают рост опухолевых клеток, особенно в моделях эндокринно–резистентного рака и моделях эндокринно–резистентного заболевания с резистентностью к палбоциклибу. Эти данные имеют большое клиническое значение, по меньшей мере отчасти, поскольку в настоящее время очень мало известно о подходящей терапии для пациентов с рецидивами, принимавших ингибиторы CDK4/6.
Исследования in vivo
МЕТОДЫ
Исследования эффективности in vivo – MCF7–LTED
[00229] Исследования in vivo осуществляли на овариэктомированных аутбредных самках голых мышей NCr возраста 8–12 недель в соответствии с руководящими указаниями, разработанными руководством фирмы и одобренными Комитетом по этике Института исследования рака. Ксенотрансплантаты для моделирования пациентов, резистентных к лечению ароматазой, вводили путем инокуляции клеток MCF7–LTED (5×106) в матрице из базальной мембраны (1:1 Matrigel; BD Biosciences) в правый бок каждого животного. Как только опухоли достигали размера 7 мм, мышей рандомизировали и обрабатывали либо фулвестрантом 200 мг/кг (сформулированным в арахисовом масле), вводимым подкожно один раз в неделю (день 5), либо 50 мг/кг CCT289346, вводимым два раза в неделю через пероральный зонд (день 1 и день 4), либо комбинацией этих двух средств в течение 40 дней. Контрольную группу обрабатывали обоими носителями. Опухоли измеряли два раза в неделю в течение 40 дней.
[00230] Рост опухоли оценивали два раза в неделю во всех группах путем измерения штангенциркулем двух самых больших диаметров. Объемы затем рассчитывали по формуле: a × b2 × π/6, где a и b – ортогональные диаметры опухоли. Для каждой опухоли объемы представляли по отношению к исходному объему как относительный объем опухоли (RTV). Рассчитывали средние значения (и SE) RTV в той же группе лечения и получали кривые роста в зависимости от времени.
Установление PDX
[00231] Самок швейцарских голых мышей закупали у Charles River (Les Arbresles, Франция) и содержали в специфических условиях, свободных от патогенов. Уход за ними и условия их содержания соответствовали установленным руководящим принципам и правилам Французского комитета по этике (разрешение на проект № 02163.02). PDX устанавливали из первичных хирургических образцов при информированном согласии пациента, как описано в другом документе (Marangoni et al. 2007). HBCx–34 OvaR PDX устанавливали из ER+ ксенотрансплантатов рака молочной железы с приобретенной резистентностью к эстроген–депривации (отсутствие восполнения эстрогена, связанного с овариэктомией), как ранее опубликовано (Cottu et al. 2014). PDX HBCx–86 устанавливали из ранней стадии ER+ PI3KCA мутированного рака молочной железы, как описано в Hatem et al. (Hatem et al 2016), придавая независимость от эстрогена последовательными пассажами опухоли без восполнения эстрогена.
Исследования эффективности in vivo в PDX
[00232] Фулвестрант (Faslodex, AstraZeneca, Macclesfield, UK) вводили внутримышечно с использованием иглы 273/4 в дозе 50 мг/кг один раз в неделю (день 5). CCT289346 вводили через желудочный зонд в дозе 25 мг/кг два раза в неделю (дни 1 и 4). Когда опухоли достигли объема 60–200 мм3, мышей индивидуально идентифицировали и случайным образом распределяли в контрольную или получавшую лечение группы (10 мышей на группу), и лечение начинали. Лечение вводили в течение 5–6 недель. Рост опухоли оценивали путем измерения двух перпендикулярных диаметров опухолей штангенциркулем два раза в неделю. Отдельные объемы опухолей рассчитывали как V=a b2/2, где a является наибольшим диаметром, b – наименьшим. Для каждой опухоли объемы представляли по отношению к исходному объему как относительный объем опухоли (RTV). Рассчитывали средние значения (и SE) RTV в той же группе лечения и получали кривые роста в зависимости от времени.
РЕЗУЛЬТАТЫ
[00233] Анализ модели MCF7–LTED показал, что как фулвестрант, так и CCT289346 в качестве монотерапии значительно уменьшали объем опухоли по сравнению с контролем, но не было никакой статистической разницы между этими средствами. Комбинация показала тенденцию к статистической значимости по сравнению с применяемым отдельно фулвестрантом (р=0,066) (Фиг. 17).
[00234] Оценка модели PDX HBCx–34 показала значительное уменьшение объема опухоли в ответ как на фулвестрант, так и на CCT289346. Поразительно, что субоптимальная концентрация CCT289346 (25 мг/кг) в качестве монотерапии уменьшала объем опухоли до такой же степени, что и фульвестрант. Комбинация CCT289346 и фулвестранта показала значительное уменьшение (р=0,024) по сравнению с только одним фулвестрантом (Фиг. 18).
[00235] Оценка модели PDX HBCx–86 показала значительное уменьшение объема опухоли как с CCT289346, так и с фулвестрантом, хотя фулвестрант в качестве монотерапии оказался лучше. Поразительно, что комбинация фулвестранта и CCT289346 показала значительное уменьшение объема опухоли (р <0,0001) по сравнению с только одним фулвестрантом (Фиг. 19).
[00236] Таким образом, вышеизложенное показывает, что ингибиторы MPS1 эффективны in vivo в моделях резистентности к эстроген–депривации.
[00237] Все ссылки, включая публикации, патентные заявки и патенты, процитированные в настоящей заявке, включены в настоящую заявку посредством ссылки во всей их полноте и в той степени, как если бы каждый ссылочный документ был индивидуально и конкретно указан как включенный посредством ссылки и был изложен в настоящей заявке во всей его полноте (в максимальной степени, разрешенной законом).
[00238] Все заголовки и подзаголовки используются только для удобства и не должны рассматриваться как ограничивающие изобретение каким–либо образом.
[00239] Использование в настоящей заявке любого и всех примеров или формулировок для представления в качестве примера (например, “такой как”) предназначено просто для лучшего освещения изобретения и не налагает ограничения на объем изобретения, если не указано иное. Ни один термин в описании не должен быть истолкован как указывающий на любой не включенный в описание элемент, который необходим для практического применения изобретения.
[00240] Цитирование и включение патентных документов в настоящей заявке сделано только для удобства и не отражает какого–либо представления о действительности, патентоспособности и/или возможности применения таких патентных документов.
[00241] Настоящее изобретение включает все модификации и эквиваленты объекта изобретения, перечисленного в приложенных к нему параграфах, как это разрешено применимым законодательством.
ЛИТЕРАТУРА
Asghar U, Witkiewicz AK, Turner NC, Knudsen ES. The history and future of targeting cyclin–dependent kinases in cancer therapy.Nat Rev Drug Discov. 2015 Feb;14(2):130–46.
Brough R, Frankum JR, Sims D, Mackay A, Mendes–Pereira AM, Bajrami I, et al. Functional viability profiles of breast cancer. Cancer discovery. 2011;1:260– 73.
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646–74.
Ma CX, Reinert T, Chmielewska I, Ellis MJ. Mechanisms of aromatase inhibitor resistance. Nat Rev Cancer. 2015 May;15(5):261–75.
Musgrove EA, Caldon CE, Barraclough J, Stone A, Sutherland RL. Cyclin D as a therapeutic target in cancer. Nature reviews Cancer. 2011; 11:558–72.
Miller TW, Balko JM, Fox EM, Ghazoui Z, Dunbier A, Anderson H, et al. ERalpha dependent E2F transcription can mediate resistance to estrogen deprivation in human breast cancer. Cancer discovery 2011;1:338–41.
Marangoni E, Vincent–Salomon A, Auger N, Degeorges A, Assayag F, de Cremoux P, de Plater L, Guyader C, De Pinieux G, Judde JG, Rebucci M, Tran–Perennou C, Sastre–Garau X, Sigal–Zafrani B, Delattre O, Diéras V, Poupon MF. A new model of patient tumor–derived breast cancer xenografts for preclinical assays. Clin Cancer Res. 2007 Jul 1;13(13):3989–98.
Cottu P, Bièche I, Assayag F, El Botty R, Chateau–Joubert S, Thuleau A, Bagarre T, Albaud B, Rapinat A, Gentien D, de la Grange P, Sibut V, Vacher S, Hatem R, Servely JL, Fontaine JJ, Decaudin D, Pierga JY, Roman–Roman S, Marangoni E. Acquired resistance to endocrine treatments is associated with tumor–specific molecular changes in patient–derived luminal breast cancer xenografts. Clin Cancer Res. 2014 Aug 15;20(16):4314–25. doi: 10.1158/1078–0432.CCR–13–3230. Epub 2014 Jun 19.
Hatem R, El Botty R, Chateau–Joubert S, Servely JL, Labiod D, de Plater L, Assayag F, Coussy F, Callens C, Vacher S, Reyal F, Cosulich S, Diéras V, Bièche I, Marangoni ETargeting mTOR pathway inhibits tumor growth in different molecular subtypes of triple–negative breast cancers. Oncotarget. 2016 Jul 26;7(30):48206–48219. doi: 10.18632/oncotarget.10195.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788174C2 |
| ПРОИЗВОДНЫЕ N2-(2-ФЕНИЛ)-ПИРИДО[3,4-d]ПИРИМИДИН-2,8-ДИАМИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ MPS1 ИНГИБИТОРА | 2015 |
|
RU2693460C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| БЕНЗОПИРАНОВЫЕ И БЕНЗОКСЕПИНОВЫЕ ИНГИБИТОРЫ РI3K И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2506267C2 |
| ПРОИЗВОДНЫЕ 2-(ФЕНИЛ ИЛИ ПИРИД-3-ИЛ)АМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2647849C2 |
| ПРОИЗВОДНОЕ ПИРИДО[3,4-d]ПИРИМИДИНА И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 2016 |
|
RU2695337C2 |
| КОНДЕНСИРОВАННОЕ 4-ОКСОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ | 2005 |
|
RU2358969C2 |
| СОЕДИНЕНИЯ, ГЕТЕРОБИЦИКЛО-ЗАМЕЩЕННЫЕ-[1,2,4]ТРИАЗОЛО[1,5c]ХИНАЗОЛИН-5-АМИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ А2А АНТАГОНИСТОВ | 2013 |
|
RU2671628C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2006 |
|
RU2421454C2 |
| ДИАМИНОТРИАЗОЛЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2003 |
|
RU2350606C2 |
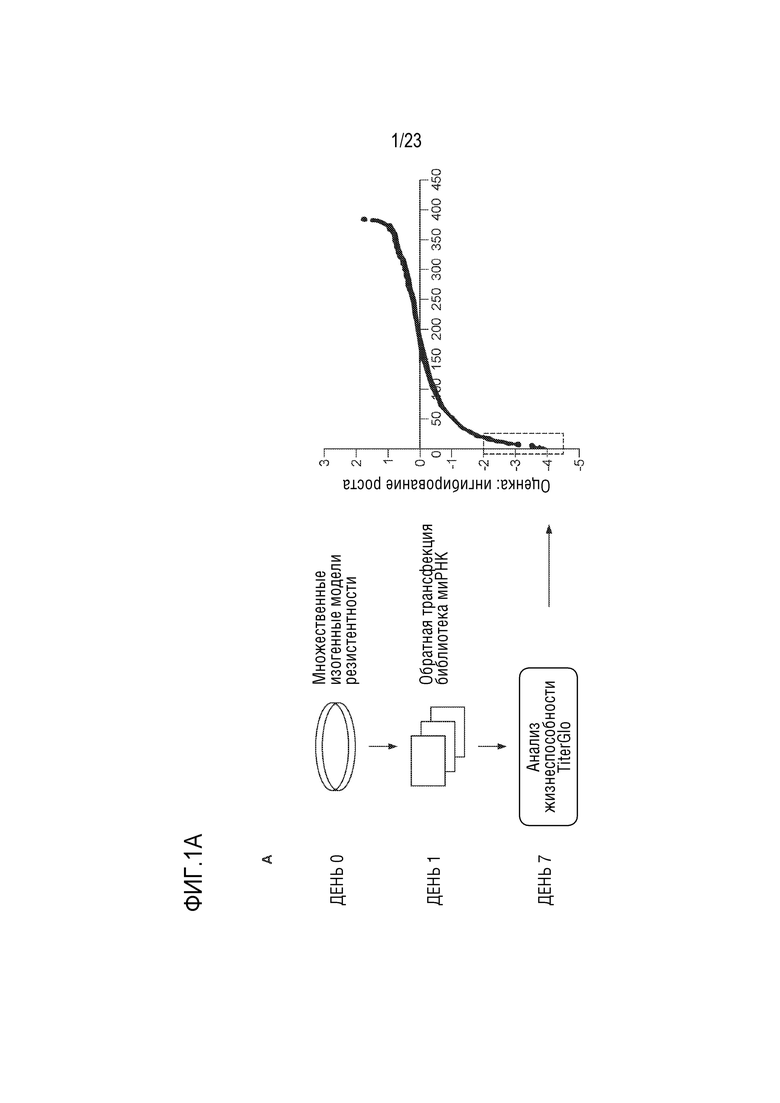
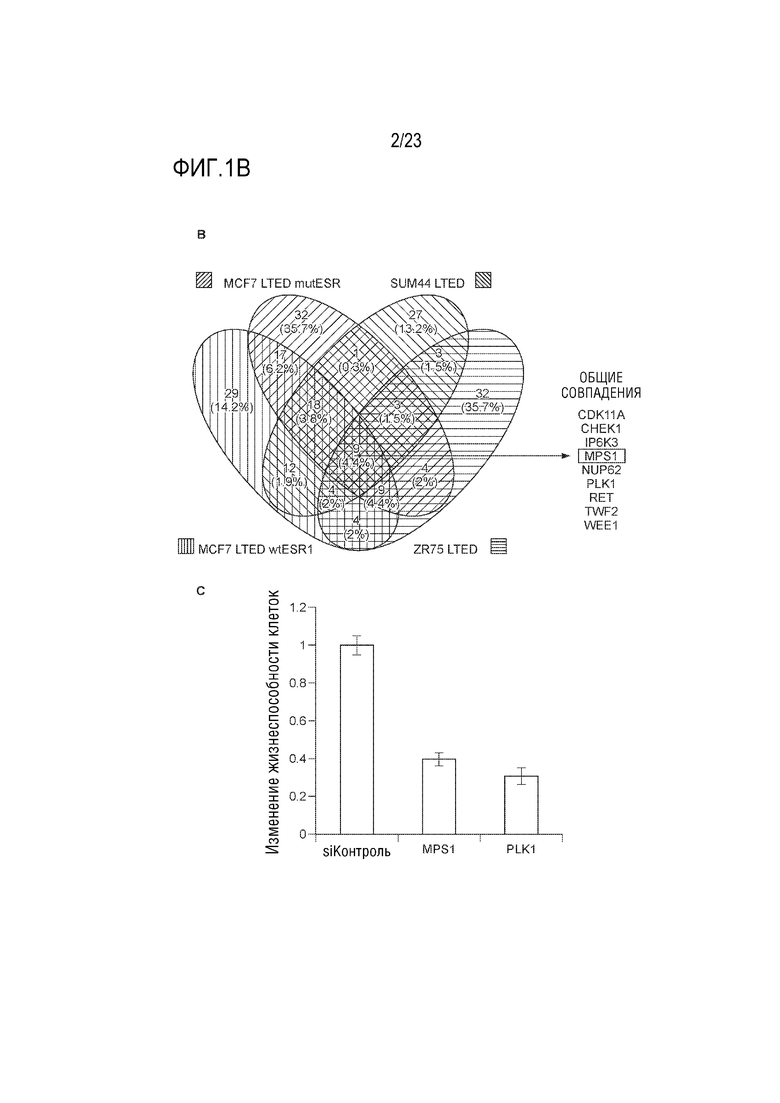
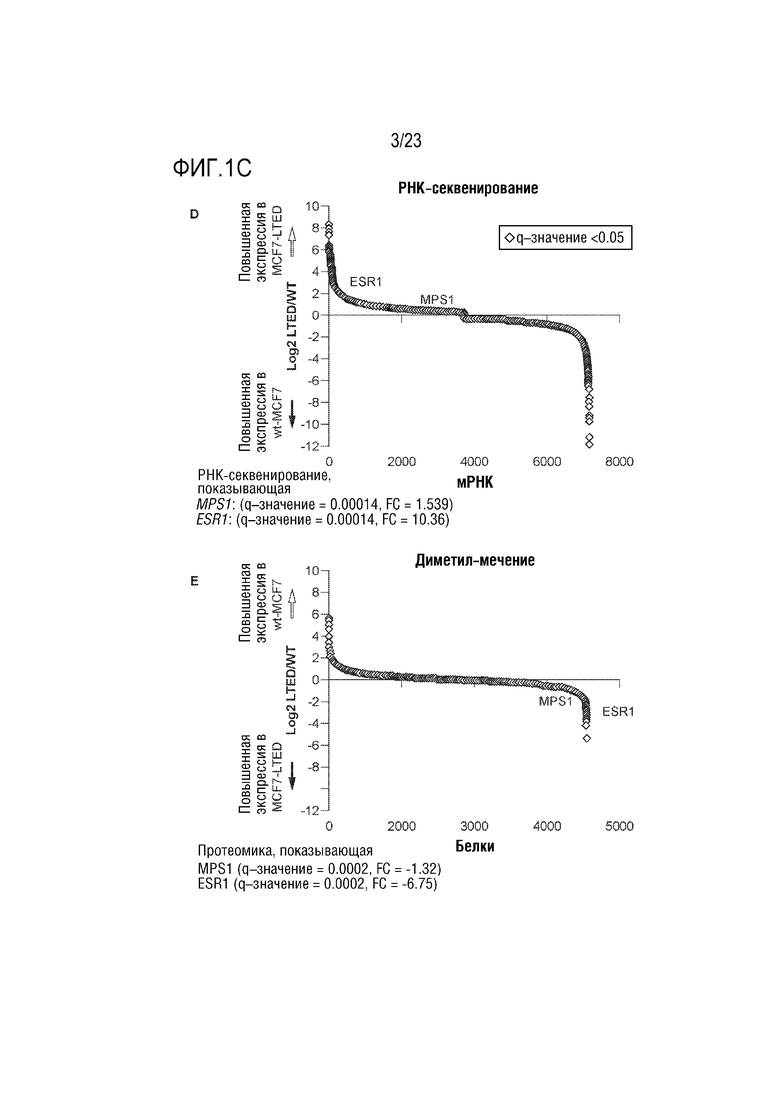
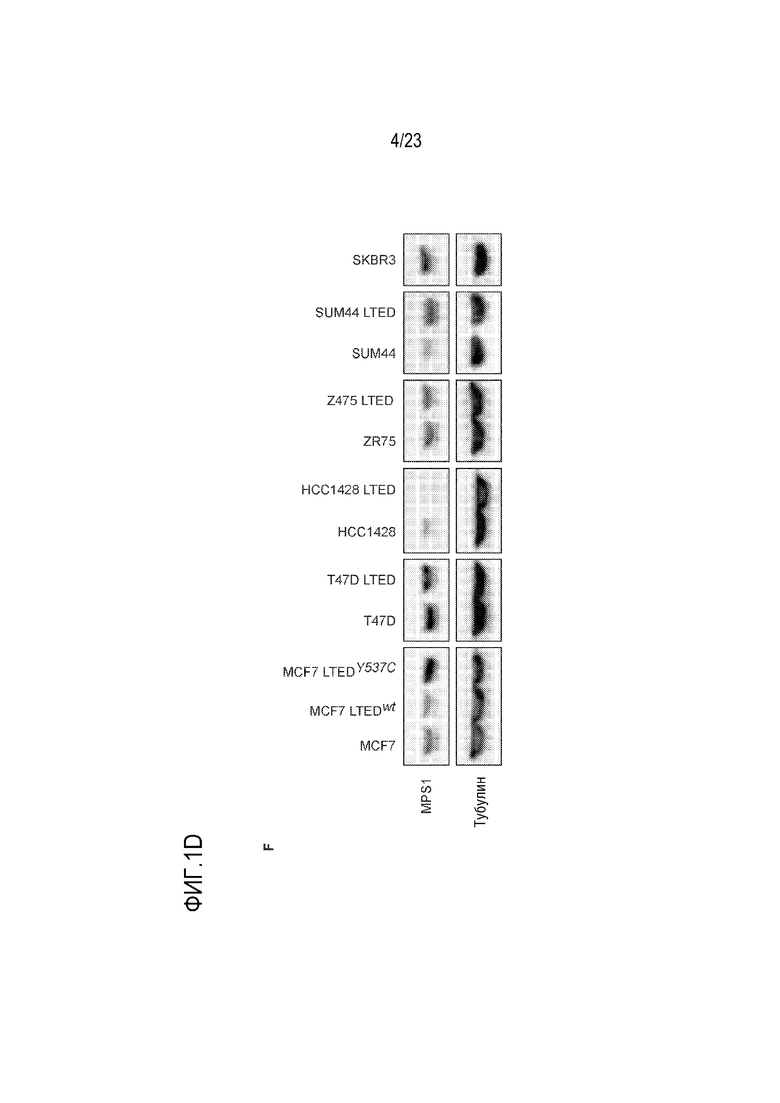
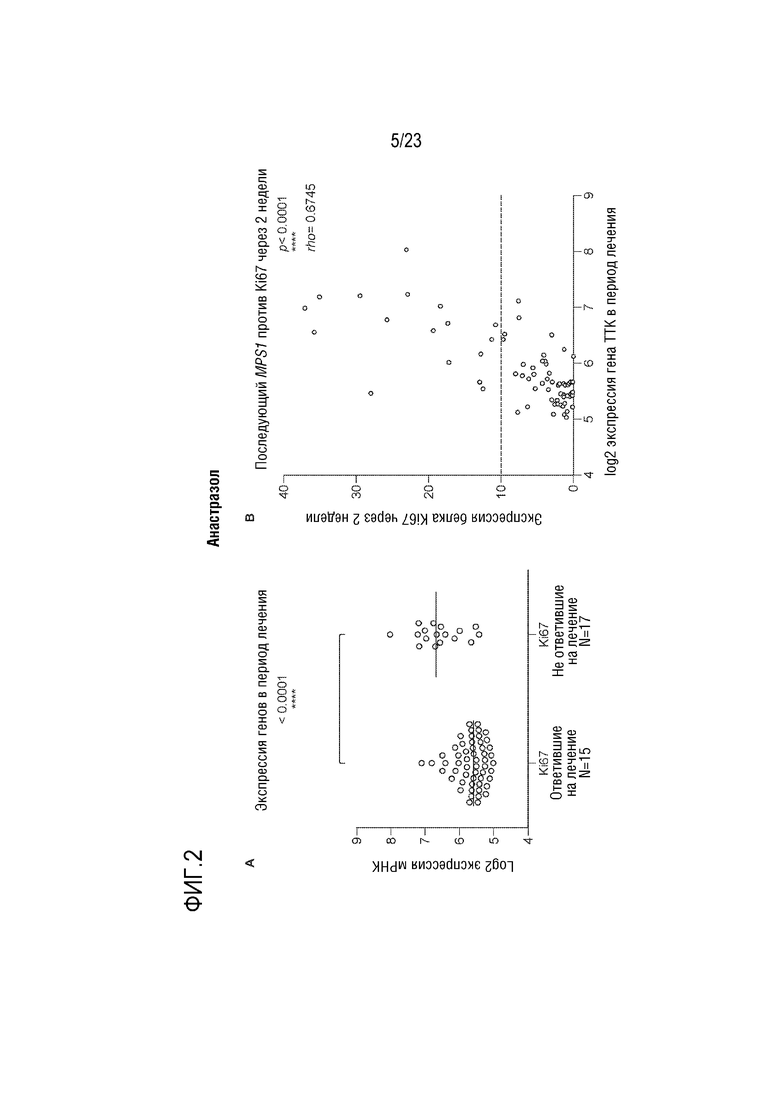
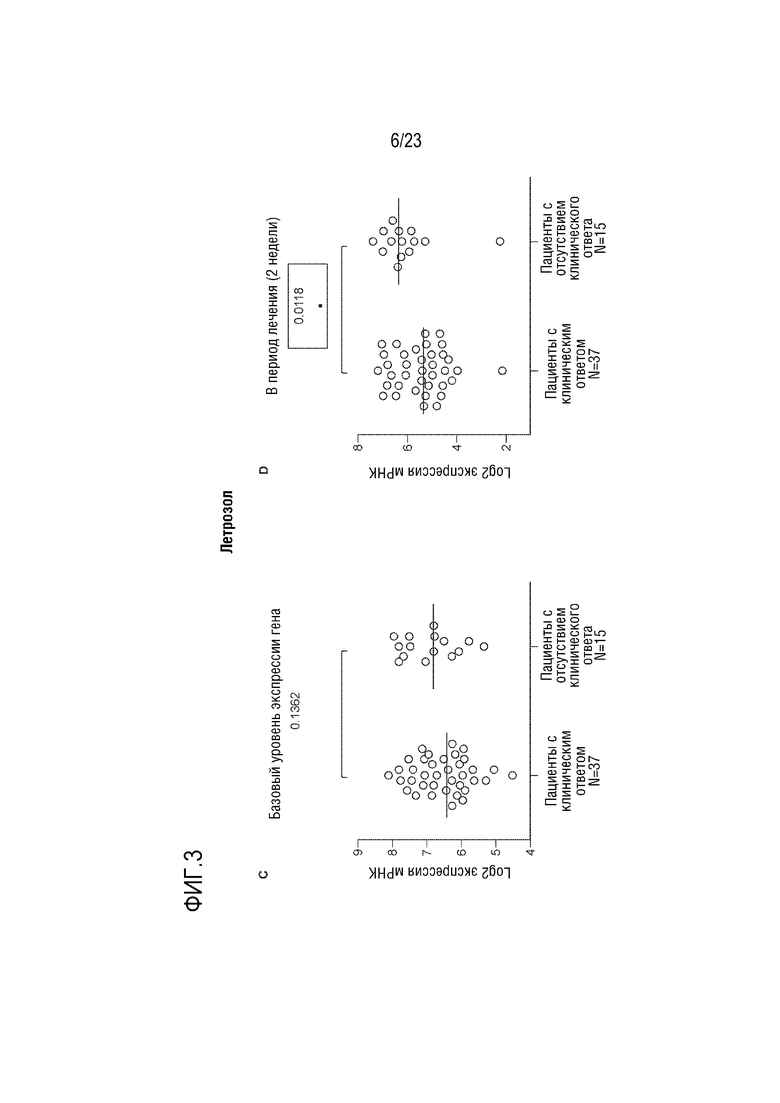
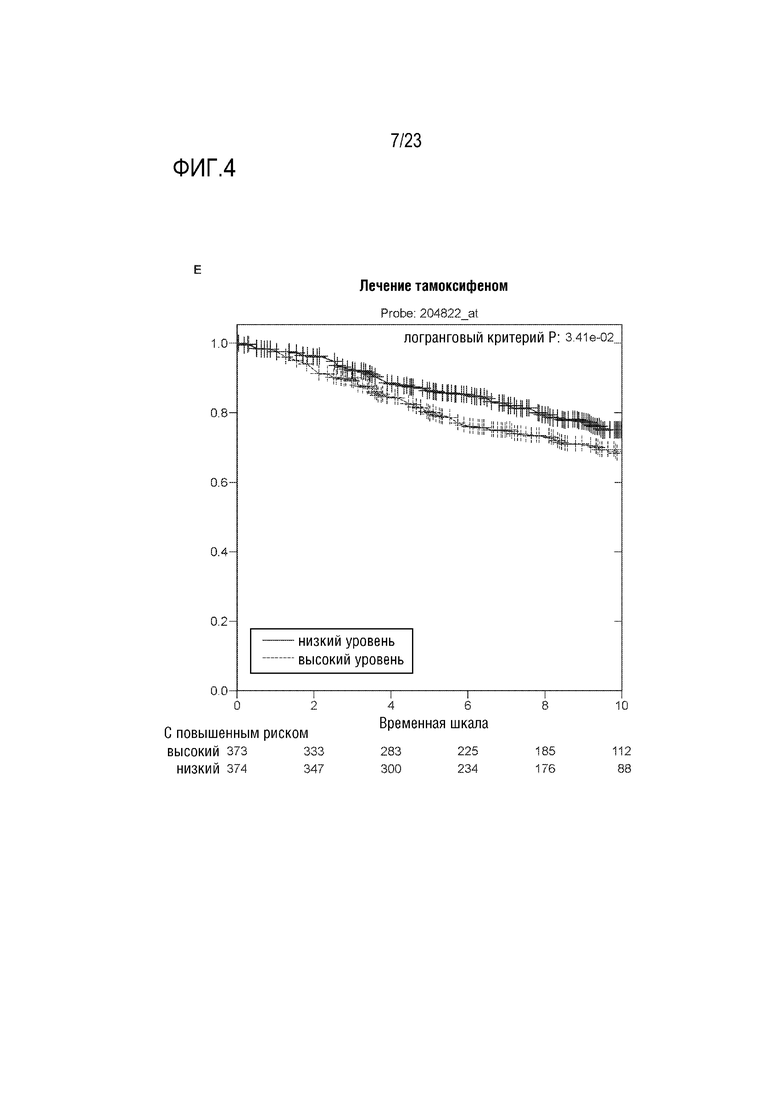
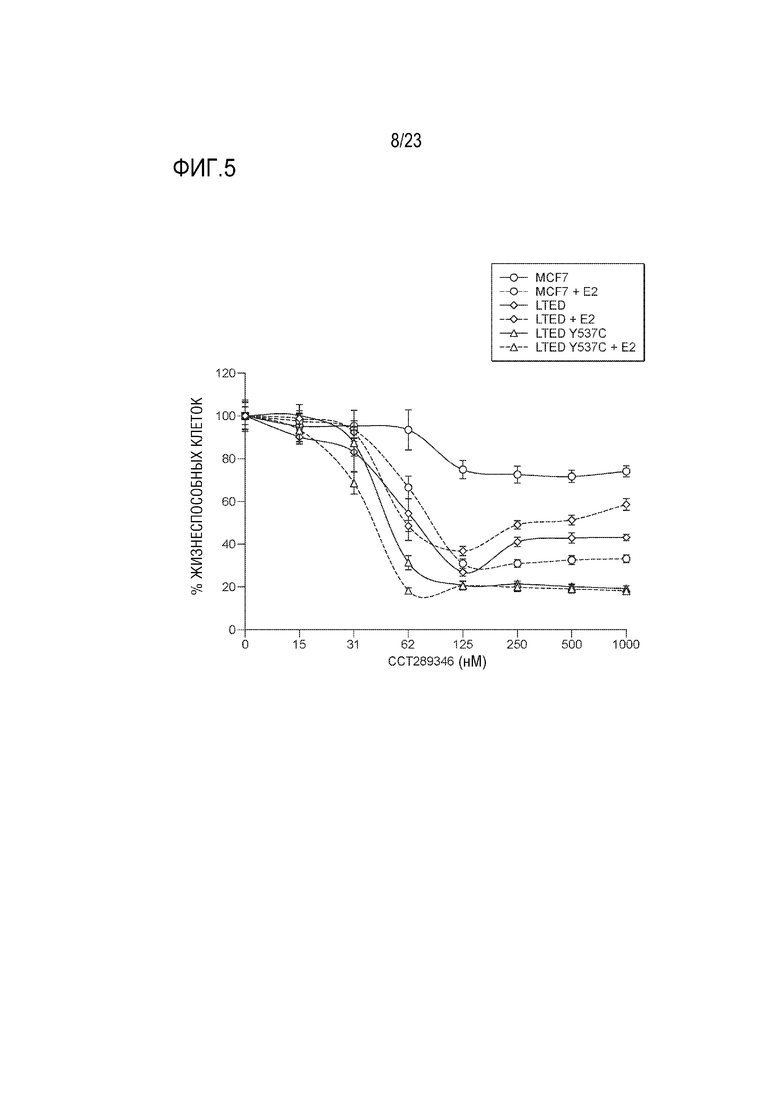
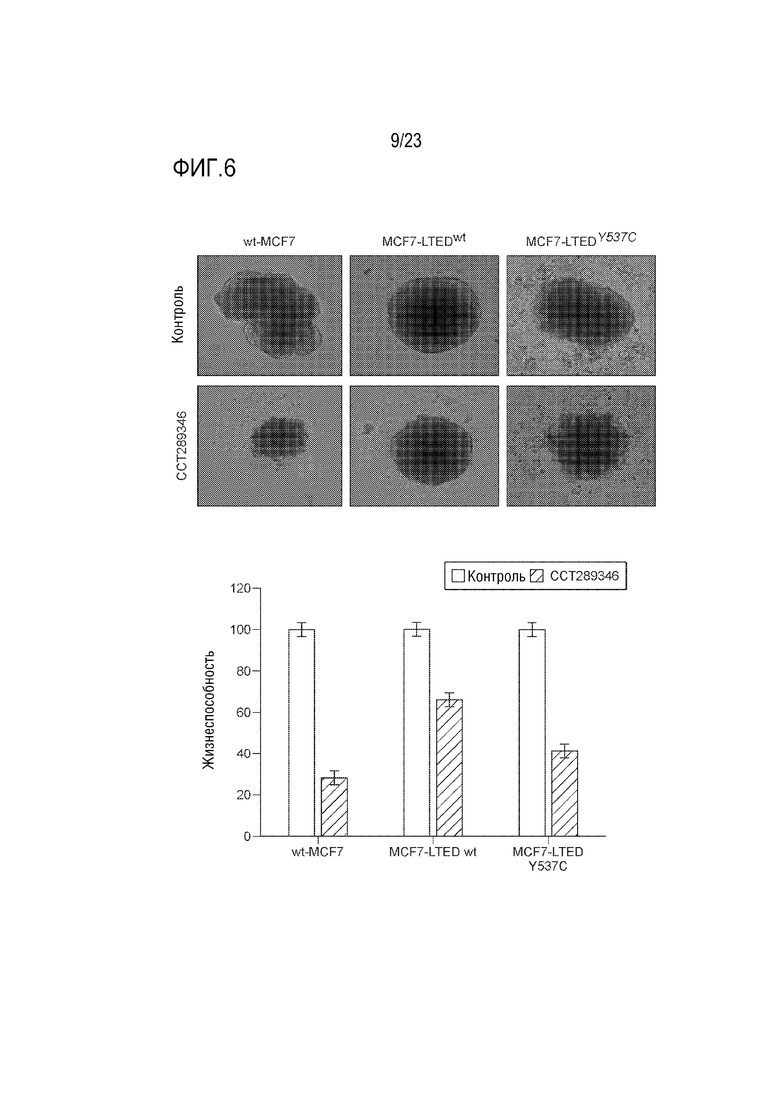
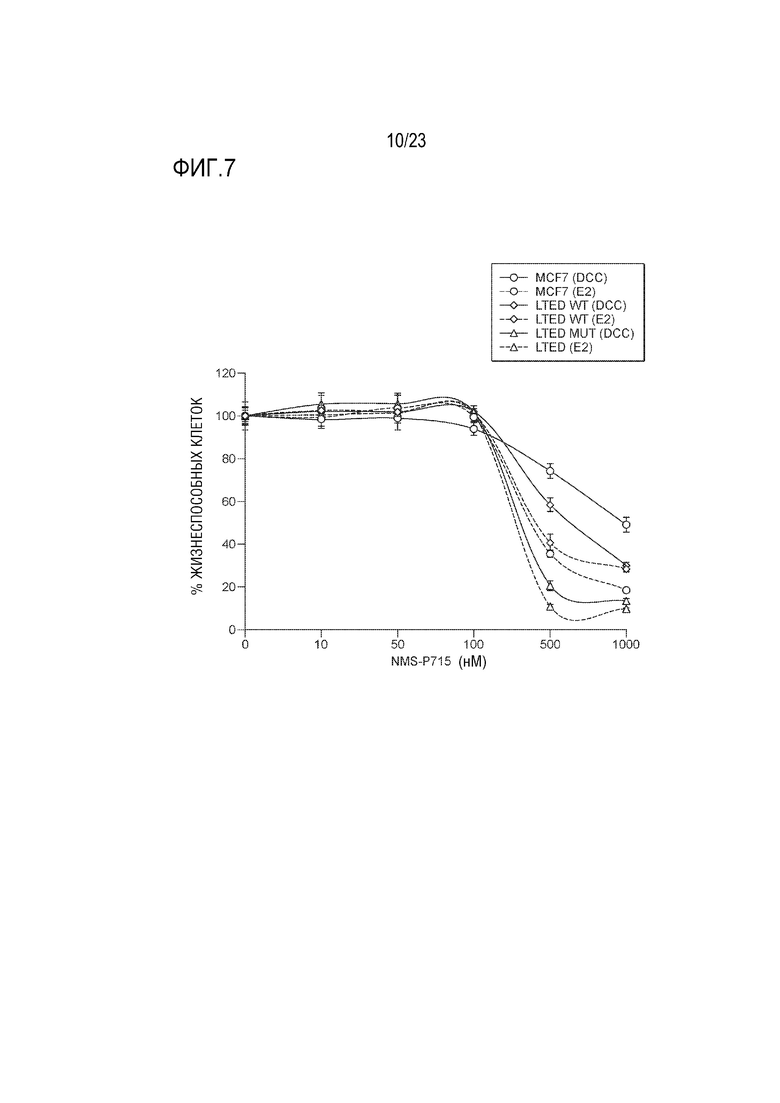
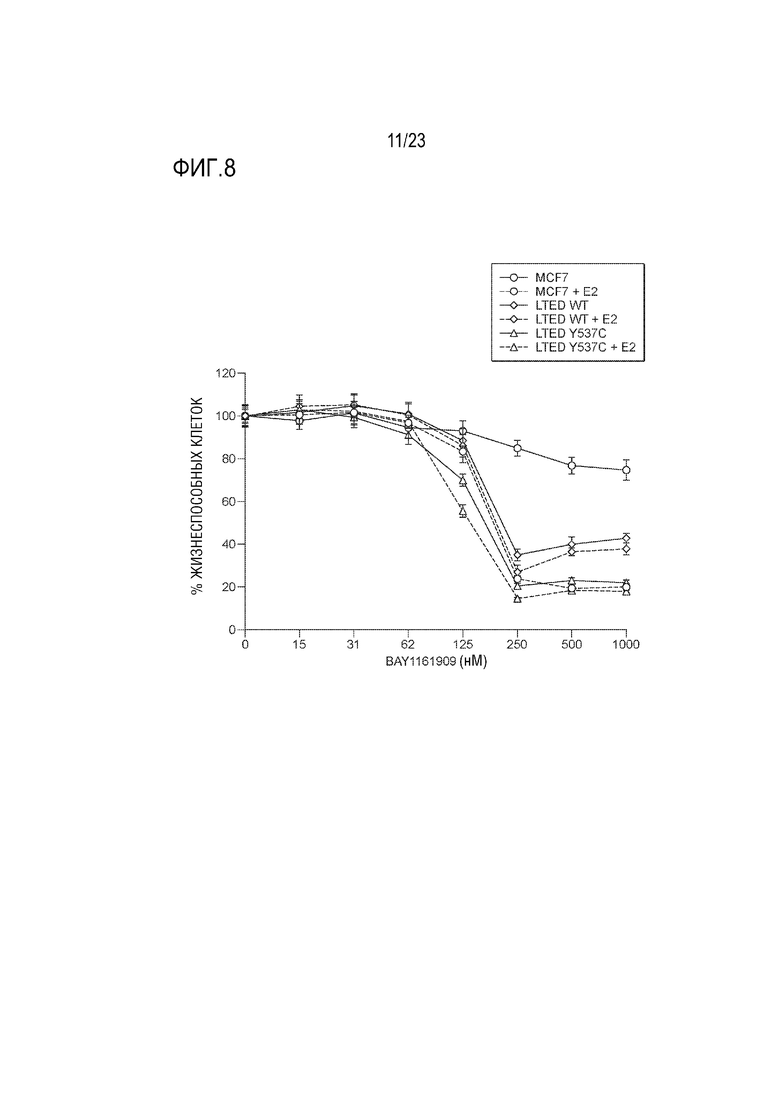
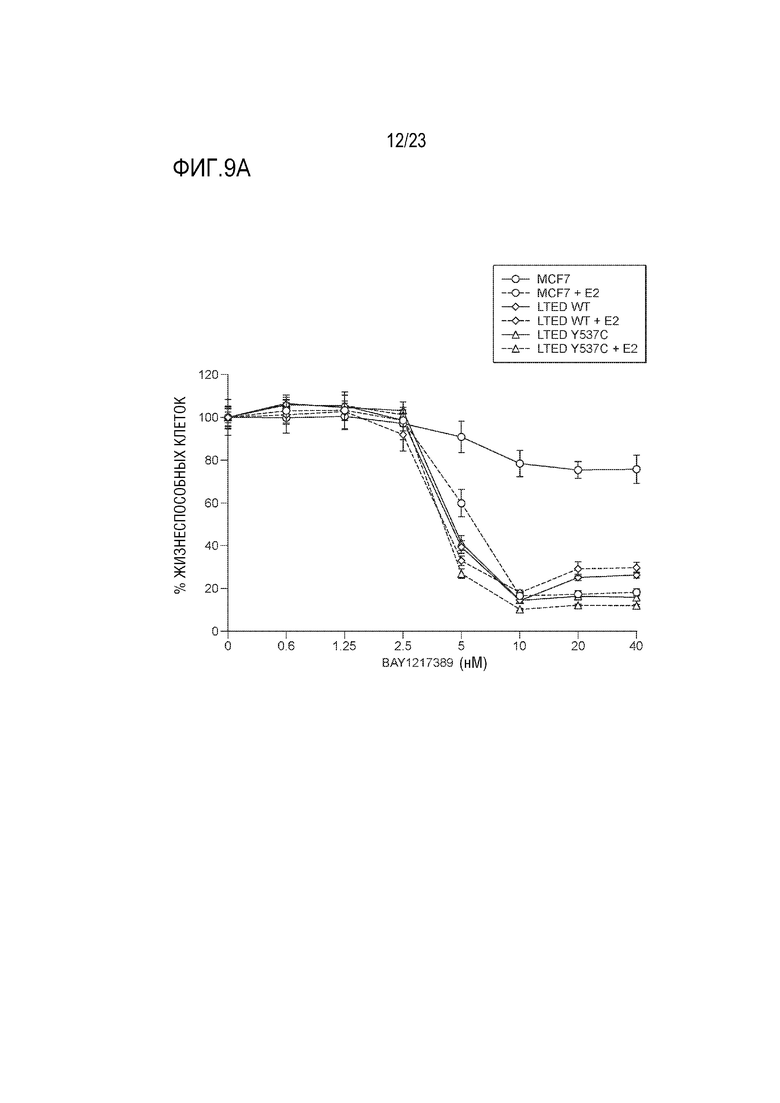
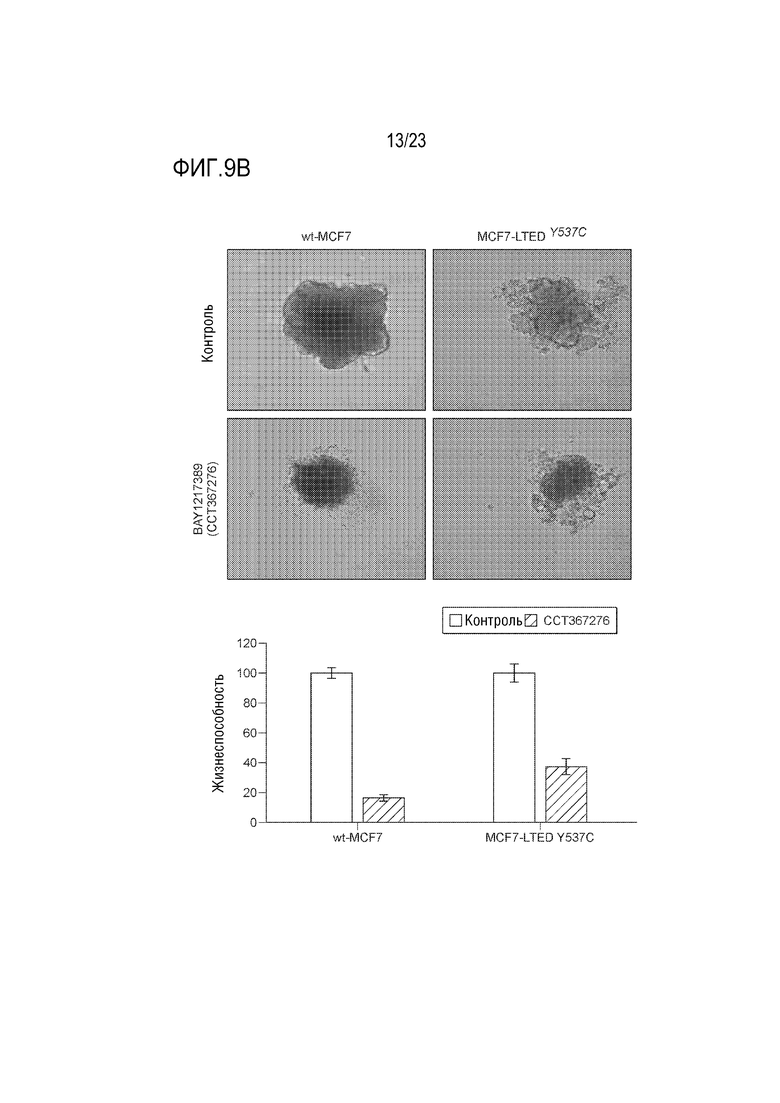
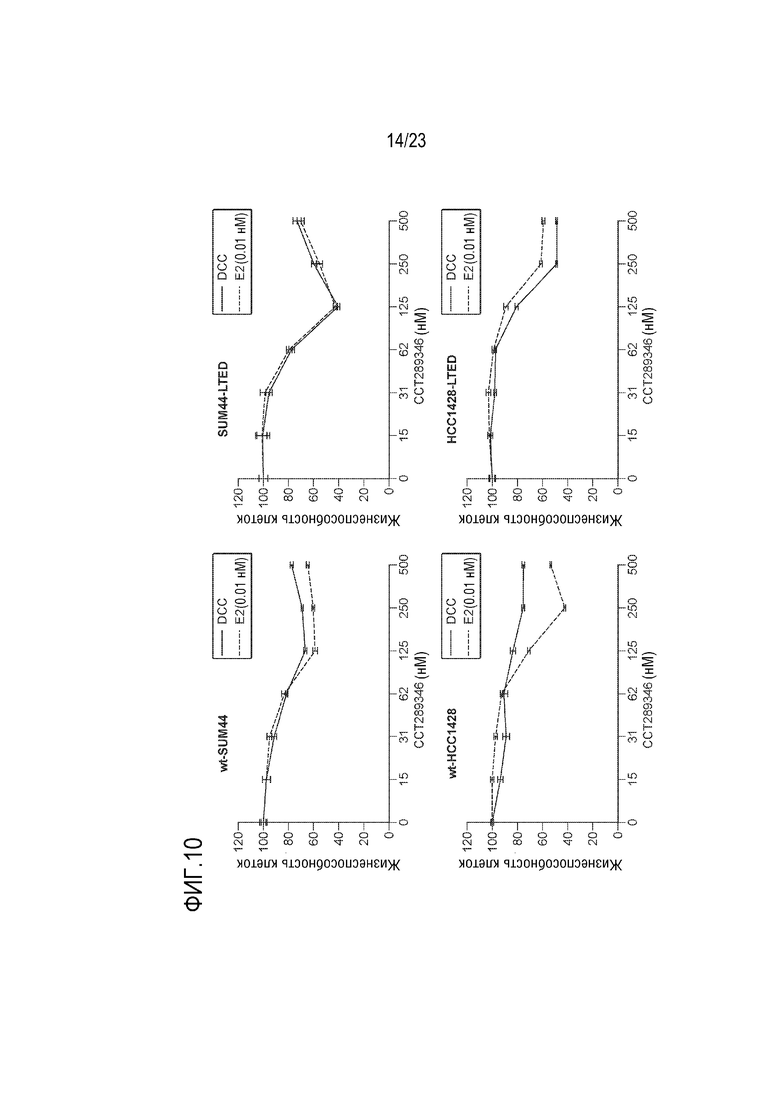
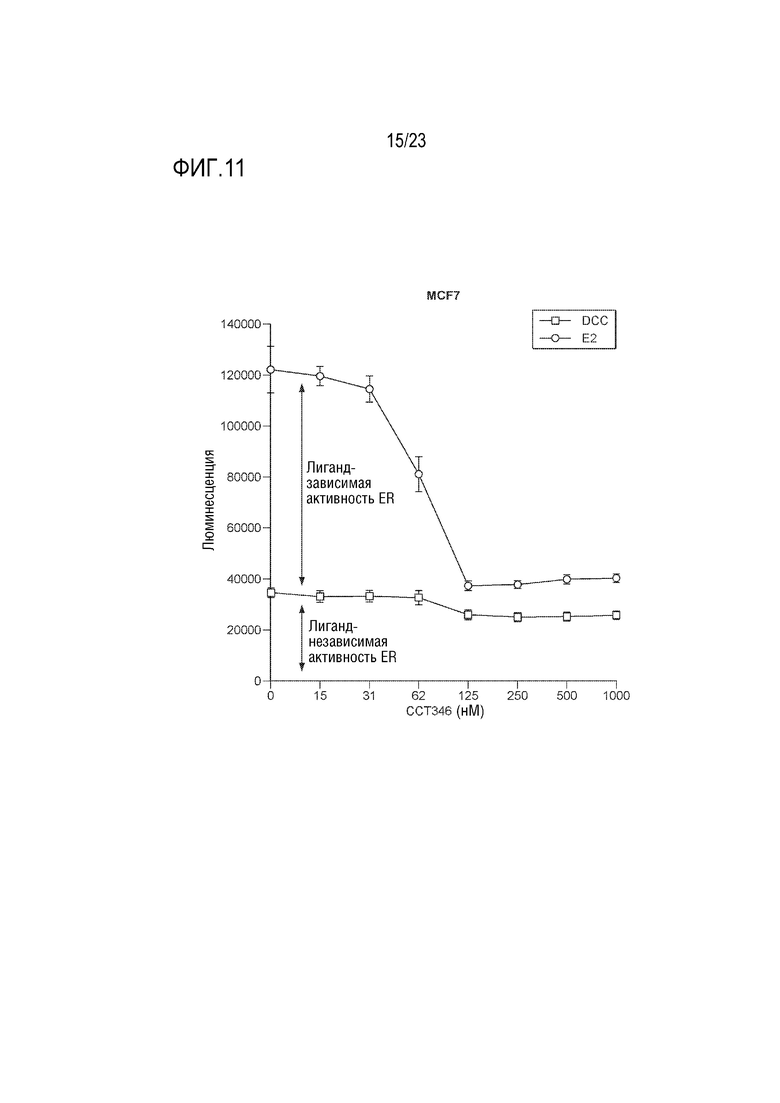
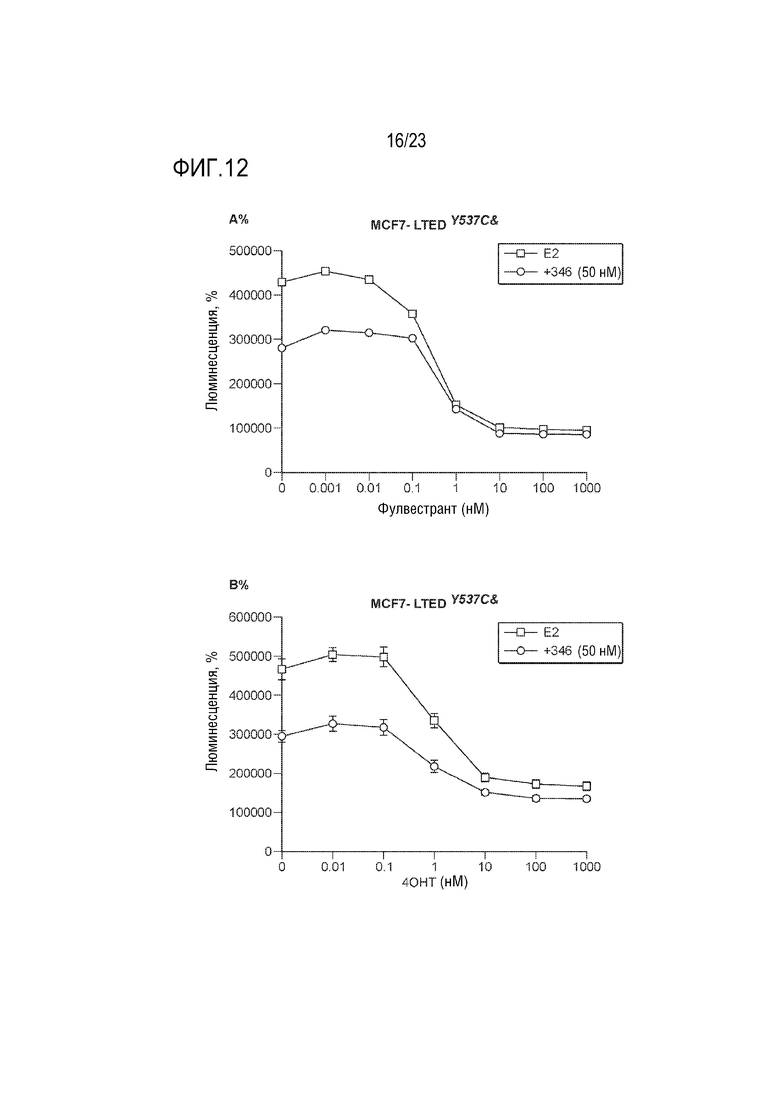
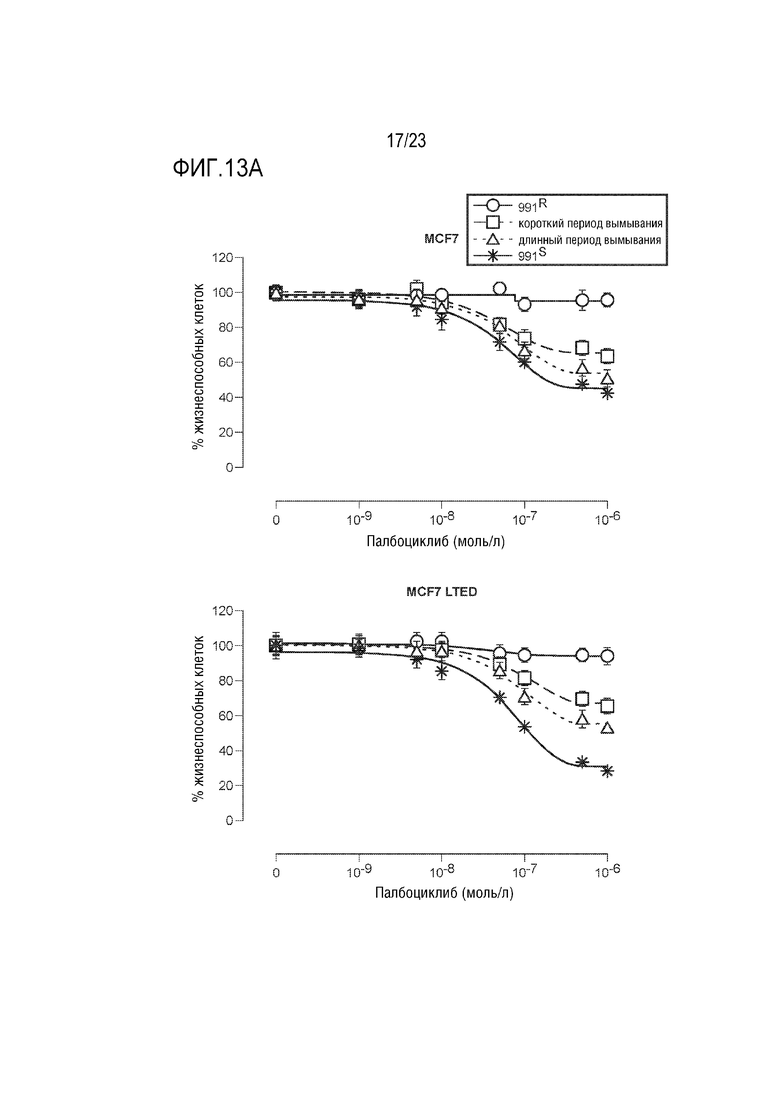
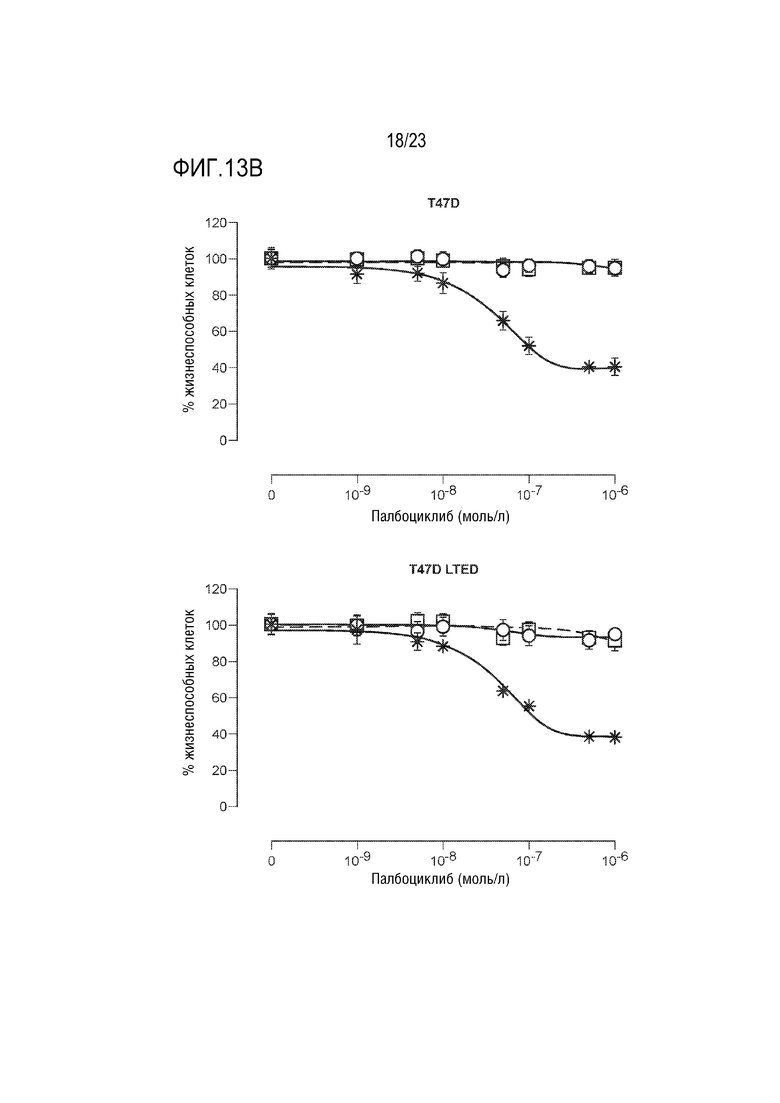
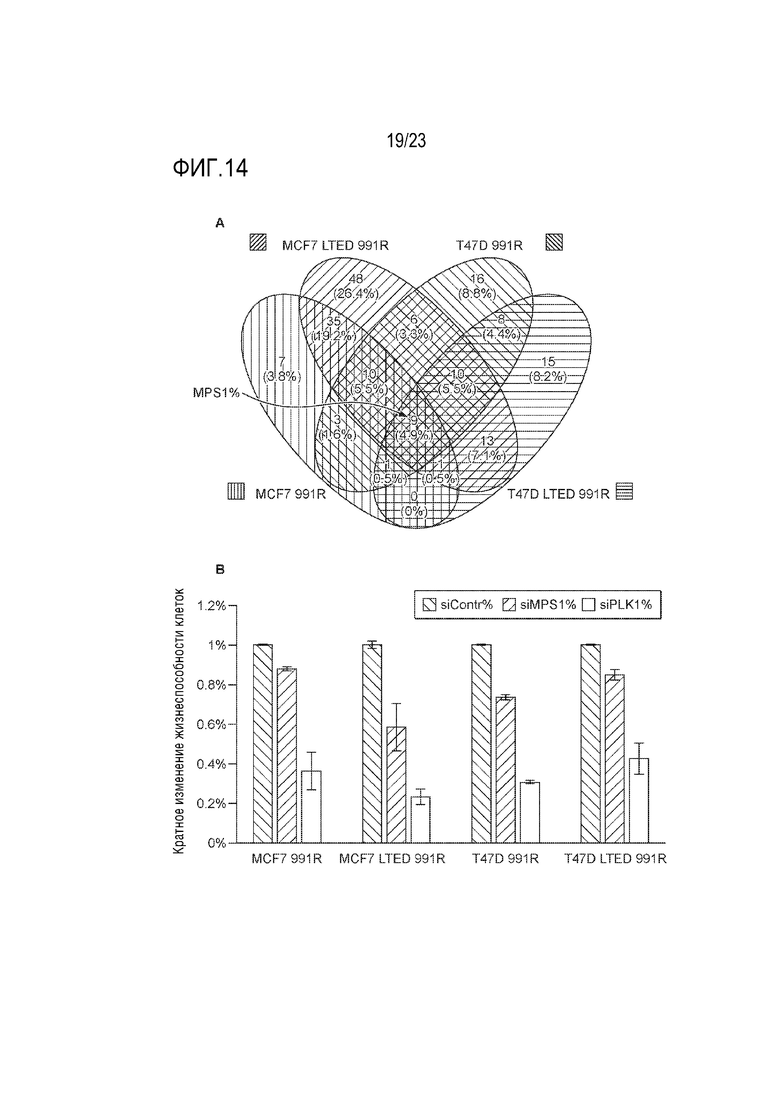
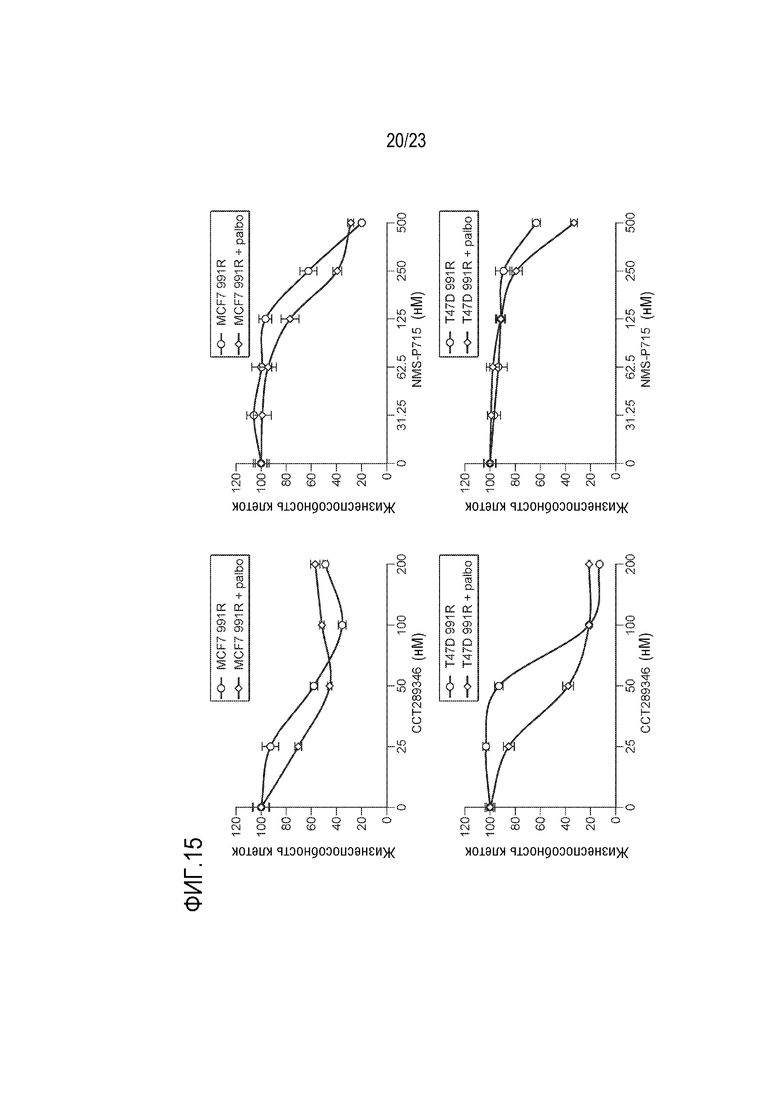
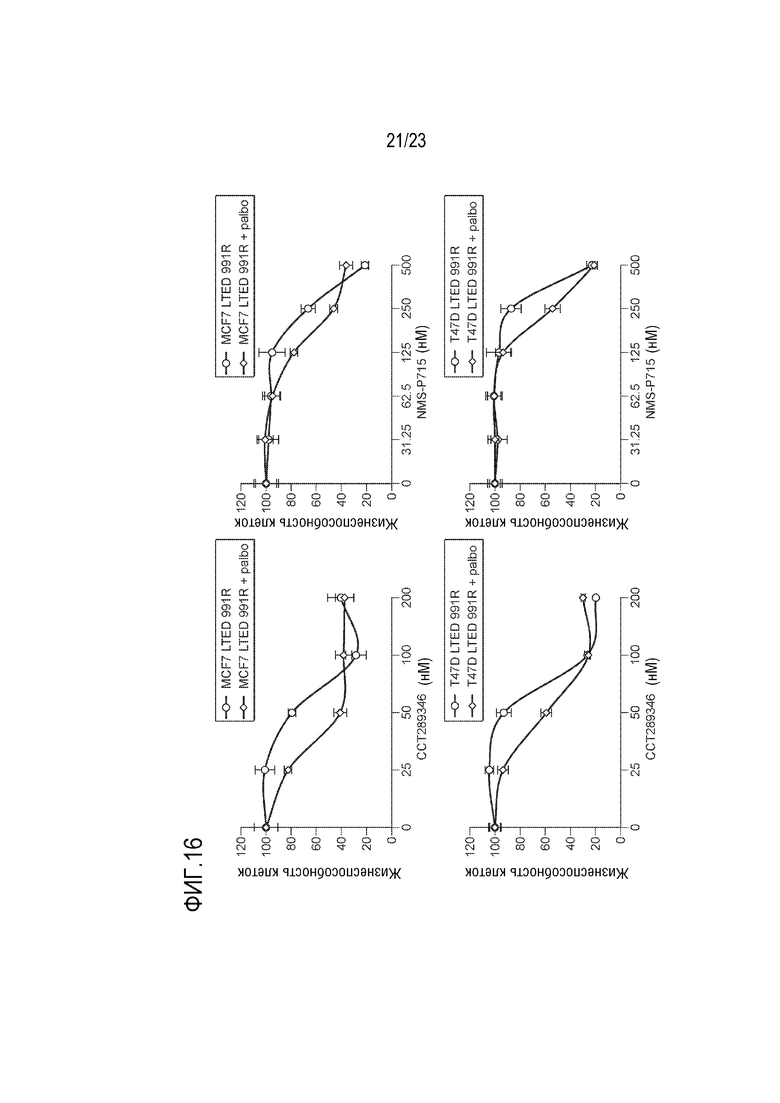
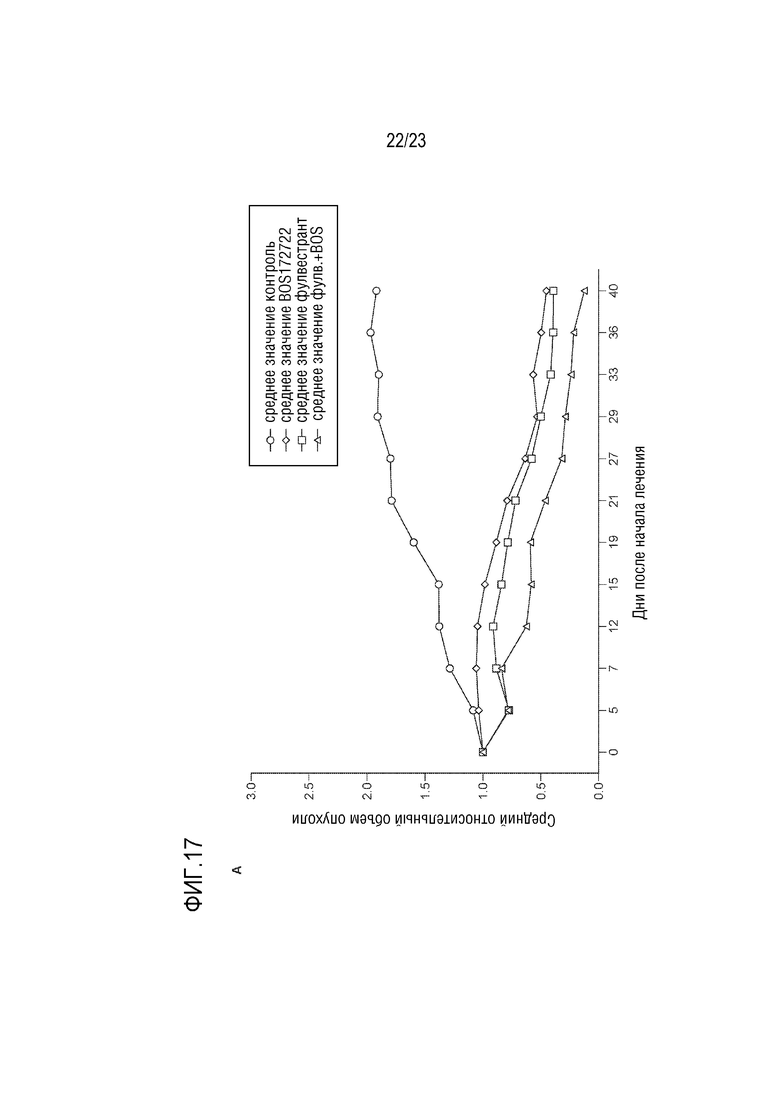
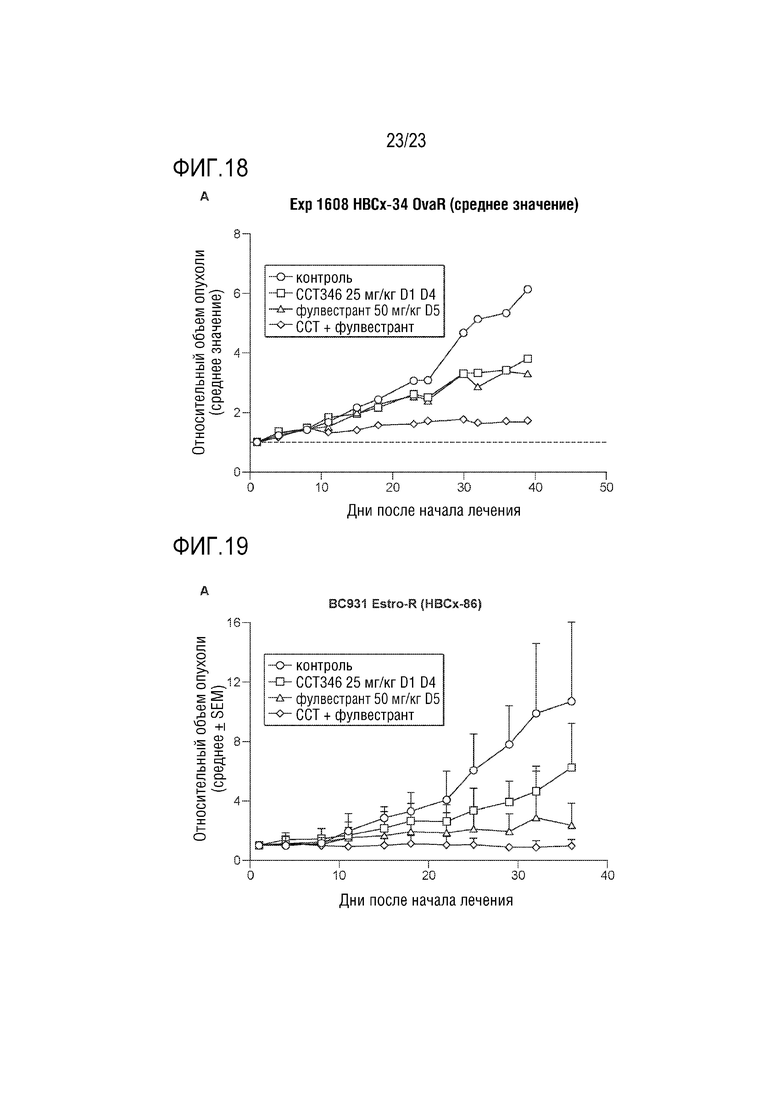
Группа изобретений относится к области медицины, а именно к онкологии и терапии, и предназначена для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом. Способ лечения включает введение указанному субъекту терапевтически эффективного количества ингибитора MPS1, причем указанный субъект ранее лечился препаратом эндокринной терапии и/или указанный рак молочной железы является резистентным к эндокринной терапии. Также представлены применения ингибитора MPS1 для лечения эстроген–рецептор–положительного рака молочной железы у субъекта и для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы у субъекта. Использование группы изобретений обеспечивает эффективное лечение эстроген–рецептор–положительного рака молочной железы. 3 н. и 81 з.п. ф-лы, 19 ил., 1 пр.
1. Способ для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества ингибитора MPS1, где:
(i) указанный субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии;
где ингибитор MPS1 выбирают из группы, состоящей из:
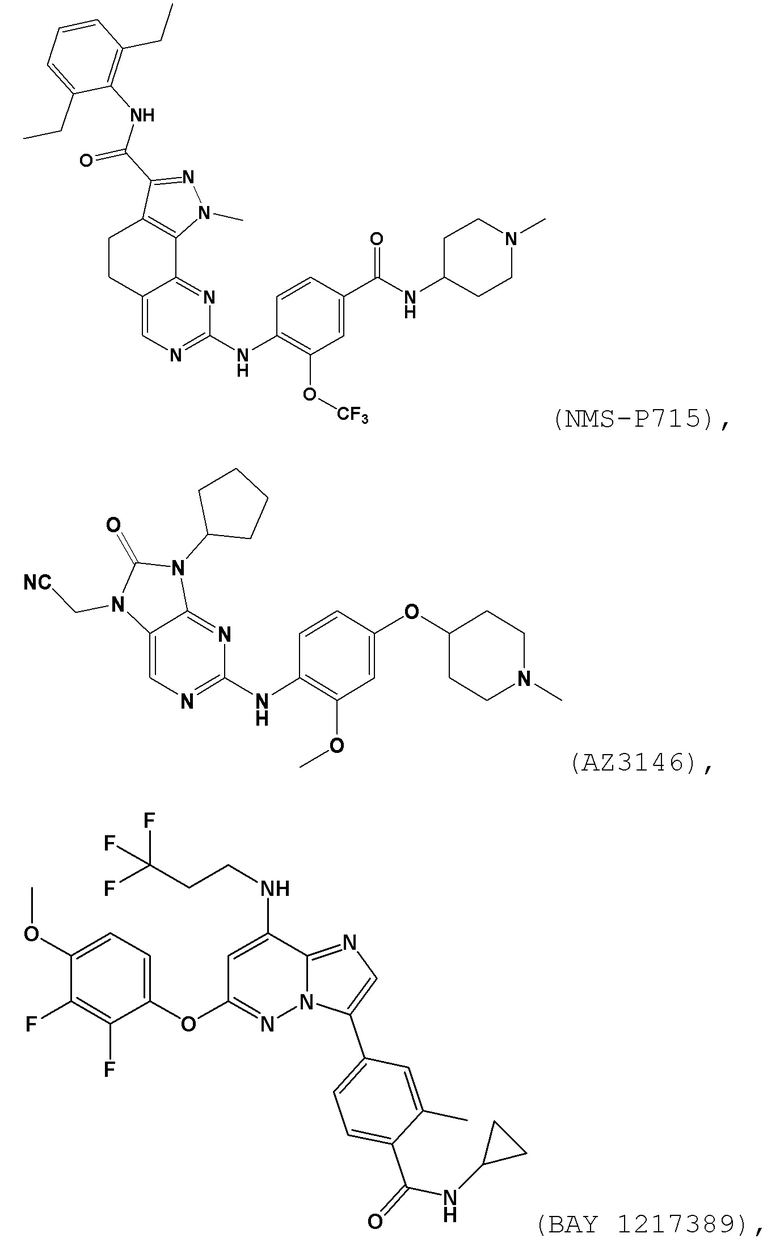
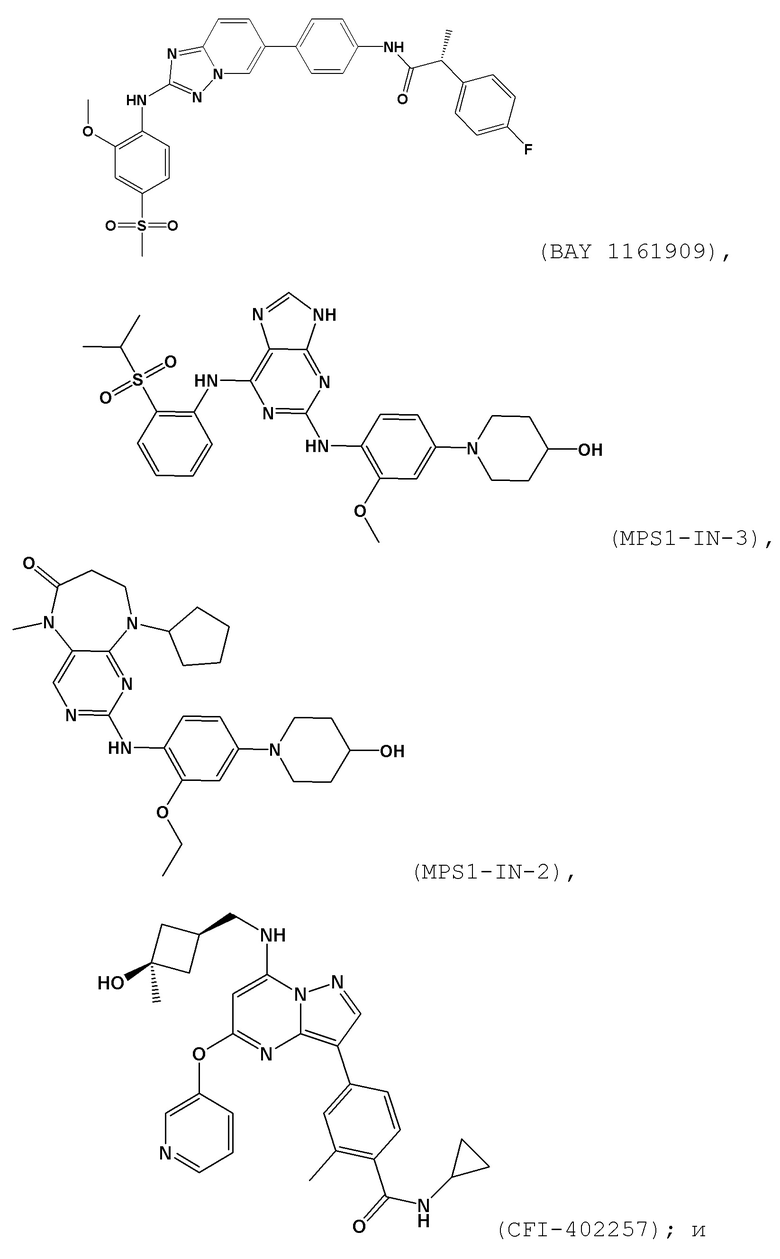
соединения формулы V
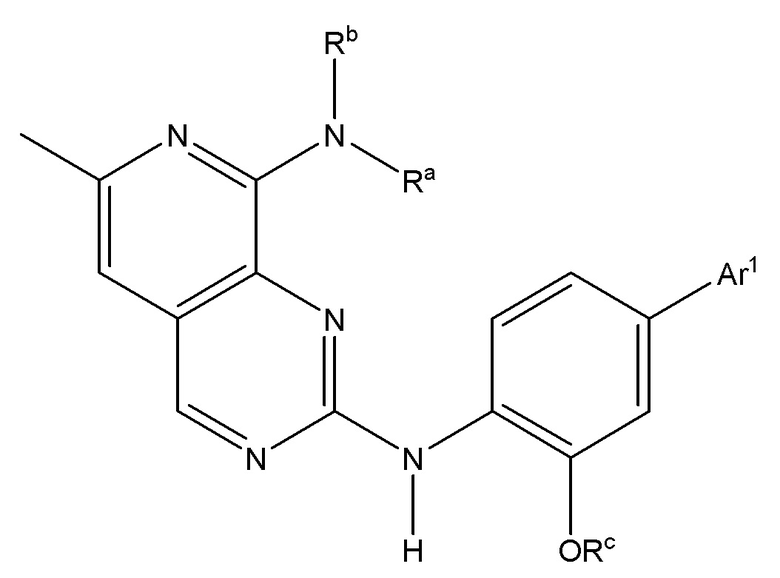 (V)
(V)
где
Ra представляет собой водород;
Rb представляет собой C1–6 алкил, необязательно замещенный галогеном; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют 4–10–членное гетероциклическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из водорода, C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила;
Rc представляет собой C1–3 алкил; и
Ar1 представляет собой 5– или 6–членное гетероарильное кольцо, необязательно замещенное одним или несколькими заместителями, независимо выбранными из C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила.
2. Способ по п. 1, где у субъекта предыдущее лечение препаратом эндокринной терапии было неудачным.
3. Способ по любому из пп. 1 и 2, где субъект имел рецидив в процессе или после лечения препаратом эндокринной терапии.
4. Способ по любому из предшествующих пунктов, где у субъекта было прогрессирование заболевания в процессе или после лечения препаратом эндокринной терапии.
5. Способ по любому из предшествующих пунктов, где у субъекта развился резистентный к эндокринной терапии рак молочной железы в процессе или после лечения препаратом эндокринной терапии.
6. Способ по любому из пп. 1–5, где указанный рак молочной железы является de novo резистентным к эндокринной терапии.
7. Способ по любому из предшествующих пунктов, где эндокринная терапия включает/состоит по существу из/состоит из введения эндокринного средства.
8. Способ по п. 7, где эндокринное средство выбрано из одного или нескольких из ингибитора ароматазы, селективного модулятора эстрогеновых рецепторов (SERM) и селективного деструктора/даун–регулятора эстрогеновых рецепторов (SERD).
9. Способ по любому из предшествующих пунктов, где эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения ингибитором ароматазы и SERD.
10. Способ по любому из пп. 7 и 8, где эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения средствами SERM и SERD.
11. Способ по любому из пп. 8 и 9, где ингибитор ароматазы выбран из группы, состоящей из анастрозола, экземестана и летрозола или их фармацевтически приемлемых солей или сольватов.
12. Способ по любому из пп. 8 и 10, где SERM представляет собой тамоксифен или его фармацевтически приемлемые соли или сольваты.
13. Способ по любому из пп. 8–10, где SERD представляет собой фулвестрант или его фармацевтически приемлемые соли или сольваты.
14. Способ по любому из предшествующих пунктов, где субъект находится в пременопаузальном периоде.
15. Способ по любому из пп. 1–13, где субъект находится в постменопаузальном периоде.
16. Способ по любому из предшествующих пунктов, где
(i) субъекта дополнительно ранее лечили ингибитором CDK4/6; и/или
(ii) рак молочной железы дополнительно резистентен к лечению ингибитором CDK4/6.
17. Способ по п. 16, где у субъекта было неудачным лечение ингибитором CDK4/6.
18. Способ по любому из пп. 16 и 17, где субъект имел рецидив в процессе или после лечения ингибитором CDK4/6.
19. Способ по любому из пп. 16–18, где у субъекта было прогрессирование заболевания в процессе или после лечения ингибитором CDK4/6.
20. Способ по любому из предшествующих пунктов, где у субъекта развился резистентный к ингибитору CDK4/6 рак молочной железы в процессе или после лечения ингибитором CDK4/6.
21. Способ по любому из пп. 1–20, где рак молочной железы является de novo резистентным к лечению ингибитором CDK4/6.
22. Способ по любому из пп. 16–21, где ингибитор CDK4/6 выбран из группы, состоящей из палбоциклиба, абемациклиба и рибоциклиба или их фармацевтически приемлемых солей или сольватов.
23. Способ по любому из предшествующих пунктов, где способ дополнительно включает введение указанному субъекту эндокринного средства отдельно, последовательно и/или в комбинации с ингибитором MPS1.
24. Способ по п. 19, где эндокринное средство выбрано из группы, состоящей из тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
25. Способ по любому из предшествующих пунктов, где ингибитор MPS1 выбран из группы, состоящей из
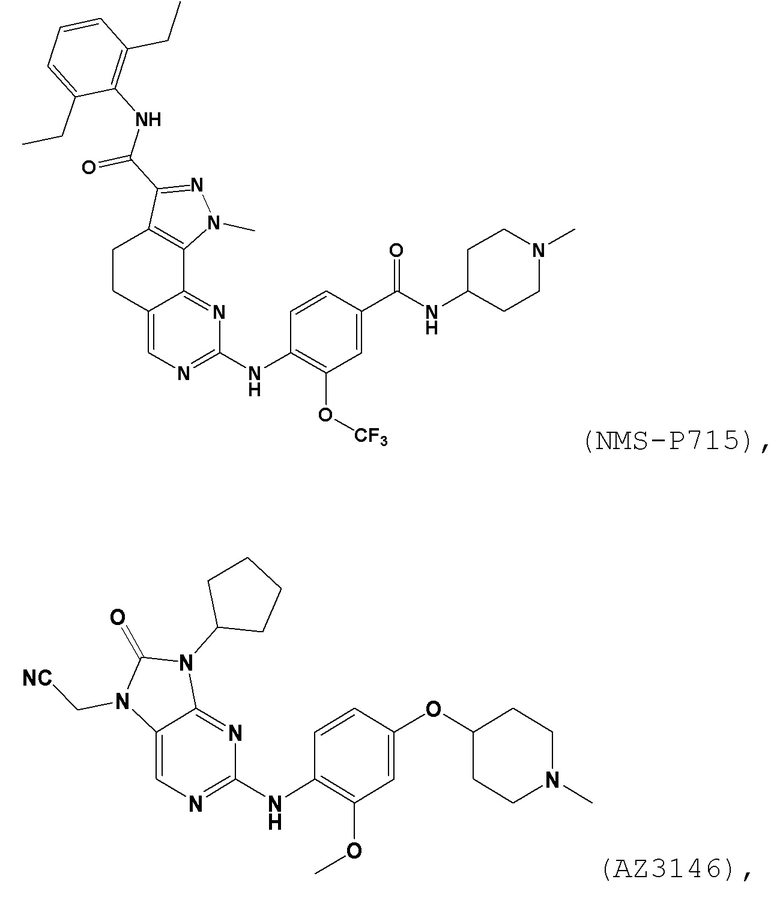
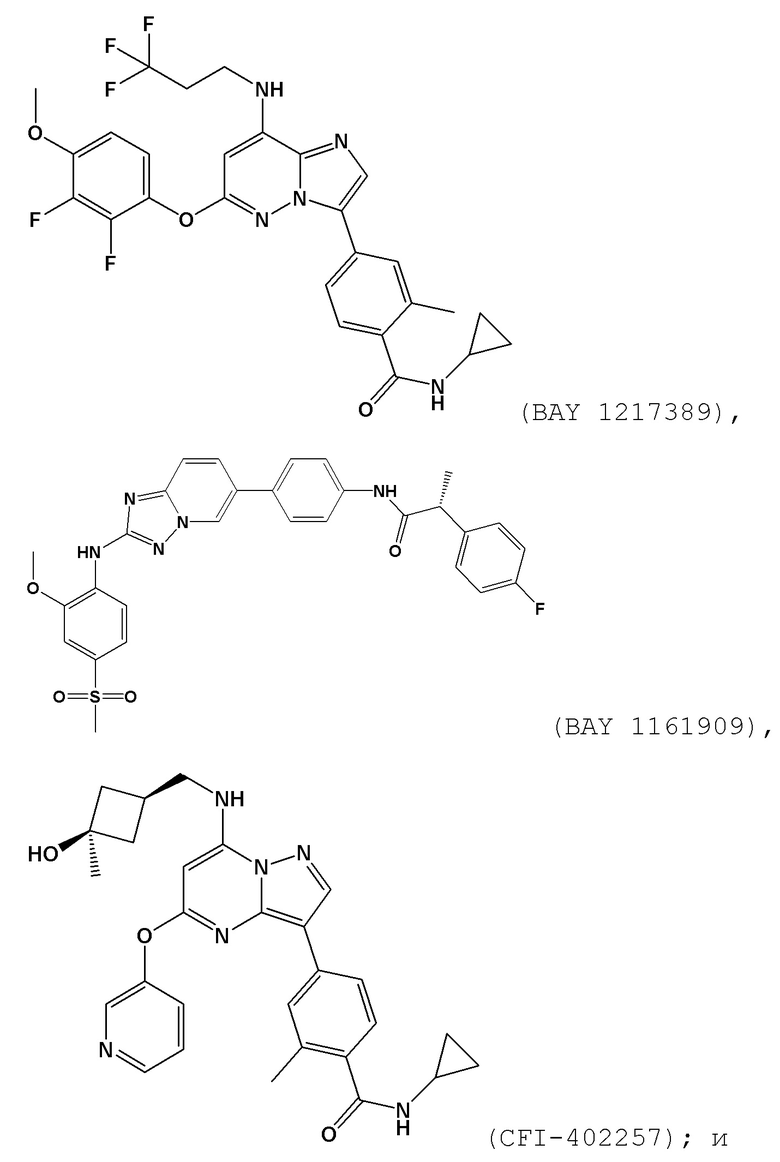
N2-(2-этокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-6-метил-N8-неопентилпиридо[3,4-d]пиримидин-2,8-диамина (CCT289346) или их фармацевтически приемлемой соли или сольвата.
26. Способ по любому из пп. 1-25, где ингибитор MPS1 выбран из группы, состоящей из соединения формулы V или его фармацевтически приемлемой соли или сольвата.
27. Способ по п. 26, где ингибитор MPS1 выбран из следующих:
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амин;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амин;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрил;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
или фармацевтически приемлемой соли или сольвата такого соединения.
28. Способ по любому из предшествующих пунктов, где ингибитор MPS1 представляет собой N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин или его фармацевтически приемлемую соль.
29. Применение ингибитора MPS1 для применения в лечении эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, где:
(i) субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии;
где ингибитор MPS1 выбирают из группы, состоящей из:
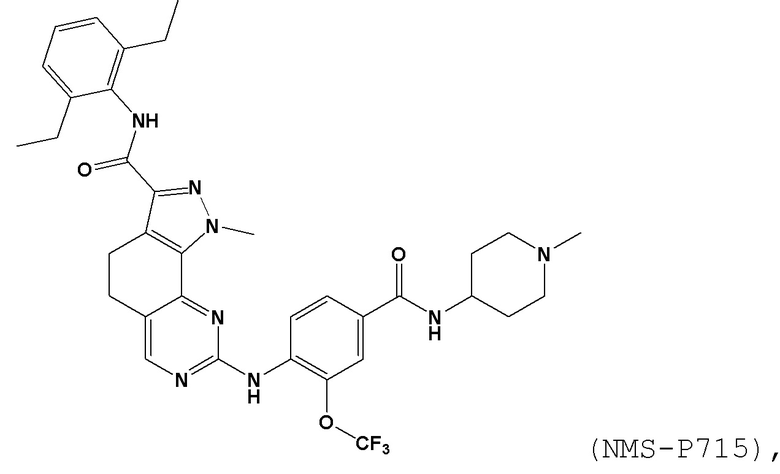
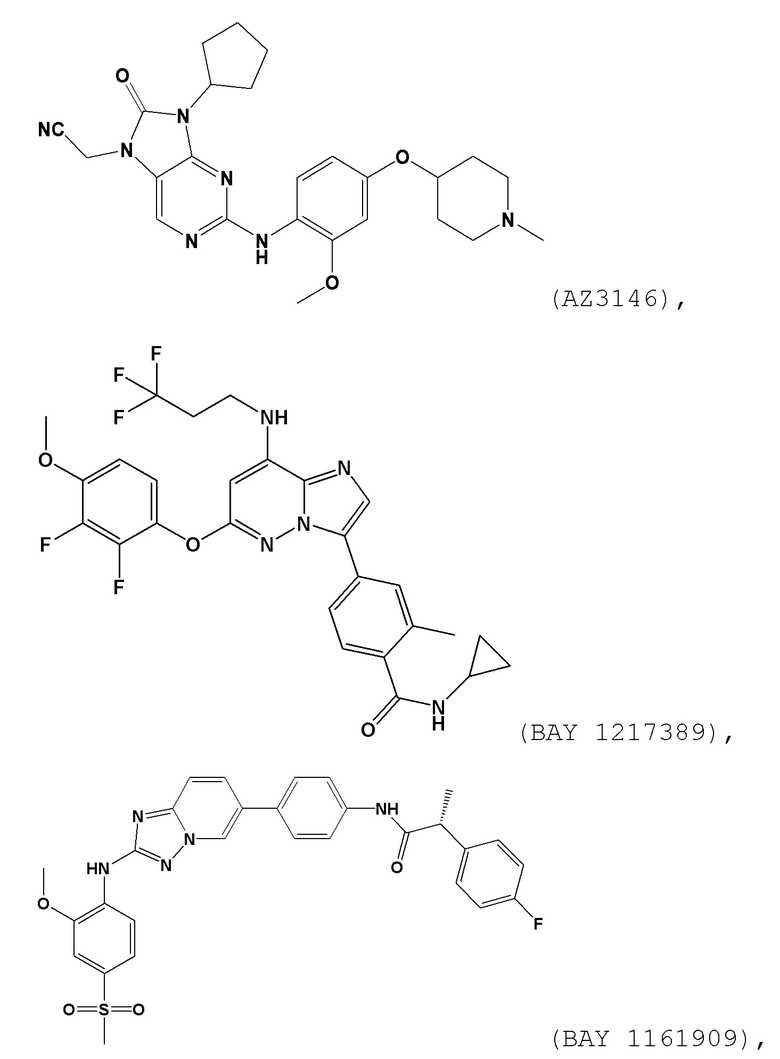
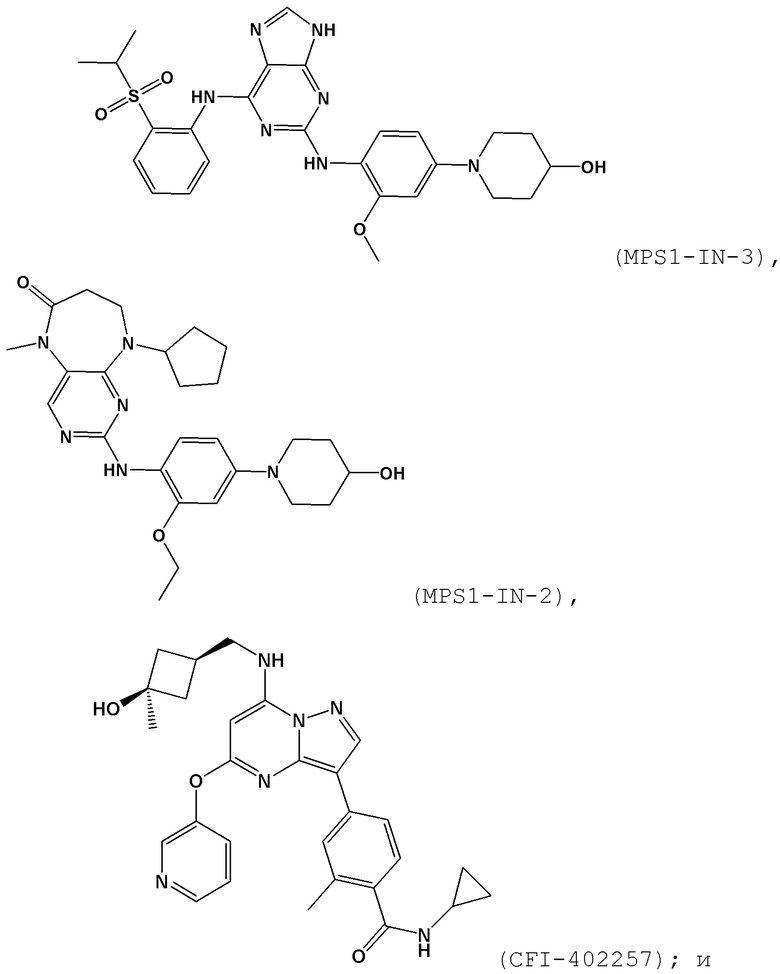
соединения формулы V
 (V)
(V)
где
Ra представляет собой водород;
Rb представляет собой C1–6 алкил, необязательно замещенный галогеном; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют 4–10–членное гетероциклическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из водорода, C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила;
Rc представляет собой C1–3 алкил; и
Ar1 представляет собой 5– или 6–членное гетероарильное кольцо, необязательно замещенное одним или несколькими заместителями, независимо выбранными из C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила.
30. Применение по п. 29, где у субъекта было неудачное лечение препаратом эндокринной терапии.
31. Применение по любому из пп. 29 и 30, где субъект имел рецидив в процессе или после лечения препаратом эндокринной терапии.
32. Применение по любому из пп. 29-31, где у субъекта было прогрессирование заболевания в процессе или после лечения препаратом эндокринной терапии.
33. Применение по любому из пп. 29-32, где у субъекта развился резистентный к эндокринной терапии рак молочной железы в процессе или после лечения препаратом эндокринной терапии.
34. Применение по любому из пп. 29-33, где рак молочной железы является de novo резистентным к эндокринной терапии.
35. Применение по любому из пп. 29-34, где эндокринная терапия включает/состоит по существу из/состоит из введения эндокринного средства.
36. Применение по п. 35, где эндокринное средство выбрано из одного или нескольких из ингибитора ароматазы, селективного модулятора эстрогеновых рецепторов (SERM) и селективного деструктора/даун–регулятора эстрогеновых рецепторов (SERD).
37. Применение по любому из пп. 35 и 36, где эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения ингибитором ароматазы и SERD.
38. Применение по любому из пп. 35 и 36, где эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения средствами SERM и SERD.
39. Применение по любому из пп. 36 и 37, где ингибитор ароматазы выбран из группы, состоящей из анастрозола, экземестана и летрозола или их фармацевтически приемлемых солей или сольватов.
40. Применение по любому из пп. 36 и 38, где SERM представляет собой тамоксифен или его фармацевтически приемлемые соли или сольваты.
41. Применение по любому из пп. 36-38, где SERD представляет собой фулвестрант или его фармацевтически приемлемые соли или сольваты.
42. Применение по любому из пп. 29-41, где субъект находится в пременопаузальном периоде.
43. Применение по любому из пп. 29-41, где субъект находится в постменопаузальном периоде.
44. Применение по любому из пп. 29-43, где
(i) субъекта дополнительно ранее лечили ингибитором CDK4/6; и/или
(ii) рак молочной железы дополнительно резистентен к лечению ингибитором CDK4/6.
45. Применение по п. 44, где у субъекта было неудачным лечение ингибитором CDK4/6.
46. Применение по любому из пп. 44 и 45, где субъект имел рецидив в процессе или после лечения ингибитором CDK4/6.
47. Применение по любому из пп. 44-46, где у субъекта было прогрессирование заболевания в процессе или после лечения ингибитором CDK4/6.
48. Применение по любому из пп. 44-47, где у субъекта развился резистентный к ингибитору CDK4/6 рак молочной железы в процессе или после лечения ингибитором CDK4/6.
49. Применение по любому из пп. 44-48, где рак молочной железы является de novo резистентным к лечению ингибитором CDK4/6.
50. Применение по любому из пп. 44-49, где ингибитор CDK4/6 выбран из группы, состоящей из палбоциклиба, абемациклиба и рибоциклиба или их фармацевтически приемлемых солей или сольватов.
51. Применение по любому из пп. 29-50, где соединение, способное ингибировать MPS1, предназначено для отдельного, последовательного и/или совместного применения с эндокринным средством.
52. Применение по п. 51, где эндокринное средство выбрано из группы, состоящей из тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
53. Применение по любому из пп. 29-52, где ингибитор MPS1 выбран из группы, состоящей из:
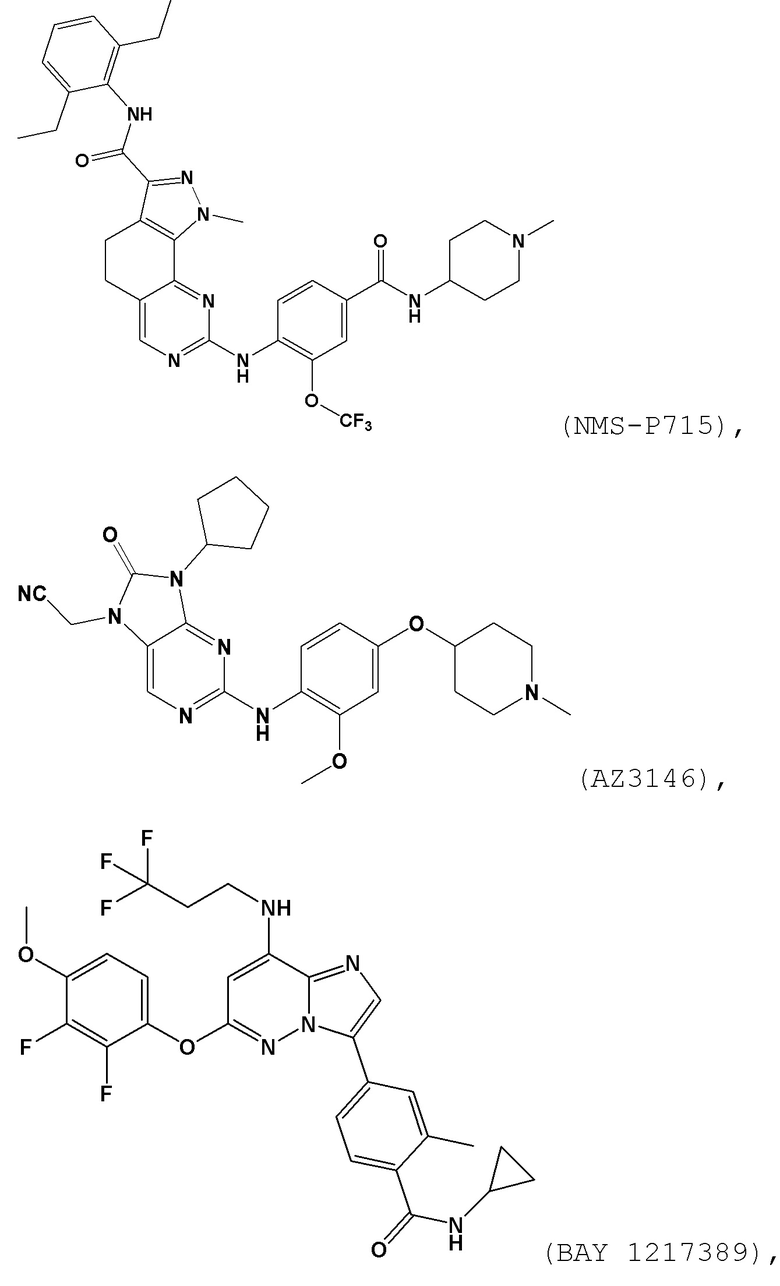
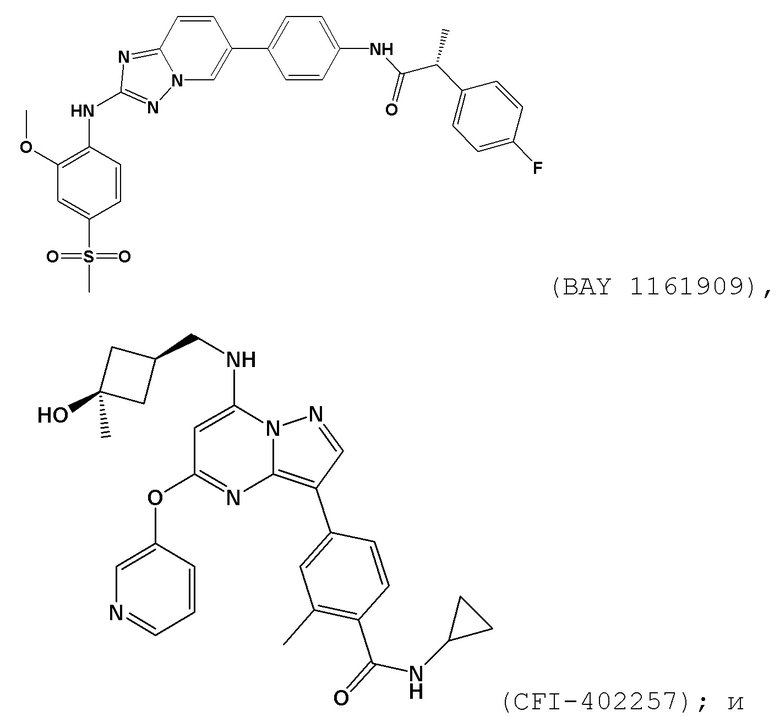
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин (CCT289346) или его фармацевтически приемлемой соли или сольвата.
54. Применение по любому из пп. 29-52, где ингибитор MPS1 выбран из группы, состоящей из соединения формулы V или его фармацевтически приемлемой соли или сольвата.
55. Применение по п. 54, где ингибитор MPS1 выбран из следующих:
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амин;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амин;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрил;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
или фармацевтически приемлемой соли или сольвата такого соединения.
56. Применение по любому из пп. 29-55, где ингибитор MPS1 представляет собой N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин или его фармацевтически приемлемую соль.
57. Применение ингибитора MPS1 для получения лекарственного средства для лечения эстроген–рецептор–положительного рака молочной железы у субъекта, нуждающегося в этом, где:
(i) субъект ранее лечился препаратом эндокринной терапии; и/или
(ii) указанный рак молочной железы является резистентным к эндокринной терапии;
где ингибитор MPS1 выбирают из группы, состоящей из:
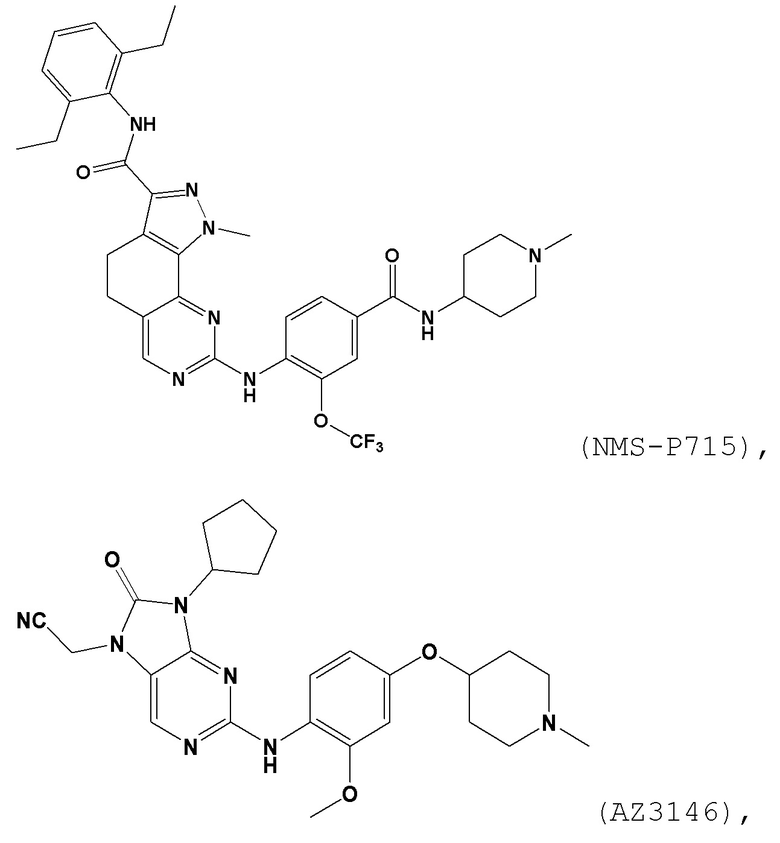
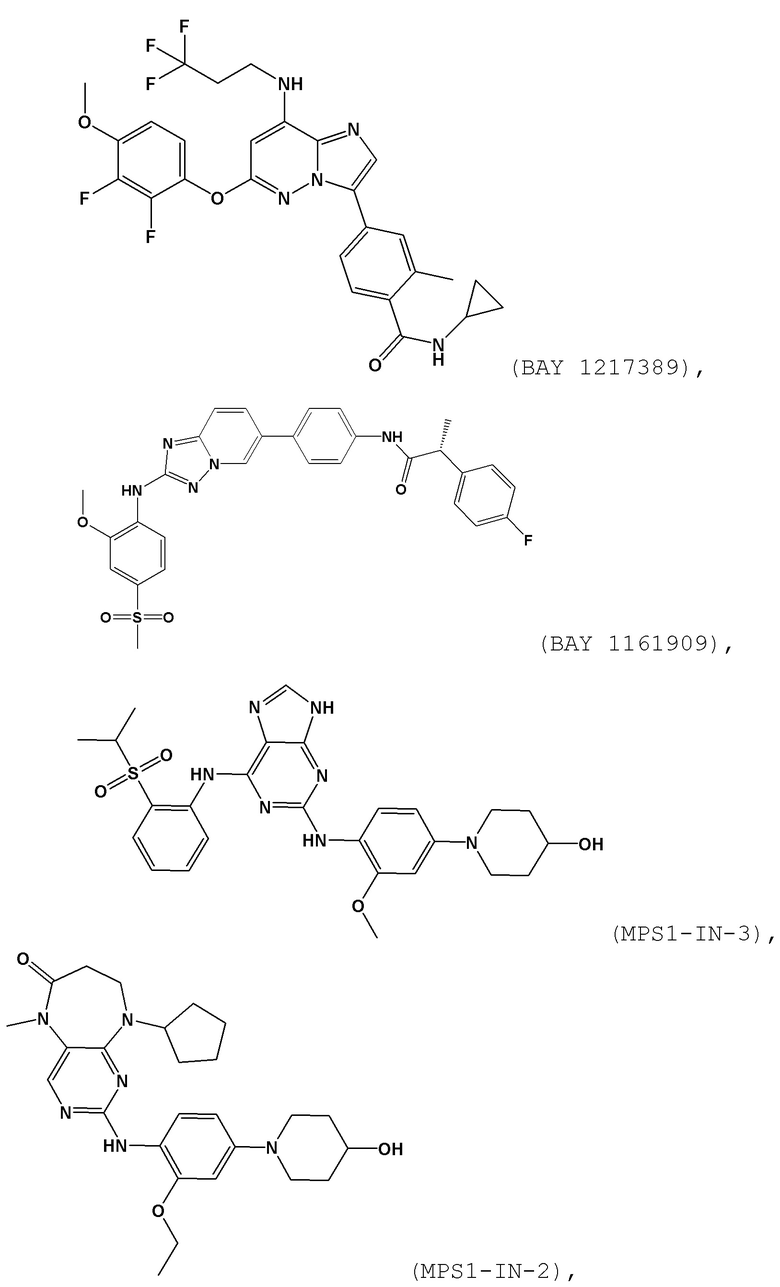
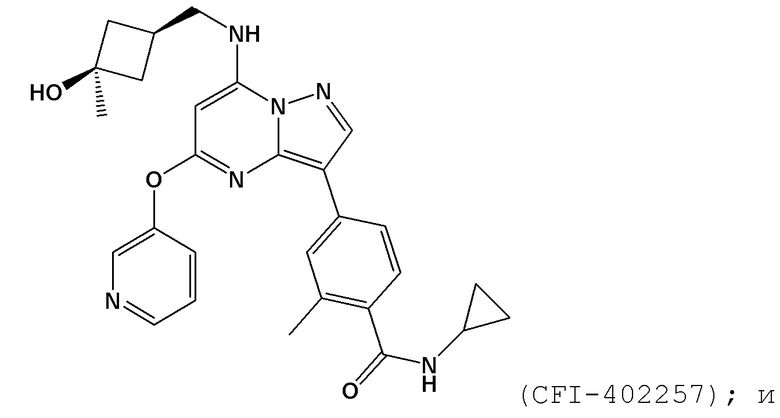
соединения формулы V
 (V)
(V)
где
Ra представляет собой водород;
Rb представляет собой C1–6 алкил, необязательно замещенный галогеном; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют 4–10–членное гетероциклическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из водорода, C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила;
Rc представляет собой C1–3 алкил; и
Ar1 представляет собой 5– или 6–членное гетероарильное кольцо, необязательно замещенное одним или несколькими заместителями, независимо выбранными из C1–6 алкила, O–C1–6 алкила, CN, C1–6 галогеналкила и O–C1–6 галогеналкила.
58. Применение по п. 57, где у субъекта было неудачным лечение препаратом эндокринной терапии.
59. Применение по любому из пп. 57 и 58, где субъект имел рецидив в процессе или после лечения препаратом эндокринной терапии.
60. Применение по любому из пп. 57-59, где у субъекта было прогрессирование заболевания в процессе или после лечения препаратом эндокринной терапии.
61. Применение по любому из пп. 57-60, где у субъекта развился резистентный к эндокринной терапии рак молочной железы в процессе или после лечения препаратом эндокринной терапии.
62. Применение по любому из пп. 57-61, где рак молочной железы является de novo резистентным к эндокринной терапии.
63. Применение по любому из пп. 57-62, где эндокринная терапия включает/состоит по существу из/состоит из введения эндокринного средства.
64. Применение по п. 63, где эндокринное средство выбрано из одного или нескольких из ингибитора ароматазы, селективного модулятора эстрогеновых рецепторов (SERM) и селективного деструктора/даун–регулятора эстрогеновых рецепторов (SERD).
65. Применение по любому из пп. 57-64, где эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения ингибитором ароматазы и SERD.
66. Применение по любому из пп. 57-64, где эндокринная терапия включает/состоит по существу из/состоит из отдельного, последовательного или комбинированного лечения средствами SERM и SERD.
67. Применение по любому из пп. 64 и 65, где ингибитор ароматазы выбран из группы, состоящей из анастрозола, экземестана и летрозола или их фармацевтически приемлемых солей или сольватов.
68. Применение по любому из пп. 64 и 66, где SERM представляет собой тамоксифен или его фармацевтически приемлемые соли или сольваты.
69. Применение по любому из пп. 64-66, где SERD представляет собой фулвестрант или его фармацевтически приемлемые соли или сольваты.
70. Применение по любому из пп. 57-69, где субъект находится в пременопаузальном периоде.
71. Применение по любому из пп. 57-69, где субъект находится в постменопаузальном периоде.
72. Применение по любому из пп. 57-71, где
(i) субъекта дополнительно ранее лечили ингибитором CDK4/6; и/или
(ii) рак молочной железы дополнительно резистентен к лечению ингибитором CDK4/6.
73. Применение по п. 72, где у субъекта было неудачным лечение ингибитором CDK4/6.
74. Применение по любому из пп. 72 и 73, где субъект имел рецидив в процессе или после лечения ингибитором CDK4/6.
75. Применение по любому из пп. 72-74, где у субъекта было прогрессирование заболевания в процессе или после лечения ингибитором CDK4/6.
76. Применение по любому из пп. 72-75, где у субъекта развился резистентный к ингибитору CDK4/6 рак молочной железы в процессе или после лечения ингибитором CDK4/6.
77. Применение по любому из пп. 72-76, где рак молочной железы является de novo резистентным к лечению ингибитором CDK4/6.
78. Применение по любому из пп. 72-77, где ингибитор CDK4/6 выбран из группы, состоящей из палбоциклиба, абемациклиба и рибоциклиба или их фармацевтически приемлемых солей или сольватов.
79. Применение по любому из пп. 57-78, где соединение, способное ингибировать MPS1, предназначено для отдельного, последовательного и/или совместного применения с эндокринным средством.
80. Применение по п. 79, где эндокринное средство выбрано из группы, состоящей из тамоксифена и фулвестранта или их фармацевтически приемлемых солей или сольватов.
81. Применение по любому из пп. 57-80, где ингибитор MPS1 выбран из группы, состоящей из
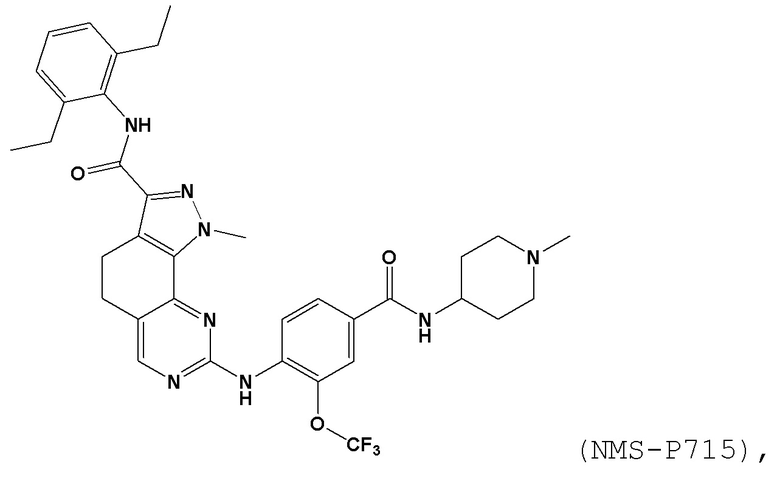
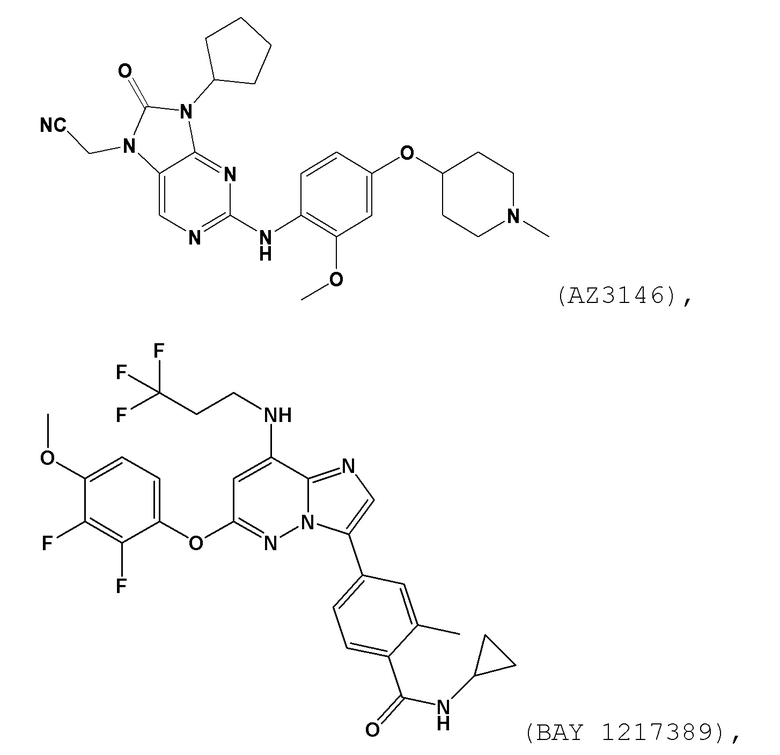
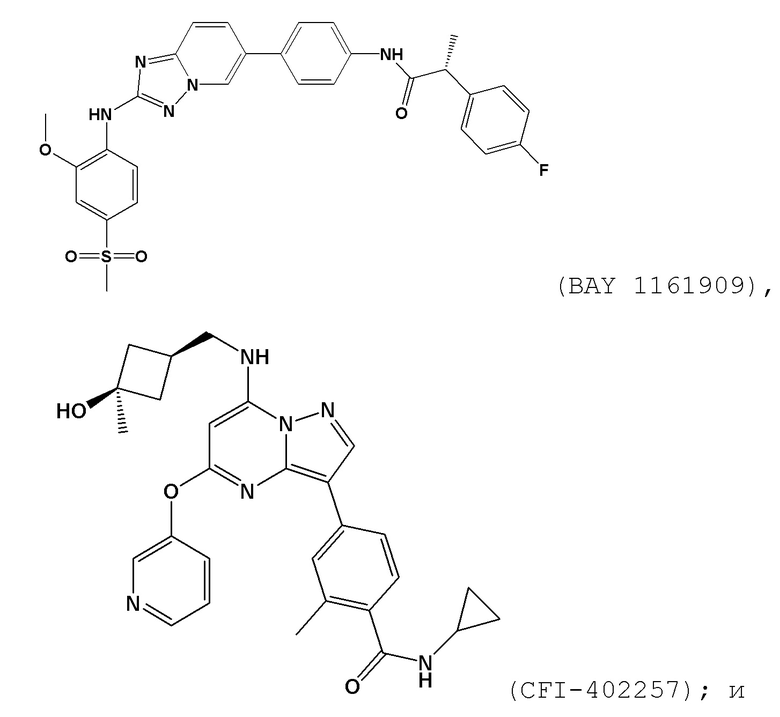
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамина (CCT289346) или его фармацевтически приемлемой соли или сольвата.
82. Применение по любому из пп. 57-80, где ингибитор MPS1 выбран из группы, состоящей из соединения формулы V или его фармацевтически приемлемой соли или сольвата.
83. Применение по п. 82, где ингибитор MPS1 выбран из следующих:
N2–(4–(4,5–диметил–4H–1,2,4–триазол–3–ил)–2–этоксифенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
(S)–N8–(3,3–диметилбутан–2–ил)–N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2,8–диамин;
8–(3,3–диметилазетидин–1–ил)–N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метилпиридо[3,4–d]пиримидин–2–амин;
N–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–8–(3–метокси–3–метилазетидин–1–ил)–6–метилпиридо[3,4–d]пиримидин–2–амин;
1–(2–((2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)амино)–6–метилпиридо[3,4–d]пиримидин–8–ил)–3–метилазетидин–3–карбонитрил;
N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин;
или фармацевтически приемлемой соли или сольвата такого соединения.
84. Применение по любому из пп. 57-83, где ингибитор представляет собой N2–(2–этокси–4–(4–метил–4H–1,2,4–триазол–3–ил)фенил)–6–метил–N8–неопентилпиридо[3,4–d]пиримидин–2,8–диамин или его фармацевтически приемлемую соль.
| US 2016362409 A1, 15.12.2016 | |||
| WO 2013066440 A1, 10.05.2013 | |||
| US 2016008365 A1, 14.01.2016 | |||
| US 2017107577 A1, 20.04.2017 | |||
| SUGIMOTO Y et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Bioorg Med Chem, 2017, 25(7):2156-2166. | |||
Авторы
Даты
2023-01-17—Публикация
2018-06-19—Подача