Текст описания приведен в факсимильном виде.










































































































| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННАЯ КСИЛАНАЗА | 2005 |
|
RU2394909C2 |
| КОМПОЗИЦИЯ ФЕРМЕНТНОЙ СМЕСИ ДЛЯ ГИДРОЛИЗА СМЕСИ ЦЕЛЛЮЛОЗНЫХ И ГЕМИЦЕЛЛЮЛОЗНЫХ МАТЕРИАЛОВ (ВАРИАНТЫ) И СПОСОБЫ ЕЕ ИСПОЛЬЗОВАНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2536256C2 |
| ГЕН ABFB-2 PENICILLIUM FUNICULOSUM | 2006 |
|
RU2388820C2 |
| СПОСОБ ОБРАБОТКИ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА И ИСПОЛЬЗУЕМЫЕ В НЕМ ФЕРМЕНТЫ | 2006 |
|
RU2458128C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |
| НОВЫЕ РЕГУЛИРУЮЩИЕ ЭКСПРЕССИЮ ПОСЛЕДОВАТЕЛЬНОСТИ И ПРОДУКТ ЭКСПРЕССИИ В ОБЛАСТИ ГИФОМИЦЕТОВ | 2001 |
|
RU2272835C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОМИКРОБНЫМ ДЕЙСТВИЕМ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2006 |
|
RU2403260C2 |
| ВАРИАНТЫ КСИЛАНАЗЫ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2017 |
|
RU2752204C2 |
| КЛЕТКА НИТЧАТЫХ ГРИБОВ С ДЕФИЦИТОМ ПРОТЕАЗ И СПОСОБЫ ЕЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2645252C2 |
| СПОСОБЫ ПОВЫШЕНИЯ УСИЛИВАЮЩЕЙ ЦЕЛЛЮЛОЛИТИЧЕСКОЙ АКТИВНОСТИ ПОЛИПЕПТИДА | 2008 |
|
RU2510417C2 |






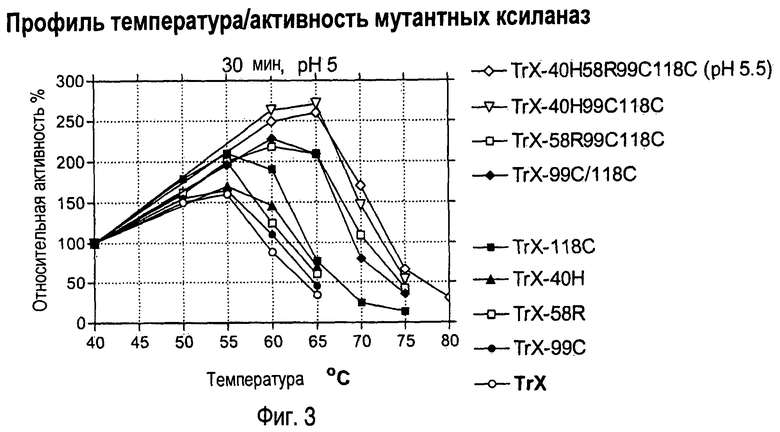
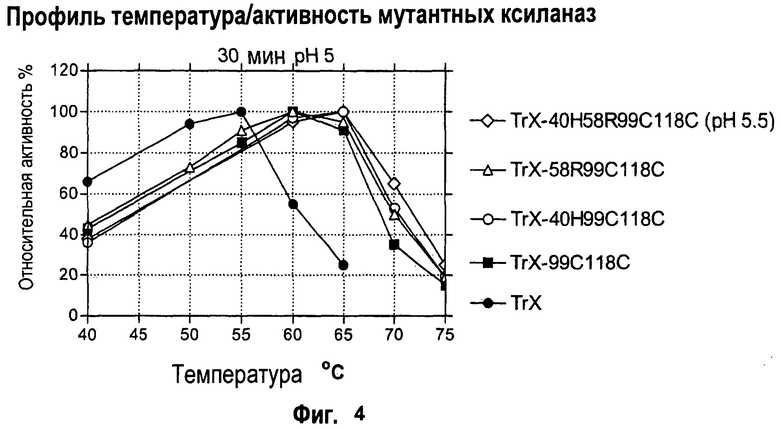
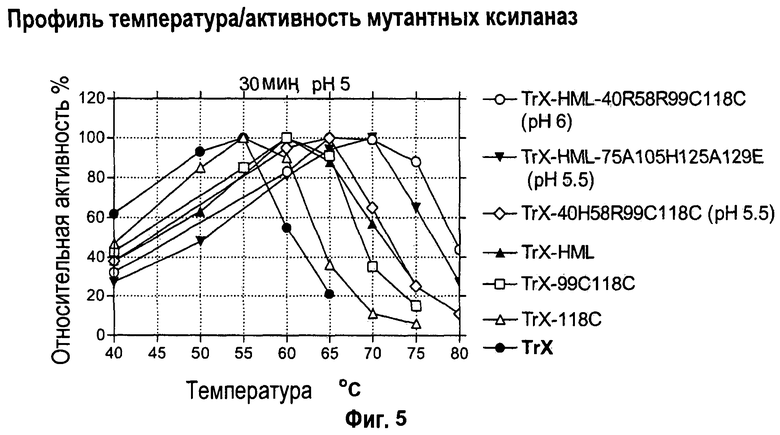
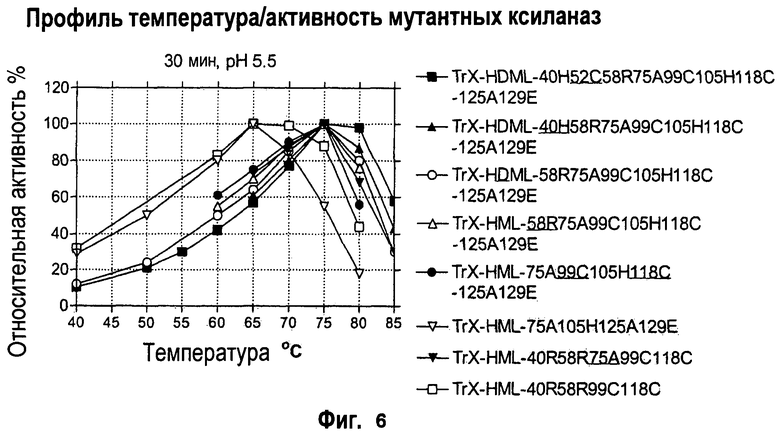
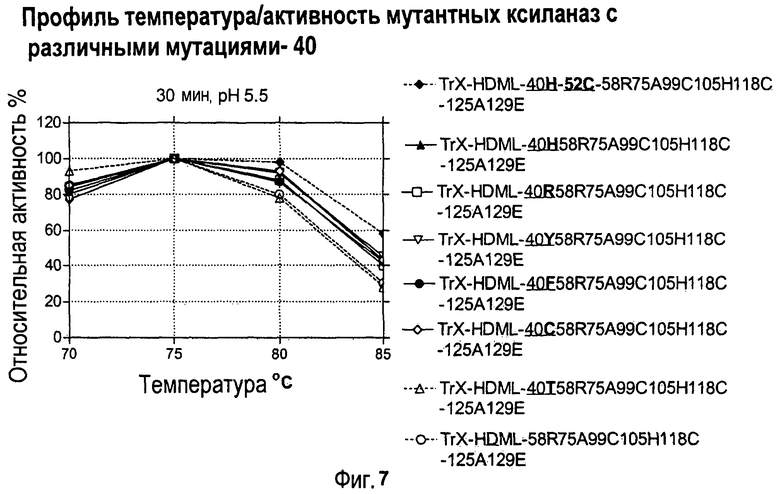
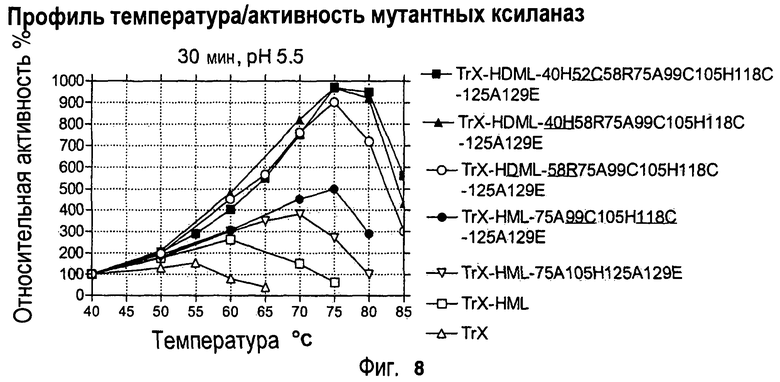
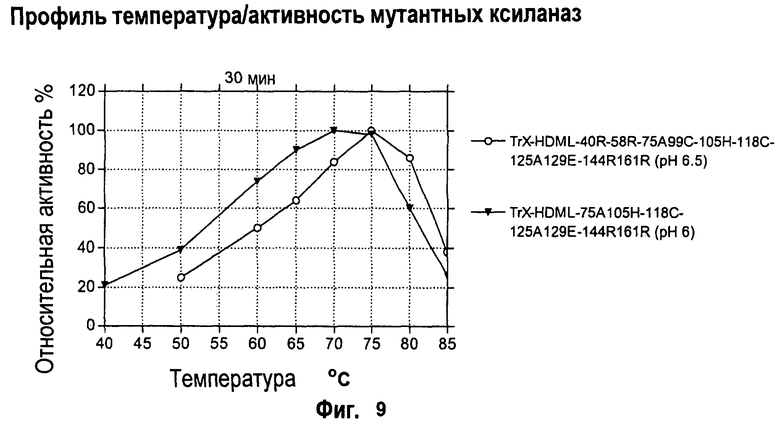
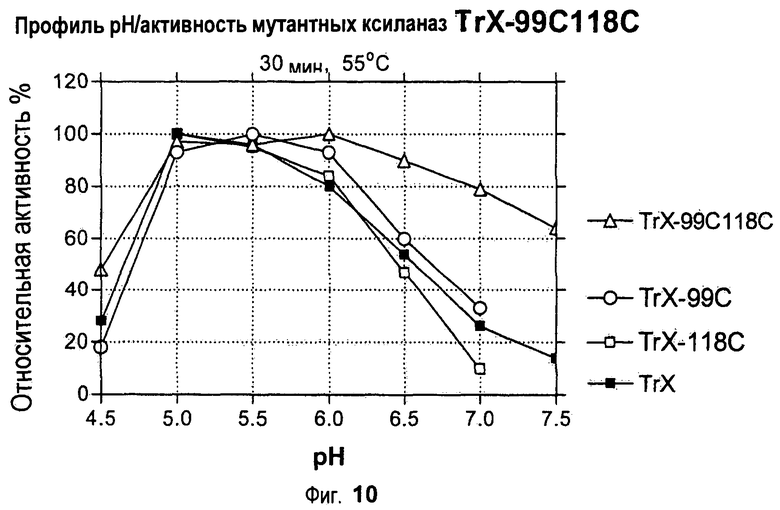
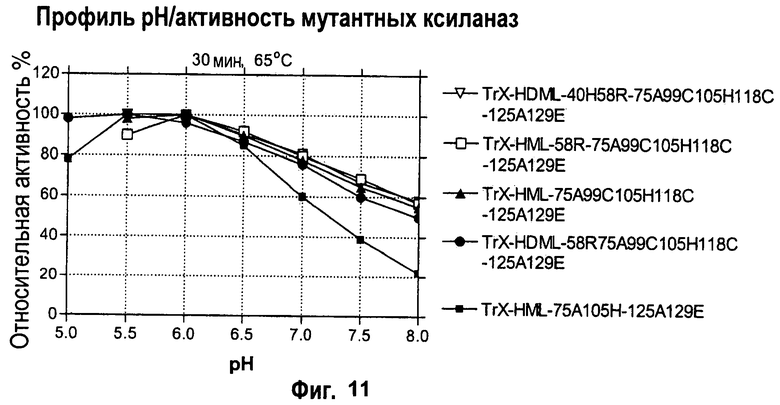
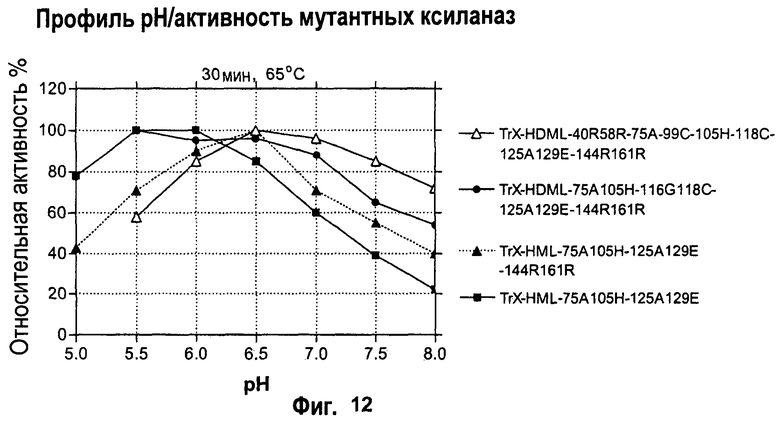
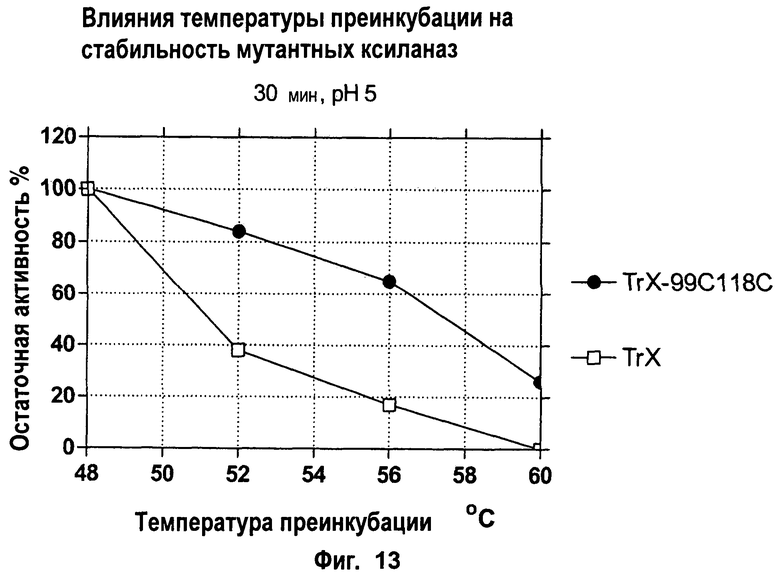

Изобретение относится к биохимии и представляет собой различные варианты модифицированной ксиланазы Семейства 11. В одном из вариантов модифицированная ксиланаза Семейства 11 содержит цистеиновые остатки в положениях 99 и 118 с образованием внутримолекулярной дисульфидной связи, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином, причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II из Trichoderma reesei SEQ ID NO: 16, представленной в описании. Другие варианты включают аминокислотные замены в положениях 99 и 118 на Cys с образованием дисульфидной связи и 40 на Arg, Cys, Phe, Tyr, His или основную аминокислоту, в положениях 10, 58, 105, 144 и 161 на основную аминокислоту в любом из положений, 27 и 29 на гидрофобную аминокислоту в любом из положений, 75 и 125 на неполярную аминокислоту в любом из положений, 11 и 129 на кислую аминокислоту в любом из положений, 131 на Asn, 52 на Cys. Еще одним вариантом настоящего изобретения является модифицированная ксиланаза Семейства 11, содержащая замену на гистидин в положении 40, причем указанное положение определяют с помощью выравнивания аминокислотных последовательностей указанной модифицированной ксиланазы и ксиланазы II Trichoderma reesei с последовательностью SEQ ID NO: 16. Изобретение позволяет получить клиланазу с повышенной термофильностью, алкалофильностью, термостойкостью. 9 н. и 8 з.п. ф-лы, 22 табл., 17 ил., 16 пр.
1. Модифицированная ксиланаза Семейства 11, содержащая цистеиновые остатки в положениях 99 и 118, с образованием внутримолекулярной дисульфидной связи, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином, причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена.
2. Модифицированная ксиланаза Семейства 11, содержащая
(а) аминокислотную замену в положении 40, выбранную из группы, состоящей из Arg, Cys, Phe, Tyr и His; и
(б) цистеиновые остатки в положениях 99 и 118, образующие внутримолекулярную дисульфидную связь,
причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином, причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена модифицированная ксиланаза Семейства 11.
3. Модифицированная ксиланаза Семейства 11, содержащая:
(а) основную аминокислоту в качестве замены в положении 58 и
(б) цистеиновые остатки в положениях 99 и 118, образующие внутримолекулярную дисульфидную связь, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином, причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена модифицированная ксиланаза Семейства 11.
4. Модифицированная ксиланаза по п.3, отличающаяся тем, что основная аминокислотная замена в положении 58 представляет собой Arg.
5. Модифицированная ксиланаза Семейства 11, содержащая:
(а) основную аминокислотную замену в каждом из положений 40 и 58 и
(б) цистеиновые остатки в положениях 99 и 118, образующие внутримолекулярную дисульфидную связь, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином,
причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена модифицированная ксиланаза Семейства 11.
6. Модифицированная ксиланаза по п.5, отличающаяся тем, что основная аминокислота в положении 40 представляет собой His, а основная аминокислота в положении 58 представляет собой Arg.
7. Модифицированная ксиланаза по п.1, отличающаяся тем, что указанная ксиланаза Семейства 11 представляет собой ксиланазу Trichoderma reesei.
8. Модифицированная ксиланаза Семейства 11, содержащая:
(а) основную аминокислотную замену в каждом из положений 40 и 58;
(б) цистеиновые остатки в положениях 99 и 118, образующие внутримолекулярную дисульфидную связь, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином;
(в) основную аминокислотную замену в положении 10;
(г) гидрофобную аминокислотную замену в положении 27;
(д) гидрофобную аминокислотную замену в положении 29;
(е) неполярную аминокислотную замену в положении 75;
(ж) основную аминокислотную замену в положении 105;
(з) неполярную аминокислотную замену в положении 125;
(и) кислую аминокислотную замену в положении 129 и
(к) кислую аминокислотную замену в положении 11;
причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена модифицированная ксиланаза Семейства 11.
9. Модифицированная ксиланаза по п.8, отличающаяся тем, что кислая аминокислота в положении 11 представляет собой Asp.
10. Модифицированная ксиланаза Семейства 11, содержащая:
(а) основную аминокислотную замену в каждом из положений 40 и 58;
(б) цистеиновые остатки в положениях 99 и 118, образующие внутримолекулярную дисульфидную связь, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином;
(в) основную аминокислотную замену в положении 10;
(г) гидрофобную аминокислотную замену в положении 27;
(д) гидрофобную аминокислотную замену в положении 29;
(е) неполярную аминокислотную замену в положении 75;
(ж) основную аминокислотную замену в положении 105;
(з) неполярную аминокислотную замену в положении 125;
(и) кислую аминокислотную замену в положении 129;
(к) кислую аминокислотную замену в положении 11 и
(л) Asn в положении 131,
причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена модифицированная ксиланаза Семейства 11.
11. Модифицированная ксиланаза Семейства 11, содержащая:
(а) основную аминокислотную замену в каждом из положений 40 и 58;
(б) цистеиновые остатки в положениях 99 и 118, образующие внутримолекулярную дисульфидную связь, причем указанная внутримолекулярная дисульфидная связь образована замещением аминокислоты в положениях 99 и 118 цистеином;
(в) основную аминокислотную замену в положении 10;
(г) гидрофобную аминокислотную замену в положении 27;
(д) гидрофобную аминокислотную замену в положении 29;
(е) неполярную аминокислотную замену в положении 75;
(ж) основную аминокислотную замену в положении 105;
(з) неполярную аминокислотную замену в положении 125;
(и) кислую аминокислотную замену в положении 129;
(к) кислую аминокислотную замену в положении 11;
(л) Asn в положении 131;
(м) Cys в положении 52 и
(н) основную аминокислотную замену в каждом из положений 144 и 161, причем указанные положения определяют с помощью выравнивания последовательности указанной модифицированной ксиланазы Семейства 11 с аминокислотной последовательностью ксиланазы II Trichoderma reesei, представленной в SEQ ID NO:16, при этом указанная модифицированная ксиланаза Семейства 11 не получена из родительской ксиланазы Семейства 11 с природными цистеиновыми остатками в положениях 99 и 118 и демонстрирует повышенную термофильность, алкалофильность, термостойкость или сочетание этих свойств по сравнению с исходной ксиланазой Семейства 11, из которой получена модифицированная ксиланаза Семейства 11.
12. Модифицированная ксиланаза по п.11, отличающаяся тем, что основная аминокислотная замена в каждом из положений 144 и 161 представляет собой Arg.
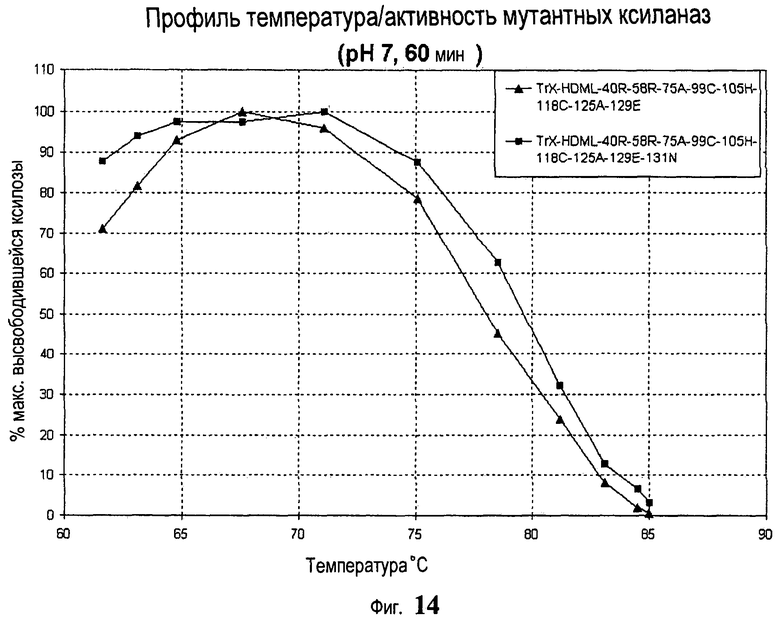
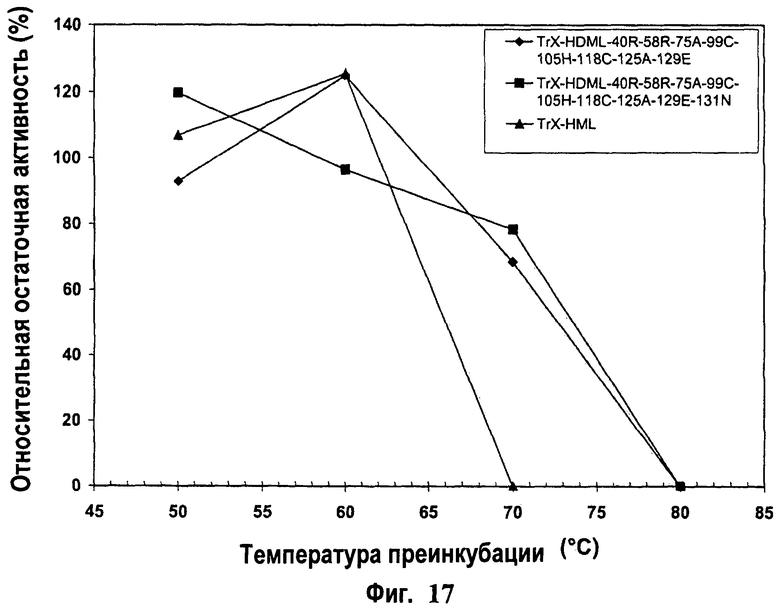
13. Модифицированная ксиланаза по любому из пп.1-12, отличающаяся тем, что она имеет максимальную эффективную температуру (MET) между примерно 65°С и примерно 85°С.
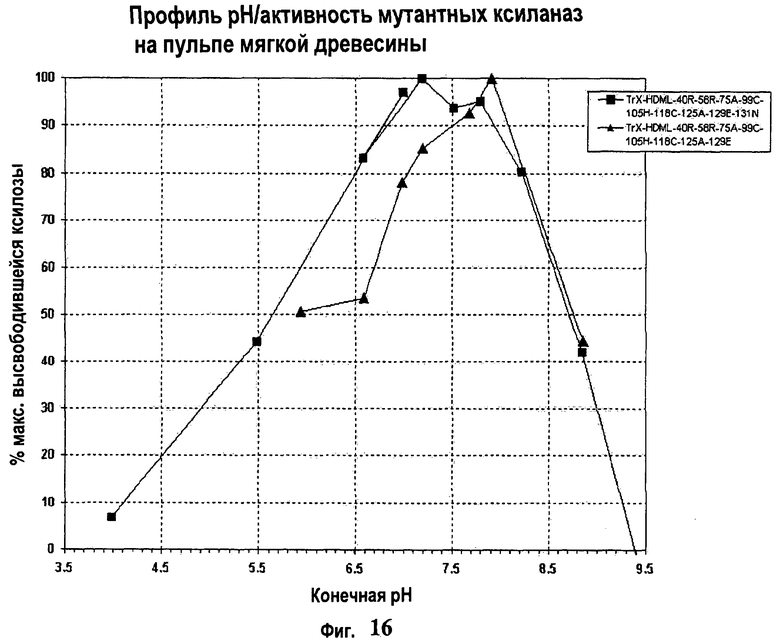
14. Модифицированная ксиланаза по любому из пп.1-12, отличающаяся тем, что она имеет максимальное эффективное значение pH (МЕР) между примерно pH 6.5 и примерно pH 8.0.
15. Модифицированная ксиланаза по любому из пп.1-14, полученная из Bacillus, Cellulomonas, Chainia, Clostridium, Fibrobacter, Neocallimastix, Ruminococcus, Schizophyllum, Streptomyces, Thermobifida, Thermomyces, Piromyces, Talaromyces, Orpinomyces, Phanerochaete, Gibberella, Cochliobolus, Aureobasidium, Chaetomiun, Dictyoglomus, Magnaporthe, Penicillium, Fusarium, Humicola, Trichoderma или Hypocrea.
16. Модифицированная ксиланаза Семейства 11, выбранная из группы, состоящей из:
TrX-99C-118C (SEQ ID NO:66);
TrX-40H-99C-118C (SEQ ID NO:67);
TrX-58R-99C-118C (SEQ ID NO:68);
TrX-40H-58R-99C-118C (SEQ ID NO:69);
TrX-10H-27M-29L-40R-58R-99C-118C (SEQ ID NO:70);
TrX-10H-27M-29L-40R-58R-75A-99C-118C (SEQ ID NO:71);
TrX-10H-27M-29L-75A-99C-105H-118C-125A-129E (SEQ ID NO:72);
TrX-10H-27M-29L-58R-75A-99C-105H-118C-125A-129E (SEQ ID NO:73);
TrX-10H-11D-27M-29L-58R-75A-99C-105H-118C-125A-129E (SEQ ID NO:74);
TrX-10H-11D-27M-29L-40X-58R-75A-99C-105H-118C-125A-129E,
отличающаяся тем, что X обозначает С, F, H, Y или R (SEQ ID NO:75, 76, 77, 78 и 79, соответственно);
TrX-10H-11D-27M-29L-40H-52C-58R-75A-99C-105H-118C-125A-129E (SEQ ID NO:80);
TrX-10H-11D-27M-29L-40R-58R-75A-99C-105H-118C-125A-129E-144R-161R (SEQ ID NO:81); и
TrX-10H-11D-27M-29L-58R-75A-99C-105H-118C-125A-129E-131N (SEQ ID NO:82).
17. Модифицированная ксиланаза Семейства 11, содержащая замену на гистидин в положении 40, причем указанное положение определяют с помощью выравнивания аминокислотных последовательностей указанной модифицированной ксиланазы и ксиланазы II Trichoderma reesei пo определению в SEQ ID NO:16.
| DATABASE: GenPept, PDB: 1XYP_A, 20.12.1995 | |||
| Устройство для отбора пробы из селевогопОТОКА | 1979 |
|
SU828002A1 |
| Устройство для биопсии | 1982 |
|
SU1222256A1 |
| Способ получения изобутилена | 1959 |
|
SU127252A1 |
| WO 2005093072 A1, 06.10.2005 | |||
| Поворотные направляющие для лесопильной рамы | 1932 |
|
SU29587A1 |
| ГАЗОВЫЙ ХРОМАТОГРАФ | 0 |
|
SU192487A1 |
| WO 02052100 A2, 04.07.2002 | |||
| RU 93052158 A, 20.07.1995. | |||
Авторы
Даты
2012-10-20—Публикация
2007-04-10—Подача