Ссылка на перечень последовательностей
Данная заявка содержит перечень последовательностей в машиночитаемой форме, который включен в данный документ с помощью ссылки.
Предпосылки изобретения
Область изобретения
Настоящее изобретение относится к вариантам ксиланазы, полинуклеотидам, кодирующим эти варианты; конструкциям на основе нуклеиновой кислоты, векторам и клеткам-хозяевам, содержащим эти полинуклеотиды; композициям, содержащим варианты ксиланазы, и способам применения этих вариантов.
Описание уровня техники
Ксиланы представляют собой разновидности гемицеллюлозы, встречающиеся у всех наземных растений (Popper and Tuohy, 2010, Plant Physiology 153: 373-383). Их особенно много во вторичных клеточных стенках и клетках ксилемы. У травянистых растений с клеточными стенками II типа глюкуроноарабиноксиланы являются основной гемицеллюлозой и присутствуют в виде растворимых или нерастворимых пищевых волокон во многих пищевых и кормовых продуктах на основе травы.
Растительные ксиланы имеют β-1,4-связанную ксилопиранозную основную цепь, которая может быть замещена в положении O2 или O3 арабинозой, глюкуроновой кислотой и уксусной кислотой видо- и тканеспецифическим образом. Богатые крахмалом семена подсемейства Panicoideae с экономически важными видами, такими как кукуруза, сорго, рис и просо, характеризуются особыми типами высокозамещенных ксиланов в стенках их клеток. По сравнению с пшеничной мукой, где более 60% ксилозильных звеньев в остове арабиноксилана являются незамещенными. В ксилане кукурузного зерна соответствующий процент незамещенных ксилозилов в основной цепи составляет 20-30%, а в сорго - 35-40% (Huismann et al., 2000, Carbohydrate Polymers 42: 269-279). Кроме того, в кукурузе и сорго боковые цепи ксилана могут быть длиннее, чем единственная замена арабинозой или глюкуроновой кислотой, которая является обычной для других ксиланов. Эта дополнительная сложность боковой цепи часто обусловлена наличием сахаров, представляющих собой L- и D-галактозу и D-ксилозу, связанных с арабинозой или глюкуроновой кислотой боковой цепи. Кроме того, приблизительно каждая десятая молекула арабинозы в ксилане зерна кукурузы этерифицирована феруловой кислотой, и приблизительно каждая четвертая молекула ксилозы характеризуется ацетилированием (Agger et al., 2010, J. Agric. Food Chem. 58: 6141-6148). Все эти факторы в совокупности делают высокозамещенные ксиланы в кукурузе и сорго устойчивыми к разрушению традиционными ксиланазами.
Известные ферменты, ответственные за гидролиз остова ксилана, классифицируются на семейства ферментов на основе сходства последовательностей (cazy.org). Ферменты с преимущественно эндоксиланазной активностью ранее были описаны в семействе гликозидгидролаз (GH) 5, 8, 10, 11, 30 и 98. Ферменты в семействе имеют некоторые общие характеристики, такие как трехмерная укладка, и обычно характеризуются одним и тем же механизмом реакции. Некоторые семейства GH имеют узкую субстратную специфичность или моноспецифичность, в то время как другие семейства характеризуются показателями широкой субстратной специфичности.
Коммерчески доступные ксиланазы GH10 и GH11 часто используют для расщепления ксилозного остова арабиноксилана. В кормах для животных это приводит к разрушению клеточной стенки злаков с последующим улучшением высвобождения питательных веществ (крахмала и белка), инкапсулированных в клетках. Разрушение ксилана также приводит к образованию олигомеров ксилозы, которые могут быть использованы для ферментации в задней кишке и, следовательно, могут способствовать животному получать большее количество усвояемой энергии. Однако такие ксиланазы чувствительны к стерическим затруднениям в боковой цепи и, хотя они эффективны при разрушении арабиноксилана из пшеницы, они не очень эффективны в отношении ксилана, находящегося в семенах видов из семейства Poaceae, таких как кукуруза или сорго.
Кукурузу используют во всем мире в качестве корма для животных, и поэтому существует необходимость в обнаружении новых полипептидов, обладающих ксиланазной активностью, которые способны расщеплять высокоразветвленный остов ксилана в клеточной стенке, чтобы высвобождать больше ксилозы и других питательных веществ, которые заключены внутри клеточной стенки.
Настоящее изобретение предусматривает варианты ксиланазы с улучшенными свойствами по сравнению с их исходным вариантом.
Краткое описание изобретения
Настоящее изобретение относится к вариантам ксиланазы, содержащим замену в одном или нескольких (например, некоторых) положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317 и 321 SEQ ID NO: 1, где вариант ксиланазы обладает ксиланазной активностью, и где вариант ксиланазы характеризуется последовательностью, на по меньшей мере 60% идентичной SEQ ID NO: 1, 2, 3, 4, 5 или 6. Настоящее изобретение также относится к композициям, таким как гранулы, жидкие композиции, кормовые добавки для животных или корм для животных, содержащим вариант ксиланазы по настоящему изобретению.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим варианты ксиланазы; конструкциям на основе нуклеиновой кислоты, векторам и клеткам-хозяевам, содержащим полинуклеотиды, и способам получения вариантов ксиланазы.
Настоящее изобретение дополнительно относится к применению вариантов ксиланазы в корме для животных; в добавках в корм для животных; в получении композиции для применения в корме для животных; для улучшения пищевой ценности корма для животных; для повышения усвояемости корма для животных; для улучшения одного или нескольких параметров продуктивности животного; для солюбилизации ксилана из материала на растительной основе и/или для высвобождения крахмала из материала на растительной основе; способам получения продукта ферментации; способам получения теста или выпеченного продукта и способам получения варианта ксиланазы.
Обзор перечня последовательностей
SEQ ID NO: 1 представляет собой аминокислотную последовательность зрелой ксиланазы GH30 из Bacillus subtilis.
SEQ ID NO: 2 представляет собой аминокислотную последовательность зрелой ксиланазы GH30 из Bacillus amyloliquefaciens.
SEQ ID NO: 3 представляет собой аминокислотную последовательность зрелой ксиланазы GH30 из Bacillus licheniformis.
SEQ ID NO: 4 представляет собой аминокислотную последовательность зрелой ксиланазы GH30 из Bacillus subtilis.
SEQ ID NO: 5 представляет собой аминокислотную последовательность зрелой ксиланазы GH30 из Paenibacillus pabuli.
SEQ ID NO: 6 представляет собой аминокислотную последовательность зрелой ксиланазы GH30 из Bacillus amyloliquefaciens HB-26.
Краткое описание графических материалов
На фигуре 1 представлено выравнивание аминокислотных последовательностей ксиланазы из Bacillus subtilis (SEQ ID NO: 1), ксиланазы из Bacillus amyloliquefaciens (SEQ ID NO: 2), ксиланазы из Bacillus licheniformis (SEQ ID NO: 3), ксиланазы из Bacillus subtilis (SEQ ID NO: 4), ксиланазы из Paenibacillus pabuli (SEQ ID NO: 5) и ксиланазы из Bacillus amyloliquefaciens (SEQ ID NO: 6).
Определения
Ксиланаза. Термин ʺксиланазаʺ означает глюкуроноарабиноксилан-эндо-1,4-бета-ксиланазу (E.C. 3.2.1.136), которая катализирует эндогидролиз 1,4-бета-D-ксилозильных связей в некоторых глюкуроноарабиноксиланах. Активность ксиланазы можно определить с использованием 0,2% AZCL-глюкуроноксилана в качестве субстрата в 0,01% TRITON® X-100 и 200 мМ фосфата натрия, pH 6, при 37°C. Одна единица ксиланазной активности определяется как 1,0 мкмоль азурина, вырабатываемого в минуту при 37°С, рН 6, из 0,2% AZCL-глюкуроноксилана в качестве субстрата в 200 мМ фосфата натрия, рН 6.
Аллельный вариант. Термин ʺаллельный вариантʺ означает любую из двух или более альтернативных форм гена, занимающих один и тот же локус в хромосоме. Аллельное разнообразие возникает в естественных условиях вследствие мутации и может приводить к полиморфизму в пределах популяций. Генные мутации могут быть в неструктурном гене (без изменений в кодируемом полипептиде) или могут кодировать полипептиды с измененными аминокислотными последовательностями. Аллельный вариант полипептида представляет собой полипептид, кодируемый аллельным вариантом гена.
Животное. Термин ʺживотноеʺ относится ко всем животным, кроме людей. Примерами животных являются нежвачные животные и жвачные животные. К жвачным животным относятся, например, такие животные, как овцы, козы, крупный рогатый скот, например, крупный рогатый скот мясного направления, коровы и молодые телята, олени, яки, верблюды, ламы и кенгуру. К нежвачным животным относятся животные с однокамерным желудком, например, боровы или свиньи (в том числе без ограничения поросята, растущие свиньи и свиноматки); домашняя птица, такая как индейки, утки и куры (в том числе без ограничения цыплята-бройлеры, куры-несушки); лошади (в том числе без ограничения чистокровные, тяжеловозные и полукровные), молодые телята; рыба (в том числе без ограничения род Seriola, арапайма, барбус, морской окунь, луфарь, семейство прохилодонтовых, лещ, голавль, черный паку, карп, сом, катль, ханос, арктический голец, цихлиды, кобия, треска, краппи, корифены, горбыль, угорь, бычок, золотая рыбка, гурами, групер, Parachromis managuensis, палтус, Barbonymus gonionotus, лабео, лаи, голец, скумбрия, молочная рыба, мохарра, ильная рыба, кефаль, пако, Etroplus suratensis, Odontesthes regia, окунь, щука, помпано, плотва, лосось, Heterobranchus longifilis, канадский судак, сибас, морской лещ, нотропис, семейство Eleotridae, змееголов, кампечинский луциан, снуковые, солеевые, сигановые, осетровые, рыба-луна, плексоглоссовые, линь, Andinoacara rivulatus, тилапия, форель, тунец, палтус, ряпушка, судак и сиг); и ракообразные (в том числе без ограничения мелкие креветки и глубоководные креветки).
Корм для животных. Термин ʺкорм для животныхʺ относится к любому соединению, препарату или смеси, подходящим или предназначенным для потребления животным. Корм для животных, предназначенный для животных с однокамерным желудком, обычно содержит концентраты, а также витамины, минералы, ферменты, пробиотики, аминокислоты и/или другие кормовые ингредиенты (например, в премиксе), в то время как корм для жвачных животных обычно содержит фураж (включая грубые корма и силос) и может дополнительно содержать концентраты, а также витамины, минералы, ферменты, пробиотики, аминокислоты и/или другие кормовые ингредиенты (например, в премиксе).
Арабиноксилансодержащий материал. Термин ʺарабиноксилансодержащий материалʺ означает любой материал, содержащий арабиноксилан. Арабиноксилан представляет собой гемицеллюлозу, находящуюся как в первичных, так и во вторичных клеточных стенках растений, включая древесину и зерна злаков, состоящую из сополимеров двух пентозных сахаров, арабинозы и ксилозы. Арабиноксилановая цепь содержит большое количество 1,4-связанных звеньев ксилозы. Многие звенья ксилозы замещены 2-, 3- или 2,3-замещенными остатками арабинозы.
Примерами арабиноксилансодержащего материала являются фураж, грубые корма, семена и зерна (как цельные, так и полученные дроблением, измельчением и т. д., например, из кукурузы, овса, ржи, ячменя, пшеницы), деревья или твердые породы дерева (такие как тополь, ива, эвкалипт, пальма, клен, береза), бамбук, травяные и/или древесные энергетические культуры, сельскохозяйственные пищевые и кормовые культуры, кормовые продукты для животных, кожура маниоки, бобы какао, сахарный тростник, сахарная свекла, мякоть бобов рожкового дерева, овощной или фруктовый жмых, древесные отходы, кора, стружка, опилки, древесная масса, целлюлозный раствор, макулатура, картон, и древесные отходы, полученные в результате строительства и сноса, твердые или иловые отходы промышленных или муниципальных сточных вод, навоз, отходы производства процессов пивоварения и/или ферментации, влажный концентрат зерновой барды, сухая зерновая барда, пивная дробина, барда и багасса.
Фураж, как определено в данном документе, также включает грубые корма. Фураж представляет собой свежий растительный материал, такой как сено и силос из кормовых растений, травы и других кормовых растений, морских водорослей, проросших зерен и бобовых или любой их комбинации. Примерами кормовых растений являются люцерна, лядвенец рогатый, капуста (например, капуста кормовая, рапс (канола), брюква, репа), клевер (например, клевер гибридный, клевер красный, клевер подземный, клевер белый), трава (например, свинорой пальчатый, костер, райграс высокий, овсяница, трехзубка распростертая, луговые травы, мискантус, садовая трава, райграс, просо прутьевидное, тимофеевка), кукуруза (маис), конопля, просо культурное, ячмень, разновидности овса, рожь, сорго, соевые бобы, и пшеница, и овощи, такие как свекла. Культурами, подходящими для силосования, являются обыкновенные травы, виды клевера, люцерны, вики, разновидности овса, рожь и маис. К фуражу также относятся растительные остатки от производства зерна (такие как кукурузная солома; солома из пшеницы, ячменя, овса, ржи и других зерновых культур); остатки овощей, такие как свекловичная ботва; остатки от производства масличных семян, такие как стебли и листья сои, рапса и других бобовых; и фракции от переработки зерна для потребления животными или человеком, или от производства топлива или из других отраслей промышленности.
Грубые корма представляют собой, как правило, сухой растительный материал с высокими показателями содержания волокон, такой как волокна, отруби, шелуха от семян и зерен, и растительные остатки (такие как резаная солома, копра, солома, мякина, отходы сахарной свеклы).
Предпочтительными источниками арабиноксилансодержащих материалов являются фураж, грубые корма, семена и зерна, сахарный тростник, сахарная свекла и древесная масса.
Прирост массы тела. Термин ʺприрост массы телаʺ означает увеличение живой массы животного в течение определенного периода времени, например, увеличение массы с 1-го по 21-й день.
cDNA. Термин "cDNA" означает молекулу ДНК, которую можно получить с помощью обратной транскрипции из зрелой сплайсированной молекулы mRNA, полученной из эукариотической или прокариотической клетки. В cDNA отсутствуют интронные последовательности, которые могут присутствовать в соответствующей геномной ДНК. Исходный, первичный РНК-транскрипт является предшественником mRNA, который подвергается процессингу в ходе ряда стадий, в том числе сплайсинга, перед тем как станет зрелой сплайсированной mRNA.
Кодирующая последовательность. Выражение ʺкодирующая последовательностьʺ означает полинуклеотид, который непосредственно определяет аминокислотную последовательность варианта. Пределы кодирующей последовательности обычно определяются открытой рамкой считывания, которая начинается со стартового кодона, такого как ATG, GTG или TTG, и заканчивается стоп-кодоном, таким как TAA, TAG или TGA. Кодирующая последовательность может представлять собой геномную ДНК, cDNA, синтетическую ДНК или их комбинацию.
Регуляторные последовательности. Выражение ʺрегуляторные последовательностиʺ означает последовательности нуклеиновой кислоты, необходимые для экспрессии полинуклеотида, кодирующего вариант согласно настоящему изобретению. Каждая регуляторная последовательность может быть нативной (т. е. из того же гена) или чужеродной (т. е. из другого гена) по отношению к кодирующему вариант полинуклеотиду или нативной или чужеродной по отношению друг к другу. Такие регуляторные последовательности включают в себя без ограничения лидерную последовательность, последовательность полиаденилирования, пропептидную последовательность, промотор, последовательность сигнального пептида и терминатор транскрипции. Как минимум, регуляторные последовательности включают в себя промотор, а также сигналы остановки транскрипции и трансляции. В регуляторных последовательностях могут быть предусмотрены линкеры с целью введения специфических сайтов рестрикции, способствующих лигированию регуляторных последовательностей с кодирующей областью полинуклеотида, кодирующего вариант.
Экспрессия. Выражение ʺэкспрессияʺ включает любой этап, связанный с получением варианта, в том числе без ограничения транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Вектор экспрессии. Выражение ʺвектор экспрессииʺ означает линейную или циклическую молекулу ДНК, которая содержит полинуклеотид, кодирующий вариант, и функционально связана с регуляторными последовательностями, которые обеспечивают ее экспрессию.
Коэффициент конверсии корма. Термин ʺкоэффициент конверсии кормаʺ означает количество корма, которое скармливают животному для увеличения массы животного на указанную величину. Улучшенный коэффициент конверсии корма означает более низкий коэффициент конверсии корма. Под ʺболее низким коэффициентом конверсии кормаʺ или ʺулучшенным коэффициентом конверсии кормаʺ подразумевается, что применение композиции кормовой добавки приводит к уменьшению количества корма, которое необходимо скормить животному, чтобы увеличить массу животного на определенную величину, по сравнению с количеством корма, необходимым для увеличения массы животного на такую же величину, когда корм не содержит указанную композицию кормовой добавки.
Эффективность кормления. Термин ʺэффективность кормленияʺ означает величину прироста массы на единицу корма, когда животное вскармливают ad libitum, или на определенное количество пищи в течение определенного периода времени. Под ʺповышенной эффективностью кормленияʺ подразумевается, что применение композиции кормовой добавки в соответствии с настоящим изобретением в корме приводит к увеличению прироста массы на единицу потребления корма по сравнению с животным, которое кормили без наличия указанной композиции кормовой добавки.
Фрагмент. Термин "фрагмент" означает полипептид с отсутствием одной или нескольких (например, некоторых) аминокислот с амино- и/или карбоксильного конца зрелого полипептида; где фрагмент характеризуется ксиланазной активностью. В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков, по меньшей мере 350 аминокислотных остатков или по меньшей мере 370 аминокислотных остатков.
В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков из SEQ ID NO: 1, по меньшей мере 350 аминокислотных остатков из SEQ ID NO: 1 или по меньшей мере 370 аминокислотных остатков SEQ ID NO: 1. В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков из SEQ ID NO: 2, по меньшей мере 350 аминокислотных остатков из SEQ ID NO: 2 или по меньшей мере 370 аминокислотных остатков из SEQ ID NO: 2. В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков из SEQ ID NO: 3, по меньшей мере 350 аминокислотных остатков из SEQ ID NO: 3 или по меньшей мере 370 аминокислотных остатков из SEQ ID NO: 3. В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков из SEQ ID NO: 4, по меньшей мере 350 аминокислотных остатков из SEQ ID NO: 4 или по меньшей мере 370 аминокислотных остатков из SEQ ID NO: 4. В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков из SEQ ID NO: 5, по меньшей мере 350 аминокислотных остатков из SEQ ID NO: 5 или по меньшей мере 370 аминокислотных остатков из SEQ ID NO: 5. В одном аспекте фрагмент содержит по меньшей мере 330 аминокислотных остатков из SEQ ID NO: 6, по меньшей мере 350 аминокислотных остатков из SEQ ID NO: 6 или по меньшей мере 370 аминокислотных остатков из SEQ ID NO: 6.
Высокоразветвленный ксилан. Выражение ʺвысокоразветвленный ксиланʺ означает, что более 50% ксилозильных звеньев в остове арабиноксилана являются замещенными. Это предпочтительно рассчитывают на основе анализа связей, выполненного в Huismann et al. Carbohydrate Polymers, 2000, 42:269-279.
Клетка-хозяин. Термин ''клетка-хозяин'' означает любой тип клеток, который является восприимчивым к трансформации, трансфекции, трансдукции или подобным процедурам с помощью конструкции на основе нуклеиновой кислоты или вектора экспрессии, содержащих полинуклеотид по настоящему изобретению. Термин ʺклетка-хозяинʺ охватывает любого потомка исходной клетки, который не является идентичным исходной клетке вследствие мутаций, которые происходят в ходе репликации.
Улучшенное свойство. Выражение ʺулучшенное свойствоʺ означает характеристику, связанную с вариантом, которая является улучшенной при сравнении с исходной формой. Такие улучшенные свойства включают без ограничения эффективность катализа, скорость катализа, химическую стабильность, устойчивость к окислению, активность при определенных значениях pH, стабильность при определенных значениях pH, удельную активность, стабильность в условиях хранения, связывание субстрата, расщепление субстрата, субстратную специфичность, стабильность в присутствии субстрата, свойства поверхности, активность при определенных значениях температуры и термостабильность. В одном из вариантов осуществления улучшенным свойством является улучшенная термостабильность.
Выделенный. Выражение ʺвыделенныйʺ означает вещество в форме или в окружении, которые не встречаются в естественных условиях. Неограничивающие примеры выделенных веществ предусматривают (1) любое не встречающееся в естественных условиях вещество, (2) любое вещество, в том числе без ограничения любой фермент, вариант, нуклеиновую кислоту, белок, пептид или кофактор, которые по меньшей мере частично отделены от одного или нескольких или всех, встречающихся в естественных условиях составляющих, с которыми они связаны в естественных условиях; (3) любое вещество, модифицированное человеком, по сравнению с таким веществом, встречающимся в природе, или (4) любое вещество, модифицированное с помощью увеличения количества вещества по сравнению с другими компонентами, с которыми оно связано в естественных условиях (например, несколько копий гена, кодирующего вещество; применение более сильного промотора, чем промотор, связанный в естественных условиях с геном, кодирующим вещество). Выделенное вещество может присутствовать в образце в виде ферментационного бульона.
Зрелый полипептид. Термин ʺзрелый полипептидʺ означает полипептид в его окончательной форме после трансляции и любых посттрансляционных модификаций, таких как процессинг N -концевой части, усечение C -концевой части, гликозилирование, фосфорилирование и т. д.
В одном аспекте зрелый полипептид представляет собой аминокислоты 1-391 из SEQ ID NO: 1. В одном аспекте зрелый полипептид представляет собой аминокислоты 1-391 из SEQ ID NO: 2. В одном аспекте зрелый полипептид представляет собой аминокислоты 1-392 из SEQ ID NO: 3. В одном аспекте зрелый полипептид представляет собой аминокислоты 1-391 из SEQ ID NO: 4. В одном аспекте зрелый полипептид представляет собой аминокислоты 1-393 из SEQ ID NO: 5. В одном аспекте зрелый полипептид представляет собой аминокислоты 1-391 из SEQ ID NO: 6.
Из уровня техники известно, что клетка-хозяин может вырабатывать смесь из двух или более различных зрелых полипептидов (т. e. с другой C -концевой и/или N -концевой аминокислотой), экспрессируемых одним и тем же полинуклеотидом. Из уровня техники также известно, что в различных клетках-хозяевах процессинг полипептидов осуществляется по-разному, и таким образом одна клетка-хозяин, экспрессирующая полинуклеотид, может вырабатывать отличающийся зрелый полипептид (например, с другой C -концевой и/или N -концевой аминокислотой) по сравнению с другой клеткой-хозяином, экспрессирующей тот же полинуклеотид.
Последовательность, кодирующая зрелый полипептид. Выражение ʺпоследовательность, кодирующая зрелый полипептидʺ означает полинуклеотид, который кодирует зрелый полипептид, обладающий ксиланазной активностью.
Мутант. Выражение ʺмутантʺ означает полинуклеотид, кодирующий вариант.
Конструкция на основе нуклеиновой кислоты. Термин "конструкция на основе нуклеиновой кислоты" означает либо одно-, либо двухнитевую молекулу на основе нуклеиновой кислоты, выделенную из встречающегося в естественных условиях гена или модифицированную для того, чтобы она содержала сегменты нуклеиновых кислот в таком порядке, который в иных случаях не может существовать в естественных условиях, или являющуюся синтетической, которая содержит одну или несколько регуляторных последовательностей.
Усвояемость питательного вещества. Термин ʺусвояемость питательного веществаʺ означает долю питательного вещества, которая исчезает из желудочно-кишечного тракта или определенного сегмента желудочно-кишечного тракта, например, тонкой кишки. Усвояемость питательного вещества можно измерить как разницу между тем, что вводят субъекту, и тем, что выходит в фекалиях субъекта, или между тем, что вводят субъекту, и тем, что остается в содержимом указанного сегмента желудочно-кишечного тракта, например, подвздошной кишки.
Усвояемость питательного вещества, как используется в данном документе, можно измерить по разнице между потреблением питательного вещества и выделенным питательным веществом посредством полного сбора экскрементов в течение периода времени; или с применением инертного маркера, который не абсорбируется животным и позволяет исследователю рассчитать количество питательного вещества, которое исчезло во всем желудочно-кишечном тракте или в сегменте желудочно-кишечного тракта. Таким инертным маркером может быть диоксид титана, оксид хрома или не растворимая в кислоте зола. Усвояемость можно выразить в виде процентной доли от питательного вещества в корме или в единицах массы усваиваемого питательного вещества на единицу массы питательного вещества в корме. Используемое в данном документе выражение усвояемость питательного вещества включает усвояемость крахмала, усвояемость жира, усвояемость белка и усвояемость аминокислот.
Используемое в данном документе выражение усвояемость энергии означает валовую энергию потребленного корма минус валовая энергия фекалий или валовую энергию потребленного корма минус валовая энергия оставшегося содержимого указанного сегмента желудочно-кишечного тракта животного, например, подвздошной кишки. Используемое в данном документе выражение метаболизируемая энергия относится к кажущейся метаболизируемой энергии и означает валовую энергию потребленного корма минус валовая энергия, содержащаяся в фекалиях, моче и газообразных продуктах пищеварения. Усвояемость энергии и метаболизируемую энергию можно измерить как разницу между потреблением валовой энергии и валовой энергией, выделяемой с фекалиями или содержимым, присутствующим в указанном сегменте желудочно-кишечного тракта, с применением тех же способов, что и для измерения усвояемости питательных веществ, с соответствующими поправками на экскрецию азота для расчета метаболизируемой энергии корма.
Функционально связанный. Выражение ʺфункционально связанныйʺ означает конфигурацию, при которой регуляторная последовательность размещена в соответствующем положении относительно кодирующей последовательности полинуклеотида так, что регуляторная последовательность управляет экспрессией кодирующей последовательности.
Исходная форма или исходная ксиланаза. Выражение "исходная форма" или "исходная ксиланаза" означает ксиланазу, в которой произведена замена для получения вариантов ксиланазы по настоящему изобретению. Исходная форма может представлять собой встречающийся в естественных условиях полипептид (дикого типа) или его вариант или фрагмент.
Процентная доля растворенного ксилана. Выражение ʺпроцентная доля растворенного ксиланаʺ означает количество ксилозы, измеренное в надосадочной жидкости после инкубации с ферментом, по сравнению с общим количеством ксилозы, присутствующей в субстрате до инкубации с ферментом. Для целей настоящего изобретения процентную долю растворенного ксилана можно рассчитать с применением обезжиренного обескрахмаленного маиса (DFDSM) в качестве субстрата. DFDSM готовят в соответствии с ʺПолучением обезжиренного обескрахмаленного маиса (DFDSM)ʺ в экспериментальном разделе.
Процентную долю растворенного ксилана из обезжиренного обескрахмаленного маиса (DFDSM) можно определить с применением условий реакции при 20 мкг фермента/г DFDSM и инкубации при 40°C, pH 5, в течение 2,5 часа, как описано в ʺАнализе солюбилизации ксилозыʺ в данном документе. Таким образом, выражение ʺосуществляют в условиях реакции при 20 мкг варианта ксиланазы на грамм обезжиренного обескрахмаленного маиса (DFDSM) и инкубации при 40°С, рН 5, в течение 2,5 часаʺ следует понимать так, что процентную долю растворенного ксилана рассчитывают, как описано в ʺАнализе солюбилизации ксилозыʺ в данном документе.
В более подробном варианте осуществления 2% (вес./вес.) суспензию DFDSM получали в 100 мМ ацетате натрия, 5 мМ CaCl2, pH 5, и оставляли гидратироваться в течение 30 мин. при комнатной температуре при осторожном перемешивании. После гидратации 200 мкл суспензии субстрата переносили пипеткой в 96-луночный планшет и смешивали с 20 мкл раствора фермента с получением конечной концентрации фермента 20 PPM относительно субстрата (20 мкг фермента/г субстрата). Смеси фермент/субстрат оставляли для гидролиза в течение 2,5 ч. при 40°С при осторожном перемешивании (500 об./мин.) в инкубаторе для планшетов. После ферментационного гидролиза планшеты с ферментом/субстратом центрифугировали в течение 10 мин. при 3000 об./мин., а 50 мкл надосадочной жидкости смешивали с 100 мкл 1,6 М HCl и переносили в пробирки для ПЦР объемом 300 мкл и оставляли для кислотного гидролиза в течение 40 мин. при 90°С в аппарате для ПЦР. Образцы нейтрализовали с помощью 125 мкл 1,4 М NaOH после кислотного гидролиза и загружали в HPAE-PAD для анализа моносахаридов.
Идентичность последовательностей. Родство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром ʺидентичность последовательностейʺ.
В целях настоящего изобретения идентичность последовательностей между двумя аминокислотными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который реализован в программе Needle из пакета программ EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), например, версии 5.0.0 или более поздней. Применяемыми параметрами являются: штраф за открытие гэпа, составляющий 10, штраф за продление гэпа, составляющий 0,5, и матрица замен EBLOSUM62 (версия BLOSUM62 для EMBOSS). Выводимые данные в Needle, обозначенные как "наиболее длинный идентичный участок" (полученные с применением опции nobrief), применяют в качестве процента идентичности и рассчитывают следующим образом:
(идентичные остатки x 100)/(длина выравниваемого участка - общее число гэпов в выравниваемом участке).
В контексте настоящего изобретения идентичность последовательностей у двух дезоксирибонуклеотидных последовательностей определяют с применением алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, выше), который применен в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, выше), например, версии 5.0.0 или более поздней. Применяемыми параметрами являются штраф за открытие гэпа, составляющий 10, штраф за продление гэпа, составляющий 0,5, и матрица замен EDNAFULL (версия NCBI NUC4.4 для EMBOSS). Выходные данные в Needle, помеченные как "самая длинная идентичность" (полученные с применением опции nobrief), применяют в качестве процента идентичности и рассчитывают следующим образом:
(идентичные дезоксирибонуклеотиды x 100)/(длина выравниваемого участка - общее число гэпов в выравниваемом участке)
Условия жесткости. Условия различной жесткости определены ниже.
Выражение ʺусловия очень низкой жесткостиʺ означает для зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°C в 5X SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 25% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. В заключение, материал-носитель промывают три раза, каждый раз в течение 15 минут с применением 1,4х SSC, 0,2% SDS при 55°C.
Выражение ʺусловия низкой жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°C в 5X SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 25% формамиде после стандартной процедуры Саузерн-блоттнига в течение 12-24 часов. В заключение, материал-носитель промывают три раза, каждый раз в течение 15 минут с применением 1,4х SSC, 0,2% SDS при 60°C.
Выражение ʺусловия умеренной жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°C в 5X SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 35% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. В заключение, материал-носитель промывают три раза, каждый раз в течение 15 минут с применением 1,4х SSC, 0,2% SDS при 65°C.
Выражение ʺусловия умеренно-высокой жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°C в 5X SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 35% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. В заключение, материал-носитель промывают три раза, каждый раз в течение 15 минут с применением 0,7х SSC, 0,2% SDS при 65°C.
Выражение ʺусловия высокой жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°C в 5X SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 50% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. В заключение, материал-носитель промывают три раза, каждый раз в течение 15 минут с применением 0,7х SSC, 0,2% SDS при 70°C.
Выражение ʺусловия очень высокой жесткостиʺ означает для зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°C в 5X SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 50% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. В заключение, материал-носитель промывают три раза, каждый раз в течение 15 минут с применением 0,7х SSC, 0,2% SDS при 75°C.
Подпоследовательность. Термин ʺподпоследовательностьʺ означает полинуклеотид, у которого отсутствуют один или несколько (например, некоторое количество) нуклеотидов с 5'- и/или 3'-конца последовательности, кодирующей зрелый полипептид; причем подпоследовательность кодирует фрагмент, обладающий ксиланазной активностью.
Вариант. Выражение ʺвариантʺ означает полипептид, обладающий ксиланазной активностью, содержащий изменение, т. e. замену, вставку и/или делецию в одном или нескольких (например, некоторых) положениях. Замена означает замещение аминокислоты, занимающей определенное положение, другой аминокислотой; делеция означает устранение аминокислоты, занимающей определенное положение; а вставка означает добавление аминокислоты рядом и непосредственно после аминокислоты, занимающей определенное положение. Варианты по настоящему изобретению обладают по меньшей мере 20%, например, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% ксиланазной активностью полипептида под SEQ ID NO: 1.
Ксиланаза дикого типа. Выражение ксиланаза ʺдикого типаʺ означает ксиланазу, экспрессируемую встречающимся в естественных условиях микроорганизмом, таким как бактерия, дрожжи или нитчатый гриб, обнаруживаемые в природе.
Условные обозначения для указания вариантов
В контексте настоящего изобретения SEQ ID NO: 1 применяют для определения соответствующего аминокислотного остатка в другой ксиланазе. Аминокислотную последовательность другой ксиланазы выравнивают с SEQ ID NO: 1, и на основании выравнивания номер положения аминокислоты, соответствующий любому аминокислотному остатку в SEQ ID NO: 1, определяют с применением алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который реализован в программе Needle из пакета программ EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), например, версии 5.0.0 или более поздней. Применяемыми параметрами являются: штраф за открытие гэпа, составляющий 10, штраф за продление гэпа, составляющий 0,5, и матрица замен EBLOSUM62 (версия BLOSUM62 для EMBOSS).
Идентификацию соответствующего аминокислотного остатка в другой ксиланазе можно определить с помощью выравнивания нескольких полипептидных последовательностей с применением компьютерных программ, включая без ограничения MUSCLE (множественное сравнение последовательностей с помощью log-ожидания; версия 3.5 или более поздняя; Edgar, 2004, Nucleic Acids Research 32: 1792-1794), MAFFT (версия 6.857 или более поздняя; Katoh and Kuma, 2002, Nucleic Acids Research 30: 3059-3066; Katoh et al., 2005, Nucleic Acids Research 33: 511-518; Katoh and Toh, 2007, Bioinformatics 23: 372-374; Katoh et al., 2009, Methods in Molecular Biology 537: 39-64; Katoh and Toh, 2010, Bioinformatics 26: 1899-1900) и EMBOSS EMMA, в которой применяется ClustalW (1.83 или более поздняя; Thompson et al., 1994, Nucleic Acids Research 22: 4673-4680), с применением их соответствующих параметров по умолчанию.
Если другой фермент отличается от полипептида SEQ ID NO: 1 так, что с помощью традиционного сравнения на основании последовательностей невозможно обнаружить их родство (Lindahl и Elofsson, 2000, J. Mol. Biol. 295: 613-615), то можно применять другие алгоритмы попарного сравнения последовательностей. Большей чувствительности поиска на основании последовательности можно достичь с использованием программ поиска, в которых используются вероятностные представления семейств полипептидов (профилей) для поиска по базам данных. Например, программа PSI BLAST создает профили посредством итеративного процесса поиска по базам данных и способна обнаруживать отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большей чувствительности можно достичь, если семейство или суперсемейство для данного полипептида имеет одного или нескольких представителей в базах данных структуры белков. Программы, например, GenTHREADER (Jones, 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881), применяют информацию из ряда источников (PSI BLAST, данные прогнозирования вторичной структуры, профили структурного выравнивания и потенциалы сольватации) в качестве вводимых данных в нейронную сеть, с помощью которой предсказывают укладку структуры для последовательности, по которой задан запрос. Подобным образом способ по Gough et al., 2000, J. Mol. Biol. 313: 903-919, можно применять для выравнивания последовательности с неизвестной структурой с моделями суперсемейств, присутствующими в базе данных SCOP. В свою очередь, эти выравнивая можно применять для создания моделей гомологии для полипептида, и точность таких моделей можно оценивать с помощью ряда инструментов, разработанных для данной цели.
Для белков с известной структурой доступны несколько инструментов и ресурсов для отыскания и создания структурных выравниваний. Например, суперсемейства белков в SCOP были выравнены по структуре, и результаты этих выравниваний находятся в открытом доступе, а также доступны для загрузки. Структуры двух или более белков можно выравнять с применением ряда алгоритмов, таких как выравнивание на основе матрицы расстояний (Holm and Sander, 1998, Proteins 33: 88-96) или комбинаторного удлинения (Shindyalov and Bourne, 1998, Protein Engineering 11: 739-747), и выполнение этих алгоритмов можно дополнительно применять для составления запросов по представляющей интерес структуре в базах данных структуры с целью нахождения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16: 566-567).
При описании вариантов по настоящему изобретению нижеописанная номенклатура адаптирована для простоты упоминания. Используется принятая IUPAC однобуквенная или трехбуквенная аббревиатура для аминокислот.
Замены. В отношении аминокислотной замены используют следующую номенклатуру: исходная аминокислота, положение, заменяющая аминокислота. Соответственно, замена треонина в положении 226 на аланин обозначается как ʺThr226Alaʺ или ʺT226Aʺ. Несколько мутаций разделяют знаками сложения (ʺ+ʺ), например, ʺGly205Arg+Ser411Pheʺ или ʺG205R+S411Fʺ, представляющие замены в положениях 205 и 411 глицина (G) на аргинин (R) и серина (S) на фенилаланин (F) соответственно.
Делеции. В отношении делеции аминокислот используют следующую номенклатуру: исходная аминокислота, положение, *. Соответственно, делеция глицина в положении 195 обозначается ʺGly195*ʺ или ʺG195*ʺ. Несколько делеций разделяют знаками сложения (ʺ+ʺ), например, ʺGly195*+Ser411*ʺ или ʺG195*+S411*ʺ.
Вставки. В отношении вставки аминокислоты применяется следующая номенклатура: исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначается ʺGly195GlyLysʺ или ʺG195GKʺ. Вставку нескольких аминокислот обозначают [исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота № 1, вставленная аминокислота № 2 и т. д]. Например, вставка лизина и аланина после глицина в положении 195 обозначается ʺGly195GlyLysAlaʺ или ʺG195GKAʺ.
В таких случаях вставленный(ые) аминокислотный(ые) остаток(и) нумеруют путем добавления строчных букв к номеру положения аминокислотного остатка, предшествующего вставленному(ым) аминокислотному(ым) остатку(ам). Следовательно, в вышеуказанном примере последовательность будет иметь следующий вид.
Множественные изменения. Варианты, содержащие множественные изменения, разделены знаками сложения (ʺ+ʺ), например, ʺArg170Tyr+Gly195Gluʺ или ʺR170Y+G195Eʺ представляют собой замену аргинина и глицина в положениях 170 и 195 соответственно на тирозин и глутаминовую кислоту.
Различные изменения. Когда различные изменения могут вводиться в какое-либо положение, различные изменения разделяют запятой, например, ʺArg170Tyr,Gluʺ представляет замену аргинина в положении 170 на тирозин или глутаминовую кислоту. Следовательно, ʺTyr167Gly,Ala+Arg170Gly,Alaʺ обозначает следующие варианты:
ʺTyr167Gly+Arg170Glyʺ, ʺTyr167Gly+Arg170Alaʺ, ʺTyr167Ala+Arg170Glyʺ и ʺTyr167Ala+Arg170Alaʺ.
Подробное описание изобретения
Настоящее изобретение относится к выделенным вариантам ксиланазы, содержащим замену в одном или нескольких (например, некоторых) положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317 и 321 SEQ ID NO: 1, где вариант обладает ксиланазной активностью.
Варианты
Настоящее изобретение предусматривает варианты ксиланазы, содержащие замену в одном или нескольких (например, некоторых) положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321,, где вариант обладает ксиланазной активностью. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой. В одном варианте осуществления варианты представляют собой варианты ксиланазы GH30, предпочтительно варианты GH30 подсемейства 8.
В одном варианте осуществления последовательность варианта характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но менее чем на 100% идентичной аминокислотной последовательности исходной ксиланазы.
В другом варианте осуществления вариант характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, например, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 1.
В другом варианте осуществления вариант характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, например, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 2. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 2.
В другом варианте осуществления вариант характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, например, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 3. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 3.
В другом варианте осуществления вариант характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, например, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 4. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 4.
В другом варианте осуществления вариант характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, например, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 5. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 5.
В другом варианте осуществления вариант характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, например, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 6. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 6.
В одном варианте осуществления настоящее изобретение относится к варианту ксиланазы GH30 подсемейства 8, характеризующемуся улучшенной термостабильностью по сравнению с исходной ксиланазой, содержащему замену в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321,, где положения соответствуют положениям в SEQ ID NO: 1, и где вариант обладает ксиланазной активностью и характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1.
В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus, такую как описанная в данном документе ниже. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus subtilis, такую как SEQ ID NO: 1 или SEQ ID NO: 4, предпочтительно SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus amyloliquefaciens, такую как SEQ ID NO: 2 или SEQ ID NO: 6. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus licheniformis, такую как SEQ ID NO: 3. В другом аспекте исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus, такую как описанная ниже в данном документе. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus pabuli, такую как SEQ ID NO: 5.
В одном аспекте количество изменений в вариантах по настоящему изобретению составляет 1-20, например, 1-10 и 1-5, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений.
В другом аспекте вариант содержит замену в одном или нескольких (например, некоторых) положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321.. В другом аспекте вариант содержит замену в двух положениях, соответствующих любому из положений 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321.. В другом аспекте вариант содержит замену в трех положениях, соответствующих любому из положений 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321. В другом аспекте вариант содержит замену в каждом положении, соответствующем положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321.. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus, такую как описанная в данном документе ниже. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus subtilis, такую как SEQ ID NO: 1 или SEQ ID NO: 4, предпочтительно SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus amyloliquefaciens, такую как SEQ ID NO: 2 или SEQ ID NO: 6. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus licheniformis, такую как SEQ ID NO: 3. В другом аспекте исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus, такую как описанная ниже в данном документе. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus pabuli, такую как SEQ ID NO: 5.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 24. В другом аспекте аминокислота в положении, соответствующем положению 24, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Trp. В другом аспекте вариант содержит или состоит из замены H24W полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 26. В другом аспекте аминокислота в положении, соответствующем положению 26, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Glu. В другом аспекте вариант содержит или состоит из замены A26E полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 36. В другом аспекте аминокислота в положении, соответствующем положению 36, заменена на Ala, Asn, Arg, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu или Thr. В другом аспекте вариант содержит или состоит из замены R36L,T полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 37. В другом аспекте аминокислота в положении, соответствующем положению 37, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu или Thr. В другом аспекте вариант содержит или состоит из замены E37L,T полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 60. В другом аспекте аминокислота в положении, соответствующем положению 60, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Asn. В другом аспекте вариант содержит или состоит из замены R60N полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 71. В другом аспекте аминокислота в положении, соответствующем положению 71, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ile, Leu или Thr. В другом аспекте вариант содержит или состоит из замены K71I,L,T полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 74. В другом аспекте аминокислота в положении, соответствующем положению 74, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ile или Leu. В другом аспекте вариант содержит или состоит из замены V74I,L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 75. В другом аспекте аминокислота в положении, соответствующем положению 75, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Asn, Glu, Leu или Thr. В другом аспекте вариант содержит или состоит из замены K75E,L,N,T полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 76. В другом аспекте аминокислота в положении, соответствующем положению 76, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu. В другом аспекте вариант содержит или состоит из замены H76L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 124. В другом аспекте аминокислота в положении, соответствующем положению 124, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Tyr. В другом аспекте вариант содержит или состоит из замены F124Y полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 133. В другом аспекте аминокислота в положении, соответствующем положению 133, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ile. В другом аспекте вариант содержит или состоит из замены Y133I полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 155. В другом аспекте аминокислота в положении, соответствующем положению 155, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Met. В другом аспекте вариант содержит или состоит из замены I155M полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 167. В другом аспекте аминокислота в положении, соответствующем положению 167, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Glu. В другом аспекте вариант содержит или состоит из замены N167E полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 208. В другом аспекте аминокислота в положении, соответствующем положению 208, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu. В другом аспекте вариант содержит или состоит из замены V208L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 317. В другом аспекте аминокислота в положении, соответствующем положению 317, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Asp. В другом аспекте вариант содержит или состоит из замены S317D полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замены в положении, соответствующем положению 321. В другом аспекте аминокислота в положении, соответствующем положению 321, заменена на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ala. В другом аспекте вариант содержит или состоит из замены G321A полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 26, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 60, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 71, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 60, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 71, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36 и 37, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 37 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 37 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 37 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 37 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 76 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 76 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 124 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 124 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 124 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 124 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 133 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 133 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 133 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 133 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 155 и 167, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 155 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 155 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 167 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 167 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 167 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 208 и 317, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 208 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 317 и 321, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26 и 71, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36, 37 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36, 37 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 37, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 124, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 133, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 155, 167 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71 и 74, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 36, 37, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74 и 75, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74, 75 и 76, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74, 75 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74, 75 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 71, 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74, 75, 76 и 155, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74, 75, 76 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 71, 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 26, 71, 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из замен в положениях, соответствующих положениям 24, 26, 71, 74, 75, 76, 155 и 208, таких как описаны выше.
В другом аспекте вариант содержит или состоит из одной или нескольких (например, некоторых) замен, выбранных из группы, состоящей из H24W, A26E, V74L, K75L, H76L, I155M и V208L. В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus, такую как описанная в данном документе ниже. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus subtilis, такую как SEQ ID NO: 1 или SEQ ID NO: 4, предпочтительно SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus amyloliquefaciens, такую как SEQ ID NO: 2 или SEQ ID NO: 6. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus licheniformis, такую как SEQ ID NO: 3. В другом аспекте исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus, такую как описанная ниже в данном документе. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus pabuli, такую как SEQ ID NO: 5.
В другом аспекте вариант содержит или состоит из замен H24W+A26E полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H24W+V74L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H24W+K75L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H24W+H76L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H24W+I155M полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H24W+V208L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен A26E+V74L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен A26E+K75L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен A26E+H76L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен A26E+I155M полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен A26E+V208L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен V74L+K75L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен V74L+H76L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен V74L+I155M полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен V74L+V208L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен K75L+H76L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен K75L+I155M полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен K75L+V208L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H76L+I155M полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен H76L+V208L полипептида под SEQ ID NO: 1.
В другом аспекте вариант содержит или состоит из замен I155M+V208L полипептида под SEQ ID NO: 1.
Варианты могут дополнительно содержать одно или несколько дополнительных изменений в одном или нескольких (например, некоторых) других положениях.
В одном варианте осуществления настоящее изобретение относится к вариантам ксиланазы GH30 подсемейства 8, характеризующимся улучшенной термостабильностью по сравнению с исходной ксиланазой, содержащим замену, перечисленную в группе, состоящей из:
24, 24+167, 36+167, 71+74, 76+124,
26, 24+208, 36+208, 71+75, 76+133,
36, 24+317, 36+317, 71+76, 76+155,
37, 24+321, 36+321, 71+124, 76+167,
60, 26+36, 37+60, 71+133, 76+208,
71, 26+37, 37+71, 71+155, 76+317,
74, 26+60, 37+74, 71+167, 76+321,
75, 26+71, 37+75, 71+208, 124+133,
76, 26+74, 37+76, 71+317, 124+155,
124, 26+75, 37+124, 71+321, 124+167,
133, 26+76, 37+133, 74+75, 124+208,
155, 26+124, 37+155, 74+76, 124+317,
167, 26+133, 37+167, 74+124, 124+321,
208, 26+155, 37+208, 74+133, 133+155,
317, 26+167, 37+317, 74+155, 133+167,
321, 26+208, 37+321, 74+167, 133+208,
24+26, 26+317, 60+71, 74+208, 133+317,
24+36, 26+321, 60+74, 74+317, 133+321,
24+37, 36+37, 60+75, 74+321, 155+167,
24+60, 36+60, 60+76, 75+76, 155+208,
24+71, 36+71, 60+124, 75+124, 155+317,
24+74, 36+74, 60+133, 75+133, 155+321,
24+75, 36+75, 60+155, 75+155, 167+208,
24+76, 36+76, 60+167, 75+167, 167+317,
24+124, 36+124, 60+208, 75+208, 167+321,
24+133, 36+133, 60+317, 75+317, 208+317,
24+155, 36+155, 60+321, 75+321, 208+321,
и 317+321;
где положения соответствуют положениям в последовательности под SEQ ID NO: 1, и где вариант обладает ксиланазной активностью и характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus, такую как описанная в данном документе ниже. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus subtilis, такую как SEQ ID NO: 1 или SEQ ID NO: 4, предпочтительно SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus amyloliquefaciens, такую как SEQ ID NO: 2 или SEQ ID NO: 6. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus licheniformis, такую как SEQ ID NO: 3. В другом аспекте исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus, такую как описанная ниже в данном документе. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus pabuli, такую как SEQ ID NO: 5.
В одном варианте осуществления замену выбирают из группы, состоящей из:
A26E, H76L, K75L, R60N,
E37L, I155M, K75N, S317D,
E37T, K71I, K75T, V208L,
F124Y, K71L, N167E, V74I,
G321A, K71T, R36L, V74L,
H24W, K75E, R36T, Y133I,
H24W+A26E, R36T+S317D, K71I+K75T, K75E+H76L,
H24W+R36L, R36T+G321A, K71I+H76L, K75E+F124Y,
H24W+R36T, E37L+R60N, K71I+F124Y, K75E+Y133I,
H24W+E37L, E37L+K71I, K71I+Y133I, K75E+I155M,
H24W+E37T, E37L+K71L, K71I+I155M, K75E+N167E,
H24W+R60N, E37L+K71T, K71I+N167E, K75E+V208L,
H24W+K71I, E37L+V74I, K71I+V208L, K75E+S317D,
H24W+K71L, E37L+V74L, K71I+S317D, K75E+G321A,
H24W+K71T, E37L+K75E, K71I+G321A, K75L+H76L,
H24W+V74I, E37L+K75L, K71L+V74I, K75L+F124Y,
H24W+V74L, E37L+K75N, K71L+V74L, K75L+Y133I,
H24W+K75E, E37L+K75T, K71L+K75E, K75L+I155M,
H24W+K75L, E37L+H76L, K71L+K75L, K75L+N167E,
H24W+K75N, E37L+F124Y, K71L+K75N, K75L+V208L,
H24W+K75T, E37L+Y133I, K71L+K75T, K75L+S317D,
H24W+H76L, E37L+I155M, K71L+H76L, K75L+G321A,
H24W+F124Y, E37L+N167E, K71L+F124Y, K75N+H76L,
H24W+Y133I, E37L+V208L, K71L+Y133I, K75N+F124Y,
H24W+I155M, E37L+S317D, K71L+I155M, K75N+Y133I,
H24W+N167E, E37L+G321A, K71L+N167E, K75N+I155M,
H24W+V208L, E37T+R60N, K71L+V208L, K75N+N167E,
H24W+S317D, E37T+K71I, K71L+S317D, K75N+V208L,
H24W+G321A, E37T+K71L, K71L+G321A, K75N+S317D,
R36L+E37L, E37T+K71T, K71T+V74I, K75N+G321A,
R36L+E37T, E37T+V74I, K71T+V74L, K75T+H76L,
R36L+R60N, E37T+V74L, K71T+K75E, K75T+F124Y,
R36L+K71I, E37T+K75E, K71T+K75L, K75T+Y133I,
R36L+K71L, E37T+K75L, K71T+K75N, K75T+I155M,
R36L+K71T, E37T+K75N, K71T+K75T, K75T+N167E,
R36L+V74I, E37T+K75T, K71T+H76L, K75T+V208L,
R36L+V74L, E37T+H76L, K71T+F124Y, K75T+S317D,
R36L+K75E, E37T+F124Y, K71T+Y133I, K75T+G321A,
R36L+K75L, E37T+Y133I, K71T+I155M, H76L+F124Y,
R36L+K75N, E37T+I155M, K71T+N167E, H76L+Y133I,
R36L+K75T, E37T+N167E, K71T+V208L, H76L+I155M,
R36L+H76L, E37T+V208L, K71T+S317D, H76L+N167E,
R36L+F124Y, E37T+S317D, K71T+G321A, H76L+V208L,
R36L+Y133I, E37T+G321A, V74I+K75E, H76L+S317D,
R36L+I155M, R60N+K71I, V74I+K75L, H76L+G321A,
R36L+N167E, R60N+K71L, V74I+K75N, F124Y+Y133I,
R36L+V208L, R60N+K71T, V74I+K75T, F124Y+I155M,
R36L+S317D, R60N+V74I, V74I+H76L, F124Y+N167E,
R36L+G321A, R60N+V74L, V74I+F124Y, F124Y+V208L,
R36T+E37L, R60N+K75E, V74I+Y133I, F124Y+S317D,
R36T+E37T, R60N+K75L, V74I+I155M, F124Y+G321A,
R36T+R60N, R60N+K75N, V74I+N167E, Y133I+I155M,
R36T+K71I, R60N+K75T, V74I+V208L, Y133I+N167E,
R36T+K71L, R60N+H76L, V74I+S317D, Y133I+V208L,
R36T+K71T, R60N+F124Y, V74I+G321A, Y133I+S317D,
R36T+V74I, R60N+Y133I, V74L+K75E, Y133I+G321A,
R36T+V74L, R60N+I155M, V74L+K75L, I155M+N167E,
R36T+K75E, R60N+N167E, V74L+K75N, I155M+V208L,
R36T+K75L, R60N+V208L, V74L+K75T, I155M+S317D,
R36T+K75N, R60N+S317D, V74L+H76L, I155M+G321A,
R36T+K75T, R60N+G321A, V74L+F124Y, N167E+V208L,
R36T+H76L, K71I+V74I, V74L+Y133I, N167E+S317D,
R36T+F124Y, K71I+V74L, V74L+I155M, N167E+G321A,
R36T+Y133I, K71I+K75E, V74L+N167E, V208L+S317D,
R36T+I155M, K71I+K75L, V74L+V208L, V208L+G321A,
R36T+N167E, K71I+K75N, V74L+S317D, S317D+G321A,
R36T+V208L, и V74L+G321A.
Вариант ксиланазы может дополнительно содержать одну или несколько аминокислотных замен. Изменения аминокислот могут быть незначительными, то есть являться консервативными аминокислотными заменами или вставками, которые не оказывают значительного влияния на укладку и/или активность белка; небольшими делециями, как правило, размером 1-30 аминокислот; небольшими удлинениями на амино или карбокси-конце, такими как метиониновый остаток на амино-конце; небольшим линкерным пептидом размером до 20-25 остатков; или небольшим удлинением, которое облегчает очистку с помощью изменения суммарного заряда, или другой функциональной группой, такой как полигистидиновый тракт, антигенный эпитоп или связывающий домен.
Примерами консервативных замен являются замены в пределах групп основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и небольших аминокислот (глицин, аланин, серин, треонин и метионин). Аминокислотные замены, которые в целом не изменяют удельную активность, известны из уровня техники и описаны, например, в H. Neurath и R.L. Hill, 1979, In, The Proteins, Academic Press, New York. Обычные замены представляют собой Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Asn/Gln, Gln/Glu, Ala/Glu и Asp/Gly. Другими примерами консервативных замен являются G на A; A на G, S; V на I, L, A, T, S; I на V, L, M; L на I, M, V; M на L, I, V; P на A, S, N; F на Y, W, H; Y на F, W, H; W на Y, F, H; R на K, E, D; K на R, E, D; H на Q, N, S; D на N, E, K, R, Q; E на Q, D, K, R, N; S на T, A; T на S, V, A; C на S, T, A; N на D, Q, H, S; Q на E, N, H, K, R.
В качестве альтернативы изменения аминокислот имеют такой характер, что физико-химические свойства полипептидов изменяются. Например, изменения аминокислот могут улучшать термоустойчивость полипептида, изменять субстратную специфичность, изменять pH-оптимум и т. п.
Незаменимые аминокислоты в полипептиде можно идентифицировать в соответствии с процедурами, известными из уровня техники, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). В последней методике отдельные мутации, заключающиеся в замене на аланин, вводят в каждый остаток в молекуле и полученные в результате мутантные молекулы исследуют в отношении ксиланазной активности с целью идентификации аминокислотных остатков, которые являются определяющими для активности молекулы. См. также Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Активный сайт для ферментативного или другого биологического взаимодействия можно определять также с помощью физического анализа структуры, которую определяют с помощью таких методик, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное мечение в сочетании с мутацией аминокислот предполагаемого контактирующего сайта. См., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. Mol. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309: 59-64. Об идентичности незаменимых аминокислот можно также сделать заключение на основании выравнивания с родственным полипептидом.
В одном варианте осуществления вариант характеризуется улучшенной термостабильностью по сравнению с исходным ферментом.
В одном варианте осуществления настоящее изобретение относится к варианту ксиланазы, обладающему ксиланазной активностью, где:
(a) вариант ксиланазы содержит замену в одном или нескольких положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 в SEQ ID NO: 1;
(b) вариант ксиланазы характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1; и
(c) вариант ксиланазы характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой.
В одном варианте осуществления настоящее изобретение относится к варианту ксиланазы, обладающему ксиланазной активностью, где:
(a) вариант ксиланазы содержит замену в одном или нескольких положениях, соответствующих положениям 24, 26, 60, 71, 74, 75, 76, 155, 208, 317, и 321 в SEQ ID NO: 1;
(b) вариант ксиланазы характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1; и
(c) вариант ксиланазы характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой.
В одном варианте осуществления настоящее изобретение относится к варианту ксиланазы, обладающему ксиланазной активностью, где:
(a) вариант ксиланазы содержит одну или несколько замен, выбранных из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A, где положения соответствуют положениям в SEQ ID NO: 1;
(b) вариант ксиланазы характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1; и
(c) вариант ксиланазы характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой.
В одном варианте осуществления настоящее изобретение относится к варианту ксиланазы, обладающему ксиланазной активностью, где:
(a) вариант ксиланазы содержит одну или несколько замен, выбранных из группы, состоящей из H24W, A26E, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, V208L, S317D, G321A, R36T+I155M, R36L+I155M, I155M+N167E, R36T+V208L, R36L+V208L, N167E+V208L, E37T+V208L и R36T+E37T, где положения соответствуют положениям в SEQ ID NO: 1;
(b) вариант ксиланазы характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1; и
(c) вариант ксиланазы характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой.
В одном варианте осуществления исходная ксиланаза представляет собой SEQ ID NO: 1.
Исходные ксиланазы.
В одном варианте осуществления исходную ксиланазу получают или она может быть получена из таксономического порядка Bacillales, предпочтительно таксономического семейства Bacillaceae или более предпочтительно из рода Bacillus subtilis, Bacillus amyloliquefaciens, Bacillus licheniformis или Paenibacillus pabuli. В одном варианте осуществления исходную ксиланазу получают или она может быть получена из таксономического отряда Bacillales, предпочтительно таксономического семейства Bacillaceae, и характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1.
В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus, такую как описанная в данном документе ниже. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus subtilis, такую как SEQ ID NO: 1 или SEQ ID NO: 4, предпочтительно SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus amyloliquefaciens, такую как SEQ ID NO: 2 или SEQ ID NO: 6. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Bacillus licheniformis, такую как SEQ ID NO: 3. В другом аспекте исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus, такую как описанная ниже в данном документе. В одном варианте осуществления исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8 из Paenibacillus pabuli, такую как SEQ ID NO: 5.
Исходная ксиланаза может представлять собой (a) полипептид, последовательность которого на по меньшей мере 60% идентична SEQ ID NO: 1, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или на 100%, который обладает ксиланазной активностью. В одном аспекте аминокислотная последовательность исходной формы отличается не более 10 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, от SEQ ID NO: 1. В другом аспекте исходная форма содержит или состоит из аминокислотной последовательности под SEQ ID NO: 1. В другом аспекте исходная форма представляет собой фрагмент SEQ ID NO: 1, который обладает ксиланазной активностью.
Исходная ксиланаза может представлять собой (a) полипептид, последовательность которого на по меньшей мере 60% идентична SEQ ID NO: 2, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или на 100%, который обладает ксиланазной активностью. В одном аспекте аминокислотная последовательность исходной формы отличается не более 10 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, от SEQ ID NO: 2. В другом аспекте исходная форма содержит или состоит из аминокислотной последовательности под SEQ ID NO: 2. В другом аспекте исходная форма представляет собой фрагмент SEQ ID NO: 2, который обладает ксиланазной активностью.
Исходная ксиланаза может представлять собой (a) полипептид, последовательность которого на по меньшей мере 60% идентична SEQ ID NO: 3, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или на 100%, который обладает ксиланазной активностью. В одном аспекте аминокислотная последовательность исходной формы отличается не более 10 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, от SEQ ID NO: 3. В другом аспекте исходная форма содержит или состоит из аминокислотной последовательности под SEQ ID NO: 3. В другом аспекте исходная форма представляет собой фрагмент SEQ ID NO: 3, который обладает ксиланазной активностью.
Исходная ксиланаза может представлять собой (a) полипептид, последовательность которого на по меньшей мере 60% идентична SEQ ID NO: 4, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или на 100%, который обладает ксиланазной активностью. В одном аспекте аминокислотная последовательность исходной формы отличается не более 10 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, от SEQ ID NO: 4. В другом аспекте исходная форма содержит или состоит из аминокислотной последовательности под SEQ ID NO: 4. В другом аспекте исходная форма представляет собой фрагмент SEQ ID NO: 4, который обладает ксиланазной активностью.
Исходная ксиланаза может представлять собой (a) полипептид, последовательность которого на по меньшей мере 60% идентична SEQ ID NO: 5, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или на 100%, который обладает ксиланазной активностью. В одном аспекте аминокислотная последовательность исходной формы отличается не более 10 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, от SEQ ID NO: 5. В другом аспекте исходная форма содержит или состоит из аминокислотной последовательности под SEQ ID NO: 5. В другом аспекте исходная форма представляет собой фрагмент SEQ ID NO: 5, который обладает ксиланазной активностью.
Исходная ксиланаза может представлять собой (a) полипептид, последовательность которого на по меньшей мере 60% идентична SEQ ID NO: 6, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 91%, на по меньшей мере 92%, на по меньшей мере 93%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или на 100%, который обладает ксиланазной активностью. В одном аспекте аминокислотная последовательность исходной формы отличается не более 10 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10, от SEQ ID NO: 6. В другом аспекте исходная форма содержит или состоит из аминокислотной последовательности под SEQ ID NO: 6. В другом аспекте исходная форма представляет собой фрагмент SEQ ID NO: 6, который обладает ксиланазной активностью.
Другие исходные ксиланазы могут представлять собой ксиланазы с одним из следующих номеров доступа GENESEQP:
BCM03690, BBY25441, BBD43833, AZG87760, BBW75090, BCM03682, BBW96675, BCM03671, ADJ35022, BBW83525, BCM03685, BBW88031, BCM03707, AZH70238, AZG87766, BBX36748, BCM03686, AZQ23477, BCM03677, BCM03691, BCM03681, BCM03676, BCM03688, AZG68558, ADJ35028, BCM03687, BBG80964, AZX66647, AZH70244, BCM03689, AZM95903, BBW79314, BBX47049, BCM03683, BCM03679, BBW95840, BBX52401, BBW92246, BBX42063 и AZG68552.
Другие исходные ксиланазы могут представлять собой ксиланазы с одним из следующих номеров доступа Uniprot: A0A016QIT0, A0A024BEN2, A0A059N8P2, A0A060J1Q4, A0A060J3N3, A0A060MDP8, A0A063XEB2, A0A063Z3F5, A0A066ZQH2, A0A068QG80, A0A069DJA1, A0A074QA16, A0A076GH62, A0A076X095, A0A080UGI0, A0A081DRH7, A0A081L9P3, A0A085CCQ4, A0A086DRT4, A0A086SGC4, A0A086WWT9, A0A089J0T9, A0A089L7Q4, A0A089LS30, A0A089MA96, A0A089MMY5, A0A090ZY18, A0A093UG96, A0A097RET6, A0A097RT57, A0A0A0TJX0, A0A0A0TS05, A0A0A1STB1, A0A0A7GLZ8, A0A0A8C3V5, A0A0B0QGI0, A0A0B4S841, A0A0C2TMZ1, A0A0C5CYD2, A0A0D7XHL0, A0A0D7XPV8, A0A0D8JJW7, A0A0E1LNG3, A0A0E1P2T5, A0A0F5MCQ0, A0A0F5YUV2, A0A0G2M1V3, A0A0G2Z099, A0A0G3VDP8, A0A0H1RW51, A0A0H3DZC9, A0A0J1HNE5, A0A0J1I8S6, A0A0J5XBB3, A0A0J6E3H1, A0A0J6ENY2, A0A0J6MZ81, A0A0J6PTT5, A0A0K0HYL4, A0A0K6JZ62, A0A0K6L1E5, A0A0K6L5C0, A0A0K6LRC5, A0A0K6MBZ9, A0A0K9EI79, A0A0K9G2M8, A0A0L6C9N3, A0A0L7MT05, A0A0L7SGL4, A0A0M0HBT0, A0A0M2EI36, A0A0M2S6E2, A0A0M9X369, A0A0P0TKN9, A0A0P7GC51, A0A0Q3W7T1, A0A0Q4R8I7, A0A0Q7SDS0, A0A0R3K873, A0A0T6LD54, A0A0U3M226, A0A0U5Q000, A0A0V8QN06, A0A0V8QPQ0, A0A0V8RCK0, A0A0W1Q0Y8, A0A0W7XI48, A0A0W8K830, A0A0X1TCR2, A0A0X8C7K8, A0A0X8DHN5, A0A0X8KDH2, A0A0X9LBN0, A0A101YC92, A0A101YL97, A0A117SZP6, A0A124JQM2, A0A125UIF6, A0A127DQZ4, A0A132BP80, A0A132TGU4, A0A132TSQ5, A0A136AEB9, A0A142F586, A0A150L2Y6, A0A160EHD0, A0A164XMN2, A0A172HNW1, A0A172XIR5, A0A199NI63, A0A199WHT5, A0A1A0CC44, A0A1A0G7Q3, A0A1A5VV23, A0A1A5YLD9, A0A1A7LKF3, A0A1B2AW76, A0A1C3SIT4, A0A1C4AHG6, A0A1D9PK78, A0A1E4Y0F1, A0A1G9MAD1, A0A1J0BBP6, A0A1J0C7I7, A0A1J5WRC5, A0A1J6F1D5, A0A1K1TBA7, A0A1L3PT45, A0A1L3QYI6, A0A1L3SH52, A0A1L4DM20, A0A1L5LNU4, A0A1L6CEM3, A0A1L6ZLN8, A0A1L6ZTD9, A0A1M7SMM4, A0A1N6S500, A0A1N7B930, A0A1N7E7E0, A0A1R1E8G3, A0A1R1ESJ7, A0A1R1FQ77, A0A1R1GBK8, A0A1R1GT02, A0A1R1HH77, A0A1S2F2R2, A0A1U3ULV5, A7Z5A1, A8FDV2, B3KF38, D1MEP8, D3EH02, D4FXC2, E0RDU2, E1ACF9, E1UV03, E3E322, E8VJ45, F4E4B0, F4EKU6, G0IKW9, G4EVQ6, G4HGL4, G4P7F1, G7W2J1, H0FNN1, H1ACZ7, H2AJ54, H3K352, H6CPJ0, H6WCZ0, H8XMR3, I4XB64, J0X3V6, J7JVZ4, K2HJT3, K2P3H7, L0BLZ3, L0CY72, L8AKB2, M1KJT1, M1U2J5, M1XAU4, M2U9N8, N0DFI8, Q45070, Q6YK37, Q70K02, R9TYN3, S6FS40, S6FXS9, U1T362, U1ZC44, U2TM90, U4PL99, U5X5B8, V5MRU9, V7Q6M1, V9REY3, W4AZH7, W4BXI4, W4C6X9, W4D801, W4DEL3, W8ILG7 и W9TFT6.
Полипептид может представлять собой гибридный полипептид, в котором область одного полипептида слита с N концом или C концом области другого полипептида.
Исходная форма может представлять собой слитый полипептид или расщепляемый слитый полипептид, в котором другой полипептид слит с N концом или C концом полипептида по настоящему изобретению. Слитый полипептид получают с помощью слияния полинуклеотида, кодирующего другой полипептид, с полинуклеотидом по настоящему изобретению. Методики получения слитых полипептидов известны из уровня техники и включают лигирование кодирующих последовательностей, кодирующих полипептиды, с тем, чтобы они находились в рамке и чтобы экспрессия слитого полипептида находилась под контролем одних и тех же промотора(промоторов) и терминатора. Слитые полипептиды можно также конструировать с применением интеиновой технологии, в которой слитые полипептиды создаются посттрансляционно (Cooper et al., 1993, EMBO J. 12: 2575-2583; Dawson et al., 1994, Science 266: 776-779).
Слитый полипептид может дополнительно содержать сайт расщепления между двумя полипептидами. После секреции слитого белка сайт расщепляется с высвобождением двух полипептидов. Примеры сайтов расщепления включают без ограничения сайты, раскрытые в Martin et al., 2003, J. Ind. Microbiol. Biotechnol. 3: 568-576; Svetina et al., 2000, J. Biotechnol. 76: 245-251; Rasmussen-Wilson et al., 1997, Appl. Environ. Microbiol. 63: 3488-3493; Ward et al., 1995, Biotechnology 13: 498-503; и Contreras et al., 1991, Biotechnology 9: 378-381; Eaton et al., 1986, Biochemistry 25: 505-512; Collins-Racie et al., 1995, Biotechnology 13: 982-987; Carter et al., 1989, Proteins: Structure, Function, and Genetics 6: 240-248; и Stevens, 2003, Drug Discovery World 4: 35-48.
Исходную форму можно получить из микроорганизмов любого рода. В контексте настоящего изобретения термин ʺполученный изʺ, который используется в данном документе применительно к определенному источнику, будет означать, что исходная молекула, кодируемая полинуклеотидом, продуцируется тем же источником или штаммом, в который был вставлен полинуклеотид из источника. В одном аспекте исходная форма секретируется внеклеточно.
Полипептид может быть бактериальным полипептидом. Например, полипептид может представлять собой полипептид грамположительных бактерий, такой как полипептид Bacillus, Clostridium, Enterococcus, Geobacillus, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus или Streptomyces, обладающий ксиланазной активностью. В одном варианте осуществления полипептид происходит из бактерии класса Bacilli, например, из отряда Bacillales, или из семейства Paenibacillaceae, или из рода Paenibacillus, или из видов Paenibacillus sp-19179 или Paenibacillus panacisoli.
В другом варианте осуществления полипептид происходит из бактерии класса Clostridia, например, из отряда Clostridiales, или из семейства Clostridiaceae, или из рода Clostridium, или из вида Clostridium saccharobutylicum.
В другом варианте осуществления полипептид происходит из бактерии класса Clostridia, например, из отряда Clostridiales, или из семейства Ruminococcaceae, или из рода Ruminococcus, или из вида Ruminococcus sp. CAG:330.
В другом варианте осуществления полипептид происходит из бактерии класса Gammaproteobacteria, например, из отряда Alteromonadales, или из семейства Pseudoalteromonadaceae, или из рода Pseudoalteromonas, или из вида Pseudoalteromonas tetraodonis.
В другом варианте осуществления полипептид происходит из бактерии класса Gammaproteobacteria, например, из отряда Enterobacteriales, или из семейства Enterobacteriaceae, или из рода Pectobacterium, или из вида Pectobacterium carotovorum.
В другом варианте осуществления полипептид происходит из бактерии класса Actinobacteria, например, из отряда Streptomycetales, или из семейства Streptomycetaceae, или из рода Streptomyces, или из вида Streptomyces sp-62627.
В другом варианте осуществления полипептид происходит из бактерии класса Gammaproteobacteria, например, из отряда Vibrionales, или из семейства Vibrionaceae, или из рода Vibrio, или из вида Vibrio rhizosphaerae.
В одном аспекте исходная форма представляет собой ксиланазу Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis или Bacillus thuringiensis.
В другом аспекте исходная форма представляет собой ксиланазу Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis или Streptococcus equi подвида Zooepidemicus.
В другом аспекте исходная форма представляет собой ксиланазу Bacillus subtilis, например, ксиланазу с аминокислотной последовательностью под SEQ ID NO: 1.
Будет понятно, что в отношении вышеупомянутых видов настоящее изобретение охватывает как совершенную, так и несовершенную стадии, а также другие таксономические эквиваленты, например, анаморфы, вне зависимости от названия вида, под которым они известны. Специалисты в данной области техники легко поймут идентичность соответствующих эквивалентов.
Штаммы этих видов являются легкодоступными неограниченному кругу лиц в ряде коллекций культур, таких как Американская коллекция типовых культур (American Type Culture Collection) (ATCC), Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ), Centraalbureau Voor Schimmelcultures (CBS) и Коллекция патентованных культур Службы сельскохозяйственных исследований (Agricultural Research Service Patent Culture Collection), Северный региональный исследовательский центр (Northern Regional Research Center) (NRRL).
Исходную молекулу можно идентифицировать и получить из других источников, в том числе микроорганизмов, выделенных из природной среды (например, почвы, компостов, воды и т. д.), или образцов ДНК, полученных непосредственно из природных материалов (например, почвы, компостов, воды и т. д.), с использованием вышеупомянутых зондов. Методики выделения микроорганизмов и ДНК непосредственно из естественных мест обитания хорошо известны из уровня техники. Полинуклеотид, кодирующий исходную форму, можно затем получить подобным образом с помощью скрининга библиотеки геномной ДНК, или cDNA другого микроорганизма, или образца смешанной ДНК. После того как полинуклеотид, кодирующий исходную форму, выявили зондом(-ами), полинуклеотид можно выделить или клонировать с помощью методик, которые хорошо известны специалисту в данной области техники (см., например, Sambrook et al., 1989, supra).
Получение вариантов
Настоящее изобретение также относится к способам получения варианта, обладающего ксиланазной активностью, включающим: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 1, где вариант обладает ксиланазной активностью; и (b) выделение варианта. В одном варианте осуществления вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1. В одном варианте осуществления исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1. В одном варианте осуществления замену выбирают из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A. Настоящее изобретение дополнительно относится к варианту ксиланазы, полученному описанным в данном документе способом.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза представляет собой ксиланазу GH30 подсемейства 8, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 где положения соответствуют положениям SEQ ID NO: 1, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1; и (b) выделение варианта. В одном варианте осуществления исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1. В одном варианте осуществления замену выбирают из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A. Настоящее изобретение дополнительно относится к варианту ксиланазы, полученному описанным в данном документе способом.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 1, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно, по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% SEQ ID NO: 1; и (b) выделение варианта. В одном варианте осуществления замену выбирают из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A. Настоящее изобретение дополнительно относится к варианту ксиланазы, полученному описанным в данном документе способом.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 2, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 2, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 2; и (b) выделение варианта.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 3, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 3, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 3; и (b) выделение варианта.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 4, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 4, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 4; и (b) выделение варианта.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 5, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 5, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 5; и (b) выделение варианта.
В одном варианте осуществления настоящее изобретение относится к способу получения варианта, обладающего ксиланазной активностью и характеризующегося улучшенной термостабильностью по сравнению с исходной ксиланазой, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 6, включающему: (a) введение в исходную ксиланазу замены в одном или нескольких (например, некоторых) положениях, выбранных из группы, состоящей из 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 6, где вариант характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 6; и (b) выделение варианта.
Варианты можно получить с применением любой процедуры мутагенеза, известной из уровня техники, такой как сайт-направленный мутагенез, конструирование синтетических генов, конструирование полусинтетических генов, случайный мутагенез, шаффлинг и т. д.
Сайт-направленный мутагенез представляет собой методику, в которой одну или несколько (например, некоторое количество) мутаций вводят в один или несколько определенных сайтов в полинуклеотиде, кодирующем исходную форму.
Сайт-направленный мутагенез можно проводить in vitro с помощью ПЦР, включающей использование олигонуклеотидных праймеров, содержащих требуемую мутацию. Сайт-направленный мутагенез можно также осуществлять in vitro с помощью кассетного мутагенеза, включающего расщепление рестрикционным ферментом по сайту в плазмиде, содержащей полинуклеотид, кодирующий исходную молекулу, и последующего лигирования олигонуклеотида, содержащего мутацию, в полинуклеотид. Обычно рестрикционный фермент, который расщепляет плазмиду и олигонуклеотид, является одним и тем же, обеспечивая возможность лигирования друг с другом липких концов плазмиды и вставки. См., например, Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76: 4949-4955 и Barton et al., 1990, Nucleic Acids Res. 18: 7349-4966.
Сайт-направленный мутагенез можно проводить также in vivo с помощью способов, известных из уровня техники. См., например, публикацию заявки на патент США № 2004/0171154; Storici et al., 2001, Nature Biotechnol. 19: 773-776; Kren et al., 1998, Nat. Med. 4: 285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43: 15-16.
Согласно настоящему изобретению можно применять любую процедуру сайт-направленного мутагенеза. Доступны многие коммерческие наборы, которые можно использовать для получения вариантов.
Конструирование синтетического гена включает в себя синтез in vitro молекулы полинуклеотида, предназначенной для кодирования представляющего интерес полипептида. Синтез гена можно осуществлять с использованием ряда методик, таких как мультиплексная микрочиповая технология, описанная Tian et al. (2004, Nature 432: 1050-1054), и подобных технологий, где олигонуклеотиды синтезируются и собираются на фотопрограммируемых микропотоковых чипах.
Одну или несколько аминокислотных замен, делеций и/или вставок можно осуществлять и исследовать с помощью известных способов мутагенеза, рекомбинации и/или шаффлинга с последующей соответствующей процедурой скрининга, например, таких, как раскрыты в Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413 или WO 95/22625. Другие способы, которые можно применять, включают ПЦР пониженной точности, фаговый дисплей (например, Lowman et al., 1991, Biochemistry 30: 10832-10837; патент США № 5223409; WO 92/06204) и мутагенез, направленный на участок (Derbyshire et al., 1986, Gene 46: 145; Ner et al., 1988, DNA 7: 127).
Способы мутагенеза/шаффлинга можно объединять со способами автоматизированного скрининга с высокой пропускной способностью для выявления активности клонированных, подвергнутых мутагенезу полипептидов, экспрессируемых клетками-хозяевами (Ness et al., 1999, Nature Biotechnology 17: 893-896). Подвергнутые мутагенезу молекулы ДНК, которые кодируют активные полипептиды, можно извлекать из клеток-хозяев и быстро секвенировать с применением стандартных способов из уровня техники. Такие способы предусматривают возможность быстрого определения важности отдельных аминокислотных остатков в полипептиде.
Конструирование полусинтетического гена проводят с помощью объединения аспектов конструирования синтетических генов, и/или сайт-направленного мутагенеза, и/или случайного мутаганеза, и/или шаффлинга. Полусинтетическая конструкция характеризуется процессом, в котором используются фрагменты полинуклеотида, которые синтезируют в сочетании с методиками ПЦР. Таким образом, определенные области генов можно синтезировать de novo, в то время как другие области можно амплифицировать с использованием сайт-специфических мутагенных праймеров, тогда как остальные области можно подвергнуть ПЦР, допускающей ошибки, или ПЦР, не допускающей ошибки. Затем подпоследовательности полинуклеотидов можно подвергнуть шаффлингу.
Полинуклеотиды
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим вариант по настоящему изобретению.
Конструкции нуклеиновых кислот
Настоящее изобретение относится также к конструкциям на основе нуклеиновой кислоты, содержащим полинуклеотид, кодирующий вариант по настоящему изобретению, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют экспрессией кодирующей последовательности в подходящей клетке-хозяине в условиях, подходящих для регуляторных последовательностей.
С полинуклеотидом можно производить действия с помощью ряда способов с целью обеспечения экспрессии варианта. Манипуляция с полинуклеотидом до его вставки в вектор может быть желательной или необходимой, в зависимости от вектора экспрессии. Методики модификации полинуклеотидов, в которых применяют способы рекомбинантных ДНК, хорошо известны из уровня техники.
Регуляторная последовательность может представлять собой промотор, полинуклеотид, который узнается клеткой-хозяином для экспрессии полинуклеотида. Промотор содержит последовательности, регулирующие транскрипцию, которые опосредуют экспрессию варианта. Промотор может представлять собой любой полинуклеотид, который проявляет транскрипционную активность в клетке-хозяине, в том числе мутантные, усеченные и гибридные промоторы, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды, либо гомологичные, либо гетерологичные по отношению к клетке-хозяину.
Примерами подходящих промоторов для управления транскрипцией конструкций на основе нуклеиновой кислоты по настоящему изобретению в бактериальной клетке-хозяине являются промоторы, полученные из гена альфа-амилазы Bacillus amyloliquefaciens (amyQ), гена альфа-амилазы Bacillus licheniformis (amyL), гена пенициллиназы Bacillus licheniformis (penP), гена мальтогенной амилазы Bacillus stearothermophilus (amyM), гена левансахаразы Bacillus subtilis (sacB), генов xylA и xylB Bacillus subtilis, гена cryIIIA Bacillus thuringiensis (Agaisse and Lereclus, 1994, Molecular Microbiology 13: 97-107), lac-оперона E. coli, trc-промотора E. coli (Egon et al., 1988, Gene 69: 301-315), из гена агаразы Streptomyces coelicolor (dagA) и гена прокариотической бета-лактамазы (Villa-Kamaroff et al., 1978, Proc. Natl. Acad. Sci. USA 75: 3727-3731), а также tac-промотор (DeBoer et al., 1983, Proc. Natl. Acad. Sci. USA 80: 21-25). Дополнительные промоторы описаны в "Useful proteins from recombinant bacteria" в Gilbert et al., 1980, Scientific American 242: 74-94; и в Sambrook et al., 1989, выше. Примеры тандемных промоторов раскрыты в WO 99/43835.
Примеры подходящих промоторов для управления транскрипцией конструкций на основе нуклеиновой кислоты по настоящему изобретению в клетке-хозяине, являющейся клеткой нитчатого гриба, представляют собой промоторы, полученные из генов ацетамидазы Aspergillus nidulans, нейтральной альфа-амилазы Aspergillus niger, кислотостабильной альфа-амилазы Aspergillus niger, глюкоамилазы Aspergillus niger или Aspergillus awamori (glaA), амилазы TAKA Aspergillus oryzae, щелочной протеазы Aspergillus oryzae, триозофосфатизомеразы Aspergillus oryzae, трипсиноподобной протеазы Fusarium oxysporum (WO 96/00787), амилоглюкозидазы Fusarium venenatum (WO 00/56900), Daria Fusarium venenatum (WO 00/56900), Quinn Fusarium venenatum (WO 00/56900), липазы Rhizomucor miehei, аспартатпротеиназы Rhizomucor miehei, бета-глюкозидазы Trichoderma reesei, целлобиогидролазы I Trichoderma reesei, целлобиогидролазы II Trichoderma reesei, эндоглюканазы I Trichoderma reesei, эндоглюканазы II Trichoderma reesei, эндоглюканазы III Trichoderma reesei, эндоглюканазы IV Trichoderma reesei, эндоглюканазы V Trichoderma reesei, ксиланазы I Trichoderma reesei, ксиланазы II Trichoderma reesei, бета-ксилозидазы Trichoderma reesei, а также промотор NA2 tpi (модифицированный промотор из гена нейтральной альфа-амилазы Aspergillus, в котором нетранслируемая лидерная последовательность была заменена на нетранслируемую лидерную последовательность из гена триозофосфатизомеразы Aspergillus; при этом неограничивающие примеры включают в себя модифицированные промоторы из гена нейтральной альфа-амилазы Aspergillus niger, в которых нетранслируемая лидерная последовательность была заменена на нетранслируемую лидерную последовательность из гена триозофосфатизомеразы Aspergillus nidulans или Aspergillus oryzae); а также мутантные, усеченные и гибридные промоторы, полученные из них.
Для дрожжей-хозяев пригодные промоторы получают из генов енолазы Saccharomyces cerevisiae (ENO 1), галактокиназы Saccharomyces cerevisiae (GAL1), алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae (ADH1, ADH2/GAP), триозофосфатизомеразы Saccharomyces cerevisiae (TPI), металлотионеина Saccharomyces cerevisiae (CUP1) и 3-фосфоглицераткиназы Saccharomyces cerevisiae. Другие пригодные промоторы для клеток-хозяев, относящихся к дрожжам, описаны в Romanos et al., 1992, Yeast 8: 423-488.
Регуляторная последовательность может представлять собой также терминатор транскрипции, который распознается клеткой-хозяином с терминацией транскрипции. Терминаторная последовательность функционально связана с 3' концом полинуклеотида, кодирующего вариант. Можно использовать любой терминатор, который функционирует в клетке-хозяине.
Предпочтительные терминаторы для бактериальных клеток-хозяев получают из генов щелочной протеазы Bacillus clausii (aprH), альфа-амилазы Bacillus licheniformis (amyL) и рибосомной РНК Escherichia coli (rrnB).
Предпочтительные терминаторы для клеток-хозяев, относящихся к нитчатым грибам, получают из генов антранилат-синтазы Aspergillus nidulans, глюкоамилазы Aspergillus niger, альфа-глюкозидазы Aspergillus niger, TAKA-амилазы Aspergillus oryzae и трипсиноподобной протеазы Fusarium oxysporum.
Предпочтительные терминаторы для клеток-хозяев, относящихся к дрожжам, получают из генов енолазы Saccharomyces cerevisiae, цитохрома C Saccharomyces cerevisiae (CYC1) и глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae . Другие пригодные терминаторы для клеток-хозяев, относящихся к дрожжам, описаны в Romanos et al., 1992, выше.
Регуляторная последовательность может представлять собой также область, стабилизирующую mRNA, расположенную ниже промотора и выше кодирующей последовательности гена, который повышает экспрессию гена.
Примеры подходящих участков-стабилизаторов mRNA получены из гена cryIIIA Bacillus thuringiensis (WO 94/25612) и гена SP82 Bacillus subtilis (Hue et al., 1995, Journal of Bacteriology 177: 3465-3471).
Регуляторная последовательность может также представлять собой лидерную последовательность, нетранслируемый участок mRNA, важный для трансляции в клетке-хозяине. Лидерная последовательность функционально связана с 5' -концом полинуклеотида, кодирующего вариант. Можно применять любую лидерную последовательность, функционирующую в клетке-хозяине.
Предпочтительные лидерные последовательности для клеток-хозяев, относящихся к нитчатым грибам, получают из генов TAKA-амилазы Aspergillus oryzae и триозофосфат-изомеразы Aspergillus nidulans.
Подходящие лидерные последовательности клеток-хозяев, относящихся к дрожжам, получают из генов енолазы Saccharomyces cerevisiae (ENO 1), 3 фосфоглицераткиназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae и алкогольдегидрогеназы/глицеральдегид-3 фосфатдегидрогеназы Saccharomyces cerevisiae (ADH2/GAP).
Регуляторная последовательность может также представлять собой последовательность полиаденилирования, последовательность, функционально связанную с 3' концом последовательности, кодирующей вариант, и при транскрипции распознается клеткой-хозяином как сигнал к присоединению полиаденозиновых остатков к транскрибируемой mRNA. Можно применять любую последовательность полиаденилирования, функционирующую в клетке-хозяине.
Предпочтительные последовательности полиаденилирования для клеток-хозяев, относящихся к нитчатым грибам, получают из генов антранилатсинтазы Aspergillus nidulans, глюкоамилазы Aspergillus niger, альфа-глюкозидазы Aspergillus niger, амилазы TAKA Aspergillus oryzae и трипсиноподобной протеазы Fusarium oxysporum.
Пригодные последовательности полиаденилирования для клеток-хозяев, относящихся к дрожжам, описаны в Guo and Sherman, 1995, Mol. Cellular Biol. 15: 5983-5990.
Регуляторная последовательность может представлять собой также кодирующий участок сигнального пептида, который кодирует сигнальный пептид, связанный с N концом варианта, и направляет вариант по секреторному пути клетки. 5' конец кодирующей последовательности полинуклеотида может по своей природе содержать последовательность, кодирующую сигнальный пептид, связанную в естественных условиях в трансляционной рамке считывания с сегментом кодирующей последовательности, которая кодирует вариант. В качестве альтернативы 5' конец кодирующей последовательности может содержать последовательность, кодирующую сигнальный пептид, которая является чужеродной по отношению к кодирующей последовательности. Чужеродная последовательность, кодирующая сигнальный пептид, может требоваться в тех случаях, когда кодирующая последовательность в естественных условиях не содержит последовательность, кодирующую сигнальный пептид. В качестве альтернативы чужеродной последовательностью, кодирующей сигнальный пептид, можно просто заменить природную последовательность, кодирующую сигнальный пептид, с целью повышения секреции варианта. Однако можно использовать любую последовательность, кодирующую сигнальный пептид, которая направляет экспрессируемый вариант по секреторному пути в клетке-хозяине.
Эффективные последовательности, кодирующие сигнальный пептид, для бактериальных клеток-хозяев представляют собой последовательности, кодирующие сигнальный пептид, полученные из генов мальтогенной амилазы Bacillus NCIB 11837, субтилизина Bacillus licheniformis, бета-лактамазы Bacillus licheniformis, альфа-амилазы Bacillus stearothermophilus, нейтральных протеаз Bacillus stearothermophilus (nprT, nprS, nprM) и prsA Bacillus subtilis. Дополнительные сигнальные пептиды описаны в Simonen and Palva, 1993, Microbiological Reviews 57: 109-137.
Эффективные последовательности, кодирующие сигнальный пептид, для клеток-хозяев, относящихся к нитчатым грибам, представляют собой последовательности, кодирующие сигнальный пептид, полученные из генов нейтральной амилазы Aspergillus niger, глюкоамилазы Aspergillus niger, амилазы TAKA Aspergillus oryzae, целлюлазы Humicola insolens, эндоглюканазы V Humicola insolens, липазы Humicola lanuginosa и аспартатпротеиназы Rhizomucor miehei.
Пригодные сигнальные пептиды для клеток-хозяев, относящихся к дрожжам, получают из генов альфа-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие пригодные последовательности, кодирующие сигнальный пептид, описаны в Romanos et al., 1992, выше.
Регуляторная последовательность может также представлять собой кодирующую последовательность пропептида, которая кодирует пропептид, расположенный на N конце варианта. Получаемый в результате полипептид известен как профермент или про-полипептид (или, в некоторых случаях, зимоген). Про-полипептид обычно неактивен и может быть превращен в активный полипептид с помощью каталитического или автокаталитического отщепления пропептида от про-полипептида. Последовательность, кодирующую пропептид, можно получить из генов щелочной протеазы Bacillus subtilis (aprE), нейтральной протеазы Bacillus subtilis (nprT), лакказы Myceliophthora thermophila (WO 95/33836), аспарагиновой протеиназы Rhizomucor miehei и альфа-фактора Saccharomyces cerevisiae.
В случае, если присутствуют последовательности как сигнального пептида, так и пропептида, последовательность пропептида расположена рядом с N концом варианта, а последовательность сигнального пептида расположена рядом с N концом последовательности пропептида.
Также может быть желательным добавление регулирующих последовательностей, которые регулируют экспрессию варианта относительно роста клетки-хозяина. Примерами регулирующих систем являются такие системы, которые вызывают включение или выключение экспрессии гена в ответ на химический или физический стимул, в том числе на наличие соединения, осуществляющего регуляцию. Регулирующие системы в прокариотических системах включают в себя системы операторов lac, tac и trp. У дрожжей можно применять систему ADH2 или систему GAL1. У нитчатых грибов можно применять промотор гена глюкоамилазы Aspergillus niger, промотор гена така-альфа-амилазы Aspergillus oryzae и промотор гена глюкоамилазы Aspergillus oryzae. Другими примерами регулирующих последовательностей являются таковые, которые обеспечивают возможность амплификации гена. В эукариотических системах эти регулирующие последовательности предусматривают ген дигидрофолатредуктазы, амплифицируемый в присутствии метотрексата, и гены металлотионеинов, амплифицируемые в присутствии тяжелых металлов. В этих случаях полинуклеотид, кодирующий вариант, будет функционально связан с регулирующей последовательностью.
Векторы экспрессии
Настоящее изобретение также относится к рекомбинантным векторам экспрессии, содержащим полинуклеотид, кодирующий вариант по настоящему изобретению, промотор, а также сигналы остановки транскрипции и трансляции. Различные нуклеотидные и регуляторные последовательности можно объединять вместе с получением рекомбинантного вектора экспрессии, который может включать в себя один или несколько соответствующих сайтов рестрикции для обеспечения возможности вставки или замены полинуклеотида, кодирующего вариант, в таких сайтах. В качестве альтернативы полинуклеотид можно экспрессировать с помощью вставки полинуклеотида или конструкции на основе нуклеиновой кислоты, содержащей полинуклеотид, в подходящий вектор для экспрессии. При создании вектора экспрессии кодирующую последовательность располагают в векторе таким образом, чтобы кодирующая последовательность была функционально связана с подходящими регуляторными последовательностями для экспрессии.
Рекомбинантный вектор экспрессии может представлять собой любой вектор (например, плазмиду или вирус), который можно удобным образом подвергать процедурам рекомбинантной ДНК и который может обеспечивать экспрессию полинуклеотида. Как правило, выбор вектора будет зависеть от совместимости вектора с клеткой-хозяином, в которую должен быть введен вектор. Вектор может представлять собой линейную или замкнутую кольцевую плазмиду.
Вектор может представлять собой автономно реплицирующийся вектор, т. е. вектор, который существует в виде внехромосомного объекта, репликация которого не зависит от хромосомной репликации, например, плазмиду, внехромосомный элемент, мини-хромосому или искусственную хромосому. Вектор может содержать любые средства для обеспечения саморепликации. Альтернативно, при введении в клетку-хозяина вектор может интегрироваться в геном и реплицироваться вместе с хромосомой (хромосомами), в которые он был интегрирован. Более того, можно применять один вектор или плазмиду либо два или более векторов или плазмид, которые в совокупности содержат общую ДНК, которую необходимо ввести в геном клетки-хозяина или транспозон.
Вектор может содержать один или несколько селектируемых маркеров, которые позволяют легко проводить отбор трансформированных, трансфицированных, трансдуцированных или подобных клеток. Селектируемый маркер представляет собой ген, продукт которого обеспечивает устойчивость к биоцидам или вирусам, устойчивость к тяжелым металлам, прототрофность для ауксотрофов и т. п.
Примерами бактериальных селектируемых маркеров являются dal-гены Bacillus licheniformis или Bacillus subtilis, или маркеры, которые придают устойчивость к антибиотикам, такую как устойчивость к ампициллину, хлорамфениколу, канамицину, неомицину, спектиномицину или тетрациклину. Подходящие маркеры для клеток-хозяев, относящихся к дрожжам, включают в себя без ограничения ADE2, HIS3, LEU2, LYS2, MET3, TRP1 и URA3. Селектируемые маркеры для применения в клетке-хозяине, относящейся к нитчатому грибу, предусматривают без ограничения amdS (ацетамидазу), argB (орнитинкарбамоилтрансферазу), bar (фосфинотрицинацетилтрансферазу), hph (гигромицинфосфотрансферазу), niaD (нитратредуктазу), pyrG (оротидин-5' фосфатдекарбоксилазу), sC (сульфатаденилтрансферазу) и trpC (антранилатсинтазу), а также их эквиваленты. Для применения в клетке Aspergillus предпочтительными являются гены amdS и pyrG Aspergillus nidulans или Aspergillus oryzae и ген bar Streptomyces hygroscopicus.
Вектор может содержать элемент(элементы), который(которые) обеспечивает(обеспечивают) интеграцию вектора в геном клетки-хозяина или автономную репликацию вектора в клетке независимо от генома.
Интеграция вектора в геном клетки-хозяина может зависеть от последовательности полинуклеотида, кодирующей вариант, или любого другого элемента вектора для интеграции в геном путем гомологичной или негомологичной рекомбинации. Альтернативно вектор может содержать дополнительные полинуклеотиды для управления интеграцией в геном клетки-хозяина в точном местоположении(местоположениях) в хромосоме(хромосомах) путем гомологичной рекомбинации. Для повышения возможности интеграции в точном местоположении интегрируемые элементы должны содержать достаточное количество нуклеиновых кислот, как например, от 100 до 10000 пар оснований, от 400 до 10000 пар оснований и от 800 до 10000 пар оснований, последовательность которых в высокой степени характеризуется идентичностью соответствующей последовательности-мишени для увеличения вероятности гомологичной рекомбинации. Интегрирующие элементы могут представлять собой любую последовательность, которая является гомологичной последовательности-мишени в геноме клетки-хозяина. Кроме того, интегрируемые элементы могут представлять собой некодирующие или кодирующие полинуклеотиды. С другой стороны, вектор можно интегрировать в геном клетки-хозяина с помощью негомологичной рекомбинации.
Для автономной репликации вектор может дополнительно содержать точку начала репликации, что обеспечивает возможность автономной репликации вектора в рассматриваемой клетке-хозяине. Точка начала репликации может представлять собой любой плазмидный репликатор, опосредующий автономную репликацию, который функционирует в клетке. Термин ʺточка начала репликацииʺ или ʺрепликатор плазмидыʺ означает полинуклеотид, который обеспечивает возможность репликации плазмиды или вектора in vivo.
Примерами бактериальных точек начала репликации являются точки начала репликации плазмид pBR322, pUC19, pACYC177, и pACYC184, обеспечивающие возможность репликации в E. coli, и pUB110, pE194, pTA1060 и  обеспечивающие возможность репликации в Bacillus.
обеспечивающие возможность репликации в Bacillus.
Примеры точек начала репликации для применения в клетке-хозяине, относящейся к дрожжам, представляют собой точки начала репликации 2-микронной плазмиды ARS1, ARS4, комбинацию ARS1 и CEN3 и комбинацию ARS4 и CEN6.
Примерами точек начала репликации, пригодных в клетке нитчатого гриба, являются AMA1 и ANS1 (Gems et al., 1991, Gene 98: 61-67; Cullen et al., 1987, Nucleic Acids Res. 15: 9163-9175; WO 00/24883). Выделение гена AMA1 и конструирование плазмид или векторов, содержащих ген, можно проводить в соответствии со способами, раскрытыми в WO 00/24883.
Для повышения продуцирования варианта в клетку-хозяина можно ввести более чем одну копию полинуклеотида по настоящему изобретению. Увеличения числа копий полинуклеотида можно достичь с помощью интеграции по меньшей мере одной дополнительной копии последовательности в геном клетки-хозяина или с помощью внедрения амплифицируемого селектируемого маркерного гена с полинуклеотидом, причем клетки, содержащие амплифицированные копии селектируемого маркерного гена, и следовательно, дополнительные копии полинуклеотида, можно отбирать с помощью культивирования клеток в присутствии подходящего средства для отбора.
Методики, применяемые для лигирования описанных выше элементов для конструирования рекомбинантных векторов экспрессии по настоящему изобретению, хорошо известны специалисту в данной области техники (см., например, Sambrook et al., 1989, выше).
Клетки-хозяева
Настоящее изобретение также относится к рекомбинантным клеткам-хозяевам, содержащим полинуклеотид, кодирующий вариант по настоящему изобретению, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют продуцированием варианта по настоящему изобретению. Конструкция или вектор, содержащие полинуклеотид, вводят в клетку-хозяина так, чтобы конструкция или вектор сохранялись в виде интегрированного в хромосому элемента или в виде самореплицирующегося внехромосомного вектора, как описано ранее. Термин "клетка-хозяин" охватывает любого потомка исходной клетки, который не является идентичным исходной клетке вследствие мутаций, происходящих в ходе репликации. Выбор клетки-хозяина будет в значительной степени зависеть от гена, кодирующего вариант, и его источника.
Клетка-хозяин может представлять собой любую клетку, пригодную при рекомбинантном получении варианта, например, прокариота или эукариота.
Прокариотическая клетка-хозяин может представлять собой клетку любой грамположительной или грамотрицательной бактерии. Грамположительные бактерии включают без ограничения, Bacillus, Clostridium, Enterococcus, Geobacillus, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus, и Streptomyces. Грамотрицательные бактерии включают без ограничения Campylobacter, E. coli, Flavobacterium, Fusobacterium, Helicobacter, Ilyobacter, Neisseria, Pseudomonas, Salmonella и Ureaplasma.
Бактериальная клетка-хозяин может представлять собой любую клетку Bacillus, в том числе без ограничения клетки Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis и Bacillus thuringiensis.
Бактериальная клетка-хозяин может представлять собой также любую клетку Streptococcus, в том числе без ограничения клетки Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis и Streptococcus equi подвида Zooepidemicus.
Бактериальная клетка-хозяин может также представлять собой любую клетку Streptomyces, в том числе без ограничения клетки Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus и Streptomyces lividans.
Введение ДНК в клетку Bacillus можно осуществлять посредством трансформации протопластов (см., например, Chang and Cohen, 1979, Mol. Gen. Genet. 168: 111-115), трансформации компетентных клеток (см., например, Young and Spizizen, 1961, J. Bacteriol. 81: 823-829 или Dubnau and Davidoff-Abelson, 1971, J. Mol. Biol. 56: 209-221), электропорации (см., например, Shigekawa and Dower, 1988, Biotechniques 6: 742-751) или конъюгации (см., например, Koehler and Thorne, 1987, J. Bacteriol. 169: 5271-5278). Введение ДНК в клетку E. coli можно осуществлять посредством трансформации протопластов (см., например, Hanahan, 1983, J. Mol. Biol. 166: 557-580) или электропорации (см., например, Dower et al., 1988, Nucleic Acids Res. 16: 6127-6145). Введение ДНК в клетку Streptomyces можно осуществлять посредством трансформации протопластов, электропорации (см., например, Gong et al., 2004, Folia Microbiol. (Praha) 49: 399-405), конъюгации (см., например, Mazodier et al., 1989, J. Bacteriol. 171: 3583-3585) или трансдукции (см., например, Burke et al., 2001, Proc. Natl. Acad. Sci. USA 98: 6289-6294). Введение ДНК в клетку Pseudomonas можно осуществлять посредством электропорации (см., например, Choi et al., 2006, J. Microbiol. Methods 64: 391-397), или конъюгации (см., например, Pinedo and Smets, 2005, Appl. Environ. Microbiol. 71: 51-57). Введение ДНК в клетку Streptococcus можно осуществлять посредством естественной компетентности (см., например, Perry and Kuramitsu, 1981, Infect. Immun. 32: 1295-1297), трансформации протопластов (см., например, Catt and Jollick, 1991, Microbios 68: 189-207), электропорации (см., например, Buckley et al., 1999, Appl. Environ. Microbiol. 65: 3800-3804) или конъюгации (см., например, Clewell, 1981, Microbiol. Rev. 45: 409-436). Тем не менее, можно применять любой известный из уровня техники способ введения ДНК в клетку-хозяина.
Клетка-хозяин может также быть эукариотической клеткой, такой как клетка млекопитающего, насекомого, растения или гриба.
Клетка-хозяин может представлять собой клетку гриба. ʺГрибыʺ, как применяется в данном документе, включают отделы Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota, а также Oomycota и все митоспоровые грибы (как определено Hawksworth et al. в Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK).
Клетка-хозяин, относящаяся к грибам, может представлять собой клетку, относящуюся к дрожжам. ʺДрожжиʺ, при применении в данном документе, включают аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, принадлежащие к несовершенным грибам (бластомицеты). Поскольку классификация дрожжей в будущем может измениться, в контексте настоящего изобретения дрожжи следует определять согласно описанному в Biology and Activities of Yeast (Skinner, Passmore, and Davenport, editors, Soc. App. Bacteriol. Symposium Series No. 9, 1980).
Клетка-хозяин, относящаяся к дрожжам, может представлять собой клетку Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia, как, например, клетку Kluyveromyces lactis, Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis, Saccharomyces oviformis или Yarrowia lipolytica.
Клетка-хозяин, относящаяся к грибам, может представлять собой клетку нитчатого гриба. ʺНитчатые грибыʺ включают все нитчатые формы подотделов Eumycota и Oomycota (как определено Hawksworth et al., 1995, выше). Нитчатые грибы, как правило, характеризуются клеточной стенкой мицелия, состоящей из хитина, целлюлозы, глюкана, хитозана, маннана и других сложных полисахаридов. Вегетативный рост происходит посредством удлинения гиф, а катаболизм углерода является облигатно-аэробным. Напротив, вегетативный рост дрожжей, таких как Saccharomyces cerevisiae, происходит посредством почкования одноклеточного таллома, а катаболизм углерода может быть ферментативным.
Клетка-хозяин, относящаяся к нитчатым грибам, может представлять собой клетку Acremonium, Aspergillus, Aureobasidium, Bjerkandera, Ceriporiopsis, Chrysosporium, Coprinus, Coriolus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Phlebia, Piromyces, Pleurotus, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes, или Trichoderma.
Например, клетка-хозяин, относящаяся к нитчатым грибам, может представлять собой клетку Aspergillus awamori, Aspergillus foetidus, Aspergillus fumigatus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Bjerkandera adusta, Ceriporiopsis aneirina, Ceriporiopsis caregiea, Ceriporiopsis gilvescens, Ceriporiopsis pannocinta, Ceriporiopsis rivulosa, Ceriporiopsis subrufa, Ceriporiopsis subvermispora, Chrysosporium inops, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium merdarium, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium tropicum, Chrysosporium zonatum, Coprinus cinereus, Coriolus hirsutus, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Phlebia radiata, Pleurotus eryngii, Thielavia terrestris, Trametes villosa, Trametes versicolor, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei, или Trichoderma viride.
Клетки, относящиеся к грибам, можно трансформировать с помощью способа, предусматривающего образование протопластов, трансформацию протопластов и регенерацию клеточной стенки способом, известным per se. Подходящие процедуры для трансформации клеток-хозяев Aspergillus и Trichoderma описаны в EP 238023, Yelton et al., 1984, Proc. Natl. Acad. Sci. USA 81: 1470-1474, и Christensen et al., 1988, Bio/Technology 6: 1419-1422. Подходящие способы трансформации видов Fusarium описаны в Malardier et al., 1989, Gene 78: 147-156 и WO 96/00787. Дрожжи можно трансформировать с применением методик, описанных Becker and Guarente, в Abelson, J.N. and Simon, M.I., editors, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp 182-187, Academic Press, Inc., New York; Ito et al., 1983, J. Bacteriol. 153: 163; и Hinnen et al., 1978, Proc. Natl. Acad. Sci. USA 75: 1920.
Способы получения
Настоящее изобретение относится также к способам получения варианта, включающим: (a) культивирование клетки-хозяина по настоящему изобретению в условиях, подходящих для экспрессии варианта, и (b) выделение варианта.
Клетки-хозяева культивируют в питательной среде, подходящей для продуцирования варианта, с использованием способов, известных из уровня техники. Например, клетку можно культивировать с помощью культивирования во встряхиваемой колбе или при мелкомасштабной или крупномасштабной ферментации (в том числе непрерывной, периодической, подпитываемой или твердофазной ферментации) в лабораторных или промышленных ферментерах, осуществляемой в подходящей среде и в условиях, обеспечивающих возможность экспрессии и/или выделения варианта. Культивирование осуществляют в подходящей питательной среде, содержащей источники углерода и азота, а также неорганические соли, с применением процедур, известных из уровня техники. Подходящие среды доступны от коммерческих поставщиков или могут быть получены в соответствии с опубликованными композициями (например, в каталогах Американской коллекции типовых культур). Если вариант секретируется в питательную среду, то вариант можно извлечь непосредственно из среды. Если вариант не секретируется, то его можно извлечь из клеточных лизатов.
Вариант можно выявить с использованием способов, известных из уровня техники, которые являются специфическими для вариантов. Данные способы выявления включают без ограничения применение специфических антител, образование продукта ферментативной реакции или исчезновение субстрата фермента. Например, для определения активности варианта можно использовать ферментный анализ.
Вариант можно извлечь с использованием способов, известных из уровня техники. Например, вариант можно извлечь из питательной среды с помощью общепринятых процедур, в том числе без ограничения сбора, центрифугирования, фильтрования, экстракции, распылительной сушки, выпаривания или осаждения.
Вариант можно очистить с помощью ряда процедур, известных из уровня техники, в том числе без ограничения хроматографии (например, ионообменной, аффинной, гидрофобной хроматографии, хроматофокусирования и гель-хроматографии), электрофоретических процедур (например, препаративного изоэлектрического фокусирования), дифференциальной растворимости (например, осаждения сульфатом аммония), SDS PAGE или экстракции (см, например, Protein Purification, Janson and Ryden, editors, VCH Publishers, New York, 1989) с получением практически чистых вариантов.
В альтернативном аспекте вариант не извлекают, а вместо этого используют в качестве источника варианта клетку-хозяина по настоящему изобретению, экспрессирующую вариант.
Составы ферментационного бульона или клеточные композиции
Настоящее изобретение также относится к составу ферментационного бульона или клеточным композициям, содержащим полипептид по настоящему изобретению. Продукт в виде ферментационного бульона дополнительно содержит дополнительные ингредиенты, применяемые в процессе ферментации, такие как, например, клетки (в том числе клетки-хозяева, содержащие ген, кодирующий полипептид по настоящему изобретению, которые применяют для получения полипептида, представляющего интерес), клеточный дебрис, биомассу, ферментационную среду и/или продукты ферментации. В некоторых вариантах осуществления композиция представляет собой цельный бульон с погибшими клетками, содержащий органическую кислоту(кислоты), погибшие клетки и/или клеточный дебрис и среду культуры.
Термин "ферментационный бульон", применяемый в данном документе, относится к препарату, получаемому посредством клеточной ферментации, который не подвергается или подвергается минимальному извлечению и/или очистке. Например, ферментационные бульоны получают, когда микробные культуры выращивают до насыщения, инкубируют в углерод-ограничивающих условиях для обеспечения синтеза белка (например, экспрессии ферментов клетками-хозяевами) и секреции в среду культуры клеток. Ферментационный бульон может содержать нефракционированные или фракционированные составляющие ферментационных материалов, образованных в конце ферментации. Как правило, ферментационный бульон является нефракционированным и содержит истощенную среду культуры и клеточный дебрис, присутствующий после удаления микробных клеток (например, клеток нитчатых грибов), например, посредством центрифугирования. В некоторых вариантах осуществления ферментационный бульон содержит истощенную среду культуры клеток, внеклеточные ферменты и жизнеспособные и/или нежизнеспособные микробные клетки.
В одном варианте осуществления состав ферментационного бульона и клеточные композиции содержат первый компонент на основе органической кислоты, содержащий по меньшей мере одну органическую кислоту с 1-5 атомами углерода и/или ее соль, и второй компонент на основе органической кислоты, содержащий по меньшей мере одну органическую кислоту с 6 или более атомами углерода и/или ее соль. В конкретном варианте осуществления первый компонент на основе органической кислоты представляет собой уксусную кислоту, муравьиную кислоту, пропионовую кислоту, их соль или смесь двух или более из приведенных выше кислот, и второй компонент на основе органической кислоты представляет собой бензойную кислоту, циклогексанкарбоновую кислоту, 4 метилвалериановую кислоту, фенилуксусную кислоту, их соль или смесь двух или более из приведенных выше кислот.
В одном аспекте композиция содержит органическую кислоту(кислоты) и необязательно дополнительно содержит погибшие клетки и/или клеточный дебрис. В одном варианте осуществления погибшие клетки и/или клеточный дебрис удаляют из цельного бульона с погибшими клетками с получением композиции, которая не содержит данные компоненты.
Составы ферментационного бульона или клеточные композиции могут дополнительно содержать консервант и/или противомикробное средство (например, бактериостатическое средство), в том числе без ограничения сорбит, хлорид натрия, сорбат калия и другие, известные из уровня техники.
Цельный бульон с погибшими клетками или композиция могут содержать нефракционированные составляющие ферментационных материалов, образованных в конце ферментации. Как правило, цельный бульон с погибшими клетками или композиция содержат истощенную среду культуры и клеточный дебрис, присутствующие после выращивания до насыщения микробных клеток (например, клеток нитчатых грибов), инкубированных в углерод-ограничивающих условиях с обеспечением синтеза белка. В некоторых вариантах осуществления цельный бульон с погибшими клетками или композиции содержат истощенную среду культуры клеток, внеклеточные ферменты и погибшие клетки нитчатых грибов. В некоторых вариантах осуществления микробные клетки, присутствующие в цельном бульоне с погибшими клетками или композиции, могут быть пермеабилизированы и/или лизированы с применением способов, известных из уровня техники.
Цельный бульон или клеточная композиция, описанные в данном документе, обычно представляют собой жидкость, но могут содержать нерастворимые компоненты, такие как погибшие клетки, клеточный дебрис, компоненты среды культуры и/или нерастворимый(нерастворимые) фермент(ферменты). В некоторых вариантах осуществления нерастворимые компоненты можно удалять с получением осветленной жидкой композиции.
Составы на основе цельного бульона и клеточные композиции по настоящему изобретению могут быть получены посредством способа, описанного в WO 90/15861 или WO 2010/096673.
Композиции на основе ферментов
Настоящее изобретение также относится к композициям, содержащим полипептид по настоящему изобретению. Предпочтительно композиции обогащены полипептидом по настоящему изобретению. Термин ʺобогащенныйʺ указывает, что ксиланазная активность композиции была увеличена, например, с коэффициентом обогащения по меньшей мере 1,1, например, по меньшей мере 1,2, по меньшей мере 1,3, по меньшей мере 1,4, по меньшей мере 1,5, по меньшей мере 2,0, по меньшей мере 3,0, по меньшей мере 4,0, по меньшей мере 5,0, по меньшей мере 10.
В одном варианте осуществления композиция содержит полипептид по настоящему изобретению и одно или несколько средств для составления, как описано ниже.
Композиции могут дополнительно предусматривать множество ферментативных активностей, например, один или несколько (например, некоторое количество) ферментов, выбранных из группы, состоящей из ацетилксиланэстеразы, ацилглицероллипазы, амилазы, альфа-амилазы, бета-амилазы, арабинофуранозидазы, целлобиогидролазы, целлюлазы, ферулоилэстеразы, галактаназы, альфа-галактозидазы, бета-галактозидазы, бета-глюканазы, бета-глюкозидазы, глюкан-1,4-а-глюкозидазы, глюкан-1,4-альфа-мальтогидролазы, глюкан-1,4-а-глюкозидазы, глюкан-1,4-альфа-мальтогидролазы, лизофосфолипазы, лизоцима, альфа-маннозидазы, бета-маннозидазы (маннаназы), фитазы, фосфолипазы А1, фосфолипазы А2, фосфолипазы D, протеазы, пуллуланазы, пектинэстеразы, триацилглицеринлипазы, ксиланазы, бета-ксилозидазы или любой их комбинации.
Композиции могут дополнительно содержать один или несколько микроорганизмов. В одном варианте осуществления микроорганизм выбран из группы, состоящей из Bacillus subtilis, Bacillus licheniformis, Bacillus amyloliquefaciens, Bacillus cereus, Bacillus pumilus, Bacillus polymyxa, Bacillus megaterium, Bacillus coagulans, Bacillus circulans, Bifidobacterium bifidum, Bifidobacterium animalis, Bifidobacterium sp., Carnobacterium sp., Clostridium butyricum, Clostridium sp., Enterococcus faecium, Enterococcus sp., Lactobacillus sp., Lactobacillus acidophilus, Lactobacillus farciminus, Lactobacillus rhamnosus, Lactobacillus reuteri, Lactobacillus salivarius, Lactococcus lactis, Lactococcus sp., Leuconostoc sp., Megasphaera elsdenii, Megasphaera sp., Pediococsus acidilactici, Pediococcus sp., Propionibacterium thoenii, Propionibacterium sp. и Streptococcus sp. или любой их комбинации.
В одном варианте осуществления композиция содержит одно или несколько средств для составления, как раскрыто в данном документе, предпочтительно одно или несколько соединений, выбранных из перечня, состоящего из глицерина, этиленгликоля, 1,2-пропиленгликоля или 1,3-пропиленгликоля, хлорида натрия, бензоата натрия, сорбата калия, сульфата натрия, сульфата калия, сульфата магния, тиосульфата натрия, карбоната кальция, цитрата натрия, декстрина, глюкозы, сахарозы, сорбита, лактозы, крахмала, каолина и целлюлозы.
В одном варианте осуществления композиция содержит один или несколько компонентов, выбранных из перечня, состоящего из витаминов, минералов и аминокислот.
В одном варианте осуществления композиция содержит материал на растительной основе, полученный из подсемейства Panicoideae, как раскрыто в данном документе, предпочтительно маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское, или представленный в обработанной форме, такой как молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское или любую их комбинацию.
Состав
Фермент по настоящему изобретению можно составить в виде жидкости или твердого вещества. Для жидкого состава средство для составления может предусматривать полиол (такой как, например, глицерин, этиленгликоль или пропиленгликоль), соль (такую как, например, хлорид натрия, бензоат натрия, сорбат калия) или сахар или производное сахара (такое как, например, декстрин, глюкоза, сахароза и сорбит). Таким образом, в одном варианте осуществления композиция представляет собой жидкую композицию, содержащую полипептид по настоящему изобретению и один или несколько средств для составления, выбранных из перечня, состоящего из глицерина, этиленгликоля, 1,2-пропиленгликоля, 1,3-пропиленгликоля, хлорида натрия, бензоата натрия, сорбата калия, декстрина, глюкозы, сахарозы и сорбита. Жидкий состав можно распылять на корм после его гранулирования или можно добавлять в питьевую воду, подаваемую животным.
Для твердого состава настоящий состав может быть, например, в виде гранул, высушенного распылением порошка или агломерата (например, как раскрыто в WO 2000/70034). Средство для составления может содержать соль (органические или неорганические соли цинка, натрия, калия или кальция, такие как, например, ацетат кальция, бензоат кальция, карбонат кальция, хлорид кальция, цитрат кальция, сорбат кальция, сульфат кальция, ацетат калия, бензоат калия, карбонат калия, хлорид калия, цитрат калия, сорбат калия, сульфат калия, ацетат натрия, бензоат натрия, карбонат натрия, хлорид натрия, цитрат натрия, сульфат натрия, ацетат цинка, бензоат цинка, карбонат цинка, хлорид цинка, цитрат цинка, сорбат цинка, сульфат цинка), крахмал или сахар или производное сахара (такое как, например, сахароза, декстрин, глюкоза, лактоза, сорбит).
В одном варианте осуществления композиция представляет собой твердую композицию, такую как высушенная распылением композиция, содержащая ксиланазу по настоящему изобретению и одно или несколько средств для составления, выбранных из перечня, состоящего из хлорида натрия, бензоата натрия, сорбата калия, сульфата натрия, сульфата калия, сульфата магния, тиосульфата натрия, карбоната кальция, цитрата натрия, декстрина, глюкозы, сахарозы, сорбита, лактозы, крахмала и целлюлозы. В предпочтительном варианте осуществления средство для составления выбрано из одного или нескольких следующих соединений: сульфата натрия, декстрина, целлюлозы, тиосульфата натрия, сульфата магния и карбоната кальция.
Настоящее изобретение также относится к ферментным гранулам/частицам, содержащим ксиланазу по настоящему изобретению, необязательно в комбинации с одним или несколькими дополнительными ферментами. Гранула состоит из ядра и необязательно одного или нескольких покрытий (наружных слоев), окружающих ядро.
Обычно размер гранулы/частицы, измеренный как эквивалентный сферический диаметр (средний размер частиц на основе объема) гранулы, составляет 20-2000 мкм, в частности, 50-1500 мкм, 100-1500 мкм или 250-1200 мкм.
Ядро можно получить путем гранулирования смеси ингредиентов, например, способом, включающим такие методы грануляции, как кристаллизация, осаждение, дражирование, нанесение покрытия в псевдоожиженном слое, агломерация в псевдоожиженном слое, роторное распыление, экструзия, приллирование, сферонизация, способы уменьшения размера, барабанная грануляция и/или грануляция с высоким сдвигом.
Способы получения ядра можно найти в Handbook of Powder Technology; Particle size enlargement, C. E. Capes; Volume 1; 1980; Elsevier. Способы получения включают известные технологии составления корма и гранул, например, следующие.
a) Высушенные распылением продукты, где жидкий раствор, содержащий фермент, распыляют в распылительной сушильной башне с образованием небольших капель, которые во время своего движения вниз по сушильной башне высыхают с образованием ферментсодержащего материала в виде частиц.
b) Слоистые продукты, где фермент наносят в виде слоя вокруг предварительно сформированной инертной частицы ядра, причем ферментсодержащий раствор распыляют, как правило, в аппарате с псевдоожиженным слоем, где предварительно сформированные частицы ядра псевдоожижают, и ферментсодержащий раствор прилипает к частицам ядра и высыхает, оставляя слой сухого фермента на поверхности частицы ядра. Частицы желаемого размера можно получить таким образом, если можно будет найти пригодные частицы ядра желаемого размера. Этот тип продукта описан, например, в WO 97/23606.
c) Частицы ядра с абсорбированием, где вместо нанесения фермента в виде слоя вокруг ядра данный фермент абсорбируют на поверхности ядра и/или в ней. Такой способ описан в WO 97/39116.
d) Экструдированные или гранулированные продукты, где ферментсодержащую пасту прессуют в гранулы или под давлением экструдируют через небольшое отверстие и нарезают на частицы, которые впоследствии высушивают. Такие частицы обычно имеют значительный размер, поскольку материал, в котором проделано экструзионное отверстие (обычно пластина с высверленными отверстиями), устанавливает предел допустимого перепада давления в экструзионном отверстии. Кроме того, очень высокие значения давления экструзии при использовании небольшого отверстия увеличивают выделение тепла в ферментной пасте, которое вредит ферменту.
e) Приллированные продукты, где ферментсодержащий порошок суспендируют в расплавленном воске и суспензию распыляют, например, через распылитель с вращающимся диском, в охлаждающую камеру, где капли быстро затвердевают (Michael S. Showell (editor); Powdered detergents; Surfactant Science Series; 1998; vol. 71; p. 140-142; Marcel Dekker). Полученный продукт представляет собой продукт, в котором фермент равномерно распределен по инертному материалу, а не концентрируется на его поверхности. Также US 4016040 и US 4713245 представляют собой документы, относящиеся к этой методике.
f) Продукты грануляции в смесителе, где жидкость добавляют к композиции в виде сухого порошка, например, из традиционных компонентов гранулирования, причем фермент вводят либо с жидкостью, либо с порошком, либо и то и другое. Жидкость и порошок смешивают, и, когда влага жидкости абсорбируется в сухом порошке, компоненты сухого порошка начинают прилипать и агломерировать, и частицы будут накапливаться с образованием гранул, содержащих фермент. Такой способ описан в US 4106991 и родственных документах EP 170360, EP 304332, EP 304331, WO 90/09440 и WO 90/09428. В конкретном продукте данного способа, где различные смесители с высоким усилием сдвига можно применять в качестве грануляторов, грануляты, состоящие из фермента в виде фермента, наполнителей и связующих веществ и т.д., смешивают с целлюлозными волокнами для укрепления частиц с получением так называемого Т-гранулята. Укрепленные частицы, будучи более прочными, выделяют меньше ферментационной пыли.
g) Уменьшение размера, где ядра получают измельчением или дроблением более крупных частиц, гранул, таблеток, брикетов и т. д., содержащих фермент. Требуемую фракцию частиц ядра получают путем просеивания измельченного или дробленого продукта. Частицы с избыточным или меньшим размером можно переработать. Уменьшение размера описано в (Martin Rhodes (editor); Principles of Powder Technology; 1990; Chapter 10; John Wiley & Sons).
h) Грануляция в псевдоожиженном слое, которая включает суспендирование частиц в воздушном потоке и распыление жидкости на псевдоожиженные частицы через форсунки. Частицы, попавшие под капельки спрея, смачиваются и становятся липкими. Липкие частицы сталкиваются с другими частицами и прилипают к ним и образуют гранулу.
I) Ядра можно подвергнуть сушке, например, в сушилке с псевдоожиженным слоем. Специалист в данной области может применять другие известные в производстве кормов или поверхностно-активных средств способы сушки гранул. Сушка предпочтительно происходит при температуре продукта от 25 до 90°С. Для некоторых ферментов важно, чтобы ядра, содержащие фермент, содержали небольшое количество воды перед нанесением покрытия. Если чувствительные к воде ферменты наносят до того, как излишек воды будет удален, они будут захватываться внутри ядра, и это может отрицательно повлиять на активность фермента. После сушки ядра предпочтительно содержат 0,1-10 вес./вес. % воды.
Ядро может включать в себя дополнительные материалы, такие как наполнители, волокнистые материалы (целлюлозные или синтетические волокна), стабилизирующие средства, солюбилизирующие средства, суспендирующие средства, средства, регулирующие вязкость, легкие сферы, пластификаторы, соли, смазочные вещества и ароматизаторы.
Ядро может содержать связывающее средство, такое как синтетический полимер, воск, жир или углевод.
Ядро может содержать соль поливалентного катиона, восстановитель, антиоксидант, катализатор разложения пероксида и/или кислотный буферный компонент, обычно в виде гомогенной смеси.
В одном варианте осуществления ядро содержит материал, выбранный из группы, состоящей из солей (таких как ацетат кальция, бензоат кальция, карбонат кальция, хлорид кальция, цитрат кальция, сорбат кальция, сульфат кальция, ацетат калия, бензоат калия, карбонат калия, хлорид калия, цитрат калия, сорбат калия, сульфат калия, ацетат натрия, бензоат натрия, карбонат натрия, хлорид натрия, цитрат натрия, сульфат натрия, ацетат цинка, бензоат цинка, карбонат цинка, хлорид цинка, цитрат цинка, сорбат цинка, сульфат цинка), крахмала или сахара или производного сахара (такого как, например, сахароза, декстрин, глюкоза, лактоза, сорбит), малых органических молекул, крахмала, муки, целлюлозы, и минералов, и глинистых минералов (также известных как гидратированные филлосиликаты алюминия). В одном варианте осуществления ядро содержит глинистый минерал, такой как каолинит или каолин.
Ядро может включать инертную частицу с ферментом, абсорбированным в ней или нанесенным на поверхность, например, с помощью нанесения покрытия в псевдоожиженном слое.
Ядро может иметь диаметр 20-2000 мкм, в частности, 50-1500 мкм, 100-1500 мкм или 250-1200 мкм.
Ядро может быть окружено по меньшей мере одним покрытием, например, для улучшения стабильности при хранении, для уменьшения образования пыли во время обработки или для окрашивания гранулы. Необязательное(необязательные) покрытие(покрытия) может(могут) включать покрытие из соли, и/или воска, и/или муки или другие подходящие материалы для покрытия.
Покрытие можно нанести в количестве, составляющем по меньшей мере 0,1% от массы ядра, например, по меньшей мере 0,5%, 1% или 5%. Количество может составлять не более 100%, 70%, 50%, 40% или 30%.
Толщина покрытия предпочтительно составляет по меньшей мере 0,1 мкм, в частности, по меньшей мере 0,5 мкм, по меньшей мере 1 мкм или по меньшей мере 5 мкм. В некоторых вариантах осуществления толщина покрытия составляет менее 100 мкм, например, менее 60 мкм или менее 40 мкм.
Покрытие должно инкапсулировать область ядра, образуя практически непрерывный слой. Выражение ʺпрактически непрерывный слойʺ следует понимать как покрытие, имеющее мало или не имеющее отверстий, так что область ядра инкапсулирована или заключена в оболочку с малым количеством или без непокрытых участков. Слой или покрытие должны быть, в частности, однородными по толщине.
Покрытие может дополнительно содержать другие материалы, известные в данной области техники, например, наполнители, средства, уменьшающие липкость, пигменты, красители, пластификаторы и/или связывающие средства, такие как диоксид титана, каолин, карбонат кальция или тальк.
Солевое покрытие может содержать по меньшей мере 60% соли по весу, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% по весу.
Соль можно добавлять из раствора соли, где соль полностью растворена, или из суспензии соли, где мелкие частицы имеют размер менее 50 мкм, например, менее 10 мкм или менее 5 мкм.
Соляное покрытие может содержать одну соль или смесь двух или более солей. Соль может быть растворимой в воде, в частности, иметь растворимость по меньшей мере 0,1 г в 100 г воды при 20°С, предпочтительно по меньшей мере 0,5 г на 100 г воды, например, по меньшей мере 1 г на 100 г воды, например, по меньшей мере 5 г на 100 г воды.
Соль может представлять собой неорганическую соль, например, соли сульфата, сульфита, фосфата, фосфоната, нитрата, хлорида или карбоната, или соли простых органических кислот (менее 10 атомов углерода, например, 6 или менее атомов углерода), таких как цитрат, малонат или ацетат. Примерами катионов в этих солях являются ионы щелочных или щелочно-земельных металлов, ион аммония или ионы первого ряда переходных металлов, таких как натрий, калий, магний, кальций, цинк или алюминий. Примеры анионов включают хлорид, бромид, йодид, сульфат, сульфит, бисульфит, тиосульфат, фосфат, одноосновный фосфат, двухосновный фосфат, гипофосфит, дигидропирофосфат, тетраборат, борат, карбонат, бикарбонат, метасиликат, цитрат, малат, малеат, малонат, сукцинат, сорбат, лактат, формиат, ацетат, бутират, пропионат, бензоат, тартрат, аскорбат или глюконат. В частности, можно использовать соли сульфата, сульфита, фосфата, фосфоната, нитрата, хлорида или карбоната щелочных или щелочно-земельных металлов или соли простых органических кислот, такие как цитрат, малонат или ацетат.
Соль в покрытии может иметь постоянную влажность при 20°С выше 60%, в частности, выше 70%, выше 80% или выше 85%, или это может быть другая гидратная форма такой соли (например, ангидрат). Солевое покрытие может быть таким, как описано в WO1997/05245, WO1998/54980, WO1998/55599, WO2000/70034, WO2006/034710, WO2008/017661, WO2008/017659, WO2000/020569, WO2001/004279, WO1997/05245, WO2000/01793, WO2003/059086, WO2003/059087, WO2007/031483, WO2007/031485, WO2007/044968, WO2013/192043, WO2014/014647 и WO2015/197719, или полимерным покрытием, как описано в WO 2001/00042.
Конкретными примерами подходящих солей являются NaCl (CH20°C=76%), Na2CO3 (CH20°C=92%), NaNO3 (CH20°C=73%), Na2HPO4 (CH20°C=95%), Na3PO4 (CH25°C=92%), NH4Cl (CH20°C=79,5%), (NH4)2HPO4 (CH20°C=93,0%), NH4H2PO4 (CH20°C=93,1%), (NH4)2SO4 (CH20°C=81,1%), KCl (CH20°C=85%), K2HPO4 (CH20°C=92%), KH2PO4 (CH20°C=96,5%), KNO3 (CH20°C=93,5%), Na2SO4 (CH20°C=93%), K2SO4 (CH20°C=98%), KHSO4 (CH20°C=86%), MgSO4 (CH20°C=90%), ZnSO4 (CH20°C=90%) и цитрат натрия (CH25°C=86%). Другие примеры включают NaH2PO4, (NH4) H2PO4, CuSO4, Mg(NO3)2, ацетат магния, ацетат кальция, бензоат кальция, карбонат кальция, хлорид кальция, цитрат кальция, сорбат кальция, сульфат кальция, ацетат калия, бензоат калия, карбонат калия, хлорид калия, цитрат калия, сорбат калия, ацетат натрия, бензоат натрия, цитрат натрия, сульфат натрия, ацетат цинка, бензоат цинка, карбонат цинка, хлорид цинка, цитрат цинка и сорбат цинка.
Соль может быть в безводной форме, или она может представлять собой гидратированную соль, т. е. кристаллический гидрат соли со связанной(связанными) молекулой(молекулами) воды кристаллизации, как описано в WO 99/32595. Конкретные примеры включают безводный сульфат натрия (Na2SO4), безводный сульфат магния (MgSO4), гептагидрат сульфата магния (MgSO4.7H2O), гептагидрат сульфата цинка (ZnSO4.7H2O), двухосновный гептагидрат фосфата натрия (Na2HPO4.7H2O), гексагидрат нитрата магния (Mg(NO3)2(6H2O)), дигидрат цитрата натрия и тетрагидрат ацетата магния.
Предпочтительно соль наносят в виде раствора соли, например, с применением псевдоожиженного слоя.
Восковое покрытие может содержать по меньшей мере 60% воска по весу, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% по весу.
Конкретными примерами восков являются полиэтиленгликоли; полипропилены; карнаубский воск; канделильский воск; пчелиный воск; гидрогенизированное растительное масло или животный жир, такие как полиэтиленгликоль (PEG), метилгидроксипропилцеллюлоза (MHPC), поливиниловый спирт (PVA), гидрогенизированный говяжий жир, гидрогенизированное пальмовое масло, гидрогенизированное масло семян хлопка и/или гидрогенизированное масло соевых бобов; спирты жирных кислот; моноглицериды и/или диглицериды, такие как глицерилстеарат, где стеарат представляет собой смесь стеариновой и пальмитиновой кислот; микрокристаллический воск; парафины и жирные кислоты, такие как гидрогенизированные линейные длинноцепочечные жирные кислоты, и их производные. Предпочтительным воском является пальмовое масло или гидрогенизированное пальмовое масло.
Гранула может содержать ядро, содержащее ксиланазу по настоящему изобретению, одно или несколько солевых покрытий и одно или несколько восковых покрытий. Примеры ферментных гранул с несколькими покрытиями показаны в WO1993/07263, WO1997/23606 и WO2016/149636.
Непылящие грануляты можно получить, например, как раскрыто в патентах США №№ 4106991 и 4661452, и их можно необязательно покрывать с применением способов, известных из уровня техники. Покрывающие материалы могут быть восковыми покрывающими материалами и пленкообразующими покрывающими материалами. Примерами восковых покрывающих материалов являются поли(этиленоксидные) продукты (полиэтиленгликоль, PEG) со средними значениями молярного веса 1000-20000; этоксилированные нонилфенолы, содержащие 16-50 этиленоксидных звеньев; этоксилированные жирные спирты, в которых спирт содержит от 12 до 20 атомов углерода и в которых присутствует от 15 до 80 этиленоксидных звеньев; жирные спирты; жирные кислоты; а также моно-, и ди-, и триглицериды жирных кислот. Примеры пленкообразующих покрывающих материалов, подходящих для нанесения с помощью методик с использованием псевдоожиженного слоя, приведены в GB 1483591.
Грануляты могут дополнительно содержать один или несколько дополнительных ферментов. Каждый фермент будет в таком случае присутствовать в большем количестве гранул, обеспечивая более равномерное распределение ферментов, а также уменьшать физическую сегрегацию разных ферментов из-за различных размеров частиц. Способы получения многоферментных комбинированных гранулятов раскрыты в раскрытии ip.com IPCOM000200739D.
Другой пример составления ферментов с применением комбинированных гранулятов раскрыт в WO 2013/188331.
Настоящее изобретение также относится к защищенным ферментам, полученным в соответствии со способом, раскрытым в EP 238216.
Таким образом, в дополнительном аспекте настоящее изобретение предусматривает гранулу, которая содержит:
(a) ядро, содержащее ксиланазу по настоящему изобретению, и
(b) покрытие, состоящее из одного или нескольких слоев, окружающих ядро.
В одном варианте осуществления покрытие предусматривает солевое покрытие, описанное в данном документе. В одном варианте осуществления покрытие предусматривает восковое покрытие, описанное в данном документе. В одном варианте осуществления покрытие предусматривает солевое покрытие, за которым следует восковое покрытие, описанные в данном документе.
Кормовые добавки для животных
Настоящее изобретение также относится к композициям корма для животных и добавкам в корм для животных, содержащим одну или несколько ксиланаз по настоящему изобретению. В одном варианте осуществления корм для животных или кормовая добавка для животных содержит средство для составления и одну или несколько ксиланаз по настоящему изобретению. В дополнительном варианте осуществления средство для составления предусматривает одно или несколько из следующих соединений: глицерин, этиленгликоль, 1,2-пропиленгликоль или 1,3-пропиленгликоль, хлорид натрия, бензоат натрия, сорбат калия, сульфат натрия, сульфат калия, сульфат магния, тиосульфат натрия, карбонат кальция, цитрат натрия, декстрин, глюкозу, сахарозу, сорбит, лактозу, крахмал и целлюлозу.
Таким образом, настоящее изобретение дополнительно относится к кормовой добавке для животных, содержащей один или несколько витаминов и вариант ксиланазы по настоящему изобретению. Настоящее изобретение также относится к кормовой добавке для животных, содержащей один или несколько минералов и вариант ксиланазы по настоящему изобретению. Настоящее изобретение также относится к кормовой добавке для животных, содержащей одну или несколько аминокислот и вариант ксиланазы по настоящему изобретению.
В одном варианте осуществления количество фермента в добавке в корм для животных составляет от 0,001% до 10% по весу композиции.
В одном варианте осуществления кормовая добавка для животных содержит одно или несколько средств для составления, предпочтительно, как описано в данном документе выше.
В одном варианте осуществления кормовая добавка для животных содержит один или несколько дополнительных ферментов, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит один или несколько пробиотиков, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит один или несколько витаминов, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит один или несколько минералов, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит одну или несколько аминокислот, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит один или несколько пребиотиков, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит одну или несколько органических кислот, предпочтительно, как описано в данном документе ниже.
В одном варианте осуществления кормовая добавка для животных содержит одно или несколько средств растительного происхождения, предпочтительно, как описано в данном документе ниже.
Корм для животных
Настоящее изобретение также относится к композициям корма для животных, содержащим один или несколько вариантов ксиланазы по настоящему изобретению. Настоящее изобретение также относится к корму для животных, содержащему гранулу, описанную в данном документе, и материал на растительной основе. Настоящее изобретение также относится к корму для животных, содержащему кормовую добавку для животных, описанную в данном документе, и материал на растительной основе. В одном варианте осуществления материал на растительной основе происходит из подсемейства Panicoideae.
Композиции корма для животных или рационы характеризуются относительно высоким содержанием белка. Рационы домашней птицы и свиней можно охарактеризовать, как указано в таблице B из WO 01/58275, столбцы 2-3. Рационы рыб можно охарактеризовать, как указано в столбце 4 этой таблицы B. Кроме того, такие рационы рыб обычно характеризуются содержанием сырого жира 200-310 г/кг.
Композиция корма для животных по настоящему изобретению характеризуется содержанием сырого белка 50-800 г/кг и, кроме того, содержит по меньшей мере одну ксиланазу, заявляемую в данном документе.
Дополнительно или в качестве альтернативы (содержанию сырого белка, указанному выше) композиция корма для животных по настоящему изобретению характеризуется содержанием метаболизируемой энергии 10-30 МДж/кг; и/или содержанием кальция 0,1-200 г/кг; и/или содержанием доступного фосфора 0,1-200 г/кг; и/или содержанием метионина 0,1-100 г/кг; и/или содержанием метионина плюс цистеин 0,1-150 г/кг; и/или содержанием лизина 0,5-50 г/кг.
В конкретных вариантах осуществления содержание метаболизируемой энергии, сырого белка, кальция, фосфора, метионина, метионина плюс цистеин и/или лизина находится в любом из диапазонов 2, 3, 4 или 5 в таблице B из WO 01/58275 (R. 2-5).
Сырой белок рассчитывают как азот (N), умноженный на коэффициент 6,25, т. е. сырой белок (г/кг)=N (г/кг) х 6,25. Содержание азота определяют по способу Кьельдаля (A.O.A.C., 1984, Official Methods of Analysis 14th ed., Association of Official Analytical Chemists, Washington DC).
Метаболизируемую энергию можно рассчитать на основе публикации NRC Nutrient requirements in swine, ninth revised edition, 1988, Подкомитета по питанию свиней Комитета по питанию животных Департамента сельского хозяйства Национального исследовательского совета. National Academy Press, Washington, D.C., pp. 2-6, и The European Table of Energy Values for Poultry Feed-stuffs Центра исследования и развития птицеводства в Спелдерхолте, 7361 DA Beekbergen, The Netherlands. Grafisch bedrijf Ponsen & looijen bv, Wageningen. ISBN 90-71463-12-5.
Содержание в рационе кальция, доступного фосфора и аминокислот в полных рационах животных рассчитывают на основе таблиц кормов, таких как Veevoedertabel 1997, gegevens over chemische samenstelling, verteerbaarheid en voederwaarde van voedermiddelen, Central Veevoederbureau, Runderweg 6, 8219 pk Lelystad. ISBN 90-72839-13-7.
В конкретном варианте осуществления композиция корма для животных по настоящему изобретению содержит по меньшей мере один растительный белок, определенный выше.
Композиция корма для животных по настоящему изобретению может также содержать животный белок, такой как мясная и костная мука, перьевая мука и/или рыбная мука, как правило, в количестве 0-25%. Композиция корма для животных по настоящему изобретению может также содержать сухую гранулированную барду (DDGS), как правило, в количествах 0-30%.
В еще более конкретных вариантах осуществления композиция корма для животных согласно настоящему изобретению содержит 0-80% маиса; и/или 0-80% сорго; и/или 0-70% пшеницы; и/или 0-70% ячменя; и/или 0-30% овса; и/или 0-40% соевой муки; и/или 0-25% рыбной муки; и/или 0-25% мясной и костной муки; и/или 0-20% сыворотки.
Корм для животных может содержать растительные белки. В конкретных вариантах осуществления содержание белка из растительных белков составляет по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, или 90% (вес./вес.). Растительные белки можно получать из таких источников растительных белков, как бобовые и злаковые, например, материалы из растений семейств Fabaceae (Leguminosae), Cruciferaceae, Chenopodiaceae и Poaceae, такие как мука из соевых бобов, люпиновая мука, рапсовая мука и их комбинации.
В конкретном варианте осуществления источник растительного белка представляет собой материал из одного или нескольких растений семейства Fabaceae, например, сои, люпина, гороха или бобов. В другом конкретном варианте осуществления источник растительного белка представляет собой материал из одного или нескольких растений семейства Chenopodiaceae, например, свеклы, сахарной свеклы, шпината или киноа. Другими примерами источников растительного белка являются рапс и капуста. В другом конкретном варианте осуществления соя является предпочтительным источником растительного белка. Другими примерами источников растительного белка являются зерновые, такие как ячмень, пшеница, рожь, овес, маис (кукуруза), рис и сорго.
Рационы для животных можно, например, производить в виде мешанки (негранулированной) или в виде гранулированного корма. Как правило, молотые комбикорма смешивают и добавляют существенные количества важных витаминов и минералов в соответствии со спецификациями для указанного вида. Ферменты можно добавлять в виде твердых или жидких ферментных составов. Например, в случае мешанки твердый или жидкий ферментный состав можно добавлять до или во время этапа смешивания ингредиентов. В случае гранулированного корма (жидкий или твердый) препарат ксиланазы/фермента можно также добавлять до или во время этапа добавления кормовых ингредиентов. Обычно жидкий препарат ксиланазы/фермента содержит ксиланазу по настоящему изобретению, необязательно с полиолом, таким как глицерин, этиленгликоль или пропиленгликоль, и его добавляют после этапа гранулирования, например, путем распыления жидкого состава на гранулы. Фермент также можно включать в кормовую добавку или премикс.
В качестве альтернативы ксиланазу можно получать путем замораживания смеси жидкого раствора фермента с объемообразующим средством, таким как молотая соевая мука, и затем лиофилизации смеси.
Конечная концентрация фермента в рационе находится в диапазоне 0,01-200 мг белка фермента на кг рациона, предпочтительно 0,05-100 мг/кг рациона, более предпочтительно 0,1-50 мг, еще более предпочтительно 0,2-20 мг белка фермента на кг рациона животных.
В настоящее время предполагается, что фермент вводят в одном или нескольких из следующих количеств (диапазонов доз): 0,01-200; 0,05-100; 0,1-50; 0,2-20; 0,1-1; 0,2-2; 0,5-5 или 1-10 - все эти диапазоны приведены в мг белка ксиланазы на кг корма (ppm).
Для определения количества мг белка ксиланазы на кг корма ксиланазу очищают от кормовой композиции, а удельную активность очищенной ксиланазы определяют с использованием соответствующего анализа (см. раздел ʺАктивность ксиланазыʺ). Активность ксиланазы кормовой композиции как таковой также определяют с использованием того же анализа и на основе этих двух результатов определения рассчитывают дозу в мг белка ксиланазы на кг корма.
В конкретном варианте осуществления кормовая добавка для животных по настоящему изобретению предназначена для включения (или предписана как таковая, которая должна быть включена) в рационы животных или корм для животных при уровнях от 0,01 до 10,0%; более конкретно от 0,05 до 5,0%; или от 0,2 до 1,0% (% означает г добавки на 100 г корма). Это особенно касается премиксов.
Те же принципы применяют для определения количества мг белка ксиланазы в добавках в корм. Разумеется, если имеется образец ксиланазы, используемой для получения кормовой добавки или корма, в этом образце определяют удельную активность (нет необходимости очищать ксиланазу от кормовой композиции или добавки).
Материал на растительной основе из подсемейства Panicoideae
В одном варианте осуществления материал на растительной основе из подсемейства Panicoideae получен из трибы Andropogoneae, например, таксономического ранга Andropogon или Andropterum или Apluda или Apocopis или Arthraxon или Bothriochloa или Capillipedium или Chionachne или Chrysopogon или Coelorachis или Coix или Cymbopogon или Dichanthium или Diheteropogon или Dimeria или Elionurus или Eremochloa или Euclasta или Eulalia или Germainia или Hemarthria или Heteropholis или Heteropogon или Hyparrhenia или Hyperthelia или Imperata или Ischaemum или Iseilema или Kerriochloa или Microstegium или Miscanthidium или Miscanthus или Mnesithea или Ophiuros или Oxyrhachis или Phacelurus или Pholiurus или Pogonatherum или Polytoca или Polytrias или Pseudopogonatherum или Pseudosorghum или Rhytachne или Rottboellia или Saccharum (например, сахарный тростник) или Sarga или Schizachyrium или Sehima или Sorghastrum или Sorghum или Spodiopogon или Thaumastochloa или Thelepogon или Themeda или Trachypogon или Triarrhena или Tripsacum или Urelytrum или Vetiveria или Vossia или Xerochloa или Zea.
В предпочтительном варианте осуществления материал на растительной основе из подсемейства Panicoideae получен из таксономического ранга Zea, такого как виды Zea diploperennis, Zea luxurians, Zea mays, Zea nicaraguensis или Zea perennis.
В предпочтительном варианте осуществления материал на растительной основе из подсемейства Panicoideae получен из таксономического ранга Sorghum, такого как виды Sorghum amplum, Sorghum angustum, Sorghum arundinaceum, Sorghum australiense, Sorghum bicolor, Sorghum brachypodum, Sorghum bulbosum, Sorghum ecarinatum, Sorghum exstans, Sorghum grande, Sorghum halepense, Sorghum hybrid cultivar, Sorghum interjectum, Sorghum intrans, Sorghum laxiflorum, Sorghum leiocladum, Sorghum macrospermum, Sorghum matarankense, Sorghum nitidum, Sorghum plumosum, Sorghum propinquum, Sorghum purpureosericeum, Sorghum stipoideum, Sorghum sudanense, Sorghum timorense, Sorghum versicolor, Sorghum sp. 'Silk' или Sorghum sp., как определено в WO2007/002267.
В другом варианте осуществления материал на растительной основе из подсемейства Panicoideae получен из трибы Paniceae, например, таксономического ранга Acritochaete, Acroceras, Alexfloydia, Alloteropsis, Amphicarpum, Ancistrachne, Anthephora, Brachiaria (например, брахиария), Calyptochloa, Cenchrus, Chaetium, Chaetopoa, Chamaeraphis, Chlorocalymma, Cleistochloa, Cyphochlaena, Cyrtococcum, Dichanthelium, Digitaria, Dissochondrus, Echinochloa, Entolasia, Eriochloa, Homopholis, Hygrochloa, Hylebates, Ixophorus, Lasiacis, Leucophrys, Louisiella, Megaloprotachne, Megathyrsus, Melinis, Microcalamus, Moorochloa, Neurachne, Odontelytrum, Oplismenus, Ottochloa, Panicum, Paractaenum, Paraneurachne, Paratheria, Parodiophyllochloa, Paspalidium, Pennisetum, Plagiosetum, Poecilostachys, Pseudechinolaena, Pseudochaetochloa, Pseudoraphis, Rupichloa, Sacciolepis, Scutachne, Setaria, Setariopsis, Snowdenia, Spinifex, Stenotaphrum, Stereochlaena, Thrasya, Thuarea, Thyridolepis, Tricholaena, unclassified Paniceae, Uranthoecium, Urochloa (например, брахиария), Walwhalleya, Whiteochloa, Yakirra, Yvesia, Zuloagaea или Zygochloa.
В предпочтительном варианте осуществления материал на растительной основе из подсемейства Panicoideae получен из таксономического ранга Panicum, например, видов Panicum adenophorum, Panicum aff. aquaticum JKT-2012, Panicum amarum, Panicum antidotale, Panicum aquaticum, Panicum arctum, Panicum arundinariae, Panicum atrosanguineum, Panicum auricomum, Panicum auritum, Panicum bartlettii, Panicum bergii, Panicum bisulcatum, Panicum boliviense, Panicum brazzavillense, Panicum brevifolium, Panicum caaguazuense, Panicum campestre, Panicum capillare, Panicum cayennense, Panicum cayoense, Panicum cervicatum, Panicum chloroleucum, Panicum claytonii, Panicum coloratum, Panicum cyanescens, Panicum decompositum, Panicum deustum, Panicum dichotomiflorum, Panicum dinklagei, Panicum distichophyllum, Panicum dregeanum, Panicum elephantipes, Panicum fauriei, Panicum flexile, Panicum fluviicola, Panicum gouinii, Panicum gracilicaule, Panicum granuliferum, Panicum guatemalense, Panicum hallii, Panicum heterostachyum, Panicum hirticaule, Panicum hirtum, Panicum hylaeicum, Panicum incumbens, Panicum infestum, Panicum italicum, Panicum laetum, Panicum laevinode, Panicum lanipes, Panicum larcomianum, Panicum longipedicellatum, Panicum machrisianum, Panicum malacotrichum, Panicum margaritiferum, Panicum micranthum, Panicum miliaceum, Panicum milioides, Panicum millegrana, Panicum mystasipum, Panicum natalense, Panicum nephelophilum, Panicum nervosum, Panicum notatum, Panicum olyroides, Panicum paludosum, Panicum pansum, Panicum pantrichum, Panicum parvifolium, Panicum parviglume, Panicum pedersenii, Panicum penicillatum, Panicum petersonii, Panicum phragmitoides, Panicum piauiense, Panicum pilosum, Panicum pleianthum, Panicum polycomum, Panicum polygonatum, Panicum pseudisachne, Panicum pygmaeum, Panicum pyrularium, Panicum queenslandicum, Panicum racemosum, Panicum repens, Panicum rhizogonum, Panicum rigidulum, Panicum rivale, Panicum rude, Panicum rudgei, Panicum schinzii, Panicum schwackeanum, Panicum sellowii, Panicum seminudum, Panicum stapfianum, Panicum stenodes, Panicum stramineum, Panicum subalbidum, Panicum subtiramulosum, Panicum sumatrense, Panicum tenellum, Panicum tenuifolium, Panicum trichanthum, Panicum trichidiachne, Panicum trichoides, Panicum tricholaenoides, Panicum tuerckheimii, Panicum turgidum, Panicum urvilleanum, Panicum validum, Panicum venezuelae, Panicum verrucosum, Panicum virgatum, Panicum wettsteinii, Panicum sp., Panicum sp. Christin 16-200, Panicum sp. ELS-2011, Panicum sp. EM389 или Panicum sp. Forest 761.
В дополнительном варианте осуществления материал на растительной основе, полученный из подсемейства Panicoideae, представляет собой маис (Zea), кукурузу (Zea), сорго (Sorghum), просо прутьевидное (Panicum virgatum), просо культурное (Panicum miliaceum), просо африканское (Cenchrus violaceus также называемое Pennisetum glaucum), просо итальянское (Setaria italica также называемое Panicum italicum), или находится в обработанной форме, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское или любая их комбинация.
В одном варианте осуществления материал на растительной основе из подсемейства Panicoideae получен из семян растения. В предпочтительном варианте осуществления материал на растительной основе, полученный из подсемейства Panicoideae, получен из семян маиса (Zea), кукурузы (Zea), сорго (Sorghum), проса прутьевидного (Panicum virgatum), проса культурного (Panicum miliaceum), проса африканского (Cenchrus violaceus, также называемого Pennisetum glaucum), проса итальянского (Setaria italica, также называемого Panicum italicum) или из семян, которые были обработаны, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское или любая их комбинация.
В другом варианте осуществления описанные в данном документе композиции необязательно содержат один или несколько ферментов. Ферменты можно классифицировать на основе справочника Enzyme Nomenclature от NC-IUBMB, 1992, см. также сайт ENZYME в сети Интернет: http://www.expasy.ch/enzyme/. ENZYME представляет собой хранилище информации, относящейся к номенклатуре ферментов. Он основан главным образом на рекомендациях Комитета по номенклатуре Международного союза биохимии и молекулярной биологии (IUB-MB), Academic Press, Inc., 1992, и на нем описан каждый тип охарактеризованного фермента, для которого предоставлен номер EC (Комиссия по ферментам) (Bairoch A. The ENZYME database, 2000, Nucleic Acids Res 28:304-305). Эта номенклатура ферментов IUB-MB основана на их субстратной специфичности и иногда на их молекулярном механизме; такая классификация не отражает структурных особенностей этих ферментов.
Другая классификация определенных гликозидгидролазных ферментов, таких как эндоглюканаза, ксиланаза, галактаназа, маннаназа, декстраназа, лизоцим и галактозидаза, описана в Henrissat et al., ʺThe carbohydrate-active enzymes database (CAZy) in 2013ʺ, Nucl. Acids Res. (1 January 2014) 42 (D1): D490-D495; см. также www.cazy.org.
Таким образом, композиция по настоящему изобретению также может содержать по меньшей мере еще один фермент, выбранный из группы, состоящей из фитазы (EC 3.1.3.8 или 3.1.3.26); ксиланазы (EC 3.2.1.8); галактаназы (EC 3.2.1.89); альфа-галактозидазы (EC 3.2.1.22); протеазы (EC 3.4); фосфолипазы A1 (EC 3.1.1.32); фосфолипазы A2 (EC 3.1.1.4); лизофосфолипазы (EC 3.1.1.5); фосфолипазы C (3.1.4.3); фосфолипазы D (EC 3.1.4.4); амилазы, такой как, например, альфа-амилаза (EC 3.2.1.1); арабинофуранозидазы (EC 3.2.1.55); бета-ксилозидазы (EC 3.2.1.37); ацетилксиланэстеразы (EC 3.1.1.72); ферулоилэстеразы (EC 3.1.1.73); целлюлазы (EC 3.2.1.4); целлобиогидролаз (EC 3.2.1.91); бета-глюкозидазы (EC 3.2.1.21); пуллуланазы (EC 3.2.1.41), альфа-маннозидазы (EC 3.2.1.24), маннаназы (EC 3.2.1.25) и бета-глюканазы (EC 3.2.1.4 или EC 3.2.1.6) или любой их смеси.
В конкретном варианте осуществления композиция по настоящему изобретению содержит фитазу (ЕС 3.1.3.8 или 3.1.3.26). Примеры коммерчески доступных фитаз включают фитазу Bio-FeedTM (Novozymes), Ronozyme® P, Ronozyme® NP и Ronozyme® HiPhos (DSM Nutritional Products), NatuphosTM (BASF), NatuphosTM E (BASF), Finase® и Quantum® Blue (AB Enzymes), OptiPhos® (Huvepharma), фитазу AveMix® (Aveve Biochem), Phyzyme® XP (Verenium/DuPont) и Axtra® PHY (DuPont). Другие предпочтительные фитазы включают те, которые описаны, например, в WO 98/28408, WO 00/43503 и WO 03/066847.
В конкретном варианте осуществления композиция по настоящему изобретению содержит ксиланазу (ЕС 3.2.1.8). Примеры коммерчески доступных ксиланаз включают Ronozyme® WX (DSM Nutritional Products), Econase® XT и Barley (AB Vista), Xylathin® (Verenium), Hostazym® X (Huvepharma), Axtra® XB (ксиланаза/бета-глюканаза, DuPont) и Axtra® XAP (ксиланаза/амилаза/протеаза, DuPont), AveMix® XG 10 (ксиланаза/глюканаза) и AveMix® 02 CS (ксиланаза/глюканаза/пектиназа, Aveve Biochem) и Naturgrain (BASF).
В конкретном варианте осуществления композиция по настоящему изобретению содержит протеазу (EC 3.4). Примеры коммерчески доступных протеаз включают Ronozyme® ProAct (DSM Nutritional Products).
В конкретном варианте осуществления композиция по настоящему изобретению содержит альфа-амилазу (EC 3.2.1.1). Примеры коммерчески доступных альфа-амилаз включают Ronozyme® A и RONOZYME® RumiStar™ (DSM Nutritional Products).
В конкретном варианте осуществления композиция по настоящему изобретению содержит многокомпонентный ферментный продукт, такой как FRA® Octazyme (Framelco), Ronozyme® G2, Ronozyme® VP и Ronozyme® MultiGrain (DSM Nutritional Products), Rovabio® Excel или Rovabio® Advance (Adisseo).
Дополнительные ферменты
В другом варианте осуществления описанные в данном документе композиции необязательно содержат один или несколько ферментов. Ферменты можно классифицировать на основе справочника Enzyme Nomenclature от NC-IUBMB, 1992, см. также сайт ENZYME в сети Интернет: http://www.expasy.ch/enzyme/. ENZYME представляет собой хранилище информации, относящейся к номенклатуре ферментов. Он основан главным образом на рекомендациях Комитета по номенклатуре Международного союза биохимии и молекулярной биологии (IUB-MB), Academic Press, Inc., 1992, и на нем описан каждый тип охарактеризованного фермента, для которого предоставлен номер EC (Комиссия по ферментам) (Bairoch A. The ENZYME database, 2000, Nucleic Acids Res 28:304-305). Эта номенклатура ферментов IUB-MB основана на их субстратной специфичности и иногда на их молекулярном механизме; такая классификация не отражает структурных особенностей этих ферментов.
Другая классификация определенных гликозидгидролазных ферментов, таких как эндоглюканаза, галактаназа, маннаназа, декстраназа, лизоцим и галактозидаза, описана в Henrissat et al, ʺThe carbohydrate-active enzymes database (CAZy) in 2013ʺ, Nucl. Acids Res. (1 January 2014) 42 (D1): D490-D495; см., также www.cazy.org.
Таким образом, композиция по настоящему изобретению может также содержать по меньшей мере еще один фермент, выбранный из группы, состоящей из ацетилксиланэстеразы (EC 3.1.1.23), ацилглицероллипазы (EC 3.1.1.72), альфа-амилазы (EC 3.2.1.1), бета-амилазы (EC 3.2.1.2), арабинофуранозидазы (EC 3.2.1.55), целлобиогидролаз (EC 3.2.1.91), целлюлазы (EC 3.2.1.4), ферулоилэстеразы (EC 3.1.1.73), галактаназы (EC 3.2.1.89), альфа-галактозидазы (EC 3.2.1.22), бета-галактозидазы (EC 3.2.1.23), глюкан-1,4-α-глюкозидазы (глюкоамилазы) (EC 3.2.1.3), глюкан-1,4-альфа-мальтогидролазы (мальтогенной альфа-амилазы) (EC 3.2.1.133), бета-глюканазы (EC 3.2.1.6), бета-глюкозидазы (EC 3.2.1.21), триацилглицероллипазы (EC 3.1.1.3), лизофосфолипазы (EC 3.1.1.5), лизоцима (EC 3.2.1.17), альфа-маннозидазы (EC 3.2.1.24), бета-маннозидазы (маннаназы) (EC 3.2.1.25), фитазы (EC 3.1.3.8, EC 3.1.3.26, EC 3.1.3.72), фосфолипазы A1 (EC 3.1.1.32), фосфолипазы A2 (EC 3.1.1.4), фосфолипазы D (EC 3.1.4.4), протеазы (EC 3.4), пуллуланазы (EC 3.2.1.41), пектинэстеразы (EC 3.1.1.11), ксиланазы (EC 3.2.1.8, EC 3.2.1.136), бета-ксилозидазы (EC 3.2.1.37) или любой их комбинации.
В конкретном варианте осуществления композиция по настоящему изобретению содержит галактаназу (EC 3.2.1.89) и бета-галактозидазу (EC 3.2.1.23).
В конкретном варианте осуществления композиция по настоящему изобретению содержит альфа-галактозидазу (EC 3.2.1.22).
В конкретном варианте осуществления композиция по настоящему изобретению содержит фитазу (ЕС 3.1.3.8 или 3.1.3.26). Примеры коммерчески доступных фитаз включают фитазу Bio-FeedTM (Novozymes), Ronozyme® P, Ronozyme® NP и Ronozyme® HiPhos (DSM Nutritional Products), NatuphosTM (BASF), NatuphosTM E (BASF), Finase® и Quantum® Blue (AB Enzymes), OptiPhos® (Huvepharma), фитазу AveMix® (Aveve Biochem), Phyzyme® XP (Verenium/DuPont) и Axtra® PHY (DuPont). Другие предпочтительные фитазы включают те, которые описаны, например, в WO 98/28408, WO 00/43503 и WO 03/066847.
В конкретном варианте осуществления композиция по настоящему изобретению содержит ксиланазу (ЕС 3.2.1.8). Примеры коммерчески доступных ксиланаз включают Ronozyme® WX (DSM Nutritional Products), Econase® XT и Barley (AB Vista), Xylathin® (Verenium), Hostazym® X (Huvepharma), Axtra® XB (ксиланаза/бета-глюканаза, DuPont) и Axtra® XAP (ксиланаза/амилаза/протеаза, DuPont), AveMix® XG 10 (ксиланаза/глюканаза) и AveMix® 02 CS (ксиланаза/глюканаза/пектиназа, Aveve Biochem) и Naturgrain (BASF).
В конкретном варианте осуществления композиция по настоящему изобретению содержит протеазу (EC 3.4). Примеры коммерчески доступных протеаз включают Ronozyme® ProAct (DSM Nutritional Products).
В конкретном варианте осуществления композиция по настоящему изобретению содержит альфа-амилазу (EC 3.2.1.1). Примеры коммерчески доступных альфа-амилаз включают Ronozyme® A и RONOZYME® RumiStar™ (DSM Nutritional Products).
В конкретном варианте осуществления композиция по настоящему изобретению содержит многокомпонентный ферментный продукт, такой как FRA® Octazyme (Framelco), Ronozyme® G2, Ronozyme® VP и Ronozyme® MultiGrain (DSM Nutritional Products), Rovabio® Excel или Rovabio® Advance (Adisseo).
Эубиотики
Эубиотики представляют собой соединения, которые предназначены для обеспечения здорового баланса микрофлоры в желудочно-кишечном тракте. Эубиотики охватывают ряд различных добавок в корм, таких как пробиотики, пребиотики, средства растительного происхождения (эфирные масла) и органические кислоты, которые более подробно описаны ниже.
Пробиотики
В одном варианте осуществления композиция корма для животных дополнительно содержит один или несколько дополнительных пробиотиков. В конкретном варианте осуществления композиция корма для животных дополнительно содержит бактерию из одного или нескольких следующих родов: Lactobacillus, Lactococcus, Streptococcus, Bacillus, Pediococcus, Enterococcus, Leuconostoc, Carnobacterium, Propionibacterium, Bifidobacterium, Clostridium и Megasphaera или любой их комбинации.
В предпочтительном варианте осуществления композиция корма для животных дополнительно содержит бактерию из одного или нескольких следующих штаммов: Bacillus subtilis, Bacillus licheniformis, Bacillus amyloliquefaciens, Bacillus cereus, Bacillus pumilus, Bacillus polymyxa, Bacillus megaterium, Bacillus coagulans, Bacillus circulans, Enterococcus faecium, Enterococcus spp, и Pediococcus spp, Lactobacillus spp, Bifidobacterium spp, Lactobacillus acidophilus, Pediococsus acidilactici, Lactococcus lactis, Bifidobacterium bifidum, Propionibacterium thoenii, Lactobacillus farciminus, lactobacillus rhamnosus, Clostridium butyricum, Bifidobacterium animalis ssp. animalis, Lactobacillus reuteri, Lactobacillus salivarius ssp. salivarius, Megasphaera elsdenii, Propionibacteria sp.
В более предпочтительном варианте осуществления композиция, кормовая добавка для животных или корм для животных дополнительно содержат бактерию из одного или нескольких следующих штаммов Bacillus subtilis: 3A-P4 (PTA-6506), 15A-P4 (PTA-6507), 22C-P1 (PTA-6508), 2084 (NRRL B-500130), LSSA01 (NRRL-B-50104), BS27 (NRRL B-501 05), BS 18 (NRRL B-50633), BS 278 (NRRL B-50634), DSM 29870, DSM 29871, DSM 32315, NRRL B-50136, NRRL B-50605, NRRL B-50606, NRRL B-50622 и PTA-7547.
В более предпочтительном варианте осуществления композиция, кормовая добавка для животных или корм для животных дополнительно содержат бактерию из одного или нескольких следующих штаммов Bacillus pumilus: NRRL B-50016, ATCC 700385, NRRL B-50885 или NRRL B-50886.
В более предпочтительном варианте осуществления композиция, кормовая добавка для животных или корм для животных дополнительно содержат бактерию из одного или нескольких следующих штаммов Bacillus lichenformis: NRRL B 50015, NRRL B-50621 или NRRL B-50623.
В более предпочтительном варианте осуществления композиция, кормовая добавка для животных или корм для животных дополнительно содержат бактерию из одного или нескольких следующих штаммов Bacillus amyloliquefaciens: DSM 29869, DSM 29869, NRRL B 50607, PTA-7543, PTA-7549, NRRL B-50349, NRRL B-50606, NRRL B-50013, NRRL B-50151, NRRL B-50141, NRRL B-50147 или NRRL B-50888.
Количество бактерий каждого из бактериальных штаммов в композиции корма для животных составляет от 1×104 до 1×1014 КОЕ/кг сухого вещества, предпочтительно от 1×106 до 1×1012 КОЕ/кг сухого вещества и более предпочтительно от 1×107 до 1×1011 КОЕ/кг сухого вещества. В более предпочтительном варианте осуществления количество бактерий каждого из бактериальных штаммов в композиции корма для животных составляет от 1×108 до 1×1010 КОЕ/кг сухого вещества.
Количество бактерий каждого из бактериальных штаммов в композиции корма для животных составляет от 1×105 до 1×1015 КОЕ/животное/день, предпочтительно от 1×107 до 1×1013 КОЕ/животное/день и более предпочтительно от 1×108 до 1×1012 КОЕ/животное/день. В более предпочтительном варианте осуществления количество бактерий каждого из бактериальных штаммов в композиции корма для животных составляет от 1×109 до 1×1011 КОЕ/животное/день. В одном варианте осуществления количество пробиотиков составляет от 0,001% до 10% композиции.
В другом варианте осуществления один или несколько бактериальных штаммов присутствуют в форме стабильной споры.
Примерами коммерческих продуктов являются Cylactin® (DSM Nutritional Products), Alterion (Adisseo), Enviva PRO (DuPont Animal Nutrition), Syncra® (смесь фермент+пробиотик, DuPont Animal Nutrition), Ecobiol® и Fecinor® (Norel/Evonik) и GutCare® PY1 (Evonik).
Пребиотики
Пребиотики представляют собой вещества, которые вызывают рост или активность микроорганизмов (например, бактерий и грибов), способствующих хорошему состоянию их хозяина. Пребиотики, как правило, представляют собой неперевариваемые волокнистые соединения, которые проходят непереваренными через верхнюю часть желудочно-кишечного тракта и стимулируют рост или активность полезных бактерий, которые колонизируют толстый кишечник, действуя в качестве субстрата для них. Обычно пребиотики обеспечивают увеличение количества или активности бифидобактерий и молочнокислых бактерий в ЖК-тракте.
Производные дрожжей (инактивированные цельные дрожжи или клеточные стенки дрожжей) также могут рассматриваться в качестве пребиотиков. Они часто содержат маннан-олигосахариды, дрожжевые бета-глюканы или белковое содержимое и обычно образуются из клеточной стенки дрожжей Saccharomyces cerevisiae.
В одном варианте осуществления количество пребиотиков составляет от 0,001% до 10% по весу композиции. Примерами дрожжевых продуктов являются Yang® и Agrimos (Lallemand Animal Nutrition).
Средства растительного происхождения
средства растительного происхождения представляют собой группу природных стимуляторов роста или не являющихся антибиотиками стимуляторов роста, используемых в качестве добавок в корм, полученных из трав, специй или других растений. Средства растительного происхождения могут представлять собой отдельные вещества, полученные из эфирных масел/экстрактов, отдельных растений и смеси растений (растительных продуктов) или смеси эфирных масел/экстрактов/растений (специализированных продуктов).
Примерами средств растительного происхождения являются розмарин, шалфей, орегано, тимьян, гвоздика и лемонграсс. Примерами эфирных масел являются тимол, эвгенол, метакрезол, ванилин, салицилат, резорцин, гваякол, гингерол, масло лаванды, иононы, ирон, эвкалиптол, ментол, масло мяты перечной, альфа-пинен; лимонен, анетол, линалоол, метилдигидроджасмонат, карвакрол, пропионовая кислота/пропионат, уксусная кислота/ацетат, масляная кислота/бутират, розмариновое масло, гвоздичное масло, гераниол, терпинеол, цитронеллол, амил и/или бензилсалицилат, циннамальдегид, растительный полифенол (танин), куркума и экстракт куркумы.
В одном варианте осуществления количество фитогенных средств составляет от 0,001% до 10% по весу композиции. Примерами коммерческих продуктов являются Crina® (DSM Nutritional Products); CinergyTM, BiacidTM, ProHacidTM Classic и ProHacidTM AdvanceTM (все Promivi/Cargill) и Envivo EO (DuPont Animal Nutrition).
Органические кислоты
Органические кислоты (С1-С7) широко распространены в природе как нормальные компоненты растений или тканей животных. Они также образуются в результате микробной ферментации углеводов, главным образом в толстой кишке. Их часто применяют в свиноводстве и птицеводстве в качестве замены стимуляторов роста, представляющих собой антибиотики, поскольку они оказывают профилактический эффект в отношении кишечных проблем, таких как некротический энтерит у цыплят и инфекция Escherichia coli у поросят. Органические кислоты могут продаваться в виде монокомпонента или смесей, как правило, из 2 или 3 различных органических кислот. Примерами органических кислот являются пропионовая кислота, муравьиная кислота, лимонная кислота, молочная кислота, сорбиновая кислота, яблочная кислота, уксусная кислота, фумаровая кислота, бензойная кислота, масляная кислота и винная кислота или их соли (обычно натриевая или калиевая соль, такая как диформиат калия или бутират натрия).
В одном варианте осуществления количество органической кислоты составляет от 0,001% до 10% по весу композиции. Примерами коммерческих продуктов являются VevoVitall® (DSM Nutritional Products), Amasil®, Luprisil®, Lupro-Grain®, Lupro-Cid®, Lupro-Mix® (BASF), н-масляная кислота AF (OXEA) и Adimix Precision (Nutriad).
Премикс
Включение композиции добавок в корм, приведенной в качестве примера в данном документе выше, в корма для животных, например, корма для домашней птицы, на практике осуществляется с применением концентрата или премикса. Премикс обозначает предпочтительно однородную смесь из одного или нескольких микроингредиентов с разбавителем и/или носителем. Премиксы используют для облегчения равномерного диспергирования микроингредиентов в большей смеси. Премикс в соответствии с настоящим изобретением можно добавлять к ингредиентам корма или в питьевую воду в виде твердых веществ (например, в виде водорастворимого порошка) или жидкостей.
Аминокислоты
Композиция по настоящему изобретению может дополнительно содержать одну или несколько аминокислот. Примерами аминокислот, которые используются в кормах для животных, являются лизин, аланин, бета-аланин, треонин, метионин и триптофан. В одном варианте осуществления количество аминокислоты составляет от 0,001% до 10% по весу композиции.
Витамины и минералы
В другом варианте осуществления корм для животных может содержать один или несколько витаминов, например, один или несколько жирорастворимых витаминов и/или один или несколько водорастворимых витаминов. В другом варианте осуществления корм для животных может необязательно содержать один или несколько минералов, например, один или несколько микроэлементов и/или один или несколько макроэлементов.
Обычно жиро- и водорастворимые витамины, а также микроэлементы составляют часть так называемого премикса, предназначенного для добавления в корм, тогда как макроэлементы обычно добавляют в корм отдельно.
Неограничивающие примеры жирорастворимых витаминов включают витамин А, витамин D3, витамин E и витамин K, например, витамин K3.
Неограничивающие примеры водорастворимых витаминов включают витамин C, витамин B12, биотин и холин, витамин B1, витамин B2, витамин B6, ниацин, фолиевую кислоту и пантотенат, например, Ca-D-пантотенат.
Неограничивающие примеры микроэлементов включают бор, кобальт, хлорид, хром, медь, фтор, йод, железо, марганец, молибден, йод, селен и цинк.
Неограничивающие примеры макроэлементов включают кальций, магний, фосфор, калий и натрий.
В одном варианте осуществления количество витаминов составляет от 0,001% до 10% по весу композиции. В одном варианте осуществления количество минералов составляет от 0,001% до 10% по весу композиции.
Пищевые потребности в этих компонентах (представленных в качестве примера для домашней птицы и поросят/свиней) перечислены в таблице A из WO 01/58275. Пищевая потребность означает, что эти компоненты должны содержаться в рационе в указанных концентрациях.
В качестве альтернативы кормовая добавка для животных по настоящему изобретению содержит по меньшей мере один из отдельных компонентов, указанных в таблице A из WO 01/58275. Выражение ʺпо меньшей мере одинʺ означает один или больше одного, один или два, или три, или четыре и так далее, вплоть до всех тринадцати или до всех пятнадцати отдельных компонентов. Более конкретно, этот по меньшей мере один отдельный компонент включен в добавку по настоящему изобретению в таком количестве, чтобы обеспечить концентрацию в корме в диапазоне, указанном в столбце четыре, или в столбце пять, или в столбце шесть таблицы А.
В еще одном дополнительном варианте осуществления кормовая добавка для животных по настоящему изобретению содержит по меньшей мере один из приведенных ниже витаминов, предпочтительно для обеспечения концентрации в корме в диапазонах, указанных в приведенной ниже таблице 1 (для рационов поросят и рационов бройлеров соответственно).
Таблица 1. Типичные рекомендации по витаминам
Другие ингредиенты корма
Композиция по настоящему изобретению может дополнительно содержать красители, стабилизаторы, улучшающие рост добавки и ароматические соединения/ароматизаторы, полиненасыщенные жирные кислоты (PUFA); молекулы, образующие активные формы кислорода, антиоксиданты, противомикробные пептиды, противогрибковые полипептиды и соединения для защиты от микотоксинов.
Примерами красителей являются каротиноиды, такие как бета-каротин, астаксантин и лютеин.
Примерами ароматических соединений/ароматизаторов являются креозол, анетол, дека-, ундека- и/или додекалактоны, иононы, ирон, гингерол, пиперидин, пропилиденфталид, бутилиденфталид, капсаицин и танин.
Примерами противомикробных пептидов (AMP) являются CAP18, лейкоцин А, тритрптицин, протегрин-1, танатин, дефензин, лактоферрин, лактоферрицин и овиспирин, такой как новиспирин (Robert Lehrer, 2000), плектазины и статины, включая соединения и полипептиды, раскрытые в WO 03/044049 и WO 03/048148, а также варианты или фрагменты вышеуказанного, которые сохраняют противомикробную активность.
Примерами противогрибковых полипептидов (AFP) являются пептиды Aspergillus giganteus и Aspergillus niger, а также их варианты и фрагменты, которые сохраняют противогрибковую активность, как раскрыто в WO 94/01459 и WO 02/090384.
Примерами полиненасыщенных жирных кислот являются C18, C20 и C22 полиненасыщенные жирные кислоты, такие как арахидоновая кислота, докозагексаеновая кислота, эйкозапентаеновая кислота и гамма-линолевая кислота.
Примерами молекул, образующих активные формы кислорода, являются химические вещества, такие как перборат, персульфат или перкарбонат; и ферменты, такие как оксидаза, оксигеназа или синтетаза.
Антиоксиданты можно использовать для ограничения количества активных форм кислорода, которые могут образовываться, таким образом, чтобы уровень активных форм кислорода находился в равновесии с антиоксидантами.
Микотоксины, такие как дезоксиниваленол, афлатоксин, зеараленон и фумонизин, могут находиться в кормах для животных и могут приводить к ухудшению продуктивности или болезни животных. Соединения, которые могут регулировать уровни микотоксина, например, путем деактивации микотоксина или связывания микотоксина, можно добавлять в корм для снижения этих негативных эффектов. Примерами соединений для защиты от микотоксинов являются Vitafix®, Vitafix Ultra (Nuscience), Mycofix®, Mycofix® Secure, FUMzyme®, Biomin® BBSH, Biomin® MTV (Biomin), Mold-Nil®, Toxy-Nil® и Unike® Plus (Nutriad).
Растения
Настоящее изобретение также относится к выделенным растениям, например, трансгенным растению, части растения или растительной клетке, содержащим полинуклеотид согласно настоящему изобретению с тем, чтобы экспрессировать и продуцировать полипептид или домен в извлекаемых количествах. Полипептид или домен можно извлечь из растения или части растения. В качестве альтернативы растение или часть растения, содержащие полипептид или домен, можно применять без дополнительной очистки для улучшения качества пищи или корма, например, улучшения пищевой ценности, вкусовой привлекательности и реологических свойств, или для устранения фактора, препятствующего усвоению питательных веществ.
Трансгенное растение может иметь две семядоли (двудольное) или одну семядолю (однодольное). Примерами однодольных растений являются злаковые растения, такие как мятлик (мятлик луговой, Poa), кормовая трава, такая как Festuca, Lolium, трава умеренной климатической зоны, такая как Agrostis, и зерновые растения, например, пшеница, разновидности овса, рожь, ячмень, рис, сорго и маис (кукуруза).
Примерами двудольных растений являются табак, бобовые, такие как разновидности люпина, картофель, сахарная свекла, горох, фасоль и соя, и крестоцветные растения (семейство Brassicaceae), такие как цветная капуста, рапс и близкородственный модельный организм Arabidopsis thaliana.
Примерами частей растения являются стебель, каллюс, листья, корень, плоды, семена и клубни, а также отдельные ткани, составляющие эти части, например, эпидермис, мезофилл, паренхима, сосудистые ткани, меристемы.
Растительные клетки и конкретные компартменты растительной клетки, такие как хлоропласты, апопласты, митохондрии, вакуоли, пероксисомы и цитоплазма, также рассматриваются как части растения.
В объем настоящего изобретения также включено потомство таких растений, частей растений и растительных клеток.
Трансгенное растение или растительная клетка, экспрессирующие полипептид или домен, могут быть сконструированы в соответствии со способами, известными из уровня техники.
Настоящее изобретение также относится к способам получения полипептида или домена по настоящему изобретению, включающим (a) культивирование трансгенных растения или растительной клетки, содержащих полинуклеотид, кодирующий полипептид или домен в условиях, благоприятных для выработки полипептида или домена; и (b) выделение полипептида или домена.
Способы применения
Настоящее изобретение также относится к способам применения вариантов ксиланазы или их композиций, например, для корма для животных, способам получения продукта ферментации и применения в хлебопекарном производстве. Настоящее изобретение также относится к способам применения вариантов ксиланазы или их композиций, таких как, например, описанные ниже.
Применение в корме для животных
Настоящее изобретение также относится к способам применения вариантов ксиланазы в корме для животных.
Термин ʺживотноеʺ включает всех животных. Примерами животных являются нежвачные животные и жвачные животные. Жвачные животные включают, например, животных, таких как овцы, козы и крупный рогатый скот, например, крупный рогатый скот мясного направления, коровы и молодые телята. В конкретном варианте осуществления животное является нежвачным животным. Нежвачные животные включают животных с однокамерным желудком, например, боровы или свиньи (в том числе без ограничения поросята, растущие свиньи и свиноматки); домашняя птица, такая как индейки, утки и куры (в том числе без ограничения бройлерные куры, куры-несушки); лошади (в том числе без ограничения чистокровные, тяжеловозные и полукровные); молодые телята; и рыба (в том числе без ограничения лосось, форель, тиляпия, сом и карпы); и ракообразные (в том числе без ограничения мелкие креветки и глубоководные креветки).
При применении согласно настоящему изобретению варианты ксиланазы можно скармливать животному до, после или одновременно с рационом. Последнее предпочтительно.
В конкретном варианте осуществления форма, в которой вариант ксиланазы добавляют в корм или добавку в корм для животных, является четко определенной. Четко определенное означает, что препарат ксиланазы и/или арабинофуранозидазы характеризуется по меньшей мере 50%-ной чистотой, определенной методом эксклюзионной хроматографии (см. пример 12 в WO 01/58275). В других конкретных вариантах осуществления препарат ксиланазы и/или арабинофуранозидазы характеризуется чистотой, составляющей по меньшей мере 60, 70, 80, 85, 88, 90, 92, 94 или по меньшей мере 95%, определенной с помощью этого способа.
Четко определенный препарат ксиланазы является предпочтительным. Например, гораздо проще правильно дозировать в корм ксиланазу, которая по существу не характеризуется вмешательством или загрязнением другими ксиланазами. Выражение ʺправильно дозироватьʺ относится, в частности, к цели получения последовательных и постоянных результатов и возможности оптимизировать дозировку на основе желаемого эффекта.
Однако для применения в корме для животных ксиланаза не обязательно должна быть такой чистой, например, она может содержать другие ферменты, и в этом случае ее можно называть препаратом ксиланазы.
Препарат ксиланазы можно (a) добавлять непосредственно в корм или (b) его можно использовать при получении одной или нескольких промежуточных композиций, таких как кормовые добавки или премиксы, которые впоследствии добавляют в корм (или используют в процессе обработки). Степень чистоты, описанная выше, относится к чистоте исходного препарата ксиланазы, независимо от того, применяют ли его согласно (а) или (b) выше.
Способы улучшения пищевой ценности корма для животных
Настоящее изобретение также относится к способу улучшения пищевой ценности корма для животных, содержащего материал на растительной основе, полученный из подсемейства Panicoideae, включающему добавление в корм варианта ксиланазы.
Выражение ʺулучшение пищевой ценности корма для животныхʺ означает улучшение доступности питательных веществ в корме. Пищевая ценность относится, в частности, к улучшению солюбилизации и разрушению арабиноксилансодержащей фракции (например, такой как гемицеллюлоза) корма, что приводит к увеличению высвобождения питательных веществ из клеток эндосперма, которые имеют клеточные стенки, состоящие из чрезвычайно трудноразлагаемой гемицеллюлозы. Следовательно, повышенное высвобождение арабиноксилановых олигомеров указывает на разрушение клеточных стенок, и в результате пищевая ценность корма улучшается, что приводит к увеличению скорости роста, и/или прироста массы, и/или конверсии корма (т. e. массы потребленного корма относительно прироста массы). Кроме того, высвобождение арабиноксилановых олигомеров может привести к улучшению использования этих компонентов как таковых либо непосредственно, либо путем бактериальной ферментации в задней кишке, что приводит к выработке короткоцепочечных жирных кислот, которые могут легко абсорбироваться в задней кишке и использоваться в энергетическом метаболизме.
Способы улучшения продуктивности животных
Настоящее изобретение дополнительно относится к способу улучшения одного или нескольких параметров продуктивности животного, включающему введение одному или нескольким животным варианта ксиланазы и материала на растительной основе, полученного из подсемейства Panicoideae.
Материал на растительной основе, полученный из подсемейства Panicoideae, можно вводить вместе с вариантом ксиланазы или отдельно от него. Вариант ксиланазы можно вводить в композиции или в добавке в корм для животных. В одном варианте осуществления материал на растительной основе, полученный из подсемейства Panicoideae, представляет собой маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское или представлен в обработанной форме, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское или любая их комбинация. В дополнительном варианте осуществления материал на растительной основе, полученный из подсемейства Panicoideae, получен из фракции семян (такой как эндосперм и/или шелуха) растения.
В одном варианте осуществления улучшение продуктивности животного представляет собой увеличение прироста массы тела. В другом варианте осуществления улучшение представляет собой улучшение коэффициента конверсии корма. В дополнительном варианте осуществления улучшение представляет собой повышение эффективности кормления. В дополнительном варианте осуществления улучшение представляет собой увеличение прироста массы тела, и/или улучшение коэффициента конверсии корма, и/или повышение эффективности кормления.
Способы солюбилизации ксилана из материалов на растительной основе
Настоящее изобретение дополнительно относится к способам солюбилизации ксилана из материала на растительной основе, например, путем разрушения ксилозного остова стерически затрудненного арабиноксилана, находящегося в материале на растительной основе, полученном из подсемейства Panicoideae, с солюбилизированием, тем самым, увеличенных количеств арабиноксилана, которые измеряют в виде арабинозы и ксилозы. Увеличение разрушения и, следовательно, увеличение высвобождения арабинозы и ксилозы могут привести к преимуществам для многих отраслей промышленности, в которых применяют материал на растительной основе, полученный из подсемейства Panicoideae.
Количество крахмала, присутствующего в необработанном растительном материале, затрудняет обнаружение значительной солюбилизации арабиноксилана. Таким образом, модельные субстраты, в которых крахмал и жир, присутствующие в растительном материале, удаляют без влияния на степень замещения, можно применять с целью определения улучшенных комбинаций ферментов по сравнению с комбинациями, известными из уровня техники. Одним из модельных субстратов является обезжиренный обескрахмаленный маис (DFDSM), и его можно получить, как описано в примерах. Важно, чтобы модельный субстрат не был получен с применением сильнокислых или сильнощелочных условий или высоких температур, поскольку такие условия могут приводить к удалению молекул углеводов боковой цепи и/или сложноэфирных групп, присутствующих в остове ксилана. Если эти группы боковых цепей будут удалены, то сложность и степень замещения снизятся, что приведет к получению арабиноксиланового материала, который легко разрушается известными растворами. По этой причине предварительная обработка теплом, кислотой и/или основанием применяется при конверсии биомассы.
Чтобы измерить солюбилизацию арабиноксилана, растворимый арабиноксилан гидролизуют кислотой, что приводит к высвобождению ксилозы и арабинозы в надосадочную жидкость. Затем выявляют эту ксилозу и арабинозу с применением, например, способа HPLC, описанного в данном документе. Чем выше степень солюбилизации арабиноксилана, тем больше количество ксилозы и арабинозы, высвобождающихся при кислотном гидролизе. Считается, что увеличение солюбилизации арабиноксилана обеспечивает раскрытие клеточных стенок, что может привести к высвобождению питательных веществ, таких как крахмал и белок, которые заключены внутри. Высвобождение крахмала и других питательных веществ может приводить к улучшению продуктивности животных и/или улучшению пищевой ценности корма для животных.
В одном варианте осуществления процентное содержание растворенного ксилана составляет по меньшей мере 4%, когда способ осуществляют в условиях реакции при 20 мкг варианта ксиланазы на грамм обезжиренного обескрахмаленного маиса (DFDSM) и инкубации при 40°C, pH 5, в течение 2,5 часа.
В другом варианте осуществления вариант ксиланазы обеспечивает солюбилизирование с получением по меньшей мере 7% растворенного ксилана из материала на растительной основе, полученного из подсемейства Panicoideae, когда способ осуществляют в условиях реакции при 20 мкг варианта ксиланазы на грамм обезжиренного обескрахмаленного маиса (DFDSM) и инкубации при 40°С, рН 5, в течение 2,5 часа.
В более предпочтительном варианте осуществления вариант ксиланазы обеспечивает солюбилизирование с получением по меньшей мере 9,5% растворенного ксилана из материала на растительной основе, полученного из подсемейства Panicoideae, когда способ осуществляют в условиях реакции при 20 мкг варианта ксиланазы на грамм обезжиренного обескрахмаленного маиса (DFDSM) и инкубации при 40°С, рН 5, в течение 2,5 часа.
Способы высвобождения крахмала
Настоящее изобретение дополнительно относится к способу высвобождения крахмала из материала на растительной основе, включающему обработку материала на растительной основе, полученного из подсемейства Panicoideae, с помощью варианта ксиланазы.
Способы получения продуктов ферментации
Способы получения продуктов ферментации из неклейстеризованного крахмалсодержащего материала
Настоящее изобретение также относится к способам получения продуктов ферментации из крахмалсодержащего материала без клейстеризации (т. e. без тепловой обработки) крахмалсодержащего материала (часто называемых способом ʺгидролиза сырого крахмалаʺ). Продукт ферментации, такой как этанол, можно получать без разжижения водного суспензии, содержащей крахмалсодержащий материал и воду. В одном варианте осуществления способ по настоящему изобретению включает осахаривание (например, измельченного) крахмалсодержащего материала, например, гранулированного крахмала, ниже начальной температуры клейстеризации, предпочтительно в присутствии альфа-амилазы и/или фермента(ферментов), обеспечивающего (обеспечивающих) образование источника углеводов, с получением сахаров, которые можно ферментировать в продукт ферментации при помощи подходящего ферментирующего организма. В этом варианте осуществления желаемый продукт ферментации, например, этанол, получают из неклейстеризованных (т. e. без тепловой обработки), предпочтительно размолотых зерен злаковых культур, таких как кукуруза.
Соответственно, в одном аспекте настоящее изобретение относится к способам получения продукта ферментации из крахмалсодержащего материала, включающим одновременно осахаривание и ферментацию крахмалсодержащего материала с использованием ферментов, обеспечивающих образование источника углеводов, и ферментирующего организма при температуре ниже начальной температуры клейстеризации указанного крахмалсодержащего материала в присутствии варианта протеазы по настоящему изобретению. Осахаривание и ферментация также могут быть раздельными. Таким образом, в другом аспекте настоящее изобретение относится к способам получения продуктов ферментации, включающим следующие стадии:
(i) осахаривания крахмалсодержащего материала при температуре ниже начальной температуры клейстеризации с применением фермента, обеспечивающего образование источника углеводов, например, глюкоамилазы; и
(ii) ферментирования с применением ферментирующего организма;
где стадию (i) проводят с использованием по меньшей мере глюкоамилазы и варианта ксиланазы по настоящему изобретению.
В одном варианте осуществления альфа-амилазу, в частности, альфа-амилазу грибов, также добавляют на стадии (i). Стадии (i) и (ii) можно выполнять одновременно.
Способы получения продуктов ферментации из клейстеризованного крахмалсодержащего материала
В данном аспекте настоящее изобретение относится к способам получения продуктов ферментации, особенно этанола, из крахмалсодержащего материала, причем данный способ включает стадию разжижения и последовательно или одновременно выполняемые стадии осахаривания и ферментирования. Следовательно, настоящее изобретение относится к способу получения продукта ферментации из крахмалсодержащего материала, включающему стадии:
(a) разжижения крахмалсодержащего материала в присутствии альфа-амилазы;
(b) осахаривания разжиженного материала, полученного на стадии (а), с применением фермента, обеспечивающего образование источника углеводов;
(c) ферментирования с применением ферментирующего организма;
где вариант ксиланазы по настоящему изобретению присутствует на стадиях a), b) и/или c).
Суспензию нагревают выше температуры клейстеризации и могут добавлять вариант альфа-амилазы для инициации разжижения (разбавления). В одном варианте осуществления суспензия может подвергаться тепловой обработке для дополнительной клейстеризации суспензии перед тем, как ее подвергают действию альфа-амилазы на стадии (a). В одном варианте осуществления разжижение можно выполнять в виде трехступенчатого способа горячей суспензии. Суспензию нагревают до 60-95°C, предпочтительно до 70-90°C, например, предпочтительно до 80-85°C при pH 4-6, в частности, при pH 4,5-5,5, и добавляют вариант альфа-амилазы, необязательно вместе с пуллуланазой и/или протеазой, предпочтительно металлопротеиназой, для инициации разжижения (разбавления). Процесс разжижения обычно проводят при рН 4-6, в частности, при рН от 4,5 до 5,5. Стадию осахаривания (b) можно проводить с применением условий, хорошо известных в данной области. Например, полное осуществление способа осахаривания может длиться от приблизительно 24 до приблизительно 72 часов, тем не менее обычно выполняют предварительное осахаривание, как правило, за 40-90 минут при температуре 30-65°C, как правило, приблизительно при 60°C, с последующим полным осахариванием в ходе ферментирования в осуществлении способа одновременного осахаривания и ферментации (SSF-способ). Осахаривание обычно проводят при температуре от 20°С до 75°С, в частности, при 40-70°С, обычно около 60°С, и при рН от 4 до 5, обычно приблизительно 4,5. Наиболее широко применяемым способом получения продукта ферментации, особенно этанола, является способ одновременного осахаривания и ферментации (SSF), в котором отсутствует стадия выдержки для осахаривания, что означает, что ферментирующий организм, такой как дрожжи, и фермент(ферменты) могут быть добавлены вместе. SSF обычно можно проводить при температуре от 25°С до 40°С, например, от 28°С до 35°С, например, от 30°С до 34°С, предпочтительно около приблизительно 32°С. В одном варианте осуществления ферментирование продолжается от 6 до 120 часов, в частности, от 24 до 96 часов.
Крахмалсодержащие материалы
В способе по настоящему изобретению можно применять любой подходящий крахмалсодержащий исходный материал. Исходный материал обычно выбирают, исходя из необходимого продукта ферментации. Примеры крахмалсодержащих исходных материалов, подходящих для применения в способах по настоящему изобретению, включают ячмень, бобы, маниоку, зерновые, кукурузу, майло, горох, картофель, рис, рожь, саго, сорго, сладкий картофель, тапиоку, пшеницу и цельные зерна или любую их смесь. Крахмалсодержащий материал также может представлять собой восковой или не восковой тип кукурузы и ячменя. В одном из предпочтительных вариантов осуществления крахмалсодержащим материалом является кукуруза. В одном из предпочтительных вариантов осуществления крахмалсодержащим материалом является пшеница.
Продукты ферментации
Термин ʺпродукт ферментацииʺ означает продукт, полученный в способе или процессе, включающем ферментацию с использованием ферментирующего организма. Продукты ферментации включают спирты (например, этанол, метанол, бутанол); органические кислоты (например, лимонную кислоту, уксусную кислоту, итаконовую кислоту, молочную кислоту, янтарную кислоту, глюконовую кислоту); кетоны (например, ацетон); аминокислоты (например, глутаминовую кислоту); газы (например, H2 и CO2); антибиотики (например, пенициллин и тетрациклин); ферменты; витамины (например, рибофлавин, B12, бета-каротин) и гормоны. В предпочтительном варианте осуществления продукт ферментации представляет собой этанол, например, топливный этанол; питьевой этанол, т. e. питьевые нейтральные спиртные напитки; или промышленный этанол или продукты, используемые в промышленности потребительских спиртных напитков (например, пива и вина), молочной промышленности (например, кисломолочных продуктов), кожевенной промышленности и табачной промышленности Предпочтительные типы пива включают эли, сорта крепкого пива, сорта пива "портер", сорта светлого пива, сорта горького пива, солодовые напитки, хаппосю, пиво с высоким содержанием алкоголя, слабоалкогольное пиво, низкокалорийное пиво или легкое пиво. В одном варианте осуществления продукт ферментации представляет собой этанол.
Ферментирующие организмы
Термин ʺферментирующий организмʺ относится к любому организму, включая бактериальные и грибковые организмы, такие как дрожжи и нитчатые грибы, пригодному для получения желаемого продукта ферментации. Подходящие ферментирующие организмы способны ферментировать, т. e. превращать ферментируемые сахара, такие как арабиноза, фруктоза, глюкоза, мальтоза, манноза или ксилоза, напрямую или косвенно в желаемый продукт ферментации.
Примеры ферментирующих организмов включают грибковые организмы, такие как дрожжи. Предпочтительные дрожжи включают штаммы Saccharomyces, в частности, Saccharomyces cerevisiae или Saccharomyces uvarum; штаммы Pichia, в частности, Pichia stipitis, такие как Pichia stipitis CBS 5773 или Pichia pastoris; штаммы Candida, в частности, Candida arabinofermentans, Candida boidinii, Candida diddensii, Candida shehatae, Candida sonorensis, Candida tropicalis или Candida utilis. Другие ферментирующие организмы включают штаммы Hansenula, в частности, Hansenula anomala или Hansenula polymorpha; штаммы Kluyveromyces, в частности, Kluyveromyces fragilis или Kluyveromyces marxianus; и штаммы Schizosaccharomyces, в частности, Schizosaccharomyces pombe.
В одном варианте осуществления ферментирующий организм представляет собой организм, ферментирующий C6-сахар, такой как штамм, например, Saccharomyces cerevisiae.
В одном варианте осуществления ферментирующий организм представляет собой организм, ферментирующий C5-сахар, такой как штамм, например, Saccharomyces cerevisiae.
Ферментация
Условия ферментации определяют на основании, например, вида растительного материала, доступных ферментируемых сахаров, ферментирующего организма (организмов) и/или желаемого продукта ферментации. Специалист в данной области может легко определить подходящие условия ферментации. Ферментацию можно проводить в традиционно применяемых условиях. Предпочтительные процессы ферментации представляют собой анаэробные процессы.
Например, ферментацию можно проводить при температурах до 75°C, например, при 40-70°C, например, при 50-60°C. Однако также известны бактерии со значительно более низким температурным оптимумом, примерно до комнатной температуры (около 20°С). Примеры подходящих ферментирующих организмов можно найти в разделе ʺФерментирующие организмыʺ выше.
Для получения этанола с применением дрожжей ферментация может продолжаться от 24 до 96 часов, в частности, от 35 до 60 часов. В одном варианте осуществления ферментацию проводят при температуре от 20 до 40°С, предпочтительно от 26 до 34°С, в частности, около 32°С. В одном варианте осуществления значение pH составляет от pH 3 до pH 6, предпочтительно около pH 4-5.
Применение в хлебопекарном производстве
В настоящем изобретении раскрыт способ приготовления теста, который включает введение в тесто варианта ксиланазы по настоящему изобретению.
Фраза ʺвведение в тестоʺ определена в данном документе как добавление варианта ксиланазы в тесто, к любому ингредиенту, из которого должно быть изготовлено тесто, и/или к любой смеси ингредиентов теста, из которых должно быть изготовлено тесто.
Другими словами, вариант ксиланазы можно добавлять на любой стадии получения теста и можно добавлять на одной, двух или более стадиях. Вариант ксиланазы можно добавлять к ингредиентам теста, которое замешивают и выпекают, с применением способов, хорошо известных в данной области.
Термин ʺтестоʺ определен в данном документе как смесь муки и других ингредиентов, достаточно плотная для замешивания или раскатывания.
Тесто может содержать муку, полученную из любого зерна злаков, включая пшеницу, ячмень, рожь, овес, кукурузу, сорго, рис, просо и любые их смеси.
Тесто также может содержать другие традиционные ингредиенты теста, например, белки, такие как сухое молоко, глютен и соя; яйца (или цельные яйца, или яичные желтки, или яичные белки); окислитель, такой как аскорбиновая кислота, бромат калия, йодат калия, азодикарбонамид (ADA) или персульфат аммония; аминокислоту, такую как L-цистеин; крахмал и/или соль, такую как хлорид натрия, ацетат кальция, сульфат натрия или сульфат кальция. Крахмал может представлять собой пшеничный крахмал, кукурузный крахмал, маисовый крахмал, крахмал тапиоки, крахмал маниоки, картофельный крахмал; и/или сахар, такой как сахароза, тростниковый сахар, лактоза или кукурузный сироп с высоким содержанием фруктозы.
Тесто может содержать жир (триглицерид), такой как гранулированный жир или шортенинг.
Тесто может быть свежим, замороженным или частично выпеченным (предварительно выпеченным).
Тесто обычно представляет собой заквашенное тесто или тесто, подлежащее разрыхлению. Тесто можно разрыхлять различными способами, например, путем добавления химических разрыхлителей, например, бикарбоната натрия, или путем добавления закваски (заквашивание теста), но предпочтительно разрыхлять тесто путем добавления подходящей дрожжевой культуры, такой как культура Saccharomyces cerevisiae (пекарские дрожжи), например, коммерчески доступного штамма S. cerevisiae.
Выпеченный продукт
Настоящее изобретение также относится к способу приготовления выпеченного или приготовленного на пару продукта из теста (такого как волокнистое тесто), или мягкого, или с хрустящей корочкой, и белого, светлого или темного типа.
Примерами выпеченных продуктов являются хлеб, как правило, в форме буханок или рулетов, формовой хлеб, хлеб для тостов, формовой хлеб из форм с крышкой и без крышки, булочки, булочки для гамбургеров, рулеты, багеты, черный хлеб, цельнозерновой хлеб, хлеб с начинкой, хлеб с отрубями, плоский хлеб, тортилья, лаваш, арабский хлеб, индийский плоский хлеб, приготовленный на пару хлеб и любые их разновидности.
Предпочтительные варианты осуществления настоящего изобретения
Предпочтительные варианты осуществления настоящего изобретения описаны в ряде пунктов, приведенных ниже.
1. Вариант ксиланазы, предусматривающий замену в одном или нескольких положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317, и 321 SEQ ID NO: 1, где вариант ксиланазы обладает ксиланазной активностью и где вариант ксиланазы характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1, 2, 3, 4, 5 или 6.
2. Вариант ксиланазы по п 1, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1.
3. Вариант ксиланазы по любому из пп. 1-2, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 2.
4. Вариант ксиланазы по любому из пп. 1-3, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 3.
5. Вариант ксиланазы по любому из пп. 1-4, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 4.
6. Вариант ксиланазы по любому из пп. 1-5, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 5.
7. Вариант ксиланазы по любому из пп. 1-6, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 6.
8. Вариант ксиланазы по любому из пп. 1-7, где вариант является выделенным.
9. Вариант ксиланазы по любому из пп. 1-8, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 1.
10. Вариант ксиланазы по п. 9, где исходная ксиланаза содержит аминокислотную последовательность под SEQ ID NO: 1 или состоит из нее, или представляет собой фрагмент SEQ ID NO: 1, где фрагмент обладает ксиланазной активностью.
11. Вариант ксиланазы по любому из пп. 1-8, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 2.
12. Вариант ксиланазы по п. 11, где исходная ксиланаза содержит аминокислотную последовательность под SEQ ID NO: 2 или состоит из нее, или представляет собой фрагмент SEQ ID NO: 2, где фрагмент обладает ксиланазной активностью.
13. Вариант ксиланазы по любому из пп. 1-8, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 3.
14. Вариант ксиланазы по п. 13, где исходная ксиланаза содержит аминокислотную последовательность под SEQ ID NO: 3 или состоит из нее, или представляет собой фрагмент SEQ ID NO: 3, где фрагмент обладает ксиланазной активностью.
15. Вариант ксиланазы по любому из пп. 1-8, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 4.
16. Вариант ксиланазы по п. 15, где исходная ксиланаза содержит аминокислотную последовательность под SEQ ID NO: 4 или состоит из нее, или представляет собой фрагмент SEQ ID NO: 4, где фрагмент обладает ксиланазной активностью.
17. Вариант ксиланазы по любому из пп. 1-8, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 5.
18. Вариант ксиланазы по п. 17, где исходная ксиланаза содержит аминокислотную последовательность под SEQ ID NO: 5 или состоит из нее, или представляет собой фрагмент SEQ ID NO: 5, где фрагмент обладает ксиланазной активностью.
19. Вариант ксиланазы по любому из пп. 1-8, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 6.
20. Вариант ксиланазы по п. 19, где исходная ксиланаза содержит аминокислотную последовательность под SEQ ID NO: 6 или состоит из нее, или представляет собой фрагмент SEQ ID NO: 6, где фрагмент обладает ксиланазной активностью.
21. Вариант ксиланазы по любому из пп. 1-20, который характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95% идентичной, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной аминокислотной последовательностью исходной ксиланазы.
22. Вариант ксиланазы по любому из пп. 1-21, где исходная ксиланаза получена или может быть получена из таксономического отряда Bacillales, предпочтительно из таксономического семейства Bacillaceae.
23. Вариант ксиланазы по любому из пп. 1-22, где исходная ксиланаза получена или может быть получена из таксономического рода Bacillus subtilis, Bacillus amyloliquefaciens, Bacillus licheniformis или Paenibacillus pabuli.
24. Вариант ксиланазы по любому из пп. 1-20, где количество изменений составляет 1-20, например, 1-10 и 1-5, как, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений.
25. Вариант ксиланазы по любому из пп. 1-24, который предусматривает замену в положении, соответствующем положению 24.
26. Вариант ксиланазы по п. 25, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Trp.
27. Вариант ксиланазы по любому из пп. 1-26, который предусматривает замену в положении, соответствующем положению 26.
28. Вариант ксиланазы по п. 27, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Glu.
29. Вариант ксиланазы по любому из пп. 1-28, который предусматривает замену в положении, соответствующем положению 36.
30. Вариант ксиланазы по п. 29, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu или Thr.
31. Вариант ксиланазы по любому из пп. 1-30, который предусматривает замену в положении, соответствующем положению 37.
32. Вариант ксиланазы по п. 31, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu или Thr.
33. Вариант ксиланазы по любому из пп. 1-32, который предусматривает замену в положении, соответствующем положению 60.
34. Вариант ксиланазы по п. 33, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Asn.
35. Вариант ксиланазы по любому из пп. 1-34, который предусматривает замену в положении, соответствующем положению 71.
36. Вариант ксиланазы по п. 35, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ile, Leu или Thr.
37. Вариант ксиланазы по любому из пп. 1-36, который предусматривает замену в положении, соответствующем положению 74.
38. Вариант ксиланазы по п. 37, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ile или Leu.
39. Вариант ксиланазы по любому из пп. 1-38, который предусматривает замену в положении, соответствующем положению 75.
40. Вариант ксиланазы по п. 39, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Asn, Glu, Leu или Thr.
41. Вариант ксиланазы по любому из пп. 1-40, который предусматривает замену в положении, соответствующем положению 76.
42. Вариант ксиланазы по п. 41, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu.
43. Вариант ксиланазы по любому из пп. 1-42, который предусматривает замену в положении, соответствующем положению 124.
44. Вариант ксиланазы по п. 43, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Tyr.
45. Вариант ксиланазы по любому из пп. 1-44, который предусматривает замену в положении, соответствующем положению 133.
46. Вариант ксиланазы по п. 45, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ile.
47. Вариант ксиланазы по любому из пп. 1-46, который предусматривает замену в положении, соответствующем положению 155.
48. Вариант ксиланазы по п. 47, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Met.
49. Вариант ксиланазы по любому из пп. 1-48, который предусматривает замену в положении, соответствующем положению 167.
50. Вариант ксиланазы по п. 49, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности на Glu.
51. Вариант ксиланазы по любому из пп. 1-50, который предусматривает замену в положении, соответствующем положению 208.
52. Вариант ксиланазы по п. 51, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Leu.
53. Вариант ксиланазы по любому из пп. 1-52, который предусматривает замену в положении, соответствующем положению 317.
54. Вариант ксиланазы по п. 53, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Asp.
55. Вариант ксиланазы по любому из пп. 1-54, который предусматривает замену в положении, соответствующем положению 321.
56. Вариант ксиланазы по п. 55, где замена представляет собой замену на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr или Val, в частности, на Ala.
57. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в двух положениях из соответствующих положениям 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
58. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в трех положениях, соответствующих положениям из 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
59. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в четырех положениях из соответствующих положениям из 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
60. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в пяти положениях из соответствующих положениям 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
61. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в шести положениях из соответствующих положениям 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
62. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в семи положениях из соответствующих положениям 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
63. Вариант ксиланазы по любому из пп. 1-56, который предусматривает замену в каждом из положений, соответствующих положениям 24, 26, 36, 37, 71, 74, 75, 76, 155 и 208.
64. Вариант ксиланазы по любому из пп. 1-63, который характеризуется улучшенным свойством по сравнению с исходной формой, где улучшенное свойство выбрано из группы, состоящей из эффективности катализа, скорости катализа, химической стабильности, устойчивости к окислению, активности при определенных значениях pH, стабильности при определенных значениях pH, удельной активности, стабильности в условиях хранения, связывания субстрата, расщепления субстрата, субстратной специфичности, стабильности в присутствии субстрата, поверхностных свойств, активности при определенных значениях температуры и термостабильности.
65. Вариант ксиланазы по п. 64, где исходная ксиланаза представляет собой SEQ ID NO: 1.
66. Вариант ксиланазы по любому из пп. 1-63, который характеризуется улучшенной термостабильностью по сравнению с исходной ксиланазой.
67. Вариант ксиланазы по любому из пп. 1-63, который характеризуется улучшенной термостабильностью по сравнению с SEQ ID NO: 1.
68. Композиция, содержащая вариант ксиланазы по любому из пп. 1-67 и средство для составления.
69. Композиция по п. 68, где средство для составления содержит одно или несколько из следующих соединений: глицерина, этиленгликоля, 1,2-пропиленгликоля или 1,3-пропиленгликоля, хлорида натрия, бензоата натрия, сорбата калия, сульфата натрия, сульфата калия, сульфата магния, тиосульфата натрия, карбоната кальция, цитрата натрия, декстрина, глюкозы, сахарозы, сорбита, лактозы, крахмала, каолина, мальтодекстрина, циклодекстрина, пшеницы, PVA, ацетата, фосфата и целлюлозы.
70. Композиция по любому из пп. 68-69, дополнительно содержащая один или несколько дополнительных ферментов.
71. Композиция по п. 70, где один или несколько дополнительных ферментов выбраны из группы, состоящей из ацетилксиланэстеразы, альфа-амилазы, бета-амилазы, арабинофуранозидазы, целлобиогидролазы, целлюлазы, ферулоилэстеразы, галактаназы, альфа-галактозидазы, бета-галактозидазы, бета-глюканазы, бета-глюкозидазы, липазы, глюкан-1,4-а-глюкозидазы, глюкан-1,4-альфа-мальтогидролазы, лизофосфолипазы, лизоцима, маннаназы, альфа-маннозидазы, бета-маннозидазы, фитазы, фосфолипазы А1, фосфолипазы А2, фосфолипазы С, фосфолипазы D, протеазы, пуллуланазы, пектиназы, пектинлиазы, ксиланазы, бета-ксилозидазы или любой их комбинации.
72. Композиция по любому из пп. 68-71, дополнительно содержащая один или несколько микроорганизмов.
73. Композиция по п. 72, где один или несколько микроорганизмов выбраны из группы, состоящей из Bacillus subtilis, Bacillus licheniformis, Bacillus amyloliquefaciens, Bacillus cereus, Bacillus pumilus, Bacillus polymyxa, Bacillus megaterium, Bacillus coagulans, Bacillus circulans, Bifidobacterium bifidum, Bifidobacterium animalis, Bifidobacterium sp., Carnobacterium sp., Clostridium butyricum, Clostridium sp., Enterococcus faecium, Enterococcus sp., Lactobacillus sp., Lactobacillus acidophilus, Lactobacillus farciminus, Lactobacillus rhamnosus, Lactobacillus reuteri, Lactobacillus salivarius, Lactococcus lactis, Lactococcus sp., Leuconostoc sp., Megasphaera elsdenii, Megasphaera sp., Pediococsus acidilactici, Pediococcus sp., Propionibacterium thoenii, Propionibacterium sp. и Streptococcus sp. или любой их комбинации.
74. Композиция по любому из пп. 68-73, дополнительно содержащая материал на растительной основе.
75. Композиция по п. 74, где материал на растительной основе получен из подсемейства Panicoideae
76. Композиция по п. 75, где материал на растительной основе, полученный из подсемейства Panicoideae, представляет собой маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское, или представлен в обработанной форме, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское, или любую их комбинацию.
77. Композиция по п. 74-75, где материал на растительной основе, полученный из подсемейства Panicoideae, получен из фракции семян (такой как эндосперм и/или шелуха) растения.
78. Гранула, содержащая вариант ксиланазы по любому из пп. 1-67 и средство для составления.
79. Гранула по п. 78, где одно или несколько средств для составления выбраны из перечня, состоящего из глицерина, этиленгликоля, 1,2-пропиленгликоля или 1,3-пропиленгликоля, хлорида натрия, бензоата натрия, сорбата калия, сульфата натрия, сульфата калия, сульфата магния, тиосульфата натрия, карбоната кальция, цитрата натрия, декстрина, глюкозы, сахарозы, сорбита, лактозы, крахмала, каолина и целлюлозы, предпочтительно выбраны из перечня, состоящего из 1,2-пропиленгликоля, 1,3-пропиленгликоля, сульфата натрия, декстрина, целлюлозы, тиосульфата натрия, каолина и карбоната кальция.
80. Гранула по любому из пп. 78-79, где гранула содержит частицу ядра и одно или несколько покрытий.
81. Гранула по п. 80, где покрытие содержит соль, и/или воск, и/или муку.
82. Гранула по любому из пп. 78-81, дополнительно содержащая один или несколько дополнительных ферментов.
83. Гранула по п. 82, где один или несколько дополнительных ферментов выбраны из группы, состоящей из ацетилксиланэстеразы, альфа-амилазы, бета-амилазы, арабинофуранозидазы, целлобиогидролазы, целлюлазы, ферулоилэстеразы, галактаназы, альфа-галактозидазы, бета-галактозидазы, бета-глюканазы, бета-глюкозидазы, липазы, глюкан-1,4-а-глюкозидазы, глюкан-1,4-альфа-мальтогидролазы, лизофосфолипазы, лизоцима, маннаназы, альфа-маннозидазы, бета-маннозидазы, фитазы, фосфолипазы А1, фосфолипазы А2, фосфолипазы С, фосфолипазы D, протеазы, пуллуланазы, пектиназы, пектинлиазы, ксиланазы, бета-ксилозидазы или любой их комбинации.
84. Кормовая добавка для животных, содержащая вариант ксиланазы по любому из пп. 1-67, композицию по любому из пп. 68-77 или гранулу по любому из пп. 78-83 и один или несколько компонентов, выбранных из группы, состоящей из:
одного или нескольких витаминов;
одного или нескольких минералов;
одной или нескольких аминокислот;
одного или нескольких средств растительного происхождения;
одного или нескольких пребиотиков;
одной или нескольких органических кислот и
одного или нескольких других кормовых ингредиентов.
85. Жидкий состав, содержащий вариант ксиланазы по любому из пп. 1-67.
86. Жидкий состав по п. 85, где доза варианта ксиланазы составляет от 0,01% до 25% (вес/вес) жидкого состава, предпочтительно от 0,05% до 20% (вес/вес), более предпочтительно от 0,2% до 15% (вес/вес), более предпочтительно от 0,5% до 15% (вес/вес) или наиболее предпочтительно от 1,0% до 10% (вес/вес) варианта ксиланазы.
87. Жидкий состав по любому из пп. 85-86, где состав дополнительно содержит от 20% до 80% (вес/вес) полиола.
88. Жидкий состав по п. 87, где полиол выбран из группы, состоящей из глицерина, сорбита, пропиленгликоля (MPG), этиленгликоля, диэтиленгликоля, триэтиленгликоля, 1,2-пропиленгликоля или 1,3-пропиленгликоля, дипропиленгликоля, полиэтиленгликоля (PEG), характеризующегося средней молекулярной массой ниже приблизительно 600, и полипропиленгликоля (PPG), характеризующегося средней молекулярной массой ниже приблизительно 600, или любой их комбинации.
89. Жидкий состав по любому из пп. 85-88, где состав дополнительно содержит от 0,01% до 2,0% (вес/вес) консерванта.
90. Жидкий состав по п. 89, где консервант выбран из группы, состоящей из сорбата натрия, сорбата калия, бензоата натрия и бензоата калия или любой их комбинации.
91. Жидкий состав по любому из пп. 85-90, дополнительно содержащий один или несколько компонентов, выбранных из перечня, состоящего из:
одного или нескольких ферментов;
одного или нескольких микроорганизмов;
одного или нескольких витаминов;
одного или нескольких минералов;
одной или нескольких аминокислот;
одного или нескольких средств растительного происхождения;
одного или нескольких пребиотиков;
одной или нескольких органических кислот и
одного или нескольких других кормовых ингредиентов.
92. Способ получения корма для животных, включающий нанесение жидкого состава по любому из пп. 85-91 на материал на растительной основе.
93. Способ по п. 92, где жидкий состав наносят с помощью распылителя.
94. Способ по любому из пп. 92-93, где материал на растительной основе предусматривает бобовые, злаки, разновидности овса, рожь, ячмень, пшеницу, маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское, сою, дикую сою, бобы, люпин, фасоль остролистную, фасоль огненно-красную, Phaseolus filiformis, лимскую фасоль, фасоль обыкновенную, кормовые бобы (бобы обыкновенные), нут, чечевицу, арахис, испанский арахис, канолу, рапс (рапс масличный), рис, свеклу, капусту, сахарную свеклу, шпинат, киноа или горох в их обработанной форме (такой как соевый шрот, рапсовый шрот) или любую их комбинацию.
95. Способ по любому из пп. 92-94, где материал на растительной основе находится в гранулированной форме.
96. Корм для животных, содержащий вариант ксиланазы по любому из пп. 1-67, композицию по любому из пп. 68-77, гранулу по любому из пп. 78-83, кормовую добавку для животных по п. 84 или жидкий состав по любому из пп. 85-91 и материал на растительной основе.
97. Корм для животных по п. 96, где материал на растительной основе получен из подсемейства Panicoideae.
98. Корм для животных по п. 97, где материал на растительной основе, полученный из подсемейства Panicoideae, представляет собой маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское, или представлен в обработанной форме, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское, или любую их комбинацию.
99. Корм для животных по любому из пп. 96-97, где материал на растительной основе, полученный из подсемейства Panicoideae, получен из фракции семян (такой как эндосперм и/или шелуха) растения.
100. Гранулированный корм для животных, полученный с помощью способа по любому из пп. 92-95 или с помощью гранулирования корма для животных по любому из пп. 96-99.
101. Способ улучшения одного или нескольких параметров продуктивности животного, включающий введение одному или нескольким животным варианта ксиланазы по любому из пп. 1-67, композиции по любому из пп. 68-77, гранулы по любому из пп. 78-83, кормовой добавки для животных по п. 84, жидкого состава по любому из пп. 85-91, корма для животных по любому из пп. 96-99 или гранулированного корма для животных по п. 100.
102. Способ солюбилизации ксилана из материала на растительной основе, включающий обработку материала на растительной основе с помощью варианта ксиланазы по любому из пп. 1-67, композиции по любому из пп. 68-77, гранулы по любому из пп. 78-83, кормовой добавки для животных по п. 84 или жидкого состава по любому из пп. 85-91.
103. Способ высвобождения крахмала из материала на растительной основе, включающий обработку материала на растительной основе с помощью варианта ксиланазы по любому из пп. 1-67, композиции по любому из пп. 68-77, гранулы по любому из пп. 78-83, кормовой добавки для животных по п. 84 или жидкого состава по любому из пп. 85-91.
104. Способ улучшения пищевой ценности корма для животных, включающий добавление в корм, содержащий материал на растительной основе, варианта ксиланазы по любому из пп. 1-67, композиции по любому из пп. 68-77, гранулы по любому из пп. 78-83, кормовой добавки для животных по п. 84 или жидкого состава по любому из пп. 85-91.
105. Способ по любому из пп. 102-104, где материал на растительной основе получен из подсемейства Panicoideae.
106. Способ по п. 105, где материал на растительной основе, полученный из подсемейства Panicoideae, представляет собой маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское, или представлен в обработанной форме, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское, или любую их комбинацию.
107. Способ по любому из пп. 105-106, где материал на растительной основе, полученный из подсемейства Panicoideae, получен из фракции семян (такой как эндосперм и/или шелуха) растения.
108. Применение варианта ксиланазы по любому из пп. 1-67, композиции по любому из пп. 68-77, гранулы по любому из пп. 78-83, кормовой добавки для животных по п. 84, жидкого состава по любому из пп. 85-91, корма для животных по любому из пп. 96-99 или гранулированного корма для животных по п. 100:
в корме для животных;
в кормовых добавках для животных;
при получении композиции для применения в корме для животных;
для улучшения пищевой ценности корма для животных;
для повышения усвояемости корма для животных;
для улучшения одного или нескольких параметров продуктивности у животного;
для солюбилизации ксилана из материала на растительной основе;
для высвобождения крахмала из материала на растительной основе.
109. Применение по п. 108, где материал на растительной основе получен из подсемейства Panicoideae.
110. Применение по п. 109, где материал на растительной основе, полученный из подсемейства Panicoideae, представляет собой маис, кукурузу, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское, или представлен в обработанной форме, например, молотая кукуруза, молотый маис, обезжиренный маис, обезжиренный обескрахмаленный маис, молотое сорго, молотое просо прутьевидное, молотое просо культурное, молотое просо итальянское, молотое просо африканское, или любую их комбинацию.
111. Применение по любому из пп. 108-110, где материал на растительной основе, полученный из подсемейства Panicoideae, получен из фракции семян (такой как эндосперм и/или шелуха) растения.
112. Способ получения продукта ферментации, включающий следующие стадии:
(a) осахаривание крахмалсодержащего материала при температуре ниже начальной температуры клейстеризации с применением альфа-амилазы, глюкоамилазы и варианта ксиланазы по любому из пп. 1-67; и
(b) ферментирование с применением ферментирующего организма.
113. Способ получения продукта ферментации из крахмалсодержащего материала, включающий стадии:
(a) разжижения крахмалсодержащего материала с помощью альфа-амилазы;
(b) осахаривания разжиженного материала, полученного на стадии (а), с помощью глюкоамилазы и варианта ксиланазы по любому из пп. 1-67;
(c) ферментирования с применением ферментирующего организма.
114. Способ по п. 113, где стадии b) и c) выполняют одновременно.
115. Способ по любому из пп. 112-114, где крахмалсодержащий материал предусматривает маис, кукурузу, пшеницу, рожь, ячмень, тритикале, сорго, просо прутьевидное, просо культурное, просо африканское, просо итальянское.
116. Способ по любому из пп. 112-115, где продукт ферментации представляет собой спирт, в частности, этанол.
117. Способ по любому из пп. 112-116, где ферментирующий организм представляет собой дрожжи, в частности, Saccharomyces sp., более конкретно Saccharomyces cerevisiae.
118. Применение варианта ксиланазы по любому из пп. 1-67 для получения этанола из крахмалсодержащего материала.
119. Способ получения теста или выпеченного продукта, приготовленного из теста, который включает введение в тесто варианта ксиланазы по любому из пп. 1-67.
120. Способ по п. 119, где тесто содержит муку, выбранную из группы, состоящей из пшеницы, ячменя, ржи, овса, кукурузы, сорго, риса, проса и любых их смесей.
121. Выделенный полинуклеотид, кодирующий вариант ксиланазы по любому из пп. 1-67, где полинуклеотид функционально связан с одной или несколькими регуляторными последовательностями, которые управляют продуцированием варианта ксиланазы в рекомбинантной клетке-хозяине.
122. Конструкция на основе нуклеиновой кислоты, содержащая полинуклеотид по п. 121.
123. Вектор экспрессии, содержащий полинуклеотид по п. 121.
124. Рекомбинантная клетка-хозяин, содержащая конструкцию на основе нуклеиновой кислоты по п. 122 или вектор экспрессии по п. 123.
125. Способ получения варианта ксиланазы, включающий:
a. культивирование клетки-хозяина по п. 124 в условиях, подходящих для экспрессии варианта ксиланазы; и
b. выделение варианта ксиланазы.
126. Трансгенные растение, часть растения или растительная клетка, трансформированные с помощью полинуклеотида по п. 121.
127. Способ получения варианта ксиланазы по любому из пп. 1-67, включающий:
a. культивирование трансгенных растения или растительной клетки, содержащих полинуклеотид, кодирующий вариант ксиланазы, в условиях, благоприятных для выработки варианта ксиланазы; и
b. выделение варианта ксиланазы.
128. Полинуклеотид, кодирующий вариант ксиланазы по любому из пп. 1-67.
129. Конструкция на основе нуклеиновой кислоты или вектор экспрессии, содержащие полинуклеотид по п. 128, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют продуцированием полипептида у экспрессирующего хозяина.
130. Рекомбинантная клетка-хозяин, содержащая полинуклеотид по п. 128, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют продуцированием полипептида.
131. Способ получения варианта ксиланазы по любому из пп. 1-67, включающий:
(a) культивирование клетки, которая в своей форме дикого типа вырабатывает полипептид, в условиях, благоприятных для выработки полипептида; и
(b) выделение полипептида.
132. Способ получения варианта ксиланазы по любому из пп. 1-67, включающий:
(a) культивирование клетки-хозяина по п. 130 в условиях, благоприятных для выработки полипептида; и
(b) выделение полипептида.
133. Состав на основе цельного бульона или композиция на основе клеточной культуры, содержащие вариант ксиланазы по любому из пп. 1-67.
134. Способ получения варианта ксиланазы, включающий введение в исходную ксиланазу замены в одном или нескольких положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317 и 321 SEQ ID NO: 1, где вариант обладает ксиланазной активностью; и выделение варианта ксиланазы.
135. Способ по п. 134, где вариант ксиланазы характеризуется улучшенным свойством по сравнению с исходной формой, где улучшенное свойство выбрано из группы, состоящей из эффективности катализа, скорости катализа, химической стабильности, устойчивости к окислению, активности при определенных значениях pH, стабильности при определенных значениях pH, удельной активности, стабильности в условиях хранения, связывания субстрата, расщепления субстрата, субстратной специфичности, стабильности в присутствии субстрата, поверхностных свойств, активности при определенных значениях температуры и термостабильности.
136. Способ по любому из пп. 134-135, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1.
137. Способ по любому из пп. 134-136, где замена выбрана из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A.
138. Вариант ксиланазы, полученный с помощью способа по любому из пп. 134-137.
Настоящее изобретение дополнительно описано с помощью следующих примеров, которые не следует толковать как ограничивающие объем настоящего изобретения.
Примеры
Субстраты
Получение обескрахмаленного маиса (DSM)
107 кг измельченного маиса (<10 мм) смешивают в резервуаре с 253 кг водопроводной воды при 53°С с получением суспензии. Температура суспензии составляет 47°C, а pH 5,9. Значение pH доводят до 6,15 с помощью 1 л 1 н. NaOH и затем резервуар нагревают до 95°C. 1,119 кг альфа-амилазы Termamyl® (Novozymes A/S, Багсвэрд, Дания) добавляют при 52°C и инкубируют в течение 80 мин. при 95°C. Значение pH, измеренное в конце инкубации, составляет 6,17. К суспензии добавляют холодную водопроводную воду и суспензию центрифугируют и сливают с осадка 3 раза с использованием декантера Westfalia CA-225-110 (4950±10 об./мин., расход ~600 л/ч.) с получением 64,5 кг осадка. Затем осадок собирают, замораживают и сушат вымораживанием с получением 17,1 кг обескрахмаленного маиса (DSM).
Получение обезжиренного обескрахмаленного маиса (DFDSM)
500 мл ацетона добавляют к 100 г обескрахмаленного маиса, полученного, как описано выше. Суспензию перемешивают в течение 5 минут и дают отстояться. Ацетон сливают с осадка и процедуру повторяют 2 раза. Остаток сушат на воздухе в течение ночи с получением обезжиренного обескрахмаленного маиса (DFDSM), который хранят при комнатной температуре.
Получение обескрахмаленного сорго
Цельные семена сорго размалывают и просеивают, а фракцию меньше 0,5 мм используют для дальнейшей обработки. Просеянную фракцию суспендируют в 25 мМ NaOAc, pH 5,5, при 20% сухого вещества и обескрахмаливают. Обескрахмаливание включает в себя первую стадию при 85°C с применением 500 ppm альфа-амилазы Termamyl SC (Novozymes A/S, Багсвэрд, Дания) в течение 20 мин. с последующей инкубацией в течение ночи с использованием 250 ppm Attenuzyme Flex (Novozymes A/S, Багсвэрд, Дания) при 65°C. Суспензию центрифугируют, а жидкость сливают с осадка. После этого проводят еще одну процедуру обескрахмаливания путем добавления воды MilliQ и 200 ppm Termamyl SC и 200 ppm Attenuzyme Flex с инкубированием в течение ночи при 65°C.
Волокно сорго отделяют от жидкости вакуумной фильтрацией через фильтр из стекловолокна Whatman F. Затем осадок на фильтре несколько раз промывают избытком воды для удаления растворимых сахаров. Наконец, обескрахмаленное волокно сорго сушат в сушильном шкафу при температуре 65°С, и сухое волокно быстро измельчают в кофемолке, так что размер частиц обычно составляет менее 1 мм.
Анализ солюбилизации ксилозы
Активность варианта ксиланазы в отношении обезжиренного обескрахмаленного маиса (DFDSM) измеряют с помощью высокоэффективной анионообменной хроматографии с импульсным амперометрическим детектированием (HPAE-PAD). 2% (вес/вес) суспензию DFDSM получают в 100 мМ ацетате натрия, 5 мМ CaCl2, pH 5, и оставляют гидратироваться в течение 30 мин. при комнатной температуре при осторожном перемешивании. После гидратации 200 мкл суспензии субстрата переносили пипеткой в 96-луночный планшет и смешивали с 20 мкл раствора фермента с получением конечной концентрации фермента 20 PPM относительно субстрата (20 мкг фермента/г субстрата). Смеси фермент/субстрат оставляют для гидролиза в течение 2,5 часа при 40°С при осторожном перемешивании (500 об./мин.) в инкубаторе для планшетов (Biosan PST-100 HL). После ферментационного гидролиза планшеты с ферментом/субстратом центрифугируют в течение 10 мин. при 3000 об./мин, и 50 мкл надосадочной жидкости (гидролизата) смешивают с 100 мкл 1,6 М HCl и переносят в пробирки для ПЦР объемом 300 мкл, и оставляют для кислотного гидролиза в течение 40 мин. при 90°С в аппарате для ПЦР. Целью кислотного гидролиза является превращение растворимых полисахаридов, высвобождаемых с помощью варианта ксиланазы, в виде моносахаридов, которые можно количественно определить с помощью HPAE-PAD. Образцы нейтрализуют с помощью 125 мкл 1,4 М NaOH после кислотного гидролиза и устанавливают на HPAE-PAD для анализа моносахаридов (ксилоза, арабиноза и глюкоза) (Dionex ICS-3000 с использованием колонки CarboPac PA1). Соответствующие калибровочные кривые сделаны с использованием исходных растворов моносахаридов, которые подвергаются такой же процедуре кислотного гидролиза, что и образцы. Процентную долю растворенной ксилозы рассчитывают согласно уравнению:
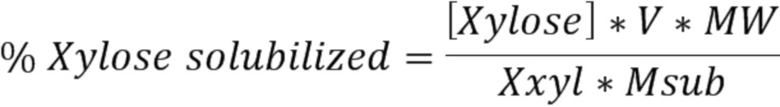
где [ксилоза] обозначает концентрацию ксилозы в надосадочной жидкости, измеренную с помощью HPAE-PAD, V - объем образца, МВт - молекулярная масса внутренней ксилозы в арабиноксилане (132 г/моль), Xxyl, фракция ксилозы в DFDSM (0,102) и Msub - масса DFDSM в образце.
Пример 1. Конструирование вариантов ксиланазы под SEQ ID NO: 1
Варианты ксиланазы получали с помощью сайт-направленного мутагенеза. Геномную ДНК, полученную из организма, содержащего ген ксиланазы, использовали в качестве матрицы для создания сайт-направленных мутантов.
Для создания фрагмента использовали мутагенный прямой праймер и обратный праймер. Этот фрагмент использовали в качестве мегапраймера для получения кассеты вставки. Чтобы обеспечить интеграцию при двойном кроссинговере после трансформации, кассета содержала расположенные выше и расположенные ниже последовательности на концах. Провели отбор и мутацию подтвердили секвенированием ДНК гена ксиланазы.
Варианты протестировали, как описано в примере 2.
Пример 2. Анализ теплового развертывания белков (TSA, оценка теплового сдвига)
Анализ теплового развертывания белка вариантов под SEQ ID NO: 1 контролировали с помощью Sypro Orange (Invitrogen, S-6650) с использованием прибора для ПЦР в реальном времени (Applied Biosystems; Step-One-Plus). Буфер: 100 мМ муравьиная кислота/формиат натрия pH 3,77+50 мМ NaCl.
В 96-луночном белом ПЦР-планшете образец объемом 15 мкл (очищенный обессоленный фермент при 50 ppm в буфере) смешивали (1:1) с Sypro Orange (конц.=10X; исходный раствор от поставщика=5000X) в буфере.
Планшет запечатывали оптической ПЦР-пленкой. В устройстве для ПЦР устанавливали скорость сканирования при 76°C в час, начиная при 25°C и заканчивая при 96°C.
Флуоресценцию контролировали каждые 20 секунд, используя встроенный источник LED, генерирующий голубой свет для определения возбуждения и ROX-фильтр (610 нм, эмиссия).
Значения Tm рассчитывали как максимальное значение первой производной (dF/dK) (Gregory et al., 2009, J. Biomol. Screen. 14: 700). Дельта Tm представляет собой разницу между Tm варианта ксиланазы и Tm ксиланазы дикого типа и представлена в таблице 2 ниже.
Таблица 2. Анализ теплового развертывания белка вариантов ксиланазы под SEQ ID NO: 1
Результаты показывают, что варианты ксиланазы характеризуются улучшенной термостабильностью по сравнению с ксиланазой дикого типа.
Пример 3. Анализ теплового развертывания белков (TSA, оценка теплового сдвига) из образцов культурального бульона
Выбранные замены выполняли в еще одной ксиланазе GH30 подсемейства 8 (с применением способа, описанного в примере 1), чтобы увидеть, будут ли такие замены приводить к проявлению аналогичных термостабилизирующих свойств. Ксиланаза GH30_8 представляла собой последовательность под SEQ ID NO: 6, ксиланазу GH30_8 из Bacillus amyloliquefaciens с 90,5% идентичностью SEQ ID NO: 1.
Тепловое развертывание белков контролировали с помощью Sypro Orange (Invitrogen, S-6650) с применением прибора для ПЦР в реальном времени (Applied Biosystems; Step-One-Plus).
Образцы культурального бульона флокулировали и разбавляли перед анализом TSA.
К культуральному бульону добавляли 4% (об./об.) GC850™ (Al2(OH)5Cl), получаемого от Gulbrandsen или NordPac 18 (доступный от Nordisk Aluminat A/S, Дания), перемешивали и центрифугировали.
К надосадочной жидкости добавляли 10% (об./об.) 1,0 M HCl с последующим 8-кратным разведением в буфере: 100 мМ муравьиная кислота/формиат натрия pH 3,77+50 мМ NaCl.
В 96-луночном белом ПЦР-планшете образец объемом 15 мкл (флокулированный и разбавленный) смешивали (1:1) с Sypro Orange (Conc.=10X; исходный раствор от поставщика=5000X) в буфере.
Планшет запечатывали оптической ПЦР-пленкой. В устройстве для ПЦР устанавливали скорость сканирования при 76°C в час, начиная при 25°C и заканчивая при 96°C.
Флуоресценцию контролировали каждые 20 секунд, используя встроенный источник LED, генерирующий голубой свет для определения возбуждения и ROX-фильтр (610 нм, эмиссия).
Значения Tm рассчитывали как максимальное значение первой производной (dF/dK) (Gregory et al., 2009, J. Biomol. Screen. 14: 700).
Дельта Tm представляет собой разницу между Tm варианта ксиланазы и Tm ксиланазы дикого типа и представлена в таблице 3 ниже.
Таблица 3. Анализ теплового развертывания белка вариантов ксиланазы под SEQ ID NO: 6
Результаты показывают, что замены, которые приводят к термостабилизации последовательности под SEQ ID NO: 1, также приводят к термостабилизации последовательности под SEQ ID NO: 6. Следовательно, можно ожидать, что такие замены приведут к термостабилизации других подобных ксиланаз GH30_8, особенно ксиланаз GH30_8 из таксономического семейства Bacillaceae.
Пример 4. Корм для животных и кормовые добавки для животных
Гранула
Гранулу получают с помощью гранулирования варианта ксиланазы по настоящему изобретению с наполнителем, таким как сульфат натрия, сульфат магния, карбонат кальция и/или целлюлоза, и затем необязательно покрывают гранулу восковым покрытием (например, гидрогенизированным пальмовым маслом) или солевым покрытием (например, сульфатом натрия и/или сульфатом магния).
В качестве альтернативы, гранулы получают путем абсорбции жидкого раствора варианта ксиланазы по настоящему изобретению на инертном ядре и затем необязательно покрывают гранулы восковым покрытием (например, гидрогенизированным пальмовым маслом) или солевым покрытием (например, сульфатом натрия и/или сульфатом магния).
Кормовая добавка для животных
Состав премикса варианта ксиланазы по настоящему изобретению, содержащий от 0,01 г до 10 г белка фермента на кг премикса (необязательно составленного в виде гранулы с покрытием) добавляют к следующему премиксу:
5000000 МЕ Витамин A
1000000 МЕ Витамин D3
13333 мг Витамин E
1000 мг Витамин K3
750 мг Витамин B1
2500 мг Витамин B2
1500 мг Витамин B6
7666 мкг Витамин B12
12333 мг Ниацин
33333 мкг Биотин
300 мг Фолиевая кислота
3000 мг Ca-D-пантотенат
1666 мг Cu
16666 мг Fe
16666 мг Zn
23333 мг Mn
133 мг Co
66 мг I
66 мг Se
5,8 % Кальций
25 % Натрий
Корм для животных
Это пример корма для животных (корма для бройлеров), содержащего кормовую добавку для животных, описанную выше.
62,55% Маис
33,8% Соевый шрот (50% сырого белка)
1,0% Соевое масло
0,2% DL-метионин
0,22% DCP (дикальцийфосфат)
0,76% CaCO3 (карбонат кальция)
0,32% Песок
0,15% NaCl (хлорид натрия)
1% вышеуказанного премикса
Ингредиенты смешивают и корм гранулируют при желаемой температуре, например, 60, 65, 75, 80, 85, 90 или даже 95°C.
Жидкий состав
Жидкий состав варианта ксиланазы по настоящему изобретению содержит от 0,1% до 10% (вес/вес) белка фермента, 40-60% глицерина, от 0,1 до 0,5% бензоата натрия и воду. Жидкий состав распыляют на гранулированный корм для животных, описанный выше (в этом случае кормовая добавка для животных не будет содержать вариант ксиланазы по настоящему изобретению).
Объем описанного и заявленного в данном документе изобретения не должен ограничиваться конкретными аспектами, раскрытыми в данном документе, поскольку эти аспекты предполагаются как иллюстрации некоторых аспектов настоящего изобретения. Предполагается, что любые эквивалентные аспекты находятся в пределах объема настоящего изобретения. Действительно, различные модификации настоящего изобретения в дополнение к продемонстрированным и описанным в данном документе станут очевидны специалистам в данной области из вышеприведенного описания. Предполагается, что такие модификации также входят в объем прилагаемой формулы изобретения. В случае противоречия настоящее раскрытие, в том числе определения, будет иметь преобладающую силу.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Novozymes A/S
Danielsen, Steffen
Hansen, Peter Kamp
Rasmussen, Frank Winther
Pache, Roland Alexander
<120> ВАРИАНТЫ КСИЛАНАЗЫ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ
<130> 14220-WO-PCT
<150> EP16178681
<151> 2016-07-08
<160> 6
<170> PatentIn версия 3.5
<210> 1
<211> 391
<212> БЕЛОК
<213> Bacillus subtilis
<400> 1
Ala Ala Ser Asp Val Thr Val Asn Val Ser Ala Glu Lys Gln Val Ile
1 5 10 15
Arg Gly Phe Gly Gly Met Asn His Pro Ala Trp Ala Gly Asp Leu Thr
20 25 30
Ala Ala Gln Arg Glu Thr Ala Phe Gly Asn Gly Gln Asn Gln Leu Gly
35 40 45
Phe Ser Ile Leu Arg Ile His Val Asp Glu Asn Arg Asn Asn Trp Tyr
50 55 60
Lys Glu Val Glu Thr Ala Lys Ser Ala Val Lys His Gly Ala Ile Val
65 70 75 80
Phe Ala Ser Pro Trp Asn Pro Pro Ser Asp Met Val Glu Thr Phe Asn
85 90 95
Arg Asn Gly Asp Thr Ser Ala Lys Arg Leu Lys Tyr Asn Lys Tyr Ala
100 105 110
Ala Tyr Ala Gln His Leu Asn Asp Phe Val Thr Phe Met Lys Asn Asn
115 120 125
Gly Val Asn Leu Tyr Ala Ile Ser Val Gln Asn Glu Pro Asp Tyr Ala
130 135 140
His Glu Trp Thr Trp Trp Thr Pro Gln Glu Ile Leu Arg Phe Met Arg
145 150 155 160
Glu Asn Ala Gly Ser Ile Asn Ala Arg Val Ile Ala Pro Glu Ser Phe
165 170 175
Gln Tyr Leu Lys Asn Leu Ser Asp Pro Ile Leu Asn Asp Pro Gln Ala
180 185 190
Leu Ala Asn Met Asp Ile Leu Gly Thr His Leu Tyr Gly Thr Gln Val
195 200 205
Ser Gln Phe Pro Tyr Pro Leu Phe Lys Gln Lys Gly Ala Gly Lys Asp
210 215 220
Leu Trp Met Thr Glu Val Tyr Tyr Pro Asn Ser Asp Thr Asn Ser Ala
225 230 235 240
Asp Arg Trp Pro Glu Ala Leu Asp Val Ser Gln His Ile His Asn Ala
245 250 255
Met Val Glu Gly Asp Phe Gln Ala Tyr Val Trp Trp Tyr Ile Arg Arg
260 265 270
Ser Tyr Gly Pro Met Lys Glu Asp Gly Thr Ile Ser Lys Arg Gly Tyr
275 280 285
Asn Met Ala His Phe Ser Lys Phe Val Arg Pro Gly Tyr Val Arg Ile
290 295 300
Asp Ala Thr Lys Asn Pro Asn Ala Asn Val Tyr Val Ser Ala Tyr Lys
305 310 315 320
Gly Asp Asn Lys Val Val Ile Val Ala Ile Asn Lys Ser Asn Thr Gly
325 330 335
Val Asn Gln Asn Phe Val Leu Gln Asn Gly Ser Ala Ser Asn Val Ser
340 345 350
Arg Trp Ile Thr Ser Ser Ser Ser Asn Leu Gln Pro Gly Thr Asn Leu
355 360 365
Thr Val Ser Gly Asn His Phe Trp Ala His Leu Pro Ala Gln Ser Val
370 375 380
Thr Thr Phe Val Val Asn Arg
385 390
<210> 2
<211> 391
<212> БЕЛОК
<213> Bacillus amyloliquefaciens
<400> 2
Ala Ala Asn Asp Val Thr Val Asn Ile Ser Ala Glu Arg Gln Val Ile
1 5 10 15
Arg Gly Phe Gly Gly Met Asn His Pro Ala Trp Val Gly Asp Leu Thr
20 25 30
Ala Ala Gln Arg Glu Thr Ala Phe Gly Asn Gly Gln Asn Gln Leu Gly
35 40 45
Phe Ser Ile Leu Arg Ile His Val Asp Glu Asn Arg Asn Asn Trp Tyr
50 55 60
Lys Glu Val Glu Thr Ala Lys Ser Ala Ile Lys His Gly Ala Ile Val
65 70 75 80
Phe Ala Ser Pro Trp Asn Pro Pro Asn Asp Met Val Glu Thr Phe Asn
85 90 95
His Asn Gly Asp Thr Ser Ala Lys Arg Leu Arg Tyr Asp Lys Tyr Ala
100 105 110
Ala Tyr Ala Gln His Leu Asn Asp Phe Val Asn Phe Met Lys Ser Asn
115 120 125
Gly Val Asn Leu Tyr Ala Ile Ser Ile Gln Asn Glu Pro Asp Tyr Ala
130 135 140
His Glu Trp Thr Trp Trp Thr Pro Gln Glu Ile Leu Arg Phe Met Arg
145 150 155 160
Glu Asn Ala Gly Ser Ile Asn Ala Arg Val Ile Ala Pro Glu Ser Phe
165 170 175
Gln Tyr Leu Lys Asn Leu Ser Asp Pro Ile Leu Asn Asp Pro Gln Ala
180 185 190
Leu Ala Asn Met Asp Ile Leu Gly Thr His Leu Tyr Gly Thr Gln Val
195 200 205
Ser Gln Phe Pro Tyr Pro Leu Phe Lys Gln Lys Gly Ala Gly Lys Asp
210 215 220
Leu Trp Met Thr Glu Val Tyr Tyr Pro Asn Ser Asp Asn Asn Ser Ala
225 230 235 240
Asp Arg Trp Pro Glu Ala Leu Asp Val Ser Gln His Ile His Ser Ser
245 250 255
Met Val Glu Gly Asp Leu Gln Ala Tyr Val Trp Trp Tyr Ile Arg Arg
260 265 270
Ser Tyr Gly Pro Met Lys Glu Asp Gly Thr Ile Ser Lys Arg Gly Tyr
275 280 285
Asn Met Ala His Phe Ser Lys Phe Val Arg Pro Gly Tyr Val Arg Ile
290 295 300
Asp Ala Thr Lys Asn Pro Asn Pro Asn Val Tyr Val Ser Ala Tyr Lys
305 310 315 320
Gly Asp Asn Lys Val Val Ile Val Ala Ile Asn Lys Thr Asn Thr Gly
325 330 335
Val Asn Gln Asn Phe Val Leu Gln Asn Gly Ser Ala Ser Gln Val Ser
340 345 350
Arg Trp Ile Thr Ser Ser Asn Ser Asn Leu Gln Pro Gly Thr Asp Leu
355 360 365
Lys Val Thr Asp Asn His Phe Trp Ala His Leu Pro Ala Gln Ser Val
370 375 380
Thr Thr Phe Val Val Lys Arg
385 390
<210> 3
<211> 392
<212> БЕЛОК
<213> Bacillus licheniformis
<400> 3
Ala Ala Ser Asp Ala Thr Val Arg Leu Ser Ala Glu Lys Gln Val Ile
1 5 10 15
Arg Gly Phe Gly Gly Met Asn His Pro Ala Trp Ile Gly Asp Leu Thr
20 25 30
Ala Ala Gln Arg Glu Thr Ala Phe Gly Asn Gly Gln Asn Gln Leu Gly
35 40 45
Phe Ser Ile Leu Arg Ile His Val Asp Glu Asn Arg Asn Asn Trp Tyr
50 55 60
Arg Glu Val Glu Thr Ala Lys Ser Ala Ile Lys His Gly Ala Ile Val
65 70 75 80
Phe Ala Ser Pro Trp Asn Pro Pro Ser Asp Met Val Glu Thr Phe Asn
85 90 95
Arg Asn Gly Asp Thr Ser Ala Lys Arg Leu Arg Tyr Asp Lys Tyr Ala
100 105 110
Ala Tyr Ala Lys His Leu Asn Asp Phe Val Thr Phe Met Lys Asn Asn
115 120 125
Gly Val Asn Leu Tyr Ala Ile Ser Val Gln Asn Glu Pro Asp Tyr Ala
130 135 140
His Asp Trp Thr Trp Trp Thr Pro Gln Glu Ile Leu Arg Phe Met Lys
145 150 155 160
Glu Asn Ala Gly Ser Ile Asn Ala Arg Val Ile Ala Pro Glu Ser Phe
165 170 175
Gln Tyr Leu Lys Asn Ile Ser Asp Pro Ile Val Asn Asp Pro Lys Ala
180 185 190
Leu Ala Asn Met Asp Ile Leu Gly Ala His Leu Tyr Gly Thr Gln Leu
195 200 205
Asn Asn Phe Ala Tyr Pro Leu Phe Lys Gln Lys Gly Ala Gly Lys Asp
210 215 220
Leu Trp Met Thr Glu Val Tyr Tyr Pro Asn Ser Asp Asn His Ser Ala
225 230 235 240
Asp Arg Trp Pro Glu Ala Leu Asp Val Ser His His Ile His Asn Ser
245 250 255
Met Val Glu Gly Asp Phe Gln Ala Tyr Val Trp Trp Tyr Ile Arg Arg
260 265 270
Ser Tyr Gly Pro Met Lys Glu Asp Gly Thr Ile Ser Lys Arg Gly Tyr
275 280 285
Asn Met Ala His Phe Ser Lys Phe Val Arg Pro Gly Tyr Val Arg Val
290 295 300
Asp Ala Thr Lys Ser Pro Ala Ser Asn Val Tyr Val Ser Ala Tyr Lys
305 310 315 320
Gly Asp Asn Lys Val Val Ile Val Ala Ile Asn Lys Asn Asn Ser Gly
325 330 335
Val Asn Gln Asn Phe Val Leu Gln Asn Gly Ser Val Ser Gln Val Ser
340 345 350
Arg Trp Ile Thr Ser Ser Ser Ser Asn Leu Gln Pro Gly Thr Asn Leu
355 360 365
Asn Val Thr Asp Asn His Phe Trp Ala His Leu Pro Ala Gln Ser Val
370 375 380
Thr Thr Phe Val Ala Asn Leu Arg
385 390
<210> 4
<211> 391
<212> БЕЛОК
<213> Bacillus subtilis
<400> 4
Ala Ala Asn Asp Val Thr Val Asn Ile Ser Ala Glu Lys Gln Val Ile
1 5 10 15
Arg Gly Phe Gly Gly Met Asn His Pro Ala Trp Val Gly Asp Leu Thr
20 25 30
Ala Ala Gln Arg Glu Thr Ala Phe Gly Asn Gly Gln Asn Gln Leu Gly
35 40 45
Phe Ser Ile Leu Arg Ile His Val Asp Glu Asn Arg Asn Asn Trp Tyr
50 55 60
Lys Glu Val Glu Thr Ala Lys Ser Ala Ile Lys His Gly Ala Ile Val
65 70 75 80
Phe Ala Ser Pro Trp Asn Pro Pro Ser Asn Met Val Glu Thr Phe Asn
85 90 95
His Asn Gly Asp Thr Ser Ala Lys Arg Leu Arg Tyr Asp Lys Tyr Ala
100 105 110
Ala Tyr Ala Gln His Leu Asn Asp Phe Val Thr Phe Met Lys Ser Asn
115 120 125
Gly Val Asn Leu Tyr Ala Ile Ser Ile Gln Asn Glu Pro Asp Tyr Ala
130 135 140
His Glu Trp Thr Trp Trp Thr Pro Gln Glu Ile Leu Arg Phe Met Arg
145 150 155 160
Glu Asn Ala Gly Ser Ile Asn Ala Arg Val Ile Ala Pro Glu Ser Phe
165 170 175
Gln Tyr Leu Lys Asn Leu Ser Asp Pro Ile Leu Asn Asp Pro Gln Ala
180 185 190
Leu Ala Asn Met Asp Ile Leu Gly Thr His Leu Tyr Gly Thr Gln Val
195 200 205
Ser Gln Phe Pro Tyr Pro Leu Phe Lys Gln Lys Gly Ala Gly Lys Asp
210 215 220
Leu Trp Met Thr Glu Val Tyr Tyr Pro Asn Ser Asp Asn Asn Ser Ala
225 230 235 240
Asp Arg Trp Pro Glu Ala Leu Asp Val Ser Gln His Ile His Asn Ser
245 250 255
Met Val Glu Gly Asp Phe Gln Ala Tyr Val Trp Trp Tyr Ile Arg Arg
260 265 270
Ser Tyr Gly Pro Met Lys Glu Asp Gly Thr Ile Ser Lys Arg Gly Tyr
275 280 285
Asn Met Ala His Phe Ser Lys Phe Val Arg Pro Gly Tyr Val Arg Ile
290 295 300
Asp Ala Thr Lys Asn Pro Asn Pro Asn Val Tyr Val Ser Ala Tyr Lys
305 310 315 320
Gly Asp Asn Lys Val Val Ile Val Ala Ile Asn Lys Ser Asn Thr Gly
325 330 335
Val Asn Gln Asn Phe Val Leu Gln Asn Gly Ser Ala Ser Gln Val Ser
340 345 350
Arg Trp Ile Thr Ser Ser Asn Ser Asn Leu Gln Pro Gly Thr Asn Leu
355 360 365
Lys Val Thr Asp Asn His Phe Trp Ala His Leu Pro Ala Gln Ser Val
370 375 380
Thr Thr Phe Val Val Ile Arg
385 390
<210> 5
<211> 393
<212> БЕЛОК
<213> Paenibacillus pabuli
<400> 5
Ala Ala Ser Asp Val Thr Val Asn Leu Ser Ser Glu Lys Gln Leu Ile
1 5 10 15
Lys Gly Phe Gly Gly Ile Asn His Pro Asn Trp Ile Gly Asp Leu Thr
20 25 30
Pro Ser Gln Arg Asp Thr Ala Phe Gly Asn Gly Gln Asn Gln Leu Gly
35 40 45
Phe Ser Ile Leu Arg Ile Tyr Ile Asp Asp Asn Lys Asn Asn Trp Tyr
50 55 60
Lys Glu Ile Pro Thr Ala Lys Arg Ala Ile Glu Gln Gly Ala Ile Val
65 70 75 80
Phe Ala Ser Pro Trp Asn Pro Pro Ser Asp Met Val Glu Thr Phe Asn
85 90 95
Arg Asn Gly Asp Thr Ala Ala Lys Arg Leu Lys Tyr Asp Lys Tyr Ala
100 105 110
Ala Tyr Ala Gln His Leu Asn Asp Phe Val Ser Tyr Met Lys Ser Asn
115 120 125
Gly Val Asn Leu Tyr Ala Ile Ser Val Gln Asn Glu Pro Asp Tyr Ala
130 135 140
His Asp Trp Thr Trp Trp Thr Pro Gln Glu Met Leu Arg Phe Met Lys
145 150 155 160
Asp Tyr Ala Gly Ser Ile Thr Gly Thr Lys Val Met Ala Pro Glu Ser
165 170 175
Phe Ser Tyr Leu Lys Glu Met Ser Asp Pro Ile Leu Asn Asp Pro Gln
180 185 190
Ala Leu Ala Asn Met Asp Ile Leu Gly Ala His Thr Tyr Gly Thr Gln
195 200 205
Phe Ser Asn Phe Pro Tyr Pro Leu Phe Lys Gln Lys Gly Ala Gly Lys
210 215 220
Glu Leu Trp Met Ser Glu Val Tyr Tyr Pro Asn Ser Asn Ala Asn Ser
225 230 235 240
Ala Asp His Trp Pro Glu Ala Leu Asp Val Ser Tyr His Ile His His
245 250 255
Ala Met Val Glu Ala Asp Phe Gln Ala Tyr Val Trp Trp Tyr Ile Arg
260 265 270
Arg Gln Tyr Gly Pro Met Lys Glu Asp Gly Thr Ile Ser Lys Arg Gly
275 280 285
Tyr Asn Met Ala His Phe Ser Lys Phe Val Arg Pro Gly Phe Val Arg
290 295 300
Val Asp Ala Thr Lys Asn Pro Asp Thr Gln Thr Phe Ile Ser Ala Phe
305 310 315 320
Lys Gly Asp Asn Lys Val Val Ile Val Ala Ile Asn Arg Gly Thr Ser
325 330 335
Ala Val Asn Gln Lys Phe Val Leu Gln Asn Gly Asn Ala Ser Asn Val
340 345 350
Ser Ser Trp Val Thr Asp Ser Thr Arg Asn Leu Ala Ala Gly Ser Ser
355 360 365
Ile Ile Met Thr Gly Asn Thr Phe Thr Ala Gln Leu Pro Ser Gln Ser
370 375 380
Val Thr Thr Phe Val Ala Gln Leu Asn
385 390
<210> 6
<211> 391
<212> БЕЛОК
<213> Bacillus amyloliquefaciens
<400> 6
Ala Ala Ser Asp Ala Thr Val Asn Ile Ser Ala Glu Arg Gln Val Ile
1 5 10 15
Arg Gly Phe Gly Gly Met Asn His Pro Ala Trp Ile Gly Asp Leu Thr
20 25 30
Ala Pro Gln Arg Val Thr Ala Phe Gly Asn Gly Gln Asn Gln Leu Gly
35 40 45
Phe Ser Val Leu Arg Ile His Val Asp Glu Asn Arg Asn Asn Trp Tyr
50 55 60
Lys Glu Val Glu Thr Ala Lys Ser Ala Ile Lys His Gly Ala Ile Val
65 70 75 80
Phe Ala Ser Pro Trp Asn Pro Pro Asn Asp Met Val Glu Thr Phe Asn
85 90 95
His Asn Gly Asp Thr Ser Ala Lys Arg Leu Arg Tyr Asp Lys Tyr Ala
100 105 110
Ala Tyr Ala Gln His Leu Asn Asp Phe Val Asn Phe Met Lys Ser Asn
115 120 125
Gly Val Asn Leu Tyr Ala Ile Ser Met Gln Asn Glu Pro Asp Tyr Ala
130 135 140
His Glu Trp Thr Trp Trp Thr Pro Gln Glu Ile Leu Arg Phe Met Arg
145 150 155 160
Glu Asn Ala Gly Ser Ile Asn Thr Arg Val Ile Ala Pro Glu Ser Phe
165 170 175
Gln Tyr Leu Lys Asn Ile Ser Asp Pro Ile Leu Asn Asp Pro Gln Ala
180 185 190
Leu Arg Asn Met Asp Ile Leu Gly Thr His Leu Tyr Gly Thr Gln Val
195 200 205
Ser Gln Phe Pro Tyr Pro Leu Phe Lys Gln Lys Gly Gly Gly Lys Glu
210 215 220
Leu Trp Met Thr Glu Val Tyr Tyr Pro Asn Ser Asp Asn Tyr Ser Ala
225 230 235 240
Asp Arg Trp Pro Glu Ala Leu Gly Val Ser Glu His Ile His His Ser
245 250 255
Met Val Glu Gly Asp Phe Gln Ala Tyr Val Trp Trp Tyr Ile Arg Arg
260 265 270
Ser Tyr Gly Pro Met Lys Glu Asp Gly Met Ile Ser Lys Arg Gly Tyr
275 280 285
Asn Met Ala His Phe Ser Lys Phe Val Arg Pro Gly Tyr Val Arg Ile
290 295 300
Asp Ala Thr Lys Asn Pro Glu Pro Asn Val Tyr Val Ser Ala Tyr Lys
305 310 315 320
Gly Asp Asn Lys Val Val Ile Val Ala Ile Asn Lys Asn Asn Thr Gly
325 330 335
Val Asn Gln Asn Phe Val Leu Gln Asn Gly Thr Ala Ser Gln Val Ser
340 345 350
Arg Trp Ile Thr Ser Ser Ser Ser Asn Leu Gln Pro Gly Thr Asp Leu
355 360 365
Lys Val Thr Asp Asn His Phe Trp Ala His Leu Pro Ala Gln Ser Val
370 375 380
Thr Thr Phe Val Val Lys Arg
385 390
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ УЛУЧШЕНИЯ ЗДОРОВЬЯ РАСТЕНИЯ С ПРИМЕНЕНИЕМ СВОБОДНЫХ ФЕРМЕНТОВ И МИКРООРГАНИЗМОВ, ЭКСПРЕССИРУЮЩИХ ФЕРМЕНТЫ НА ПОВЫШЕННОМ УРОВНЕ | 2017 |
|
RU2802848C2 |
| ВАРИАНТЫ СКВАЛЕНГОПЕНЦИКЛАЗЫ (SHC) | 2020 |
|
RU2829857C1 |
| МОЛЕКУЛЫ АНТИ-SIGLEC-9 АНТИТЕЛА | 2020 |
|
RU2833330C1 |
| МОЛЕКУЛЫ АНТИТЕЛ ПРОТИВ ВИРУСА BK | 2021 |
|
RU2835801C1 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ TIGIT И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2776714C2 |
| Связывающие молекулы, специфичные в отношении CD73, и пути их применения | 2015 |
|
RU2730665C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА СВЕРТЫВАНИЯ XI | 2017 |
|
RU2757314C2 |
| Белки, являющиеся модификаторами вкуса и вкусоароматических свойств | 2019 |
|
RU2823578C2 |
| АНТИТЕЛА, БЛОКИРУЮЩИЕ CD73 | 2020 |
|
RU2819204C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕДАКТИРОВАНИЯ ГЕНОВ | 2019 |
|
RU2804665C2 |

Изобретение относится к биотехнологии и представляет собой вариант ксиланазы, предусматривающий замену в одном или более положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317 и 321 SEQ ID NO: 1, где указанная замена выбрана из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A; где вариант ксиланазы обладает ксиланазной активностью, и где вариант ксиланазы характеризуется последовательностью, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1, 2, 3, 4, 5 или 6; и где указанный вариант имеет улучшенную термостабильность по сравнению с SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6. Изобретение также относится к использованию данного варианта ксиланазы в корме для животных и для получения выпечного продукта. Изобретение позволяет получать термостабильный вариант ксиланазы. 27 н. и 9 з.п. ф-лы, 1 ил., 3 табл., 4 пр.
1. Вариант ксиланазы, предусматривающий замену в одном или более положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317 и 321 SEQ ID NO: 1, где указанная замена выбрана из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A; где вариант ксиланазы обладает ксиланазной активностью, и где вариант ксиланазы характеризуется последовательностью, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1, 2, 3, 4, 5 или 6; и где указанный вариант имеет улучшенную термостабильность по сравнению с SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
2. Вариант ксиланазы по п. 1, который характеризуется последовательностью, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1, 2, 3, 4, 5 и/или 6.
3. Вариант ксиланазы по п. 1 или 2, который представляет собой вариант исходной ксиланазы, где исходная ксиланаза характеризуется последовательностью, на по меньшей мере 60%, например, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98%, на по меньшей мере 99% или 100% идентичной SEQ ID NO: 1.
4. Вариант ксиланазы по любому из пп. 1-3, который характеризуется улучшенным свойством по сравнению с исходной формой, где улучшенное свойство выбрано из группы, состоящей из эффективности катализа, скорости катализа, химической стабильности, устойчивости к окислению, активности при определенных значениях pH, стабильности при определенных значениях pH, удельной активности, стабильности в условиях хранения, связывания субстрата, расщепления субстрата, субстратной специфичности, стабильности в присутствии субстрата, поверхностных свойств, активности при определенных значениях температуры и термостабильности.
5. Композиция фермента, содержащая вариант ксиланазы по любому из пп. 1-4 и средство для составления.
6. Композиция фермента по п. 5, дополнительно содержащая:
один или более дополнительных ферментов;
один или более микроорганизмов и/или
материал на растительной основе.
7. Гранула, содержащая вариант ксиланазы по любому из пп. 1-4 и средство для составления.
8. Кормовая добавка для животных, содержащая вариант ксиланазы по любому из пп. 1-4, композицию по любому из пп. 5, 6 или гранулу по п. 7 и один или более компонентов, выбранных из группы, состоящей из:
одного или более витаминов;
одного или более минералов;
одной или более аминокислот;
одного или более средств растительного происхождения;
одного или более пребиотиков;
одной или более органических кислот и
одного или более других кормовых ингредиентов.
9. Жидкий состав фермента, содержащий вариант ксиланазы по любому из пп. 1-4 и от 20 до 80% (вес./вес.) полиола и/или от 0,01 до 2,0% (вес./вес.) консерванта.
10. Жидкий состав по п. 9, дополнительно содержащий один или более компонентов, выбранных из перечня, состоящего из:
одного или более ферментов;
одного или более микроорганизмов;
одного или более витаминов;
одного или более минералов;
одной или более аминокислот;
одного или более средств растительного происхождения;
одного или более пребиотиков;
одной или более органических кислот и
одного или более других кормовых ингредиентов.
11. Корм для животных, содержащий вариант ксиланазы по любому из пп. 1-4, композицию по любому из пп. 5, 6, гранулу по п. 7, кормовую добавку для животных по п. 8 или жидкий состав по любому из пп. 9, 10 и материал на растительной основе из подсемейства Panicoideae.
12. Способ улучшения одного или более параметров продуктивности животного, включающий введение одному или более животным варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11.
13. Способ солюбилизации ксилана из материала на растительной основе из подсемейства Panicoideae, включающий обработку материала на растительной основе с помощью варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8 или жидкого состава по любому из пп. 9, 10.
14. Способ высвобождения крахмала из материала на растительной основе из подсемейства Panicoideae, включающий обработку материала на растительной основе с помощью варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8 или жидкого состава по любому из пп. 9, 10.
15. Способ улучшения пищевой ценности корма для животных, включающий добавление к корму, содержащему материал на растительной основе, варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8 или жидкого состава по любому из пп. 9, 10.
16. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 в корме для животных.
17. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 в кормовых добавках для животных.
18. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 при получении композиции для применения в корме для животных.
19. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 для улучшения пищевой ценности корма для животных.
20. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 для повышения усвояемости корма для животных.
21. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 для улучшения одного или более параметров продуктивности у животного.
22. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 для солюбилизации ксилана из материала на растительной основе из подсемейства Panicoideae.
23. Применение варианта ксиланазы по любому из пп. 1-4, композиции по любому из пп. 5, 6, гранулы по п. 7, кормовой добавки для животных по п. 8, жидкого состава по любому из пп. 9, 10 или корма для животных по п. 11 для высвобождения крахмала из материала на растительной основе из подсемейства Panicoideae.
24. Способ получения продукта ферментации, включающий следующие стадии:
(a) осахаривание крахмалсодержащего материала при температуре ниже начальной температуры клейстеризации с применением альфа-амилазы, глюкоамилазы и варианта ксиланазы по любому из пп. 1-4; и
(b) ферментирование с применением ферментирующего организма.
25. Способ получения теста, который включает введение в тесто варианта ксиланазы по любому из пп. 1-4.
26. Способ получения выпеченного продукта, приготовленного из теста, который включает введение в тесто варианта ксиланазы по любому из пп. 1-4.
27. Выделенный полинуклеотид, кодирующий вариант ксиланазы по любому из пп. 1-4.
28. Конструкция на основе нуклеиновой кислоты для экспрессии полинуклеотида, содержащая полинуклеотид по п. 27.
29. Конструкция на основе нуклеиновой кислоты по п. 28, где указанный полинуклеотид функционально связан с одной или более контрольных последовательностей, которые направляют продукцию варианта ксиланазы в рекомбинантной клетке-хозяине.
30. Вектор экспрессии для экспрессии полинуклеотида, содержащий полинуклеотид по п. 27.
31. Рекомбинантная клетка-хозяин для рекомбинантной продукции варианта ксиланазы, содержащая конструкцию на основе нуклеиновой кислоты по п. 28 или 29 или вектор экспрессии по п. 30.
32. Способ получения варианта ксиланазы, включающий:
(a) культивирование клетки-хозяина по п. 31 в условиях, подходящих для экспрессии варианта ксиланазы; и
(b) выделение варианта ксиланазы.
33. Способ получения варианта ксиланазы, включающий введение в исходную ксиланазу замены в одном или более положениях, соответствующих положениям 24, 26, 36, 37, 60, 71, 74, 75, 76, 124, 133, 155, 167, 208, 317 и 321 SEQ ID NO: 1, где указанная замена выбрана из группы, состоящей из H24W, A26E, R36L, R36T, E37T, R60N, K71T, K71I, V74L, V74I, K75N, K75L, H76L, I155M, N167E, V208L, S317D и G321A; где вариант обладает ксиланазной активностью; и выделение варианта ксиланазы; где вариант ксиланазы характеризуется последовательностью, на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 97%, на по меньшей мере 98% или на по меньшей мере 99%, но на менее чем 100% идентичной SEQ ID NO: 1, 2, 3, 4, 5 или 6; и где указанный вариант имеет улучшенную термостабильность по сравнению с SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6;
и выделение указанного варианта ксиланазы.
34. Способ по п. 33, где вариант характеризуется по меньшей мере 95% идентичностью SEQ ID NO: 1.
35. Способ по любому из пп. 33, 34, где вариант ксиланазы характеризуется улучшенным свойством по сравнению с исходной формой, где улучшенное свойство выбрано из группы, состоящей из эффективности катализа, скорости катализа, химической стабильности, устойчивости к окислению, активности при определенных значениях pH, стабильности при определенных значениях pH, удельной активности, стабильности в условиях хранения, связывания субстрата, расщепления субстрата, субстратной специфичности, стабильности в присутствии субстрата, поверхностных свойств, активности при определенных значениях температуры и термостабильности.
36. Способ по любому из пп. 33-35, где исходная ксиланаза характеризуется по меньшей мере 70% идентичностью, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90% или наиболее предпочтительно по меньшей мере 95% идентичностью SEQ ID NO: 1.
| WO 2003106654 A3, 24.12.2003 | |||
| МОДИФИЦИРОВАННАЯ КСИЛАНАЗА | 2007 |
|
RU2464313C2 |
| Прибор для построения контуров при аэрофотосъемках | 1928 |
|
SU11452A1 |
| МОДИФИЦИРОВАННАЯ КСИЛАНАЗА | 2005 |
|
RU2394909C2 |
Авторы
Даты
2021-07-23—Публикация
2017-06-22—Подача