Текст описания приведен в факсимильном виде.




















































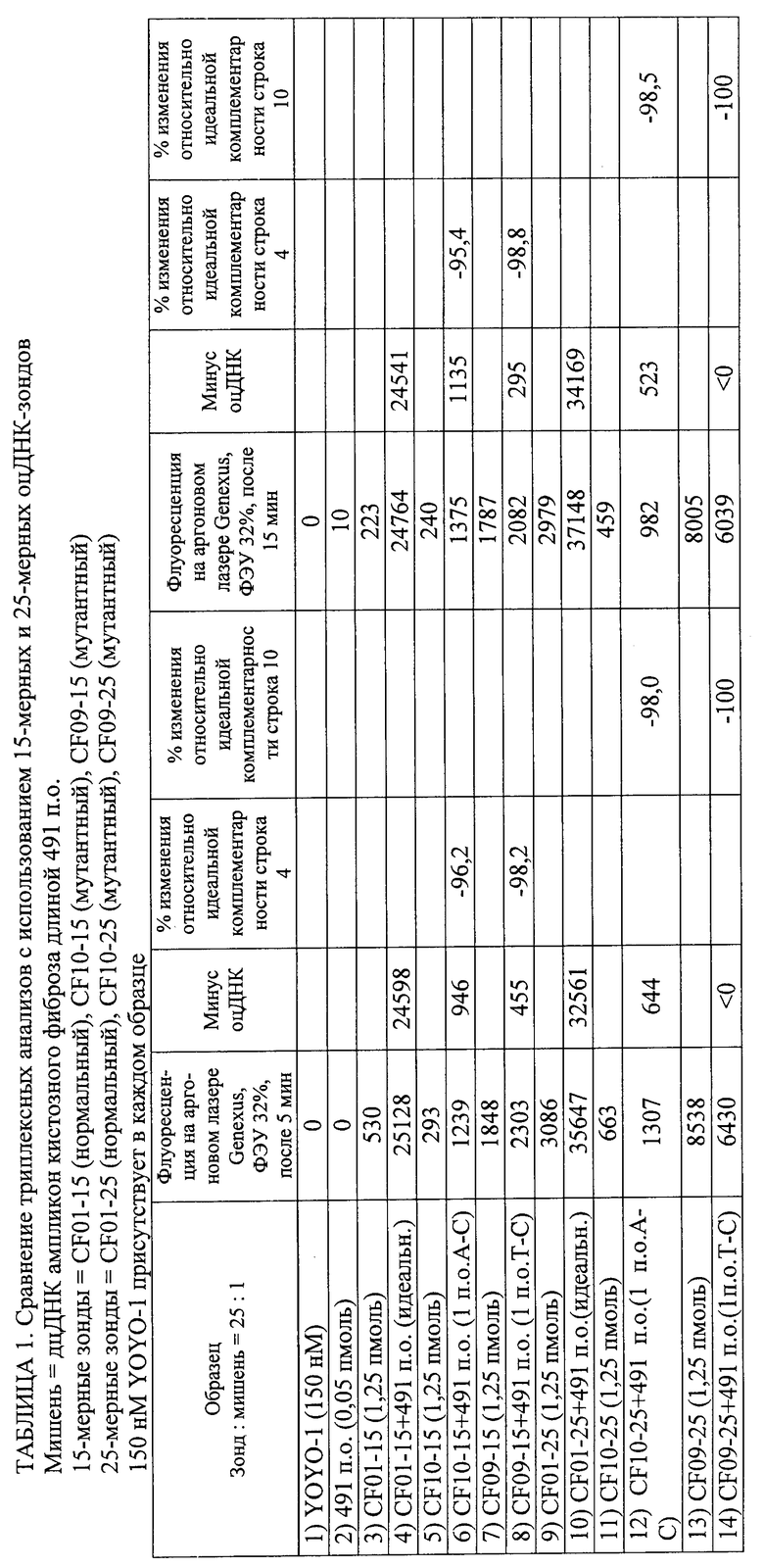

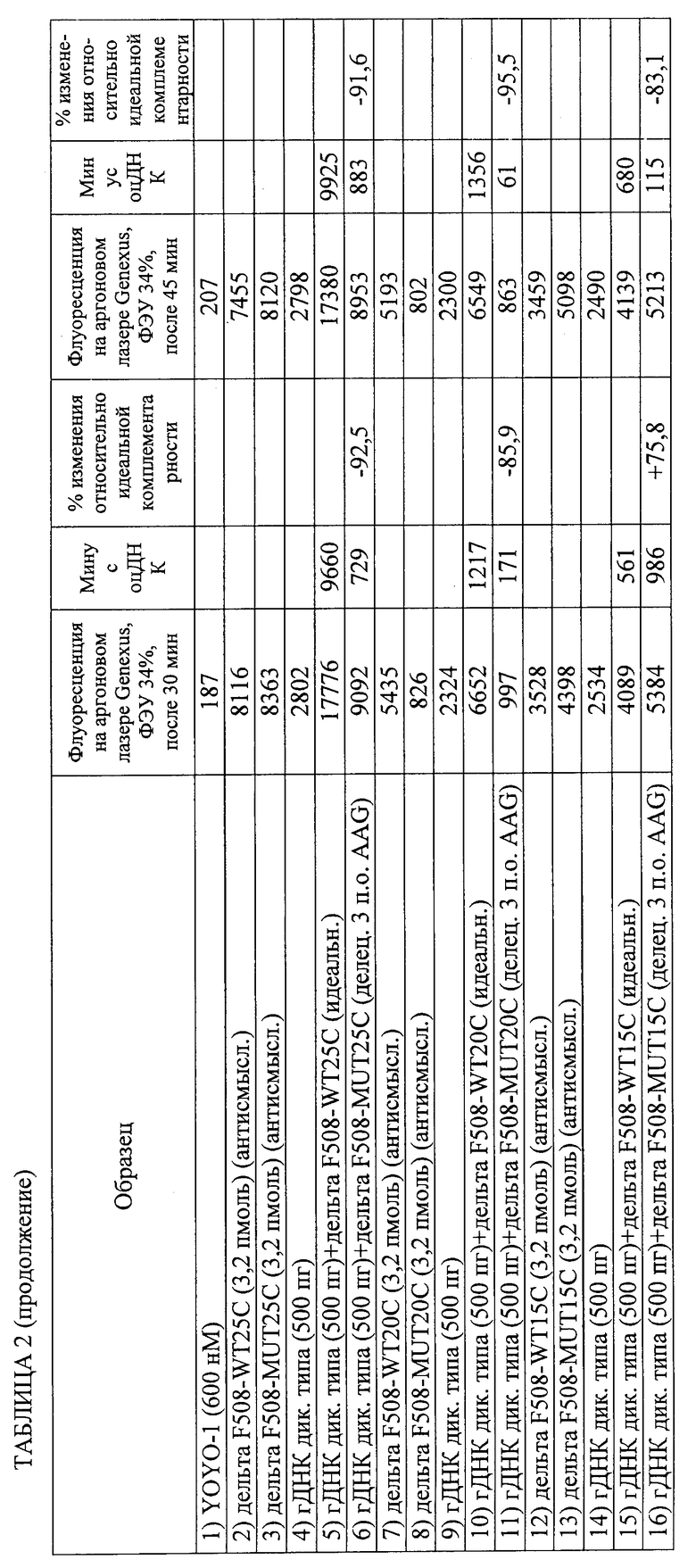
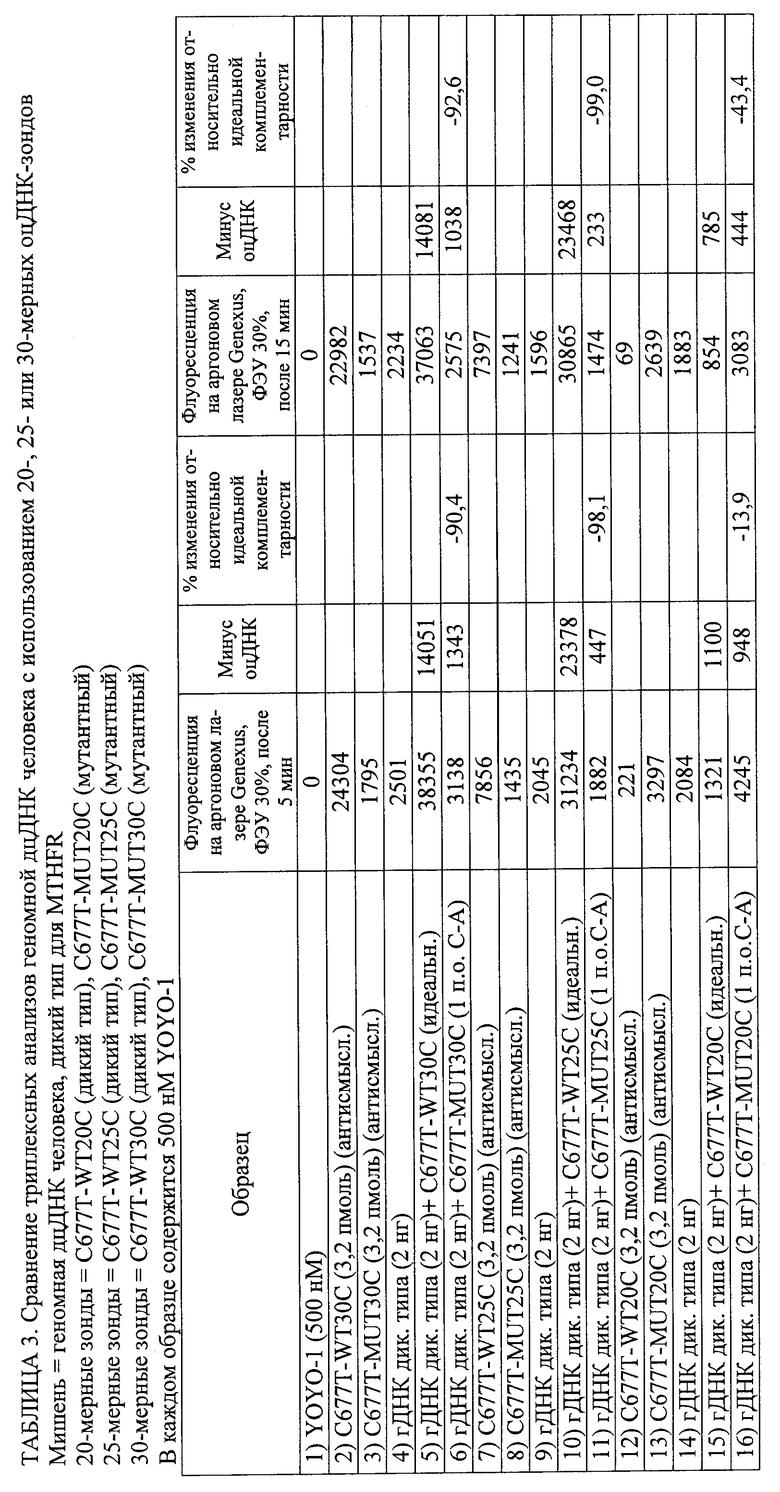


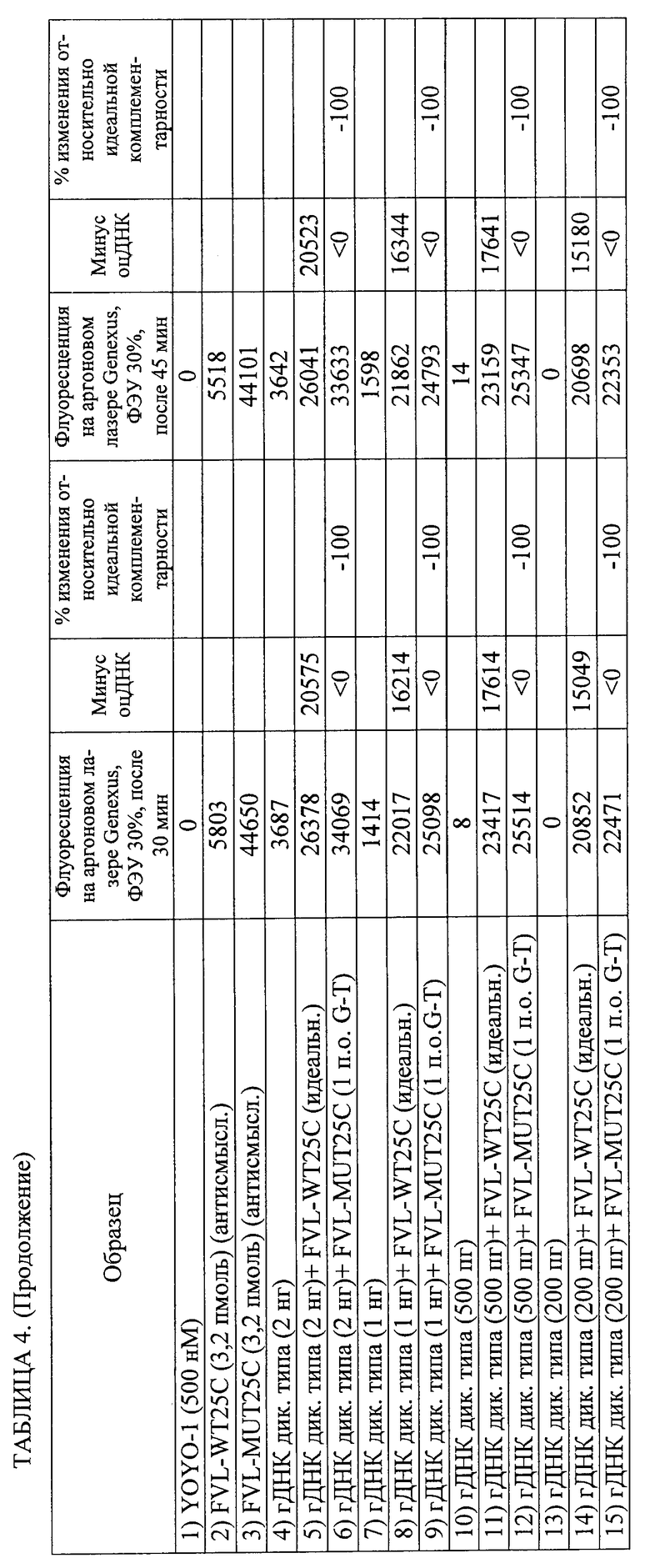




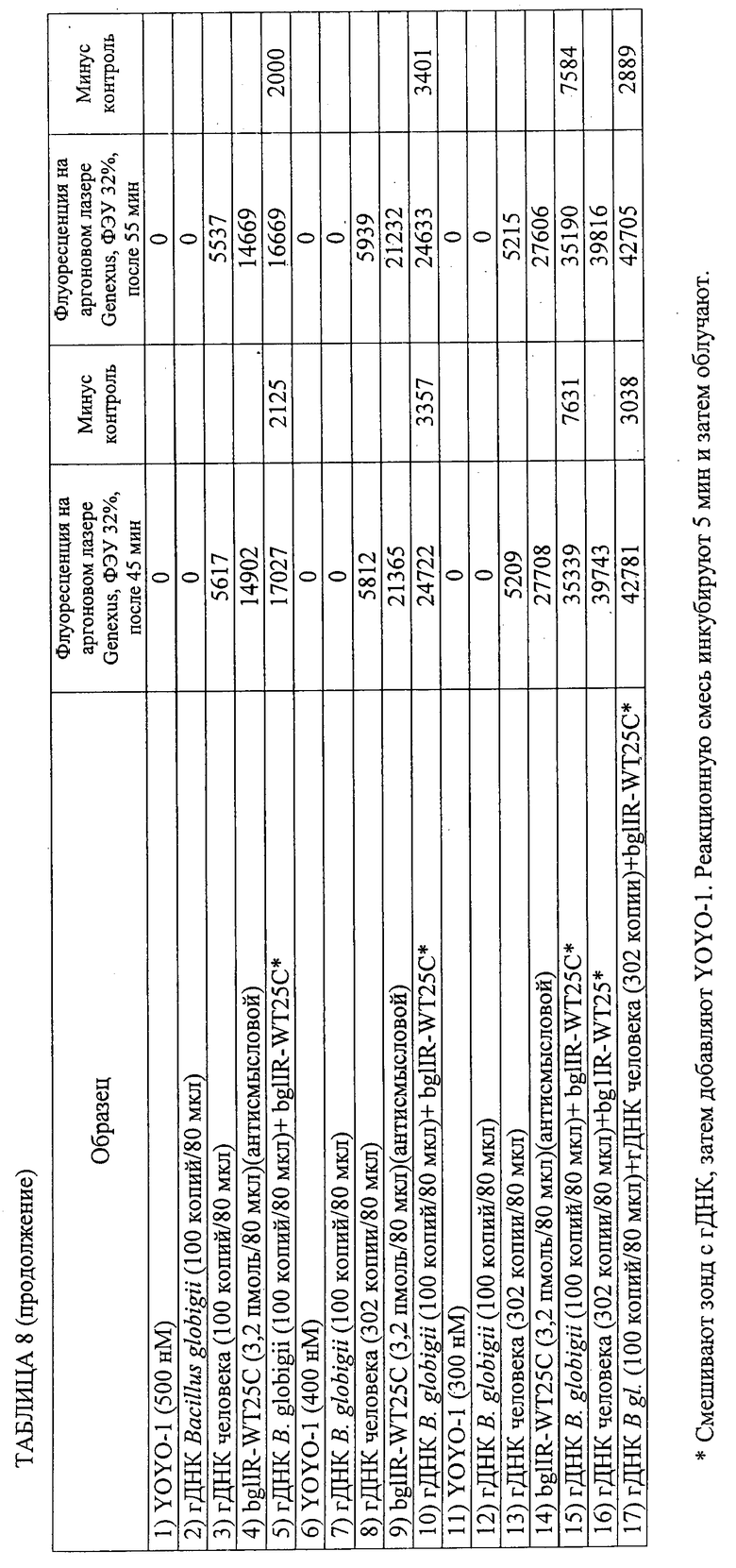










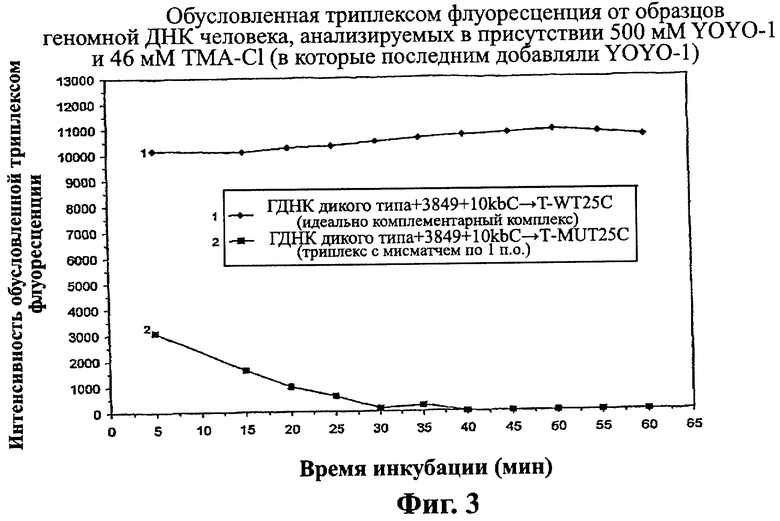
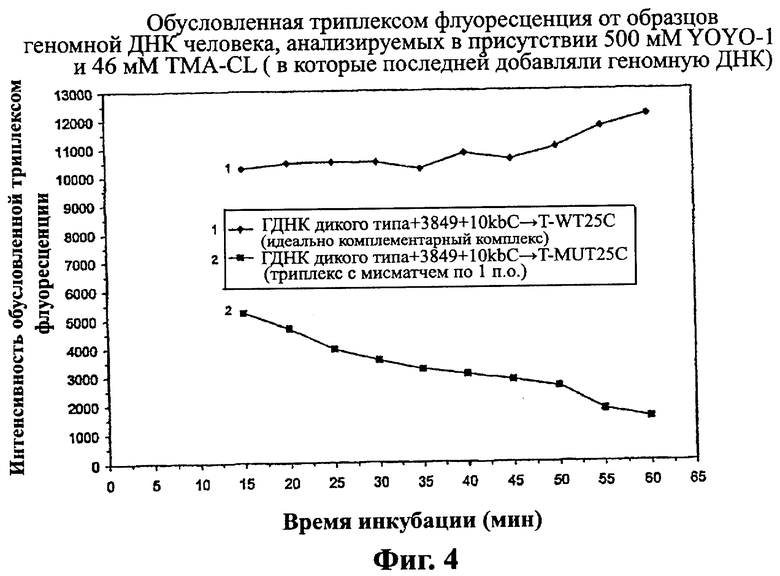

Изобретение относится к области биотехнологии, а именно к способу обнаружения нуклеотидной последовательности в геномном образце. Способ включает получение геномного образца, включающего некоторое количество дуплексных нуклеиновых кислот, содержащих нуклеотидные последовательности-мишени. Подготавливают гибридизационную смесь, включающую геномный образец, зонды, промотирующие гибридизацию агенты и метки. Проводят инкубацию гибридизационной смеси, содержащей комплексы дуплексных нуклеотидных последовательностей-мишеней, зондов и меток. Облучают инкубированную смесь с помощью излучения, способного стимулировать излучение энергии по крайней мере некоторых из меток. Устанавливают на основании данных флуоресцентного сигнала, являются ли нуклеотидные последовательности-зонды идеально комплементарными нуклеотидным последовательностям-мишеням для обнаружения присутствия этой нуклеотидной последовательности в геномном образце. Способ осуществляют без денатурирования дуплексных нуклеиновых кислот и без амплификации дуплексных нуклеиновых кислот путем полимеразной цепной реакции (ПЦР), при этом отношение количества зондов к количеству дуплексных нуклеиновых кислот составляет от 3,2×109 до 1012. Предложенное изобретение позволяет обнаруживать нуклеотидный полиморфизм в геномной мишени без амплификации мишени. 2 н. и 51 з.п. ф-лы, 5 ил., 8 табл., 8 пр.
1. Способ обнаружения нуклеотидной последовательности в геномном образце, который включает:
обеспечение геномного образца, включающего некоторое количество дуплексных нуклеиновых кислот, содержащих нуклеотидные последовательности-мишени;
обеспечение некоторого количества зондов, включающих нуклеотидные последовательности-зонды;
обеспечение гибридизационной смеси, включающей геномный образец, некоторое количество зондов, некоторое количество промотирующих гибридизацию агентов и метки;
инкубацию гибридизационной смеси с целью обеспечения инкубированной смеси, содержащей комплексы дуплексных нуклеотидных последовательностей-мишеней, зондов и меток;
облучение инкубированной смеси с помощью излучения, способного стимулировать по крайней мере некоторые из меток излучать энергию; и
установление на основании флуоресцентного сигнала, являются ли нуклеотидные последовательности-зонды идеально комплементарными нуклеотидным последовательностям-мишеням для обнаружения таким образом, присутствует ли эта нуклеотидная последовательность в геномном образце,
где отношение количества зондов к количеству дуплексных нуклеиновых кислот составляет от 3,2×109 до 1012 и где способ осуществляют без денатурирования дуплексных нуклеиновых кислот и без амплификации дуплексных нуклеиновых кислот путем полимеразной цепной реакции (ПЦР).
2. Способ по п.1, где выявляют точечный или множественный нуклеотидный полиморфизм.
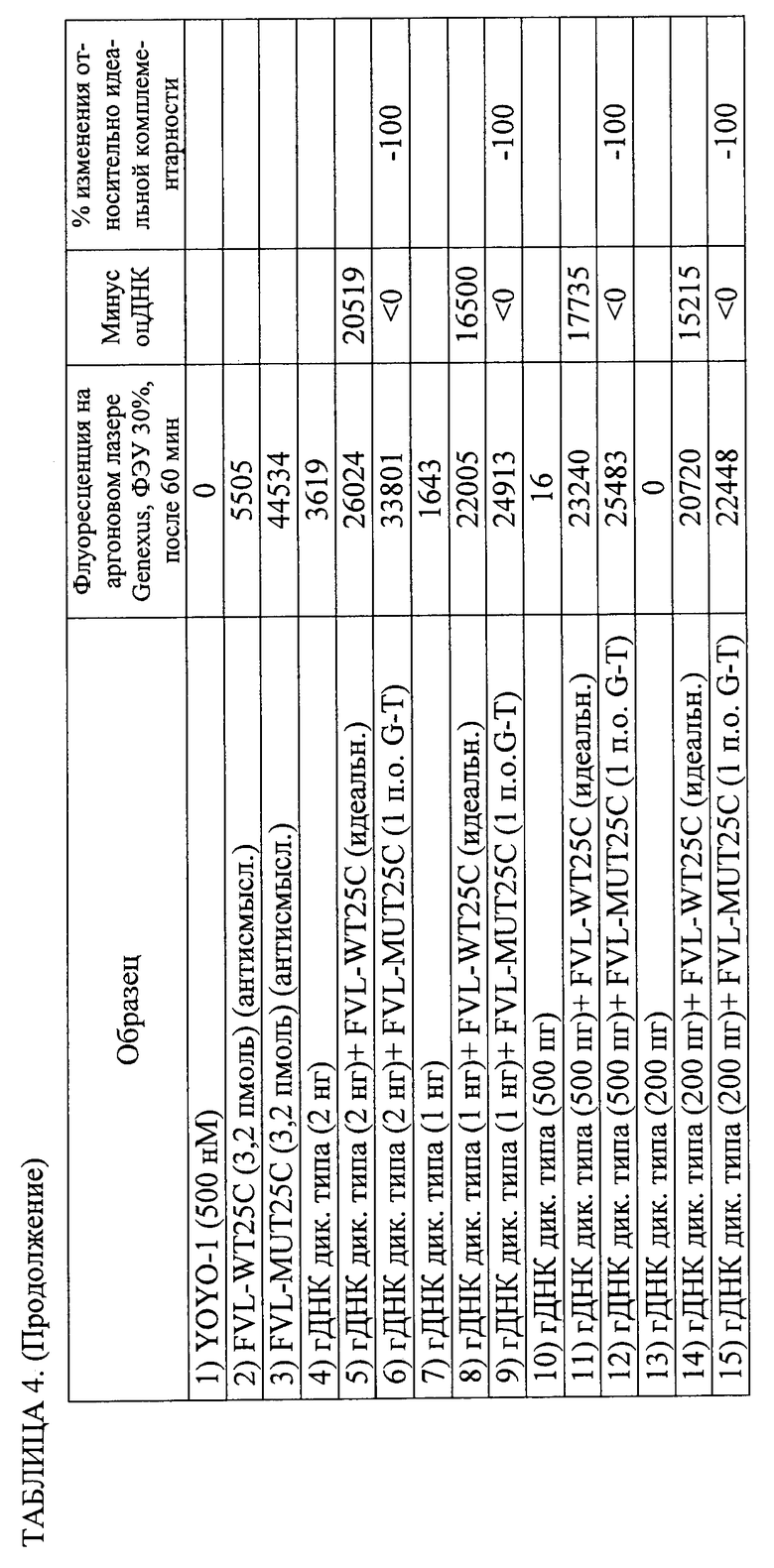
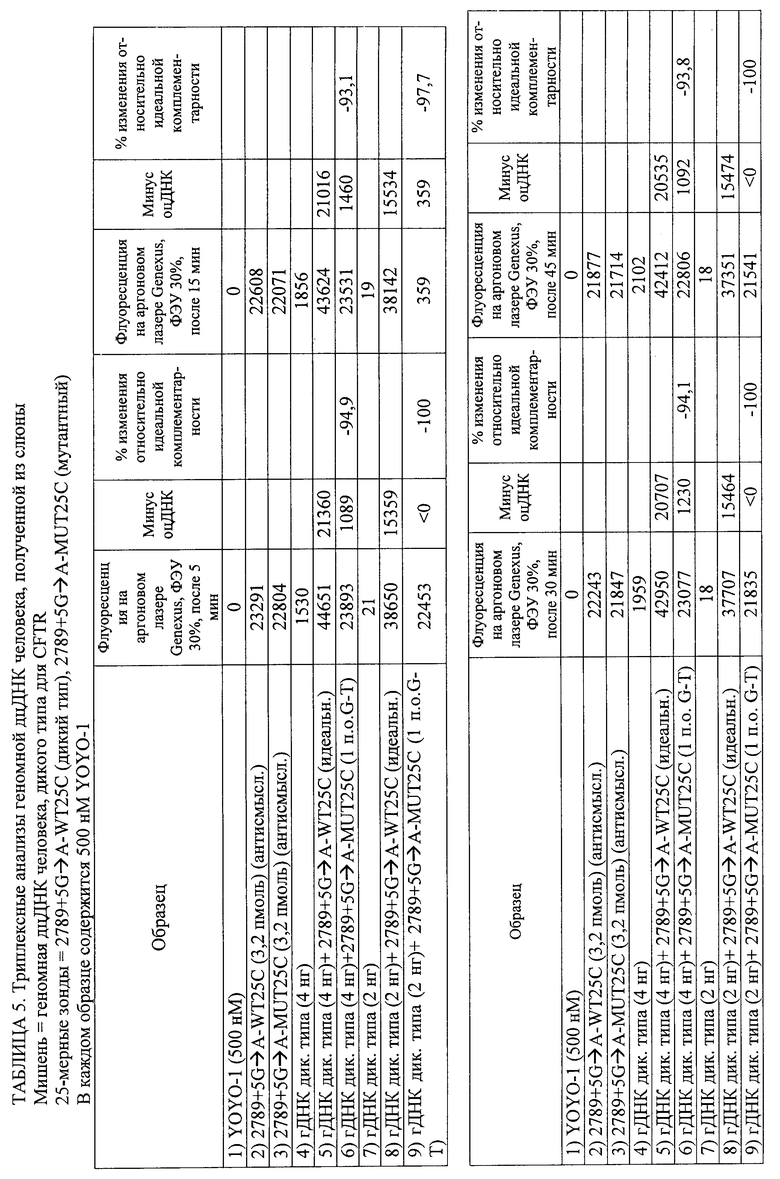
3. Способ по п.1, в котором обнаружение завершают в пределах 60 мин после обеспечения гибридизационной смеси.
4. Способ по п.3, где определяют гаплотип.
5. Способ по п.1, где обнаруживают морфологический статус организма или клетки, из которых был получен геномный образец, причем этот морфологический статус включает по меньшей мере одну из информации, касающейся стадии развития, и информации, касающейся состояния болезни.
6. Способ по п.1, в котором количество дуплексных нуклеиновых кислот в геномном образце составляет менее 700 копий.
7. Способ по п.6, в котором количество дуплексных нуклеиновых кислот в геномном образце составляет от примерно 150 до примерно 300 копий.
8. Способ по п.6, в котором геномный образец состоит, по существу, из содержимого единичной клетки.
9. Способ по п.1, в котором детектирование осуществляют в биологической клетке.
10. Способ по п.1, в котором геномный образец имеет длину более 5 т.п.о.
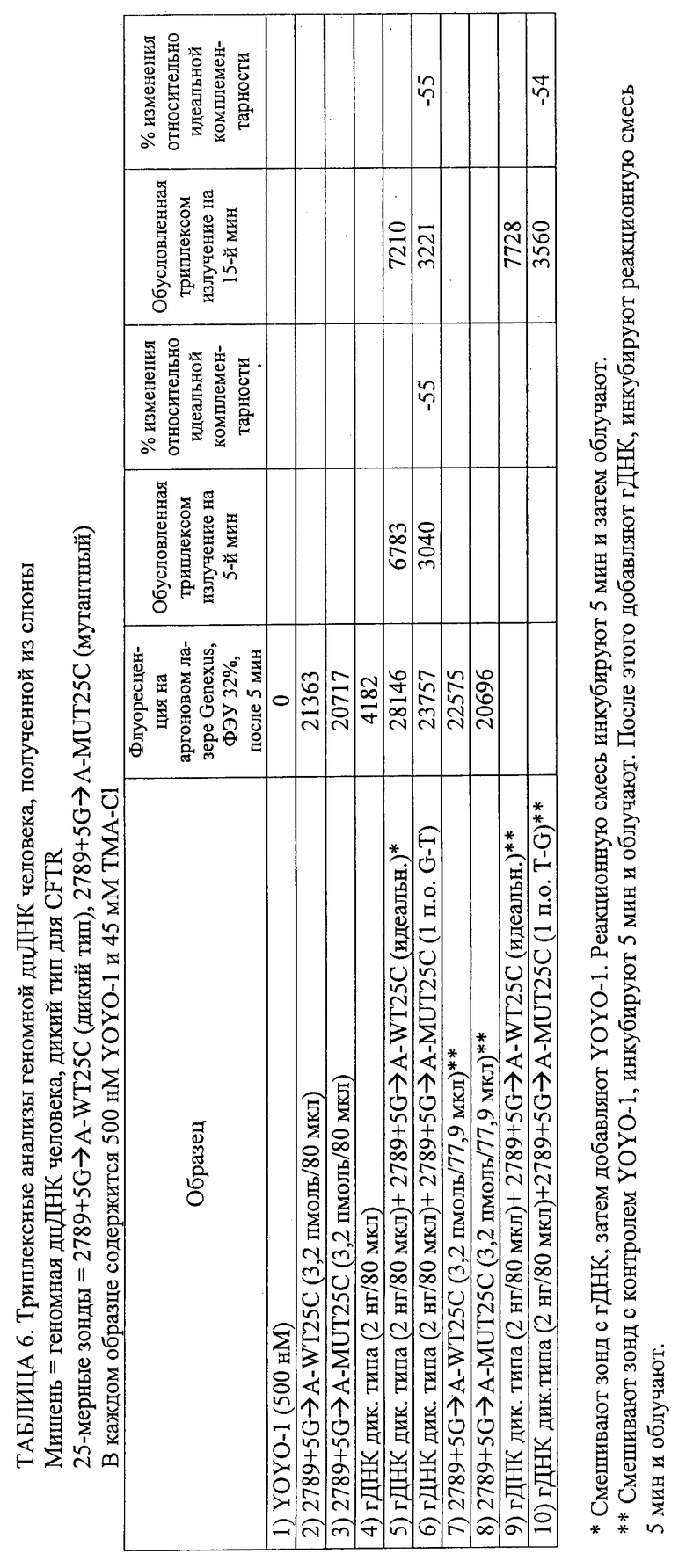
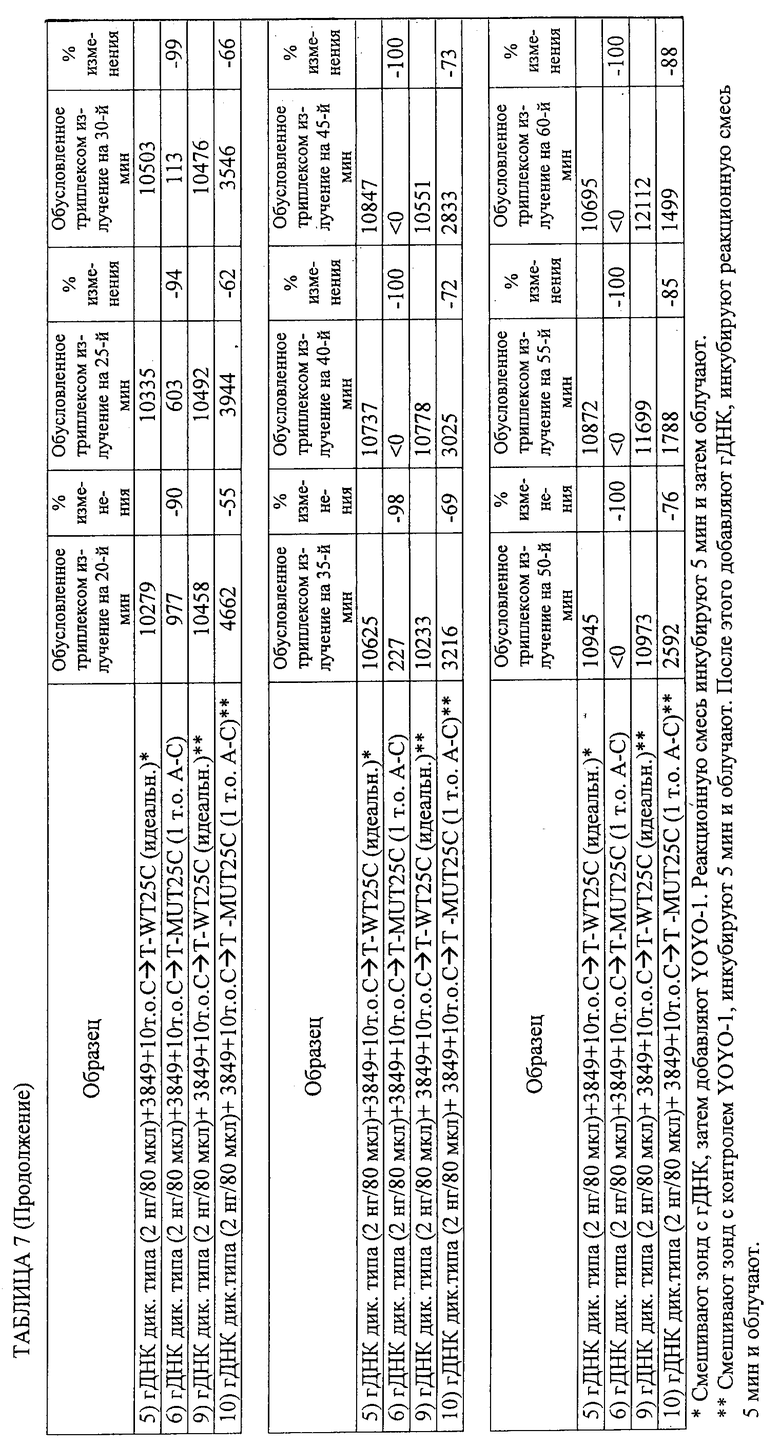
11. Способ по п.1, в котором геномный образец не является фрагментированным в ходе осуществления способа.
12. Способ по п.1, в котором нуклеотидная последовательность принадлежит патогену, присутствующему или ранее присутствовавшему в организме или клетке, из которых получают геномный образец.
13. Способ по п.1, в котором каждый из зондов, если он единичный, представляет собой одноцепочечную нуклеиновую кислоту или аналог нуклеиновой кислоты длиной от 15 до 30 оснований.
14. Способ по п.1, в котором каждый из промотирующих гибридизацию агентов является интеркалирующей меткой.
15. Способ по п.14, в котором интеркалирующая метка включает димерные цианиновые красители.
16. Способ по п.15, в котором интеркалирующая метка состоит из YOYO-1.
17. Способ по п.1, в котором метками являются интеркалирующие флуорофоры, которые также являются промотирующими гибридизацию агентами.
18. Способ по п.1, в котором каждый из промотирующих гибридизацию агентов является космотропом.
19. Способ по п.1, в котором каждый из промотирующих гибридизацию агентов является катионом соединения, выбранного из группы, состоящей из (CH3)4NCl, (CH3)3N·HCl, NaCl, Na2SO4, Na2HPO4 и (NH4)2SO4.
20. Способ по п.1, в котором метками являются неинтеркалирующие флуорофоры.
21. Способ по п.1, в котором время инкубации составляет от 1 до 10 мин и способ полностью осуществляется в пределах менее 15 мин.
22. Способ по п.1, в котором гибридизационную смесь выдерживают в течение периода инкубации при температуре от 20 до 40°С.
23. Способ по п.1, в котором по меньшей мере одно основание зондов связывается с каким-либо основанием или парой оснований нуклеотидных последовательностей-мишеней по Уотсон-Криковскому механизму взаимодействия комплементарных оснований между комплементарными основаниями и/или механизму взаимодействия гомологичных оснований между идентичными основаниями, в результате чего каждым из комплексов является триплекс.
24. Способ по п.1, в котором по меньшей мере одно основание зондов связывается с каким-либо основанием или парой оснований нуклеотидных последовательностей-мишений по Уотсон-Криковскому механизму взаимодействия комплементарных оснований между комплементарными основаниями и/или механизму взаимодействия гомологичных оснований между идентичными основаниями, в результате чего каждым из комплексов является квадруплекс.
25. Способ по п.1, в котором зонды и нуклеотидные последовательности-мишени связываются между собой не только как антипараллельные цепи согласно правилам спаривания оснований Уотсона-Крика.
26. Способ по п.1, в котором источником излучения является лазер с плотностью энергии луча приблизительно 84 Вт/(см2/с).
27. Способ по п.1, в котором для определения того, являются ли нуклеотидные последовательности-зонды идеально комплементарными нуклеотидным последовательностям-мишеням, флуоресцентный сигнал образца сравнивают с эталонным флуоресцентным сигналом.
28. Способ по п.1, в котором обнаружение включает регистрацию изменения флуоресцентного сигнала в течение определенного периода времени для определения того, являются ли нуклеотидные последовательности-зонды идеально комплементарными нуклеотидным последовательностям-мишеням, и в котором увеличение флуоресцентного сигнала в течение определенного периода времени указывает на идеальную комплементарность, а снижение флуоресцентного сигнала во времени указывает на отсутствие идеальной комплементарности.
29. Способ по п.1, в котором зонды обеспечивают в гибридизационной смеси в насыщающем мишень количестве.
30. Способ по п.1, в котором дискриминацию флуоресцентного сигнала от фоновых сигналов максимизируют за счет переноса энергии или миграции энергии между интеркалированными внутри мишени метками и метками, интеркалированными между зондом и мишенью.
31. Способ по п.1, в котором каждый из зондов имеет длину в 20-30 оснований или пар оснований.
32. Способ по п.1, в котором геномный образец добавляют к гибридизационной смеси после зондов, промотирующих гибридизацию агентов и меток.
33. Способ по п.1, в котором последними добавляют к гибридизационной смеси промотирующие гибридизацию агенты или метки.
34. Способ по п.1, в котором геномный образец очищают, частично очищают, не очищают или разбавляют.
35. Способ по п.1, в котором гибридизационная смесь дополнительно включает множество дополнительных зондов, которые связываются с последовательностями геномного образца, находящимися рядом с нуклеотидной последовательностью-мишенью.
36. Способ по п.1, в котором каждый из зондов включает тушитель излучения и по меньшей мере одну из меток.
37. Способ по п.1, в котором каждый из зондов модифицируют по меньшей мере одной присоединенной группировкой.
38. Способ по п.1, в котором метки включают наборы для FET, FRET, миграции энергии или редокс-наборы.
39. Способ по п.1, в котором метки включают квантовые точки.
40. Способ по п.1, в котором обнаруживают повторы, инсерции или делеции нуклеотидных последовательностей.
41. Способ по п.1, в котором обнаружение повторяют, варьируя условия гибридизационной смеси.
42. Способ по п.1, где обнаруживают раковое или болезненное состояние организма или клетки, из которых получают геномный образец, или определяют беременность организма.
43. Способ по п.1, в котором геномный образец получают из образца ткани человека, клеток полости рта, крови, жидкости, слюны, мочи или фекалий и метят маркером для молекулярной идентификации, соответствующим источнику геномного образца.
44. Способ по п.1, в котором зонды обеспечивают на подложке, выбираемой из группы, состоящей из бусины, планшета, мембраны, пленки, микролунки, электрода, колонки и капиллярной трубки.
45. Способ по п.1, в котором зонды обеспечивают на серебряной островковой пленке.
46. Способ по п.1, в котором после стадии инкубации и перед стадией воздействия энергией инкубированную смесь дополнительно инкубируют в таких условиях, что зонды диссоциируют от нуклеотидных последовательностей-мишеней, и в котором стадия обнаружения включает определение на основании сигнала, диссоциировали ли зонды от нуклеотидных последовательностей-мишеней, с целью определения того, являются ли зонды идеально комплементарными нуклеотидным последовательностям-мишеням.
47. Способ по п.1, в котором каждый из зондов включает одну или более частей и, по меньшей мере, одна из этих частей имеет длину от 5 до 30 оснований.
48. Способ по п.1, дополнительно включающий стадию обеспечения, по меньшей мере, одного блокирующего зонда для подавления связывания зондов с последовательностью геномного образца, не являющейся мишенью.
49. Способ по п.1, в котором комплекс действует как фотонная структура для сбора фотонной энергии и переноса энергии на излучающую сигнал метку.
50. Способ по п.1, в котором стадии способа повторяют более одного раза с целью получения более чем одной гибридизационной смеси и более чем одного флуоресцентного сигнала при условии, что каждую гибридизационную смесь образуют путем объединения геномного образца, зондов, промотирующих гибридизацию агентов и меток в иной последовательности.
51. Способ по п.1, в котором обнаружение включает регистрацию изменения анизотропии флуоресценции флуоресцентного агента во времени с целью определения, являются ли зонды идеально комплементарными нуклеотидным последовательностям-мишеням.
52. Способ обнаружения нуклеотидной последовательности в геномном образце, который включает:
обеспечение геномного образца, выделенного из тела человека или животного, включающего некоторое количество одноцепочечных или двухцепочечных нуклеиновых кислот, содержащих нуклеотидные последовательности-мишени;
обеспечение некоторого количества зондов, включающих нуклеотидные последовательности-зонды;
обеспечение гибридизационной смеси, включающей геномный образец, некоторое количество зондов, некоторое количество промотирующих гибридизацию агентов и метки;
инкубацию гибридизационной смеси с целью получения инкубированной смеси, содержащей комплекс одноцепочечных или двухцепочечных нуклеиновых кислот, зондов и меток;
воздействие энергией на инкубированную смесь, достаточной для того, чтобы получить от гибридизационной смеси сигнал; и
установление на основании сигнала, являются ли нуклеотидные последовательности-зонды идеально комплементарными нуклеотидным последовательностям-мишеням для обнаружения таким образом, присутствует ли эта нуклеотидная последовательность в геномном образце,
где: а) отношение количества зондов к количеству нуклеиновых кислот составляет от 3,2×109 до 1012, б) обнаружение завершают в пределах 60 мин после обеспечения гибридизационной смеси и с) способ осуществляют без денатурирования дуплексной нуклеиновой кислоты и без амплификации дуплексной нуклеиновой кислоты путем полимеразной цепной реакции (ПЦР).
53. Способ по п.52, в котором после стадии инкубации и перед стадией воздействия энергией инкубированную смесь дополнительно инкубируют в таких условиях, что зонды диссоциируют от нуклеотидной последовательности-мишени, и в котором стадия обнаружения включают определение на основании сигнала, диссоциировали ли зонды от нуклеотидных последовательностей-мишеней, с целью определения того, являются ли зонды идеально комплементарными нуклеотидным последовательностям-мишеням.
| WO 03010326 A2, 06.02.2003 | |||
| АНАЛИЗ ИНТЕНСИВНОСТИ ФЛУОРЕСЦЕНЦИИ ДЛЯ ДУПЛЕКСНОЙ И ТРИПЛЕКСНОЙ ГИБРИДИЗАЦИИ НУКЛЕИНОВЫХ КИСЛОТ В РАСТВОРЕ С ИСПОЛЬЗОВАНИЕМ ФЛУОРЕСЦЕНТНЫХ ИНТЕРКАЛЯТОРОВ | 2000 |
|
RU2273668C2 |
| ГОМОГЕННЫЙ АНАЛИЗ ДУПЛЕКСНОЙ ИЛИ ТРИПЛЕКСНОЙ ГИБРИДИЗАЦИИ С ИСПОЛЬЗОВАНИЕМ МНОЖЕСТВЕННЫХ ИЗМЕРЕНИЙ ПРИ ВАРЬИРУЕМЫХ УСЛОВИЯХ | 2001 |
|
RU2242518C2 |
Авторы
Даты
2012-10-20—Публикация
2005-09-23—Подача