ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к детекции нуклеиновокислотной последовательности-мишени в анализе с PCE-SH (РТО Cleavage and Extension-Dependent Signaling Oligonucleotide Hybridization - гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения зондирующего и метящего олигонуклеотида (РТО)).
СВЕДЕНИЯ О РОДСТВЕННОМ УРОВНЕ ТЕХНИКИ
Гибридизация ДНК представляет собой фундаментальный процесс в молекулярной биологии, и на него влияют ионная сила, состав оснований, длина фрагмента, до которого укорочена нуклеиновая кислота, степень ошибочного спаривания и присутствие денатурирующих агентов. Основанные на гибридизации ДНК технологии были бы чрезвычайно полезным средством в определении конкретной нуклеиновокислотной последовательности и были бы, несомненно, необходимы в области клинической диагностики, генетических исследований и лабораторной судебно-медицинской экспертизы.
Однако, в традиционных методах и способах, основанных главным образом на гибридизации, с большой вероятностью получаются ложноположительные результаты вследствие неспецифической гибридизации между зондами и последовательностями, не являющимися мишенями. Ввиду этого, остаются проблемы, требующие разрешения с точки зрения повышения надежности этих способов.
Помимо способов с гибридизацией зондов были предложены различные подходы с использованием дополнительных ферментативных реакций, например, способ с применением TaqMan™-зондов.
В способе с применением TaqMan™-зондов меченый зонд, гибридизованный с нуклеиновокислотной последовательностью-мишенью, расщепляется под действием 5'-нуклеазной активности ДНК-полимеразы, зависящей от прямого праймера, генерируя сигнал, указывающий на присутствие последовательности-мишени (патенты США №№5210015, 5538848 и 6326145). Согласно способу с применением TaqMan™-зондов предлагается два подхода для генерирования сигнала: зависящее от полимеризации расщепление и не зависящее от полимеризации расщепление. При зависящем от полимеризации расщеплении удлинение прямого праймера должно происходить до того, как полимераза нуклеиновых кислот встретится с 5'-концом меченого зонда. По мере продолжения реакции удлинения полимераза постепенно расщепляет 5'-конец меченого зонда. При не зависящем от полимеризации расщеплении прямого праймера и меченый зонд гибридизуются с нуклеиновокислотной последовательностью-мишенью в непосредственной близости, так что связывание полимеразы нуклеиновых кислот с 3'-концом прямого праймера приводит ее в контакт с 5'-концом меченого зонда, результатом чего является высвобождение метки. Кроме того, в способе с применением TaqMan™-зондов описывается, что меченый зонд, имеющий на своем 5'-конце 5'-хвостовой участок, не гибридизующийся с последовательностью-мишенью, также расщепляется с образованием фрагмента, содержащего данный 5'-хвостовой участок.
Сообщалось о некоторых способах, в которых зонд, имеющий 5'-хвостовой участок, некомлементарный последовательности-мишени, расщепляется под действием 5'-нуклеазы с высвобождением фрагмента, содержащего данный 5'-хвостовой участок.
Например, в патенте США №5691142 описывается расщепляемая структура, которая должна перевариваться под действием 5'-нуклеазной активности ДНК-полимеразы. Приводится пример расщепляемой структуры, в которой олигонуклеотид, содержащий 5'-участок, не комплементарный матрице, и 3'-участок, комплементарный матрице, гибридизуется с данной матрицей, и в непосредственной близости с этой матрицей гибридизуется располагающийся против хода транскрипции олигонуклеотид. Такая расщепляемая структура расщепляется ДНК-полимеразой, обладающей 5'-нуклеазной активностью, или модифицированной ДНК-полимеразой со сниженной способностью к синтезу с высвобождением 5'-участка, некомплементарного данной матрице. Высвободившийся 5'-участок далее гибридизуется с олигонуклеотидом, имеющим шпилечную структуру, с образованием расщепляемой структуры, индуцируя тем самым прогрессирующие реакции расщепления, необходимые для детекции последовательности-мишени.
В патенте США №7381532 описывается способ, в котором расщепляемая структура, содержащая располагающийся против хода транскрипции олигонуклеотид с блокированным 3'-концом, расщепляется ДНК-полимеразой, обладающей 5'-нуклеазной активностью, или нуклеазой FEN (Flap EndoNuclease - флэп-эндонуклеаза) с высвобождением некомплементарного 5'-концевого одноцепочечного "свисающего" участка (флэпа), и детекцию этого высвободившегося 5'-концевого "свисающего" участка осуществляют, используя анализ по размеру или систему двух взаимодействующих меток. В патенте США №6893819 описывается, что детектируемые высвободившиеся "свисающие" участки получаются в результате применения зависящего от синтеза нуклеиновой кислоты, флэп-опосредованного способа амплификации последовательностей. В этом способе высвободившийся из первой расщепляемой структуры "свисающий" участок опосредует зависящим от синтеза нуклеиновой кислоты образом расщепление второй расщепляемой структуры, что необходимо для высвобождения "свисающего" участка из второй расщепляемой структуры, и высвободившиеся "свисающие" участки детектируют.
Используя гибридизацию меченных флуоресцентной меткой зондов в жидкой фазе, можно осуществить одновременную детекцию множества нуклеиновокислотных последовательностей-мишеней с применением флуоресцентной метки даже одного типа путем анализа кривой плавления. Однако, традиционные технологии детекции последовательностей-мишеней с применением 5'-нуклеаза-опосредованного расщепления зондов, содержащих систему двух взаимодействующих меток, требуют наличия флуоресцентных меток различных типов для различных последовательностей-мишеней при детекции множественных мишеней, что ограничивает число детектируемых последовательностей-мишеней ввиду ограниченного количества типов флуоресцентных меток.
В публикации заявки на патент США 2008/0241838 описывается способ детекции мишени с использованием расщепления зонда, содержащего 5'-концевой участок, некомплементарный нуклеиновокислотной последовательности-мишени, и гибридизации зонда захвата. Метка расположена на некомплементарном 5'-концевом участке. Меченый зонд, гибридизованный с последовательностью-мишенью, расщепляется с высвобождением фрагмента, после чего этот фрагмент далее гибридизуется с зондом захвата для детекции присутствия последовательности-мишени. В этом способе необходимо, чтобы нерасщепленный/интактный зонд не гибридизовался с зондом захвата. Для этого зонд захвата, имеющий меньшую длину, должен быть иммобилизован на твердой подложке. Однако такое ограничение приводит к снижению эффективности гибридизации на твердой подложке, а также к затруднениям в оптимизации реакционных условий.
Таким образом, в данной области техники сохраняется давно назревшая необходимость в разработке новых подходов к детекции последовательности-мишени, предпочтительно множественных последовательностей-мишеней, в жидкой фазе и на твердой фазе, не только посредством гибридизации, но также с использованием ферментативных реакций, таких как 5'-нуклеолитическая реакция, более удобным, надежным и воспроизводимым образом. Кроме того, в данной области техники также существует необходимость в новом способе детекции мишени, не ограниченном количеством типов меток (в частности, флуоресцентными метками).
Таким образом, в данной области техники сохраняется давно назревшая необходимость в разработке новых подходов к детекции нуклеиновокислотной последовательности-мишени более удобным, надежным и воспроизводимым образом, свободным от недостатков, присущих традиционным технологиям.
По всей этой заявке сделаны ссылки на различные патенты и публикации, и упоминания о них приведены в круглых скобках. Тем самым описание этих патентов и публикаций во всей их полноте включено в эту заявку посредством ссылок с целью более полного описания данного изобретения и состояния области техники, к которой это изобретение имеет отношение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения провели интенсивные исследования с целью разработки новых подходов для детекции последовательностей-мишеней, характеризующихся более высокой точностью и удобством, помимо прочего, в режиме множественной детекции. В результате авторы изобретения разработали новые протоколы для детекции последовательностей-мишеней, в которых детекция мишени осуществляется с использованием ферментативных реакций, таких как 5'-нуклеолитическая реакция и удлинение, и зависящей от удлинения гибридизации, а также посредством гибридизации зондов. Протоколы по настоящему изобретению хорошо адаптированы как к реакциям в жидкой фазе, так и к реакциям на твердой фазе, и это дает возможность осуществлять детекцию множественных последовательностей-мишеней с более высокой точностью и более удобным образом.
Соответственно, данным изобретением решается задача разработки способа детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО).
Другой задачей данного изобретения является создание набора для детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH.
Другие задачи и преимущества настоящего изобретения станут очевидны из следующего далее подробного описания в сочетании с прилагаемыми формулой изобретения и фигурами.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг. 1 схематически показаны структуры РТО (probing and tagging oligonucleotide - зондирующего и метящего олигонуклеотида), СТО (capturing and templating oligonucleotide - захватывающего и матричного олигонуклеотида) и SO (signaling oligonucleotide - сигнального олигонуклеотида), использованных в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО). Предпочтительно, чтобы 3'-концы РТО, СТО и SO были блокированы, чтобы препятствовать их удлинению.
На Фиг. 2 схематически представлен PCE-SH-анализ, в котором используется внутрицепочечная система двух взаимодействующих меток (intrastrand interactive dual label). SO имеет репортерную молекулу и молекулу-гаситель.
На Фиг. 3 схематически представлен PCE-SH-анализ с использованием одиночной метки. В качестве одиночной метки SO имеет репортерную молекулу. Репортерная молекула необходима для того, чтобы демонстрировать различную интенсивность сигнала в зависимости от ее присутствия на одноцепочечной форме или двухцепочечной форме.
На Фиг. 4 схематически представлен PCE-SH-анализ с использованием межцепочечной системы двух взаимодействующих меток (interstrand interactive dual label) и двух SO. Каждый из этих двух SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток.
На Фиг. 5 схематически представлен PCE-SH-анализ с использованием межцепочечной системы двух взаимодействующих меток. SO содержит репортерную молекулу, а удлиненная цепь содержит молекулу-гаситель.
На Фиг. 6 схематически представлен PCE-SH-анализ с использованием межцепочечной системы двух взаимодействующих меток. SO содержит репортерную молекулу, а удлиненная цепь содержит структуру гаситель-(остаток изо-dG (изодезоксигуанозин)), встраиваемую во время реакции удлинения.
На Фиг. 7 схематически представлен PCE-SH-анализ с использованием межцепочечной системы двух взаимодействующих меток. SO содержит репортерную молекулу, а удлиненная цепь содержит структуру гаситель-(остатки dA (дезоксиаденозин)), встраиваемую во время реакции удлинения.
На Фиг. 8 схематически представлен PCE-SH-анализ с использованием интеркалирующих красителей. SO содержит акцептор. В качестве доноров используют SYBR зеленый.
На Фиг. 9 схематически представлен PCE-SH-анализ для детекции нуклеотидной вариации.
На Фиг. 10А показаны результаты детекции гена Neisseria gonorrhoeae в режиме реального времени с использованием PCE-SH-анализа. SO содержит репортерную молекулу и молекулу-гаситель.
На Фиг. 10В показаны результаты детекции гена Neisseria gonorrhoeae с использованием PCE-SH-анализа, включающего в себя стадии анализа плавления. SO содержит репортерную молекулу и молекулу-гаситель.
На Фиг. 11А показаны результаты детекции гена Neisseria gonorrhoeae в режиме реального времени посредством PCE-SH-анализа с использованием амплификации посредством ПЦР (polymerase chain reaction - полимеразная цепная реакция). SO содержит репортерную молекулу и молекулу-гаситель.
На Фиг. 11В показаны результаты детекции гена Neisseria gonorrhoeae в режиме реального времени с использованием PCE-SH-анализа, включающего в себя стадии пост-ПЦР-анализа плавления. SO содержит репортерную молекулу и молекулу-гаситель.
На Фиг. 12 показаны результаты детекции однонуклеотидной вариации нуклеиновокислотной последовательности-мишени с использованием PCE-SH-анализа, включающего в себя стадии пост-ПЦР-анализа плавления. Была обнаружена мутация С677Т в гене метилентетрагидрофолатредуктазы (MTHFR).
На Фиг. 13А показаны результаты детекции гена Neisseria gonorrhoeae в режиме реального времени посредством PCE-SH-анализа с использованием 5'-нуклеазной активности, не зависящей от располагающегося против хода транскрипции олигонуклеотида.
На Фиг. 13В показаны результаты детекции гена Neisseria gonorrhoeae в PCE-SH-анализе, включающем в себя стадии анализа плавления, с использованием 5'-нуклеазной активности, не зависящей от располагающегося против хода транскрипции олигонуклеотида.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящего изобретения предложен способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
а) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся против хода транскрипции олигонуклеотидом и зондирующим и метящим олигонуклеотидом (РТО); при этом располагающийся против хода транскрипции олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; РТО содержит (1) 3'-концевой узнающий мишень участок (3'-targeting portion), содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок (5'-tagging portion), содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся против хода транскрипции олигонуклеотид предшествует РТО;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом располагающийся против хода транскрипции олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок (templating portion), содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс;
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
Авторы настоящего изобретения провели интенсивные исследования с целью разработки новых подходов для детекции последовательностей-мишеней, характеризующихся более высокой точностью и удобством, помимо прочего, в режиме множественной детекции. В результате авторы изобретения разработали новые протоколы для детекции последовательностей-мишеней, в которых детекция мишеней осуществляется с использованием ферментативных реакций, таких как 5'-нуклеолитическая реакция и удлинение, и зависящей от удлинения гибридизации, а также гибридизации зондов. Протоколы по настоящему изобретению хорошо адаптированы как к реакциям в жидкой фазе, так и к реакциям на твердой фазе, и это дает возможность осуществлять детекцию множественных последовательностей-мишеней с более высокой точностью и более удобным образом.
В настоящем изобретении реализуются поочередные события в такой последовательности: гибридизация зондов; расщепление и удлинение РТО (зондирующего и метящего олигонуклеотида) и зависящая от удлинения гибридизация сигнального олигонуклеотида. Поэтому способ называется анализом с PCE-SH (с гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО).
PCE-SH-анализ далее будет описан более подробно.
Стадия (а). Гибридизация располагающегося против хода транскрипции олигонуклеотида и РТО с нуклеиновокислотной последовательностью-мишенью
Согласно настоящему изобретению нуклеиновокислотная последовательность-мишень сначала гибридизуется с располагающимся против хода транскрипции олигонуклеотидом и РТО (зондирующим и метящим олигонуклеотидом).
Используемый в данном описании термин "нуклеиновая кислота-мишень", "нуклеиновокислотная последовательность-мишень" или "последовательность-мишень" относится к представляющей интерес для детекции нуклеиновокислотной последовательности, на которой отжигают зонд или праймер, либо которую гибридизуют с зондом или праймером в условиях гибридизации, отжига или амплификации.
Используемый в данном описании термин "зонд" относится к молекуле одноцепочечной нуклеиновой кислоты, содержащей участок или участки, по существу комплементарный(ые) нуклеиновокислотной последовательности-мишени.
Термин "праймер", как он использован в данном описании, относится к олигонуклеотиду, который способен действовать в качестве точки инициации синтеза в случае его помещения в условия, при которых индуцируется синтез продукта удлинения праймера, комплементарного цепи нуклеиновой кислоты (матрице), т.е. в присутствии нуклеотидов и агента для полимеризации, такого как ДНК-полимераза, и при подходящих значениях температуры и рН.
Предпочтительно, чтобы зонд и праймер представляли собой молекулы одноцепочечных дезоксирибонуклеотидов. Зонды или праймеры, используемые в данном изобретении, могут содержать природный dNMP (дезоксинуклеозид-монофосфат) (т.е. dAMP (дезоксиаденозин-монофосфат), dGMP (дезоксигуанозин-монофосфат), dCMP (дезоксицитидин-монофосфат) и dTMP (дезокситимидин-монофосфат)), модифицированный нуклеотид или неприродный нуклеотид. Зонды или праймеры также могут включать рибонуклеотиды.
Праймер должен иметь достаточную длину, чтобы праймировать синтез продуктов удлинения в присутствии агента для полимеризации. Точная длина праймеров будет зависеть от многих факторов, включая температуру, способ применения и источник праймера. Термин "отжиг" или "праймирование", как он использован в данном описании, относится к присоединению олигодезоксинуклеотида или нуклеиновой кислоты к являющейся матрицей нуклеиновой кислоте, при этом данное присоединение позволяет полимеразе осуществлять полимеризацию нуклеотидов с образованием молекулы нуклеиновой кислоты, которая комплементарна нуклеиновой кислоте, являющейся матрицей, или ее части.
Термин "гибридизация", используемый в данном описании, относится к образованию двухцепочечной нуклеиновой кислоты из комплементарных одноцепочечных нуклеиновых кислот. Гибридизация может осуществляться между двумя цепями нуклеиновой кислоты, полностью сопоставимыми или в значительной степени сопоставимыми при некотором количестве ошибочных спариваний. Комплементарность, необходимая для гибридизация, может зависеть от условий гибридизации, в частности от температуры.
Гибридизация нуклеиновокислотной последовательности-мишени с располагающимся "против хода транскрипции (передним по ходу)" олигонуклеотидом и РТО может быть осуществлена в подходящих условиях гибридизации, определенных в установленном порядке путем оптимизации методик. Такие условия, как температура, концентрация компонентов, продолжительность гибридизации и промывки, компоненты буферов, их рН и ионная сила, могут быть изменены в зависимости от различных факторов, включая длину и GC-состав олигонуклеотида (располагающегося против хода транскрипции олигонуклеотида и РТО) и нуклеотидной последовательности-мишени. Например, когда используется относительно короткий олигонуклеотид, предпочтительно, чтобы были приняты условия низкой жесткости. Подробные условия гибридизации можно найти в Joseph Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001); и M.L.M. Anderson, Nucleic Acid Hybridization, Springer-Verlag New York Inc. N.Y. (1999).
He предполагается различия между терминами "отжиг" и "гибридизация", и эти термины будут использованы взаимозаменяемо.
Располагающийся против хода транскрипции олигонуклеотид и РТО содержат гибридизующиеся нуклеотидные последовательности, комплементарные нуклеиновокислотной последовательности-мишени. Термин "комплементарный" используется в данном описании для указания на то, что праймеры или зонды являются в достаточной степени комплементарными, чтобы селективно гибридизоваться с нуклеиновокислотной последовательностью-мишенью в намеченных условиях отжига или в жестких условиях, охватывая термины "по существу комплементарный" и "полностью комплементарный", предпочтительно "полностью комплементарный".
5'-Концевой тегирующий участок РТО имеет нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени. Матричный участок СТО (захватывающего и матричного олигонуклеотида) имеет нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО. Термин "некомплементарный" используется в данном описании для указания на то, что праймеры или зонды являются в достаточной степени некомплементарными, чтобы не гибридизоваться селективно с нуклеиновокислотной последовательностью-мишенью в намеченных условиях отжига или в жестких условиях, охватывая термины "по существу некомплементарный" и "полностью некомплементарный", предпочтительно "полностью некомплементарный".
Например, термин "некомплементарный" в отношении 5'-концевого тегирующего участка РТО означает, что 5'-концевой тегирующий участок является в достаточной степени некомплементарным, чтобы не гибридизоваться селективно с нуклеиновокислотной последовательностью-мишенью в намеченных условиях отжига или в жестких условиях, охватывая термины "по существу некомплементарный" и "полностью некомплементарный", предпочтительно "полностью некомплементарный".
Используемый в данном описании термин "РТО (зондирующий и метящий олигонуклеотид)" означает олигонуклеотид, содержащий (1) 3'-концевой узнающий мишень участок, служащий в качестве зонда, и (2) 5'-концевой тегирующий участок с нуклеотидной последовательностью, некомплементарной нуклеиновокислотной последовательности-мишени, который высвобождается в результате нуклеолитической реакции из РТО после гибридизации с нуклеиновокислотной последовательностью-мишенью. 5'-Концевой тегирующий участок и 3'-концевой узнающий мишень участок в РТО должны располагаться в направлении 5'→3'. РТО схематически показан на Фиг. 1.
Гибридизацию на стадии (а) предпочтительно проводят в жестких условиях, так что 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью.
Для РТО не предусматривается какой-либо конкретной длины. Например, длина РТО может составлять 15-150 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 20-150 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-60 нуклеотидов, 20-50 нуклеотидов, 30-150 нуклеотидов, 30-100 нуклеотидов, 30-80 нуклеотидов, 30-60 нуклеотидов, 30-50 нуклеотидов, 35-100 нуклеотидов, 35-80 нуклеотидов, 35-60 нуклеотидов или 35-50 нуклеотидов. 3'-Концевой узнающий мишень участок РТО может быть любой длины при условии, что он специфически гибридизуется с нуклеиновокислотными последовательностями-мишенями. Например, длина 3'-концевого узнающего мишень участка РТО может составлять 10-100 нуклеотидов, 10-80 нуклеотидов, 10-50 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-50 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-50 нуклеотидов, 20-40 нуклеотидов или 20-30 нуклеотидов. 5'-Концевой тегирующий участок может быть любой длины при условии, что он специфически гибридизуется с матричным участком СТО и далее удлиняется. Например, длина 5'-концевого тегирующего участка РТО может составлять 5-50 нуклеотидов, 5-40 нуклеотидов, 5-30 нуклеотидов, 5-20 нуклеотидов, 10-50 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 10-20 нуклеотидов, 15-50 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов или 15-20 нуклеотидов.
На 3'-конце РТО может находиться группа 3'-ОН. Предпочтительно 3'-конец РТО "блокирован" с целью недопущения его удлинения.
Блокирование может быть достигнуто традиционными методами. Например, блокирование можно осуществить путем добавления химической группировки, такой как биотин, метки, фосфатая группа, алкильная группа, ненуклеотидный линкер, фосфотионат или алкандиол, к 3'-гидроксильной группе последнего нуклеотида. Альтернативно, блокирование может быть выполнено посредством удаления 3'-гидроксильной группы последнего нуклеотида или путем использования нуклеотида, лишенного 3'-гидроксильной группы, такого как дидезоксинуклеотид.
Альтернативно, РТО может быть сконструирован так, чтобы принимать шпилечную структуру.
Отсутствие гибридизации между 5'-концевым тегирующим участком РТО и нуклеиновокислотной последовательностью-мишенью означает отсутствие образования из них стабильной двухцепочечной структуры в определенных условиях гибридизации. Согласно предпочтительному воплощению 5'-концевой тегирующий участок РТО, не вовлеченный в гибридизацию с нуклеиновокислотной последовательностью-мишенью, образует одноцепочечную структуру.
Расположенный в направлении 3' -5'олигонуклеотид предшествует РТО.
Помимо этого, располагающийся против хода транскрипции олигонуклеотид или его удлиненная цепь, гибридизованная с нуклеиновокислотной последовательностью-мишенью, индуцирует расщепление РТО ферментом, обладающим 5'-нуклеазной активностью.
Индукция расщепления РТО при посредстве располагающегося против хода транскрипции олигонуклеотида может протекать двумя путями: (1) как индукция расщепления, не зависящая от удлинения располагающегося против хода транскрипции олигонуклеотида; и (2) как индукция расщепления, зависящая от удлинения располагающегося против хода транскрипции олигонуклеотида.
В том случае, когда располагающийся против хода транскрипции олигонуклеотид локализован достаточно близко к РТО, чтобы индуцировать расщепление РТО ферментом, обладающим 5'-нуклеазной активностью, тогда фермент, связавшийся с располагающимся против хода транскрипции олигонуклеотидом, расщепляет РТО без реакции удлинения. В отличие от этого, когда располагающийся против хода транскрипции олигонуклеотид локализован в отдалении от РТО, тогда фермент, обладающий полимеразной активностью, (например, матричная полимераза) катализирует удлинение располагающегося против хода транскрипции олигонуклеотида (например, прямого праймера), а фермент, обладающий 5'-нуклеазной активностью, связавшийся с удлиненным продуктом, расщепляет РТО.
Следовательно, располагающийся против хода транскрипции олигонуклеотид может быть локализован относительно РТО двумя способами. Располагающийся против хода транскрипции олигонуклеотид может быть локализован достаточно близко к РТО, чтобы индуцировать расщепление РТО не зависящим от удлинения образом. Альтернативно, располагающийся против хода транскрипции олигонуклеотид может быть локализован достаточно далеко от РТО, чтобы индуцировать расщепление РТО зависящим от удлинения образом.
Используемый в данном описании термин "расположенный вблизи" в отношении расположений или локализаций означает, что располагающийся против хода транскрипции олигонуклеотид локализован близко к 3'-концевому узнающему мишень участку РТО с образованием "ника" (одноцепочечного разрыва). Кроме того, этот термин означает, что располагающийся против хода транскрипции олигонуклеотид локализован на расстоянии 1-30 нуклеотидов, 1-20 нуклеотидов или 1-15 нуклеотидов от 3'-концевого узнающего мишень участка РТО.
Используемый в данном описании термин "отдаленный" в отношении расположений или локализаций, включает в себя любые расположения или локализации, достаточные для обеспечения протекания реакций удлинения.
Согласно предпочтительному воплощению располагающийся против хода транскрипции олигонуклеотид локализован на достаточном отдалении от РТО, чтобы индуцировать расщепление РТО зависящим от удлинения образом.
Согласно предпочтительному воплощению располагающийся против хода транскрипции олигонуклеотид представляет собой располагающийся против хода транскрипции праймер или располагающийся против хода транскрипции зонд. Располагающийся против хода транскрипции праймер подходит для индукции не зависящего от удлинения расщепления или для индукции зависящего от удлинения расщепления, а располагающийся против хода транскрипции зонд подходит для индукции не зависящего от удлинения расщепления.
Альтернативно, располагающийся против хода транскрипции олигонуклеотид может иметь последовательность, частично перекрывающуюся с 5'-концевой частью 3'-концевого узнающего мишень участка РТО. Предпочтительно, чтобы длина перекрывающейся последовательности составляла 1-10 нуклеотидов, более предпочтительно 1-5 нуклеотидов, еще более предпочтительно 1-3 нуклеотида. В том случае, когда располагающийся против хода транскрипции олигонуклеотид имеет последовательность, частично перекрывающуюся с 5'-концевой частью 3'-концевого узнающего мишень участка РТО, этот 3'-концевой узнающий мишень участок частично расщепляется вместе с 5'-концевым тегирующим участком в реакции расщепления на стадии (b). Помимо этого, присутствие перекрывающейся последовательности позволяет расщеплять желаемый сайт 3'-концевого узнающего мишень участка.
Согласно предпочтительному воплощению прямой праймер индуцирует посредством своей удлиненной цепи расщепление РТО ферментом, обладающим 5'-нуклеазной активностью.
В настоящем изобретении могут быть применены традиционные технологии для реакций расщепления с использованием располагающихся против хода транскрипции олигонуклеотидов при условии, что располагающийся против хода транскрипции олигонуклеотид индуцирует расщепление РТО, гибридизованного с нуклеиновокислотной последовательностью-мишенью, с высвобождением фрагмента, содержащего 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО. Например, в настоящем изобретении могут быть применены патенты США №№5210015, 5487972, 5691142, 5994069 и 7381532 и публикация заявки на патент США №2008/0241838.
Согласно предпочтительному воплощению данный способ осуществляют в присутствии обратного праймера. Обратный праймер дополнительно образует нуклеиновокислотную последовательность-мишень, которая будет гибридизоваться с РТО, повышая чувствительность детекции мишени.
Согласно предпочтительному воплощению, когда используют располагающийся прямой праймер и обратный праймер, дополнительно для удлинения этих праймеров применяют матричную полимеразу нуклеиновых кислот.
Согласно предпочтительному воплощению располагающийся против хода транскрипции олигонуклеотид (прямой праймер или располагающийся против хода транскрипции зонд), обратный праймер и/или 5'-концевой тегирующий участок РТО имеют структуру олигонуклеотида с двойным праймированием (dual priming oligonucleotide; DPO), разработанную авторами настоящего изобретения. Олигонуклеотиды, имеющие структуру DPO, демонстрируют значительно улучшенную специфичность к мишени по сравнению с традиционными праймерами и зондами (см. WO 2006/095981; Chun et. al., Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene, Nucleic Acid Research, 35: 6e40 (2007)).
Согласно предпочтительному воплощению 3'-концевой узнающий мишень участок РТО имеет структуру модифицированного олигонуклеотида с двойной специфичностью (modified dual specificity oligonucleotide; mDSO), разработанную авторами настоящего изобретения. Структура модифицированного олигонуклеотида с двойной специфичностью (mDSO) демонстрирует значительно улучшенную специфичность к мишени по сравнению с традиционными зондами (см. WO 2011/028041).
Стадия (b). Высвобождение фрагмента из РТО
Далее, продукт со стадии (а) приводят в контакт с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО. РТО, гибридизованный с нуклеиновокислотной последовательностью-мишенью, расщепляется ферментом, обладающим 5'-нуклеазной активностью, высвобождая фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО.
Используемый в данном описании термин "условия для расщепления РТО" означает условия, достаточные для осуществления расщепления РТО, гибридизованного с нуклеиновокислотной последовательностью-мишенью, ферментом, обладающим 5'-нуклеазной активностью, такие как температура, рН, ионная сила, буфер, длина и последовательность олигонуклеотидов и ферменты. Например, когда в качестве фермента, обладающего 5'-нуклеазной активностью, используют Тар; ДНК-полимеразу, условия для расщепления РТО включают трис-HCl буфер, KCl, MgCl2 и температуру.
Когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, его 3'-концевой узнающий мишень участок вовлечен в гибридизацию, а 5'-концевой тегирующий участок образует одноцепочечную структуру без гибридизации с нуклеиновокислотной последовательностью-мишенью (см. Фиг. 2). По существу, олигонуклеотид, содержащий как одноцепочечную, так и двухцепочечную структуры, может быть переварен с использованием фермента, обладающего 5'-нуклеазной активностью, с применением разнообразных технологий, известных специалисту в данной области.
Сайты расщепления РТО варьируют в зависимости от типа располагающихся против хода транскрипции олигонуклеотидов (располагающегося против хода транскрипции зонда или прямого праймера), сайтов гибридизации располагающихся против хода транскрипции олигонуклеотидов и условий расщепления (см. патенты США №№5210015, 5487972, 5691142, 5994069 и 7381532 и публикацию заявки на патент США №2008/0241838).
Большое число традиционных технологий может быть применено для проведения реакции расщепления РТО, приводящей к высвобождению фрагмента, содержащего 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка.
Кратко, на стадии (b) могут быть три сайта расщепления. Во-первых, сайтом расщепления является соединительный сайт (junction site) между гибридизующимся участком РТО (3'-концевым узнающим мишень участком) и негибридизующимся участком (5'-концевым тегирующим участком). Второй сайт расщепления представляет собой сайт локализации нескольких нуклеотидов в 3'-направлении от 3'-конца 5'-концевого тегирующего участка РТО. Второй сайт расщепления локализован в 5'-концевой части 3'-концевого узнающего мишень участка РТО. Третий сайт расщепления представляет собой сайт локализации нескольких нуклеотидов в 5'-направлении от 3'-конца 5'-концевого тегирующего участка РТО.
Согласно предпочтительному воплощению первоначальным сайтом расщепления РТО матричной полимеразой, обладающей 5'-нуклеазной активностью, после удлинения прямого праймера является исходная точка двойной цепи между РТО и нуклеиновокислотной последовательностью-мишенью или сайт на расстоянии 1-3 нуклеотида от этой исходной точки.
В связи с этим, используемый в данном описании термин "фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО" в отношении расщепления РТО ферментом, обладающим 5'-нуклеазной активностью, применяется для обозначения (1) 5'-концевого тегирующего участка, (2) 5'-концевого тегирующего участка и 5'-концевой части 3'-концевого узнающего мишень участка и (3) части 5'-концевого тегирующего участка. В данной заявке термин "фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО" также можно описать как "фрагмент РТО".
Термин "часть", используемый в отношении РТО или СТО, как например, часть 5'-концевого тегирующего участка РТО, 5'-концевая часть 3'-концевого узнающего мишень участка РТО и 5-' концевой части захватывающего участка СТО, относится к нуклеотидной последовательности, содержащей 1-40, 1-30, 1-20, 1-15, 1-10 или 1-5 нуклеотидов, предпочтительно 1, 2, 3 или 4 нуклеотида.
Согласно предпочтительному воплощению фермент, обладающий 5'-нуклеазной активностью, представляет собой ДНК-полимеразу, обладающую 5'-нуклеазной активностью, или нуклеазу FEN, более предпочтительно термостабильную ДНК-полимеразу, обладающую 5'-нуклеазной активностью, или нуклеазу FEN.
Подходящей ДНК-полимеразой, обладающей 5'-нуклеазной активностью, в данном изобретении является термостабильная ДНК-полимераза, полученная из ряда бактериальных видов, включая Thermus aquaticus (Taq), Thermus thermophilus (Tth), Thermus filiformis, Thermus flavus, Thermococcus literalis, Thermus antranikianii, Thermus caldophilus, Thermus chliarophilus, Thermus igniterrae, Thermus lacteus, Thermus oshimai, Thermus ruber, Thermus rubens, Thermus scotoductus, Thermus silvanus, Thermus species Z05, Thermus species sps 17, Thermus thermophilus, Thermotoga maritima, Thermotoga neapolitana, Thermosipho africanus, Thermococcus litoralis, Thermococcus barossi, Thermococcus gorgonarius, Thermotoga maritima, Thermotoga neapolitana, Thermosiphoafricanus, Pyrococcus woesei, Pyrococcus horikoshii, Pyrococcus abyssi, Pyrodictium occultum, Aquifex pyrophilus и Aquifex aeolieus. Наиболее предпочтительно, чтобы термостабильная ДНК-полимераза представляла собой Taq полимеразу.
Альтернативно, в настоящем изобретении можно использовать ДНК-полимеразы, обладающие 5'-нуклеазной активностью, модифицированные с целью уменьшения полимеразной активности.
Используемая нуклеаза FEN (флэп-эндонуклеаза) представляет собой флэп-специфичную 5'-нуклеазу.
Подходящая для настоящего изобретения нуклеаза FEN включает нуклеазы FEN, полученные из ряда бактериальных видов, включая Sulfolobus solfataricus, Pyrobaculum aerophilum, Thermococcus litoralis, Archaeaglobus veneficus, Archaeaglobus profundus, Acidianus brierlyi, Acidianus ambivalens, Desulfurococcus amylolyticus, Desulfurococcus mobilis, Pyrodictium brockii, Thermococcus gorgonarius, Thermococcus zilligii, Methanopyrus kandleri, Methanococcus igneus, Pyrococcus horikoshii, Aeropyrum pernix и Archaeaglobus veneficus.
Когда прямой праймер используют на стадии (а), предпочтительно, чтобы условия для расщепления РТО включали реакцию удлинения прямого праймера.
Согласно предпочтительному воплощению на стадии (а) используют прямой праймер, для удлинения прямого праймера используют матричную полимеразу. Эта матричная полимераза может быть идентична ферменту, обладающему 5'-нуклеазной активностью, или отличаться от фермента, обладающего 5'-нуклеазной активностью.
В некоторых случаях на стадии (а) используют располагающийся прямой праймер, для удлинения располагающегося прямого праймера используют матричную полимеразу, и эта матричная полимераза отличается от фермента, обладающего 5'-нуклеазной активностью.
Стадия (с). Гибридизация фрагмента, высвободившегося из РТО, с СТО
Фрагмент, высвободившийся из РТО, гибридизуется с СТО (захватывающим и матричным олигонуклеотидом).
СТО содержит в направлении 3'→5'(1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО.
СТО действует в качестве матрицы для удлинения фрагмента, высвободившегося из РТО. Этот фрагмент, служащий в качестве праймера, гибридизуется с СТО и удлиняется с образованием удлиненного дуплекса.
Матричный участок может содержать любую последовательность при условии, что он не комплементарен 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО. Кроме того, матричный участок может содержать любую последовательность при условии, что он может действовать в качестве матрицы для удлинения фрагмента, высвободившегося из РТО.
Как описано выше, когда фрагмент, содержащий 5'-концевой тегирующий участок РТО, высвобождается, предпочтительно, чтобы захватывающий участок СТО был сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку. Когда фрагмент, содержащий 5'-концевой тегирующий участок и 5'-концевую часть 3'-концевого узнающего мишень участка, высвобождается, предпочтительно, чтобы захватывающий участок СТО был сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку и 5'-концевой части 3'-концевого узнающего мишень участка. Когда фрагмент, содержащий часть 5'-концевого тегирующего участка РТО высвобождается, предпочтительно, чтобы захватывающий участок СТО был сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную части 5'-концевого тегирующего участка.
Кроме того, возможно конструирование захватывающего участка СТО с предполагаемыми сайтами расщепления РТО. Например, если захватывающий участок СТО сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку, тогда либо фрагмент, содержащий часть 5-концевого тегирующего участка, либо фрагмент, содержащий 5'-концевой тегирующий участок, мог бы гибридизоваться с захватывающим участком и затем удлиняться. Когда фрагмент, содержащий 5'-концевой тегирующий участок и 5'-концевую часть 3'-концевого узнающего мишень участка высвобождается, он может гибридизоваться с захватывающим участком СТО, сконструированным так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку, и затем успешно удлиняться, несмотря на присутствие некомплементарных нуклеотидов на 3'-концевом участке фрагмента. Это возможно потому, что праймеры могут удлиняться в зависимости от реакционных условий, несмотря на то, что их 3'-конец содержит некоторое количество некомплементарных нуклеотидов (например, 1-3 некомплементарных нуклеотида).
Когда высвобождается фрагмент, содержащий 5'-концевой тегирующий участок и 5'-концевую часть 3'-концевого узнающего мишень участка, 5'-концевая часть захватывающего участка СТО может быть сконструирована так, чтобы она содержала нуклеотидную последовательность, комплементарную расщепляемой 5'-концевой части 3'-концевого узнающего мишень участка, в результате чего преодолеваются проблемы, связанные с некомплементарными нуклеотидами (см. Фиг. 1).
Предпочтительно нуклеотидная последовательность 5'-концевой части захватывающего участка СТО, комплементарная расщепляемой 5'-концевой части 3'-концевого узнающего мишень участка, может быть выбрана в зависимости от предполагаемых сайтов расщепления на 3'-концевом узнающем мишень участке РТО. Предпочтительно, чтобы нуклеотидная последовательность 5'-концевой части захватывающего участка СТО, комплементарная расщепляемой 5'-концевой части 3'-концевого узнающего мишень участка, составляла 1-10 нуклеотидов, более предпочтительно 1-5 нуклеотидов, еще более предпочтительно 1-3 нуклеотида.
На 3'-конце СТО могут содержаться дополнительные нуклеотиды, не вовлеченные в гибридизацию с фрагментом. Кроме того, захватывающий участок СТО может содержать нуклеотидную последовательность, комплементарную только части фрагмента (например, части фрагмента, содержащей его 3'-концевой участок), при условии, что она стабильно гибридизуется с этим фрагментом.
Используемый термин "захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка" охватывает в данном описании различные конструкции и составы захватывающего участка СТО, как обсуждалось выше.
СТО может быть сконструирован так, чтобы принимать шпилечную структуру.
Длина СТО может варьировать в широких пределах. Например, длина СТО составляет 7-1000 нуклеотидов, 7-500 нуклеотидов, 7-300 нуклеотидов, 7-100 нуклеотидов, 7-80 нуклеотидов, 7-60 нуклеотидов, 7-40 нуклеотидов, 15-1000 нуклеотидов, 15-500 нуклеотидов, 15-300 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 20-1000 нуклеотидов, 20-500 нуклеотидов, 20-300 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-60 нуклеотидов, 20-40 нуклеотидов, 30-1000 нуклеотидов, 30-500 нуклеотидов, 30-300 нуклеотидов, 30-100 нуклеотидов, 30-80 нуклеотидов, 30-60 нуклеотидов или 30-40 нуклеотидов. Захватывающий участок СТО может иметь любую длину при условии, что он специфически гибридизуется с фрагментом, высвободившимся из РТО. Например, длина захватывающего участка СТО составляет 5-100 нуклеотидов, 5-60 нуклеотидов, 5-40 нуклеотидов, 5-30 нуклеотидов, 5-20 нуклеотидов, 10-100 нуклеотидов, 10-60 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 10-20 нуклеотидов, 15-100 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов или 15-20 нуклеотидов. Матричный участок СТО может иметь любую длину при условии, что он может действовать в качестве матрицы при удлинении фрагмента, высвободившегося из РТО. Например, длина матричного участка СТО составляет 1-900 нуклеотидов, 1-400 нуклеотидов, 1-300 нуклеотидов, 1-100 нуклеотидов, 1-80 нуклеотидов, 1-60 нуклеотидов, 1-40 нуклеотидов, 1-20 нуклеотидов, 2-900 нуклеотидов, 2-400 нуклеотидов, 2-300 нуклеотидов, 2-100 нуклеотидов, 2-80 нуклеотидов, 2-60 нуклеотидов, 2-40 нуклеотидов, 2-20 нуклеотидов, 5-900 нуклеотидов, 5-400 нуклеотидов, 5-300 нуклеотидов, 5-100 нуклеотидов, 5-80 нуклеотидов, 5-60 нуклеотидов, 5-40 нуклеотидов, 5-30 нуклеотидов, 10-900 нуклеотидов, 10-400 нуклеотидов, 10-300 нуклеотидов, 15-900 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов или 15-20 нуклеотидов.
На 3'-конце СТО может находиться группа 3'-ОН. Предпочтительно 3'-конец СТО блокирован с целью недопущения его удлинения. Не допускающее удлинения блокирование СТО может быть достигнуто традиционными методами. Например, блокирование можно осуществить путем добавления химической группировки, такой как биотин, метки, фосфатая группа, алкильная группа, ненуклеотидный линкер, фосфотиоат или алкандиол, к 3'-гидроксильной группе последнего нуклеотида СТО. Альтернативно, блокирование может быть выполнено посредством удаления 3'-гидроксильной группы последнего нуклеотида или путем использования нуклеотида, лишенного 3'-гидроксильной группы, такого как дидезоксинуклеотид.
Фрагмент, высвободившийся из РТО, гибридизуется с СТО, в результате чего получается структура, подходящая для удлинения фрагмента. Несмотря на то, что нерасщепленный РТО также гибридизуется с захватывающим участком СТО через свой 5'-концевой тегирующий участок, его 3'-концевой узнающий мишень участок не гибридизуется с СТО, что препятствует образованию удлиненного дуплекса.
Гибридизация на стадии (с) может быть описана более подробно со ссылкой на описания, приведенные на стадии (а).
Стадия (d). Удлинение фрагмента
Реакцию удлинения проводят, используя продукт со стадии (с) и матричную полимеразу нуклеиновых кислот. Фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс. В отличие от этого, нерасщепленный РТО, гибридизованный с захватывающим участком СТО, не удлиняется, в результате чего удлиненной цепи не образуется.
Используемый в данном описании термин "удлиненный дуплекс" обозначает дуплекс, образованный путем реакции удлинения, в которой фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с использованием матричного участка СТО в качестве матрицы и матричной полимеразы нуклеиновых кислот.
Используемый в данном описании термин "удлиненная цепь" в отношении фрагмента обозначает последовательность, состоящую из фрагмента и его удлиненной последовательности.
Используемый в данном описании термин "удлиненная последовательность" в отношении фрагмента обозначает только вновь удлиненную последовательность, которая представляет собой участок удлиненной цепи, за исключением этого фрагмента.
Матричная полимераза нуклеиновых кислот, используемая на стадии (d), может включать любую полимеразу нуклеиновых кислот, например, кленовский фрагмент ДНК-полимеразы I из Е. coli, термостабильную ДНК-полимеразу и ДНК-полимеразу бактериофага 17. Предпочтительно полимераза представляет собой термостабильную ДНК-полимеразу, которая может быть получена из ряда бактериальных видов, включая Thermus aquaticus (Taq), Thermus thermophilus (Tth), Thermus filiformis, Thermus flavus, Thermococcus literalis, Thermus antranikianii, Thermus caldophilus, Thermus chliarophilus, Thermus igniterrae, Thermus lacteus, Thermus oshimai, Thermus ruber, Thermus rubens, Thermus scotoductus, Thermus silvanus, Thermus species Z05, Thermus species sps 17, Thermus thermophilus, Thermotoga maritima, Thermotoga neapolitana, Thermosipho africanus, Thermococcus litoralis, Thermococcus barossi, Thermococcus gorgonarius, Thermotoga maritima, Thermotoga neapolitana, Thermosiphoafricanus, Pyrococcus furiosus (Pfu), Pyrococcus woesei, Pyrococcus horikoshii, Pyrococcus abyssi, Pyrodictium occultum, Aquifex pyrophilus и Aquifex aeolieus. Наиболее предпочтительно матричная полимераза нуклеиновых кислот представляет собой Taq полимеразу.
Согласно предпочтительному воплощению матричная полимераза нуклеиновых кислот включает обратную транскриптазу.
Согласно предпочтительному воплощению фермент, обладающий 5'-нуклеазной активностью, используемый на стадии (b), идентичен матричной полимеразе нуклеиновых кислот, используемой на стадии (d). Более предпочтительно, чтобы фермент, обладающий 5'-нуклеазной активностью, используемый на стадии (b), матричная полимераза нуклеиновых кислот, используемая для удлинения прямого праймера, и матричная полимераза нуклеиновых кислот, используемая на стадии (d), были идентичны друг другу.
Стадия (е). Генерирование сигнала посредством гибридизации удлиненной цепи и SO
После осуществления реакции удлинения удлиненная цепь гибридизуется с сигнальным олигонуклеотидом (SO). Генерируется сигнал, указывающий на присутствие нуклеиновокислотной последовательности-мишени. Понятие "сигнал" включает в себя генерирование или гашение сигнала или изменение сигнала (усиление или ослабление сигнала).
SO, который предназначен для гибридизации с удлиненной цепью, содержит последовательность, комплементарную этой удлиненной цепи.
Если SO содержит последовательность, комплементарную только фрагменту РТО, то сигнал, не относящийся к мишени, не может генерироваться в результате гибридизации нерасщепленного РТО и SO в некоторых системах генерирования сигналов, изложенных в данном описании ниже.
Если положение встроенных меток в удлиненной цепи, как проиллюстрировано на Фиг. 6, соответственно скорректировано, то сигнал, не относящийся к мишени, не может генерироваться даже при использовании SO, содержащего последовательность, комплементарную только фрагменту РТО.
Вместе с тем, если SO содержит последовательность, комплементарную только фрагменту РТО, то сигнал, не относящийся к мишени, может генерироваться в результате гибридизации нерасщепленного РТО и SO в некоторых системах генерирования сигналов, изложенных в данном описании ниже (например, в системе генерирования сигналов из Фиг. 2).
При возникновении проблемы с генерированием сигнала, не относящегося к мишени, часть SO должна быть сконструирована так, чтобы она содержала последовательность, комплементарную части вновь синтезированной удлиненной последовательности.
Согласно предпочтительному воплощению SO содержит последовательность, комплементарную удлиненной последовательности.
Согласно предпочтительному воплощению по меньшей мере часть SO содержит последовательность, комплементарную удлиненной
последовательности. Длина такой части SO, содержащей последовательность, комплементарную удлиненной последовательности, составляет по меньшей мере один, два, три, четыре, пять или десять нуклеотидов.
Если часть SO сконструирована так, что она содержит последовательность, комплементарную части вновь синтезированной удлиненной последовательности, то величина Тпл для продукта гибридизации SO и удлиненной цепи отличается от величины Ттл для продукта гибридизации SO и нерасщепленного РТО. Разница в величинах Тпл позволяет отличить сигналы от этих двух продуктов гибридизации. Например, при детекции в режиме реального времени сигналы, не относящиеся к мишени, можно исключить путем регулирования температуры для детекции с учетом величин Тпл или с использованием анализа кривой плавления по пикам плавления.
Предпочтительно, чтобы SO в пределах всей своей последовательности мог содержать последовательность, комплементарную удлиненной последовательности. Альтернативно, SO может содержать часть, имеющую последовательность, комплементарную удлиненной последовательности. Например, одна часть SO может содержать последовательность, комплементарную удлиненной последовательности, а другая часть может содержать последовательность, комплементарную ее фрагменту.
Предпочтительно, чтобы SO в пределах всей своей последовательности содержал последовательность, комплементарную удлиненной последовательности.
SO может быть любой длины, например, 5-100 нуклеотидов, 5-80 нуклеотидов, 5-60 нуклеотидов, 5-40 нуклеотидов, 5-20 нуклеотидов, 5-10 нуклеотидов, 10-100 нуклеотидов, 10-80 нуклеотидов, 10-60 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 10-20 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов, 15-20 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-60 нуклеотидов, 20-40 нуклеотидов или 20-30 нуклеотидов.
SO может принимать шпилечную структуру.
Предпочтительно, чтобы 3'-конец SO был блокирован, чтобы препятствовать его удлинению.
Альтернативно, удлинению может быть подвергнут SO с неблокированным 3'-ОН-концом.
Система генерирования сигналов, выбранная в настоящем изобретении, характеризуется ассоциацией генерирования сигналов с гибридизацией SO. Другими словами, после гибридизации SO с удлиненной цепью обеспечивается получение детектируемого сигнала. Гибридизация SO с удлиненной цепью происходит только тогда, когда присутствует нуклеиновокислотная последовательность-мишень и осуществляется расщепление РТО. Таким образом, детектируемый сигнал указывает на присутствие нуклеиновокислотной последовательности-мишени. При этом, если желательно, настоящее изобретение может быть осуществлено в режиме реального времени.
Чтобы непосредственно связать гибридизацию SO с сигналами, в настоящем изобретении используют SO с соединенной с ним по меньшей мере одной меткой.
Согласно предпочтительному воплощению детектируемый сигнал, указывающий на присутствие нуклеиновокислотной последовательности-мишени, обеспечивается посредством (1) метки, соединенной с SO, (2) комбинации метки, соединенной с SO, и метки, соединенной с фрагментом РТО, (3) комбинации метки, соединенной с SO, и метки, встраиваемой в удлиненную цепь во время реакции удлинения на стадии (d), или (4) комбинации метки, соединенной с SO, и интеркалирующего красителя.
Системы меток, использованные в этом изобретении, будут описаны подробно ниже.
(1) Одиночная метка, соединенная с SO
В настоящем изобретении можно получить сигнал, характеризующий образование удлиненной цепи, который указывает на присутствие нуклеиновокислотной последовательности-мишени, с использованием одиночной метки (см. Фиг. 3).
Согласно предпочтительному воплощению SO помечен одиночной меткой, и гибридизация между SO и удлиненной цепью на стадии (е) индуцирует изменение сигнала от одиночной метки с получением детектируемого сигнала.
Использование в данном изобретении одиночной метки должно обеспечить получение разных сигналов в зависимости от ее присутствия на двухцепочечной или одноцепочечной структуре. Одиночная метка представляет собой флуоресцентную метку, люминесцентную метку, хемилюминесцентную метку, электрохимическую метку и металлическую метку.
Предпочтительно, чтобы одиночная метка представляла собой флуоресцентную метку, способную обеспечить получение сигналов с различными интенсивностями в зависимости от того, соединена ли она с двухцепочечной или одноцепочечной нуклеиновой кислотой.
На Фиг. 3 проиллюстрировано предпочтительное воплощение настоящего изобретения с использованием одиночной метки. Как проиллюстрировано на Фиг. 3, одиночная флуоресцентная метка, соединенная с SO, гибридизованным с удлиненной цепью, демонстрирует более интенсивный сигнал флуоресценции, чем метка, соединенная с негибридизованным SO.
Для детекции присутствия нуклеиновокислотной последовательности-мишени измеряют изменения (усиление или ослабление) интенсивности флуоресценции от одиночных флуоресцентных меток.
Типы и предпочтительные сайты связывания одиночных флуоресцентных меток, используемых в данном изобретении, описаны в патентах США №№7537886 и 7348141, идеи которых включены в данное описание посредством ссылки во всей своей полноте. Предпочтительно, чтобы одиночная флуоресцентная метка представляла собой JOE, FAM, TAMRA, ROX и другую метку на основе флуоресцеина. Меченый нуклеотидный остаток предпочтительно расположен в позиции внутреннего нуклеотидного остатка в пределах олигонуклеотида, а не на 5'-конце или 3'-конце.
Согласно предпочтительному воплощению одиночная метка на SO локализована на расстоянии 1-15 нуклеотидов, 1-10 нуклеотидов или 1-5 нуклеотидов от его 5'-конца или его 3'-конца. Более предпочтительно, чтобы одиночная метка была локализована в средней части SO.
Одиночная флуоресцентная метка, используемая в настоящем изобретении, может быть описана со ссылкой на описания для репортерной молекулы и молекулы-гасителя, указанные ниже.
(2) Внутрицепочечная система двух взаимодействующих меток, соединенная с SO
Система взаимодействующих меток представляет собой генерирующую сигнал систему, в которой происходит передача энергии между донорной молекулой и акцепторной молекулой без участия радиоактивности. В качестве репрезентативной системы взаимодействующих меток система меток при резонансном переносе энергии флуоресценции (fluorescence resonance energy transfer; FRET) включает флуоресцентную репортерную молекулу (донорную молекулу) и молекулу-гаситель (акцепторную молекулу). При FRET донор энергии является флуоресцентным, а акцептор энергии может быть флуоресцентным или нефлуоресцентным. Для другой формы систем взаимодействующих меток донор энергии является нефлуоресцентным, например, является хромофором, а акцептор энергии является флуоресцентным. Для еще одной формы систем взаимодействующих меток донор энергии является люминесцентным, например биолюминесцентным, хемилюминесцентным, электрохемилюминесцентным, а акцептор является флуоресцентным. Донорная молекула и акцепторная молекула могут быть описаны в настоящем изобретения как репортерная молекула и молекула-гаситель, соответственно.
Предпочтительно, чтобы сигнал, указывающий на образование удлиненной цепи (то есть, на присутствие нуклеиновокислотной последовательности-мишени), генерировался системами взаимодействующих меток, более предпочтительно системой FRET-меток (т.е. системой двух взаимодействующих меток).
Согласно предпочтительному воплощению, SO помечен с использованием системы двух взаимодействующих меток, содержащей репортерную молекулу и молекулу-гаситель, и гибридизация между SO и удлиненной цепью на стадии (е) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала. Перед гибридизацией SO репортерная молекула и молекула-гаситель на SO конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы. После гибридизации репортерная молекула и молекула-гаситель на SO конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, и это приводит к изменениям сигналов от системы двух взаимодействующих меток.
Фиг. 2 представляет собой пример предпочтительного воплощения настоящего изобретения с использованием системы двух взаимодействующих меток. Фрагмент, высвободившийся из РТО, гибридизованного с нуклеиновокислотной последовательностью-мишенью, гибридизуется с захватывающим участком СТО и удлиняется с образованием удлиненной цепи. После гибридизации удлиненной цепи с SO репортерная молекула и молекула-гаситель на SO конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, и это приводит к изменениям сигналов от системы двух взаимодействующих меток (например, к увеличению сигнала от репортерных молекул). В отличие от этого, когда нуклеиновокислотная последовательность-мишень не присутствует, расщепления РТО не происходит. Нерасщепленный РТО не удлиняется, пока он гибридизован с захватывающим участком СТО. Репортерная молекула и молекула-гаситель на SO, не вовлеченном в гибридизацию, конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы.
Используемое в данном описании выражение "репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу" означает, что репортерная молекула и молекула-гаситель пространственно приближены друг к другу благодаря наличию конформационной структуры у фрагмента или SO, такой как случайная спираль и шпилечная структура.
Используемое в данном описании выражение "репортерная молекула и молекула-гаситель конформационно разделены" означает, что репортерная молекула и молекула-гаситель пространственно разделены в результате изменения конформационной структуры SO после образования двойной цепи в результате осуществления гибридизации с удлиненной цепью.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель расположены на 5'-конце (или 3'-конце) и 3'-конце (или 5'-конце) SO. Согласно предпочтительному воплощению одна из молекул на SO, репортерная молекула или молекула-гаситель, расположена на его 5'-конце или на расстоянии 1-5 нуклеотидов от его 5'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации SO.
Согласно предпочтительному воплощению одна из молекул на SO, репортерная молекула или молекула-гаситель, расположена на его 3'-конце или на расстоянии 1-5 нуклеотидов от его 3'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации SO.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель расположены на расстоянии не более 80 нуклеотидов, более предпочтительно не более 60 нуклеотидов, еще более предпочтительно не более 30 нуклеотидов, еще более предпочтительно не более 25 нуклеотидов друг от друга. Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель разделены по меньшей мере 4 нуклеотидами, более предпочтительно по меньшей мере 6 нуклеотидами, еще более предпочтительно по меньшей мере 10 нуклеотидами, еще более предпочтительно по меньшей мере 15 нуклеотидами.
Репортерная молекула и молекула-гаситель для использования в настоящем изобретении могут включать любые молекулы, известные в данной области техники. Примерами их являются: Су2™ (506), YO-PRO™-1 (509), YOYO™-1 (509), кальцеин (517), FITC (флуоресцеинизотиоцианат) (518), FluorX™ (519), Alexa™ (520), родамин 110 (520), Oregon Green™ (орегон зеленый) 500 (522), Oregon Green™ 488 (524), RiboGreen™ (525), Rhodamine Green™ (родаминовый зеленый) (527), родамин 123 (529), Magnesium Green™ (531), Calcium Green™ (533), TO-PRO™-1 (533), TOT01 (533), JOE (2',7'-диметокси-4',5'-дихлорофлуоресцеин) (548), BODIPY530/550 (550), Dil (565), BODIPY TMR (568), BODIPY558/568 (568), BODIPY564/570 (570), Cy3™ (570), Alexa™ 546 (570), TRITC (тетраметилродамин-изотиоцианат) (572), Magnesium Orange™ (575), фикоэритрин R&B (575), родамин-фаллоидин (575), Calcium Orange™ (576), пиронин Y (580), родамин В (580), TAMRA (тетраметилродамин) (582), Rhodamine Red™ (родаминовый красный) (590), Cy3.5™ (596), ROX (6-карбокси-Х-родамин) (608), Calcium Crimson™ (615), Alexa™ 594 (615), техасский красный (615), нильский красный (628), YO-PRO™-3 (631), YOYO™-3 (631), R-фикоцианин (642), С-фикоцианин (648), TO-PRO™-3 (660), ТОТОЗ (660), DiD DilC(5) (665), Cy5™ (670), тиадикарбоцианин (671), Cy5.5 (694), HEX (556), ТЕТ (536), Biosearch Blue (447), CAL Fluor Gold 540 (544), CAL Fluor Orange 560 (559), CAL Fluor Red 590 (591), CAL Fluor Red 610 (610), CAL Fluor Red 635 (637), FAM (карбоксифлуоресцеин) (520), флуоресцеин (520), флуоресцеин-С3 (520), Pulsar 650 (566), Quasar 570 (667), Quasar 670 (705) и Quasar 705 (610). Числа в скобках представляют собой длину волны, соответствующую максимуму излучения, в нанометрах. Предпочтительно, чтобы репортерная молекула и молекула-гаситель включали JOE, FAM, TAMRA, ROX и другую метку на основе флуоресцеина.
Подходящие пары репортер-гаситель описаны в ряде публикаций, которые приведены ниже: Pesce et al., editors, Fluorescence Spectroscopy (Marcel Dekker, New York, 1971); White et al., Fluorescence Analysis: A Practical Approach (Marcel Dekker, New York, 1970); Berlman, Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd Edition (Academic Press, New York, 1971); Griffiths, Color and Constitution of Organic Molecules (Academic Press, New York, 1976); Bishop, editor, Indicators (Pergamon Press, Oxford, 1972); Haugland, Handbook of Fluorescent Probes and Research Chemicals (Molecular Probes, Eugene, 1992); Pringsheim, Fluorescence and Phosphorescence (Interscience Publishers, New York, 1949); Haugland, R. R, Handbook of Fluorescent Probes and Research Chemicals, 6 Edition (Molecular Probes, Eugene, Oreg., 1996); патенты США №№3996345 и 4351760.
Стоит отметить, что в настоящем изобретении может быть использована нефлуоресцентная "черная" молекула-гаситель (или "темная" молекула-гаситель), способная гасить флуоресценцию в широком диапазоне длин волн или на конкретной длине волны. Примерами таких гасителей являются BHQ (Black Hole 1) и DABCYL (4-((4-(диметиламино)фенил)-азо)бензойная кислота).
Для FRET-метки, адаптированной к SO, термин "репортер" охватывает донора FRET, а термин "гаситель" охватывает другого партнера (акцептора) FRET Например, в качестве репортера используют краситель на основе флуоресцеина, а в качестве гасителя краситель на основе родамина.
(3) Межцепочечная система двух взаимодействующих меток
В воплощении с использованием межцепочечной системы двух взаимодействующих меток удлиненная цепь имеет одну из двух взаимодействующих меток, включающих репортерную молекулу и молекулу-гаситель, a SO имеет другую из двух взаимодействующих меток.
Воплощение с использованием межцепочечной системы двух взаимодействующих меток может быть осуществлено тремя приведенными ниже способами.
Согласно первому способу SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, фрагмент РТО содержит другую метку, выбранную из репортерной молекулы и молекулы-гасителя; удлиненная цепь содержит метку, происходящую из фрагмента РТО, и при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала (см. Фиг. 5).
Метка, соединенная с SO, может представлять собой либо репортерную молекулу, либо молекулу-гаситель, а метка, соединенная с фрагментом, может представлять собой либо молекулу-гаситель, либо репортерную молекулу.
Место встраивания метки на РТО определяют с учетом его сайта расщепления для того, чтобы фрагмент РТО мог содержать эту метку.
Такая метка может быть присоединена к любому месту (например, тегирующему участку РТО) на фрагменте РТО, при условии, что она взаимодействует с меткой, присоединенной к SO, после гибридизации с SO, индуцируя изменение сигналов. Такая метка может быть присоединена к любому месту (например, к 5'-концу SO) на SO, при условии, что она взаимодействует с меткой на фрагменте РТО после гибридизации с фрагментом РТО, индуцируя изменение сигналов.
Согласно второму способу SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, а матричный участок СТО содержит нуклеотид, имеющий первое неприродное основание; при этом реакцию удлинения на стадии (d) осуществляют в присутствии нуклеотида, имеющего как второе неприродное основание с аффинностью специфического связывания с первым неприродным основанием, так и другую молекулу, выбранную из репортерной молекулы и молекулы-гасителя, в результате чего происходит встраивание метки в удлиненную цепь; при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала (см. Фиг. 6).
Используемый в данном описании термин "неприродное основание" относится к производным природных оснований, таких как аденин (А), гуанин (G), тимин (Т), цитозин (С) и урацил (U), которые способны к образованию связанных водородными связями пар оснований. Используемый в данном описании термин "неприродное основание" включает в себя основания, характеризующиеся другими картинами образования пар оснований по сравнению с природными основаниями как исходными соединениями, как описано, например, в патентах США №№5432272, 5965364, 6001983 и 6037120. Образование пар оснований между неприродными основаниями заключается в образовании двух или трех водородных связей, как и у природных оснований. Образование пар оснований между неприродными основаниями также происходит с учетом специфичности.
Конкретные примеры неприродных оснований включают следующие основания в комбинациях пар оснований изо-С/изо-G, изо-dC/изо-dG, К/Х, H/J и M/N (см. патент США №7422850).
Метка, встраиваемая в процессе удлинения, предпочтительно соединяется с нуклеотидом, более предпочтительно с нуклеозид-трифосфатом. Предпочтительно такая метка связывается с основанием нуклеозид-трифосфата.
Поясненное примером воплощение описано со ссылкой на Фиг. 6. Фрагмент гибридизуется с СТО, содержащим нуклеотид, имеющий неприродное основание (например, изо-dC) с аффинностью специфического связывания с неприродным основанием (например, изо-dG). Удлинение осуществляют в присутствии нуклеотида, имеющего изо-dG, меченный гасителем, с образованием удлиненной цепи. В реакции удлинения нуклеотид, имеющий изо-dG с гасителем, встраивается в сайт, расположенный напротив нуклеотида, имеющего изо-dC. После гибридизации удлиненной цепи, содержащей структуру гаситель-изо-dG, с SO, меченным репортером, гаситель на удлиненной цепи гасит сигнал от репортера на SO, индуцируя изменение сигнала, что обеспечивает получение детектируемого сигнала.
Одна из двух взаимодействующих меток соединена с SO, а другая встраивается в удлиненную цепь из реакционного раствора во время реакции удлинения.
Метка, соединенная с SO, может представлять собой либо репортерную молекулу, либо молекулу-гаситель, а метка, встраиваемая в удлиненную цепь, может представлять собой либо молекулу-гаситель, либо репортерную молекулу.
Метка, встраиваемая в удлиненную цепь, может быть соединена с любым местом на удлиненной цепи (например, 3'-концом удлиненной цепи), при условии, что она взаимодействует с меткой на SO после гибридизации с SO, индуцируя изменение сигналов. Такая метка может быть присоединена к любому месту (например, к 5'-концу SO) на SO, при условии, что она взаимодействует с меткой, встроенной в удлиненную цепь, после гибридизации с удлиненной цепью, индуцируя изменение сигналов.
Согласно третьему способу SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, и реакцию удлинения на стадии (d) осуществляют в присутствии нуклеотида, имеющего другую метку, выбранную из репортерной молекулы и молекулы-гасителя, в результате чего происходит встраивание метки в удлиненную цепь; при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала (см. Фиг. 7).
Метка, соединенная с SO, может представлять собой либо репортерную молекулу, либо молекулу-гаситель (предпочтительно репортерную молекулу), а метка, встраиваемая в удлиненную цепь, может представлять собой либо молекулу-гаситель, либо репортерную молекулу (предпочтительно молекулу-гаситель).
(4) Система двух взаимодействующих меток с применением двух SO В воплощении, относящемся к системе двух взаимодействующих меток с применением двух SO, согласно способу по настоящему изобретению используют дополнительный SO, содержащий последовательность, комплементарную удлиненной цепи, два SO гибридизуются с удлиненной цепью близко друг к другу, каждый из этих двух SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток; и гибридизация между этими двумя SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала (см. Фиг. 4).
Предпочтительно по меньшей мере один из двух SO содержит участок, гибридизованный с вновь удлиненной последовательностью в реакции удлинения.
Принцип, лежащий в основе осуществления воплощения, относящегося к системе двух взаимодействующих меток с применением двух SO, выглядит следующим образом: фрагмент, высвободившийся из РТО, гибридизованного с нуклеиновокислотной последовательностью-мишенью, гибридизуется с захватывающим участком СТО и удлиняется с образованием удлиненной цепи. После этого два SO гибридизуются с удлиненной цепью. При гибридизации, поскольку два SO гибридизуются с удлиненной цепью близко друг к другу, репортерная молекула и молекула-гаситель на этих двух SO располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, и это приводит к изменению сигналов от системы двух взаимодействующих меток (например, к увеличению сигнала от репортерных молекул). В отличие от этого, когда нуклеиновокислотная последовательность-мишень не присутствует, расщепления РТО не происходит.Нерасщепленный РТО не удлиняется, пока он гибридизован с захватывающим участком СТО. Репортерная молекула и молекула-гаситель на двух SO, не вовлеченных в гибридизацию, разделяются друг от друга, генерируя сигнал от репортерной молекулы.
Согласно предпочтительному воплощению два SO могут быть гибридизованы с любыми сайтами удлиненной цепи при условии, что их гибридизация с удлиненной цепью позволяет молекуле-гасителю гасить сигнал от репортерной молекулы. Предпочтительно два SO располагаются в непосредственной близости друг к другу или на расстоянии 1-5 нуклеотидов друг от друга.
Согласно предпочтительному воплощению, когда два SO могут быть гибридизованы с удлиненной цепью близко друг к другу, тогда репортерная молекула и молекула-гаситель могут быть соединены с любыми сайтами на этих двух SO при условии, что молекула-гаситель гасит сигнал от репортерной молекулы. Например, репортерная молекула или молекула-гаситель, присоединена к 5'-концу одного SO или на расстоянии 1-5 нуклеотидов от его 5'-конца, а молекула-гаситель или репортерная молекула присоединена к 3'-концу другого SO или на расстоянии 1-5 нуклеотидов от его 3'-конца.
(5) FRET-метка, в которой используются интеркалирующие красители
Согласно настоящему изобретению практическое осуществление получения сигнала с применением FRET (резонансного переноса энергии флуоресценции) возможно с использованием интеркалирующих красителей.
Согласно предпочтительному воплощению SO содержит акцептор FRET, и гибридизацию на стадии (е) осуществляют в присутствии интеркалирующего красителя; при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от акцептора SO с получением детектируемого сигнала (см. Фиг. 8).
Примеры интеркалирующих красителей для применения в данном изобретении включают SYBR™ Green I, PO-PRO™-1, BO-PRO™-1, SYTO™43, SYTO™44, SYTO™45, SYTOX™Blue, POPO™-1, POPO™-3, BOBO™-1, BOBO™-3, LO-PRO™-1, JO-PRO™-1, YO-PRO™1, TO-PRO™1, SYTO™11, SYTO™13, SYTO™15, SYTO™16, SYTO™20, SYTO™23, TOTO™-3, YOYO™3, GelStar™ и триазоловый оранжевый. Эти интеркалирующие красители специфически интеркалируют в двухцепочечные молекулы нуклеиновых кислот, генерируя сигналы.
Принцип, лежащий в основе осуществления воплощения, относящегося к FRET-метке с использованием интеркалирующих красителей, выглядит следующим образом: фрагмент, высвободившийся из РТО, гибридизованного с нуклеиновокислотной последовательностью-мишенью, гибридизуется с захватывающим участком СТО и удлиняется с образованием удлиненной цепи. После этого SO, меченный акцептором, гибридизуется с удлиненной цепью с образованием двухцепочечной молекулы нуклеиновой кислоты, и далее интеркалирующие красители связываются с этой двухцепочечной молекулой нуклеиновой кислоты. В результате облучения, необходимого для возбуждения донора, происходит перенос энергии от интеркалирующих красителей, служащих в качестве донорной молекулы, к акцептору, что индуцирует изменение сигнала от акцептора, обеспечивая получение детектируемого сигнала. В отличие от этого, явления FRET не происходит в отсутствие нуклеиновокислотной последовательности-мишени, в результате чего не происходит никакого изменения сигнала.
Согласно предпочтительному воплощению акцептор, соединенный с SO, включает различные описанные выше одиночные флуоресцентные метки, но ими не ограничивается.
Метка может быть присоединена к SO или РТО традиционными методами. Предпочтительно она присоединена к SO или РТО через спейсер, содержащий по меньшей мере три атома углерода (например, 3-углеродный спейсер, 6-углеродный спейсер или 12-углеродный спейсер).
SO, используемый в настоящем изобретении, включает любые зонды, способные давать сигналы, зависящие от гибридизации, например, Molecular beacon™ (патент США №5925517), Hybeacons™ (D.J. French, et al., Molecular and Cellular Probes (2001) 13, 363-374 и патент США №7348141), самогасящийся зонд с двумя метками (патент США №5876930), LUX™ (I.A. Nazarenko, et al. Nucleic Acids Res., 2002, 30: 2089-2095 и патент США №7537886) и гибридизационный зонд (Bernard PS, et al., Clin. Chem., 2000, 46, 147-148 и Deepti Parashar et al., Indian J. Med. Res., 124, обзорная статья, октябрь 2006, 385-398).
Стадия (f). Детекция сигнала от мишени
Окончательно, осуществляют детекцию детектируемого сигнала, полученного на стадии (е), при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
Как рассмотрено выше, гибридизационное событие, происходящее с SO, синхронизировано с событием поступления сигнала от меток на продукте гибридизации, обеспечивая получение сигналов, указывающих на присутствие нуклеиновокислотной последовательности-мишени. При этом настоящее изобретение может быть осуществлено в режиме реального времени с использованием меток, обеспечивающих получение сигналов, детектируемых в режиме реального времени.
Альтернативно, детектирование сигнала от мишени может быть осуществлено с использованием анализа плавления, поскольку метки, применяемые в настоящем изобретении, способны обеспечить получение детектируемых сигналов во время плавления продукта гибридизации или плавления и гибридизации продукта гибридизации.
Используемый в данном описании термин "анализ плавления" означает метод, с использованием которого сигнал от мишени, указывающий на присутствие удлиненного дуплекса, получают в результате плавления удлиненного дуплекса, включая метод измерения сигналов при двух различных температурах, анализ кривой плавления, анализ картины плавления и анализ пиков плавления. Предпочтительно анализ плавления представляет собой анализ кривой плавления.
Например, когда дуплекс между SO и удлиненной цепью плавится, репортерная молекула и молекула-гаситель на одноцепочечном SO конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, вследствие чего индуцируется изменение сигналов с получением детектируемого сигнала. Кроме того, в том случае, когда SO и удлиненная цепь повторно гибридизуются с образованием дуплекса, тогда репортерная молекула и молекула-гаситель на SO конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, вследствие чего индуцируется изменение сигналов с получением детектируемого сигнала (см. Фиг. 2).
Согласно предпочтительному воплощению детекцию присутствия удлиненной цепи фрагмента РТО осуществляют, применяя анализ кривой плавления с использованием величин Тпл для дуплекса между SO и удлиненной цепью.
В том случае, когда для анализа используют величины Тпл для дуплекса между SO и удлиненной цепью, предпочтительно применение меток (например, флуоресцентных меток), позволяющих осуществлять гомогенный анализ без какого-либо разделения продукта гибридизации между SO и удлиненной цепью.
Согласно предпочтительному воплощению продукт гибридизации между SO и удлиненной цепью имеет величины Тпл, регулируемые последовательностью и/или длиной этого фрагмента РТО, последовательностью и/или длиной СТО, последовательностью и/или длиной SO и их комбинацией.
Например, величины Тпл продукта гибридизации можно регулировать, регулируя степень ошибочного спаривания последовательности SO. Кроме того, величины Тпл продукта гибридизации также можно регулировать, регулируя длину SO.
Предпочтительно способ по настоящему изобретению дополнительно включает между стадиями (е) и (f) стадию получения детектируемого сигнала посредством плавления продукта гибридизации со стадии (е) или посредством плавления и гибридизации продукта гибридизации со стадии (е); при этом стадию (f) осуществляют, детектируя сигнал с целью определения присутствия удлиненной цепи.
Альтернативно, способ по настоящему изобретению дополнительно включает после стадии (f) стадию получения детектируемого сигнала посредством плавления продукта гибридизации со стадии (е) или посредством плавления и гибридизации продукта гибридизации со стадии (е), при этом присутствие удлиненной цепи определяют более одного раза.
Согласно предпочтительному воплощению детекцию присутствия удлиненной цепи фрагмента РТО осуществляют с использованием анализа кривой гибридизации.
Используемый в данном описании термин "Тпл" относится к температуре плавления, при которой половина популяции двухцепочечных молекул нуклеиновой кислоты диссоциирует до одноцепочечных молекул. Величина Тпл определяется длиной и содержанием G/C-nap в гибридизованных нуклеотидах. Величина Тпл может быть рассчитана традиционными методами, такими как правило Уоллеса (R.B. Wallace et al., Nucleic Acids Research, 6: 3543-3547 (1979)) и метод ближайших соседей (SantaLucia J. Jr., et al., Biochemistry, 35: 3555-3562 (1996); Sugimoto N., et al., Nucleic Acids Res., 24: 4501-4505 (1996)).
Согласно предпочтительному воплощению величина Тпл относится к фактическим величинам Тпл в реакционных условиях, реально используемых на практике.
Кривая плавления или кривая гибридизации может быть получена с использованием традиционных технологий, например, как описано в патентах США №№6174670 и 5789167, Drobyshev et al., Gene 188: 45 (1997); Kochinsky и Mirzabekov, Human Mutation, 19: 343 (2002); Livehits et al., J. Biomol. Structure Dynam., 11: 783 (1994) и Howell et al., Nature Biotechnology, 17: 87 (1999). Например, кривая плавления или кривая гибридизации может представлять собой графическое изображение или отображение изменения выходного сигнала в зависимости от изменения такого параметра, как жесткость условий гибридизации. Можно построить график зависимости выходного сигнала непосредственно от параметра гибридизации. В типичном случае кривая плавления или кривая гибридизации будут характеризоваться выходным сигналом, например флуоресценцией, который указывает на относительное количество дуплексной структуры (то есть на степень гибридизации), отложенным по оси Y, и параметром гибридизации, отложенным по оси X.
Из графика зависимости первой производной сигнала флуоресценции от температуры, т.е. графика зависимости скорости изменения сигнала флуоресценции от температуры (dF/dT от Т) или (-dF/dT от Т) получают пик плавления.
Детекцию образования удлиненной цепи можно осуществить, беря за основу размер удлиненной цепи. SO, гибридизованный с удлиненной цепью, обеспечивает получение детектируемого сигнала с целью детекции удлиненной цепи по размеру удлиненной цепи. Например, если детекцию образования удлиненной цепи осуществляют различными электрофоретическими методами, такими как гель-электрофорез и электрофорез в полиакриламидном геле, SO, гибридизованный с удлиненной цепью, обеспечивает получение сигнала с гелевой матрицы, что указывает на присутствие удлиненной цепи. Предпочтительно используют SO с одиночной флуоресцентной меткой.
РТО, СТО и SO могут содержать природные dNMP. Альтернативно, РТО, СТО и SO могут содержать модифицированный нуклеотид или неприродный нуклеотид, как например, PNA (peptide nucleic acid - пептидо-нуклеиновая кислота; см. публикацию РСТ № WO 92/20702) и LNA (locked nucleic acid - "закрытая" нуклеиновая кислота, см. публикации РСТ №№ WO 98/22489, WO 98/39352 и WO 99/14226). РТО, СТО и SO могут содержать универсальные основания, такие как дезоксиинозин, инозин, 1-(2'-дезокси-бета-D-рибофуранозил)-3-нитропиррол и 5-нитроиндол. Термин "универсальное основание" относится к основанию, способному образовывать пары оснований с каждым из природных оснований ДНК/РНК с небольшим отличием между ними.
Как описано выше, РТО может расщепляться в сайте, локализованном в 3'-направлении от 3'-конца 5'-концевого тегирующего участка РТО. Этот сайт расщепления может быть расположен в 5'-концевой части 3'-концевого узнающего мишень участка РТО. В том случае, когда фрагмент РТО содержит 5'-концевую часть 3'-концевого узнающего мишень участка РТО, сайт СТО, гибридизуемый с 5'-концевой частью 3'-концевого узнающего мишень участка, может содержать универсальное основание, вырожденную последовательность или их комбинацию. Например, если РТО расщепляется в сайте, локализованном на расстоянии одного нуклеотида в 3'-направлении от 3'-конца 5'-концевого тегирующего участка РТО, то выгодно, чтобы 5'-концевая часть захватывающего участка СТО содержала универсальное основание для гибридизации с данным нуклеотидом. Если РТО расщепляется в сайте, локализованном на расстоянии двух нуклеотидов в 3'-направлении от 3'-конца 5'-концевого тегирующего участка РТО, то выгодно, чтобы 5'-конец захватывающего участка СТО содержал вырожденную последовательность, а ближайший к нему в 3'-направлении нуклеотид содержал универсальное основание. Соответственно, в том случае, когда расщепление РТО происходит в различных сайтах 5'-концевой части 3'-концевого узнающего мишень участка, использование универсальных оснований и вырожденных последовательностей в СТО является полезным. Помимо этого, когда для скрининга множественных нуклеиновокислотных последовательностей-мишеней в условиях индукции расщепления, зависящего от удлинения прямого праймера, используют РТО, имеющие один и тот же 5'-концевой тегирующий участок, могут быть созданы фрагменты РТО, имеющие различные 5'-концевые части 3'-концевого узнающего мишень участка. В таких случаях полезно использование в СТО универсальных оснований и вырожденных последовательностей. Стратегии с использованием универсальных оснований и вырожденных последовательностей в СТО позволяют применять один тип или минимальное количество типов СТО для скрининга множественных нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению способ по настоящему изобретению дополнительно включает стадию денатурации между стадиями (d) и (е). Удлиненный дуплекс, образованный на стадии (d), подвергают денатурации до получения одноцепочечной формы и затем гибридизуют с SO.
Согласно предпочтительному воплощению способ дополнительно включает повторение всех или некоторых из стадий (a)-(f) с денатурацией между повторяющимися циклами. Например, способ дополнительно включает повторение стадий (a)-(b), (a)-(d) или (a)-(f) с денатурацией между повторяющимися циклами, более предпочтительно с использованием обратного праймера. Это повторение позволяет амплифицировать нуклеиновокислотную последовательность-мишень и/или сигнал от мишени.
Согласно предпочтительному воплощению способ по настоящему изобретению дополнительно включает повторение стадий (а)-(е) с денатурацией между повторяющимися циклами и плавление продукта гибридизации со стадии (е) или плавление и гибридизацию продукта гибридизации со стадии (е) с получением детектируемого сигнала; при этом стадию (f) осуществляют, детектируя сигнал с целью определения присутствия удлиненной цепи.
Денатурация может быть осуществлена с использованием традиционных методов, включая, но не ограничиваясь этим, нагревание, обработку щелочью, формамидом, мочевиной и глиоксалем, ферментативные методы (например, действие геликазы) и связывание белков. Например, плавления можно достичь посредством нагревания при температуре, изменяющейся в диапазоне от 80°С до 105°С. Общие методы осуществления такой обработки приведены в Joseph Sambrook, et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001).
Согласно предпочтительному воплощению настоящее изобретение может быть осуществлено путем проведения серии анализов плавления для качественной или количественной детекции нуклеиновокислотной последовательности-мишени.
Более предпочтительно настоящее изобретение включает (1) повторение стадий (a)-(d) с денатурацией между повторяющимися циклами с образованием удлиненной цепи, (2) проведение анализа плавления продукта гибридизации SO и удлиненной цепи и (3) повторение стадий (1) и (2) по меньшей мере дважды. При использовании такого подхода анализ плавления повторно осуществляют по меньшей мере дважды через определенный интервал времени.
Согласно предпочтительному воплощению число повторов стадий (a)-(d) возможно можно регулировать. При проведении серии анализов плавления число повторов стадий (a)-(d) для одного акта анализа плавления может быть одинаковым или может отличаться от числа повторов стадий (a)-(d) для другого акта анализа плавления.
Специалисту в данной области будет понятно, что повторение стадий (а)-(d) представляет собой иллюстративный пример образования удлиненной цепи. Например, настоящее изобретение можно осуществить путем повторения стадий (а)-(b) и проведения стадий (с) и (d) с образованием удлиненной цепи, после чего провести анализ плавления.
Согласно предпочтительному воплощению стадии (a)-(f) осуществляют в реакционном сосуде или в отдельных реакционных сосудах. Например, стадии (a)-(b), (c)-(d) или (e)-(f) могут быть осуществлены в отдельных реакционных сосудах.
Согласно предпочтительному воплощению стадии (а)-(b) и (c)-(f) могут быть проведены одновременно или по отдельности даже в одном реакционном сосуде в зависимости от реакционных условий (в частности, температуры).
Согласно предпочтительному воплощению стадии (а)-(b) повторяют с денатурацией.
В тех случаях, когда в процессе повторения в качестве располагающегося против хода транскрипции олигонуклеотида используют располагающийся прямой праймер, способ по настоящему изобретению предпочтительно осуществляют в присутствии располагающегося обратного праймера, предпочтительно с применением ПЦР.
Согласно предпочтительному воплощению проведение в настоящем изобретении по меньшей мере двух анализов плавления позволяет осуществить количественную детекцию нуклеиновокислотной последовательности-мишени.
Площадь под пиком плавления и высота пика плавления, полученные в анализе плавления, зависят от количества удлиненного дуплекса, предоставляя информацию относительно исходного количества нуклеиновокислотной последовательности-мишени.
Согласно предпочтительному воплощению способ по настоящему изобретению включает (1) увеличение числа удлиненных цепей путем повторения стадий (a)-(d) с денатурацией между повторяющимися циклами, (2) проведение анализа плавления продукта гибридизации между SO и удлиненной цепью и (3) повторение стадий (1) и (2) по меньшей мере дважды. Количество нуклеиновокислотной последовательности-мишени можно измерить путем определения числа циклов в анализах плавления, при котором достигается предварительно заданная пороговая величина для площадей и/или высот полученных пиков плавления.
Альтернативно, количественное определение нуклеиновокислотной последовательности-мишени может быть осуществлено посредством построения графика зависимости данных анализа плавления (например, площади или высоты пиков) от числа повторения циклов, проводимых для увеличения количества удлиненной цепи.
В настоящем изобретении не требуется, чтобы нуклеиновокислотные последовательности-мишени, подлежащие детекции и/или амплификации, имели какую-либо определенную последовательность или длину, включая любые молекулы ДНК (гДНК и кДНК) и РНК.
Если в качестве исходного материала используют мРНК, перед проведением стадии отжига необходима стадия обратной транскрипции, детали которой можно найти в Joseph Sambrook, et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001); и Noonan, K.F. et al., Nucleic Acids Res., 16: 10366 (1988)). Для обратной транскрипции в качестве праймера можно использовать случайный гексамер или олигонуклеотид dT, способный гибридизоваться с мРНК.
Нуклеиновокислотные последовательности-мишени, которые могут подлежать детекции и/или амплификации, включают любую природную нуклеиновую кислоту прокариотического, эукариотического (например, из простейших и паразитов, грибов, дрожжей, высших растений, низших и высших животных, в том числе млекопитающих и человека), вирусного (например, из вируса герпеса, ВИЧ, вируса гриппа, вируса Эпштейна-Барр, вируса гепатита, полиовируса и т.д.) или вироидного происхождения.
Нуклеиновокислотная последовательность-мишень, подлежащая детекции согласно настоящему изобретению, включает большое разнообразие нуклеиновокислотных последовательностей, например, последовательности в геноме, искусственно выделенные или фрагментированные последовательности и синтезированные последовательности (например, последовательности кДНК и штрихкодовые последовательности). Например, нуклеиновокислотная последовательность-мишень включает маркерные последовательности для иммуно-ПЦР (иПЦР). В иПЦР применяют конъюгаты, образованные между нуклеиновокислотными маркерными последовательностями и антителами, в сочетании с ПЦР, что широко используется для детекции различных типов мишеней, включая белки (см. Sano et al., Science, 258, pp: 120-122 (1992), патент США №5665539, Niemeyer et al., Trends in Biotechnology, 23, pp: 208-216 (2005), публикацию заявки напатент США №2005/0239108 и Ye et al., Journal of Environmental Science, 22, pp: 796-800 (2010)).
Настоящее изобретение также применяется для детекции нуклеотидной вариации. Предпочтительно, чтобы нуклеиновокислотная последовательность-мишень содержала нуклеотидную вариацию. Термин "нуклеотидная вариация", используемый в данном описании, относится к любым одиночным или множественным нуклеотидным заменам, делециям или вставкам в последовательности ДНК в конкретном положении среди непрерывных сегментов ДНК, которые в других случаях являются одинаковыми в последовательности. Такие непрерывные сегменты ДНК включают ген или любую другую часть хромосомы. Такие нуклеотидные вариации могут быть результатом мутации или представлять собой вариации полиморфных аллелей. Например, нуклеотидная вариация, детектируемая в настоящем изобретении, включает SNP (single nucleotide polymorphism - однонуклеотидный полиморфизм), мутацию, делецию, вставку, замену и транслокацию. Примером нуклеотидной вариации являются многочисленные вариации в геноме человека (например, вариации в гене MTHFR (метилентетрагидрофолат-редуктазы)), вариации, вовлеченные в возникновение лекарственной устойчивости у патогенных микроорганизмов, и вызывающие онкогенез вариации. Термин "нуклеотидная вариация", используемый в данном описании, включает в себя любую вариацию в конкретном положении в молекуле ДНК. Другими словами, термин нуклеотидная вариация включает в себя дикий тип и любой его мутантный тип в конкретном положении в молекуле ДНК.
В настоящем изобретении для детекции нуклеотидной вариации в нуклеиновокислотной последовательности-мишени в том случае, когда используемые праймеры или зонды имеют последовательность, комплементарную этой нуклеотидной вариации в данной нуклеиновокислотной последовательности-мишени, нуклеиновокислотная последовательность-мишень, содержащая такую нуклеотидную вариацию, описывается в данном изобретении как сопоставимая матрица (matching или match template). В том случае, когда используемые праймеры или зонды имеют последовательность, не комплементарную этой нуклеотидной вариации в данной нуклеиновокислотной последовательности-мишени, нуклеиновокислотная последовательность-мишень, содержащая такую нуклеотидную вариацию, описывается в данном изобретении как несопоставимая матрица (mismatching или mismatch template).
Для детекции нуклеотидных вариаций 3'-прямого праймера можно сконструировать таким образом, чтобы он располагался напротив сайта нуклеотидной вариации в нуклеиновокислотной последовательности-мишени. Согласно предпочтительному воплощению 3'-конец прямого праймера имеет последовательность, комплементарную данной нуклеотидной вариации в нуклеиновокислотной последовательности-мишени. 3'-Конец прямого праймера, имеющего последовательность, комплементарную данной нуклеотидной вариации в этой нуклеиновокислотной последовательности-мишени, отжигают с сопоставимой матрицей и удлиняют, чтобы индуцировать расщепление РТО. Полученный фрагмент РТО гибридизуется с СТО, удлиняется и гибридизуется с SO с получением сигнала от мишени. В отличие от этого, когда 3'-конец располагающегося прямого праймера не соответствует нуклеотидной вариации в несопоставимой матрице, он не удлиняется в условиях, необходимых для отжига 3'-конца праймеров и являющихся существенными для удлинения, даже когда прямой праймер гибридизуется с несопоставимой матрицей, ввиду этого никакого сигнала от мишени не генерируется.
Альтернативно, можно использовать расщепление РТО в зависимости от гибридизации РТО, имеющего последовательность, комплементарную последовательности с нуклеотидной вариацией в нуклеиновокислотной последовательности-мишени. Например, в регулируемых условиях РТО, имеющий последовательность, комплементарную последовательности с нуклеотидной вариацией в нуклеиновокислотной последовательности-мишени, гибридизуется с сопоставимой матрицей и затем расщепляется. Полученный фрагмент РТО гибридизуется с СТО, удлиняется и гибридизуется с SO с получением сигнала от мишени. Вместе с тем в данных регулируемых условиях РТО не гибридизуется с несопоставимой матрицей, имеющей последовательность, не комплементарную последовательности в месте расположения нуклеотидной вариации, и не расщепляется. В этом случае предпочтительно, чтобы последовательность в РТО, комплементарная последовательности с нуклеотидной вариацией, была расположена в середине 3'-концевого узнающего мишень участка РТО.
Альтернативно, предпочтительно, чтобы 5'-концевая часть 3'-концевого узнающего мишень участка в РТО была ориентирована по отношению к нуклеотидной вариации в нуклеиновокислотной последовательности-мишени для детекции этой нуклеотидной вариации, и 5'-концевая часть 3'-концевого узнающего мишень участка в РТО имела последовательность, комплементарную последовательности с нуклеотидной вариацией в нуклеиновокислотной последовательности-мишени (см. Фиг. 9).
Когда зонд, имеющий на своем 5'-концевом участке сайт распознавания нуклеотидной вариации, гибридизуется с несопоставимой матрицей, его 5'-концевой участок в определенных условиях может образовывать одиночную цепь. Данный зонд может соответствовать РТО. Сигнал можно генерировать, используя способ по настоящему изобретению. Этот подход может быть полезен для детекции нуклеиновокислотной последовательности-мишени, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания нуклеотидной вариации в зондах.
Согласно предпочтительному воплощению используемая в настоящем изобретении нуклеиновокислотная последовательность-мишень представляет собой предварительно амплифицированную нуклеиновокислотную последовательность. Использование предварительно амплифицированной нуклеиновокислотной последовательности дает возможность значительно повысить чувствительность и специфичность детекции мишени по настоящему изобретению.
Согласно предпочтительному воплощению способ осуществляют в присутствии обратного праймера.
Преимущества настоящего изобретения могут быть особо отмечены при одновременной (множественной) детекции по меньшей мере двух нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению способ осуществляют с целью детекции по меньшей мере двух типов (более предпочтительно по меньшей мере трех типов, еще более предпочтительно по меньшей мере пяти типов) нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению способ осуществляют с целью детекции по меньшей мере двух типов (более предпочтительно по меньшей мере трех типов, еще более предпочтительно по меньшей мере пяти типов) нуклеиновокислотных последовательностей-мишеней; причем располагающийся против хода транскрипции олигонуклеотид включает по меньшей мере два типа (более предпочтительно по меньшей мере три типа, еще более предпочтительно по меньшей мере пять типов) олигонуклеотидов, РТО включает по меньшей мере два типа (более предпочтительно по меньшей мере три типа, еще более предпочтительно по меньшей мере пять типов) РТО, СТО включает по меньшей мере два типа (предпочтительно, по меньшей мере три типа, более предпочтительно по меньшей мере пять типов) СТО, и SO включает по меньшей мере два типа (предпочтительно по меньшей мере три типа, более предпочтительно по меньшей мере пять типов) SO; при этом, когда присутствуют по меньшей мере два типа нуклеиновокислотных последовательностей-мишеней, данный способ обеспечивает получение по меньшей мере двух типов сигналов от мишеней, соответствующих по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней.
5'-Концевые тегирующие участки по меньшей мере двух РТО могут иметь идентичную друг другу последовательность. Например, если настоящее изобретение осуществляют для скрининга нуклеиновокислотных последовательностей-мишеней, то 5'-концевые тегирующие участки РТО могут иметь идентичную последовательность.
Кроме того, один тип СТО можно использовать для детекции множества нуклеиновокислотных последовательностей-мишеней. Например, когда для скрининга нуклеиновокислотных последовательностей-мишеней применяют РТО, содержащие идентичную последовательность в своих 5'-концевых тегирующих участках, можно использовать один тип СТО.
Когда настоящее изобретение осуществляют с целью одновременной детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней с использованием анализа кривой плавления, и продукты гибридизации со стадии (е), соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, имеют отличающиеся друг от друга величины Тпл, можно осуществить детекцию по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней с применением метки даже одного типа (например, FAM).
Согласно предпочтительному воплощению величину Тпл гибрида SO/удлиненная цепь можно регулировать последовательностью и/или длиной SO, последовательностью и/или длиной части удлиненной цепи, которая должна гибридизоваться с SO, или их комбинацией. В частности, когда удлиненные цепи, образованные в процессе множественной детекции по настоящему изобретению, гибридизуются с SO одного типа, тогда величины Тпл гибридов между удлиненными цепями и SO отличаются друг от друга, если части удлиненных цепей, которые должны гибридизоваться с SO, сконструированы так, что они имеют разные последовательности. Ввиду этого, множественную детекцию на практике можно осуществить даже с использованием SO одного типа.
Настоящее изобретение может быть осуществлено на твердой фазе, такой как микрочип.
Согласно предпочтительному воплощению настоящее изобретение осуществляют на твердой фазе, и СТО или SO иммобилизуют на твердой подложке через его 5-конец или 3'-конец.
Для проведения реакции на твердой фазе СТО или SO иммобилизуют непосредственно или опосредованно (предпочтительно опосредованно) через его 5'-конец или 3'-конец (предпочтительно 3'-конец) на поверхности твердой подложки. Кроме того, иммобилизацию СТО или SO на поверхности твердой подложки можно проводить ковалентным или нековалентным образом. В тех случаях, когда иммобилизованные СТО или SO иммобилизованы на поверхности твердой подложки опосредованно, используют подходящие линкеры. Линкеры, полезные в данном изобретении, могут включать любые линкеры, используемые для иммобилизации зондов на поверхности твердой подложки. Например, алкильные или арильные соединения с аминной функциональной группой либо алкильные или арильные соединения с тиоловой функциональной группой служат в качестве линкеров для иммобилизации СТО или SO. Помимо этого, в качестве линкеров может служить поли(Т)-хвост или поли(А)-хвост.
Согласно предпочтительному воплощению твердая подложка, используемая в настоящем изобретении, представляет собой микрочип. Микрочип, обеспечивающий соблюдение условий реакции в данном изобретении, может включать любой из микрочипов, которые известны специалисту в данной области. Все процессы в настоящем изобретении, то есть гибридизацию с нуклеиновокислотными последовательностями-мишенями, расщепление, удлинение, плавление и детекцию флуоресценции осуществляют на микрочипе. Иммобилизованные на микрочипе СТО или SO служат в качестве гибридизуемых элементов чипа. Твердая подложка для изготовления микрочипа включает металлы (например, золото, сплав золота и меди, аллюминий), оксид металла, стекло, керамику, кварц, кремний, полупроводник, пластинку из Si/SiO2, германий, арсенид галия, углерод, углеродную нанотрубку, полимеры (например, полистирол, полиэтилен, полипропилен и полиакриламид), сефарозу, агарозу и коллоиды, но этим не ограничивается. Большинство используемых в данном изобретении иммобилизованных СТО или SO может быть иммобилизовано на доступном участке или двух или более доступных участках на твердой подложке, которая может содержать 2-1000000 доступных участков. Чтобы получить микрочип или микрочипы для заданного применения, иммобилизованные СТО или SO могут быть изготовлены с использованием традиционных технологий изготовления, таких как фотолитография, технология струйной печати, механическое точечное нанесение пятен и их производные.
Согласно предпочтительному воплощению SO, иммобилизованный на поверхности твердой подложки, имеет систему двух взаимодействующих меток.
В настоящем изобретении, в результате расщепления РТО, гибридизованного с нуклеиновой кислотой-мишенью, получают фрагмент РТО, и его отжигают с СТО и удлиняют на СТО, что приводит к образованию удлиненной цепи.
Кроме того, для увеличения числа удлиненных цепей возможно получение дополнительных фрагментов, которые могут удлиняться на СТО, посредством применения дополнительной реакции 5'-нуклеазного расщепления с использованием дополнительного РТО, который содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную удлиненной цепи, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную удлиненной цепи, но комплементарную захватывающему участку СТО.
Предпочтительно дополнительный РТО располагается справа по отношению к SO, гибридизующемуся с удлиненной цепью. SO индуцирует расщепление дополнительного РТО ферментом, обладающим 5'-нуклеазной активностью. Когда 3'-конец SO удлинен, удлиненная цепь SO индуцирует расщепление дополнительного РТО.
Упомянутое выше предпочтительное воплощение имеет ту особенность, что образование дополнительных фрагментов зависит от образования удлиненной цепи.
Альтернативно, дополнительные фрагменты можно получить посредством использования дополнительного РТО, который содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную матричному участку СТО, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, некомплементарную матричному участку СТО, но комплементарную захватывающему участку СТО.
Предпочтительное воплощение с амплификацией нуклеиновокислотной последовательности-мишени
Настоящее изобретение предпочтительно осуществляют одновременно с амплификацией нуклеиновокислотной последовательности-мишени, используя пару праймеров, состоящую из прямого праймера и обратного праймера, способных участвовать в синтезе данной нуклеиновокислотной последовательности-мишени.
В другом аспекте данного изобретения предложен способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
(a) гибридизацию нуклеиновокислотной последовательности-мишени с парой праймеров, содержащей прямой праймер и обратный праймер, и РТО (зондирующим и метящим олигонуклеотидом); при этом каждый из праймеров, прямой праймер и обратный праймер, содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотным последовательностям-мишеням; РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; РТО локализован между располагающимся прямым праймером и обратным праймером; при этом РТО блокирован по его 3'-концу, чтобы не допустить его удлинения;
(b) приведение в контакт продукта со стадии (а) с матричной полимеразой нуклеиновых кислот, обладающей 5'-нуклеазной активностью, в условиях, подходящих для удлинения праймеров и для расщепления РТО; при этом, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, прямой праймер удлиняется, и удлиненная цепь индуцирует расщепление РТО матричной полимеразой нуклеиновых кислот, обладающей 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс;
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
Поскольку в предпочтительном воплощении настоящего изобретения применяются стадии описанного выше способа по настоящему изобретению, общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Согласно предпочтительному воплощению способ дополнительно включает повторение всех или некоторых из стадий (a)-(f) с денатурацией между повторяющимися циклами. Например, способ дополнительно включает повторение стадий (a)-(b), (a)-(d) или (a)-(f) с денатурацией между повторяющимися циклами. Повторение реакций сопровождается амплификацией нуклеиновокислотной последовательности-мишени. Амплификацию
предпочтительно осуществляют в соответствии с ПЦР (полимеразной цепной реакцией), описанной в патентах США №№4683195, 4683202 и 4800159.
Согласно предпочтительному воплощению способ осуществляют для детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней.
Способ детекции мишени посредством PCE-SH-анализа, основанный на использовании 5'-нуклеазной активности, не зависящей от располагающегося против хода транскрипции олигонуклеотида
Настоящее изобретение может быть осуществлено без использования располагающихся против хода транскрипции олигонуклеотидов.
В еще одном аспекте настоящего изобретения предложен способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
а) гибридизацию нуклеиновокислотной последовательности-мишени с зондирующим и метящим олигонуклеотидом (РТО); при этом РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом РТО расщепляется ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5'(1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс;
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
С учетом амплификации нуклеиновокислотных последовательностей-мишеней и эффективности расщепления РТО, PCE-SH-анализ по настоящему изобретению предпочтительно проводят с использованием располагающихся против хода транскрипции олигонуклеотидов.
Способ детекции нуклеотидной вариации в PCE-SH-анализе
В следующем аспекте настоящего изобретения предложен способ детекции нуклеотидной вариации в нуклеиновокислотной последовательности-мишени в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
а) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся против хода транскрипции олигонуклеотидом и зондирующим и метящим олигонуклеотидом (РТО); при этом располагающийся против хода транскрипции олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени, и (3) сайт распознавания нуклеотидной вариации, содержащий последовательность, комплементарную последовательности с нуклеотидной вариацией в нуклеиновой кислоте-мишени, расположенный в 5'-концевой части 3'-концевого узнающего мишень участка; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся против хода транскрипции олигонуклеотид предшествует РТО; располагающийся против хода транскрипции олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5'-нуклеазной активностью;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания нуклеотидной вариации, и 5'-концевая часть 3'-концевого узнающего мишень участка образует двойную цепь с нуклеиновокислотной последовательностью-мишенью, индуцируя расщепление, начиная с первого начального сайта расщепления, тогда высвобождается первый фрагмент; при этом, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания нуклеотидной вариации, и 5'-концевая часть 3'-концевого узнающего мишень участка не образует двойной цепи с нуклеиновокислотной последовательностью-мишенью, индуцируя расщепление, начиная со второго начального сайта расщепления, расположенного справа относительно первого начального сайта расщепления, тогда высвобождается второй фрагмент; при этом второй фрагмент содержит дополнительный 3'-концевой участок, позволяющий отличить второй фрагмент от первого фрагмента;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5'(1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом первый фрагмент или второй фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом, когда первый фрагмент гибридизуется с захватывающим участком СТО, он удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО; при этом, когда второй фрагмент гибридизуется с захватывающим участком СТО, он не удлиняется; и
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие нуклеотидной вариации, последовательность которой комплементарна сайту распознавания нуклеотида в РТО.
Авторы настоящего изобретения обнаружили, что сайт расщепления зонда можно регулировать в зависимости от присутствия и отсутствия представляющих интерес нуклеотидных вариаций, при этом фрагменты, высвободившиеся в результате расщепления в разных сайтах, отличаются по их способности к удлинению на искусственной матрице.
В настоящем изобретении реализуются поочередные события в такой последовательности: гибридизация зондов; расщепление и удлинение РТО; образование зависящей от нуклеотидной вариации удлиненной цепи; и детекция удлиненной цепи с использованием сигнального олигонуклеотида. Поэтому способ называется анализом "Детекция вариаций посредством гибридизации сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО (VD-PCE-SH-анализ)".
Согласно предпочтительному воплощению нуклеотидная вариация, детектируемая согласно настоящему изобретению, представляет собой вариацию в результате изменения одного нуклеотида, как например SNP.
В настоящей заявке нуклеиновокислотная последовательность-мишень, имеющая нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания этой нуклеотидной вариации в РТО, также описывается как "сопоставимая матрица". Нуклеиновокислотная последовательность-мишень, имеющая нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания этой нуклеотидной вариации в РТО, также описывается как "несопоставимая матрица".
Согласно предпочтительному воплощению термин "некомплементарный" в сочетании с фразой "нуклеотидная вариация, последовательность которой не комплементарна сайту распознавания нуклеотидной вариации" используется в данном описании как охватывающий некомплементарность, обусловленную наличием вставки или делеции.
В VD-PCE-SH-анализе по настоящему изобретению используют РТО, имеющий сайт распознавания нуклеотидной вариации, расположенный в 5'-концевой части 3'-концевого узнающего мишень участка, для обеспечения избирательности РТО в отношении конкретной нуклеотидной вариации. Когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания данной нуклеотидной вариации, (т.е. с сопоставимой матрицей), 5'-концевая часть 3'-концевого узнающего мишень участка образует двойную цепь с сопоставимой матрицей; однако, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной вариации, (т.е. с несопоставимой матрицей), 5'-концевая часть 3'-концевого узнающего мишень участка не образует двойной цепи с несопоставимой матрицей.
Следует отметить, что такие разные картины гибридизации в случае представляющей интерес нуклеотидной вариации отвечают за различие в начальных сайтах расщепления РТО, в результате чего образуются два типа фрагментов РТО, обуславливая различие в сигналах в зависимости от присутствия представляющей интерес нуклеотидной вариации.
Первый фрагмент получается в результате расщепления гибрида, образованного между РТО и сопоставимой матрицей, а второй фрагмент получается в результате расщепления гибрида, образованного между РТО и несопоставимой матрицей, соответственно. Второй фрагмент содержит дополнительный 3'-концевой участок, делающий второй фрагмент отличным от первого фрагмента.
Образование либо первого фрагмента, либо второго фрагмента можно отчетливо обнаружить с использованием реакции удлинения на СТО.
Как правило, гибридизация между 3'-концевой частью праймеров и матрицей является очень критичной для удлинения праймеров в жестких условиях. В настоящем изобретении и первый фрагмент, и второй фрагмент, оба гибридизуются с одним и тем же сайтом СТО. Как описано выше, второй фрагмент содержит дополнительный 3'-концевой участок по сравнению с первым фрагментом. Регулируя условия гибридизации и последовательность СТО, располагающуюся напротив дополнительного 3'-концевого участка второго фрагмента, можно обеспечить удлинение только первого фрагмента.
Согласно предпочтительному воплощению СТО имеет последовательность, выбранную такой, что СТО не гибридизуется с дополнительным 3'-концевым участком второго фрагмента, предотвращая удлинение второго фрагмента при его гибридизации с захватывающим участком СТО.
Согласно предпочтительному воплощению последовательность СТО, располагающаяся напротив дополнительного 3'-концевого участка второго фрагмента, не комплементарна дополнительному 3'-концевому участку.
Образование удлиненной цепи в результате удлинения первого фрагмента можно обнаружить посредством использования SO по настоящему изобретению, описанного выше.
Согласно традиционным технологиям использования 5'-нуклеазной активности для детекции нуклеотидных вариаций гибридизация используемых зондов определяется полной последовательностью зонда или зависит от нее. В таких традиционных технологиях разработка и конструирование зондов и оптимизация реакционных условий вызывают большие затруднения, поскольку гибридизация зондов, зависящая от присутствия нуклеотидных вариаций, вынуждена в основном определяться различием в один нуклеотид.
Согласно VD-PCE-SH-анализу сайт распознавания нуклеотидной вариации располагается в 5'-концевой части вовлеченного в гибридизацию участка зондов, что позволяет оптимизировать условия гибридизации в сторону удобства. Помимо этого, в VD-PCE-SH-анализе по-разному осуществляется детекция нуклеотидной вариации, скорее по локальному участку зондов, чем по полной последовательности зондов, вследствие чего можно с высокой степенью точности обнаружить различие даже в один нуклеотид, например, SNP.
Специалисту в данной области известно, что последовательность зондов, расположенная близко к последовательности, располагающейся напротив SNP, оказывает очень сильное влияние на гибридизацию зондов. Как правило, традиционные зонды имеют последовательность, располагающуюся напротив SNP в их средней части. В этом смысле традиционные зонды могут не "выбрать" близлежащую последовательность, окружающую SNP, вовлеченный в гибридизацию. Традиционные технологии имеют серьезные ограничения, обусловленные лежащими близко к SNP последовательностями.
VD-PCE-SH-анализ по настоящему изобретению будет описан более подробно, как приведено ниже.
Поскольку VD-PCE-SH-анализ по настоящему изобретению представляет собой одно из применений описанного выше PCE-SH-анализа, общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Стадия (а). Гибридизация располагающегося против хода транскрипции олигонуклеотида и РТО с нуклеиновокислотной последовательностью-мишенью
Согласно настоящему изобретению нуклеиновокислотная последовательность-мишень сначала гибридизуется с располагающимся против хода транскрипции олигонуклеотидом и РТО.
РТО, используемый для детекции нуклеотидных вариаций, содержит (1) 3'-концевой узнающий мишень участок, служащий в качестве зонда, (2) 5'-концевой тегирующий участок с нуклеотидной последовательностью, не комплементарной нуклеиновокислотной последовательности-мишени, и (3) сайт распознавания нуклеотидной вариации, содержащий последовательность, комплементарную последовательности данной нуклеотидной вариации в нуклеиновой кислоте-мишени, расположенный в 5'-концевой части 3'-концевого узнающего мишень участка. 5'-Концевой тегирующий участок в результате нуклеолитической реакции высвобождается из РТО после гибридизации с нуклеиновокислотной последовательностью-мишенью. 5'-Концевой тегирующий участок и 3'-концевой узнающий мишень участок в РТО должны располагаться в направлении 5'→3' . PTO-NV схематически показан на Фиг. 9.
РТО включает в себя сайт распознавания нуклеотидной вариации, содержащий последовательность, комплементарную последовательности данной нуклеотидной вариации, расположенную в 5'-концевой части 3'-концевого узнающего мишень участка.
Когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания данной вариации, 5'-концевая часть 3'-концевого узнающего мишень участка образует двойную цепь с нуклеиновокислотной последовательностью-мишенью. Когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной вариации, 5'-концевая часть 3'-концевого узнающего мишень участка не образует двойной цепи с нуклеиновокислотной последовательностью-мишенью. Такие разные картины гибридизации в случае представляющей интерес нуклеотидной вариации отвечают за различие в сайтах расщепления РТО, в результате чего образуются два типа фрагментов РТО, обуславливая различие в сигналах в зависимости от присутствия представляющей интерес нуклеотидной вариации. 5'-Концевую часть 3'-концевого узнающего мишень участка в РТО также можно описать как "образующий одну цепь 5'-концевой участок" 3'-концевого узнающего мишень участка в РТО при гибридизации с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной вариации.
Сайт распознавания нуклеотидной вариации, расположенный в 5'-концевой части 3'-концевого узнающего мишень участка в РТО, содержит последовательность, комплементарную последовательности нуклеотидной вариации. Например, когда подлежащая детекции нуклеотидная вариация представляет собой SNP, сайт распознавания нуклеотидной вариации содержит нуклеотид, комплементарный данному SNP.
Согласно предпочтительному воплощению сайт распознавания нуклеотидной вариации локализован в пределах 10 нуклеотидов, более предпочтительно 8 нуклеотидов; еще более предпочтительно 6 нуклеотидов, еще наиболее предпочтительно 4 нуклеотидов, 3 нуклеотидов, 2 нуклеотидов или 1 нуклеотида от 5'-конца 3'-концевого узнающего мишень участка в РТО. Предпочтительно сайт распознавания нуклеотидной вариации локализован на 5'-конце 3'-концевого узнающего мишень участка в РТО.
Термин "сайт" со ссылкой или на сайт распознавания нуклеотидной вариации в зондах, или на сайт нуклеотидной вариации в последовательностях-мишенях, используется в данном описании для включения не только одного нуклеотида, но также и множества нуклеотидов.
Гибридизацию на стадии (а) предпочтительно проводят в жестких условиях, так что 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью.
Стадия (b). Высвобождение фрагмента из РТО
Далее, продукт со стадии (а) приводят в контакт с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО.
Когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания данной вариации, (т.е. с сопоставимой матрицей) и 5'-концевая часть 3'-концевого узнающего мишень участка образует двойную цепь с нуклеиновокислотной последовательностью-мишенью, индуцируя расщепление, начиная с первого начального сайта расщепления, тогда высвобождается первый фрагмент (см. Фиг. 9).
Когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной вариации, (т.е. с несопоставимой матрицей) и 5'-концевая часть 3'-концевого узнающего мишень участка не образует двойной цепи с нуклеиновокислотной последовательностью-мишенью, индуцируя расщепление, начиная со второго начального сайта расщепления, расположенного справа относительно первого начального сайта расщепления, тогда высвобождается второй фрагмент; при этом второй фрагмент содержит дополнительный 3'-концевой участок, позволяющий отличить второй фрагмент от первого фрагмента (см. Фиг. 9).
Когда в образце отсутствует нуклеиновокислотная последовательность-мишень, расщепления РТО не происходит.
Соответственно, различия в сайтах расщепления и типах образованных фрагментов РТО приводят к получению разных картин удлинения в зависимости от присутствия и отсутствия представляющей интерес нуклеотидной вариации в нуклеиновокислотной последовательности-мишени, способствуя дифференцированному обнаружению нуклеотидной вариации в нуклеиновокислотной последовательности-мишени.
Сайт расщепления с удлинением прямых праймеров обычно локализован в направлении 5'→3' относительно начального нуклеотида двойной цепи (т.е. сайта ветвления) в структурах, включающих одиночную цепь и двойную цепь, или на расстоянии 1-2 нуклеотидов от начального нуклеотида. В результате реакции расщепления образуются фрагменты, содержащие 5-концевой тегирующий участок и часть 3'-концевого узнающего мишень участка. В том случае, когда настоящее изобретение осуществляют с использованием индукции расщепления, не зависящего от удлинения располагающегося против хода транскрипции олигонуклеотида, сайт расщепления РТО может быть скорректирован по отношению к месту локализации располагающихся против хода транскрипции олигонуклеотидов.
Используемый в данном описании термин "первый начальный сайт расщепления" в отношении РТО означает сайт расщепления РТО, который расщепляется первым, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания данной вариации. Используемый в данном описании термин "второй начальный сайт расщепления" в отношении РТО означает сайт расщепления РТО, который расщепляется первым, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной вариации.
Используемый в данном описании термин "первый фрагмент" относится к фрагменту, образуемому в результате расщепления в первом начальном сайте расщепления. Данный термин используется взаимозаменяемо с терминами "первый сегмент" и "первый фрагмент РТО". Термин "второй фрагмент" относится в данном описании к фрагменту, образуемому в результате расщепления во втором начальном сайте расщепления. Данный термин используется взаимозаменяемо с терминами "второй сегмент" и "второй фрагмент РТО".
Предпочтительно, чтобы первый фрагмент и второй фрагмент каждый содержал 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка.
В зависимости от используемых методов расщепления, после расщепления первого начального сайта расщепления (или второго начального сайта расщепления) может происходить последующее расщепление. Например, в том случае, когда для расщепления используется 5'-нуклеазная реакция вместе с удлинением прямых праймеров, начальный сайт расщепления и следующая за ним последовательность расщепляются. В том случае, когда используется располагающийся против хода транскрипции зонд и реакция расщепления происходит в сайте, находящемся в стороне от места локализации зонда, реакция расщепления может происходить только в данном сайте, и расщепления в следующих за ним сайтах может не происходить.
Согласно предпочтительному воплощению начальный сайт расщепления, зависящий от удлинения прямых праймеров, может располагаться в направлении 5'→3' относительно начального нуклеотида двойной цепи (т.е. сайта ветвления).
Как показано на Фиг. 9, отображающей пример настоящего изобретения, сайт распознавания нуклеотидной вариации располагается на 5'-конце 5'-концевой части 3'-концевого узнающего мишень участка. В этом случае первый начальный сайт расщепления располагается в непосредственной близости в направлении 5'→3' по отношению к 5'-концевой части 3'-концевого узнающего мишень участка. Другими словами, первый начальный сайт расщепления располагается в непосредственной близости в направлении 3' по отношению к сайту распознавания нуклеотидной вариации. Второй начальный сайт расщепления обычно располагается на расстоянии 1 нуклеотида в направлении 3' от сайта распознавания нуклеотидной вариации.
Если сайт распознавания нуклеотидной вариации располагается на расстоянии 1 нуклеотида от 5'-конца 5'-концевой части 3'-концевого узнающего мишень участка, то первый начальный сайт расщепления располагается в непосредственной близости в направлении 5'по отношению к сайту распознавания нуклеотидной вариации. Второй начальный сайт расщепления обычно располагается на расстоянии 1 нуклеотида в направлении 3' от сайта распознавания нуклеотидной вариации.
Согласно предпочтительному воплощению 5'-концевая часть может частично содержать не способную к гибридизации последовательность (или не подходящую для спаривания оснований последовательность). Введение не способной к гибридизации последовательности в 5'-концевую часть очень выгодно по сравнению с образованием одиночной цепи 5'-концевой части в тех случаях, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной нуклеотидной вариации. Помимо этого, введение последовательности, не способной к гибридизации, дает возможность корректировать второй начальный сайт расщепления.
Согласно предпочтительному воплощению 5'-концевая часть 3'-концевого узнающего мишень участка в РТО содержит группировку, не подходящую для спаривания оснований, локализованную в пределах 1-10 нуклеотидов (более предпочтительно 1-5 нуклеотидов) от сайта распознавания нуклеотидной вариации. Группировка, не подходящая для спаривания оснований, не позволяет 5'-концевой части 3'-концевого узнающего мишень участка образовывать двойную цепь с нуклеотидной последовательностью-мишенью, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой не комплементарна сайту распознавания данной вариации.
Использование группировки, не подходящей для спаривания оснований, (например, некомплементарного нуклеотида) усиливает способность РТО к распознаванию нуклеотидных вариаций.
Согласно предпочтительному воплощению группировка, не подходящая для спаривания оснований, не ингибирует образования двойной цепи между 5'-концевой частью и нуклеиновокислотной последовательностью-мишенью, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, имеющей нуклеотидную вариацию, последовательность которой комплементарна сайту распознавания данной нуклеотидной вариации.
Согласно предпочтительному воплощению присутствие группировки, не подходящей для спаривания оснований, увеличивает расстояние между первым начальным сайтом расщепления и вторым начальным сайтом расщепления.
Предпочтительно, чтобы группировка, не подходящая для спаривания оснований, располагалась справа относительно сайта распознавания нуклеотидной вариации.
Например, если некомплементарный нуклеотид в качестве группировки, не подходящей для спаривания оснований, вводят в положение, находящееся на расстоянии 2 нуклеотидов в направлении 3' от сайта распознавания нуклеотидной вариации, то второй начальный сайт расщепления корректируют к положению, находящемуся на расстоянии 2 нуклеотидов от сайта распознавания нуклеотидной вариации. В случае, когда некомплементарный нуклеотид не используется, второй начальный сайт расщепления располагается на расстоянии 1 нуклеотида от сайта распознавания нуклеотидной вариации. Таким образом, используя группировку, не подходящую для спаривания оснований, можно увеличивать расстояние между первым начальным сайтом расщепления и вторым начальным сайтом расщепления.
Группировка, не подходящая для спаривания оснований, включает любые группировки, не образующие пары оснований между нуклеиновокислотными последовательностями-мишенями. Предпочтительно, чтобы группировка, не подходящая для спаривания оснований, представляла собой (1) нуклеотид, содержащий искусственное некомплементарное основание, основание, не подходящее для спаривания оснований, модифицированное таким образом, что оно не способно образовывать пару оснований, или универсальное основание, (2) нуклеотид, не подходящий для спаривания оснований, модифицированный таким образом, что он не способен образовывать пару оснований, или (3) химическое соединение, не подходящее для спаривания оснований.
Например, группировка, не подходящая для спаривания оснований, содержит алкиленовую группу, рибофуранозил-нафталин, дезоксирибофуранозил-нафталин, метафосфат, фосфотиоатную связь, алкилфосфотриэфирную связь, арилфосфотриэфирную связь, алкилфосфонатную связь, арилфосфонатную связь, гидрофосфонатную связь, алкилфосфоамидатную связь и арилфосфоамидатную связь. В качестве группировок, не подходящих для спаривания оснований, также используют традиционные углеродные спейсеры. Универсальные основания в качестве группировок, не подходящих для спаривания оснований, полезны для корректировки сайтов расщепления в РТО.
Поскольку пары оснований, содержащие универсальные основания, такие как дезоксиинозин, 1-(2'-дезокси-бета-D-рибофуранозил)-3-нитропиррол и 5-нитроиндол, характеризуются меньшей способностью к связыванию по сравнению с природными основаниями, эти универсальные основания можно использовать в качестве группировок, не подходящих для спаривания оснований, в определенных условиях гибридизации.
Группировка, не подходящая для спаривания оснований, введенная в 5'-концевую часть, содержит предпочтительно 1-10, более предпочтительно 1-5, еще более предпочтительно 1-2 группировки. Ряд группировок, не подходящих для спаривания оснований, могут быть расположены в 5'-концевой части непрерывно или через промежутки. Предпочтительно группировка, не подходящая для спаривания оснований, содержит 2-5 следующих друг за другом группировок.
Предпочтительно группировка, не подходящая для спаривания оснований, представляет собой не подходящее для спаривания оснований химическое соединение.
Согласно предпочтительному воплощению сайт распознавания нуклеотидной вариации и группировка, не подходящая для спаривания оснований, локализованы в РТО в пределах 10 нуклеотидов (более предпочтительно 8 нуклеотидов, 7 нуклеотидов, 6 нуклеотидов, 5 нуклеотидов, 4 нуклеотидов, 3 нуклеотидов, 2 нуклеотидов или 1 нуклеотида, более предпочтительно 1 нуклеотида) от 5'-конца 3'-концевого узнающего мишень участка.
Альтернативно, реакция расщепления может быть выполнена только в первом начальном сайте расщепления, но не во втором начальном сайте расщепления. Например, если используется располагающийся против хода транскрипции зонд и реакция расщепления происходит в сайте, находящемся в стороне от места локализации этого зонда, то реакция расщепления может происходить только в первом начальном сайте расщепления в том случае, когда РТО гибридизуется с сопоставимой матрицей. Когда РТО гибридизуется с несопоставимой матрицей, сайт ветвления (второй начальный сайт расщепления) не может быть подвергнут расщеплению ввиду большого расстояния от располагающегося против хода транскрипции зонда.
Согласно предпочтительному воплощению, если РТО гибридизуется с несопоставимой матрицей, то второй начальный сайт расщепления содержит начальный сайт двойной цепи (т.е. сайт ветвления) в структурах, включающих одиночную цепь и двойную цепь.
Согласно одному из воплощений РТО имеет блокирующий участок, содержащий в качестве блокатора по меньшей мере один нуклеотид, устойчивый к расщеплению ферментом, обладающим 5'-нуклеазной активностью, и этот блокирующий участок расположен во втором начальном сайте расщепления. Блокирующий участок предотвращает расщепление во втором начальном сайте расщепления и последующие расщепления.
Число блокаторов, содержащихся в блокирующем участке, может быть неограниченным, предпочтительно 1-10, более предпочтительно 2-10, еще более предпочтительно 3-8, наиболее предпочтительно 3-6 блокаторов. Блокаторы, присутствующие в зондах, могут быть расположены непрерывно или через промежутки, предпочтительно непрерывно. Нуклеотиды, служащие в качестве блокаторов, имеющие остов, устойчивый к 5'→3'-экзонуклеазной активности, включают любые нуклеотиды, известные специалисту в данной области. Например, они содержат различные фосфотиоатные связи, фосфонатные связи, фосфоамидатные связи и модификации по положению 2' углеводной части. Согласно более предпочтительному воплощению нуклеотиды, имеющие остов, устойчивый к 5'→3'-экзонуклеазе, содержат фосфотиоатную связь, алкилфосфотриэфирную связь, арилфосфотриэфирную связь, алкилфосфонатную связь, арилфосфонатную связь, гидрофосфонатную связь, алкилфосфоамидатную связь, арилфосфоамидатную связь, фосфоселенатную связь, модификацию 2'-0-аминопропил, модификацию 2'-O-алкил, модификацию 2'-O-аллил, модификацию 2'-O-бутил, α-аномерный олигодезоксинуклеотид и модификацию 1-(4'-тио-β-D-рибофуранозил).
Стадия (с). Гибридизация фрагмента, высвободившегося из РТО, с СТО
Фрагмент, высвободившийся из РТО, гибридизуется с СТО (захватывающим и матричным олигонуклеотидом).
Первый фрагмент и второй фрагмент в большинстве случаев содержат последовательность, способную к гибридизации с захватывающим участком СТО, и поэтому один из них гибридизуется с СТО.
Второй фрагмент, образующийся при гибридизации с несопоставимой матрицей, содержит дополнительный 3'-концевой участок в отличие от первого фрагмента, образующегося при гибридизации с сопоставимой матрицей.
Согласно предпочтительному воплощению СТО имеет последовательность, выбранную такой, что СТО не гибридизуется с дополнительным 3'-концевым участком второго фрагмента, предотвращая удлинение второго фрагмента при его гибридизации с захватывающим участком СТО. Например, последовательность СТО можно выбрать такой, что СТО будет иметь некомплементарный(е) нуклеотид(ы), располагающий(е)ся напротив дополнительного 3'-концевого участка второго фрагмента. Альтернативно, вместо некомплементарного нуклеотида можно использовать универсальные основания.
Первый начальный сайт расщепления (или второй начальный сайт расщепления) может быть не фиксированным, а скорее разным в зависимости от условий. Например, начальные сайты расщепления могут располагаться в направлении 5'→3' относительно начального нуклеотида двойной цепи (т.е. сайта ветвления) в структурах, включающих одиночную цепь и двойную цепь, и на расстоянии 1-2 нуклеотидов от начального нуклеотида. В этом случае предпочтительно, чтобы последовательность СТО была выбрана такой, чтобы самый короткий фрагмент, высвободившийся в результате первого начального расщепления, избирательно удлинялся согласно настоящему изобретению с образованием удлиненной цепи, указывающей на присутствие нуклеотидной вариации.
Стадия (d). Удлинение фрагмента
Когда первый фрагмент гибридизуется с захватывающим участком СТО, он удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО. Когда второй фрагмент гибридизуется с захватывающим участком СТО, он не удлиняется.
Как правило, удлинение праймеров можно регулировать посредством гибридизации 3'-концевой части праймеров и матрицы. Благодаря подбору последовательностей праймеров и реакционных условий (например, температуры отжига), удлинение праймеров, имеющих в своей 3'-концевой части 1-3 некомплементарных нуклеотида, является допустимым. Альтернативно, удлинение праймеров может быть допустимым, только когда они имеют последовательность, полностью комплементарную последовательностям-мишеням.
Согласно предпочтительному воплощению последовательность СТО выбрана такой, что избирательно удлиняется либо первый фрагмент, либо второй фрагмент.
Согласно предпочтительному воплощению удлинение фрагмента осуществляют в таких условиях, что даже тогда, когда имеет место одно ошибочное спаривание в 3'-концевой части фрагмента, удлинения не происходит.
Стадия (е). Генерирование сигнала посредством гибридизации удлиненной цепи и SO
После осуществления реакции удлинения удлиненная цепь гибридизуется с сигнальным олигонуклеотидом (SO). Получают сигнал, указывающий на присутствие нуклеотидной вариации, последовательность которой комплементарна сайту распознавания данного нуклеотида в РТО.
Подробности в отношении гибридизации между удлиненной цепью и SO, систем меток и генерирования сигнала будут описаны со ссылкой на указанные выше описания.
Стадия (f). Детекция сигнала
Окончательно, осуществляют детекцию детектируемого сигнала, полученного на стадии (е), при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеотидной вариации, последовательность которой комплементарна сайту распознавания данного нуклеотида в РТО.
Подробности осуществления детекции сигнала будут описаны со ссылкой на указанные выше описания.
Согласно одному из воплощений настоящее изобретение, предложенное для детекции нуклеотидной вариации, может быть осуществлено без использования располагающихся против хода транскрипции олигонуклеотидов. При этом используют ферменты, обладающие 5'-нуклеазной активностью, не зависящей от располагающегося против хода транскрипции олигонуклеотида. С учетом амплификации нуклеиновокислотных последовательностей-мишеней, реакционных условий и 5'-нуклеазной активности, настоящее изобретение предпочтительно осуществляют с использованием располагающихся против хода транскрипции олигонуклеотидов, более предпочтительно располагающихся против хода транскрипции праймеров.
Наборы для детекции мишени
В следующем аспекте данного изобретения предложен набор для детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), содержащий:
(a) зондирующий и метящий олигонуклеотид (РТО); при этом РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью;
(b) располагающийся против хода транскрипции олигонуклеотид, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; при этом располагающийся против хода транскрипции олигонуклеотид предшествует РТО; при этом располагающийся против хода транскрипции олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) захватывающий и матричный олигонуклеотид (СТО); при этом СТО содержит в направлении 3'→5'(1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс; и
(d) сигнальный олигонуклеотид (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью.
Поскольку набор по данному изобретению составлен для осуществления описанного выше способа детекции по настоящему изобретению, общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Согласно предпочтительному воплощению по меньшей мере часть SO содержит последовательность, комплементарную удлиненной последовательности.
Согласно предпочтительному воплощению набор содержит (1) метку, соединенную с SO, (2) комбинацию метки, соединенной с SO, и метки, соединенной с фрагментом РТО, (3) комбинацию метки, соединенной с SO, и метки, встраиваемой в удлиненную цепь, или (4) комбинацию метки, соединенной с SO, и интеркалирующего красителя.
Согласно предпочтительному воплощению, SO помечен с использованием системы двух взаимодействующих меток, содержащей репортерную молекулу и молекулу-гаситель.
Согласно предпочтительному воплощению SO помечен одиночной меткой.
Согласно предпочтительному воплощению набор дополнительно включает в себя дополнительный SO, содержащий последовательность, комплементарную удлиненной цепи, при этом два SO гибридизуются с удлиненной цепью близко друг к другу, каждый из этих двух SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток.
Согласно предпочтительному воплощению SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, а фрагмент РТО содержит другую метку, выбранную из репортерной молекулы и молекулы-гасителя.
Согласно предпочтительному воплощению SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, а матричный участок СТО содержит нуклеотид, имеющий первое неприродное основание; при этом набор дополнительно содержит нуклеотид, имеющий как второе неприродное основание с аффинностью специфического связывания с первым неприродным основанием, так и другую молекулу, выбранную из репортерной молекулы и молекулы-гасителя.
Согласно предпочтительному воплощению SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, и набор дополнительно содержит нуклеотид, имеющий другую молекулу, выбранную из репортерной молекулы и молекулы-гасителя.
Согласно предпочтительному воплощению SO содержит акцептор FRET (резонансного переноса энергии флуоресценции), и набор дополнительно содержит интеркалирующий краситель.
Согласно предпочтительному воплощению РТО, СТО и/или SO блокирован по его 3'-концу, чтобы препятствовать его удлинению.
Согласно предпочтительному воплощению располагающийся против хода транскрипции олигонуклеотид представляет собой прямой праймер или располагающийся против хода транскрипции зонд.
Согласно предпочтительному воплощению набор дополнительно содержит фермент, обладающий 5'-нуклеазной активностью.
Согласно предпочтительному воплощению предложен набор для детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней; при этом располагающийся против хода транскрипции олигонуклеотид включает по меньшей мере два типа олигонуклеотидов, РТО включает по меньшей мере два типа РТО, СТО включает по меньшей мере два типа СТО, и SO включает по меньшей мере два типа SO.
Согласно предпочтительному воплощению набор дополнительно содержит обратный праймер.
Отличительные признаки и преимущества данного изобретения будут обобщены ниже.
(а) В настоящем изобретении для получения сигналов от мишеней не используют зонды, которые должны гибридизоваться с нуклеиновокислотными последовательностями-мишенями. Примечательно, что в настоящем изобретении применяют зонды (сигнальные олигонуклеотиды), которые должны гибридизоваться с удлиненной цепью, образованной зависящим от мишени образом, при котором удлиненная цепь синтезируется с использованием СТО, искусственно выбранного в качестве матриц. В настоящем изобретении сначала используют РТО для "зондирования" нуклеиновокислотных последовательностей-мишеней, а затем, во вторую очередь, SO для получения сигналов посредством гибридизации с зависящей от присутствия мишени удлиненной цепью, что способствует значительному повышению специфичности и гораздо большему удобству при определении реакционных условий ввиду возможности регулирования условий генерирования сигнала независимо от состава нуклеиновокислотных последовательностей-мишеней. Такие признаки создают условия для более легкого установления факта генерирования сигнала при одновременной детекции множественных мишеней в разнообразных клинических образцах и для предотвращения получения ложноположительных сигналов.
(b) В традиционных технологиях, использующих зонды, которые должны гибридизоваться с нуклеиновокислотными последовательностями-мишенями, гибридизацию зондов с нуклеиновокислотными последовательностями-мишенями осуществляют в условиях конкуренции с последовательностями, комплементарными этим нуклеиновокислотным последовательностям-мишеням. Между тем, в настоящем изобретении можно провести амплификацию только удлиненной цепи с использованием регулируемого количества СТО в качестве матриц и, вследствие этого, гарантировать эффективную гибридизацию зондов, что дает возможность эффективного получения сигналов, указывающих на присутствие нуклеиновокислотных последовательностей-мишеней.
(c) В настоящем изобретении детекцию присутствия нуклеиновокислотных последовательностей-мишеней можно осуществлять в режиме реального времени или с использованием анализа плавления.
(d) Величину Тпл продукта гибридизации удлиненной цепи и SO можно регулировать последовательностью и/или длиной SO, и поэтому задавать произвольным образом. Благодаря использованию такого признака: (1) в настоящем изобретении можно осуществлять детекцию нуклеиновокислотных последовательностей-мишеней, выявляя ложноположительные сигналы, поскольку сигналы, генерированные при температурах, отличающихся от предварительно заданных величин Тпл, соответствуют ложноположительным сигналам; (2) произвольное задание величин Тпл продукта гибридизации становится более выгодным при множественной детекции по меньшей мере в случае двух нуклеиновокислотных последовательностей-мишеней.
(e) На величину Тпл в традиционном анализе кривой плавления гибрида, образованного зондом и нуклеиновокислотной последовательностью-мишенью, влияет вариабельность последовательности в этой нуклеиновокислотной последовательности-мишени. Однако наличие удлиненной цепи в настоящем изобретении обеспечивает постоянную величину Тпл независимо от вариабельности последовательности в нуклеиновокислотных последовательностях-мишенях, позволяя обеспечить исключительную точность в анализе кривой плавления.
(f) Следует отметить, что последовательности 5-концевого тегирующего участка РТО, СТО и SO могут быть выбраны без учета состава нуклеиновокислотных последовательностей-мишеней. Это позволяет предварительно конструировать пул последовательностей для 5'-концевого тегирующего участка РТО, СТО и SO. Несмотря на то, что 3'-концевой узнающий мишень участок РТО должен быть получен с учетом нуклеиновокислотных последовательностей-мишеней, СТО и SO можно получить стандартным образом без учета или сведений о нуклеиновокислотных последовательностях-мишенях.
(g) В настоящем изобретении для детекции мишени подходит большое количество традиционных меченых зондов.
(h) Когда продукты гибридизации удлиненных цепей и SO имеют разные величины Тпл, можно осуществить детекцию по меньшей мере двух нуклеиновокислотных последовательностей-мишеней посредством анализа кривой плавления даже с использованием системы меток, обеспечивающей получение сигналов с одинаковыми характеристиками флуоресценции. Данное преимущество позволяет не иметь ограничений, связанных с числом детектируемых флуоресцентных меток при множественной детекции в режиме реального времени.
Теперь настоящее изобретение будет описано более подробно в примерах. Специалистам в данной области техники будет очевидно, что эти примеры предназначены для более конкретного иллюстрирования, и объем настоящего изобретения, как он изложен в прилагаемой формуле изобретения, не ограничивается данными примерами.
ПРИМЕРЫ
ПРИМЕР 1. Оценка применимости анализа с гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО (PCE-SH)
Проводили оценку применимости нового анализа - анализа с гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО (PCE-SH), в отношении обнаружения нуклеиновокислотной последовательности-мишени при (1) детекции в режиме реального времени при предварительно заданной температуре или (2) посредством анализа плавления (см. Фиг. 2).
Для удлинения прямого праймера, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью.
РТО и СТО не содержат никакой метки. РТО и СТО блокированы углеродным спейсером по своим 3'-концам. В качестве матрицы-мишени использовали синтетический олигонуклеотид для гена Neisseria gonorrhoeae (NG). Сигнальный олигонуклеотид (SO) имеет флуоресцентную репортерную молекулу (CAL Fluor Red 610) на своем 5'-конце и имеет молекулу-гаситель (BHQ-2) на своем 3'-конце.
Последовательности синтетической матрицы, прямого праймера, РТО, СТО и SO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой тегирующий участок РТО).
1-1. Детекция в режиме реального времени при предварительно заданной температуре
Реакцию проводили в конечном объеме 20 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1) для гена NG, 10 пмоль прямого праймера (SEQ ID NO: 2), 5 пмоль РТО (SEQ ID NO: 3), 0,5 пмоль СТО (SEQ ID NO: 4), 0,5 пмоль SO (SEQ ID NO: 5) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Tag ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 30 циклам по 30 с при 95°С, 60 с при 60°С и 30 с при 72°С. Детекцию генерированного сигнала осуществляли на стадии гибридизации (60°С) каждого цикла. Температуру детекции определяли таким образом, чтобы гибрид "удлиненная цепь-SO" сохранял двухцепочечную форму.
Как показано на Фиг. 10А, флуоресцентный сигнал детектировали в присутствии матрицы. В отсутствие матрицы, РТО, СТО или SO никакого сигнала не детектировали.
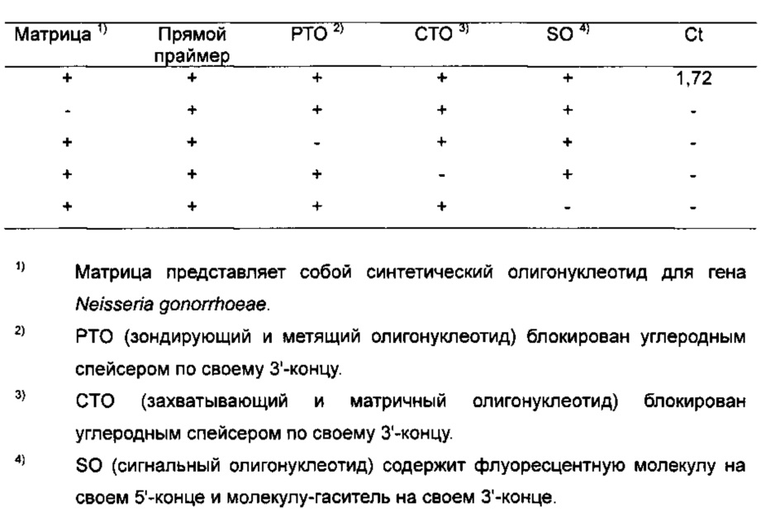
1-2. Анализ плавления
По окончании реакции в примере 1-1 получали кривую плавления, охлаждая реакционную смесь до 55°С, выдерживая при 55°С в течение 30 с и медленно нагревая от 55°С до 85°С. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации гибрида "удлиненная цепь-SO". Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг. 10 В, пик при температуре 68,5°С, соответствующей ожидаемой величине Тпл гибрида удлиненная цепь-SO, детектировали в присутствии матрицы. В отсутствие матрицы, РТО, СТО или SO никакого пика не детектировали.
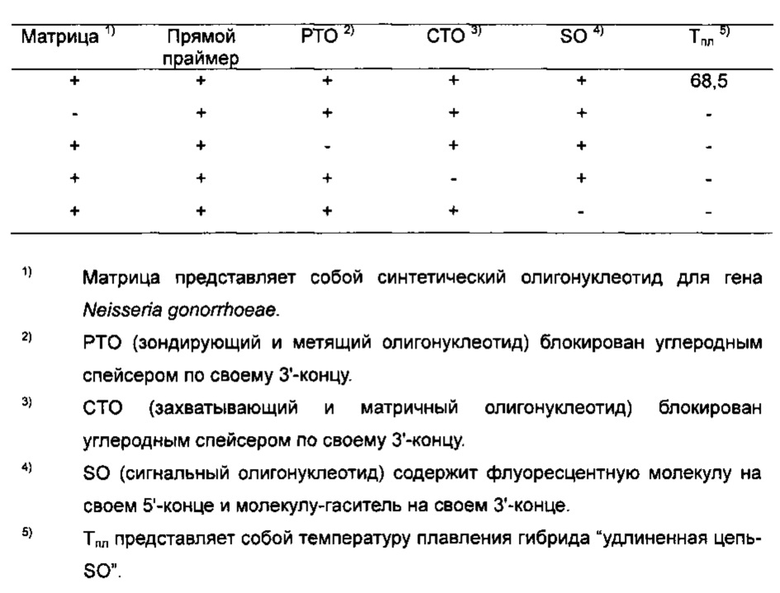
ПРИМЕР 2. Детекция нуклеиновокислотной последовательности-мишени с использованием PCE-SH-анализа
Далее авторы изобретения исследовали, можно ли посредством PCE-SH-анализа осуществлять детекцию нуклеиновокислотной последовательности-мишени (1) с использованием ПЦР в режиме реального времени или (2) с использованием пост-ПЦР-анализа плавления.
Для удлинения прямого праймера и обратного праймера, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью.
РТО и СТО не содержат никакой метки. РТО и СТО блокированы углеродным спейсером по своим 3'-концам. В качестве матрицы-мишени использовали геномную ДНК из гена NG. SO имеет флуоресцентную репортерную молекулу (CAL Fluor Red 610) на своем 5'-конце и имеет молекулу-гаситель (BHQ-2) на своем 3'-конце.
Последовательности прямого праймера, обратного праймера, РТО, СТО и SO, использованных в этом примере, представляют собой:


2-1. Детекция в режиме реального времени при предварительно заданной температуре в процессе ПЦР
Реакцию проводили в конечном объеме 20 мкл, содержащем 100 пг геномной ДНК из NG, 10 пмоль прямого праймера (SEQ ID NO: 2), 10 пмоль обратного праймера (SEQ ID NO: 6), 5 пмоль РТО (SEQ ID NO: 3), 0,5 пмоль СТО (SEQ ID NO: 4), 0,5 пмоль SO (SEQ ID NO: 5) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 50 циклам по 30 с при 95°С, 60 с при 60°С и 30 с при 72°С. Детекцию сигнала осуществляли на стадии гибридизации (60°С) каждого цикла. Температуру детекции определяли таким образом, чтобы гибрид удлиненная цепь-SO сохранял двухцепочечную форму.
Как показано на Фиг. 11А, флуоресцентный сигнал (Ct (cycle threshold - порог насыщения реакции): 30,34) детектировали в присутствии матрицы. В отсутствие матрицы никакого сигнала не детектировали.


2-2. Пост-ПЦР-анализ плавления
По окончании реакции в примере 2-1 получали кривую плавления, охлаждая реакционную смесь до 55°С, выдерживая при 55°С в течение 30 с и медленно нагревая от 55°С до 85°С. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации гибрида "удлиненная цепь-SO". Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг. 11В, пик при температуре 68,5°С, соответствующей ожидаемой величине Тпл гибрида "удлиненная цепь-SO", детектировали в присутствии матрицы. В отсутствие матрицы никакого пика не детектировали.

ПРИМЕР 3. Распознавание однонуклеотидной вариации в нуклеиновокислотной последовательности-мишени с использованием PCE-SH
Далее авторы изобретения исследовали, можно ли посредством PCE-SH-анализа разпознать однонуклеотидную вариацию в нуклеиновокислотной последовательности-мишени.
Для удлинения прямого праймера и обратного праймера, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью. РТО и СТО не содержат никакой метки. РТО и СТО блокированы углеродным спейсером по своим 3'-концам. В качестве нуклеиновых кислот-мишеней использовали геномные ДНК человека гена MTHFR дикого типа (С), гетеро-типа (С/Т) и мутантного типа (Т) с мутацией С677Т. SO имеет молекулу-гаситель (BHQ-2) на своем 5'-конце и имеет флуоресцентную репортерную молекулу (CAL Fluor Red 610) на своем 3'-конце.
Для детекции дикого типа использовали РТО-1 (SEQ ID NO: 9) и СТО-1 (SEQ ID NO: 11), а для детекции мутантного типа использовали РТО-2 (SEQ ID NO: 10) и СТО-2 (SEQ ID NO: 12). Когда присутствовал ген дикого типа, происходило образование удлиненной цепи (далее обозначаемой как "удлиненная цепь дикого типа") при использовании СТО-1 в качестве матрицы. В случае присутствия гена мутантного типа, происходило образование удлиненной цепи (далее обозначаемой как "удлиненная цепь мутантного типа") при использовании СТО-2 в качестве матрицы. При обнаружении продуктов гибридизации удлиненных цепей и SO посредством анализа плавления детекция двух типов удлиненных цепей может осуществляться по-разному даже с применением SO одного типа. Например, если удлиненные цепи сконструированы так, что они имеют разные последовательности на участке, который должен гибридизоваться с SO, то продукты гибридизации имеют различные значения Тпл, и это способствует дифференцированному обнаружению образования удлиненных цепей.
Последовательности прямого праймера, обратного праймера, РТО, СТО и SO, использованных в этом примере, представляют собой:


Реакцию проводили в конечном объеме 20 мкл, содержащем 30 нг человеческой геномной ДНК MTHFR дикого (С), гетеро- (С/Т) или мутантного (Т) типа (С677Т), 10 пмоль прямого праймера (SEQ ID NO: 7), 10 пмоль обратного праймера (SEQ ID NO: 8), по 5 пмоль каждого из РТО (SEQ ID NO: 9 и 10), по 0,1 пмоль каждого из СТО (SEQ ID NO: 11 и 12), 0,5 пмоль SO (SEQ ID NO: 13) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taqf ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 40 циклам по 30 с при 95°С, 60 с при 55°С и 30 с при 72°С. По окончании реакции получали кривую плавления, охлаждая реакционную смесь до 45°С, выдерживая при 45°С в течение 30 с и медленно нагревая от 45°С до 85°С. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации гибрида "удлиненная цепь-SO". Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг. 12, пик при температуре 71,0°С, соответствующей ожидаемой величине Тпл для гибрида "удлиненная цепь дикого типа-SO", детектировали в присутствии матрицы дикого типа. Пик при температуре 55,5°С, соответствующей ожидаемой величине Тпл для гибрида "удлиненная цепь мутантного типа-SO", детектировали в присутствии матрицы мутантного типа. Пик при 71,0°С (дикий тип) и пик при 55,5°С (мутантный тип) детектировали в присутствии матрицы гетеро-типа. В отсутствие матрицы любого из этих типов никакого пика не детектировали.
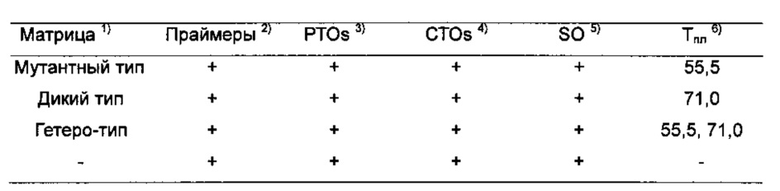

ПРИМЕР 4. Оценка применимости PCE-SH-анализа с Использованием расщепления РТО, не зависящего от располагающегося против хода транскрипции олигонуклеотида
Далее оценивали применимость PCE-SH-анализа для детекции нуклеиновокислотной последовательности-мишени без использования располагающегося против хода транскрипции олигонуклеотида посредством (1) детекции в режиме реального времени при предварительно заданной температуре или (2) посредством анализа плавления.
Для расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую б' -нуклеазной активностью.
РТО и СТО не содержат никакой метки. РТО и СТО блокированы углеродным спейсером по своим 3'-концам. В качестве матрицы-мишени использовали синтетический олигонуклеотид для гена Neisseria gonorrhoeae (NG). SO имеет флуоресцентную репортерную молекулу (CAL Fluor Red 610) на своем 5'-конце и имеет молекулу-гаситель (BHQ-2) на своем 3'-конце.
Последовательности синтетической матрицы, РТО, СТО и SO, использованных в этом примере, представляют собой:

4-1. Детекция в режиме реального времени при предварительно заданной температуре
Реакцию проводили в конечном объеме 20 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1) для гена NG, 5 пмоль РТО (SEQ ID NO: 3), 0,5 пмоль СТО (SEQ ID NO: 4), 0,5 пмоль SO (SEQ ID NO: 5) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 30 циклам по 30 с при 95°С, 60 с при 60°С и 30 с при 72°С. Детекцию генерированного сигнала осуществляли на стадии гибридизации (60°С) каждого цикла. Температуру детекции определяли таким образом, чтобы гибрид "удлиненная цепь-SO" сохранял двухцепочечную форму.
Как показано на Фиг. 13А, флуоресцентный сигнал детектировали в присутствии матрицы. В отсутствие матрицы никакого сигнала не детектировали.
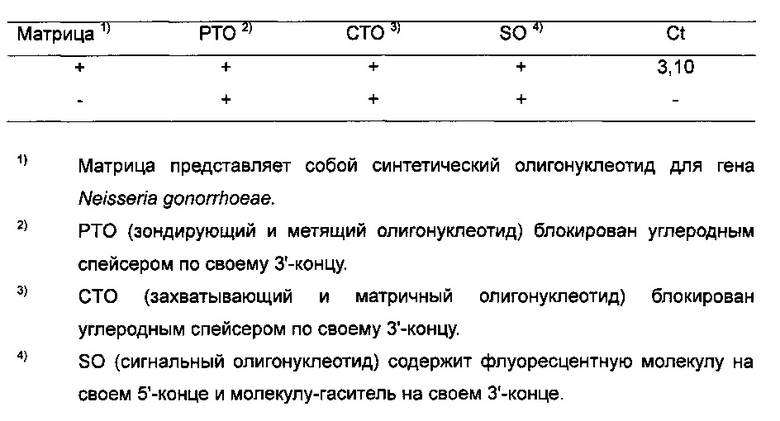
4-2. Анализ плавления
По окончании реакции в примере 4-1 получали кривую плавления, охлаждая реакционную смесь до 55°С, выдерживая при 55°С в течение 30 с и медленно нагревая от 55°С до 85°С. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации гибрида "удлиненная цепь-SO". Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг. 13В, пик при температуре 68,5°С, соответствующей ожидаемой величине Тпл гибрида "удлиненная цепь-SO", детектировали в присутствии матрицы. В отсутствие матрицы никакого пика не детектировали.

Основываясь на описании предпочтительного воплощения настоящего изобретения, следует понимать, что его варианты и модификации, соответствующие сущности изобретения, могут стать очевидными специалистам в данной области, и объем данного изобретения следует определять прилагаемой формулой изобретения и ее эквивалентами.




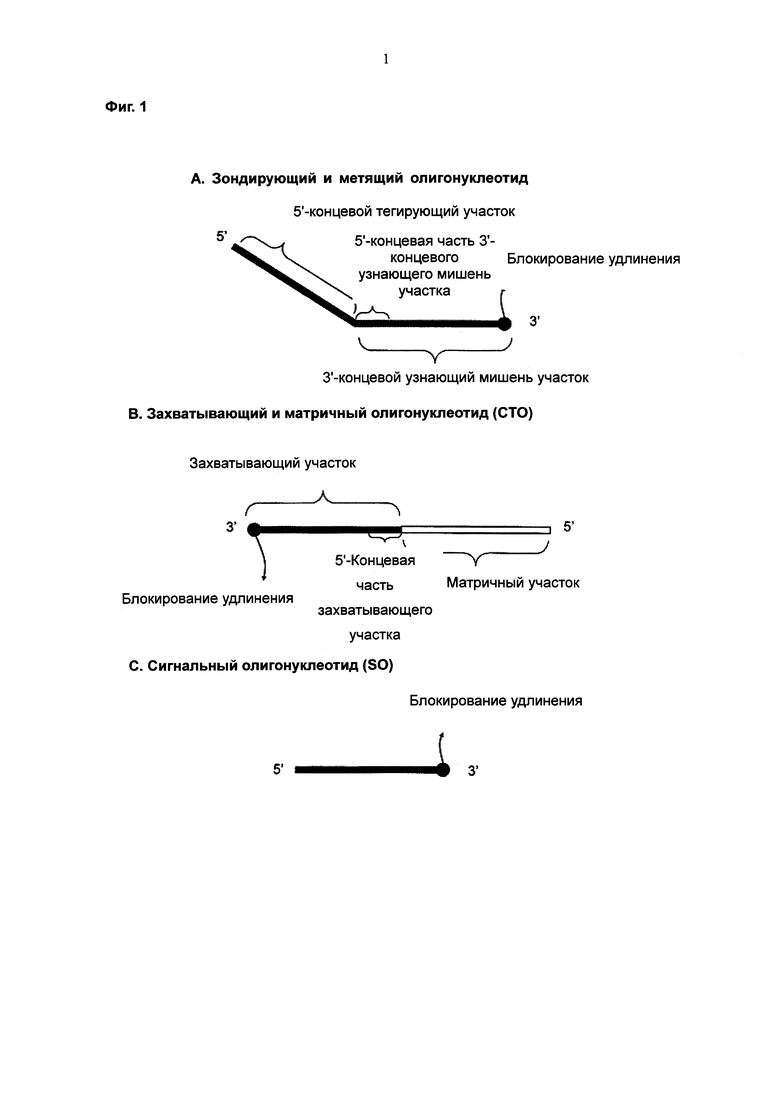
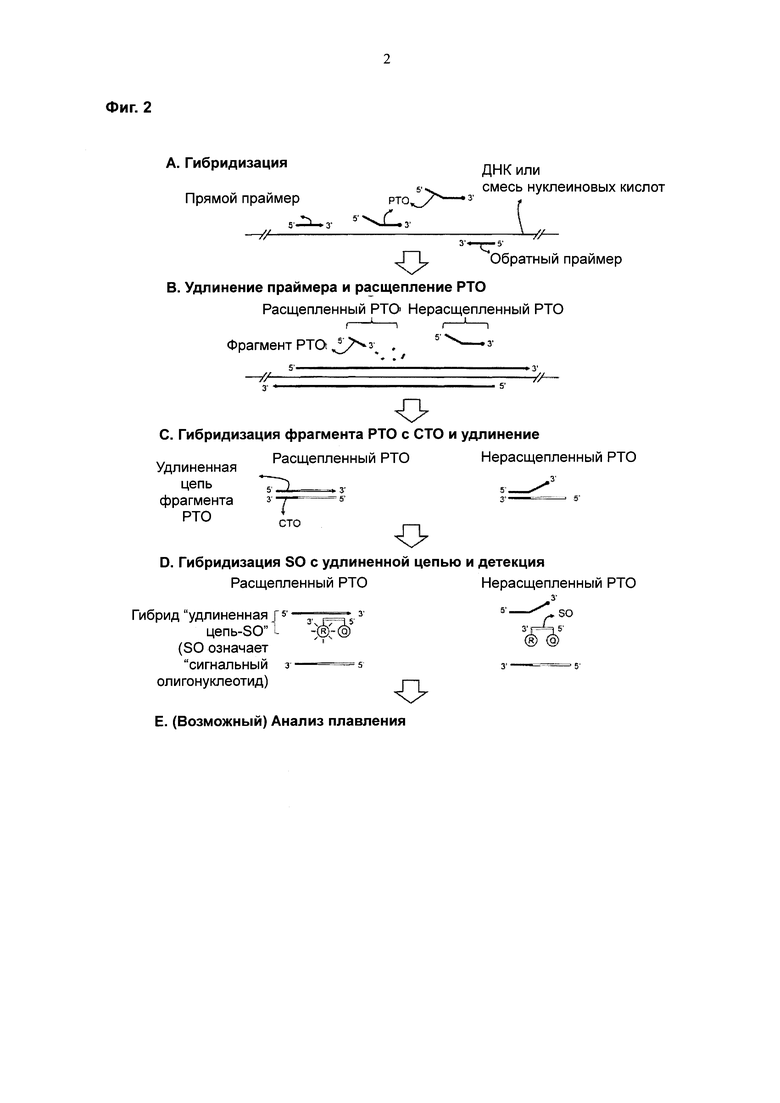
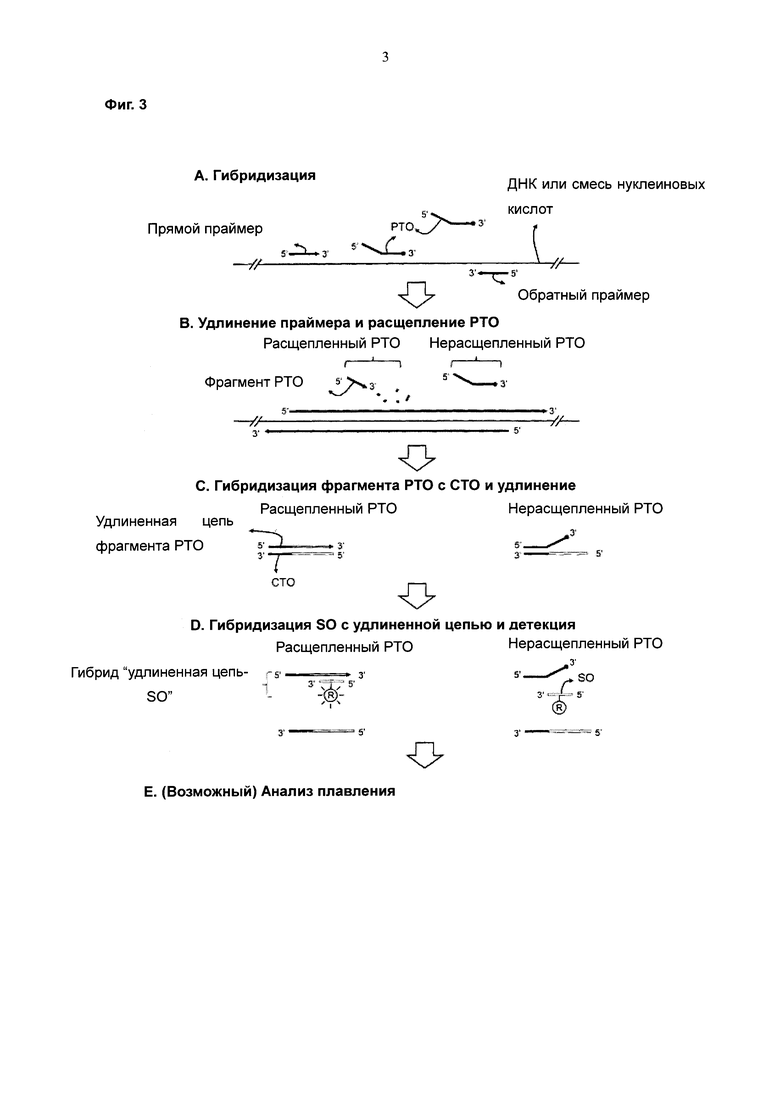
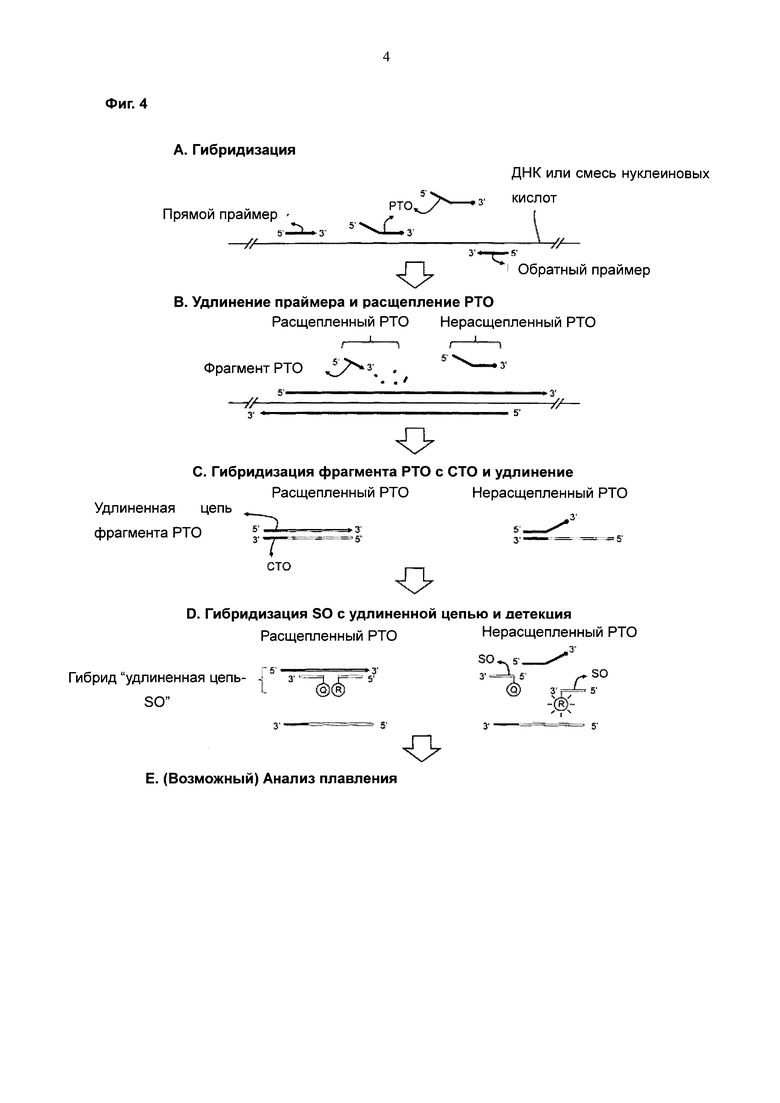
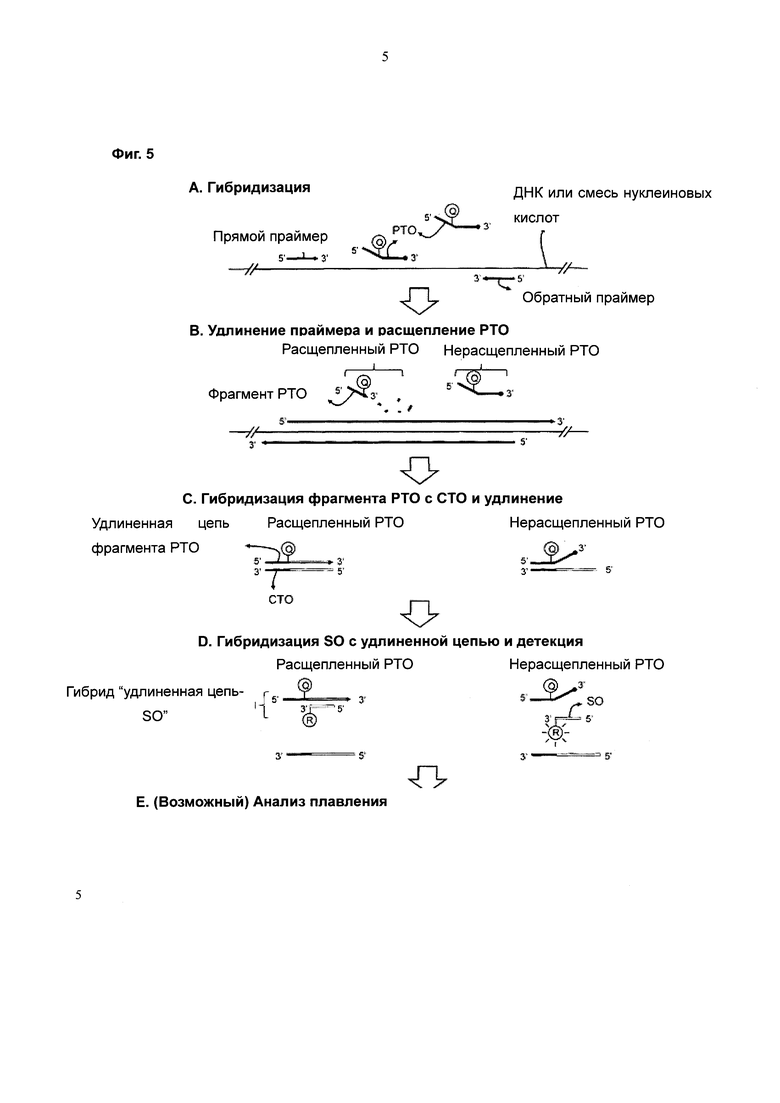
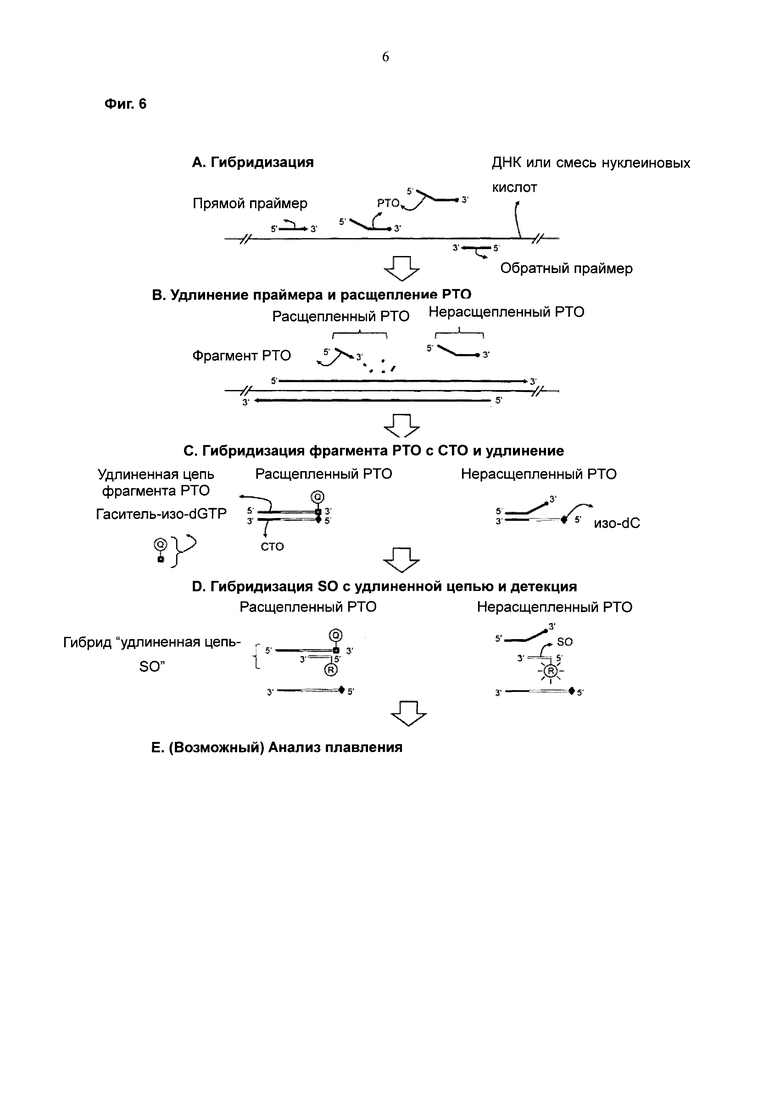
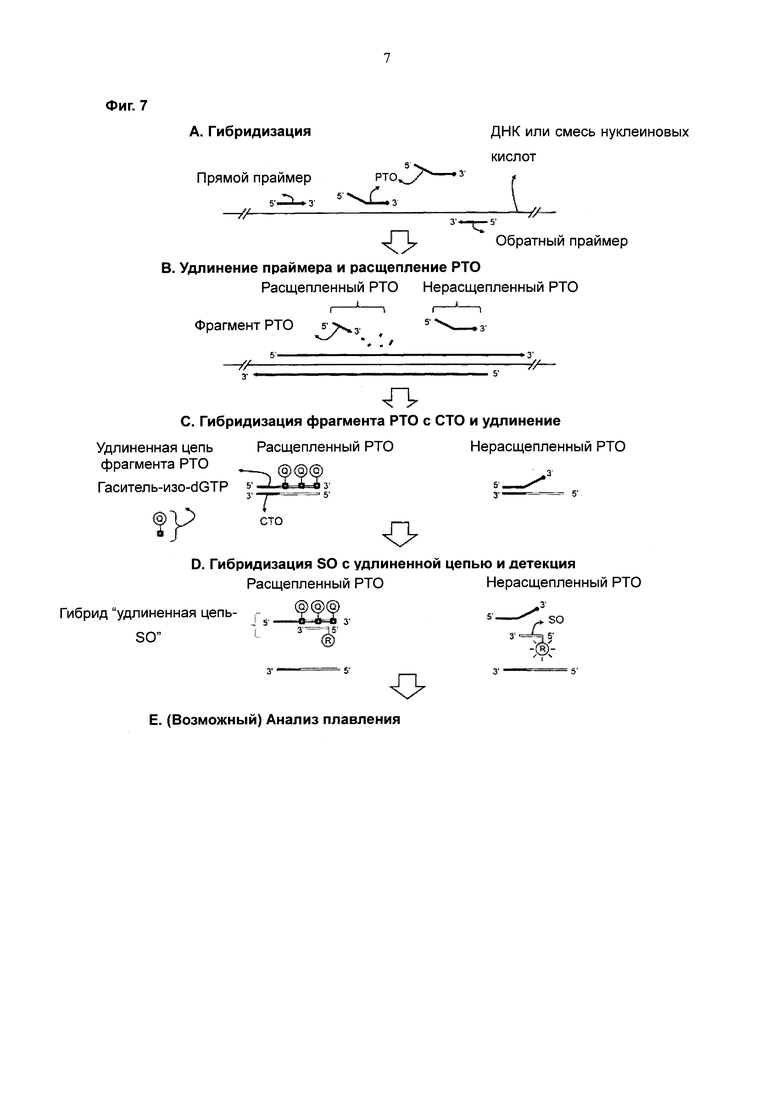
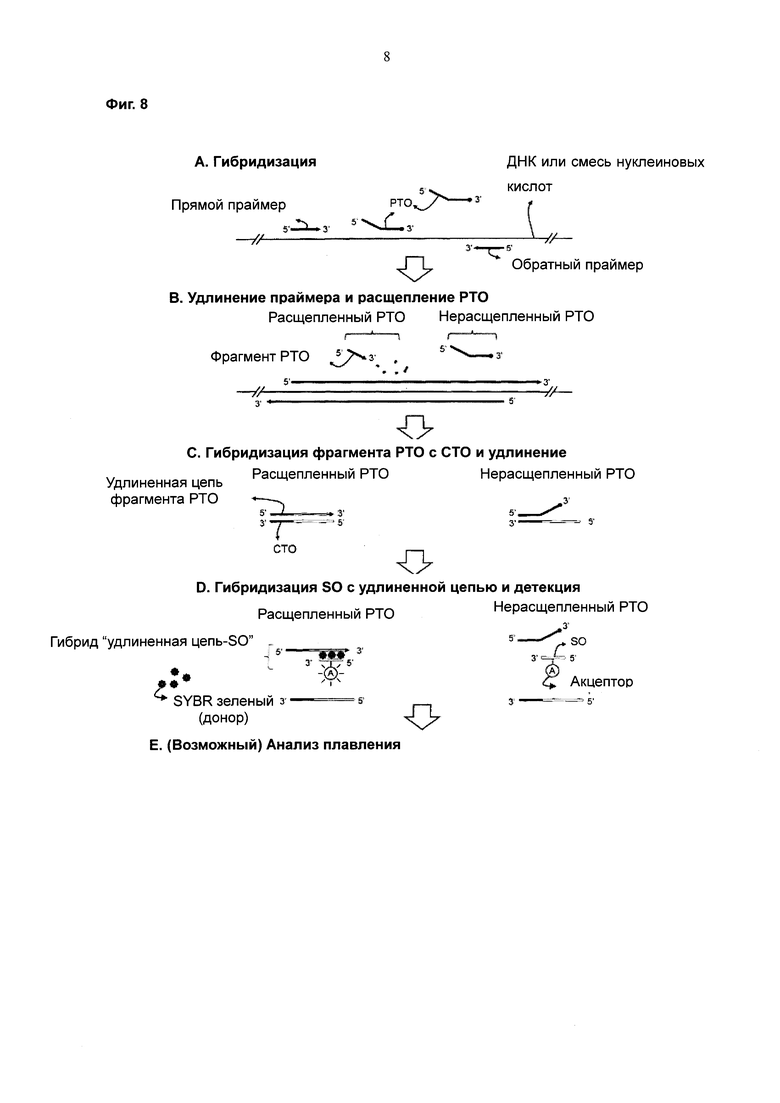
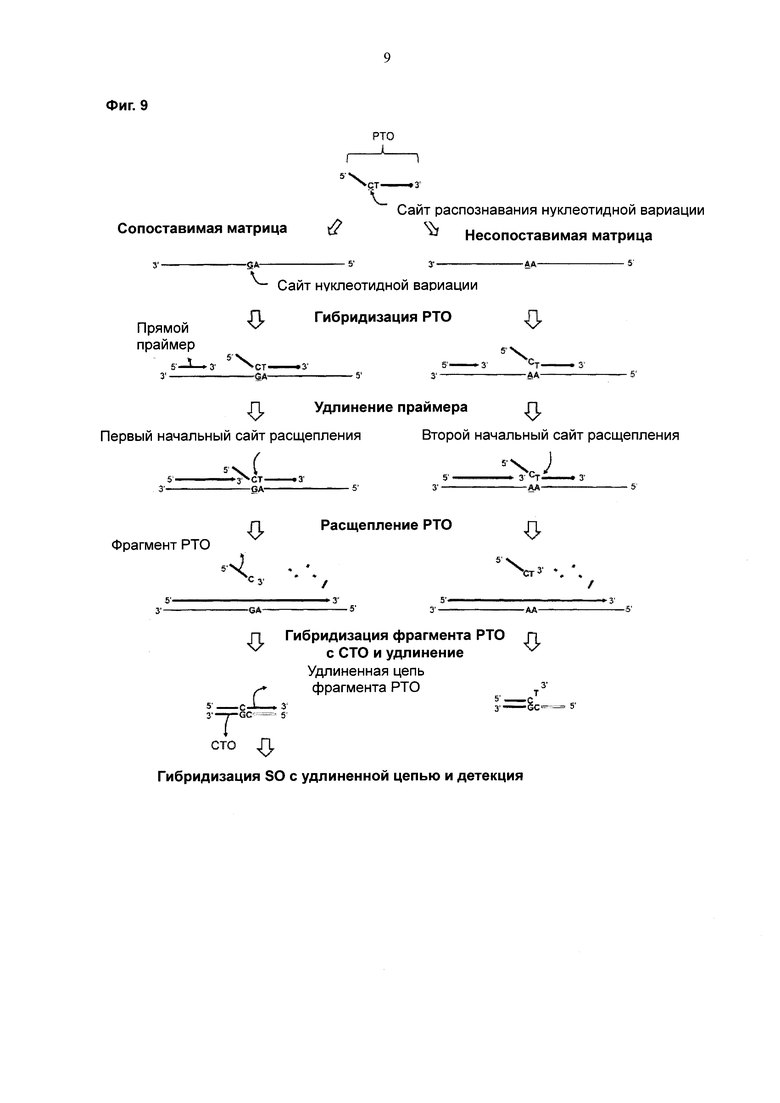
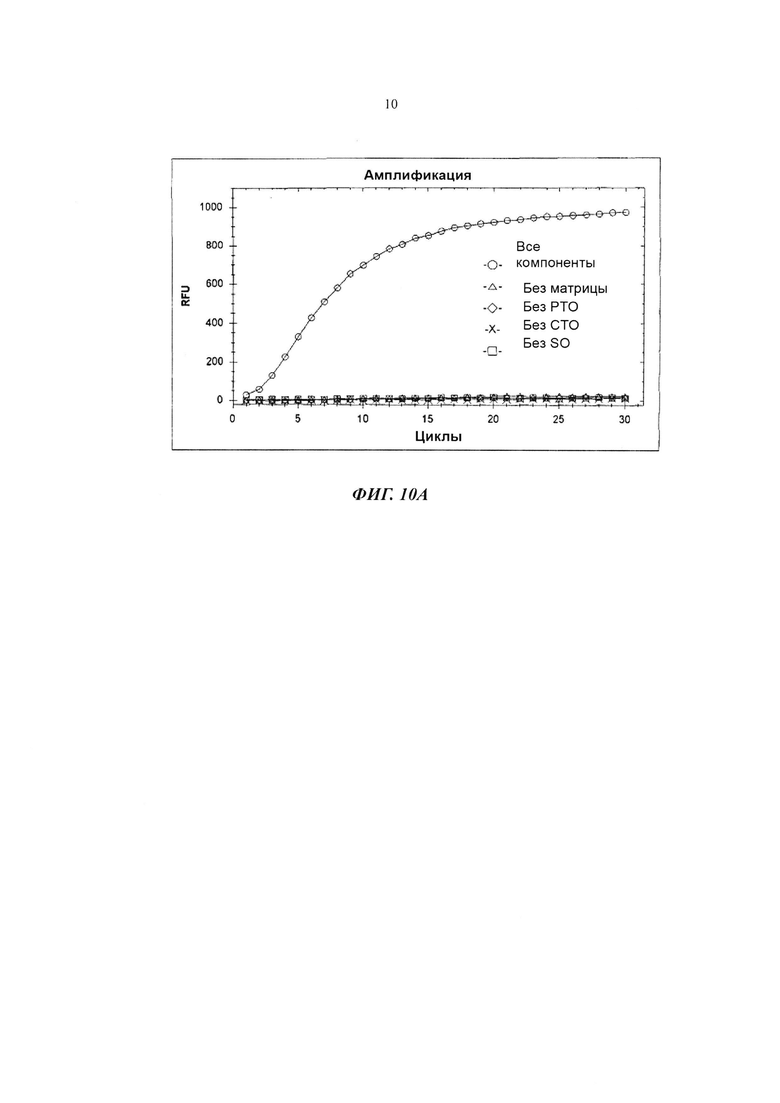
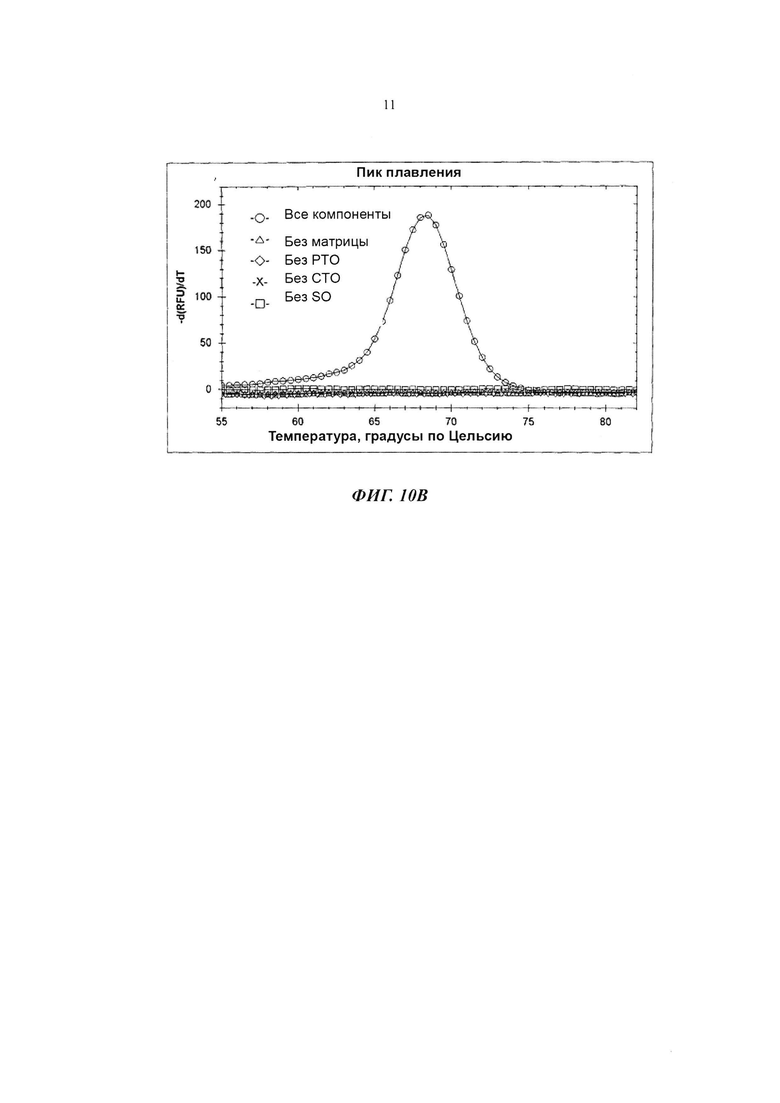
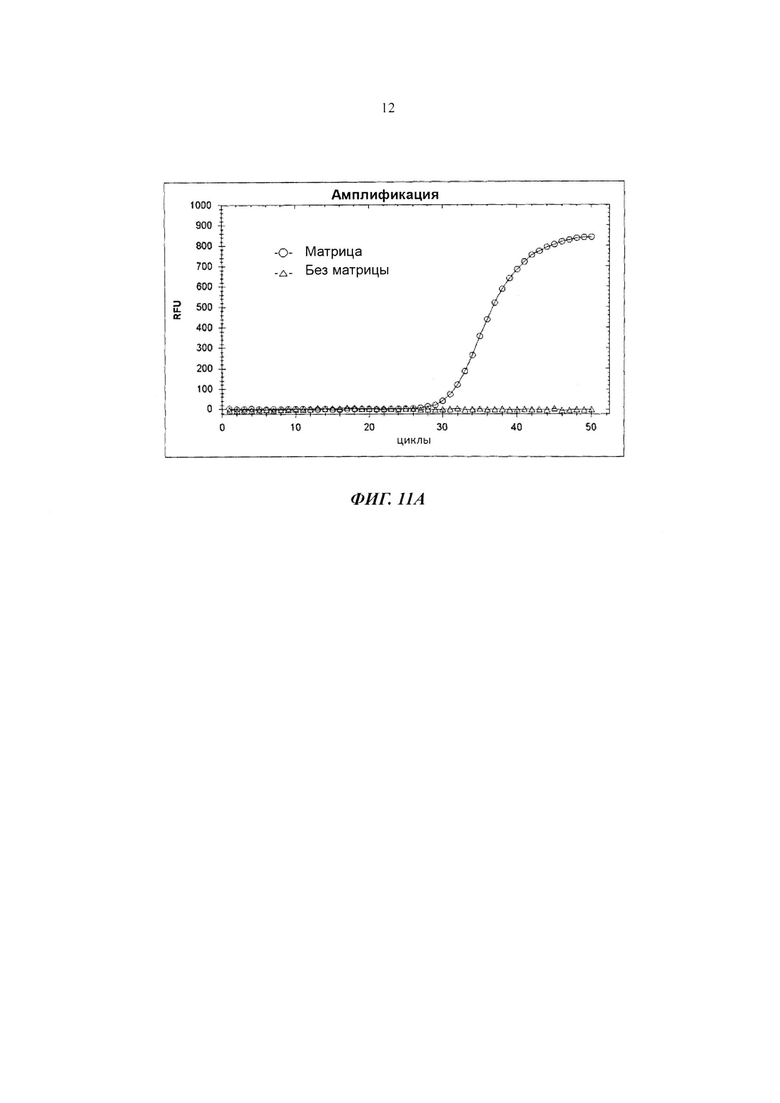
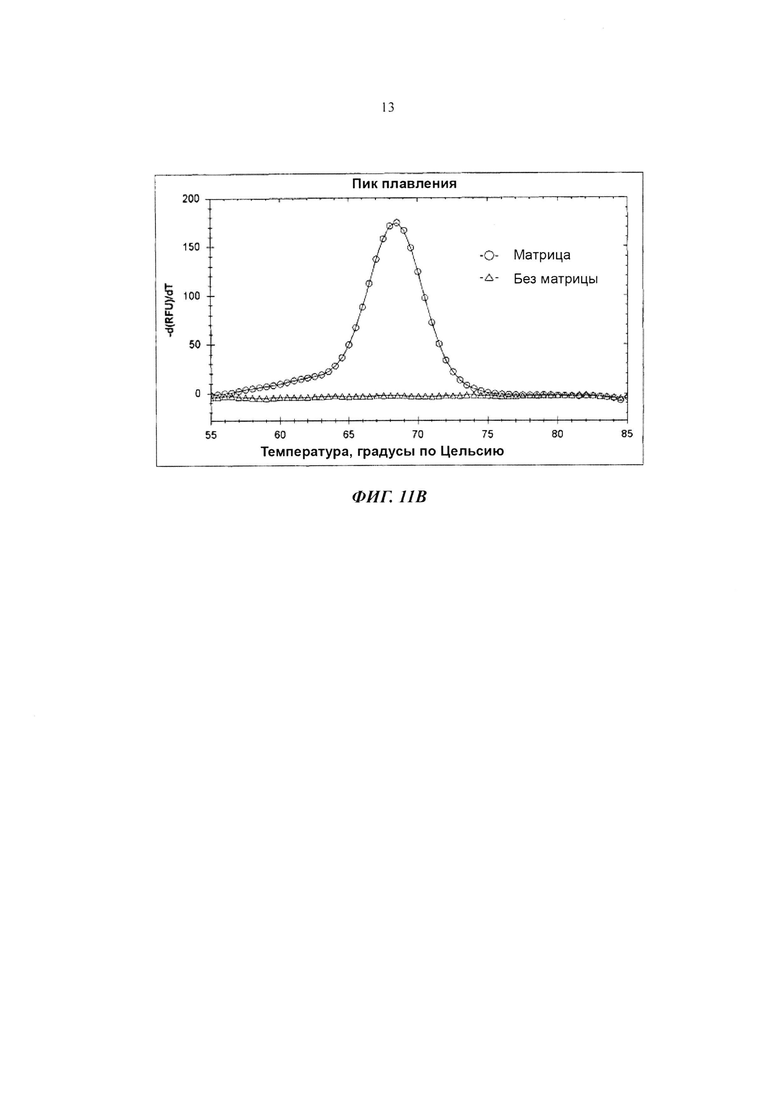
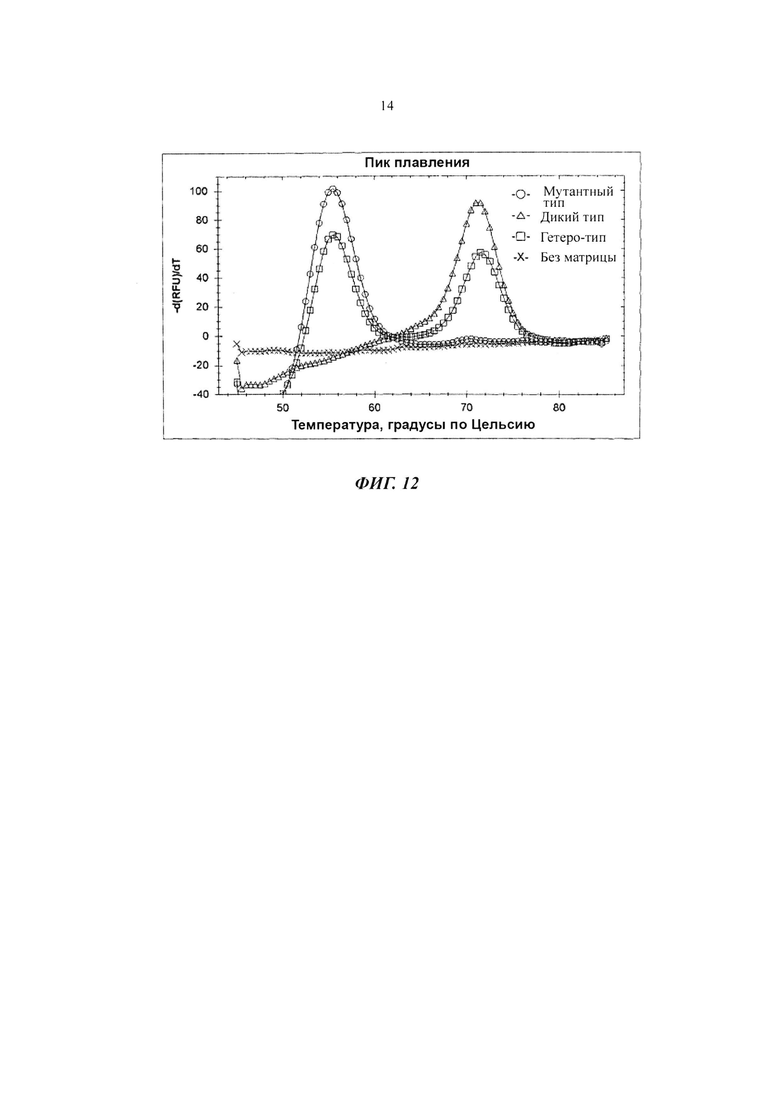
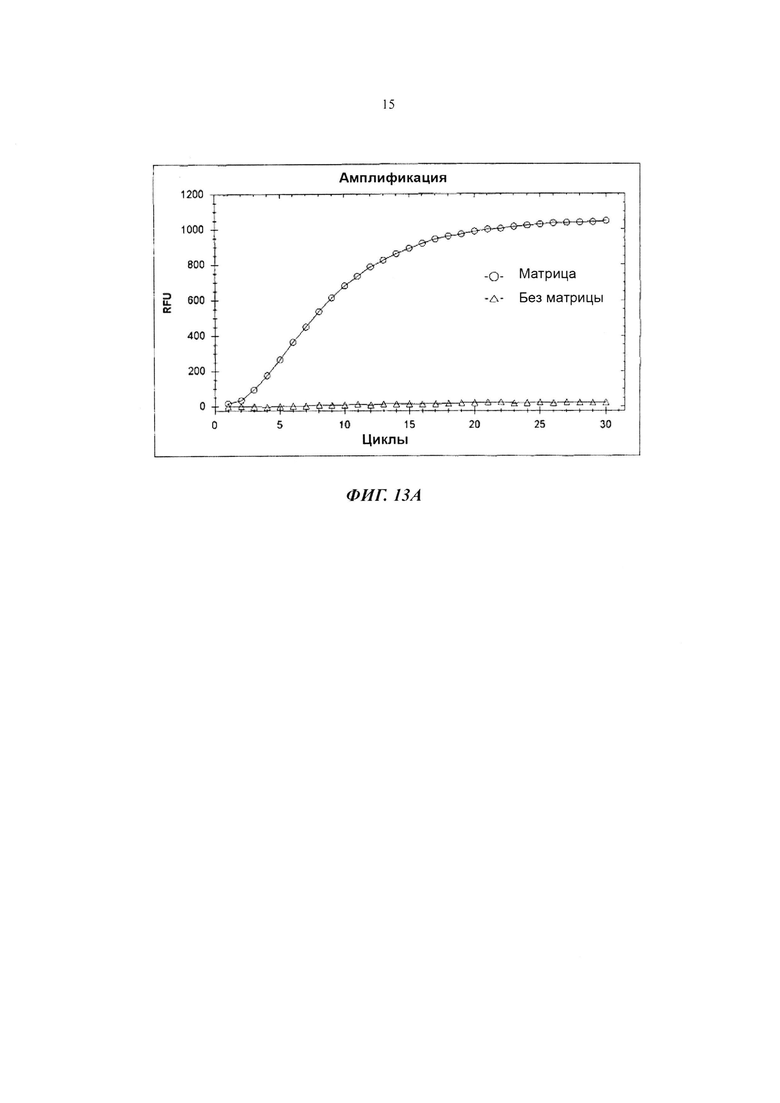
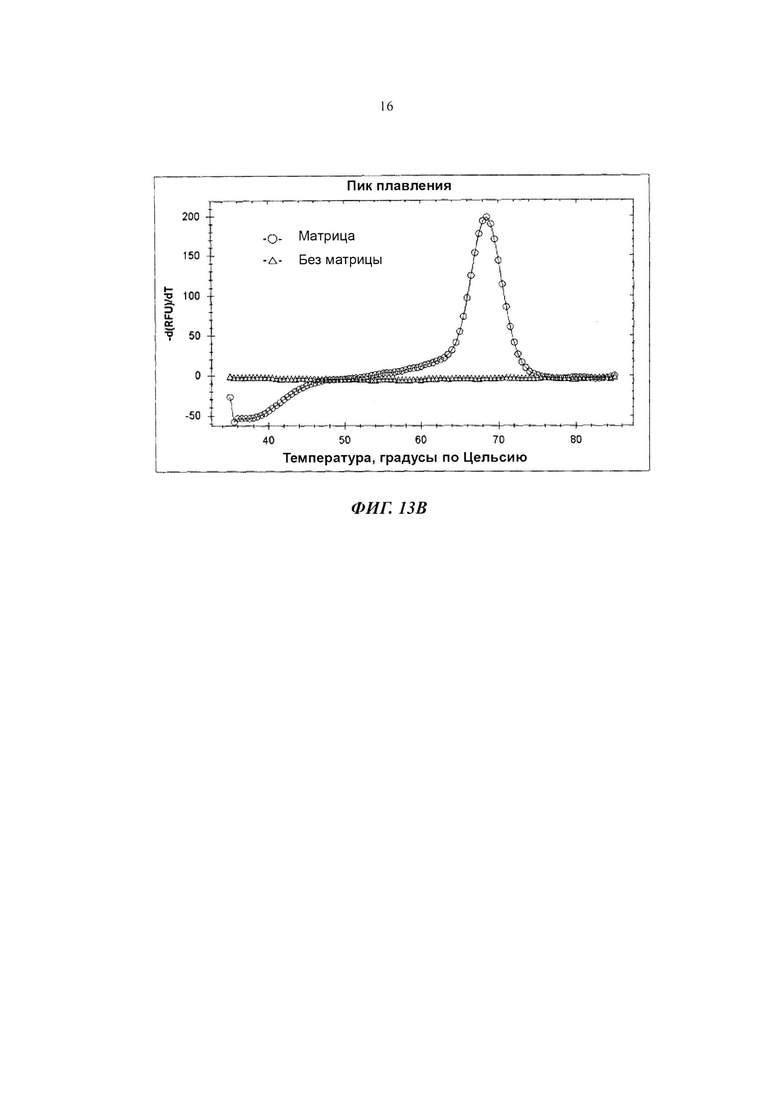
Группа изобретений относится к области биотехнологии, в частности к детекции нуклеиновокислотной последовательности-мишени в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения зондирующего и метящего олигонуклеотида (РТО)). Для получения сигналов от мишеней не используют зонды, которые должны гибридизоваться с нуклеиновокислотными последовательностями-мишенями. При этом применяют зонды (сигнальные олигонуклеотиды), которые должны гибридизоваться с удлиненной цепью, образованной зависящим от мишени образом, при котором удлиненная цепь синтезируется с использованием захватывающего и матричного олигонуклеотида (СТО), искусственно выбранного в качестве матриц. 3 н. и 28 з.п. ф-лы, 16 ил., 4 пр.
1. Способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
а) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся против хода транскрипции олигонуклеотидом и зондирующим и метящим олигонуклеотидом (РТО); при этом располагающийся против хода транскрипции олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной
последовательности-мишени; РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; причем располагающийся против хода транскрипции олигонуклеотид предшествует РТО;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом располагающийся против хода транскрипции олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс;
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
2. Способ по п. 1, где по меньшей мере часть SO содержит последовательность, комплементарную удлиненной последовательности.
3. Способ по п. 1, где детектируемый сигнал обеспечивается посредством (1) метки, соединенной с SO, (2) комбинации метки, соединенной с SO, и метки, соединенной с фрагментом РТО, (3) комбинации метки, соединенной с SO, и метки, встраиваемой в удлиненную цепь во время реакции удлинения на стадии (d), или (4) комбинации метки, соединенной с SO, и интеркалирующего красителя.
4. Способ по п. 1, где SO помечен с использованием системы двух взаимодействующих меток, содержащей репортерную молекулу и молекулу-гаситель, и гибридизация между SO и удлиненной цепью на стадии (е) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала.
5. Способ по п. 1, где SO помечен одиночной меткой, и гибридизация между SO и удлиненной цепью на стадии (е) индуцирует изменение сигнала от одиночной метки с получением детектируемого сигнала.
6. Способ по п. 5, где одиночная метка представляет собой одиночную флуоресцентную метку.
7. Способ по п. 1, в котором используют дополнительный SO, содержащий последовательность, комплементарную удлиненной цепи, два SO гибридизуются с удлиненной цепью близко друг к другу, каждый из этих двух SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток; и гибридизация между этими двумя SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала.
8. Способ по п. 1, где SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, фрагмент РТО содержит другую метку, выбранную из репортерной молекулы и молекулы-гасителя; удлиненная цепь содержит метку, происходящую из фрагмента РТО, и при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала.
9. Способ по п. 1, где SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, а матричный участок СТО содержит нуклеотид, имеющий первое неприродное основание; при этом реакцию удлинения на стадии (d) осуществляют в присутствии нуклеотида, имеющего как второе неприродное основание с аффинностью специфического связывания с первым неприродным основанием, так и другую молекулу, выбранную из репортерной молекулы и молекулы-гасителя, в результате чего происходит встраивание метки в удлиненную цепь; при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала.
10. Способ по п. 1, где SO содержит одну метку, выбранную из репортерной молекулы и молекулы-гасителя системы двух взаимодействующих меток, и реакцию удлинения на стадии (d) осуществляют в присутствии нуклеотида, имеющего другую метку, выбранную из репортерной молекулы и молекулы-гасителя, в результате чего происходит встраивание метки в удлиненную цепь; при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от системы двух взаимодействующих меток с получением детектируемого сигнала.
11. Способ по п. 1, где SO содержит акцептор FRET (резонансного переноса энергии флуоресценции), и гибридизацию на стадии (е) осуществляют в присутствии интеркалирующего красителя; при этом гибридизация между SO и удлиненной цепью индуцирует изменение сигнала от акцептора SO с получением детектируемого сигнала.
12. Способ по п. 1, где РТО, СТО и/или SO блокирован по его 3'-концу, чтобы препятствовать его удлинению.
13. Способ по п. 1, где располагающийся против хода транскрипции олигонуклеотид представляет собой прямой праймер или располагающийся против хода транскрипции зонд.
14. Способ по п. 1, где располагающийся против хода транскрипции олигонуклеотид локализован достаточно близко к РТО, чтобы индуцировать расщепление РТО ферментом, обладающим 5'-нуклеазной активностью.
15. Способ по п. 13, где прямой праймер индуцирует посредством своей удлиненной цепи расщепление РТО ферментом, обладающим 5'-нуклеазной активностью.
16. Способ по п. 1, где захватывающий участок СТО содержит в своей 5'-концевой части нуклеотидную последовательность, комплементарную части 3'-концевого узнающего мишень участка РТО.
17. Способ по п. 16, где длина нуклеотидной последовательности, комплементарной части 3'-концевого узнающего мишень участка РТО, составляет 1-10 нуклеотидов.
18. Способ по п. 1, дополнительно включающий между стадиями (е) и (f) стадию получения детектируемого сигнала посредством плавления продукта гибридизации со стадии (е) или посредством плавления и гибридизации продукта гибридизации со стадии (е); при этом стадию (f) осуществляют, детектируя сигнал с целью определения присутствия удлиненной цепи.
19. Способ по п. 1, дополнительно включающий после стадии (f) стадию получения и обнаружения детектируемого сигнала посредством плавления продукта гибридизации со стадии (е) или посредством плавления и гибридизации продукта гибридизации со стадии (е), при этом присутствие удлиненной цепи определяют более одного раза.
20. Способ по п. 18, где присутствие удлиненной цепи определяют с использованием анализа кривой плавления или анализа кривой гибридизации.
21. Способ по п. 1, дополнительно включающий стадию денатурации между стадиями (d) и (е).
22. Способ по п. 1, дополнительно включающий повторение всех или некоторых из стадий (a)-(f) с денатурацией между повторяющимися циклами.
23. Способ по п. 22, дополнительно включающий повторение стадий (а)-(е) с денатурацией между повторяющимися циклами и плавление продукта гибридизации со стадии (е) или плавление и гибридизацию продукта гибридизации со стадии (е) с получением детектируемого сигнала; при этом стадию (f) осуществляют, детектируя сигнал с целью определения присутствия удлиненной цепи.
24. Способ по п. 1, где стадии (a)-(f) осуществляют в реакционном сосуде или некоторые из стадий (a)-(f) осуществляют в отдельных реакционных сосудах.
25. Способ по п. 1, который осуществляют для детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней; при этом располагающийся против хода транскрипции олигонуклеотид включает по меньшей мере два типа олигонуклеотидов, РТО включает по меньшей мере два типа РТО, СТО включает по меньшей мере два типа СТО, и SO включает по меньшей мере два типа SO.
26. Способ по п. 1, где располагающийся против хода транскрипции олигонуклеотид на стадии (а) представляет собой прямой праймер, и на стадии (b) используют матричную полимеразу нуклеиновых кислот для удлинения прямого праймера.
27. Способ по п. 1, где нуклеиновокислотная последовательность-мишень содержит нуклеотидную вариацию.
28. Способ по любому из пп. 1-27, который осуществляют в присутствии обратного праймера.
29. Способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
(a) гибридизацию нуклеиновокислотной последовательности-мишени с парой праймеров, содержащей прямой праймер и обратный праймер, и РТО (зондирующим и метящим олигонуклеотидом); при этом каждый из праймеров, прямой праймер и обратный праймер, содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотным последовательностям-мишеням; РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; РТО локализован между прямым праймером и обратным праймером; при этом РТО блокирован по его 3'-концу, чтобы не допустить его удлинения;
(b) приведение в контакт продукта со стадии (а) с матричной полимеразой нуклеиновых кислот, обладающей 5'-нуклеазной активностью, в условиях, подходящих для удлинения праймеров и для расщепления РТО; при этом, когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, прямой праймер удлиняется, и удлиненная цепь индуцирует расщепление РТО матричной полимеразой нуклеиновых кислот, обладающей 5-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс;
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
30. Способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения РТО), включающий:
а) гибридизацию нуклеиновокислотной последовательности-мишени с зондирующим и метящим олигонуклеотидом (РТО); при этом РТО содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой тегирующий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом РТО расщепляется ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с захватывающим и матричным олигонуклеотидом (СТО); при этом СТО содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи, содержащей удлиненную последовательность, комплементарную матричному участку СТО, образуя тем самым удлиненный дуплекс;
(e) гибридизацию удлиненной цепи с сигнальным олигонуклеотидом (SO); при этом SO содержит последовательность, комплементарную этой удлиненной цепи, и по меньшей мере одну метку; SO обеспечивает получение детектируемого сигнала посредством гибридизации с удлиненной цепью; и
(f) детекцию сигнала; при этом детекция сигнала указывает на присутствие удлиненной цепи и присутствие нуклеиновокислотной последовательности-мишени.
31. Способ по п. 19, где присутствие удлиненной цепи определяют с использованием анализа кривой плавления или анализа кривой гибридизации.
| US 7381532 B2 03.06.2008 | |||
| WO 2011078441 A1 30.06.2011 | |||
| US 20080160535 A1 03.07.2008. |
Авторы
Даты
2017-01-18—Публикация
2012-07-03—Подача