Изобретение относится к медицине, в частности к коррекции гипоксических состояний. Такую коррекцию предлагается осуществлять с помощью применения известного препарата лактоферрина по новому назначению.
Проблема фармакологической коррекции гипоксических состояний в настоящее время относится к числу приоритетных. Актуальность применения антигипоксантов объясняется чрезвычайно широким распространением гипоксии, возникающей как в условиях дефицита кислорода во внешней среде, так и в результате самых разных патологических состояний, связанных с нарушением функций дыхательной, сердечно-сосудистой систем, а также транспортной функции крови. Во всех случаях, в конечном счете, возникает снижение доставки кислорода к тканям до уровня, недостаточного для поддержания функции, метаболизма и структуры клетки. Согласно современным представлениям гипоксические состояния возникают практически при любой патологии [Вестник РАМН, 1999, №3, с.18-25]. Начиная с 1993 года в руководстве «Лекарственные средства» антигипоксанты выделены в самостоятельную группу.
В настоящее время показано, что для предотвращения гипоксических состояний перспективными являются соединения со свойствами хелаторов, например производное кумарина под лабораторным шифром πQ226 [Вестн. Смоленск. Мед. Акад., 2000, №3, с.94-95].
С 70-х годов прошлого века лекарственное средство десферал (ДФО, N-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4оксобутанеол}амино)пентил]-N-гидроксисукцинамид, хелатор железа) применяется при отравлениях железом и алюминием, гемохроматозе у пациентов с определенными типами хронической анемии (талассемия и миелобластический синдром), которые требуют многократных трансфузий эритроцитов, что приводит к увеличению токсического железа в тканях. Кроме десферала, в настоящее время при подобных патологиях применяют коммерчески доступные синтетические фармакологические средства (хелаторы железа) - деферасирокс (ДФР) и деферипрон (ДФП) [Hematologica, 2004, v.89, №10, p.1187-1193].
Эффективность этих трех препаратов объясняется снижением уровня ферритина в крови у таких пациентов с врожденной хронической анемией, поскольку повышенный уровень ферритина является прогностическим признаком риска развития гемохроматоза. Однако синтетические препараты обладают рядом побочных эффектов, например ДФО приводит к задержке роста у детей, помутнению роговицы, слепоте и глухоте, препарат противопоказан при беременности и лактации [Справочник Видаль, 1995, с.418]. Для ДФП характерным побочным действием является агранулоцитоз, а ДФР вызывает тошноту, диарею и приводит к почечной дисфункции [Blood, 2006, v.91, №3, p.873-880].
С 1993 года известно, что ДФО является фармакологическим миметиком гипоксии, вызывая стабилизацию гипоксия-индуцибельного фактора-1 альфа (ГИФ-1а). ГИФ-1а является плейотропным транскрипционным фактором, постоянно синтезируемым в клетке и подвергающимся деградации при нормоксии и в отсутствие дефицита железа.
В случае гипоксии или дефицита железа инактивируются гидроксилазы - ферменты, гидроксилирующие ГИФ-1а по аминокислотным остаткам (пролин, аспарагин), что приводит к стабилизации ГИФ-1а за счет невозможности его дальнейшего убиквитинилирования и протеосомной деградации.
Таким образом, при гипоксии либо дефиците железа (в том числе, за счет действия хелатора железа ДФО [Blood, 1993, v.82, №12, p.3610-3615]) происходит стабилизация ГИФ-1а, который транспортируется в ядро, где образует гетеродимер с ГИФ-1бета и активирует транскрипцию более 200 генов, половина из которых отвечают за выживание клетки. К мишеням ГИФ-1а, являющегося ключевым регулятором патофизиологического ответа на стресс и гипоксию, относятся гены, участвующие в метаболизме железа (трансферрин и его рецептор, ферритин, церулоплазмин, гепсидин, гемоксигеназа), в ангиогенезе (ростовой фактор эндотелия - VEGF), в эритропоэзе (эритропоэтин), в вазодилатации (индуцибельная синтаза оксида азота), в пролиферации клеток (инсулиноподобный ростовой фактор - IGF2), в метаболизме глюкозы (транспортер глюкозы - Glut1,3), в регуляции pH (карбоновая ангидраза 9) и в онкосупрессии (р53, р21, р27) [Exp. Neorol. 2009, v.216, №1, p.7-15; Antioxidants and Redox Signaling, 2010, v.12, №4, p.445-458], т.е. гены, ответственные за множество процессов в организме.
Лекарства, стабилизирующие ГИФ-1а, являются перспективными как прекондиционирующие стимулы при лечении ишемии. Так, ДФО, который более 30 лет использовали для коррекции интоксикации железом и анемии, в настоящее время проходит клинические испытания при инсультах [Stroke, 2009, v.40, №3, p.90-91]. Известно также о нейропротекторных свойствах ДФО на животной модели болезни Альцгеймера [Eur. J. Neurosci., 2009, v.29, №7, p.1323-1334] и болезни Паркинсона [Ann. NY Acad. Sci., 2004, v.1012, p.306-325; Neourochem. Int., 2010, v.57, №3, p.198-205]. ДФО является эффективным прекондиционирующим соединением в моделях неонатального и взрослого инсульта.
Учитывая перечисленные выше защитные эффекты ГИФ-1a, применение лекарственных средств, вызывающих его стабилизацию за счет уменьшения пула железа, является перспективным для поддержания толерантности к ишемии и нейродегенерации [Transl. Stroke Res., 2010, v.3, №11, p.19-30]. Ингибиторы пролил-гидроксилаз, стабилизирующие ГИФ-1a, являются эффективными нефропротекторами на моделях цисплатиновой нефротоксичности, экспериментальном гломерулонефрите, диабетической нефропатии [J. Pharmacol. Sci., 2009, v.109, p.24-31].
Белок семейства трансферринов, лактоферрин (ЛФ), синтезируемый в апо-форме и обнаруживаемый в грудном молоке, в ряде экзокринных секретов и секреторных гранулах нейтрофильных лейкоцитов, характеризуется чрезвычайной полифункциональностью. В частности, ЛФ обладает свойствами антимикробного, транскрипционного, иммуномодулирующего, ростового и противоопухолевого факторов.
Отличительным свойством ЛФ среди других трансферринов является его высокая аффинность к ионам железа (Ка 1020 л/моль) и стабильность его железного комплекса в кислой среде вплоть до pH 3,0.
Однако до сих пор хелаторным свойствам ЛФ уделялось недостаточно внимания: способность секвестрировать ионы железа, необходимые для роста микроорганизмов, рассматривалась только в свете его бактерицидно-бактериостатических и антиоксидантных свойств (хелатируя железо, ЛФ препятствует реакциям Фентоновской химии - образованию гидроксильных радикалов, повреждающих все виды биомолекул).
Препараты, содержащие ЛФ, используют в медицинской практике, но по другому назначению. Так, инъекционный препарат "Лапрот" (регистрационное удостоверение от 15.12.2006, N ЛС-002374) используется в комплексной терапии полиорганной недостаточности различного генеза, гнойно-септических осложнений после оперативных вмешательств: 50 мг апоЛФ человека в/в в течение 5 дней (разрешение Федеральной службы по надзору в сфере здравоохранения и социального развития от 29.12.2007 N, ФС-2007/249). Тем не менее, в настоящее время нет четких представлений о механизмах плейотропного действия ЛФ.
Учитывая, что белки с антиоксидантыми свойствами могут быть эффективными антигипоксантами, например основной антиоксидант плазмы крови церулоплазмин [Экспер. Клин. Фарм., 2003, т.66, №3, с.62-65], авторы впервые провели серию опытов по изучению антигипоксических свойств ЛФ и выявили, что его апо-форма запускает механизм железозависимой стабилизации ГИФ-1а. Так, авторами продемонстрировано антигипоксическое действие апо-формы ЛФ (апоЛФ) у самок мышей C57Black (вес 20-25 г) на модели острой нормобарической гипоксии с гиперкапнией [Психофарм. и биол. наркология, 2005, т.5, №3, с.979-983], которую создавали помещением мышей в герметичный аптечный штанглаз емкостью 200 мл.
Высокоочищенный апоЛФ выделяли из грудного молока и вводили в/б в дозе 5 мг на мышь. Контрольным мышам вводили в/б физиологический раствор или альбумин в тех же дозах. Об устойчивости к гипоксии судили по времени, прошедшему до потери животными позы и появления первых признаков агонального дыхания. АпоЛФ в дозе 5 мг достоверно увеличивал время жизни до 140% (p<0.05), переводя 75% мышей из группы низкоустойчивых в группы средне- и высокоустойчивых к гипоксии животных.
Особого интереса заслуживали два факта: насыщенный железом ЛФ не оказывал подобного действия (см. Таблица 1), а максимальное протективное действие апо-формы ЛФ наступало через сутки после введения препарата. Это заставляет думать, что главный механизм предотвращения апоЛФ гипоксии заключается в его хелатирующих свойствах, вызывающих активацию неизвестных протективных генов. Эффективным антигипоксантом оказался хелатор железа и миметик гипоксии - ДФО (Таблица 1). Выбранные дозы апо-ЛФ и ДФО (по 5 мг на мышь) соответствуют эффективным дозам, препятствующим эндотоксимии, принятым в литературе [Innate Immun. 2010, v.16, №2, p.67-79].
Предположив, что хелаторные свойства ЛФ и его отсроченный (через 24 часа) антигипоксический эффект обеспечивают его активность как транскрипционного фактора, авторы обнаружили, что апо-ЛФ (5 мг/мышь внутрибрюшинно), так же как и фармакологический миметик гипоксии, синтетический хелатор железа ДФО (положительный контроль), вызывает стабилизацию ГИФ-1a у мышей и крыс в исследованных органах (печень, легкие, сердце, мозг и почки, по данным Вестерн-блоттинга с моноклональными антителами против ГИФ-1a, см. Таблица 2).
Особого интереса заслуживает тот факт, что месячные мышата, получавшие вместо воды грудное молоко (2 мг/мл апо-ЛФ) либо коровье молоко с добавкой апо-ЛФ, показали стабилизацию ГИФ-1a в исследованных органах (печень, легкие, сердце, мозг и почки, по данным Вестерн-блоттинга с моноклональными антителами против ГИФ-1a, см. Таблица 2) на 3 и 6 день такой диеты. В отличие от синтетических хелаторов железа (ДФО по литературным данным не проникает через мембрану клетки), ЛФ у взрослых крыс проникает через желудочно-кишечный тракт в кровоток через лимфатическую систему [Exp. Physiol., 2004, v.89, p.263-270] и гематоэнцефалический барьер [J. Vet. Med. Sci., 2008, v.70, №3, p.313-315] при пероральном введении. Тогда как эффект ДФО достигается только в случае внутривенных либо подкожных инъекций, а ДФП, применяемый в виде таблеток с 1987 года, малоэффективен при терапии талассемии по сравнению с ДФО [Ann. Hematol., 2006, v.85, №5, p.315-319].
Для препаратов ЛФ до сих пор не установлено токсических доз. При внутривенном введении препарата лактоферрина, известном на фармакологическом рынке как препарат «Лапрот», который обычно вводят курсами по 50 мг внутривенно, не было отмечено аллергических реакций в дозах до 100 мг. АпоЛФ коровы в виде таблеток используется за рубежом как антианемическое средство и онкосупрессор у онкологических больных и в профилактических целях при риске онкологии без обнаружения побочных эффектов. Известно о применении 200 мг ЛФ ежедневно в течение 3-х месяцев [Oncologist. 2010, v.15, №8, p.894-902] и до 3 г ЛФ в день в течение года [Cancer Prev. Res. (Phila), 2009. v.2, №11, 975-983] у онкологических больных.
Учитывая, что стабилизация ГИФ-1a приводит к активации адаптационных механизмов в клетках, представляется перспективным использовать препараты, содержащие лактоферрин человека, по новому назначению: для профилактики нейродегенеративных, ишемических и гипоксических состояний, а также при хронических заболеваниях почек. Препарат можно вводить интраназально и в виде таблеток. Благодаря тому что лактоферрин проникает через гематоэнцефалический барьер, а также в кровоток через желудочно-кишечный тракт, лактоферрин, содержащийся в препаратах, легко биодоступен.
Опыты по изучению устойчивости к гипоксии проводились на старых, низкоустойчивых к гипоксии 18-месячных мышах. При введении апо-ЛФ у данных животных была выявлена стабилизация ГИФ-1a и параллельно увеличивалось время жизни в условиях острой нормобарической гипоксии с гиперкапнией. Известно, что у старых мышей и крыс увеличена активность пролил-гидроксилаз, вызывающих дестабилизацию ГИФ-1a (Am. J. Physiol. Regul. Integr. Сотр. Physiol. 2009. V.297, 158-165). Такие животные являются низкоустойчивыми к гипоксии, не отвечающими стабилизацией ГИФ-1а и экспрессией его мишеней в ответ на гипоксический стимул. Однако миметик гипоксии (хлорид кобальта) способен стабилизировать ГИФ-1а у таких животных. Можно предложить апо-ЛФ как стабилизатор ГИФ-1а и эффективный прекондиционирующий стимул у людей пожилого возраста.
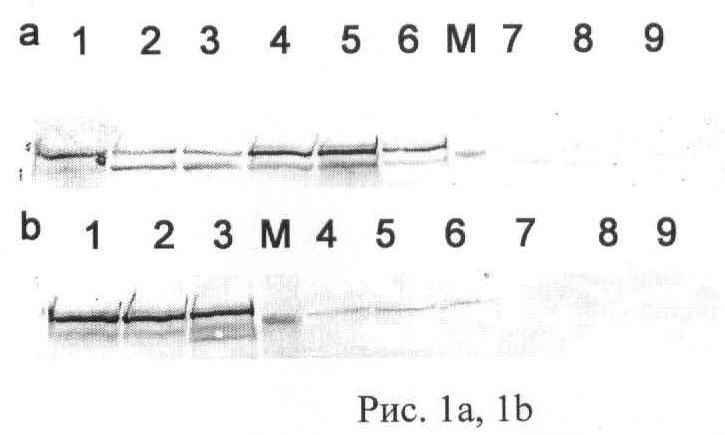
Введение апо-ЛФ вызывает не только стабилизацию ГИФ-1a (данные на Рис.1а по выявлению иммунореактивных зон Вестерн-блоттингом к ГИФ-1a в гомогенатах тканей мышей через 24 часа после в/б введения 5 мг апо-ЛФ на мышь - дорожки 1-3, дорожки 4-6 - положительный контроль после в/б введения 5 мг десферала на мышь, дорожки 7-9 - отрицательный контроль после в/б введения 200 мкл физиологического раствора, М - окрашенный маркер молекулярной массы (135 кДа): 1, 4, 7 - мозг, 2, 5, 8 - печень и 3, 6, 9 - почки), но и увеличение синтеза генов-мишеней данного транскрипционного фактора, эритропоэтина и церулоплазмина (данные на Рис.1b по выявлению иммунореактивных зон Вестерн-блоттингом к церулоплазмину в гомогенатах тканей мышей через 24 часа после введения апо-ЛФ - дорожки 1-3, дорожки 4-6 - положительный контроль после введения десферала, дорожки 7-9 - отрицательный контроль после введения физиологического раствора, М - окрашенный маркер молекулярной массы (135 кДа): 1, 4, 7 - мозг, 2, 5, 8 - печень и 3, 6, 9 - почки). Увеличение концентрации эритропоэтина в сыворотке крови мышей и крыс выявлено с помощью твердофазного иммуноферментного анализа. Увеличение содержания церулоплазмина в мозге, печени, сердце, легких и почках выявлено с помощью Вестерн-блоттинга с антителами к ЦП мыши. Оба белка отвечают за адаптацию к гипоксии и выживание нейронов при воспалении и нейродегенерации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ ГИПОКСИИ | 2003 |
|
RU2251432C2 |
| 3-(N,N-ДИМЕТИЛКАРБАМОИЛОКСИ)-2-ЭТИЛ-6-МЕТИЛПИРИДИНА СУКЦИНАТ, ОБЛАДАЮЩИЙ АНТИГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 1993 |
|
RU2095350C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ОРГАНИЗМА К ОСТРОЙ ГИПОКСИИ В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2517032C1 |
| Способ получения лактоферрина | 2018 |
|
RU2717340C1 |
| СРЕДСТВА, ОБЛАДАЮЩИЕ АНТИГИПОКСИЧЕСКИМИ СВОЙСТВАМИ | 2002 |
|
RU2232576C2 |
| АНТИГИПОКСИЧЕСКОЕ СРЕДСТВО | 2001 |
|
RU2213571C2 |
| СПОСОБ АДАПТАЦИИ ОРГАНИЗМА ЖИВОТНОГО К ХРОНИЧЕСКОЙ ГИПОБАРИЧЕСКОЙ ГИПОКСИИ В ЭКСПЕРИМЕНТЕ | 2022 |
|
RU2800891C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПЕРЕГРУЗКИ ОРГАНИЗМА ЖЕЛЕЗОМ ИЛИ ГЕМАХРОМАТОЗА | 2014 |
|
RU2557959C1 |
| АНТИГИПОКСИЧЕСКОЕ СРЕДСТВО | 2011 |
|
RU2472503C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ | 2001 |
|
RU2199337C1 |
Изобретение относится к медицине, в частности к применению апо-формы лактоферрина человека в качестве антигипоксанта и стабилизатора гипоксия-индуцибельного фактора-1 альфа. Изобретение обеспечивает использование природного хелатора железа лактоферрина, отсутствие токсичности, гипоаллергенность, способность проникать через кишечник в кровоток и через гематоэнцефалический барьер. 2 табл., 1 ил.
Применение апо-формы лактоферрина человека в качестве антигипоксанта и стабилизатора гипоксия-индуцибельного фактора-1 альфа.
| NORRBY K | |||
| Human apo-lactoferrin enhances angiogenesis mediated by vascular endothelial growth factor A in vivo | |||
| J | |||
| Vasc | |||
| Res | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| abstract, PMID: 15192265, найдено в PubMed | |||
| WANG GL et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2012-10-27—Публикация
2011-03-11—Подача