Изобретение относится к медицине, а именно к фармакологии.
Изобретение касается расширения арсенала антигипоксических средств, для лечения состояний, связанных с нарушением обеспечения органов и тканей кислородом, путем использования для этой цели N-изопропиламидов N-замещенных производных 2-аминоэтансульфокислоты, которые раньше были известны как соединения, проявляющие антиаритмическую и противоязвенную активность [1, 2].
Соединения проявляют антигипоксические свойства на различных моделях гипоксии, обладают низкой токсичностью.
Проведенный фармакологический анализ обнаружил соединения, проявляющие способность повышать устойчивость органов и тканей к гипоксии. Доклинические испытания препаратов позволяют рекомендовать их в качестве антигипоксантов для профилактики и лечения гипоксических состояний различной этиологии.
В настоящее время довольно хорошо известна симптоматика расстройств мозгового кровообращения, острого и хронического кислородного голодания и сопутствующие им изменения метаболизма мозга [3]. Расстройства деятельности мозга и других систем, связанные с гипоксией, наблюдаются не только при различных заболеваниях человека, но также имеют место и при осуществлении профессиональной деятельности, связанной с освоением водного, воздушного и космического пространства, а также с влиянием нарушенной экологии. Известно, что мозг очень чувствителен к пониженному содержанию кислорода. Снижение концентрации кислорода в крови в два раза приводит не только к существенному ухудшению памяти, обучаемости и работоспособности, ототоксическому действию, поражению сетчатки глаза, нарушению двигательной активности [4, 5]. При этом в первую очередь страдают нервные клетки гиппокампа, неокортекса и стриатума, которые принимают участие в регуляции и осуществлении моторного поведения млекопитающих [6].
Интенсивный поиск антигипоксантов - средств, коррегирующих кислороддефицитные состояния и повышающих устойчивость органов и тканей к гипоксии, остается актуальным и в настоящее время.
В свете современных представлений о ведущей роли биоэнергетических нарушений при гипоксии и фазности этого процесса антигипоксанты подразделяют по механизму действия на специфические и неспецифические [7].
К специфическим антигипоксантам относят вещества, способные в условиях гипоксии повышать активность энергосинтезирующих процессов, транспортно-дыхательной системы митохондрий, ферментов биологического окисления. Кроме того, эти препараты улучшают транспортную функцию крови по доставке кислорода к тканям, предотвращают или устраняют внутриклеточный ацидоз. К первой группе относят средства, применяемые при гипоксиях различного генеза, улучшающие дыхание в митохондриях (корректоры прямого энергетического обмена): олифен, витамин К3, лимонтар, мексидол, проксипин, убинон, цитохром С, (ГОМК) - гамма-оксимасляная кислота, препараты аспарагиновой кислоты.
К антигипоксантам неспецифического действия относят лекарственные препараты, увеличивающие доставку кислорода к тканям: сосудорасширяющие препараты; антиоксиданты; субстраты пуринового цикла; нейромедиаторные средства, модулирующие состояние энергетического обмена через рецепторы; вещества, увеличивающие образование простациклина в сосудистой стенке; ингибиторы каскада арахидоновой кислоты; ингибиторы ксантиноксидазы; блокаторы кальциевых каналов; β-адренолитики [8].
В качестве препаратов сравнения нами были использованы известные фармакологические вещества: антигипоксант специфического действия - гутимин, ноотропное средство - пирацетам, ксантинола никотинат, оказывающий сосудорасширяющее действие, и серосодержащее аминокислота - таурин.
Известно, что гутимин и его аналоги обладают широким спектром их защитного действия на различных моделях общей и органной гипоксии [9]. Препарат прошел доклинические испытания, промышленность его не выпускает.
Лечебные свойства пирацетама определяются его способностью улучшать интегративную деятельность мозга, способствовать консолидации памяти, улучшать процессы обучения, восстанавливать и стабилизировать нарушенные функции мозга. Применяют препарат при разных заболеваниях нервной системы, особенно связанных с сосудистыми нарушениями и патологией обменных процессов мозга. Однако, несмотря на большое значение ноотропных препаратов в регуляции ГАМКергических тормозных процессов в мозге, не исключается их действие на другие нейромедиаторные системы мозга, включая моноаминергические, глютаматергическую и др. Известно, что пирацетам усиливает синтез дофамина, повышает уровень норадреналина в мозге. Некоторые ноотропы повышают содержание в мозге серотонина. Препарат противопоказан при острой почечной недостаточности, диабете и наличии в анамнезе указаний на аллергические реакции [10].
Ксантинола никотинат сочетает свойства теофиллина и никотиновой кислоты. Препарат расширяет периферические сосуды, улучшает коллатеральное, мозговое кровообращение, уменьшает явления церебральной гипоксии. Препарат улучшает метаболические процессы в послеоперационном периоде после удаления опухолей мозга, ушибов мозга и др. Однако при приеме препарата имеются противопоказания, свойственные препаратам группы теофиллина и никотиновой кислоты: гиперфункция щитовидной железы, эпилептоидные припадки, острый инфаркт миокарда, сердечная недостаточность II-III степени, язвенная болезнь желудка и 12-перстной кишки и т.д. [10].
Известен препарат таурин, или тауфон (2-аминоэтансульфокислота), его биологическая роль сводится к модуляции нервных и биохимических процессов в ЦНС и в специализированных системах, а также регуляции мембранной возбудимости. Таурин препятствует повреждению внутриклеточных мембран внешними агентами, подавляет перекисное окисление липидов, стабилизирует мембранную проницаемость и транспорт ионов [11, 12]. Однако таурин обладает сравнительно невысокой фармакологической активностью и поэтому возникла потребность в поиске новых высокоэффективных средств в ряду производных таурина.
В результате химических реакций получены N-изопропиламиды N-замещенной 2-аминоэтансульфокислоты:
N-изопропиламид 2-(1-метил-2-фенилэтил)аминоэтансульфокислоты - препарат №1;
N-изопропиламид 2-(бензил)аминоэтансульфокислоты - препарат №2;
N-изопропиламид 2-(1-фенилэтил)аминоэтансульфокислоты - препарат №3.
Эти препараты апробированы нами в эксперименте в качестве антигипоксических средств среди производных таурина. Неожиданно эффект от их использования превзошел ожидания, после чего вещества подвергли их подробному исследованию на различных моделях гипоксии.
Задачу, которую решает данное изобретение, составляет изучение способности предлагаемых производных таурина повышать устойчивость ЦНС к гипоксии.
Способ получения антигипоксантов, общая формула которых:
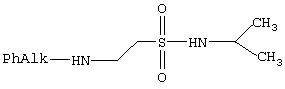
где PhAlk:
препарат I: N-изопропиламид 2-фенилизопропиламиноэтансульфокислоты
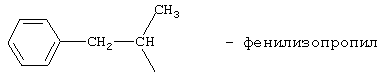
препарат II: N-изопропиламид 2-бензиламиноэтансульфокислоты
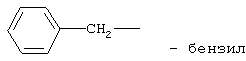
препарат III: N-изопропиламид 2-фенилэтиламиноэтансульфокислоты
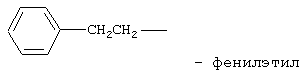
При синтезе для стабилизации N-изопропиламиды выделяют и хранят в виде хлоргидратов.
1. Этиленсульфонилизопропиламид
В трехгорлую литровую колбу с мешалкой, капельной воронкой и обратным холодильником помещают 28,7 г (0,14 г-моль) β-бромэтансульфохлорида в 250 мл сухого бензола. При перемешивании и охлаждении ледяной водой (2-3°С) медленно прикапывают смесь (0,19 г-моль) изопропиламина и 38 г (0,37 г-моль) триэтиламина в 200 мл сухого бензола. После окончания добавления перемешивают 1 ч, затем охлаждение снимают, перемешивают еще 1 ч при комнатной температуре. Осадок отфильтровывают, хорошо промывают сухим бензолом. Добавляют несколько кристаллов гидрохинона и бензол отгоняют в вакууме водоструйного насоса при температуре бани 25-26°С. Остаток, светло-желтое масло, перегоняют в вакууме, т. кип. 115-118°С при 3 мм, n
2. N-замещенные 2-аминоэтансульфонилизопропиламиды
0,03 г-моль этиленсульфонилизопропиламида и 0,32 г-моль амина в 50 мл спирта ректификата нагревают на водяной бане 10-12 ч. Спирт отгоняют в вакууме. Оставшееся масло или осадок промывают несколько раз гексаном (сливают декантацией, если продукт жидкий, или фильтруют, если твердый), сушат в вакууме. К остатку добавляют рассчитанное количество 105%-ного спиртового раствора HCl, разбавляют сухим эфиром и образовавшуюся соль фильтруют, промывают эфиром и кристаллизуют [1]. Константы, выход и данные анализа приведены в табл. 1 и 2.
Для удаления HCl хлоргидраты обрабатывают раствором едкого натра при перемешивании в течение 30 мин и охлаждении. Выпавший осадок промывают водой до нейтральной реакции промывных вод. Высушивают в вакууме. Перекристаллизацию осуществляют из четыреххлористого углерода. N-изопропиламид 2-(N-фенилэтил)аминоэтансульфокислоты имеет температуру плавления 93-94°С.
Молекулярная масса: 270.38
Элементный анализ
Найдено, %: С 57.52; Н 8.07; N 10.42; S 11.68.
Брутто-формула C13H22N2O2S
Вычислено, %: С 57.78; Н 8.15; N 10.37; S 11.85.
Строение полученных хлоргидратов N-изопропиламидов (I-III) подтверждено данными спектров ЯМР-‘Н (табл. 2).

N-изопропиламид 2-(N-бензил)аминоэтансульфокислоты имеет температуру плавления 72-73°С.
Молекулярная масса: 256.36
Элементный анализ
Найдено, %: С 56.42; Н 7.93; N 10.68; S 12.38.
Брутто-формула C13H22N2O2S
Вычислено, %: С 56.22;Н 7.86; N 10.93; S 12.51.
N-изопропиламид 2-(N-фенилизопропил)аминоэтансульфокислоты имеет температуру плавления 28-30°С.
Молекулярная масса: 284.42
Элементный анализ
Найдено, %: С 58.91; Н 8.32; N 10.08; S 11.15.
Брутто-формула C13H22N2O2S
Вычислено, %: С 59.12; Н 8.51; N 9.85; S 11.27.
Пример.
а). N-изопропиламид 2-(N-фенилэтил)аминоэтансульфокислоты, хлоргидрат
4,54 г этиленсульфонизопропиламида и 3,83 г α-фенилэтиламина в 75 мл этанола кипятят в колбе с обратным холодильником 12 часов. Спирт отгоняют, оставшееся масло обрабатывают гексаном, сливают декантацией. Сушат в вакууме, вес основания 5 г (масло). Основание растворяют в 35 мл сухого эфира, добавляют при охлаждении ледяной водой 2,0 г HCl в 6 мл абсолютного этанола. Выделившийся осадок хлоргидрата отфильтровывают, промывают эфиром, сушат в вакуум-эксикаторе. Кристаллизуют из смеси ацетон с абсолютным этанолом (3:1).
Вес 6,67 г, т.пл. 161-162° Выход 71,5%.
Найдено %: С 50.71, Н 7.66, N 9.32, S 10.59, Cl 11.50
С13Н23N2O2СlS. Вычислено, %: С 50.88, Н 7.56, N 9.13, S 10.45, Cl 11.56.
б). N-изопропиламид 2-(N-фенилэтил)аминоэтансульфокислоты
1,2 г хлоргидрата изопропиламида фенилэтиламиноэтансульфокислоты растворяют при нагревании в 40 мл воды и после охлаждения раствора до 40-50°С добавляют при перемешивании 5 мл 2 н раствора едкого натра. Смесь перемешивают еще 30 мин при охлаждении ледяной водой, выпавший осадок отфильтровывают, тщательно промывают водой до нейтральной реакции промывных вод и высушивают в вакууме. После перекристаллизации из четыреххлористого углерода получают 0,86 г (79,6%) изопропиламида фенилэтиламиноэтансульфокислоты с т.пл. 93-94°С. Найдено, %: С 57.52, Н 8.07, N 10.42, S 11.68. C13H22N2O2S. Вычислено, %: С 57.78, Н 8.15, N 10.37, S 11.85.
Спектр протонного магнитного резонанса N-изопропиламида 2-(N-фенилэтил)аминоэтансульфокислоты
Спектр ЯМР-1Н изопропиламида фенилэтиламиноэтансульфокислоты записан на приборе Bruker СХР-300, 300 МГц. Растворитель CDCl3, концентрация 10 мг/мл.
δ, м.д.
1. 172s (3H)
1. 194s (3H)
1. 519s (1H)
2. 788 m (2H)
2. 893m (2H)
3. 116m (4H)
3. 608 m (1H)
4. 570 s (1H)
7. 175-7.321 m (5H)
Острую токсичность препаратов при внутрибрюшинном введении оценивали на 200 мышах-самцах массой 18-20 г в течение суток после введения препаратов. Общий срок наблюдения составлял 15 дней. Оценку полученных данных и расчет LD50 производили по методу Кербера [13].
Определение острой токсичности исследуемых соединений показало, что значения распределились от 195 до 375 мг/кг массы тела животного. Это послужило основанием для выбора доз при дальнейших исследованиях в диапазоне 15-35 мг/кг.
Антигипоксические свойства изучали на мышах и крысах. Использовали три модели: гипоксию с гиперкапнией, гемическую гипоксию и гипоксическую гипоксию в барокамере [14].
Нормобарическую гипоксическую гипоксию с гиперкапнией воспроводили на мышах одинаковой массы 19 г, которых помещали по одному в герметически закрываемые банки объемом 200 см3.
Гемическую гипоксию воспроизводили на мышах массой 18-22 г путем однократного подкожного введения нитрита натрия в дозе 150 мг/кг.
Гипобарическая гипоксическая гипоксия. Работа выполнена на крысах-самцах линии Wistar массой 250-300 г. Животные подвергались воздействию гипоксии в специальной камере емкостью 100 л, содержавшей системы терморегуляции, вентиляции, адсорбции выдыхаемого СO2 и газового анализа. Условия, создаваемые в барокамере, соответствовали содержанию кислорода при подъеме на высоту 11000 м со скоростью 50 м/с в течение 30 мин. Концентрация углекислоты в камере не превышала 0,1%, а температура - 22°С. Контрольных животных в течение эксперимента содержали в клетке при нормальном рO2. В ходе эксперимента исследовали поведение животных. Во всех использованных моделях в качестве эталонного антигипоксанта применяли гутимин - 25 мг/кг и ноотропный препарат пирацетам - 100 мг/кг. Исследуемые вещества вводили животным каждой группы (n=10) внутрибрюшинно за 30 мин до начала действия гипоксии в оптимальной дозе 25 мг/кг массы тела. Контрольным животным вводили только физиологический раствор. Оценивали количество погибших животных и время наступления гибели. При использовании нормобарической гипоксической гипоксии с гиперкапнией все соединения оказывали антигипоксическое действие (табл. 1). Максимальный эффект отмечен у препаратов: №1, №3, который был сопоставим или превышал таковой у прототипа гутимина. Аналогичную закономерность отмечали в двух других типах гипоксии: при гемической гипоксии наиболее активны были препараты №1, №3, а при гипобарической гипоксической гипоксии - препараты №2, №3.
Таким образом, на основании проведенного анализа можно заключить, что из исследованных производных таурина выраженными антигипоксическими свойствами обладают все три препарата: №1, №2, №3. Наибольшую антигипоксическую активность проявили препараты №3, №1.
Влияние препаратов N-алкиламидов 2-алкиламиноэтансульфокислоты на активность ацетилхолиностеразы при хронической гипоксии
Нарушение снабжения органов и тканей кислородом при гипоксии приводит к изменению ряда биохимических показателей, в том числе к изменению активности ацетилхолиностеразы. Уровень таких изменений может свидетельствовать о степени поражения мембран клеток разных органов и тканей при гипоксии. Напротив, восстановление исследуемых биохимических показателей под воздействием лекарственных препаратов отражает эффективность применения последних при данной патологии.
Хроническая гипоксическая гипоксия снижает уровень активности мембранно-связанного фермента ацетилхолинэстеразы (АХЭ) в синаптосомах мозга, мембранных препаратах сердца и желудка крыс. Нами была проведена оценка способности ряда препаратов (гутимина, препарата №1, №2, №3) восстанавливать активность этого фермента в исследуемых органах.
Методика выполнения эксперимента. Моделирование гипобарической гипоксической гипоксии проводили на крысах-самцах линии Wistar весом 250-300 г. Животные подвергались воздействию гипоксии в специальной камере емкостью 100 л, содержавшей системы терморегуляции, вентиляции, адсорбции выдыхаемого СO2 и газового анализа. Животным каждой группы (n=10) за 30 мин до начала действия гипоксии внутрибрюшинно вводили 0,2 мл водных растворов исследуемых препаратов в дозе 25 мг/кг. Контрольным животным вводили только физиологический раствор. В ходе эксперимента содержание кислорода снижалось в камере с 20 до 7,8% (что соответствует содержанию кислорода на высоте 8000 м) в течение 30 мин и удерживалось на этом уровне еще 2,5 ч. Концентрация углекислоты в камере не превышала 0,1% при температуре 22°С. Контрольные животные (n=10) содержались в течение этого же периода времени в клетке при нормальном давлении. После окончания действия гипоксии экспериментальных и контрольных животных декапитировали, извлекали большие полушария головного мозга, сердце и желудок. Выделенные органы замораживали в жидком азоте и хранили до проведения биохимических исследований.
Для исследования влияния гипоксии на биохимические характеристики мозга крыс использовали препарат синаптосом больших полушарий мозга. Согласно литературным данным именно в этой субклеточной фракции наблюдаются наиболее существенные биохимические изменения при нарушении снабжения мозга кислородом [15]. Для получения информации о состоянии синаптических аппаратов мозга, а также мембран сердца и желудка анализировали активность ацетилхолинэстеразы (АХЭ) - фермента, отражающего функциональное состояние холинэргических нейронов [16].
Методика выделения синаптосом. Синаптосомы выделяли из больших полушарий головного мозга. Все процедуры проводились при 4°С. Гомогенат ткани в 0,32 М растворе сахарозы, приготовленном на 0,01 М трис-НСl (рН 7,4), центрифугировали 10 мин при 1000 g. Осадок суспендировали в исходном растворе сахарозы и вновь центрифугировали в том же режиме. Объединенный супернатант центрифугировали 20 мин при 20 000 g, осадок суспендировали в исходном растворе сахарозы и центрифугировали в градиенте концентраций сахарозы при 100 000 g в течение 1 ч. Фракцию синаптосом, образовавшуюся на границе 0,8 и 1,2 М растворов сахарозы, отбирали пастеровской пипеткой и центрифугировали 20 мин 20 000 g. Осадок синаптосом дважды промывали 0,01 М трис-HCl (рН 7,4), центрифугируя каждый раз по 20 мин при 20 000 g. Промытый осадок синаптосом суспендировали в 2 мл 0,01 М трис-НСl (рН 7,4).
Получение препарата мембран сердечной мышцы. Мембранную фракцию сердечной мышцы выделяли по методу Авдонина и соавторов [17].
Ткань сердца после размораживания взвешивали, помещали в 20 mM трис-НСl (рН 7,4, 50 мл буфера на 1 г ткани), измельчали ножницами и гомогенизировали в гомогенизаторе типа Politron в течение 1 мин. Гомогенат фильтровали через двухслойную марлю и центрифугировали многократно на центрифуге К-23 при 1600 об/мин в течение 10 мин. После каждого центрифугирования осадок гомогенизировали в 30 мл 20 mM трис-HCl (рН 7,4). Отмывки проводили до полного просветления надосадочной жидкости. Полученный таким образом в осадке препарат мембран суспендировали в 10 мл исходного буфера.
Получение препарата мембран желудка. Мембранную фракцию желудка получали по схеме, описанной для сердечной мышцы, с некоторыми модификациями. Супернатанты, полученные после первых двух центрифугирований гомогената желудка в 20 mM трис-HCl, объединяли и центрифугировали на центрифуге К-24 20 мин при 13 500 об/мин. Полученный осадок суспендировали в 5 мл исходного буфера. В аликвотах полученных суспензий синаптосом мозга, мембран сердца и желудка проводили определение содержания белка по методу Лоури. Активность ацетилхолинэстеразы анализировали по методу Эллмана [18]. Полученные результаты анализировали, используя t-тест и метод парных сравнений.
Наблюдение за животными, подвергавшимися действию гипоксии, в нашем исследовании показало, что на ранних сроках гипоксии происходит временная активация общей двигательной активности крыс, затем способность к точным координированным движениям нарушается и к концу эксперимента животные, как правило, находятся в состоянии адинамии.
Полученные нами данные свидетельствуют, что трехчасовая гипоксия приводит к снижению активности АХЭ мозга (табл. 2). Снижение активности АХЭ согласуется с наблюдаемым снижением двигательной активности крыс на ранних этапах кислородного голодания. Введение всех исследованных нами синтетических препаратов (гутимина, №1, №2 и №3) не только предотвращало снижение активности АХЭ в мозге, но даже приводило к ее повышению по сравнению с контролем. Гипоксическая гипоксия приводила к снижению активности АХЭ сердца и не вызывала изменений активности этого фермента в мембранах желудка (табл. 2). Введение препарата №1 предотвращало снижения активности АХЭ в сердце, чего не наблюдалось для всех других препаратов. Более того, введение гутимина, препаратов №1 и №2 приводило к достоверному повышению активности АХЭ в мембранах желудка по сравнению с контролем.
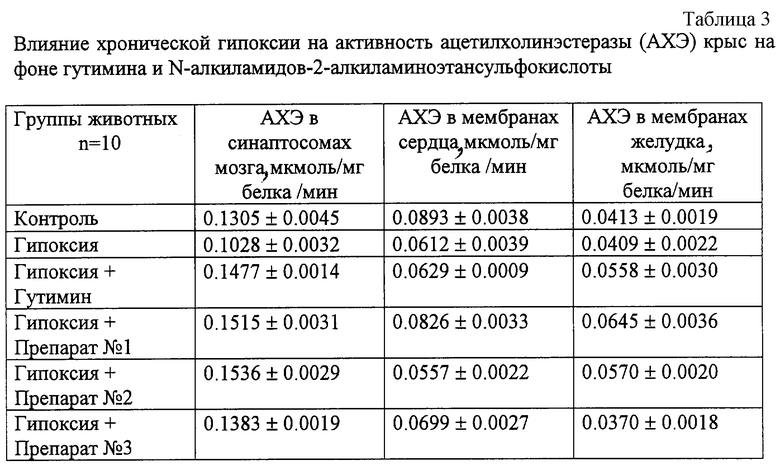
Тест на выживаемость животных с глобальной гипоксией мозга
Гипоксический синдром является непременным спутником критического состояния и обусловлен ухудшением транспорта кислорода к клетке и нарушением его утилизации в результате тяжелых расстройств метаболической и функциональной активности различных органов и систем. В связи с этим необходимо изучать относительную эффективность препарата при гипоксии с учетом фазности этого процесса.
Относительную эффективность препарата №3 оценивали по выживаемости животных с глобальной гипоксией мозга, вызванной билатеральной окклюзией общих сонных артерий (БООСА) у крыс-самцов массой 180-200 г. Препарат №3 вводили внутрибрюшинно в дозе 25 мг/кг два раза в день в течение 7 суток после окклюзии. В качестве аналогов использовали пирацетам в дозе 100 мг/кг и ксантинола никотинат в дозе 25 мг/кг два раза в день в течение 7 суток после окклюзии. Контрольным животным с БООСА по аналогичной схеме вводили физиологический раствор. Оценивали выживаемость животных. Относительную эффективность препарата №3 и аналогов определяли по формуле [19]
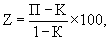
где Z - относительная эффективность препарата;
П - доля выживших животных с препаратом;
К - доля выживших животных в контроле.
Установлено, что эффект препарата №3 аналогичен действию ксантинола никотината. Препарат №3 пролонгировал продолжительность жизни животных с БООСА, о чем свидетельствует динамика их выживаемости на протяжении эксперимента (табл. 4).
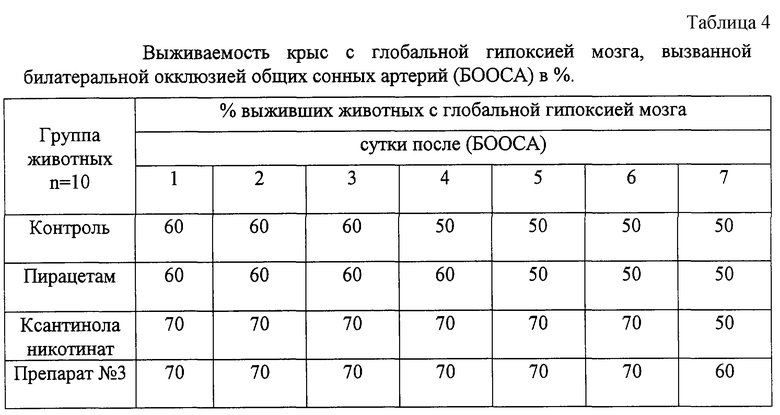
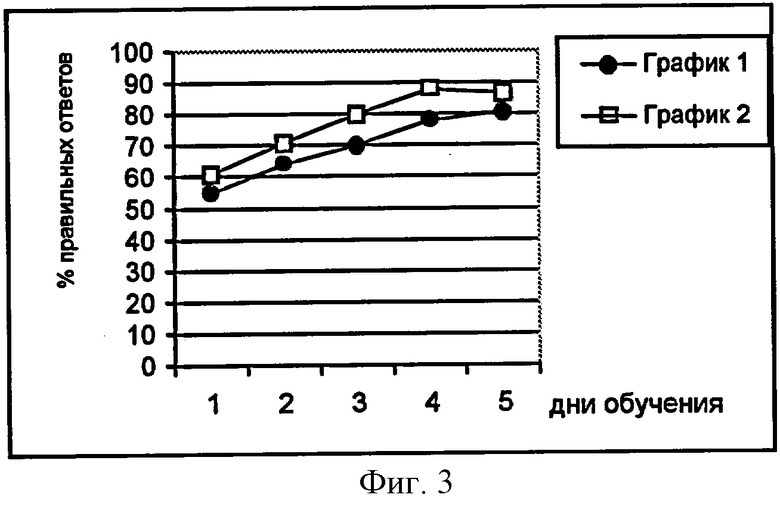
Оценка относительной эффективности препарата №3, пирацетама, ксантинола никотината позволяет говорить об отсутствии положительного действия пирацетама на выживаемость животных в первые семь суток после БООСА На фиг. 1 представлена относительная эффективность препаратов, о которой судят по выживаемости крыс с моделированной глобальной ишемией мозга. По оси абсцисс - сутки после билатеральной окклюзии общих сонных артерий; по оси ординат - относительная эффективность препаратов, %. А - пирацетам, 100 мг/кг; Б - ксантинола никотинат, 25 мг/кг; В - препарат №3, 25 мг/кг. Его относительная эффективность в этот период колеблется от 0 до 20%. В то же время, относительная эффективность препарата №3 составляет 25-40% в течение всего срока наблюдения и совпадает по динамике и выраженности с относительной эффективностью ксантинола никотината.
Влияние N-изопропиламид 2-(1-фенилэтил)аминоэтансульфокислоты препарата №3 на кровоснабжение внутреннего уха морских свинок, подвергшихся действию вибрации
Известно, что последствием влияния длительной вибрации является расстройство кровообращения, острое и хроническое кислородное голодание и сопутствующие им изменения метаболизма органов и тканей. Расстройства деятельности мозга и других систем, связанные с гипоксией, наблюдаются при осуществлении профессиональной деятельности, связанной с освоением воздушного и космического пространства. Известно, что мозг очень чувствителен к пониженному содержанию кислорода. Снижение концентрации кислорода в крови в два раза приводит не только к существенному ухудшению памяти, обучаемости и работоспособности, ототоксическому действию, поражению сетчатки глаза, нарушению двигательной активности [4]. При этом в первую очередь страдают нервные клетки гиппокампа, неокортекса и стриатума, которые принимают участие в регуляции и осуществлении моторного поведения млекопитающих [5]. В этих случаях необходимо применение препаратов как с профилактической, так и с лечебной целью, которые способны повышать активность энергосинтезирующих процессов, улучшать транспортную функцию крови по доставке кислорода к тканям, предотвращать или устранять внутриклеточный ацидоз, повышать устойчивость органов и систем к вредным для организма воздействиям.
Отопротекторное действие препарата №3 изучали при поражении внутреннего уха у морских свинок, подвергшихся действию вибрации в течение одного месяца. Эксперименты проведены на морских свинках-самцах весом 250-300 г. Первая группа животных получала препарат в дозе 15 мг/кг внутримышечно в течение 7 суток с начала воздействия, вторая - в течение 7 суток после окончания вибрации. Третья группа животных - только воздействие вибрации в течение одного месяца. Четвертая группа - контроль (интактные животные).
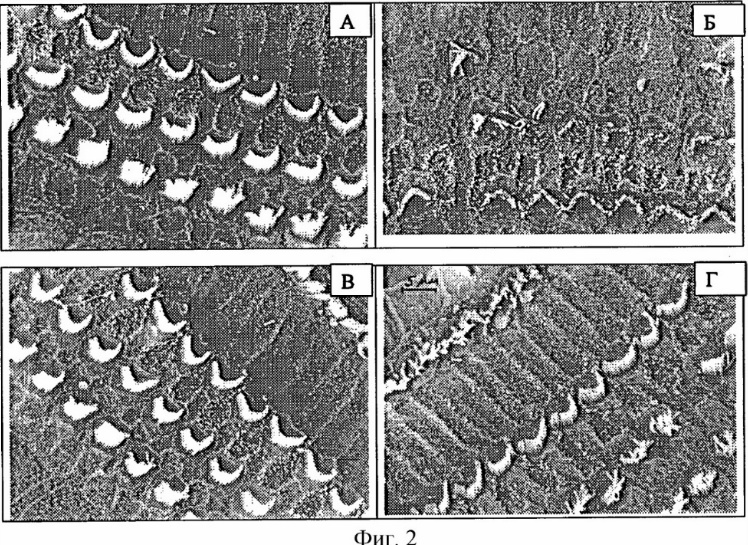
Показано, что у контрольных животных в норме на поверхности спирального органа наружные волосковые клетки имеют три ряда стереоцилий, собранных в пучки (фиг. 2,А). При вибрационном воздействии в течение месяца на поверхности спирального органа многие наружные волосковые клетки замещаются опорными клетками. У некоторых наружных волосковых клеток отсутствуют полностью или частично стериоцилии (фиг. 2,Б). Кроме того, вибрация вызывает нарушения в структуре митохондрий как наружных, так и внутренних волосковых клеток. Применение препарата №3 у морских свинок способствовало сохранению ультраструктуры волосковых клеток. Однако профилактическое введение препарата №3 в течение 7 суток с начала воздействия вибрации оказывало более выраженное защитное действие (фиг. 2,В), чем применение препарата с лечебной целью в течение 7 суток после окончания вибрации (фиг. 2,Г), приводя к лучшей сохранности ультраструктуры волосковых клеток во всех отделах улитки. На электронно-микроскопических срезах апикального отдела улиток не обнаружено разрушающихся наружных волосковых клеток. Отопротекторный эффект препарата можно объяснить способностью препарата оказывать антигипоксическое действие.
Влияние N-изопропиламид 2-(1-метил-2-фенилэтил)аминоэтансульфокислоты - препарата №1 на трансплацентарное кровообращение и качество потомства
Изучено влияние препарата №1 на потомство беременных крыс, которым вводили его внутрижелудочно в дозах 10 и 50 мг/кг в течение всего периода беременности. Показано отсутствие эмбриотоксического и тератогенного действия препарата №1 в используемых дозах в антенатальном и постнатальном периодах развития крысят. Психофизиологические показатели: физическое развитие, скорость созревания сенсорно-двигательных рефлексов в период вскармливания, эмоционально-двигательное поведение, обучаемость и память у экспериментальных животных не уступали данным показателям животных контрольной группы. Препарат №1 в дозе 50 мг/кг проявил положительный эффект при выработке условного рефлекса у крыс, достигших 3-месячного возраста, в У-образном лабиринте с пищевым подкреплением.
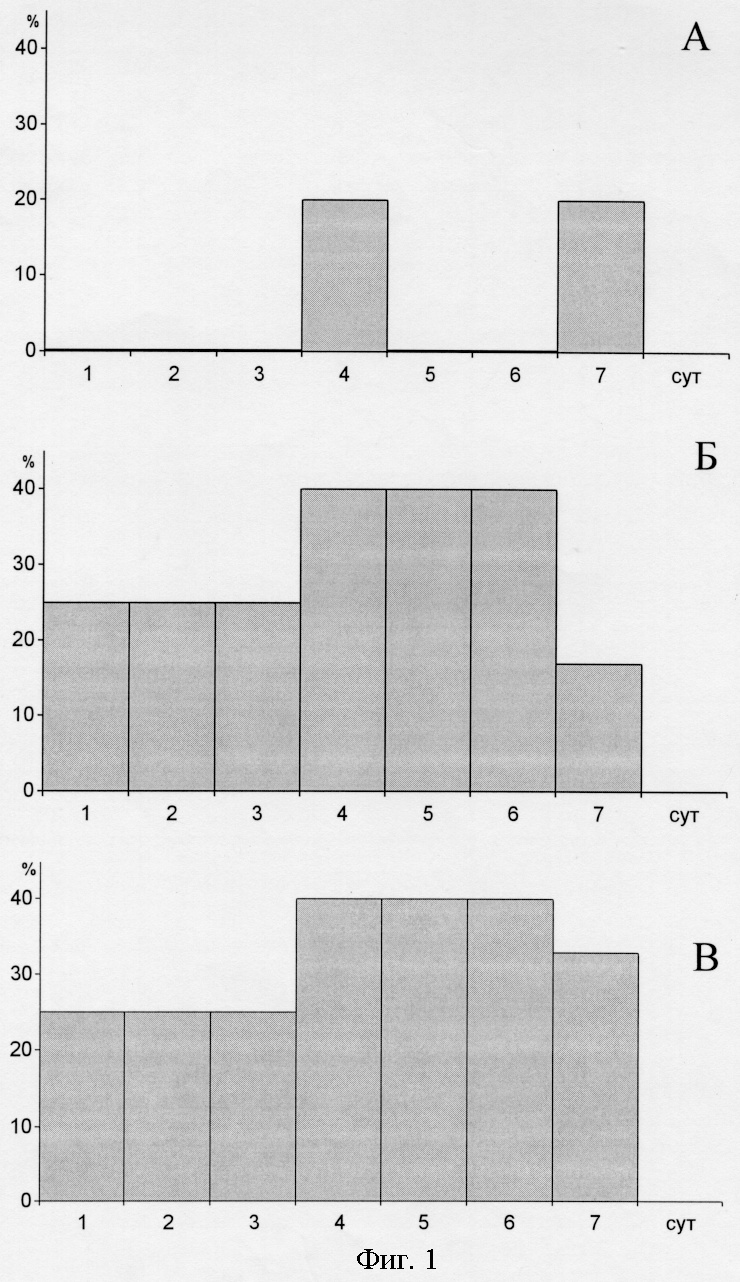
В результате проведенных исследований установлено, что экспериментальные животные, получавшие препарат №1, в среднем достигли критерия обучения раньше, чем контрольные. На фиг. 3 представлены результаты обучения крыс в У-образном лабиринте с пищевым подкреплением, где график 1 - контроль; график 2 - препарат №1.
Процент правильных ответов на 2, 3, 4 день обучения экспериментальной группы достоверно выше, чем у контрольной группы. Общее количество правильных ответов за весь период обучения в контрольной группе составило 74%, а в экспериментальной - 83%. Положительное трансплацентарное действие препарата №1 на обучаемость крыс нового поколения связано с его антигипоксической активностью, которую препарат в наибольшей степени проявлял на модели гемической и хронической гипоксической гипоксии. Применение препарата №1 у крыс на протяжении всего периода беременности способствовало улучшению микроциркуляции и плацентарного кровообращения, предупреждало развитие гипоксических состояний как в антенатальном, так и в постнатальном периодах развития крысят и не снижало численность потомства.
Литература
1. Средство для лечения язвенной болезни желудка и 12-перстной кишки. Патент РФ N 2179439, БИ №5 от 20.02.2002; Сапронов Н.С., Гавровская Л.К., Селина Е.Н.
2. Антиаритмическое средство. Заявка на патент с положительным решением 99126233 от 14.12.1999.
3. Самойлов М.О. Реакция нейронов мозга на гипоксию. Л.: Наука, 1985, 190 с.
4. Luft U.C. Aviation physiology - the effect of altitude.//In: Handbook of Physiology, 1965, v. II, Section 3: Respiration. (Fenn W.O. and Rahn H., eds.), p. 1099-1145. American Physiological Society, Washington.
5. Лукьянова Л.Д. Проблемы фармакологической коррекции гипоксии и поиска антигипоксантов //Клеточные механизмы реализации фармакологического эффекта. - М.: Медицина, 1990, с.184-216.
6. Smith M.L., Auer R.N., Siesjo B.K. The density and distribution of ischemic brain injury in the rat following 2-10 min of forebrain ischemia.//Act Neuropathology. (Berl.) 1984, v. 64, №2, p.319.
7. Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции. //Бюлл. эксперим. биол. мед., 1997, т.124, №9, с.244-254.
8. Маркова И.В., Афанасьев В.В., Цыбулькин Э.К., Неженцев М.В. Клиническая токсикология детей и подростков. СПб, 1998-1999, т. 1-2.
9. Виноградов В.М., Пастушенков Л.В., Сумина Э.Н. Повышение резистентности к гипоксии с помощью гутимина //Пат. физиол., 1981, №4, с.81-85.
10. Машковский М.Д. Лекарственные средства. М.: Медицина, 1993. т.1-2.
11. Маньковская И.Н., Вавилова Г.Л., Харламова О.Н., Носарь В.И., Братусь Л.В. Влияние таурина на активность транспортных АТР-аз и ферментов энергетического обмена в разных тканях крыс при острой гипоксической гипоксии.//Укр. Биохим. Журн., 1992, №6, с.43-48.
12. Нефедов Л.И. Проявление биологической активности таурина.//Весцi Акадэми Навук Беларусi. Серыя бiялагiчных навук. 1992, №3-4, с.99-106.
13. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Рига, 1959.
14. Воронина Т.А., Островская Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М.: Ремедиум, 2000, с.153-158.
15. Wright C.E., Tallan H.H., Lin Y.Y., Gaul C.E. //Ann. Rev. Biochem. J. 1988, v.55, p.427-453.
16. Ahtee Z., Helmecokoski J., Heinonen H., Koskimes A. //Brit.J. Phannacol., 1979, v. 66, №3, p.480.
17. Авдонин П.В., Панченко М.П., Ткачук В.А. Действие GTP и NaF на аденилатциклазу сердца кролика, активированную гуанил-5’-илимидодифосфатом.//Биохимия, 1980, т. 45, с.1970-1979.
18. Ellman G.L., Courtney K.D., Anders V., Jr., Featherstone R.M. A new and rapid colorimetric determination of acetylcholinesterase activity.//Biochem. Phannacol, 1961, v.7, №1, р.88.
19. Иванова И.А., Бобков Ю.Г. Сравнительное изучение некоторых препаратов на разных моделях гипоксии мозга.//Бюлл. эксперим. биол. и мед., 1984, №11, с.567-570.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕЙРОПРОТЕКТОРНОЕ СРЕДСТВО | 2004 |
|
RU2268715C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГИПОГЛИКЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385717C1 |
| Применение ксенона, иммобилизированного в носителе в средстве для повышения резистентности организма к гипоксии | 2018 |
|
RU2696100C1 |
| Способ оценки антигипоксической активности химических соединений | 1986 |
|
SU1455320A1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОГИПОКСИЧЕСКОЙ, АКТОПРОТЕКТОРНОЙ, НООТРОПНОЙ АКТИВНОСТЯМИ И ВЛИЯЮЩЕЕ НА ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2462245C1 |
| СРЕДСТВО ДЛЯ ЗАЖИВЛЕНИЯ КОЖНЫХ РАН ПЕРВИЧНЫМ НАТЯЖЕНИЕМ | 2004 |
|
RU2270007C2 |
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ АНТИГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2094056C1 |
| АНТИГИПОКСИЧЕСКОЕ СРЕДСТВО | 2001 |
|
RU2213571C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОБЕНЗОТИАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВОГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ИСПОЛЬЗОВАНИЯ | 2010 |
|
RU2448100C1 |
| НАТРИЕВАЯ СОЛЬ ПОЛИ(ПАРАДИГИДРОКСИ- ПАРАФЕНИЛЕН)ТИОСУЛЬФОКИСЛОТЫ В КАЧЕСТВЕ РЕГУЛЯТОРА МЕТАБОЛИЗМА КЛЕТОК И АНТИГИПОКСАНТА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ | 2000 |
|
RU2257202C2 |
Предложены средства, обладающие антигипоксическими свойствами. В качестве таковых предложены N-изопропиламид 2-(1-фенил-этил)аминоэтансульфокислоты, N-изопропиламид 2-(1-метил-2-фенил-этил)аминоэтансульфокислоты или N-изопропиламид 2-(бензил)аминоэтансульфокислоты. Изобретение расширяет арсенал средств указанного назначения. 4 табл., 3 ил.
Антигипоксическое средство, отличающееся тем, что оно представляет собой N-изопропиламид 2-(1-фенилэтил)аминоэтансульфокислоты, или N-изопропиламид 2-(1-метил-2-фенилэтил)аминоэтансульфокислоты, или N-изопропиламид 2-(бензил)аминоэтансульфокислоты.
| Торкунов П.А | |||
| и др | |||
| Действие нового производного таурина при различных вариантах гипоксических состояний./ Экспериментальная и клиническая фармакология, 2000, т | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| RU 1370948 A1, 20.01.1996 | |||
| АНТИАРИТМИЧЕСКОЕ СРЕДСТВО | 1999 |
|
RU2185159C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЯЗВЕННОЙ БОЛЕЗНИ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ | 2000 |
|
RU2179439C1 |
| JP 11071341, 16.03.1999. | |||
Авторы
Даты
2004-07-20—Публикация
2002-07-30—Подача