ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка является частичным продолжением заявки США №11/736908, поданной 18 апреля 2007, по которой испрашивается приоритет временной заявки США №60/745899, поданной 28 апреля 2006, временной заявки США №60/827695, поданной 30 сентября 2006 и временной заявки США №60/882670, поданной 29 декабря 2006, полные содержания которых включены в настоящее описание в качестве ссылки.
Настоящее изобретение относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток. В частности, настоящее изобретение относится к усовершенствованному способу формирования эндодермы поджелудочной железы, клеток, экспрессирующих гормоны поджелудочной железы, и клеток, секретирующих гормоны поджелудочной железы. Настоящее изобретение также относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток без применения слоя клеток-кормилиц.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Достижения в области клеточной заместительной терапии сахарного диабета I типа и недостаточность трансплантируемых островков Лангерганса сфокусировали интерес на развитии источников инсулин-продуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним подходом является воспроизведение функциональных β-клеток из плюрипотентных стволовых клеток, например, таких как эмбриональные стволовые клетки.
В эмбриональном развитии позвоночных плюрипотентная клетка дает начало группе клеток, включающей три зародышевых листка (эктодерму, мезодерму и эндодерму), в процессе, известном как гаструляция. Ткани, такие как, например, щитовидной железы, тимуса, поджелудочной железы, кишечной трубки и печени, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией в этом процессе является образование дефинитивной эндодермы. Клетки дефинитивной эндодермы экспрессируют целый ряд маркеров, таких как HNF-3бета, GATA4, Mixl1, CXCR4 и Sox-17.
Формирование поджелудочной железы происходит в результате дифференцировки дефинитивной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют панкреатический дуоденальный гомеобокс-ген, Pdx1. В отсутствие Pdx1 поджелудочная железа не в состоянии развиваться больше вентральных и дорсальных зачатков. Таким образом, экспрессия Pdx1 отмечает критический этап в органогенезе поджелудочной железы. Зрелая поджелудочная железа содержит, наряду с другими клеточными типами, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани возникают в результате дифференцировки панкреатической эндодермы.
Клетки, обладающие признаками островковых клеток, по имеющимся сведениям, были получены из эмбриональных клеток мыши. Например, Lumelsky et al. (Science 292:1389, 2001) сообщают о дифференцировке мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, аналогичные панкреатическим островкам. Soria et al. (Diabetes 49:157, 2000) сообщают, что инсулин-секретирующие клетки, полученные из мышиных эмбриональных стволовых клеток, нормализуют гликемию у мышей с диабетом, индуцированным стрептозотоцином.
В одном примере Hori et al. (PNAS 99: 16105, 2002) описывают, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид 3-киназы (LY294002) продуцировала клетки, которые были похожи на β-клетки.
В другом примере Blyszczuk et al. (PNAS 100:998, 2003) сообщает о воспроизведении инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток, конститутивно экспрессирующих Pax4.
Micallef et al. сообщает, что ретиноевая кислота может регулировать детерминацию эмбриональных стволовых клеток в форму Pdx1-позитивной панкреатической эндодермы. Ретиноевая кислота является наиболее эффективной в индукции экспрессии Pdx1 при добавлении в культуры на 4 день дифференцировки эмбриональных стволовых клеток на протяжении периода, соответствующего концу гаструляции у эмбриона (Diabetes 54:301, 2005).
Miyazaki et al. сообщает о линии мышиных эмбриональных стволовых клеток, гиперэкспрессирующих Pdx1. Их результаты показывают, что экзогенная экспрессия Pdx1 явно усиливала экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6, и HNF6 в полученных в результате дифференцированных клетках (Diabetes 53: 1030, 2004).
Skoudy et al. сообщает, что активин A (представитель суперсемейства TGFβ) положительно регулирует экспрессию экзокринных панкреатических генов (p48 и амилазы) и эндокринных генов (Pdx1, инсулина и глюкагона) в мышиных эмбриональных стволовых клетках. Максимальный эффект наблюдался с использованием 1 нМ активина А. Они также наблюдали, что на уровень экспрессии инсулина и мРНК Pdx1 не влияла ретиноевая кислота; однако обработка 3 нМ FGF7 приводила к повышенному уровню транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
Shiraki et al. изучали эффекты факторов роста, которые специфически усиливали дифференцировку эмбриональных стволовых клеток в Pdx1-позитивные клетки. Они наблюдали, что TGFβ2 воспроизводимо давал более высокую долю Pdx1-позитивных клеток (Genes Cells. 2005 Jun; 10(6): 503-16).
Gordon et al. демонстрировали индукцию brachyury+/HNF-3beta+клеток эндодермы из мышиных эмбриональных стволовых клеток в отсутствие сыворотки и в присутствии активина наряду с ингибитором сигнального пути Wnt (US 2006/0003446A1).
Gordon et al. (PNAS, Vol 103, p.16806, 2006) утверждает, что «пути передачи сигнала Wnt и TGF-бета/nodal/активин одновременно требовались для образования передней первичной полоски».
Однако мышиная модель развития эмбриональной стволовой клетки не может точно имитировать программу развития у высших млекопитающих, например у людей.
Thomson et al. выделяли эмбриональные стволовые клетки из бластоцист человека (Science 282:114, 1998). Параллельно Gearhart с соавторами получал линии эмбриональных зародышевых клеток человека (hEG) из зародышевой ткани гонад (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от мышиных эмбриональных стволовых клеток, дифференцировке которых можно препятствовать просто культивированием с лейкоз-ингибирующим фактором (LIF), эмбриональные стволовые клетки человека должны поддерживаться в самых особых условиях (патент США №6200806; WO 99/20741; WO 01/51616).
D'Amour et al. описывает получение обогащенных культур дефинитивной эндодермы, полученных из эмбриональных стволовых клеток человека в присутствии высокой концентрации активина и низкой концентрации сыворотки (D'Amour KA et al. 2005). Трансплантация этих клеток под почечную капсулу мышей приводила к дифференцировке в более зрелые клетки с характеристиками некоторых органов эндодермы. Клетки дефинитивной эндодермы, полученные из эмбриональных стволовых клеток человека, далее могут быть дифференцированы в Pdx1-позитивные клетки после добавления FGF-10 (US 2005/0266554A1).
D'Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) утверждает «Мы разработали процесс, который превращает эмбриональные стволовые клетки человека (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Этот процесс имитирует органогенез поджелудочной железы in vivo, направляя клетки через стадии, напоминающие дефинитивную эндодерму, эндодерму кишечной трубки, панкреатическую эндодерму и эндокринного предшественника на пути к клеткам, которые экспрессируют эндокринные гормоны».
В другом примере Fisk et al. сообщает о системе получения клеток панкреатических островков из эмбриональных стволовых клеток человека (US2006/0040387A1). В этом случае путь дифференцировки был разделен на три стадии. Эмбриональные стволовые клетки человека сначала дифференцировали в эндодерму, используя сочетание н-бутирата и активина А. Затем клетки культивировали с антагонистами TGFβ, такими как Noggin в сочетании с EGF или бетацеллюлином для получения Pdx1-позитивных клеток. Конечная дифференцировка индуцировалась под действием никотинамида.
В одном примере Benvenistry et al. утверждает: «Мы сделали вывод о том, что гиперэкспрессия Pdx1 усиливала экспрессию панкреатических обогащенных генов, для индукции экспрессии инсулина могут потребоваться дополнительные сигналы, которые присутствуют только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Таким образом, все еще остается существенная потребность в разработке условий для создания линий плюрипотентных стволовых клеток, которые могут быть размножены для направления на текущие клинические нужды, сохраняющих потенциал к дифференцировке в панкреатические эндокринные клетки, в клетки, экспрессирующие гормоны поджелудочной железы, или клетки, секретирующие гормоны поджелудочной железы. Авторы изобретения предприняли альтернативный подход к улучшению эффективности дифференцировки эмбриональных стволовых клеток человека в эндокринные клетки поджелудочной железы.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, включающему стадии:
а) культивирования плюрипотентных стволовых клеток и
b) дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы,
c) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы и
d) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, дифференцируются из плюрипотентных стволовых клеток путем обработки плюрипотентных стволовых клеток одним из следующих способов:
а) культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, затем культивирования клеток с активином А и сывороткой, а затем культивирования клеток с активином А и сывороткой другой концентрации, или
b) культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, затем культивирования клеток с активином А с сывороткой другой концентрации, или
c) культивирования плюрипотентных клеток в среде, содержащей активин A и лиганд Wnt в отсутствие сыворотки, затем удаления лиганда Wnt и культивирования клеток с активином A с сывороткой, или
d) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, и культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt, или
e) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральной среде, содержащей сыворотку, затем культивирования плюрипотентных стволовых клеток с активином A во второй культуральной среде, содержащей сыворотку, или
f) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральной среде, содержащей сыворотку, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt во второй культуральной среде, содержащей сыворотку в другой концентрации, или
g) культивирования плюрипотентных стволовых клеток в среде, дополненной B27, и содержащей лиганд Wnt и активин A, или
h) культивирования плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, в среде, дополненной B27 и содержащей активин A.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, дифференцируются из клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем обработки клеток, эксперессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, одним из следующих способов:
а) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы фактором роста фибробластов и ингибитора сигнального пути хэджхог (hedgehog), затем удаления среды, содержащей фактор роста фибробластов и ингибитор сигнального пути хэджхог, и последующего культивирования клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и ингибитор сигнального пути хэджхог, или
b) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов, или
c) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой, затем удаления ретиноевой кислоты и последующей обработки клеток по меньшей мере одним фактором роста фибробластов.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, дифференцируются из клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, одним из следующих способов:
a) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей DAPT и экзендин 4, затем удаления среды, содержащей DAPT и экзендин 4, и последующего культивирования клеток в среде, содержащей экзендин 1, IGF-1 и HGF, или
b) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей экзендин 4, затем удаления среды, содержащей экзендин 4 и в дальнейшем культивирования клеток в среде, содержащей экзендин 1, IGF-1 и HGF, или
c) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей DAPT и экзендин 4, или
d) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в среде, содержащей экзендин 4, или
e) оОбработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы фактором, который ингибирует сигнальный путь Notch.
В одном варианте осуществления настоящее изобретение относится к способу лечения пациента, страдающего диабетом, включающему стадии:
a) культивирования плюрипотентных стволовых клеток,
b) дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы,
c) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы,
d) дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в клетки β-клеточной линии дифференцировки и
e) имплантации пациенту клеток β-клеточной линии дифференцировки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 панели a) показана экспрессия маркеров дефинитивной эндодермы CXCR4, GATA4, HNF-3бета, Mixl1, Sox-17 в линии эмбриональных стволовых клеток человека H9 после обработки 100 нг/мл активина A в течение двух, пяти и восьми дней. Экспрессию маркеров дефинитивной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека. На панели b) показана экспрессия маркеров передней эндодермы Cerberus, Otx-1 и Hex генов в линии эмбриональных стволовых клеток человека H9 после обработки 100 нг/мл активина A в течение трех и пяти дней.
На фиг.2 показана экспрессия маркеров дефинитивной эндодермы в линии эмбриональных стволовых клеток человека H9 после обработки 100 нг/мл активина A в течение пяти дней. Экспрессию маркеров дефинитивной эндодермы определяли с помощью иммуногистохимии. На панели (a) показана экспрессия Sox-17. На панели (b) показана экспрессия HNF-3бета. На панели (c) показана экспрессия Oct3/4.
На фиг.3 показана экспрессия маркеров дефинитивной эндодермы в линии эмбриональных стволовых клеток человека H9, следуя пошаговому протоколу дифференцировки. Экспрессию маркеров дефинитивной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека. На панели (a) показана экспрессия GATA4. На панели (b) показана экспрессия Sox-17. На панели (c) показана экспрессия HNF-3бета. На панели (d) показана экспрессия Mixl1. Точки на графике, отмеченные 'AA', означают обработку активином A в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д). Точки на графике, отмеченные 'UT', означают необработанные контроли, культивированные в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д).
На фиг.4 показана экспрессия маркеров экстра-эмбриональной эндодермы в линии эмбриональных стволовых клеток человека H9, следуя пошаговому протоколу дифференцировки. Экспрессию маркеров экстраэмбриональной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека. На панели (a) показано действие 100 нг/мл активина A на экспрессию AFP. На панели (b) показано действие 100 нг/мл активина A на экспрессию Sox7. Точки на графике, отмеченные 'AA', означают обработку активином A в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д). Точки на графике, отмеченные 'UT' означают необработанные контроли, культивированные в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д).
На фиг.5 показана экспрессия маркеров мезодермы и эктодермы в линии эмбриональных стволовых клеток человека H9, следуя пошаговому протоколу дифференцировки. Экспрессию маркеров мезодермы и эктодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клеток человека. На панели (a) показано действие 100 нг/мл активина A на экспрессию Brachyury. На панели (b) показано действие 100 нг/мл активина A на экспрессию Zic1. Точки на графике, отмеченные 'AA', означают обработку активином А в течение одного (1 д), трех (3 д), пяти (5 д) или семи дней (7 д). Точки на графике, отмеченные 'UT', означают необработанные контроли, культивированные в течение одного (1d), трех (3д), пяти (5д) или семи дней (7д).
На фиг.6 показана экспрессия маркеров дефинитивной эндодермы Brachyury (панель a) CXCR4 (панель b), Mixl1 (панель c), Sox17 (панель d), HNF-3бета (панель e), Oct4 (панель F) в линии эмбриональных стволовых клеток человека H7 после обработки 100 нг/мл активином A в течение одного, трех, пяти и семи дней. Экспрессию маркеров дефинитивной эндодермы исследовали на уровне мРНК и нормировали к уровням экспрессии в необработанных эмбриональных стволовых клетках человека.
На фиг.7 показана экспрессия маркеров дефинитивной эндодермы в линии эмбриональных стволовых клеток человека H9 после применения протокола дифференцировки. Экспрессию маркеров дефинитивной эндодермы определяли с помощью иммуногистохимии. На панелях (a) и (b) показана экспрессия Sox-17. На панелях (c) и (d) показана экспрессия HNF-3бета. На панелях (e) и (f) показана экспрессия GATA4. На панелях (b), (d) и (f) показано контрастное окрашивание ядер с использованием DAPI. Колонки, отмеченные как «обработанные», означают обработку активином А (100 нг/мл) в течение пяти дней. Колонки, отмеченные как «необработанные», означают необработанные контроли.
На фиг.8 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения второго протокола дифференцировки. Экспрессию маркеров панкреатической эндодермы исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (a) показана экспрессия Pdx1. На панели (b) показана экспрессия GLUT-2. На панели (c) показана экспрессия PTF1a.
На фиг.9 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения второго протокола дифференцировки. Экспрессию маркеров панкреатической эндодермы определяли с помощью иммуногистохимии. На панели (a) показана экспрессия Pdx1 в необработанном контроле, а на панели (b) показана экспрессия Pdx1 в культуре, обработанной в соответствии с пошаговым протоколом дифференцировки.
На фиг.10 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения третьего протокола дифференцировки. Экспрессию панкреатических эндокринных маркеров исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (а) показана экспрессия NeuroD1. На панели (b) показана экспрессия Ngn3. На панели (с) показана экспрессия инсулина. На панели (d) показана экспрессия Hes-1, уровень экспрессии нормирован к клеткам панкреатической эндодермы.
На фиг.11 показана экспрессия маркеров панкреатической эндодермы в линии эмбриональных стволовых клеток человека H9 после применения протокола дифференцировки. Экспрессию маркеров панкреатической эндодермы исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (а) показана экспрессия Nkx2.2. На панели (b) показана экспрессия Pdx1.
На фиг.12 показана экспрессия PDX-1 в клетках каждого пассажа (P0, P1 и P2) в культуре. Экспрессию PDX-1 исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека H9, обработанных активином А.
На фиг.13 показана экспрессия маркеров гепатоцитов в линии эмбриональных стволовых клеток человека H9 после применения третьего протокола дифференцировки. Экспрессию маркеров гепатоцитов исследовали с помощью ПЦР и нормировали к уровням экспрессии в эмбриональных стволовых клетках человека, обработанных активином А. На панели (а) показана экспрессия AFP. На панели (b) показана экспрессия альбумина.
На фиг.14 показана экспрессия маркеров плюрипотентности в линии эмбриональных стволовых клеток человека H9. Экспрессию маркеров плюрипотентности исследовали с помощью иммуногистохимии. На панели (а) показана экспрессия Oct-4. На панели (b) показана экспрессия щелочной фосфатазы.
На фиг.15 показан кариотип линии эмбриональных стволовых клеток человека H9. Кариотип определяли на клетках с числом пассажей P36, которые культивировали на клетках-кормилицах - мышиных эмбриональных фибробластах.
На фиг.16 изображена схема протокола дифференцировки по настоящему изобретению, где эмбриональные стволовые клетки человека дифференцированы в дефинитивную эндодерму в системе без питающего подслоя.
На фиг.17 изображен профиль FACS линии эмбриональных стволовых клеток человека H9 с количеством пассажей 44, культивированных на MATRIGEL различных концентраций и подвергаемых действию сыворотки низкой концентрации (0,5-2%) и высокой концентрации активина A (100 нг/мл) в течение 5 дней. Экспрессия маркера дефинитивной эндодермы CXCR4 (CD184) показана по оси Y, а экспрессия ES маркера CD9 показана по оси X.
На фиг.18 показаны результаты ПЦР в режиме реального времени в отношении маркеров дефинитивной эндодермы из культур линии эмбриональных стволовых клеток человека H9 пассажа 44, культивированных с разведением MATRIGEL 1:10  разведением MATRIGEL 1:20
разведением MATRIGEL 1:20  или разведением MATRIGEL 1:30
или разведением MATRIGEL 1:30  и подвергнутых протоколу дифференцировки, описанному в примере 14. Кратность индукции относится к недифференцированным клеткам линии эмбриональных стволовых клеток человека H9, с количеством пассажей 44, культивированных в среде, кондиционированной с использованием эмбриональных фибробластов мыши.
и подвергнутых протоколу дифференцировки, описанному в примере 14. Кратность индукции относится к недифференцированным клеткам линии эмбриональных стволовых клеток человека H9, с количеством пассажей 44, культивированных в среде, кондиционированной с использованием эмбриональных фибробластов мыши.
На фиг.19 показаны графики рассеяния общей экспрессии генов в недифференцированных плюрипотентных стволовых клетках и клетках дефинитивной эндодермы, полученных в результате дифференцировки плюрипотентных стволовых клеток. Показанные данные представляют собой данные, полученные от культур линии эмбриональных стволовых клеток человека H9 пассажа 44, культивированных на эмбриональных фибробластах мыши (правая панель), и пассажа 83, культивированных на MATRIGEL (левая панель).
На фиг.20 изображена экспрессия CXCR4 по данным FACS на 5 день для линии эмбриональных стволовых клеток человека H1 (панель a), линии эмбриональных стволовых клеток человека H7 (панель b) и линии эмбриональных стволовых клеток человека H9 (панель c), культивированных на эмбриональных фибробластах мыши клетках-кормилицах, подвергнутых протоколу дифференцировки дефинитивной эндодермы, описанному в примере 4.
На фиг.21 показаны результаты ПЦР в режиме реального времени экспрессии указанных маркеров дефинитивной эндодермы в культурах линии эмбриональных стволовых клеток человека H7 (панель a) и линии эмбриональных стволовых клеток человека H9 (панель b), культивированных на эмбриональных фибробластах мыши клетках-кормилицах. Результаты выражены как кратность увеличения относительно недифференцированных клеток.
На фиг.22 изображена экспрессия CXCR4 по данным FACS на 5 день для линии эмбриональных стволовых клеток человека H1 (панель a), линии эмбриональных стволовых клеток человека H7 (панель b) и линии эмбриональных стволовых клеток человека H9 (панель c), культивированных на MATRIGEL (разведение 1:30) и подвергавшихся протоколу дифференцировки дефинитивной эндодермы, описанному в примере 4.
На фиг.23 показаны результаты ПЦР в режиме реального времени экспрессии указанных маркеров дефинитивной эндодермы в культурах линии эмбриональных стволовых клеток человека H7 (панель a), и линии эмбриональных стволовых клеток человека H9 (панель b), и линии эмбриональных стволовых клеток человека H1 (панель c). Результаты выражены как кратность увеличения относительно недифференцированных клеток. Клетки были обработаны в соответствии со способами, описанными в примере 4.
На фиг.24 представлены фазово-контрастные изображения культур эмбриональных стволовых клеток человека линии H9 пассажа 46 в присутствии 100 нг/мл активина A (панель a) или 100 нг/мл активина A+20 нг/мл Wnt-3a (панель b). Клетки обрабатывали в течение пяти дней.
На фиг.25 изображена экспрессия CXCR4 по данным FACS в культурах эмбриональных стволовых клеток человека линии H7 пассажа 44 (панели a и b) и H9 пассажа 46 (панели c и d) после обработки в соответствии со способами, описанными в примере 4. На панелях b и d показано действие 20 нг/мл Wnt-3a на экспрессию CXCR4. На панелях a и c показана экспрессия CXCR4 в отсутствие Wnt-3a. Результаты были получены через 5 дней после обработки.
На фиг.26 представлены данные ПЦР в режиме реального времени экспрессии генов, указанных в культурах эмбриональных стволовых клеток человека линии H7 (панель a) и H9 (панель b). Культуры обрабатывали по протоколу дифференцировки, описанному в примере 4. Также были протестированы действия агонистов Wnt - Wnt-3a (20 нг/мл), Wnt-5a (20 нг/мл) и Wnt-7a (20 нг/мл), как указано на этих панелях. Клетки обрабатывали в течение 5 дней. Результаты выражены как кратность увеличения относительно недифференцированных клеток.
На фиг.27 представлена экспрессия CXCR4 в культурах эмбриональных стволовых клеток человека линии H9 пассажа 46, по данным FACS через пять дней после обработки. На панели (a) представлена экспрессия CXCR4 в отсутствие Wnt-3a. На панели (b) представлена экспрессия CXCR4 после обработки 10 нг/мл Wnt-3a. На панели (c) представлена экспрессия CXCR4 после обработки 20 нг/мл Wnt-3a, и на панели (d) представлена экспрессия CXCR4 после обработки 50 нг/мл Wnt-3a.
На фиг.28 представлена экспрессия характерных маркеров, указанных в культурах эмбриональных стволовых клеток человека линии H9 через 5 дней после обработки. Результаты показаны как кратность увеличения экспрессии относительно необработанных клеток, как определено с помощью ПЦР в режиме реального времени. На панели (а) показано действие 10, 20 и 50 нг/мл Wnt-3a на экспрессию указанных маркерных генов дефинитивной эндодермы. На панели (b) показано действие 1, 5 или 10 нг/мл Wnt-3a (ось x метки: 10, 5, 1) на экспрессию goosecoid  и экспрессию CXCR4
и экспрессию CXCR4  через 2 (2 д) и 5 (5 д) дней после обработки. На панели (с) показано действие 1, 5 или 10 нг/мл Wnt-3a на число клеток, на 2 день
через 2 (2 д) и 5 (5 д) дней после обработки. На панели (с) показано действие 1, 5 или 10 нг/мл Wnt-3a на число клеток, на 2 день  или 5 день
или 5 день 
На фиг.29 представлена экспрессия CXCR4 в культурах эмбриональных стволовых клеток человека линии H9 по данным FACS, после 5 дневной обработки по протоколу дифференцировки, описанному в примере 4. Клетки культивировали в отсутствие Wnt-3a или GSK-3B ингибитора (панель a), 20 нг/мл Wnt-3a в течение всего 5 дневного периода (панель b), 1000 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель c), 500 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель d), 100 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель e), 10 нМ GSK-3B ингибитора IX в течение всего 5 дневного периода (панель f), 100 нМ GSK-3B ингибитора IX в течение 1-2 дней (панель g), 10 нМ GSK-3B ингибитора IX в течение 1-2 дней (панель h).
На фиг.30 представлена генная экспрессия маркеров дефинитивной эндодермы посредством ПЦР в режиме реального времени. Результаты выражены как кратность увеличения относительно необработанных клеток. На панели (а) показаны данные, полученные от эмбриональных стволовых клеток человека линии H9 с количеством пассажей 48, обработанных по протоколу для дефинитивной эндодермы, описанному в примере 4, содержащему Wnt-3a или GSK-3B ингибитор в указанных концентрациях и времени. На панели (b) показаны данные, полученные от эмбриональных стволовых клеток человека линии H9 с количеством пассажей 46, обработанных по протоколу для дефинитивной эндодермы, описанному в примере 4, содержащему Wnt-3a или GSK-3B ингибитор в указанных концентрациях и времени.
На фиг.31 представлена экспрессия CXCR4 по данным FACS для линий эмбриональных стволовых клеток, используемых в настоящем изобретении. На панелях (a-d) показаны данные, полученные от эмбриональных стволовых клеток человека линии H9 с количеством пассажей 49. На панелях (e-f) показаны данные, полученные от эмбриональных стволовых клеток человека линии H1 с количеством пассажей 46. Данные были получены через 5 дней после обработки. Клетки были обработаны в следующих условиях: панель (a): 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ GSK-3B ингибитора IX в течение первых двух дней; панель (d): 10 нг/мл активина A в течение всех пяти дней плюс 100 нМ GSK-3B IX ингибитора в течение первых двух дней, панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней, и панель (f):10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней.
На фиг.32 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 49, обработанных 10, 50 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B, и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражены как кратность увеличения относительно необработанных клеток.
На фиг.33 представлена экспрессия CXCR4 по данным FACS для эмбриональных стволовых клеток линии H9 пассажа 53. Данные были получены через 5 дней после обработки. Клетки обрабатывали в следующих условиях: Панель (a): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней и 25 нг/мл BMP-4 в течение 3-5 дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ GSK-3B ингибитора IX в течение первых двух дней; панель (d): 20 нг/мл Wnt-3a+25 нг/мл BMP-4 в течение всех пяти дней; панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a+100 нМ GSK-3B ингибитора IX в течение первых двух дней, и панель (f): 100 нг/мл активина A+25 нг/мл BMP-4 в течение всех пяти дней. Для всех панелей ось X представляет экспрессию CD9, а ось Y представляет экспрессию CXCR4 (CD184).
На фиг.34 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени, для культур эмбриональных стволовых клеток человека линии H1 пассажа 46, обработанных 10 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a или 100 нМ GSK-3B ингибитора: панель (a): экспрессия AFP, Bry, CXCR4, GSC, и POU5F (Oct-4) и панель (b): SOX-17, HNF-3B, и GATA4. Результаты выражены как кратность увеличения относительно необработанных клеток.
На фиг.35 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 49, обработанных 50 или 100 нг/мл активина A плюс 10 или 100 нМ GSK-3B ингибитора: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B, и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражены как кратность увеличения относительно необработанных клеток.
На фиг.36 представлена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 53, обработанных сочетаниями активина A, Wnt-3a, GSK-3 ингибитора, и BMP-4, в течение пяти дней: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B, и SOX7 и панель (b): SOX-17, HNF-3B и GATA4.
На фиг.37 представлено процентное значение экспрессии CXCR4, определенной с помощью FACS, в культурах эмбриональных стволовых клеток человека линии H9, обработанных в условиях, перечисленных в примере 22.
На фиг.38 представлена экспрессия маркеров дефинитивной эндодермы, как определено с помощью FACS, в культурах эмбриональных стволовых клеток человека линии H9, культивированных на фибронектине (панель a) или MATRIGEL™ (панель b).
На фиг.39 представлена экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени, в культурах эмбриональных стволовых клеток человека линии H9, культивированных на фибронектине  или 1:10 разведении MATRIGEL с пониженным содержанием фактора роста
или 1:10 разведении MATRIGEL с пониженным содержанием фактора роста 
На фиг.40 представлено действие различных концентраций MATRIGEL в присутствии сыворотки низкой концентрации, 100 нг/мл активина A и 20 нг/мл Wnt-3a на дифференцировку эмбриональных стволовых клеток человека в дефинитивную эндодерму. Клетки были обработаны в соответствии со способами, описанными в примере 4. Результаты показаны как уровни экспрессии указанных генов, как определено с помощью ПЦР в режиме реального времени.
На фиг.41 изображена роль Wnt-3a в образовании дефинитивной эндодермы эмбриональными стволовыми клетками человека, подращиваемыми на MATRIGEL, но дифференцированных на эмбриональных фибробластах мыши. На панелях (a-d) показаны данные ПЦР в режиме реального времени для указанных генов. На панелях (e-g) показаны данные FACS для указанных условий.
На фиг.42 показана дифференцировка эмбриональных стволовых клеток человека, культивируемых на субстрате для тканевых культур, покрытом MATRIGEL™ для дефинитивной эндодермы с последующей обработкой Wnt ингибитором DKK-1. Показанные результаты представляют собой экспрессию указанных генов, как определено с помощью ПЦР в режиме реального времени в клетках H9, обработанных в соответствии со способами, описанными в примере 4 в присутствии 20 нг/мл Wnt-3A плюс 100 нг/мл DKK1 (DE+DKK1) или в отсутствие DKK1 (DE).
На фиг.43 показано иммунофлуоресцентное окрашивание маркеров дефинитивной эндодермы в культурах эмбриональных стволовых клеток человека линии H9, культивированных на субстрате для тканевых культур, покрытом MATRIGEL, и дифференцированных в сыворотке низкой концентрации плюс 100 нг/мл активина-A без (панель a) или с (панель b) 20 нг/мл Wnt-3a. Ecad=E-кадгерин, NCAM=N-кадгерин.
На фиг.44 показана дифференцировка эмбриональных стволовых клеток человека линии SA002 пассажа 38 в дефинитивную эндодерму. Клетки обрабатывали в течение пяти дней в указанных условиях и генную экспрессию определяли с помощью ПЦР в режиме реального времени для генов, указанных на панелях.
На фиг.45 показана экспрессия CXCR4 по данным FACS в линии эмбриональных стволовых клеток человека SA002 пассажа 38 после обработки 100 нг/мл активина A (панель a), 100 нг/мл активина A+20 нг/мл Wnt-3a (панель b) или 100 нг/мл активина A+100 нМ GSK-3B ингибитора IX (панель c). Клетки обрабатывали в течение пяти дней.
На фиг.46 показана дифференцировка эмбриональных стволовых клеток человека линии H1 пассажа 55 в дефинитивную эндодерму на субстрате для тканевых культур, покрытом сывороткой человека. Клетки обрабатывали в указанных условиях и генную экспрессию определяли с помощью ПЦР в режиме реального времени, для генов, указанных на панелях.
На фиг.47 показана дифференцировка культур эмбриональных стволовых клеток человека линии H1 при P54, на субстрате для тканевых культур, покрытом MATRIGEL™, в дефинитивную эндодерму. Действия различных GSK-B ингибиторов тестировали, следуя пятидневному протоколу DE. Следующие GSK-3B ингибиторы оценивали при 100 нМ в течение первых двух дней обработки: GSK-3B VIII, IX, XI и XII.
На фиг.48 показана экспрессия AFP (панель a), Pdx-1 (панель b), Cdx-2 и Glut-2 (панель c) и HNF-3бета, HNF-6 и соматостатина (панель d) в культурах эмбриональных стволовых клеток человека линии H9 пассажа 49, культивированных и обработанных в соответствии со способами, описанными в примере 4, в присутствии 20 нг/мл Wnt-3a в течение первых двух дней обработки. Вслед за этой обработкой клетки обрабатывали в течение еще трех дней 2% FBS плюс 1 мкМ ретиноевой кислоты, 0,1 - 1 мкМ TTNPB (4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталенил)-1-пропенил]бензойной кислоты (каротиноидная кислота)) или 0,1-10 мкМ AM-580 (4-[(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталенил)карбоксамид]бензойной кислоты). Далее клетки обрабатывали в течение еще трех дней в 2% FBS плюс 20 нг/мл bFGF.
На фиг.49 показаны результаты ПЦР в режиме реального времени экспрессии маркеров дефинитивной эндодермы, указанных на панелях a и b, в культурах эмбриональных стволовых клеток человека линии H1, обработанных активином A и Wnt-1 в течение указанного времени и в указанных концентрациях.
На фиг.50 представлена экспрессия CXCR4 и CD9 по данным FACS на 4-5 день для EXPRES01, BGO1V и H1 клеточных линий P50, подвергавшихся воздействию определенной средой дифференцировки или средой дифференцировки на основе минимальной сыворотки.
На фиг.51 изображены данные ПЦР в режиме реального времени для EXPRES01, BGO1V и H1 культур, обработанных минимальной сывороточной или специфической средой+активин A+WNT3A на 4-5 день.
На фиг.52 представлены иммунофлуоресцентные изображения EXPRES 01 клеток P49, дифференцированных в DE, используя 1% b27+DM-F12+активин A+WNT3A+GSK03B ингибитор в течение пяти дней.
На фиг.53 представлены данные ПЦР в режиме реального времени для клеток H1, на которые воздействовали либо минимальной сывороткой+активном A, либо специфической средой+активин A на 1-5 день.
ПОДРОБНОЕ ОПИСАНИЕ
Для ясности изложения, а не для ограничения, подробное описание изобретения разделено на подразделы, в которых описаны или проиллюстрированы определенные признаки, варианты осуществления или применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, характеризующиеся их способностью на одноклеточном уровне как к самообновлению, так и к дифференцировке с образованием потомства клеток, в том числе самообновляющихся клеток-предшественников, не обновляющихся клеток-предшественников и окончательно дифференцированных клеток. Стволовые клетки также характеризуются их способностью к дифференцировке in vitro в функциональные клетки различных линий клеточной дифференцировки из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также приводить к образованию тканей нескольких зародышевых листков после трансплантации и вносят вклад по существу в большинство, если не все ткани после инъекции в бластоцисты.
Стволовые клетки классифицируются по их потенциалу развития на: (1) тотипотентные, означая способность давать начало всем эмбриональным и внеэмбриональным клеточным типам; (2) плюрипотентные, означая способность давать начало всем эмбриональным клеточным типам; (3) мультипотентные, означая способность давать начало субпопуляции линий дифференцировки, но все в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (HSC) могут продуцировать потомство, которое включает HSC (самообновление), клетки крови, ограниченные олигопотентные предшественники и все клеточные типы и элементы (например, тромбоциты), которые являются нормальными компонентами крови); (4) олигопотентные, означая способность давать начало более ограниченной субпопуляции клеточных линий дифференцировки, чем мультипотентные стволовые клетки; и (5) унипотентные, означая способность давать начало единственной клеточной линии дифференцировки (например, сперматогенные стволовые клетки).
Дифференцировка представляет собой процесс, посредством которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает признаки специализированной клетки, как, например, нервной клетки или мышечной клетки. Дифференцированная или индуцированная дифференцировкой клетка представляет собой клетку, которая стала на более специализированное («коммиттированное») положение в последовательности клеточных поколений. Термин «коммиттированная» при применении к процессу дифференцировки относится к клетке, которая прошла по пути дифференцировки до точки, в которой при нормальных обстоятельствах она продолжит дифференцироваться в специфический клеточный тип или субпопуляцию клеточных типов и не может при нормальных обстоятельствах дифференцироваться в другой клеточный тип или вернуться к менее дифференцированному клеточному типу. Де-дифференцировка относится к процессу, посредством которого клетка возвращается в менее специализированное (или коммитированное) положение в последовательности клеточных поколений. Используемая в настоящем описании последовательность клеточных поколений характеризует наследственность клетки, т.е. из каких клеток она произошла и каким клеткам она может дать начало. Последовательность клеточных поколений размещает клетки в пределах наследственной схемы развития и дифференцировки. Линиеспецифичный маркер относится к характеристике, специфично связанной с фенотипом клеток линии дифференцировки, представляющей интерес, и может быть использован для оценки дифференцировки некоммиттированной клетки в представляющую интерес линию дифференцировки.
Используемый в настоящем изобретении «AFP» или «белок альфа-фетопротеин» относится к антигену, продуцируемому в начале развития печени. AFP также может быть экспрессирован во внеэмбриональных клетках.
«Альбумин» представляет собой мономерный белок, который составляет примерно половину всех сывороточных белков у взрослых.
«β-клеточная линия дифференцировки» относится к клеткам с положительной генной экспрессией в отношении транскрипционного фактора PDX-1 и по меньшей мере одного из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 бета, MAFA, Pax4 и Pax6. Клетки, экспрессирующие маркеры, характерные для β-клеточной линии дифференцировки, включают β клетки.
«Brachyury», используемый в настоящем изобретении, является представителем семейства генов T-box. Он является маркером клеток первичной полоски и мезодермы.
«Клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы», используемые в настоящем изобретении, относятся к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: SOX-17, GATA-4, HNF-3 бета, GSC, Cer1, Nodal, FGF8, Brachyury, Mix-подобный гомеобокс белок, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA-6, CXCR4, C-Kit, CD99, или OTX2. Клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, включают клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезоэндодермы и клетки дефинитивной эндодермы.
«c-Kit» и «CD117» оба относятся к рецепторной тирозинкиназе клеточной поверхности, имеющей последовательность, описанную в Genbank Accession No. X06182, или природный вариант этой последовательности (например, аллельный вариант).
Используемый в настоящем описании «CD99» относится к белку, кодируемому геном wit номер доступа NM_002414.
«Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы», в настоящем описании относятся к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: PDX-1, HNF-1бета, PTF-1 альфа, HNF-6, или HB9. Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, включают клетки панкреатической эндодермы.
«Клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки», в настоящем описании относятся к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: NGN-3, NeuroD, Islet-1, PDX-1, NKX6.1, Pax-4, Ngn-3 или PTF-1 альфа. Клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, включают панкреатические эндокринные клетки, клетки, экспрессирующие гормоны поджелудочной железы, и клетки, секретирующие гормоны поджелудочной железы, и клетки β-клеточной линии дифференцировки.
«Cer1» или «Cerebrus» в настоящем описании относится к представителю суперсемейства белков «цистеиновый узел».
«CXCR4» в настоящем описании относится к рецептору стромального клеточного фактора 1 (SDF-1), также известного как «LESTR» или «фузин». При гаструляции мышиного эмбриона CXCR4 экспрессируется в дефинитивной эндодерме и мезодерме, а не во внеэмбриональной эндодерме.
«Дефинитивная эндодерма» в настоящем описании относится к клеткам, которые несут характеристики клеток, возникающих из эпибласта во время гаструляции и которые формируют желудочно-кишечный тракт и его производные. Клетки дефинитивной эндодермы экспрессируют следующие маркеры: HNF-3 бета, GATA-4, SOX-17, Cerberus, OTX2, goosecoid, C-Kit, CD99, и Mixl1.
«Внеэмбриональная эндодерма» в настоящем описании относится к популяции клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX-7, AFP и SPARC.
«FGF-2», «FGF-4» «FGF-8» «FGF-10» и «FGF-17» в настоящем описании являются представителями семейства фактора роста фибробластов.
«GATA-4» и «GATA-6» являются представителями семейства транскрипционного фактора GATA. Это семейство транскрипционных факторов индуцируется сигнальным путем TGF-β и вносит вклад в сохранение ранних маркеров эндодермы.
«GLUT-2» в настоящем описании относится к молекуле переносчику глюкозы, которая экспрессируется в многочисленных эмбриональных тканях и тканях взрослого организма, в том числе поджелудочной железе, печени, кишечнике, головном мозге и почках.
«Goosecoid» или «GSC» в настоящем описании относится к гомеодоменному транскрипционному фактору, экспрессируемому в дорсальной губе бластопоры.
«HB9» в настоящем описании относится к гомеобокс-гену 9.
«HNF-1 альфа», «HNF-1 бета», «HNF-3 бета» и «HNF-6» принадлежат печеночному ядерному фактору семейства транскрипционных факторов, который характеризуется высококонсервативным ДНК связывающим доменом и двумя короткими карбоксиконцевыми доменами.
«Islet-1» или «Isl-1» в настоящем описании является представителем LIM/гомеодомена семейства транскрипционных факторов и экспрессируется в развивающейся поджелудочной железе.
«MafA» в настоящем описании представляет собой транскрипционный фактор, экспрессируемый в поджелудочной железе, и контролирует экспрессию генов, вовлеченных в биосинтез и секрецию инсулина.
«Маркеры» в настоящем описании представляют собой молекулы нуклеиновой кислоты или полипептида, которые дифференциально экспрессируются в клетке, представляющей интерес. В этом контексте дифференциальная экспрессия означает повышенный уровень для положительного маркера и сниженный уровень для отрицательного маркера. Определяемый уровень маркерной нуклеиновой кислоты или полипептида существенно выше или ниже в клетках, представляющих интерес, по сравнению с другими клетками, так что представляющую интерес клетку можно идентифицировать и отличить от других клеток, используя любой из целого ряда способов, известных в данной области.
«Клетка мезодермы» в настоящем описании относится к клетке, экспрессирующей по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF-3 бета, GSC, FGF17, GATA-6.
«Mixl1» в настоящем описании относится к гомеобокс-гену, который является маркером для клеток в первичной полоске, мезодерме и эндодерме.
«NeuroD» в настоящем описании представляет собой основной транскрипционный фактор спираль-петля-спираль (bHLH), участвующий в нейрогенезе.
«NGN-3» в настоящем описании является представителем семейства нейрогенина основных транскрипционных факторов спираль-петля-спираль.
«Nkx-2.2» и «Nkx-6.1» в настоящем описании являются представителями семейства транскрипционных факторов Nkx.
«Nodal» в настоящем описании является представителем суперсемейства белков TGF бета.
«Oct-4» является представителем транскрипционного фактора POU-домен и по праву считается отличительным признаком плюрипотентных стволовых клеток. На взаимосвязь Oct-4 с плюрипотентными стволовыми клетками указывает его сильно ограниченная недифференцированными плюрипотентными стволовыми клетками экспрессия. При дифференцировке в соматические линии дифференцировки экспрессия Oct-4 быстро исчезает.
«Панкреатическая эндокринная клетка», или «клетка, экспрессирующая гормоны поджелудочной железы», в настоящем описании относится к клетке, способной экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
«Клетка, секретирующая гормоны поджелудочной железы» в настоящем описании относится к клетке, способной секретировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
«Pax-4» и «Pax-6» в настоящем описании представляют собой транскрипционные факторы, специфичные для β-клеток поджелудочной железы, которые участвуют в развитии островков.
«PDX-1» в настоящем описании относится к гомеодомену транскрипционного фактора, участвующему в развитии поджелудочной железы.
«Клетка пре-первичной полоски» в настоящем описании относится к клетке, экспрессирующей по меньшей мере один из следующих маркеров: Nodal или FGF8.
«Клетка первичной полоски» в настоящем описании относится к клетке, экспрессирующей по меньшей мере один из следующих маркеров: Brachyury, Mix-подобный гомеобокс-белок или FGF4.
«PTF-1 альфа» в настоящем описании относится к основному белку спираль-петля-спираль 48 кДа, который представляет собой последовательность-специфичную ДНК-связывающую субъединицу тримерного панкреатического транскрипционного фактора-1 (PTF1).
«SOX-1», «SOX-2», «SOX-7» и «SOX-17» в настоящем описании являются представителями семейства транскрипционных факторов SOX и участвуют в эмбриогенезе.
«SPARC» в настоящем описании также известен как «кислый секретируемый белок и богатый цистеином».
«SSEA-1» (стадиеспецифичный эмбриональный антиген-1) представляет собой гликолипидный поверхностный антиген, находящийся на поверхности стволовых клеток мышиной тератокарциномы (EC), эмбриональных зародышевых клетках мыши и человека (EG) и мышиных эмбриональных стволовых клетках (ES).
«SSEA-3» (стадиеспецифичный эмбриональный антиген-3) представляет собой гликолипидный поверхностный антиген, находящийся на поверхности стволовых клеток тератокарциномы человека (EC), эмбриональных зародышевых клеток человека (EG) и эмбриональных стволовых клеток человека (ES).
«SSEA-4» (стадиеспецифичный эмбриональный антиген-4) представляет собой гликолипидный поверхностный антиген, находящийся на поверхности стволовых клеток тератокарциномы человека (EC), эмбриональных зародышевых клеток человека (EG) и эмбриональных стволовых клеток человека (ES).
«TRA1-60» представляет собой кератинсульфат родственный антиген, который экспрессируется на поверхности стволовых клеток тератокарциномы человека (EC), эмбриональных зародышевых клеток человека (EG) и эмбриональных стволовых клеток человека (ES).
«TRA1-81» представляет собой кератинсульфат родственный антиген, который экспрессируется на поверхности стволовых клеток тератокарциномы человека (EC), эмбриональных зародышевых клеток человека (EG) и эмбриональных стволовых клеток человека (ES).
«TRA2-49» представляет собой изозим щелочной фосфатазы на поверхности стволовых клеток тератокарциномы человека (EC) и эмбриональных стволовых клеток человека (ES).
«UTF-1» в настоящем описании относится к коактиватору транскрипции, экспрессируемому в плюрипотентных эмбриональных стволовых клетках и внеэмбриональных клетках.
«Zic1» в настоящем описании является представителем семейства Zic транскрипционного фактора. Zic1 регулирует экспрессию нейрональных и нейрональных крест-специфичных генов и экспрессируется в клетках дорсальной нервной трубки и пре-мигрирующего нервного гребня.
Выделение, размножение и культивирование плюрипотентных стволовых клеток
Характеристика плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или несколько стадиеспецифичных эмбриональных антигенов (SSEA) 3 и 4 и маркеры, выявляемые с помощью антител, обозначенных Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцировка плюрипотентных клеток in vitro приводит к потере экспрессии SSEA-4, Tra-1-60 и Tra-1-81 (при наличии) и повышению экспрессии SSEA-1. Недифференцированные плюрипотентные стволовые клетки обычно обладают активностью щелочной фосфатазы, которую можно определить путем фиксации клеток 4% параформальдегидом, а затем обнаруживая с помощью Vector Red в качестве субстрата, как описано производителем (Vector Laboratories, Burlingame Calif.). Недифференцированные плюрипотентные стволовые клетки также обычно экспрессируют Oct-4 и TERT, определяемые с помощью РВ-ПЦР.
Другим желаемым фенотипом размноженных плюрипотентных стволовых клеток является возможность дифференцироваться в клетки всех трех зародышевых листков: тканей эндодермы, мезодермы и эктодермы. Плюрипотентность плюрипотентных стволовых клеток может быть подтверждена, например, путем введения клеток мышам с тяжелым комбинированным иммудодефицитом (SCID), фиксируя образующиеся тератомы 4% параформальдегидом, а затем исследуя их гистологически для подтверждения наличия всех клеточных типов из трех зародышевых листков. Альтернативно, плюрипотентность может быть определена путем создания эмбриоидных тел и оценки эмбриоидных тел на наличие маркеров, связанных с тремя зародышевыми листками.
Размноженные линии плюрипотентных стволовых клеток могут быть кариотипированы, используя стандартную технологию G-бэндинга, и проведено сравнение с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, которые имеют «нормальный кариотип», что означает, что клетки являются эуплоидными, в которых присутствуют все хромосомы человека, и заметно не изменены.
Источники плюрипотентных стволовых клеток
Типы плюрипотентных стволовых клеток, которые могут быть использованы, включают устойчивые линии плюрипотентных стволовых клеток, полученных из тканей, сформированных после гестации, в том числе пре-эмбриональной ткани (например, такой как бластоцист), эмбриональной ткани или зародышевой ткани, взятой в любой момент во время гестации, обычно, но не обязательно, приблизительно до 10-12 недель гестации. Неограничивающие примеры представляют собой устойчивые линии эмбриональных стволовых клеток человека или эмбриональных зародышевых клеток человека, например, таких как линии эмбриональных стволовых клеток человека H1, H7 и H9 (WiCell). Также рассматривается применение композиции по настоящему описанию во время создания или стабилизации таких клеток, в этом случае источником клеток могли быть первичные плюрипотентные клетки, взятые непосредственно из ткани-источника. Также подходящими являются клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие клеток-кормилиц. Также подходящими являются мутантные линии эмбриональных стволовых клеток человека, например, такие как BG01v (BresaGen, Athens, GA).
В одном варианте осуществления эмбриональные стволовые клетки человека получают, как описано Thomson et al. (патент США №5843780; Science 282:1145, 1998; Curr. Top.Dev. Biol. 38:133 ff., 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культивирование плюрипотентных стволовых клеток
В одном варианте осуществления плюрипотентные стволовые клетки обычно культивируют на слое клеток-кормилиц, которые поддерживают плюрипотентные стволовые клетки различными путями. Альтернативно, плюрипотентные стволовые клетки культивируют в культуральной системе, которая по существу свободна от клеток-кормилиц, но, тем не менее, поддерживает пролиферацию плюрипотентных стволовых клеток, не подвергая их значительной дифференцировке. Рост плюрипотентных стволовых клеток в культуре, свободной от клеток-кормилиц, без дифференцировки поддерживают, используя среду, кондиционированную путем культивирования предварительно с другим типом клеток. Альтернативно, рост плюрипотентных стволовых клеток в культуре, свободной от клеток-кормилиц, без дифференцировки, поддерживают, используя химическую среду определенного состава. В одном варианте осуществления рост плюрипотентных стволовых клеток в культуре, свободной от клеток-кормилиц, без дифференцировки поддерживают, используя химическую среду определенного состава, состоящую из среды, дополненной B27.
Например, Reubinoff et al (Nature Biotechnology 18: 399-404 (2000)) и Thompson et al (Science 6 November 1998: Vol.282. no. 5391, pp.1145 - 1147) описывают культуру линий плюрипотентных стволовых клеток из бластоцистов человека, используя слой клеток-кормилиц мышиных эмбриональных фибробластов.
Richards et al (Stem Cells 21: 546-556, 2003) исследовали панель 11 различных слоев клеток-кормилиц взрослого человека, зародышевых и новорожденных на их способность поддерживать культуру плюрипотентных стволовых клеток человека. Richards et al утверждает: «линии эмбриональных стволовых клеток человека, культивированные на клетках-кормилицах - фибробластах кожи взрослого человека, сохраняют морфологию эмбриональных стволовых клеток человека и остаются плюрипотентными».
В US20020072117 описываются клеточные линии, которые продуцируют среду, которая поддерживает рост плюрипотентных стволовых клеток приматов в культуре без питающего подслоя. Используемые клеточные линии представляют собой мезенхимальные и фибробласт-подобные клеточные линии, полученные из эмбриональных тканей или дифференцированные из эмбриональных стволовых клеток. В US20020072117 также описывается применение клеточных линий в качестве первичного слоя клеток-кормилиц.
В другом примере, Wang et al (Stem Cells 23: 1221-1227, 2005) описывает способы длительного выращивания плюрипотентных стволовых клеток человека на слоях клеток-кормилиц, полученных из эмбриональных стволовых клеток человека.
В другом примере, Stojkovic et al (Stem Cells 2005 23: 306-314, 2005) описывают систему клеток-кормилиц, полученную в результате спонтанной дифференцировки эмбриональных стволовых клеток человека.
В другом примере, Miyamoto et al (Stem Cells 22: 433-440, 2004) описывают источник клеток-кормилиц, полученных из плаценты человека.
Amit et al (Biol. Reprod 68: 2150-2156, 2003) описывает слой клеток-кормилиц, полученных из крайней плоти человека.
В другом примере, Inzunza et al (Stem Cells 23: 544-549, 2005) описывают слой клеток-кормилиц из постнатальных фибробластов крайней плоти человека.
В US6642048 описывается среда, которая поддерживает рост плюрипотентных стволовых клеток приматов (pPS) в культуре без питающего подслоя, и клеточные линии, подходящие для продукции такой среды. В US6642048 утверждается: «Настоящее изобретение включает мезенхимальные и фибробласт-подобные клеточные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. Способы получения таких клеточных линий, рабочих сред и растущих стволовых клеток, использующих кондиционированную среду, описаны и проиллюстрированы в настоящем описании».
В другом примере, в WO2005014799 описывается кондиционированная среда для поддержания, пролиферации и дифференцировки клеток млекопитающих. В WO2005014799 утверждается: «Культуральная среда, полученная в соответствии с настоящим изобретением, кондиционирована клеточной секреторной активностью клеток мыши, в частности дифференцированных и иммортализованных трансгенных гепатоцитов, названных MMH (Met Murine Hepatocyte)».
В другом примере, Xu et al (Stem Cells 22: 972-980, 2004) описывает кондиционированную среду, полученную из производных эмбриональных стволовых клеток человека, которые были генетически модифицированы для гиперэкспрессии теломеразной обратной транскриптазы человека.
В другом примере, в US20070010011 описывается культуральная среда определенного химического состава для подращивания плюрипотентных стволовых клеток.
В альтернативной культуральной среде используется бессывороточная среда, дополненная факторами роста, способными стимулировать пролиферацию эмбриональных стволовых клеток. Например, Cheon et al (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005) описывают бессывороточную культуральную систему без питающего подслоя, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной сывороточной замещающей среде (SR), дополненной различными факторами роста, способными индуцировать самообновление эмбриональных стволовых клеток.
В другом примере, Levenstein et al (Stem Cells 24: 568-574, 2006) описывают способы длительного культивирования эмбриональных стволовых клеток человека в отсутствие фибробластов или кондиционированной среды, используя среду, дополненную bFGF.
В другом примере, в US20050148070 описывается способ культивирования эмбриональных стволовых клеток человека в среде определенного состава без сыворотки и без клеток-кормилиц - фибробластов, указанный способ предусматривает: культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минералы, по меньшей мере один трансферрин или заменитель трансферрина, по меньшей мере один инсулин или заменитель инсулина, указанная культуральная среда по существу свободна от эмбриональной сыворотки млекопитающего и содержит по меньшей мере примерно 100 нг/мл фактора роста фибробластов, способного активировать сигнальный рецептор фактора роста фибробластов, где указанный фактор роста поступает из источника, отличного только от питающего подслоя фибробластов, указанная среда поддерживала пролиферацию стволовых клеток в недифференцированном состоянии без клеток-кормилиц или кондиционированной среды.
В другом примере, в US20050233446 описывается среда определенного состава, используемая при культивировании стволовых клеток, в том числе недифференцированных примордиальных стволовых клеток приматов. В растворе указанная среда по существу является изотоничной в отношении культивируемых стволовых клеток. В заданной культуре конкретная среда содержит основную среду и некоторое количество каждого из bFGF, инсулина и аскорбиновой кислоты, необходимых для поддержания по существу недифференцированного роста примордиальных стволовых клеток.
В другом примере в US6800480 утверждается: «В одном варианте осуществления предлагается клеточная культуральная среда для роста примордиальных стволовых клеток, полученных от приматов, в по существу недифференцированном состоянии, которая включает низкое осмотическое давление, основную среду с низким содержанием эндотоксина, которая эффективна для поддержания роста примордиальных стволовых клеток, полученных от приматов. Основную среду объединяют с питательной сывороткой, эффективной для поддержания роста примордиальных стволовых клеток, полученных от приматов, и субстратом, выбранным из группы, состоящей из клеток-кормилиц и компонента внеклеточного матрикса, образованного из клеток-кормилиц. Эта среда дополнительно включает заменимые аминокислоты, антиоксидант, первый фактор роста, выбранный из группы, состоящей из нуклеозидов и соли пирувата».
В другом примере, в US20050244962 утверждается: «в одном аспекте настоящее изобретение относится к способу культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируют в культуре, по существу свободной от эмбриональной сыворотки млекопитающих (предпочтительно также по существу свободной от любой сыворотки животного) и в присутствии фактора роста фибробластов, который поступает из источника, отличного лишь от питающего подслоя фибробластов. В предпочтительном виде питающий подслой фибробластов, ранее требуемый для поддержания культуры стволовых клеток, становится необязательным, посредством добавления достаточного количества фактора роста фибробластов».
В дополнительном примере, в WO2005065354 описывается изотоничная культуральная среда определенного состава, которая по существу свободна от питающего подслоя и свободна от сыворотки, содержащая: a) базальную среду; b) количество bFGF, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; c) некоторое количество инсулина, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; и d) некоторое количество аскорбиновой кислоты, достаточное для поддержания роста по существу недифференцированных стволовых клеток человека.
В другом примере, в WO2005086845 описывается способ сохранения недифференцированных стволовых клеток, указанный способ предусматривает воздействие на стволовую клетку представителя семейства белков трансформирующего фактора роста бета (TGFβ), представителя семейства белков фактора роста фибробластов (FGF), или никотинамида (NIC) в количестве, достаточном для сохранения клеток в недифференцированном состоянии в течение достаточного количества времени для достижения желаемого результата.
Плюрипотентные стволовые клетки могут быть помещены на подходящий культуральный субстрат. В одном варианте осуществления подходящий культуральный субстрат представляет собой компонент внеклеточного матрикса, как, например, полученный из базальной мембраны или который может формировать часть сцеплений рецептора молекулы адгезии с лигандом. В одном варианте осуществления подходящим культуральным субстратом является MATRIGEL® (Becton Dickenson). MATRIGEL® представляет собой растворимый препарат из опухолевых клеток Engelbreth-Holm-Swarm, который образует гель при комнатной температуре с образованием реконструированной базальной мембраны.
В качестве альтернативы подходят другие компоненты внеклеточного матрикса и смеси компонентов. В зависимости от пролиферирующего клеточного типа это может включать ламинин, фибронектин, протеогликан, энтактин, гепарансульфат и подобное, отдельно или в различных сочетаниях.
Плюрипотентные стволовые клетки могут находиться на субстрате в подходящем распределении и в присутствии среды, которая способствует выживанию клеток, размножению и сохранению желаемых характеристик. Все эти характеристики являются благоприятными в результате пристального внимания к распределению при засеивании и легко могут быть определены специалистом в данной области.
Подходящая культуральная среда может быть получена из следующих компонентов, например, таких как, модифицированная по Дульбекко среда Игла (DMEM), Gibco # 11965-092; Knockout модифицированная по Дульбекко среда Игла (KO DMEM), Gibco # 10829-018; Ham's F12/50% минимальная среда DMEM; 200 мМ L-глутамин, Gibco # 15039-027; раствор заменимых аминокислот, Gibco 11140-050; β-меркаптоэтанол, Sigma # M7522; основной рекомбинантный фактор роста фибробластов человека (bFGF), Gibco # 13256-029.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки
Плюрипотентные стволовые клетки, подходящие для применения в настоящем изобретении, включают, например, эмбриональные стволовые клетки человека линии H9 (NIH код: WA09), эмбриональные стволовые клетки человека линии H1 (NIH код: WA01), эмбриональные стволовые клетки человека линии H7 (NIH код: WA07) и эмбриональные стволовые клетки человека линии SA002 (Cellartis, Sweden). Также для применения в настоящем изобретении подходят клетки, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных стволовых клеток: ABCG2, cripto, CD9, FoxD3, Connexin43, Connexin45, Oct4, Sox2, Nanog, hTERT, UTF-1, ZFP42, SSEA-3, SSEA-4, Tra1-60, Tra1-81.
Маркеры, характерные для линии дифференцировки дефинитивной эндодермы, выбраны из группы, состоящей из SOX-17, GATA4, Hnf-3бета, GSC, Cer1, Nodal, FGF8, Brachyury, Mix-подобного гомеобокс-белка, FGF4 CD48, эомезодермина (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и OTX2. Подходящими для применения в настоящем изобретении являются клетки, экспрессирующие по меньшей мере один из маркеров, характерных для линии дифференцировки дефинитивной эндодермы. В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, представляют собой клетки-предшественники первичной полоски. В альтернативном аспекте клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, представляют собой клетки мезоэндодермы. В альтернативном аспекте, клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, представляют собой клетки дефинитивной эндодермы.
Маркеры, характерные для линии дифференцировки панкреатической эндодермы, выбраны из группы, состоящей из Pdx1, HNF-1бета, PTF1a, HNF-6, HB9 и PROX1. Подходящими для применения в настоящем изобретении являются клетки, которые экспрессируют по меньшей мере один из маркеров, характерных для линии дифференцировки панкреатической эндодермы. В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, представляют собой клетки панкреатической эндодермы.
Маркеры, характерные для панкреатической эндокринной линии дифференцировки, выбраны из группы, состоящей из NGN-3, NeuroD, Islet-1, Pdx-1, NKX6.1, Pax-4, Ngn-3 и PTF-1 альфа. В одном варианте осуществления панкреатические эндокринные клетки способны экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Подходящими для применения в настоящем изобретении являются клетки, которые экспрессируют по меньшей мере один из маркеров, характерных для панкреатической эндокринной линии дифференцировки. В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, представляют собой панкреатические эндокринные клетки. Панкреатическими эндокринными клетками могут быть клетки, экспрессирующие гормоны поджелудочной железы. Альтернативно, панкреатические эндокринные клетки могут быть клетками, секретирующими гормоны поджелудочной железы.
В одном аспекте настоящего изобретения панкреатические эндокринные клетки представляют собой клетки, экспрессирующие маркеры, характерные для линии дифференцировки β клеток. Клетки, экспрессирующие маркеры, характерные для линии дифференцировки β клеток, экспрессируют Pdx1 и по меньшей мере один из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 бета, MAFA, Pax4 и Pax6. В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии дифференцировки β клеток, представляют собой β клетки.
Образование клеток, экспрессирующих маркеры, характерные
для линии дифференцировки дефинитивной эндодермы
Плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, любым способом, известным из уровня техники, или любым способом, предложенным в этом изобретении.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, в соответствии со способами, описанными у D'Amour et al, Nature Biotechnology 23, 1534-1541 (2005).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, в соответствии со способами, описанными у Shinozaki et al, Development 131, 1651-1662 (2004).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, в соответствии со способами, описанными у McLean et al, Stem Cells 25, 29-38 (2007).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем культивирования плюрипотентных клеток в среде, содержащей активин A в отсутствие сыворотки, затем культивирования клеток с активином A и сывороткой, а затем культивирования клеток с активином A и сывороткой в различных концентрациях. Пример этого способа описан в Nature Biotechnology 23, 1534-1541 (2005).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем культивирования плюрипотентных клеток в среде, содержащей активин A в отсутствие сыворотки, затем культивирования клеток с активином A с сывороткой в другой концентрации. Пример этого способа описан у D' Amour et al, Nature Biotechnology, 2005.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы путем культивирования плюрипотентных клеток в среде, содержащей активин A и лиганд Wnt в отсутствие сыворотки, затем удаления лиганда Wnt и культивирования клеток с активином A с сывороткой. Пример этого способа описан в Nature Biotechnology 24, 1392-1401 (2006).
В одном аспекте настоящего изобретения плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем высевания плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральной среде, содержащей сыворотку, в течение некоторого периода времени, а затем культивирования плюрипотентных стволовых клеток с активином A во второй культуральной среде, содержащей более высокую концентрацию сыворотки, примерно в течение другого периода времени.
Концентрация сыворотки в первой культуральной среде, описанной выше, может составлять примерно от нуля примерно до 0,5 процентов, и время культивирования может составлять примерно от одного примерно до трех дней. Концентрация сыворотки во второй культуральной среде, описанной выше, может составлять примерно от 0,5 процента примерно до двух процентов, а время культивирования может составлять примерно от одного примерно до четырех дней.
В альтернативном варианте осуществления настоящего изобретения плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем высевания плюрипотентных стволовых клеток на субстрат тканевой культуры, покрытый внеклеточным матриксом, затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральной среде, содержащей сыворотку, примерно в течение некоторого периода времени, и затем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt во второй культуральной среде, содержащей более высокую концентрацию сыворотки, в течение другого периода времени.
Концентрация сыворотки в первой культуральной среде, описанной выше, может составлять примерно от нуля примерно до 0,5 процентов, а время культивирования может составлять примерно от одного примерно до трех дней. Концентрация сыворотки во второй культуральной среде, описанной выше, может составлять примерно от 0,5 процента примерно до двух процентов, а время культивирования может составлять примерно от одного примерно до четырех дней.
В одном варианте осуществления настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, включающему стадии:
а) высевания плюрипотентных стволовых клеток на субстрат тканевой культуры, покрытый внеклеточным матриксом, и
b) культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt.
Культивирование плюрипотентных стволовых клеток с активином A и лигандом Wnt можно проводить в единой культуральной среде. Единая культуральная среда может представлять собой среду, дополненную сывороткой. Альтернативно, единая культуральная среда может представлять собой химическую среду определенного состава, содержащую среду, дополненную B27. Альтернативно, культивирование плюрипотентных стволовых клеток с активином A и лигандом Wnt можно проводить по отдельности или вместе в более чем одной культуральной среде. В одном варианте осуществления культивирование плюрипотентных стволовых клеток с активином A и лигандом Wnt проводят в двух культуральных средах. Несколько культуральных сред могут предствлять собой среды, дополненные сывороткой. Альтернативно, несколько культуральных сред могут представлять собой химические среды определенного состава, содержащие среды, дополненные B27.
Внеклеточный матрикс
В одном аспекте настоящего изобретения плюрипотентные стволовые клетки культивируют и дифференцируют на субстрате тканевой культуры, покрытом внеклеточным матриксом. Внеклеточный матрикс может представлять собой солюбилизированный препарат базальной мембраны, экстрагированный из клеток саркомы мыши (продаваемый компанией BD Biosciences под торговым наименованием MATRIGEL). Альтернативно, внеклеточный матрикс может представлять собой MATRIGEL с пониженным содержанием фактора роста. Альтернативно, внеклеточным матриксом может быть фибронектин. В альтернативном варианте осуществления плюрипотентные стволовые клетки культивируют и дифференцируют на субстрате тканевой культуры, покрытом сывороткой человека.
Внеклеточный матрикс может быть разбавлен до нанесения на субстрат тканевой культуры. Примеры подходящих способов для разбавления внеклеточного матрикса и для нанесения на субстрат тканевой культуры можно найти у Kleinman, H. K., et al., Biochemistry 25:312 (1986), and Hadley, M. A., et al., J. Cell. Biol. 101:1511 (1985).
В одном варианте осуществления внеклеточный матрикс представляет собой MATRIGEL. В одном варианте осуществления субстрат тканевой культуры покрыт MATRIGEL в разведении 1:10. В альтернативном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL в разведении 1:15. В альтернативном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL в разведении 1:30. В альтернативном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL в разведении 1:60.
В одном варианте осуществления внеклеточный матрикс представляет собой MATRIGEL с пониженным содержанием фактора роста. В одном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL с пониженным содержанием фактора роста в разведении 1:10. В альтернативном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL с пониженным содержанием фактора роста в разведении 1:15. В альтернативном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL с пониженным содержанием фактора роста в разведении 1:30. В альтернативном варианте осуществления субстрат тканевой культуры покрывают MATRIGEL с пониженным содержанием фактора роста в разведении 1:60.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, на внеклеточном матриксе, с использованием единой культуральной среды
При использовании единой культуральной среды она должна содержать достаточно низкие концентрации определенных факторов, чтобы дать возможность плюрипотентным стволовым клеткам дифференцироваться в дефинитивную эндодерму, например, таких как инсулин и IGF (как описано в WO2006020919). Это может достигаться путем снижения концентрации сыворотки, или альтернативно, путем использования среды определенного химического состава, в которой отсутствует инсулин и IGF. Примеры сред определенного химического состава описаны у Wiles et al (Exp Cell Res. 1999 Feb 25; 247(1): 241-8).
Концентрация сыворотки в культуральной среде может находиться в интервале примерно от 0% примерно до 10%. В альтернативном варианте осуществления концентрация может находиться в интервале примерно от 0% примерно до 5%. В альтернативном варианте осуществления концентрация может находиться в интервале примерно от 0% примерно до 2%. В альтернативном варианте осуществления концентрация может составлять примерно 2%.
Альтернативно, культуральная среда может быть дополнена B27 в интервале примерно от 0,5% примерно до 1%.
Время культивирования с активином А и лигандом Wnt может находиться в интервале примерно от 1 дня примерно до 7 дней. В альтернативном варианте осуществления время культивирования может находиться в интервале примерно от 1 дня примерно до 3 дней. В альтернативном варианте осуществления время культивирования может составлять примерно 3 дня.
Активин A может быть использован в любой концентрации, подходящей для индукции дифференцировки плюрипотентных стволовых клеток. Концентрация может составлять примерно от 1 пг/мл примерно до 100 мкг/мл. В альтернативном варианте осуществления концентрация может составлять примерно от 1 пг/мл примерно до 1 мкг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно от 1 пг/мл примерно до 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно от 50 нг/мл примерно до 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно 100 нг/мл.
Выбор лиганда Wnt может быть оптимизирован для улучшения эффективности процесса дифференцировки. Лиганд Wnt может быть выбран из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном варианте осуществления лиганд Wnt представляет собой Wnt-1. В альтернативном варианте осуществления лиганд Wnt представляет собой Wnt-3a.
Лиганд Wnt может быть в концентрации примерно от 1 нг/мл примерно до 1000 нг/мл. В альтернативном варианте осуществления концентрация может составлять примерно от 10 нг/мл примерно до 100 нг/мл.
Единая культуральная среда также может содержать ингибитор GSK-3B. Ингибитор GSK-3B может быть выбран из группы, состоящей из ингибитора GSK-3B IX и ингибитора GSK-3B XI. В одном варианте осуществления ингибитор GSK-3B представляет собой GSK-3B ингибитор IX. Авторы изобретения не увидели разницы между ингибиторами IX и XI. У авторов изобретения их не было в первоначально поданной патентной заявке WNT.
При культивировании плюрипотентных стволовых клеток с ингибитором GSK-3B, концентрация ингибитора GSK-3B может составлять примерно от 1 нМ примерно до 1000 нМ. В альтернативном варианте осуществления плюрипотентные стволовые клетки культивируют с ингибитором GSK-3B в концентрации примерно 10 нМ примерно до 100 нМ.
Единая культуральная среда также может содержать по меньшей мере один дополнительный фактор, который может усиливать образование клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы из плюрипотентых стволовых клеток. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, полученных способами по настоящему изобретению. Далее, по меньшей мере один другой дополнительный фактор может усиливать способность клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, полученных способами по настоящему изобретению, образовывать другие клеточные типы или улучшать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, представители семейства TGF-β, в том числе TGF-β1, 2, и 3, сывороточный альбумин, представители семейства факторов роста фибробластов, тромбоцитарный фактор роста AA и -BB, богатая тромбоцитами плазма, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -8, -10, 11), глюкагон-подобный пептид I и II (GLP-I и II), GLP-1 и GLP-2 миметотело, Экзендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, хелаторы меди, например, такие как триэтиленпентамин, форсколин, Na-бутират, активин, бетацеллюлин, ITS, noggin, фактор роста нервов, nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин 1, VEGF, MG132 (EMD, CA), N2 и B27 дополнительные вещества (Gibco, CA), стероидный алкалоид, например, такой как циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белки семейства Dickkopf, экстракт гипофиза быка, белок, ассоциированный с неогенезом островков (INGAP), Indian hedgehog, sonic hedgehog, ингибиторы протеасомы, ингибиторы сигнального пути Notch, ингибиторы sonic hedgehog или их сочетания.
По меньшей мере один другой дополнительный фактор может быть дополнен кондиционированной средой, полученной от панкреатических клеточных линий, например, таких как, PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), печеночных клеточных линий, например, таких как, HepG2 (ATCC No: HTB-8065), интестинальных клеточных линий, например, таких как FHs 74 (ATCC No: CCL-241), и первичных или трансформированных эндотелиальных клеток.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, на внеклеточном матриксе, с использованием двух культуральных сред
Дифференцировка плюрипотентных стволовых клеток в клетки линии дифференцировки дефинитивной эндодермы, может осуществляться путем культивирования плюрипотентных стволовых клеток с активином A и лигандом Wnt, с использованием двух культуральных сред. Таким образом, дифференцировка плюрипотентных стволовых клеток может осуществляться следующим образом:
а) высевание плюрипотентных стволовых клеток на субстрат тканевой культуры, покрытый внеклеточным матриксом,
b) культивирование плюрипотентных стволовых клеток с активином A и лигандом Wnt в первой культуральнрой среде и
c) культивирование плюрипотентных стволовых клеток с активином A во второй культуральной среде.
Первая культуральная среда может содержать сыворотку в низкой концентрации, а вторая культуральная среда может содержать сыворотку в более высокой концентрации, чем первая культуральная среда.
Вторая культуральная среда может содержать лиганд Wnt.
Первая культуральная среда: первая культуральная среда должна содержать достаточно низкие концентрации некоторых факторов, чтобы дать возможность плюрипотентным стволовым клеткам дифференцироваться в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, например, такие как, инсулин и IGF (как описано в WO2006020919). Это может достигаться путем снижения концентрации сыворотки или, альтернативно, путем использования среды определенного химического состава, лишенной инсулина и IGF. Примеры среды определенного химического соства описаны у Wiles et al (Exp Cell Res. 1999 Feb 25; 247(1):241-8.).
В первой культуральной среде может быть низкая концентрация сыворотки по сравнению со второй культуральной средой. Повышение концентрации сыворотки во второй культуральной среде повышает выживаемость клеток или, альтернативно, может усиливать пролиферацию клеток. Концентрация сыворотки в первой среде может находиться в интервале примерно от 0% примерно до 10%. Альтернативно, концентрация сыворотки в первой среде может находиться в интервале примерно от 0% примерно до 2%. Альтернативно, концентрация сыворотки в первой среде может находиться в интервале примерно от 0% примерно до 1%. Альтернативно, концентрация сыворотки в первой среде может составлять примерно 0,5%.
При культивировании плюрипотентных стволовых клеток с активином A и лигандом Wnt, с использованием по меньшей мере двух культуральных сред, время культивирования в первой культуральной среде может находиться в интервале примерно от 1 дня примерно до 3 дней.
Активин A может быть использован в любой концентрации, подходящей для индукции дифференцировки плюрипотентных стволовых клеток. Концентрация может составлять примерно от 1 пг/мл примерно до 100 мкг/мл. В альтернативном варианте осуществления концентрация может составлять примерно от 1 пг/мл примерно до 1 мкг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно от 1 пг/мл примерно до 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно от 50 нг/мл примерно до 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно 100 нг/мл.
Выбор лиганда Wnt может быть оптимизирован для улучшения эффективности процесса дифференцировки. Лиганд Wnt может быть выбран из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном варианте осуществления лиганд Wnt представляет собой Wnt-1. В альтернативном варианте осуществления лиганд Wnt представляет собой Wnt-3a.
Концентрация лиганда Wnt может составлять примерно от 1 нг/мл примерно до 1000 нг/мл. В альтернативном варианте осуществления концентрация может составлять примерно от 10 нг/мл примерно до 100 нг/мл.
Первая культуральная среда также может содержать ингибитор GSK-3B. Ингибитор GSK-3B может быть добавлен в первую культуральную среду, во вторую культуральную среду или как в первую, так и во вторую культуральную среду.
Ингибитор GSK-3B может быть выбран из группы, состоящей из ингибитора GSK-3B IX и ингибитора GSK-3B XI. В одном варианте осуществления ингибитор GSK-3B представляет собой ингибитор GSK-3B IX.
При культивировании плюрипотентных стволовых клеток с ингибитором GSK-3B концентрация ингибитора GSK-3B может составлять примерно от 1 нМ примерно до 1000 нМ. В альтернативном варианте осуществления плюрипотентные стволовые клетки культивируют с ингибитором GSK-3B в концентрации примерно от 10 нМ примерно до 100 нМ.
Первая культуральная среда также может содержать по меньшей мере один дополнительный фактор, который может усиливать образование клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы из плюрипотентных стволовых клеток. Альтернативно, по меньшей мере один дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, полученных способами по настоящему изобретению. Далее, по меньшей мере один другой дополнительный фактор может усиливать способность клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, полученных способами по настоящему изобретению, образовывать другие типы клеток или улучшать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором, например, может быть никотинамид, представители семейства TGF-β, в том числе TGF-β1, 2 и 3, сывороточный альбумин, представители семейства факторов роста фибробластов, тромбоцитарный фактор роста AA и -BB, богатая тромбоцитами плазма, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -8, -10, 11), глюкагон-подобный пептид-I и II (GLP-I и II), GLP-1 и GLP-2 миметотело, экзендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, хелаторы меди, такие как, например, триэтиленпентамин, форсколин, Na-бутират, активин, бетацеллюлин, ITS, noggin, фактор рота нервов, nodal, вальпроевая кислота, трихостатин А, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин-1, VEGF, MG132 (EMD, CA), N2 и B27 дополнительные вещества (Gibco, CA), стероидный алкалоид, например, такой как циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белок семейства Dickkopf, экстракт гипофиза быка, белок, ассоциированный с неогенезом островков (INGAP), Indian hedgehog, sonic hedgehog, ингибиторы протеасомы, ингибиторы сигнального пути notch, ингибиторы sonic hedgehog или их сочетания.
По меньшей мере один другой дополнительный фактор может быть предоставлен кондиционированной средой, полученной из панкреатических клеточных линий, например, таких как PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), печеночных клеточных линий, например, такой как HepG2 (ATCC No: HTB-8065), и интестинальных клеточных линий, например, такой как FHs 74 (ATCC No: CCL-241).
Вторая культуральная среда: вторая культуральная среда должна содержать некоторые факторы, например, такие как инсулин и IGF (как описано в WO2006020919), в достаточной концентрации для того, чтобы способствовать выживанию культивируемых клеток. Это может достигаться путем повышения концентрации сыворотки или, альтернативно, путем использования среды определенного химического состава, в которой концентрации инсулина и IGF повышены по сравнению с первой культуральной средой. Примеры среды определенного химического состава описаны у Wiles et al (Exp Cell Res. 1999 Feb 25; 247(1):241-8.).
Во второй культуральной среде, имеющей более высокую концентрацию сыворотки, концентрация сыворотки второй культуральной среды может находиться в интервале примерно от 0,5% примерно до 10%. Альтернативно, концентрация сыворотки второй культуральной среды может находиться в интервале примерно от 0,5% примерно до 5%. Альтернативно, концентрация сыворотки второй культуральной среды может находиться в интервале примерно от 0,5% примерно до 2%. Альтернативно, концентрация сыворотки второй культуральной среды может составлять примерно 2%. При культивировании плюрипотентных стволовых клеток со второй культуральной средой время культивирования может находиться в диапазоне примерно от 1 дня примерно до 4 дней.
Аналогично первой культуральной среде активин A может быть использован в любой концентрации, подходящей для индукции дифференцировки плюрипотентных стволовых клеток. Указанная концентрация может составлять примерно от 1 пг/мл примерно до 100 мкг/мл. В альтернативном варианте осуществления концентрация может составлять примерно от 1 пг/мл примерно до 1 мкг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно от 1 пг/мл примерно до 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно от 50 нг/мл примерно до 100 нг/мл. В другом альтернативном варианте осуществления концентрация может составлять примерно 100 нг/мл.
Лиганд Wnt может находиться в концентрации примерно от 1 нг/мл примерно до 1000 нг/мл. В альтернативном варианте осуществления концентрация может составлять примерно от 10 нг/мл примерно до 100 нг/мл.
Лиганд Wnt может быть выбран из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном варианте осуществления лиганд Wnt представляет собой Wnt-1. В альтернативном варианте осуществления лиганд Wnt представляет собой Wnt-3a.
Вторая культуральная среда также может содержать ингибитор GSK-3B. Ингибитор GSK-3B может быть добавлен в первую культуральную среду, во вторую культуральную среду или как в первую, так и во вторую культуральную среду.
Ингибитор GSK-3B может быть выбран из группы, состоящей из ингибитора GSK-3B IX и ингибитора GSK-3B XI. В одном варианте осуществления ингибитор GSK-3B представляет собой ингибитор GSK-3B IX.
При культивировании плюрипотентных стволовых клеток с ингибитором GSK-3B концентрация ингибитора GSK-3B может составлять примерно от 1 нМ примерно до 1000 нМ. В альтернативном варианте осуществления плюрипотентные стволовые клетки культивируют с ингибитором GSK-3B в концентрации примерно от 10 нМ примерно до 100 нМ.
Аналогично первой культуральной среде вторая культуральная среда также может содержать по меньшей мере один дополнительный фактор, который может усиливать образование клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы из плюрипотентных стволовых клеток. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, полученных способами по настоящему изобретению. Далее, по меньшей мере один другой дополнительный фактор может усиливать способность клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, полученных способами по настоящему изобретению, образовывать другие клеточные типы или улучшать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, представители семейства TGF-β, в том числе TGF-β1, 2 и 3, сывороточный альбумин, представители семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, богатая тромбоцитами плазма, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -8, -10, 11), глюкагон-подобный пептид-I и II (GLP-I и II), GLP-1 и GLP-2 миметотело, Экзендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, хелаторы меди, например, такие как триэтиленпентамин, форсколин, Na-Бутират, активин, бетацеллюлин, ITS, noggin, фактор роста нервов, nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин-1, VEGF, MG132 (EMD, CA), N2 и B27 дополнительные вещества (Gibco, CA), стероидный алкалоид, например, такой как циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белки семейства Dickkopf, экстракт гипофиза быка, белок, ассоциированный с неогенезом островков (INGAP), Indian hedgehog, sonic hedgehog, ингибиторы протеасом, ингибиторы сигнального пути Notch, ингибиторы sonic hedgehog или их сочетания.
По меньшей мере один другой дополнительный фактор может быть предоставлен кондиционированной средой, полученной из панкреатических клеточных линий, например, таких как PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), линий печеночных клеток, например, таких как HepG2 (ATCC No: HTB-8065), и линий интестинальных клеток, например, таких как FHs 74 (ATCC No: CCL-241).
Выявление клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы
Образование клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, может быть обнаружено путем тестирования на наличие маркеров до и после проведения конкретного протокола. Плюрипотентные стволовые клетки обычно не экспрессируют такие маркеры. Таким образом, дифференцировка плюрипотентных стволовых клеток выявляется тогда, когда клетки начинают экспрессировать такие маркеры.
Эффективность дифференцировки можно определить путем воздействия на обрабатываемую клеточную популяцию агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии дифференцировки дефинитивной эндодермы.
Способы оценки экспрессии белковых маркеров и маркеров - нуклеиновой кислоты в культивированных или выделенных клетках являются стандартными в данной области. Эти способы включают количественную полимеразную цепную реакцию с обратной транскриптазой (RT-PCR), Нозерн блоты, гибридизацию in situ (смотри, например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммуноанализы, такие как иммуногистохимический анализ секционного материала, Вестерн блоттинг, и на маркеры, которые доступны в интактных клетках, анализ с помощью проточной цитометрии (FACS) (смотри, например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Примеры антител, подходящих для выявления некоторых белковых маркеров, перечислены в Таблице IA. Следует отметить, что имеются альтернативные антитела, направленные на те же маркеры, которые распознаются антителами, перечисленными в Таблице IA, или они могут быть легко получены. Такие альтернативные антитела также могут быть использованы для оценки экспрессии маркеров в клетках, выделенных в соответствии с настоящим изобретением.
Например, характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжают выявлять дополнительные характеристики плюрипотентных стволовых клеток. Маркеры плюрипотентных стволовых клеток включают, например, экспрессию одного или нескольких из следующего: ABCG2, cripto, FoxD3, Connexin43, Connexin45, Oct4, Sox2, Nanog, hTERT, UTF-1, ZFP42, SSEA-3, SSEA-4, Tra1-60, Tra1-81.
После обработки плюрипотентных стволовых клеток способами по настоящему изобретению дифференцированные клетки могут быть очищены путем воздействия на обработанную клеточную популяцию агентом (таким как антитело), который специфически распознает белковый маркер, например CXCR4, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии дифференцировки дефинитивной эндодермы.
Образование клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы
Клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, любым способом из уровня техники или любым способом, предложенным в этом изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, в соответствии со способами, описанными у D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, фактором роста фибробластов и ингибитором сигнального пути хэджхог KAAD-циклопамином, затем удаления среды, содержащей фактор роста фибробластов и KAAD-циклопамин, и после этого путем культивирования клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и KAAD-циклопамин. Пример этого способа описан у Nature Biotechnology 24, 1392-1401 (2006).
В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение некоторого периода времени. Этот период времени может составлять примерно от одного примерно до шести дней.
В альтернативном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток ретиноевой кислотой в течение некоторого периода времени. Этот период времени может составлять примерно от одного примерно до трех дней. Ретиноевую кислоту впоследствии удаляют и клетки обрабатывают по меньшей мере одним фактором роста фибробластов в течение другого периода времени. Этот период времени может составлять примерно от одного примерно до трех дней.
В одном варианте осуществления настоящее изобретение относится к способу дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, включающему стадии:
а) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, и
b) обработки клеток, экспрессирующих маркеры-характеристики линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов.
Любая клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной эндодермы, подходит для дифференцировки в клетку, экспрессирующую маркеры, характерные для линии дифференцировки панкреатической эндодермы, с помощью этого способа. Клетки могут быть обработаны в среде определенного химического состава, содержащей среду, дополненную B27. Альтернативно, клетки могут быть обработаны в бессывороточной среде. Альтернативно, клетки могут быть обработаны в среде, дополненной сывороткой.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для дефинитивной эндодермы, обрабатывают ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение примерно от одного примерно до шести дней. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для дефинитивной эндодермы, обрабатывают ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение примерно шести дней.
По меньшей мере один фактор роста фибробластов выбран из группы, состоящей из FGF-2, FGF-4 и FGF-10.
Любая клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной эндодермы, подходит для дифференцировки в клетку, экспрессирующую маркеры, характерные для линии дифференцировки панкреатической эндодермы, с помощью этого способа. Клетки могут быть обработаны в среде определенного химического состава, содержащей среду, дополненную B27. Альтернативно, клетки могут быть обработаны в бессывороточной среде. Альтернативно, клетки могут быть обработаны в среде, дополненной сывороткой.
В альтернативном варианте осуществления настоящее изобретение относится к способу дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, включающему стадии:
a) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы,
b) обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой, и
с) удаления ретиноевой кислоты и последующей обработки клеток по меньшей мере одним фактором роста фибробластов.
Любая клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной эндодермы, подходит для дифференцировки в клетку, экспрессирующую маркеры, характерные для линии дифференцировки панкреатической эндодермы, с помощью этого способа. Клетки могут быть обработаны в среде определенного химического состава, содержащей среду, дополненную B27. Альтернативно, клетки могут быть обработаны в бессывороточной среде. Альтернативно, клетки могут быть обработаны в среде, дополненной сывороткой.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для дефинитивной эндодермы, обрабатывают ретиноевой кислотой в течение примерно от одного примерно до трех дней. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для дефинитивной эндодермы, обрабатывают ретиноевой кислотой в течение примерно трех дней. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для дефинитивной эндодермы, обрабатывают по меньшей мере одним фактором роста фибробластов в течение примерно от одного примерно до трех дней. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для дефинитивной эндодермы, обрабатывают по меньшей мере одним фактором роста фибробластов в течение примерно трех дней.
По меньшей мере один фактор роста фибробластов выбран из группы, состоящей из FGF-2, FGF-4 и FGF-10.
Любая клетка, экспрессирующая маркеры, характерные для линии дифференцировки дефинитивной эндодермы, подходит для дифференцировки в клетку, экспрессирующую маркеры, характерные для линии дифференцировки панкреатической эндодермы, с помощью этого способа. Клетки могут быть обработаны в среде определенного химического состава, содержащей среду, дополненную B27. Альтернативно, клетки могут быть обработаны в бессывороточной среде. Альтернативно, клетки могут быть обработаны в среде, дополненной сывороткой.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой. Альтернативно, клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают FGF-2, или, альтернативно, FGF-4, или, альтернативно, FGF-10. В альтернативном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают по меньшей мере одним из следующих факторов: ретиноевая кислота, FGF-2, FGF-4 или FGF-10. В альтернативном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и по меньшей мере одним из следующих факторов роста фибробластов: FGF-2, FGF-4 или FGF-10. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и FGF-2. В другом варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и FGF-4. В дополнительном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и FGF-10.
Ретиноевая кислота может быть использована в концентрации примерно от 1 нМ примерно до 1 мМ. В одном варианте осуществления ретиноевую кислоту используют в концентрации 1 мкМ.
FGF-2 может быть использован в концентрации примерно от 50 пг/мл примерно до 50 мкг/мл. В одном варианте осуществления FGF-2 используют в концентрации 50 нг/мл.
FGF-4 может быть использован в концентрации примерно от 50 пг/мл примерно до 50 мкг/мл. В одном варианте осуществления FGF-4 используют в концентрации 50 нг/мл.
FGF-10 может быть использован в концентрации примерно от 50 пг/мл примерно до 50 мкг/мл. В одном варианте осуществления FGF-10 используют в концентрации 50 нг/мл.
Клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, могут быть обработаны по меньшей мере одним дополнительным фактором, который может усиливать образование клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, полученных способами по настоящему изобретению. Далее, по меньшей мере один другой дополнительный фактор может усиливать способность клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, полученных способами по настоящему изобретению, образовывать другие клеточные типы или улучшать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, представители семейства TGF-β, в том числе TGF-β1, 2 и 3, сывороточный альбумин, представители семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, богатая тромбоцитами плазма, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -8, -10, 11), глюкагон-подобный пептид-I и II (GLP-I и II), GLP-1 и GLP-2 миметотело, Экзендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, хелаторы меди, например, такие как триэтиленпентамин, форсколин, Na-бутират, активин, бетацеллюлин, ITS, noggin, фактор роста нервов, nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин-1, VEGF, MG132 (EMD, CA), N2 и B27 дополнительные вещества (Gibco, CA), стероидный алкалоид, например, такой как циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белки семейства Dickkopf, экстракт гипофиза быка, белок, ассоциированный с неогенезом островков (INGAP), Indian hedgehog, sonic hedgehog, ингибиторы протеасом, ингибиторы сигнального пути Notch, ингибиторы sonic hedgehog или их сочетания.
По меньшей мере один другой дополнительный фактор может быть предоставлен кондиционированной средой, полученной из панкреатических клеточных линий, например, таких как PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), линий печеночных клеток, например, таких как HepG2 (ATCC No: HTB-8065), и линий интестинальных клеток, например, таких как FHs 74 (ATCC No: CCL-241).
Выявление клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы
Маркеры, характерные для линии дифференцировки панкреатической эндодермы, хорошо известны специалистам в данной области, и продолжают идентифицировать дополнительные маркеры, характерные для линии дифференцировки панкреатической эндодермы. Эти маркеры могут быть использованы для подтверждения того, что клетки, обработанные в соответствии с настоящим изобретением, дифференцировались с приобретением свойств, характерных для линии дифференцировки панкреатической эндодермы. Маркеры, специфичные для линии дифференцировки панкреатической эндодермы, включают экспрессию одного или нескольких транскрипционных факторов, например, таких как Hlxb9, PTF-1a, PDX-1, HNF-6, HNF-1бета.
Эффективность дифференцировки можно определить путем воздействия на обработанную клеточную популяцию агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии дифференцировки панкреатической эндодермы.
Способы оценки экспрессии белковых маркеров и маркеров - нуклеиновых кислот в культивированных или выделенных клетках являются стандартными в данной области. Эти способы включают в себя полимеразную цепную реакцию с обратной транскриптазой (ОТ-ПЦР), Нозерн блоты, гибридизацию in situ (смотри, например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммуноанализы, такие как иммуногистохимический анализ секционного материала, Вестерн блоттинг, и для маркеров, которые доступны в интактных клетках, анализ с помощью проточной цитометрии (FACS) (смотри, например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Примеры антител, подходящих для выявления некоторых белковых маркеров, перечислены в Таблице IA. Следует отметить, что имеются альтернативные антитела, направленные на те же маркеры, которые распознаются антителами, перечисленными в Таблице IA, или могут быть легко получены. Такие альтернативные антитела также могут быть использованы для оценки экспрессии маркеров в клетках, выделенных в соответствии с настоящим изобретением.
Образование клеток, экспрессирующих маркеры панкреатической эндокринной линии дифференцировки
Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, любым способом из уровня техники или любым способом, описанным в настоящем изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, в соответствии со способами, описанными у D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, путем культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в среде, содержащей DAPT и Экзендин 4, затем удаления среды, содержащей DAPT и Экзендин 4, и последующего культивирования клеток в среде, содержащей Экзендин 1, IGF-1 и HGF. Пример этого способа описан у Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, путем культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в среде, содержащей Экзендин 4, затем удаления среды, содержащей Экзендин 4, и последующего культивирования клеток в среде, содержащей Экзендин 1, IGF-1 и HGF. Пример этого способа описан у D' Amour et al, Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, путем культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей DAPT и Экзендин 4. Пример этого способа описан у D' Amour et al, Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, путем культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, в среде, содержащей Экзендин 4. Пример этого способа описан у D' Amour et al, Nature Biotechnology, 2006.
В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы фактором, который ингибирует сигнальный путь Notch. Фактором, который ингибирует сигнальный путь Notch, может быть антагонист внеклеточного рецептора Notch. Альтернативно, этот фактор может ингибировать биологическую активность рецептора Notch. Альтернативно, этот фактор может ингибировать или быть антагонистом элемента в каскаде сигнальной трансдукции Notch в клетке. Клетки могут быть обработаны в среде определенного химического состава, содержащей среду, дополненную B27. Альтернативно, клетки могут быть обработаны в бессывороточной среде. Альтернативно, клетки могут быть обработаны в среде, дополненной сывороткой.
В одном варианте осуществления фактор, который ингибирует сигнальный путь Notch, представляет собой ингибитор γ-секретазы. В одном варианте осуществления ингибитор γ-секретазы представляет собой трет-бутиловый эфир 1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-5-2R-гидрози-5 фенилпентил]карбаминовой кислоты, также известный как L-685458.
L-685458 может быть использован в концентрации примерно от 0,1 мкМ примерно до 100 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 90 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 80 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 70 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 60 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 50 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 40 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 30 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 20 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 10 мкМ.
В одном варианте осуществления настоящее изобретение относится к способу дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, включающему стадии:
a) культивирования клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы, и
b) обработки клеток фактором, который ингибирует сигнальный путь Notch.
Любая клетка, экспрессирующая маркеры, характерные для линии дифференцировки панкреатической эндодермы, подходит для дифференцировки в клетку, экспрессирующую маркеры, характерные для панкреатической эндокринной линии дифференцировки, с помощью этого способа. Клетки могут быть обработаны в среде определенного химического состава, содержащей среду, дополненную B27. Альтернативно, клетки могут быть обработаны в бессывороточной среде. Альтернативно, клетки могут быть обработаны в среде, дополненной сывороткой.
В одном варианте осуществления фактор, который ингибирует сигнальный путь Notch, представляет собой ингибитор γ-секретазы. В одном варианте осуществления ингибитор γ-секретазы представляет собой трет-бутиловый эфир 1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрози-5-фенилпентил]карбаминовой кислоты, также известный как L-685458.
Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, обрабатывают фактором, который ингибирует сигнальный путь Notch, в течение примерно от одного примерно до пяти дней. Альтернативно, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, обрабатывают фактором, который ингибирует сигнальный путь Notch примерно в течение от трех примерно до пяти дней. Альтернативно, клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, обрабатывают фактором, который ингибирует сигнальный путь Notch, примерно в течение пяти дней.
В одном варианте осуществления фактор, который ингибирует сигнальный путь Notch, представляет собой ингибитор γ-секретазы. В одном варианте осуществления ингибитор γ-секретазы представляет собой трет-бутиловый эфир 1S-бензил-4R-[1-(1S-карбамоил-2-фенэтилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрози-5-фенилпентил]карбаминовой кислоты, также известный как L-685458.
L-685458 может быть использован в концентрации примерно от 0,1 мкМ примерно до 100 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 90 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 80 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 70 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 60 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 50 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 40 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 30 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 20 мкМ. В одном варианте осуществления L-685458 используют в концентрации примерно 10 мкМ.
Клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, могут быть обработаны по меньшей мере одним дополнительным фактором, который может усиливать образование клеток, экспрессирующих маркеры, характерные для панкреатической эндокринной линии дифференцировки. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры, характерные для панкреатической эндокринной линии дифференцировки, полученных способами по настоящему изобретению. Далее, по меньшей мере один другой дополнительный фактор может усиливать способность клеток, экспрессирующих маркеры, характерные для панкреатической эндокринной линии дифференцировки, полученных способами по настоящему изобретению, образовывать другие клеточные типы или улучшать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, представители семейства TGF-β, в том числе TGF-β1, 2 и 3, сывороточный альбумин, представители семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, богатая тромбоцитами плазма, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -8, -10, 11), глюкагон-подобный пептид-I и II (GLP-I и II), GLP-1 и GLP-2 миметотело, Экзендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, хелаторы меди, например, такие как триэтиленпентамин, форсколин, Na-Бутират, активин, бетацеллюлин, ITS, noggin, фактор роста нервов, nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин-1, VEGF, MG132 (EMD, CA), N2 и B27 дополнительные вещества (Gibco, CA), стероидный алкалоид, например, такой как циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белки семейства Dickkopf, экстракт гипофиза быка, белок, ассоциированный с неогенезом островков (INGAP), Indian hedgehog, sonic hedgehog, ингибиторы протеасом, ингибиторы сигнального пути Notch, ингибиторы sonic hedgehog или их сочетания.
По меньшей мере один другой дополнительный фактор может быть предоставлен кондиционированной средой, полученной из панкреатических клеточных линий, например, таких как PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), линий печеночных клеток, например, таких как HepG2 (ATCC No: HTB-8065), и линий интестинальных клеток, например, таких как FHs 74 (ATCC No: CCL-241).
Выявление клеток, экспрессирующих маркеры, характерные для панкреатической эндокринной линии дифференцировки
Маркеры, характерные для клеток панкреатической эндокринной линии дифференцировки, хорошо известны специалистам в данной области, и дополнительные маркеры, характерные для панкреатической эндокринной линии дифференцировки, продолжают идентифицировать. Эти маркеры могут быть использованы для подтверждения того, что клетки, обработанные в соответствии с настоящим изобретением, дифференцировались для приобретения свойств, характерных для панкреатической эндокринной линии дифференцировки. Маркеры, специфичные для панкреатической эндокринной линии дифференцировки, включают экспрессию одного или нескольких транскрипционных факторов, например, таких как NGN-3, NeuroD, Islet-1.
Маркеры, характерные для клеток β-клеточной линии дифференцировки, хорошо известны специалистам в данной области, и дополнительные маркеры, характерные для β-клеточной линии дифференцировки, продолжают идентифицировать. Эти маркеры могут быть использованы для подтверждения того, что клетки, обработанные в соответствии с настоящим изобретением, дифференцировались для приобретения свойств, характерных для β-клеточной линии дифференцировки. Характеристики, специфичные для β-клеточной линии дифференцировки, включают экспрессию одного или нескольких транскрипционных факторов, таких как, например, Pdx1 (панкреатический и дуоденальный гомеобокс-ген-1), Nkx2.2, Nkx6.1, Isl1, Pax6, Pax4, NeuroD, Hnf1b, Hnf-6, Hnf-3бета и MafA, среди прочих. Эти транскрипционные факторы являются общепринятыми в данной области для идентификации эндокринных клеток. Смотри, например, Edlund (Nature Reviews Genetics 3: 524-632 (2002)).
Эффективность дифференцировки можно определить путем воздействия на обработанную клеточную популяцию агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры, характерные для панкреатической эндокринной линии дифференцировки. Альтернативно, эффективность дифференцировки можно определить путем воздействия на обработанную клеточную популяцию агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры, характерные для β-клеточной линии дифференцировки.
Способы оценки экспрессии белковых маркеров и маркеров - нуклеиновых кислот в культивированных или выделенных клетках являются стандартными в данной области. Эти способы включают количественную полимеразную цепную реакцию с обратной транскриптазой (ОТ-ПЦР), Нозерн блоты, гибридизацию in situ (смотри, например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммуноанализы, такие как иммуногистохимический анализ секционного материала, Вестерн блоттинг, и для маркеров, которые доступны в интактных клетках, с помощью проточной цитометрии (FACS) (смотри, например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Примеры антител, подходящих для выявления некоторых белковых маркеров, перечислены в Таблице IA. Следует отметить, что имеются альтернативные антитела, направленные на те же маркеры, которые распознаются антителами, перечисленными в Таблице IA, или могут быть легко получены. Такие альтернативные антитела также могут быть использованы для оценки экспрессии маркеров в клетках, выделенных в соответствии с настоящим изобретением.
Способы лечения
В одном аспекте настоящее изобретение относится к способу лечения пациента, страдающего диабетом 1 типа или имеющего риск развития диабета 1 типа. Этот способ включает культивирование плюрипотентных стволовых клеток, дифференцировку плюрипотентных стволовых клеток in vitro в β-клеточную линию дифференцировки и имплантацию пациенту клеток β-клеточной линии дифференцировки.
Еще в одном аспекте настоящее изобретение относится к способу лечения пациента, страдающего диабетом 2 типа или имеющего риск развития диабета 2 типа. Этот способ включает культивирование плюрипотентных стволовых клеток, дифференцировку культивированных клеток in vitro в β-клеточную линию дифференцировки и имплантацию пациенту клеток β-клеточной линии дифференцировки.
При необходимости пациенту можно дополнительно проводить лечение фармацевтическими средствами или биологически активными веществами, которые облегчают выживание и функционирование трансплантированных клеток. Эти средства могут включать, например, инсулин, представителей семейства TGF-β, в том числе TGF-β1, 2 и 3, костные морфогенные белки (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов-1 и -2, тромбоцитарный фактор роста-AA и -BB, богатую тромбоцитами плазму, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -7, -8, -10, -15), сосудистый эндотелиальный фактор роста (VEGF), плеотропин, эндотелин, среди прочих. Другие фармацевтические соединения могут включать, например, никотинамид, глюкагон-подобный пептид-I (GLP-1) и II, GLP-1 и 2 миметотело, Экзендин-4, ретиноевую кислоту, паратиреоидный гормон, ингибиторы MAPK, например, такие как соединения, описанные в опубликованной патентной заявке США 2004/0209901 и опубликованной заявке США 2004/0132729.
Плюрипотентные стволовые клетки могут быть дифференцированы в инсулин-продуцирующие клетки до трансплантации реципиенту. В особом варианте осуществления плюрипотентные стволовые клетки полностью дифференцированы в β-клетки до трансплантации реципиенту. Альтернативно, плюрипотентные стволовые клетки могут быть трансплантированы реципиенту в недифференцированном или частично дифференцированном состоянии. Дальнейшая дифференцировка может происходить в организме реципиента.
Клетки дефинитивной эндодермы, или, альтернативно, клетки панкреатической эндодермы, или, альтернативно, β-клетки могут быть имплантированы в виде клеток в суспензии или сформированы в кластеры, которые могут быть введены путем инфузии в портальную вену печени. Альтернативно, клетки могут быть предоставлены в биосовместимых разлагаемых полимерных носителях, пористых неразлагаемых устройствах или инкапсулированы для защиты от иммунной реакции организма-хозяина. Клетки могут быть имплантированы в соответствующее место в организме реципиента. Места имплантации включают, например, печень, природную поджелудочную железу, подкапсульное пространство почки, сальник, брюшную полость, субсерозное пространство, кишечник, желудок или подкожный карман.
Для усиления дальнейшей дифференцировки, выживания или активности имплантированных клеток дополнительные факторы, такие как факторы роста, антиоксиданты или противовоспалительные средства, могут быть введены до, одновременно с или после введения клеток. В некоторых вариантах осуществления факторы роста используют для дифференцировки введенных клеток in vivo. Эти факторы могут быть секретированы эндогенными клетками и подвергаться воздействию введенных клеток in situ. Имплантированные клетки могут быть индуцированы к дифференцировке посредством любого сочетания эндогенных и экзогенно вводимых факторов роста, известных в уровне техники.
Количество клеток, используемых в имплантации, зависит от ряда различных факторов, в том числе состояния пациента и реакции на лечение, и может быть определено специалистом в данной области.
В одном аспекте настоящее изобретение относится к способу лечения пациента, страдающего диабетом или имеющего риск развития диабета. Этот способ включает культивирование плюрипотентных стволовых клеток, дифференцировку культивированных клеток in vitro в β-клеточную линию дифференцировки и включение этих клеток в трехмерную основу. Эти клетки могут сохраняться in vitro на этой основе до имплантации пациенту. Альтернативно, основа, содержащая клетки, может быть непосредственно имплантирована пациенту без дополнительного культивирования in vitro. Основа необязательно может быть включена по меньшей мере с одним фармацевтическим средством, которое облегчает выживание и функционирование трансплантированных клеток.
Материалы основы, подходящие для применения для целей настоящего изобретения, включают тканевые матрицы, трубки, перегородки, и резервуары, подходящие для репарации тканей. В частности, синтетические и природные материалы в форме пен, губок, гелей, гидрогелей, волокон и нетканных структур, которые были использованы in vitro и in vivo для реконструкции или регенерации биологической ткани, а также для доставки хемотактических средств для индукции тканевого роста, подходящие для применения при осуществлении способов по настоящему изобретению. Смотри, например, материалы, описанные в патенте США 5770417, патенте США 6022743, патенте США 5567612, патенте США 5759830, патенте США 6626950, патенте США 6534084, патенте США 6306424, патенте США 6365149, патенте США 6599323, патенте США 6656488, опубликованной заявке США 2004/0062753 A1, патенте США 4557264 и патенте США 6333029.
Для получения основы с включенным фармацевтическим средством фармацевтическое средство может быть смешано с раствором полимера до формирования основы. Альтернативно, фармацевтическое средство могло быть нанесено на готовую основу, предпочтительно в присутствии фармацевтического носителя. Фармацевтическое средство может находиться в виде жидкости, мелкоизмельченного твердого вещества или любой другой подходящей физической форме. Альтернативно, эксципиенты могут быть добавлены к основе для изменения скорости высвобождения фармацевтического средства. В альтернативном варианте осуществления в основу включают по меньшей мере одно фармацевтическое соединение, которое представляет собой противовоспалительное соединение, например, такие соединения, как описано в патенте США 6509369.
В основу может быть включено по меньшей мере одно фармацевтическое соединение, которое представляет собой соединение против апоптоза, например, такие соединения, как описано в патенте США 6793945.
В основу также может быть включено по меньшей мере одно фармацевтическое соединение, которое представляет собой ингибитор фиброза, например, такие соединения, как описано в патенте США 6331298.
В основу также может быть включено по меньшей мере одно фармацевтическое соединение, которое способно усиливать ангиогенез, например, такие соединения, как описано в опубликованной заявке США 2004/0220393 и опубликованной заявке США 2004/0209901.
В основу также может быть включено по меньшей мере одно фармацевтическое соединение, которое представляет собой иммуносуппрессирующее соединение, например, такие соединения, как описано в опубликованной заявке США 2004/0171623.
В основу также может быть включено по меньшей мере одно фармацевтическое соединение, которое представляет собой фактор роста, например, такой как представители семейства TGF-β, в том числе TGF-β1, 2 и 3, костные морфогенные белки (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов-1 и -2, тромбоцитарный фактор роста-AA и -BB, богатая тромбоцитами плазма, инсулиновый фактор роста (IGF-I, II), фактор дифференцировки роста (GDF-5, -6, -8, -10, -15), сосудистый эндотелиальный фактор роста (VEGF), плеотропин, эндотелин, среди прочих. Другие фармацевтические соединения могут включать, например, никотинамид, индуцируемый гипоксией фактор 1-альфа, глюкагон-подобный пептид-I (GLP-1), GLP-1 и GLP-2 миметотело и II, Экзендин-4, nodal, noggin, NGF, ретиноевую кислоту, паратиреоидный гормон, тенасцин-C, тропоэластин, пептиды, производные тромбина, кателицидины, дефенсины, ламинин, биологические пептиды, содержащие клеточные и гепарин-связывающие домены адгезивных белков внеклеточного матрикса, таких как фибронектин и витронектин, ингибиторы MAPK, например, такие соединения, как описано в опубликованной заявке США 2004/0209901 и опубликованной заявке США 2004/0132729.
Включение клеток по настоящему изобретению в каркас может достигаться простым размещением клеток на каркасе. Клетки могут входить в каркас путем простой диффузии (J. Pediatr. Surg. 23 (1 Pt 2): 3-9 (1988)). Было разработано несколько других подходов для повышения эффективности посева клеток. Например, были использованы роллерные колбы при посеве хондроцитов на каркасы из полигликолевой кислоты (Biotechnol. Prog. 14(2): 193-202 (1998)). Другим подходом для высевания клеток является применение центрифугирования, которое приводит к минимальному стрессу для посеянных клеток и повышает эффективность высевания. Например, Yang et al. разработали способ высевания клеток (J. Biomed. Mater. Res. 55(3): 379-86 (2001)), названный Centrifugational Cell Immobilization (CCI).
Настоящее изобретение далее проиллюстрировано, но не ограничено, следующими примерами.
ПРИМЕРЫ
Пример 1
Культура эмбриональных стволовых клеток человека
Эмбриональные стволовые клетки человека линий H1, H7 и H9 получали от WiCell Research Institute, Inc., (Madison, WI) и культивировали в соответствии с инструкциями, предоставленными институтом поставщиком. Вкратце, клетки культивировали на клетках-кормилицах - эмбриональных фибробластах мыши (MEF) в клеточной среде ES, состоящей из DMEM/F12 (Invitrogen/GIBCO), дополненной 20% заменителем сыворотки «knockout serum replacement», 100 нМ MEM заменимых аминокислот, 0,5 мМ бета-меркаптоэтанола, 2 мМ L-глутамина с 4 нг/мл основного фактора роста фибробластов человека (bFGF) (все от Invitrogen/GIBCO). Клетки MEF, полученные из эмбрионов мыши E13 - 13,5, приобретали у компании Charles River. Клетки MEF размножали в среде DMEM, дополненной 10% FBS (Hyclone), 2 мМ глутамином и 100 мМ MEM заменимых аминокислот. Субконфлюэнтные культуры клеток MEF обрабатывали 10 мкг/мл митомицина C (Sigma, St. Louis, MO) в течение 3 часов для задержки деления клеток, затем трипсинизировали и высевали при 2×104/см2 на чашки, покрытые 0,1% желатином крупного рогатого скота. Клетки MEF из пассажа со второго по четвертый использовали в качестве питающего подслоя. Эмбриональные стволовые клетки человека, высеянные на питающий подслой клеток MEF, культивировали при 37°C в атмосфере 5% CO2/ во влажной камере для тканевых культур. При конфлюэнтности (приблизительно 5-7 дней после высевания) эмбриональные стволовые клетки человека обрабатывали 1 мг/мл коллагеназы IV типа (Invitrogen/GIBCO) в течение 5-10 мин, а затем аккуратно снимали с поверхности, используя 5-мл пипетку. Клетки центрифугировали при 900 об/мин в течение 5 мин и осадок ресуспендировали и снова высевали в соотношении клеток 1:3 - 1:4 в свежей культуральной среде.
Пример 2
Образование дефинитивной эндодермы
Изучали действия активина A на экспрессию маркеров дефинитивной эндодермы. Активин A (100 нг/мл) добавляли в популяции эмбриональных стволовых клеток, культивированных на мышиных эмбриональных фибробластах. Клетки культивировали непрерывно в присутствии активина A и собирали в указанные моменты времени. Уровни экспрессии маркеров дефинитивной эндодермы определяли с помощью ПЦР (Фиг.1), FACS (результаты суммированы в Таблице II) и иммуногистохимии (Фиг.2).
Активин A индуцировал зависимое от времени повышение экспрессии мРНК CXCR4, GATA4, HNF-3бета, Mixl1 и Sox-17 в линии H9 (Фиг.1, панель a). Также наблюдалась значительная активация маркеров передней эндодермы, генов Cerberus, Otx-1 и Hex (Фиг.1, панель b). Увеличение белка CXCR4 наблюдали с помощью анализа FACS после обработки активином А. Экспрессия E-кадгерина и N-кадгерина не изменялась после обработки активином A (Таблица IIA). CXCR4 позитивные клетки также являлись высоко позитивными в отношении C-kit, EPCAM, CD99 и негативными в отношении CD9. Профиль экспрессии для этих маркеров был согласованным среди всех трех исследуемых клеточных линий hES (Таблица IIB для H7 и Таблица IIC для H1). Иммуногистохимический анализ, проводимый с клетками, обработанными активином А в течение пяти дней, показал, что 30-40% клеток в обработанной культуре были позитивными в отношении Sox17 и HNF-3бета. Одновременно почти 100% дифференцированных клеток оставались Oct4-позитивными (Фиг.2). Вместе со снижением экспрессии поверхностных маркеров плюрипотентности, в сочетании с повышением экспрессии маркеров дефинитивной эндодермы, эти данные дают возможность предположить, что активин A способствует дифференцировке эмбриональных стволовых клеток человека в дефинитивную эндодерму.
Пример 3
Образование панкреатической эндодермы
В клеточные культуры добавляли факторы роста, которые, как известно, индуцируют дифференцировку эмбриональных стволовых клеток человека в панкреатическую эндодерму. В частности, известно, что активин A, bFGF и ретиноевая кислота индуцируют образование панкреатической эндодермы, добавленные в клеточные культуры.
В первой серии экспериментов активин А добавляли в популяции эмбриональных стволовых клеток человека, культивированных на эмбриональных фибробластах мыши в течение семи дней в DMEM/F12, дополненной 0-2% сывороткой и активным A (100 нг/мл). Клетки собирали в моменты времени, указанные на фиг.3, и исследовали с помощью ПЦР на экспрессию показанных генов (Фиг.3, 4 и 5). На фиг.3 ПЦР анализ указывал на то, что клетки, обработанные активином, экспрессировали широкий спектр генов, связанных с развитием эндодермы, в том числе GATA4 (Фиг.3, панель a), Sox-17 (Фиг.3, панель b), HNF-3beta (Фиг.3, панель c) и Mixl-1 (Фиг.3, панель d). Однако экспрессии гена Pdx1 обнаружено не было. Тот же профиль экспрессии маркеров линии дифференцировки наблюдали в клетках Н7, обработанных активином А (Фиг.6, панели а-f). На этой стадии не было значительного снижения экспрессии Oct4.
Активин A вызывал зависимое от времени снижение экспрессии маркеров внеэмбриональной эндодермы Sox7 (Фиг.4, панель a) и AFP (Фиг.4, панель b). Активин A снижал экспрессию Brachyury (Фиг.5, панель a), но не оказывал воздействия на экспрессию нейронального маркера Zic1 (Фиг.5, панель b).
Взятые вместе, эти данные дают возможность предположить, что повышенная экспрессия Sox-17, Mixl1, Gata4, и HNF-3бета вместе с активацией генов маркеров передней эндодермы Otx1, Cer1 и Hex соответствует образованию дефинитивной эндодермы в ответ на обработку активином A. Анализ маркеров дефинитивной эндодермы с помощью иммуногистохимии показал, что экспрессия белка этих генов также отражала тенденции, наблюдаемые в экспрессии мРНК. Уровни экспрессии HNF-3бета, Sox-17, и GATA4 были низкими в необработанных клетках, приблизительно от 10 до 20% всех клеток. Обработка активином A (100 нг/мл) в течение пяти дней повышала экспрессию HNF-3бета, Sox-17 и GATA4 приблизительно до 50-90% всех клеток (Фиг.7).
Во второй серии экспериментов культуры эмбриональных стволовых клеток человека поддерживали в условиях недифференцированной культуры в течение 2-3 дней в соответствии со способами, описанными в Примере 1. После достижения клетками 70-80% конфлюэнтности среду меняли на DMEM/F12 с 0-2% FBS с добавлением активина A в концентрации 100 нг/мл и культивировали в присутствии активина A в течение либо трех, пяти, либо семи дней. После этого промежутка времени клетки затем дополнительно обрабатывали в течение пяти - шести дней сочетаниями ретиноевой кислоты и bFGF, как показано на фиг.8. Культуры собирали и получали образцы мРНК для анализа. Также были включены контрольные культуры, состоящие из клеток, обработанных только активином А в течение пяти дней.
Анализ генной экспрессии показал, что только активин А или ретиноевая кислота не индуцировали экспрессию Pdx1. Аналогичные результаты наблюдались в культурах клеток, обработанных ретиноевой кислотой в сочетании с FGF и в присутствии активина A (Фиг.8, панель a). Однако обработка клеток ретиноевой кислотой и FGF в отсутствие активина A еще больше увеличивала экспрессию Pdx1 (Фиг.8, панель a). Клетки, обработанные в течение трех дней активином A, затем обработанные в течение 5 дней 1 мкМ ретиноевой кислоты и 50 нг/мл bFGF (также известным как FGF-2) в отсутствие активина A, показали уровень экспрессии Pdx1, который приблизительно был в 3500 раз выше, чем наблюдалось в образцах, обработанных только активином А в течение 5 дней (Фиг.8, панель a). Иммуногистохимический анализ показал, что от 5 до 20% всех клеток экспрессировали Pdx1 (Фиг.9).
Обработка 1 мкМ ретиноевой кислоты и bFGF в отсутствие активина A также вызывала повышение экспрессии GLUT-2 и PTF1a (Фиг.8, панель c), чего не наблюдалось в клетках, обработанных в присутствии только активина A. Наибольшее повышение экспрессии GLUT-2 и PTF1a наблюдалось в клетках, обработанных 1 мкМ ретиноевой кислоты и 50 нг/мл bFGF. Взятые вместе, эти данные дают возможность предположить, что образование панкреатической эндодермы дополнительно усиливается удалением активина A из клеточных культур после формирования дефинитивной эндодермы.
Пример 4
Образование панкреатических эндокринных клеток
Культуры эмбриональных стволовых клеток человека поддерживали в условиях недифференцированной культуры в течение 3-4 дней в соответствии со способами, описанными в Примере 1. После достижения клетками 50-60% конфлюэнтности среду заменяли на DMEM/F12 без FBS, содержащую активин A в концентрации 100 нг/мл, и клетки культивировали в этой среде в течение одного дня. После одного дня культивирования среду удаляли и заменяли средой, содержащей 0,5% FBS с 100 нг/мл активина A, и клетки культивировали в течение одного дня. После второго однодневного культивирования среду удаляли и заменяли средой, содержащей 2% FBS с 100 нг/мл активина A, и клетки культивировали в течение одного дня. После этого промежутка времени клетки затем обрабатывали в течение шести дней сочетаниями ретиноевой кислоты и FGF, как описано в Примере 2, затем культуральную среду удаляли и заменяли средой, содержащей DMEM/F12 с 2% FBS, содержащего ингибиторы γ-секретазы L-685458 в концентрации 10 мкМ в течение трех дней. Культуры собирали и получали образцы мРНК для анализа. Также были включены контрольные культуры, состоящие из клеток, обработанных только активином A.
Анализ генной экспрессии показал, что активин A отдельно или в сочетании с ретиноевой кислотой и FGF не индуцировал экспрессию Ngn3 или инсулина (Фиг.10, панель a, c). Снижение экспрессии Hes-1 также наблюдалось после обработки L-685458. Максимальное ингибирование наблюдалось на третий день после обработки (Фиг.10, панель d). Однако обработка клеток L-685458 индуцировала экспрессию Ngn3 до уровня приблизительно в 50 раз выше, чем наблюдалось в образцах, обработанных только активином A или ретиноевой кислотой с FGF в сочетании. 70-кратное увеличение экспрессии инсулина наблюдалось в образцах, обработанных ингибитором γ-секретазы. Экспрессия NeuroD1 также дополнительно повышалась посредством обработки L-685458 (Фиг.10, панель a). Взятые вместе, эти данные дают возможность предположить, что образование эндокринных клеток дополнительно усиливается путем удаления ретиноевой кислоты и FGF из клеточных культур и добавления ингибиторов γ-секретазы после образования панкреатической эндодермы.
Пример 5
Образование панкреатических эндокринных клеток, экспрессирующих Nkx2.2
Клетки дефинитивной эндодермы, полученные в соответствии со способами, описанными в Примере 2, обрабатывали следующим образом: клетки культивировали в минимальной среде, содержащей DMEM/F12 с 2% FBS плюс 50 нг/мл активина A, 50 нг/мл основного FGF и 1 мкМ ретиноевой кислоты в течение 3-5 дней. Клетки непрерывно культивировали в течение еще 3 - 5 дней в минимальной среде с ретиноевой кислотой в концентрации 1 мкМ, отдельно или с bFGF. Образцы РНК получали из клеток в различные моменты времени на протяжении этого процесса, чтобы облегчить оценку направленной дифференцировки клеток. Кроме того, культуральную среду и факторы регулярно удаляли и пополняли во время всего протокола дифференцировки. Добавление активина A показало повышение экспрессии Nkx2.2 примерно в 35 раз по сравнению с образцами без активина А. Образцы, обработанные активином A, в течение первых трех дней культивирования сохраняли экспрессию Pdx1 на уровне, сходном с образцами, не содержащими активин A (Фиг.11). Взятые вместе, эти данные дают возможность предположить, что экспрессия панкреатического эндокринного маркера Nkx2.2 дополнительно усиливается добавлением активина А в первые три дня обработки ретиноевой кислотой и bFGF.
Пример 6
Пассаж и размножение клеток панкреатической эндодермы в культуре
В этом примере демонстрируется, что клетки панкреатической эндодермы, происходящие из эмбриональных стволовых клеток человека, в настоящем изобретении можно поддерживать в клеточной культуре и пересевать без дальнейшей дифференцировки. Клетки панкреатической эндодермы дифференцировали в присутствии 100 нг/мл активина A в DMEM/F12 с низкой концентрацией сыворотки. DMEM/F12 с низкой концентрацией сыворотки содержала 0% (об/об) эмбриональной сыворотки теленка (FBS) в 1 день, 0,5% (об/об) FBS на второй день и 2% (об/об) FBS в каждый последующий день. Через четыре дня дифференцировки клетки культивировали в DMEM/F12 с низкой концентрацией сыворотки, содержащей 2% (об/об) FBS, 1 мкМ ретиноевой кислоты и 50 нг/мл bFGF всего в течение шести и более дней. Через шесть дней дифференцировки клетки поддерживали в культуре в DMEM/F12 с низкой концентрацией сыворотки, содержащей 2% (об/об) FBS в присутствии 50 нг/мл FGF10 всего в течение 6 дней. Во время шестидневного периода культивирования клетки панкреатической эндодермы дважды пересевали, и время удвоения клеточной популяции составляет примерно от 36 до 48 часов во время этого 6-дневного культивирования. На 0, 3 и 6 день культивирования Q-ПЦР использовали для измерения экспрессии маркерных генов, указывающих на панкреатическую эндодерму. На Фиг.12 показано, что клетки, выращенные в присутствии 50 нг/мл FGF10, сохраняли экспрессию маркера панкреатической эндодермы Pdx1 во время 6-дневного периода после их получения.
Пример 7
Получение гепатоцитов из эмбриональных стволовых клеток человека
Культуры эмбриональных стволовых клеток человека поддерживали в условиях недифференцированной культуры в течение 2-3 дней в соответствии со способами, описанными в Примере 1. После достижения клетками 70-80% конфлюэнтности среду заменяли на DMEM/F12 с 2% FBS, содержащей активин A в концентрации 100 нг/мл, и клетки культивировали в присутствии активина A в течение семи дней. После 7 дней обработки активином A затем клетки обрабатывали в течение пяти дней в условиях, показанных на Фиг.13. После этого времени клетки собирали и получали образцы мРНК для анализа.
Повышение экспрессии α-фетопротеина (AFP) и альбумина (фиг.13, панель a) наблюдалось у клеток, культивированных в отсутствие активина A. Экспрессия дополнительно повышалась под действием ретиноевой кислоты и FGF-4 (фиг.13, панель b). Взятые вместе, эти данные дают возможность предположить, что культуры эмбриональных стволовых клеток человека способны экспрессировать маркеры гепатоцитов после обработки, описанной выше. Более того, эмбриональные стволовые клетки человека способны дифференцироваться в клетки, экспрессирующие маркеры, которые характерны для гепатоцитов.
Пример 8
Характеристика эмбриональных стволовых клеток человека линии H9
Качество клеток H9 проверяли на протяжении периода времени, путем оценки экспрессии некоторых маркеров, экспрессируемых недифференцированными ES клетками (Carpenter et al., 2001; Reubinoff et al., 2000; Thomson et al., 1998a). Клетки H9 демонстрировали реципрокную экспрессию стадиеспецифичных эмбриональных антигенов (Таблица III). Клетки H9 оказывают сильное иммунореактивное действие в отношении SSEA-3, SSEA-4, Tra-1-60, Tra-1-81, AP и CD9 антигенов, каждый из которых является характерным для дифференцированных эмбриональных стволовых клеток человека.
РВ-ПЦР проводили для оценки экспрессии генов, характерных для эмбриональных стволовых клеток, например, таких как OCT3/4, SOX-2, UTF-1, REX-1, Cx43, Cx45, ABCG-2 и TERT, подтверждая, что клетки, выращенные в этом примере, по-видимому, аналогичны ранее описанным недифференцированным эмбриональным стволовым клеткам человека (Таблица III). Экспрессию белка OCT3/4 и активность щелочной фосфатазы (Chemicon) подтверждали с помощью иммуноокрашивания. Большинство клеток H9 были позитивными в отношении OCT3/4 и AP (фиг.14). В целом, эти результаты демонстрируют, что клетки Н9, используемые в этом примере, существенно не отличались по морфологии и иммуноокрашиванию антигенов или экспрессии маркера плюрипотентности по сравнению с данными других лабораторий.
Пример 9
Активированный флуоресценцией клеточный сортинг (FACS)
Иммобилизованные клетки удаляли с культуральных планшетов путем пятиминутного инкубирования с раствором TrypLE™ Express (Invitrogen, CA). Снятые клетки ресуспендировали в культуральной среде эмбриональных стволовых клеток человека и извлекали с помощью центрифугирования с последующим промыванием и ресуспендированием клеток в красящем буфере, состоящем из 2% BSA, 0,05% азида натрия в PBS (Sigma, MO). При необходимости, у клеток блокировали Fc-рецептор в течение 15 минут, используя раствор 0,1% γ-глобулина (Sigma). Аликвоты (приблизительно 105 клеток) инкубировали с моноклональными антителами, конъюгированными либо с фикоэритрином (PE), либо с аллофикоцианином (APC) (5 мкл антитела на 106 клеток), как указано в Таблице I, или с неконъюгированным первичным антителом. Контроли включали соответствующие изотипически сходные антитела, неокрашенные клетки и клетки, окрашенные только вторичным конъюгированным антителом. Все инкубирования с антителами проводили в течение 30 мин при 4°C, после чего клетки промывали красящим буфером. Образцы, которые были окрашены неконъюгированными первичными антителами, инкубировали еще в течение 30 мин при 4°C со вторичными конъюгированными антителами, меченными PE или APC. Перечень использованных вторичных антител смотри в Таблице I. Промытые клетки осаждали и ресуспендировали в красящем буфере и молекулы клеточной поверхности идентифицировали, используя прибор FACS Array (BD Biosciences), собирая, по меньшй мере 10000 событий.
Пример 10
Иммуногистохимия
Клетки, посеянные на чашки, покрытые 0,1% Матригелем (BD), фиксировали 4% параформальдегидом в течение 20 мин при комнатной температуре. Фиксированные клетки блокировали в течение 1 ч при комнатной температуре PBS/0,1%BSA/10% нормальной сывороткой цыпленка/0,5% Тритоном X-100, а затем инкубировали в течение ночи с первичными антителами в PBS/0,1%BSA/10% нормальной сыворотке цыпленка при 4°C. Перечень первичных антител и их рабочие разведения показаны в Таблице IB. После трех промываний в PBS/0,1% BSA флуоресцентные вторичные антитела в разведении 1:100 в PBS инкубировали с клетками в течение 1 ч при комнатной температуре, чтобы дать возможность для связывания. Контрольные образцы включали реакции, в которых первичное антитело исключали или в которых первичное антитело было заменено соответствующими подобранными иммуноглобулинами отрицательного контроля в той же концентрации, что и первичные антитела. Окрашенные образцы промывали; к каждому образцу добавляли каплю PROLONG® (Invitrogen, CA), содержащего диамидино-2-фенилиндол, дигидрохлорид (DAPI) для контрокрашивания ядер и действия в качестве реагента против обесцвечивания. Изображения получали, используя инвертированный конфокальный микроскоп Nikon Eclipse C-1 (Nikon, Japan) и объектив 10-60X.
Пример 11
ПЦР анализ недифференцированных клеток
Экстракция РНК, очистка и синтез кДНК. Образцы РНК очищали путем связывания с силикагелевой мембраной (Rneasy Mini Kit, Qiagen, CA) в присутствии этанол-содержащего буфера с высоким содержанием солей с последующим промыванием для удаления загрязнений. РНК далее очищали, используя набор TURBO DNA-free (Ambion, INC), и РНК высокого качества затем элюировали в воду. Выход и чистоту оценивали с помощью считывания показаний спектрофотометра при A260 и A280. Копии кДНК получали из очищенной РНК, используя набор High Capacity cDNA archive ABI (ABI, CA).
ПЦР амплификация в режиме реального времени и количественный анализ. Если не указано иное, все реактивы приобретали у Applied Biosystems. ПЦР реакции в режиме реального времени проводили, используя систему обнаружения последовательностей ABI PRISM(R)7900. TAQMAN(R)UNIVERSAL PCR MASTER MIX(R)ABI, CA) использовали с 20 нг обратно транскрибированной РНК в общем объеме реакционной смеси 20 мкл. Каждый образец кДНК прогоняли в двух повторах для исправления ошибок пипетирования. Праймеры и FAM-меченные зонды TAQMAN(R) использовали в концентрациях 200 нМ. Уровень экспрессии для каждого целевого гена стандартизировали, используя внутренний контроль глицеральдегид-3-фосфат дегидрогеназу человека (GAPDH), ранее разработанный компанией Applied Biosystem. Перечислены следующие праймеры и наборы зондов: Oct3/4 (Hs00742896), SOX-2 (Hs00602736), UTF-1 (Hs00747497), Rex-1 (Hs00399279), Connexin 43 (Hs00748445), Connexin 45 (Hs00271416), ABCG2 (Hs00184979), Tert (Hs00162669), HNF 3β(Hs00232764), GATA-4 (Hs00171403), Mixl1 (Hs00430824), Sox7 (Hs00846731), AFP (Hs00173490), Brachyury (Hs00610080), GSC (Hs00418279_m1), Pdx-1 (Hs00426216), PTF1a (Hs00603586), Ngn3 (Hs00360700), NeuroD1 (Hs00159598), Инсулин (Hs00355773) и Glu2 (Hs00165775). Праймеры Sox17 создавали, используя программу PRIMERS (ABI, CA), и были следующие последовательности: Sox17: TGGCGCAGCAGATACCA (SEQ ID NO:1), AGCGCCTTCCACGACTTG (SEQ ID NO:2) и CCAGCATCTTGCTCAACTCGGCG (SEQ ID NO:3). После начального инкубирования при 50°C в течение 2 мин с последующим инкубированием при 95°C в течение 10 мин образцы подвергали циклам 40 раз на двух стадиях - стадии денатурации при 95°C в течение 15 с с последующей стадией отжига/удлинения при 60°C в течение 1 мин. Анализ данных проводили, используя программное обеспечение системы обнаружения последовательностей GENEAMP®7000. Для каждого набора праймер/зонд определяли значение Ct как количество циклов, при котором интенсивность флуоресценции достигала особой величины в середине экспоненциальной области амплификации. Уровни относительной генной экспрессии рассчитывали, используя сравнительный Ct метод. Вкратце, для каждого образца кДНК значение Ct внутреннего контроля вычитали из Ct интересующего гена с получением величины дельта Ct (ΔCt). Стандартизованное количество мишени было рассчитано как 2-ΔCt, принимая эффективность амплификации за 100%. Окончательные данные выражали относительно калибровочного образца.
Пример 12
Анализ кариотипа
Кариотип клеток H9 определяли с помощью стандартного анализа кариотипа G-бэндинга. Всего оценивали 100 метафазных пластинок (Applied Genetics Laboratories, Inc.). В 100 проанализированных клетках не было обнаружено хромосомных аберраций. Цитогенетический анализ показал, что клетки имели нормальное количество аутосом и модальное число хромосом 46. На Фиг.15 представлен характерный кариотип, полученный из эмбриональных стволовых клеток человека линии H9.
Пример 13
Культура эмбриональных стволовых клеток человека на субстрате тканевой культуры, покрытом внеклеточным матриксом
Эмбриональные стволовые клетки человека линий H1, H7 и H9 получали из WiCell Research Institute, Inc. (Madison, WI) и культивировали в соответствии с инструкциями, предоставленными институтом поставщиком. Вкратце, клетки культивировали на клетках кормилицах - эмбриональных фибробластах мыши (MEF) в среде ES клеток, состоящей из DMEM/F12 (Invitrogen/GIBCO), дополненной 20% заменителем сыворотки «knockout serum replacement», 100 нМ MEM заменимых аминокислот, 0,5 мМ бета-меркаптоэтанола, 2 мМ L-глутамина с 4 нг/мл основного фактора роста фибробластов человека (bFGF). MEF клетки, происходящие из мышиных эмбрионов E13 - 13,5, приобретали у компании Charles River. MEF клетки размножали в среде DMEM, дополненной 10% FBS (Hyclone), 2 мМ глутамина и 100 мМ MEM заменимых аминокислот.Субконфлюэнтные культуры клеток MEF обрабатывали 10 мкг/мл митомицина C (Sigma, St. Louis, MO) в течение 3 ч для задержки деления клеток, затем трипсинизировали и высевали при 2×104/см2 на чашки, покрытые 0,1% желатином крупного рогатого скота. Клетки MEF из пассажей со второго по четвертый использовали в качестве питающего подслоя. Эмбриональные стволовые клетки человека высевали на питающий подслой клеток MEF, культивировали при 37°C в атмосфере 5% CO2 во влажной камере для тканевой культуры. При конфлюэнтности (приблизительно 5-7 дней после высевания) эмбриональные стволовые клетки человека обрабатывали 1 мг/мл коллагеназы IV типа (Invitrogen/GIBCO) в течение 5 - 10 мин, а затем осторожно снимали с поверхности, используя 5 мл стеклянную пипетку. Клетки центрифугировали при 900 об/мин в течение 5 мин и осадок ресуспендировали и заново высевали в соотношении клеток 1:3 - 1:4 на чашках, покрытых MATRIGEL™ без фактора роста в разведении 1:30 (BD Biosciences). Клетки впоследствии культивировали в MEF-кондиционированной среде, дополненной 8 нг/мл bFGF и коллагеназой, пересевали на чашках, покрытых MATRIGEL, по меньшей мере на протяжении пяти пассажей. Клетки культивировали на MATRIGEL™ обычным образом, пересевали с коллагеназой IV (Invitrogen/GIBCO), диспазой (BD Biosciences) или ферментом либеразой (Roche, IN).
Пример 14
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом внеклеточным матриксом, в дефинитиную эндодерму
Дифференцировку эмбриональных стволовых клеток в дефинитивную эндодерму проводили, как описано ранее в Nature Biotechnology 23, 1534-1541 (Dec 2005). Вкратце, на культуры H9 с конфлюэнтностью приблизительно 60-70% воздействовали средой DMEM:/F12, дополненной 0,5% FBS и 100 нг/мл активина A в течение двух дней, с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA) в течение еще трех дней. Клетки H9 культивировали на чашках, покрытых MATRIGEL с пониженным содержанием фактора роста в разведении 1:30 - 1:10 или на стандартном MATRIGEL в разведении 1:30 - 1:10. Чашки покрывали MATRIGEL на 1 час при комнатной температуре.
На 5 день культуры анализировали с помощью FACS на экспрессию CXCR4, E-кадгерина, CD9, N-кадгерина и с помощью ПЦР в режиме реального времени на SOX-17, SOX-7, альфа-фетопротеин (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3 бета и GATA4. AFP и SOX-7 рассматривают в качестве маркеров висцеральной эндодермы, тогда как GATA4, HNF-3 бета и SOX-17 представляют маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют маркеры первичной полоски. На Фиг.17 представлена экспрессия CXCR4 по данным FACS. Существует значительное повышение экспрессии CXCR4 клетками, культивируемыми на чашках, покрытых MATRIGEL в разведении 1:10 по сравнению с более низкими концентрациями MATRIGEL. Более того, MATRIGEL без факторов роста не был также эффективен при образовании клеток дефинитивной эндодермы, по сравнению со стандартным MATRIGEL.
На Фиг.18 показаны результаты ПЦР в режиме реального времени, подтверждающие, что клетки, культивированные на чашках, покрытых MATRIGEL в разведении 1:10, показали значительную активацию маркеров дефинитивной эндодермы по сравнению с клетками, культивированными на MATRIGEL в разведении 1:30.
Пример 15
Микрочиповый анализ изменений генной экспрессии в эмбриональных стволовых клетках после образования дефинитивной эндодермы
Суммарную РНК выделяли из следующих культур эмбриональных стволовых клеток человека, используя набор RNeasy mini (Qiagen): клетки H9P83, культивированные на чашках, покрытых MATRIGEL, и на которые воздействовали средой DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A, в течение двух дней, с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней; клетки H9P44, культивированные на MEF и на которые действовали средой DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A в течение дополнительных трех дней. Контроли для каждой группы включали клетки, посеянные на чашках, покрытых MATRIGEL, и культивированные в MEF-кондиционированной среде, или клетки, посеянные на MEF и культивированные в среде ES.
Получение образцов, гибридизацию и анализ изображений проводили в соответствии с Affymetrix Human Genome U133 Plus 2.0 Array. После нормализации и логарифмирования анализ данных проводили с помощью программного обеспечения OmniViz® (MA) и GENESIFTER (VizXLabs, WA). Вариабельность в пределах каждой обработки и среди различных обработок сравнивали, используя коэффициент корреляции Пирсона. Несоответствие профилей генной экспрессии между различными обработками наряду с коэффициентом корреляции между линиями представлено на Фиг.19. Значительные различия генной экспрессии между образцами оценивали, используя дисперсионный анализ и F-критерий с приведенным P-значением (коррекция Benjamini и Hochberg) ≼ 0,05. Только гены с присутствующим сигналом были включены в анализ. В таблице IV перечислены гены, которые дифференциально экспрессируются с разницей по меньшей мере 5 раз между различными образцами. Представлены нормализованные значения интенсивности генов, которые значительно экспрессировались, вместе со стандартной ошибкой среднего (SEM) для каждого гена.
Пример 16
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевых культур, покрытом MATRIGEL™, в дефинитивную эндодерму
Дифференцировку эмбриональных стволовых клеток в дефинитивную эндодерму проводили, как описано ранее в Nature Biotechnology 23, 1534-1541 (Dec 2005). Вкратце, H9, H7 или H1 клеточные культуры, посеянные на MATRIGEL™ с пониженным содержанием факторов роста (разведение 1:30) с конфлюэнтностью приблизительно 60-70%, подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A (R&D Systems, MN), в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. Во всех последующих примерах, если не указано иное, этот режим обработки будет называться протоколом дефинитивной эндодермы (DE). Одновременно H9, H7 и H1 клетки, культивированные на MEF питающем подслое, также подвергали тому же протоколу DE, описанному выше.
На 5 день культуры анализировали с помощью FACS на экспрессию CXCR4, E-кадгерина, CD9, CD99 и N-кадгерина (CD56) и с помощью ПЦР в режиме реального времени на SOX-17, SOX-7, альфа фетопротеин (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3 бета и GATA4. AFP и SOX-7 рассматриваются как маркеры висцеральной эндодермы, тогда как GATA4, HNF-3бета и SOX-17 представляют маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют маркеры первичной полоски.
H-линии, культивированные на мышином питающем подслое и подвергаемые протоколу DE, в результате давали активную экспрессию маркеров DE и экспрессию CXCR4 по данным FACS (фиг.20). Также имело место значительное снижение экспрессии E-кадгерина после обработки по протоколу DE. И, наконец, популяции CXCR4+ также окрашивались позитивно в отношении CD117. На Фиг.21 показана значительная активация макреров дефинитивной эндодермы по сравнению с необработанными H7 (Фиг.21, панель a) и H9 клетками (Фиг.21, панель b).
В отличие от H-линий, культивированных на MEF питающем подслое, H-линии, культивированные на MATRIGEL™ (разведение 1:30) и обработанные по протоколу дефинитивной эндодермы, не показали активной экспрессии маркеров дефинитивной эндодермы. В частности, экспрессия CXCR4 по данным FACS и ПЦР в режиме реального времени была значительно ниже для клеток, культивированных на MATRIGEL™ по сравнению с клетками, культивированными на эмбриональных фибробластах мыши. Экспрессия маркеров дефинитивной эндодермы следует за общим профилем ответа с H1, являющимся больше, чем H9, который больше, чем H7 (Фиг.22 и 23). На Фиг.22 клетки H1 показали значительное повышение экспрессии CXCR4 по сравнению с линиями H7 и H9. Следует отметить, что во всех случаях экспрессия CXCR4 была ниже для клеток, культивированных на MATRIGEL™ (разведение 1:30), по сравнению с клетками, культивированными на эмбриональных фибробластах мыши. На Фиг.23 (панели a-c) показаны результаты ПЦР в режиме реального времени, демонстрирующие, что имело место незначительное повышение активации макреров дефинитивной эндодермы в линиях H7 (Фиг.23, панель a) и H9 (Фиг.23, панель b). Однако линия H1 (Фиг.23, панель c) показала более сильную активацию маркеров дефинитивной эндодермы по сравнению с линиями H7 и H9.
Пример 17
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытой MATRIGEL™, в дефинитивную эндодерму (DE) - роль лигандов Wnt
Эмбриональные стволовые H7P44 и H9P46 культивировали на покрытых MATRIGEL™ (разведение 1:10) чашках и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A (R&D Systems, MN), в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней. В некоторые культуры добавляли 20 нг/мл Wnt-3a (Catalog# 1324-WN-002, R&D Systems, MN), 20 нг/мл Wnt-5a (Catalog# 654-WN-010, R&D Systems, MN), 25 нг/мл Wnt-7a (Catalog# 3008-WN-025, R&D Systems, MN) или 25 нг/мл Wnt-5b (Catalog# 3006-WN-025, R&D Systems, MN) на протяжении пяти дней обработки. На Фиг.24 представлены фазовоконтрастные изображения культуры дефинитивной эндодермы H9P46 в присутствии высокой концентрации (a) AA или (b) AA+20 нг/мл Wnt-3a. На Фиг.25 изображена экспрессия CXCR4 по данным FACS на 5 день в отношении линий H7P44 и H9P46, культивированных на MATRIGEL™ (разведение 1:30) и подвергнутых протоколу DE+Wnt-3a (Фиг.25, панели b и d) и -Wnt-3a (Фиг.25, панели a и c). Присутствие Wnt-3a в культурах DE привело в результате к сильной экспрессии CXCR4 (CD184) по сравнению с культурами DE, обработанными сывороткой в низкой концентрации плюс высокой концентрацией AA. На Фиг.26 представлены данные ПЦР в режиме реального времени для a) H7 и b) H9 культур, обработанных сывороткой в низкой концентрации+AA+/- лигандами Wnt. Для обеих линий H добавление WNT-3a приводило в результате к значительной активации маркеров дефинитивной эндодермы. В отличие от этого Wnt 5a, Wnt-5b и Wnt-7a оказывали минимальное влияние на экспрессию маркеров дефинитивной эндодермы.
Пример 18
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму: эффективная доза Wnt-3a
Эмбриональные стволовые клетки H9P46 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:10), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 100 нг/мл активина A (AA) и 10-50 нг/мл WNt-3a (R&D Systems, MN), в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 100 нг/мл активина A (AA) и 10-50 нг/мл Wnt-3a, в течение еще трех дней. Контрольные культуры не обрабатывали Wnt-3a. На Фиг.27, панели a) изображена экспрессия CXCR4 по данным FACS на 5 день в отсутствие Wnt-3a, b) 10 нг/мл Wnt-3a, c) 20 нг/мл Wnt-3a и d) 50 нг/мл Wnt-3a. В отсутствие Wnt-3a экспрессия CXCR4 была очень низкой. Напротив, добавление 10-50 нг/мл Wnt-3a значительно повышало число CXCR4 позитивных клеток. Более того, добавление 10 нг/мл Wnt-3a было так же эффективно, как и добавление 50 нг/мл Wnt-3a. Результаты ПЦР в режиме реального времени (Фиг.28, панель a) также подтверждают эти данные.
В отдельном исследовании клетки H9p52 высевали на MATRIGEL™ с низким содержанием факторов роста 1:30. В течение первых двух дней по протоколу DE использовали Wnt3A в диапазоне доз: 10нг/мл, 5нг/мл и 1 нг/мл. На Фиг.28 панель b показан ПЦР анализ маркеров DE через 5 дней после обработки. Количество клеток в конце эксперимента отмечено на Фиг.28, панель c. Это указывает на то, что клетки являются пролиферирующими при использовании более высоких доз Wnt-3a. Удлинение обработки Wnt-3a до пяти дней (5 д) оказывало небольшое воздействие на маркеры DE по данным ПЦР и существенно не увеличивало число клеток (Фиг.28, панель c). Эти данные указывают на то, что 10 нг/мл Wnt-3a в течение 2 дней достаточно для достижения оптимального размножения клеток и дифференцировки дефинитивной эндодермы.
Пример 19
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму (DE) - действие ингибитора GSK-3B
Для подтверждения того, что действие Wnt-3a происходило на протяжении всего пути Wnt, ингибитор GSK-3 использовали для активации нижележащих мишеней Wnt, таких как бета катенин. Эмбриональные стволовые клетки H9P46-P48 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:10), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 100 нг/мл активина-A (AA) и 10-1000 нМ ингибитора GSK-3B IX (Catalog# 361550, Calbiochem, CA), в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 100 нг/мл активина A (AA) и 0-1000 нМ ингибитора GSK-3B IX (Catalog# 361550, Calbiochem, CA) в течение дополнительных трех дней. Контрольные культуры обрабатывали сывороткой в низкой концентрации плюс высокой дозой активина A+/- Wnt-3a. На Фиг.29, панель а), представлена экспрессия CXCR4 по данным FACS на 5 день в отсутствие Wnt-3a или ингибитора GSK-3B, b)+20 нг/мл Wnt-3a, c)+1000 нМ ингибитора GSK-3B IX, d)+500 нМ ингибитора GSK-3B IX, e)+100 нМ ингибитора GSK-3B IX, f)+10 нМ GSK-3B ингибитора IX, g)+100 нМ GSK-3B ингибитора IX в течение 1-2 дней и h)+10 нМ ингибитора GSK-3B IX в течение 1-2 дней.
В отсутствие Wnt-3a или при 10 нМ ингибитора GSK-3B экспрессия CXCR4 была очень низкой. В отличие от этого добавление 20 нг/мл Wnt-3a или 100-1000 нМ ингибитора GSK-3B значительно увеличивало количество CXCR4 позитивных клеток. Более того, добавление 100 нМ ингибитора GSK-3B в течение 1-2 дней было также эффективно, как добавление 100 нМ ингибитора GSK-3B в течение всего пятидневного периода. На Фиг.30 изображена генная экспрессия маркеров дефинитивной эндодермы для клеток H9P48 (панель a) и клеток H9P46 (панель b).
На Фиг.16 представлено описание протокола дифференцировки в настоящем изобретении, в котором эмбриональные стволовые клетки дифференцируются в дефинитивную эндодерму в системе без питающего подслоя.
Пример 20
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму (DE)- эффективная доза активина-A в присутствии ингибитора GSK-3B или Wnt-3A
Эмбриональные стволовые клетки H9P49 и H1P46 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:10), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 10-100 нг/мл активина A (AA) и 100 нМ ингибитора GSK-3B IX (Catalog# 361550, Calbiochem, CA) или 20 нг/мл Wnt-3a, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 10-100 нг/мл активина A (AA), в течение дополнительных трех дней. Контрольные культуры обрабатывали сывороткой в низкой концентрации плюс 100 нг/мл активина A. На Фиг.31 изображена экспрессия CXCR4 по данным FACS для H9P49 и H1P46 на 5 день с a) 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, b) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, c) 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора GSK-3B IX в течение первых двух дней, d) 10 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора GSK-3B IX в течение первых двух дней, e) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней и f) 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней. На Фиг.31 панели a-d для клеток H9P49 и панели e-f для клеток H1P46. На Фиг.32 представлена генная экспрессия маркеров дефинитивной эндодермы для культур H9P49, обработанных 10, 50 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a: панель a: экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель b: SOX-17 и GATA4. Этого ясно не видно. По-видимому, это проблема с номерами позиций или это проблема верстки. Судя по всему, сильная экспрессия маркеров дефинитивной эндодермы может быть получена при использовании 50 нг/мл AA+20 нг/мл Wnt-3A или 100 нМ ингибитора GSK-3B IX. Более низкие дозы активина A приводят к формированию внеэмбриональной эндодермы.
Пример 21
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму (DE)- сочетание Wnt-3a и ингибитора GSK-3B
Эмбриональные стволовые клетки H9P53 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:30), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 100 нг/мл активина A (AA), и 100 нМ ингибитора GSK-3B IX (Catalog# 361550, Calbiochem, CA)+/- 20 нг/мл Wnt-3a в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 10-100 нг/мл активина-A (AA), в течение дополнительных трех дней. Одновременно культуры H9P53 обрабатывали 25 нг/мл BMP-4 (Catalog# 314-BP-010, R&D Systems, MN)+/- 20 нг/мл Wnt-3A+/- 100 нг/мл активина A. Контрольные культуры обрабатывали сывороткой в низкой концентрации плюс 100 нг/мл активина A. На Фиг.33 изображена экспрессия CXCR4 по данным FACS на 5 день с a) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней и 25 нг/мл BMP-4 в течение 3-5 дней, b) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, c) 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора GSK-3B IX в течение первых двух дней, d) 20 нг/мл Wnt-3a+25 нг/мл BMP-4 в течение всех пяти дней, e) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A+100 нМ ингибитора GSK-3B IX в течение первых двух дней, и f) 100 нг/мл активина A+25 нг/мл BMP-4 в течение всех пяти дней. На Фиг.34 изображена генная экспрессия маркеров дефинитивной эндодермы, определенная с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H1 пассажа 46, обработанных 10 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a или 100 нМ ингибитора GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC и POU5F (Oct-4) и панель (b): SOX-17, HNF-3B и GATA4. Результаты выражены как кратность повышения по сравнению с необработанными клетками. На Фиг.35 изображена генная экспрессия маркеров дефинитивной эндодермы, как определено с помощью ПЦР в режиме реального времени для культур эмбриональных стволовых клеток человека линии H9 пассажа 49, обработанных 50 или 100 нг/мл активина A плюс 10 или 100 нМ ингибитора GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражены как кратность повышения по сравнению с необработанными клетками. На Фиг.36 представлена генная экспрессия маркеров дефинитивной эндодермы для культуры H9P53, обработанной сочетаниями активина A, Wnt-3a, ингибитора GSK-3 и BMP-4: a) экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и SOX7 и b) SOX-17, HNF-3B и GATA4. Добавление BMP-4 к протоколу DE, по-видимому, индуцирует образование маркера мезодермы BRY, а сочетание Wnt-3A и ингибитора GSK-4B не приводит к значительной активации маркеров дефинитивной эндодермы по сравнению с добавлением каждого агента самого по себе в присутствии активина A.
Пример 22
Дифференцировка эмбриональных стволовых клеток человека, культивированных на MEF, в дефинитивную эндодерму (DE) - сочетание Wnt-3a, Активина A, Wnt-5a, BMP-2, BMP-4, BMP-6, BMP-7, IL-4 и SDF-1 в сыворотке низкой концентрации
Клетки H9P44 высевали на 6 луночные планшеты, предварительно покрытые эмбриональными фибробластами мыши, обработанными митомицином (MEF). Клетки выращивали до конфлюэнтности 70-80% в клеточной среде ES, состоящей из DMEM/F12 (Invitrogen/GIBCO), дополненной 20% заменителем сыворотки «knockout serum replacement», 100 нМ MEM заменимых аминокислот, 0,5 мМ бета-меркаптоэтанола, 2 мМ L-глутамина (все от Invitrogen/GIBCO) и 8 нг/мл основного фактора роста фибробластов человека (bFGF) (R&D Systems).
Для образования DE, клетки обрабатывали в присутствии или отсутствие активина A (100 нг/мл) в дополнение к другим факторам роста, подробно описанным ниже. Факторы роста добавляли для повышения концентрации FBS поэтапно, как указано в следующей схеме:
День 0: 0% FBS в DMEM/F12
День 1: 0,5% FBS в DMEM/F12
День 2: 2% FBS в DMEM/F12.
День 3: Клетки собирали для FACS анализа и РВ-ПЦР.
Все факторы роста приобретали у R&D Systems, MN. Подробное описание и концентрации факторов роста для каждой группы обработки представлены ниже.
1. Контроль - факторы роста не добавляют
2. Активин A (100 нг/мл)
3. Активин A (100 нг/мл)+Wnt-3a (10 нг/мл)+Wnt5a (10 нг/мл)
4. Активин A (100 нг/мл)+Wnt-3a (10 нг/мл)+Wnt5a (10 нг/мл)+BMP2 (100 нг/мл)
5. Активин A (100 нг/мл)+BMP-4 (100 нг/мл)
6. Активин A (100 нг/мл)+BMP-6 (100 нг/мл)
7 Активин A (100 нг/мл)+BMP-7 (100 нг/мл)
8. Активин A (100 нг/мл)+BMP-4 (100 нг/мл)+BMP-6 (100 нг/мл)+BMP-7 (100 нг/мл)
9. IL-4 (10 нг/мл)
10. SDF1a (20 нг/мл)
11. Активин A (100 нг/мл)+IL-4 (10 нг/мл)+SDF1a (20 нг/мл)
12. BMP2 (100 нг/мл)+BMP-4 (100 нг/мл)+BMP-6 (100 нг/мл)+BMP-7 (100 нг/мл)
13. Активин A (100 нг/мл) BMP-2 (100 нг/мл)+BMP-4 (100 нг/мл)+BMP-6 (100 нг/мл)+BMP-7 (100 нг/мл)
14. Активин A (100 нг/мл)+IL-4 (10 нг/мл)
15. Активин A (100 нг/мл)+(SDF1a (20 нг/мл)
16. Активин A (100 нг/мл)+Wnt-3a (10 нг/мл)+Wnt-5a (10 нг/мл)+Wnt-7a (10 нг/мл)
17. Активин A (100 нг/мл)+IL-4 (10 нг/мл)+SDF1a (20 нг/мл)+BMP-4 (100 нг/мл)
Результаты
Клетки собирали на 3 день обработки по протоколу DE. Для анализа аликвоту обработанных клеток использовали для получения РНК для RT-PCR и остальные клетки использовали для FACS анализа. Частота (%) CXCR4 показана на Фиг.37. Добавление указанных выше факторов роста не усиливало экспрессии CXCR4 выше обработки 100 нг/мл AA в сыворотке низкой концентрации.
Для РВ-ПЦР анализа клетки анализировали на экспрессию выбранной панели маркеров дефинитивной эндодермы. Представленные результаты калибровали относительно клеток, выращенных в минимальной среде, но не обработанных активином A или любым другим фактором роста. В соответствии с данными FACS в Таблице V показано, что не было значительной активации маркеров дефинитивной эндодермы под действием добавления факторов роста, таких как Wnt-3a, в культуры, обработанные высокой дозой активина A в сыворотке низкой концентрации. В отличие от предыдущих примеров, показывающих значительное увеличение маркеров DE для клеток ES, культивированных в условиях без питающего подслоя в присутствии активина A, WNT3A и сыворотки низкой концентрации.
Пример 23
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, или фибронектине человека, в дефинитивную эндодерму (DE)
Клетки H9P55 выращивали и дифференцировали на фибронектине человека или MATRIGEL™ со стандартным содержанием факторов роста (BD Biosciences). 1 мл DMEM/F12 (Invitrogen/GIBCO), содержащей 1 мкг/мл фибронектина человека (R&D systems, MN), добавляли в каждую лунку 6 луночного планшента для культивирования тканей. Альтернативно, MATRIGEL™ со стандартным содержанием факторов роста разводили 1:10 в DMEM/F12 и 1 мл разбавленного MATRIGEL™ добавляли в каждую лунку 6 луночного планшета для обработки тканевых культур. Клетки выращивали с коллагеназой. После достижения клетками 80% конфлюэнтности имела место обработка следующим образом: 2 дня 0,5% FBS, содержащей 10 нг/мл мышиного рекомбинантного Wnt3a (R&D) и 100 нг/мл активина A (R&D). За этим следовало 3 дня 2% FBS плюс 100 нг/мл активина A. На Фиг.38, панели a-b изображена экспрессия CXCR4 эмбриональными стволовыми клетками, культивированными на фибронектине и MATRIGEL соответственно. Результаты ПЦР в режиме реального времени (Фиг.39) подтверждают, что образование дефинитивной эндодермы было эквивалентным на планшетах, покрытых фибронектином и MATRIGEL™.
Пример 24
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL TM , в различных концентрациях, в дефинитивную эндодерму
Культуры H9 с конфлюэнтностью приблизительно 60-70% подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 20 нг/мл Wnt-3a и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 20 нг/мл Wnt-3a и 100 нг/мл активина A (AA), в течение дополнительных трех дней. H9 клетки культивировали на планшетах, покрытых стандартным MATRIGEL в разведении 1:60 - 1:10. Планшеты покрывали MATRIGEL в течение 1 часа при комнатной температуре.
Результаты ПЦР в режиме реального времени показаны на Фиг.40. Обработка эмбриональных стволовых клеток человека сывороткой в низкой концентрации, активином A и Wnt3a приводила к экспрессии генов CXCR4, GATA4, Goosecoid, HNF-3бета и SOX-17, давая возможность предположить, что клетки дифференцировались на стадию дефинитивной эндодермы. Однако, по-видимому, в присутствии Wnt-3A концентрация покрытия MATRIGEL™ не играет важную роль в дифференцировке.
Пример 25
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом внеклеточным матриксом, и впоследствии культивированных на MEF и дифференцированных в дефинитивную эндодерму - роль Wnt-3a
Клетки линии эмбриональных стволовых клеток H9, культивированных на MATRIGEL™ по меньшей мере в течение пяти пассажей, высевали на питающий подслой MEF в среде ES. При достижении клетками 60-70% конфлюэнтности на них воздействовали средой DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней. Дополнительные группы обработки включают Wnt-3a в концентрации 20 нг/мл в течение всех пяти дней +10-100 нг/мл активина A.
На 3 и 5 день культуры анализировали с помощью ПЦР в режиме реального времени на SOX-17, SOX-7, альфа-фетопротеин (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3 бета, GATA4, hTERT и Oct4. AFP и SOX-7 рассматривают в качестве маркеров висцеральной эндодермы, тогда как GATA4, HNF-3бета и SOX-17 представляют маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют маркеры первичной полоски. hTERT и Oct-4 представляют собой маркеры для самообновления и плюрипотентности соответственно. Результаты ПЦР в режиме реального времени показаны на фиг.41, панели a-d. FACS анализ также проводили на 3 и 5 день. Анализировали уровни экспрессии CXCR-4 и CD9, и они представлены на фиг.41, панель e.
В отсутствие Wnt-3a, уровни экспрессии AFP клеток, культивированных в 100 нг/мл активина A, аналогичны уровням, наблюдаемым в необработанных контролях. Однако с добавлением Wnt-3a к клеткам, культивированным в 100 нг/мл активина A, имеет место повышение экспрессии AFP, которая повышается с течением времени. При использовании более низкой концентрации активина A, экспрессия AFP является очень высокой, независио от присутствия Wnt-3a (Фиг.41, панель a). Это дает возможность предположить, что высокая концентрация активина A необходима для того, чтобы удержать клетки от дифференцировки во внеэмбриональные ткани.
По данным FACS анализа, CXCR4 позитивные клетки, составляющие 32-42% популяции в образцах, обработанных высокой концентрацией активина A, но не обработанные Wnt-3a, по сравнению с 23-33% популяции в образцах, обработанных высокой концентрацией активина A и Wnt-3a на 3 день (Фиг.41, панель e). К 5 дню обработки 28-32% клеток, обработанных высокой концентрацией активина A, но не обработанных Wnt-3a, экспрессировали CXCR4 по сравнению с 43-51% клеток, обработанных высокой концентрацией активина A и Wnt-3a (Фиг.41, панель f). В клетках, обработанных низкой концентрацией активина A, было больше CXCR4 позитивных клеток в группе обработки без Wnt3a (11-20%) по сравнению с группой, обработанной Wnt-3a (3-4%) (Фиг.41, панель g). В целом, Wnt-3a, по-видимому, не играл значительной роли в дифференцировке эмбриональных стволовых клеток человека, культивированных на MEF, в дефинитивную эндодерму. Это дает возможность предположить, что этот питающий подслой, вероятно, секретирующий достаточно Wnt-3a или аналогичного лиганда для того, чтобы усилить образование дефинитивной эндодермы, индуцированное активином А.
Пример 26
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом внеклеточным матриксом, в дефинитивную эндодерму после обработки ингибитором Wnt - DKK-1
Для определения, вызывало ли добавление Wnt-3a усиление дифференцировки, ингибитор Wnt-3 передачи сигнала добавляли в культуры. Культуры H9 с конфлюэнтностью приблизительно 60-70% подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 20 нг/мл Wnt3a, 100 нг/мл Dikkopf-1 (DKK-1) и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней. H9 клетки культивировали на планшетах, покрытых MATRIGEL с пониженным содержанием факторов роста в разведении 1:30. Планшеты покрывали MATRIGEL в течение 1 часа при комнатной температуре.
На 5 день культуры анализировали с помощью ПЦР в режиме реального времени на SOX-17, SOX-7, альфа-фетопротеин (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3 бета, GATA4, hTERT и Oct4. AFP и SOX-7 рассматривали в качестве маркеров висцеральной эндодермы, тогда как GATA4, HNF-3бета и SOX-17 представляли маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют маркеры первичной полоски. hTERT и Oct-4 являются маркерами самообновления и плюропотентности соответственно. Результаты показаны на Фиг.42.
В присутствии Wnt3a клетки экспрессируют CXCR4, GATA4, HNF-3бета и SOX17, все маркеры дефинитивной эндодермы. Маркеры образования первичной полоски, такие как goosecoid, также выявлялись на уровнях, выше, чем выявлялось в необработанных контролях. С добавлением DKK1 уровень экспрессии указанных выше маркеров дифференцировки резко снижается до уровня, сходного с таковыми в необработанных клетках.
Пример 27
Иммунофлуоресцентное окрашивание маркеров DE эмбриональных стволовых клеток H9, культивированных на субстрате тканевых культур, покрытых MATRIGEL, и дифференцированных в сыворотке низкой концентрации плюс активин-a и+/- Wnt-3a
5 дневные культуры DE клеток H9 окрашивали в соответствии с примером 10 на SOX-17, HNF-3B, GATA-4, N-кадгерин и E-кадгерин. Все ядра контрастно окрашивали DAPI. 20 нг/мл Wnt-3a в результате приводили к существенно большему количеству ядер, окрашенных позитивно на SOX-17, HNF-3бета и GATA-4, по сравнению с культурами, дифференцированными в отсутствие Wnt-3a. Более того, добавление Wnt-3a в результате приводило к значительной потере экспрессии e-кадгерина и повышенной экспрессии N-кадгерина (Фиг.43, панель a и Фиг.43, панель b).
Пример 28
Микрочиповый анализ изменений генной экспрессии в эмбриональных стволовых клетках после образования дефинитивной эндодермы на MEF по сравнению с MATRIGEL™
Суммарную РНК выделяли из следующих культур эмбриональных стволовых клеток, используя набор RNeasy mini (Qiagen): A) клетки H9P33 культивировали на планшетах, покрытых MATRIGEL™ (разведение 1:30), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней; B) клетки H9P44 культивировали на MEF и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12 дополненной 2% FBS и 100 нг/мл активина A, в течение дополнительных трех дней, и C) клетки H9P48 культивировали на планшетах, покрытых MATRIGEL™ (разведение 1:30), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A плюс 20 нг/мл Wnt-3A, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней. Контроли для каждой группы включали клетки, посеянные на чашках, покрытых MATRIGEL, и культивированные в MEF-кондиционированной среде, или клетки, посеянные на MEF и культивированные в среде ES. Все группы содержали три биологических репликата, и каждый биологический репликат повторяли на двух отдельных генных чипах.
Получение образцов, гибридизацию и анализ изображений проводили в соответствии с Affymetrix Human Genome U133 Plus 2.0 Array. После нормализации и логарифмирования анализ данных проводили с использованием программного обеспечения OmniViz® (MA) и GENESIFTER (VizXLabs, WA). Значительные различия в генной экспрессии между образцами выражали, используя дисперсионный анализ и F-критерий с приведенным P-значением (коррекция Benjamini и Hochberg) ≤0,05. Только гены с присутствующим сигналом по меньшей мере в одной группе были включены в анализ. В Таблице VI приведены средние значения нормализованной и логарифмированной интенсивности сигнала генов, показывающие по меньшей мере 5-кратные различия между группой A, группой B и группой C наряду с приведенным P-значением для каждого гена.
Пример 29
Дифференцировка SA002 ES линии, культивированной на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму (DE)
Клетки SA002 P38 (Cellartis, Sweden), предварительно культивированные по меньшей мере на протяжении трех пассажей на планшетах, покрытых MATRIGEL (разведение 1:30), в MEF-CM, дополненной 8 нг/мл bFGF, подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS и 100 нг/мл активина A (R&D Systems, MN)+/- 20 нг/мл Wnt-3a или 100 нМ ингибитора GSK-3B IX, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней. Результаты ПЦР в режиме реального времени представлены на Фиг.44, панели a & b. Аналогично линиям H1, H7 и H9, для линии SA002 также требовалось добавление Wnt-3A для сильной экспрессии маркеров DE. Экспрессия CXCR4 изображена на Фиг.45: a) обработка AA, b) AA+Wnt-3a, c) AA+ингибитор GSK-3B.
Пример 30
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом сывороткой человека, в дефинитивную эндодерму (DE)
Культуры эмбриональных стволовых клеток человека линии H1 в пассаже 55 выращивали и дифференцировали на планшетах, покрытых сывороткой человека (Sigma, #H1388, MO). 0,5 мл сыворотки человека добавляли в каждую лунку 6-луночного планшета для тканевых культур, инкубировали в течение 1 часа при комнатной температуре и аспирировали перед добавлением эмбриональных стволовых клеток человека. После достижения клетками 80% конфлюэнтности их обрабатывали следующим образом: 2 дня 0,5% FBS, содержащей 10 нг/мл мышиного рекомбинантного Wnt3a (R&D) или 100 нМ ингибитора GSK-3B IX (Catalog# 361550, Calbiochem, CA) и 100 нг/мл активина A (R&D). После этого 3 дня 2% FBS плюс 100 нг/мл активина A. Затем культуры анализировали с помощью ПЦР в режиме реального времени (Фиг.46, панели a & b). Сильную экспрессию маркеров дефинитивной эндодермы отмечали для клеток, обработанных активином A+ингибитором GSK-3B или Wnt-3A, по сравнению с клетками, обработанными только активином A. Эти данные соответствуют сведениям авторов изобретения для эмбриональных стволовых клеток, культивированных на планшетах, покрытых MATRIGEL™ или фибронектином человека.
Пример 31
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму (DE) - оценка различных ингибиторов GSK-3B
Эффективность ряда коммерчески доступных ингибиторов GSK-3B оценивали при образовании DE из эмбриональных стволовых клеток человека. Оценивали следующие ингибиторы GSK-3B в концентрации 100 нМ: ингибитор GSK-3B VIII (Catalog# 361549, Calbiochem, CA), ингибитор GSK-3B IX (Catalog# 361550, Calbiochem, CA), ингибитор GSK-3B XI (Catalog# 361553, Calbiochem, CA), ингибитор GSK-3B XII (Catalog# 361554, Calbiochem, CA). ES клетки H1P54 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:30), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 100 нг/мл активина A (AA)+/- различные ингибиторы GSK-3B, в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 100 нг/мл активина A (AA), в течение дополнительных трех дней. Контрольные культуры обрабатывали сывороткой в низкой концентрации плюс высокой дозой AA. На Фиг.47, панели a и b, представлена генная экспрессия маркеров дефинитивной эндодермы на 5 день. Ингибиторы GSK-3B IX и XI оба были эффективными в индукции формирования DE по сравнению с ингибитором GSK-3B VIII и XII.
Пример 32
Образование панкреатической эндодермы эмбриональными стволовыми клетками человека, культивированными в условиях без питающего подслоя - оценка аналогов ретиноевой кислоты
Эмбриональные стволовые клетки H9P49 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:30), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 20 нг/мл Wnt-3a (Catalog# 1324-WN-002, R&D Systems, MN) и 100 нг/мл активина A (R&D Systems, MN), в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина A (AA), в течение дополнительных трех дней. На 5 день клетки собирали для анализа с помощью FACS и ПЦР в режиме реального времени. Как указано в предыдущих примерах, в результате этого протокола получали сильную активацию маркеров дефинитивной эндодермы, таких как CXCR4 и SOX-17. Полученные в результате клетки дефинитивной эндодермы на 5 день подвергали воздействию следующим условиям среды для индукции образования панкреатической эндодермы: культивирование в среде DMEM/F12, дополненной 2% FBS и 1 мкМ полностью транс-ретиноевой кислоты (RA) (Catalog#R2625, Sigma, MO), или 0,1-10 мкМ AM-580 (4-[(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталенил)карбоксамидо]бензойной кислотой, Catalog#A8843, Sigma, MO), или 0,1-1 мкМ TTNPB (4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталенил)-1-пропенил]бензойной кислотой Arotinoid acid, Catalog#T3757, Sigma, MO), в течение 3 дней. AM-580 и TTNPB являются аналогами ретиноевой кислоты с аффинностью к рецепторам ретиноевой кислоты. После обработки ретиноевой кислотой проводили дополнительную обработку в течение трех дней в среде DMEM/F12, дополненной 2% FBS и 20-50 нг/мл bFGF (Catalog#F0291, Sigma, MO). Культуры собирали и получали образцы мРНК для анализа.
Анализ генной экспрессии показал, что (Фиг.48, панели a-d) добавление 1 мкМ ретиноевой кислоты с последующим воздействием bFGF значительно активирует маркеры панкреатической эндодермы, такие как PDX-1. Более того, в результате этого протокола происходит сильная экспрессия маркеров эндодермы передней кишки, таких как CDX-2 и AFP. В концентрации 1 мкМ добавление аналогов ретиноевой кислоты приводило в результате к эквивалентым маркерам панкреатической эндодермы и передней кишки. Однако добавление 1 мкМ аналогов ретиноевой кислоты приводило в результате к более сильной экспрессии AFP по сравнению с полностью транс-ретиноевой кислотой. Однако добавление 10 мкМ AM-580 подавляло экспрессию AFP и CDX-2 при сохранении высокой экспрессии PDX-1.
Пример 34
Действие обработки Wnt-3a на экспрессию цитокинов в эмбриональных стволовых клетках человека
Эффект того, что обработка Wnt-3a имеет преимущество в экспрессии цитокинов, анализировали, используя белковую матрицу. Клетки эмбриональных стволовых клеток человека линии H9 культивировали в соответствии со способами, описанными в Примере 15. При пассаже 54 клетки дифференцировали в присутствии 100 нг/мл активина A+/- 10 нг/мл Wnt-3a в течение 2 дней в 0,5% FBS DMEM/F12. Клетки впоследствии культивировали в течение дополнительных трех дней в 100 нг/мл активина A и 2% FBS DMEM/F12. В конце 5 дня определяли экспрессию CXCR4 с помощью FACS для каждой группы обработки. Клетки, обработанные только активином A, имели 1% от клеток, экспрессирующих CXCR4. Клетки, обработанные активином A и Wnt3a, имели 73% клеток, позитивных в отношении экспрессии CXCR4.
Клеточные лизаты получали из клеток каждой группы обработки, с помощью набора для лизиса клеток млекопитающих (Sigma-Aldrich,MO). Кондиционированную среду из каждой группы обработки собирали и концентрировали. Матричный анализ цитокинов проводили, используя панели матрицы цитокинов, поставляемые RayBiotech, GA (http://www.raybiotech.com/). В Таблице VII приведена экспрессия цитокинов, факторов роста и рецепторов после нормализации данных и вычитания фоновых значений. Для каждой панели также включены положительные и отрицательные контроли. Показанные данные представляют собой два независимых образца на группу обрабатываемых клеток (1, 2).
Заметную активацию ангиогенина, IGFBP-1 и EGF видно в кондиционированной среде клеток, обработанных Wnt3. Многочисленные белки активируются в клеточных лизатах, обработанных Wnt3a, в том числе IGFBP-1, TGFбета-1 и TGFбета-3. Эти активированные белки могут быть добавлены обратно в дифференцировочную среду для восстановления или усиления действия Wnt3a на образование дефинитивной эндодермы.
Пример 35
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры, покрытом MATRIGEL™, в дефинитивную эндодерму: роль Wnt1
ES клетки H1P55 культивировали на чашках, покрытых MATRIGEL™ (разведение 1:30), и подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, и 100 нг/мл активина A+/- 10-20 нг/мл WNT-1 (PeproTech, NJ, Catalogue#120-17) в течение двух дней с последующей обработкой средой DMEM/F12, дополненной 2% FBS, 100 нг/мл активина A (AA) и+/- 10 или 20 нг/мл WNT-1, в течение дополнительных трех дней. Тестировали следующие сочетания WNT1+AA:
a) 20 нг/мл WNT1+100 нг/мл AA в 0,5% FBS+DM-F12 в течение 1-2 дней, затем 2% FBS+DM-F12+100 нг/мл AA в течение третьего дня, b) 20 нг/мл WNT1+100 нг/мл AA в 0,5% FBS+DM-F12 в течение 1-2 дней, затем 2% FBS+DM-F12+100 нг/мл AA в течение 3-5 дней, c) 10 нг/мл WNT1+100 нг/мл AA в 0,5% FBS+DM-F12 в течение 1-2 дней, затем 2% FBS+DM-F12+100 нг/мл AA в течение третьего дня, d) 10 нг/мл WNT1+100 нг/мл AA в 0,5% FBS+DM-F12 в течение 1-2 дней, затем 2% FBS+DM-F12+100 нг/мл AA в течение 3-5 дней, e) 20 нг/мл WNT1+100 нг/мл AA в 0,5% FBS+DM-F12 в течение 1-2 дней, затем 2% FBS+DM-F12+100 нг/мл AA+20 нг/мл WNT1 в течение третьего дня, f) 20 нг/мл WNT1+100 нг/мл AA в 0,5% FBS+DM-F12 в течение 1-2 дней, затем 2% FBS+DM-F12+100 нг/мл AA+20 нг/мл WNT1 в течение 3-5 дней. На Фиг.49, панели a и b изображены данные ПЦР в режиме реального времени в отношении маркеров дефинитивной эндодермы после обработки клеток H1 сывороткой низкой концентрации, AA и Wnt-1. Добавление 20 нг/мл WNT1 в присутствии 100 нг/мл AA приводило в результате к значительной активации маркеров дефинитивной эндодермы (Bry, CXCR4, GSC, SOX17, HNF-3B, и GATA-4).
Пример 36
Дифференцировка эмбриональных стволовых клеток человека, культивированных на субстрате тканевой культуры в дефинитивную эндодерму в среде определенного состава
Эмбриональные стволовые клетки H1, культивированные в гипоксических условиях (приблизительно 3% O2) и высеянные на чашках, покрытых MATRIGEL™ (разведение1:30), культивировали в MEF-кондиционированной среде приблизительно примерно до 60-70% конфлюэнтности, а затем подвергали воздействию среды DMEM/F12, дополненной 0,5% FBS, 20 нг/мл WNT-3a (Catalog# 1324-WN-002, R&D Systems, MN) и 100 нг/мл активина-A (R&D Systems, MN), в течение двух дней, с последующей обработкой средой DMEM/F12, дополненной 2% FBS и 100 нг/мл активина-A (AA), в течение еще 3-4 дней. Одновременно клетки H1, культивированные на MATRIGEL, подвергали воздействию DMEM-F12 или DMEM-LG, дополненной 0,5-1% B27 (Invitrogen, Ca)+20 нг/мл WNT-3a+100 нг/мл активина-A+/- ингибитор GSK-3B IX (Catalog# 361550, Calbiochem, CA), в течение 4-5 дней. В некоторых культурах дополнение 1% N2 (Invitrogen, Ca) использовали вместо 1% B27.
Более того, клеточные линии, выделенные из родительской ES линии H9 назваемые «EXPRES» клетками (EXpandable Pre-Primitive Streak cells), также подвергали воздействию среды того же состава, как описано выше для индукции образования дефинитивной эндодермы (DE). Свойства клеток EXPRES ранее описаны в заявке США 60/913475. Наконец, клетки линии BGO1V, полученные от Invitrogen и культивированные на планшетах, покрытых MATRIGEL, в MEF-кондиционированной среде+8 нг/мл bFGF, подвергали воздействию дифференцировочной среды, упомянутой выше, для индукции образования DE. На Фиг.50 изображена экспрессия CXCR4 и CD9 по данным FACS на 4-5 день для клеточных линий EXPRES01, BGO1V и H1 P50, на которые воздействовали дифференцировочной средой определенного состава или дифференцировочной средой, основанной на сыворотке низкой концентрации. Для всех тестированных линий экспрессия CXCR4 была эквивалентна при использовании среды определенного состава на основе 1% B27 добавки по сравнению со средой на основе FBS. Более того, добавка 1% N2 была не способна индуцировать образование DE, вероятно, вследствие высокой концентрации инсулина (8,6 мкМ) в добавке N2. На Фиг.51 показаны данные ПЦР в режиме реального времени для культур EXPRES01, BGO1V и H1, обработанных сывороткой низкой концентрации или средой определенного состава+AA+WNT3A на 4-5 день. В результате этого протокола происходит значительная активация маркеров DE. На Фиг.52 представлены изображения иммунофлуоресценции клеток EXPRES 01 P49, дифференцированных в DE, с использованием 1% b27+DM-F12+активин-A+WNT3A+ингибитор GSK03B в течение пяти дней. Большинство клеток окрашиваются позитивно на GATA-4, SOX-17, и HNF-3B и меньшинство клеток окрашиваются позитивно на OCT-4, SOX-2 и Nanog.
Пример 37
Дифференцировка эмбриональных стволовых клеток человека, культивированных на MEF, в дефинитивную эндодерму в среде определенного состава
Клетки H1 высевали на 6 луночные планшеты, предварительно засеянные эмбриональными фибробластами мыши, обработанными митомицином (MEF). Клетки выращивали до 70-80% конфлюэнтности в клеточной среде ES, состоящей из DMEM/F12 (Invitrogen/GIBCO), дополненной 20% заменителем сыворотки «knockout serum replacement», 100 нМ MEM заменимых аминокислот, 0,5 мМ бета-меркаптоэтанола, 2 мМ L-глутамина (все от Invitrogen/GIBCO) и 8 нг/мл основного фактора роста фибробластов человека (bFGF) (R&D Systems).
Для образования DE клетки обрабатывали в присутствии или отсутствие активина-A (100 нг/мл) в дополенение к другим факторам роста, подробно описанным ниже. Факторы роста добавляли для повышения концентрации FBS поэтапно, как указано в следующей схеме:
День 0: 0% FBS или 1% B27 в DMEM-LG или RPMI
День 1: 0,5% FBS или 1% B27 в DMEM/F12 или RPMI
День 2-5: 2% FBS или 1% B27 в DMEM/F12 или RPMI
Альтернативно, клетки обрабатывали в среде HESGro (Chemicon, Ca)+100 нМ LY-Соединения (EMD, CA)+100 нг/мл AA в течение 1-5 дней.
Клетки собирали для анализа с помощью FACS и РВ-ПЦР на 1-5 день. Все факторы роста приобретали у R&D Systems, MN. На Фиг.53 показаны данные ПЦР в режиме реального времени для клеток H1, на которые воздействовали либо сывороткой низкой концентрации+активин-A, либо средой определенного состава+активин-A на 1-5 день. Кратность изменения уровней экспрессии нормировали к значениям 1 дня.
Публикации, цитируемые по всему этому документу, тем самым включены в качестве ссылки в полном объеме. Хотя различные аспекты настоящего изобретения были проиллюстрированы выше ссылкой на примеры и предпочтительные варианты осуществления, будет понятно, что объем изобретения определяется не приведенным выше описанием, а следующей формулой изобретения, составленной по всем правилам в соответствии с патентным законом.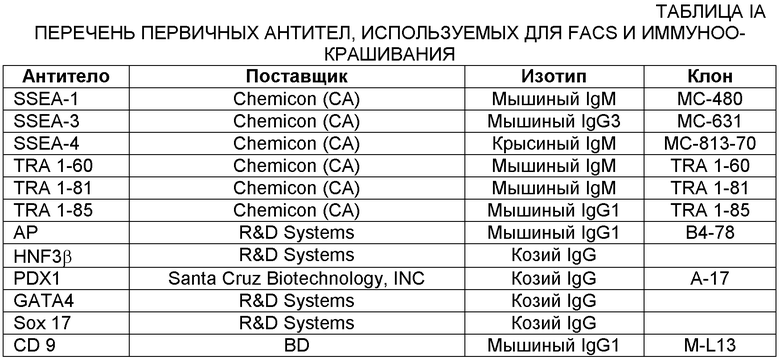
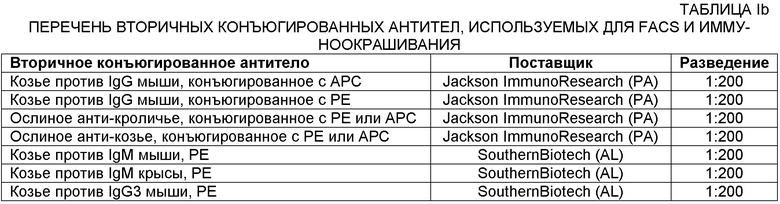
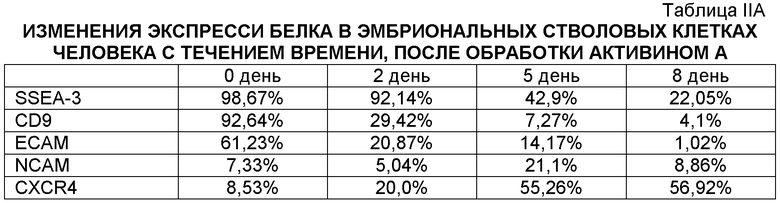
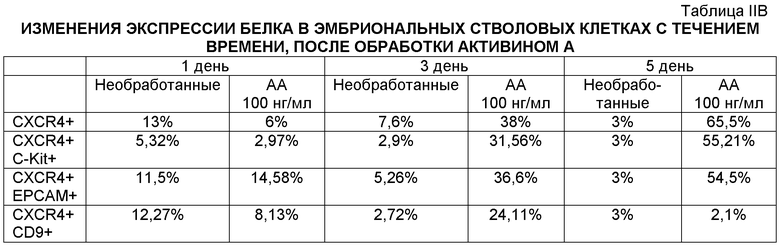

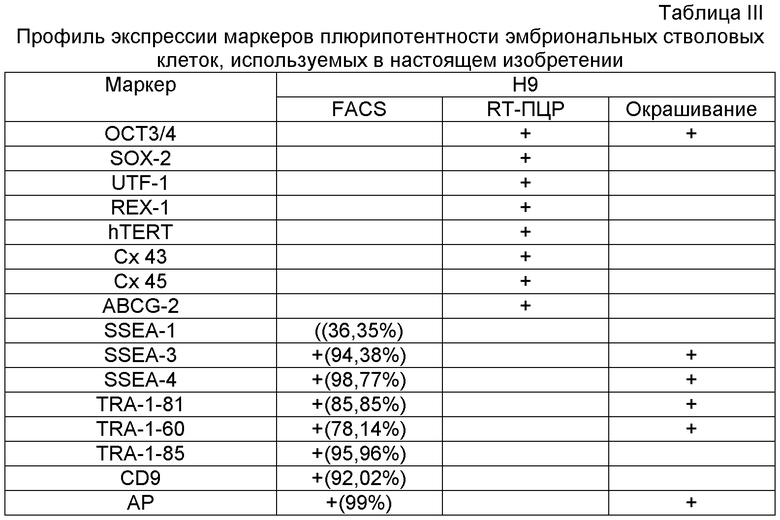
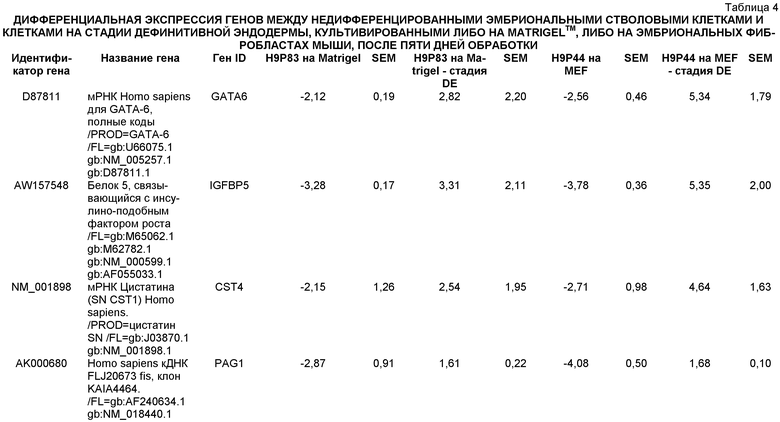

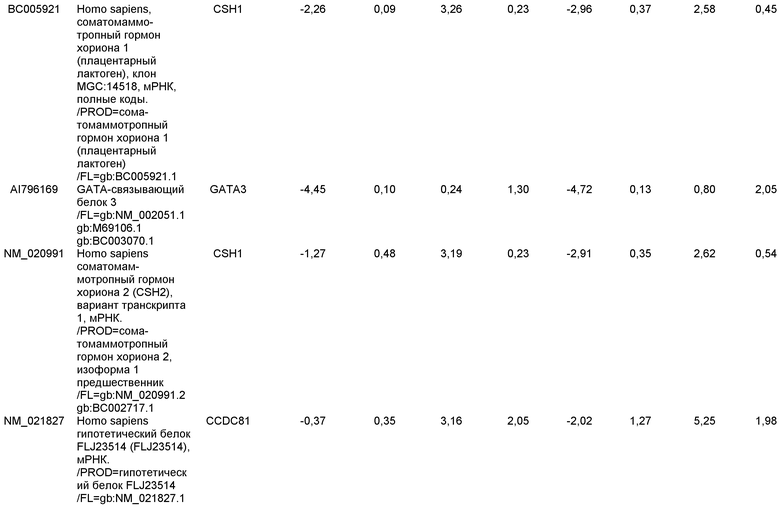
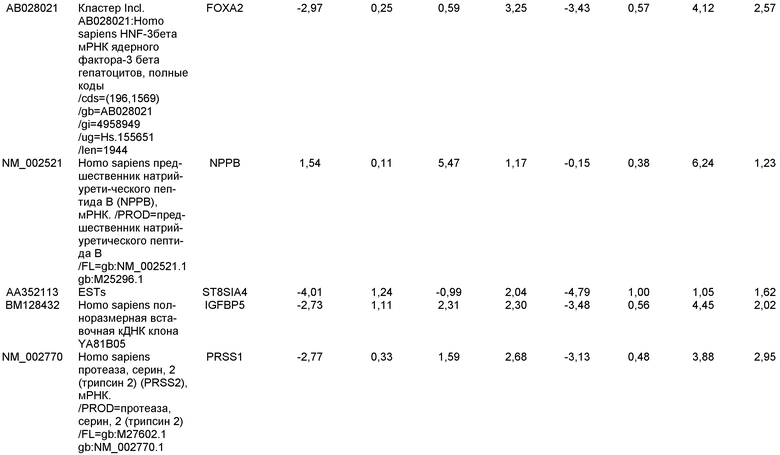
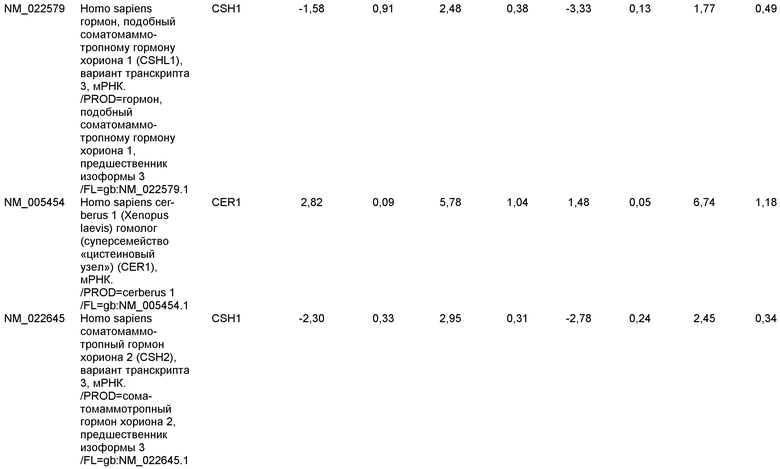
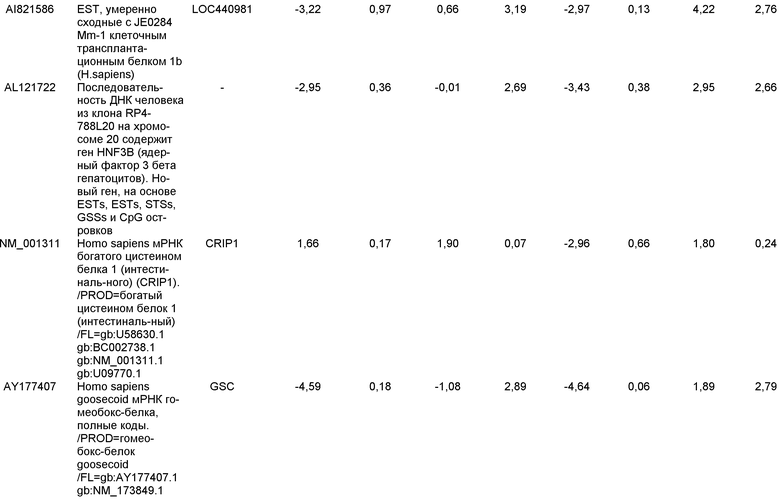
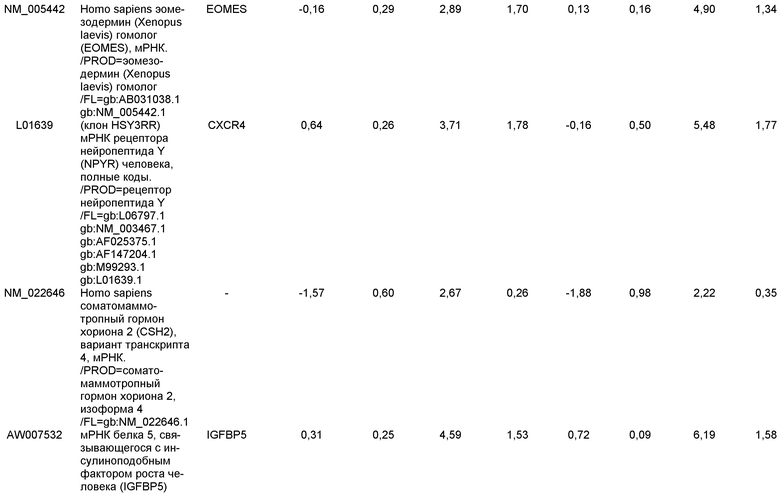
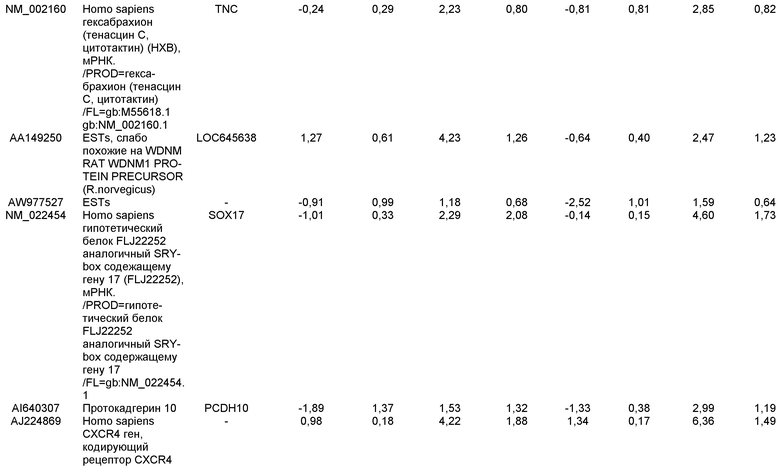
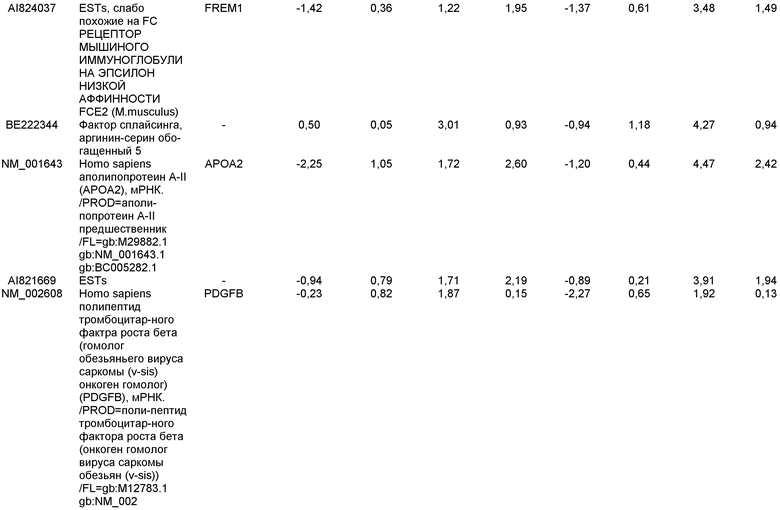
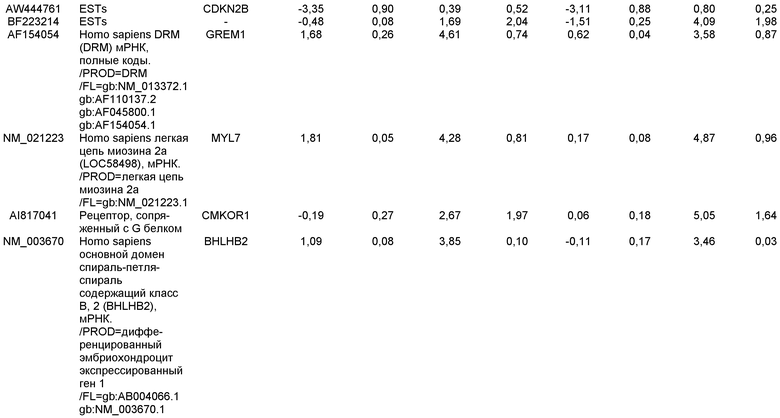
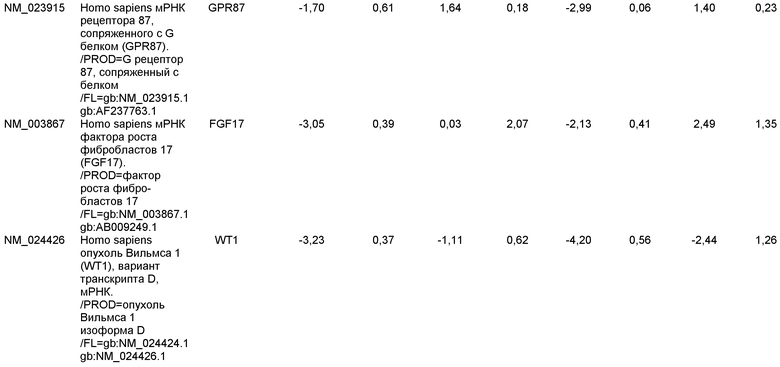
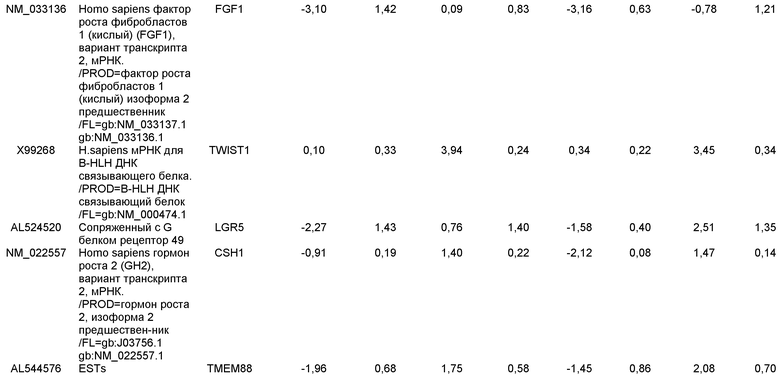
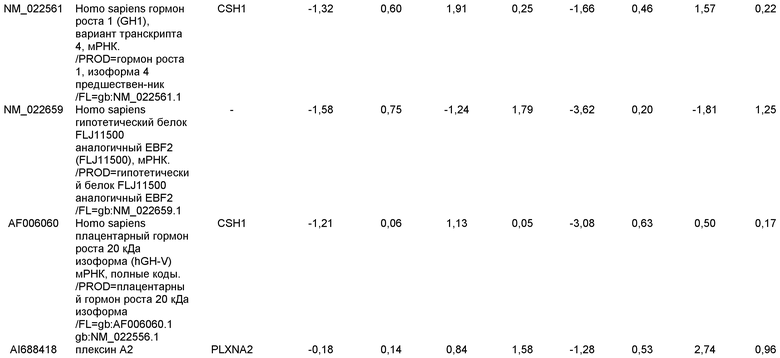
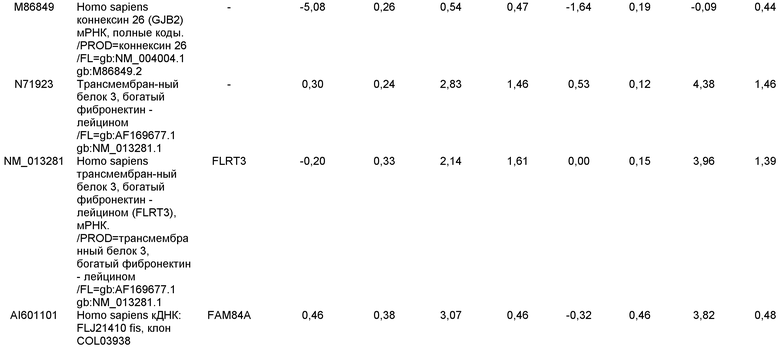
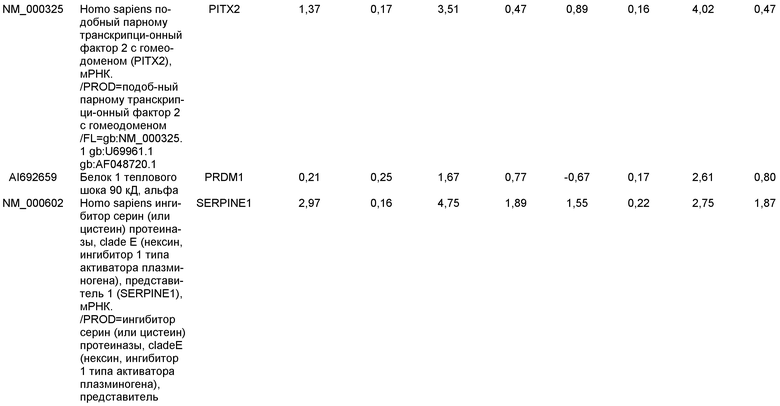
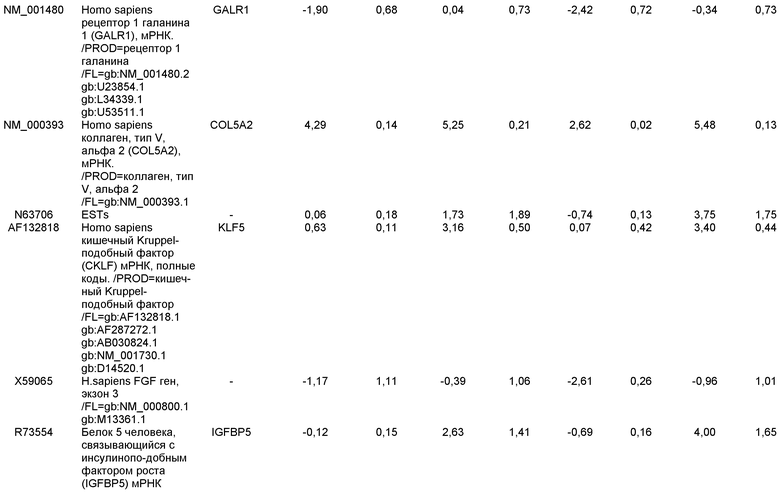
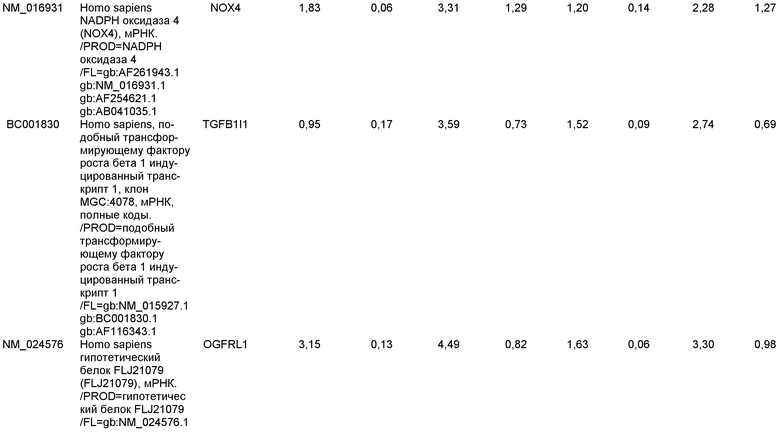
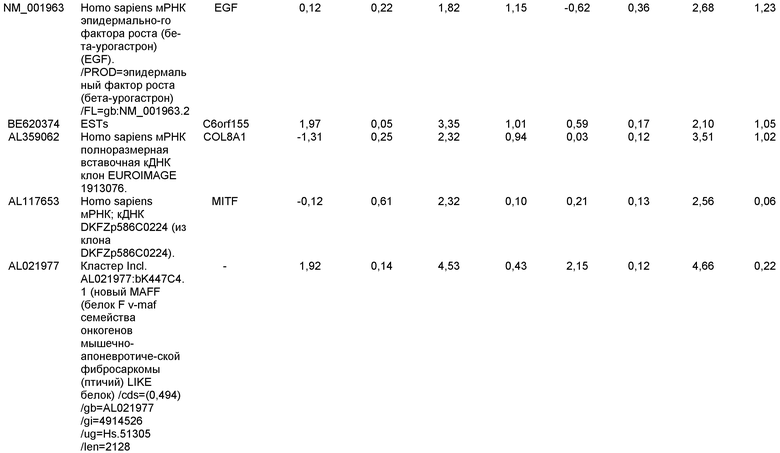
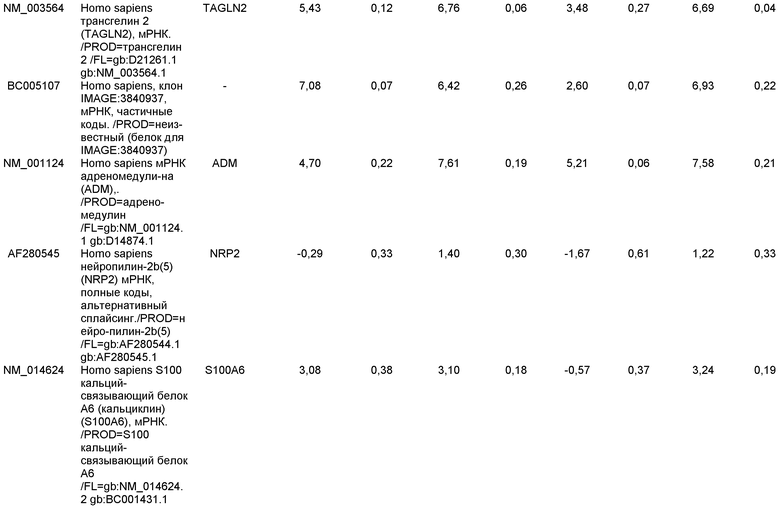
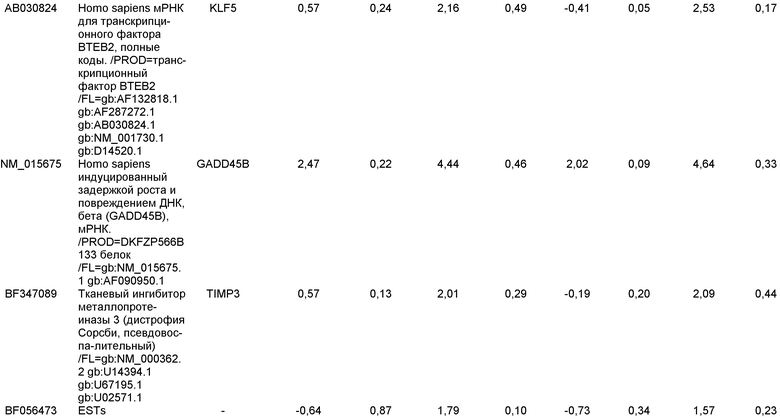
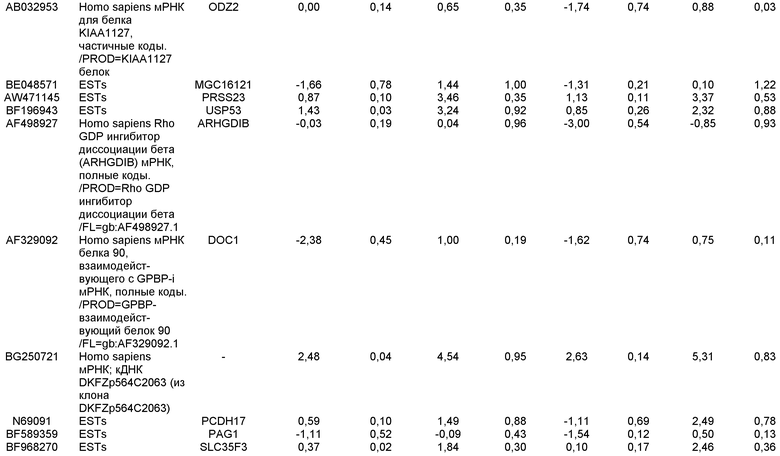
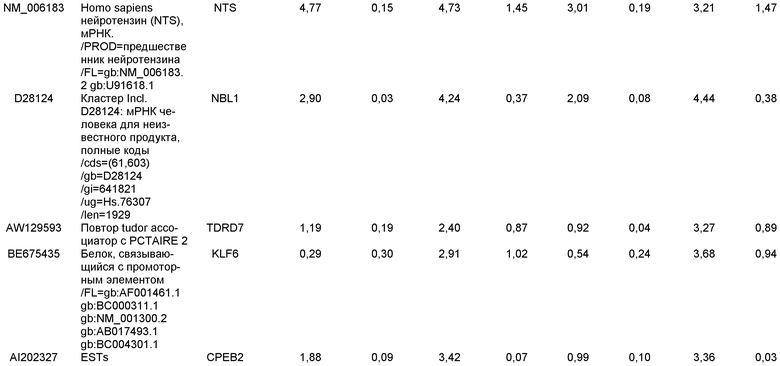
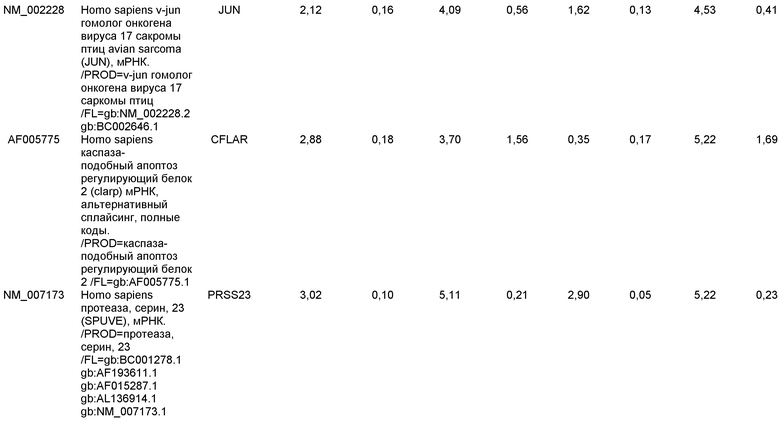
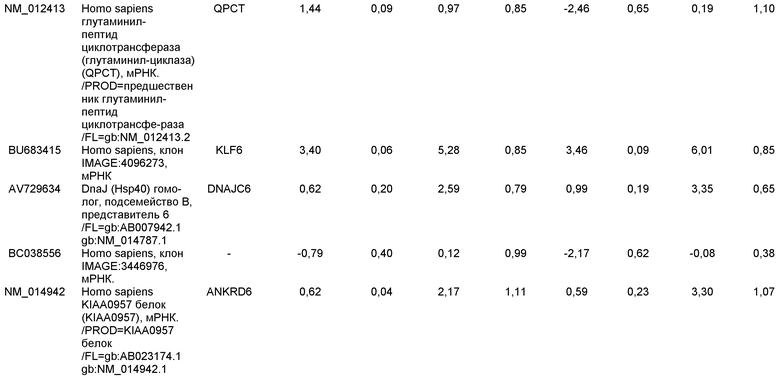
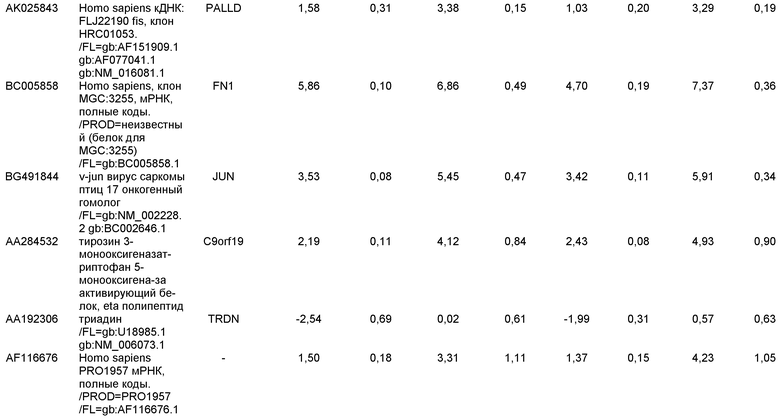
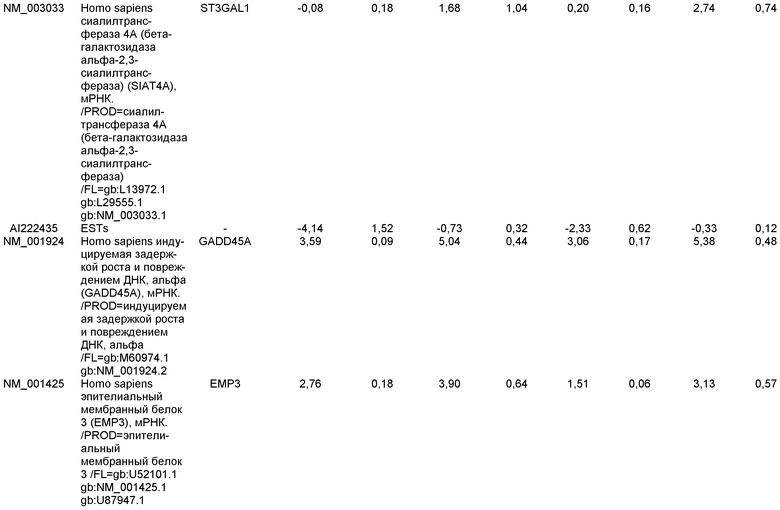
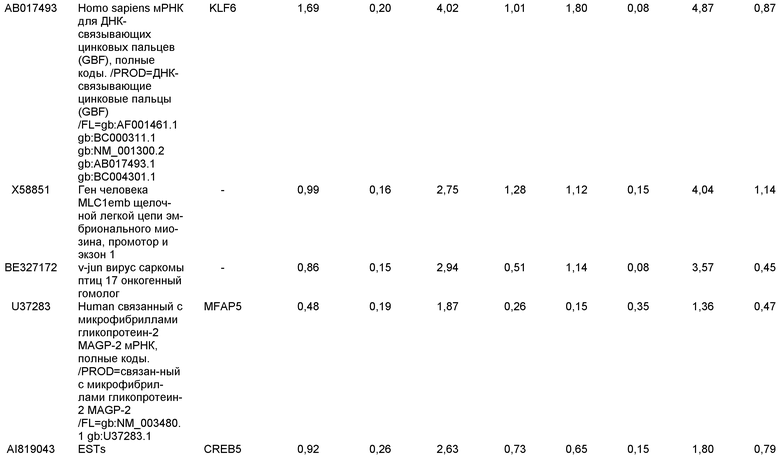
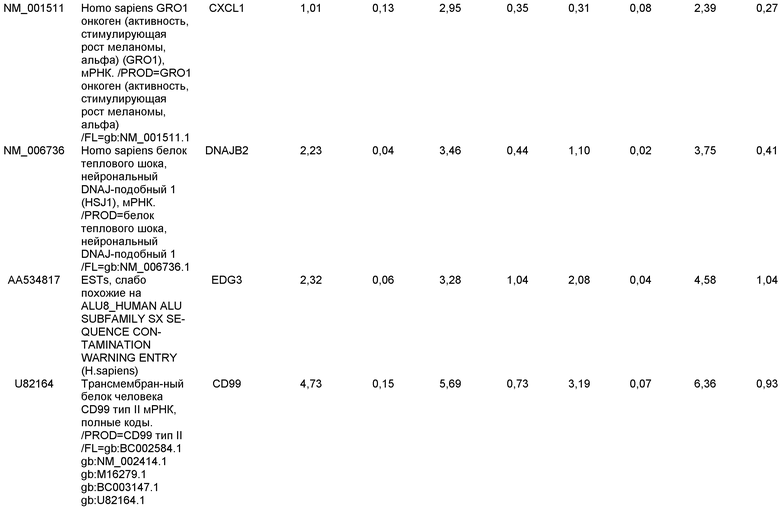
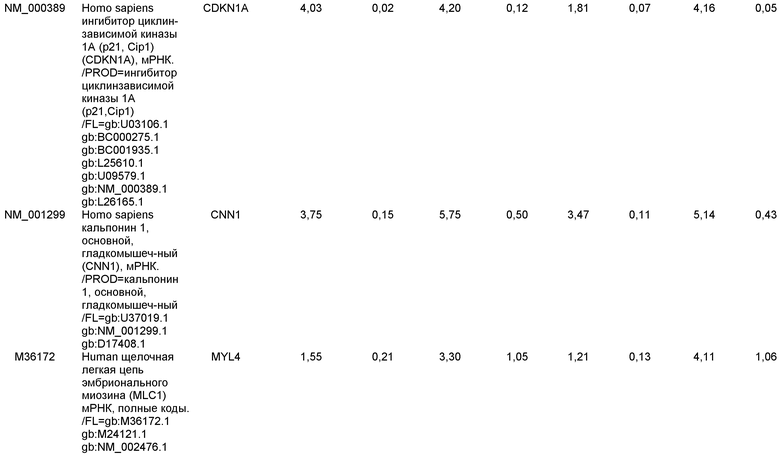
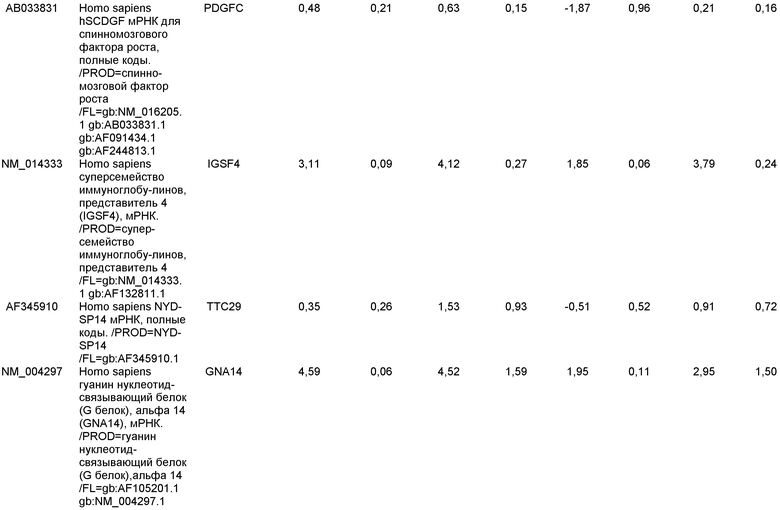
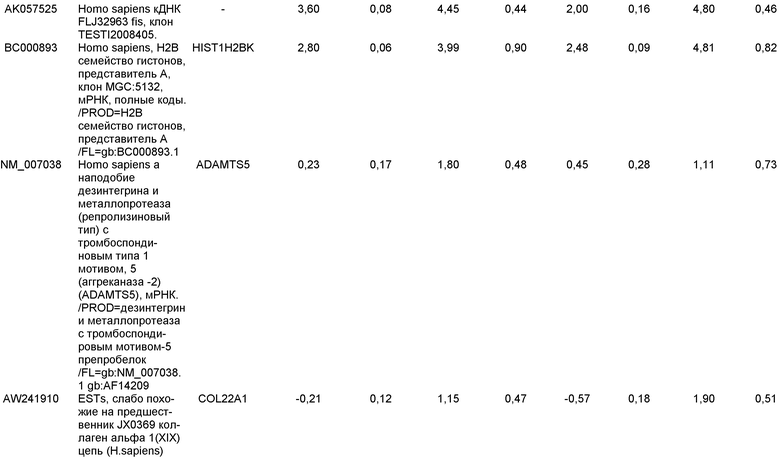
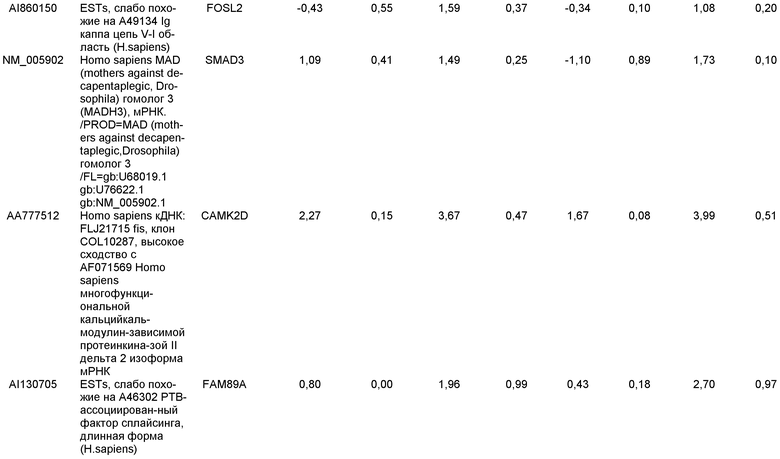
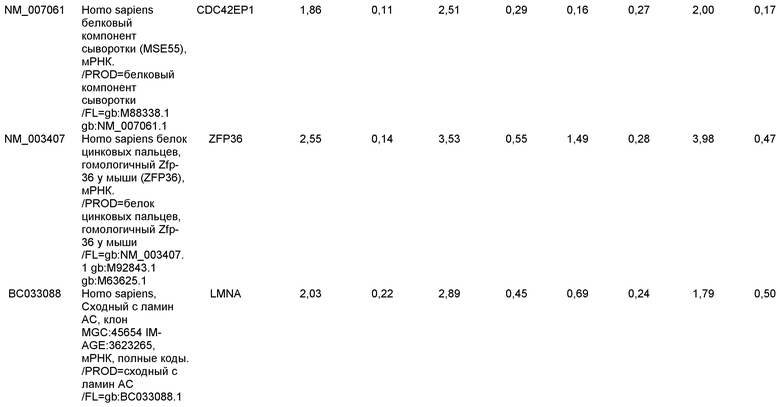
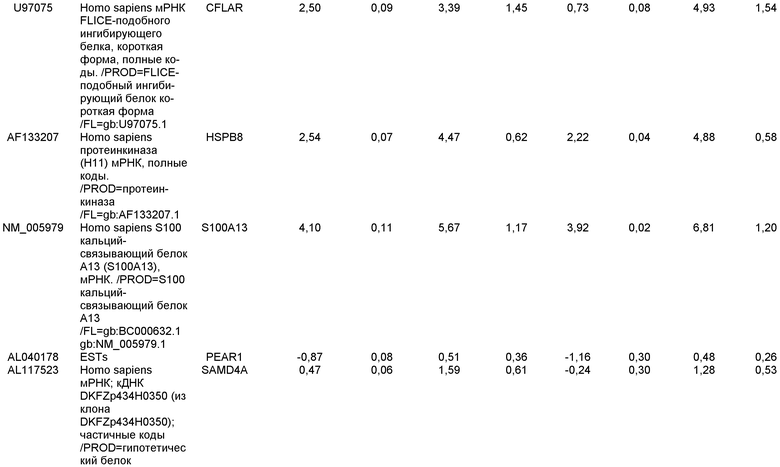
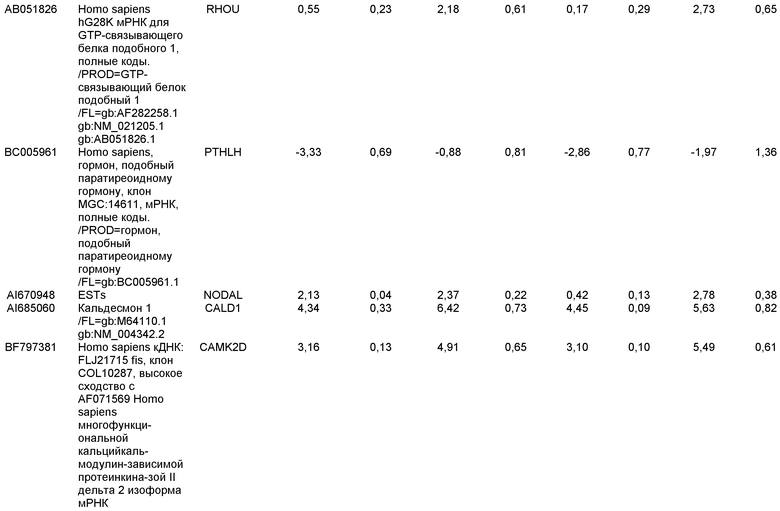
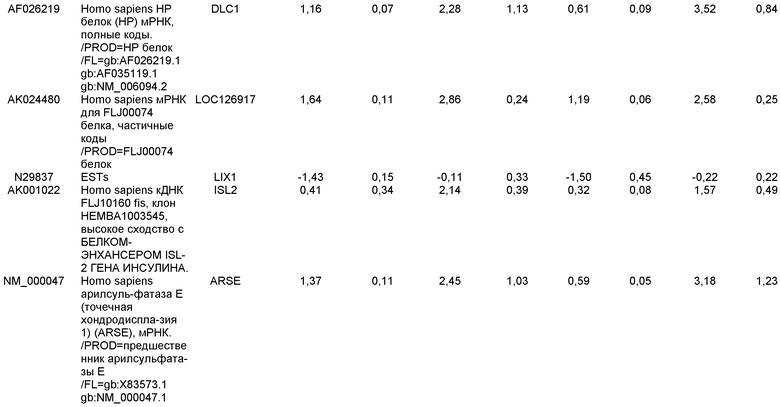
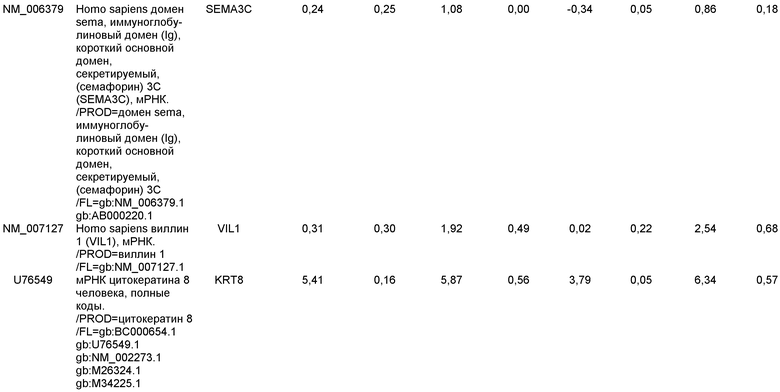
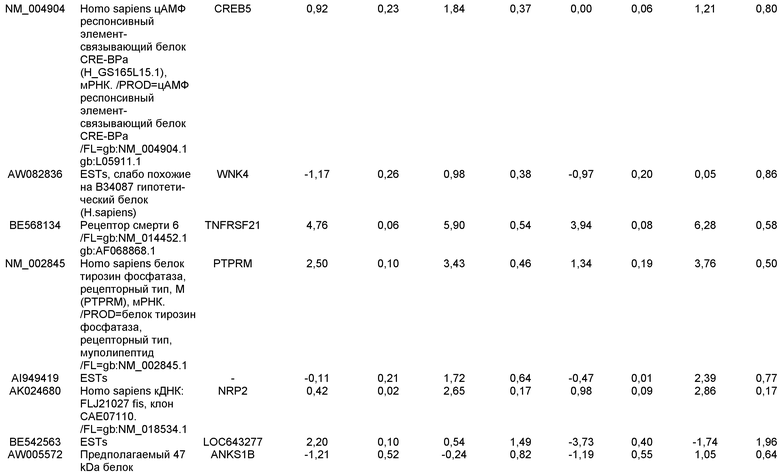
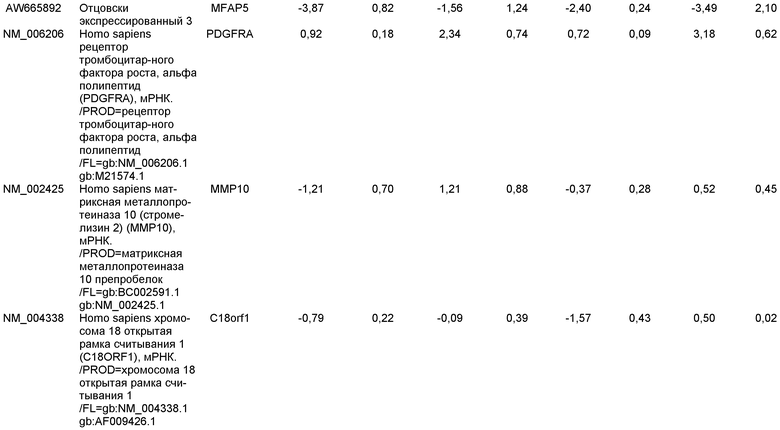
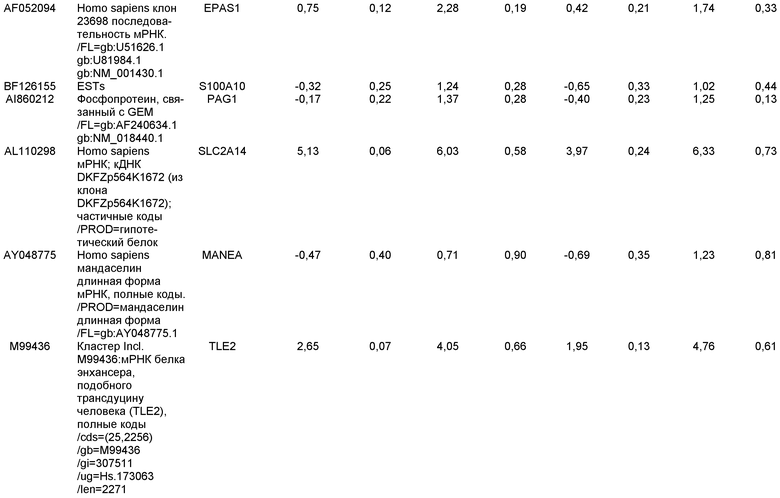
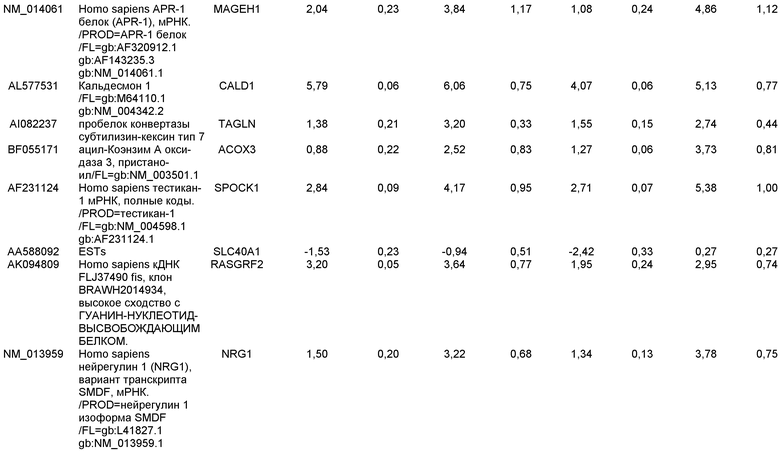
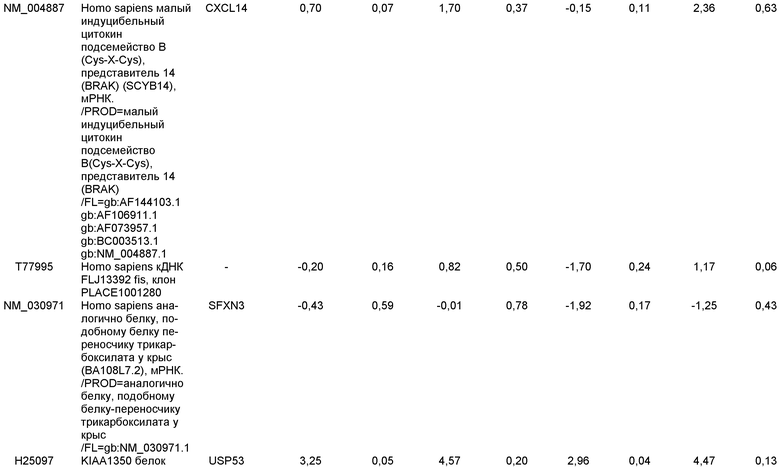
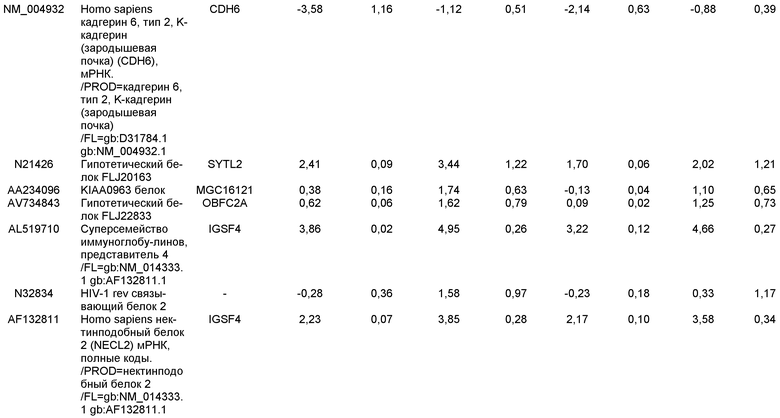

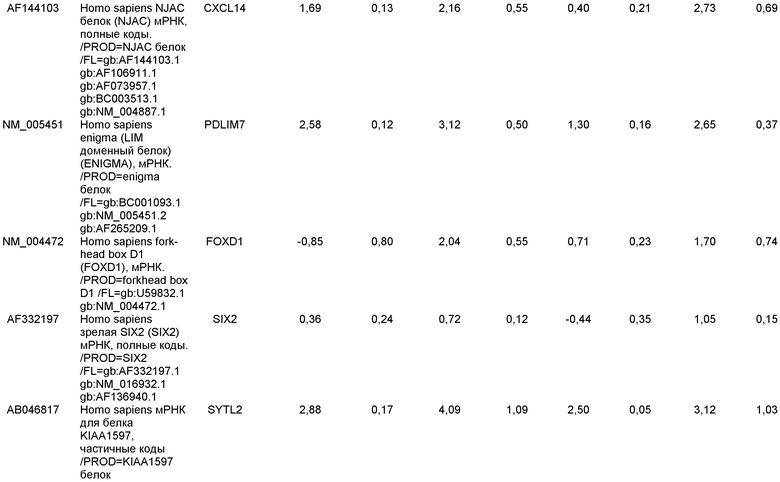
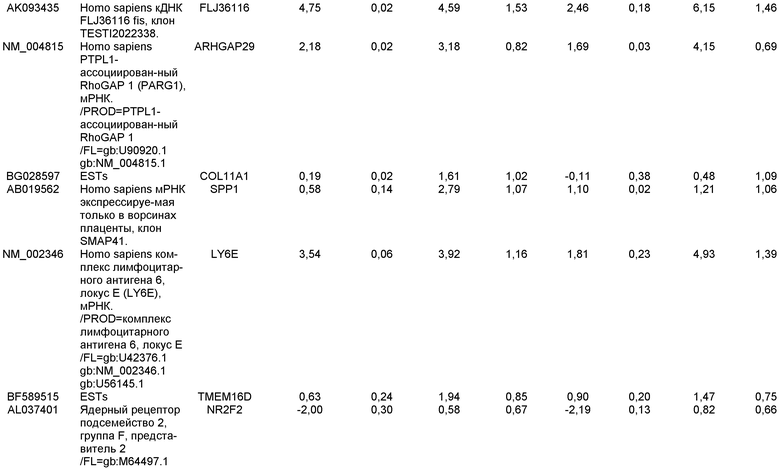
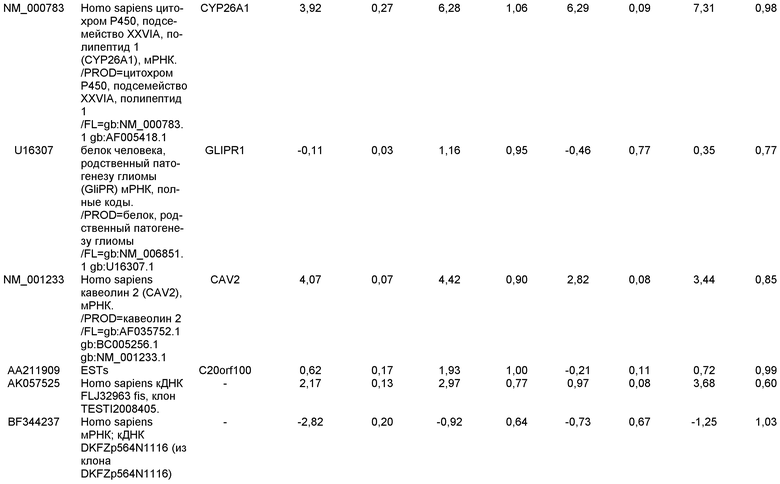
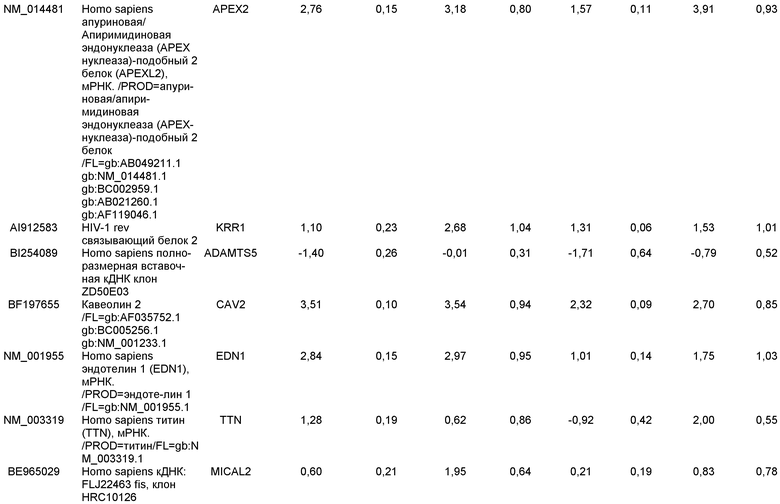
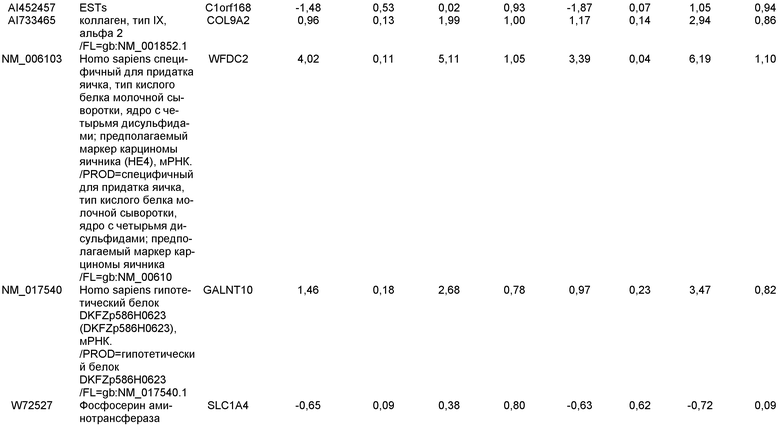
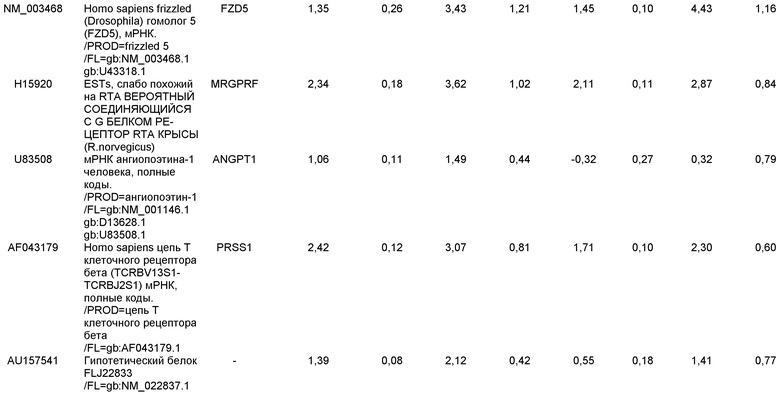
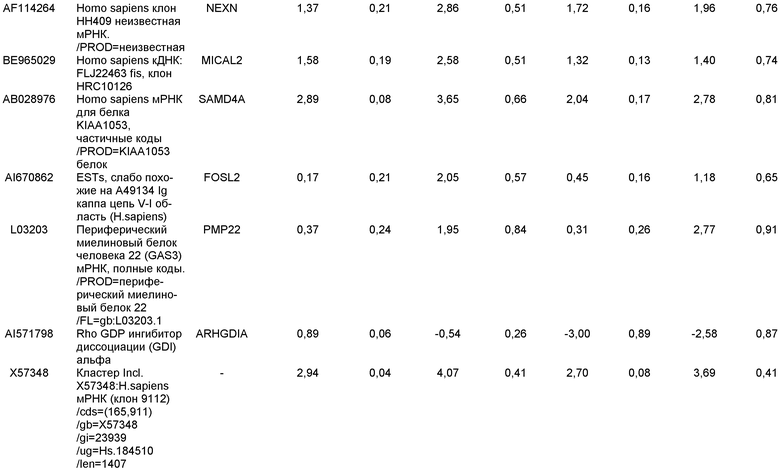
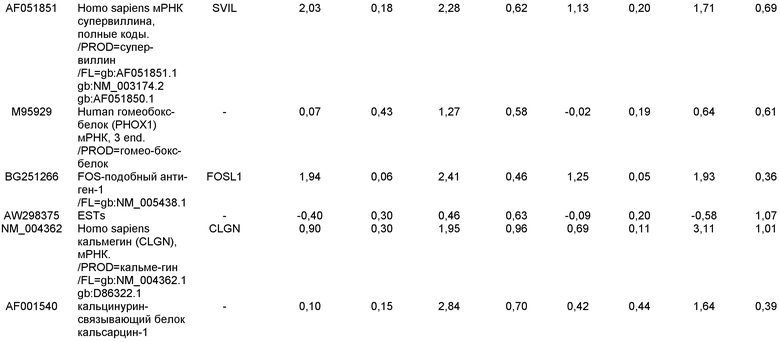
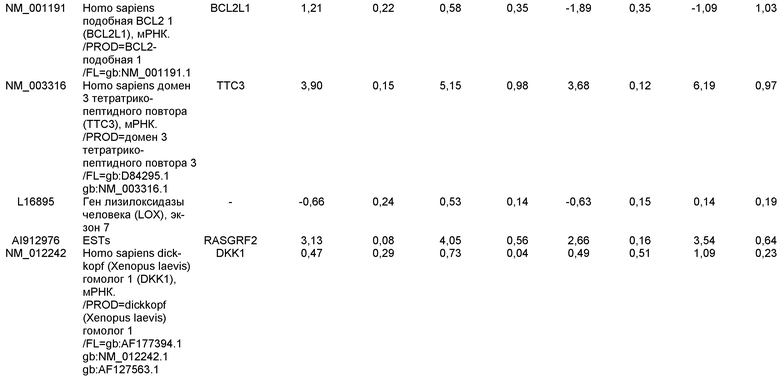
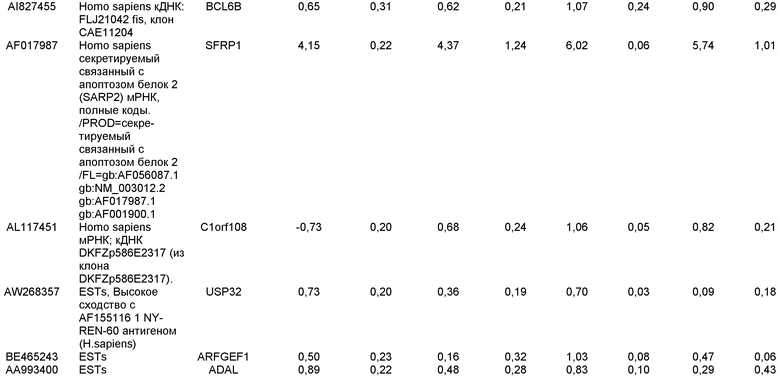
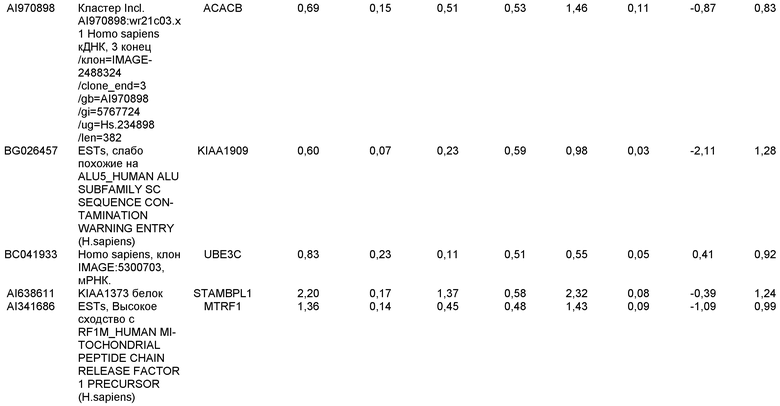
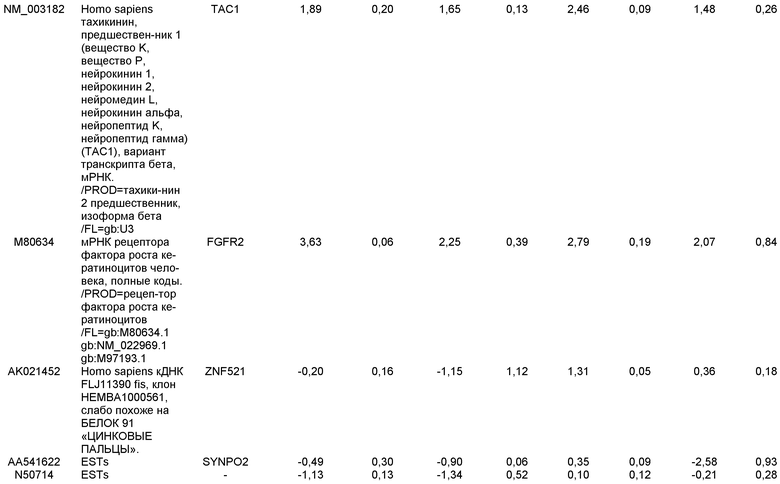
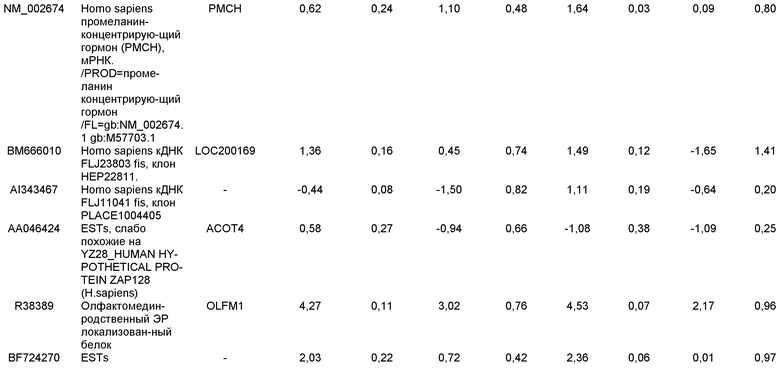

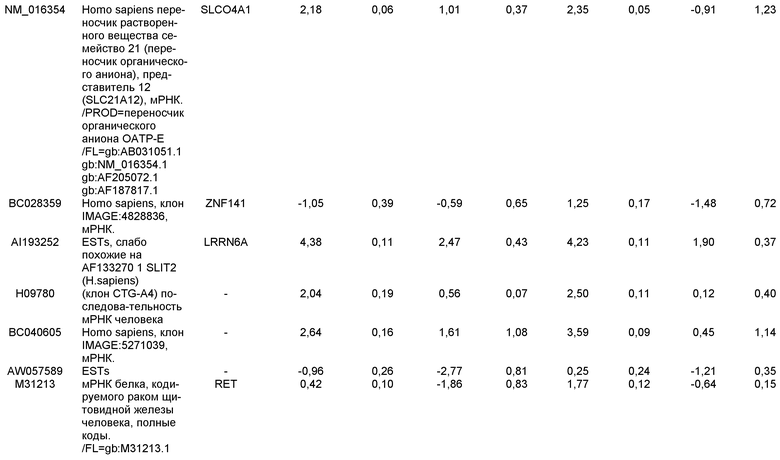
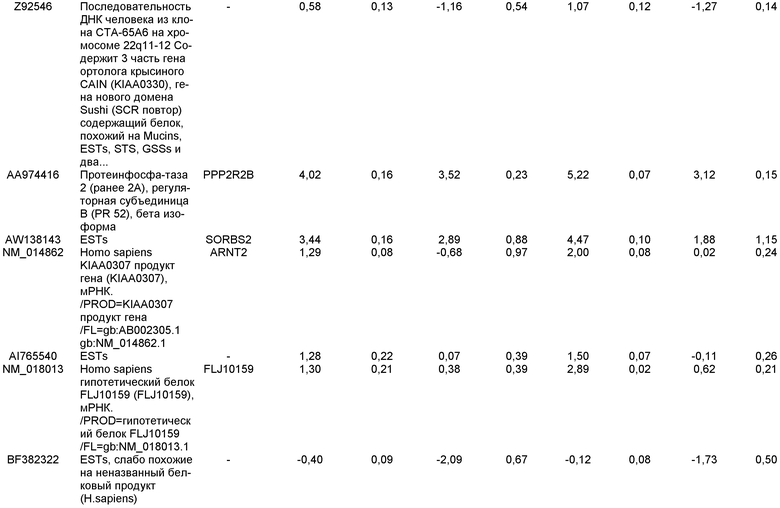
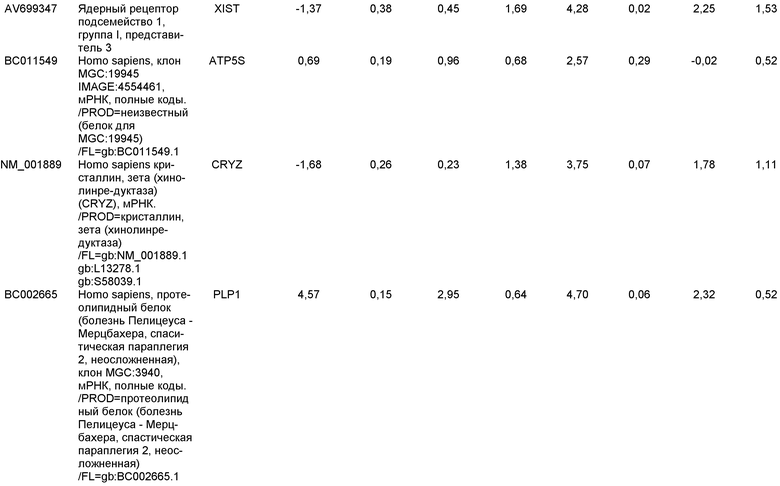
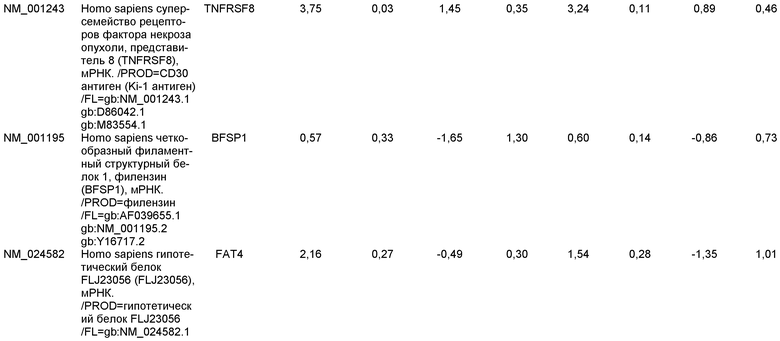
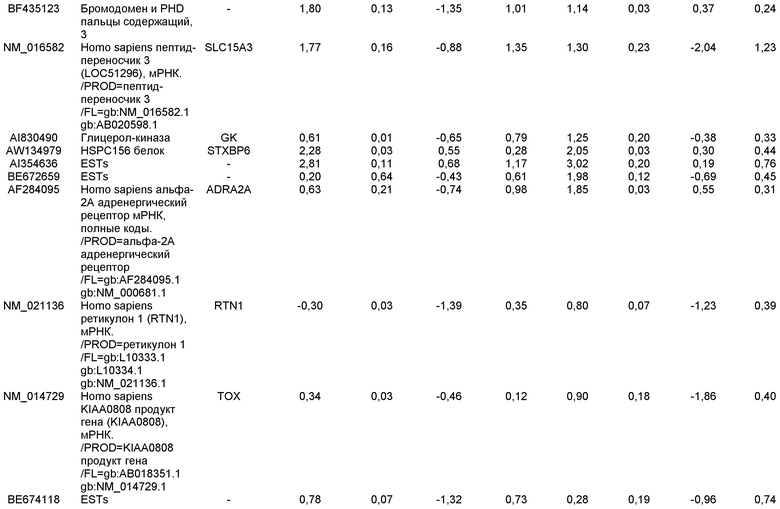
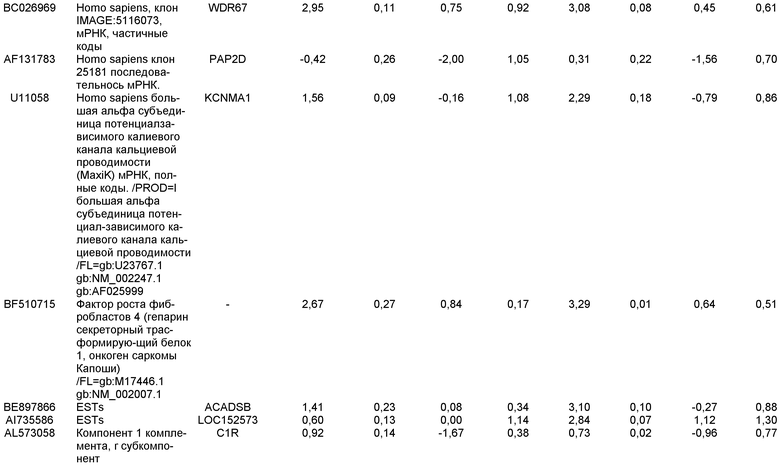
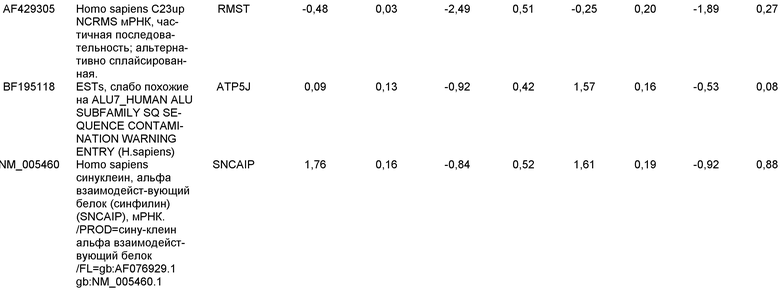
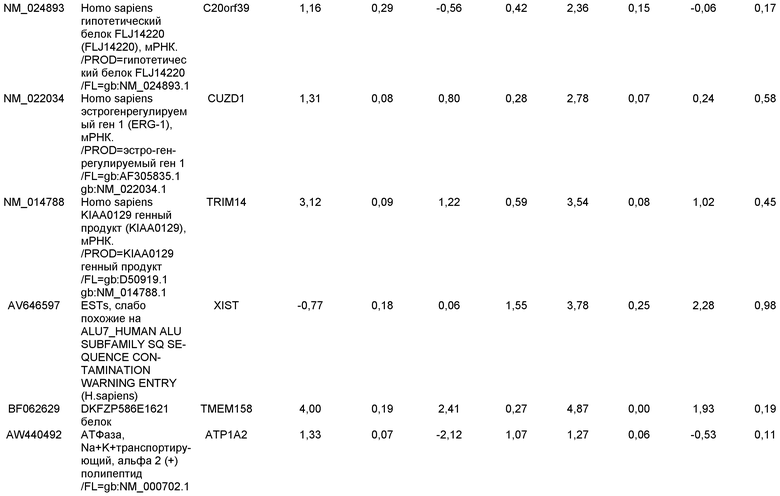
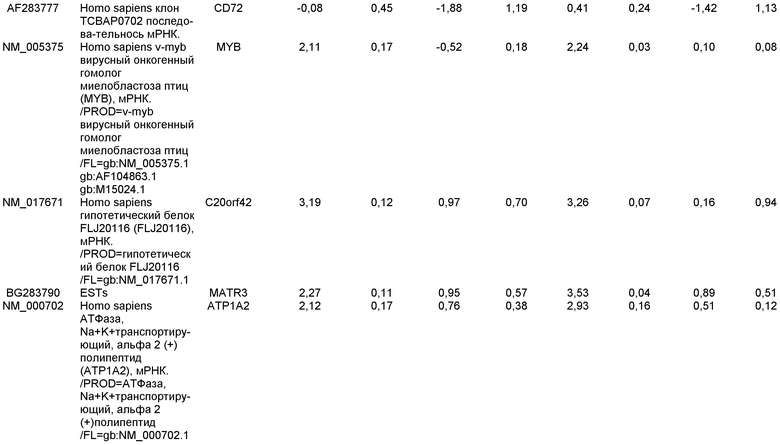
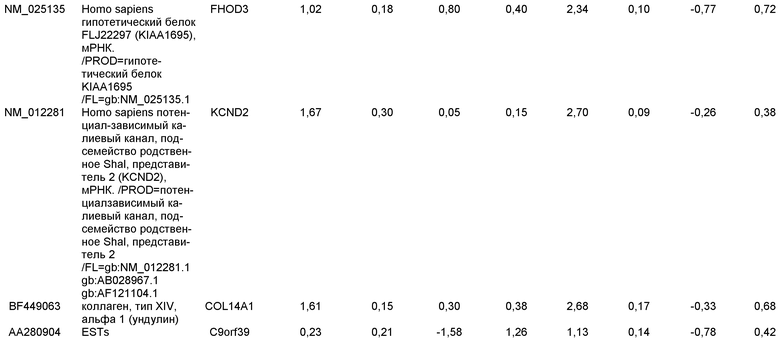
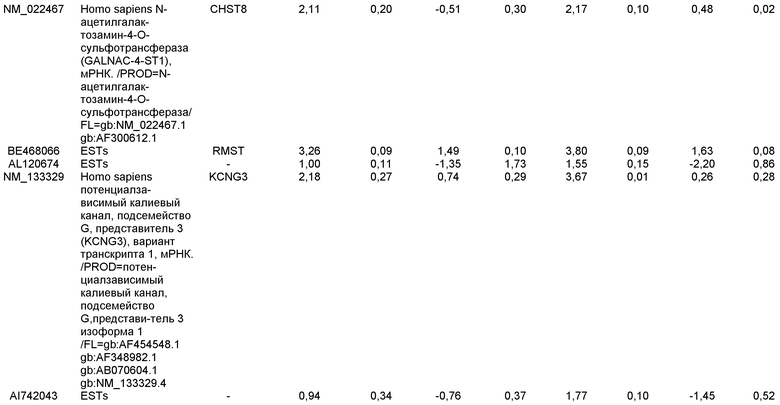
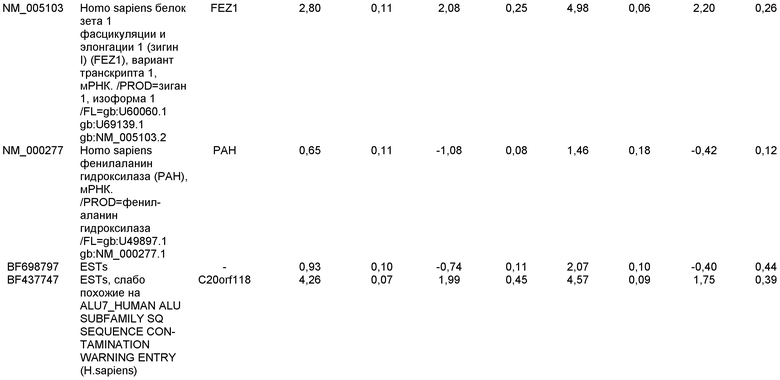

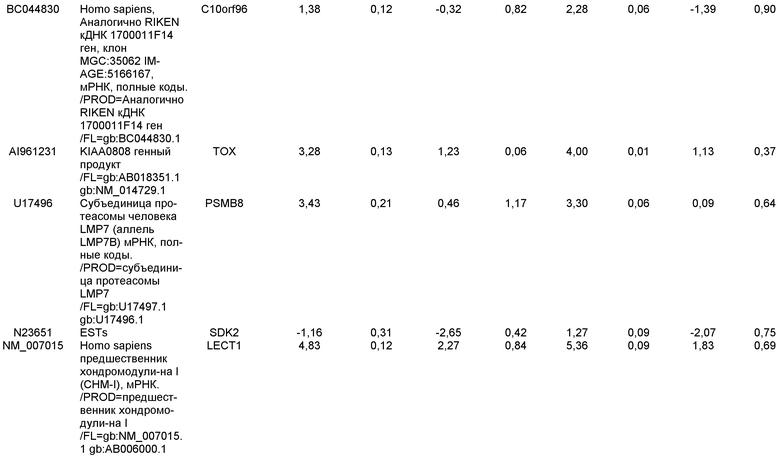
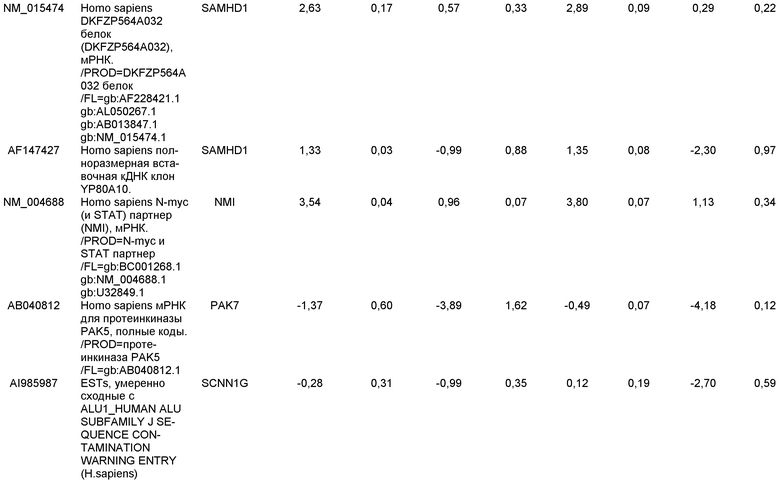
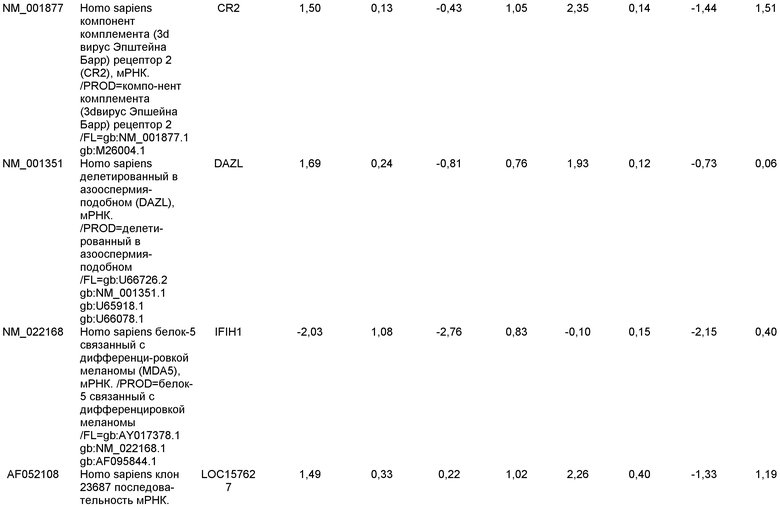
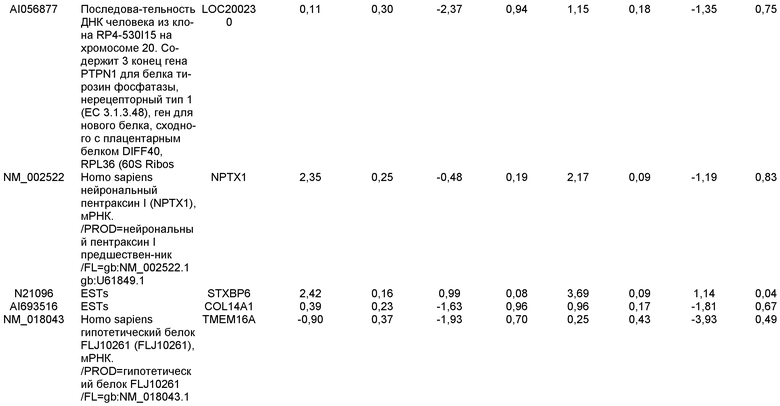
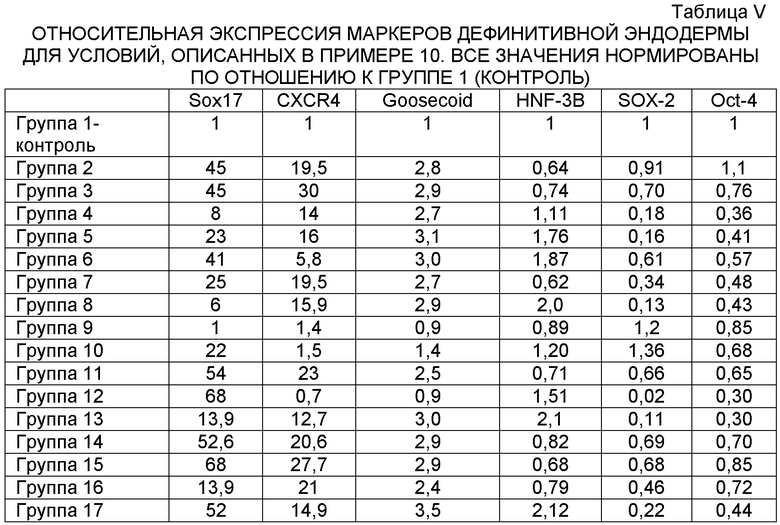
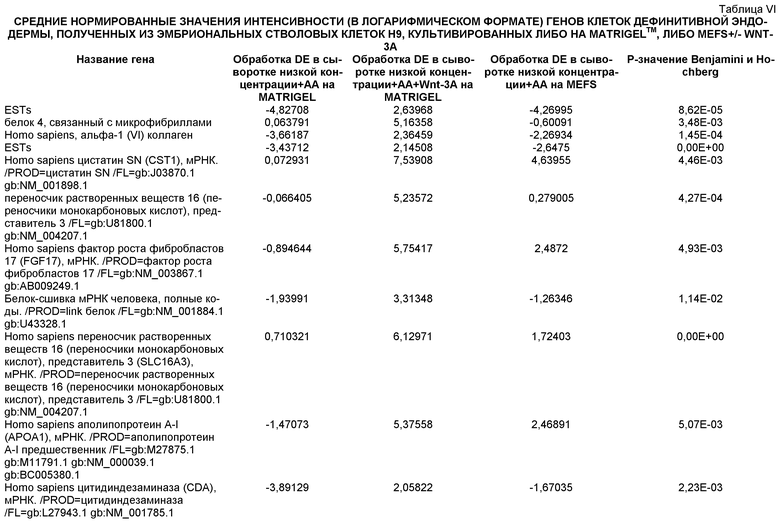
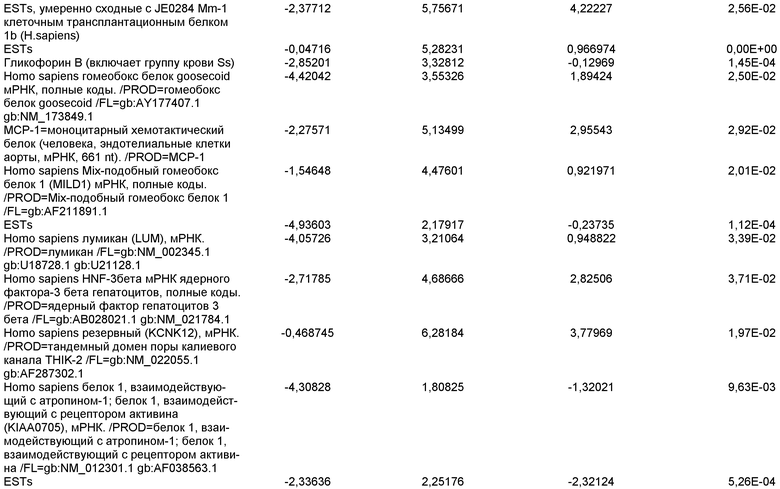


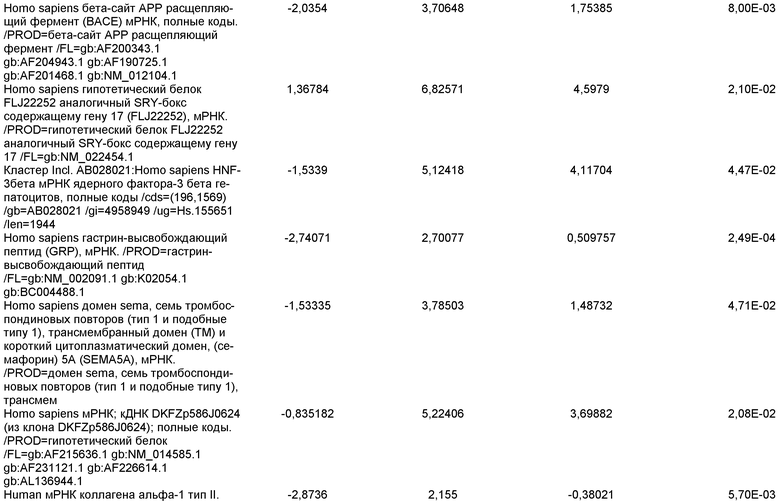
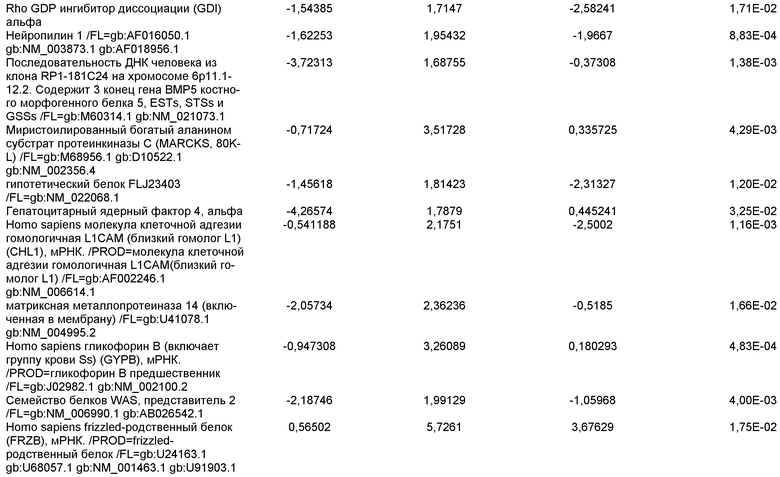
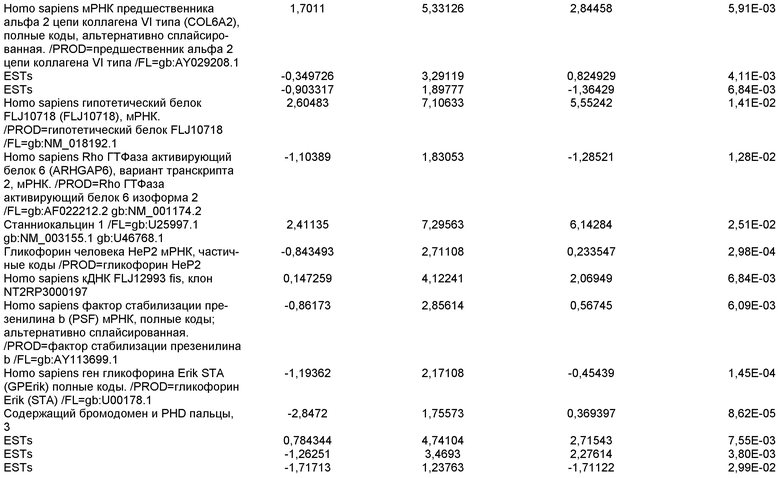
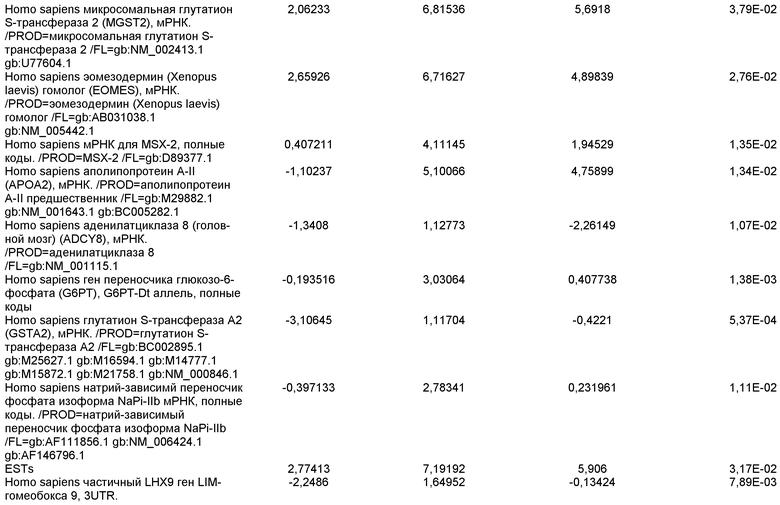
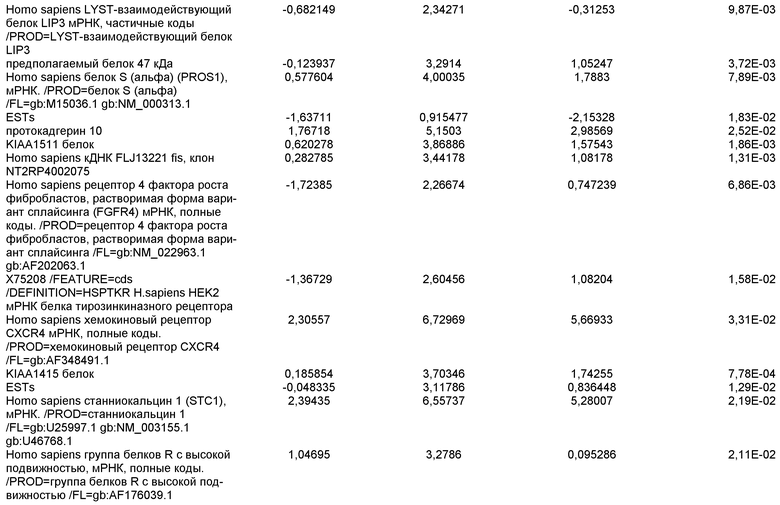
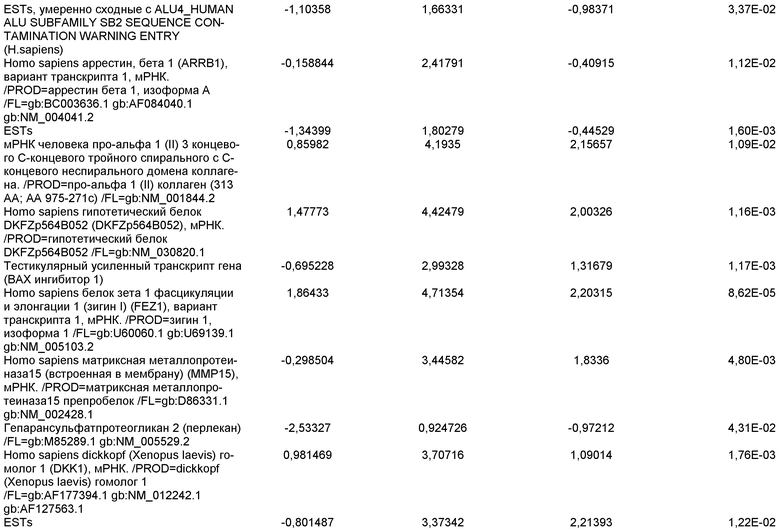
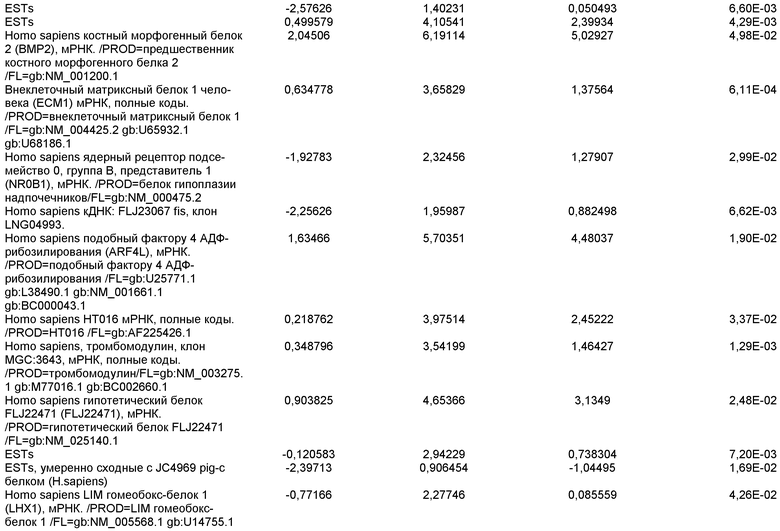
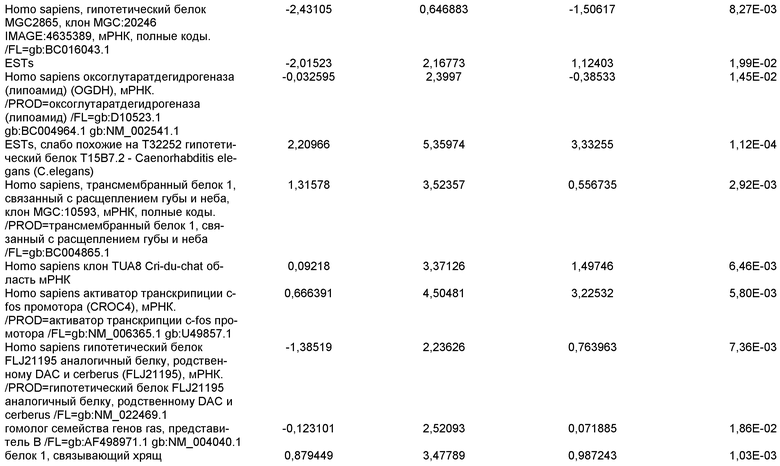
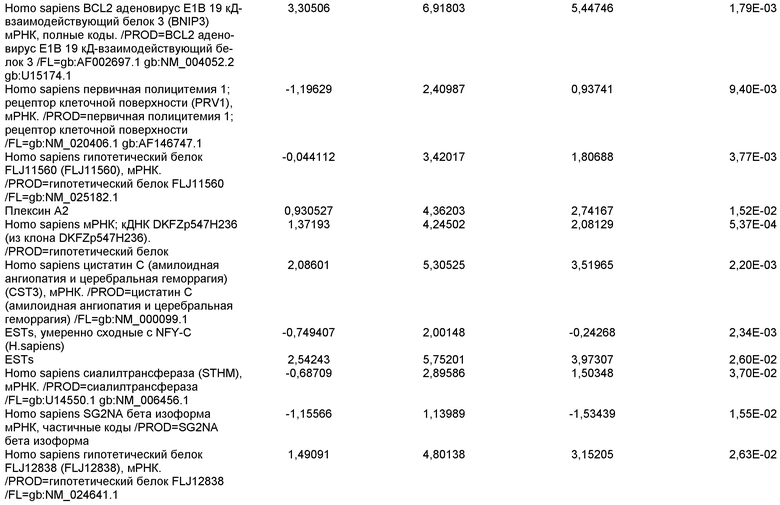
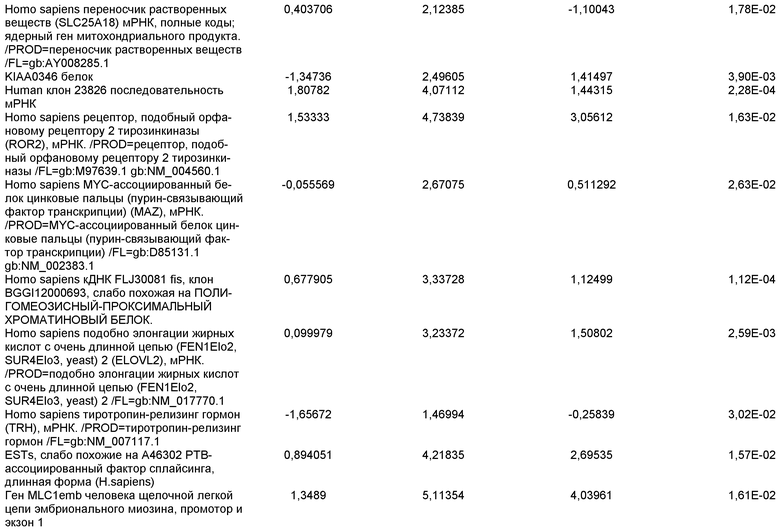
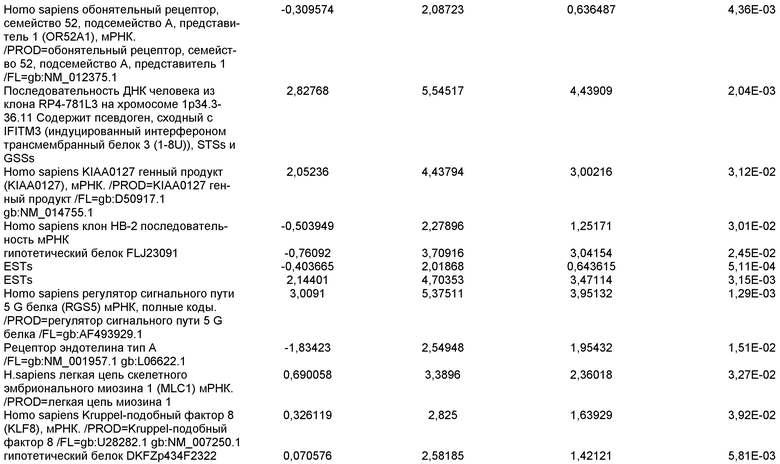
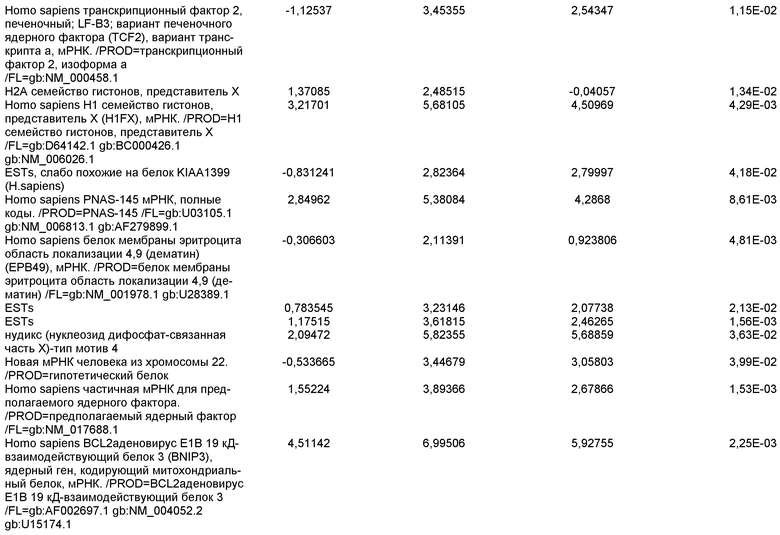
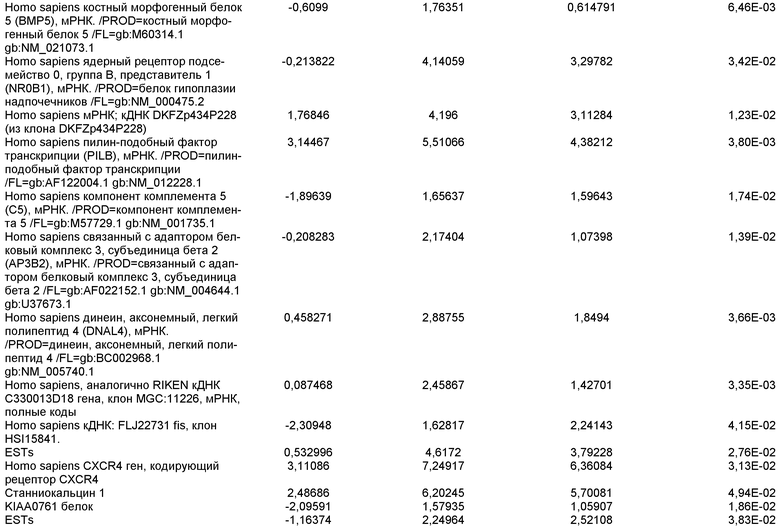
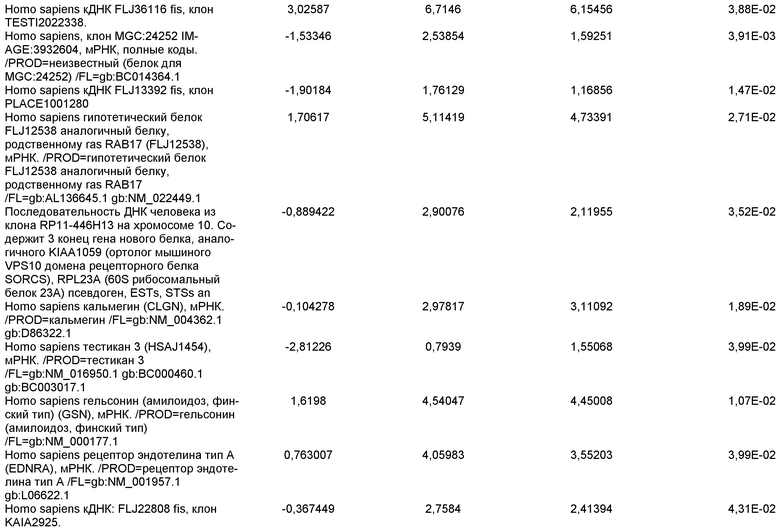
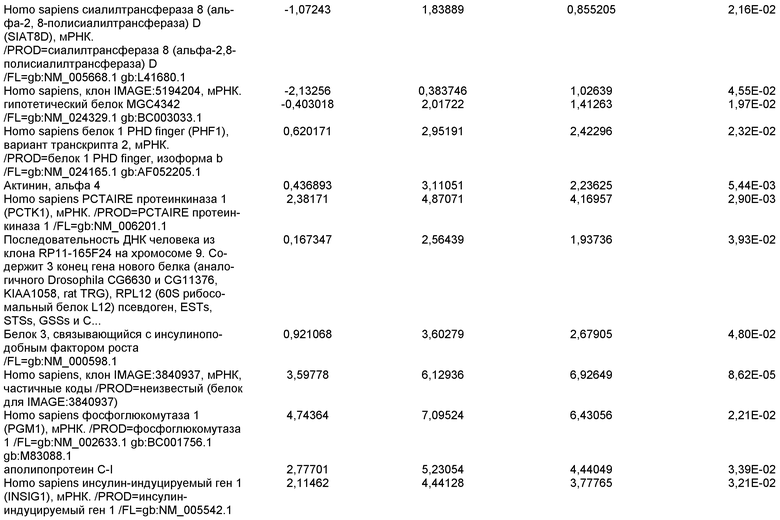
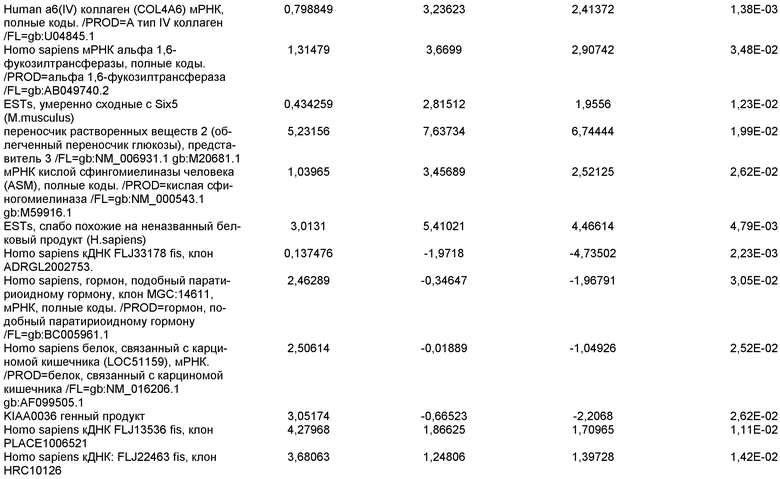
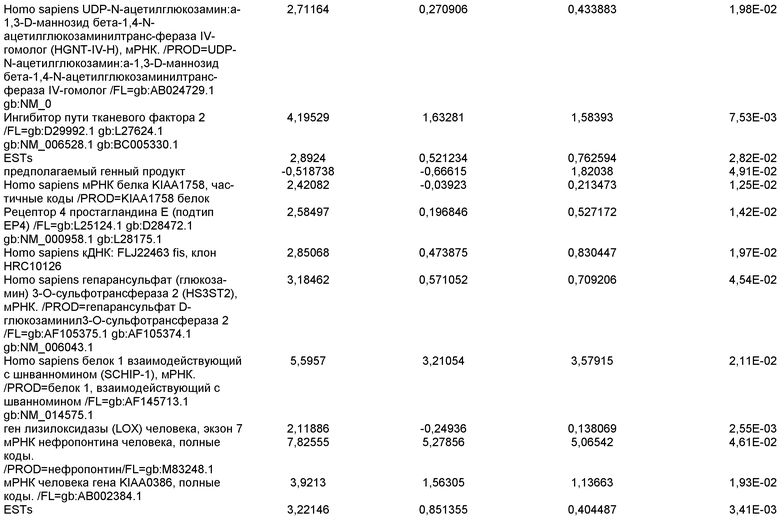
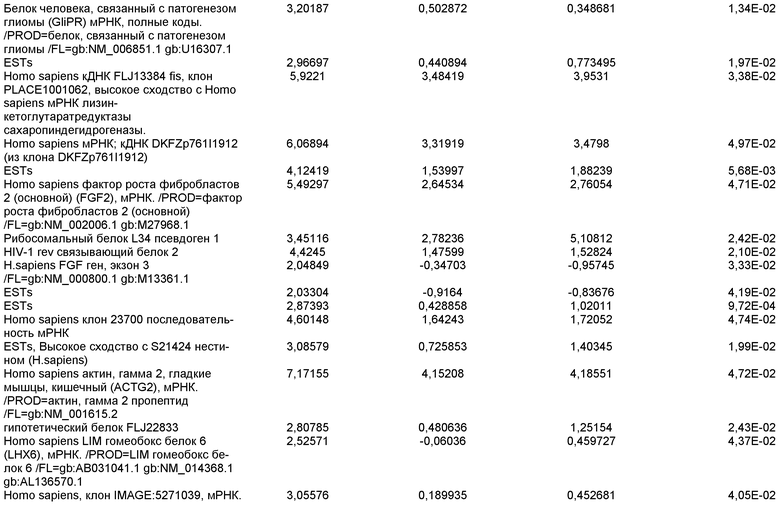

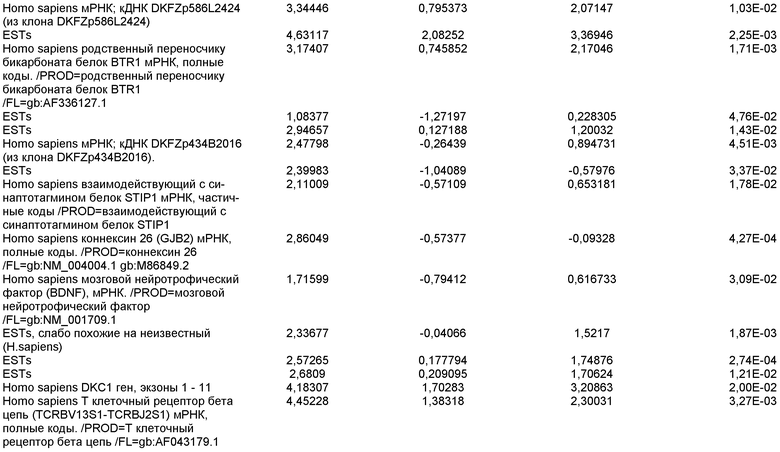
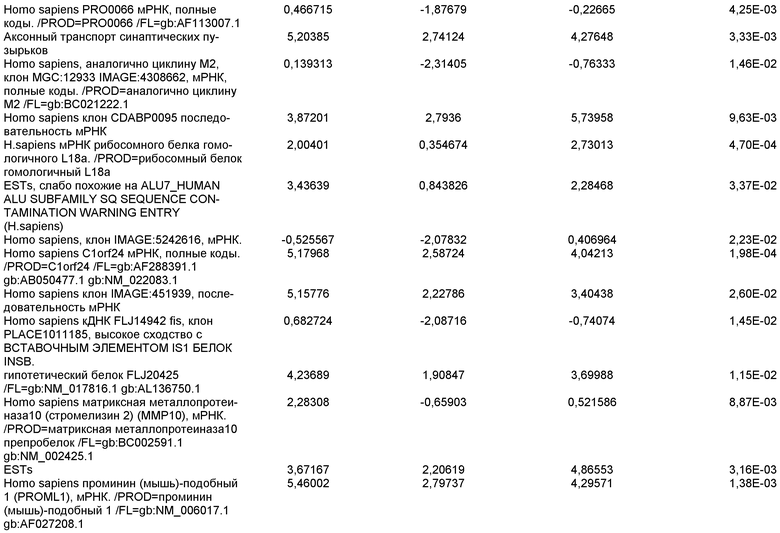
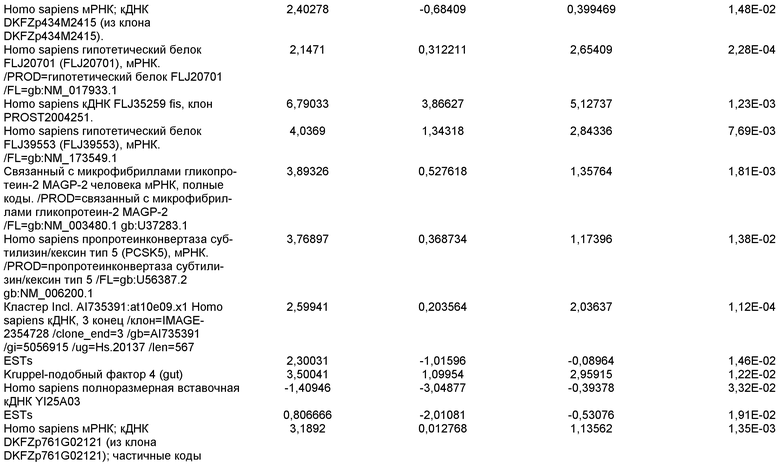
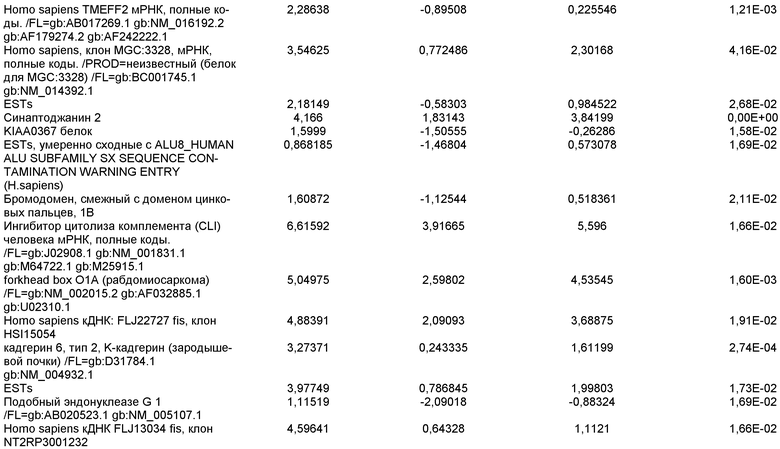




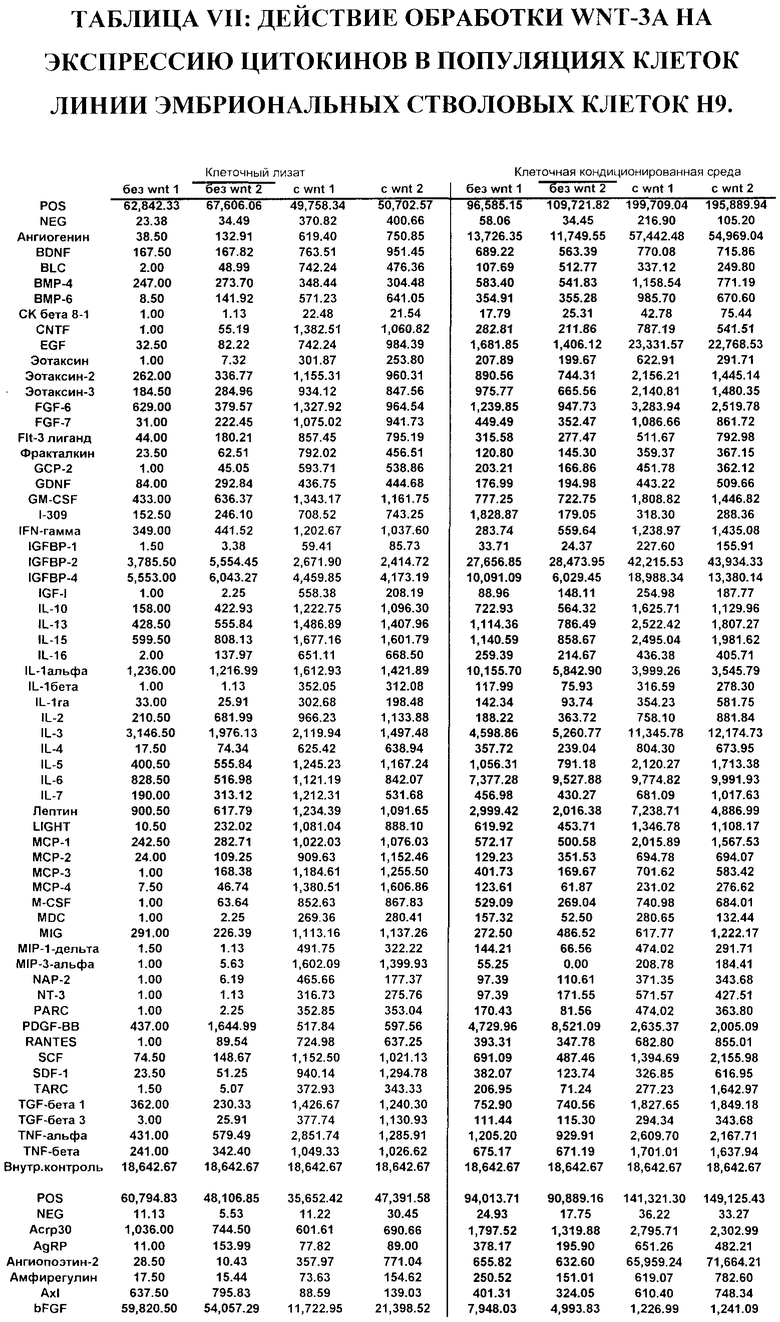
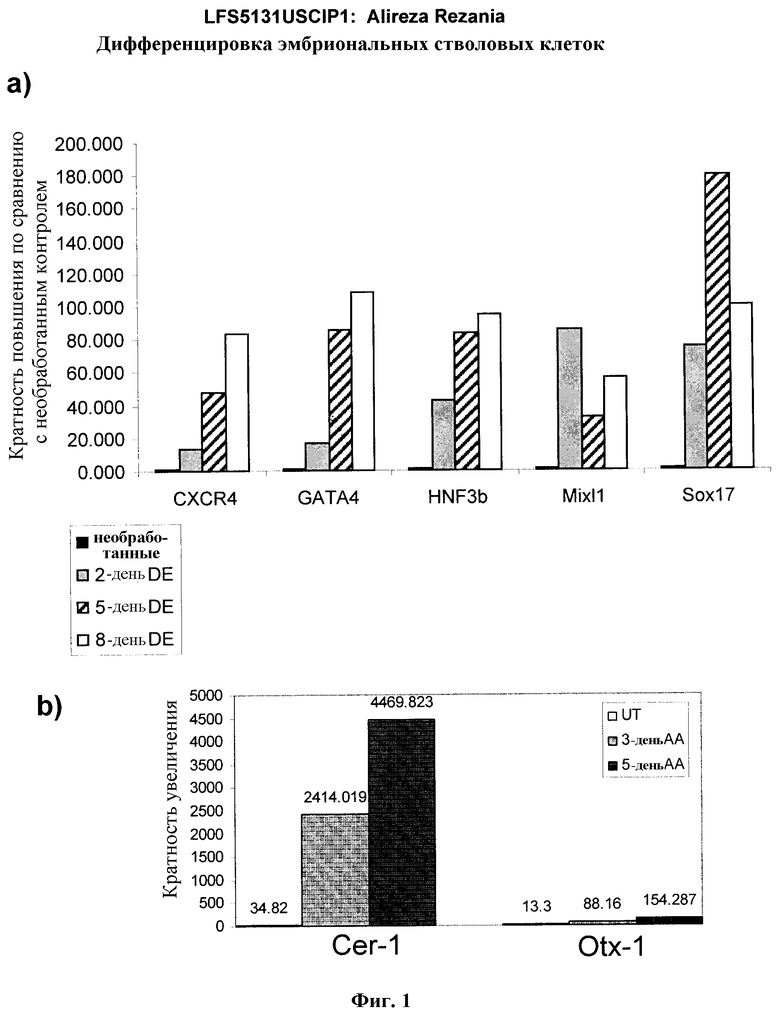

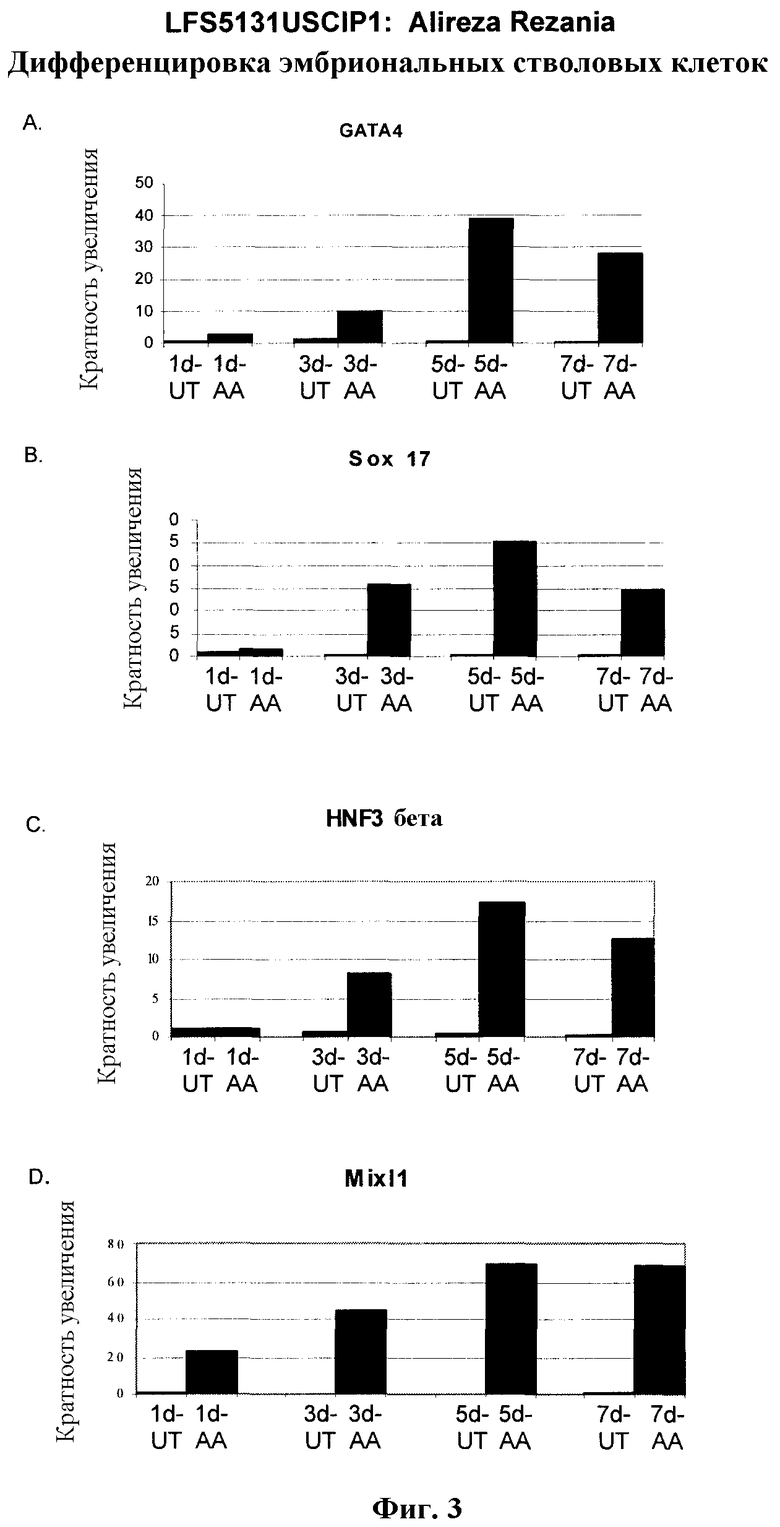
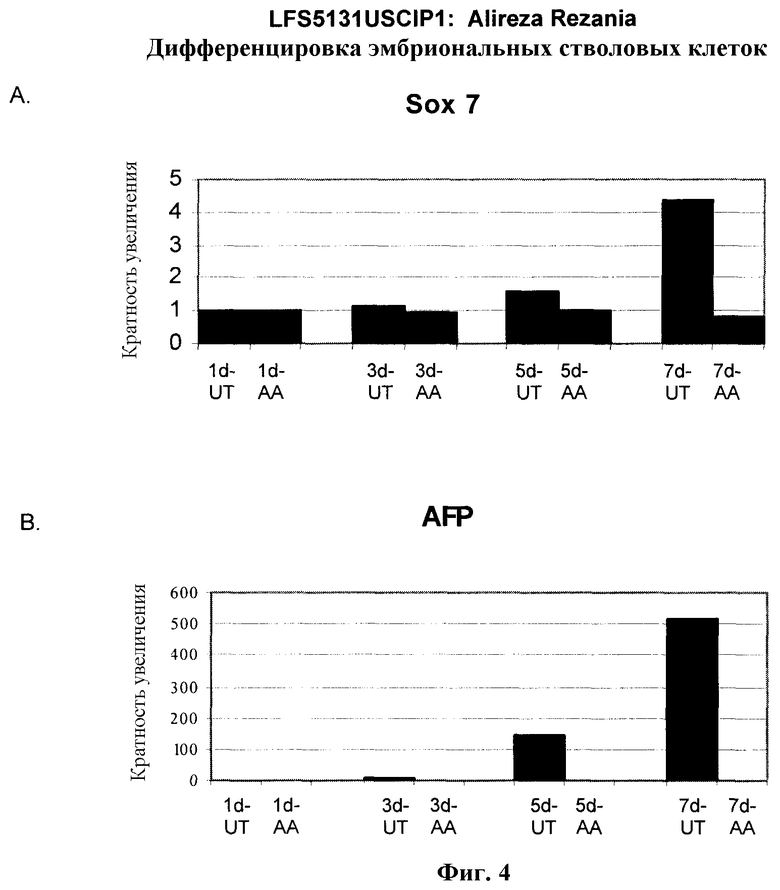
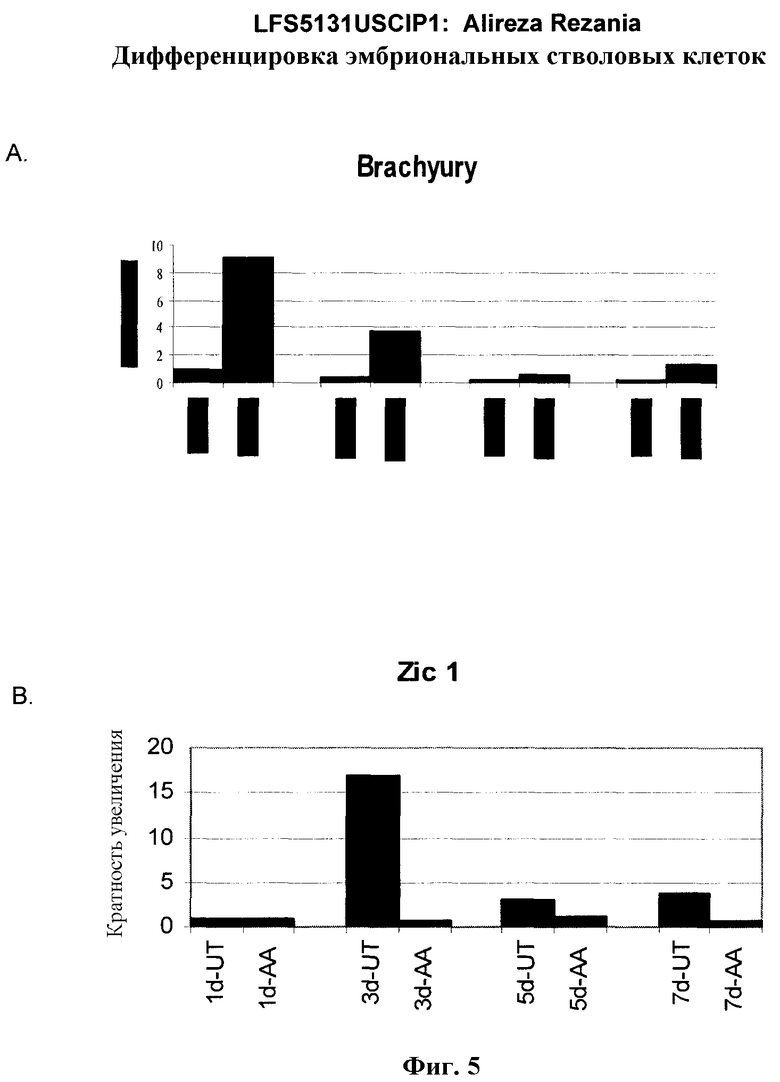
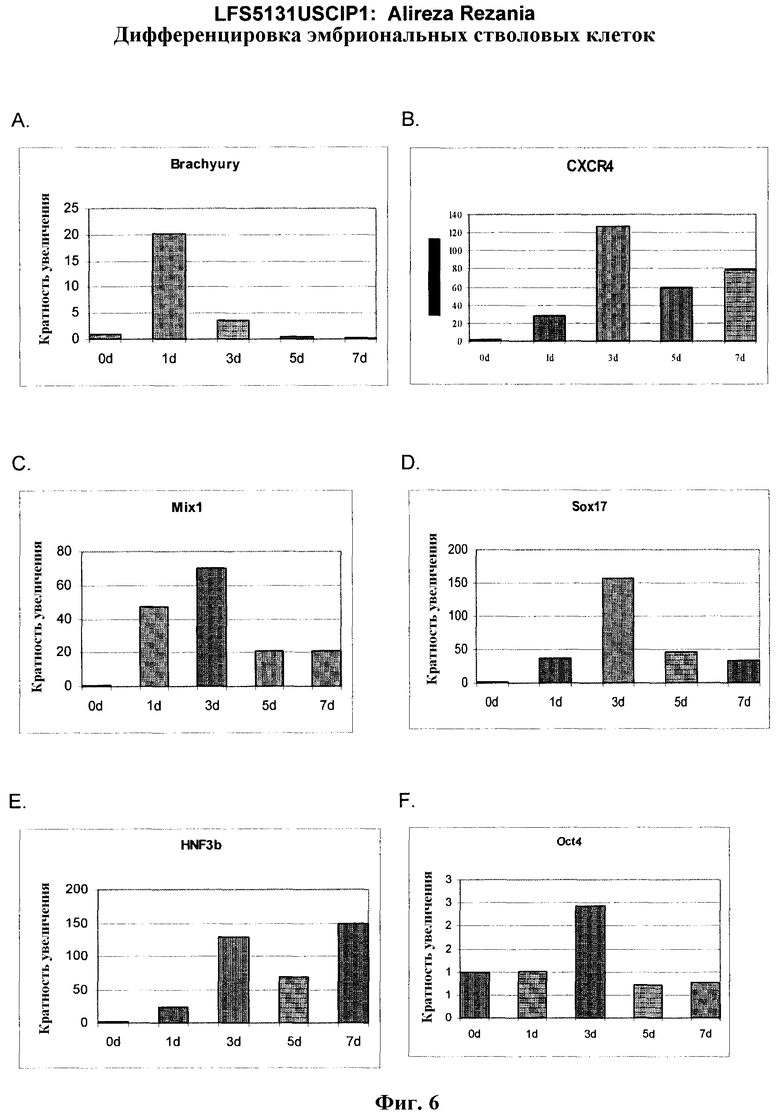
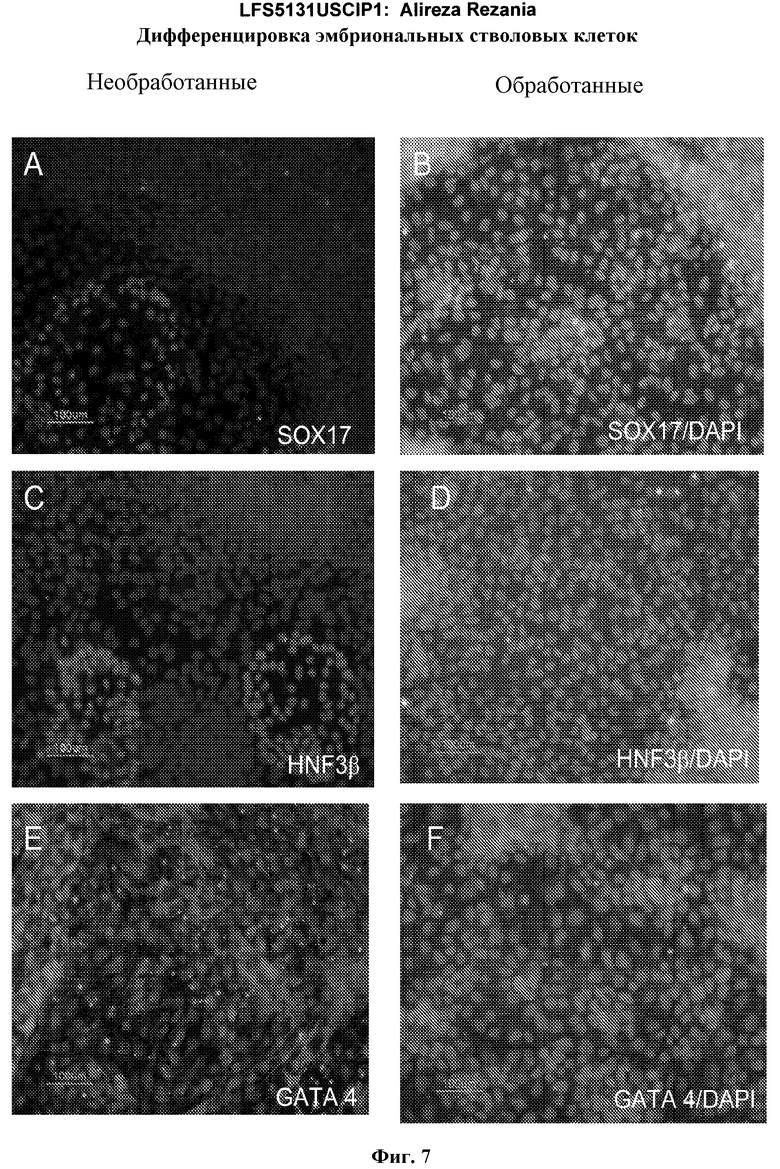
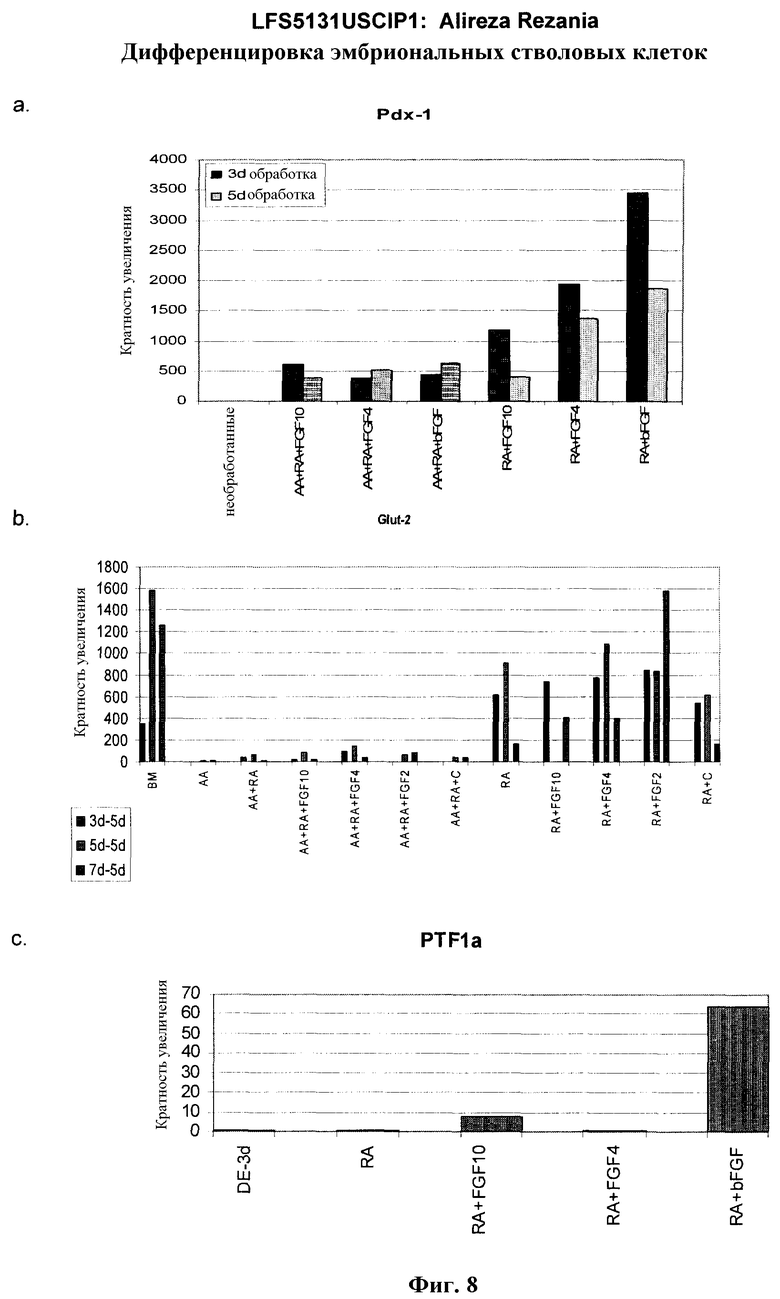
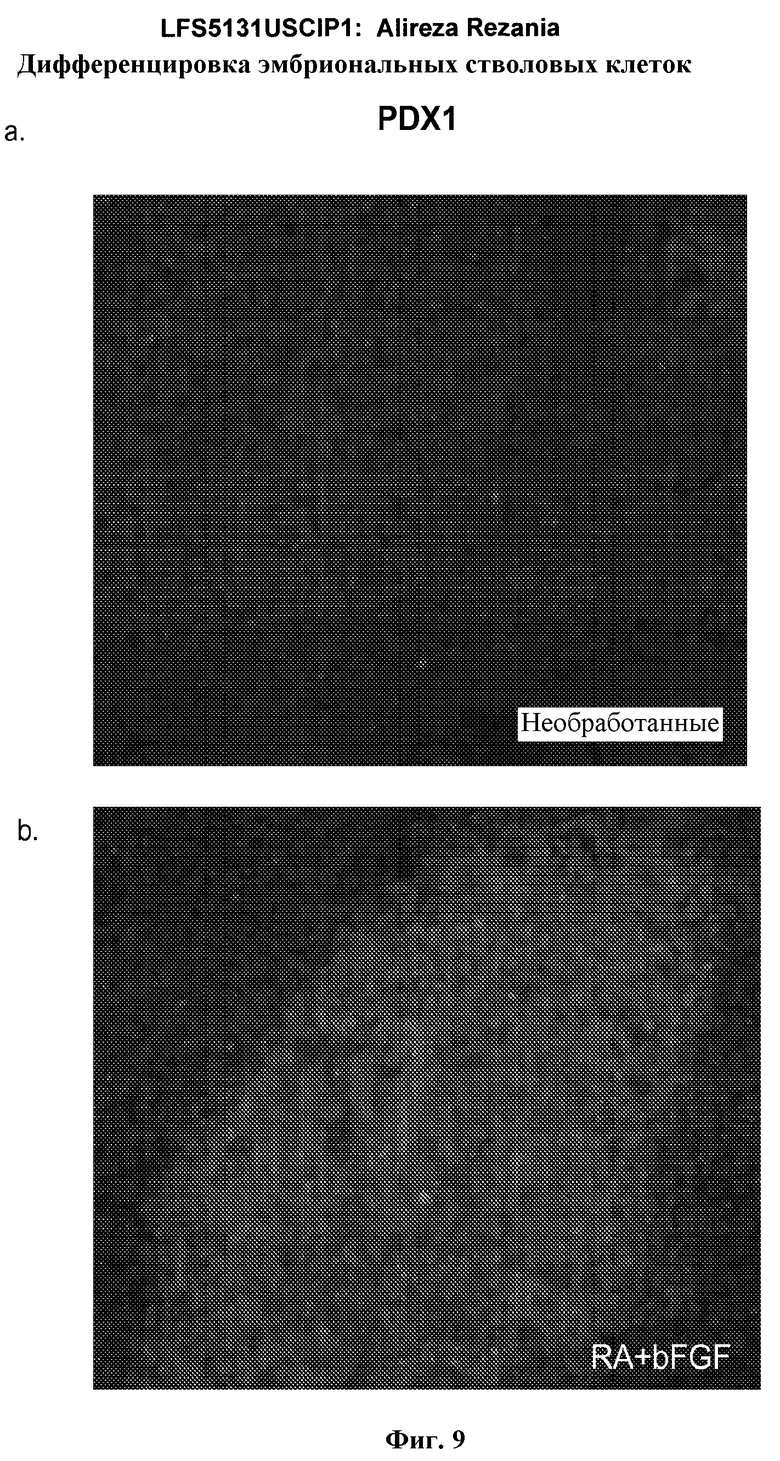
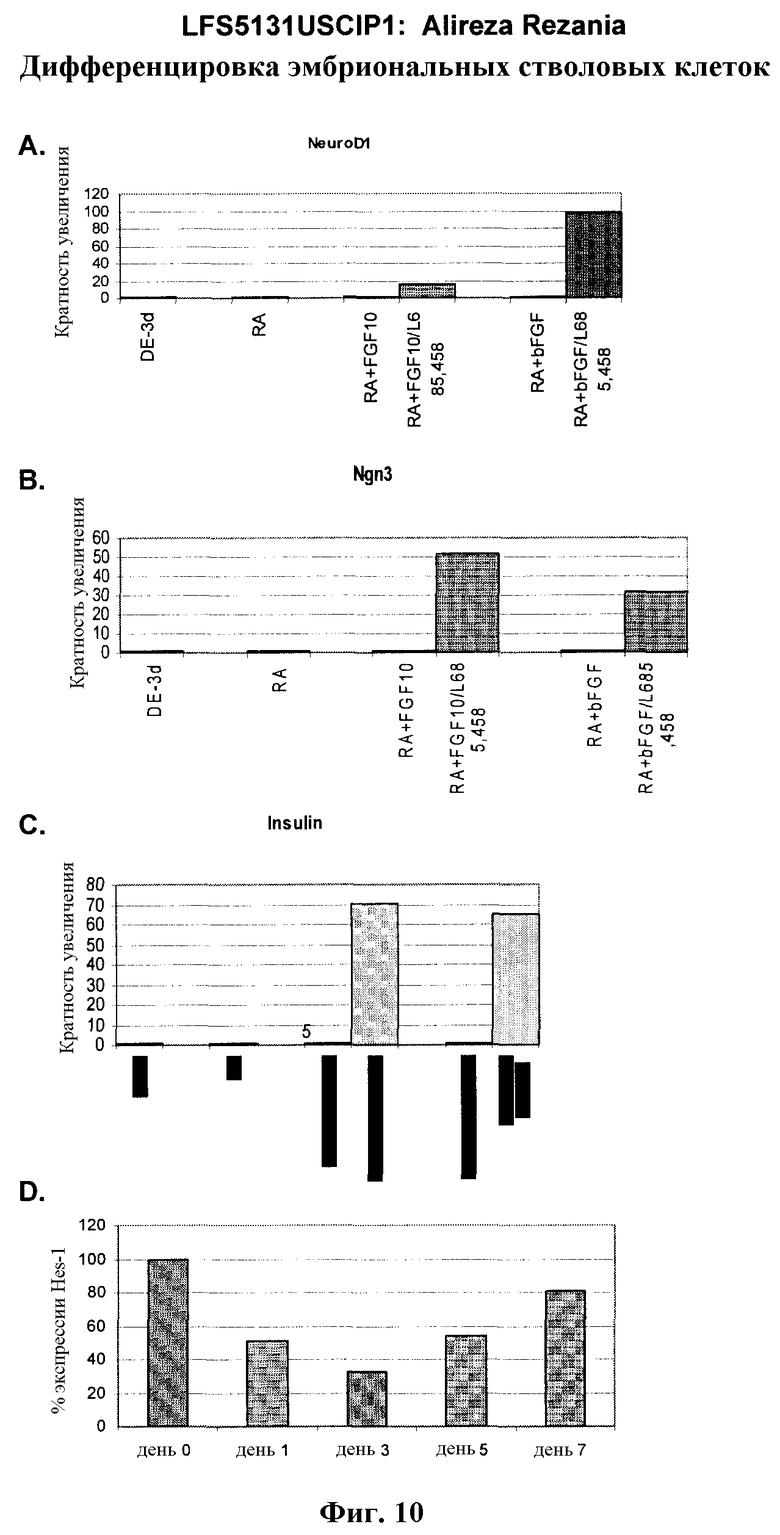
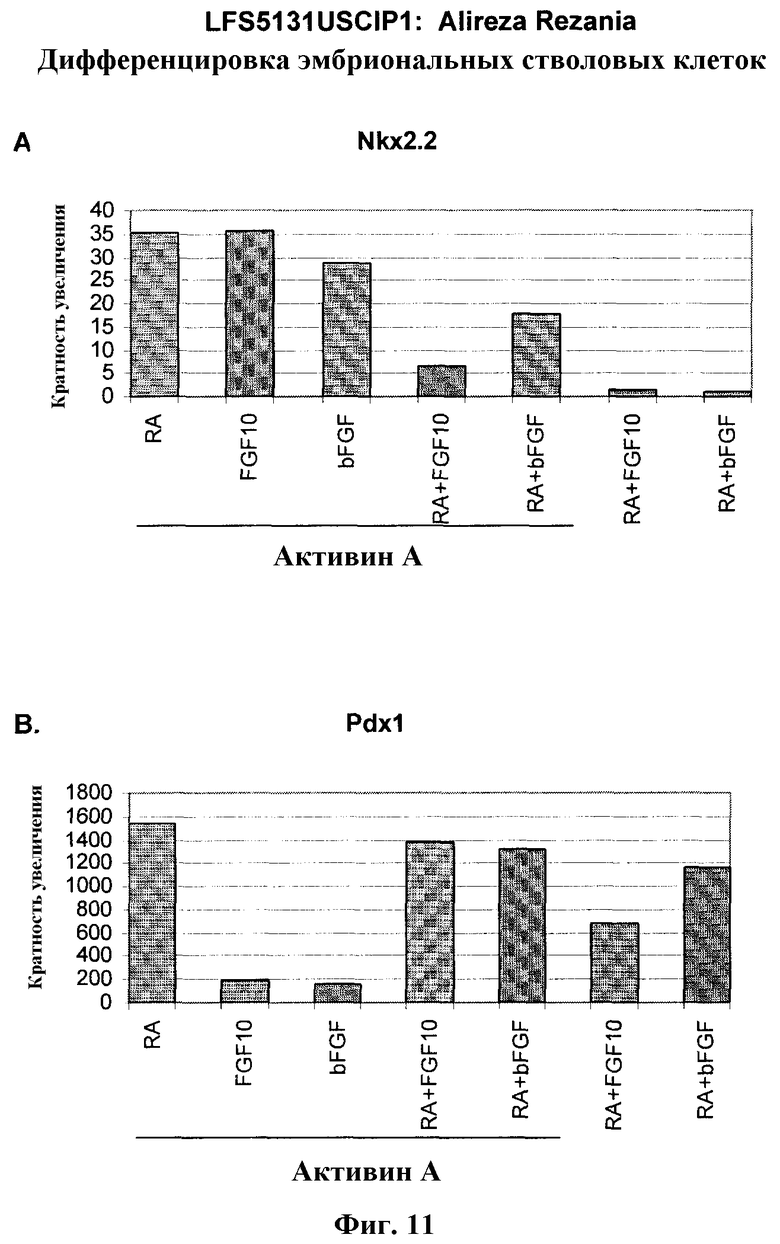
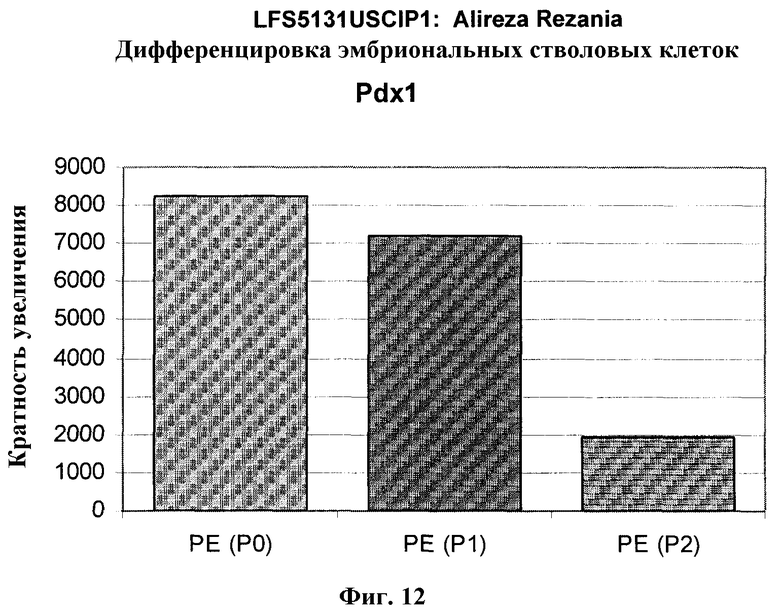
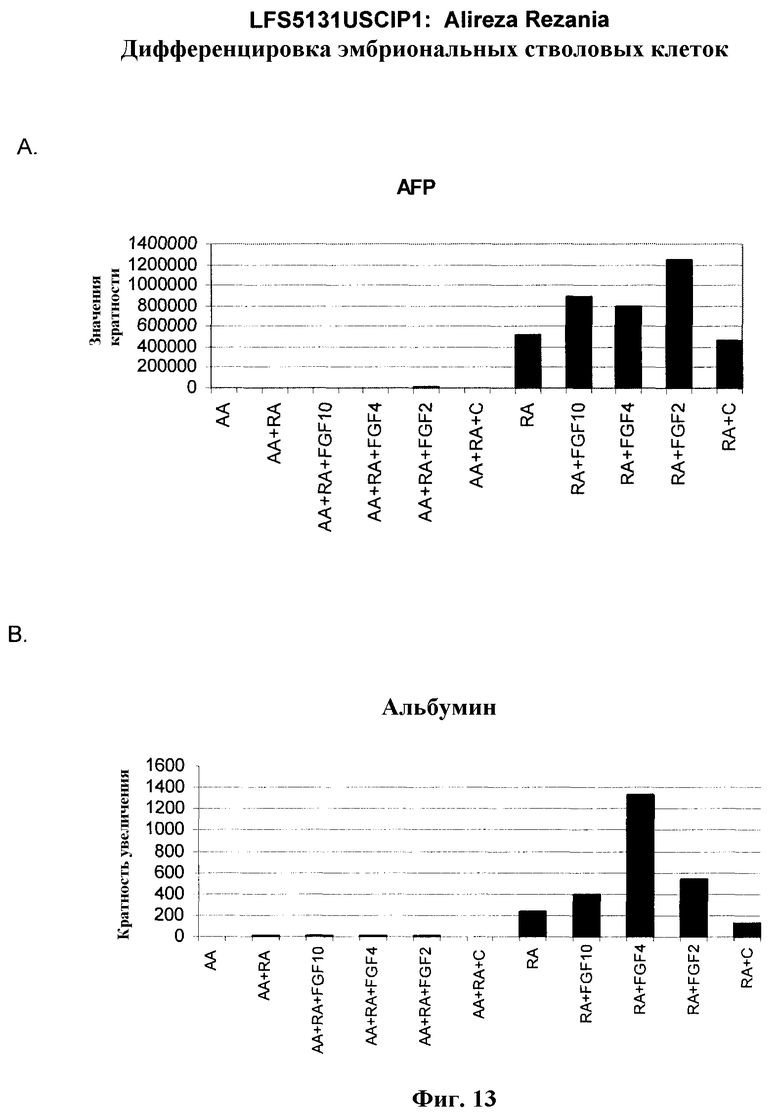
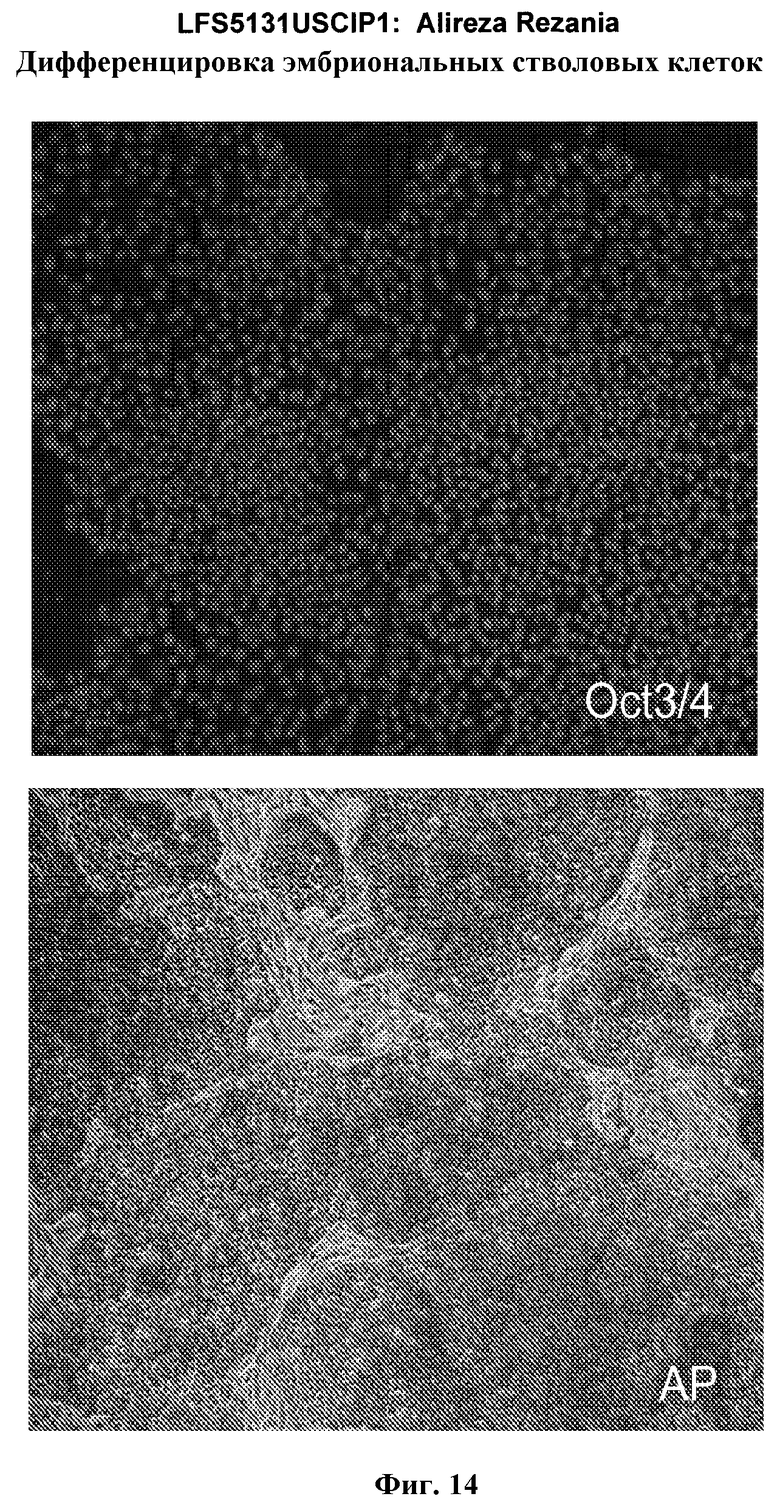
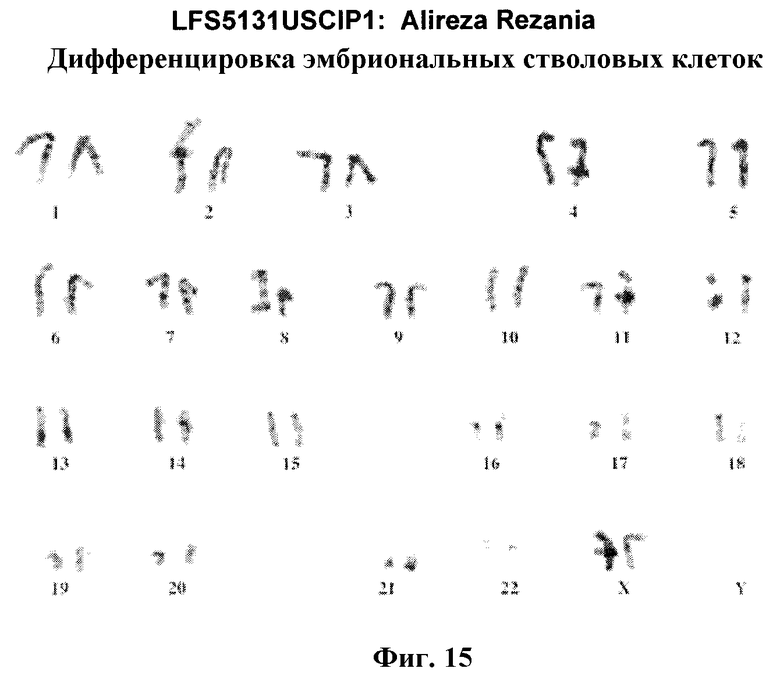
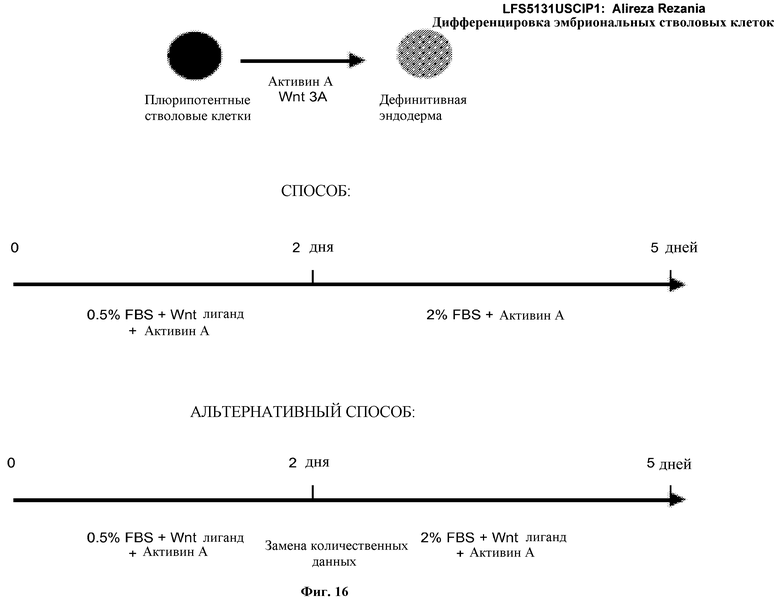
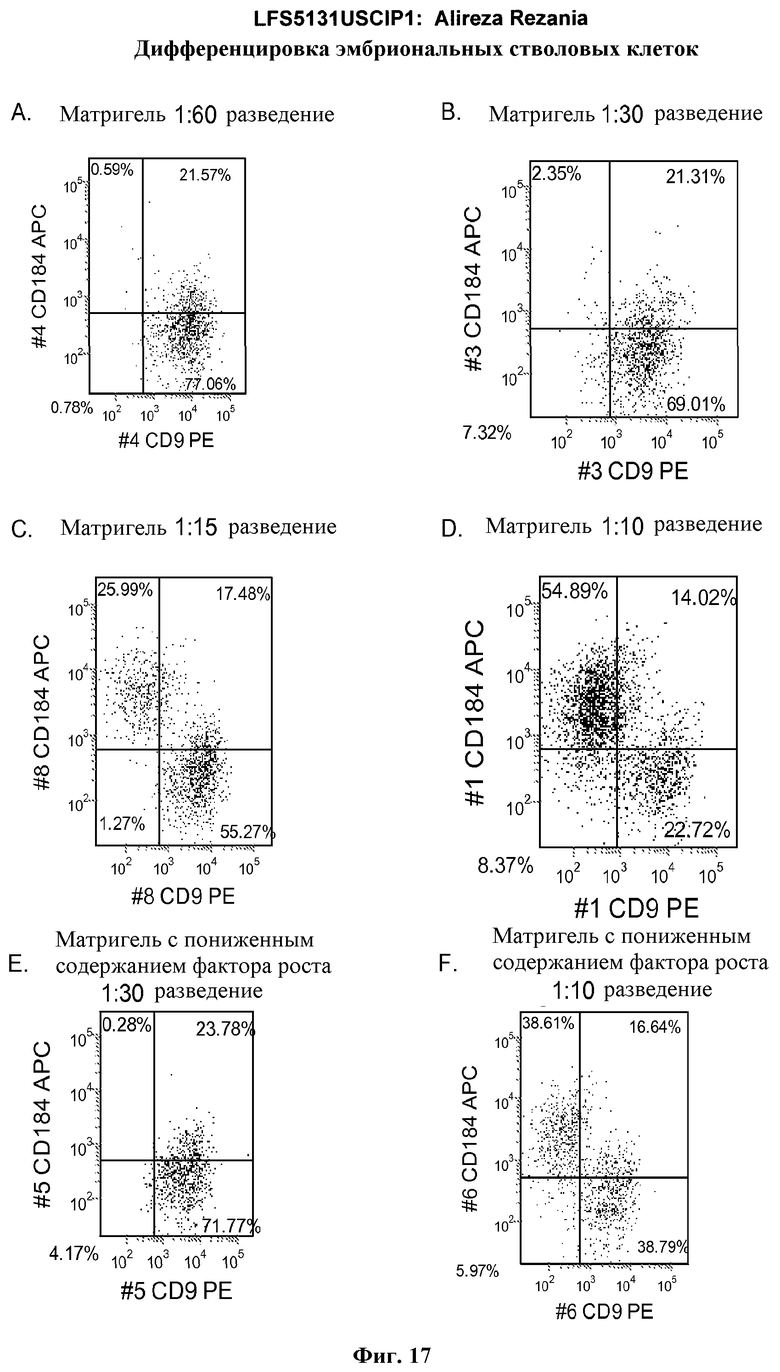
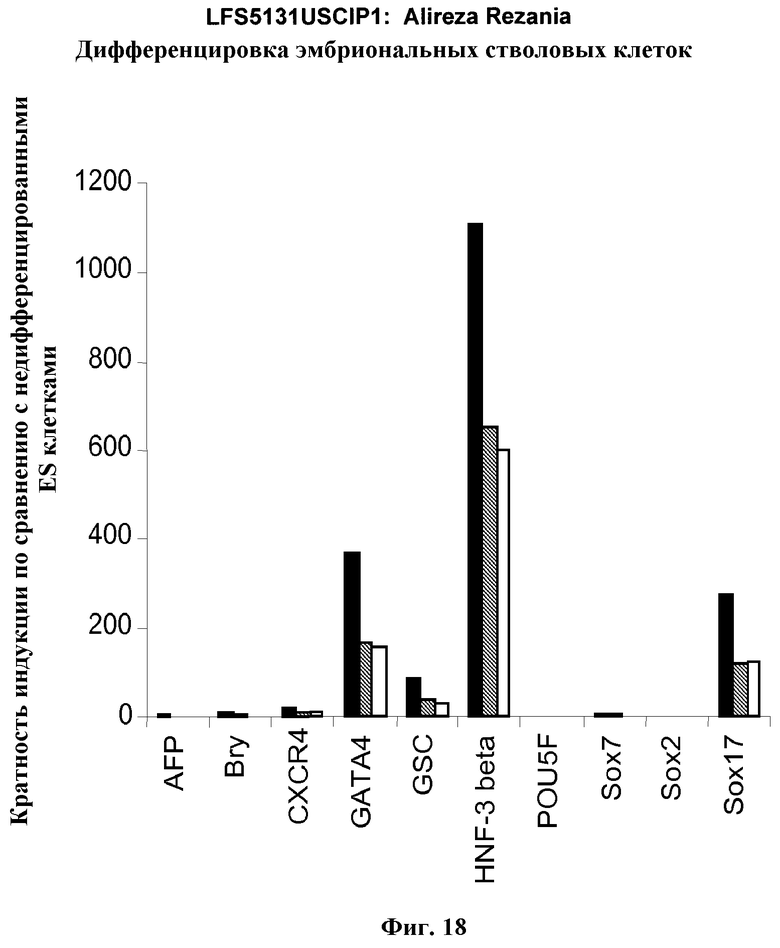
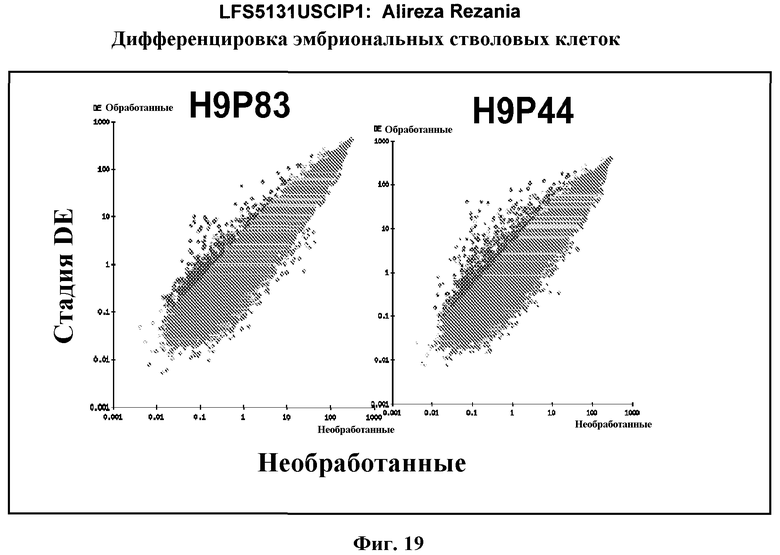
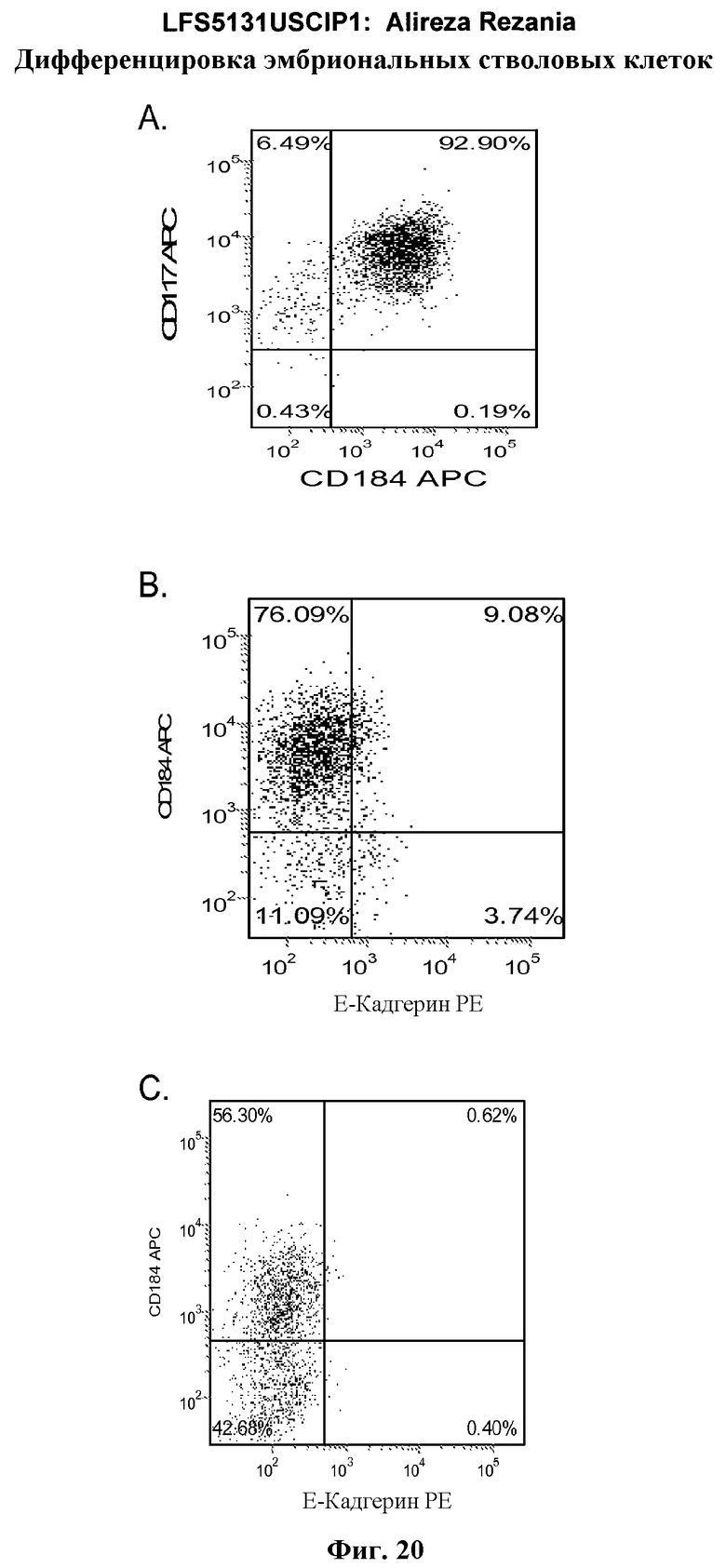
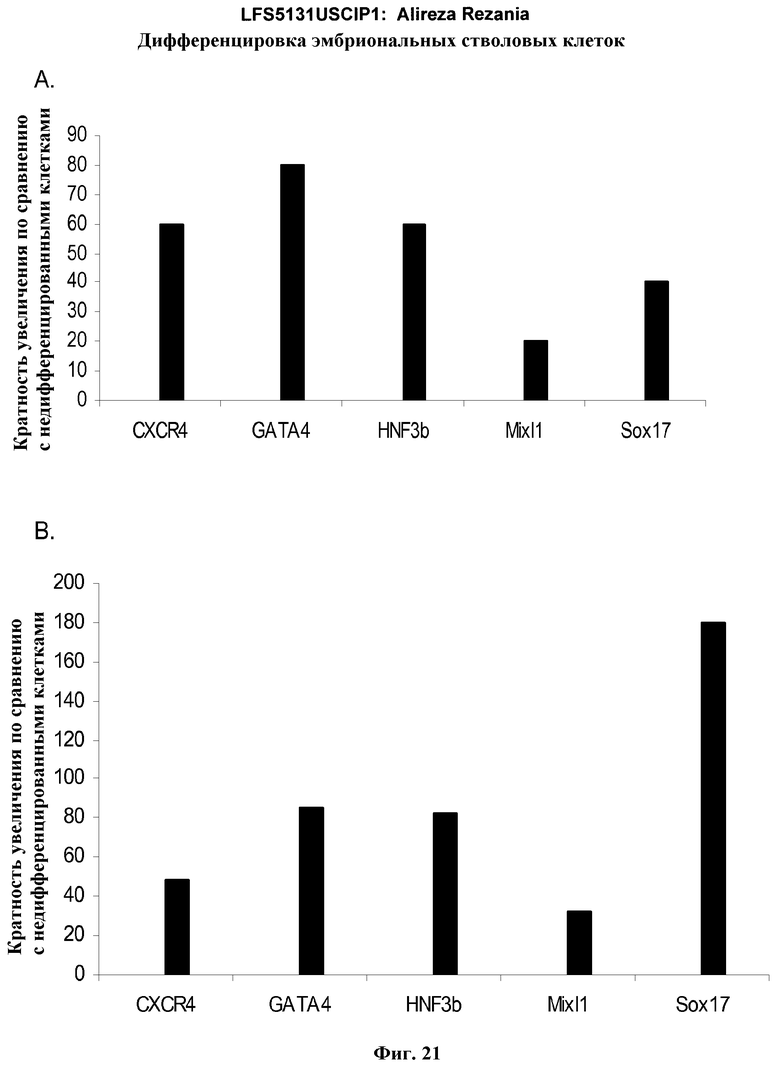
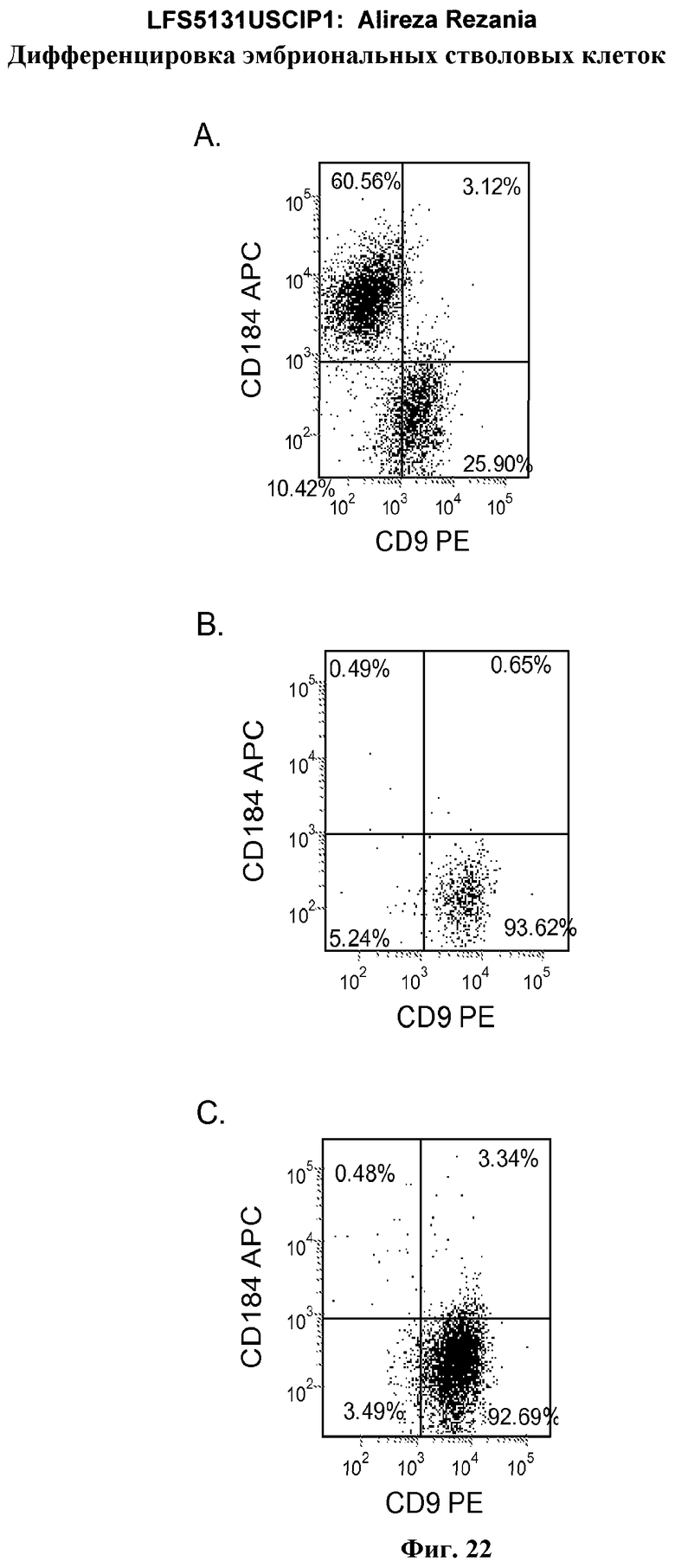
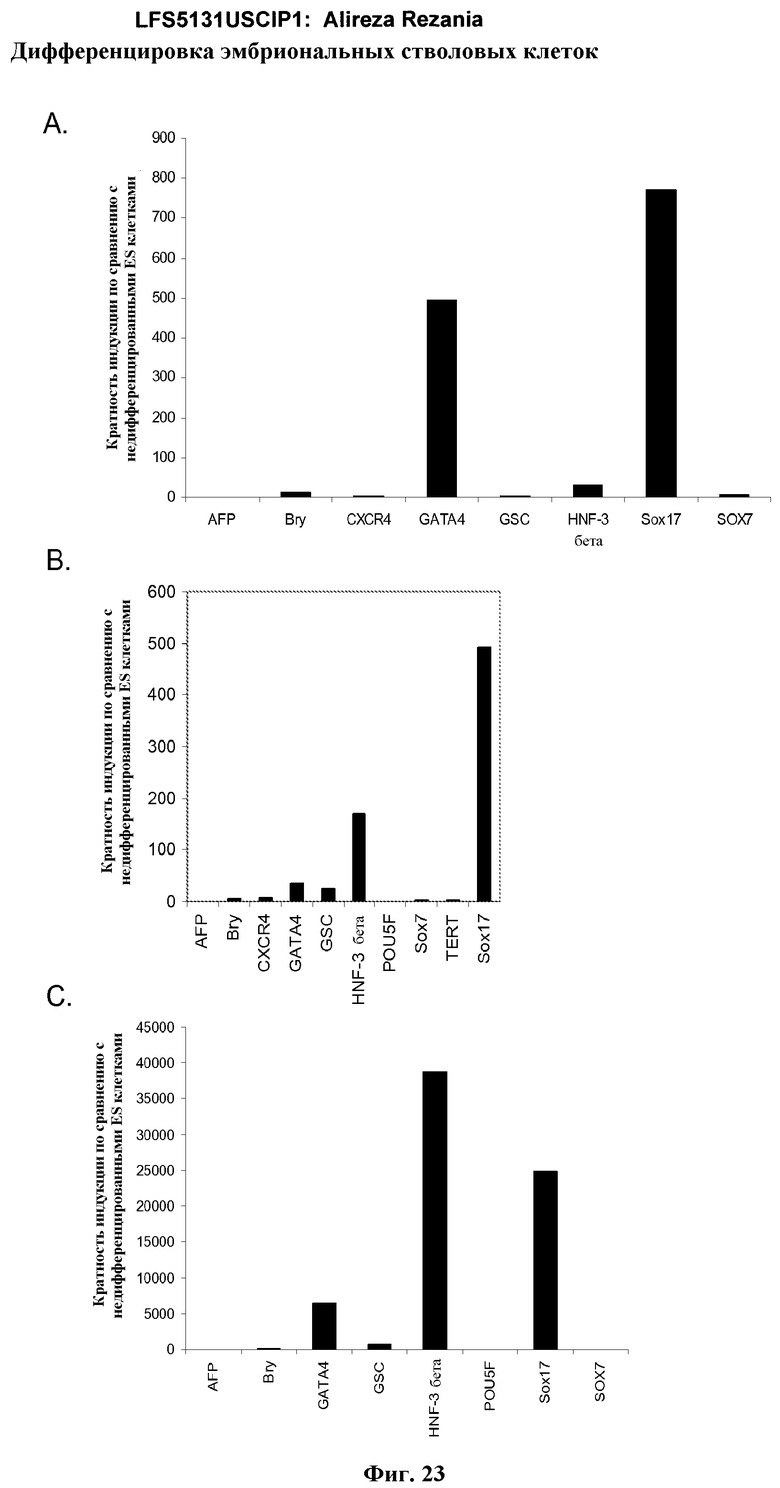

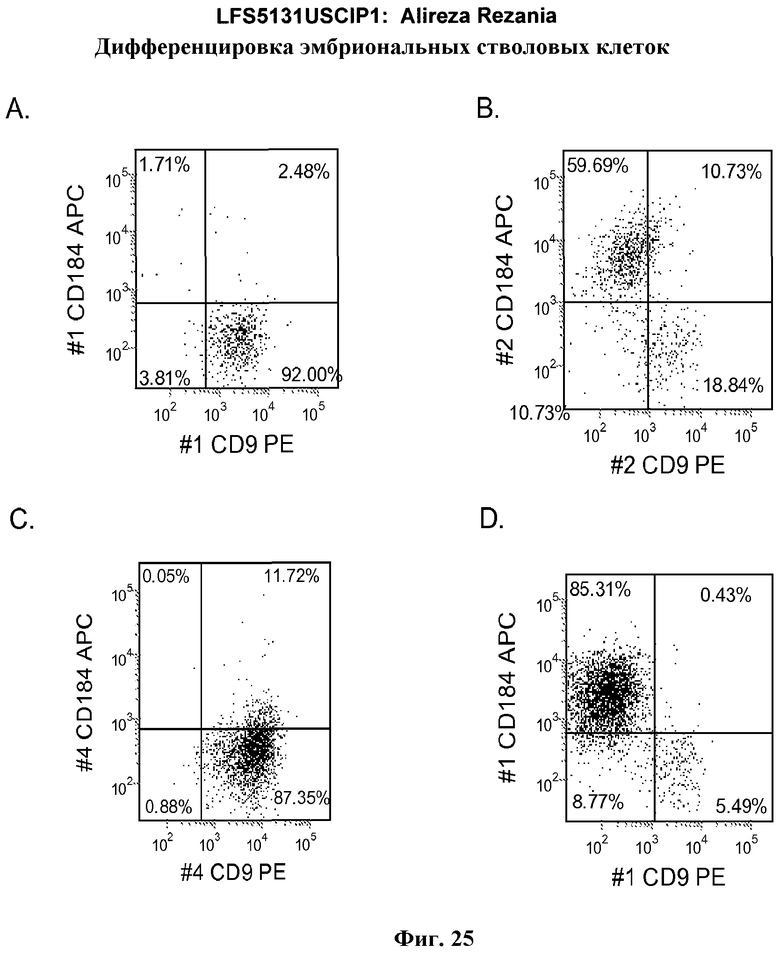
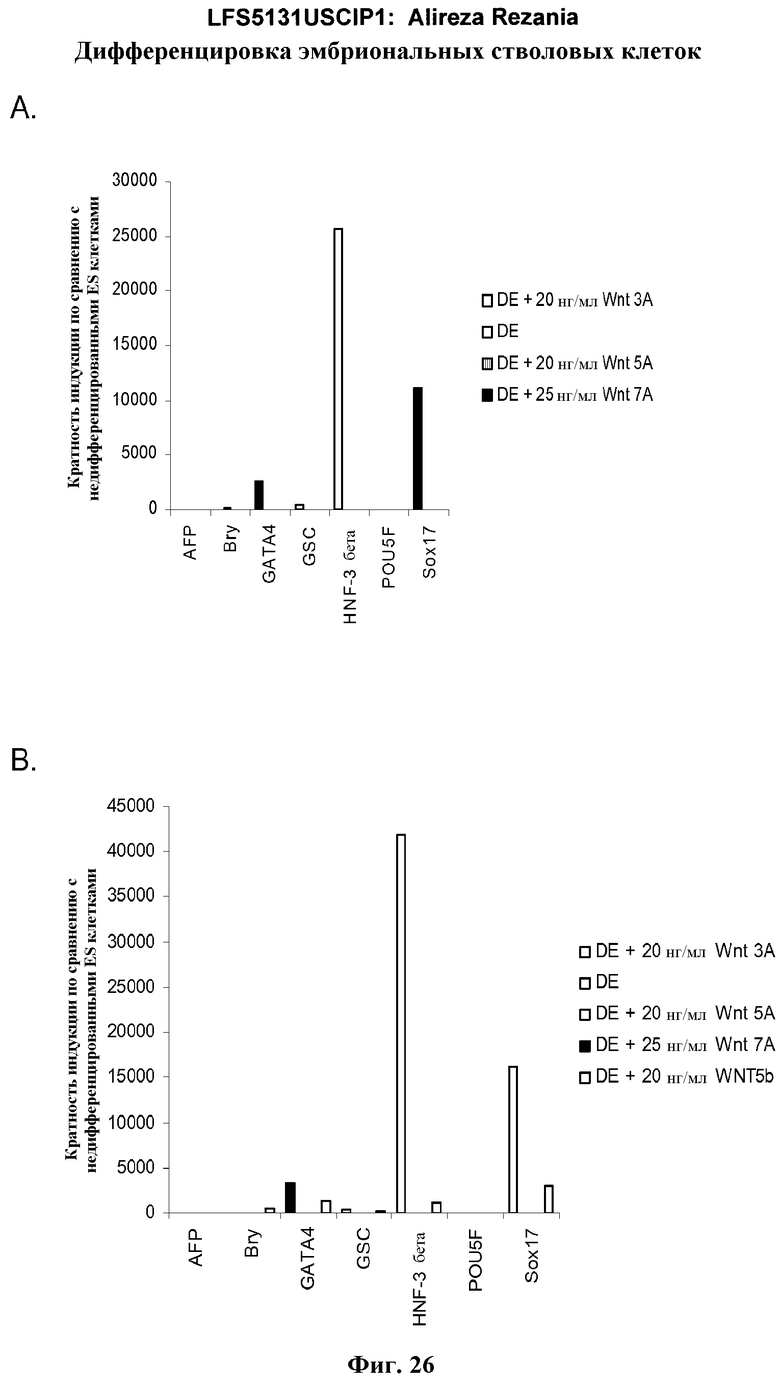
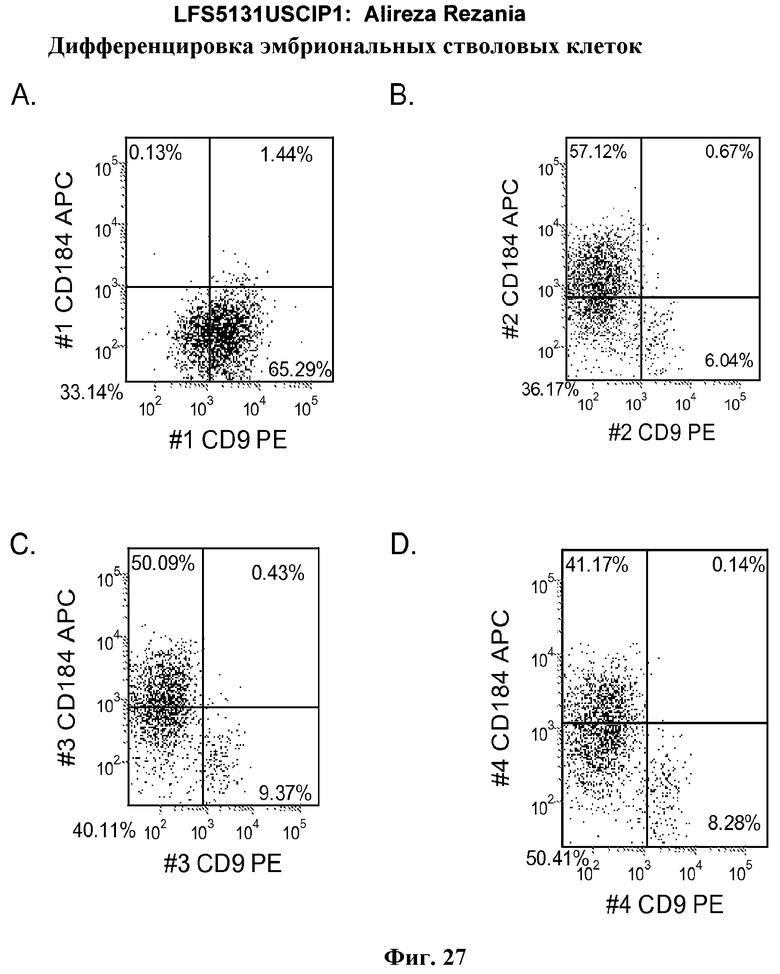
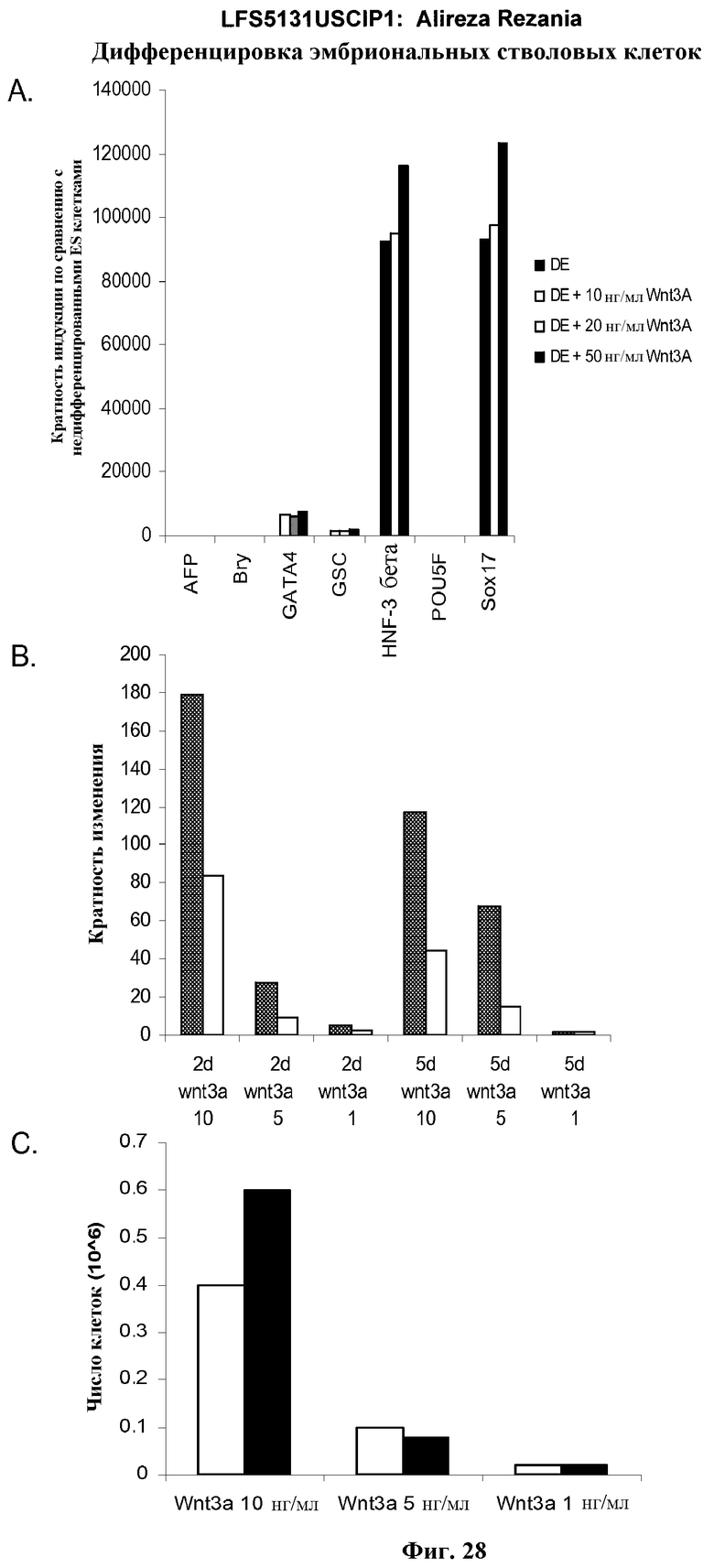
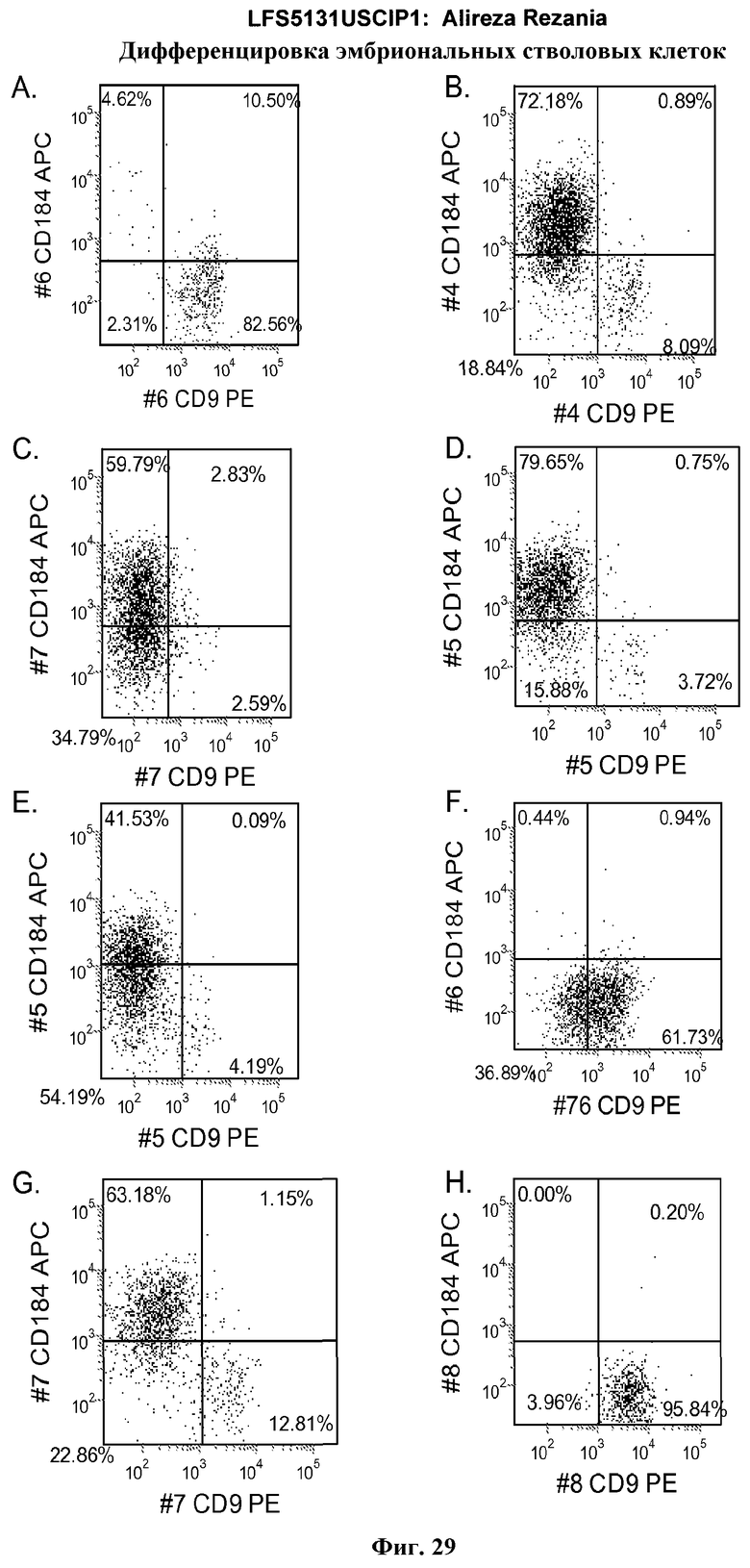
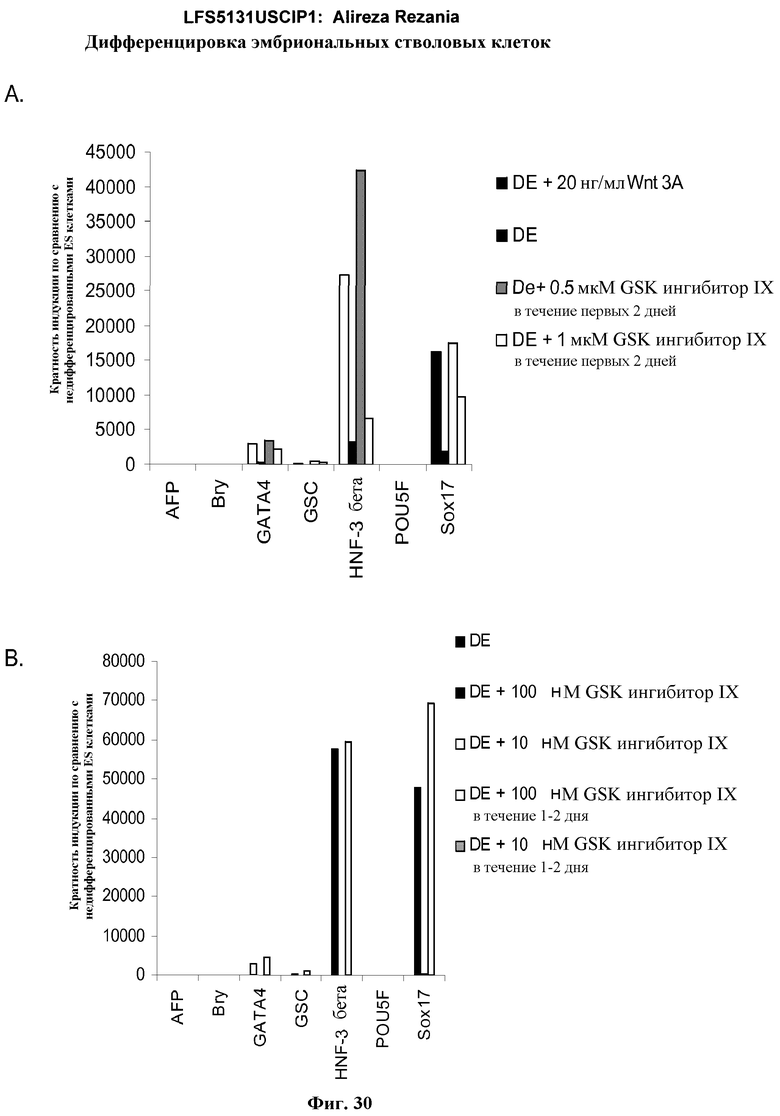
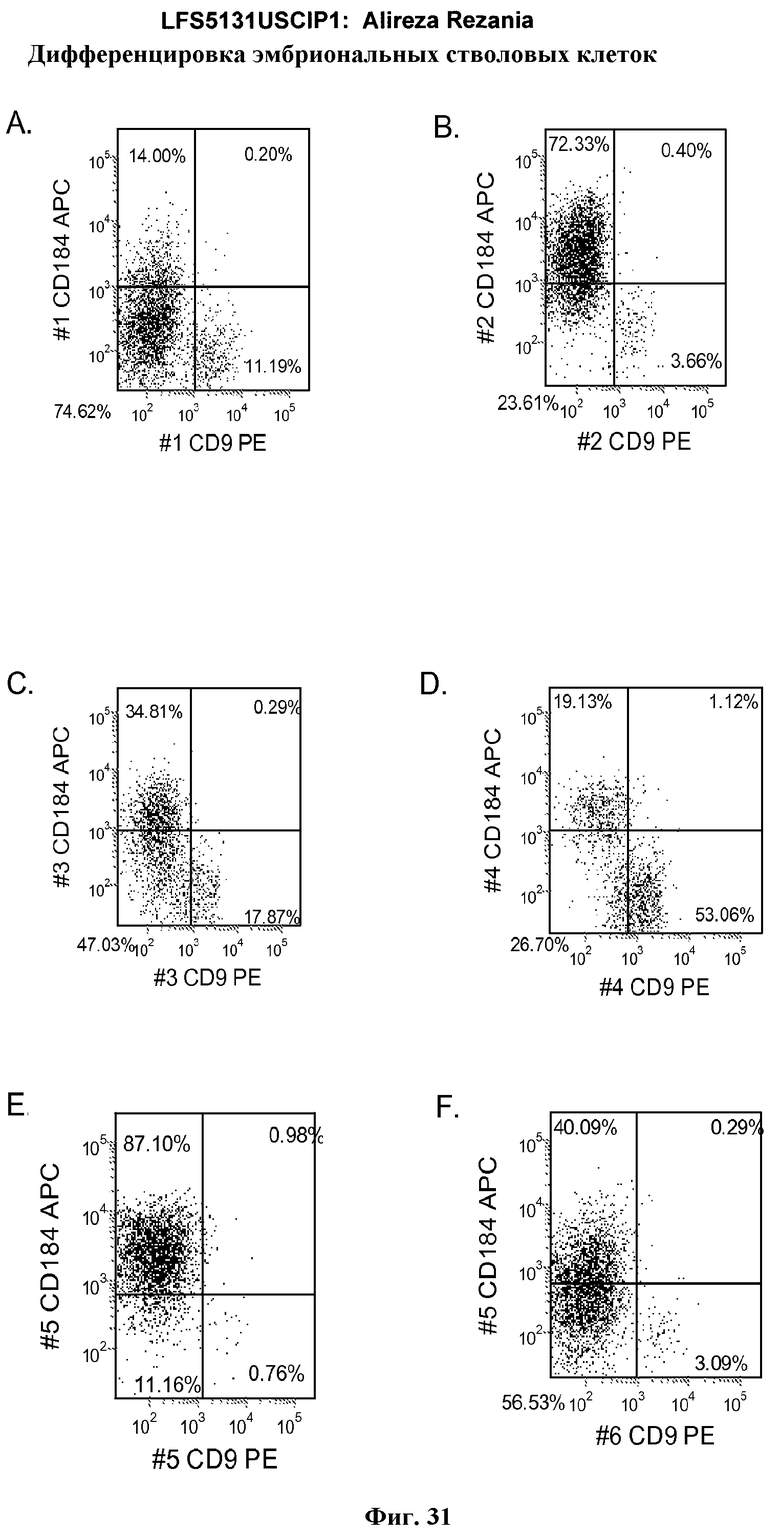
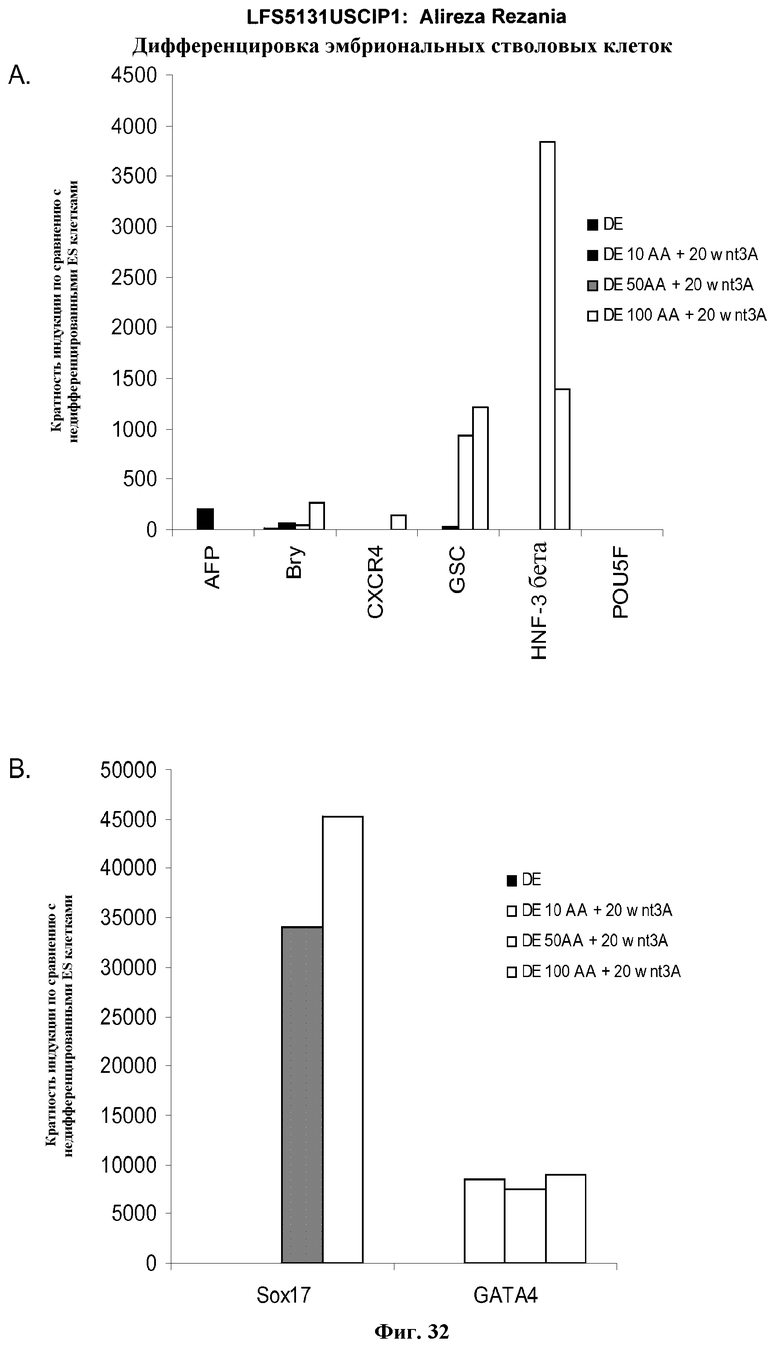
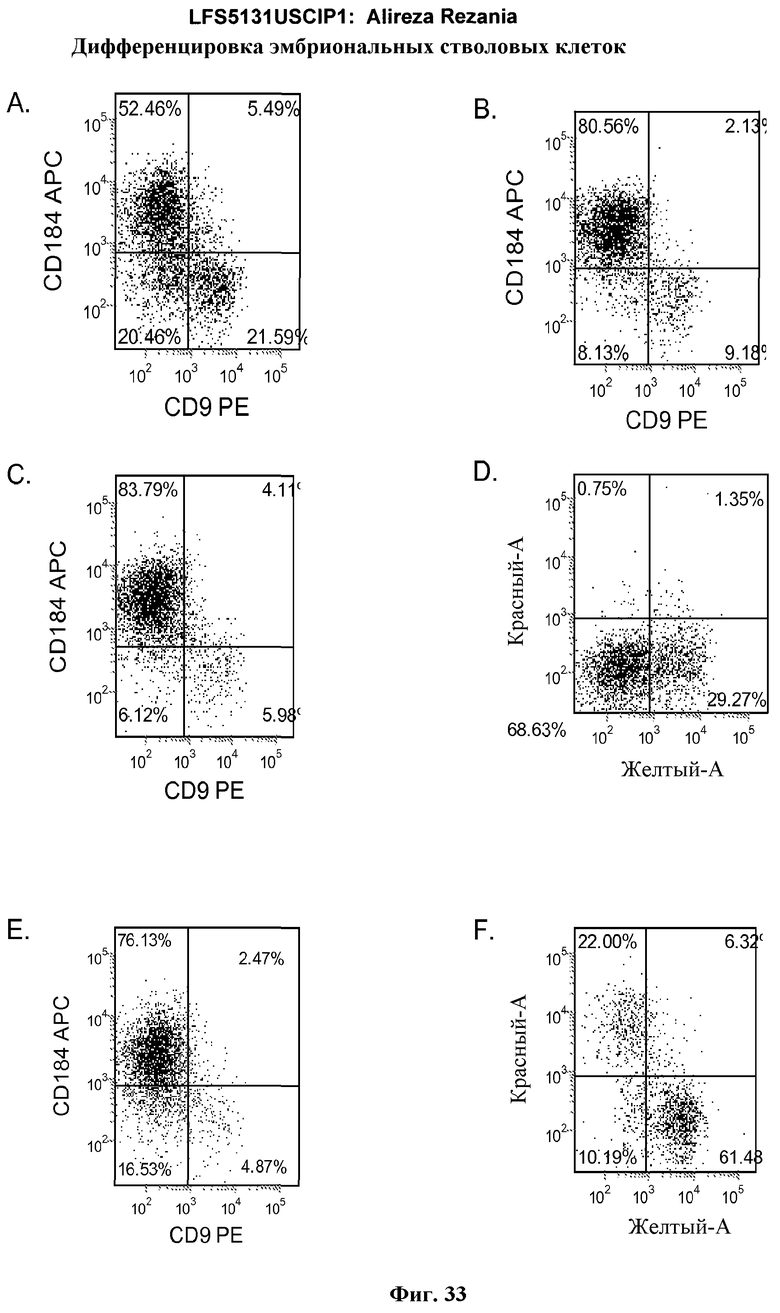
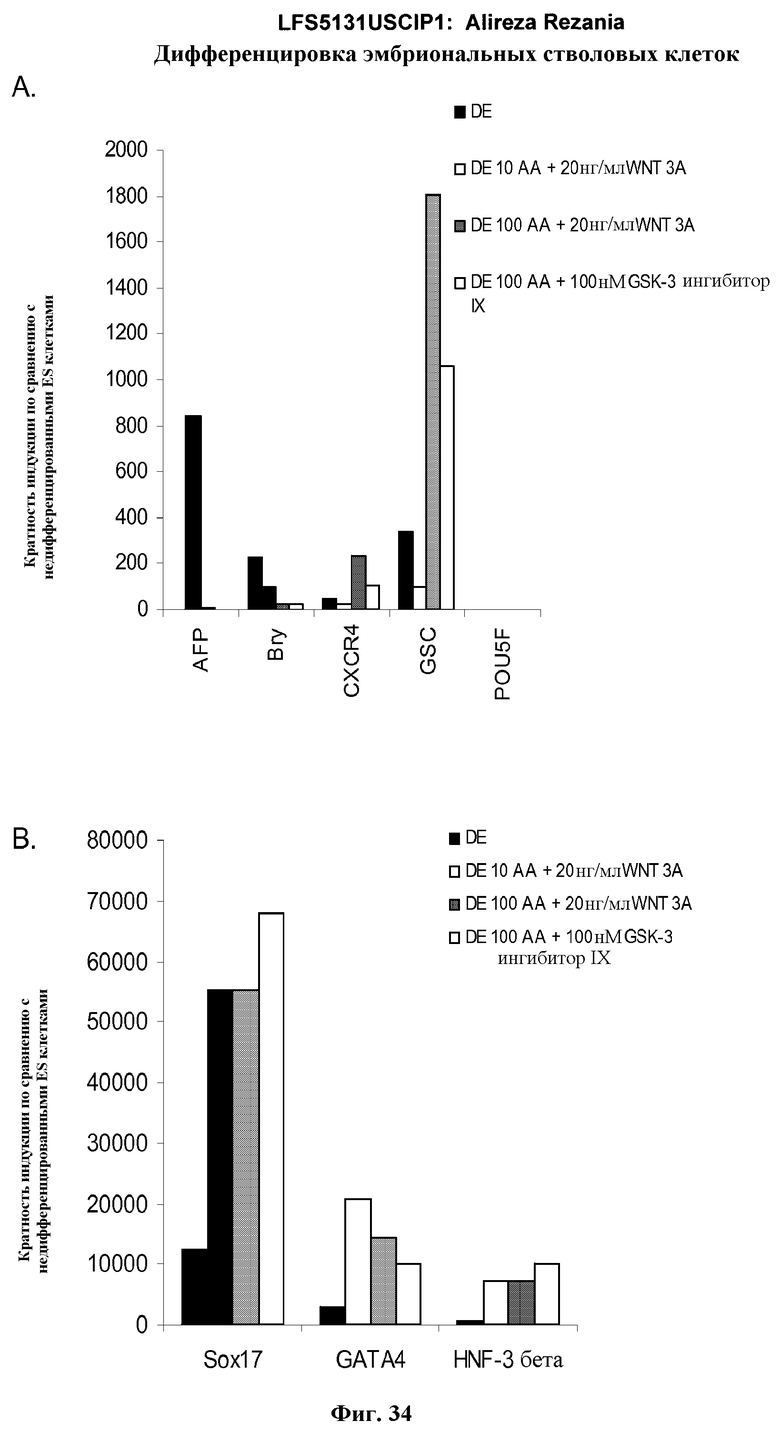
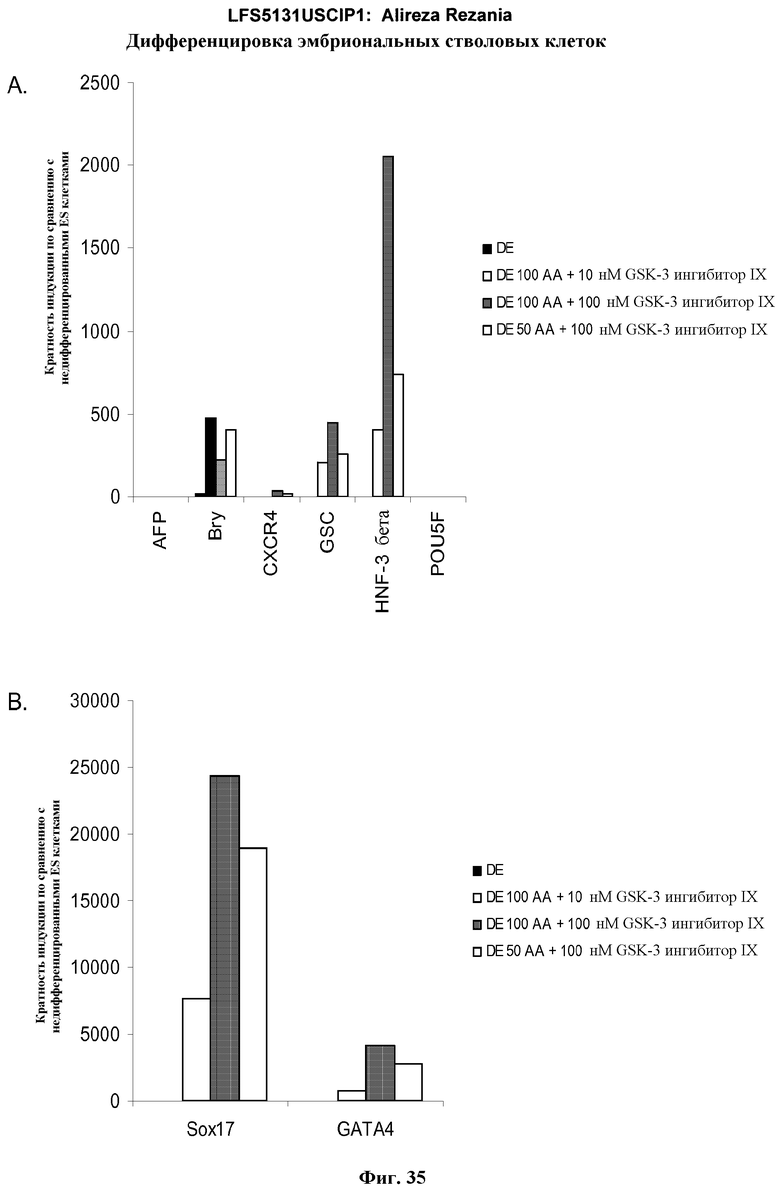
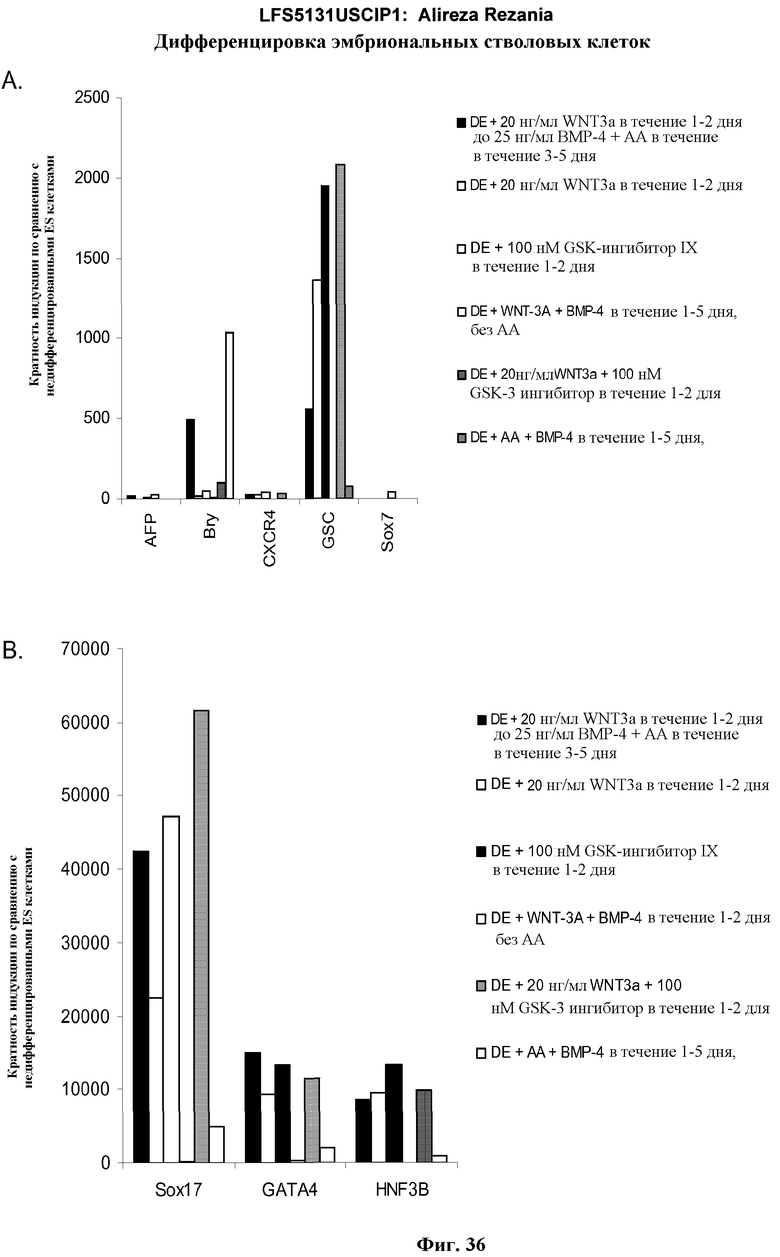
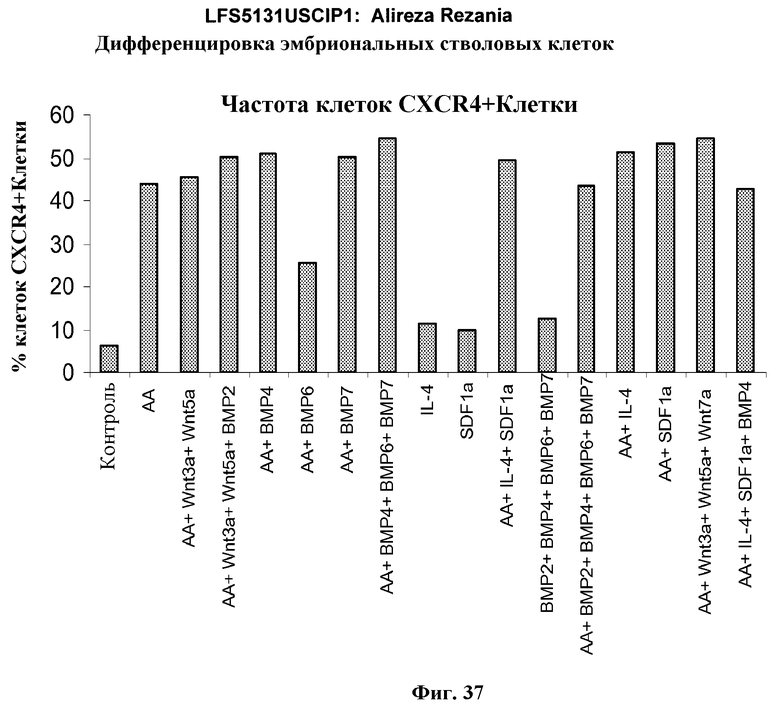
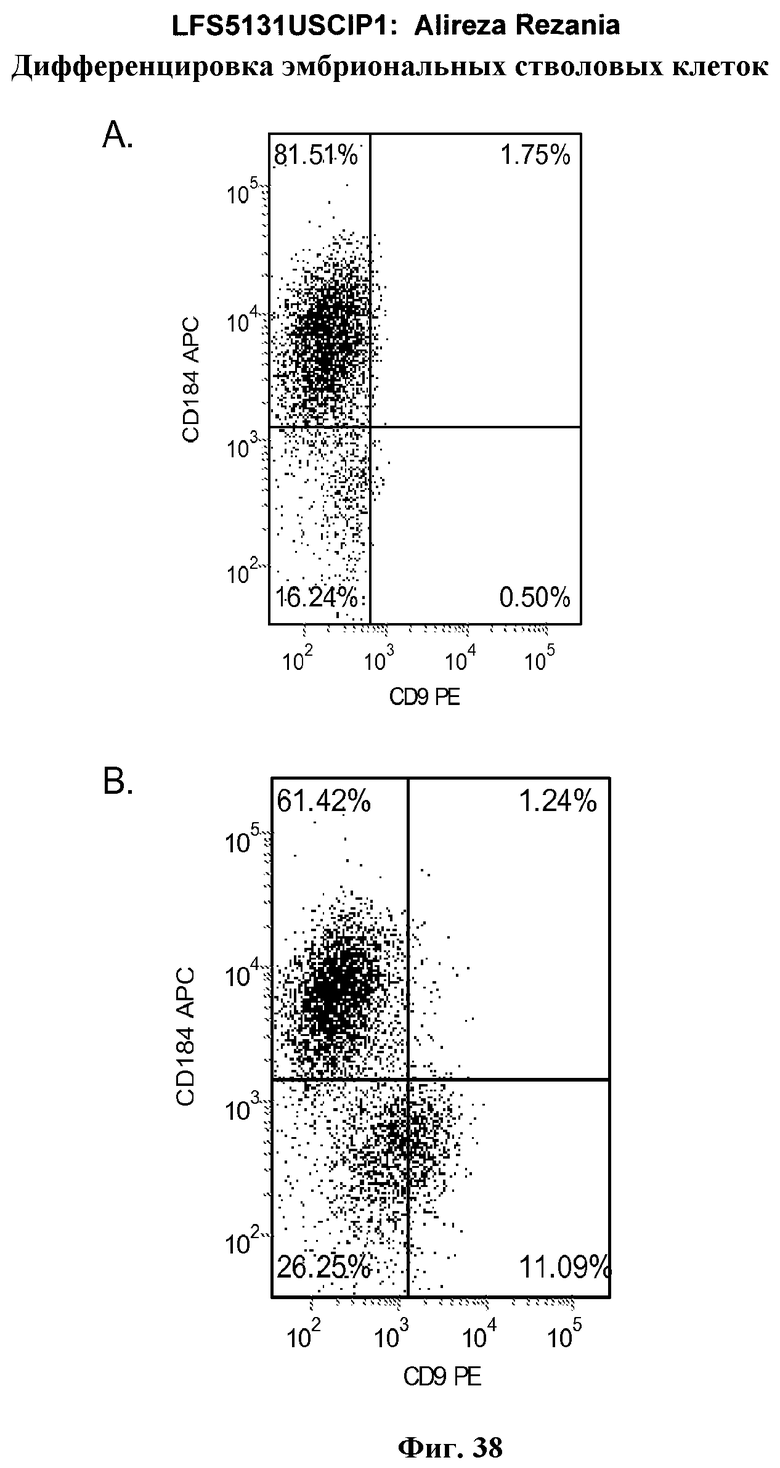
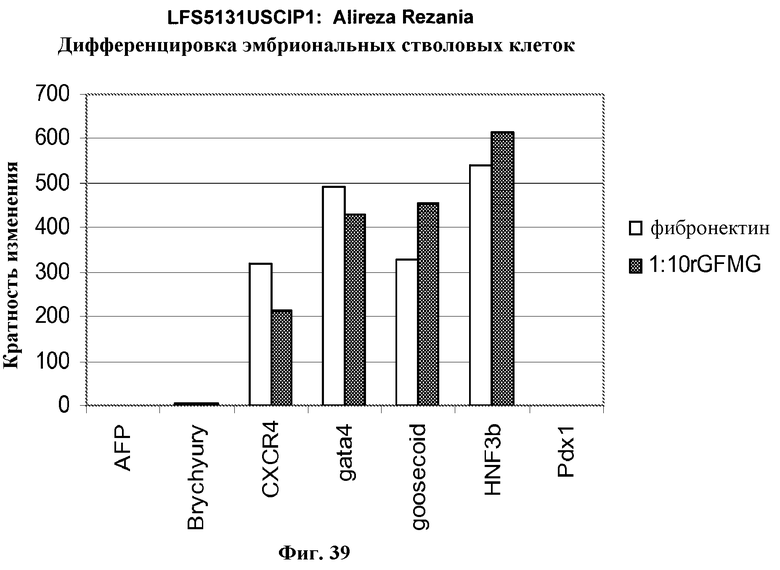
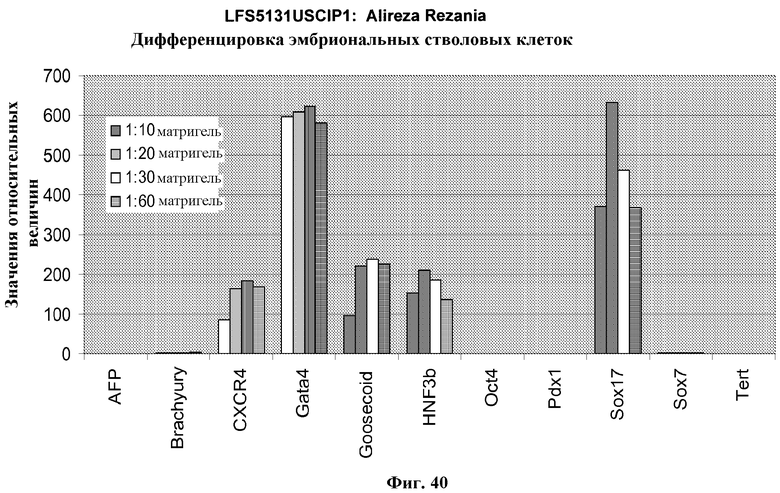
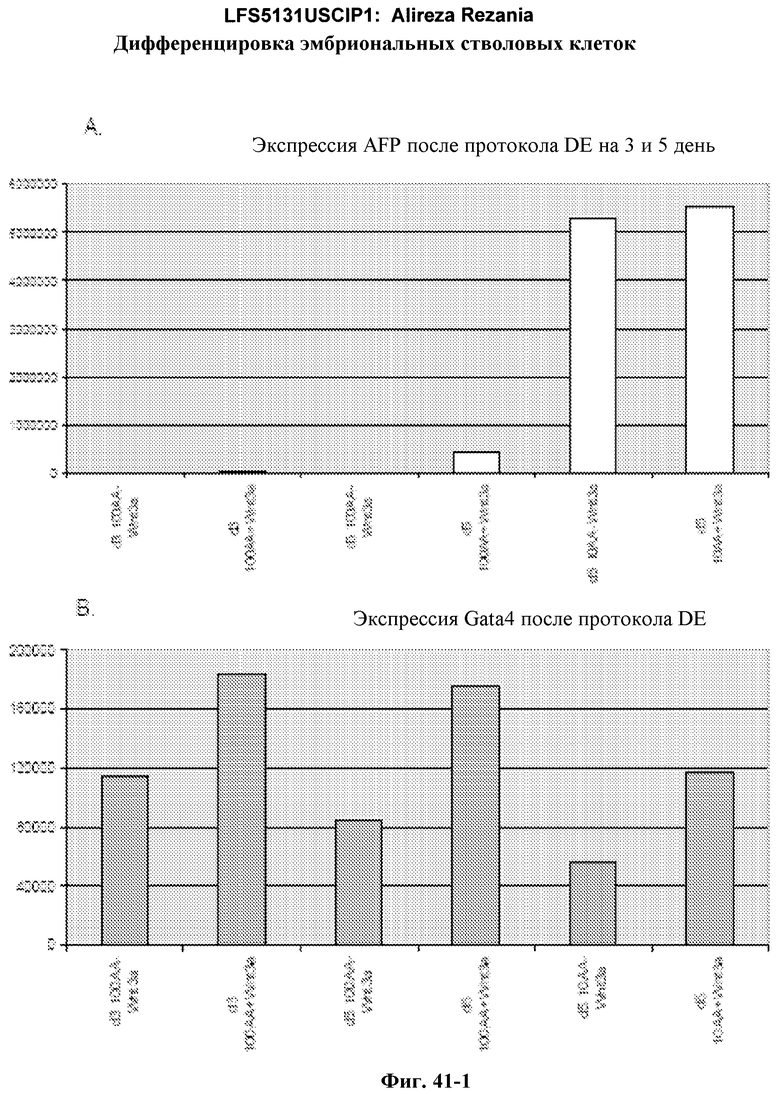
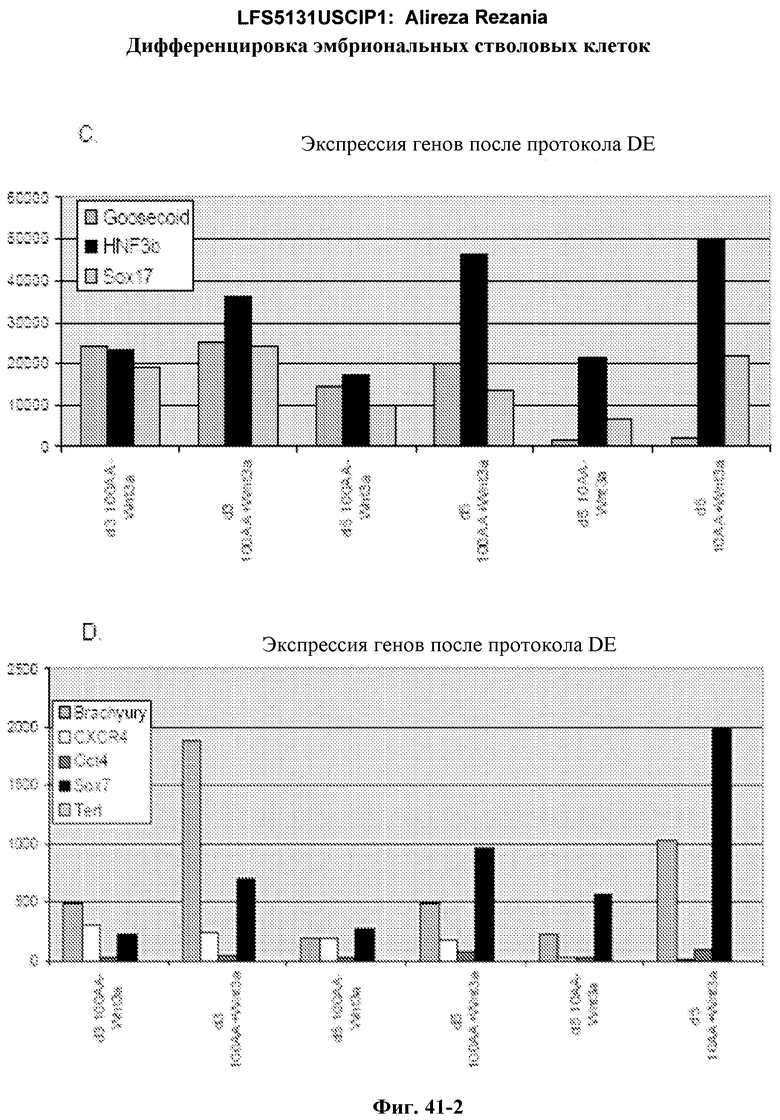
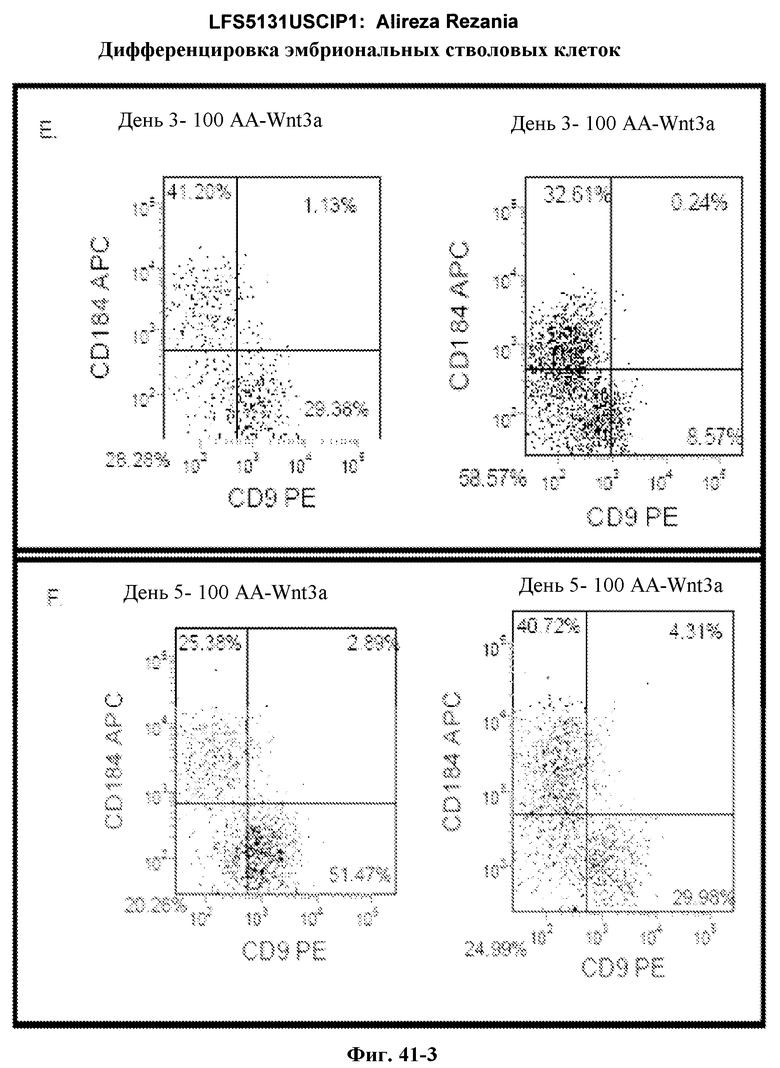
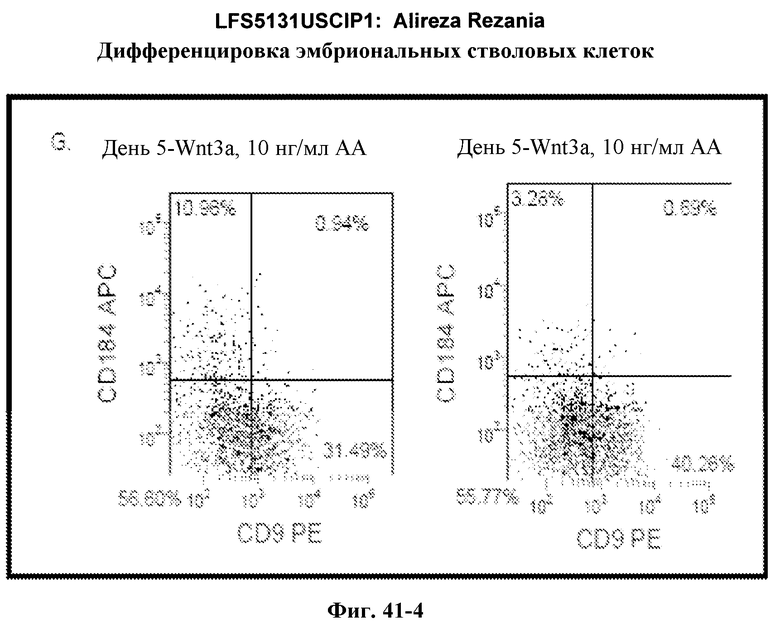
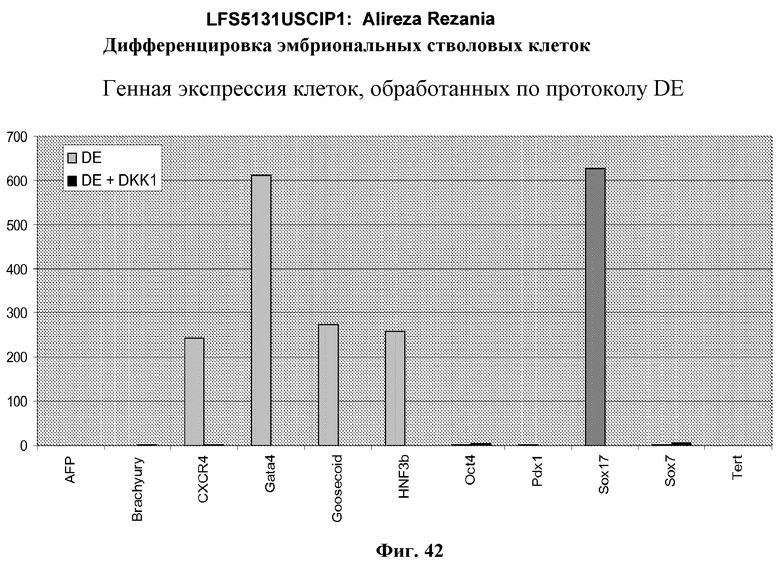

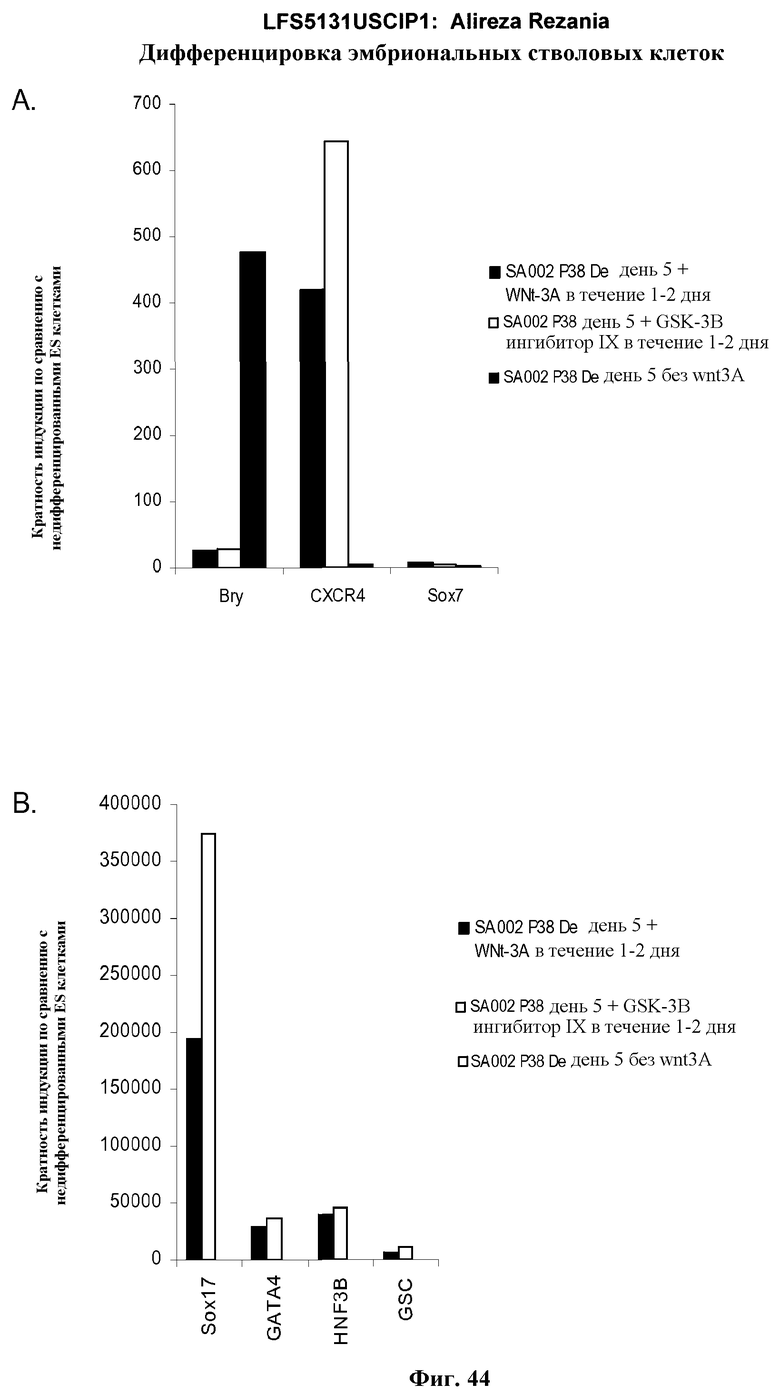
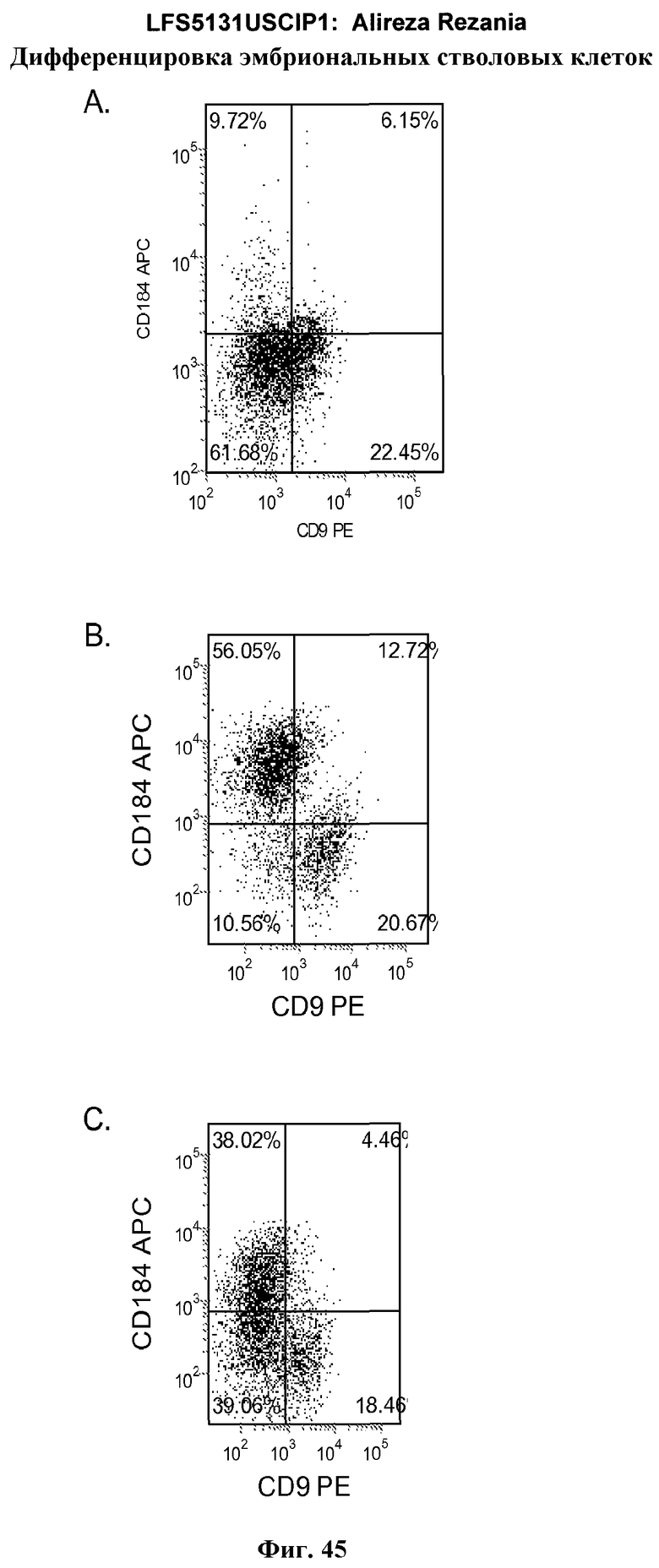
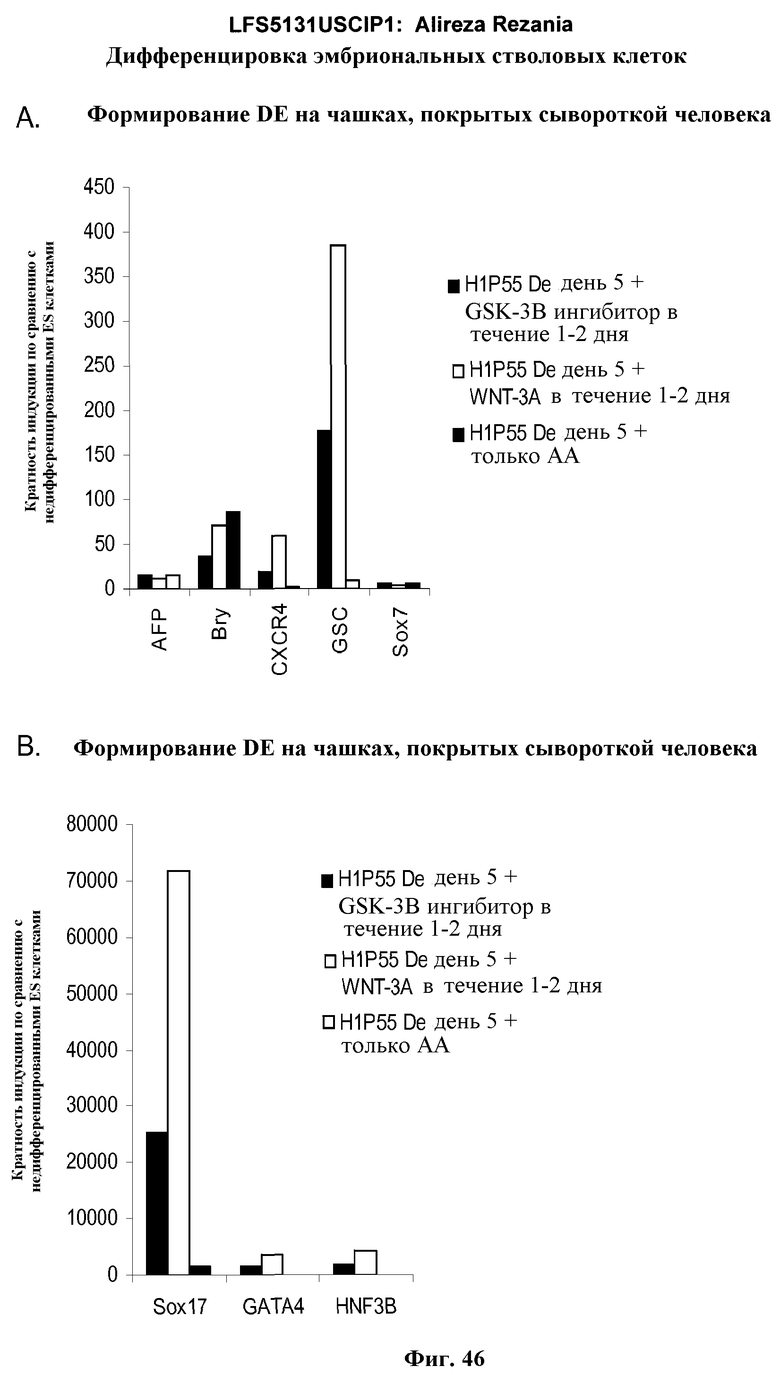
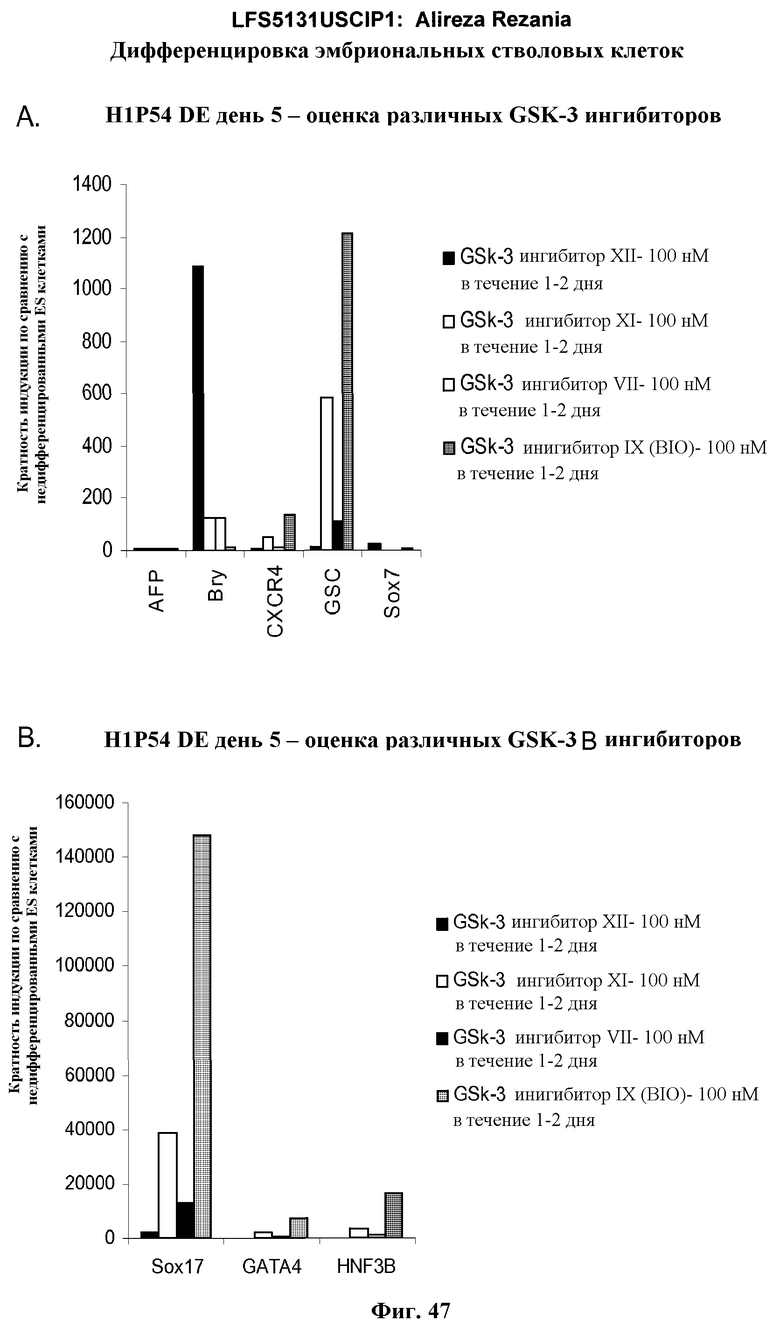
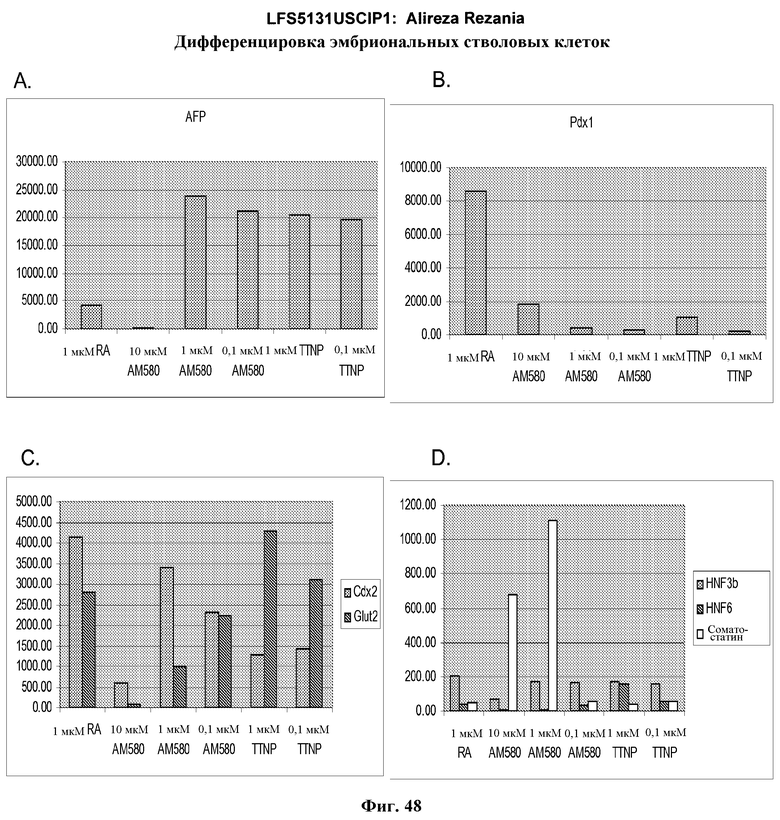
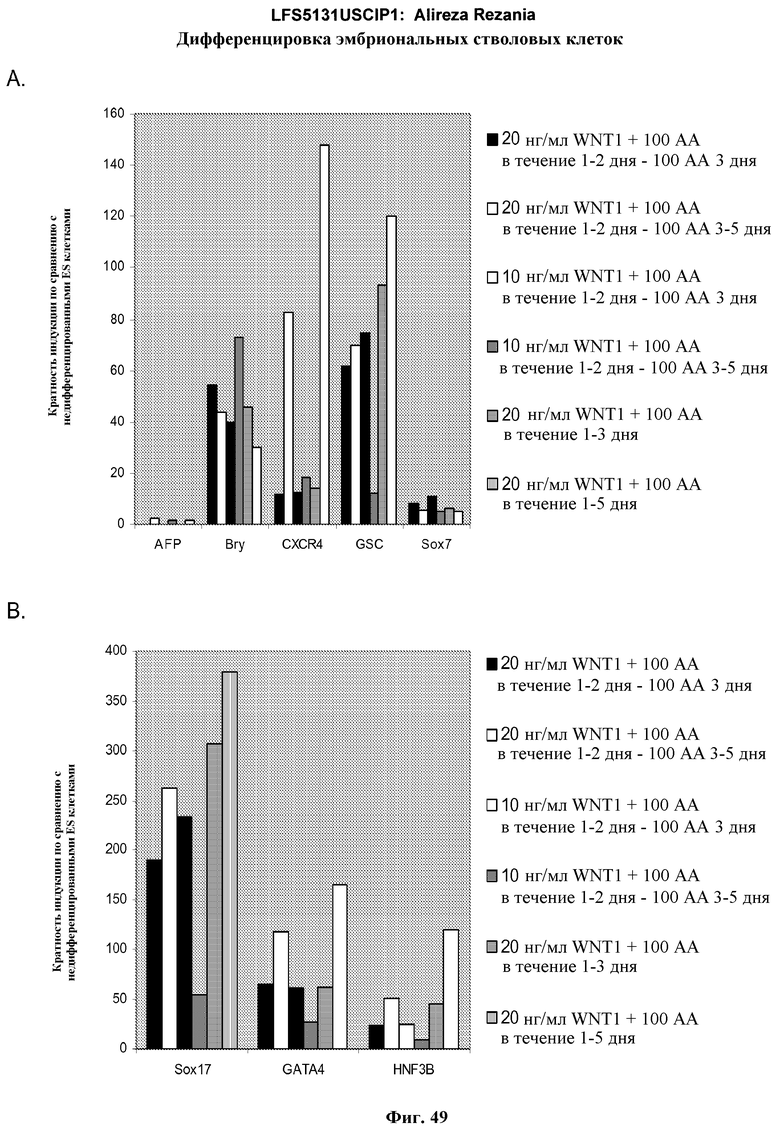
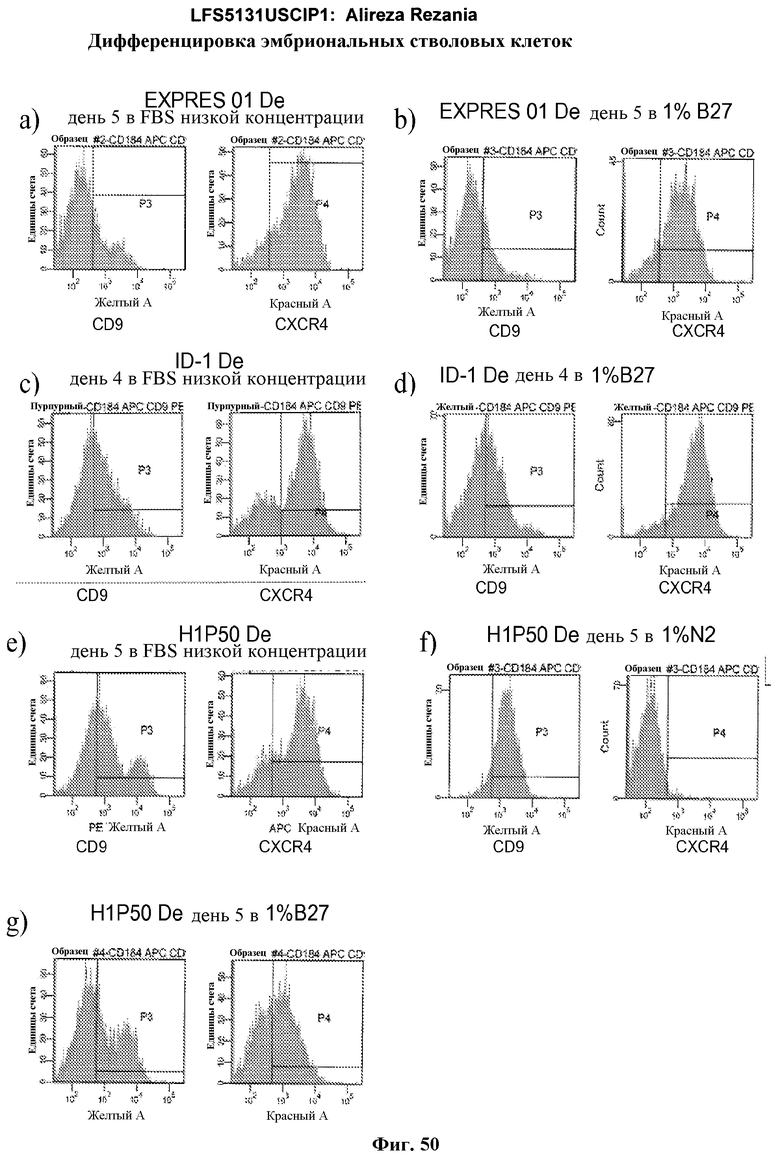
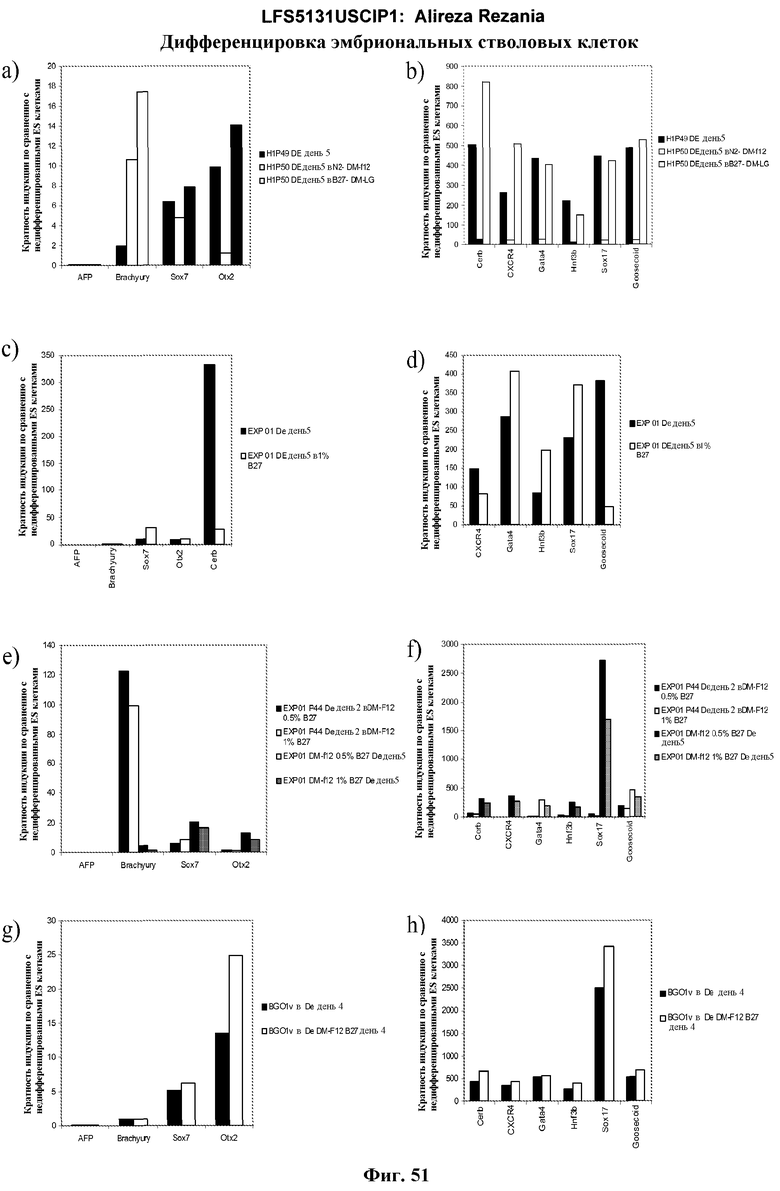

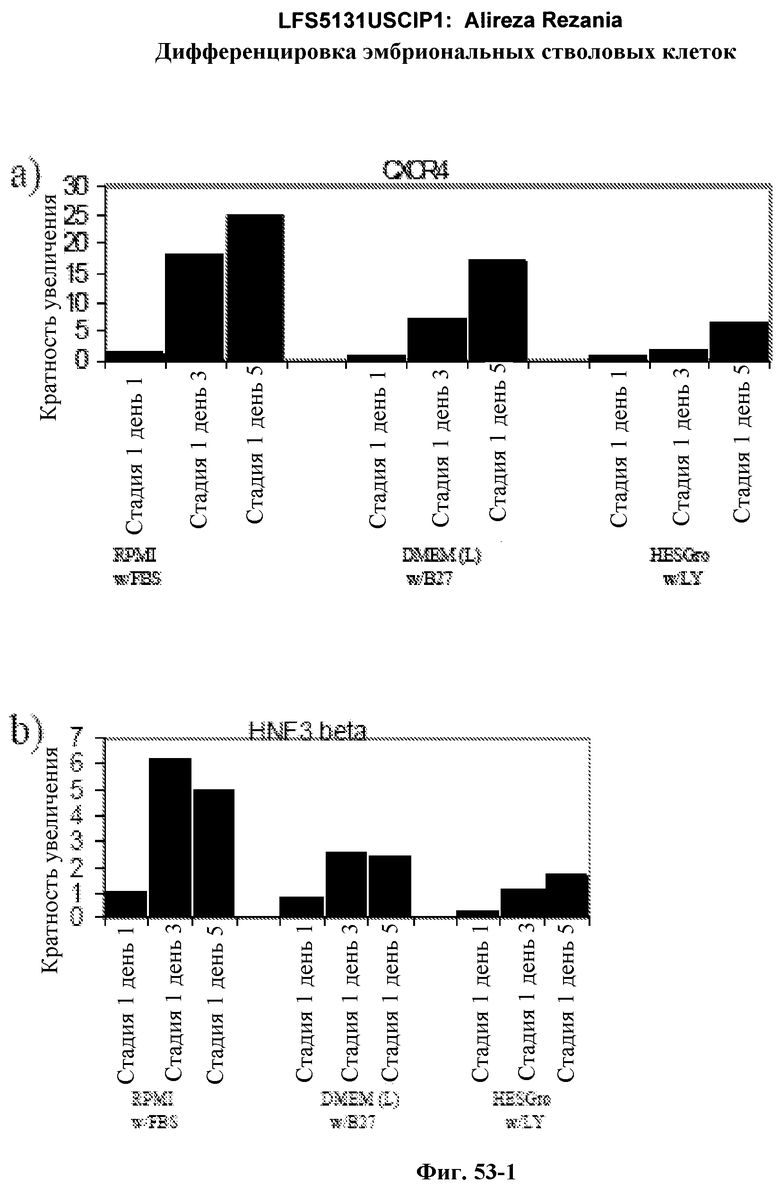
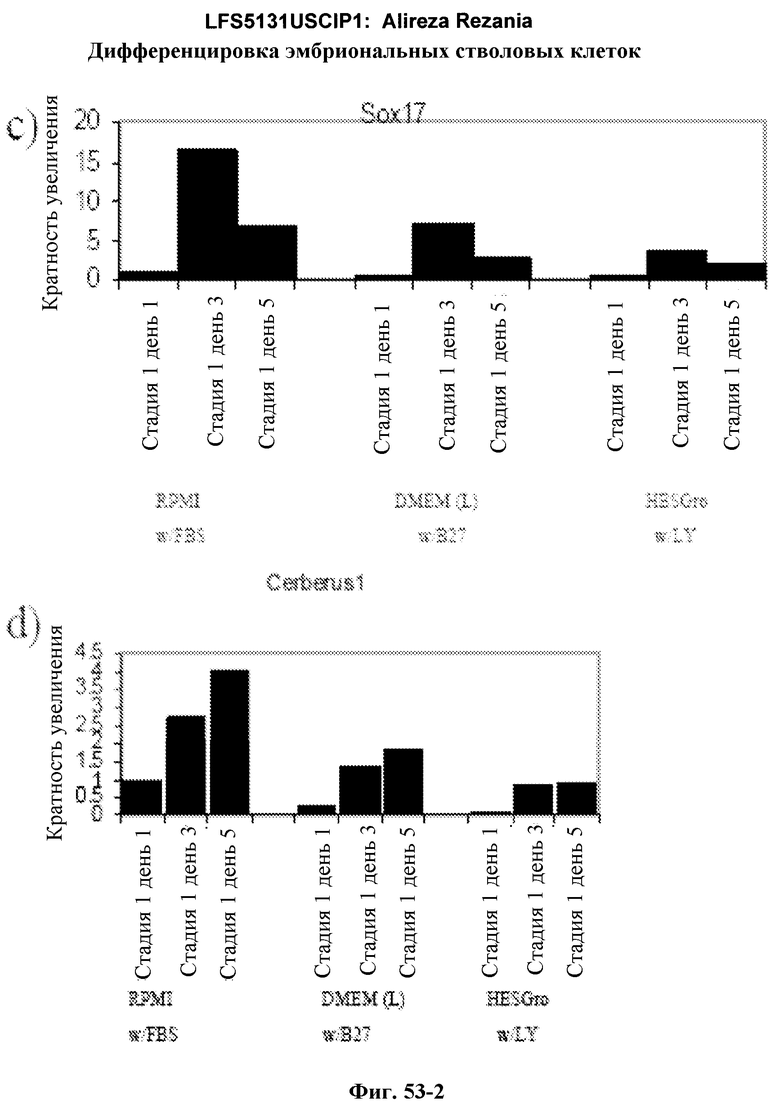
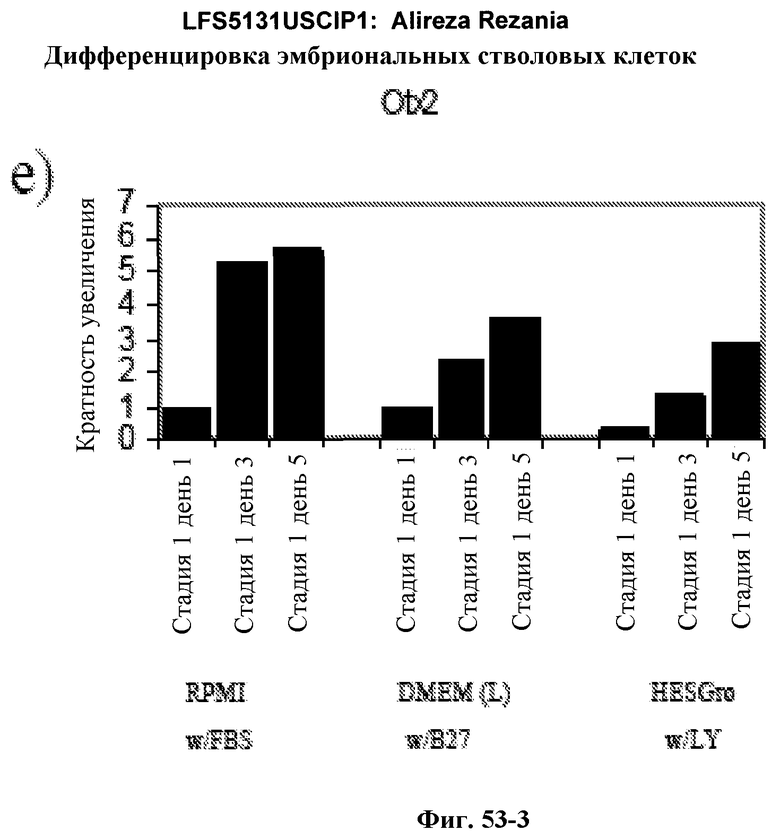
Изобретение относится к биотехнологии. Описаны способы дифференцировки плюрипотентных стволовых клеток путем культивирования плюрипотентных стволовых клеток в среде определенного химического состава, дополненной В27 и обработанной активином А. Изобретение позволяет улучшить эффективность дифференцировки стволовых клеток в эндокринные клетки поджелудочной железы. 3 н. и 29 з.п. ф-лы, 53 ил., 7 табл., 37 пр.
1. Способ дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, включающий стадии:
а. культивирования плюрипотентных стволовых клеток,
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде определенного химического состава, содержащей среду, дополненную В27, и обработки плюрипотентных клеток активином А,
с. дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы по меньшей мере с одним фактором роста фибробластов, или ретиноевой кислотой, и по меньшей мере одним фактором роста фибробластов, и
d. дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии дифференцировки, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки панкреатической эндодермы с ингибитором гамма секретазы.
2. Способ по п.1, в котором В27 используют в концентрации примерно от 0,5% примерно до 1%.
3. Способ по п.1, в котором В27 используют в концентрации примерно 1%.
4. Способ по п.1, в котором стадия дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, достигается с помощью способа, включающего стадии:
а. высевания плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, и
b. культивирования плюрипотентных стволовых клеток в среде определенного химического состава, содержащей среду, дополненную В27.
5. Способ по п.1, в котором В27 используют в концентрации примерно от 0,5% примерно до 1%.
6. Способ по п.1, в котором В27 используют в концентрации примерно 1%.
7. Способ по п.4, в котором В27 используют в концентрации примерно от 0,5% примерно до 1%.
8. Способ по п.4, в котором В27 используют в концентрации примерно 1%.
9. Способ по п.1, в котором стадия дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, достигается с помощью способа, включающего стадии:
а. высевания плюрипотентных стволовых клеток на субстрат тканевой культуры, покрытый внеклеточным матриксом,
b. культивирования плюрипотентных стволовых клеток с активином А и лигандом Wnt в первой культуральной среде, и
с. культивирования плюрипотентных стволовых клеток с активином А во второй культуральной среде.
10. Способ по п.1, в котором стадия дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, достигается с помощью способа, дополнительно включающего высевание плюрипотентных стволовых клеток на питающий подслой фибробластов.
11. Способ по п.4, в котором плюрипотентные стволовые клетки культивируют в среде определенного химического состава, содержащей DMEM-F12, дополненную В27, лигандом Wnt и активином А.
12. Способ по п.4, в котором плюрипотентные стволовые клетки культивируют в среде определенного химического состава, содержащей DMEM-LG, дополненную В27, лигандом Wnt и активином А.
13. Способ дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, включающий стадии:
а. культивирования плюрипотентных стволовых клеток в среде определенного химического состава, содержащей среду, дополненную В27,
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, путем обработки плюрипотентных клеток активином А, и
с. дифференцировки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы в клетки, экспрессирующие маркеры, характерные для линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дифференцировки дефинитивной эндодермы по меньшей мере одним фактором роста фибробластов, или ретиноевой кислотой, и по меньшей мере одним фактором роста фибробластов.
14. Способ по п.13, в котором В27 используют в концентрации примерно от 0,5% примерно до 1%.
15. Способ по п.13, в котором В27 используют в концентрации примерно 1%.
16. Способ по п.13, в котором стадия дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, достигается с помощью способа, дополнительно включающего высевание плюрипотентных стволовых клеток на питающий подслой фибробластов.
17. Способ дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, которые характерны для линии дифференцировки дефинитивной эндодермы, включающий стадии:
а. высевания плюрипотентных стволовых клеток на субстрат тканевой культуры, покрытый внеклеточным матриксом, и
b. культивирования плюрипотентных стволовых клеток в среде определенного химического состава, содержащей среду, дополненную В27, и обработки плюрипотентных клеток активином А.
18. Способ по п.17, в котором В27 используют в концентрации примерно от 0,5% примерно до 1%.
19. Способ по п.17, в котором В27 используют в концентрации примерно 1%.
20. Способ по п.17, в котором стадия дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дифференцировки дефинитивной эндодермы, достигается с помощью способа, включающего высевание плюрипотентных стволовых клеток на питающий подслой фибробластов.
21. Способ по п.17, в котором плюрипотентные стволовые клетки культивируют в среде определенного химического состава, содержащей DMEM-F12, дополненную В27, лигандом Wnt и активином А.
22. Способ по п.21, в котором В27 находится в концентрации примерно от 0,5% примерно до 1%.
23. Способ по п.21, в котором В27 находится в концентрации примерно 1%.
24. Способ по п.17, в котором плюрипотентные стволовые клетки культивируют в среде определенного химического состава, содержащей DMEM-LG, дополненную В27, лигандом Wnt и активином А.
25. Способ по п.24, в котором В27 находится в концентрации примерно от 0,5% примерно до 1%.
26. Способ по п.24, в котором В27 находится в концентрации примерно 1%.
27. Способ по п.1, в котором плюрипотентные стволовые клетки культивируют в среде определенного химического состава, содержащей DMEM-F12, дополненную В27 и активином А.
28. Способ по п.27, в котором В27 находится в концентрации примерно от 0,5% примерно до 1%.
29. Способ по п.27, в котором В27 находится в концентрации примерно 1%.
30. Способ по п.1, в котором плюрипотентные стволовые клетки культивируют в среде определенного химического состава, содержащей DMEM-F12, дополненную В27 и активином А.
31. Способ по п.30, в котором В27 находится в концентрации примерно от 0,5% примерно до 1%.
32. Способ по п.30, в котором В27 находится в концентрации примерно 1%.
| SEGEV H et al: "Differentiation of human embryonic stem cells into insulin-producing clusters", stem cells, 2004, vol: 22 p.265, 266 | |||
| RU 2005131581 A, 27.04.2006. |
Авторы
Даты
2012-10-27—Публикация
2008-07-18—Подача