Изобретение относится к микробиологии и клинической лабораторной диагностике и может быть использовано как вариант для определения антиоксидантного потенциала микроорганизмов при оценке антиоксидантного статуса и микроэкологических особенностей организма человека.
Описание изобретения
Изобретение относится к микробиологии и клинической лабораторной диагностике и может быть использовано как вариант определения антиоксидантного потенциала микроорганизмов при оценке микробного статуса организма человека. Типовые патологические процессы, такие как гипоксия и воспаление, свойственные и развивающиеся при большинстве соматических и инфекционных заболеваниях, тяжелых травмах и ранениях, всегда сопровождаются избыточным образованием активных форм кислорода, что приводит к усилению процессов перекисного окисления липидов, входящих в состав клеточных мембран [1]. Существенный вклад в поддержании окислительно-восстановительного баланса организма вносит нормальная микрофлора [2].
Известен способ RU №2112241, C1 6G01N 33/48, G01N 33/50 (дата публикации формулы изобретения 1998.05.27) определения концентрации малонового диальдегида с помощью тиобарбитуровой кислоты (ТБК). В данном способе для анализа используют минимальное количество сыворотки крови или гомогената (0,2-0,5 мл), растворение ТБК и инкубацию образца проводят в присутствии Тритона Х-100, смесь перемешивают с постоянной частотой колебаний (120 качаний в мин), реакцию останавливают дигидрокверцетином; перед определением оптической плотности образца добавляют трилон Б и смесь этанола с хлороформом в соотношении (7:3). В основе метода лежит реакция между малоновым диальдегидом (МДА) и тиобарбитуровой кислотой, которая при высокой температуре и кислом значении рН протекает с образованием окрашенного триметинового комплекса, содержащего одну молекулу МДА и две молекулы тиобарбитуровой кислоты. Максимум поглощения комплекса приходится на 532 нм. Рабочий раствор тиобарбитуровой кислоты (ТБК) готовят путем растворения навески ТБК 864 мг в 100 мл смеси, содержащей 1% раствор тритона Х-100 и 8,2 М раствор этанола.
Однако данный способ обладает рядом недостатков: он не учитывает специфики метаболизма микроорганизмов, для повышения растворимости липидных фракций и 2-тиобарбитуровой кислоты предлагается использовать специальный реактив (полиоксиэтилен-п-(трет-октил) фенол (Тритон Х-100)), а также реактив, требующий особых условий хранения и работы (трихлорметан). Наиболее близким к заявляемому является способ выявления у микроорганизмов протективного действия в эффекте Фентона RU 2279079, С2 G01N 33/483, C12Q 1/02.
В заявляемом способе выявления у микроорганизмов протективного действия в эффекте Фентона исследуемую культуру микроорганизмов выращивают в жидкой питательной среде, отделяют супернатант от микробных клеток центрифугированием, параллельно готовят контроль, представляющий жидкую питательную среду, далее каждую из проб обрабатывают хлороформом и отделяют супернатант от хлороформа центрифугированием, затем в опытную пробу и контроль добавляют тест-культуру Staphylococcus aureus ГИСК №201108, инкубируют, отделяют клетки тест-культуры центрифугированием и готовят из них микробную взвесь, в каждую из проб добавляют раствор пероксида водорода и инкубируют, отделяют клетки тест-культуры центрифугированием, добавляют к ним питательную среду, инкубируют, измеряют оптическую плотность выросших культур в опытной и контрольной пробах, определяют степень прироста биомассы тест-культуры в опыте. Недостатком данного способа является использование в качестве показателя протективного эффекта микроорганизмов только степень прироста клеточной массы по оптической плотности. Поэтому способ не учитывает кинетических показателей, возникающих при добавлении в исследуемую систему прооксидантов. Способ характеризует длительность и относительная многостадийность. Результаты эксперимента требуют нескольких стадий инкубации, которые должны подбираться с учетом физиологии микроорганизмов. Рассматриваемый способ не позволяет определять количественные характеристики, отражающие антиоксидантный потенциал микроорганизмов, входящих в состав микробиоценоза человека. Определение протективного действия у исследуемой культуры в эффекте Фентона, по этому способу, возможно только при наличии в среде малых концентраций пероксида водорода.
Задачей предлагаемого изобретения является усовершенствование известного способа определения антиоксидантной активности, а также возможность использования предлагаемого способа для определения антиоксидантного статуса у микроорганизмов, не продуцирующих пероксид водорода и/или инактивирующих его ферментов.
Сущностью способа является определение антиоксидантного статуса микроорганизмов по их способности блокировать реакцию перекисного окисления липидов и/или ингибировать фосфолипазы.
Способ определения антиоксидантной активности микроорганизмов заключается в том, что оценивается антиоксидантная активность бульонных культур микроорганизмов или взвеси микроорганизмов в физиологическом растворе, выращенных на плотной питательной среде. В предлагаемом способе в качестве окисляемой среды используется раствор лецитина. Известно, что под действием фосфолипаз от лецитина отщепляется одна из жирных кислот, превращая его в лизолецитин. Данный продукт обладает высокой токсичностью в отношении клеток, вызывая их некроз [1]. По предлагаемому способу перекисное окисление лецитина запускается добавлением к нему суспензии клеток микроорганизмов - продуцентов фосфолипаз, выделенных от обследуемого, а при их отсутствии используется известный музейный штамм с фосфолипазной активностью. Далее, в среду последовательно добавляются водный раствор аскорбиновой кислоты, ионы железа (II) (в виде раствора железа сульфата). После этого анализируемые образцы инкубируют в течение 30 мин при температуре 42°С, при постоянном встряхивании. После этого в исследуемый образец вносят концентрированную ортофосфорную кислоту до рН 1, и 1% раствор 2-тиобарбитуровой кислоты в диметилсульфоксиде и этаноле (1:1). Реакционную смесь нагревают в водяной бане при t=70°C в течение 20 мин, охлаждают в темном месте до температуры +4°С и добавляют 3 мл н-бутанола, тщательно перемешивают, центрифугируют при 3 тыс. об/мин, отделяют бутанольную фазу и спектрофотометрируют, учитывая минимум пропускания при 550 нм. При спектрофотометрировании кюветой сравнения является кювета с н-бутанолом. В заявляемом способе используется несколько контролей: контроль максимально-возможной перекисной реакции (для осуществляемого исследования), для этого используют образец лецитина с инициированным окислением без антиоксиданта и контроль ингибирования перекисного окисления, где в качестве образцов сравнения используют эквимолярные количества вещества с известной антиоксидантной активностью. Для сравнения антиоксидантного статуса веществ в гидрофильной фазе использован водный раствор 6-метил-2-этил-пиридин-3-ола, а у веществ с липофильными свойствами в качестве образца сравнения используется токоферола ацетата - масляный раствор.
Количественно антиоксидантную активность выражают в условных единицах антиоксидантной активности (Еаоа), рассчитанных по формуле
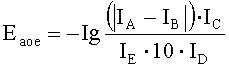
где
Еаоа - единицы антиоксидантной активности,
IA - интенсивность светового потока (в единицах пропускания), прошедшего через слой поглощающего раствора исследуемого образца при 550 нм,
IB - интенсивность светового потока (в единицах пропускания), прошедшего через слой поглощающего раствора питательной среды при 550 нм,
IC - интенсивность светового потока (в единицах пропускания), прошедшего через слой поглощающего раствора контроля с индуцированным окислением при 550 нм,
10 - коэффициент перевода в единицы объема,
IE - молярный коэффициент триметинового комплекса в единицах пропускания 0,413 ммоль·см-1,
ID - интенсивность светового потока (в единицах пропускания), прошедшего через слой поглощающего раствора контроля с известным антиоксидантом при 550 нм.
Пример 1.
Культуру Staphylococcus aureus, выделенную из кишечного микробиоценоза обследуемого, выращивали на мясо-пептонном агаре при 37°С в течение 48 ч. Затем суспендировали в стерильном 0,9% растворе натрия хлорида и стандартизировали по стандарту мутности до 109 микробных тел в 1 мл.
Выделенный из каловых масс этого же пациента штамм Bifidobacterium breve, выращивали в жидкой питательной среде Блаурокка. В день исследований готовили растворы: лецитина 0,1%, аскорбиновой кислоты 0,79М, сульфата железа 0,07М на бидистиллированной, свежепрокипяченой и охлажденной до комнатной температуры воде.
В опытные пробирки добавляли по 0,5 мл раствора лецитина, 0,3 мл бактериального субстрата, исследуемого на антиоксидантную активность - В.breve, и 0,8 мл раствора аскорбиновой кислоты. Реакцию образования свободных радикалов инициировали добавлением 0,8 мл раствора железа сульфата. Пробирки помещали в термостат при постоянном встряхивании на 30 мин. В качестве контроля эталонного антиоксиданта использовали 0,3 мл раствора эмоксипина. В качестве контроля максимально возможного перекисного окисления использовали пробирку с образцом лецитина, где инициирован процесс в отсутствии антиоксиданта. Исследуемые пробирки помещали в термостат на 30 мин, при температуре 42°С, при постоянном встряхивании. После этого в исследуемые образцы последовательно вносили 0,2 мл концентрированной ортофосфорной кислоты и 0,8 мл 1% раствора 2-тиобарбитуровой кислоты. Полученную реакционную смесь нагревали в водяной бане при t=70°C в течение 20 мин, охлаждали в темном месте до температуры +4°С и при тщательном перемешивании добавляли 3 мл н-бутанола. Полученную эмульсию центрифугировали при 3 тыс. об/мин, аккуратно отделяли бутанольную фазу, которую спектрофотометрировали на спектрофотометре СФ-2000, учитывая единицы пропускания при 550 нм. В качестве кюветы сравнения использовали кювету с н-бутанолом. Подставив полученные значения в формулу, рассчитали, что для анализируемого штамма Bifidobacterium breve антиоксидантная активность составила 3,03 Еаоа.
Источники информации
1. Шанин В.Ю. Клиническая патофизиология. С-Пб.: «Специальная литература», 1998, 569 с.
2. Шендеров Б.А. Медицинская микробная экология и функциональное питание, в 3-х т. / Б.А.Шендеров. - М.: Грань, 2001, т.3, 288 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения свободно-радикального окисления в модельной системе | 2016 |
|
RU2627459C2 |
| СПОСОБ ОЦЕНКИ СУТОЧНОГО МОЛОДНЯКА ПТИЦЫ | 2018 |
|
RU2699719C1 |
| СПОСОБ ОЦЕНКИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ РАСТИТЕЛЬНОГО СЫРЬЯ ИЗ САБЕЛЬНИКА БОЛОТНОГО (Comarum palustre L.) | 2013 |
|
RU2535139C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВЫСОКОГО РИСКА РАЗВИТИЯ ПРОИЗВОДСТВЕННО ОБУСЛОВЛЕННЫХ И ПРОФЕССИОНАЛЬНЫХ ЗАБОЛЕВАНИЙ У РАБОТНИКОВ ХИМИЧЕСКОГО КОМПЛЕКСА, ЗАНЯТЫХ ВО ВРЕДНЫХ УСЛОВИЯХ ТРУДА | 2013 |
|
RU2545911C1 |
| КОСМЕТИЧЕСКОЕ И/ИЛИ ДЕРМАТОЛОГИЧЕСКОЕ СРЕДСТВО И АНТИОКСИДАНТ | 2005 |
|
RU2290169C1 |
| СПОСОБ ДИАГНОСТИКИ ОБОСТРЕНИЯ ХОЛЕЦИСТИТА | 1995 |
|
RU2119670C1 |
| СПОСОБ ДИАГНОСТИКИ ОКИСЛИТЕЛЬНОГО СТРЕССА ОРГАНИЗМА ЧЕЛОВЕКА | 2003 |
|
RU2236008C1 |
| Ускоренный способ оценки антиоксидантной активности растительного сырья из сабельника болотного (COMARUM PALUSTRE L.) | 2022 |
|
RU2806256C1 |
| СПОСОБ ОЦЕНКИ ОБЩЕГО ОКСИДАНТНОГО СТАТУСА ОРГАНИЗМА | 2009 |
|
RU2407450C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПРОИЗВОДСТВЕННО ОБУСЛОВЛЕННЫХ ЗАБОЛЕВАНИЙ У РАБОТНИКОВ, ЗАНЯТЫХ ВО ВРЕДНЫХ УСЛОВИЯХ ТРУДА | 2017 |
|
RU2655815C1 |
Изобретение относится к микробиологии и клинической лабораторной диагностике. Способ количественного определения антиоксидантной активности микроорганизмов заключается в том, что оценивается антиоксидантная активность бульонной культуры микроорганизмов или взвеси клеток микроорганизмов, выращенных на твердой питательной среде. В качестве окисляемой среды используется раствор лецитина, а в качестве инициаторов перекисного окисления: клетки Staphylococcus aureus, аскорбиновая кислота, ионы железа (II) (в виде водного раствора железа сульфата). Определение антиоксидантной активности по способности ингибировать перекисное окисление липидов проводят добавлением концентрированной ортофосфорной кислоты, и 1% раствора 2-тиобарбитуровой кислоты в диметилсульфоксиде и этаноле (1:1). Окрашенный комплекс экстрагируют н-бутанолом и, отделив бутанольную фазу, спектрофотометрируют, учитывая единицы пропускания при 550 нм, где в качестве кюветы сравнения используют кювету с н-бутанолом. Параллельно приготавливают два контроля, где в пробирки, содержащие субстрат окисления - лецитин, добавлено вещество с известной антиоксидантной активностью, а в другой инициированное перекисное окисление осуществляется без добавления антиоксиданта. Полученные значения антиоксидантного статуса рассчитываются в единицах антиоксидантной активности. 1 пр.
Способ количественного определения антиоксидантной активности микроорганизмов заключается в том, что оценивается антиоксидантная активность бульонной культуры микроорганизмов или взвеси клеток микроорганизмов, выращенных на твердой питательной среде, отличающийся тем, что в качестве окисляемой среды используется раствор лецитина, а в качестве инициаторов перекисного окисления: последовательно добавляются суспензия клеток Staphylococcus aureus в физиологическом растворе, раствор аскорбиновой кислоты, ионы железа (II) (в виде водного раствора железа сульфата), инкубируют в течение 30 мин, при температуре t=42°C, при постоянном встряхивании, после этого закисляют до рН 1 добавлением концентрированной ортофосфорной кислоты и 1%-ного раствора 2-тиобарбитуровой кислоты в диметилсульфоксиде и этаноле (1:1), нагревают в водяной бане при t=70°C в течение 20 мин, охлаждают, добавляют 3 мл н-бутанола, тщательно перемешивают, центрифугируют при 3 тыс. об/мин, отделяют бутанольную фазу и спектрофотометрируют, учитывая единицы пропускания при 550 нм, где в качестве кюветы сравнения используют кювету с н-бутанолом, а в качестве контролей используют пробирки, в которые к субстрату окисления - лецитину в одну добавлено вещество с известной антиоксидантной активностью, а в другой инициированное перекисное окисление осуществляется без добавления антиоксиданта.
| СПОСОБ ВЫЯВЛЕНИЯ У МИКРООРГАНИЗМОВ ПРОТЕКТИВНОГО ДЕЙСТВИЯ В ЭФФЕКТЕ ФЕНТОНА | 2004 |
|
RU2279079C2 |
| US 20070231836 A1, 04.10.2007 | |||
| Лабораторные исследования в ветеринарии | |||
| / Под ред | |||
| В.Я | |||
| АНТОНОВА | |||
| - М.: Колос, 1971, с.420-457. | |||
Авторы
Даты
2012-10-27—Публикация
2011-07-06—Подача