Изобретение относится к микробиологии и может быть использовано в исследовательской работе НИИ и практической работе бактериологических лабораторий клинических учреждений, исследующих свойства микроорганизмов, которые характеризуют межмикробные взаимодействия и играют роль в формировании нормальных микробиоценозов тела человека.
Известна генерация в биологических системах активных форм кислорода, в частности гидроксильного радикала *ОН (Свободные радикалы в биологии / Под ред. У.Прайора. М.: Мир, 1979. Т.1. 318 с.). Его появление связано с реакциями, протекающими при участии пероксида водорода и восстановленных ионов металлов переходной валентности, например железа (II) (реакция Фентона) (Ryan T.P., Aust S.D. The role of iron in oxygen-mediated toxicities// Crit. Rev. Toxicol. - 1992. - Vol.22. P.119-141):
Н2О2+Fe+2=*OH+OH-+Fe+3
Именно при наличии в среде малых концентраций пероксида водорода образуется гидроксильный радикал (*ОН), вызывающий гибель клеток микроорганизмов в результате так называемого эффекта Фентона (Сгибнев А.В. Регуляция активности бактериальной каталазы в межмикробных взаимодействиях//Дисс....канд. биол. наук. - Оренбург. 2002. - 150 с.) путем окислительного повреждения ДНК (Смирнова Г.В., Музыка Н.Г., Глуховченко М.Н., Октябрьский О.Н. Перекись водорода модулирует внутриклеточные уровни тиолов и калия в клетках Escherichia coli// Микробиология. 1998. Т.67. №5. С.594-600.).
В микробиоценозах тела человека присутствуют микроорганизмы, которые, вырабатывая пероксид водорода, тем самым препятствуют заселению биотопа аллохтонными микроорганизмами (Hillier S.L., Krohn M.A., Klebanoff S.J., Eschenbach D.A. The relationship of hydrogen peroxide-producing lactobacilli to bacterial vaginosis and genital microflora in pregnant women// Obstet. Gynekol. - 1992. - Vol.79, №3. - Р.369-373). В то же время автохтонные микроорганизмы в микробиоценозах достаточно устойчивы к воздействию пероксида водорода, продуцируемого микробами. Их устойчивость к высоким концентрациям пероксида водорода объясняется стимуляцией каталазной активности (Menendez M.C., Ainsa J.A., Martin С., Garcia M.J. katGI and katGII encode two different catalases-peroxidases in Mycobacterium fortuitum./ J. Bacteriol. 1997. Vol.179. (22). P.6880-6886), тогда как устойчивость микроорганизмов при влиянии гидроксильного радикала не связана с каталазной активностью (McCormick M.L., Buettner G.R., Britigan B.E. Endogenous superoxide dismutase levels regulate iron-dependent hydroxyl radical formation in Escherichia coli exposed to hydrogen peroxide// J. Bacteriol. 1998 V.180(3), P.622-625) и может определяться межбактериальными взаимодействиями.
Задачей заявляемого технического решения является создание способа выявления у микроорганизмов протективного действия в эффекте Фентона.
Для решения указанной задачи в заявляемом способе выявления у микроорганизмов протективного действия в эффекте Фентона исследуемую культуру микроорганизмов выращивают в жидкой питательной среде, отделяют супернатант от микробных клеток центрифугированием, параллельно готовят контроль, представляющий жидкую питательную среду, далее каждую из проб обрабатывают хлороформом и отделяют супернатант от хлороформа центрифугированием, затем в опытную пробу и контроль добавляют тест-культуру Staphylococcus aureus ГИСК №201108, инкубируют, отделяют клетки тест-культуры центрифугированием и готовят из них микробную взвесь, в каждую из проб добавляют раствор пероксида водорода и инкубируют, отделяют клетки тест-культуры центрифугированием, добавляют к ним питательную среду, инкубируют, измеряют оптическую плотность выросших культур в опытной и контрольной пробах, определяют степень прироста биомассы тест-культуры в опыте по формуле
П=[(ОДоп-ОДк]/ОДк]·100%,
где П - степень прироста биомассы тест-культуры в опыте по сравнению с контролем;
ОДк - оптическая плотность тест-культуры в контроле;
ОДоп - оптическая плотность тест-культуры в опыте,
и затем судят о наличии или отсутствии у исследуемой культуры микроорганизмов протективного действия в эффекте Фентона по степени прироста биомассы тест-культуры в опыте.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Авторами экспериментально установлено новое свойство микроорганизмов - способность предохранять микроорганизмы от окислительного действия эффекта Фентона, возникающего при наличии в среде малых концентраций пероксида водорода.
При изучении влияния супернатантов на выживание микроорганизмов под действием малых концентраций пероксида водорода авторами была обнаружена способность различных видов микроорганизмов предохранять другие микроорганизмы, заселяющие данный биотоп, от окислительного действия эффекта Фентона. В результате этих исследований было сделано предположение о наличии у микроорганизмов веществ, способных предохранять микроорганизмы от окислительного действия активных форм кислорода, в частности гидроксильного радикала, образующегося в результате взаимодействия пероксида водорода с ионами железа (II). Данное предположение было подтверждено проведенными исследованиями.
На первом этапе исследований были определены концентрации пероксида водорода, вызывающие эффект Фентона. Для этого готовили взвеси из музейных культур Staphylococcus aureus ATCC 6538P и Staphylococcus epidermidis CCM 2124 (способ приготовления взвесей: 24-часовую агаровую культуру микроорганизмов смывали стерильным 0,9% раствором хлорида натрия и готовили микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46). К 0,4 мл полученных микробных взвесей добавляли по 0,8 мл раствора пероксида водорода в концентрациях от 0,5 до 60 мМ с интервалом в 5 мМ, инкубировали в течение 30 минут при 37°С. Инкубированные смеси центрифугировали (3000 g в течение 15 минут), отделенные клетки культур микроорганизмов дважды отмывали стерильным 0,9% раствором хлорида натрия и готовили из них микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46. К 0.4 мл полученных микробных взвесей добавляли 2,6 мл жидкой питательной среды (мясопептонный бульон) и инкубировали в течение 3-5 часов при 37°С при периодическом перемешивании, затем измеряли оптическую плотность бульонных культур в опыте и контроле при 591 нм на СФ-46. Результаты исследований представлены на чертеже, отражающем выживаемость культур Staphylococcus aureus ATCC 6538P и Staphylococcus epidermidis CCM 2124 в зависимости от концентрации пероксида водорода.
Как видно из данных, представленных на чертеже, концентрации пероксида водорода, вызывающие эффект Фентона, составляют 0,5-20 мМ.
На следующем этапе исследования культуры Corynebacterium minutissimum, С. aquaticum, Staphylococcus epidermidis, S. aureus, Lactobacillus sp., выделенные из женского репродуктивного тракта, и музейные штаммы Staphylococcus epidermidis CCM 2124 и S. aureus ATCC 6538P выращивали в жидкой питательной среде (для каждого вида микроорганизма использовали соответствующий тип питательной среды) при 37°С в течение 24 часов. Бульонные культуры микроорганизмов центрифугировали (3000 g в течение 15 минут), супернатант отделяли от бактериальных клеток. Супернатанты различных микроорганизмов обрабатывали хлороформом в течение часа (0,2 мл хлороформа на 2 мл супернатанта). Параллельно готовили контрольные пробы - жидкие питательные среды (для каждой пробы соответствующий тип питательной среды) обрабатывали хлороформом в течение часа (0,2 мл хлороформа на 2 мл среды). Центрифугировали контрольные и опытные пробы для удаления хлороформа (3000 g в течение 15 минут). В опытные пробирки разливали по 0,8 мл приготовленных супернатантов, в контрольные - 0,8 мл жидкой питательной среды, обработанной хлороформом. В опытные и контрольные пробирки добавляли по 0,4 мл микробной взвеси культур микроорганизмов Staphylococcus aureus ATCC 6538P и Staphylococcus epidermidis CCM 2124 (способ приготовления взвесей: 24-часовую агаровую культуру микроорганизмов смывали стерильным 0,9% раствором хлорида натрия и готовили микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46). Полученные смеси инкубировали в течение 40-60 минут при 37°С. Инкубированные смеси центрифугировали (3000 g в течение 15 минут), отделенные клетки культур микроорганизмов дважды отмывали стерильным 0,9% раствором хлорида натрия и готовили из них микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46. К 0,4 мл полученных микробных взвесей добавляли по 0,8 мл раствора пероксида водорода в концентрациях от 0,5 до 20 мМ с интервалом в 5 мМ, инкубировали в течение 30 минут при 37°С. Инкубированные смеси центрифугировали (3000 g в течение 15 минут), отделенные клетки культур микроорганизмов дважды отмывали стерильным 0,9% раствором хлорида натрия и готовили из них микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46. К 0,4 мл полученных микробных взвесей добавляли 2,6 мл жидкой питательной среды (мясопептонного бульона) и инкубировали в течение 3-5 часов при 37°С и периодическом перемешивании, затем измеряли оптическую плотность выросших культур опытных и контрольных проб при 591 нм на СФ-46 и определяли прирост биомассы тест-культур в опыте по сравнению с контролем. Результаты исследований приведены в таблицах 1 и 2.
Как видно из таблиц, супернатанты различных видов микроорганизмов влияли на выживаемость Staphylococcus aureus ATCC 6538P и Staphylococcus epidermidis CCM 2124 в условиях действия эффекта Фентона, а именно повышали ее, на основе чего авторами был сделан вывод о протективном действии исследуемых культур микроорганизмов в эффекте Фентона. Наибольшее протективное действие исследуемых культур микроорганизмов по отношению к тест-штаммам Staphylococcus aureus ATCC 6538P и Staphylococcus epidermidis CCM 2124 от эффекта Фентона было зарегистрировано в культуральной среде с концентрацией пероксида водорода 10 мМ.
Авторами были проведены исследования по выбору из Staphylococcus aureus ATCC 6538P и Staphylococcus epidermidis CCM 2124 индикаторной культуры, позволяющей тестировать наличие или отсутствие у исследуемых микроорганизмов протективного действия в эффекте Фентона.
Авторами в качестве тест-культуры был выбран штамм Staphylococcus aureus ATCC 6538P на основании большей его чувствительности к повреждающему действию эффекта Фентона и большей устойчивостью его к высоким концентрациям пероксида водорода по сравнению с Staphylococcus epidermidis (см. чертеж). Штамм депонирован в ГИСК им. Л.А.Тарасевича под регистрационным номером 201108 (Каталог штаммов Всесоюзного музея патогенных бактерий, вып.1. - М., 1982).
Предлагаемый штамм Staphylococcus aureus ATCC 6538P растет на простых питательных средах в виде желтых непрозрачных колоний диаметром 2-3 мм, грамположительный, неспорообразующий, микроаэрофил, каталазоположительный, растет на твердых питательных средах с 10-15% хлорида натрия, образует кислоту из сахарозы, мальтозы, D-маннитола, D-маннозы, D-трегалозы, α-лактозы, D-галактозы, β-D-фруктозы, D-рибозы, α-гемолитический, коагулазоположительный, восстанавливает нитраты, продуцирует гиалуронидазу щелочную фосфатазу, аргинингидролазу, уреазу, фибринолизин, β-гликозидазу, дезоксирибонуклеазу, термоустойчивую нуклеазу, фактор слипания.
Способ осуществляется следующим образом:
1. Исследуемые культуры микрорганизмов выращивают в 2-3 мл жидкой питательной среды (для каждого вида микроорганизмов используется соответствующий тип питательной среды) при 37°С в течение 24 часов.
2. Бульонные культуры центрифугируют (3000 g в течение 15 минут), супернатанты отделяют от микробных клеток.
3. Супернатанты обрабатывают хлороформом в течение часа (0,2 мл хлороформа на 2 мл пробы).
4. Параллельно готовят контрольную пробу - жидкую питательную среду (для каждого вида микроорганизма соответствующий тип питательной среды), обработанную хлороформом в течение часа (0,2 мл хлороформа на 2 мл пробы).
5. Каждую из проб центрифугированием отделяют от хлорофорт (3000 g в течение 15 минут).
6. В опытную пробирку разливают 0,8 мл супернатантов, в контрольную - 0,8 мл жидкой питательной среды, обработанной хлороформом.
7. В опытную и контрольную пробы добавляют по 0,4 мл взвеси S. aureus (способ приготовления взвеси: 24-часовую агаровую культуру S. aureus смывают 0,9% раствором хлорида натрия и готовят микробную взвесь, оптическая плотность которой соответствует 0,27 при 591 нм на СФ-46).
8. Инкубируют опытную и контрольную пробы в течение 40-60 минут при 37°С.
9. После инкубации опытную и контрольную пробы центрифугируют (3000g в течение 15 минут), отделенные клетки тест-культуры S. aureus дважды отмывают 0,9% раствором хлорида натрия центрифугированием (3000g в течение 15 минут) и готовят микробную взвесь, оптическая плотность которой соответствует 0,27 при 591 нм на СФ-46.
10. В каждую из проб объемом 0,4 мл добавляют по 0,8 мл раствора пероксида водорода в концентрации 10 мМ и инкубируют в течение 30 минут при 37°С.
11. После инкубации опытную и контрольную пробы центрифугируют (3000g в течение 15 минут), отделенные клетки тест-культуры дважды отмывают стерильным 0,9% раствором хлорида натрия и готовят из них микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46.
12. В каждую из проб объемом 0,4 мл добавляют 2,6 мл мясопептонного бульона и инкубируют в течение 3-5 часов при 37°С и периодическом помешивании, затем измеряют оптическую плотность выросших культур микроорганизмов в опытной и контрольной пробах при 591 нм на СФ-46.
13. Определяют степень прироста биомассы тест-культуры в опыте по формуле:
П=[(ОДоп-ОДк]/ОДк]·100%,
где П - степень прироста тест-культуры в опыте по сравнению с контролем;
ОДк - оптическая плотность тест-культуры в контроле;
ОДоп - оптическая плотность тест-культуры в опыте и затем судят о наличии или отсутствии у исследуемой культуры микроорганизмов протективного действия в эффекте Фентона по степени прироста биомассы тест-культуры в опыте.
Примеры конкретного выполнения способа
Пример 1. Из влагалища здоровой женщины выделен представитель нормофлоры Corynebacterium minutissimum. Исследуемую культуру выращивали в жидкой питательной среде (мясопептонный бульон) 24 часа при 37°С, отделяли супернатант, обрабатывали его хлороформом в течение часа (0,2 мл хлороформа на 2 мл супернатанта). Параллельно готовили контрольную пробу - жидкую питательную среду (мясопептонный бульон), обрабатывали хлороформом в течение часа (0,2 мл хлороформа на 2 мл среды). Центрифугировали контрольную и опытную пробы для удаления хлороформа (3000 g в течение 15 минут). В опытные пробирки разливали по 0,8 мл приготовленных супернатантов, в контрольные - 0,8 мл жидкой питательной среды, обработанной хлороформом. В опытные и контрольные пробирки добавляли по 0,4 мл микробной взвеси культуры микроорганизма Staphylococcus aureus ATCC 6538 Р (способ приготовления взвеси: 24-часовую агаровую культуру микроорганизма смывали стерильным 0,9% раствором хлорида натрия и готовили микробную взвесь, оптическая плотность которой соответствует 0,27 при 591 нм на СФ-46). Инкубировали опытную и контрольную пробы в течение часа при 37°С. Инкубированные смеси центрифугировали (3000 g в течение 15 минут), отделенные клетки тест-культуры дважды отмывали стерильным 0,9% раствором хлорида натрия и готовили из них микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46. К 0,4 мл полученных микробных взвесей добавляли по 0,8 мл раствора пероксида водорода в концентрации 10 мМ, инкубировали в течение 30 минут при 37°С. Инкубированные смеси центрифугировали (3000 g в течение 15 минут), отделенные клетки культур микроорганизмов дважды отмывали стерильным 0,9% раствором хлорида натрия и готовили из них микробные взвеси, оптическая плотность которых соответствовала 0,27 при 591 нм на СФ-46. К 0,4 мл полученных микробных взвесей добавляли 2,6 мл мясопептонного бульона и инкубировали в течение 5 часов при 37°С и периодическом помешивании, затем измеряли оптическую плотность выросших культур в опыте и контроле при 591 нм на СФ-46 и судили о наличии или отсутствии у исследуемой культуры микроорганизмов способности предохранять микроорганизмы от действия эффекта Фентона по формуле:
П(С. minutissimum)=[(0,179-0,145)/0,145]·100%=20,1%,
где П(С. minutissimum) - степень прироста тест-культуры в опыте с Corynebacterium minutissimum;
0,145 - оптическая плотность тест-культуры в контроле;
0,179 - оптическая плотность тест-культуры в опыте с С. minutissimum.
Выявлено, что супернатант С. minutissimum повышал выживаемость тест-штамма в условиях действия эффекта Фентона, на основании чего был сделан вывод о способности исследуемой культуры предохранять тест-штамм от активных форм кислорода.
Пример 2. С кожи здорового мужчины выделены представитель микрофлоры Staphylococcus epidermidis. Для выявления у выделенной культуры микроорганизма протективного действия в эффекте Фентона были проведены исследования согласно примеру 1. Степень прироста тест-культуры составила 0% (оптическая плотность тест-культуры в контроле - 0.145, в опыте - 0,145).
На основании полученных результатов сделан вывод о отсутствии у исследуемой культуры протективного действия в эффекте Фентона.
Таким образом, использование предлагаемого способа позволяет выявить новое свойство микроорганизмов - протективное действие в эффекте Фентона, возникающего при наличии в среде малых концентраций пероксида водорода, которое может быть использовано для изучения физиологии микробных клеток и расшифровки механизмов взаимодействия микроорганизмов в биоценозах.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ У БАКТЕРИЙ ИНГИБИТОРОВ КАТАЛАЗЫ МИКРООРГАНИЗМОВ | 2000 |
|
RU2180353C2 |
| Способ выявления у микроорганизмов протективного действия на молекулу гемоглобина | 2017 |
|
RU2687061C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНТИОКСИДАНТНОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2011 |
|
RU2465593C1 |
| СПОСОБ ИНДИВИДУАЛЬНОГО ВЫБОРА ЭФФЕКТИВНОГО ХИМИОТЕРАПЕВТИЧЕСКОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ МИКРОБНОЙ ЭТИОЛОГИИ | 2003 |
|
RU2273854C2 |
| СПОСОБ ВЫБОРА ШТАММОВ МИКРООРГАНИЗМОВ-ДЕСТРУКТОРОВ НЕФТИ И НЕФТЕПРОДУКТОВ | 2009 |
|
RU2426781C2 |
| СПОСОБ ДЕЗИНФЕКЦИИ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ | 2006 |
|
RU2321426C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЛОНИЗАЦИОННОЙ РЕЗИСТЕНТНОСТИ ЭКОЛОГИЧЕСКОЙ НИШИ ТЕЛА ЧЕЛОВЕКА | 2000 |
|
RU2175673C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛАКТОФЕРРИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2003 |
|
RU2245923C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ПРОДУКЦИИ МИКРООРГАНИЗМАМИ ИНГИБИТОРОВ АНТИМИКРОБНОГО БЕЛКА ТРОМБОЦИТОВ (β-ЛИЗИНА) | 2007 |
|
RU2351654C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИКАРНОЗИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1998 |
|
RU2132879C1 |
Изобретение относится к биотехнологии. Способ осуществляется следующим образом: исследуемую культуру микроорганизмов выращивают в жидкой питательной среде, отделяют супернатант от микробных клеток центрифугированием, параллельно готовят контроль, представляющий жидкую питательную среду. Далее каждую из проб обрабатывают хлороформом и отделяют супернатант от хлороформа центрифугированием. Затем в опытную пробу и контроль добавляют тест-культуру Staphylococcus aureus ГИСК № 201108, инкубируют, отделяют клетки тест-культуры центрифугированием и готовят из них микробную взвесь. При этом в каждую из проб добавляют раствор пероксида водорода и инкубируют, отделяют клетки тест-культуры центрифугированием, добавляют к ним питательную среду, инкубируют. После всего вышесказанного измеряют оптическую плотность выросших культур в опытной и контрольной пробах, определяют степень прироста биомассы тест-культуры в опыте по формуле П=[(ОДоп-ОДк]/ОДк]·100%, где П - степень прироста биомассы тест-культуры в опыте по сравнению с контролем; ОДк - оптическая плотность тест-культуры в контроле; ОДоп - оптическая плотность тест-культуры в опыте, и затем судят о наличии или отсутствии у исследуемой культуры микроорганизмов протективного действия в эффекте Фентона по степени прироста биомассы тест-культуры в опыте. Способ позволяет выявить и изучить новое свойство микроорганизмов - протективное действие в эффекте Фентона, возникающего при наличии в среде малых концентраций пероксида водорода, которое может быть использовано для изучения физиологии микробных клеток и расшифровки механизмов взаимодействия микроорганизмов в биоценозах. 1 ил., 2 табл.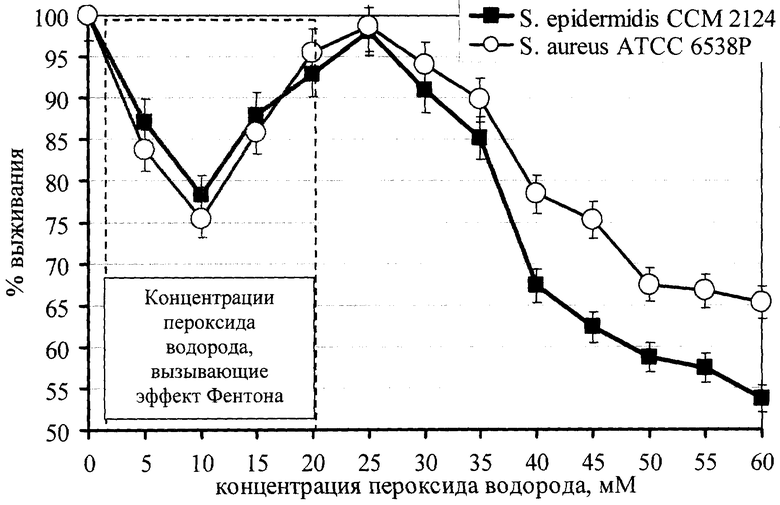
Способ выявления у микроорганизмов протективного действия в эффекте Фентона, заключающийся в том, что исследуемую культуру микроорганизмов выращивают в жидкой питательной среде, отделяют супернатант от микробных клеток центрифугированием, параллельно готовят контроль, представляющий жидкую питательную среду, далее каждую из проб обрабатывают хлороформом и отделяют супернатант от хлороформа центрифугированием, затем в опытную пробу и контроль добавляют тест-культуру Staphylococcus aureus ГИСК № 201108, инкубируют, отделяют клетки тест-культуры центрифугированием и готовят из них микробную взвесь, в каждую из проб добавляют раствор пероксида водорода и инкубируют, отделяют клетки тест-культуры центрифугированием, добавляют к ним питательную среду, инкубируют, измеряют оптическую плотность выросших культур в опытной и контрольной пробах, определяют степень прироста биомассы тест-культуры в опыте по формуле
П=[(ОДоп-ОДк]/ОДк]•100%,
где П - степень прироста биомассы тест-культуры в опыте по сравнению с контролем;
ОДк - оптическая плотность тест-культуры в контроле;
ОДоп - оптическая плотность тест-культуры в опыте,
и затем судят о наличии или отсутствии у исследуемой культуры микроорганизмов протективного действия в эффекте Фентона по степени прироста биомассы тест-культуры в опыте.
| RU 2163021 С2, 10.02.2001 | |||
| ПОЛИМЕРЫ АЛКИЛАРИЛПОЛИЭФИРОСПИРТОВ, ОБЛАДАЮЩИЕ АНТИОКИСЛИТЕЛЬНЫМИ СВОЙСТВАМИ | 1994 |
|
RU2147235C1 |
| СПОСОБ ВЫЯВЛЕНИЯ У БАКТЕРИЙ ИНГИБИТОРОВ КАТАЛАЗЫ МИКРООРГАНИЗМОВ | 2000 |
|
RU2180353C2 |
Авторы
Даты
2006-06-27—Публикация
2004-08-09—Подача