ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основании 35 U.S.C. $ 119(e) согласно заявке U.S. S.N. 60/870821, поданной 19 декабря 2006 г., которая включена в данное описание посредством ссылки во всей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к органическим соединениям, которые можно использовать для лечения и/или профилактики млекопитающего, в особенности к ингибиторам белков IAP, используемым для лечения раковых заболеваний.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Апоптоз или программируемая гибель клеток представляет собой процесс, который регулируется генетическими и биохимическими механизмами и играет важную роль в развитии и гомеостазе у беспозвоночных и позвоночных. Отклонения в процессе апоптоза, которые приводят к преждевременной гибели клеток, связывают с рядом нарушений развития. Недостаточность апоптоза, которая приводит к отсутствию гибели клеток, связывают с раком и хроническими вирусными инфекциями (Thompson et al., (1995) Science 267, 1456-1462).
К эффекторным молекулам, играющим ключевую роль в апоптозе, относятся каспазы (цистеинсодержащие аспартат-специфичные протеазы). Каспазы представляют собой активные протеазы, которые после активации расщепляют белки, присутствующие внутри живых клеток, по участкам, следующим за остатками аспарагиновой кислоты. Поскольку каспазы являются такими активными протеазами, необходим строгий контроль за данным семейством белков, чтобы предотвратить преждевременную гибель клеток. Как правило, каспазы синтезируются в виде преимущественно неактивных зимогенов, которые активируются в результате протеолитического процессинга. Протеолитический процессинг является только одним из путей регуляции каспаз. Второй механизм опосредуется семейством белков, которые связывают и ингибируют каспазы.
Семейство молекул, которые ингибируют каспазы, относится к ингибиторам апоптоза (IAP) (Deveraux et al., J Clin Immunol (1999), 19:388-398). IAP изначально были обнаружены в бакуловирусе благодаря их способности функционально замещать белок P35, кодируемый антиапоптотическим геном (Crook et al. (1993) J Virology 67, 2168-2174). IAP обнаружены в разных организмах, от дрозофилы до человека. Независимо от происхождения IAP, их структура содержит от одного до трех доменов повторов IAP бакуловируса (BIR), и большинство из них также содержит карбокси-концевой пальчиковый мотив RING. Сам домен BIR представляет собой цинк-связывающий домен, который состоит примерно из 70 остатков и содержит 4 альфа-спиральных участка и 3 бета-складчатых участка, в том числе остатки цистеина и гистидина, которые координируют ион цинка (Hinds et al., (1999) Nat. Struct. Biol. 6, 648-651). Считается, что именно домен BIR обуславливает антиапоптотический эффект путем ингибирования каспаз и, как следствие, апоптоза. Например, IAP, связанный с человеческой X-хромосомой (XIAP), ингибирует каспазу 3, каспазу 7 и Apaf-1-цитохром C-опосредованную активацию каспазы 9 (Deveraux et al., (1998) EMBO J. 17, 2215-2223). Каспазы 3 и 7 ингибируются доменом BIR2 XIAP, тогда как за ингибирование активности каспазы 9 отвечает домен BIR3 XIAP. XIAP экспрессируется повсеместно в большинстве взрослых и зародышевых тканей (Liston et al., Nature, 1996, 379(6563):349), а в ряде опухолевых клеточных линий серии NCI 60 наблюдается повышенный уровень его экспрессии (Fong et al., Genomics, 2000, 70:113; Tamm et al., Clin. Cancer Res. 2000, 6(5): 1796). Показано, что сверхэкспрессия XIAP в опухолевых клетках обеспечивает защиту против ряда проапоптотических стимулов и устойчивость к химиотерапии (LaCasse et al., Oncogene, 1998, 17(25): 3247). С этими данными согласуются результаты, свидетельствующие о наличии хорошей корреляции между уровнем белка XIAP и выживанием у пациентов с острым миелогенным лейкозом (Tamm et al., supra). Показано, что понижающая регуляция экспрессии XIAP под действием антисмысловых олигонуклеотидов сенсибилизирует опухолевые клетки к широкому ряду проапоптотических средств, вызывающих гибель клеток, как in vitro, так и in vivo (Sasaki et al., Cancer Res., 2000, 60(20):5659; Lin et al., Biochem J., 2001, 353:299; Hu et al., Clin. Cancer Res., 2003, 9(7):2826). Также показано, что Smac/DIABLO-производные пептиды сенсибилизируют ряд различных клеточных линий к апоптозу, индуцированному разными проапоптотическиими средствами (Arnt et al., J. Biol. Chetn., 2002, 277(46):44236; Fulda et al., Nature Med., 2002, 8(8): 808; Guo et al., Blood,2002, 99(9):3419; Vucic et al., J. Biol. Chem.,2002, 277(14): 12275; Yang et al., Cancer Res., 2003, 63(4):831).
Меланомный IAP (ML-IAP) представляет собой IAP, который не детектируется в большинстве нормальных взрослых тканей, но при меланоме подвергается интенсивной повышающей регуляции (Vucic et al., (2000) Current Bio 10: 1359-1366). В результате определения белковой структуры обнаружена значительная гомология ML-IAP BIR и пальчиковых доменов RING и соответствующих доменов, присутствующих в человеческих XIAP, C-IAP1 и C-IAP2. Домен BIR ML-IAP имеет максимальную степень подобия по отношению к BIR2 и BIR3 XIAP, C-IAP1 и C-IAP2, и, по данным делеционного анализа, отвечает за ингибирование апоптоза. Кроме того, Vucic et al. демонстрируют, что ML-IAP может ингибировать апоптоз, индуцированный химиотерапевтическим средством. Анализ таких средств, как адриамицин и 4-третичный бутилфенол (4-TBP), в системе меланомных клеточных культур со сверхэкспрессией ML-IAP показал, что химиотерапевтические средства уничтожают такие клетки гораздо менее эффективно, чем нормальные контрольные меланоциты. Антиапоптотическая активность ML-IAP отчасти обусловлена ингибированием каспаз 3 и 9. ML-IAP не ингибирует в значительной степени каспазы 1, 2, 6 или 8.
Поскольку апоптоз представляет собой путь, строго контролируемый несколькими взаимодействующими факторами, открытие, что IAP, в свою очередь, тоже регулируются, не является неожиданным. У фруктовой мушки дрозофилы белки Reaper (rpr), Head Involution Defective (hid) и GRIM физически взаимодействуют с семейством IAP дрозофилы и ингибируют их антиапоптотическую активность. У млекопитающих белки SMAC/DIABLO блокируют IAP, обеспечивая протекание апоптоза. Показано, что в процессе нормального апоптоза происходит процессинг SMAC с образованием активной формы и высвобождением ее из митохондрий в цитоплазму, где она физически связывается с IAP и предотвращает связывание IAP с каспазой. Ингибирование IAP позволяет каспазе оставаться активной и, как следствие, обеспечивает протекание апоптоза. Интересно, что изучение гомологии последовательностей ингибиторов IAP позволило сделать вывод, что существует четыре аминокислотных мотива на N-концах процессированных, активных белков. По-видимому, данный тетрапептид связывается гидрофобным карманом домена BIR, препятствуя связыванию домена BIR с каспазами (Chai et al., (2000) Nature 406:855-862, Liu et al., (2000) Nature 408: 1004-1008, Wu et al., (2000) Nature 408 1008-1012).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение предлагает новые ингибиторы белков IAP, имеющих общую формулу (I)
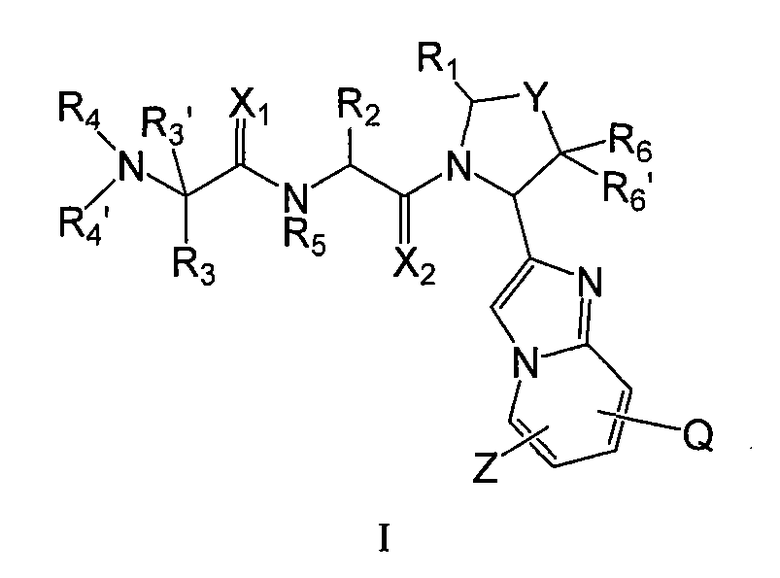
где
каждый из X1 и X2 независимо обозначает O или S;
Y обозначает связь, (CR7R7)m, O или S;
Z обозначает H, галоген, гидроксил, карбоксил, амино, нитро, циано, алкил, карбоцикл или гетероцикл; где указанные алкил, карбоцикл и гетероцикл необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, необязательно замещенный алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-;
Q обозначает H, галоген, гидроксил, карбоксил, амино, нитро, циано, алкил, карбоцикл или гетероцикл; где указанные алкил, карбоцикл и гетероцикл необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, необязательно замещенный алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-;
R1 обозначает H, OH или алкил; или R и R2 вместе образуют 5-8-членный гетероцикл;
R2 обозначает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен заместителями, выбранными из группы, включающей галоген, гидроксил, оксо, тион, меркапто, карбоксил, алкил, галогеналкил, ацил, алкокси, алкилтио, сульфонил, амино и нитро, где указанные алкил, ацил, алкокси, алкилтио и сульфонил необязательно замещены такими заместителями, как гидрокси, меркапто, галоген, амино, алкокси, гидроксиалкокси и алкоксиалкокси;
R3 обозначает H или алкил, необязательно замещенный галогеном или гидроксилом; или R3 и R4 вместе образуют 3-6-членный гетероцикл;
R3' обозначает H, или R3 и R3' вместе образуют 3-6-членный карбоцикл;
R4 и R4' независимо обозначают H, гидроксил, амино, алкил, карбоцикл, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси или гетероциклоалкилоксикарбонил; где каждый алкил, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси и гетероциклоалкилоксикарбонил необязательно замещен галогеном, гидроксилом, меркапто, карбоксилом, алкилом, алкокси, амино, имино и нитро; или R4 и R4' вместе образуют гетероцикл;
R5 обозначает H или алкил;
каждый из R6 и R6' независимо обозначает H, алкил, арил или аралкил;
R7 обозначает H, циано, гидроксил, меркапто, галоген, нитро, карбоксил, амидино, гуанидино, алкил, карбоцикл, гетероцикл или -U-V; где U обозначает -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-, а V обозначает алкил, карбоцикл или гетероцикл; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; и алкил, карбоцикл и гетероцикл необязательно замещены такими заместителями, как гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, галогензамещенный алкил, амино, циано нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл;
R8 обозначает H, алкил, карбоцикл или гетероцикл, где одна или несколько групп CH2 или CH указанного алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8) или -C(O)-; указанные алкил, карбоцикл и гетероцикл необязательно замещены такими заместителями, как гидроксил, алкокси, ацил, галоген, меркапто, оксо (=O), карбоксил, ацил, галогензамещенный алкил, амино, циано нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл; и
m обозначает число от 0 до 4.
В другом аспекте данное изобретение предлагает композиции, содержащие соединения формулы I и носитель, разбавитель или эксципиент.
В другом аспекте данное изобретение предлагает способ индуцирования апоптоза в клетке, включающий введение в указанную клетку соединения формулы I.
В другом аспекте данное изобретение предлагает способ сенсибилизации клетки к апоптотическому сигналу, включающий введение в указанную клетку соединения формулы I.
В другом аспекте данное изобретение предлагает способ ингибирования связывания белка IAP с белком каспазой, включающий контактирование указанного белка IAP с соединением формулы I.
В другом аспекте данное изобретение предлагает способ лечения заболевания или состояния, связанного со сверхэкспрессией белка IAP, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения формулы I.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
"Ацил" представляет собой карбонил, содержащий заместитель, и имеет формулу -C(O)-R, в которой R обозначает H, алкил, карбоцикл, гетероцикл, карбоциклзамещенный алкил или гетероциклзамещенный алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные далее значения. Ацильные группы включают алканоил (например, ацетил), ароил (например, бензоил) и гетероароил.
Если не указано иначе, "алкил" представляет собой разветвленную или неразветвленную, насыщенную или ненасыщенную (т. е. алкенил, алкинил) алифатическую углеводородную группу, содержащую до 12 атомов углерода. В составе другого термина, например, "алкиламино", алкильный фрагмент может обозначать насыщенную углеводородную цепь, однако он также может включать ненасыщенные углеводородные цепи, такие как "алкениламино" и "алкиниламино". Примерами конкретных алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 2,2-диметилбутил, н-гептил, 3-гептил, 2-метилгексил и т. п. Термины "низший алкил", "C1-C4 алкил" и "алкил, состоящий из 1-4 атомов углерода", являются синонимами и используются как взаиимозаменяемые для обозначения метила, этила, 1-пропила, изопропила, циклопропила, 1-бутила, втор-бутила или т-бутила. Если специально не определено, замещенные алкильные группы могут содержать один, два, три или четыре заместителя, которые могут быть одинаковыми или разными. Если не указано иначе, примерами заместителей являются галоген, амино, гидроксил, защищенный гидроксил, меркапто, карбокси, алкокси, нитро, циано, амидино, гуанидино, мочевина, сульфонил, сульфинил, аминосульфонил, алкилсульфониламино, арилсульфониламино, аминокарбонил, ациламино, алкокси, ацил, ацилокси, карбоцикл, гетероцикл. Примеры вышеуказанных замещенных алкильных групп включают, без ограничения; цианометил, нитрометил, гидроксиметил, тритилоксиметил, пропионилоксиметил, аминометил, карбоксиметил, карбоксиэтил, карбоксипропил, алкилоксикарбонилметил, аллилоксикарбониламинометил, карбамоилоксиметил, метоксиметил, этоксиметил, т-бутоксиметил, ацетоксиметил, хлорметил, бромметил, иодметил, трифторметил, 6-гидроксигексил, 2,4-дихлор(н-бутил), 2-амино(изо-пропил), 2-карбамоилоксиэтил и т. п. Алкильная группа также может быть замещена карбоциклической группой. Примеры включают циклопропилметильную, циклобутилметильную, циклопентилметильную и циклогексилметильную группы, а также соответствующие -этильные, -пропильные, -бутильные, -пентильные, -гексильные группы и др. Замещенные алкилы включают замещенные метилы, например, метильную группу, замещенную такими же заместителями, как и "замещенная Cn-Cm алкильная" группа. Примеры замещенной метильной группы включают такие группы, как гидроксиметил, замещенный гидроксиметил (например, тетрагидропиранилоксиметил), ацетоксиметил, карбамоилоксиметил, трифторметил, хлорметил, карбоксиметил, бромметил и иодметил.
"Амидин" представляет собой группу -C(NH)-NHR, в которой R обозначает H, алкил, карбоцикл, гетероцикл, карбоциклзамещенный алкил или гетероциклзамещенный алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные выше значения. Конкретным примером амидина является группа -NH-C(NH)-NH2.
Термин "амино" относится к первичным (т. e. -NH2), вторичным (т. е. -NRH) и третичным (т. е. -NRR) аминам, в которых R обозначает H, алкил, карбоцикл, гетероцикл, карбоциклзамещенный алкил или гетероциклзамещенный алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные выше значения. Конкретными примерами вторичных и третичных аминов являются алкиламин, диалкиламин, ариламин, диариламин, аралкиламин и диаралкиламин, где алкил имеет указанные в данном описании значения и является необязательно замещенным. Конкретные примеры вторичных и третичных аминов включают метиламин, этиламин, пропиламин, изопропиламин, фениламин, бензиламин диметиламин, диэтиламин, дипропиламин и диизопропиламин.
Термин "аминозащитная группа" в данном описании относится к производным, обычно используемым для блокировки или защиты аминогруппы при проведении реакций на других функциональных группах соединения. Примеры таких защитных групп включают карбаматы, амиды, алкильные и арильные группы, имины, а также многие N-гетероатомные производные, которые можно удалить с получением целевой аминогруппы. Конкретными аминозащитными группами являются Boc, Fmoc и Cbz. Другие примеры данных групп можно найти в T. W. Greene и P. G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapter 7; E. Haslam, "Protective Groups in Organic Chemistry", J. G. W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, и T. W. Greene, "Protective Groups in Organic Synthesis", John Wiley и Sons, New York, NY, 1981. Термин "защищенная аминогруппа" относится к аминогруппе, замещенной одной из вышеуказанных аминозащитных групп.
Термин "арил", используемый отдельно или в составе другого термина, относится к карбоциклической ароматической группе, конденсированной или неконденсированной, которая содержит указанное число атомов, или, если число атомов не указано, до 14 атомов углерода. Конкретные примеры арильной группы включают фенил, нафтил, бифенил, фенантренил, нафтаценил и т. п. (см., например, Lang's Handbook of Chemistry (Dean, J. A., ed) 13th ed. Table 7-2 [1985]). Конкретным примером арила является фенил. Замещенный фенил или замещенный арил представляет собой фенильную группу или арильную группу, замещенную одним, двумя, тремя, четырьмя или пятью, например 1-2, 1-3 или 1-4, заместителями, выбранными, если не указано иначе, из группы, включающей галоген (F, Cl, Br, I), гидрокси, защищенный гидрокси, циано, нитро, алкил (например C1-C6 алкил), алкокси (например C1-C6 алкокси), бензилокси, карбокси, защищенный карбокси, карбоксиметил, защищенный карбоксиметил, гидроксиметил, защищенный гидроксиметил, аминометил, защищенный аминометил, трифторметил, алкилсульфониламино, алкилсульфониламиноалкил, арилсульфониламино, арилсульфониламиноалкил, гетероциклилсульфониламино, гетероциклилсульфониламиноалкил, гетероциклил, арил или другие указанные группы. В свою очередь, одна или несколько метиновых (CH) и/или метиленовых (CH2) групп в данных заместителях могут быть замещены группой, подобной указанным выше. Примеры "замещенного фенила" включают, без ограничения, моно- или ди(галоген)фенильную группу, такую как 2-хлорфенил, 2-бромфенил, 4-хлорфенил, 2,6-дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 3-хлорфенил, 3-бромфенил, 4-бромфенил, 3,4-дибромфенил, 3-хлор-4-фторфенил, 2-фторфенил и т. п.; моно- или ди(гидрокси)фенильную группу, такую как 4-гидроксифенил, 3-гидроксифенил, 2,4-дигидроксифенил, ихо гидроксизащищенные производные и т. п.; нитрофенильную группу, такую как 3- или 4-нитрофенил; цианофенильную группу, например 4-цианофенил; моно- или ди(низший алкил)фенильную группу, такую как 4-метилфенил, 2,4-диметилфенил, 2-метилфенил, 4-(изопропил)фенил, 4-этилфенил, 3-(н-пропил)фенил и т. п.; моно- или ди(алкокси)фенильную группу, такую как 3,4-диметоксифенил, 3-метокси-4-бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилоксифенил, 3-этоксифенил, 4-(изопропокси)фенил, 4-(т-бутокси)фенил, 3-этокси-4-метоксифенил и т. п.; 3- или 4-трифторметилфенил; моно- или дикарбоксифенил или (защищенную карбокси)фенильную группу, такую как 4-карбоксифенил; моно- или ди(гидроксиметил)фенил или (защищенный гидроксиметил)фенил, такой как 3-(защищенный гидроксиметил)фенил или 3,4-ди(гидроксиметил)фенил; моно- или ди(аминометил)фенил или (защищенный аминометил)фенил, такой как 2-(аминометил)фенил или 2,4-(защищенный аминометил)фенил; или моно- или ди(N-(метилсульфониламино))фенил, такой как 3-(N-метилсульфониламино))фенил. Кроме того, термин "замещенный фенил" относится к дизамещенным фенильным группам, содержащим разные заместители, таким как 3-метил-4-гидроксифенил, 3-хлор-4-гидроксифенил, 2-метокси-4-бромфенил, 4-этил-2-гидроксифенил, 3-гидрокси-4-нитрофенил, 2-гидрокси-4-хлорфенил, и т. п., а также к тризамещенным фенильным группам, содержащим разные заместители, таким как 3-метокси-4-бензилокси-6-метилсульфониламино, 3-метокси-4-бензилокси-6-фенилсульфониламино, и к тетразамещенным фенильным группам, содержащим разные заместители, таким как 3-метокси-4-бензилокси-5-метил-6-фенилсульфониламино. Конкретные примеры замещенной фенильной группы включают 2-хлорфенил, 2-аминофенил, 2-бромфенил, 3-метоксифенил, 3-этоксифенил, 4-бензилоксифенил, 4-метоксифенил, 3-этокси-4-бензилоксифенил, 3,4-диэтоксифенил, 3-метокси-4-бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилокси-6-метилсульфониламинофенил. Конденсированные арильные циклы также могут быть замещены любым количеством, например 1, 2 или 3, заместителей, описанных в данной документе, так же, как и замещенные алкильные группы.
Термины "карбоциклил", "карбоциклильный, "карбоцикл" и "карбоцикло", используемые по отдельности или в составе сложных групп, таких как карбоциклоалкильная группа, относятся к моно-, би- или трициклическим алифатическим фрагментам, содержащим от 3 до 14 атомов углерода, например от 3 до 7 атомов углерода, которые могут быть насыщенными или ненасыщенными, ароматическими или неароматическими. Конкретными примерами насыщенных карбоциклических групп являются циклопропильные, циклобутильные, циклопентильные и циклогексильные группы. Конкретным примером насыщенного карбоцикла является циклопропил. Другим конкретным примером насыщенного карбоцикла является циклогексил. Конкретными примерами ненасыщенных карбоциклов являются ароматические, например, арильные группы, определенные выше, такие как фенил. Термины "замещенный карбоциклил", "замещенный карбоцикл" и "замещенный карбоцикло" относятся к указанным группам, замещенным такими же заместителями, как и "замещенная алкильная" группа.
Термин "карбоксизащитная группа" в данном описании относится к сложноэфирным производным карбоксильной группы, обычно используемым для блокирования или защиты карбоксильной группы при проведении реакции на других функциональных группах соединения. Примеры таких защитных групп карбоксильной группы включают 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2',4,4'-тетраметоксибензгидрил, алкил, такой как т-бутил или т-амил, тритил, 4-метокситритил, 4,4'-диметокситритил, 4,4',4"-триметокситритил, 2-фенилпроп-2-ил, триметилсилил, т-бутилдиметилсилил, фенацил, 2,2,2-трихлорэтил, бета-(триметилсилил)этил, бета-(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)проп-1-ен-3-ил и подобные им фрагменты. Тип карбоксизащитной группы не имеет значения при условии, что дериватизированная карбоксильная группа является стабильной в условиях последующей реакции (реакций), проводимой по другим положениям молекулы и что защитную группу можно удалить в нужный момент, не разрушая остальную часть молекулы. В частности, важно, чтобы карбоксизащищенная молекула не подвергалась воздействию сильных нуклеофильных оснований, таких как гидроксид лития или NaOH, или восстанавливающих условий с использованием высоко активных гидридов металлов, таких как LiAlH4. (Таких жестких условий удаления также следует избегать при удалении аминозащитных групп и гидроксизащитных групп, описанных ниже). Конкретными примерами защитных групп для карбоксильной группы являются алкильные (например, метил, этил, т-бутил), аллильные, бензильные и п-нитробензильные группы. Подобные карбоксизащитные группы, используемые при работе с цефалоспорином, пенициллином и пептидами, также можно использовать для защиты заместителей карбоксильной группы. Другие примеры указанных групп можно найти в T. W. Greene & P. G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, N.Y., 1991, chapter 5; E. Haslam, "Protective Groups in Organic Chemistry", J. G. W. McOmie, Ed., Plenum Press, New York, N.Y., 1973, Chapter 5, и T. W. Greene, "Protective Groups in Organic Synthesis", John Wiley & Sons, New York, NY, 1981, Chapter 5. Термин "защищенный карбокси" относится к карбоксильной группе, замещенной одной из вышеуказанных карбоксизащитных групп.
Термин "гуанидин" относится к группе -NH-C(NH)-NHR, в которой R обозначает H, алкил, карбоцикл, гетероцикл, карбоциклзамещенный алкил или гетероциклзамещенный алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные выше значения. Конкретным примером гуанидина является группа -NH-C(NH)-NH2.
Термин "гидроксизащитная группа" в данном описании относится к производному гидроксильной группы, обычно используемому для блокирования или защиты гидроксильной группы при проведении реакций на других функциональных группах соединения. Примеры таких защитных групп включают тетрагидропиранилокси, бензоил, ацетокси, карбамоилокси, бензил, и силиловые простые эфиры (например, TBS, TBDPS). Другие примеры указанных групп можно найти в T. W. Greene & P. G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapters 2-3; E. Haslam, "Protective Groups in Organic Chemistry", J. G. W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, & T. W. Greene, "Protective Groups in Organic Synthesis", John Wiley & Sons, New York, NY, 1981. Термин "защищенный гидрокси" относится к гидрксильной группе, замещенной одной из вышеуказанных гидроксизащитных групп.
Термины "гетероциклическая группа", "гетероциклический", "гетероцикл", "гетероциклил" или "гетероцикло", используемые по отдельности или в составе сложных групп, таких как гетероциклоалкильная группа, являются взаимозаменяемыми и относятся к моно-, би- или трициклическому, насыщенному или ненасыщенному, ароматическому (гетероарил) или неароматическому циклу, содержащему указанное число атомов, как правило, от 5 до примерно 14 атомов в цикле, где атомы в цикле включают атомы углерода и, по меньшей мере, один гетероатом (атом азота, серы или кислорода), например, от 1 до 4 гетероатомов. Обычно 5-членный цикл содержит от 0 до 2 двойных связей, а 6- или 7-членный цикл содержит от 0 до 3 двойных связей, причем гетероатомы азота или серы могут быть необязательно окисленными (например, SO, SO2) и некоторые гетероатомы азота могут быть необязательно квартенизованы. Конкретными примерами неароматических гетероциклов являются морфолинил (морфолино), пирролидинил, оксиранил, оксетанил, тетрагидрофуранил, 2,3-дигидрофуранил, 2H-пиранил, тетрагидропиранил, тииранил, тиетанил, тетрагидротиетанил, азиридинил, азетидинил, 1-метил-2-пирролил, пиперазинил и пиперидинил. "Гетероциклоалкильная" группа представляет собой определенную выше гетероциклическую группу, ковалентно связанную с определенной выше алкильной группой. Конкретными примерами 5-членных гетероциклов, содержащих атом серы или кислорода и от одного до трех атомов азота, являются тиазолил, в частности тиазол-2-ил и тиазол-2-ил-N-оксид, тиадиазолил, в частности 1,3,4-тиадиазол-5-ил и 1,2,4-тиадиазол-5-ил, оксазолил, например оксазол-2-ил, и оксадиазолил, такой как 1,3,4-оксадиазол-5-ил и 1,2,4-оксадиазол-5-ил. Конкретные примеры 5-членных гетероциклов, содержащих от 2 до 4 атомов азота, включают имидазолил, такой как имидазол-2-ил; триазолил, такой как 1,3,4-триазол-5-ил; 1,2,3-триазол-5-ил, 1,2,4-триазол-5-ил, и тетразолил, такой как 1H-тетразол-5-ил. Конкретными примерами бензоконденсированных 5-членных гетероциклов являются бензоксазол-2-ил, бензтиазол-2-ил и бензимидазол-2-ил. Конкретными примерами 6-членных гетероциклов, содержащих от одного до трех атомов азота и необязательно атом серы или кислорода, являются пиридил, такой как пирид-2-ил, пирид-3-ил и пирид-4-ил; пиримидил, такой как пиримид-2-ил и пиримид-4-ил; триазинил, такой как 1,3,4-триазин-2-ил и 1,3,5-триазин-4-ил; пиридазинил, в частности пиридазин-3-ил и пиразинил. Конкретными примерами являются N-оксиды пиридина и N-оксиды пиридазина, а также пиридил, пиримид-2-ил, пиримид-4-ил, пиридазинил и 1,3,4-триазин-2-ил. Заместители "необязательно замещенных гетероциклов" и другие примеры описанных выше 5- и 6-членных циклических систем можно найти в W. Druckheimer et al., патент США № 4278793. В конкретном воплощении такие необязательно замещенные гетероциклические группы могут быть замещены гидроксилом, алкилом, алкокси, ацилом, галогеном, меркапто, оксо, карбоксилом, ацилом, галогензамещенным алкилом, амино, циано, нитро, амидино и гуанидино.
Термин "гетероарил", используемый отдельно или в составе сложной группы, такой как гетераралкильная группа, относится к моно-, би- или трициклической ароматической системе, содержащей указанное число атомов, где, по меньшей мере, один цикл представляет собой 5-, 6- или 7-членный цикл, содержащий от одного до четырех гетероатомов, выбранных из группы, включающей азот, кислород и серу, в конкретном воплощении, по меньшей мере, один гетероатом представляет собой азот (Lang's Handbook of Chemistry, выше). Данное определение включает все бициклические группы, в которых любой из вышеперечисленных гетероарильных циклов конденсирован с бензольным циклом. Конкретные гетероарилы включают гетероатом азота или кислорода. Нижеследующие циклические системы являются примерами гетероарильных (либо замещенных, либо незамещенных) групп, обозначаемых термином "гетероарил": тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, тиазинил, оксазинил, триазинил, тиадиазинил, оксадиазинил, дитиазинил, диоксазинил, оксатиазинил, тетразинил, тиатриазинил, оксатриазинил, дитиадиазинил, имидазолинил, дигидропиримидил, тетрагидропиримидил, тетразоло[1,5-b]пиридазинил и пуринил, а также бензоконденсированные производные, например бензоксазолил, бензофурил, бензотиазолил, бензотиадиазолил, бензотриазолил, бензоимидазолил и индолил. Конкретными примерами "гетероарила" являются: 1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ила натриевая соль, 1,2,4-тиадиазол-5-ил, 3-метил-1,2,4-тиадиазол-5-ил, 1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 2-гидрокси-1,3,4-триазол-5-ил, 2-карбокси-4-метил-1,3,4-триазол-5-ила натриевая соль, 2-карбокси-4-метил-1,3,4-триазол-5-ил, 1,3-оксазол-2-ил, 1,3,4-оксадиазол-5-ил, 2-метил-1,3,4-оксадиазол-5-ил, 2-(гидроксиметил)-1,3,4-оксадиазол-5-ил, 1,2,4-оксадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-тиол-1,3,4-тиадиазол-5-ил, 2-(метилтио)-1,3,4-тиадиазол-5-ил, 2-амино-1,3,4-тиадиазол-5-ил, 1H-тетразол-5-ил, 1-метил-1H-тетразол-5-ил, 1-(1-(диметиламино)эт-2-ил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-ила натриевая соль, 1-(метилсульфоновая кислота)-1H-тетразол-5-ил, 1-(метилсульфоновая кислота)-1H-тетразол-5-ила натриевая соль, 2-метил-1H-тетразол-5-ил, 1,2,3-триазол-5-ил, 1-метил-1,2,3-триазол-5-ил, 2-метил-1,2,3-триазол-5-ил, 4-метил-1,2,3-триазол-5-ил, пирид-2-ила N-оксид, 6-метокси-2-(N-оксид)-пиридаз-3-ил, 6-гидроксипиридаз-3-ил, 1-метилпирид-2-ил, 1-метилпирид-4-ил, 2-гидроксипиримид-4-ил, 1,4,5,6-тетрагидро-5,6-диоксо-4-метил-as-триазин-3-ил, 1,4,5,6-тетрагидро-4-(формилметил)-5,6-диоксо-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-as-триазин-3-ила натриевая соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-ила натриевая соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-метокси-2-метил-as-триазин-3-ил, 2,5-дигидро-5-оксо-as-триазин-3-ил, 2,5-дигидро-5-оксо-2-метил-as-триазин-3-ил, 2,5-дигидро-5-оксо-2,6-диметил-as-триазин-3-ил, тетразоло[1,5-b]пиридазин-6-ил и 8-аминотетразоло[1,5-b]пиридазин-6-ил. Альтернативными примерами "гетероарила" являются: 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ила натриевая соль, 1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 1H-тетразол-5-ил, 1-метил-1H-тетразол-5-ил, 1-(1-(диметиламино)эт-2-ил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-ила натриевая соль, 1-(метилсульфоновая кислота)-1H-тетразол-5-ил, 1-(метилсульфоновая кислота)-1H-тетразол-5-ила натриевая соль, 1,2,3-триазол-5-ил, 1,4,5,6-тетрагидро-5,6-диоксо-4-метил-as-триазин-3-ил, 1,4,5,6-тетрагидро-4-(2-формилметил)-5,6-диоксо-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-ила натриевая соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-ил, тетразоло[1,5-b]пиридазин-6-ил и 8-аминотетразоло[1,5-b]пиридазин-6-ил. Гетероарильные группы могут быть необязательно замещены, как описано для гетероциклов.
Термин "ингибитор" относится к соединению, которое уменьшает или предотвращает связывание белков IAP с каспазами, или которое уменьшает или предотвращает ингибирование апоптоза под действием белка IAP. Альтернативно термин "ингибитор" относится к соединению, которое предотвращает связывающее взаимодействие X-IAP с каспазами или связывающее взаимодействие ML-IAP со SMAC.
Если не указано иначе, термин "необязательно замещенный" относится к группе, которая может быть незамещена или замещена одним или несколькими (например, 0, 1, 2, 3 или 4) заместителями, перечисленными для данной группы, причем указанные заместители могут быть одинаковыми или разными. В одном воплощении необязательно замещенная группа имеет 1 заместитель. В другом воплощении необязательно замещенная группа имеет 2 заместителя. В другом воплощении необязательно замещенная группа имеет 3 заместителя.
Термин "фармацевтически приемлемые соли" включает как кислотно-, так и основно-аддитивные соли. Термин "фармацевтически приемлемая кислотно-аддитивная соль" относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований и не оказывают нежелательного биологического или иного ответа, данные соли получают с использованием неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т. п., и органических кислот, которые могут быть выбраны из классов алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т. п.
"Фармацевтически приемлемые основно-аддитивные соли" включают соли, образованные неорганическими основаниями, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т. п. Примерами основно-аддитивных солей являются соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включающих природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперизин, пиперидин, N-этилпиперидин, полиаминовые смолы и т. п. Предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин.
Термин "сульфонил" относится к группе -SO2-R, в которой R обозначает H, алкил, карбоцикл, гетероцикл, карбоциклзамещенный алкил или гетероциклзамещенный алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные выше значения. Примерами сульфонильных групп являются алкилсульфонил (т. е. -SO2-алкил), например метилсульфонил; арилсульфонил, например фенилсульфонил; аралкилсульфонил, например бензилсульфонил.
Фраза "их соли и сольваты" в данном описании означает, что соединения данного изобретения могут существовать в виде одной солевой или сольватной формы, или в виде смеси таких форм. Например, соединение данного изобретения может существовать в виде по существу чистой одной солевой или сольватной формы, или оно также может существовать в виде смесей двух или более солевых или сольватных форм.
Настоящее изобретение предлагает новые соединения, имеющие общую формулу I:
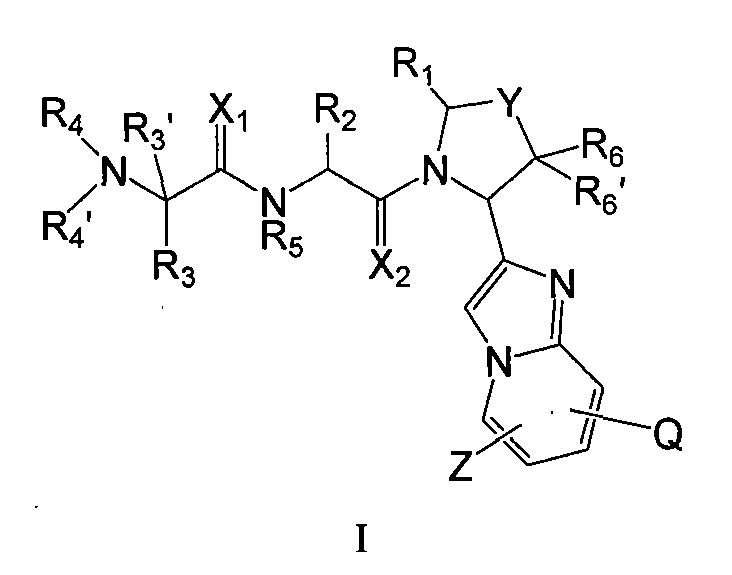
где Q, X1, X2, Y, Z, R1, R2, R3, R3', R4, R4', R5, R6, R6' и n имеют значения, указанные в данном описании. Если не указано иначе, соединения данного изобретения включают их соли, сольваты и полиморфы.
Каждый из X1 и X2 независимо обозначает O или S. В конкретном воплощении и X1 и X2 обозначают O. В другом конкретном воплощении и X1 и X2 обозначают S. В другом конкретном воплощении X1 обозначает S, а X2 обозначает O. В другом конкретном воплощении X1 обозначает O, а X2 обозначает S.
Y обозначает связь, (CR7R7)m, O или S. В одном воплощении Y обозначает связь, (CR7R7)m, O или S; где m обозначает 1 или 2, а R7 имеет значения, указанные в данном описании, или обозначает H, галоген, алкил, арил, аралкил, амино, ариламино, алкиламино, аралкиламино, алкокси, арилокси или аралкилокси. В конкретном воплощении Y обозначает (CHR7)m, O или S; где m обозначает 1 или 2, а R7 обозначает H, галоген, алкил, арил, аралкил, амино, ариламино, алкиламино, аралкиламино, алкокси, арилокси или аралкилокси. В конкретном воплощении Y обозначает CH2. В конкретном воплощении m обозначает 1. В конкретном воплощении Y обозначает связь. В конкретном воплощении m обозначает 1, а Y обозначает CHR7, где R7 обозначает аралкилокси, например бензилокси. В конкретном воплощении m обозначает 1, а Y обозначает CHR7, где R7 обозначает F. В конкретном воплощении m обозначает 1, а Y обозначает CHR7, где R7 обозначает аралкиламино, например бензиламино. В другом конкретном воплощении Y обозначает O. В другом конкретном воплощении Y обозначает S.
Z обозначает H, галоген, гидроксил, карбоксил, амино, нитро, циано, алкил, карбоцикл или гетероцикл; где указанные алкил, карбоцикл и гетероцикл необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, необязательно замещенный алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл, или необязательно замещенный гетероцикл; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, - NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-. В одном воплощении Z обозначает H, галоген, гидроксил, карбоксил, амино, нитро, алкил, карбоцикл или гетероцикл, где указанные алкил, карбоцикл и гетероцикл необязательно замещены галогеном, гидроксилом, карбоксилом, амино и нитро. В одном воплощении Z обозначает H, галоген или алкил. В одном воплощении Z обозначает H. В одном воплощении Z обозначает алкил, такой как метил, этил, пропил и изопропил. В одном воплощении Z обозначает фенил или нафтил.
Q обозначает H, галоген, гидроксил, карбоксил, амино, нитро, циано, алкил, карбоцикл или гетероцикл; где указанные алкил, карбоцикл и гетероцикл необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, необязательно замещенный алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, - NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-. Заместители "необязательно замещенного алкила", "необязательно замещенного карбоцикла" и "необязательно замещенного гетероцикла" замещены, как вышеуказанные группы алкил, карбоцикл и гетероцикл в Q. В конкретном воплощении заместителями такого "необязательно замещенного алкила" являются гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, амино, циано, нитро, амидино и гуанидино. В конкретном воплощении такие необязательно замещенные группы карбоцикл и гетероцикл замещены гидроксилом, алкилом, алкокси, ацилом, галогеном, меркапто, оксо, карбоксилом, ацилом, галогензамещенным алкилом, амино, циано, нитро, амидино и гуанидино. В конкретном воплощении Q обозначает карбоцикл или гетероцикл, необязательно замещенный галогеном, амино, оксо, алкилом, карбоциклом или гетероциклом; где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, - NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; и где указанные алкил, карбоцикл или гетероцикл необязательно замещены такими заместителями, как галоген, амино, гидроксил, меркапто, карбоксил, алкокси, алкоксиалкокси, гидроксиалкокси, алкилтио, ацилокси, ацилоксиалкокси, алкилсульфонил, алкилсульфонилалкил, алкилсульфинил и алкилсульфинилалкил. В конкретном воплощении Q обозначает карбоцикл или гетероцикл, имеющие значения, указанные в данном описании, которые необязательно замещены, как указано в данном описании, а Z выбран из группы, включающей H, галоген, карбоксил, амино, нитро и циано. В конкретном воплощении Q обозначает арил или гетероарил, а Z выбран из группы, включающей H, галоген, карбоксил, амино, нитро и циано. В конкретном воплощении Z обозначает H. В другом конкретном воплощении другими вариантами Z являются H, галоген или алкил.
В конкретном воплощении Q обозначает карбоцикл или гетероцикл, выбранный из группы, включающей III-1 - III-16
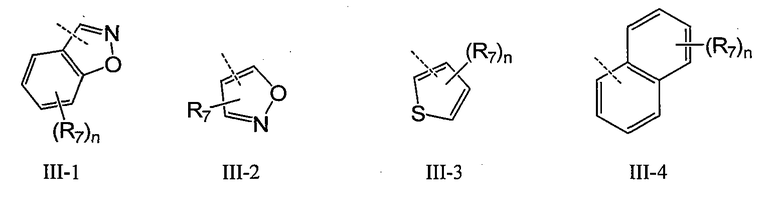
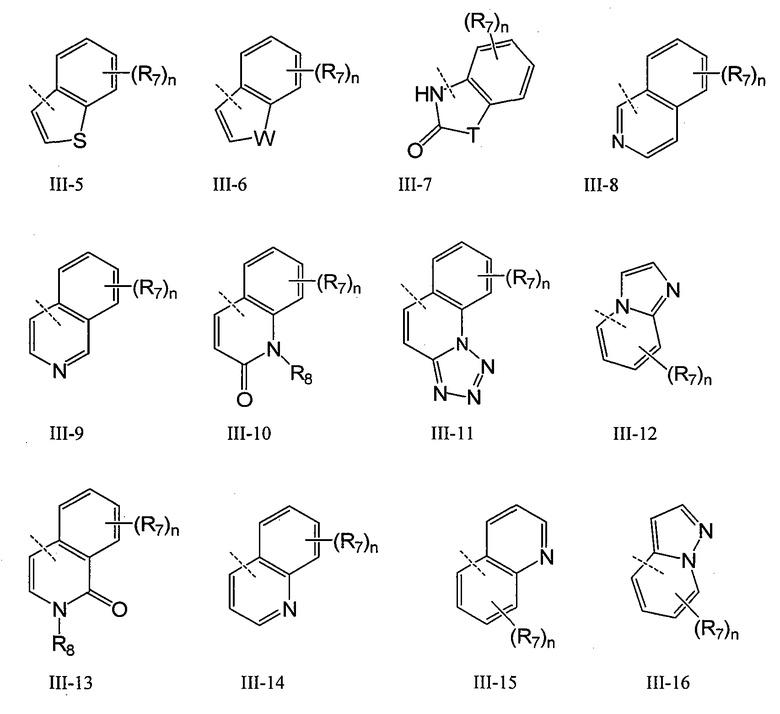
где n обозначает 1-4, например 1-3, например 1-2, например 1; T обозначает O, S, NR8 или CR7R7; W обозначает O, NR8 или CR7R7; а R7 и R8 имеют указанные выше значения. В одном воплощении Q имеет общую формулу III-1 - III-16, а Z выбран из группы, включающей H, галоген, карбоксил, амино, нитро и циано. В конкретном воплощении Z обозначает H. В другом конкретном воплощении Z обозначает H, галоген или алкил.
В конкретном воплощении Q обозначает карбоцикл или гетероцикл, выбранный из группы, включающей IIIa - IIIs:
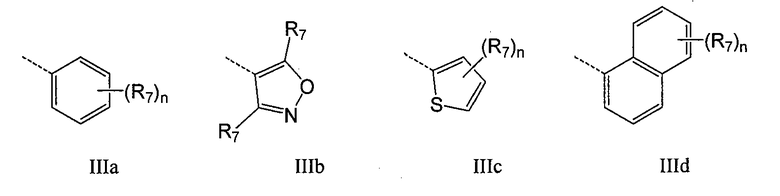
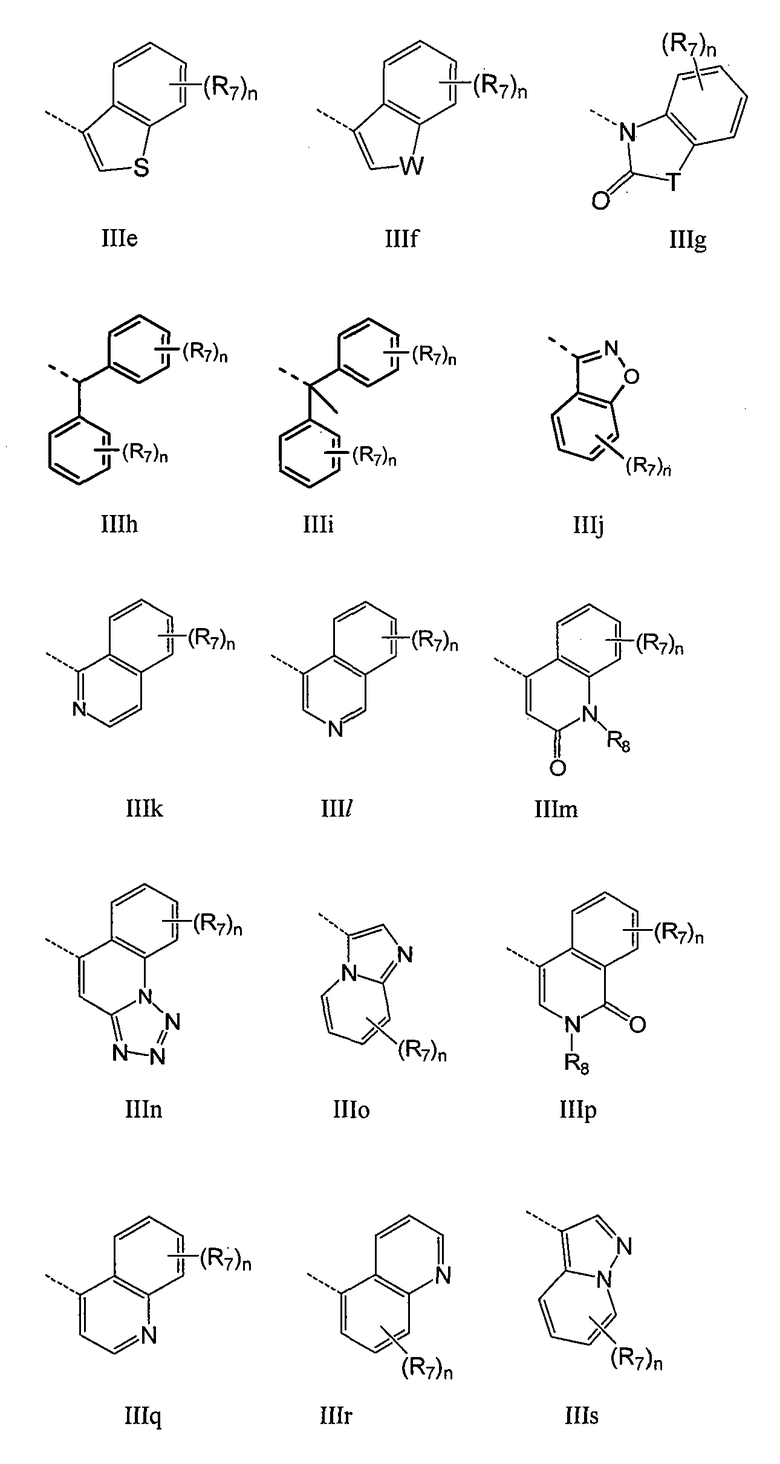
где n обозначает 1-4, например 1-3, например, 1-2, например, 1; T обозначает O, S, NR8 или CR7R7; W обозначает O, NR8 или CR7R7; а R7 и R8 имеют указанные выше значения. В конкретном воплощении Q обозначает любой фрагмент из IIIa-IIIi, где R8 обозначает H, а R7 выбран из группы, включающей H, F, Cl, Me, метокси, гидроксиэтокси, метоксиэтокси, ацетоксиэтокси, метилсульфонил, метилсульфонилметил, фенил и морфолин-4-ил. В другом конкретном воплощении Q обозначает IIId. В конкретном воплощении Q обозначает IIId, замещенный по 4 положению R7. В другом конкретном воплощении Q обозначает IIId, замещенный по 5 положению R7. В конкретном воплощении Q обозначает F, Me, iPr, фенил, фенил, замещенный следующим образом: 2-Cl, 3-Cl, 4-Cl, 2-F, 3-F или 4-F, бензил, пирид-3-ил или пирид-4-ил. В одном воплощении Q имеет общую формулу IIIa - IIIs, а Z выбран из группы, включающей H, галоген, карбоксил, амино, нитро и циано. В конкретном воплощении Z обозначает H. В другом конкретном воплощении Z обозначает H, галоген или алкил.
R1 обозначает H, OH или алкил; или R1 и R2 вместе образуют 5-8-членный гетероцикл. В конкретном воплощении R1 обозначает H. В конкретном воплощении R1 и R2 вместе образуют 6-членный цикл. В конкретном воплощении R1 и R2 вместе образуют 7-членный цикл. В другом конкретном воплощении R1 и R2 вместе образуют 8-членный цикл. В другом конкретном воплощении R1 и R2 вместе образуют 7-членный цикл, а Y обозначает S. В другом конкретном воплощении R1 обозначает H, а Y обозначает CH2. В другом конкретном воплощении R обозначает H, а Y обозначает S. В другом конкретном воплощении R1 обозначает H, а Y обозначает O.
R2 обозначает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен заместителем, выбранным из группы, включающей галоген, гидроксил, оксо, тион, меркапто, карбоксил, алкил, галогеналкил, ацил, алкокси, алкилтио, сульфонил, амино и нитро, где указанные алкил, ацил, алкокси, алкилтио и сульфонил необязательно замещены такими заместителями как гидрокси, меркапто, галоген, амино, алкокси, гидроксиалкокси и алкоксиалкокси. В одном воплощении R2 обозначает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен заместителем, выбранным из группы, включающей галоген, гидроксил, оксо, тион, меркапто, карбоксил, алкил, галогеналкил, алкокси, алкилтио, сульфонил, амино и нитро. В конкретном воплощении R2 обозначает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен заместителем, выбранным из группы, включающей галоген, гидроксил, оксо, меркапто, тион, карбоксил, алкил, галогеналкил, алкокси, ацил, алкилтио, ацил, гидроксиацил, метоксиацил, сульфонил, амино и нитро. В одном воплощении R2 обозначает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен заместителем, выбранным из группы, включающей галоген, гидроксил, меркапто, карбоксил, алкил, алкокси, ацил, амино и нитро. В конкретном воплощении R2 обозначает алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероцикл или гетероциклилалкил. В конкретном воплощении R2 обозначает алкил, циклоалкил или гетероцикл. В конкретном воплощении R2 выбран из группы, включающей т-бутил, изопропил, циклогексил, тетрагидропиран-4-ил, N-метилсульфонилпиперидин-4-ил, тетрагидротиопиран-4-ил, тетрагидротиопиран-4-ил (в которых S находится в окисленной форме в виде SO или SO2), циклогексан-4-он, 4-гидроксициклогексан, 4-гидрокси-4-метилциклогексан, 1-метилтетрагидропиран-4-ил, 2-гидроксипроп-2-ил, бут-2-ил, тиофен-3-ил, пиперидин-4-ил, N-ацетилпиперидин-4-ил, N-гидроксиэтилпиперидин-4-ил, N-(2-гидроксиацетил)пиперидин-4-ил, N-(2-метоксиацетил)пиперидин-4-ил, пиридин-3-ил, фенил, тетрагидрофуран-2-илкарбонил, метоксиэтанон, 2-метоксиэтоксиэтанон и 1-гидроксиэт-1-ил. В одном воплощении данного изобретения R2 обозначает т-бутил, изопропил, циклогексил, циклопентил, фенил или тетрагидропиран-4-ил. В конкретном воплощении R2 обозначает фенил. В конкретном воплощении R2 обозначает циклогексил. В другом воплощении R2 обозначает тетрагидропиран-4-ил. В другом конкретном воплощении R2 обозначает изопропил (т. е. боковую цепь аминокислоты валина). В другом конкретном воплощении R2 обозначает т-бутил. В конкретном воплощении R2 ориентирован так, что аминокислота, или аналог аминокислоты, в состав которой он входит, находится в L-конфигурации.
R3 обозначает H или алкил, необязательно замещенный галогеном или гидроксилом; или R3 и R4 вместе образуют 3-6-членный гетероцикл. В одном воплощении R3 обозначает H или алкил; или R3 и R4 вместе образуют 3-6-членный гетероцикл. В одном воплощении R3 обозначает H или метил, этил, пропил или изопропил. В особенно предпочтительном воплощении R3 обозначает H или метил. В другом конкретном воплощении R3 обозначает метил. В другом конкретном воплощении R3 обозначает фторметил. В другом конкретном воплощении R3 обозначает этил. В другом конкретном воплощении R3 обозначает гидроксиэтил. В конкретном воплощении R3 обозначает фторметил. В конкретном воплощении R3 обозначает гидроксиэтил. В другом воплощении R3 ориентирован так, что аминокислота, или аналог аминокислоты, в состав которой он входит, находится в L-конфигурации. В конкретном воплощении R3 и R4 вместе с атомами, к которым они присоединены, образуют 3-6-членный гетероцикл. В конкретном воплощении R3 и R4 вместе образуют азетидиновый цикл. В конкретном воплощении R3 и R4 вместе образуют пирролидин.
R3' обозначает H, или R3 и R3' вместе образуют 3-6-членный карбоцикл. В одном воплощении R3' обозначает H. В другом воплощении R3 и R3' вместе образуют 3-6-членный карбоцикл, например циклопропил. В конкретном воплощении R3 и R3' оба обозначают метил.
R4 и R4' независимо обозначают H, гидроксил, амино, алкил, карбоцикл, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси или гетероциклоалкилоксикарбонил; где каждый алкил, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси и гетероциклоалкилоксикарбонил необязательно замещен галогеном, гидроксилом, меркапто, карбоксилом, алкилом, алкокси, амино, имино и нитро; или R4 и R4' вместе образуют гетероцикл. В одном воплощении R4 и R4' независимо обозначают H, гидроксил, амино, алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто, карбоксилом, алкилом, алкокси, амино и нитро; или R4 и R4' вместе образуют гетероцикл. В конкретном воплощении R4 и R4' вместе образуют гетероцикл, например азетидиновый цикл или пирролидиновый цикл. В конкретном воплощении R4 и R4' оба обозначают H. В другом конкретном воплощении R4 обозначает метил, а R4' обозначает H. В конкретном воплощении один из R4 и R4' обозначает гидроксил (OH), а другой обозначает H. В другом воплощении один из R4 и R4' обозначает амино, такой как NH2, NHMe и NHEt, а другой обозначает H. В конкретном воплощении R4' обозначает H, а R4 обозначает H, алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил. В конкретном воплощении R4 обозначает группу, выбранную из следующих фрагментов:
R5 обозначает H или алкил. В конкретном воплощении R5 обозначает H или метил. В конкретном воплощении R5 обозначает H. В другом конкретном воплощении R5 обозначает метил.
Каждый из R6 и R6' независимо обозначает H, алкил, арил или аралкил. В конкретном воплощении R6 обозначает алкил, например метил. В другом конкретном воплощении R6 обозначает арил, например фенил. В другом конкретном воплощении R6 обозначает аралкил, например бензил. В конкретном воплощении R6 и R6' являются одинаковыми, например, оба обозначают алкил, например, оба обозначают метил. В другом конкретном воплощении R6 обозначает метил, а R6' обозначает H.
R7 в каждом случае независимо обозначает H, циано, гидроксил, меркапто, галоген, нитро, карбоксил, амидино, гуанидино, алкил, карбоцикл, гетероцикл или -U-V; где U обозначает -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, - NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-, а V обозначает алкил, карбоцикл или гетероцикл; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, - NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; а алкил, карбоцикл и гетероцикл необязательно замещены такими заместителями, как гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, галогензамещенный алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл. Заместители "необязательно замещенного карбоцикла" и "необязательно замещенного гетероцикла" имеют указанные выше значения. В конкретном воплощении такие карбоциклические и гетероциклические группы замещены заместителями, выбранными из группы, включающей гидроксил, алкил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, галогензамещенный алкил, амино, циано, нитро, амидино и гуанидино. В одном воплощении R7 обозначает H, галоген, алкил, галогеналкил, арил, аралкил, амино, ариламино, алкиламино, аралкиламино, алкокси, алкоксиалкокси, арилокси или аралкилокси.
R8 обозначает H, алкил, карбоцикл или гетероцикл, где одна или несколько групп CH2 или CH указанного алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8) или -C(O)-; а указанные алкил, карбоцикл и гетероцикл необязательно замещены такими заместителями, как гидроксил, алкокси, ацил, галоген, меркапто, оксо (=О), карбоксил, ацил, галогензамещенный алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл. Заместители "необязательно замещенного карбоцикла" и "необязательно замещенного гетероцикла" имеют указанные выше значения. В конкретном воплощении такие карбоциклические и гетероциклические группы замещены гидроксилом, алкилом, алкокси, ацилом, галогеном, меркапто, оксо, карбоксилом, ацилом, галогензамещенным алкилом, амино, циано, нитро, амидино и гуанидино. В конкретном воплощении R8 обозначает H, алкил или ацил. В одном воплощении R8 обозначает метил. В другом воплощении R8 обозначает ацетил. В конкретном воплощении R8 обозначает H. В одном воплощении R7 обозначает H, галоген, амино, гидроксил, карбоксил, алкил, галогеналкил или аралкил. В конкретном воплощении R7 обозначает галоген, например Cl или F. В конкретном воплощении R7 обозначает H. Следует понимать, что заместители, определенные для R7 и R8, а также для других переменных, описанных в данном документе, должны соответствовать допустимой валентности.
m обозначает 0-4. В одном воплощении m обозначает 0. В одном воплощении m обозначает 1. В одном воплощении m обозначает 2. В одном воплощении m обозначает 3. В одном воплощении m обозначает 4.
Соединения данного изобретения содержат один или несколько асимметричных атомов углерода. Соответственно, соединения могут существовать в виде диастереомеров, энантиомеров или их смесей. При синтезе соединений в качестве исходных или промежуточных веществ можно использовать рацематы, диастереомеры или энантиомеры. Диастереомерные соединения можно разделить хроматографическими методами или путем кристаллизации. Подобным образом, смеси энантиомеров можно разделить с помощью таких же способов, или с помощью других, известных в данной области способов. Все асимметричные атомы углерода могут находиться в R- или S-конфигурации, причем обе указанные конфигурации входят в объем настоящего изобретения. В конкретном воплощении соединения данного изобретения имеют показанную ниже стереохимическую конфигурацию формулы I'
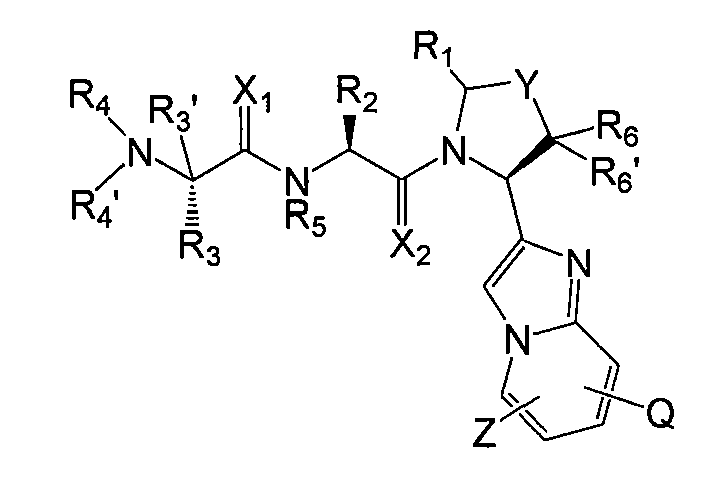
I'
где X1, X2, Y, Z, Q, R1, R2, R3, R4, R4', R5, R6 и R6' имеют значения, указанные в данном описании.
В конкретных воплощениях соединения данного изобретения имеют общую формулу IIa-IId
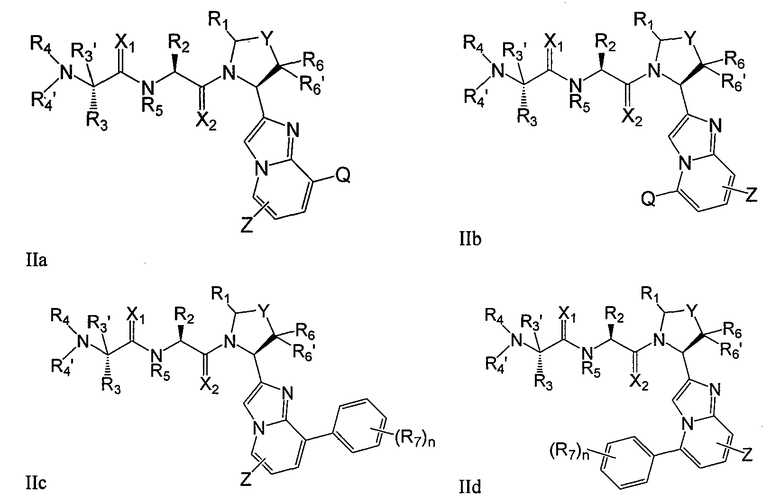
где X1, X2, Y, Z, Q, R1, R2, R3, R4, R4', R5, R6, R6' и R7 имеют значения, указанные в данном описании.
Данное изобретение также охватывает пролекарства описанных выше соединений. Подходящие лекарства, если это применимо, включают известные аминозащитные и карбоксизащитные группы, которые высвобождаются, например, в результате гидролиза, с образованием исходного соединения в физиологических условиях. К конкретному классу пролекарств относятся соединения, в которых атом азота амино-, амидино-, аминоалкиленамино-, иминоалкиленамино- или гуанидиногруппы замещен гидроксильной (OH) группой, алкилкарбонильной (-CO-R) группой, алкоксикарбонильной (-CO-OR) группой, ацилоксиалкилалкоксикарбонильной (-CO-O-R-O-CO-R) группой, где R обозначает моновалентную или двухвалентную группу, как указано выше, или группой, имеющей формулу -C(O)-O-CP1P2-галогеналкил, где P1 и P2 могут быть одинаковыми или разными и обозначают H, низший алкил, низший алкокси, циано, галоген низший алкил или арил. В конкретном воплощении атом азота представляет собой один из атомов азота амидиногруппы соединений данного изобретения. Указанные пролекарственные соединения получают путем взаимодействия описанных выше соединений данного изобретения с активированным ацильным соединением, в результате чего атом азота соединения данного изобретения присоединяется к карбонилу активированного ацильного соединения. Подходящие активированные карбонильные соединения содержат нужную уходящую группу, связанную с углеродом карбонила, и включают ацилгалогениды, ациламины, соли ацилпиридиния, ацилалкоксиды, в частности ацилфеноксиды, такие как п-нитрофеноксиацил, динитрофеноксиацил, фторфеноксиацил и дифторфеноксиацил. Реакции обычно являются экзотермическими и их проводят в инертных растворителях при пониженных температурах, например от -78 до примерно 5°C. Реакции также обычно проводят в присутствии неорганического основания, такого как карбонат калия или бикарбонат натрия, или органического основания, такого как амин, в том числе пиридин, триэтиламин и др. Один способ получения пролекарств описан в USSN 08/843369, поданной 15 апреля 1997 г. (соответствует публикации PCT WO9846576), содержание которой включено в данное описание посредством ссылки во всей полноте.
Ниже приведены конкретные соединения формулы I:
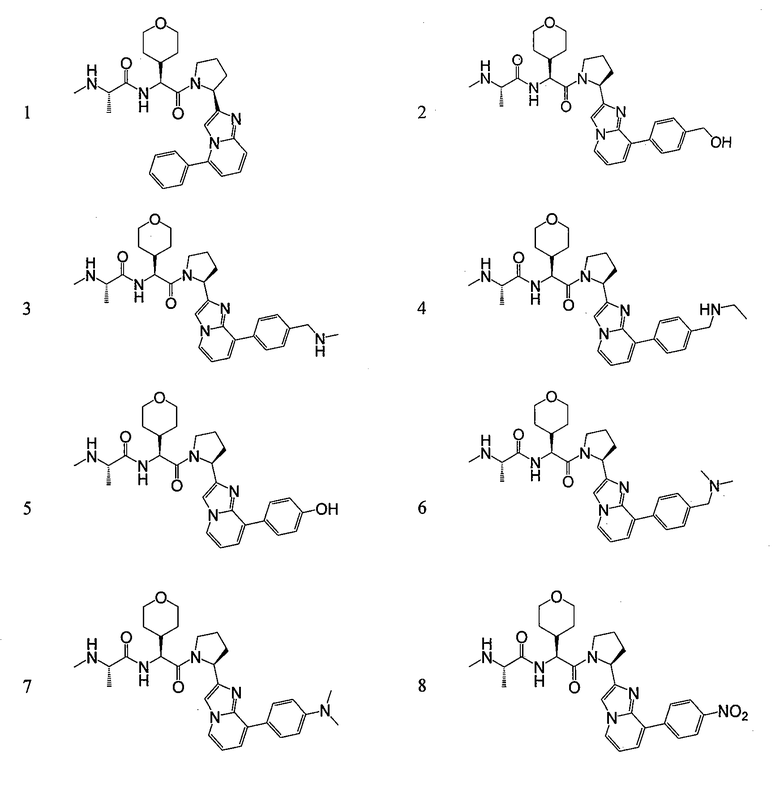
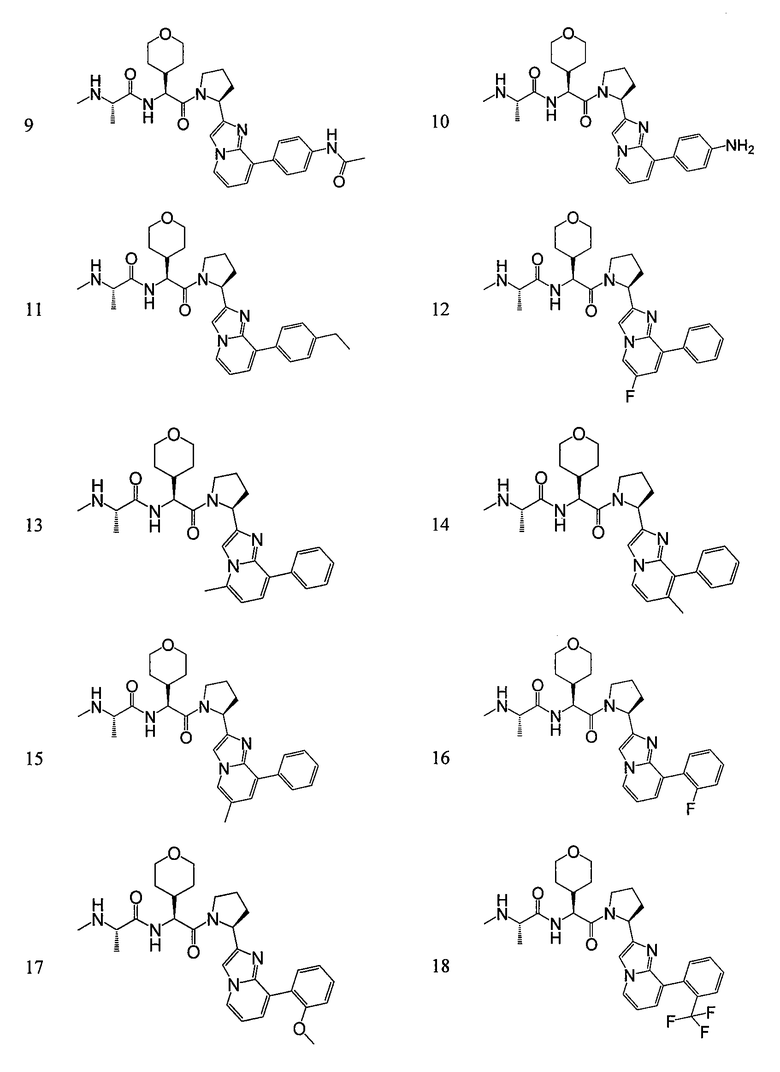
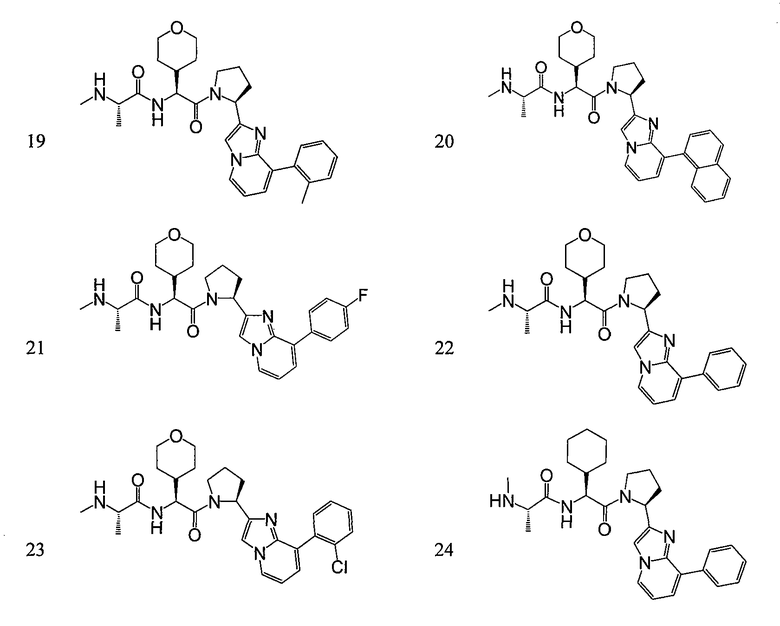
Соединения данного изобретения могут существовать в разных резонансных формах, причем все такие резонансные формы входят в объем настоящего изобретения.
СИНТЕЗ
Соединения данного изобретения получают с помощью стандартных способов органического синтеза из коммерчески доступных исходных веществ и реагентов. Следует понимать, что выбор способов синтеза, используемых для получения соединений данного изобретения, зависит от конкретных заместителей, присутствующих в соединении, и что может потребоваться проведение разных стадий защиты и удаления защитных групп, традиционно используемых в органическом синтезе, которые не показаны в нижеследующих общих схемах. В конкретной общей схеме синтеза соединения данного изобретения можно получить путем присоединения аналогов аминокислотных остатков с использованием обычных методов образования амидной связи. В схеме 1, где Q, Y, Z, R1, R6 и R6' имеют указанные выше значения, а Pr обозначает походящую защитную группу, присоединяют аминозащищенные аналоги аминокислотных остатков, затем удаляют защитные группы и получают конечные соединения.
Схема 1

Следует понимать, что аналоги аминокислот можно присоединять в любом порядке, и что для этого можно использовать твердофазный носитель, широко применяющийся в данной области. Например, на схеме 2 показан альтернативный способ присоединения аналога аминокислотного остатка.
Схема 2
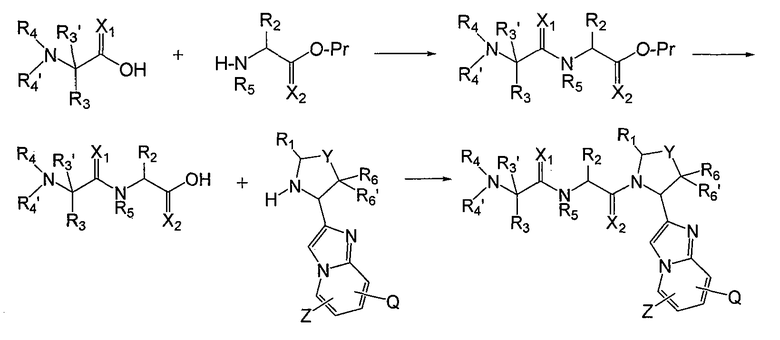
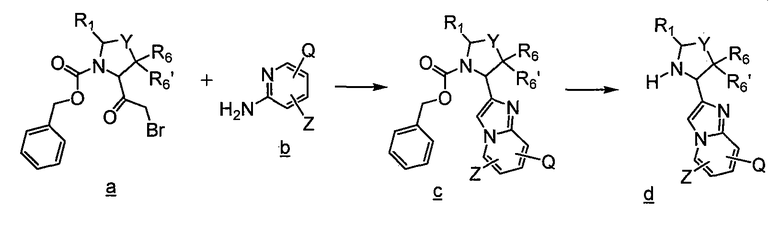
Имидазо[1,2a]пиридиновые промежуточные соединения можно получить по схеме 3, где Q, Y, Z, R1, R6 и R6' имеют указанные выше значения. Исходный бромин a подвергают взаимодействию с 2-аминопиридилом b, получая защищенное соединение c, с которого затем удаляют защитные группы с получением промежуточного соединения d, используемого в синтезе соединений данного изобретения.
Схема 3
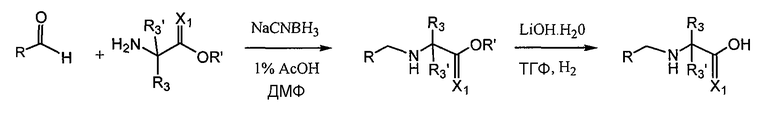
Соединения данного изобретения, в которых R4 или R4' отличаются от H, можно получить с помощью стандартных методов органической химии, например путем восстановительного аминирования, где исходный аналог аминокислотного остатка, например, NH2-CH(R3)-C(O)-OH, подвергают взаимодействию с подходящим альдегидом или кетоном с получением желательных заместителей R4 и R4'. См. схему 4. Затем полученное R4/R4'-замещенное аминокислотное промежуточное соединение можно конъюгировать со следующим промежуточным аминокислотным соединением или остатком соединения с помощью стандартных методов пептидного синтеза.
Схема 4
В конкретном воплощении аланин подвергают взаимодействию с 1-метилиндол-2-карбоксальдегидом и восстанавливают цианоборгидридом натрия, растворенным в 1% HOAc/DMF, с получением N-замещенного остатка аланина, который можно использовать для получения соединений данного изобретения. См. схему 5.
Схема 5
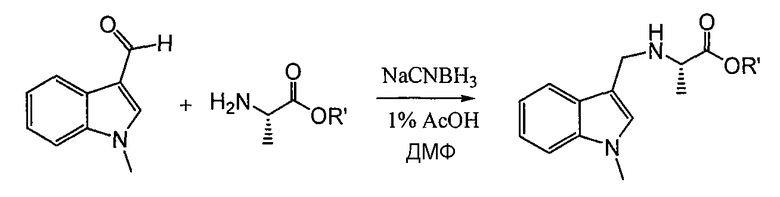
Альтернативно метод восстановительного аминирования используют на последней стадии получения соединения для введения заместителей R4/R4'.
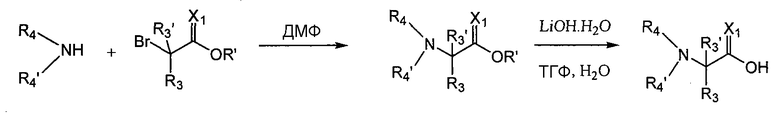
Если соединения данного изобретения содержат заместители R4 или R4', отличные от H, их можно получить путем замещения подходящего кислого промежуточного соединения, которое содержит уходящую группу, желательным амином. Например, Br-CH(R3)-C(O)-OH замещают амином R4-NH2 или R4-NH-R4' в соответствии со схемой 6.
Схема 6
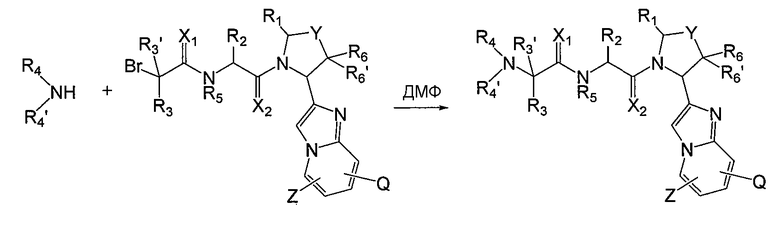
Альтернативно на последней стадии получения соединения можно провести реакцию замещения с введением заместителей R4 или R4', как показано на схеме 7.
Схема 7
В конкретном воплощении в схемах 6 и 7 используют следующие амины:
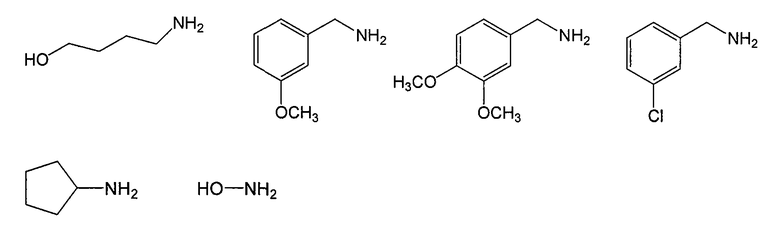
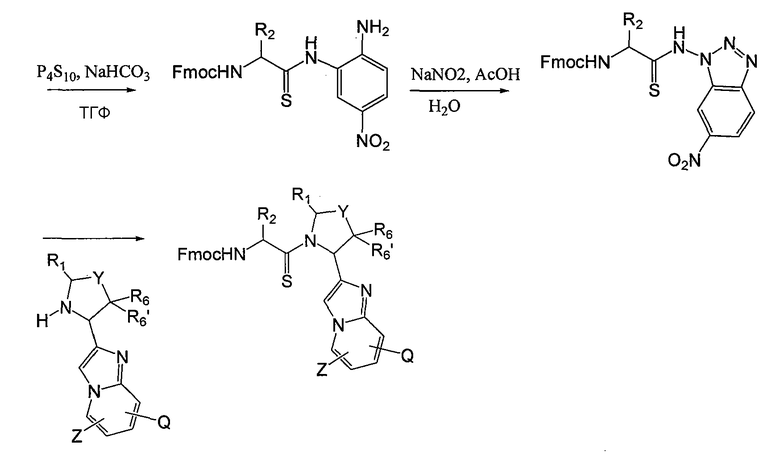
Соединения данного изобретения, в которых либо X, либо X2, обозначает серу, т. е. соединения, в состав которых входит тиоамид, можно получить с помощью известных методов органической химии. Например, соединения, в которых X2 обозначает серу, можно получить по схеме 8, используя в качестве исходного соединения Fmoc-защищенный аминокислотный аналог NH2-CH(R2)-COOH, который растворяют в ТГФ и охлаждают до -25°C, после чего добавляют DIPEA и затем изобутилхлорформат. Через 10 минут добавляют диамин, 4-нитробензол-1,2-диамин и реакционную смесь непрерывно перемешивают при -25°C в течение 2 часов и затем при комнатной температуре в течение ночи. ТГФ удаляют в вакууме, после чего смесь подвергают флэш-хроматографии, используя 50% EtOAc/гексан, и получают продукт. Fmoc-аланиновое производное, пентасульфид фосфора и карбонат натрия смешивают в ТГФ и перемешивают в течение ночи. Раствор концентрируют и после хроматографии на нормальной фазе с использованием 80% EtOAc/гексан получают активированный тиоаланин. Затем активированный тиоаланин и нитрит натрия смешивают в уксусной кислоте и разбавляют H2O. Полученный осадок фильтруют и сушат, получая продукт. Тиоаланин присоединяют к аналогу аминокислотного остатка пролина, замещенного циклом A, путем растворения обоих соединений в ДМФ. С тиоамидного продукта можно удалить защитные группы путем обработки 20% PIP/DMA в течение 15 минут и затем его можно использовать для присоединения к R4/R4'-N-C(R3)(R3')-COOH. Альтернативно Fmoc-защищенный тиоамид вначале присоединяют к аналогу аминокислотного остатка пролина, замещенного циклом A, и затем, после удаления защитной группы Fmoc, присоединяют к аналогу аминокислотного остатка R4/R4'-R4/R4'-N-C(R3)(R3')-COOH.
Схема 8
ПОКАЗАНИЯ
Соединения данного изобретения ингибируют связывание белков IAP с каспазами, в частности, связывающее взаимодействие X-IAP с каспазами 3 и 7. Данные соединения также ингибируют связывание ML-IAP с белком Smac. Соответственно, соединения данного изобретения можно использовать для индуцирования апоптоза в клетках или сенсибилизации клеток к апоптотическим сигналам, в частности раковых клеток. Соединения данного изобретения можно использовать для индуцирования апоптоза в клетках с повышенной экспрессией белков IAP. Альтернативно соединения данного изобретения можно использовать для индуцирования апоптоза в клетках с нарушенным митохондриальным апоптотическим путем приводит к ингибированию высвобождения Smac из белков ML-IAP, например, в результате повышающей регуляции Bcl-2 или понижающей регуляции Bax/Bak. В более широком смысле, данные соединения можно использовать для лечения всех типов рака, при которых нарушается способность клеток вступать в апоптоз. Примерами таких типов рака являются нейробластома, карцинома кишечника, такая как карцинома прямой кишки, карцинома толстой кишки, злокачественный семейный аденоматозный полипоз и наследственный неполипозный колоректальный рак, карцинома пищевода, карцинома губ, карцинома гортани, карцинома гортаноглотки, карцинома языка, карцинома слюнных желез, карцинома желудка, аденокарцинома, медуллярная карцинома щитовидной железы, папиллярная карцинома щитовидной железы, карцинома почки, карцинома паренхимы почки, карцинома яичника, карцинома шейки матки, карцинома тела матки, карцинома эндометрия, хороиадальная карцинома, карцинома поджелудочной железы, карцинома простаты, карцинома яичек, карцинома молочной железы, карцинома мочевыводящих путей, меланома, опухоли мозга, такие как глиобластома, астроцитома, менингиома, медуллобластома и периферические нейроэктодермальные опухоли, лимфома Ходжкина, неходжкинская лимфома, лимфома Беркитта, острый лимфолейкоз (ALL), хронический лимфолейкоз (CLL), острый миелолейкоз (AML), хронический миелолейкоз (CML), Т-клеточный лимфолейкоз взрослых, печеночно-клеточная карцинома, карцинома желчного пузыря, карцинома бронхов, мелкоклеточная карцинома легкого, немелкоклеточная карцинома легкого, множественная миелома, базалиома, тератома, ретинобластома, хороидальная меланома, семинома, рабдомиосаркома, краниофарингиома, остеосаркома, хондросаркома, миосаркома, липосаркома, фибросаркома, саркома Юинга и плазмоцитома.
Соединения данного изобретения можно использовать для сенсибилизации клеток к апоптотическим сигналам. Соответственно, соединения можно вводить до, одновременно или после лучевой терапии или цитостатической или противоопухолевой химиотерапии. Соединения, используемые для цитостатической химиотерапии, включают, без ограничения, (i) антиметаболиты, такие как цитарабин, флударабин, 5-фтор-2'-дезоксиуридин, гемцитабин, гидроксимочевина или метотрексат; (ii) средства, обеспечивающие фрагментацию ДНК, такие как блеомицин, (iii) средства, обеспечивающие поперечную сшивку ДНК, такие как хлорамбуцил, цисплатин, циклофосфамид или азотистый иприт; (iv) интеркалирующие средства, такие как адриамицин (доксорубицин) или митоксантрон; (v) ингибиторы синтеза белка, такие как L-аспарагиназа, циклогексимид, пуромицин или дифтерийный токсин; (vi) средства, отравляющие топоизомеразу I, такие как камптотецин или топотекан; (vii) средства, отравляющие топоизомеразу II, такие как этопозид (VP-16) или тенипозид; (viii) средства, направленные на микротрубочки, такие как кольцемид, колхицин, паклитаксел, винбластин или винкристин; (ix) ингибиторы киназы, такие как флавопиридол, стауроспорин, STI571 (CPG 57148B) или UCN-01 (7-гидроксистауроспорин); (x) разнородные исследовательские средства, такие как тиоплатин, PS-341, бутират ET-18-OCH3 или ингибиторы фарнезилтрансферазы (L-739749, L-744832); полифенолы, такие как кверцетин, ресвератрол, пицетаннол, эпигаллокатехина галлат, теафлавины, флаванолы, процианидины, бетулиновая кислота и ее производные; (xi) гормоны, такие как глюкокортикоиды или фенретинид; (xii) антагонисты гормонов, такие как антагонисты тамоксифена, финастерида или LHRH. В конкретном воплощении соединения настоящего изобретения вводят вместе с цитостатическим соединением, выбранным из группы, включающей цисплатин, доксорубицин, таксол, таксотере и митомицин C. В конкретном воплощении цитостатическое соединение представляет собой доксорубицин.
Другой класс активных соединений, пригодных для применения в настоящем изобретении, включает соединения, способные сенсибилизировать к апоптотическим сигналам, или индуцировать апоптоз путем связывания с рецепторами смерти ("агонисты рецепторов смерти"). Такие агонисты рецепторов смерти включают лиганды рецепторов смерти, такие как фактор некроза опухоли α (TNF-α), фактор некроза опухоли β (TNF-β, лимфотоксин-α), LT-β (лимфотоксин-[бета]), TRAIL (Apo2L, лиганд DR4), лиганд CD95 (Fas, APO-1), лиганд TRAMP (DR3, Apo-3), лиганд DR6, а также фрагменты и производные перечисленных лигандов. В одном воплощении лиганд рецептора смерти представляет собой TNF-α. В конкретном воплощении лиганд рецептора смерти представляет собой Apo2L/TRAIL. Кроме того, агонисты рецепторов смерти включают агонистические антитела против рецепторов смерти, такие как антитело против CD95, антитело против TRAIL-R1 (DR4), антитело против TRAIL-R2 (DR5), антитело против TRAIL-R3, антитело против TRAIL-R4, антитело против DR6, антитело против TNF-R1 и антитело против TRAMP (DR3), а также фрагменты и производные перечисленных антител.
Чтобы сенсибилизировать клетки для апоптоза, можно использовать соединения настоящего изобретения в комбинации с лучевой терапией. Фраза "лучевая терапия" относится к применению облучения электромагнитными волнами или частицами для лечения новообразований. Механизм действия лучевой терапии заключается в том, что облучение конкретного участка большими дозами радиации приводит к гибели репродуцирующихся клеток как в опухолевых, так и в нормальных тканях. Режим дозирования облучения, который обычно характеризуется поглощенной дозой излучения (рад), временем и фракционированием, с большой осторожностью определяет онколог. Количество излучения, получаемое пациентом, зависит от разных факторов, наиболее важными из которых являются расположение опухоли относительно других важных структур или органов организма и степень распространения опухоли. Примеры радиотерапевтических средств, предлагаемых, без ограничения, для лучевой терапии, известны в данной области (Hellman, Principles of Radiation Therapy, Cancer, in Principles I и Practice of Oncology, 24875 (Devita et al., 4th ed., vol 1, 1993). Последними достижениями в лучевой терапии являются трехмерное конформное внешнее направленное облучение, лучевая терапия с модуляцией интенсивности излучения (IMRT), стереотаксическая радиохирургия и брахитерапия (интерстициальная лучевая терапия), в последнем случае источник излучения помещают непосредственно в опухоль в виде имплантированных "зерен". Эти новые способы лечения позволяют доставлять более высокие дозы излучения к опухоли, что обуславливает их повышенную эффективность по сравнению со стандартной внешней направленной лучевой терапией.
Считается, что для радиотерапевтического применения больше всего подходит ионизирующее облучение бета-излучающими радионуклидами, поскольку оно характеризуется умеренной линейной потерей энергии (LET) ионизирующей частицы (электрон) и промежуточной дальностью (как правило, несколько миллиметров в ткани). Гамма-лучи обеспечивают более низкие уровни излучения при более высоких дистанциях. Альфа-частицы имеют другую крайность, они характеризуются очень высокой LET, но крайне низкой дальностью и, следовательно, должны находиться в тесном контакте с клетками ткани, подлежащей обработке. Кроме того, альфа-излучателями, как правило, являются тяжелые металлы, которые ограничивают возможную химию и обуславливают чрезмерный риск в результате утечки радионуклидов из участка, подлежащего обработке. В зависимости от обрабатываемой опухоли можно использовать любые излучатели, входящие в объем настоящего изобретения.
Кроме того, настоящее изобретение охватывает разновидности неионизирующего излучения, такие как, например, ультрафиолетовое (УФ) излучение, видимый свет высокой энергии, микроволновое излучение (гипертермическая терапия), инфракрасное (ИК) излучение и лазерное излучение. В конкретном воплощении настоящего изобретения применяют УФ-излучение.
Данное изобретение также включает фармацевтические композиции или лекарственные средства, содержащие соединения данного изобретения и терапевтически инертный носитель, разбавитель или эксципиент, а также способы применения соединений данного изобретения для получения таких композиций и лекарственных средств. Как правило, композиции получают путем смешивания используемых в способах данного изобретения соединений формулы I, имеющих желательную степень чистоты, при температуре окружающей среды и подходящем значении pH с физиологически приемлемыми, т. е. нетоксичными для реципиентов, носителями, в дозах и концентрациях, применяющихся в галеновой форме введения. pH композиции, как правило, зависит от конкретного применения и концентрации соединения, однако он может варьировать в диапазоне примерно от 3 до 8. В подходящем воплощении композицию получают в ацетатном буфере при pH 5. В одном воплощении ингибирующее соединение для применения в настоящем изобретении является стерильным. Соединение обычно хранят в виде твердой композиции, хотя приемлемыми являются лиофилизированные препараты или водные растворы.
Способы получения, дозирования и введения композиции данного изобретения выбирают в соответствии с надлежащей медицинской практикой. В данном контексте учитывают факторы, включающие конкретное нарушение, подлежащее лечению, вид млекопитающего, подлежащего лечению, клиническое состояние отдельного пациента, причину нарушения, участок доставки средства, способ введения, схему введения, а также другие факторы, известные врачам. Вводимое "эффективное количество" соединения зависит от таких факторов и представляет собой минимальное количество, необходимое для ингибирования взаимодействия IAP с каспазами, индуцирования апоптоза или сенсибилизации злокачественной клетки к апоптотическому сигналу. Такое количество может быть меньше количества, токсичного для нормальных клеток или для млекопитающего в целом.
Как правило, предварительное фармацевтически эффективное количество соединения данного изобретения, содержащееся во вводимой парентерально дозе, находится в интервале примерно 0,01-100 мг/кг, например, примерно 0,1-20 мг/кг массы тела пациента в день, и типичный предварительный интервал для используемого соединения составляет от 0,3 до 15 мг/кг/день. Пероральные единичные дозированные формы, такие как таблетки и капсулы, могут содержать примерно от 25 до 1000 мг соединения данного изобретения.
Соединение данного изобретения можно вводить любыми подходящими способами, которые включают пероральное, местное, чрезкожное, парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение, а также, если это желательно при местной обработке, введение в участок повреждения. Парентеральные инфузии включают внутримышечное, внутривенное, внутрисуставное, внутрибрюшинное или подкожное введение. Примером подходящей пероральной дозированной формы является таблетка, содержащая примерно 25 мг, 50 мг, 100 мг, 250 мг или 500 мг соединения данного изобретения и примерно 90-30 мг безводной лактозы, примерно 5-40 мг кроскармеллозы натрия, примерно 5-30 мг поливинилпирролидона (PVP) K30 и примерно 1-10 мг стеарата магния. Порошкообразные ингредиенты смешивают вначале друг с другом и затем с раствором PVP. Полученную композицию сушат, гранулируют, смешивают со стеаратом магния и прессуют в таблетки с помощью стандартного оборудования. Аэрозольную композицию можно получить путем растворения, например, 5-400 мг соединения данного изобретения в подходящем буферном растворе, например, в фосфатном буфере, с последующим добавлением при необходимости регулятора тоничности раствора, например соли, такой как хлорид натрия. Чтобы удалить загрязняющие вещества и примеси, раствор обычно фильтруют, например, с помощью фильтра 0,2 микрон.
ПРИМЕРЫ
Нижеследующие примеры приведены для более полного разъяснения настоящего изобретения. Однако они не предназначены для ограничения объема данного изобретения. Реагенты и растворители получают из коммерческих источников и используют, не подвергая после получения какой-либо обработке. Если не указано иначе, хроматографическую очистку проводят на колонках, набитых силикагелем, используя систему CombiFlash Companion, Teledyne-Isco, Inc. Lincoln, Nebraska. Идентификацию соединения и проверку его чистоты осуществляют методами ЖХМС и 1H ЯМР.
В данном описании используют следующие сокращения:
AcOH: уксусная кислота;
ACN: ацетонитрил;
Chg: циклогексилглицин;
DCM: дихлорметан
DIPEA: диизопропилэтиламин;
DMAP: 4-диметиламинопиридин;
DME: 1,2-диметоксиэтан;
DMF: диметилформамид;
DMSO: диметилсульфоксид
EDC: 1-этил-3-(3-диметиламинопропил)карбодиимид;
EEDQ: 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин;
EtOAc: этилацетат
EtOH: этанол;
ЖХМС: жидкостная хроматомасс-спектрометрия;
HATU: O-(7-Азобензотриазол-1-ил)1,1,3,3-тетраметилурония гексафторфосфат;
HOBt: N-Гидроксибензотриазол;
HBTU: 2-(1H-Бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат;
ВЭЖХ: высокоэффективная жидкостная хроматография;
MeOH: метанол;
NBS: N-бромсукцинамид;
TASF: трис(диметиламино)сульфония дифтортриметилсиликат;
TEA: триэтиламин;
TFA: трифторуксусная кислота;
THF: тетрагидрофуран.
Пример 1. 2-[трет-бутоксикарбонил-(1H-пиррол-2-илметил)-амино]пропионовая кислота

Этиловый эфир аланина b (5 г, 32,5 ммоль), пиррол-2-карбоксальдегид a (3,1 г, 32,5 ммоль), цианоборгидрид натрия (2,04 г, 32,5 ммоль) и AcOH (1%) смешивают в DMF и перемешивают в течение ночи. Реакцию гасят H2O и затем DMF упаривают. Смесь разбавляют EtOAc, промывают 0,1н. NaOH, сушат и концентрируют, получая продукт c, 2,5 г. Полученный сложный эфир c (2,5 г, 12,8 ммоль), ди-трет-бутилдикарбонат (3,06 г, 14 ммоль) смешивают в THF, H2O с NaHCO3 и перемешивают в течение ночи. THF упаривают и затем смесь разбавляют EtOAc, промывают 1н. NaOH, нас. NH4Cl и насыщенным соляным раствором. После сушки смесь концентрируют, получая Boc-защищенный сложный эфир d 3,3 г. Boc-защищенный сложный эфир d (1,67 г, 5,6 моль), лития гидроксид моногидрат (284 мг, 6,77 ммоль) смешивают в THF и H2O при 0°C. THF упаривают, раствор подкисляют разбавленной H2SO4 и дважды экстрагируют EtOAc. Органические слои объединяют, сушат и упаривают, получая продукт 2-[трет-бутоксикарбонил-(1H-пиррол-2-илметил)амино]пропионовую кислоту e.
Пример 2. Тетрагидропиранилглицин
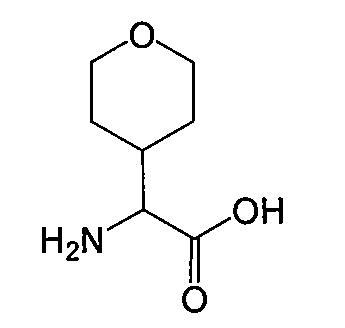
Тетрагидропиранилглицин получают от NovaBiochem, или синтезируют по способу, описанному в: Ghosh, A. K.; Thompson, W. J.; holloway, M. K.; McKee, S. P.; Duong, T. T.; Lee, H. Y.; Munson, P. M.; Smith, A. M.; Wai, J. M; Darke, P. L.; Zugay, J. A.; Emini, E. A.; Schleife, W. A.; Huff, J. R.; Anderson, P. S. J. Med. Chem, 1993, 36, 2300-2310.
Пример 3. Пиперидинилглицин

Пиперидинилглицин синтезируют по способам, описанным Shieh et al. (Tetrahedron: Asymmetry, 2001, 12, 2421-2425).
Пример 4. 4,4-дифторциклогексилглицин
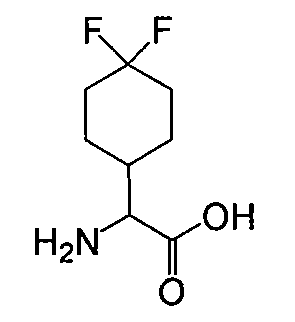
4,4-дифторциклогексилглицин получают по способам, описанным в патентной заявке США 20030216325.
Пример 5. Boc(S)-2-амино-2-(4-гидроксициклогексил)уксусная кислота
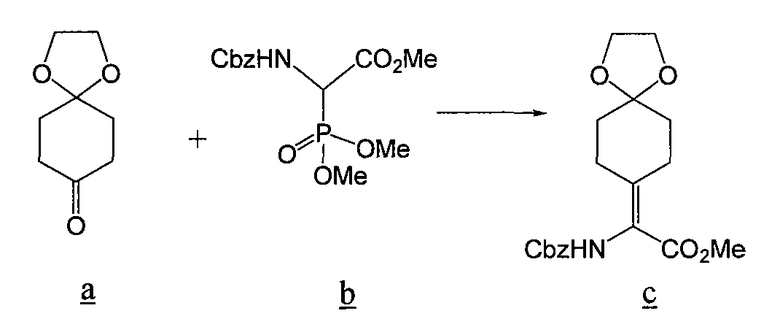
В соответствии со способом, описанным Sheih et al. (Tetrahedron: Asymmetry, 2001, 12, 2421-2425), раствор кетона a (8,4 г) и EtOAc (30 мл) добавляют к раствору N-Cbz-фосфоноглицина метилового эфира b, TMG (4,5 мл) и EtOAc (30 мл). Раствор выдерживают при к.т. в течение 48 ч, после чего промывают 1н. HCl (3×50 мл) и насыщенным соляным раствором (1x50 мл), сушат (Na2SO4), фильтруют и концентрируют. Остаток адсорбируют на целите, очищают хроматографией и затем дополнительно очищают перекристаллизацией из смеси EtOAc/гексаны, получая 5,2 г продукта c.
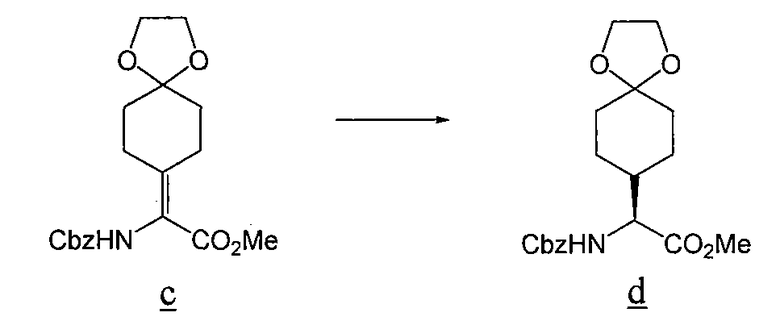
В соответствии со способом, описанным Sheih, (Tetrahedron: Asymmetry, 2001, 12, 2421-2425), раствор енамида c (5,0 г), (S,S)-Me-BPE-Rh(I) (1,5 г, Strem Chemicals, Newburyport, MA), и MeOH (100 мл) встряхивают энергично при давлении H2 70 фунт/кв. дюйм в течение 48 ч. Растворитель удаляют при пониженном давлении. Остаток помещают в EtOAc и фильтруют через SiO2, с использованием EtOAc. Растворитель удаляют при пониженном давлении, получая 4,0 г продукта d в виде бесцветного твердого вещества.
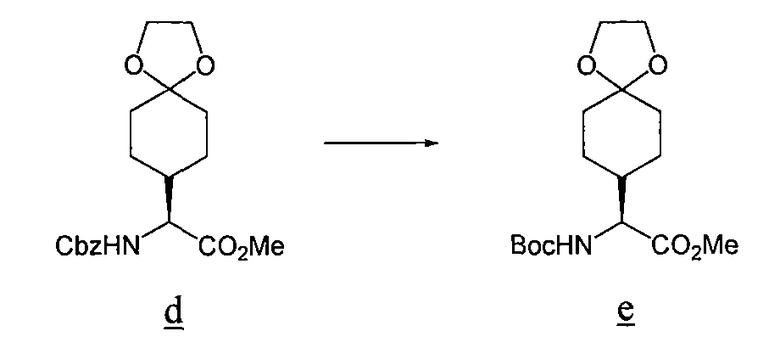
Смесь Cbz-карбамата d, (4,0, г), BoC2O, (2,9 г), 20% Pd(OH)2-C (1,0 г) и MeOH (30 мл) выдерживают при атмосферном давлении H2 в течение 6 ч. Смесь фильтруют через целит с использованием MeOH. Растворитель удаляют при пониженном давлении и получают 4,5 г остатка e, который сразу используют.
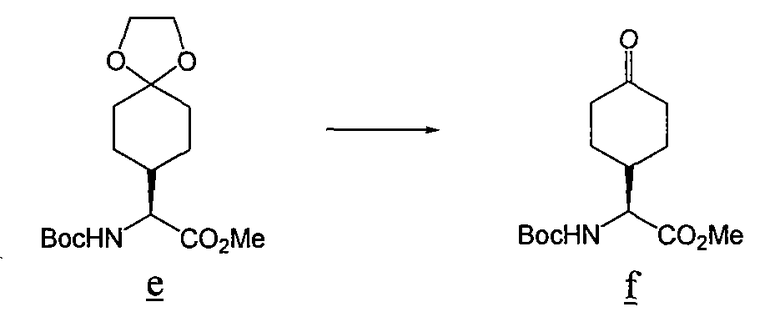
Остаток e, полученный на предыдущей стадии, растворяют в H2O (10 мл), AcOH (30 мл), THF (5 мл) и дихлоруксусной кислоте (3 мл) и выдерживают при к.т. в течение ночи. Добавляют воду (5 мл) и затем раствор и выдерживают до завершения гидролиза, которое регистрируют методом ВЭЖХ-МС. Осторожно добавляют твердый Na2CO3, пока газ не перестанет выделяться, после чего смесь разбавляют водн. NaHCO3 и экстрагируют 10% EtOAc/DCM. Объединенные органические фазы промывают один раз насыщенным соляным раствором, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией, получая 2,9 г продукта f.
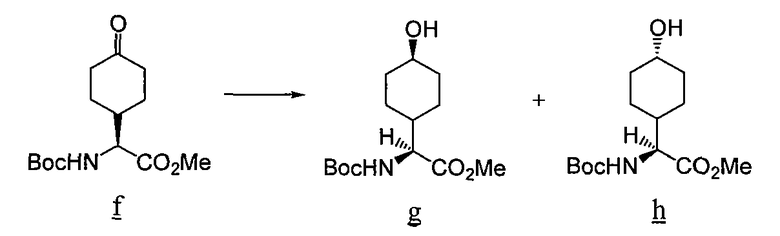
Смесь кетона f (1,5 г) и MeOH (50 мл) обрабатывают NaBH4 (290 мг) при 0°C в течение 20 мин. Смесь подкисляют до ~pH1 10% водным раствором лимонной кислоты и затем MeOH удаляют при пониженном давлении. Остаток разбавляют водой и экстрагируют 20% EtOAc/DCM. Объединенные органические фазы промывают один раз насыщенным соляным раствором, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией, получая 1,17 г продукта g и 0,23 г продукта h.
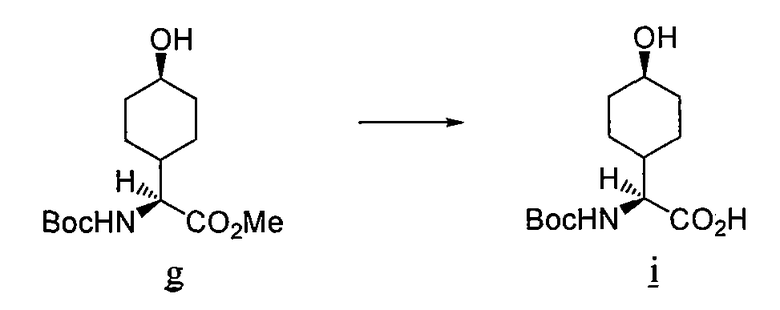
Смесь сложного эфира g (1,17 г), LiOH*H2O (160 мг), THF (3 мл) и воды (4,5 мл) перемешивают энергично при к.т. в течение ночи. Смесь разбавляют насыщенным соляным раствором и полностью экстрагируют EtOAc. Объединенные органические фазы промывают один раз насыщенным соляным раствором, сушат (Na2SO4), фильтруют и концентрируют, получая кислоту i (525 мг).
Пример 6. N-Boc-N-циклопропилметил-L-аланин
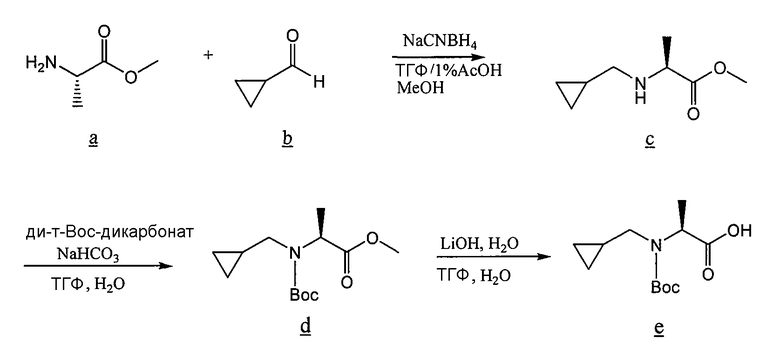
Гидрохлорид метилового эфира L-аланина a (5 г, 35,8 ммоль) и циклопропанкарбоксальдегид b (2,67 мл, 35,8 ммоль) суспендируют в 50 мл THF w/1% AcOH. После добавления 5 мл CH3OH мутный раствор становится прозрачным. Добавляют NaCNBH4 (2,25 г, 35,8 ммоль) и реакционную смесь перемешивают в течение ночи. Реакцию гасят добавлением 1н. водн. раствора NaOH, дважды экстрагируют EtOAc, органические слои сушат над Na2SO4 и концентрируют досуха. Неочищенное вещество очищают хроматографией, используя 30% EtOAc/гексан (окрашивают нингидрином), и получают соединение c (1 г, 18%). Соединение c (1 г, 6,37 ммоль) и ди-т-boc-дикарбонат (2,1 г, 9,55 ммоль) разбавляют THF (20 мл) и H2O (20 мл), после чего добавляют NaHCO3 (1,3 г, 15,9 ммоль). Реакционную смесь перемешивают в течение ночи до завершения реакции. THF удаляют при пониженном давлении и водный слой экстрагируют EtOAc 3 раза. Объединяют органические слои, промывают 1н. NaOH, нас. раствором NH4Cl и затем насыщенным соляным раствором, после чего концентрируют досуха. Boc-защищенное соединение d (1,39 г, 5,40 ммоль) перемешивают с LiOH.H2O (1,14 г, 27 ммоль) в THF (20 мл) и H2O (20 мл) в течение ночи при комнатной температуре. THF удаляют, pH водного слоя доводят до 4 путем добавления 10% лимонной кислоты, затем экстрагируют EtOAc 3 раза. Объединенные органические слои промывают насыщенным соляным раствором и концентрируют. Неочищенное вещество очищают на колонке с обращенной фазой C-18, элюируя смесью 0%-50% ацетонитрил/H2O, и получают чистое соединение e в виде белого твердого вещества (794 мг).
Пример 7. N-Boc-N-метил-L-аланин-L-циклогексилглицин
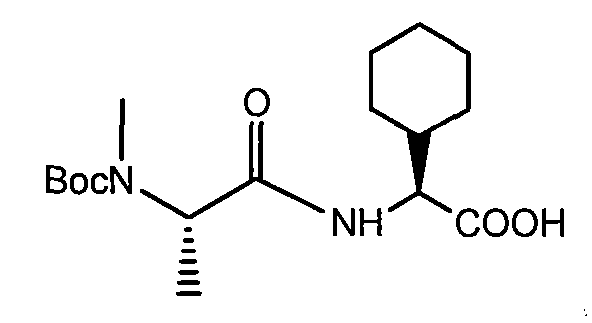
Раствор Fmoc-L-циклогексилглицина (3,6 г, 9,6 ммоль) в DCM (50 мл) и DIPEA (5,6 мл, 32 ммоль) добавляют к 2-хлортритилхлоридной смоле (5 г, 8 ммоль) и осторожно перемешивают в течение 3 часов при комнатной температуре. Смолу промывают DCM 4 раза, DCM/MeOH/DIPEA (17:2:1) 3 раза, DCM 3 раза и 2 раза диметилацетамидом (DMA). Группу Fmoc удаляют путем обработки смолы смесью 20% пиперидин/DMA (50 мл) в течение 15 минут. Смолу промывают DMA 6 раз. К смоле добавляют раствор Boc-N-метилаланина (3,3 г, 16 ммоль), HBTU (6,1 г, 16 ммоль) и DIPEA (5,6 мл, 32 ммоль) и DMA/DCM (1:1, 50 мл), после чего осторожно встряхивают в течение 2 часов при комнатной температуре. Смолу промывают DMA 5 раз, DCM 2 раза и сушат при пониженном давлении. Дипептид отщепляют от смолы путем осторожного встряхивания с HOAc/TFE/DCM (1:1:3, 100 мл) в течение 2 часов при комнатной температуре. Смолу удаляют фильтрацией и раствор концентрируют. Остаток AcOH удаляют путем азеотропной перегонки с гексанами (15-кратный объем). Твердый остаток очищают методом ВЭЖХ на обращенной фазе (C18, MeCN-H2O, 0,1%TFA), растворители удаляют лиофилизацией и получают 1,2 г (43%) дипептида N-Boc-N-метил-L-аланин-L-циклогексилглицин в виде белого порошка.
Пример 8. N-Boc-N-метил-L-аланин-L-дегидропиранилглицин
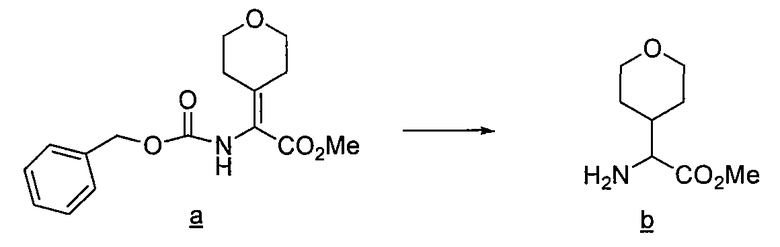
Смесь метилового эфира N-Cbz-дегидропиранилглицина a (Burk, M. J.; Gross, M. F.; Martinez, J. P. J. Am Chem. Soc. 1995, 117, 9375, и ссылки, указанные в данной публикации) (5,2 г, 17 ммоль), 5% Pd-C (500 мг), MeOH (75 мл) и THF (25 мл) выдерживают в атмосфере H2 в течение 24 ч. Смесь фильтруют через целит, который промывают MeOH, и концентрируют при пониженном давлении, получая амин b в виде бесцветного масла (количественный выход), который сразу используют.
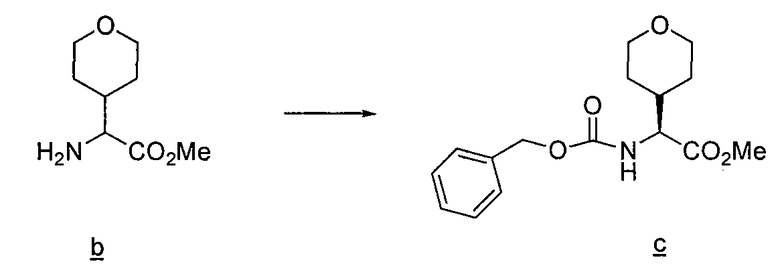
Полученный амин b объединяют с CH2Cl2 (40 мл), насыщенным водным NaHCO3 (40 мл) и охлаждают до 0°C. Затем по каплям добавляют бензилоксикарбонилхлорид (3,0 мл), после чего смесь перемешивают энергично в течение ночи. Фазы разделяют, водную фазу экстрагируют CH2Cl2 (3×20 мл). Объединенные органические фазы промывают насыщенным соляным раствором (1×50 мл), сушат (Na2SO4), фильтруют, абсорбируют на целите и хроматографируют (ISCO, колонка содержит 120 г оксида кремния, градиентное элюирование 5-55% EtOAc-гексаны), получая 4,15 г (80%) рацемического метилового эфира Cbz-пиранилглицина. Энантиомеры разделяют на колонке Chiracel OD, элюируя смесью 10% EtOH-гексаны. В данных условиях целевой S-энантиомер c элюируется первым.
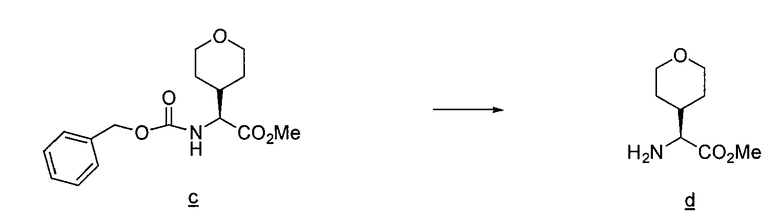
Смесь метилового эфира (S)-N-Cbz-пиранилглицина c (2,4 г, 7,82 ммоль), 10% Pd-C (700 мг), MeOH (80 мл) выдерживают при 1 атмосфере H2 в течение 24 ч. Смесь фильтруют через целит, промывая MeOH, концентрируют при пониженном давлении и получают 1,35 г (100%) амина d в виде бесцветного масла. Альтернативно пиранилглицин можно синтезировать в виде чистого энантиомера по способу Ghosh (Ghosh, A. K.; Thompson, W. J.; Holloway, M. K.; McKee, S. P.; Duong, T. T.; Lee, H. Y.; Munson, P. M.; Smith, A. M.; Wai, J. M.; Darke, P. L.; Zugay, J. A.; Imini, E. A.; Schleif, W. A.; Huff, J. R.; Anderson, P. S. J. Med. Chem., 1993, 36, 2300).
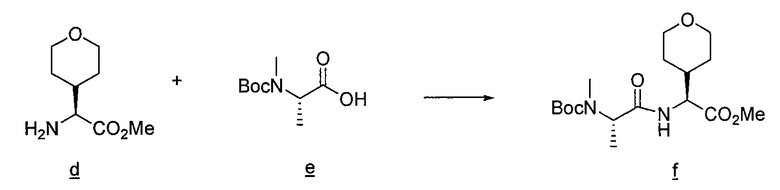
Смесь амина d (1,35 г, 7,8 ммоль), N-Boc-N-метилаланина e (1,74 г, 8,6 ммоль), EDC (1,65 г, 8,8 ммоль) и MeCN (50 мл) выдерживают при к.т. в течение ночи. MeCN удаляют при пониженном давлении, остаток разбавляют EtOAc, промывают 0,5 н. HCl (3×10 мл), 0,5 н. NaOH (3×10 мл), сушат (MgSO4), фильтруют и концентрируют, получая 2,1 г (75%) защищенного дипептида f в виде прозрачного масла.

При 0°C к раствору сложного эфира f (2,10 г, 5,86 ммоль) и THF (50 мл) добавляют LiOH-H2O (1,23 г, 29,3 ммоль) и воду (2 мл). Смесь выдерживают при 0°C в течение 2 ч, затем охлаждающую баню удаляют и смесь перемешивают в течение ночи. Затем большую часть THF удаляют при пониженном давлении, остаток разбавляют CH2Cl2, промывают 0,5н HCl, сушат (MgSO4), фильтруют и концентрируют, получая 1,53 г (78%) дипептида N-Boc-N-метил-L-аланин-L-дегидропиранилглицин g в виде бесцветного твердого вещества.
Пример 9. N-Boc-защищенная циклическая сульфониламинокислота
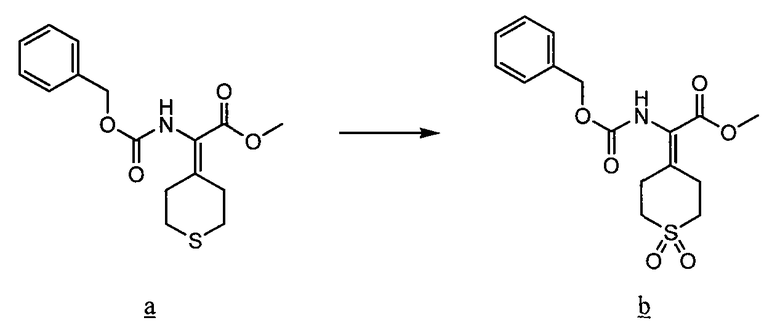
Сульфид a (810 мг, 2,5 ммоль) синтезируют по общему способу Shieh [Shieh, W-C; Xue, S.; Reel, N.; Wu, R.; Fitt, J.; Repic, O. Tetrahedron: Asymmetry, 2001, 12, 2421- 2425] и растворяют в метаноле (25 мл). Оксон (4,5 г) растворяют в деионизированной воде (25 мл). Метанольный раствор субстрата охлаждают до -10°C, после чего к реакционной смеси медленно добавляют водный раствор оксона. Реакционную смесь выдерживают на льду и затем оставляют постепенно нагреваться до комнатной температуры при перемешивании в течение ночи. Реакционную смесь разбавляют деионизированной водой примерно до 150 мл, затем выливают в смесь 90% этилацетат-гексаны и экстрагируют. Органическую фазу сушат (Na2SO4), адсорбируют на целите, очищают хроматографией на колонке, содержащей 40 г ISCO CombiFlash, элюируя 5-90% этилацетат-гексаны в течение 30 мин, и получают 804 мг (2,27 ммоль, 91%) продукта сульфона b.

В соответствии с общим способом Burk [Burk, M. J.; Gross, M. F.; Martinez, J. P. J. Am. Chem. Soc. 1995, 117, 9375-9376.], алкен b (774 мг, 2,19 ммоль), сухой метанол (40 мл) и [(S,S)-Me-BPE-Rh(COD)]+Otf- (500 мг, 0,8 ммоль) смешивают в колбе шейкера Пара, продувая азотом. Колбу Парра вакуумируют, затем заполняют газообразным водородом при 60 фунт/кВ. дюйм и энергично встряхивают в течение ночи. Метанол удаляют при пониженном давлении, после чего неочищенный продукт фильтруют через небольшой слой силикагеля, промывая этилацетатом. После упаривания растворителя получают 730 мг (2,0 ммоль, 94%) продукта c с выходом >98%.
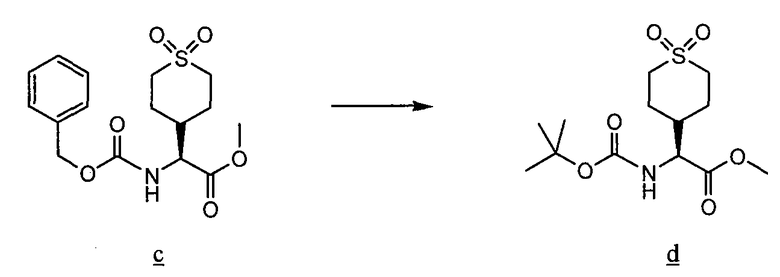
Z-Защищенный сложный аминоэфир c (804 мг, 2,27 ммоль) растворяют в метаноле (16 мл). К полученному раствору добавляют BOC-ангидрид (1,5 г, 6,8 ммоль) и затем 20% Pd(OH)2-C (250 мг). Из реакционной колбы вакуумированием удаляют весь воздух, после чего смесь энергично перемешивают в течение 5 мин. Затем колбу заполняют газообразным водородом и оставляют энергично перемешиваться при комнатной температуре в течение 6 ч. Водород удаляют, смесь фильтруют через целит, промывая метанолом, и после упаривания растворителя получают неочищенный продукт d (508 мг, 1,56 ммоль, выход 70%).
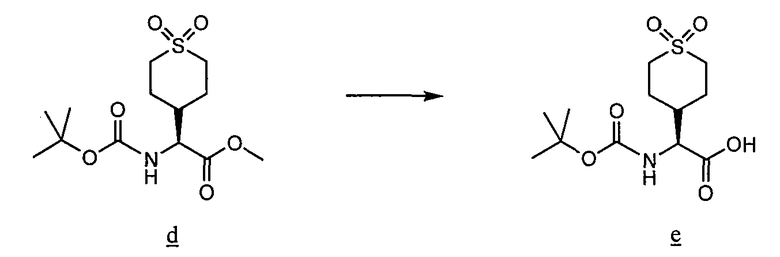
Сложный эфир d (508 мг, 1,56 ммоль) растворяют в 8 мл THF. Добавляют деионизированную воду (4 мл) и затем LiOH.H2O (120 мг, 2,8 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, подкисляют водным 1 н. раствором HCl и экстрагируют этилацетатом (3×25 мл). Затем органические экстракты сушат Na2SO4, фильтруют и концентрируют, получая 372 мг (1,21 ммоль, выход 78%) N-Boc-защищенную циклическую сульфониламинокислоту e, которую используют без дополнительной очистки.
Пример 10. N-Boc-N-метил-L-глицин
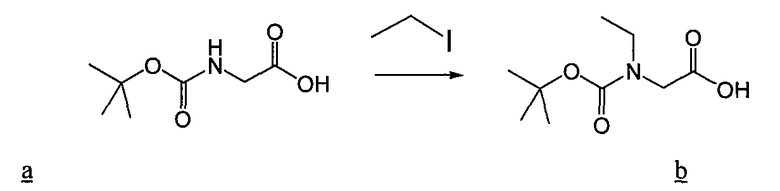
В соответствии с общим способом Grigg [Blaney, P.; Grigg, R.; Rankovic, Z.; Thornton-Pert, M.; Xu, J. Tetrahedron, 2002, 55, 1719-1737], в круглодонную колбу загружают гидрид натрия (480 мг, 60% дисперсия в масле, 12,0 ммоль, 4,0 экв.), после чего колбу продувают азотом в течение 15 мин. В колбу добавляют THF (6,0 мл) и затем суспензию охлаждают до 0°C, используя баню, содержащую воду со льдом. В другую колбу загружают BOC-глицин a (525 мг, 3,0 ммоль), сухой THF (6,0 мл) и этилиодид (1,0 мл, 12 ммоль, 4 экв.). Полученную смесь добавляют по каплям к суспензии NaH в THF при энергичном перемешивании при 0°C. После перемешивания в течение 1 ч реакционную смесь нагревают до комнатной температуры и оставляют перемешиваться в течение ночи. Затем реакционную смесь снова охлаждают до 0°C и очень медленно добавляют метанол (4 мл), чтобы погасить избыток гидрида. Смесь разбавляют деионизированной водой, после чего метанол удаляют при пониженном давлении. Примеси экстрагируют смесью 90% этилацетат-гексаны и затем водный слой подкисляют добавлением твердой лимонной кислоты до pH 2-3. Продукт экстрагируют смесью 90% этилацетат-гексаны. Полученный органический слой сушат (Na2SO4) и фильтруют. После удаления растворителей при пониженном давлении получают продукт b с количественным выходом.
Пример 11. N-Boc-фтор-L-аланин
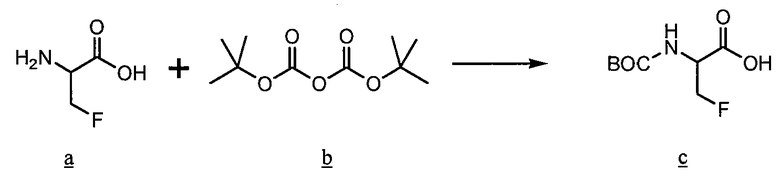
Смесь незащищенной аминокислоты a (775 мг, 7,24 ммоль) и карбоната натрия (1,69 г, 16,0 ммоль) растворяют в смеси 1:1 деионизированной воды и THF (15 мл каждого). Затем добавляют BOC-ангидрид b (1,73 г, 7,96 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, после чего THF удаляют при пониженном давлении. Затем смесь подкисляют до pH 2-3 насыщенным водным раствором лимонной кислоты и продукт экстрагируют смесью 10% этилацетат-дихлорметан. Органический слой сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении, получая прозрачную BOC-защищенную аминокислоту c (1,40 г, 6,7 ммоль, 93%), которую используют без дополнительной очистки.
Пример 12. Соединение 1
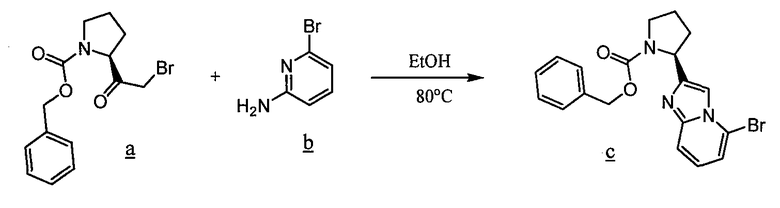
В круглодонной колбе объемом 100 мл соединение a (1,62 г, 4,97 ммоль) и 2-амино-5-бромпиридин b (1,0 г, 6,00 ммоль) смешивают с этанолом (50 мл) и перемешивают при 80°C в течение 48 ч. Затем смесь охлаждают и концентрируют. Остаток адсорбируют на силикагеле и очищают флэш-хроматографией (от 100% DCM до 10% метанол/DCM), получая 881 мг (35,4%) соединения c в виде оранжевого масла. ЖХМС: M/Z = 401.
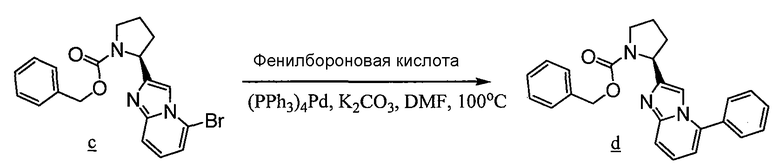
В круглодонной колбе объемом 25 мл смешивают соединение c (150 мг, 0,37 ммоль), фенилбороновую кислоту (68 мг, 0,56 ммоль), тетракис(трифенилфосфин)палладий(0) (30 мг, 0,03 ммоль) и карбонат калия (78 мг, 0,56 ммоль) в DMF (2,0 мл). Смесь перемешивают при 100°C в атмосфере азота в течение 18 ч. Затем смесь охлаждают, разбавляют этилацетатом (30 мл) и промывают водой (50 мл). Водную фазу экстрагируют этилацетатом (30 мл). Объединенные органические фазы промывают насыщенным водным раствором NaHCO3 (50 мл) и насыщенным соляным раствором (50 мл), сушат MgSO4, фильтруют и концентрируют. Остаток адсорбируют на силикагеле и очищают флэш-хроматографией (от 30% этилацетат/гексан до 100% этилацетат), получая 126 мг (84%) соединения d в виде бледно-желтого масла. ЖХМС: M/Z = 398.
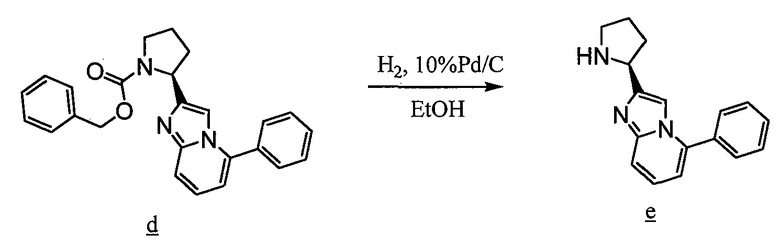
В круглодонной колбе объемом 50 мл соединение d (120 мг, 0,30 ммоль) растворяют в этаноле (10 мл) и добавляют 10% палладий на угле (24 мг). Смесь перемешивают при комнатной температуре в атмосфере водорода в течение 48 ч. Затем смесь фильтруют через целит и промывают этанолом. Фильтрат концентрируют и получают 78 мг (98%) соединения e в виде бледно-желтого масла. ЖХМС: M/Z = 264.

В круглодонной колбе объемом 10 мл смешивают соединение e (78 мг, 0,30 ммоль), соединение f (120 мг, 0,36 ммоль), N,N-диизопропилкарбодиимид (0,074 мл, 0,47 ммоль) и 1-гидрокси-7-азабензотриазол (64 мг, 0,47 ммоль) в дихлорметане (2,0 мл). Смесь перемешивают при комнатной температуре в атмосфере азота в течение 5 ч. Затем смесь концентрируют на силикагеле и очищают флэш-хроматографией (от 100% DCM до 7% MeOH/DCM), получая 182 мг (50%) соединения g в виде бледно-желтого масла. ЖХМС: M/Z = 590.
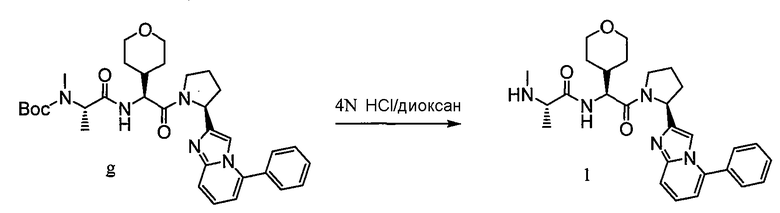
В круглодонной колбе объемом 25 мл соединение g (192 мг, 0,33 ммоль) растворяют в 4 н. растворе хлористого водорода в диоксане (4 мл, 30 ммоль). Смесь перемешивают при комнатной температуре в течение 1 ч. Затем смесь концентрируют и остаток очищают методом ВЭЖХ, получая 13,3 мг (8,3%) соединения l в виде белого твердого вещества. ЖХМС: M/Z = 490.
Пример 13. (S)-бензил-2-(2-бромацетил)пирролидин-1-карбоксилат
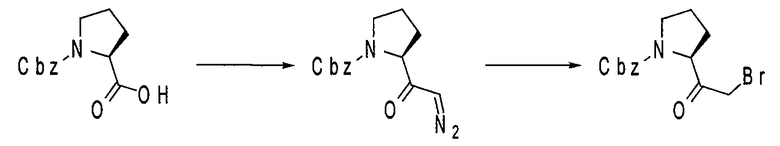
Альфа-бромкетон получают по общему способу Bures and Kulhanek (Tetrahedron: Assymetry (2005) 16(7): 1347-1354).
Раствор Diazald (4,9991 г, 23,3 ммоль), сульфата натрия (20,14 г) и диэтилового эфира (15 мл) перемешивают в течение 15 мин. Полученную смесь фильтруют, добавляют по каплям к раствору гидроксида калия (5,0050 г) в воде (8 мл) и этаноле (10 мл) при 65°C в мини-аппарате Diazald и затем перегоняют, пока реакционная смесь не приобретет бледно-желтый цвет. После перегонки диазометановый раствор хранят над гранулами гидроксида натрия при 4°C.
К раствору Cbz-Pro-OH (2,9986 г, 12,0 ммоль) в сухом тетрагидрофуране (40 мл) и сухом диэтиловом эфире (40 мл) добавляют триэтиламин (1,7 мл, 12,2 ммоль). Раствор охлаждают до -25°C и по каплям добавляют изобутилхлорформат (1,6 мл, 12,3 ммоль). Полученный раствор перемешивают при -25°C в течение 30 мин и затем нагревают до -10°C. К реакционной смеси добавляют диазометановый раствор. Образец перемешивают при -10°C в течение 1 часа. Реакционную смесь концентрируют до половины первоначального объема и промывают один раз насыщенным раствором бикарбоната натрия (50 мл). Органический слой сушат над сульфатом магния и фильтруют. Неочищенное вещество адсорбируют на силикагеле и очищают флэш-хроматографией (40 г, SiO2, 0-50% этилацетата в гексанах), получая диазокетон (2,29 г, 8,3 ммоль, 69%).
Диазокетон (1,72 г, 6,3 ммоль) растворяют в уксусной кислоте (40 мл) и охлаждают до 0°C. К раствору добавляют по каплям 48% HBr (1,1 мл, 9,7 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. Образец выливают на лед и добавляют бикарбонат натрия (5 г). Раствор экстрагируют дихлорметаном (3×100 мл). Органические экстракты промывают насыщенным раствором бикарбоната натрия (3×100 мл). Дихлорметановые экстракты сушат над сульфатом магния, фильтруют и концентрируют, получая α-бромкетона (S)-бензил-2-(2-бромацетил)пирролидин-1-карбоксилат (1,771 г, 5,4 ммоль, 86%). При хранении в чистом виде α-бромкетон является нестабильным при комнатной температуре, а также при 4°C.
Пример 14. (S)-бензил 2-(8-фенилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат

(S)-Бензил-2-(2-бромацетил)пирролидин-1-карбоксилат (1,771 г, 5,4 ммоль), 2-амино-3-бромпиридин (0,9412 г, 5,4 ммоль) и этанол (20 мл) объединяют в атмосфере азота. Реакционную смесь нагревают до 78°C и перемешивают в течение ночи. Образец концентрируют и добавляют насыщенный раствор бикарбоната натрия (50 мл). Смесь экстрагируют этилацетатом (3×50 мл). Этилацетатные экстракты сушат над сульфатом магния и фильтруют. Неочищенное вещество адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-100% этилацетата в гексанах), получая (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,869 г, 8,3 ммоль, 2,2 ммоль, 40%).
В сосуд для микроволновой печи объемом 2-5 мл, оборудованный мешалкой, добавляют (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,258 г, 0,644 ммоль), фенилбороновую кислоту (0,1026 г, 0,8415 ммоль) и карбонат калия (0,142 г, 1,03 ммоль). Реакционный сосуд вакуумируют и продувают N2 три раза. После добавления тетракис(трифенилфосфин)палладия(0) (0,0395 г, 0,0342 ммоль) сосуд вакуумируют и продувают N2 пять раз. Затем добавляют 3 мл ДМФ и 1 мл не содержащей свободного кислорода H2O, после чего сосуд подвергают микроволновому облучению при 130°C в течение 40 мин. Если анализ ЖХ/МС показывает, что исходное вещество отсутствует, реакционную смесь выливают в 200 мл H2O и экстрагируют этилацетатом (3×50 мл), после чего объединенные экстракты сушат MgSO4, фильтруют и концентрируют при пониженном давлении. Неочищенное вещество растворяют в дихлорметане и наносят на колонку 12 г, уравновешенную гексанами. Вещество элюируют градиентом от 0% до 50% этилацетата в гексанах. Фракции, содержащие продукт, объединяют и упаривают при пониженном давлении, получая целевой имидазопиридин (S)-бензил 2-(8-фенилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат.
Пример 15. (2S)-бензил 2-(8-o-толилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат
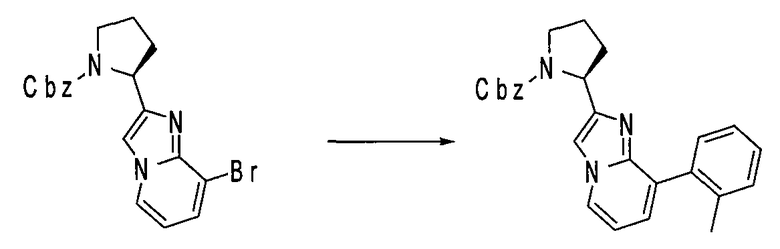
В соответствии со способом примера 14, (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,250 г, 0,62 ммоль), o-толилбороновую кислоту (0,1101 г, 0,81 ммоль), карбонат калия (0,1292 г, 0,93 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0360 г, 0,03 ммоль) подвергают взаимодействию с получением неочищенного (2S)-бензил 2-(8-o-толилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилата. Неочищенное вещество адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-70% этилацетата в гексанах), получая конечный продукт (0,247 г, 0,60 ммоль, 74%).
Пример 16. (2S)-бензил-2-(8-(2-(трифторметил)фенил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат
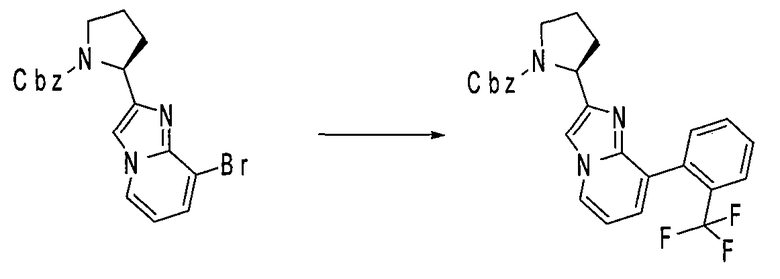
В соответствии со способом примера 14, (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,250 г, 0,62 ммоль), 2-трифторметилфенилбороновую киислоту (0,1538 г, 0,81 ммоль), карбонат калия (0,1292 г, 0,93 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0360 г, 0,03 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-100% этилацетата в гексанах), получая (2S)-бензил-2-(8-(2-(трифторметил)фенил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,264 г, 0,57 ммоль, 70%).
Пример 17. (2S)-бензил-2-(8-(2-метоксифенил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат

В соответствии со способом примера 14, (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,250 г, 0,62 ммоль), 2-метоксифенилбороновую киислоту (0,1231 г, 0,81 ммоль), карбонат калия (0,1292 г, 0,93 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0360 г, 0,03 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-100% этилацетата в гексанах), получая (2S)-бензил-2-(8-(2-метоксифенил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,269 г, 0,63 ммоль, 78%).
Пример 18. (2S)-бензил-2-(8-(нафтален-1-ил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат
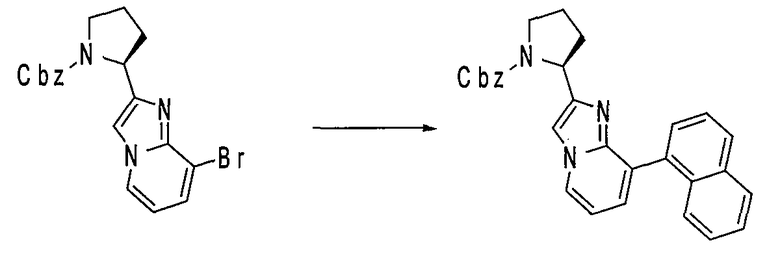
В соответствии со способом примера 14, (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,250 г, 0,62 ммоль), 1-нафтилбороновую киислоту (0,1405 г, 0,82 ммоль), карбонат калия (0,1340 г, 0,97 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0430 г, 0,04 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-50% этилацетата в гексанах), получая (2S)-бензил 2-(8-(нафтален-1-ил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,183 г, 0,41 ммоль, 66%).
Пример 19. (2S)-бензил-2-(8-(2-фторфенил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат
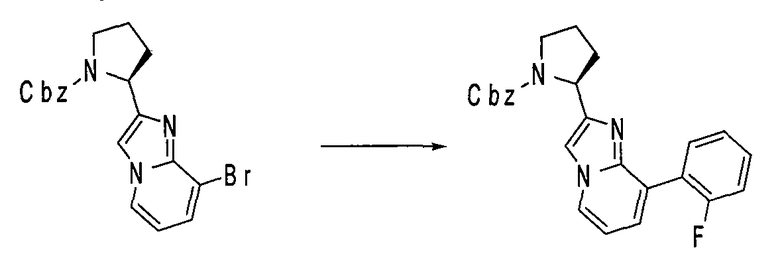
В соответствии со способом примера 14, (S)-бензил-2-(8-бромимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,2489 г, 0,62 ммоль), 2-фторфенилбороновую киислоту (0,1217 г, 0,87 ммоль), карбонат калия (0,1449 г, 1,05 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0532 г, 0,05 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-60% этилацетата в гексанах), получая (2S)-бензил 2-(8-(2-фторфенил)имидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,62 ммоль, 100%).
Пример 20. (S)-бензил-2-(6-метил-8-фенилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат
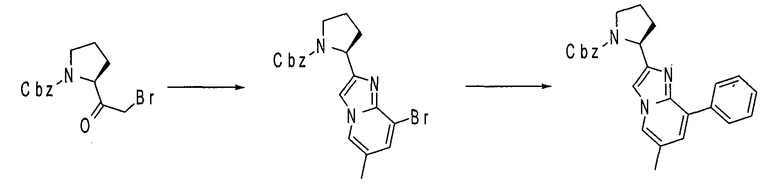
В соответствии со способом примера 14, (S)-бензил-2-(2-бромацетил)пирролидин-1-карбоксилат (0,295 г, 0,90 ммоль) и 2-амино-3-бром-5-метилпиридин (0,1765 г, 0,94 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (12 г SiO2, 0-50% этилацетата в гексанах), получая (S)-бензил-2-(8-бром-6-метилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,165 г, 0,40 ммоль, 44%).
(S)-бензил-2-(8-бром-6-метилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,165 г, 0,40 ммоль), фенилбороновую киислоту (0,0740 г, 0,61 ммоль), карбонат калия (0,1449 г, 0,65 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0351 г, 0,03 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-50% этилацетата в гексанах), получая (S)-бензил-2-(6-метил-8-фенилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,40 ммоль, 100%).
Пример 21. (S)-бензил-2-(7-метил-8-фенилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат
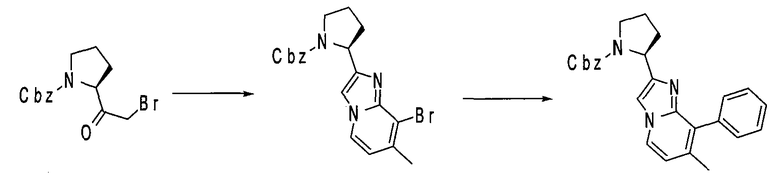
В соответствии со способом примера 14, (S)-бензил-2-(2-бромацетил)пирролидин-1-карбоксилат (0,400 г, 1,23 ммоль) и 2-амино-3-бром-4-метилпиридин (0,2344 г, 1,25 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (12 г SiO2, 0-50% этилацетата в гексанах), получая (S)-бензил-2-(8-бром-7-метилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,239 г, 0,58 ммоль, 47%).
(S)-бензил 2-(8-бром-7-метилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,239 г, 0,58 ммоль), фенилбороновую киислоту (0,0936 г, 0,77 ммоль), карбонат калия (0,1496 г, 1,08 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,0534 г, 0,05 ммоль) подвергают взаимодействию с получением неочищенного вещества, которое адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-60% этилацетата в гексанах), получая (S)-бензил 2-(7-метил-8-фенилимидазо[1,2-a]пиридин-2-ил)пирролидин-1-карбоксилат (0,58 ммоль, 100%).
Пример 22. Анализы ингибирования IAP
В описанных ниже экспериментах используют химерный домен BIR, обозначаемый MLXBIR3SG, в котором 11 из 110 остатков соответствуют остаткам, обнаруженным в XIAP-BIR3, а остальные соответствуют остаткам ML-IAP-BIR. Показано, что химерный белок MLXBIR3SG связывает и ингибирует каспазу-9 гораздо эффективнее, чем любой из нативных доменов BIR, а пептиды на основе Smac и зрелый Smac он связывает с аффинностью, подобной аффинности нативного ML-IAP-BIR. Более эффективное ингибирование каспазы-9 под действием химерного домена BIR MLXBIR3SG, трансфицированного в клетки MCF7, коррелирует с более эффективным ингибированием доксорубицин-индуцированного апоптоза. Последовательность MLXBIR3SG:
MGSSHHHHHHSSGLVPRGSHMLETEEEEEEGAGATLSRGPAFPGMGSEELRLASFYDW PLTAEVPPELLAAAGFFHTGHQDKVRCFFCYGGLQSWKRGDDPWTEHAKWFPGCQFLL RSKGQEYINNIHLTHSL (SEQ ID NO: 1)
Анализ связывания пептидов методом TR-FRET
Конкурентные эксперименты по резонансному переносу энергии флуоресценции с разрешением во времени проводят на счетчике для разных видов меток (Multilabeled Counter Reader) Wallac Victor2 (Perkin Elmer Life and Analytical Sciences, Inc.) по способу Kolb et al. (Journal of Biomolecular Screening, 1996, 1(4):203). Смесь реагентов, содержащую 300 нМ his-меченного MLXBIR3SG; 200 нМ биотинилированного пептида SMAC (AVPI); 5 мкг/мл анти-his аллофикоцианина (XL665) (CISBio International); и 200 нг/мл стрептавидина-европия (Perkin Elmer), получают в буфере для реагентов (50 мМ Tris [pH 7,2], 120 мМ NaCl, 0,1% бычьих глобулинов, 5 мМ DTT и 0,05% октилглюкозида). (Альтернативно данная смесь может содержать меченные европием антитела против His (Perkin Elmer) и стрептавидин-аллофикоцианин (Perkin Elmer) в концентрациях 6,5 нМ и 25 нМ соответственно). Смесь реагентов инкубируют при комнатной температуре в течение 30 минут. После инкубации смесь добавляют к 1:3 серийным разведениям антагонистического соединения (исходная концентрация 50 мкМ) в 384-луночных черных планшетах FIA (Greiner Bio-он, Inc.). После инкубации в течение 90 минут при комнатной температуре считывают флуоресценцию, используя фильтры для длины волны возбуждения европия (340 нм) и для длин волн испускания европия (615 нм) и аллофикоцианина (665 нм). Результаты анализа антагонистической активности рассчитывают как отношение сигнала испускания аллофикоцианина при 665 нм к сигналу испускания европия при 615 нм (данное отношение умножают на 10000 для упрощения обработки данных). Строят графики зависимости полученных значений от концентрации антагониста, после чего функцию подгоняют к уравнению с 4 параметрами, используя программное обеспечение Kaleidograph (Synergy Software, Reading, PA). Показатели антагонистической активности определяют на основе значений IC50.
Анализ связывания пептидов с использованием поляризации флуоресценции
Эксперименты по поляризации проводят на Analyst HT 96-384 (Molecular Devices Corp.) по способу Keating, S.M., Marsters, J, Beresini, M., Ladner, C, Zioncheck, K., Clark, K., Arellano, F., и Bodary., S. (2000) in Proceedings of SPIE: In Vitro Diagnostic Instrumentation (Cohn, G.E., Ed.) pp 128-137, Bellingham, WA. Образцы для измерения аффинности методом поляризации флуоресценции получают путем добавления 1:2 серийных разведений MLXBIR3SG, начиная с конечной концентрации 5 мкМ, в буфере для поляризации (50 мМ Tris [pH 7,2], 120 мМ NaCl, 1% бычьих глобулинов, 5 мМ DTT и 0,05% октилглюкозида) к 5-карбоксифлюоресцеин-конъюгированному AVPdi-Phe-NH2 (AVP-diPhe-FAM) с конечной концентрацией 5 нМ.
Зонд AVP-diPhe-FAM
Реакции прочитывают после инкубации в течение 10 минут при комнатной температуре с помощью фильтров отсечения, обычно используемых для флюорофора флюоресцеина (λex = 485 нм; λem = 530 нм) в 96-луночных черных планшетах HE96 (Molecular Devices Corp.). Строят графики зависимости значений флуоресценции от концентрации белка, после чего определяют значения IC50 путем подгонки данных к уравнению с 4 параметрами с помощью программного обеспечения Kaleidograph (Synergy software, Reading, PA). Конкурентные эксперименты проводят путем добавления MLXBIR3SG в концентрации 30 нМ в лунки, содержащие 5 нМ зонда AVP-diPhe-FAM, а также 1:3 серийные разведения антагонистических соединений, начиная с концентрации 300 мкМ, в буфере для поляризации. Образцы прочитывают после инкубации в течение 10 минут. Строят график зависимости поляризации флуоресценции от концентрации антагониста, после чего определяют значения IC50 путем подгонки данных к уравнению с 4 параметрами с помощью программного обеспечения Kaleidograph (Synergy software, Reading, PA). Константы ингибирования (Ki) для антагонистов определяют на основе значений IC50. Соединения данного изобретения, тестируемые с помощью данного анализа, имеют Ki менее 50 мкМ. Например, соединение 7 имеет Ki 18,917, соединение 20 имеет Ki 1,8312, соединение 1 имеет Ki 0,0891 и соединение 8 имеет Ki 2,3067.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ IAP | 2006 |
|
RU2451025C2 |
| ИНГИБИТОРЫ IAP | 2008 |
|
RU2491276C2 |
| ИНГИБИТОРЫ IAP | 2005 |
|
RU2401840C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2552533C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2571662C2 |
| БИСЧЕТВЕРТИЧНЫЕ СОЛИ АЛКАЛОИДА ХИННОГО ДЕРЕВА В КАЧЕСТВЕ АСИММЕТРИЧЕСКИХ МЕЖФАЗНЫХ КАТАЛИЗАТОРОВ | 2013 |
|
RU2667909C2 |
| АНТИГЕЛЬМИНТНЫЕ СОЕДИНЕНИЯ, ВКЛЮЧАЮЩИЕ СТРУКТУРУ АЗАИНДОЛОВ | 2020 |
|
RU2833563C1 |
| СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ МУКОЗИТА | 2012 |
|
RU2606128C2 |
| ПРОИЗВОДНЫЕ 1, 2, 4-ТРИАЗИН-6-ОНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2401833C2 |
| Ингибиторы ENPP1 и способы модуляции иммунного ответа | 2018 |
|
RU2800798C2 |

Настоящее изобретение относится к новым соединениям общей формулы 1:
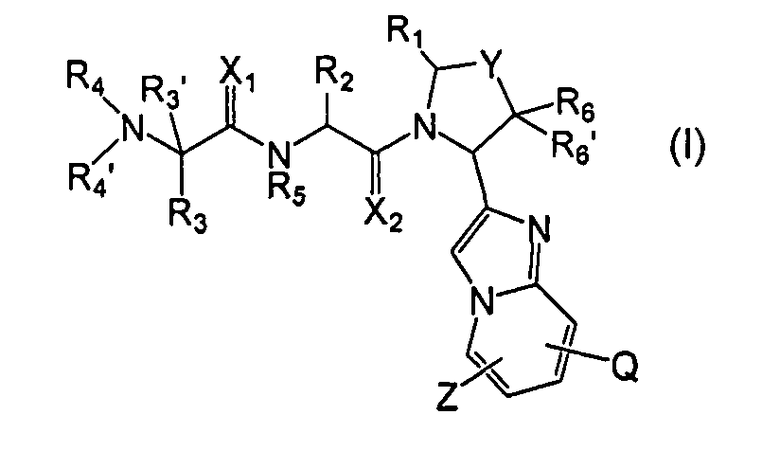
где Q, X1, X2, Y, Z, R1, R2, R3, R3', R4, R4', R5, R6, R6' и n имеют значения, указанные в описании. Эти соединения являются ингибиторами IAP, которые можно использовать в качестве терапевтических средств для лечения злокачественных заболеваний. 6 н. и 7 з.п. ф-лы, 20 пр.
1. Соединение формулы (I)
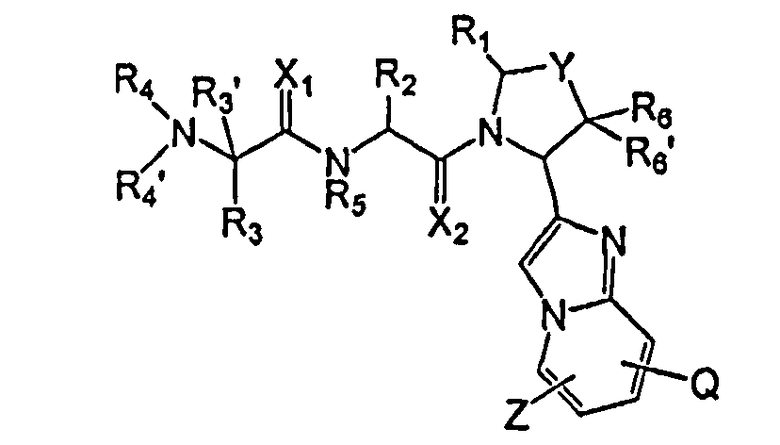
где каждый из X1 и X2 обозначает О;
Y обозначает CH2;
Z обозначает Н, алкил или фенил;
Q обозначает Н, галоген, фенил или нафтил; где указанные фенил или нафтил необязательно замещены одним или несколькими заместителями, выбранными из группы, включающей гидроксил, алкокси, галоген, необязательно замещенный алкил, амино или нитро; и где одна или несколько групп CH2 или CH алкила необязательно заменены на -O-, -N(R8)-, -C(O)-NR8-, или замещены галогеном;
R1 обозначает H;
R2 обозначает тетрагидропиранил или циклогексил;
R3 обозначает H или алкил;
R3' обозначает H;
R4 и R4' независимо обозначают H или алкил;
R5 обозначает H;
каждый из R6 и R6' обозначает H;
R8 обозначает H или алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где Z обозначает Н или алкил.
3. Соединение по п.1, где Q обозначает фенил или нафтил, необязательно замещенный алкилом и где одна или несколько групп CH2 или CH вышеуказанного алкила необязательно заменены на -O-, -N(R8)-, -C(O)-NR8-, или замещены галогеном.
4. Соединение по п.1, где R3 обозначает метил.
5. Соединение по п.2, где R1 обозначает H; R2 обозначает циклогексил; R3 обозначает метил; R3' обозначает H; R4 обозначает H; R4' обозначает H; R5 обозначает H; X1 и X2 оба обозначают O; a R6 и R6' оба обозначают H.
6. Соединение по п.1, где соединение выбирают из:
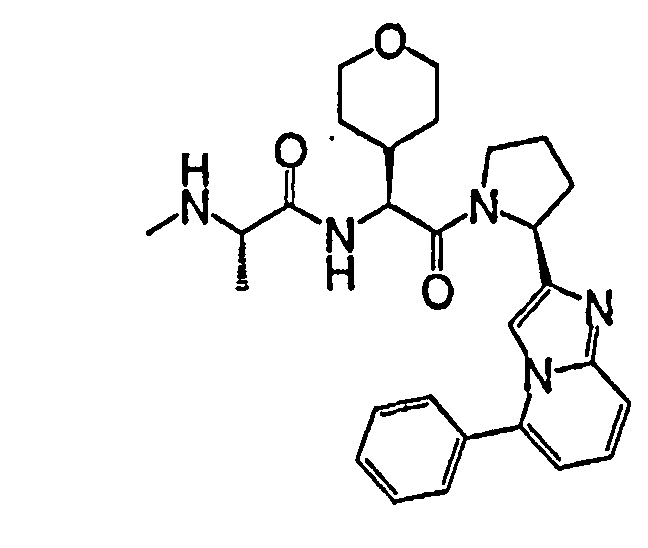 ,
, 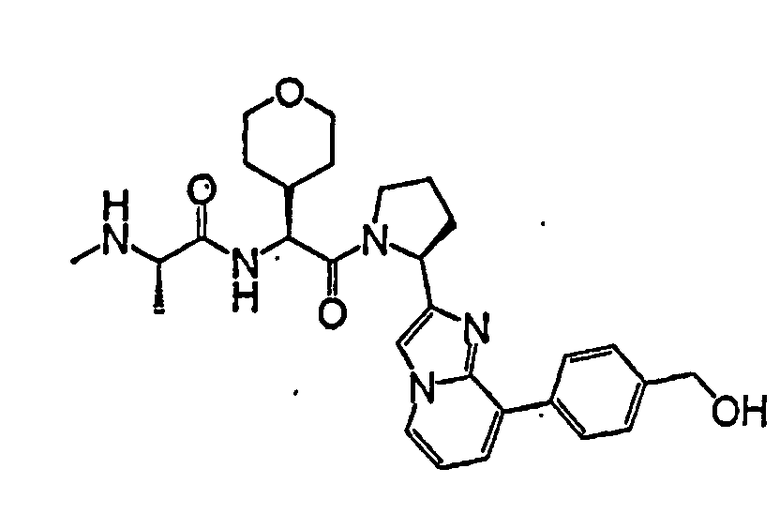 ,
,
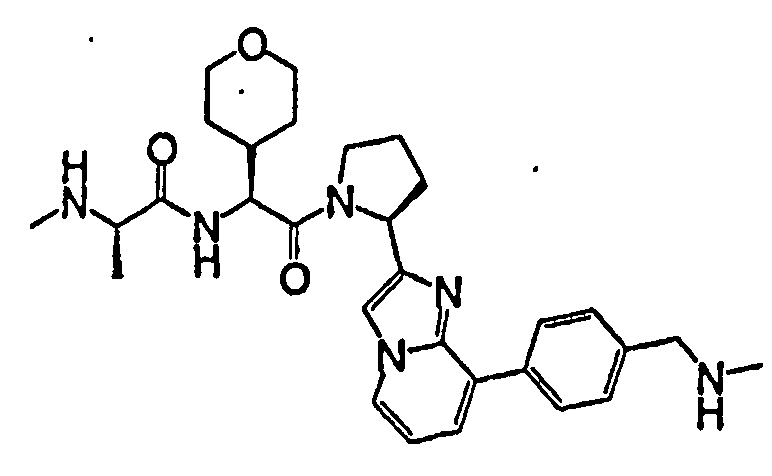 ,
,  ,
,
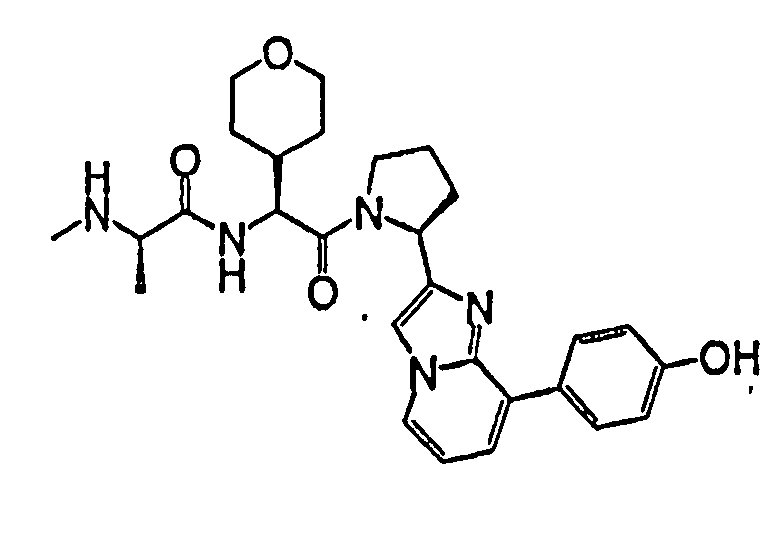 ,
, 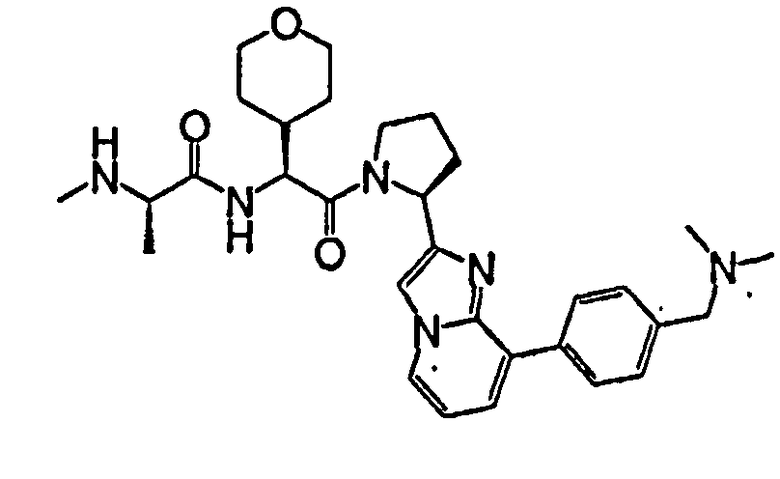 ,
,
 ,
, 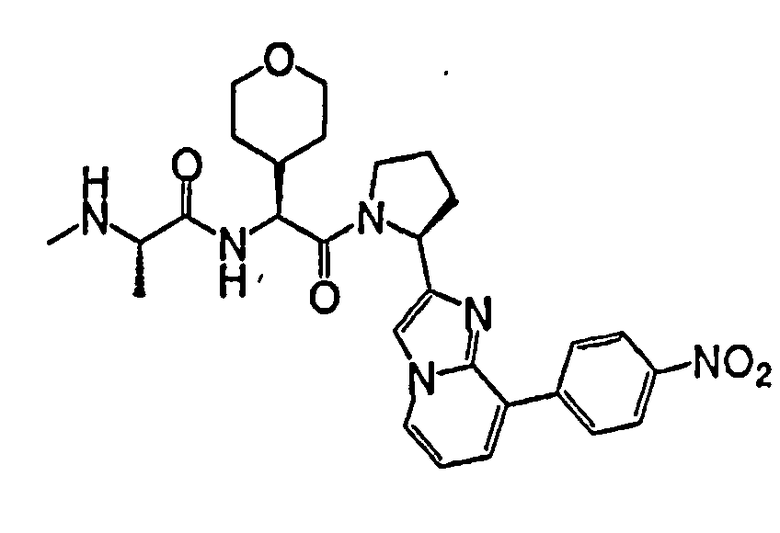 ,
,
 ,
, 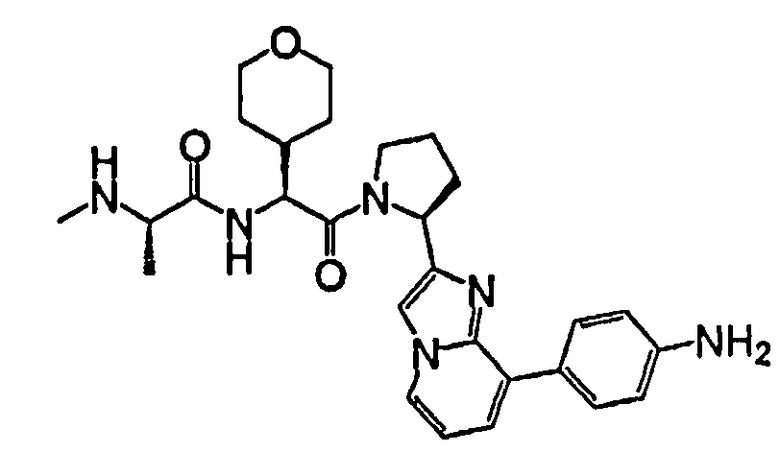 ,
,
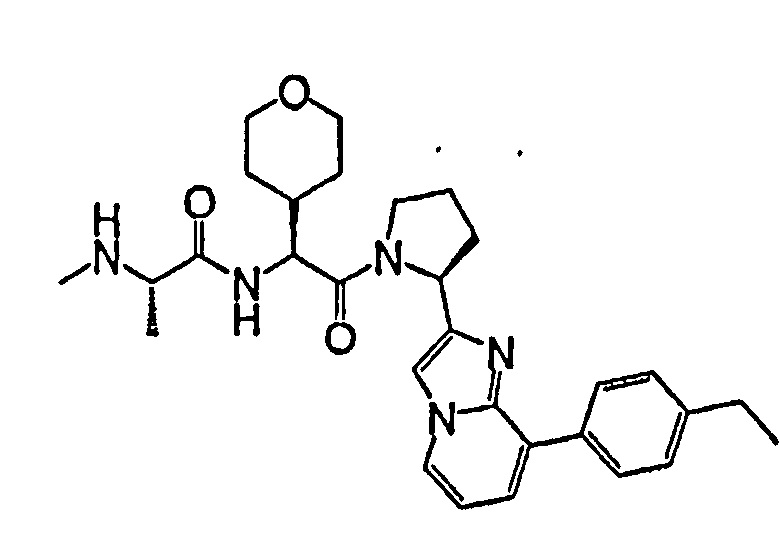 ,
, 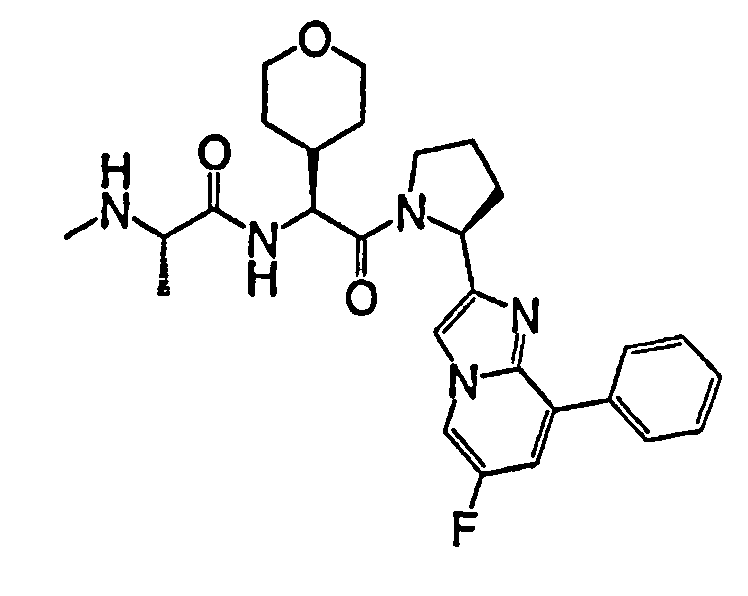 ,
,
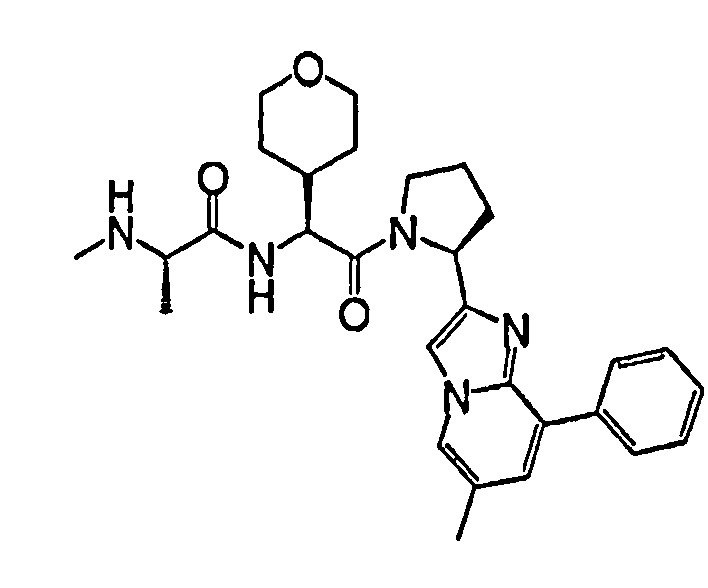 ,
,  ,
,
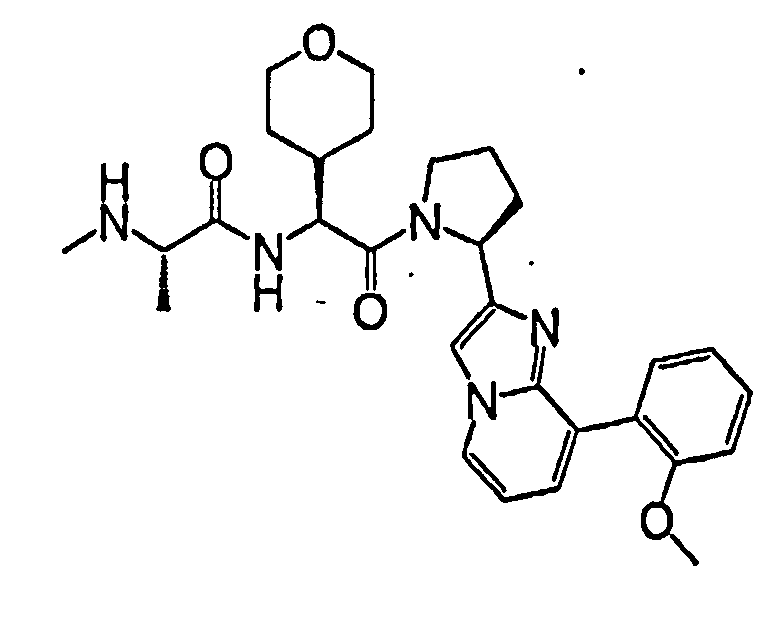 ,
, 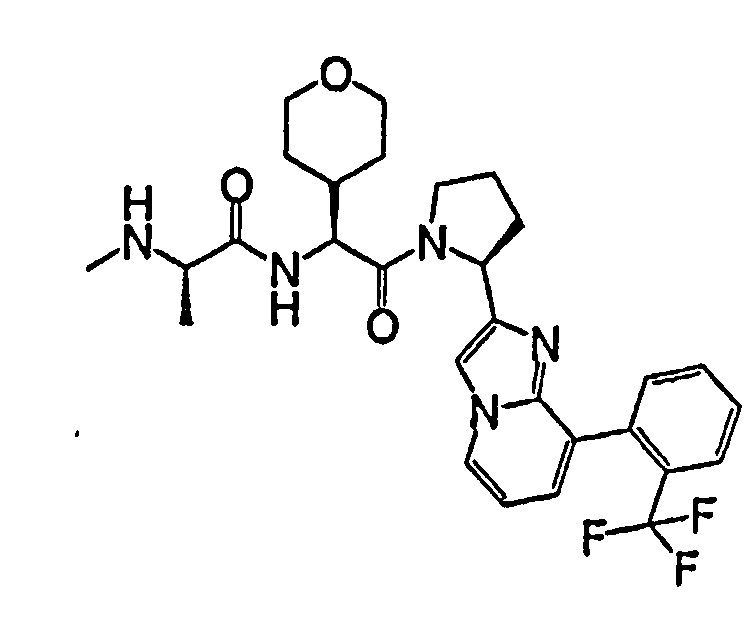 ,
,
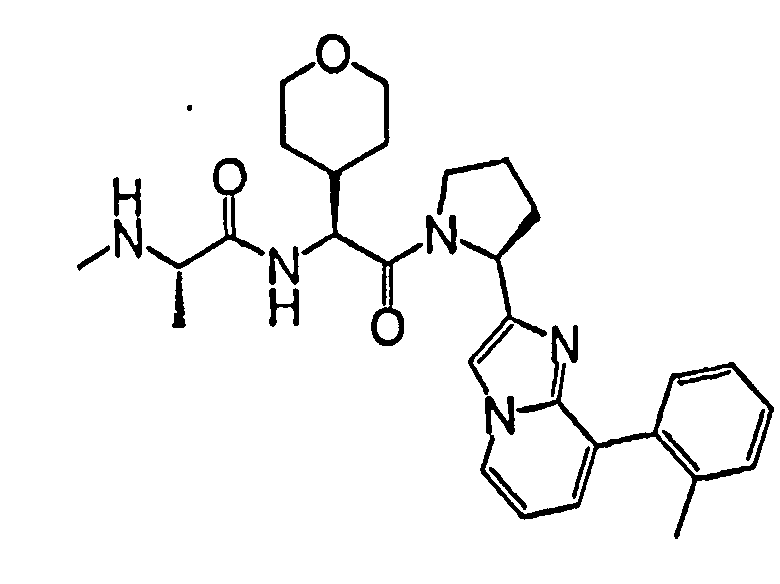 ,
, 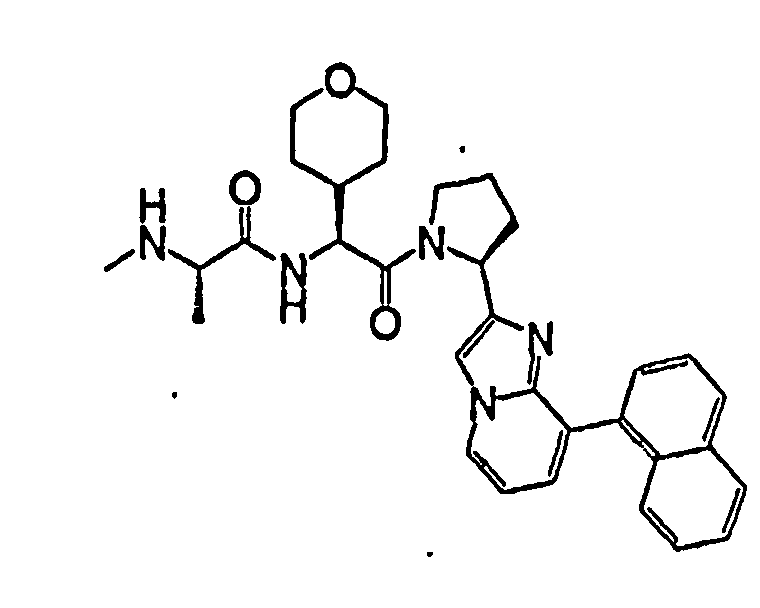 ,
,
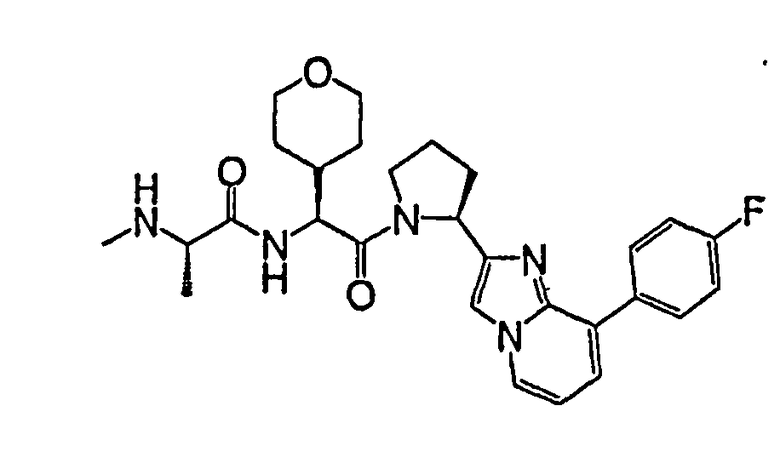 ,
,  ,
,
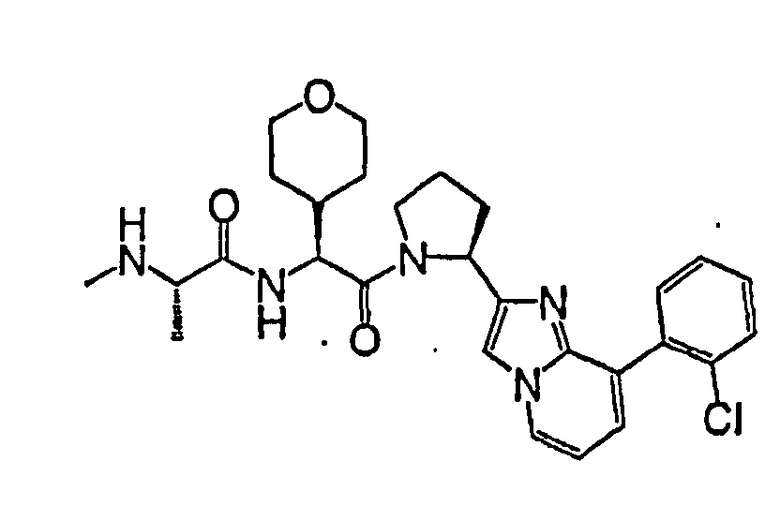 и
и  ,
,
или его фармацевтически приемлемая соль.
7. Способ индуцирования апоптоза в клетке, включающий введение в указанную клетку соединения по п.1.
8. Способ сенсибилизации клетки к апоптотическому сигналу, включающий введение в указанную клетку соединения по п.1.
9. Способ по п.8, где указанный апоптотический сигнал индуцируется путем контактирования указанной клетки с соединением, выбранным из группы, включающей цитарабин, флударабин, 5-фтор-2'-дезоксиуридин, гемцитабин, метотрексат, блеомицин, цисплатин, циклофосфамид, адриамицин (доксорубицин), митоксантрон, камптотецин, топотекан, кольцемид, колхицин, паклитаксел, винбластин, винкристин, тамоксифен, финастерид, таксотере и митомицин С, или облучением.
10. Способ по п.8, где указанный апоптотический сигнал индуцируется путем контактирования указанной клетки с Apo2L/TRAIL.
11. Способ ингибирования связывания белка IAP с белком каспазой, включающий контактирование указанного белка IAP и соединения по п.1.
12. Способ лечения заболевания или состояния, связанного со сверхэкспрессией IAP у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
13. Способ лечения рака, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
| WO 2006069063, 29.06.2006 | |||
| WO 2004005248, 15.01.2004 | |||
| WO 2005097791, 20.10.2005 | |||
| RU 2005141059, 23.06.2004. |
Авторы
Даты
2012-11-10—Публикация
2007-12-14—Подача