Изобретение относится к биологии и медицине, а именно - к области цитогенетического анализа - оценке анеуплоидии при определении генотоксических эффектов.
Анеуплоидия - изменение количества генетического материала в клетке по сравнению с нормой, возникающее при неравновесном делении - аномальной репликации целой хромосомы, как, например, при синдроме Дауна, либо при утрате одной или нескольких хромосом.
Морфометрия - количественная характеристика формы (длина, площадь, объем и т.д.).
Доза - количество вещества (фактора среды), введенное или попавшее в исследуемый объект, выражается в весовых, объемных или условных (биологических) единицах.
Из литературы известны следующие цитогенетические методы оценки генотоксических эффектов:
- микроядерный тест на клетках, культивированных в присутствии цитохалазина В, оценивающий частоту двуядерных клеток с микроядрами (Fenech, Morley, 1985; Yager et al., 1988; Pascoe, Stemp, 1990; Kocisova, Sram, 1990; Fenech et al., 2003);
- модифицированный микроядерный тест (микроядерный тест на клетках, культивированных в присутствии цитохалазина В, оценивающий - дополнительно к частоте двуядерных клеток с микроядрами - частоту делящихся клеток с микроядрами и нуклеоплазменными мостами, а также степень асимметрии деления клеток, особенности пролиферации клеток в культуре и частоту апоптоза) (Ингель, 2006; Ингель и др., 2006);
- метод оценки частоты хромосомных аберраций (изменения структуры хромосом, вызванные их разрывами, с последующим перераспределением, утратой или удвоением генетического материала). (Agence Internationale de l'Energie Atomique, 1984; Doloy, Malarbet, Guedency et al., 1991; Ludwików, Yun Xiao, Hoebe et al., 2002);
- метод оценки частоты сестринских хроматидных обменов (Tucker, Ashworth, Johnson et al., 1988; Sonmez, Kaya, Aktas et al., 1998; Lei, Hwang, Chang et al., 2002).
Нарушения числа хромосом могут быть выражены отсутствием одной из пары гомологичных хромосом (моносомия) или появлением добавочной, третьей, хромосомы (трисомия). Общее количество хромосом в кариотипе в этих случаях отличается от модального числа и для человека равняется 45 или 47.
Оценка степени анеуплоидии производится путем:
- подсчета количества хромосом на рутинно окрашенных метафазных пластинках, полученных в результате культивирования митогенстимулированных клеток крови с последующим накоплением клеток на стадии метафазы в присутствии колхицина (Agence Internationale de l'Energie Atomique, 1984; Doloy, Malarbet, Guedeney et. al., 1991; Ludwików, Yun Xiao, Hoebe et al., 2002). Недостаток метода связан с методикой приготовления цитогенетических препаратов - клетки, набухшие в гипотоническом растворе хлорида калия, фиксируют и раскапывают на влажные стекла. При этом цитоплазма лопается, в результате чего возможна потеря одной или нескольких хромосом из клеток, находящихся в стадии метафазы. Поэтому анеуплоидия в этом методе определяется только как увеличение числа хромосом по сравнению с модальным;
- подсчета количества люминесцирующих маркеров целых хромосом или центромерных районов хромосом с использованием FISH-окраски (fluorescence in situ hybridization; Y.B.Yurov, S.G.Vorsanova, I.Y.Iourov, I.A.Demidova, A.K.Beresheva, V.S.Kravetz, V.V.Monakhov, A.D.Kolotii, V.Y.Voinova-Ulas, N.L.Gorbachevskaya; Unexplained autism is frequently associated with low-level mosaic aneuploidy. J. Med. Genet., 2007; v.44, P.521-525). В рутинных медико-генетических исследованиях метод используется для оценки небольшого количества хромосом, являющихся маркерами определенных синдромов (например, синдрома Дауна - трисомия по 21 хромосоме, синдром Эдвардса - трисомия по 18 хромосоме, или синдром Тернера - генотип Х0, при котором в клетке присутствует 45 хромосом). Недостатком метода является невозможность определять весь хромосомный набор без использования сложной и дорогой техники и дорогих маркеров.
Из уровня техники наиболее близкого аналога предлагаемому техническому решению не выявлено.
Технической задачей предлагаемого способа является сокращение времени и упрощение процедуры оценки степени анеуплоидии в системе анализа генотоксической активности факторов любой природы (физических, химических, биологических), включая наноматериалы и воду с измененной структурой.
Технический результат достигается тем, что в способе экспресс-оценки потенциальной генотоксической активности веществ и факторов среды по наличию анеуплоидии в лимфоцитах периферической крови человека, образовавшихся в результате культивирования в условиях цитокинетического блока, включающем в себя культивирование лимфоцитов крови человека в условиях цитокинетического блока в присутствии изучаемого вещества, фиксацию клеток, приготовление и окраску цитогенетических препаратов, на которых после окраски для каждого препарата при помощи светового микроскопа со встроенной цифровой камерой при увеличении 10×40 проводится регистрация изображений 100 клеток, содержащих два отдельно лежащих ядра и не имеющих видимых, в т.ч. генетических, повреждений, по этим изображениям вычисляется сумма и отношение площадей ядер в каждой такой клетке. На основании полученных данных вычисляются медианы, верхний и нижний квартили, их отношение и разность, проводится статистическое сравнение препаратов по этим параметрам, в случае обнаружения значимых различий при уровне значимости р≤0,05, а также при обнаружении дозовой зависимости делается вывод о способности изучаемого вещества индуцировать анеуплоидию, которая ассоциируется с потенциальной генотоксической активностью.
Предлагаемый способ осуществляется следующим образом.
200 мкл цельной венозной крови человека культивируется стандартным образом в условиях цитокинетического блока в присутствии цитохалазина В, что приводит к образованию лимфоцитов, содержащих два и более ядра. Через 24 часа от начала культивирования в культуру добавляется исследуемое вещество или оказывается воздействие изучаемым фактором. Всего исследуются не менее пяти культур, в четыре из них добавляется исследуемое вещество в разных концентрациях, а одна культура используются для контроля. Цитохалазин В добавляется в каждую культуру на 44 часу от начала культивирования до конечной концентрации 6 мкг/мл. Еще через 28 часов культивирования клетки крови стандартно фиксируются в холодной смеси метанол-уксусная кислота (3:1). Затем нанесением нескольких капель суспензии зафиксированных клеток на сухие охлажденные предметные стекла стандартно готовятся цитогенетические препараты, которые рутинно окрашиваются азур-эозином по методу Романовского. Далее при помощи светового микроскопа со встроенной цифровой камерой при увеличении 10×40 или более на каждом препарате выбираются и фотографируются 100 двуядерных лимфоцитов без видимых, в т.ч. генетических, повреждений с отдельно лежащими четко очерченными ядрами. Полученные изображения анализируются на персональном компьютере: для каждой двуядерной клетки вычисляются сумма ([∑S]=S1+S2) и отношение (S1/S2) площадей ядер. Затем для каждого препарата формируются массивы значений этих параметров (т.о. каждой дозе и контролю соответствует два массива данных по 100 значений в каждом). Массивы значений соответствующих параметров статистически сравниваются при помощи методов непараметрического анализа (Н критерий Краскела-Уоллеса). В случае обнаружения статистически значимых различий между опытом и контролем (уровень значимости p≤0,05), а также при обнаружении дозовой зависимости исследуемое вещество (фактор) признается обладающим потенциальной генотоксической активностью. Также для указанных параметров вычисляются медианы (Med[∑S], Med[S1/S2]), верхний (75‰) и нижний (25‰) квартили, их отношение (75‰/25‰) и разность (75‰-25‰). В случае обнаружения зависимости этих параметров от дозы вещества или обнаружения различий с контролем, превышающих погрешности измерения, исследуемое вещество (фактор) признается обладающим потенциальной генотоксической активностью.
Примеры реализации способа
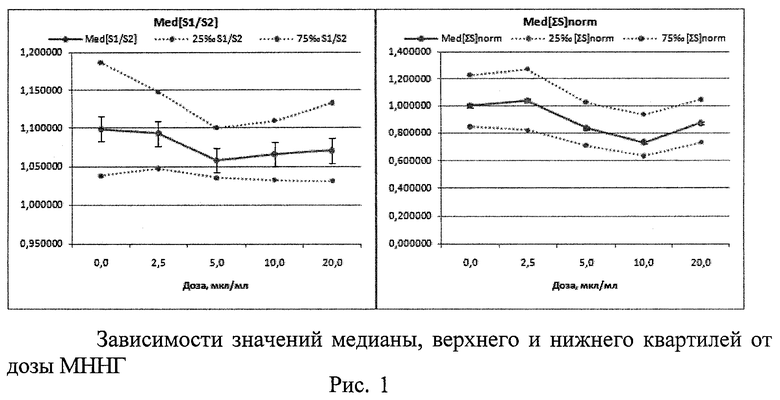
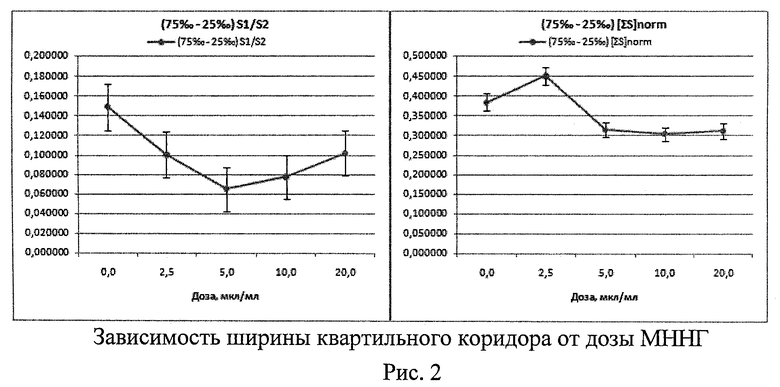
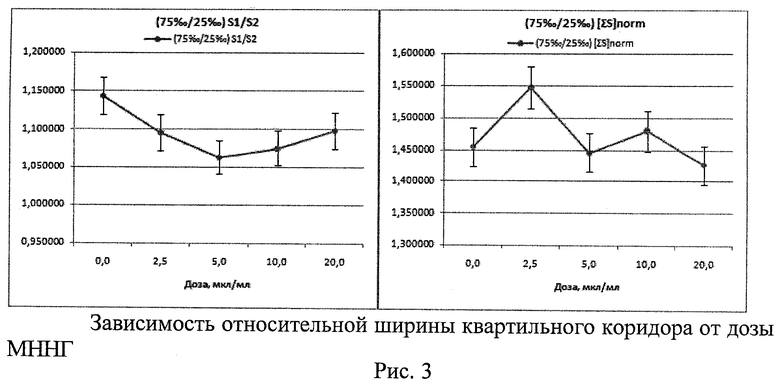
1. При исследовании генотоксической активности N-метил-N-нитро-N-нитрозогуанидина (МННГ, Aldrich) - соединения, обладающего мутагенной и канцерогенной активностями, которое используется в экспериментах как стандартный мутаген (индуктор нестабильности генома) (Рис.1 - Рис.3)
Проверка распределения морфометрических данных на нормальность критерием Шапиро-Уилка показала, что распределения отличаются от нормального с максимальным уровнем значимости р=0,01097. Методом Краскела-Уоллеса выявлено, что существуют статистически значимые различия между морфометрическими показателями, вычисленными для разных доз МННГ. При этом для Med[∑S] уровень значимости р=0,0000, а для Med[S1/S2] р=0,0031. С ростом дозы МННГ наблюдается стабильное уменьшение значений Med[S1/S2] и Med[∑S]norm (Рис.1). Цитогенетический анализ выявил выраженное дозозависимое снижение % 2-ядерных клеток в пролиферативном пуле и спектре делящихся клеток, а также рост % 1-ядерных клеток. Ярко выражены индукция МЯ в 2-ядерных клетках с увеличением дозы МННГ (характерный признак генотоксической активности), снижение % клеток в состоянии апоптоза (закрепление генетических повреждений). Проявляются эффекты увеличения асимметрии деления во 2-м митозе (увеличение частоты 3-ядерных клеток - маркер анеуплоидии), а также снижение % клеток в состоянии митоза. Эти результаты демонстрируют связь размеров и функционального состояния клеточного ядра и позволяют рассматривать морфометрию клеточных ядер как перспективный метод экспресс-оценки генотоксической активности веществ, в т.ч. - анеуплоидии.
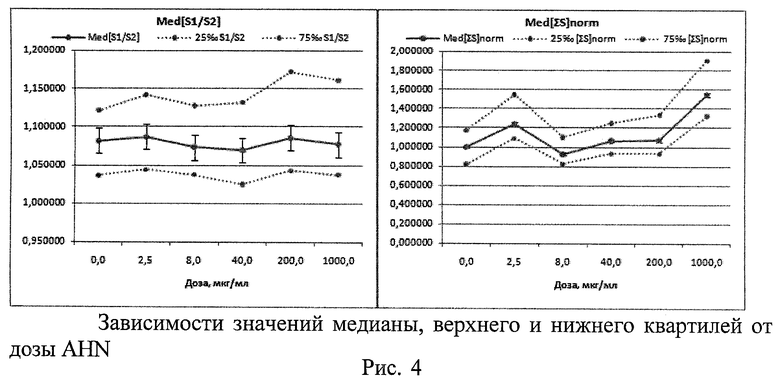
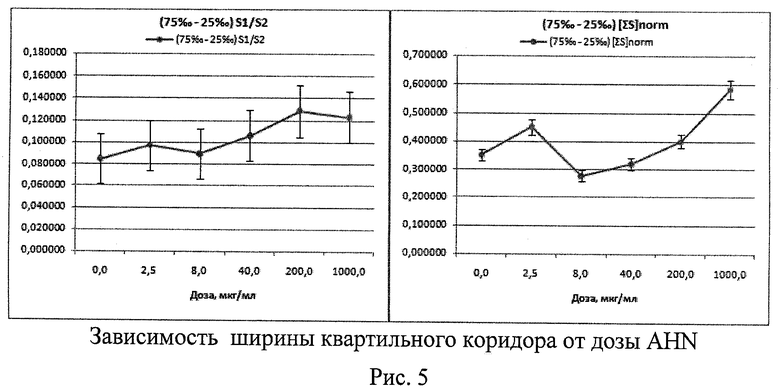
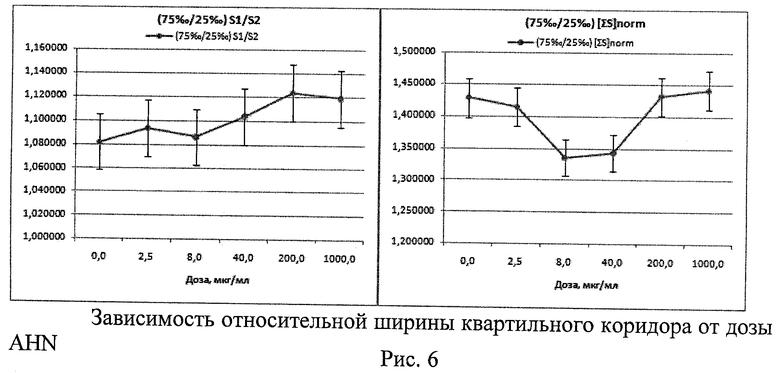
2. При исследовании потенциальной генотоксической активности нановолокон гидроксида алюминия (AHN) (тип материала - IPC (AlOOH - 55%, Al(ОН)3 - 33%, Al2O3 - 5%, Al≤5%, H2O≤2%, другие компоненты <0,55%), изготовлен ООО «Передовые порошковые технологии», РФ) (Рис.4 - Рис.6)
Проверка распределения морфометрических данных на нормальность критерием Шапиро-Уилка показала, что распределения отличаются от нормального с максимальным уровнем значимости р=0,04633. Методом Краскела-Уоллеса выявлены статистически значимые различия между показателями Med[∑S], вычисленными для разных доз AHN (р=0,0000). Различий по показателям Med[S1/S2] обнаружено не было (р=0,2467). С ростом дозы AHN наблюдается увеличение значений Med[∑S] и (75‰-25‰)∑[S], со скачком на малой дозе (Рис.4, Рис.5). В целом морфометрический анализ показывает тенденцию к увеличению размеров клеточных ядер и доли 2-ядерных клеток с асимметричными ядрами с увеличением дозы AHN. Цитогенетический анализ в модифицированном микроядерном тесте лимфоцитов крови из тех же культур выявил дозозависимое увеличение % 2-ядерных клеток в пролиферативном пуле и спектре делящихся клеток, а также снижение % 3- и 4-ядерных клеток. Наблюдается тенденция к дозозависимому снижению уровня повреждений во всех типах клеток, снижению % клеток в состоянии апоптоза и митоза. Проявляются эффекты снижения асимметрии деления во 2-м митозе (маркер анеуплоидии) и снижения % 3-ядерных клеток с микроядрами. То есть результаты цитогенетических исследований во всем диапазоне доз противоположны результатам морфометрии. В то же время цитогенетические эффекты минимальной из использованных доз AHN демонстрируют повышение генотоксичности по сравнению с контролем практически по всем параметрам (что полностью соответствуют данным морфометрии). При больших уровнях воздействия AHN наблюдаются цитотоксические эффекты, связанные с гибелью - в первую очередь - поврежденных клеток, что статистически проявляется в снижении генотоксических эффектов. Таким образом, результаты морфометрического анализа не противоречат данным цитогенетических исследований.
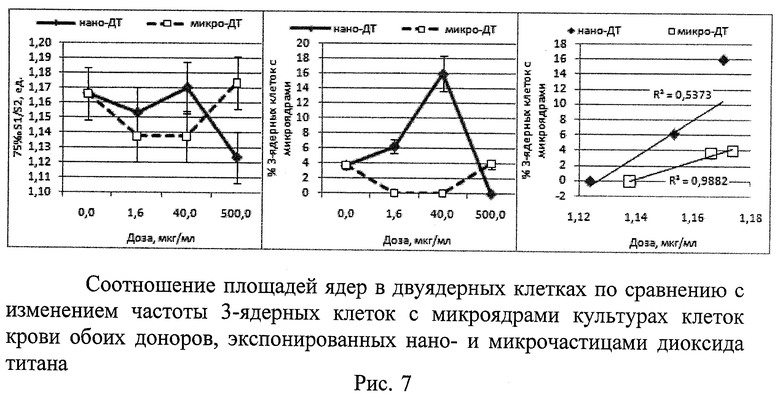
3. Исследование влияния нано- и микрочастиц диоксида титана на морфометрические показатели и показатели микроядерного теста на культуре цельной крови человека (Рис.7)
Исследования проводили на крови двух доноров. Нано-ДТ вызывал дозозависимое увеличение асимметрии ядер в двуядерных клетках культур обоих доноров. При этом между морфометрическими показателями и несколькими показателями цитогенетического анализа выявлены значимые (p≤0,05) корреляции. Это доказывает перспективность использования морфометрии ядер для предварительного скрининга генотоксических эффектов в микроядерном тесте с цитохалазином В. Асимметрия ядер в двуядерных клетках может свидетельствовать о наличии анеуплоидии либо о различиях в компактности хроматина, возникших в результате экспозиции ДТ. Индукция любого из этих событий указывает на наличие генотоксической активности у изучаемого фактора.
В качестве примера на рисунке (Рис.7) для обоих доноров приведена динамика соотношения площадей ядер в двуядерных клетках по сравнению с изменением частоты 3-ядерных клеток с микроядрами (r2=0,988, p≤0,05).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСПРЕСС-ВЫЯВЛЕНИЯ ОБЛУЧЕННЫХ ПАЦИЕНТОВ С ПОВЫШЕННЫМИ ЧАСТОТАМИ ХРОМОСОМНЫХ АБЕРРАЦИЙ | 1997 |
|
RU2141658C1 |
| Способ определения генотоксичности наночастиц | 2019 |
|
RU2711990C1 |
| СПОСОБ ПОДГОТОВКИ И ЦИТОМНЫЙ АНАЛИЗ ГЕПАТОЦИТОВ ЛАБОРАТОРНЫХ ЖИВОТНЫХ И ЧЕЛОВЕКА ДЛЯ ОЦЕНКИ ЦИТОГЕНЕТИЧЕСКОГО И ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ФАКТОРОВ РАЗНОЙ ПРИРОДЫ | 2018 |
|
RU2715388C1 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ЦИТОГЕНЕТИЧЕСКОГО И ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ НА ОРГАНИЗМ ЧЕЛОВЕКА | 2005 |
|
RU2292027C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНТОКСИКАЦИИ, ВЫЗВАННОЙ НЕКОНТРОЛИРУЕМЫМ ХРОНИЧЕСКИМ РАДИАЦИОННЫМ ОБЛУЧЕНИЕМ ЧЕЛОВЕКА | 1992 |
|
RU2093811C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НЕСТАБИЛЬНОСТИ ГЕНОМА У ДЕТЕЙ С ДЕТСКИМ ЦЕРЕБРАЛЬНЫМ ПАРАЛИЧОМ | 2005 |
|
RU2295130C1 |
| Способ прогнозирования риска развития заболеваний, являющихся причинами медицинских противопоказаний к работе с вредными факторами металлургического производства | 2020 |
|
RU2754802C1 |
| СПОСОБ БИОИНДИКАЦИИ РАДИАЦИОННОГО ВОЗДЕЙСТВИЯ НА ЩИТОВИДНУЮ ЖЕЛЕЗУ | 2009 |
|
RU2442161C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИМУТАГЕННЫМ ДЕЙСТВИЕМ | 2004 |
|
RU2258528C1 |
| СПОСОБ ОЦЕНКИ МУТАГЕННЫХ ВОЗДЕЙСТВИЙ | 2002 |
|
RU2223494C1 |
Изобретение относится к медицине, а именно к цитогенетике, и может быть использовано для экспресс-оценки степени потенциальной генотоксической активности веществ и факторов среды по наличию анеуплоидии в лимфоцитах периферической крови человека, образовавшихся в результате культивирования в условиях цитокинетического блока. Для этого культивируют лимфоциты крови человека в условиях цитокинетического блока в присутствии изучаемого вещества. Фиксируют клетки. Приготавливают и окрашивают цитогенетические препараты. Далее после окраски для каждого препарата при помощи светового микроскопа со встроенной цифровой камерой при увеличении 10×40 проводят регистрацию изображений 100 клеток, содержащих два отдельно лежащих ядра и не имеющих видимых, в т.ч. генетических, повреждений. По этим изображениям вычисляют сумму и отношение площадей ядер в каждой такой клетке. На основании полученных данных вычисляются медианы, верхний и нижний квартили, их отношение и разность. Проводят статистическое сравнение препаратов по этим параметрам. В случае обнаружения значимых различий при уровне значимости p≤0.05, а также при обнаружении дозовой зависимости делают вывод о способности изучаемого вещества индуцировать анеуплоидию, которая ассоциируется с потенциальной генотоксической активностью. Изобретение обеспечивает сокращение времени и упрощение процедуры оценки степени анеуплоидии в системе анализа генотоксической активности факторов любой природы. 7 ил., 2 пр.
Способ экспресс-оценки степени потенциальной генотоксической активности веществ и факторов среды по наличию анеуплоидии в лимфоцитах периферической крови человека, образовавшихся в результате культивирования в условиях цитокинетического блока, включающий в себя культивирование лимфоцитов крови человека в условиях цитокинетического блока в присутствии изучаемого вещества, фиксацию клеток, приготовление и окраску цитогенетических препаратов, на которых после окраски для каждого препарата при помощи светового микроскопа со встроенной цифровой камерой при увеличении 10×40 проводится регистрация изображений 100 клеток, содержащих два отдельно лежащих ядра и не имеющих видимых, в т.ч. генетических повреждений, по этим изображениям вычисляется сумма и отношение площадей ядер в каждой такой клетке, на основании полученных данных вычисляются медианы, верхний и нижний квартили, их отношение и разность, проводится статистическое сравнение препаратов по этим параметрам, в случае обнаружения значимых различий при уровне значимости p≤0,05, а также при обнаружении дозовой зависимости делается вывод о способности изучаемого вещества индуцировать анеуплоидию, которая ассоциируется с потенциальной генотоксической активностью.
| СПОСОБ ОЦЕНКИ МУТАГЕННЫХ ВОЗДЕЙСТВИЙ | 2002 |
|
RU2223494C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ФИЗИОЛОГИЧЕСКИХ СИСТЕМ | 1992 |
|
RU2054176C1 |
| WO 2005121365 A2, 22.12.2005 | |||
| ИНГЕЛЬ Ф.И | |||
| Перспективы использования микроядерного теста на лимфоцитах крови человека, культивируемых в условиях цитокинетического блока // Экологическая генетика, 2006, №3, т | |||
| IV, с.7-19 | |||
| АВТАНДИЛОВ Г.Г | |||
| Медицинская морфометрия | |||
| Руководство | |||
| // М.: Медицина, | |||
Авторы
Даты
2012-11-20—Публикация
2011-03-03—Подача