Изобретение относится к области медицины, генетики и касается способов оценки мутагенных воздействий.
Наиболее близким по технической сущности к предлагаемому является способ оценки мутагенных воздействий, заключающийся в оценке числовых нарушений хромосом (анеуплодии) в клетках исследуемых лиц путем определения частоты клеток, имеющих отклонения от нормального числа сигналов гибридизации центромероспецифичных ДНК-зондов с хромосомными мишенями в интерфазных ядрах исследуемых клеток с помощью метода флуоресцентной гибридизации in situ (Fluorescence in situ hybridization FISH) [1]. Однако данный способ имеет ограниченную область применения, недостаточную точность и информативность в силу необходимости подбора адекватной контрольной группы исследуемых тканей других индивидов, которые отличаются высокой межиндивидуальной вариабельностью в отношении биологического ответа на мутагенные воздействия факторов внешней и внутренней среды организма.
Новую техническую задачу - повышение точности, информативности и расширение области применения - достигают новым способом оценки мутагенных воздействий, включающим определение частоты анеуплоидии путем подсчета клеток с отличным от нормы числом сигналов гибридизации центромероспецифичных ДНК-зондов с хромосомными мишенями в интерфазных ядрах клеток исследуемой ткани методом флуоресцентной гибридизации in situ (FISH), причем частоту анеуплодии определяют в контрольной пробе, содержащей некультивированные клетки исследуемой ткани и в пробе, содержащей культивированные клетки той же самой ткани, прошедшие не менее одного цикла репликации ДНК, и по увеличению значения анеуплоидии в культивированных клетках, относительно некультивированных, определяют наличие мутагенного воздействия на клетки исследуемой ткани.
Способ осуществляют следующим образом. У обследуемых лиц производят забор крови, которую делят на 2 части. Лейкоциты первой части образца фиксируют сразу, а клетки второй части образца культивируют в питательной среде с фитогемагглютинином (ФГА), стимулирующим деление лимфоцитов, а фиксацию осуществляют на 50-52 часу культивирования. Известно, что ФГА-стимулированные лимфоциты выходят из стадии G0, подчиняясь экспоненциальному распределению с большой дисперсией [2], однако в зависимости от времени фиксации клеток основная их масса может находиться в разных митозах (при фиксации на 48-52 часу культивирования, преимущественно в 1 митозе, а при фиксации на 72 часу культивирования, во 2 митозе). В обоих образцах при гибридизации, по крайней мере, с 2 разными центромероспецифичными ДНК-зондами с помощью двухцветного варианта FISH-метода определяют частоту гипо- и гипердиплоидных клеток и по увеличению значения анеуплоидии в культивированных клетках, относительно некультивированных, определяют наличие мутагенного воздействия на клетки исследуемой ткани.
Как будет показано ниже, новизна предлагаемого способа оценки мутагенных воздействий заключается в экспериментальном выявлении нового эффекта, а именно - потенциальные повреждения аппарата клеточного деления, индуцированные мутагенными воздействиями, экспрессируются после прохождения клетками, по крайней мере, одного цикла репликации ДНК. Иными словами, для обнаружения мутагенных повреждений клеточного аппарата, контролирующего расхождение отдельных хромосом в митозе и приводящих к числовым нарушениям хромосом, необходимо, чтобы клетки прошли, по крайней мере, одно деление. Преимущество предлагаемого способа, по сравнению с традиционным, заключается в индивидуализации определения мутагенного воздействия на клетки отдельных лиц, поскольку в качестве контроля к культивированным клеткам выступают некультивированные клетки тех же самых индивидов.
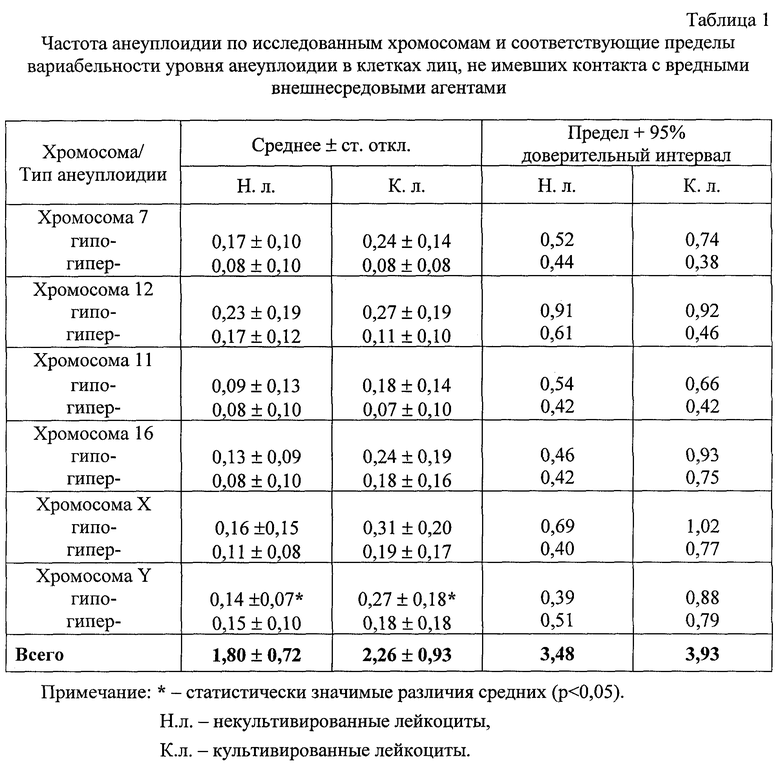
Для оценки числовых нарушений хромосом у людей в норме, при отсутствии явных генотоксических воздействий, и у лиц с профессиональными вредностями была проведена двухцветная FISH с использованием центромероспецифичных ДНК-зондов на половые хромосомы (X и Y) и на ряд аутосом набора (хромосомы 7, 11, 12 и 16). В качестве контрольной группы были обследованы 10 здоровых мужчин (средний возраст 40±5 лет), а в качестве опытной группы обследованы 15 лиц мужского пола работников, крупного ядерно-химического комплекса (средний возраст 47±6 лет), которые в ходе своей профессиональной деятельности контактировали с комплексом химических соединений и получили интегральную дозу внешнего γ-облучения в пределах от 15 до 165 бэр (средняя доза 98±42 бэр). Возрастные различия между опытной и контрольной группой статистически незначимы (р>0,05). У одних и тех же лиц в каждой реакции гибридизации исследовали от 1000 до 2000 ядер клеток некультивированных и культивированных с ФГА в течение 52 часов лейкоцитов периферической крови.
Выделение плазмидной ДНК, мечение ее с помощью реакции ник-трансляции репортерными молекулами (биотином или дигоксигенином) и флуоресцентную гибридизацию in situ проводили по стандартным методикам [3]. Детекцию гибридизационных сигналов проводили в ультрафиолетовом свете на микроскопе "ZEISS" при увеличении х1500. Предел обнаружения анеуплоидии определяли по формуле [4]: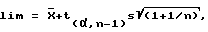
где 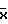 - средняя пропорция ядер с анализируемым типом анеуплоидии; t - нормированное отклонение; α- уровень значимости; n - число наблюдений; s - стандартное отклонение.
- средняя пропорция ядер с анализируемым типом анеуплоидии; t - нормированное отклонение; α- уровень значимости; n - число наблюдений; s - стандартное отклонение.
Сравнительный анализ частоты анеуплоидии в контрольной группе и группе работников ядерно-химического комплекса проводили с помощью однофакторного дисперсионного анализа. В качестве показателя достоверности отличий был выбран уровень значимости, не превышающий 0,05.
С целью получения контрольных данных по уровню анеуплоидии и пределов ее вариабельности у здоровых лиц по ряду хромосом набора с одновременной детекцией в клеточном ядре двух разных хромосом применяли двухцветный вариант FISH. В качестве ДНК-зондов использовали дигоксигенин/биотин меченые пробы на прицентромерные участки трех пар хромосом 7/12, 11/16 и X/Y. Проводили оценку распределения числа гибридизационных сигналов по указанным парам хромосом в культивированных с ФГА в течение 52 часов (прошедших в среднем 1 цикл репликации ДНК) и некультивированных лейкоцитах контрольной группы здоровых лиц - 10 здоровых мужчин, не курящих и не подвергавшихся мутагенным внешнесредовым воздействиям. Полученные данные о средней частоте гипо- и гипердиплоидии хромосом в культивированных и некультивированных лейкоцитах контрольной группы индивидов приведены в табл. 1, где указан также верхний предел спонтанной частоты для каждого вида аномалий, превышение которого может свидетельствовать о наличии анеугенного влияния, генетической нестабильности или мозаицизме.
Статистически значимое увеличение частоты спонтанной анеуплоидии в культивированных лейкоцитах, по сравнению с некультивированными, отмечено только для нуллисомии Y(р=0,04). Следует также отметить тенденцию к потере в культивированных лейкоцитах хромосомы Х(р=0,07). Суммарная частота анеуплоидии по 6 исследованным хромосомам в некультивированных и культивированных лейкоцитах составила 1,84 и 2,26% соответственно. Таким образом, у здоровых индивидов, не подвергающихся воздействию вредных внешнесредовых факторов, частота анеуплоидии в культивированных клетках, прошедших 1 цикл репликации ДНК, возрастает в среднем на 23%, по сравнению с некультивированными. Однако это различие не является статистически достоверным (р=0,25). Таким образом, в культивируемых клетках лиц, не подвергающихся воздействию мутагенных факторов, отмечается лишь незначительное повышение уровня анеуплоидии, по сравнению с некультивируемыми клетками.
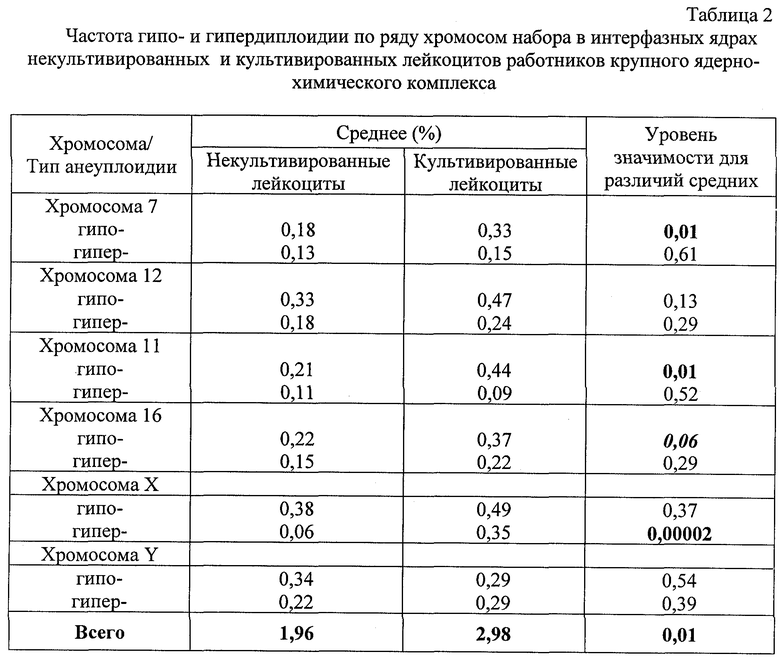
В табл. 2 представлены результаты сравнительного анализа частоты гипои гипердиплоидии по ряду хромосом набора в интерфазных ядрах некультивированных и культивированных лейкоцитов 15 работников крупного ядерно-химического комплекса, профессионально подвергающихся воздействию низких доз ионизирующей радиации и комплекса химических соединений. Видно, что статистические достоверные различия между выборками обнаруживаются по гипоплоидии хромосом 7 и 11, по гиперплоидии X-хромосомы, а также по общей сумме числовых нарушений хромосом. Суммарная частота анеуплоидии по 6 исследованным хромосомам в некультивированных и культивированных лейкоцитах работников СХК составила 1,96% и 2,98% соответственно. Таким образом, у индивидов, подвергающихся воздействию комплекса вредных внешнесредовых факторов, частота анеуплоидии в культивированных клетках, прошедших 1 цикл репликации ДНК, возрастает в среднем на 52%, по сравнению с некультивированными и это различие является статистически достверным (р<0,01). Таким образом, по сравнению с контрольной группой лиц, где соответствующее возрастание частоты анеуплоидии составило только 23%, воздействие вредных мутагенных внешнесредовых факторов вызвало более чем двукратное повышение частоты анеуплоидных клеток (фиг.1). Как видно из представленных данных, некультивированные клетки контрольной и опытной групп лиц практически не отличаются друг от друга по суммарной частоте анеуплоидных клеток, что свидетельствует о том, что потенциальные повреждения клеточного аппарата, контролирующего расхождение отдельных хромосом и приводящие к числовым нарушениям хромосом не выявляются в некультивированных клетках. Для их выявления необходимо, чтобы клетки прошли, по крайней мере, одно митотическое деление, причем в качестве контроля к культивированным клеткам могут выступать некультивированные клетки тех же самых лиц.
Полученные результаты свидетельствуют о том, что мутагенное в отношении индукции числовых нарушений хромосом (анеугенное) влияние вредных внешнесредовых факторов на клетки человека можно выявить только после прохождения этими клетками как минимум 1 клеточного деления, т.е. после прохождения клетками 1 цикла репликации ДНК. Поскольку именно делящиеся клетки демонстрируют экспрессию потенциальных повреждений аппарата клеточного деления, накопленных in vivo, то этот эффект можно положить в основу оценки анеугенного потенциала различных физических, химических и, возможно, биологических (вирусов) факторов. Таким образом, предлагаемый способ оценки мутагенного воздействия может быть использован в качестве новой тест-системы для оценки воздействия мутагенных факторов внешней и внутренней среды на наследственность человека.
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
1. Eastmond D.A., Shuler M., Rupa D.S. Advantages and limitation of using fluorescence in situ hybridization for the detection of aneuploidy in interphase human cells // Mutat. Res. -1995. -V. 348. -P. 153-162 (ПРОТОТИП).
2. Kubbies M., Shindler D., Hoehn H., Rabinovich P.S. Cell cycle kinetics by BrdU-Hoest flow cytometry: an altrenative to the differential metaphase labelling technique // Cell. Tiss. Kinet. 1985. -V. 18. -P. 551-562.
3. Rooney D.E., Czepulkowski B.H. (eds). Human cytogenetics. A practical approach. -New York.: Oxford University Press, 1992.-V.I.-P.157-192.
4. Lomax B.L., Kalousek D.K., Kuchinka B.D., Barren I.J., Harrison K.J., Safavi H. The utilization of interphase cytogenetic analysis for the detection of mosaicism // Hum. Genet. -1994. -V.93. -P. 243-247.
Изобретение относится к области медицины, генетики и касается способов оценки мутагенных воздействий. Для этого частоту анеуплоидии определяют в контрольной пробе, содержащей некультивированные клетки исследуемой ткани, и в пробе, содержащей культивированные клетки той же самой ткани, прошедшие не менее одного цикла репликации ДНК, и по увеличению значения анеуплоидии в культивированных клетках относительно некультивированных определяют наличие мутагенного воздействия на клетки исследуемой ткани. Способ обеспечивает повышение точности, информативности и расширение области применения. 2 табл. , 1 ил.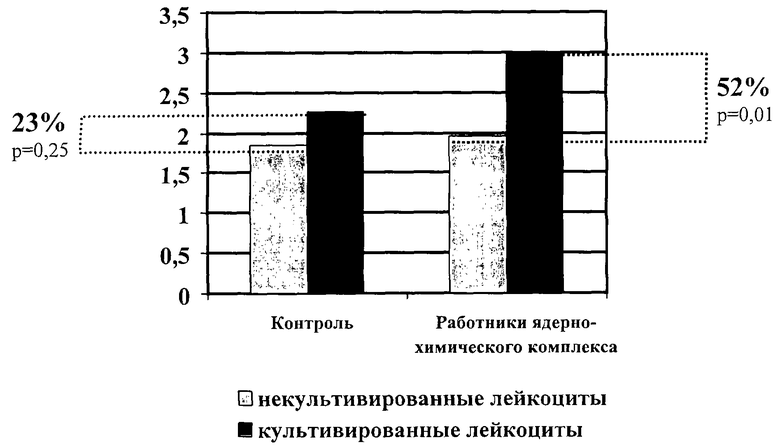
Способ оценки мутагенных воздействий, включающий определение частоты анеуплоидии путем подсчета клеток с отличным от нормы числом сигналов гибридизации центромероспецифичных ДНК-зондов с хромосомными мишенями в интерфазных ядрах клеток исследуемой ткани методом флуоресцентной гибридизации in situ (FISH), отличающийся тем, что частоту анеуплоидии определяют в контрольной пробе, содержащей некультивированные клетки исследуемой ткани и в пробе, содержащей культивированные клетки той же самой ткани прошедшие не менее одного цикла репликации ДНК, и по увеличенному значению анеуплоидии в культивированных клетках относительно некультивированных определяют уровень мутагенного воздействия на клетки исследуемой ткани.
| Eastmond D.A | |||
| et al, Mutat | |||
| Res., 1995, v.348, p | |||
| Паровозный золотник (байпас) | 1921 |
|
SU153A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ МУТАГЕННОГО ФАКТОРА В ПРОБЕ | 1992 |
|
RU2036237C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МУТАГЕННОСТИ РАСТВОРОВ | 1991 |
|
RU2034296C1 |
Авторы
Даты
2004-02-10—Публикация
2002-07-15—Подача